Applied mineralogy and non-metallic resources I. Angewandte Mineralogie und nichtmetallische Rohstoffe Nutzung und Umweltaspekte I
|
|
|
- Martin Egger
- vor 6 Jahren
- Abrufe
Transkript
1 L Herbstsemester 2009 Applied mineralogy and non-metallic resources I Angewandte Mineralogie und nichtmetallische Rohstoffe Nutzung und Umweltaspekte I 3. Dez Salz / salt (Steinsalz, rock salt), Anhydrit Gips / Anhydrite Gypsum Dr. Rainer Kündig Schweizerische Geotechnische Kommission ETH-Zentrum 8902 Zürich Salz Geschichte Kein anderer Rohstoff ist so direkt mit der Entwicklung der Menschheit verknüpft wie Salz. Stichworte Salär, Salzmünzen (salary) Salzmonopole (monopoly), Salzsteuer (salt tax) -> Italy: Sali & Tabachi Kriegsgrund und Politikum bis ins 19. Jh. (ähnlich wie heute Erdöl) Salzkarawanen Salzburg, Salzkammergut, Hallstatt (älteste noch produzierende Mine der Welt) Iod in Salz Gesundheitswesen (Kropf -> goiter, struma) Mystik, «Glück Unglück» Menschlicher Körper enthält 227 g Salz. pro Jahr konsumieren wir 7-9 kg Salz. Salzbedarf: je nach Klima zwischen 5 und 20 g pro Tag. Löslichkeit im Wasser 360 g/l bei 20 C, 391 g/l bei 100 C etc.
2 Salz Einsatzgebiete (application) Lebensmittel/Landwirtschaft (food, agriculture) Speisesalz, Nahrunsmittelzusatz, Würze, Konservierungsstoff (Pökelung), etc. Wasserbehandlung (water treatment) Wasserenthärtung/Ionenaustausch Na > Ca, Mg (z.b. Geschirrspüler) Enteisung (deicing) Herabsetzung des Gefrierpunktes; Einsatzbereich bis ca. -10 C (je kälter, desto grösser die Konzentration. Bodenstabilisierungsprodukte (bei wechselnden Feuchtigkeitsbedingungen) (stabilisation of soils) Industrielle Anwendungen (industrial application) Färbung/Entfärbung, Stabilisierung von Farben, Fixiersalze etc.; Gummi- und Kunststoffindustrie (z.b. Neopren) -> Salze beeinflussen Koagulationsverhalten; Flockungsmittel in Ölindustrie; diverse Anwendungen in der Metallurgie, z.b. Schlackenentfernung, Reinigungsprozesse;... Chemische Industrie. Ausgangsstoff für Na und Cl (chemistry, starting material) Halit (Steinsalz, NaCl) enthält in reiner Form 39.34% Na und 60.66% Cl. Neben der direkten Verwertung von Salz (technisch und biologisch) auch billigste Quelle für Natrium und Chlor in der chemischen Industrie. Salz als Ausgangsstoff in der chemischen Industrie: Alkali- und Chlor Produkte Ausgangsstoff Trennverfahren wichtige Zwischenstoffe Produkte Salz/salt Soda- Produktion Natriumbikarbonat (bicarbonate of soda) NaHCO 3 (Natron) Soda Na 2 CO 3 Mineralfutter für Tiere Feuerlöschpulver Medikamente Backpulver Wasch- und Reinigungsmittel Wasserglas Entschwefelung von Eisen Farbstoffe Glas Natriumchlorid sodium chloride Cl - Cl - Chlor-Alkali Elektrolyse chlorinealkaline electrolysis Chlor (chlorine) Cl Natronlauge (sodium hydroxide) OH - Lösungsmittel Glycerin Epoxidharze Feuerlöschmittel Desinfektionsmittel Mittel zur Wasseraufbereitung PVC-Kuststoff Reinigungsmittel Aluminium Seife Zellulose (Watte, Papier) Neutralisation von Säuren Quelle:
3 Salz Vorkommen, Entstehung Salze ozeanischer Lagerstätten (Meerwasser, offene Ozeane) Durchschnitt ca. 3.5%, variiert mit geographischer Breite (Minimum in Polarregion und am Äquator) -> W Mittelmeer 3.62%, E Mittelmeer 3.69% (Tiefenwasser 3.84%) -> Adria: N 1.8%, Mitte 2.8%, S 3.5% -> Rotes Meer %; Totes Meer bis 7.9% NaCl, dazu 14.6% MgCl hochkonzentrierte Meeresbecken (z.b. Kara Bogaz-Gol) Salzquellen, Grundwasser (Brines) intrakontinentale Seebecken (Playa Typ) (z.b. Atacama) tiefliegende Salzlager, stratiform (z.b. Zechstein) Salzdome (z.b. Oman) Salzminerale und Steinsalz Aus der Vielzahl der Alkalisalze sind wirtschaftlich-technisch zwei Hauptgruppen wichtig: Salze ozeanischer Lagerstätten Halit, Steinsalz NaCl * Glauberit Na 2 Ca(SO 4 ) 2 Mirabilit (Glaubersalz) Na 2 SO 4 10H 2 O Thenardit Na 2 SO 4 Sylvin KCl Carnallit KMgCl 3 6H 2 O Kainit KMg[Cl/SO 4 ] 3H 2 O Polyhalit K 2 Ca 2 Mg(SO 4 ) 4 2H 2 O Salze kontinentaler Salzlagerstätten Trona Na 3 H(CO 3 ) 2 2H 2 O Gaylussit CaNa 2 (CO 3 ) 2 5H 2 O Thermonatrit Na 2 CO 3 H 2 O Soda (Natron) Na 2 CO 3 10H 2 O Natronsalpeter NaNO 3 Kalisalpeter KNO 3 * heutige Reinheitsuntergrenze: 95-97%
4
5
Verschiedene Salze Lehrerinformation
 Lehrerinformation 1/8 Arbeitsauftrag Kochsalz ist den SuS täglich präsent. Doch Kochsalz macht nur einen kleinen Teil der täglichen Produktion aus. Welche Salze werden auch noch hergestellt und in welchen
Lehrerinformation 1/8 Arbeitsauftrag Kochsalz ist den SuS täglich präsent. Doch Kochsalz macht nur einen kleinen Teil der täglichen Produktion aus. Welche Salze werden auch noch hergestellt und in welchen
Elemente des Periodensystems. Natürliche Häufigkeit der Elemente
 Elemente des Periodensystems Natürliche Häufigkeit der Elemente 1 Der Wasserstoff Vorkommen Eigenschaften Gewinnung Verwendung Verbindungen 2 Vorkommen Interstellare Wasserstoffwolken Orion-Nebel und auf
Elemente des Periodensystems Natürliche Häufigkeit der Elemente 1 Der Wasserstoff Vorkommen Eigenschaften Gewinnung Verwendung Verbindungen 2 Vorkommen Interstellare Wasserstoffwolken Orion-Nebel und auf
Das Salz in unserer Suppe
 Das Salz in unserer Suppe Aufgabe 1 In der Küche verwendet man oft zwei Arten von Salz. Das eine ist Steinsalz und das andere ist Meersalz. Das Meerwasser im Mittelmeer enthält 3,8 % Salz, im Toten Meer
Das Salz in unserer Suppe Aufgabe 1 In der Küche verwendet man oft zwei Arten von Salz. Das eine ist Steinsalz und das andere ist Meersalz. Das Meerwasser im Mittelmeer enthält 3,8 % Salz, im Toten Meer
Zusammengestellt & ausgerechnet von Helmut Stabe. NaCl Salz. Halle 2003
 Zusammengestellt & ausgerechnet von Helmut Stabe NaCl Salz Halle 2003 Das in den Weltmeeren enthaltene Salz beträgt 50 Billiarden Tonnen oder 5 10 16 t. Das entspricht einer Menge von 100 Trilliarden oder
Zusammengestellt & ausgerechnet von Helmut Stabe NaCl Salz Halle 2003 Das in den Weltmeeren enthaltene Salz beträgt 50 Billiarden Tonnen oder 5 10 16 t. Das entspricht einer Menge von 100 Trilliarden oder
Technisches Merkblatt
 Technisches Merkblatt Kaliumsulfat 93% K 2 SO 4 Kaliumsulfat K 2 SO 4 93 % Sonstige Sulfate (vorwiegend MgSO 4 ) MgSO 4 + 4 % Kaliumchlorid + Natriumchlorid KCl + NaCl 2 % Sonstiges vorwiegend H 2 O 1
Technisches Merkblatt Kaliumsulfat 93% K 2 SO 4 Kaliumsulfat K 2 SO 4 93 % Sonstige Sulfate (vorwiegend MgSO 4 ) MgSO 4 + 4 % Kaliumchlorid + Natriumchlorid KCl + NaCl 2 % Sonstiges vorwiegend H 2 O 1
Kapitel III Salze und Salzbildungsarten
 Kapitel III Salze und Salzbildungsarten Einführung in die Grundlagen, Achtung: enthält auch die entsprechenden Übungen!!! Themen in [] müssen nicht auswendig gelernt werden! Navigation www.lernmaus.de
Kapitel III Salze und Salzbildungsarten Einführung in die Grundlagen, Achtung: enthält auch die entsprechenden Übungen!!! Themen in [] müssen nicht auswendig gelernt werden! Navigation www.lernmaus.de
Halogen-, Interhalogenund Edelgas-Verbindungen
 Halogen-, Interhalogenund Edelgas-Verbindungen Vorkommen und Darstellung von 2,Cl 2, 2,I 2 17 2 Cl 2 2 I 2 Vorkommen Ca 2 (lussspat) Na 3 Al 6 (Kryolith) Ca 5 (PO 4 ) 3 (luorapatit) Cl - : gelöst in Meerwasser
Halogen-, Interhalogenund Edelgas-Verbindungen Vorkommen und Darstellung von 2,Cl 2, 2,I 2 17 2 Cl 2 2 I 2 Vorkommen Ca 2 (lussspat) Na 3 Al 6 (Kryolith) Ca 5 (PO 4 ) 3 (luorapatit) Cl - : gelöst in Meerwasser
Allgemeine Geologie. Teil 16 SS 2005 Mo, Di, Mi
 Allgemeine Geologie Teil 16 SS 2005 Mo, Di, Mi 8.15 9.00 Evaporite Evaporite sind Eindampfungs-Gesteine, deren Komponenten bei hoher Verdunstung aus Randmeeren oder abflußlosen Seen auskristallisieren.
Allgemeine Geologie Teil 16 SS 2005 Mo, Di, Mi 8.15 9.00 Evaporite Evaporite sind Eindampfungs-Gesteine, deren Komponenten bei hoher Verdunstung aus Randmeeren oder abflußlosen Seen auskristallisieren.
fest, nicht gelöst: Na + Cl -
 Salzsäure + Natriumlauge Natriumchlorid + Wasser / exotherm HCl + NaOH NaCl + H 2 O / exotherm H + (aq) + Cl (aq) + Na + (aq) + OH (aq) Na + (aq) + Cl (aq) + H 2 O / exotherm fest, nicht gelöst: Na + Cl
Salzsäure + Natriumlauge Natriumchlorid + Wasser / exotherm HCl + NaOH NaCl + H 2 O / exotherm H + (aq) + Cl (aq) + Na + (aq) + OH (aq) Na + (aq) + Cl (aq) + H 2 O / exotherm fest, nicht gelöst: Na + Cl
Anorganische Chemie I Dr. Egbert Figgemeier. 30. Oktober 2006
 Anorganische Chemie I Dr. Egbert Figgemeier 30. Oktober 2006 Alkalimetalle - Allgemeines Li Valenz-Elektronenstruktur ns 1 Na K Rb Cs Fr Alkalimetalle - Physikalische Eigenschaften Metallische Eigenschaften
Anorganische Chemie I Dr. Egbert Figgemeier 30. Oktober 2006 Alkalimetalle - Allgemeines Li Valenz-Elektronenstruktur ns 1 Na K Rb Cs Fr Alkalimetalle - Physikalische Eigenschaften Metallische Eigenschaften
Vortest/Nachtest Salze (1)
 Vortest/Nachtest Salze (1) Vortest Maximal erreichbare Punktzahl: 27 (24 Punkte + 3 Jokerpunkte) Nachtest Erreichte Punktzahl: 1. Kreuze die Formeln an, die den Salzen zuzuordnen sind. (3 P.) NaCl CaCO
Vortest/Nachtest Salze (1) Vortest Maximal erreichbare Punktzahl: 27 (24 Punkte + 3 Jokerpunkte) Nachtest Erreichte Punktzahl: 1. Kreuze die Formeln an, die den Salzen zuzuordnen sind. (3 P.) NaCl CaCO
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE
 SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
Eigenschaften der Elemente der 1. Gruppe
 Eigenschaften der Elemente der 1. Gruppe 1. Gruppe (Alkalimetalle) Li, Na, K, Rb, Cs, (Fr) Elektronenkonfiguration: ns 1 reagieren mit H 2 O: M + H 2 O MOH + ½ H 2 reagieren mit H 2 : M + ½ H 2 MH reagieren
Eigenschaften der Elemente der 1. Gruppe 1. Gruppe (Alkalimetalle) Li, Na, K, Rb, Cs, (Fr) Elektronenkonfiguration: ns 1 reagieren mit H 2 O: M + H 2 O MOH + ½ H 2 reagieren mit H 2 : M + ½ H 2 MH reagieren
Säuren, Basen, Salze
 Säuren, Basen, Salze Namensgebung (=Nomenklatur) Es gibt für chemische Verbindungen grundsätzlich zwei Arten von Namen: Trivialname der alltäglich bzw. umgangssprachlich benutzte Name z. B.: Wasser, Salzsäure,
Säuren, Basen, Salze Namensgebung (=Nomenklatur) Es gibt für chemische Verbindungen grundsätzlich zwei Arten von Namen: Trivialname der alltäglich bzw. umgangssprachlich benutzte Name z. B.: Wasser, Salzsäure,
Übungen zur Allgemeinen Geologie, Nebenfach. Erta Ale, Afrika
 Übungen zur Allgemeinen Geologie, Nebenfach Erta Ale, Afrika Minerale anorganisch, (natürlich) Festkörper definierte chemische Zusammensetzung homogen definiert durch chemische Formel kristallin Physikalische
Übungen zur Allgemeinen Geologie, Nebenfach Erta Ale, Afrika Minerale anorganisch, (natürlich) Festkörper definierte chemische Zusammensetzung homogen definiert durch chemische Formel kristallin Physikalische
Kochsalz oder Natriumchlorid Best.- Nr Wissenschaftlich-didaktisches Videoprogramm Klassenstufe: Klasse
 Kochsalz oder Natriumchlorid Best.- Nr. 2021016 Wissenschaftlich-didaktisches Videoprogramm Klassenstufe: 9.-11. Klasse Dauer: 17 Minuten Dieser Film wurde von Lehrern für Schüler der 6. - 10. Klasse konzipiert.
Kochsalz oder Natriumchlorid Best.- Nr. 2021016 Wissenschaftlich-didaktisches Videoprogramm Klassenstufe: 9.-11. Klasse Dauer: 17 Minuten Dieser Film wurde von Lehrern für Schüler der 6. - 10. Klasse konzipiert.
Rohstofftag Sachsen-Anhalt Rohstoffe für die chemische Grundstoffproduktion
 Rohstofftag Sachsen-Anhalt 31.08.2015 Rohstoffe für die chemische Grundstoffproduktion Dipl.-Ing. Uwe Reh Solvay Chemicals GmbH Werk Bernburg Solvay Chemicals GmbH Werk Bernburg Industriepark 12 ha Standort
Rohstofftag Sachsen-Anhalt 31.08.2015 Rohstoffe für die chemische Grundstoffproduktion Dipl.-Ing. Uwe Reh Solvay Chemicals GmbH Werk Bernburg Solvay Chemicals GmbH Werk Bernburg Industriepark 12 ha Standort
1.5 Säuren und Basen und der ph-wert
 Seite 14 1.5 Säuren und Basen und der ph-wert 1.5.1 Säuren Geschichtlich bedingte Definition: Eine Säure ist ein Stoff, dessen wässrige Lösung sauer schmeckt oder ätzend wirkt, bzw. andere Stoffe angreift.
Seite 14 1.5 Säuren und Basen und der ph-wert 1.5.1 Säuren Geschichtlich bedingte Definition: Eine Säure ist ein Stoff, dessen wässrige Lösung sauer schmeckt oder ätzend wirkt, bzw. andere Stoffe angreift.
7. Sedimentationsprozesse im Meer 2
 7. Sedimentationsprozesse im Meer 2 - Transport und Ablagerung auf dem Schelf - Chemische und biogene Sedimentation - Meeresspiegelschwankungen - Kontinentalhang und Tiefsee Prof. Breitkreuz, TU-Freiberg,
7. Sedimentationsprozesse im Meer 2 - Transport und Ablagerung auf dem Schelf - Chemische und biogene Sedimentation - Meeresspiegelschwankungen - Kontinentalhang und Tiefsee Prof. Breitkreuz, TU-Freiberg,
2.9.2 Text für Schüler/innen zum Anwendungsbeispiel Geologie Salz
 2.9.2 Text für Schüler/innen zum Anwendungsbeispiel Geologie Salz Was ist Salz? Eine Definition: Evaporite, Salzgesteine, chemische Sedimente und Sedimentgesteine, die durch intensive Verdunstung oder
2.9.2 Text für Schüler/innen zum Anwendungsbeispiel Geologie Salz Was ist Salz? Eine Definition: Evaporite, Salzgesteine, chemische Sedimente und Sedimentgesteine, die durch intensive Verdunstung oder
Chemische Prozesstechnik ( CPT) Säuren und Basen. Prof. Dr. W. Schwieger Lehrstuhl für Chemische Reaktionstechnik Universität Erlangen-Nürnberg
 Chemische Prozesstechnik ( CPT) Säuren und Basen Prof. Dr. W. Schwieger Lehrstuhl für Chemische Reaktionstechnik Universität Erlangen-Nürnberg Chemische und Biologische Prozesstechnik ( CBPT) Säuren und
Chemische Prozesstechnik ( CPT) Säuren und Basen Prof. Dr. W. Schwieger Lehrstuhl für Chemische Reaktionstechnik Universität Erlangen-Nürnberg Chemische und Biologische Prozesstechnik ( CBPT) Säuren und
Entstehung und Vorkommen Lehrerinformation
 Lehrerinformation 1/7 Arbeitsauftrag Anhand einer Präsentation wird den SuS erklärt, wie sich Salzlager bilden. Die SuS diskutieren und folgen der Präsentation. Das Leseblatt fasst die Inhalte zusammen.
Lehrerinformation 1/7 Arbeitsauftrag Anhand einer Präsentation wird den SuS erklärt, wie sich Salzlager bilden. Die SuS diskutieren und folgen der Präsentation. Das Leseblatt fasst die Inhalte zusammen.
exc e l l e n c e i n s a l t
 excellence in salt Exzellentes Salz für unsere Kunden Salzabbau am Standort Bernburg Lederproduktion Glas und Keramik PVC-Herstellung/Elektrolyse Farbstoffe Textilfarben Reinigungs- und Desinfektionsmittel
excellence in salt Exzellentes Salz für unsere Kunden Salzabbau am Standort Bernburg Lederproduktion Glas und Keramik PVC-Herstellung/Elektrolyse Farbstoffe Textilfarben Reinigungs- und Desinfektionsmittel
Welt der Chemie Feuerwerk 178 Selbst untersucht Eigenschaften von Alkali- und Erdalkalimetallen 179 Natrium 180
 Inhalt Alkali- und Erdalkalimetalle 177 Welt der Chemie Feuerwerk 178 Selbst untersucht Eigenschaften von Alkali- und Erdalkalimetallen 179 Natrium 180 Die Elemente der I. Hauptgruppe 182 Magnesium und
Inhalt Alkali- und Erdalkalimetalle 177 Welt der Chemie Feuerwerk 178 Selbst untersucht Eigenschaften von Alkali- und Erdalkalimetallen 179 Natrium 180 Die Elemente der I. Hauptgruppe 182 Magnesium und
bestimmte mehratomige Anionen mit Sauerstoff werden mit dem lateinischen Namen benannt und enden auf at.
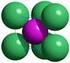 DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
Natürliche Vorkommen der Elemente
 Natürliche Vorkommen der Elemente Elemente (Gold) Sulfide (Pyrit FeS 2 ) Halogenide (Steinsalz NaCl) Oxide (Rubin Al 2 O 3 ) Natürliche Vorkommen der Elemente Carbonate (Calcit CaCO 3 ) Sulfate (Gips CaSO
Natürliche Vorkommen der Elemente Elemente (Gold) Sulfide (Pyrit FeS 2 ) Halogenide (Steinsalz NaCl) Oxide (Rubin Al 2 O 3 ) Natürliche Vorkommen der Elemente Carbonate (Calcit CaCO 3 ) Sulfate (Gips CaSO
Abgestufte Lernhilfen
 Abgestufte Lernhilfen Checkliste für die Beobachtungen: o o o o o Farbe des Indikators bei bei Zugabe zu Natronlauge Temperatur vor Zugabe der Salzsäure Farbveränderungen bei Zugabe der Salzsäure Temperaturveränderungen
Abgestufte Lernhilfen Checkliste für die Beobachtungen: o o o o o Farbe des Indikators bei bei Zugabe zu Natronlauge Temperatur vor Zugabe der Salzsäure Farbveränderungen bei Zugabe der Salzsäure Temperaturveränderungen
Der Mensch kann ohne Gold, nicht aber ohne Salz leben.
 Text aus Schroedel, Chemieheute: Chloralkali-Elektrolyse "Der Mensch kann ohne Gold, nicht aber ohne Salz leben." Dieser Satz stammt von dem römischen Geschichtsschreiber CASSIODORUS, der vor etwa 1500
Text aus Schroedel, Chemieheute: Chloralkali-Elektrolyse "Der Mensch kann ohne Gold, nicht aber ohne Salz leben." Dieser Satz stammt von dem römischen Geschichtsschreiber CASSIODORUS, der vor etwa 1500
Untersuchung bauschädlicher Salze
 Untersuchung bauschädlicher Salze Am Beispiel der Freitreppe der Alten Nationalgalerie l i in Berlin Quelle: D. Ohnmeiß Gliederung Einleitung Aufbau und Sanierungsgeschichte Bestand und Zustand Untersuchungen
Untersuchung bauschädlicher Salze Am Beispiel der Freitreppe der Alten Nationalgalerie l i in Berlin Quelle: D. Ohnmeiß Gliederung Einleitung Aufbau und Sanierungsgeschichte Bestand und Zustand Untersuchungen
7. Sedimentationsprozesse im Meer 2
 7. Sedimentationsprozesse im Meer 2 - Transport und Ablagerung auf dem Schelf - Chemische und biogene Sedimentation - Meeresspiegelschwankungen - Kontinentalhang und Tiefsee Prof. Breitkreuz, TU-Freiberg,
7. Sedimentationsprozesse im Meer 2 - Transport und Ablagerung auf dem Schelf - Chemische und biogene Sedimentation - Meeresspiegelschwankungen - Kontinentalhang und Tiefsee Prof. Breitkreuz, TU-Freiberg,
Commodity Top News No. 16
 Commodity Top News No. 16 FAKTEN ANALYSEN WIRTSCHAFTLICHE HINTERGRUNDINFORMATIONEN Salz-Gemeinschaftsunternehmen esco Werner Gwosdz Die in Kassel ansässige K+S Aktiengesellschaft und der belgische Chemie-
Commodity Top News No. 16 FAKTEN ANALYSEN WIRTSCHAFTLICHE HINTERGRUNDINFORMATIONEN Salz-Gemeinschaftsunternehmen esco Werner Gwosdz Die in Kassel ansässige K+S Aktiengesellschaft und der belgische Chemie-
Atomverbände. Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner SALZE
 Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE 1 Einstieg: Schreck lass nach! Dieser Winter hat viele Teile der Schweiz mit seinen
Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE 1 Einstieg: Schreck lass nach! Dieser Winter hat viele Teile der Schweiz mit seinen
Chemieepoche Klasse 11. Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen
 Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Seminar: Chemische Formeln
 Seminar: Chemische Formeln G. Reibnegger und W. Windischhofer (Teil I zum Thema Hauptgruppenelemente) Ziel des Seminars: Formelschreibweise der wichtigsten anorganischen Verbindungen (Säuren, Basen, Salze).
Seminar: Chemische Formeln G. Reibnegger und W. Windischhofer (Teil I zum Thema Hauptgruppenelemente) Ziel des Seminars: Formelschreibweise der wichtigsten anorganischen Verbindungen (Säuren, Basen, Salze).
Kochsalz-Kristalle (Halit) Wichtige Stoffgruppen Atomverband Stoffgruppe Metall Metall: Metallische Stoffe Salzartige Stoffe Metall Nichtmetall:
 Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Die Stoffteilchen (II): Ionengruppen und ihre Ionen
 Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Crashkurs Säure-Base
 Crashkurs Säure-Base Was sind Säuren und Basen? Welche Eigenschaften haben sie?` Wie reagieren sie mit Wasser? Wie reagieren sie miteinander? Wie sind die Unterschiede in der Stärke definiert? Was ist
Crashkurs Säure-Base Was sind Säuren und Basen? Welche Eigenschaften haben sie?` Wie reagieren sie mit Wasser? Wie reagieren sie miteinander? Wie sind die Unterschiede in der Stärke definiert? Was ist
Entstehung von Salz Lehrerinformation
 Lehrerinformation 1/5 Arbeitsauftrag Ziel Material Sozialform Zeit Anhand einer Präsentation wird den SuS erklärt, wie sich Salzlager bilden. Die SuS diskutieren und folgen der Präsentation. Das Leseblatt
Lehrerinformation 1/5 Arbeitsauftrag Ziel Material Sozialform Zeit Anhand einer Präsentation wird den SuS erklärt, wie sich Salzlager bilden. Die SuS diskutieren und folgen der Präsentation. Das Leseblatt
Die Chlor-Alkali-Elektrolyse
 Die Chlor-Alkali-Elektrolyse Inhalt I. Ein kleiner Überblick II. Verwendung der Chemikalien III. Die Verfahren 1. Diaphragmaverfahren 2. Amalgamverfahren 3. Membranverfahren IV. Zusammenfassung Literatur
Die Chlor-Alkali-Elektrolyse Inhalt I. Ein kleiner Überblick II. Verwendung der Chemikalien III. Die Verfahren 1. Diaphragmaverfahren 2. Amalgamverfahren 3. Membranverfahren IV. Zusammenfassung Literatur
1 Das Periodensystem der Elemente (PSE)
 1 DAS PERIODENSYSTEM DER ELEMENTE (PSE) 1 G P E R I U P P E O D E Abbildung 1: Perioden und Gruppen 1 Das Periodensystem der Elemente (PSE) Man unterscheidet Perioden von Gruppen (siehe Abbildung auf dieser
1 DAS PERIODENSYSTEM DER ELEMENTE (PSE) 1 G P E R I U P P E O D E Abbildung 1: Perioden und Gruppen 1 Das Periodensystem der Elemente (PSE) Man unterscheidet Perioden von Gruppen (siehe Abbildung auf dieser
Lithium Der Rohstoff für die Energiespeicherung von morgen Wolfgang Voigt
 Institut für Anorganische Chemie Lithium Der Rohstoff für die Energiespeicherung von morgen Wolfgang Voigt 8. Master Class Conference Renewable Energies 3.12.2013, FH Eberswalde Lithium Leichtestes Metall
Institut für Anorganische Chemie Lithium Der Rohstoff für die Energiespeicherung von morgen Wolfgang Voigt 8. Master Class Conference Renewable Energies 3.12.2013, FH Eberswalde Lithium Leichtestes Metall
Wir wünschen viel Spaß beim Lesen und Würzen!
 INHALT Einleitung... 4 1 Was ist Salz?... 6 2 Welche Salzarten gibt es?... 8 3 Ist es empfehlenswert, Salz mit Zusätzen wie Jod zu verwenden?... 12 4 Wie viel Salz ist empfehlenswert?... 16 5 Bei welchen
INHALT Einleitung... 4 1 Was ist Salz?... 6 2 Welche Salzarten gibt es?... 8 3 Ist es empfehlenswert, Salz mit Zusätzen wie Jod zu verwenden?... 12 4 Wie viel Salz ist empfehlenswert?... 16 5 Bei welchen
Fällung und Flockung. Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen. Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung
 Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 27.01.2017 Agenda Auffrischung Definition
Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 27.01.2017 Agenda Auffrischung Definition
Grundlagen Chemie. Dipl.-Lab. Chem. Stephan Klotz. Freiwill ige Feuerwehr Rosenheim
 Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
Curriculum Chemie Klasse 9 Albert-Einstein-Gymnasium Ulm
 Curriculum Chemie Klasse 9 Albert-Einstein-Gymnasium Ulm Klasse 9 Themen Das Kern-Hülle-Modell Modell des Atomkerns Die Atomhülle im Energiestufenmodell Elektrische Ladung im Atom Das Kern-Hülle-Modell
Curriculum Chemie Klasse 9 Albert-Einstein-Gymnasium Ulm Klasse 9 Themen Das Kern-Hülle-Modell Modell des Atomkerns Die Atomhülle im Energiestufenmodell Elektrische Ladung im Atom Das Kern-Hülle-Modell
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
Der Schmelzpunkt von Salzen
 Der Schmelzpunkt von Salzen Vergleich die Smp. der Salze (links). Welche Rolle könnten die Ionenradien bzw. die Ladung der enthaltenen Ionen spielen? Der Schmelzpunkt von Salzen ist i.d.r. sehr hoch. Er
Der Schmelzpunkt von Salzen Vergleich die Smp. der Salze (links). Welche Rolle könnten die Ionenradien bzw. die Ladung der enthaltenen Ionen spielen? Der Schmelzpunkt von Salzen ist i.d.r. sehr hoch. Er
Allgemeine und anorganische Chemie. Chemie ist die Lehre von den Stoffen und den stofflichen Veränderungen.
 Allgemeine und anorganische Chemie 1. Inhalte und Aufgaben der Chemie - Chemische Grundbegriffe Chemie ist die Lehre von den Stoffen und den stofflichen Veränderungen. Chemische Verbindungen setzen sich
Allgemeine und anorganische Chemie 1. Inhalte und Aufgaben der Chemie - Chemische Grundbegriffe Chemie ist die Lehre von den Stoffen und den stofflichen Veränderungen. Chemische Verbindungen setzen sich
1. H 2 O Grundlagen Thermodynamik 2. Lösung / Fällung Silicium, Aluminium 3. Natrium, Kalium Ionenaustausch
 Institut für Geologie Lehrstuhl für Hydrogeologie Vorlesung Grundwasserbeschaffenheit 1. H 2 O Grundlagen Thermodynamik 2. Lösung / Fällung Silicium, Aluminium 3. trium, Kalium Ionenaustausch Prof. B.
Institut für Geologie Lehrstuhl für Hydrogeologie Vorlesung Grundwasserbeschaffenheit 1. H 2 O Grundlagen Thermodynamik 2. Lösung / Fällung Silicium, Aluminium 3. trium, Kalium Ionenaustausch Prof. B.
Applied mineralogy and non-metallic resources I
 Angewandte Mineralogie und nichtmetallische Rohstoffe: Nutzung und Umweltaspekte I 651-4097-00L Herbstsemester 2013 Applied mineralogy and non-metallic resources I 10. & 17. coal I & II ; coalification,
Angewandte Mineralogie und nichtmetallische Rohstoffe: Nutzung und Umweltaspekte I 651-4097-00L Herbstsemester 2013 Applied mineralogy and non-metallic resources I 10. & 17. coal I & II ; coalification,
[Co(NH 3 ) 2 (H 2 O) 2 ] 3+
![[Co(NH 3 ) 2 (H 2 O) 2 ] 3+ [Co(NH 3 ) 2 (H 2 O) 2 ] 3+](/thumbs/33/16366221.jpg) Kap. 7.3 Das Massenwirkungsgesetz Frage 121 Kap. 7.3 Das Massenwirkungsgesetz Antwort 121 Schreiben Sie das Massenwirkungsgesetz (MWG) für die folgende Reaktion auf: Fe 3+ (aq) + 3 SCN - (aq) Fe(SCN) 3
Kap. 7.3 Das Massenwirkungsgesetz Frage 121 Kap. 7.3 Das Massenwirkungsgesetz Antwort 121 Schreiben Sie das Massenwirkungsgesetz (MWG) für die folgende Reaktion auf: Fe 3+ (aq) + 3 SCN - (aq) Fe(SCN) 3
Alkalimetalle. 2. Betrachtung der Elemente der I. Hauptgruppe [1]
![Alkalimetalle. 2. Betrachtung der Elemente der I. Hauptgruppe [1] Alkalimetalle. 2. Betrachtung der Elemente der I. Hauptgruppe [1]](/thumbs/54/33109162.jpg) Universität Regensburg Institut für Anorganische Chemie: Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Wintersemester 2011/2012 02.12.2011 Betreuung: Dr. M. Andratschke Referenten: N. Achtenberg
Universität Regensburg Institut für Anorganische Chemie: Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Wintersemester 2011/2012 02.12.2011 Betreuung: Dr. M. Andratschke Referenten: N. Achtenberg
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie)
 Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
KSO SALZE UND DIE IONENBINDUNG GF TEIL 1
 KSO SALZE UND DIE IONENBINDUNG GF TEIL 1 Skript Salze und Ionenbindung Teil 1 GF V1.0 8/15 MMo, edited by Bor 1 INHALTSVERZEICHNIS "SALZE UND IONENBINDUNG Teil 1" 1. Natriumchlorid; DAS Salz... 02 1.1
KSO SALZE UND DIE IONENBINDUNG GF TEIL 1 Skript Salze und Ionenbindung Teil 1 GF V1.0 8/15 MMo, edited by Bor 1 INHALTSVERZEICHNIS "SALZE UND IONENBINDUNG Teil 1" 1. Natriumchlorid; DAS Salz... 02 1.1
Alkalimetalle. 1. Alkalimetalle Die 1. Hauptgruppe des Periodensystems der Elemente [1-4]
![Alkalimetalle. 1. Alkalimetalle Die 1. Hauptgruppe des Periodensystems der Elemente [1-4] Alkalimetalle. 1. Alkalimetalle Die 1. Hauptgruppe des Periodensystems der Elemente [1-4]](/thumbs/31/14796766.jpg) Universität Regensburg Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Wintersemester 2009/2010 20.11. 2009 Betreuung: Dr. M. Andratschke Referenten: Andreas
Universität Regensburg Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Wintersemester 2009/2010 20.11. 2009 Betreuung: Dr. M. Andratschke Referenten: Andreas
Seminar zum Grundpraktikum Anorganische Chemie
 Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität Duisburg-Essen Analyse 2 (NH 4 ) 2 CO 3 -Gruppe Ba 2+ Sr 2+ Ca 2+ Lösliche Gruppe Na + Mg 2+ NH 4+ Eigenschaften
Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität Duisburg-Essen Analyse 2 (NH 4 ) 2 CO 3 -Gruppe Ba 2+ Sr 2+ Ca 2+ Lösliche Gruppe Na + Mg 2+ NH 4+ Eigenschaften
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT Elementfamilien
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT Elementfamilien
Kalium im Meerwasser. Copyright 2006 Armin Glaser
 Kalium im Meerwasser Copyright 2006 Armin Glaser Kalium : Physiologie Kein Leben ohne Kalium! Denn Kalium... ist für alle Organismen ein essentieller Stoff ist das häufigstes Kation in Zellen wird benötigt
Kalium im Meerwasser Copyright 2006 Armin Glaser Kalium : Physiologie Kein Leben ohne Kalium! Denn Kalium... ist für alle Organismen ein essentieller Stoff ist das häufigstes Kation in Zellen wird benötigt
Technische Magnesia Mineralische Verbindungen für technische Anwendungen
 Technische Magnesia Mineralische Verbindungen für technische Anwendungen Wenn Sie mehr erwarten... Ihre Spezialisten für mineralische Verbindungen Hamburger Hafen Hauptsitz Lüneburg Logistikzentrum Lüneburg
Technische Magnesia Mineralische Verbindungen für technische Anwendungen Wenn Sie mehr erwarten... Ihre Spezialisten für mineralische Verbindungen Hamburger Hafen Hauptsitz Lüneburg Logistikzentrum Lüneburg
Orientierungstest für angehende Industriemeister. Vorbereitungskurs Chemie
 Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Production Technologies Erlaubte Hilfsmittel: Periodensystem der Elemente Maximale Bearbeitungszeit: 30 Minuten Provadis Partner
Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Production Technologies Erlaubte Hilfsmittel: Periodensystem der Elemente Maximale Bearbeitungszeit: 30 Minuten Provadis Partner
Name: Punktzahl: von 57 Note:
 Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
LEHRPLANÜBERSICHT: CHEMIE, KLASSE 7-10 (STAND: JANUAR 2010)
 LEHRPLANÜBERSICHT: CHEMIE, KLASSE 7-10 (STAND: JANUAR 2010) Regelschule Förderschule/Lernen Förderschule/Geistige Entwicklung Anmerkungen Regelschule Klasse 7 1. Stoffe und ihre Eigenschaften 9. Gegenstand
LEHRPLANÜBERSICHT: CHEMIE, KLASSE 7-10 (STAND: JANUAR 2010) Regelschule Förderschule/Lernen Förderschule/Geistige Entwicklung Anmerkungen Regelschule Klasse 7 1. Stoffe und ihre Eigenschaften 9. Gegenstand
3.2. Aufgaben zu Säure-Base-Gleichgewichten
 .. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
.. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
Schriftliche Abschlussprüfung Chemie
 Sächsisches Staatsministerium für Kultus Schuljahr 2005/2006 Geltungsbereich: für Klassenstufe 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Sächsisches Staatsministerium für Kultus Schuljahr 2005/2006 Geltungsbereich: für Klassenstufe 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Teil 3: Verfahrenstechnik ist eine Wissenschaft
 GVC: Gesellschaft für und Chemieingenieurwesen Teil 3: ist eine Wissenschaft 1 GVC: Gesellschaft für und Chemieingenieurwesen GVC: Gesellschaft für und Chemieingenieurwesen Rohstoffe GVC: Gesellschaft
GVC: Gesellschaft für und Chemieingenieurwesen Teil 3: ist eine Wissenschaft 1 GVC: Gesellschaft für und Chemieingenieurwesen GVC: Gesellschaft für und Chemieingenieurwesen Rohstoffe GVC: Gesellschaft
Grundlagen der Chemie für Nichtchemiker AUFGABENSAMMLUNG
 AUFGABENSAMMLUNG 1. Chemische Grundlagen: Masse -Berechnungen 1-1. Berechnen Sie die molaren Massen folgender Stoffe: a)caco 3 ; b)caso 4 2H 2 O; c)agcl; d)al 2 O 3 ; e)phenol C 6 H 5 OH; f)magnesiumammoniumphosphat-
AUFGABENSAMMLUNG 1. Chemische Grundlagen: Masse -Berechnungen 1-1. Berechnen Sie die molaren Massen folgender Stoffe: a)caco 3 ; b)caso 4 2H 2 O; c)agcl; d)al 2 O 3 ; e)phenol C 6 H 5 OH; f)magnesiumammoniumphosphat-
Alkalimetalle. 1. Die Alkalimetalle Allgemeines [1-3]
![Alkalimetalle. 1. Die Alkalimetalle Allgemeines [1-3] Alkalimetalle. 1. Die Alkalimetalle Allgemeines [1-3]](/thumbs/26/8777182.jpg) Universität Regensburg Wintersemester 2007/2008 Demonstrationsversuche in anorganischer Chemie 23.11.2007 Betreuerin: Dr. M. Andratschke Referenten: Marcus Stimming, Walter Buller Alkalimetalle 1. Die
Universität Regensburg Wintersemester 2007/2008 Demonstrationsversuche in anorganischer Chemie 23.11.2007 Betreuerin: Dr. M. Andratschke Referenten: Marcus Stimming, Walter Buller Alkalimetalle 1. Die
Stöchiometrie. (Chemisches Rechnen)
 Ausgabe 2007-10 Stöchiometrie (Chemisches Rechnen) ist die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen sowie der Mengenverhältnisse der beteiligten Stoffe bei chemischen Reaktionen
Ausgabe 2007-10 Stöchiometrie (Chemisches Rechnen) ist die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen sowie der Mengenverhältnisse der beteiligten Stoffe bei chemischen Reaktionen
Bundesrealgymnasium Imst. Chemie Klasse 7. Säuren und Basen
 Bundesrealgymnasium Imst Chemie 2010-11 Klasse 7 Säuren und Basen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 Klasse 7 Säuren und Basen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Didaktische FWU-DVD. Salz Das weiße Gold
 55 11232 Didaktische FWU-DVD Salz Das weiße Gold Zur Bedienung Mit den Pfeiltasten der Fernbedienung (DVD-Player) oder der Maus (Computer) können Sie Menüpunkte und Buttons ansteuern und mit der OK-Taste
55 11232 Didaktische FWU-DVD Salz Das weiße Gold Zur Bedienung Mit den Pfeiltasten der Fernbedienung (DVD-Player) oder der Maus (Computer) können Sie Menüpunkte und Buttons ansteuern und mit der OK-Taste
P1 Säuren und Laugen aus Erde, Feuer, Luft und Wasser (ca. 25 Stunden)
 SLZB Fachbereich Naturwissenschaften Schulinternes Curriculum für das Fach Chemie Klasse 9 P1 Säuren und Laugen aus Erde, Feuer, Luft und Wasser (ca. 25 ) Sicherheitsbelehrung Wdh. PSE Atombau Säuren und
SLZB Fachbereich Naturwissenschaften Schulinternes Curriculum für das Fach Chemie Klasse 9 P1 Säuren und Laugen aus Erde, Feuer, Luft und Wasser (ca. 25 ) Sicherheitsbelehrung Wdh. PSE Atombau Säuren und
Wiederholung der letzten Vorlesungsstunde: Thema: Metallbindung
 Wiederholung der letzten Vorlesungsstunde: Thema: Metallbindung Chemische Bindungen in Metallen, Elektronengasmodell, elektronische Bänder, Bandstrukturmodell, Metalle, Halbleiter, Isolatoren, Bandlücke,
Wiederholung der letzten Vorlesungsstunde: Thema: Metallbindung Chemische Bindungen in Metallen, Elektronengasmodell, elektronische Bänder, Bandstrukturmodell, Metalle, Halbleiter, Isolatoren, Bandlücke,
Chemieepoche Klasse 11. Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen
 Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Die wichtigsten anorganischen Säuren Schwefelsäure H 2 SO 4 ihre Salze heißen Sulfate Salpetersäure HNO 3 ihre Salze
Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Die wichtigsten anorganischen Säuren Schwefelsäure H 2 SO 4 ihre Salze heißen Sulfate Salpetersäure HNO 3 ihre Salze
Voransicht. Ein Übungszirkel zum Thema Salzbildung. Hintergrundinformationen. Jolanda Hermanns, Potsdam
 Ein Übungszirkel zum Thema Salzbildung Jolanda Hermanns, Potsdam Niveau: Dauer: Sek. I 6 Unterrichtsstunden Bezug zu den KMK-Bildungsstandards Fachkompetenz: Anwendung und Verknüpfung von Inhalten aus
Ein Übungszirkel zum Thema Salzbildung Jolanda Hermanns, Potsdam Niveau: Dauer: Sek. I 6 Unterrichtsstunden Bezug zu den KMK-Bildungsstandards Fachkompetenz: Anwendung und Verknüpfung von Inhalten aus
Seite 1 von Standortbestimmung / Äquivalenzprüfung. Chemie. Freitag, 23. Mai 2014, Uhr
 Seite 1 von 8 2. Standortbestimmung / Äquivalenzprüfung Chemie Freitag, 23. Mai 2014, 16.45-18.45 Uhr Dauer der Prüfung: 120 Minuten Erlaubte Hilfsmittel: Eine vom Dozenten visierte Formelsammlung, Ein
Seite 1 von 8 2. Standortbestimmung / Äquivalenzprüfung Chemie Freitag, 23. Mai 2014, 16.45-18.45 Uhr Dauer der Prüfung: 120 Minuten Erlaubte Hilfsmittel: Eine vom Dozenten visierte Formelsammlung, Ein
Alkalimetalle. Elemente Lithium Natrium Kalium Rubidium Cäsium Relative Atommasse 6,941 23,0 39,1 85,5 132,9
 Universität Regensburg Institut für Anorganische Chemie: Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Sommersemester 2014 11.06.2014 Betreuung: Dr. M. Andratschke Referenten: Frederik Knüttel,
Universität Regensburg Institut für Anorganische Chemie: Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Sommersemester 2014 11.06.2014 Betreuung: Dr. M. Andratschke Referenten: Frederik Knüttel,
Elektrochemie HS Zusatzübung. Übung Assistent: Olga Nibel. Tel.:
 Elektrochemie HS 2016 Übung 13 19.12.2016 Assistent: Olga Nibel Tel.: 056-310-2326 E-mail: olga.nibel@psi.ch Adresse: 5232 Villigen PSI, OVGA 101A Zusatzübung Kenngrössen Dichte (Fe): 7.87 g cm -3 Molare
Elektrochemie HS 2016 Übung 13 19.12.2016 Assistent: Olga Nibel Tel.: 056-310-2326 E-mail: olga.nibel@psi.ch Adresse: 5232 Villigen PSI, OVGA 101A Zusatzübung Kenngrössen Dichte (Fe): 7.87 g cm -3 Molare
KONSERVIERUNG VON NATURDÄRMEN: Folge 2
 KONSERVIERUNG: Zur Konservierung von Naturdarmprodukten verwendet man ausschließlich Kochsalz, umgangssprachlich auch als Salz (Speisesalz) bezeichnet. Dieses Salz ist eine Natriumchloridverbindung (NaCl),
KONSERVIERUNG: Zur Konservierung von Naturdarmprodukten verwendet man ausschließlich Kochsalz, umgangssprachlich auch als Salz (Speisesalz) bezeichnet. Dieses Salz ist eine Natriumchloridverbindung (NaCl),
Aufgaben Berechnungen zum Ansetzen von Lösungen :
 Übungsblatt Seite 1 von 6 Aufgaben Berechnungen zum Ansetzen von Lösungen : Berechnen Sie die Einwaagen bzw. Mischvolumina zum Ansetzen folgender Stammlösungen. Es sollen jeweils 100 ml Lösung hergestellt
Übungsblatt Seite 1 von 6 Aufgaben Berechnungen zum Ansetzen von Lösungen : Berechnen Sie die Einwaagen bzw. Mischvolumina zum Ansetzen folgender Stammlösungen. Es sollen jeweils 100 ml Lösung hergestellt
Chlorgas trifft auf elementares Natrium
 Reaktionsgleichungen Na (s) Na(l) Na (l) + Cl (g) NaCl (s) Zeitbedarf Vorbereitung: 60 min. Durchführung: 3 min. Nachbereitung: 30 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze
Reaktionsgleichungen Na (s) Na(l) Na (l) + Cl (g) NaCl (s) Zeitbedarf Vorbereitung: 60 min. Durchführung: 3 min. Nachbereitung: 30 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze
Eigenschaften Reinstoffe Elemente Kugelteilchen Elementes Atom
 Einstieg: Atom Der Chemiker will alles genau untersuchen, um die Eigenschaften von Stoffen heraus zu finden. Er trennt Gemische in Reinstoffe. Er analysiert Reinstoffe, so dass sie in ihre Elemente zerfallen.
Einstieg: Atom Der Chemiker will alles genau untersuchen, um die Eigenschaften von Stoffen heraus zu finden. Er trennt Gemische in Reinstoffe. Er analysiert Reinstoffe, so dass sie in ihre Elemente zerfallen.
Lösungen, Salze, Ionen und Elektrolyte
 Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Schulcurriculum des Faches Chemie. für die Klassenstufen 8 10
 Schulcurriculum des Faches Chemie für die Klassenstufen 8 10 Chemie - Klasse 8 Was ist Chemie? Richtig experimentieren und Entsorgen Naturwissenschaftliche Arbeitsweise Rotkraut oder Blaukraut? Richtig
Schulcurriculum des Faches Chemie für die Klassenstufen 8 10 Chemie - Klasse 8 Was ist Chemie? Richtig experimentieren und Entsorgen Naturwissenschaftliche Arbeitsweise Rotkraut oder Blaukraut? Richtig
ph-wert Berechnung für starke Säuren / Basen
 ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
ph-wert Berechnung für starke Säuren / Basen 0.1 mol/l HCl: HCl + H 2 O H 3 O + + Cl starke Säure, vollständige Dissoziation [H 3 O + ] = 10 1 mol/l; ph = 1 0.1 mol/l NaOH: NaOH + H 2 O Na + aq + OH starke
ABFALLWIRTSCHAFT UND ABFALLENTSORGUNG
 ABFALLWIRTSCHAFT UND ABFALLENTSORGUNG Peter Lechner & Marion Huber-Humer MVA-Schlacke LVA-Nr. 813.100 & 101 Studienjahr 2011/2012 Studienjahr 2011/12 LVA 813.100 & 101 2 Stoffströme einer MVA Restabfall
ABFALLWIRTSCHAFT UND ABFALLENTSORGUNG Peter Lechner & Marion Huber-Humer MVA-Schlacke LVA-Nr. 813.100 & 101 Studienjahr 2011/2012 Studienjahr 2011/12 LVA 813.100 & 101 2 Stoffströme einer MVA Restabfall
Wiederholungen. Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers. ph-wert-berechnungen. Titrationskurvenberechnung
 Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
Anorganische-Chemie. Dr. Stefan Wuttke Butenandstr. 11, Haus E, E
 Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de Anorganische-Chemie Grundpraktikum für Biologen 2014/2015 Inhaltliche Schwerpunkte Stöchiometrie
Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de Anorganische-Chemie Grundpraktikum für Biologen 2014/2015 Inhaltliche Schwerpunkte Stöchiometrie
Mineralstoffe (Michael Büchel & Julian Appel)
 Mineralstoffe (Michael Büchel & Julian Appel) Funktion & Vorkommen Kalzium ist beteiligt am Aufbau von Knochen und Zähnen. Wichtig für die Blutgerinnung und die Muskelarbeit. Hilft Nervensignale zu übermitteln.
Mineralstoffe (Michael Büchel & Julian Appel) Funktion & Vorkommen Kalzium ist beteiligt am Aufbau von Knochen und Zähnen. Wichtig für die Blutgerinnung und die Muskelarbeit. Hilft Nervensignale zu übermitteln.
Alkali- und Erdalkalimetalle und ihre Verbindungen
 Alkali- und Erdalkalimetalle und ihre Verbindungen 1. Zur Einführung Die Metalle der ersten (Alkalimetalle) und zweiten Hauptgruppe (Erdalkalimetalle) des Periodensystems sind sehr reaktive Stoffe, deren
Alkali- und Erdalkalimetalle und ihre Verbindungen 1. Zur Einführung Die Metalle der ersten (Alkalimetalle) und zweiten Hauptgruppe (Erdalkalimetalle) des Periodensystems sind sehr reaktive Stoffe, deren
Codexkapitel B 21. Speisesalz INHALTSVERZEICHNIS I. BESCHREIBUNG 1-4 II. CHEMISCHE UND PHYSIKALISCHE ANFORDERUNGEN 5-9 III.
 Codexkapitel B 21 Speisesalz INHALTSVERZEICHNIS Absätze I. BESCHREIBUNG 1-4 II. CHEMISCHE UND PHYSIKALISCHE ANFORDERUNGEN 5-9 III. BEZEICHNUNG 10-13 IV. BEURTEILUNG 14-19 V. REGELUNG DES VERKEHRS 20-25
Codexkapitel B 21 Speisesalz INHALTSVERZEICHNIS Absätze I. BESCHREIBUNG 1-4 II. CHEMISCHE UND PHYSIKALISCHE ANFORDERUNGEN 5-9 III. BEZEICHNUNG 10-13 IV. BEURTEILUNG 14-19 V. REGELUNG DES VERKEHRS 20-25
Kapitel 13: Laugen und Neutralisation
 Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Lösung Sauerstoff: 1s 2 2s 2 2p 4, Bor: 1s 2 2s 2 2p 1, Chlor: 1s 2 2s 2 2p 6 3s 2 3p 5 Neon: 1s 2 2s 2 2p 6
 1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
Kalibrier-,Kontroll- und Prüflösungen fü
 Kalibrier-,Kontroll- und Prüflösungen fü Eichlösungen- Prüflösungen für die Photometrie, ISE und Kalibrierlösungenfür Überwachungsautomaten im Klärwerksbereich Ammonium N(NH4) Kalibrierlösung Ammonium
Kalibrier-,Kontroll- und Prüflösungen fü Eichlösungen- Prüflösungen für die Photometrie, ISE und Kalibrierlösungenfür Überwachungsautomaten im Klärwerksbereich Ammonium N(NH4) Kalibrierlösung Ammonium
Magnesit (MgCO 3 ) und Magnesia (MgO)
 Magnesit (MgCO 3 ) und Magnesia (MgO) Mg ist achthäufigstes Element der Erdkruste Mg 2+ -Konzentration im Meerwasser: 0,129% Mg ist zentraler Bestandteil des Chlorophylls Jährliche Förderung 25 Mio Tonnen
Magnesit (MgCO 3 ) und Magnesia (MgO) Mg ist achthäufigstes Element der Erdkruste Mg 2+ -Konzentration im Meerwasser: 0,129% Mg ist zentraler Bestandteil des Chlorophylls Jährliche Förderung 25 Mio Tonnen
Dr. - Ing. Martin Buchholz, Technische Universität Berlin, Watergy GmbH Berlin Closed Greenhouse Systems - A Source of Water, Energy and Food
 Closed Greenhouse Systems - A Source of Water, Energy and Food Dr.-Ing. Martin Buchholz TU-Berlin, Building Technology and Design CEO Watergy GmbH, Berlin Watergy, a closed greenhouse with internal
Closed Greenhouse Systems - A Source of Water, Energy and Food Dr.-Ing. Martin Buchholz TU-Berlin, Building Technology and Design CEO Watergy GmbH, Berlin Watergy, a closed greenhouse with internal
7. Teil: Der Mensch und die Elemente (Anorganische Zusatzstoffe im Alltag) Dr. A. Hepp (25.01.10)
 Zusatzinformation zum Anorganisch Chemischen Grundpraktikum 7. Teil: Der Mensch und die Elemente (Anorganische Zusatzstoffe im Alltag) Dr. A. Hepp (25.01.10) Uni- Münster Zusatzinform. zum Anorganisch
Zusatzinformation zum Anorganisch Chemischen Grundpraktikum 7. Teil: Der Mensch und die Elemente (Anorganische Zusatzstoffe im Alltag) Dr. A. Hepp (25.01.10) Uni- Münster Zusatzinform. zum Anorganisch
Chemikalien: Salzsäure (Schwefelsäure) Magnesiumspäne, Eisen-, Zink-, Kupfer-Späne, Silberstreifen
 I) Verhalten von Säuren gegenüber Metallen II) Der Saure Regen in Modellversuchen III) Neutralisation a) Neutralisation ( Salzsäure mit Natronlauge) b) Eindampfen der Salzlösung c) Elektrische Leitfähigkeitsmessung
I) Verhalten von Säuren gegenüber Metallen II) Der Saure Regen in Modellversuchen III) Neutralisation a) Neutralisation ( Salzsäure mit Natronlauge) b) Eindampfen der Salzlösung c) Elektrische Leitfähigkeitsmessung
Ampere ist die Einheit der Stromstärke. Das Messgerät heißt Amperemeter. Die Stromstärke gibt an, wie viele Elektronen pro Sekunde durch den Draht
 Ampere ist die Einheit der Stromstärke. Das Messgerät heißt Amperemeter. Die Stromstärke gibt an, wie viele Elektronen pro Sekunde durch den Draht rinnen. Alkohole sind chemische Verbindungen, der Alkohol,
Ampere ist die Einheit der Stromstärke. Das Messgerät heißt Amperemeter. Die Stromstärke gibt an, wie viele Elektronen pro Sekunde durch den Draht rinnen. Alkohole sind chemische Verbindungen, der Alkohol,
