C.S.I. Dem Täter auf der Spur
|
|
|
- Berthold Lehmann
- vor 6 Jahren
- Abrufe
Transkript
1 C.S.I. Dem Täter auf der Spur Was ist geschehen? In der Europaschule Jagenbach wurden aus dem Schulkiosk 230 entwendet. Welches Beweismittel wurde gesichert? Ein Schüler ist vor dem Schulkiosk auf etwas getreten und hat ein weißes Pulver auf seiner Schuhsohle festgestellt. Diese Seite muss für den Schüler während der Bearbeitung der Aufgaben immer sichtbar sein. Welche Tatverdächtigen gibt es? Klaus Klauer aus der 1a ist während der Biologiestunde mit einer Salzbrezel aufs WC gegangen. Stefanie Stibizer aus der 3b ist auf dem Weg in die Schulküche am Kiosk vorbeigekommen. Dort sollte sie Zucker holen. Zwei Schüler, Simon und Sabine, wollen den Täter überführen Sie müssen herausfinden, ob es sich bei dem weißen Pulver um Salz oder Zucker handelt. Sie dürfen es nicht probieren, denn es könnte das Rattengift sein, das der Schulwart im Keller auslegt. Klaus Klauer hat das Geld entwendet und dabei etwas Salz von seiner Salzbrezel verloren. Es könnte auch Stefanie Stibizer gewesen sein. Sie sollte Zucker holen. Stella-Klein-Löw-Weg 15 / Rund Vier B, 2.OG / 1020 Wien / Telefon / Fax / office.wien@bifie.at / Seite 1
2 Welche Untersuchungen machen Simon und Sabine? Sie haben folgende Materialien zur Verfügung: Wasser Lupe Kaffeefilter mit Filtertüte Kerze Batterie Glühlampe Kabel Diese Seite muss für den Schüler während der Bearbeitung der Aufgaben immer sichtbar sein. Streichhölzer Löffel Glas Magnet Stella-Klein-Löw-Weg 15 / Rund Vier B, 2.OG / 1020 Wien / Telefon / Fax / office.wien@bifie.at / Seite 2
3 Außerdem finden sie in einem Lexikon folgende Informationen, die sie auf einem Zettel zusammenfassen: Sabines Zettel: Zucker besteht aus Molekülen mit der Formel C12H22O11. Moleküle sind elektrisch neutral. Moleküle können in Wasser gelöst keine Ladungen transportieren. Kochsalz hat die Formel NaCl. Beim Auflösen in Wasser zerfällt Kochsalz in Natriumionen (Na ) und Chloridionen (Cl - ). Diese Ionen sind frei beweglich und können Ladungen transportieren. Auch Rattengift enthält Ionen und leitet in Wasser gelöst den elektrischen Strom. Simons Zettel: Organische Stoffe enthalten Kohlenstoff C. Sie werden beim Erhitzen schwarz, sie verkohlen. Zucker hat die Formel C12H22O11. Kochsalz hat die Formel NaCl. Rattengift hat die Formel C21 H23 Cl N2 O2. 1. Sabine und Simon planen je einen Versuch, in dem sie ihre Informationen verwenden, um herauszufinden, um welchen der drei Stoffe es sich handeln könnte. Welche Geräte und Materialien brauchen sie dazu jeweils? Sabines Versuch: o Lupe o Magnet o Batterie o Kabel o Glühlampe o Wasser o Glas o Kaffeefilter mit Filtertüte o Löffel o Kerze o Streichhölzer Simons Versuch: o Lupe o Magnet o Batterie o Kabel o Glühlampe o Wasser o Glas o Kaffeefilter mit Filtertüte o Löffel o Kerze o Streichhölzer Stella-Klein-Löw-Weg 15 / Rund Vier B, 2.OG / 1020 Wien / Telefon / Fax / office.wien@bifie.at / Seite 3
4 2. Mit welchen Versuchen können sie herausfinden, um welches Pulver es sich handeln könnte? Wähle zwei Versuche aus! Kennzeichne die entsprechenden Bilder! Dieses Beispiel darf erst sichtbar werden, wenn, Beispiel 1 beantwortet ist. Beispiel 1 darf nachher nicht mehr verändert werden. Erhitzen Lösen und Filtrieren Prüfen der Leitfähigkeit Prüfung mit einem Magneten Untersuchung mit der Lupe Stella-Klein-Löw-Weg 15 / Rund Vier B, 2.OG / 1020 Wien / Telefon / Fax / office.wien@bifie.at / Seite 4
5 3. Simon und Sabine lösen das weiße Pulver in Wasser und prüfen die Leitfähigkeit dieser Lösung. Was geschieht, wenn man die Batterie anschließt? Informationen dazu findest du auf Sabines Zettel (siehe vorne) Kreuze die richtige(n) Aussage(n) an: o Wenn die Lösung Zucker enthält, bildet sich ein Bodensatz aus Zucker. o Wenn die Lösung Kochsalz enthält, bildet sich ein Bodensatz aus Kochsalz. o Wenn die Lösung Zucker enthält, leuchtet das Lämpchen. o Wenn die Lösung Kochsalz enthält, leuchtet das Lämpchen. o Wenn die Lösung Zucker enthält, verfärbt sie sich. o Wenn die Lösung Kochsalz enthält, verfärbt sich. Prüfen der Leitfähigkeit Stella-Klein-Löw-Weg 15 / Rund Vier B, 2.OG / 1020 Wien / Telefon / Fax / office.wien@bifie.at / Seite 5
6 4. Simon findet bei der Suche im Internet auch noch Bilder zum Thema Leitfähigkeit. Er weiß, dass ein Bild die Teilchen einer Kochsalzlösung darstellt. Ein anderes Bild zeigt die Teilchen einer Zuckerlösung. Welches Bild gehört zu welcher Lösung?! Informationen dazu findest du auf Sabines Zettel (siehe vorne) Metallbindung: Die frei beweglichen Elektronen transportieren die elektrische Ladung. Atombindung: Die elektrisch neutralen Moleküle können keine Ladungen transportieren. Ionenbindung: Die Ionen sind im Wasser frei beweglich und transportieren so elektrische Ladung. o Kochsalzlösung o Zuckerlösung o keine der beiden Lösungen o Kochsalzlösung o Zuckerlösung o keine der beiden Lösungen o Kochsalzlösung o Zuckerlösung o keine der beiden Lösungen Stella-Klein-Löw-Weg 15 / Rund Vier B, 2.OG / 1020 Wien / Telefon / Fax / office.wien@bifie.at / Seite 6 Kreuze in allen Kästchen die richtigen Lösungen an!
7 5. In einem zweiten Versuch erhitzen Simon und Sabine das weiße Pulver. Kreuze die richtige(n) Aussage(n) an: Informationen dazu findest du auf Simons Zettel (siehe vorne). a) Wenn es verkohlt, könnte es... o Zucker sein, o Kochsalz sein, o Rattengift sein. b) Wenn es sich nicht verändert, könnte es... o Zucker sein, o Kochsalz sein, o Rattengift sein. Erhitzen Stella-Klein-Löw-Weg 15 / Rund Vier B, 2.OG / 1020 Wien / Telefon / Fax / office.wien@bifie.at / Seite 7
8 6. Simon und Sabine machen bei ihren Untersuchungen folgende Beobachtungen: Prüfen der Leitfähigkeit: Das in Wasser gelöste Pulver leitet den elektrischen Strom. Erhitzen: Das Pulver verändert beim Erhitzen die Farbe nicht. Das weiße Pulver ist o Zucker o Kochsalz o Rattengift Stella-Klein-Löw-Weg 15 / Rund Vier B, 2.OG / 1020 Wien / Telefon / Fax / office.wien@bifie.at / Seite 8
Löslichkeit: Welche Stoffe mischen sich?
 Löslichkeit: Welche Stoffe mischen sich? Für die Mischungsversuche wurden,, und verwendet. und sind farblos, ist gelblich. In den dargestellten Proberöhrchen wurden jeweils zwei Stoffe gemischt. Nach einiger
Löslichkeit: Welche Stoffe mischen sich? Für die Mischungsversuche wurden,, und verwendet. und sind farblos, ist gelblich. In den dargestellten Proberöhrchen wurden jeweils zwei Stoffe gemischt. Nach einiger
Einführender Text: 1. Was passiert deiner Meinung nach? Kreuze an!
 Leiter oder Nichtleiter? Benötigte Arbeitszeit: 10 Minuten Bereich: Elektrische Leiter und Nichtleiter Bild 1: www.elektrotechnik.uni-rostock.de/studium Einführender Text: Simone macht mit ihren Eltern
Leiter oder Nichtleiter? Benötigte Arbeitszeit: 10 Minuten Bereich: Elektrische Leiter und Nichtleiter Bild 1: www.elektrotechnik.uni-rostock.de/studium Einführender Text: Simone macht mit ihren Eltern
Name: Punktzahl: von 57 Note:
 Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Wasser löst fast alles
 1 Wasser löst fast alles In manchen Regionen ist das Wasser ganz schön hart. Nicht, dass Steine aus der Dusche fallen, wie in diesem Cartoon; aber durch Verdunsten oder Verdampfen von Wasser können Ablagerungen
1 Wasser löst fast alles In manchen Regionen ist das Wasser ganz schön hart. Nicht, dass Steine aus der Dusche fallen, wie in diesem Cartoon; aber durch Verdunsten oder Verdampfen von Wasser können Ablagerungen
Schüler und Schülerinnen im Labor in Rechtenthal. 4 weiße Stoffe
 Schüler und Schülerinnen im Labor in Rechtenthal 4 weiße Stoffe Chemische Laborgeräte (www.seilnacht.com) Chemische Stoffe unterscheiden sich durch ihre Eigenschaften 4 weiße Stoffe: Von außen sind sie
Schüler und Schülerinnen im Labor in Rechtenthal 4 weiße Stoffe Chemische Laborgeräte (www.seilnacht.com) Chemische Stoffe unterscheiden sich durch ihre Eigenschaften 4 weiße Stoffe: Von außen sind sie
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1. Grundwissen 8.Klasse 2 Grundwissen 8.Klasse 2. Stoffebene. Teilchen -ebene
 Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Elektrizitätslehre. Aufgabe: Fülle die freien Felder aus!
 1. Das Lämpchen wird mit einer Batterie geprüft. Ein intaktes Lämpchen würde nicht Die Batterie wird auf diese Art kurzgeschlossen. Ein intaktes Lämpchen würde 2. Was wird hier gemessen? Strom Spannung
1. Das Lämpchen wird mit einer Batterie geprüft. Ein intaktes Lämpchen würde nicht Die Batterie wird auf diese Art kurzgeschlossen. Ein intaktes Lämpchen würde 2. Was wird hier gemessen? Strom Spannung
Die Stoffteilchen (II): Ionengruppen und ihre Ionen
 Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Verbraucher. Schalter / offen
 Elektrischer Strom Strom... treibt Maschinen an... Licht... Heizung... Kraftwerk... GEFAHR Begriffe: Stromkreis Stromquelle Schaltskizze (Schaltplan) Symbole für die Schaltskizze: Verbraucher (z. B. Glühlämpchen)
Elektrischer Strom Strom... treibt Maschinen an... Licht... Heizung... Kraftwerk... GEFAHR Begriffe: Stromkreis Stromquelle Schaltskizze (Schaltplan) Symbole für die Schaltskizze: Verbraucher (z. B. Glühlämpchen)
Physikalische Grundlagen Inhalt
 Physikalische Grundlagen Inhalt Das Atommodell nach Bohr Die Gleichspannung Der Gleichstrom Der Stromfluss in Metallen Der Stromfluss in Flüssigkeiten Die Elektrolyse Die Wechselspannung Der Wechselstrom
Physikalische Grundlagen Inhalt Das Atommodell nach Bohr Die Gleichspannung Der Gleichstrom Der Stromfluss in Metallen Der Stromfluss in Flüssigkeiten Die Elektrolyse Die Wechselspannung Der Wechselstrom
Untersuche an einigen Beispielen, welche Grundstoffe am Aufbau unserer Nahrung beteiligt sind.
 Naturwissenschaften - Biologie - Allgemeine Biologie - 4 Unsere Nahrungsmittel und ihre Verdauung (P802200) 4. Nahrungsmittel und Nährstoffe Experiment von: Phywe Gedruckt: 07.0.203 5:36:8 intertess (Version
Naturwissenschaften - Biologie - Allgemeine Biologie - 4 Unsere Nahrungsmittel und ihre Verdauung (P802200) 4. Nahrungsmittel und Nährstoffe Experiment von: Phywe Gedruckt: 07.0.203 5:36:8 intertess (Version
Mischen und. Trennen. Forschertagebuch von
 Mischen und Trennen Forschertagebuch von Forscherauftrag 1 Ein Stück Zucker geht baden > 2 Gläser > zwei Zuckerwürfel > warmes und kaltes Wasser > ein Thermometer > Traubenzucker 1. Fülle beide Gläser
Mischen und Trennen Forschertagebuch von Forscherauftrag 1 Ein Stück Zucker geht baden > 2 Gläser > zwei Zuckerwürfel > warmes und kaltes Wasser > ein Thermometer > Traubenzucker 1. Fülle beide Gläser
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1. Grundwissen 9.Klasse SG 2 Grundwissen 9.Klasse SG 2. Stoffebene.
 Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE
 SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
Schweizerische Maturitätsprüfung Gruppe / Kandidat/in Nr:... Sommer 2010, Bern Name/Vorname:...
 Gruppe / Kandidat/in Nr:... Name/Vorname:... Grundlagenfach Bereich Teil: NATURWISSENSAFTEN hemie Verfasser: Richtzeit: ilfsmittel: inweise: R. Guenin, J. Lipscher, S. Steiner 80 Minuten (von total 4 Stunden)
Gruppe / Kandidat/in Nr:... Name/Vorname:... Grundlagenfach Bereich Teil: NATURWISSENSAFTEN hemie Verfasser: Richtzeit: ilfsmittel: inweise: R. Guenin, J. Lipscher, S. Steiner 80 Minuten (von total 4 Stunden)
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Atombindung. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Atombindung Das komplette Material finden Sie hier: School-Scout.de Titel: Atombindungen Reihe: Lernwerkstatt Bestellnummer:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Atombindung Das komplette Material finden Sie hier: School-Scout.de Titel: Atombindungen Reihe: Lernwerkstatt Bestellnummer:
Grundlagen. Maximilian Ernestus Waldorfschule Saarbrücken
 Grundlagen Maximilian Ernestus Waldorfschule Saarbrücken 2008/2009 Inhaltsverzeichnis 1 Chemische Elemente 2 2 Das Teilchenmodell 3 3 Mischungen und Trennverfahren 4 4 Grundgesetze chemischer Reaktionen
Grundlagen Maximilian Ernestus Waldorfschule Saarbrücken 2008/2009 Inhaltsverzeichnis 1 Chemische Elemente 2 2 Das Teilchenmodell 3 3 Mischungen und Trennverfahren 4 4 Grundgesetze chemischer Reaktionen
Abgestufte Lernhilfen
 Abgestufte Lernhilfen Checkliste für die Beobachtungen: o o o o o Farbe des Indikators bei bei Zugabe zu Natronlauge Temperatur vor Zugabe der Salzsäure Farbveränderungen bei Zugabe der Salzsäure Temperaturveränderungen
Abgestufte Lernhilfen Checkliste für die Beobachtungen: o o o o o Farbe des Indikators bei bei Zugabe zu Natronlauge Temperatur vor Zugabe der Salzsäure Farbveränderungen bei Zugabe der Salzsäure Temperaturveränderungen
Chemische Bindung. Chemische Bindung
 Chemische Bindung Atome verbinden sich zu Molekülen oder Gittern, um eine Edelgaskonfiguration zu erreichen. Es gibt drei verschiedene Arten der chemischen Bindung: Atombindung Chemische Bindung Gesetz
Chemische Bindung Atome verbinden sich zu Molekülen oder Gittern, um eine Edelgaskonfiguration zu erreichen. Es gibt drei verschiedene Arten der chemischen Bindung: Atombindung Chemische Bindung Gesetz
Freie Elektronen bilden ein Elektronengas. Feste positive Aluminiumionen. Abb. 1.1: Metallbindung: Feste Atomrümpfe und freie Valenzelektronen
 1 Grundlagen 1.1 Leiter Nichtleiter Halbleiter 1.1.1 Leiter Leiter sind generell Stoffe, die die Eigenschaft haben verschiedene arten weiterzuleiten. Im Folgenden steht dabei die Leitfähigkeit des elektrischen
1 Grundlagen 1.1 Leiter Nichtleiter Halbleiter 1.1.1 Leiter Leiter sind generell Stoffe, die die Eigenschaft haben verschiedene arten weiterzuleiten. Im Folgenden steht dabei die Leitfähigkeit des elektrischen
Schüler und Schülerinnen im Labor in Rechtenthal. 5 weiße Stoffe. Name:. Klasse: Lehrpersonen: Schule: Ich arbeite in einer Gruppe mit:..
 Schüler und Schülerinnen im Labor in Rechtenthal 5 weiße Stoffe Datum: Name:. Klasse: Lehrpersonen: Schule: Ich arbeite in einer Gruppe mit:.. .. Chemische Laborgeräte (www.seilnacht.com) (Die Laborgeräte,
Schüler und Schülerinnen im Labor in Rechtenthal 5 weiße Stoffe Datum: Name:. Klasse: Lehrpersonen: Schule: Ich arbeite in einer Gruppe mit:.. .. Chemische Laborgeräte (www.seilnacht.com) (Die Laborgeräte,
Kapitel 13: Laugen und Neutralisation
 Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Lösungen, Salze, Ionen und Elektrolyte
 Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Die Stoffteilchen (II): Ionengruppen und ihre Ionen
 Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Geht dir ein Licht auf?
 Geht dir ein Licht auf? Im folgenden Experiment wirst du erfahren, wie du mit einfachen Mitteln ein Lämpchen zum Leuchten bringst. Materialien - Glühlämpchen - Flachbatterie Auftrag Die folgenden Abbildungen
Geht dir ein Licht auf? Im folgenden Experiment wirst du erfahren, wie du mit einfachen Mitteln ein Lämpchen zum Leuchten bringst. Materialien - Glühlämpchen - Flachbatterie Auftrag Die folgenden Abbildungen
Lernmaterial Lernfeld 1 Grundlagen Physik und Chemie. Chemische Grundlagen, Bindungsarten. Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms
 Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Experiment Version 1
 Stoffe an ihren Eigenschaften erkennen Eperiment Version 1 Hier ist ein Auszug aus einem Schülerheft. Der Arbeitsauftrag ist schwarz geschrieben. Der blaue Tet stammt von einem Schüler. Aufgabe: Die drei
Stoffe an ihren Eigenschaften erkennen Eperiment Version 1 Hier ist ein Auszug aus einem Schülerheft. Der Arbeitsauftrag ist schwarz geschrieben. Der blaue Tet stammt von einem Schüler. Aufgabe: Die drei
Chemieepoche Klasse 11. Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen
 Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Die kovalente Bindung
 Die kovalente Bindung Atome, die keine abgeschlossene Elektronenschale besitzen, können über eine kovalente Bindung dieses Ziel erreichen. Beispiel: 4 H H + C H H C H H Die Wasserstoffatome erreichen damit
Die kovalente Bindung Atome, die keine abgeschlossene Elektronenschale besitzen, können über eine kovalente Bindung dieses Ziel erreichen. Beispiel: 4 H H + C H H C H H Die Wasserstoffatome erreichen damit
Teilchenmodell. Aggregatzustände. Diffusion. Spezifische Eigenschaften = Stoffeigenschaften
 Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Tatort Küche. Versuch 1: Rotkohl. Aufgabe: Geräte und Chemikalien: Versuchsdurchführung: Beobachtungen: Auswertung:
 Tatort Küche Aufgabe: Es muss anhand von chemischen Versuchen herausgefunden werden, welcher von drei sehr ähnlich aussehenden Feststoffen Zucker, welcher Kochsalz und welcher Zitronensäure ist. Das Kosten
Tatort Küche Aufgabe: Es muss anhand von chemischen Versuchen herausgefunden werden, welcher von drei sehr ähnlich aussehenden Feststoffen Zucker, welcher Kochsalz und welcher Zitronensäure ist. Das Kosten
-1 (außer in Verbindung mit Sauerstoff: variabel) Sauerstoff -2 (außer in Peroxiden: -1)
 1) DEFINITIONEN DIE REDOXREAKTION Eine Redoxreaktion = Reaktion mit Elektronenübertragung sie teilt sich in Oxidation = Elektronenabgabe Reduktion = Elektronenaufnahme z.b.: Mg Mg 2 + 2 e z.b.: Cl 2 +
1) DEFINITIONEN DIE REDOXREAKTION Eine Redoxreaktion = Reaktion mit Elektronenübertragung sie teilt sich in Oxidation = Elektronenabgabe Reduktion = Elektronenaufnahme z.b.: Mg Mg 2 + 2 e z.b.: Cl 2 +
Robinson braucht Hilfe Stoffeigenschaften experimentell erkunden
 1 von 30 Robinson braucht Hilfe Stoffeigenschaften experimentell erkunden Ira Caspari und Sebastian Reusch, Höhr-Grenzhausen Der schiffbrüchige Robinson indet Vorratssäcke, die gleich aussehende Stoffe
1 von 30 Robinson braucht Hilfe Stoffeigenschaften experimentell erkunden Ira Caspari und Sebastian Reusch, Höhr-Grenzhausen Der schiffbrüchige Robinson indet Vorratssäcke, die gleich aussehende Stoffe
Kochsalz-Kristalle (Halit) Wichtige Stoffgruppen Atomverband Stoffgruppe Metall Metall: Metallische Stoffe Salzartige Stoffe Metall Nichtmetall:
 Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Periodensystem (PSE)
 Periodensystem (PSE) - Wie sind die Elemente im PSE angeordnet? - Warum und nach welchen Kritierien können sie so angeordnet werden? - Was kann man aus dem PSE ablesen, außer der Massenzahl? Fragen zum
Periodensystem (PSE) - Wie sind die Elemente im PSE angeordnet? - Warum und nach welchen Kritierien können sie so angeordnet werden? - Was kann man aus dem PSE ablesen, außer der Massenzahl? Fragen zum
41. Welches der folgenden Elemente zeigt die geringste Tendenz, Ionen zu bilden?
 41. Welches der folgenden Elemente zeigt die geringste Tendenz, Ionen zu bilden? A) Ca B) C C) F D) Na 42. Steinsalz löst sich in Wasser, A) weil beide Ionen Hydrathüllen bilden können B) es eine Säure
41. Welches der folgenden Elemente zeigt die geringste Tendenz, Ionen zu bilden? A) Ca B) C C) F D) Na 42. Steinsalz löst sich in Wasser, A) weil beide Ionen Hydrathüllen bilden können B) es eine Säure
RAHMENRICHTLINIEN SEKUNDARSCHULE CHEMIE KULTUSMINISTERIUM. Schuljahrgänge 7 10
 RAHMENRICHTLINIEN SEKUNDARSCHULE (Ergänzung der RRL Sekundarschule Schuljahrgänge 7 10 in Umsetzung der Bildungsstandards für das Fach Chemie für den Mittleren Schulabschluss) CHEMIE Schuljahrgänge 7 10
RAHMENRICHTLINIEN SEKUNDARSCHULE (Ergänzung der RRL Sekundarschule Schuljahrgänge 7 10 in Umsetzung der Bildungsstandards für das Fach Chemie für den Mittleren Schulabschluss) CHEMIE Schuljahrgänge 7 10
Chemie 8. In der Jahrgangsstufe 8 erwerben die Schüler folgendes Grundwissen:
 In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
Kontext. Doch wie sieht Salzwasser eigentlich auf der Teilchenebene aus?
 Kontext Wenn ihr schon einmal Urlaub am Meer gemacht habt und im Meer schwimmen gegangen seid, dann kennt ihr es sicherlich: Kaum verschluckt man ein wenig Wasser, schon hat man einen unangenehmen Geschmack
Kontext Wenn ihr schon einmal Urlaub am Meer gemacht habt und im Meer schwimmen gegangen seid, dann kennt ihr es sicherlich: Kaum verschluckt man ein wenig Wasser, schon hat man einen unangenehmen Geschmack
Elektrizität VARTA. Dieses Skript gehört:
 Elektrizität VARTA Dieses Skript gehört: Versuch 1: Elektrostatik, was ist das? Elektrizität Seite 2 Fleecestoff oder Wollsocke Seidenpapierschnipsel Bleistift Luftballon 1.1 1. Reibe einen aufgeblasenen
Elektrizität VARTA Dieses Skript gehört: Versuch 1: Elektrostatik, was ist das? Elektrizität Seite 2 Fleecestoff oder Wollsocke Seidenpapierschnipsel Bleistift Luftballon 1.1 1. Reibe einen aufgeblasenen
Verschiedene feste Stoffe werden auf ihre Leitfähigkeit untersucht, z.b. Metalle, Holz, Kohle, Kunststoff, Bleistiftmine.
 R. Brinkmann http://brinkmann-du.de Seite 1 26/11/2013 Leiter und Nichtleiter Gute Leiter, schlechte Leiter, Isolatoren Prüfung der Leitfähigkeit verschiedener Stoffe Untersuchung fester Stoffe auf ihre
R. Brinkmann http://brinkmann-du.de Seite 1 26/11/2013 Leiter und Nichtleiter Gute Leiter, schlechte Leiter, Isolatoren Prüfung der Leitfähigkeit verschiedener Stoffe Untersuchung fester Stoffe auf ihre
KLASSE: 8TE NAME: Vorname: Datum:
 Kapitel II - 1 Kapitel II : Die Geräte im Alltag (S. 306-327) Achtung : Arbeite bei den Versuchen auf den folgenden Seiten nie mit dem Strom aus der Steckdose. Das kann lebensgefährlich sein! II.1) Ein
Kapitel II - 1 Kapitel II : Die Geräte im Alltag (S. 306-327) Achtung : Arbeite bei den Versuchen auf den folgenden Seiten nie mit dem Strom aus der Steckdose. Das kann lebensgefährlich sein! II.1) Ein
ELEXBO A-Car-Engineering
 1 Aufgabe: -Bauen Sie alle Schemas nacheinander auf und beschreiben Ihre Feststellungen. -Beschreiben Sie auch die Unterschiede zum vorherigen Schema. Bauen Sie diese elektrische Schaltung auf und beschreiben
1 Aufgabe: -Bauen Sie alle Schemas nacheinander auf und beschreiben Ihre Feststellungen. -Beschreiben Sie auch die Unterschiede zum vorherigen Schema. Bauen Sie diese elektrische Schaltung auf und beschreiben
"Graphit, Diamant und Fullerene"
 - 1 - Gruppenunterricht zum Thema "Graphit, Diamant und Fullerene" Schultyp: Gymnasium Art der Gruppenarbeit: Partner- und Kleingruppenarbeit Dauer der Unterrichtseinheit: Doppellektion (90 Minuten) SchülerInnen-Teil
- 1 - Gruppenunterricht zum Thema "Graphit, Diamant und Fullerene" Schultyp: Gymnasium Art der Gruppenarbeit: Partner- und Kleingruppenarbeit Dauer der Unterrichtseinheit: Doppellektion (90 Minuten) SchülerInnen-Teil
Unterschied zwischen Physik und Chemie:
 Unterschied zwischen Physik und Chemie: Der Begriff Physik bezeichnet die Lehre über Zustände und Zustandsänderungen die Chemie hingegen beschäftigt sich mit Stoffen und stofflichen Veränderungen. Unterteilung
Unterschied zwischen Physik und Chemie: Der Begriff Physik bezeichnet die Lehre über Zustände und Zustandsänderungen die Chemie hingegen beschäftigt sich mit Stoffen und stofflichen Veränderungen. Unterteilung
Grundwissen C8 NTG. 1. Stoffe und Reaktionen. Reinstoff
 Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Stromkreis. Das brauchst du: 1 Flachbatterie 4,5 V 1 Glühbirne 6 V / 0,6 W 1 Lämpchenfassung 2 Krokodilklemmen
 Stromkreis 1 Glühbirne 6 V / 0,6 W 1 Lämpchenfassung 2 Krokodilklemmen Schraube das Glühbirnchen in die Lampenfassung. Befestige jeweils eine Krokodilklemme an den Schraubkontakten der Fassung. Verbinde
Stromkreis 1 Glühbirne 6 V / 0,6 W 1 Lämpchenfassung 2 Krokodilklemmen Schraube das Glühbirnchen in die Lampenfassung. Befestige jeweils eine Krokodilklemme an den Schraubkontakten der Fassung. Verbinde
1. Einteilung und Definition 2. 2. Nachweise von Kohlenstoff 2. 3. Besonderheit von Kohlenstoff 2. 4. Vergleich: anorg. und organische Verb.
 O r g a n i s c h e h e m i e Kurzversion: 1. Einteilung und Definition 2 2. Nachweise von Kohlenstoff 2 3. Besonderheit von Kohlenstoff 2 4. ergleich: anorg. und organische erb. 2 : 1. Einteilung in anorg.
O r g a n i s c h e h e m i e Kurzversion: 1. Einteilung und Definition 2 2. Nachweise von Kohlenstoff 2 3. Besonderheit von Kohlenstoff 2 4. ergleich: anorg. und organische erb. 2 : 1. Einteilung in anorg.
Das Salz in unserer Suppe
 Das Salz in unserer Suppe Aufgabe 1 In der Küche verwendet man oft zwei Arten von Salz. Das eine ist Steinsalz und das andere ist Meersalz. Das Meerwasser im Mittelmeer enthält 3,8 % Salz, im Toten Meer
Das Salz in unserer Suppe Aufgabe 1 In der Küche verwendet man oft zwei Arten von Salz. Das eine ist Steinsalz und das andere ist Meersalz. Das Meerwasser im Mittelmeer enthält 3,8 % Salz, im Toten Meer
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde. Sommersemester 2007
 Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 2007 VL #35 am 28.06.2007 Vladimir Dyakonov Leitungsmechanismen Ladungstransport in Festkörpern Ladungsträger
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 2007 VL #35 am 28.06.2007 Vladimir Dyakonov Leitungsmechanismen Ladungstransport in Festkörpern Ladungsträger
Grundtypen der Bindung. Grundtypen chemischer Bindung. Oktettregel. A.8.1. Atombindung
 Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 9/10. Salze
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 Chemie für Biologen Vorlesung im WS 200/05 V2, Mi 10-12, S0 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil : 03.11.200) MILESS: Chemie für Biologen 66 Chemische
Chemie für Biologen Vorlesung im WS 200/05 V2, Mi 10-12, S0 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil : 03.11.200) MILESS: Chemie für Biologen 66 Chemische
Das Ohmsche Gesetz. Selina Malacarne Nicola Ramagnano. 1 von 15
 Das Ohmsche Gesetz Selina Malacarne Nicola Ramagnano 1 von 15 21./22. März 2011 Programm Spannung, Strom und Widerstand Das Ohmsche Gesetz Widerstandsprint bestücken Funktion des Wechselblinkers 2 von
Das Ohmsche Gesetz Selina Malacarne Nicola Ramagnano 1 von 15 21./22. März 2011 Programm Spannung, Strom und Widerstand Das Ohmsche Gesetz Widerstandsprint bestücken Funktion des Wechselblinkers 2 von
Licht und Farbe mit Chemie
 Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farben: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farben: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Vortest/Nachtest Salze (1)
 Vortest/Nachtest Salze (1) Vortest Maximal erreichbare Punktzahl: 27 (24 Punkte + 3 Jokerpunkte) Nachtest Erreichte Punktzahl: 1. Kreuze die Formeln an, die den Salzen zuzuordnen sind. (3 P.) NaCl CaCO
Vortest/Nachtest Salze (1) Vortest Maximal erreichbare Punktzahl: 27 (24 Punkte + 3 Jokerpunkte) Nachtest Erreichte Punktzahl: 1. Kreuze die Formeln an, die den Salzen zuzuordnen sind. (3 P.) NaCl CaCO
Bist Du nicht "FIT", dann musst Du nacharbeiten.
 Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
Magische Kristalle Prof. Dr. R. Glaum
 Magische Kristalle Prof. Dr. R. Glaum Institut für Anorganische Chemie Universität Bonn http://www.glaum.chemie.uni-bonn.de email: rglaum@uni-bonn.de Dank Herr Michael Kortmann Herr Andreas Valder Deutsche
Magische Kristalle Prof. Dr. R. Glaum Institut für Anorganische Chemie Universität Bonn http://www.glaum.chemie.uni-bonn.de email: rglaum@uni-bonn.de Dank Herr Michael Kortmann Herr Andreas Valder Deutsche
Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz
 Name: Datum: Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz Material: Kochsalz (NaCl), Leitungswasser, Mineralwasser, Becherglas, Spatel, destilliertes Wasser, Alu-Teelichtschalen,
Name: Datum: Versuch: In der Natur verschwindet nichts - Lösen und Auskristallisieren von Salz Material: Kochsalz (NaCl), Leitungswasser, Mineralwasser, Becherglas, Spatel, destilliertes Wasser, Alu-Teelichtschalen,
bestimmte mehratomige Anionen mit Sauerstoff werden mit dem lateinischen Namen benannt und enden auf at.
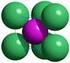 DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
Schriftliche Abschlussprüfung Chemie
 Sächsisches Staatsministerium für Kultus Schuljahr 2004/2005 Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Sächsisches Staatsministerium für Kultus Schuljahr 2004/2005 Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Chemie-Grundwissen der 9.Klasse
 Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Dissoziation, ph-wert und Puffer
 Dissoziation, ph-wert und Puffer Die Stoffmengenkonzentration (molare Konzentration) c einer Substanz wird in diesem Text in eckigen Klammern dargestellt, z. B. [CH 3 COOH] anstelle von c CH3COOH oder
Dissoziation, ph-wert und Puffer Die Stoffmengenkonzentration (molare Konzentration) c einer Substanz wird in diesem Text in eckigen Klammern dargestellt, z. B. [CH 3 COOH] anstelle von c CH3COOH oder
Experimentelle Ermittlung der molaren Lösungswärme von Kaliumchlorid
 Experimentelle Ermittlung der molaren Lösungswärme von Kaliumchlorid Versuchsaufbau : Um den Versuch durchzuführen, benötigen wir 180 g Wasser, welches in ein Becherglas gefüllt wird. Die Temperatur ermitteln
Experimentelle Ermittlung der molaren Lösungswärme von Kaliumchlorid Versuchsaufbau : Um den Versuch durchzuführen, benötigen wir 180 g Wasser, welches in ein Becherglas gefüllt wird. Die Temperatur ermitteln
Klasse: CodeNr.: 1 Code Nr.: Datum: Name: 1.)
 Klasse: CodeNr.: 1 Code Nr.: 0 5 0 5 0 5 0 5 0 10 15 10 15 10 15 10 15 10 15 10 15 10 15 10 1 1 Was bedeutet die Aufschrift "6V" auf einer Glühbirne? Was geschieht, wenn man diese Aufschrift nicht beachtet?
Klasse: CodeNr.: 1 Code Nr.: 0 5 0 5 0 5 0 5 0 10 15 10 15 10 15 10 15 10 15 10 15 10 15 10 1 1 Was bedeutet die Aufschrift "6V" auf einer Glühbirne? Was geschieht, wenn man diese Aufschrift nicht beachtet?
Praktikumsprotokoll. Grundlagen der Chemie Teil II SS Praktikum vom
 Grundlagen der Chemie Teil II SS 2002 Praktikumsprotokoll Praktikum vom 02.05.2002 Versuch 11: Herstellung einer Pufferlösung von definiertem ph Versuch 12: Sauer und alkalisch reagierende Salzlösungen
Grundlagen der Chemie Teil II SS 2002 Praktikumsprotokoll Praktikum vom 02.05.2002 Versuch 11: Herstellung einer Pufferlösung von definiertem ph Versuch 12: Sauer und alkalisch reagierende Salzlösungen
Übungen: Kraftwirkung in magnetischen Feldern
 Übungen: Kraftwirkung in magnetischen Feldern Aufgabe 1: Zwei metallische Leiter werden durch einen runden, beweglichen Kohlestift verbunden. Welche Beobachtung macht ein(e) Schüler(in), wenn der Stromkreis
Übungen: Kraftwirkung in magnetischen Feldern Aufgabe 1: Zwei metallische Leiter werden durch einen runden, beweglichen Kohlestift verbunden. Welche Beobachtung macht ein(e) Schüler(in), wenn der Stromkreis
Variablenkontrolltest
 Variablenkontrolltest Entwickelt von Simon Christoph, Martin Schwichow & Hendrik Härtig Bitte trage zunächst den siebenstelligen Code ein, den du von uns erhalten hast: Dein Code:. Auf der Rückseite wird
Variablenkontrolltest Entwickelt von Simon Christoph, Martin Schwichow & Hendrik Härtig Bitte trage zunächst den siebenstelligen Code ein, den du von uns erhalten hast: Dein Code:. Auf der Rückseite wird
Atomverbände. Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner SALZE
 Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE 1 Einstieg: Schreck lass nach! Dieser Winter hat viele Teile der Schweiz mit seinen
Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE 1 Einstieg: Schreck lass nach! Dieser Winter hat viele Teile der Schweiz mit seinen
Eine Reaktionsgleichung beschreibt die Umwandlung von Stoffen (Atomen, Molekülen, Ionen etc.), also einen chemischen Prozess.
 Chemische Reaktionen 1. Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von toffen (Atomen, Molekülen, Ionen etc.), also einen chemischen Prozess. Auf der einen eite
Chemische Reaktionen 1. Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von toffen (Atomen, Molekülen, Ionen etc.), also einen chemischen Prozess. Auf der einen eite
Regeln für selbstständiges Arbeiten
 Zum Beitrag UC 66 (2001), S. 1721 Regeln für selbstständiges Arbeiten 1. Überzeugt euch bei der Auswahl des Arbeitskastens, ob alle Gruppen ein neues Thema bekommen haben. Ansonsten tauscht nochmals die
Zum Beitrag UC 66 (2001), S. 1721 Regeln für selbstständiges Arbeiten 1. Überzeugt euch bei der Auswahl des Arbeitskastens, ob alle Gruppen ein neues Thema bekommen haben. Ansonsten tauscht nochmals die
4. Physiktest Kapitel 04 Der elektrische Strom Teil 1 Grundlagen Gruppe 1
 4. Physiktest Kapitel 04 Der elektrische Strom Teil 1 Grundlagen Gruppe 1 1. (2) Ergänze: Bereits die alten wussten, dass man Elektrizität durch Reiben von Bernstein (griechisch ) an Wolle hervorrufen
4. Physiktest Kapitel 04 Der elektrische Strom Teil 1 Grundlagen Gruppe 1 1. (2) Ergänze: Bereits die alten wussten, dass man Elektrizität durch Reiben von Bernstein (griechisch ) an Wolle hervorrufen
Hans-Dieter Barke. Struktur der Materie Diagnose, Prävention und Korrektur von Fehlvorstellungen
 Hans-Dieter Barke Universität t MünsterM Struktur der Materie Diagnose, Prävention und Korrektur von Fehlvorstellungen Struktur der Materie Diagnose, Prävention und Korrektur von Fehlvorstellungen 2 Struktur
Hans-Dieter Barke Universität t MünsterM Struktur der Materie Diagnose, Prävention und Korrektur von Fehlvorstellungen Struktur der Materie Diagnose, Prävention und Korrektur von Fehlvorstellungen 2 Struktur
Atomaufbau. Elektronen e (-) Atomhülle
 Atomaufbau Institut für Elementarteilchen Nukleonen Protonen p (+) Neutronen n (o) Elektronen e (-) Atomkern Atomhülle Atom WIBA-NET 2005 Prof. Setzer 1 Elementarteilchen Institut für Name Symbol Masse
Atomaufbau Institut für Elementarteilchen Nukleonen Protonen p (+) Neutronen n (o) Elektronen e (-) Atomkern Atomhülle Atom WIBA-NET 2005 Prof. Setzer 1 Elementarteilchen Institut für Name Symbol Masse
Hinweise zu den Aufgaben:
 Versuchsworkshop: Arbeitsaufgaben Lehrerblatt Hinweise zu den Aufgaben: Blatt 1: Die Papierschnipsel werden vom Lineal angezogen.es funktioniert nicht so gut bei feuchtem Wetter. Andere Beispiele für elektrische
Versuchsworkshop: Arbeitsaufgaben Lehrerblatt Hinweise zu den Aufgaben: Blatt 1: Die Papierschnipsel werden vom Lineal angezogen.es funktioniert nicht so gut bei feuchtem Wetter. Andere Beispiele für elektrische
4. Anorganisch-chemische Versuche
 4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
Inhaltsverzeichnis. Vorwort Zur Gestaltung des Buches
 Hans Rudolf Christen Struktur Stoff Reaktion Allgemeine und anorganische Chemie Sekundarstufe I 5401 Diesterweg Salle Frankfurt am Main Berlin München Verlag Sauerländer Aarau Vorwort Zur Gestaltung des
Hans Rudolf Christen Struktur Stoff Reaktion Allgemeine und anorganische Chemie Sekundarstufe I 5401 Diesterweg Salle Frankfurt am Main Berlin München Verlag Sauerländer Aarau Vorwort Zur Gestaltung des
ANHANG. M a g n e t i s m u s
 ANHANG M a g n e t i s m u s SV 1: Welche Magnete gibt es? Material: Memorykarten Durchführung: 1. Lege alle Karten offen vor dich hin! 2. Finde passende Pärchen! 3. Drehe nun die Karten um und mische
ANHANG M a g n e t i s m u s SV 1: Welche Magnete gibt es? Material: Memorykarten Durchführung: 1. Lege alle Karten offen vor dich hin! 2. Finde passende Pärchen! 3. Drehe nun die Karten um und mische
geschlossene Aufgaben
 geschlossene Aufgaben Bearbeitungszeit: 10:00 Minuten Aufgabe 1 Punkte: 1 Kreuzen Sie an, welche Leitfähigkeit die folgenden Flüssigkeiten aufweisen. leitfähig nicht/kaum leitfähig destilliertes Wasser
geschlossene Aufgaben Bearbeitungszeit: 10:00 Minuten Aufgabe 1 Punkte: 1 Kreuzen Sie an, welche Leitfähigkeit die folgenden Flüssigkeiten aufweisen. leitfähig nicht/kaum leitfähig destilliertes Wasser
Selbstlerneinheit Elektrizitätslehre
 Selbstlerneinheit Elektrizitätslehre. Aufgaben zur Wiederholung Aufgabe 1 Skizziere den Schaltplan eines Stromkreises mit (a) einer Batterie als Spannungsquelle und einer Lampe (L) als Verbraucher. (b)
Selbstlerneinheit Elektrizitätslehre. Aufgaben zur Wiederholung Aufgabe 1 Skizziere den Schaltplan eines Stromkreises mit (a) einer Batterie als Spannungsquelle und einer Lampe (L) als Verbraucher. (b)
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
Bau der Metalle Eigenschaften plastisch verformbar elektrisch leitfähig hohe Siede- und Schmelztemperaturen
 Metallbindungen Bau der Metalle bestehen aus positiv geladene Atomrümpfe (= Atomkern und alle Elektrone auβer den Vallenzelektronen) + frei beweglichen Auβenelektronen Atomrümpfe sind sehr fest angeordnet
Metallbindungen Bau der Metalle bestehen aus positiv geladene Atomrümpfe (= Atomkern und alle Elektrone auβer den Vallenzelektronen) + frei beweglichen Auβenelektronen Atomrümpfe sind sehr fest angeordnet
Brenner Streichhölzer Eis
 Versuch 1: Wir erhitzen Eis! Reagenzglas Reagenzglasklammer Reagenzglasständer Brenner Streichhölzer Eis Fülle soviel Eis in das Reagenzglas, dass es zu einem Drittel gefüllt ist. Damit Du Dir beim Erhitzen
Versuch 1: Wir erhitzen Eis! Reagenzglas Reagenzglasklammer Reagenzglasständer Brenner Streichhölzer Eis Fülle soviel Eis in das Reagenzglas, dass es zu einem Drittel gefüllt ist. Damit Du Dir beim Erhitzen
Gefahren des elektrischen Stroms
 en des elektrischen Stroms 1.1. Elektrischer Strom ist gefährlich. Er verursacht etwa 35% aller Brände mit einem Schaden von knapp 100 Millionen Euro jährlich. An den Brandfolgen und an Stromschlägen sterben
en des elektrischen Stroms 1.1. Elektrischer Strom ist gefährlich. Er verursacht etwa 35% aller Brände mit einem Schaden von knapp 100 Millionen Euro jährlich. An den Brandfolgen und an Stromschlägen sterben
0.3 Formeln, Gleichungen, Reaktionen
 0.3 Formeln, Gleichungen, Reaktionen Aussage von chemischen Formeln Formeln von ionischen Verbindungen - Metallkation, ein- oder mehratomiges Anion - Formel entsteht durch Ausgleich der Ladungen - Bildung
0.3 Formeln, Gleichungen, Reaktionen Aussage von chemischen Formeln Formeln von ionischen Verbindungen - Metallkation, ein- oder mehratomiges Anion - Formel entsteht durch Ausgleich der Ladungen - Bildung
Licht und Farbe mit Chemie
 Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farbe: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farbe: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
VERSUCH 1. Bringe das Glühlämpchen zum Leuchten! Zeichne deine Lösung! VERSUCH 2. 1 Flachbatterie 1 Fassung isolierten Draht (isolierte Leitungen)
 VERSUCH 1 Du brauchst: 1 Glühlämpchen (3,5 V) Bringe das Glühlämpchen zum Leuchten! Zeichne deine Lösung! Warum ist das so? VERSUCH 2 Du brauchst: 1 Glühlämpchen (3,5 V) 1 Fassung isolierten Draht (isolierte
VERSUCH 1 Du brauchst: 1 Glühlämpchen (3,5 V) Bringe das Glühlämpchen zum Leuchten! Zeichne deine Lösung! Warum ist das so? VERSUCH 2 Du brauchst: 1 Glühlämpchen (3,5 V) 1 Fassung isolierten Draht (isolierte
Robert-Koch-Gymnasium Deggendorf. Grundwissen Chemie. 8. Jahrgangsstufe
 Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Versuch 1: Wie kalt wird es, wenn man Kochsalz mit Eis mischt?
 : Wie kalt wird es, wenn man Kochsalz mit Eis mischt? Man wiege sich in je einem 250 ml-becher aus Kunststoff Kochsalz und Wasser ab und vermische sie innig, indem man das Salz zu dem Eis gibt und gut
: Wie kalt wird es, wenn man Kochsalz mit Eis mischt? Man wiege sich in je einem 250 ml-becher aus Kunststoff Kochsalz und Wasser ab und vermische sie innig, indem man das Salz zu dem Eis gibt und gut
Jeder Gegenstand Stoff Jeder Stoff Eigenschaften
 Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Die Brandbekämpfung (Gruppenversuche)
 Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Teilchenmodell. Aggregatzustände. Diffusion. Spezifische Eigenschaften = Stoffeigenschaften
 Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Similia similibus solvuntur
 5.2 Wasser als Lösungsmittel für Elektrolyte Similia similibus solvuntur Unpolare (Paraffine) oder wenig polare Stoffe (Fette) sind in unpolaren oder wenig polaren organischen Lösungsmitteln wie z. B Benzin
5.2 Wasser als Lösungsmittel für Elektrolyte Similia similibus solvuntur Unpolare (Paraffine) oder wenig polare Stoffe (Fette) sind in unpolaren oder wenig polaren organischen Lösungsmitteln wie z. B Benzin
Weihnachtliche Experimentalvorlesung im Fachbereich Chemieingenieurwesen
 Weihnachtliche Experimentalvorlesung im Fachbereich Chemieingenieurwesen Folie 1 Licht und Farbe zu Weihnachten - Dank Chemie! Folie 2 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren
Weihnachtliche Experimentalvorlesung im Fachbereich Chemieingenieurwesen Folie 1 Licht und Farbe zu Weihnachten - Dank Chemie! Folie 2 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren
Oxidation und Reduktion
 Seminar RedoxReaktionen 1 Oxidation und Reduktion Definitionen: Oxidation: Abgabe von Elektronen Die Oxidationszahl des oxidierten Teilchens wird größer. Bsp: Na Na + + e Reduktion: Aufnahme von Elektronen
Seminar RedoxReaktionen 1 Oxidation und Reduktion Definitionen: Oxidation: Abgabe von Elektronen Die Oxidationszahl des oxidierten Teilchens wird größer. Bsp: Na Na + + e Reduktion: Aufnahme von Elektronen
