Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
|
|
|
- Jasper Meissner
- vor 6 Jahren
- Abrufe
Transkript
1 Institut für hysikalische Cheie lbert-ludwigs-universität Freiburg Lösungen zu 8. Übungsblatt zur Vorlesung hysikalische Cheie I SS 00 rof. Dr. Bartsch 8. (5 unkte) Benzol erstarrt unter at bei 5,5 C; dabei ändert sich die Dichte von 0,879 g c -3 (flüssig) auf 0,89 g c -3 (fest). Die Schelzenthalpie der Verbindung beträgt 0,59 kj ol -. Bestien Sie den Gefrierpunkt von Benzol bei eine Druck von 000 at. Clapeyron-Gleichung: ( ) ( ) d S s l d V s l Definition der Entropie: S ( s l) q rev,s, S, d d V s l S, ( ) V s l d d ( ) S, Integration: ( ) V s l d d S, V s l ln S, ( ) ( ) V s l + exp ( ) ( ) S, Molares Voluen: M M M ρ ρ V V ( s l) ρ l s M M ρ ρ l s exp ( ) S,
2 78gol 78gol 0,879gc 0,89gc 0590Jol , 65K exp ( 000at at ) 5,03 0 a at a c ,65K exp,4 0 c 3 J ,85K 8. (7 unkte) Naphthalin, C 0 H 8, schilzt bei 80, C. Der Dapfdruck der Flüssigkeit beträgt 0 orr bei 85,8 C und 40 orr bei 9,3 C. Berechnen Sie it der Clausius-Clapeyron-Gleichung a) die olare Verdapfungsenthalpie V,, (4 unkte) b) den Standardsiedepunkt bei, a, ( unkte) c) die Verdapfungsentropie a Siedepunkt. ( unkt) a) Verdapfungsenthalpie V, : Clapeyron-Gleichung: ( ) ( ) d S l g d V l g Definition der Entropie: S ( l g) q rev,v, V, Ideales Gasgesetz: V R V R R V Vg, Vl, Vg, d d R V, Integration: d d R V, H V, ln R Verdapfungsenthalpie: R ln H V,
3 40orr 8,34JK ol ln 0orr HV, 48, 47kJol 358,95K 39, 45K b) Standardsiedepunkt Sdp : ln Sdp V, R Sdp Sdp R ln Sdp V, Sdp 489, 48K 8, 34JK ol 760orr ln 39, 45K 48470Jol 40orr Beziehungsweise: Sdp 489, 48K 8,34JK ol 760orr ln 358,95K 48470Jol 0orr c) Verdapfungsentropie: 48470Jol SV, + 99, 0JK ol 489, 48K V, Sdp 8.3 (6 unkte) Dapfdrücke von Flüssigkeiten isst an beispielsweise nach der Gassättigungsethode: Ein Voluen V eines Gases (geessen bei der eperatur und de Druck ) wird durch eine flüssige robe geleitet, die bei konstanter eperatur gehalten wird. Der Masseverlust, der durch das Verdapfen der Flüssigkeit entsteht, wird registriert. a) Zeigen Sie it Hilfe des Gesetzes von Dalton, dass zwischen de Dapfdruck DD und der olaren Masse M der Flüssigkeit folgender Zusaenhang besteht: R DD it. (4 unkte) + MV b) Der Dapfdruck von Geraniol (M 54, g ol - ), das in Rosenöl enthalten ist, wurde bei 0 C auf die beschriebene Weise bestit. Der Versuch ergab, dass 0,3 g Geraniol verdapften, wenn 5,00 L Stickstoff unter eine Druck von 760 orr durch die Flüssigkeit geleitet wurden. Berechnen Sie den Dapfdruck von Geraniol. ( unkte) a) Molenge des durchströenden Gases: ngas V R Molenge der verdapften Flüssigkeit: nflüssigkeit M Der Dapfdruck der Flüssigkeit entspricht de artialdruck i gesättigten Gas. 3
4 Daltonsches Gesetz: Flüssigkeit DD xflüssigkeit nflüssigkeit + ngas n R M M V DD V R V R + + M R M V R V Substitution: R MV DD + b) 3 R 8,34JK ol 383,5K 760orr 0 L 0, 0408g 5 3 MV 54, gol 760orr 5,00L,03 0 a Dapfdruck Geraniol: 5 0, 0408g 0,3g 760orr, 03 0 a DD 305a + 0, 0408g 0,3g + 760orr 8.4 (4 unkte) Skizzieren Sie die bhängigkeit des cheischen otentials des Wassers von der eperatur für den eperaturbereich von 0 K bis 500 K bei konstante Druck. Zeichnen Sie die Bereiche der festen, flüssigen und gasförigen hase sowie den Schelzpunkt und den Siedepunkt ein. Was bedeuten die Steigungen der Kurven? µ Θ µ S µ fest flüssig Θ gasförig [K] S Sdp 8.5 (6 unkte) Wie unterscheiden sich die Steigungen des cheischen otentials als Funktion der eperatur auf beiden Seiten des a) Standardgefrierpunkts und des, ( unkte) b) Standardsiedepunkts von Wasser? ( unkt) 4
5 c) U wie viel größer ist das cheische otential von auf -5 C unterkühlte Wasser i Vergleich zu Eis bei derselben eperatur? (3 unkte) Hinweis: Verwenden Sie folgende Werte: S, 6,0 kj ol -, V, 40,6 kj ol - µ µ und die Näherung:. a) Differenz der bleitungen des cheischen otentials für den Übergang s l: ( l) ( s) µ µ S ( l) S ( s) S ( ) S, S, S ( l) ( s) 600Jol µ µ, 0JK ol 73,5K b) Differenz der bleitungen des cheischen otentials für den Übergang l g: ( g) ( l) µ µ S ( g) S ( l) S ( ) V, V, Sdp ( g) ( l) 40600Jol µ µ 08,8JK ol 373,5K c) Näherung: µ µ µ µ S Differenz des cheischen otentials: µ ( l) µ ( s) µ ( l, 68K) µ ( l, 73K) µ ( s, 68K) µ ( s, 73K) Es gilt: µ ( l, 73K) µ ( s, 73K) µ ( l) µ ( s) µ ( l, 68K) µ ( s, 68K) Einsetzen der Näherung: µ ( l) µ ( s) S ( l, 68K) S ( s, 68K) S ( 68K) S, S 68K S 73K Weitere Näherung: ( ) ( ) S, S, µ ( l) µ ( s),0jol K ( 68K 73K) + 0, 0Jol lternativ: Einsetzen des Wertes aus ufgabe 7.4 für S ( 68K) : S, µ ( l) µ ( s),3jol K ( 68K 73K) + 06,5Jol Weil µ ( l, 68K) > µ ( s, 68K) gilt, ist der Übergang bei 68 K von Wasser nach Eis begünstigt. 5
6 8.6 (4 unkte) a) Wasser verdapft bei 5 C und 0, Ma; wie ändert sich dabei sein cheisches otential? Welchen Rückschluss erlaubt dieses Ergebnis hinsichtlich der cheischen Reaktivität von Wasserdapf i Vergleich zu flüssige Wasser? ( unkte) b) Wie verändert sich das cheische otential von Wasserdapf, wenn an den Druck auf Ma erhöht? ( unkte) Hinweis: Die olaren freien Bildungsenthalpien für flüssiges Wasser und Wasserdapf betragen: B G Θ (H O,l) kj ol - und B G Θ (H O,g) kj ol -. a) Reaktionsgleichung: H O( l) H O( g) Reaktionsbedingungen: 98,5K, 5 0 a Θ Θ Cheisches otential: µ G G ( H O,g) G ( H O,l) B B 8,57kJol ( 37,3)kJol + 8, 56kJol H O(g) hat ein höheres cheisches otential als H O(l). Wasserdapf ist unter Standardbedingungen cheisch reaktiver als flüssiges Wasser. b) Druckabhängigkeit des cheischen otentials: Θ µ µ + R ln Θ Ma µ µ µ R ln 8,34JK ol 98,5K ln 5, 7kJol 0,Ma Θ Θ Bei Druckerhöhung wird der Wasserdapf noch reaktiver. 8.7 (7 unkte) a) Skizzieren Sie das,-hasendiagra von Wasser (nur Niedrigdruckbereich). Bezeichnen Sie die einzelnen hasen, Koexistenzlinien und ausgezeichneten unkte i hasendiagra. Worin unterscheidet sich das hasendiagra von Wasser von typischen hasendiagraen anderer Substanzen (zu Beispiel CO ). (4 unkte) b) Erläutern Sie die Ursache für die noalie des Wassers. Zeichnen Sie dazu für CO und H O jeweils ein scheatisches Diagra, welches die eperaturabhängigkeit des cheischen otentials der koexistierenden hasen beschreibt und tragen Sie darin die Veränderung ein, die durch Druckerhöhung erfolgt. Geben Sie an, it welchen µ Zustandsfunktionen die Differentiale und µ verknüpft sind. (3 unkte) p 6
7 a),-diagra von H O: Das hasendiagra von Wasser unterscheidet sich von hasendiagraen anderer Substanzen in der Koexistenzlinie fest/flüssig. Diese hat bei Wasser eine negative Steigung, das heißt, Druckerhöhung führt zu Verflüssigung. Noralerweise ist die Steigung positiv und Druckerhöhung führt zur Erstarrung des Materials. b) eperaturabhängigkeit des cheischen otentials CO H O bleitungen: µ G S und µ G V CO : Noralfall: V (s) < V (l) µ l steigt stärker it H O: noalie: V (s) > V (l) µ s steigt stärker it 7
8 8.8 (6 unkte) Hexan (C 6 H 4 ) und Heptan (C 7 H 6 ) bilden eine ideale Mischung. a) Waru ist dies verutlich der Fall? ( unkt) In welchen b) olaren nteilen (4 unkte) c) Massenanteilen ( unkt) uss an die beiden Substanzen ischen, dait die axial ögliche Mischungsentropie auftritt? Belegen Sie Ihre ntwort durch eine Rechnung. Hinweis: Benutzen Sie die Maxiusbedingung für S Mix in Bezug auf den Molenbruch x. a) Hexan und Heptan bilden eine ideale Mischung, da die Wechselwirkungen sehr ähnlich sind. Die Moleküle sind cheisch sehr ähnlich. b) Es gilt: x + xb ( Hexan, B Heptan) Mischungsentropie: S nr x ln x + x ln x nr x ln x + x ln x [ ] ( ) ( ) Mix B B Maxiusbedingung: δ S δx Mix 0 δ S δx x Mix nr ln x + ln ( x ) + ( x ) ( ) δ S x nr ln x ln x nr ln δx x Mix ( ) x x nr ln 0 x x ln 0 x x exp ln exp[ 0] x x x x x 0,5 Definition Molenbruch: x n n + n B 8
9 n n + n 0,5 B n n B n n Molarer nteil: n n B Der olare nteil von Hexan () zu Heptan (B) ist also zu. c) Es gilt: n nb Definition: n M B M M M MHexan 86gol 0,86 M M 00gol B B B Hep tan Der Massenanteil von Hexan zu Heptan ist also 0,86 zu. 8.9 (5 unkte) Das nebenstehende Diagra zeigt für eine reale flüssige Mischung von Schwefelkohlenstoff (CS ) und ceton die artialdrucke von CS () und ceton () sowie den Gesatdapfdruck der it der Flüssigkeit i Gleichgewicht stehenden Gasphase in bhängigkeit von der Geischzusaensetzung. a) Skizzieren Sie, wie die Kurvenverläufe aussehen üssten, wenn sich die Mischung ideal verhalten würde. ( unkt) b) Benennen und geben Sie eine Gesetzäßigkeit an, die den Zusaenhang zwischen de Molenbruch einer Koponente und ihre artialdruck atheatisch beschreibt. ( unkt) c) Erläutern Sie das Konzept der ktivität anhand einer Gleichung und beschreiben Sie qualitativ, wie sich aus Dapfdruckessungen ktivitätskoeffizienten bestien lassen. (3 unkte) 3 a) 9
10 b) Raoultsches Gesetz: x Θ CS CS CS c) Erläuterung zur ktivität: Die ktivität ist die effektive Konzentration, welche den Einfluss von Wechselwirkungen zwischen den Molekülen berücksichtigt. Zusaenhang von ktivität und Molenbruch: a γ x CS CS CS a ktivität, γ ktivitätskoeffizient, x Molenbruch ktivitätskoeffizienten lassen sich über den Vergleich der realen Dapfdrücke (Experient) it den theoretisch für ideale Mischungen zu erwartenden Dapfdrücken bestien. Zusaenhänge: x ideal CS Θ CS CS real Θ CS CS CS CS γ CS CS a x ( xcs ) ( xcs ) real CS ideal CS γ ( xcs ) CS 0
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische Cheie Albert-Ludwigs-Universität Freiburg hysikalische Cheie für Studierende der Mikrosystetechnik Lösungen zu 10. Übungsblatt i WS 010/11 rof. Dr. Gräber 10.1 L (8 unkte) Skizzieren
Institut für hysikalische Cheie Albert-Ludwigs-Universität Freiburg hysikalische Cheie für Studierende der Mikrosystetechnik Lösungen zu 10. Übungsblatt i WS 010/11 rof. Dr. Gräber 10.1 L (8 unkte) Skizzieren
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische Cheie lbert-ludwigs-universität Freiburg Lösungen zu 9. Übungsblatt zur Vorlesung hysikalische Cheie I SS 2014 rof. Dr. artsch 9.1 L/M Hean (C 6 H 14 ) und Heptan (C 7 H 16 )
Institut für hysikalische Cheie lbert-ludwigs-universität Freiburg Lösungen zu 9. Übungsblatt zur Vorlesung hysikalische Cheie I SS 2014 rof. Dr. artsch 9.1 L/M Hean (C 6 H 14 ) und Heptan (C 7 H 16 )
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische heie lbert-ludwigs-universität Freiburg Lösungen zu 7. Übungsblatt zur orlesung hysikalische heie I SS 04 rof. Dr. Bartsch 7. L Berechnen Sie aus der olaren Standardentropie des
Institut für hysikalische heie lbert-ludwigs-universität Freiburg Lösungen zu 7. Übungsblatt zur orlesung hysikalische heie I SS 04 rof. Dr. Bartsch 7. L Berechnen Sie aus der olaren Standardentropie des
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische heie Albert-Ludwigs-Universität Freiburg Lösungen zu 5. Übungsblatt zur orlesung hysikalische heie I SS 04 rof. Dr. Bartsch 5. M Leiten Sie einen allgeeinen Ausdruck für die Änderung
Institut für hysikalische heie Albert-Ludwigs-Universität Freiburg Lösungen zu 5. Übungsblatt zur orlesung hysikalische heie I SS 04 rof. Dr. Bartsch 5. M Leiten Sie einen allgeeinen Ausdruck für die Änderung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum 0. Übungsblatt zur Vorlesung hysikalische Chemie I SS 04 rof. Dr. Bartsch 0. L Die freie Standardreaktionsenthalpie der
Institut für hysikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum 0. Übungsblatt zur Vorlesung hysikalische Chemie I SS 04 rof. Dr. Bartsch 0. L Die freie Standardreaktionsenthalpie der
1 EMK-Messung thermodynamischer Aktivitäten mit einer Konzentrationszelle
 EMK 1.1 1 EMK-Messung therodynaischer ktivitäten it einer Konzentrationszelle 1.1 Grundlagen Je nachde, ob in einer binären flüssigen oder festen Lösung -B die nziehungskräfte zwischen den - und B-eilchen
EMK 1.1 1 EMK-Messung therodynaischer ktivitäten it einer Konzentrationszelle 1.1 Grundlagen Je nachde, ob in einer binären flüssigen oder festen Lösung -B die nziehungskräfte zwischen den - und B-eilchen
Kolligative Eigenschaften
 Kolligative Eigenschaften Kolligative (lat. colligare, sammeln) Eigenschaften (in verdünnter Lösung): f(nzahl der eilchen des gelösten Stoffs) f(rt der eilchen des gelösten Stoffs) eispiel: Gefrierpunkt,
Kolligative Eigenschaften Kolligative (lat. colligare, sammeln) Eigenschaften (in verdünnter Lösung): f(nzahl der eilchen des gelösten Stoffs) f(rt der eilchen des gelösten Stoffs) eispiel: Gefrierpunkt,
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische Chemie Albert-Ludwigs-Universität Freiburg hysikalische Chemie für Studierende der ikrosystemtechnik Lösungen zum 7. Übungsblatt im WS 200/ rof. Dr. Gräber 7. (2 unkte) Zwischen
Institut für hysikalische Chemie Albert-Ludwigs-Universität Freiburg hysikalische Chemie für Studierende der ikrosystemtechnik Lösungen zum 7. Übungsblatt im WS 200/ rof. Dr. Gräber 7. (2 unkte) Zwischen
Institut für Abfallwirtschaft und Altlasten, TU-Dresden Seminar Thermische Abfallbehandlung - Veranstaltung 4 - Dampfkraftprozesse
 Institut für Abfallwirtschaft und Altlasten, TU-Dresden Seinar Therische Abfallbehandlung - Veranstaltung 4 - Dapfkraftprozesse Dresden, 09. Juni 2008 Dipl.- Ing. Christoph Wünsch, Prof. Dr.- Ing. habil.
Institut für Abfallwirtschaft und Altlasten, TU-Dresden Seinar Therische Abfallbehandlung - Veranstaltung 4 - Dapfkraftprozesse Dresden, 09. Juni 2008 Dipl.- Ing. Christoph Wünsch, Prof. Dr.- Ing. habil.
! #!! % & ( )! ! +, +,# # !.. +, ) + + /) # %
 ! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
2. Klausur zur Vorlesung Einführung in die physikalische Chemie für Lehramtskandidaten Modul 4, Wintersemester 05/06
 . Klausur zur Vorlesung Einführung in die hysikalische Cheie für Lehratskandidaten Modul 4, Winterseester 5/6 3. März 6, 9 5 45 Uhr Nae, Vornae:... Geburtsdatu, -ort:... Matrikelnuer:... Fachseester,.
. Klausur zur Vorlesung Einführung in die hysikalische Cheie für Lehratskandidaten Modul 4, Winterseester 5/6 3. März 6, 9 5 45 Uhr Nae, Vornae:... Geburtsdatu, -ort:... Matrikelnuer:... Fachseester,.
1 Massenwirkungsgesetz
 1 Massenwirkungsgesetz Zeige: Bei konstantem Druck und konstanter emperatur gilt für chemische Reaktionen der Art a 1 A 1 + a A + : : : a L A L b 1 B 1 + b B + : : : b R B R : K c (A i ) ai c (B j ) bj
1 Massenwirkungsgesetz Zeige: Bei konstantem Druck und konstanter emperatur gilt für chemische Reaktionen der Art a 1 A 1 + a A + : : : a L A L b 1 B 1 + b B + : : : b R B R : K c (A i ) ai c (B j ) bj
11. Der Phasenübergang
 11. Der Phasenübergang - Phasendiagramme, Kritischer Punkt und ripelpunkt - Gibbssche Phasenregel - Phasenübergänge 1. und 2. Ordnung - Das Phasengleichgewicht - Clausius-Clapeyron-Gleichung - Pictet-routon-Regel,
11. Der Phasenübergang - Phasendiagramme, Kritischer Punkt und ripelpunkt - Gibbssche Phasenregel - Phasenübergänge 1. und 2. Ordnung - Das Phasengleichgewicht - Clausius-Clapeyron-Gleichung - Pictet-routon-Regel,
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludigs-Universität Freiburg Lösungen zum 4. Übungsblatt zur orlesung Physikalische Chemie I SS 00 Prof. Dr. Bartsch 4. (6 Punkte) In einem Behälter mit der Grundfläche
Institut für Physikalische Chemie Albert-Ludigs-Universität Freiburg Lösungen zum 4. Übungsblatt zur orlesung Physikalische Chemie I SS 00 Prof. Dr. Bartsch 4. (6 Punkte) In einem Behälter mit der Grundfläche
Lösungen zum Übungsblatt 6 zur Vorlesung Physikalische Chemie WS 2009/2010 Prof. Dr. Bartsch
 Lösungen zu Übungsblatt 6 zur orlesung hysikalische heie WS 9/ rof. r. artsch 6. L (6 unkte) erechnen Sie ie Stanarverbrennungsenthalpie von thylbenzol ( 8 H, aus seiner Stanarbilungsenthalpie von H -.
Lösungen zu Übungsblatt 6 zur orlesung hysikalische heie WS 9/ rof. r. artsch 6. L (6 unkte) erechnen Sie ie Stanarverbrennungsenthalpie von thylbenzol ( 8 H, aus seiner Stanarbilungsenthalpie von H -.
PC I Thermodynamik und Transportprozesse
 20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
Die Dampfdruckkurve. Aufnahme der Dampfdruckkurve von Wasser und Bestimmung der. Verdampfungsenthalpie
 Berlin, den 31. Oktober 2000 Die Dapfdruckkurve Aufnahe der Dapfdruckkurve von Wasser und Bestiung der Verdapfungsenthalpie Durch unseren Versuch konnten wir die Gleichung der Dapfdruckkurve von destillierte
Berlin, den 31. Oktober 2000 Die Dapfdruckkurve Aufnahe der Dapfdruckkurve von Wasser und Bestiung der Verdapfungsenthalpie Durch unseren Versuch konnten wir die Gleichung der Dapfdruckkurve von destillierte
Chemische Grundgesetze
 Björn Schulz Berlin,.10.001 p.1 Cheische Grundgesetze Gesetz von der Erhaltung der Masse (Lavoisier 1785) Abbrennen einer Kerze Massenverlust geschlossenes Syste Eisennagel rostet Massenzunahe konstante
Björn Schulz Berlin,.10.001 p.1 Cheische Grundgesetze Gesetz von der Erhaltung der Masse (Lavoisier 1785) Abbrennen einer Kerze Massenverlust geschlossenes Syste Eisennagel rostet Massenzunahe konstante
Die Zusammensetzung am Ausgang der 1. Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Versuch: Wasserdampfdestillation
 Versuch: asserdafdestillation Die Molasse stellt für einen cheisch einheitlichen, niederolekularen toff eine charakteristische Kenngröße dar. Mit hysikalisch-cheischen Messethoden lässt sich die Molasse
Versuch: asserdafdestillation Die Molasse stellt für einen cheisch einheitlichen, niederolekularen toff eine charakteristische Kenngröße dar. Mit hysikalisch-cheischen Messethoden lässt sich die Molasse
KRYOSKOPIE nach BECKMANN
 U Clausthal Praktiku eil A und B 06. KRYOKOPIE nach BECKANN tand /0/00 KRYOKOPIE nach BECKANN OLAENBEIUNG EINER GELÖEN UBANZ DURC EUNG DER GEFRIERPUNK- ERNIEDRIGUNG. Versuchslatz Koonenten: - Beckann-heroeter
U Clausthal Praktiku eil A und B 06. KRYOKOPIE nach BECKANN tand /0/00 KRYOKOPIE nach BECKANN OLAENBEIUNG EINER GELÖEN UBANZ DURC EUNG DER GEFRIERPUNK- ERNIEDRIGUNG. Versuchslatz Koonenten: - Beckann-heroeter
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C?
 A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
Prof. Dr. Peter Vogl, Thomas Eissfeller, Peter Greck. Übung in Thermodynamik und Statistik 4B Blatt 8 (Abgabe Di 3. Juli 2012)
 U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter Vogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 8 Abgabe Di 3. Juli 202). Extremalprinzip
U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter Vogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 8 Abgabe Di 3. Juli 202). Extremalprinzip
NAME, Vorname Matr.-Nr. Studiengang. Prüfung am im Fach Thermodynamik II
 NAME, Vornae Matr.-Nr. Studiengang Prof. Dr.-Ing. G. Schitz Prüfung a 03. 0. 2013 i Fach Therodynaik II Fragenteil ohne Hilfsittel erreichbare Punktzahl: 20 Dauer: 20 Minuten 1. ( Punkte) Skizzieren Sie
NAME, Vornae Matr.-Nr. Studiengang Prof. Dr.-Ing. G. Schitz Prüfung a 03. 0. 2013 i Fach Therodynaik II Fragenteil ohne Hilfsittel erreichbare Punktzahl: 20 Dauer: 20 Minuten 1. ( Punkte) Skizzieren Sie
7 PHASENGLEICHGEWICHTE UND PHASENÜBERGÄNGE
 -1-7 HASENGLEICHGEWICHE UND HASENÜBERGÄNGE 7.1 Ein-Koponenten-Systee Verdapfen, Gefrieren, oder die Uwandlung von Graphit in Diaant sind Beispiele für hasenüergänge einzelner Koponenten. Noralerweise werden
-1-7 HASENGLEICHGEWICHE UND HASENÜBERGÄNGE 7.1 Ein-Koponenten-Systee Verdapfen, Gefrieren, oder die Uwandlung von Graphit in Diaant sind Beispiele für hasenüergänge einzelner Koponenten. Noralerweise werden
-1- Heute gibt es im Wesentlichen drei Ansätze, das Verhalten und die Struktur von Flüssigkeiten
 -1-14 FLÜSSIGKEIEN 14.1 orbeerkungen Flüssigkeiten sind weder streng geordnet noch völlig ungeordnet. Deshalb ist es wesentlich schwieriger, daß erhalten von Flüssigkeiten zu beschreiben, als das von Festkörpern
-1-14 FLÜSSIGKEIEN 14.1 orbeerkungen Flüssigkeiten sind weder streng geordnet noch völlig ungeordnet. Deshalb ist es wesentlich schwieriger, daß erhalten von Flüssigkeiten zu beschreiben, als das von Festkörpern
Physikalische Chemie I
 M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
Musterlösung Übung 10
 Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser (links) und Ethanol (rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser (links) und Ethanol (rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Probeklausur STATISTISCHE PHYSIK PLUS
 DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
Erreichte Punktzahlen: Die Bearbeitungszeit beträgt 3 Stunden.
 Fakultät für Physik der LMU München Prof. Ilka Brunner Vorlesung T4p, WS08/09 Klausur am 11. Februar 2009 Name: Matrikelnummer: Erreichte Punktzahlen: 1.1 1.2 1.3 2.1 2.2 2.3 2.4 Hinweise Die Bearbeitungszeit
Fakultät für Physik der LMU München Prof. Ilka Brunner Vorlesung T4p, WS08/09 Klausur am 11. Februar 2009 Name: Matrikelnummer: Erreichte Punktzahlen: 1.1 1.2 1.3 2.1 2.2 2.3 2.4 Hinweise Die Bearbeitungszeit
Kryoskopie = +. 1 cm. Theoretische Grundlagen
 Kryoskopie 1 Theoretische Grundlagen Der Dapfdruckerniedrigung eines Lösungsittels in einer Lösung (Raoultsches Gesetz) entspricht eine Siedeteperaturerhöhung und - sofern das reine Lösungsittel auskristallisiert
Kryoskopie 1 Theoretische Grundlagen Der Dapfdruckerniedrigung eines Lösungsittels in einer Lösung (Raoultsches Gesetz) entspricht eine Siedeteperaturerhöhung und - sofern das reine Lösungsittel auskristallisiert
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13. Klausur PC 1. Sommersemester :15 bis 11:45.
 Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Thermo Dynamik. Mechanische Bewegung (= Arbeit) Wärme (aus Reaktion) maximale Umsetzung
 Thermo Dynamik Wärme (aus Reaktion) Mechanische Bewegung (= Arbeit) maximale Umsetzung Aussagen der Thermodynamik: Quantifizieren von: Enthalpie-Änderungen Entropie-Änderungen Arbeit, maximale (Gibbs Energie)
Thermo Dynamik Wärme (aus Reaktion) Mechanische Bewegung (= Arbeit) maximale Umsetzung Aussagen der Thermodynamik: Quantifizieren von: Enthalpie-Änderungen Entropie-Änderungen Arbeit, maximale (Gibbs Energie)
Übung 3. Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen (Teil 2) Verständnis des thermodynamischen Gleichgewichts
 Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen (Teil 2) adiabatische Flammentemperatur Verständnis des thermodynamischen Gleichgewichts Definition von K X, K c, K p Berechnung von K
Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen (Teil 2) adiabatische Flammentemperatur Verständnis des thermodynamischen Gleichgewichts Definition von K X, K c, K p Berechnung von K
Praktikum Physikalische Chemie I. Versuch 4. p, V, T - Verhalten realer Gase am Beispiel von SF 6
 Praktikum Physikalische Chemie I ersuch 4 p,, T - erhalten realer Gase am Beispiel von SF 6 1. Grundlagen Komprimiert man ein Gas isotherm, so steigt dessen Druck näherungsweise gemäß dem idealen Gasgesetz
Praktikum Physikalische Chemie I ersuch 4 p,, T - erhalten realer Gase am Beispiel von SF 6 1. Grundlagen Komprimiert man ein Gas isotherm, so steigt dessen Druck näherungsweise gemäß dem idealen Gasgesetz
Die Eigenschaften einfacher
 Die Eigenschaften einfacher ischungen Lernziele: Thermodynamische eschreibung von ischungen Partielle molare Grössen, TD von Ischhasen Chemisches Potenzial flüssiger Phasen Eigenschaften von Lösungen,
Die Eigenschaften einfacher ischungen Lernziele: Thermodynamische eschreibung von ischungen Partielle molare Grössen, TD von Ischhasen Chemisches Potenzial flüssiger Phasen Eigenschaften von Lösungen,
Gefrierpunktserniedrigung
 Knoch, Anastasiya Datum der Durchführung: Petri, Guido 05.01.2016 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Gefrierpunktserniedrigung 1. Aufgabenstellung
Knoch, Anastasiya Datum der Durchführung: Petri, Guido 05.01.2016 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Gefrierpunktserniedrigung 1. Aufgabenstellung
Übungsblatt 2 ( )
 Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Physikalische Umwandlungen reiner Stoffe
 Physikalische Umwandlungen reiner Stoffe Lernziele: Phasendiagramme, die Stabilität von Phasen Phasengrenzen, typische Phasendiagramme Phasenübergänge, die D Gleichgewichtkriterien Die Abhängigkeit der
Physikalische Umwandlungen reiner Stoffe Lernziele: Phasendiagramme, die Stabilität von Phasen Phasengrenzen, typische Phasendiagramme Phasenübergänge, die D Gleichgewichtkriterien Die Abhängigkeit der
1. Geschwindigkeit von Elektronen in Drähten (2+2+2)
 Lösungen zur Übungen zur Physik (Elektrodynaik) SS 5 6 Übungsblatt 955 Bearbeitung bis Mi 555 Geschwindigkeit on Elektronen in Drähten (++) Ein Kupferdraht it de Durchesse durchflossen Berechnen Sie a)
Lösungen zur Übungen zur Physik (Elektrodynaik) SS 5 6 Übungsblatt 955 Bearbeitung bis Mi 555 Geschwindigkeit on Elektronen in Drähten (++) Ein Kupferdraht it de Durchesse durchflossen Berechnen Sie a)
PhysikalischeUmwandlungen
 PhysikalischeUmwandlungen reinerstoffe Lernziele: Phasendiagramme, die Stabilität von Phasen Phasengrenzen, typische Phasendiagramme Phasenübergänge, die D Gleichgewichtkriterien Die Abhängigkeit der Stabilität
PhysikalischeUmwandlungen reinerstoffe Lernziele: Phasendiagramme, die Stabilität von Phasen Phasengrenzen, typische Phasendiagramme Phasenübergänge, die D Gleichgewichtkriterien Die Abhängigkeit der Stabilität
Übung zur Vorlesung PC I Chemische Thermodynamik B.Sc. Blatt 10
 Übung zur Vorlesung PC I Chemische Thermodynamik B.Sc. Blatt 10 1. Berechnen Sie die Viskosität von Benzoldampf bei 0 C, 0 C und 900 C, verwenden sie dabei einen mittleren Stoßquerschnitt von σ 0,88 nm.
Übung zur Vorlesung PC I Chemische Thermodynamik B.Sc. Blatt 10 1. Berechnen Sie die Viskosität von Benzoldampf bei 0 C, 0 C und 900 C, verwenden sie dabei einen mittleren Stoßquerschnitt von σ 0,88 nm.
. V2. = p 2 T 1 T 2. Normbedingungen Das Volumen von 1 Mol eines idealen Gases beträgt bei Normbedingungen (1.013 bar, 0 C) Liter.
 Wäreausdehnung der Gase LMPG_GASE LABA/B Während bei Flüssigkeiten und Festkörpern die Wäreausdehnung auch von der Art des Stoffes abhängt, ist dies bei Gasen nicht der Fall. Bei konstante Druck und einer
Wäreausdehnung der Gase LMPG_GASE LABA/B Während bei Flüssigkeiten und Festkörpern die Wäreausdehnung auch von der Art des Stoffes abhängt, ist dies bei Gasen nicht der Fall. Bei konstante Druck und einer
Lösung. Nachholklausur zur Vorlesung Physikalische Chemie I - Sommersemester 2002
 Lösung Nachholklausur zur orlesung Physikalische hemie I - Sommersemester 00 6. Oktober 00, 9 5-5 Uhr Hineise - Bitte Namen auf jedes Blatt schreiben. - Auch Blatt-Rückseiten beschreiben. - Ggf. eitere
Lösung Nachholklausur zur orlesung Physikalische hemie I - Sommersemester 00 6. Oktober 00, 9 5-5 Uhr Hineise - Bitte Namen auf jedes Blatt schreiben. - Auch Blatt-Rückseiten beschreiben. - Ggf. eitere
Van der Waals-Theorie und Zustandsgleichung
 Van der Waals-Theorie und Zustandsgleichung Eine verbesserte Zustandsgleichung für klassische Gase bei höheren Dichten liefert die Van der Waals-Gleichung. Diese Gleichung beschreibt auch den Phasenübergang
Van der Waals-Theorie und Zustandsgleichung Eine verbesserte Zustandsgleichung für klassische Gase bei höheren Dichten liefert die Van der Waals-Gleichung. Diese Gleichung beschreibt auch den Phasenübergang
Die Zusammensetzung am Ausgang der Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Musterlösung Übung 9
 Musterlösung Übung 9 Aufgabe 1: Chlorierung von Phosphotrichlorid a) Von 1 mol ursprünglichem PCl 3 und Cl 2 wären 0.515 mol zu PCl 5 reagiert und 0.485 mol verblieben. Mit x i = n i ergeben sich die Molenbrüche
Musterlösung Übung 9 Aufgabe 1: Chlorierung von Phosphotrichlorid a) Von 1 mol ursprünglichem PCl 3 und Cl 2 wären 0.515 mol zu PCl 5 reagiert und 0.485 mol verblieben. Mit x i = n i ergeben sich die Molenbrüche
Bekannter Stoff aus dem 1. Semester:
 Bekannter Stoff aus dem 1. Semester: Atombau! Arten der Teilchen! Elemente/Isotope! Kernchemie! Elektronenhülle/Quantenzahlen Chemische Bindung! Zustände der Materie! Ionenbindung! Atombindung! Metallbindung
Bekannter Stoff aus dem 1. Semester: Atombau! Arten der Teilchen! Elemente/Isotope! Kernchemie! Elektronenhülle/Quantenzahlen Chemische Bindung! Zustände der Materie! Ionenbindung! Atombindung! Metallbindung
1 I. Thermodynamik. 1.1 Ideales Gasgesetz. 1.2 Vereinfachte kinetische Gastheorie. 1.3 Erster Hauptsatz der Thermodynamik.
 1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11
 23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11 Thema: Nernst scher Verteilungssatz Aufgabenstellung: 1. Ermittlung des Molekülzustandes der Benzoesäure in der Wasser- und in der Toluolphase
23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11 Thema: Nernst scher Verteilungssatz Aufgabenstellung: 1. Ermittlung des Molekülzustandes der Benzoesäure in der Wasser- und in der Toluolphase
12a Statische Flüssigkeiten
 a Statische lüssigkeiten Zustand der Materie Man unterscheidet vier unterschiedliche ggregatzustände fest gasförig flüssig Plasa Druck Definition Druck Einheit [/²][Pa] D60c d pd Druck den ein Elefant
a Statische lüssigkeiten Zustand der Materie Man unterscheidet vier unterschiedliche ggregatzustände fest gasförig flüssig Plasa Druck Definition Druck Einheit [/²][Pa] D60c d pd Druck den ein Elefant
Die Innere Energie U
 Die Innere Energie U U ist die Summe aller einem System innewohnenden Energien. Es ist unmöglich, diese zu berechnen. U kann nicht absolut angegeben werden! Differenzen in U ( U) können gemessen werden.
Die Innere Energie U U ist die Summe aller einem System innewohnenden Energien. Es ist unmöglich, diese zu berechnen. U kann nicht absolut angegeben werden! Differenzen in U ( U) können gemessen werden.
Versuch MG: Molmassenbestimmung eines Gases nach der Methode von Dumas
 Dies ist ein Beispielprotokoll zu fiktiven Versuch Molassenbestiung, das Ihnen insbesondere für die physikalischcheischen Versuche (GMS, ABS, BSP, MWG, LFG) aufzeigt, wie Ihr Protokoll auszusehen hat.
Dies ist ein Beispielprotokoll zu fiktiven Versuch Molassenbestiung, das Ihnen insbesondere für die physikalischcheischen Versuche (GMS, ABS, BSP, MWG, LFG) aufzeigt, wie Ihr Protokoll auszusehen hat.
2.2 Arbeit und Energie. Aufgaben
 Technische Mechanik 3 2.2-1 Prof. Dr. Wandinger Aufgabe 1 Auf eine Katapult befindet sich eine Kugel der Masse, die durch eine Feder beschleunigt wird. Die Feder ist a Anfang u die Strecke s 0 zusaengedrückt.
Technische Mechanik 3 2.2-1 Prof. Dr. Wandinger Aufgabe 1 Auf eine Katapult befindet sich eine Kugel der Masse, die durch eine Feder beschleunigt wird. Die Feder ist a Anfang u die Strecke s 0 zusaengedrückt.
- Chemisches Potential der idealen Gasphase: Phasengleichgewichte nichtidealer Gemische
 Inhalt von Abschnitt 3.3 3.3-0 3.3 Phasenübergänge und Phasengleichgewichte 3.3.1 Phasenübergang bei reinem Stoff 3.3.2 Phasengleichgewichte reiner Stoffe 3.3.3 Phasengleichgewichte von Stoffgemischen
Inhalt von Abschnitt 3.3 3.3-0 3.3 Phasenübergänge und Phasengleichgewichte 3.3.1 Phasenübergang bei reinem Stoff 3.3.2 Phasengleichgewichte reiner Stoffe 3.3.3 Phasengleichgewichte von Stoffgemischen
Entmischungsgleichgewichte
 ntischungsgleichgewichte Ideale binäre Mischungen Bei der Behandlung von Mischungserscheinungen in binären ysteen geht an von den beiden betreffenden reinen Koponenten aus. Für den jeweiligen toffengenanteil
ntischungsgleichgewichte Ideale binäre Mischungen Bei der Behandlung von Mischungserscheinungen in binären ysteen geht an von den beiden betreffenden reinen Koponenten aus. Für den jeweiligen toffengenanteil
Welcher Bewegungsspielraum ist für die beweglichen Auflager der Brücke zu berücksichtigen?
 Ü 4. Längendehnung einer Autobahnbrücke Bei 0 beträgt die Länge einer Autobahnbrücke 60. Die eperaturschwankung beträgt -0 i Winter bis zu +4 i Soer. Der Wäredehnungskoeffizient des bei der Brückenkonstruktion
Ü 4. Längendehnung einer Autobahnbrücke Bei 0 beträgt die Länge einer Autobahnbrücke 60. Die eperaturschwankung beträgt -0 i Winter bis zu +4 i Soer. Der Wäredehnungskoeffizient des bei der Brückenkonstruktion
Mischphasenthermodynamik Prüfung
 Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Thomas Eissfeller, Peter Greck, Tillmann Kubis, Christoph Schindler
 U München Reinhard Scholz Physik Department, 33 homas Eissfeller, Peter Greck, illmann Kubis, Christoph Schindler http://www.wsi.tum.de/33/eaching/teaching.htm Übung in heoretischer Physik 5B (hermodynamik)
U München Reinhard Scholz Physik Department, 33 homas Eissfeller, Peter Greck, illmann Kubis, Christoph Schindler http://www.wsi.tum.de/33/eaching/teaching.htm Übung in heoretischer Physik 5B (hermodynamik)
Physikalische Chemie Praktikum. Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung
 Hochschule Emden / Leer Physikalische Chemie Praktikum Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung Vers.Nr. 17 Sept. 2015 Allgemeine Grundlagen a) Reine Stoffe Bei reinen Stoffen
Hochschule Emden / Leer Physikalische Chemie Praktikum Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung Vers.Nr. 17 Sept. 2015 Allgemeine Grundlagen a) Reine Stoffe Bei reinen Stoffen
-1- In diesem Kapitel geht es nur um nicht-reaktive Mischungen, d.h. die einzelnen Substanzen reagieren nicht chemisch miteinander.
 -1-8 MISCHUNGEN In diese Kapitel geht es nur u nicht-reaktive Mischungen, d.h. die einzelnen Sustanzen reagieren nicht cheisch iteinander. 8.1 Ideale Mischungen von Gasen Möchte an sich it Mischungen eschäftigen,
-1-8 MISCHUNGEN In diese Kapitel geht es nur u nicht-reaktive Mischungen, d.h. die einzelnen Sustanzen reagieren nicht cheisch iteinander. 8.1 Ideale Mischungen von Gasen Möchte an sich it Mischungen eschäftigen,
A 2.6 Wie ist die Zusammensetzung der Flüssigkeit und des Dampfes eines Stickstoff-Sauerstoff-Gemischs
 A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
PC-Übung Nr.1 vom
 PC-Übung Nr.1 vom 17.10.08 Sebastian Meiss 25. November 2008 1. Allgemeine Vorbereitung a) Geben Sie die Standardbedingungen in verschiedenen Einheiten an: Druck p in Pa, bar, Torr, atm Temperatur T in
PC-Übung Nr.1 vom 17.10.08 Sebastian Meiss 25. November 2008 1. Allgemeine Vorbereitung a) Geben Sie die Standardbedingungen in verschiedenen Einheiten an: Druck p in Pa, bar, Torr, atm Temperatur T in
Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol
![Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol Molzahl: n = N/N A [n] = mol N ist die Anzahl der Atome oder Moleküle des Stoffes. Molmasse oder Molekularmasse: M [M ]= kg/kmol](/thumbs/50/26795947.jpg) 2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
2. Zustandsgrößen 2.1 Die thermischen Zustandsgrößen 2.1.1. Masse und Molzahl Reine Stoffe: Ein Mol eines reinen Stoffes enthält N A = 6,02214. 10 23 Atome oder Moleküle, N A heißt Avogadro-Zahl. Molzahl:
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
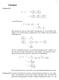 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
Musterlösung Übung 10
 Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser links) und Ethanol rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser links) und Ethanol rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Inhalt der Vorlesung. 1. Eigenschaften der Gase. 0. Einführung
 Inhalt der Vorlesung 0. Einführung 0.1 Themen der Physikal. Chemie 0.2 Grundbegriffe/ Zentrale Größe: Energie 0.3 Molekulare Deutung der inneren Energie U Molekülstruktur, Energieniveaus und elektromagn.
Inhalt der Vorlesung 0. Einführung 0.1 Themen der Physikal. Chemie 0.2 Grundbegriffe/ Zentrale Größe: Energie 0.3 Molekulare Deutung der inneren Energie U Molekülstruktur, Energieniveaus und elektromagn.
Klausur zu Grundlagen der Physikalischen Chemie (21371) - Teil 1
 Klausur zu Grundlagen der Physikalischen Chemie (21371) - Teil 1 Name: Mat.Nr.: Punkte: /50 Zur Bearbeitung der folgenden Aufgaben haben Sie 90 Minuten Zeit. Antworten dürfen in Form von Stichpunkten gegeben
Klausur zu Grundlagen der Physikalischen Chemie (21371) - Teil 1 Name: Mat.Nr.: Punkte: /50 Zur Bearbeitung der folgenden Aufgaben haben Sie 90 Minuten Zeit. Antworten dürfen in Form von Stichpunkten gegeben
Bereich Schwierigkeit Thema Quantenphysik X Photoeffekt. Caesium-Kathode. a) Skizzieren Sie den grundlegenden Versuchsaufbau zum Photoeffekt.
 Quantenphysik X Photoeffekt Caesiu-Kathode a) Skizzieren Sie den grundlegenden Versuchsaufbau zu Photoeffekt. b) Eine Fotokathode besteht aus Caesiu (W A =1,94eV) und wird it Licht der Frequenz f=6,9.
Quantenphysik X Photoeffekt Caesiu-Kathode a) Skizzieren Sie den grundlegenden Versuchsaufbau zu Photoeffekt. b) Eine Fotokathode besteht aus Caesiu (W A =1,94eV) und wird it Licht der Frequenz f=6,9.
1. Klausur zur Vorlesung Physikalische Chemie I
 1. Klausur zur Vorlesung Physikalische Chemie I Sommersemester 2006 8. Juni 2006 Angaben zur Person (BITTE LESERLICH UND IN DRUCKBUCHSTABEN) Name, Vorname... Geburtsdatum und -ort... Matrikelnummer...
1. Klausur zur Vorlesung Physikalische Chemie I Sommersemester 2006 8. Juni 2006 Angaben zur Person (BITTE LESERLICH UND IN DRUCKBUCHSTABEN) Name, Vorname... Geburtsdatum und -ort... Matrikelnummer...
Der Joule-Thomson Effekt
 Der Joule-hoson Effekt Einleitung Der Joule-hoson Effekt bezeichnet die eeraturänderung eines realen Gases bei einer adiabatischen Voluenveränderung. Der Effekt wird großtechnisch zu Beisiel i Linde- Verfahren
Der Joule-hoson Effekt Einleitung Der Joule-hoson Effekt bezeichnet die eeraturänderung eines realen Gases bei einer adiabatischen Voluenveränderung. Der Effekt wird großtechnisch zu Beisiel i Linde- Verfahren
5.2 Thermische Ausdehnung (thermische Zustandsgleichung)
 5.2 herische Ausdehnung (therische Zustandsgleichung) Praktisch alle festen, gasförigen und flüssigen Stoffe dehnen sich bei Erwärung bei konstante Druck aus, vergrößern also ihr Voluen. Alle Stoffe lassen
5.2 herische Ausdehnung (therische Zustandsgleichung) Praktisch alle festen, gasförigen und flüssigen Stoffe dehnen sich bei Erwärung bei konstante Druck aus, vergrößern also ihr Voluen. Alle Stoffe lassen
Kolligative Eigenschaften
 Prof. Dr. Norbert Hampp 1/8 11. Kolligative Eigenschaften Kolligative Eigenschaften Unter kolligativen Eigenschaften versteht man die Eigenschaften eines Systems die auf der Mischung unterschiedlicher
Prof. Dr. Norbert Hampp 1/8 11. Kolligative Eigenschaften Kolligative Eigenschaften Unter kolligativen Eigenschaften versteht man die Eigenschaften eines Systems die auf der Mischung unterschiedlicher
PCI (Biol./Pharm.) Thermodyn. Musterlösung Übung 5 H.P. Lüthi / R. Riek HS Musterlösung Übung 5
 Musterlösung Übung 5 ufgabe 1: Enthalpieänderungen bei Phasenübergängen Es ist hilfreich, zuerst ein Diagramm wie das folgende zu konstruieren: (Die gesuchten Werte sind in den umrandeten oxen.) sub X
Musterlösung Übung 5 ufgabe 1: Enthalpieänderungen bei Phasenübergängen Es ist hilfreich, zuerst ein Diagramm wie das folgende zu konstruieren: (Die gesuchten Werte sind in den umrandeten oxen.) sub X
Erreichte Punktzahlen: Die Bearbeitungszeit beträgt 3 Stunden.
 Fakultät für Physik der LMU München Prof. Ilka Brunner Michael Kay Vorlesung T4, WS11/12 Klausur am 18. Februar 2012 Name: Matrikelnummer: Erreichte Punktzahlen: 1 2 3 4 5 6 Hinweise Die Bearbeitungszeit
Fakultät für Physik der LMU München Prof. Ilka Brunner Michael Kay Vorlesung T4, WS11/12 Klausur am 18. Februar 2012 Name: Matrikelnummer: Erreichte Punktzahlen: 1 2 3 4 5 6 Hinweise Die Bearbeitungszeit
Wir wollen unsere folgenden Betrachtung auf die drei Phasen - fest, - flüssig, - gasförmig beschränken.
 8.4 Phasenübergänge und Phasengleichgewichte 8.4.1 Phasenübergang bei reinem Stoff Wir wollen unsere folgenden Betrachtung auf die drei Phasen - fest, - flüssig, - gasförmig beschränken. Die Erfahrung
8.4 Phasenübergänge und Phasengleichgewichte 8.4.1 Phasenübergang bei reinem Stoff Wir wollen unsere folgenden Betrachtung auf die drei Phasen - fest, - flüssig, - gasförmig beschränken. Die Erfahrung
Klausur Physikalische Chemie für TUHH (Chemie III)
 07.03.2012 14.00 Uhr 17.00 Uhr Moritz / Pauer Klausur Physikalische Chemie für TUHH (Chemie III) Die folgende Tabelle dient Korrekturzwecken und darf vom Studenten nicht ausgefüllt werden. 1 2 3 4 5 6
07.03.2012 14.00 Uhr 17.00 Uhr Moritz / Pauer Klausur Physikalische Chemie für TUHH (Chemie III) Die folgende Tabelle dient Korrekturzwecken und darf vom Studenten nicht ausgefüllt werden. 1 2 3 4 5 6
Spezialfälle. BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz. bei V, n = konstant: p = const.
 Spezialfälle BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz p V = n R T bei V, n = konstant: p = const. T Druck Druck V = const. Volumen T 2 T 1 Temperatur
Spezialfälle BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz p V = n R T bei V, n = konstant: p = const. T Druck Druck V = const. Volumen T 2 T 1 Temperatur
Gefrierpunktserniedrigung
 Gefrierpunktserniedrigung Zur Darstellung der möglichen Phasen einer Substanz wird deren Verhalten bei verschiedenen Drücken und Temperaturen gemessen und in ein Druck-Temperatur- Diagramm eingetragen.
Gefrierpunktserniedrigung Zur Darstellung der möglichen Phasen einer Substanz wird deren Verhalten bei verschiedenen Drücken und Temperaturen gemessen und in ein Druck-Temperatur- Diagramm eingetragen.
Lösungen zur Übungsklausur Thermodynamik WS 2003/04
 Lösungen zur Übungsklausur hermodynamik WS 003/04 Name: Vorname: Matrikelnummer: Aufgabe 3 4 5 Gesamt Note mögliche Punkte 9 0 8 9 4 40 erreichte Punkte Die Klausur wird bei Erreichen von insgesamt 0 Punkten
Lösungen zur Übungsklausur hermodynamik WS 003/04 Name: Vorname: Matrikelnummer: Aufgabe 3 4 5 Gesamt Note mögliche Punkte 9 0 8 9 4 40 erreichte Punkte Die Klausur wird bei Erreichen von insgesamt 0 Punkten
Besprechung am /
 PN1 - Physik 1 für Cheiker und Biologen Prof. J. Lipfert WS 018/19 Übungsblatt 9 Übungsblatt 9 Besprechung a 08.01.019/10.01.019 Aufgabe 1 Pirouette. Ein 1,85 Meter großer, 100 Kilogra schwerer Eishockeyspieler
PN1 - Physik 1 für Cheiker und Biologen Prof. J. Lipfert WS 018/19 Übungsblatt 9 Übungsblatt 9 Besprechung a 08.01.019/10.01.019 Aufgabe 1 Pirouette. Ein 1,85 Meter großer, 100 Kilogra schwerer Eishockeyspieler
25. Adiabatische Expansion eines idealen Gases 1
 25. Adiabatische Exansion eines idealen Gases 1 25. ADABASHE EXPANSON ENES DEALEN GASES 1. Aufgabe Für Luft als annähernd ideales Gas sollen sowohl die Molwäre bei konstante Druck, d.h.,, als auch das
25. Adiabatische Exansion eines idealen Gases 1 25. ADABASHE EXPANSON ENES DEALEN GASES 1. Aufgabe Für Luft als annähernd ideales Gas sollen sowohl die Molwäre bei konstante Druck, d.h.,, als auch das
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen!
 1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
Lösungsvorschlag Übung 2
 Lösungsvorschlag Übung Aufgabe : Dichte von Gasen a) Die Dichte ρ eines Gases ist definiert als der Quotient aus Masse m und Volumen V ρ = m V..) Die Masse eines Gases erhält man aus dem Produkt seiner
Lösungsvorschlag Übung Aufgabe : Dichte von Gasen a) Die Dichte ρ eines Gases ist definiert als der Quotient aus Masse m und Volumen V ρ = m V..) Die Masse eines Gases erhält man aus dem Produkt seiner
Theorie der Wa rme Musterlo sung 8.
 Theorie der Wa rme Musterlo sung 8. U bung 1. FS 2014 Prof. Renner Wieso trocknet Wa sche an der Wa scheleine? Unter Normalbedingungen (T 300K, p 1bar ist Wasser flu ssig. Trotzdem verdunstet Wasser aus
Theorie der Wa rme Musterlo sung 8. U bung 1. FS 2014 Prof. Renner Wieso trocknet Wa sche an der Wa scheleine? Unter Normalbedingungen (T 300K, p 1bar ist Wasser flu ssig. Trotzdem verdunstet Wasser aus
Das chemische Potential- eine Übersicht wichtiger Beziehungen
 Das chemische Potential- eine Übersicht wichtiger Beziehungen Definition des chem. Potentials Das chemische Potential beschreibt die bhängigkeit der extensiven thermodynamischen Energiegrößen von der Stoffmenge.
Das chemische Potential- eine Übersicht wichtiger Beziehungen Definition des chem. Potentials Das chemische Potential beschreibt die bhängigkeit der extensiven thermodynamischen Energiegrößen von der Stoffmenge.
Vorlesung Statistische Mechanik: Ising-Modell
 Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
1. BESTIMMUNG DER DAMPFDRUCKKURVE EINER REINEN FLÜSSIGKEIT ZUR BERECHNUNG DER VER- DAMPFUNGSENTHALPIE DH verd UND -ENTROPIE DS verd
 A1-1 1. BESTIMMUNG DER DAMPFDRUCKKURVE EINER REINEN FLÜSSIGKEIT ZUR BERECHNUNG DER VER- DAMPFUNGSENTHALPIE DH verd UND -ENTROPIE DS verd Bereiten Sie folgende Themengebiete vor Zustandsdiagramme von Einkomponentensystemen
A1-1 1. BESTIMMUNG DER DAMPFDRUCKKURVE EINER REINEN FLÜSSIGKEIT ZUR BERECHNUNG DER VER- DAMPFUNGSENTHALPIE DH verd UND -ENTROPIE DS verd Bereiten Sie folgende Themengebiete vor Zustandsdiagramme von Einkomponentensystemen
Schmelzdiagramm eines binären Stoffgemisches
 Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
Hochschule Heilbronn Technik Wirtschaft Informatik Heilbronn University Institut für math.-naturw. Grundlagen
 Technik Wirtschaft Inforatik Institut für ath-naturw Grundlagen Versuch : Kalorietrie 1 Aufgabenstellung Bestiung der Wärekapazität eines Kalorieters Bestiung der spezifischen Wärekapazität Festkörpern
Technik Wirtschaft Inforatik Institut für ath-naturw Grundlagen Versuch : Kalorietrie 1 Aufgabenstellung Bestiung der Wärekapazität eines Kalorieters Bestiung der spezifischen Wärekapazität Festkörpern
Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum
 Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum Tobias Schabel Datum des Praktikumstags: 02.12.2005 Matthias Ernst Protokoll-Datum: 12/20/2005 Gruppe A-11 11. Versuch: Schmelzdiagramm Assistent:
Praktikumsprotokoll Physikalisch-Chemisches Anfängerpraktikum Tobias Schabel Datum des Praktikumstags: 02.12.2005 Matthias Ernst Protokoll-Datum: 12/20/2005 Gruppe A-11 11. Versuch: Schmelzdiagramm Assistent:
A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
Repetitorium Physikalische Chemie für Lehramt
 Repetitorium Physikalische Chemie für Lehramt Anfangstext bei der Prüfung. Hier nicht relevant. Zu jeder der 10 Fragen werden maximal 12,5 Punkte vergeben. Höchstens 100 Punkte können erreicht werden,
Repetitorium Physikalische Chemie für Lehramt Anfangstext bei der Prüfung. Hier nicht relevant. Zu jeder der 10 Fragen werden maximal 12,5 Punkte vergeben. Höchstens 100 Punkte können erreicht werden,
8.4.5 Wasser sieden bei Zimmertemperatur ******
 8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov #13 am 30.01.2007 Folien im PDF Format unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov #13 am 30.01.2007 Folien im PDF Format unter: htt://www.hysik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
