Halogene, Nachweise in Alltagsprodukten
|
|
|
- Walter Pfaff
- vor 6 Jahren
- Abrufe
Transkript
1 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 9 & 10 Halogene, Nachweise in Alltagsprodukten
2 Auf einen Blick: Das Protokoll enthält für die Klassen 9 und 10 einen Lehrerversuch und einen Schülerversuch zum Thema Halogene, Nachweise in Alltagsprodukten der Unterrichtseinheit Elementfamilien. Der Lehrerversuch zeigt, dass Chlor durch seine bleichende Wirkung mit einem farbigen Papier nachgewiesen werden kann. Der Schülerversuch stellt den qualitativen Nachweis von Chlorid-Ionen in Alltagsprodukten durch Fällung mit Silbernitratlösung dar. Das Arbeitsblatt Nachweis der Halogenide durch Fällung dient als Unterrichtsmaterial zur Durchführung des Schülerversuchs. Inhalt 1 Beschreibung des Themas und zugehörige Lernziele Relevanz des Themas für SuS der 9. und 10. Jahrgangsstufe und didaktische Reduktion Lehrerversuch V 1 Nachweis von Chlor in Chlorreiniger Schülerversuch V 2 Nachweis von Chlorid-Ionen Didaktischer Kommentar zum Schülerarbeitsblatt Erwartungshorizont (Kerncurriculum) Erwartungshorizont (Inhaltlich)... 9
3 1 Beschreibung des Themas und zugehörige Lernziele 1 1 Beschreibung des Themas und zugehörige Lernziele Das Thema Halogene, Nachweise in Alltagsprodukten ist ein wesentlicher Bestandteil des Chemieunterrichts der Klassenstufen 9 und 10. Hier werden die Elemente der siebten Hauptgruppe des Periodensystems als eine Elementfamilie beschrieben sowie ihre gemeinsamen Eigenschaften, ihre Verwendung und Nachweisreaktionen ihrer Ionen thematisiert. Zu ihnen gehören die Elemente Fluor, Chlor, Brom, Iod und das radioaktive Astat. Sie charakterisieren sich durch hohe Elektronegativitäten, Elektronenaffinitäten und Ionisierungsenergien, weshalb sie ähnlich wie die Alkalimetalle sehr reaktiv sind und dazu neigen, mit Metallen unter Bildung von Salzen in einer stark exothermen Reaktion zu reagieren. Aufgrund ihrer großen Reaktivität kommen sie in der Natur nur in Form ihrer Verbindungen vor. Halogenide in Lösung lassen sich durch Fällungsreaktionen mit Silbernitratlösung als Nachweisreagenz unter Bildung eines schwerlöslichen Silberhalogenids qualitativ nachweisen. Im Kerncurriculum für das Fach Chemie werden für die Klassenstufen 9 und 10 Halogene im Basiskonzept Stoff-Teilchen genannt. Dabei sollen die Schülerinnen und Schüler (SuS) Elemente bestimmten Elementfamilien zuordnen, die Elemente innerhalb einer Familie vergleichen und Gemeinsamkeiten und Unterschiede feststellen. Daneben sollen sie Nachweisreaktionen auf das Vorhandensein von bestimmten Teilchen zurückführen (Kompetenzbereich Fachwissen). Darüber hinaus sollen sie qualitative Nachweisreaktionen durchführen, geeignete Untersuchungen planen und die Ergebnisse kritisch auswerten sowie vorgegebene quantitative Daten auswerten (Kompetenzbereich Erkenntnisgewinnung). Außerdem sollen sie Angaben über Produkte hinsichtlich ihrer fachlichen Richtigkeit prüfen (Kompetenzbereich Kommunikation). Das Lehrerexperiment zeigt den Nachweis von Chlor in Chlorreiniger. Dieser wird durch die bleichende Wirkung von Chlor veranschaulicht. Die SuS erkennen anhand des Versuches, dass Chlor eine bleichende Wirkung hat und aufgrund dieser Wirkung mithilfe eines farbigen Blattes Papier nachgewiesen werden kann. Daneben wiederholen/üben/festigen sie das Aufstellen von Redoxreaktionen und sehen ein, dass Chlorreiniger nicht mit säurehaltigen Reinigungsmitteln in Berührung kommen sollten. Das Schülerexperiment zeigt den qualitativen Nachweis von Chlorid-Ionen in wässriger Lösung durch Fällung mit Silbernitratlösung. Die SuS lernen dabei die Begriffe des qualitativen und quantitativen Nachweises, der Fällung, des Niederschlages, des Nachweisreagenzes und der Fällungsreaktion zu definieren sowie Alltagsprodukte auf die Anwesenheit von Chlorid-Ionen zu untersuchen.
4 2 Relevanz des Themas für SuS der 9. und 10. Jahrgangsstufe und didaktische Reduktion 2 2 Relevanz des Themas für SuS der 9. und 10. Jahrgangsstufe und didaktische Reduktion Das Thema ist ein für die Schule relevantes Thema, da SuS der Klassenstufe 9 und 10 täglich mit Halogenverbindungen in Berührung kommen, z.b. beim Würzen von Speisen mit iodiertem Kochsalz in der Küche oder beim Zähneputzen mit fluoridhaltiger Zahnpasta im Badezimmer. Des Weiteren kennen sie sicherlich auch schon den charakteristischen Geruch nach Chlor in Schwimmbädern. Einigen von ihnen sind vielleicht auch schon Iodtabletten für die Unterstützung der Schilddrüsenfunktion bekannt. Halogene und Halogenverbindungen sind daher in der Welt der SuS allgegenwärtig und werden von ihnen wahrgenommen, weshalb sich für sie Fragen ergeben, auf die sie keine Antwort haben. Daraus ergibt sich die schulische Relevanz der Unterrichtseinheit, in der das eigenständige Experimentieren der SuS zur Erschließung der Lebenswirklichkeit beitragen soll. Dennoch muss eine didaktische Reduktion des Themas vorgenommen werden. Dies bedeutet zum Einen, dass die Auswertung des Versuches Nachweis von Fluorid-Ionen (V2 des Kurzprotokolls) auf einen Ionenaustausch reduziert wird und nicht auf den eigentlichen Austausch von Liganden der Komplexreaktion eingegangen wird, da Komplexe kein Thema der 9. und 10. Jahrgangsstufe sind und auch vorher noch nicht behandelt werden. Des Weiteren werden im Versuch Chlor als Bleichmittel (V3 des Kurzprotokolls) die Struktur der Farbstoffe Anthocyan und die des synthetischen Farbstoffes der Tinte sowie die Veränderung ihrer Strukturen durch die Reaktion nicht thematisiert. Daneben findet in den Versuchen eine didaktische Reduktion dahingehend statt, dass es sich nur um Redoxreaktionen zwischen anorganischen Stoffen handelt, wobei auf Redoxreaktionen organischer Stoffe nicht eingegangen wird, da diese erst in der Oberstufe behandelt werden. Für die dargestellten Versuche wird aber folgendes Wissen benötigt: der erweiterte Redoxbegriff, der Aufbau der Salze aus Kationen und Anionen sowie die Unterscheidung zwischen Atomen und Ionen mithilfe eines differenzierten Atommodells. 3 Lehrerversuch V 1 Nachweis von Chlor in Chlorreiniger Der Versuch zeigt die Reaktion zwischen Chlorreiniger und einer sauren Lösung, bei der Chlor entsteht, das im Versuch mittels der Entfärbung eines farbigen Blattes Papier nachgewiesen wird. Achtung: Der Versuch muss im Abzug durchgeführt werden, da bei der Reaktion giftiges Chlorgas entsteht, das nicht eingeatmet werden sollte.
5 3 Lehrerversuch V 1 Nachweis von Chlor in Chlorreiniger 3 Gefahrenstoffe Natriumhypochlorit H: Schwefelsäure (2 mol/l) H: Chlor H: P: P: P: Materialien: Reagenzglas, Reagenzglasständer, Pinzette. Chemikalien: Chlorreiniger (z. B. Dan Klorix ), Schwefelsäure (2 mol/l). Durchführung: Das Reagenzglas wird zu einem Viertel des Volumens mit dem Chlorreiniger gefüllt. Anschließend wird das doppelte Volumen an Schwefelsäure hinzugefügt und die Öffnung des Glases mit einem farbigen Blatt Papier verschlossen (siehe Abb. 1). Abb. 1 - Reagenzglas mit Chlorreiniger und Schwefelsäure, das mit einem farbigen Papier bedeckt ist. Beobachtung: Die Lösung schäumt auf. Es steigt ein hellgrünes Gas auf. Die Stelle des Papiers, die die Öffnung des Reagenzglases abdeckt, wird entfärbt (siehe Abb. 2 und Abb. 3).
6 3 Lehrerversuch V 1 Nachweis von Chlor in Chlorreiniger 4 Abb. 2 - Papier vor dem Verschließen der Reagenzglasöffnung. Abb. 3 - Papier nach dem Verschließen der Reagenzglasöffnung. Deutung: Chlorbleiche enthält Natriumhypochlorit und Natriumchlorid. Gerät es mit einer Säure in Berührung, wird Chlor nach folgender Gleichung freigesetzt: ClO (aq) + Cl (aq) + 2 H 3O + (aq) Cl 2(g) + 3 H 2O (l) Bei der Reaktion handelt es sich um eine Redoxreaktion, bei der Hypochlorit reduziert und Chlorid-Ionen oxidiert werden (Komproportionierung): Oxidation: 2 Cl Cl e Reduktion: 2 ClO + 2 e Cl 2 Das bei der Reaktion gebildete Chlor steigt im Reagenzglas auf und bewirkt die Entfärbung des farbigen Papiers. Da bei der Reaktion zwischen Chlorreinigern und sauren Lösungen gasförmiges Chlor entsteht, sollten Chlorreiniger nicht mit entsprechenden Lösungen in Kontakt gebracht werden. Entsorgung: Die Reaktion im Abzug abklingen lassen, Lösung ggf. neutralisieren und über das Abwasser entsorgen. Literatur: G. Schwendt, Noch mehr Experimente mit Supermarktprodukten, WILEY-VCH, 2003, S. 204/205. H. C. Hofsäss, (Zuletzt abgerufen am um 18:32 Uhr). Der Versuch kann alternativ auch in einem Becherglas mit WC-Reiniger als saure Lösung durchgeführt werden. Das farbige Filterpapier wird hier in das Becherglas gehalten. Im Anschluss an den Versuch kann darauf eingegangen werden, dass gerade im Badezimmer, wo essig- oder zitronensäurehaltige Reinigungsmittel zur Entfernung von Kalkbelägen und Urinstein verwendet werden, darauf geachtet werden sollte, dass chlorid- und hypochlorithaltige Reiniger nicht in Kombination mit säurehaltigen Reinigungsmitteln eingesetzt werden sollten.
7 4 Schülerversuch V 2 Nachweis von Chlorid-Ionen 5 4 Schülerversuch V 2 Nachweis von Chlorid-Ionen Im Versuch werden chloridionen- und chlorohydrathaltige Alltagsprodukte auf die Anwesenheit von Chlorid-Ionen überprüft. Hierzu dient der qualitativen Nachweis von Chlorid-Ionen in wässriger Lösung durch Fällung mit einer Silbernitratlösung. Den SuS muss bekannt sein, dass die Grundbausteine der Salze Kationen und Anionen sind. Ferner müssen sie mithilfe eines differenzierten Atommodells zwischen Atomen und Ionen unterscheiden können. Gefahrenstoffe Silbernitratlösung (0,1 mol/l) H: Verd. Salpetersäure H: P: P: Aluminium Chlorohydrat H: P: Materialien: 5 Reagenzgläser, Reagenzglasständer, Pasteurpipetten, Pipettierhilfe. Chemikalien: Deodorant (mit Aluminium Chlorohydrat), demin. Wasser, Speisesalzlösung, Leitungswasser, Natriumchloridlösung, Silbernitratlösung (c = 0,1 mol/l), verd. Salpetersäure (c < 2 mol/l). Durchführung: Es wird mit dem Deodorant in ein Reagenzglas gesprüht, bis sich darin etwas Flüssigkeit gebildet hat. Hierzu werden 4 ml demin. Wasser gegeben. Daneben werden vier weitere Reagenzgläser mit 4 ml einer Speisesalzlösung, 4 ml Leitungswasser, 4 ml demin. Wasser und 4 ml einer Natriumchloridlösung befüllt und beschriftet. Anschließend werden mit Pasteurpipetten drei Tropfen der Silbernitratlösung und fünf Tropfen der verdünnten Salpetersäure einer jeden Lösung hinzugefügt. Das Reagenzglas mit demin. Wasser dient im Versuch als Blindprobe, das Reagenzglas mit Natriumchloridlösung als Vergleichsprobe. Beobachtung: In den Reagenzgläser der Deodorantlösung (siehe Abb. 5, 1. Reagenzglas von links), der Speisesalzlösung (siehe Abb. 5, 2. Reagenzglas von links) und der Natriumchloridlösung (siehe Abb. 5, 5. Reagenzglas von links) bil-
8 4 Schülerversuch V 2 Nachweis von Chlorid-Ionen 6 det sich ein weißer Niederschlag, der sich bei der Zugabe von verdünnter Salpetersäure nicht auflöst. Im Leitungswasser bildet sich ein sehr feiner Niederschlag (siehe Abb. 5, 3. Reagenzglas von links) und in demineralisiertem Wasser (siehe Abb. 5, 4. Reagenzglas von links) bleibt der Niederschlag fern. Abb. 4 - Deodorantlösung, Speisesalzlösung, Leitungswasser, demin. Wasser und Natriumchloridlösung vor Zugabe der Silbernitratlösung (von links nach rechts). Abb. 5 - Deodorantlösung, Speisesalzlösung, Leitungswasser, demin. Wasser und Natriumchloridlösung nach Zugabe der Silbernitratlösung. Deutung: In den chloridionen- und chlorohydrathaltigen Lösungen, d. h. in der Deodorantlösung, Speisesalzlösung, Leitungswasser und Natriumchloridlösung bildet sich schwerlösliches Silberchlorid, welches sich auch bei der Zugabe von verd. Salpetersäure nicht löst: Entsorgung: Literatur: Der entstandene Niederschlag wird zunächst in einer Ammoniumlösung gelöst und anschließend im Schwermetall-Abfall entsorgt. Prof. Dr. Dr. h.c. J. Strähle, Prof. Dr. E. Schweda, Jander Blasius Lehrbuch der analytischen und präparativen anorganischen Chemie, S. Hirzel Verlag Stuttgart, 16. Auflage, 2006.
9 4 Schülerversuch V 2 Nachweis von Chlorid-Ionen 7 Der Versuch ist gut dazu geeignet, Fällungsreaktionen als eine Form der Nachweisreaktionen zu thematisieren und einen neuen Teilbereich der Chemie, die analytische Chemie, einzuführen. Im Anschluss daran können weitere Nachweisreaktionen durch Fällung, wie z. B. die Fällung von Sulfationen mit Bariumionen und die Fällung von Carbonationen mit Kalkwasser behandelt werden. Außerdem bietet es sich an, im Anschluss an den Versuch einen Versuch zur Zersetzung der Silberhalogenide durchzuführen. Dazu werden die Reagenzgläser mit den Silberhalogeniden im Abzug (!) mit einer Lampe bestrahlt, wobei sie in ihre Elemente zersetzt werden. Mit diesem Anschlussversuch kann die Verwendung von Silberchlorid und Silberbromid als lichtempfindliche Stoffe in der Photographie thematisiert werden. Achtung: Silbernitratlösung sollte nicht mit der Haut und den Augen in Berührung kommen, da es schwere Verätzungen der Haut und Augenschäden verursacht.
10 Arbeitsblatt Nachweis der Halogenide durch Fällung Achtung: Salpetersäure und Silbernitratlösung sind ätzend, Natriumbromid ist reizend. Berühre diese Stoffe nicht und trage eine Schutzbrille! Entsorge die Lösungen im Schwermetall-Abfall. Materialien: Chemikalien: Durchführung: Beobachtung: Auswertung: 7 Reagenzgläser, Reagenzglasgestell, Messpipette, Spatel, Tropfpipetten, Lampe, Alufolie. Natriumchlorid, Natriumbromid, Natriumiodid, Kaliumchlorid, Kaliumbromid, Kaliumiodid, Wasser, 5 % ige Salpetersäure, 1 % ige Silbernitratlösung. Gebe in die 6 Reagenzgläser ca. 5 ml Wasser. Füge außerdem eine Spatelspitze der unter Chemikalien aufgezählten Halogensalze einem der Reagenzgläser hinzu, so dass ein jedes der Reagenzgläser mit einer unterschiedlichen Salzlösung gefüllt ist. Beschrifte die Reagenzgläser. Gebe anschließend zwei Tropfen einer 5 % igen Salpetersäure und einige Tropfen einer 1 % igen Silbernitratlösung hinzu. Fülle das siebte Reagenzglas mit reinem Wasser und setzte es wie die Halogenide mit den aufgeführten Reagenzien um (Blindprobe). Stelle nun die beiden Reagenzgläser, in die Natriumchlorid und -bromid gegeben wurde, in ein Reagenzglasständer und bestrahle sie im Abzug (!) mit einer Lampe. Umhülle die beiden Reagenzgläser, in die Kaliumchlorid und Kaliumbromid gegeben wurde, mit Alufolie. Aufgabe 1 Führe den Versuch gemäß der Anleitung durch. Notiere deine Beobachtungen. Aufgabe 2 Formuliere die Reaktionsgleichungen und erkläre deine Beobachtungen. Aufgabe 3 Nenne die Funktion der Silbernitratlösung im Versuch. Aufgabe 4 Recherchiere im Internet die Verwendung von Silberbromid und Silberchlorid in der Photographie und stelle sie der Klasse unter der Verwendung von Fachbegriffen kurz vor.
11 5 Didaktischer Kommentar zum Schülerarbeitsblatt 9 5 Didaktischer Kommentar zum Schülerarbeitsblatt Das folgende Arbeitsblatt behandelt einen Schülerversuch zum Thema Halogene. Es kann eingesetzt werden, um Fällungsreaktionen als eine Form der Nachweisreaktionen sowie die Verwendung von Silberchlorid und Silberbromid als lichtempfindliche Stoffe in der Photographie zu thematisieren und einen neuen Teilbereich der Chemie, die analytische Chemie, einzuführen. Die SuS sollen den Versuch in kleinen Gruppen durchführen, beobachten (Anforderungsbereich I) und auswerten (Anforderungsbereich II). Dabei sollen sie Fachbegriffe wie Fällung anwenden können (Anforderungsbereich I). Weiterhin sollen sie Anwendungsmöglichkeiten chemischer Erkenntnisse finden (Anforderungsbereich III). Als Vorwissen für den Versuch sollten den SuS bekannt sein, dass die Grundbausteine der Salze Kationen und Anionen sind. Ferner müssen sie mithilfe eines differenzierten Atommodells zwischen Atomen und Ionen unterscheiden können. 5.1 Erwartungshorizont (Kerncurriculum) Fachwissen: Die SuS führen Nachweisreaktionen auf das Vorhandensein von bestimmten Teilchen zurück (Aufgabe 2). Erkenntnisgewinnung: Die SuS führen qualitative Nachweisreaktionen durch (Aufgabe 1). Bei Aufgabe 1 und 3 des Arbeitsblattes handelt es sich um Aufgaben im Anforderungsbereich I, da hier von den SuS im Versuch beobachtetes Wissen wiedergegeben werden soll. Aufgabe 2 ist eine Aufgabe des Anforderungsbereichs II, da die SuS ihre gemachten Beobachtungen in Form einer Reaktionsgleichung und in Form einer Ausformulierung auswerten sollen. Bei Aufgabe 4 handelt es sich um eine Aufgabe im Anforderungsbereich III, da es sich um eine Transferaufgabe handelt. Das Ziel hierbei ist, dass die SuS Anwendungsbereiche der Halogenide kennen lernen und darüber diskutieren. 5.2 Erwartungshorizont (Inhaltlich) Aufgabe 1 Nach der Zugabe der Silbernitratlösung fallen Niederschläge aus, die je nach Halogenid unterschiedliche Farben haben. Die Niederschläge in den Reagenzgläsern mit Chloridlösung ist weiß, die in den Reagenzgläsern mit Bromidlösung blass gelb und die in den Reagenzgläsern mit Iodidlösung gelb. Im Reagenzglas mit reinem Wasser tritt keine Fällung auf. In den Reagenzgläsern, die dem Licht ausgesetzt waren, fällt ein grauer Niederschlag aus, während die mit Aluminiumfolie umhüllten Reagenzgläser unverändert bleiben.
12 5 Didaktischer Kommentar zum Schülerarbeitsblatt 10 Aufgabe 2 Ag + (aq) + Cl (aq) AgCl (s) Ag + (aq) + Br (aq) AgBr (s) Ag + (aq) + I (aq) AgI (s) 2 AgCl (s) 2 Ag (s) + Cl 2(g) 2 AgBr (s) 2 Ag (s) + Br 2(g) Nach der Zugabe der Silbernitratlösung fallen jeweils schwer lösliche Silberhalogenide aus. Silberchlorid ist weiß, Silberbromid blass gelb und Silberiodid gelb. Reaktionen, bei denen Fällungen auftreten, werden Fällungsreaktionen genannt. Silberhalogenide werden durch Licht in ihre Elemente zersetzt. Aufgabe 3 Silbernitratlösung dient als Nachweisreagenz für Halogenidionen (in Lösung). Aufgabe 4 Papierfotos bestehen aus einer Gelatineschicht, die auf Papier geleimt wurde. Diese Gelatineschicht enthält kleine Kristallbröckchen von Silberverbindungen wie Silberbromid oder Silberchlorid. Diese Silberverbindungen bilden als lichtempfindliche Stoffe die Grundlage der Schwarz-Weiß-Photographie. Bei Belichtung werden sie in ihre Bestandteile zersetzt, wobei schwarzes Silber als Feststoff ausfällt und Brom bzw. Chlor verdunstet: 2 AgCl (s) 2 Ag (s) + Cl 2(g) 2 AgBr (s) 2 Ag (s) + Br 2(g) Da das fein verteilte Silber schwarz erscheint, heben sich die belichteten Kristalle vom Hintergrund ab. Durch anschließende Entwicklungsschritte entsteht dann das Foto.
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch und
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch und
Reaktionen von Metallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
1. Qualitativer Nachweis von Anionen und Sodaauszug
 Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Metalle und Nichtmetalle
 Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Säuren und Laugen im Haushalt
 Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Stelle Salzlösungen her und überprüfe die Vorgänge beim Mischen der Lösungen.
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze (P7159700) 3.4 Salzbildung durch Fällungsreaktion Experiment von: Phywe Gedruckt: 15.10.2013 12:20:35 intertess (Version 13.06 B200, Export
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze (P7159700) 3.4 Salzbildung durch Fällungsreaktion Experiment von: Phywe Gedruckt: 15.10.2013 12:20:35 intertess (Version 13.06 B200, Export
Aggregatzustände und deren Temperaturabhängigkeit
 Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Schulversuchspraktikum. Name Thomas Polle. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Vom Alkohol zum Alken
 1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
Schwimmen, Schweben, Sinken
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 beinhaltet einen Lehrer- und vier Schülerversuche.
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 beinhaltet einen Lehrer- und vier Schülerversuche.
Licht und Farben. Kurzprotokoll
 Schulversuchspraktikum Name: Annika Münch Semester: 2. Mastersemester Klassenstufen 5/6 Licht und Farben Kurzprotokoll Auf einen Blick: Für eine Unterrichtseinheit zum Thema Licht und Farben im naturwissenschaftlichen
Schulversuchspraktikum Name: Annika Münch Semester: 2. Mastersemester Klassenstufen 5/6 Licht und Farben Kurzprotokoll Auf einen Blick: Für eine Unterrichtseinheit zum Thema Licht und Farben im naturwissenschaftlichen
Wir untersuchen Mineralwasser
 Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT Elementfamilien
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT Elementfamilien
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 7/8. Sauerstoff. Das Gas des Lebens
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Demonstrationsvorträge in Anorganischer Chemie für Studierende des Lehramtes an Gymnasien. Der Photographische Prozess
 Universität Regensburg Naturwissenschaftliche Fakultät IV Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Dozentin: Dr. M. Andratschke Demonstrationsvorträge in Anorganischer Chemie
Universität Regensburg Naturwissenschaftliche Fakultät IV Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Dozentin: Dr. M. Andratschke Demonstrationsvorträge in Anorganischer Chemie
Zuckernachweis mit Tollens-Reagenz
 Zuckernachweis mit Tollens-Reagenz Betriebsanweisung nach 0 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeitsmerkmale Silbernitrat (öllenstein) AgN 3 3-0/3 6--60-61
Zuckernachweis mit Tollens-Reagenz Betriebsanweisung nach 0 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeitsmerkmale Silbernitrat (öllenstein) AgN 3 3-0/3 6--60-61
Schulversuchspraktikum. Name: Tobias Piotrowski. Semester: Sommersemester 2013. Klassenstufen 9 & 10. ph-wert
 Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
Versuchsprotokoll:Stärkespaltung
 Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Versuchsprotokoll:Stärkespaltung Zeitaufwand: Aufbau: 5 Minuten Durchführung: 20 Minuten Abbau/Entsorgung:: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Pentahydrat
Welche Eigenschaften besitzen Calcium- und Magnesiumlaugen?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie)
 Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Chemieepoche Klasse 11. Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen
 Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Modul 3 Schülergerechtes Experimentieren
 Modul 3 Schülergerechtes Experimentieren Lernziele Fachdidaktik Chemie WS 2016/17 Studiengang: Bachelor of Education Apl. Prof. Dr. G. Hornung, A. Molitor-Schworm, A. Engelhardt Unterrichtsvorbereitung
Modul 3 Schülergerechtes Experimentieren Lernziele Fachdidaktik Chemie WS 2016/17 Studiengang: Bachelor of Education Apl. Prof. Dr. G. Hornung, A. Molitor-Schworm, A. Engelhardt Unterrichtsvorbereitung
Mische einige Stoffe mit Wasser und untersuche die entstandenen Gemischarten.
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P754800) 3.4 Lösungen, Kolloide, Suspensionen Experiment von: Seb Gedruckt: 24.03.204 :28:39 intertess
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P754800) 3.4 Lösungen, Kolloide, Suspensionen Experiment von: Seb Gedruckt: 24.03.204 :28:39 intertess
Haushaltsreiniger und Waschmittel
 Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Haushaltsreiniger und Waschmittel 3 Schülerversuche 2 Auf einen Blick: Dieses Protokoll befasst sich mit
Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Haushaltsreiniger und Waschmittel 3 Schülerversuche 2 Auf einen Blick: Dieses Protokoll befasst sich mit
Projekt- Nachweisreaktionen. Dieses Skript gehört: NaT-Lab für Schülerinnen und Schüler Johannes Gutenberg-Universität Mainz
 Projekt- Nachweisreaktionen NaT-Lab für Schülerinnen und Schüler Johannes Gutenberg-Universität Mainz Dieses Skript gehört: 1 Nachweise von Anionen 1. Nachweis von Sulfat 3 Reagenzgläser im Reagenzglasständer
Projekt- Nachweisreaktionen NaT-Lab für Schülerinnen und Schüler Johannes Gutenberg-Universität Mainz Dieses Skript gehört: 1 Nachweise von Anionen 1. Nachweis von Sulfat 3 Reagenzgläser im Reagenzglasständer
Schulversuchspraktikum. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Schulversuchspraktikum. Anne Bergmann. Sommersemester Klassenstufen 9 & 10. Alkalimetalle
 Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird zunächst fachlich
Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird zunächst fachlich
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 7 & 8. Reaktionen von Metallen mit Sauerstoff und mit Luft.
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum. Anna Hille. Sommersemester 2013. Klassenstufen 9 & 10. Salz und Salzbildung
 Schulversuchspraktikum Anna Hille Sommersemester 2013 Klassenstufen 9 & 10 Salz und Salzbildung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll enthält verschiedene
Schulversuchspraktikum Anna Hille Sommersemester 2013 Klassenstufen 9 & 10 Salz und Salzbildung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll enthält verschiedene
Versuch: Kohlenhydrate in Lebensmitteln Nachweis von Zucker
 Name: Datum: Versuch: Kohlenhydrate in Lebensmitteln Nachweis von Zucker Geräte Heizplatte, Bechergläser, Reagenzgläser, Reagenzglasständer, Spatel, Faltenfilter, Trichter Materialien Lebensmittel: Glucose,
Name: Datum: Versuch: Kohlenhydrate in Lebensmitteln Nachweis von Zucker Geräte Heizplatte, Bechergläser, Reagenzgläser, Reagenzglasständer, Spatel, Faltenfilter, Trichter Materialien Lebensmittel: Glucose,
Aktivierungsenergie und Katalyse
 1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
Farbenspiel der Redoxreaktionen
 Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 7-8 Farbenspiel der Redoxreaktionen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In
Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 7-8 Farbenspiel der Redoxreaktionen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In
Erwartete Kompetenzen. Kompetenzbereich Erkenntnisgewinnung Die Schülerinnen und Schüler E1 E2 E3 E4 E5 E6 E7 E8 E9 E10 E11 E12 E13 E14 E15 E16 E17
 Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Schulversuchspraktikum. Sommersemester 2014. Klassenstufen 11 & 12. Batterien und Akkus
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
6. Woche. Reaktionen und Nachweis der Anionen. Klasse I
 6. Woche Reaktionen und achweis der Anionen Klasse I Klassenreaktion: Die Anionen der I. Anionenklasse zeigen nach Zugabe verdünnter Salzsäure eine gut wahrnehmbare Veränderung (Gasentwicklung oder iederschlag
6. Woche Reaktionen und achweis der Anionen Klasse I Klassenreaktion: Die Anionen der I. Anionenklasse zeigen nach Zugabe verdünnter Salzsäure eine gut wahrnehmbare Veränderung (Gasentwicklung oder iederschlag
Vorgehen bei der qualitativen Analyse. Nachweisreaktion. Nachweisreaktionen. molekular gebauter Stoffe
 Vorgehen bei der qualitativen Analyse 1. Vorprobe liefert Hinweise auf die mögliche Zusammensetzung der Probe ; Bsp. Flammenfärbung 2. Blindprobe zeigt aus Aussehen der Nachweisreagenzien; Vergleichsprobe
Vorgehen bei der qualitativen Analyse 1. Vorprobe liefert Hinweise auf die mögliche Zusammensetzung der Probe ; Bsp. Flammenfärbung 2. Blindprobe zeigt aus Aussehen der Nachweisreagenzien; Vergleichsprobe
Nachweis der Kochsalzbestandteile
 Reaktionsgleichungen + NaCl (aq ) + AgNO 3 (aq ) AgCl (s) + NO 3 (aq ) + Na (aq ) Na Na h ν Na Zeitbedarf Vorbereitung: 5 min. Durchführung: 5 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Reaktionsgleichungen + NaCl (aq ) + AgNO 3 (aq ) AgCl (s) + NO 3 (aq ) + Na (aq ) Na Na h ν Na Zeitbedarf Vorbereitung: 5 min. Durchführung: 5 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP2 - Anionenreaktionen und Vorprobenanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 21.04.2006
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP2 - Anionenreaktionen und Vorprobenanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 21.04.2006
Alkali- und Erdalkalimetalle und ihre Verbindungen
 Alkali- und Erdalkalimetalle und ihre Verbindungen 1. Zur Einführung Die Metalle der ersten (Alkalimetalle) und zweiten Hauptgruppe (Erdalkalimetalle) des Periodensystems sind sehr reaktive Stoffe, deren
Alkali- und Erdalkalimetalle und ihre Verbindungen 1. Zur Einführung Die Metalle der ersten (Alkalimetalle) und zweiten Hauptgruppe (Erdalkalimetalle) des Periodensystems sind sehr reaktive Stoffe, deren
1.9 Darstellung und Eigenschaften von schwefliger Säure. Aufgabe. Welche Eigenschaften besitzt schweflige Säure?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757800).9 Darstellung und Eigenschaften von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :43:57 intertess (Version 3.06 B200,
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757800).9 Darstellung und Eigenschaften von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :43:57 intertess (Version 3.06 B200,
Schulversuchspraktikum. Dörte Hartje. Sommersemester 2013. Klassenstufen 7 & 8. Vom Erz zum Metall
 Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 7 & 8 Vom Erz zum Metall Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll enthält drei Lehrer- und
Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 7 & 8 Vom Erz zum Metall Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll enthält drei Lehrer- und
Säuren und Basen im Haushalt
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 9 & 10 Säuren und Basen im Haushalt 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Unterrichtseinheit,,Säuren
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 9 & 10 Säuren und Basen im Haushalt 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Unterrichtseinheit,,Säuren
Homogene und Heterogene Gemische
 Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
+ MnO MnO 3. Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole. Chemikalien. Materialien
 DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
4. Anorganisch-chemische Versuche
 4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad
 Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Versuchsprotokoll: Fehling- Spaltung von Saccharose
 Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Versuchsprotokoll: Fehling- Spaltung von Saccharose Zeitaufwand: Vorbereitung: 5 Minuten Durchführung: 15 Minuten Abbau/Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure
 Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 5/6. Die Luft. Das unsichtbare Gasgemisch
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 5/6 Die Luft Das unsichtbare Gasgemisch 1Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. In dieser
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 5/6 Die Luft Das unsichtbare Gasgemisch 1Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. In dieser
Jahrgänge 9 und 10 Basiskonzept Stoff-Teilchen. Basiskonzept Energie. Basiskonzept Chemische Reaktion. Basiskonzept Struktur- Eigenschaft
 Jahrgänge 9 und 10 Stoff-Teilchen - Satz von Avogadro - Stoffmengeneinheit Mol, molare Masse, Stoffmengenkonzentration - unterscheiden zwischen Stoffportion und Stoffmenge - wenden den Zusammenhang zwischen
Jahrgänge 9 und 10 Stoff-Teilchen - Satz von Avogadro - Stoffmengeneinheit Mol, molare Masse, Stoffmengenkonzentration - unterscheiden zwischen Stoffportion und Stoffmenge - wenden den Zusammenhang zwischen
4.1 Vergleich von physikalischem Vorgang und chemischer Reaktion. Aufgabe. Woran lassen sich chemische Reaktionen erkennen? (1)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
Vom Schwefel zur Schwefelsäure
 Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 9 & 10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird
Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 9 & 10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird
Qualitative Nachweise von Säuren und Basen
 Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 9 & 10 Qualitative Nachweise von Säuren und Basen Auf einen Blick: Dieses Protokoll beinhaltet 3 Lehrerversuche und 2 Schülerversuche
Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 9 & 10 Qualitative Nachweise von Säuren und Basen Auf einen Blick: Dieses Protokoll beinhaltet 3 Lehrerversuche und 2 Schülerversuche
Kohlenhydrate in Lebensmitteln Schokolade ist nicht gleich Schokolade!
 Kohlenhydrate in Lebensmitteln ist nicht gleich! Einführung Sicher hast du schon davon gehört, dass es verschiedene Zuckerarten gibt. So gibt es Traubenzucker (Glucose), Fruchtzucker (Fructose) und natürlich
Kohlenhydrate in Lebensmitteln ist nicht gleich! Einführung Sicher hast du schon davon gehört, dass es verschiedene Zuckerarten gibt. So gibt es Traubenzucker (Glucose), Fruchtzucker (Fructose) und natürlich
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Aspirin und Paracetamol im chemischen Vergleich
 Aspirin und Paracetamol im chemischen Vergleich Achtung Aspirin und Paracetamol sind geschützte Namen und dürfen nicht ohne weiteres verwendet werden. Strukturformeln Aus den Strukturformeln leiten wir
Aspirin und Paracetamol im chemischen Vergleich Achtung Aspirin und Paracetamol sind geschützte Namen und dürfen nicht ohne weiteres verwendet werden. Strukturformeln Aus den Strukturformeln leiten wir
Korrosion und Korrosionsschutz
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 11 & 12 Korrosion und Korrosionsschutz 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 11 & 12 Korrosion und Korrosionsschutz 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Vom Alkohol zum Alken
 Schulversuchspraktikum Sabine Wolff SoSe 2013 Klassenstufen 9 & 10 Vom Alkohol zum Alken 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche vorgestellt, die die Darstellung von gasförmigen Alkenen
Schulversuchspraktikum Sabine Wolff SoSe 2013 Klassenstufen 9 & 10 Vom Alkohol zum Alken 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche vorgestellt, die die Darstellung von gasförmigen Alkenen
Energie und Energieumwandlung
 Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Curriculum Fach: Chemie Klasse: 8 Hölderlin-Gymnasium Nürtingen. Chemie
 Klassenstufe 8 BS (nach S. 196/197) Curriculum Fach: Chemie Klasse: 8 Chemie Kerncurriculum Inhalte Zeit Kompetenzen: die Schülerinnen und Schüler können Stoffe und ihre Eigenschaften Bemerkungen Wichtige
Klassenstufe 8 BS (nach S. 196/197) Curriculum Fach: Chemie Klasse: 8 Chemie Kerncurriculum Inhalte Zeit Kompetenzen: die Schülerinnen und Schüler können Stoffe und ihre Eigenschaften Bemerkungen Wichtige
Praktikum Chemie für Mediziner und Zahnmediziner 125
 Praktikum Chemie für Mediziner und Zahnmediziner 125 10. Studieneinheit Lernziele Endotherme und exotherme Prozesse Temperaturabhängige Verschiebung von Gleichgewichten Zeitlicher Verlauf chemischer Reaktionen
Praktikum Chemie für Mediziner und Zahnmediziner 125 10. Studieneinheit Lernziele Endotherme und exotherme Prozesse Temperaturabhängige Verschiebung von Gleichgewichten Zeitlicher Verlauf chemischer Reaktionen
Von Arrhenius zu Brønsted
 Schulversuchspraktikum Annika Münch Sommersemester 2015 Klassenstufe 9/10 Von Arrhenius zu Brønsted 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Thema Von
Schulversuchspraktikum Annika Münch Sommersemester 2015 Klassenstufe 9/10 Von Arrhenius zu Brønsted 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Thema Von
Reaktion von Nichtmetallen mit Sauerstoff
 Schulversuchspraktikum Name: Benjamin Heuer Semester: SS2013 Klassenstufen 7&8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Name: Benjamin Heuer Semester: SS2013 Klassenstufen 7&8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Chemie. Elemente Elemente sind Stoffe, die nur aus einer Sorte von Atomen bestehen. 1. Metalle ; 2. Nichtmetalle ; 3. Halbmetalle
 Chemie 1. Wiederholung Elemente Elemente sind Stoffe, die nur aus einer Sorte von Atomen bestehen. 1. Metalle ; 2. Nichtmetalle ; 3. Halbmetalle Moleküle Moleküle sind zwei oder mehr Atome zusammen verbunden.
Chemie 1. Wiederholung Elemente Elemente sind Stoffe, die nur aus einer Sorte von Atomen bestehen. 1. Metalle ; 2. Nichtmetalle ; 3. Halbmetalle Moleküle Moleküle sind zwei oder mehr Atome zusammen verbunden.
Integrationsphase der MSS 11
 Integrationsphase der MSS 11 Atombau, PSE und Salze Kennzeichnung eines Atoms und seines Kerns Energiestufen- / Schalenmodell der Atomhülle Zusammenhang zwischen Atombau und PSE Bildung und Ladung von
Integrationsphase der MSS 11 Atombau, PSE und Salze Kennzeichnung eines Atoms und seines Kerns Energiestufen- / Schalenmodell der Atomhülle Zusammenhang zwischen Atombau und PSE Bildung und Ladung von
Schulversuchspraktikum. Till Beuermann. Sommersemester Klassenstufen 11 & 12. Batterien und Akkus
 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 11 & 12 Batterien und Akkus 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll beschäftigt sich
Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 11 & 12 Batterien und Akkus 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll beschäftigt sich
Alkalimetalle. 1. Alkalimetalle Die 1. Hauptgruppe des Periodensystems der Elemente [1-4]
![Alkalimetalle. 1. Alkalimetalle Die 1. Hauptgruppe des Periodensystems der Elemente [1-4] Alkalimetalle. 1. Alkalimetalle Die 1. Hauptgruppe des Periodensystems der Elemente [1-4]](/thumbs/31/14796766.jpg) Universität Regensburg Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Wintersemester 2009/2010 20.11. 2009 Betreuung: Dr. M. Andratschke Referenten: Andreas
Universität Regensburg Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Wintersemester 2009/2010 20.11. 2009 Betreuung: Dr. M. Andratschke Referenten: Andreas
7. Woche. Gesamtanalyse (Vollanalyse) einfacher Salze. Qualitative Analyse anorganischer Verbindungen
 7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
Praktikumsbericht vom und
 Praktikumsbericht vom 10.08.09 und 24.08.09 Das Praktikum und der folgende Bericht wurden von Corinne und Sina durchgeführt. Im Praktikum, welches am 10.08.09 stattfand, ging es um die Fragestellungen,
Praktikumsbericht vom 10.08.09 und 24.08.09 Das Praktikum und der folgende Bericht wurden von Corinne und Sina durchgeführt. Im Praktikum, welches am 10.08.09 stattfand, ging es um die Fragestellungen,
Seminar zum Grundpraktikum Anorganische Chemie
 Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2015 Christoph Wölper Universität DuisburgEssen Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2015 Christoph Wölper http://www.unidue.de/~adb297b
Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2015 Christoph Wölper Universität DuisburgEssen Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2015 Christoph Wölper http://www.unidue.de/~adb297b
Reinstoffe und Stoffgemische
 Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Auf einen Blick: Dieses Versuchsprotokoll enthält zwei Lehrer- und vier SchülerInnenexperimente
Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Auf einen Blick: Dieses Versuchsprotokoll enthält zwei Lehrer- und vier SchülerInnenexperimente
Versuch: Bromierung von n-hexan. Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Bemerkung
 Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Hausarbeit. Das Fällungs- und Löslichkeitsgleichgewicht. über. von Marie Sander
 Hausarbeit über Das Fällungs- und Löslichkeitsgleichgewicht von Marie Sander Inhaltsverzeichnis 1. Einstieg in das Thema 2. Einflüsse auf das Löslichkeitsgleichgewicht - Das Prinzip von Le Chatelier 3.
Hausarbeit über Das Fällungs- und Löslichkeitsgleichgewicht von Marie Sander Inhaltsverzeichnis 1. Einstieg in das Thema 2. Einflüsse auf das Löslichkeitsgleichgewicht - Das Prinzip von Le Chatelier 3.
REDOXPROZESSE. Die Redoxreaktion setzt sich aus einer Oxidation und einer Reduktion zusammen. [1, 2]
![REDOXPROZESSE. Die Redoxreaktion setzt sich aus einer Oxidation und einer Reduktion zusammen. [1, 2] REDOXPROZESSE. Die Redoxreaktion setzt sich aus einer Oxidation und einer Reduktion zusammen. [1, 2]](/thumbs/29/13620695.jpg) Universität Regensburg Institut für Anorganische Chemie: Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Wintersemester 2012/13 23.11.2012 Dozentin: Dr. M. Andratschke Referentinnen: Stefanie
Universität Regensburg Institut für Anorganische Chemie: Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Wintersemester 2012/13 23.11.2012 Dozentin: Dr. M. Andratschke Referentinnen: Stefanie
Arbeitsblatt Wasserkreislauf der Erde
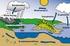 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Schuleigener Arbeitsplan für das Fach Chemie (vorläufige Fassung, gültig ab Schuljahr 2008/09)
 Laurentius-Siemer-Gymnasium Saterland Schuleigener Arbeitsplan für das Fach Chemie (vorläufige Fassung, gültig ab Schuljahr 2008/09) Jahrgangsstufe: 9 Lehrwerke / Hilfsmittel: Elemente Chemie 1, Klett
Laurentius-Siemer-Gymnasium Saterland Schuleigener Arbeitsplan für das Fach Chemie (vorläufige Fassung, gültig ab Schuljahr 2008/09) Jahrgangsstufe: 9 Lehrwerke / Hilfsmittel: Elemente Chemie 1, Klett
Fachcurriculum Chemie Jahrgang 10 ab 2017/18 (ASG-Zugang 15/16)
 Fachcurriculum Chemie Jahrgang 10 ab 2017/18 (ASG-Zugang 15/16) Ganzjähriger Unterricht 2-stündig Unterthemen Inhaltsbezogene Kompetenzen (FW) Prozessbezogene Kompetenzen (EG, KK, BW) Bemerkungen Salze,
Fachcurriculum Chemie Jahrgang 10 ab 2017/18 (ASG-Zugang 15/16) Ganzjähriger Unterricht 2-stündig Unterthemen Inhaltsbezogene Kompetenzen (FW) Prozessbezogene Kompetenzen (EG, KK, BW) Bemerkungen Salze,
Versuch: Qualitativer Nachweis von Kohlenstoff und Wasserstoff
 Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Teilnehmer/in:... Matrikel-Nr.:...
 Abschlussklausur Allgemeine und Anorganische Chemie Teil 1 (Modul BGEO1.3.1 Anorganische und Allgemeine Chemie für Geologen, Geophysiker und Mineralogen) Teilnehmer/in:... MatrikelNr.:... 1. Sie sollen
Abschlussklausur Allgemeine und Anorganische Chemie Teil 1 (Modul BGEO1.3.1 Anorganische und Allgemeine Chemie für Geologen, Geophysiker und Mineralogen) Teilnehmer/in:... MatrikelNr.:... 1. Sie sollen
Gruppe 04: Kern- und Seitenkettenbromierung von Toluol
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 04: Kern- und Seitenkettenbromierung von Toluol Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 04: Kern- und Seitenkettenbromierung von Toluol Reaktion: Chemikalien:
Wie wirkt sich die Zugabe von Salz auf den Schmelz- und Siedepunkt von Wasser aus?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Titrationen mit Alltagschemikalien
 Schulversuchspraktikum - Sommersemester 2014 Klassenstufen 9 & 10 Titrationen mit Alltagschemikalien 1 Auf einen Blick: Dieses Protokoll beschreibt 4 Versuche zum Thema Titrationen mit Alltagschemikalien.
Schulversuchspraktikum - Sommersemester 2014 Klassenstufen 9 & 10 Titrationen mit Alltagschemikalien 1 Auf einen Blick: Dieses Protokoll beschreibt 4 Versuche zum Thema Titrationen mit Alltagschemikalien.
Bist Du nicht "FIT", dann musst Du nacharbeiten.
 Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
In welchen Stoffen befinden sich Laugen, wozu werden sie verwendet?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P7158700) 2.2 Laugen - Bestandteil von Haushaltsreinigern Experiment von: Phywe Gedruckt: 15.10.2013 11:55:39 intertess (Version 13.06 B200,
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P7158700) 2.2 Laugen - Bestandteil von Haushaltsreinigern Experiment von: Phywe Gedruckt: 15.10.2013 11:55:39 intertess (Version 13.06 B200,
+ 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose
![+ 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose + 2 [Ag(NH 3 ) 2 ]+ + 2 OH - 2 Ag + 4 NH 3. Versuch: Tollensprobe mit Glucose und Saccharose](/thumbs/54/33374656.jpg) Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Tollensprobe mit Glucose
Philipps-Universität Marburg 27.01.2008 rganisches Grundpraktikum (LA) Katrin ohmann Assistent: Ralph Wieneke Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 9, Kohlenhydrate Versuch: Tollensprobe mit Glucose
Schulversuchspraktikum. Miriam Jarrar. Sommersemester Klassenstufen 7 & 8. Korrosion
 Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 7 & 8 Korrosion 1 Kontext und Ziele 1 Auf einen Blick: Dieses Protokoll beinhaltet 2 Lehrerversuche und 4 Schülerversuche für die
Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 7 & 8 Korrosion 1 Kontext und Ziele 1 Auf einen Blick: Dieses Protokoll beinhaltet 2 Lehrerversuche und 4 Schülerversuche für die
Laborbericht. Schwarz-Weiss-Photographie. Bianca Theus Anna Senn
 Laborbericht Schwarz-Weiss-Photographie Bianca Theus Anna Senn Dezember 004 Inhaltsverzeichnis 1. Ziel... 1. Einleitung... 1.1 Filmherstellung... 1. Reagenzien... 1.3 Belichtung....4 Entwicklung... 3.5
Laborbericht Schwarz-Weiss-Photographie Bianca Theus Anna Senn Dezember 004 Inhaltsverzeichnis 1. Ziel... 1. Einleitung... 1.1 Filmherstellung... 1. Reagenzien... 1.3 Belichtung....4 Entwicklung... 3.5
Vom Alkan zum Alkohol
 Schulversuchspraktikum Sommersemester 2016 Klassenstufen 9 & 10 Vom Alkan zum Alkohol Auf einen Blick: Das Protokoll Vom Alkan zum Alkohol enthält zwei Lehrerversuche und zwei Schülerversuche. Die Lehrerversuche
Schulversuchspraktikum Sommersemester 2016 Klassenstufen 9 & 10 Vom Alkan zum Alkohol Auf einen Blick: Das Protokoll Vom Alkan zum Alkohol enthält zwei Lehrerversuche und zwei Schülerversuche. Die Lehrerversuche
Versuch: Fünf Farben in einer Lösung
 Name: Datum: Versuch: Materialien: 5 x 100 ml Bechergläser (nummeriert von 1-5), Tropfpipetten, Messzylinder (50 ml), Spritzflasche mit destilliertem Wasser Chemikalien: Lösung Nr. 1: Lösung Nr. 2: Lösung
Name: Datum: Versuch: Materialien: 5 x 100 ml Bechergläser (nummeriert von 1-5), Tropfpipetten, Messzylinder (50 ml), Spritzflasche mit destilliertem Wasser Chemikalien: Lösung Nr. 1: Lösung Nr. 2: Lösung
Qualitative Analyse. - Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch,
 - Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch, Löslichkeit - charakteristische Nachweisreaktionen für Einzelionen: - Fällungsreaktionen
- Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch, Löslichkeit - charakteristische Nachweisreaktionen für Einzelionen: - Fällungsreaktionen
Vom Schwefel zur Schwefelsäure
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9&10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll wurde die Herstellung
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9&10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll wurde die Herstellung
4.2 Reaktion von Kupfer und Schwefel. Aufgabe. Woran lassen sich chemische Reaktionen erkennen? (2)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75300) 4.2 Reaktion von Kupfer und Schwefel Experiment von: Phywe Gedruckt:.0.203 2:59:32 intertess (Version 3.06 B200, Export
Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75300) 4.2 Reaktion von Kupfer und Schwefel Experiment von: Phywe Gedruckt:.0.203 2:59:32 intertess (Version 3.06 B200, Export
3.6 Thermische Zersetzung von Salzen. Aufgabe. Wie verhalten sich Salze beim Erhitzen? Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze (P759900) 3.6 Thermische Zersetzung von Salzen Experiment von: Phywe Gedruckt: 5.0.203 2:22:38 intertess (Version 3.06 B200, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze (P759900) 3.6 Thermische Zersetzung von Salzen Experiment von: Phywe Gedruckt: 5.0.203 2:22:38 intertess (Version 3.06 B200, Export 2000) Aufgabe
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm
 Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Schulversuchspraktikum. Name: Niklas Heier. Semester: Sommersemester 2013. Klassenstufen 9 & 10. Schwefelsäure
 Schulversuchspraktikum Name: Niklas Heier Semester: Sommersemester 2013 Klassenstufen 9 & 10 Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden
Schulversuchspraktikum Name: Niklas Heier Semester: Sommersemester 2013 Klassenstufen 9 & 10 Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden
