Checkliste für die Verordnung von Toctino
|
|
|
- Eugen Steinmann
- vor 6 Jahren
- Abrufe
Transkript
1 TOCTINO. W: Alitretinoin. I: Zur Behandlung von Erwachsenen mit therapierefraktärem, schwerem, chronischem Handekzem, die auf eine ausgebaute lokale Behandlung (einschliesslich Vermeidung von Kontakten mit auslösender Noxe, Hautschutz und potente topische Kortikosteroide) für mindestens 4 Wochen nicht angesprochen haben. D: 10 mg 30 mg. Einnahme der Kapseln 1 x täglich mit einer Mahlzeit. Behandlungsdauer Wochen. Nicht zur Anwendung unter 18 Jahren empfohlen. KI: Toctino ist TERATOGEN und bei schwangeren Frauen absolut kontraindiziert (siehe SS). Toctino ist bei Frauen im gebärfähigen Alter kontraindiziert, es sei denn, alle Bedingungen des Schwangerschaftsverhütungsprogramms werden eingehalten (siehe SS). Keine Blutspenden während und bis 1 Monat nach Behandlung (potentielles Risiko für Foetus bei Transfusionen während SS). Toctino ist zudem kontraindiziert bei stillenden Frauen, Leberinsuffizienz, schwerer Niereninsuffizienz, unkontrollierter Hypercholesterinamie, unkontrollierter Hypertriglyceridämie, unkontrolliertem Hypothyroidismus, Hypervitaminose A; bei Überempfindlichkeit gegenüber Alitretinoin, anderen Retinoiden oder einem der Hilfsstoffe (insbesondere Erdnuss- oder Soja-Allergie); bei seltener vererbbarer Fruktoseintoleranz sowie bei gleichzeitiger Behandlung mit Tetrazyklinen oder Methotrexat. VM: Psychische Störungen (unter Therapie mit systemischen Retinoiden wurde über Depressionen, Verstärkung von Depressionen, Angst, Aggressivität, Gemütsschwankungen, psychotische Symptome und selten über Suizidversuche/Suizide berichtet). Mit Toctino behandelte Patienten sollen auf Anzeichen einer Depression überwacht und nötigenfalls einer angemessenen Behandlung zugeführt werden. Patienten mit Depression oder Suizidalität in Anamnese sollen vor/während Behandlung psychologisch/psychiatrisch betreut werden; verstärkte Wirkung von UV-Strahlung; Knochenveränderungen (u.a. vorzeitiger Epiphysenschluss, Kalzifizierung von Sehnen und Bändern); Myalgie; Arthralgie; CPK-Erhöhung; trockene Augen, Beeinträchtigung des Nachtsehens. Patienten mit Sehstörungen sollen an Augenarzt verwiesen werden; Bei Auftreten von benigner Erhöhung des Schädelinnendrucks (Pseudotumor cerebri) soll Behandlung abgebrochen werden; Senkung von TSH und T4 (meist reversibel); Anstieg der Lebertransaminasen; entzündliche Darmerkrankungen; Überwachung von Plasmacholesterin und Triglyceriden: bei nicht kontrollierbarer Hyperlipidämie oder Symptomen von Pankreatitis muss Behandlung abgebrochen werden; bei Patienten mit Diabetes mellitus, starkem Übergewicht, kardiovaskulären Risikofaktoren oder Fettstoffwechselstörungen sind häufigere Kontrollen der Serumlipide erforderlich (diese Patienten sollten initial mit 10 mg 1 x täglich behandelt und falls erforderlich bis zur Maximaldosis von 30 mg hochtitriert werden). Selten allergische Reaktionen inkl. allergischer Vaskulitis. IA: starke CYP3A4- oder PgP-Inhibitoren (z.b. Ketoconazol); Simvastatin; andere Retinoide; Tetrazykline; Methotrexat; Johanniskraut. SS: Toctino ist bei schwangeren Frauen absolut kontraindiziert (siehe KI). Wenn trotz Massnahmen zur Empfängnisverhütung während oder 1 Monat nach Behandlung SS eintritt, besteht hohes Risiko schwerwiegender Missbildungen des Fötus. Bei SS muss Behandlung abgebrochen werden und Zuweisung an auf Teratologie spezialisierten Arzt erfolgen. KI besteht auch bei Frauen im gebärfähigen Alter, ausser alle Konditionen des Schwangerschaftsverhütungsprogramms werden eingehalten. Dieses umfasst Patientenaufklärung, Verhütungsberatung, Schwangerschaftstests (vor, während, 5 Wochen nach Behandlung) und zuverlässige, unterbrechungsfreie Empfängnisverhütung ab 1 Monat vor, während, und bis 1 Monat nach Behandlung. Toctino Verschreibung an Frauen im gebärfähigen Alter ist auf Behandlungsdauer von 30 Tagen begrenzt, Fortsetzung bedarf neuer Verschreibung. Abgabe v. Toctino bis spätestens 7 Tage nach Verschreibung (Details siehe Fachinformation). UW: Sehr häufig: Kopfschmerzen; erhöhte Triglycerid-, und Cholesterin Werte, erniedrigte Lipoproteine (HDL). Häufig: Augenreizung, Konjunktivitis, Trockenheit von Augen, Haut und/ oder Lippen, Gesichtsröte, Ekzem, Dermatitis, Erythem, Cheileitis, Alopezie, Arthralgie, Myalgie; erhöhte CPK und Transaminasen, Anämie, erhöhte EBK, Thrombozytose, Monozytopenie, erniedrigtes TSH und ft4. Gelegentlich: verschwommenes Sehen, Katarakt; Epistaxis; Pruritus, Hautexfoliation, asteatotisches Exzem; Exostose, Hyperostose, Spondylitis ankylosans. Selten: Vaskulitis, Pseudotumor Cerebri. P: Kaps à 10/30 mg: 30. Kassenzulässig (AK A). Stand der Information: Oktober GlaxoSmithKline AG. Ausführliche Angaben finden Sie unter Unerwünschte Arzneimittelwirkungen melden Sie bitte unter pv.swiss@gsk.com. GlaxoSmithKline AG Talstrasse Münchenbuchsee Telefon Tél: Fax: CH/ART/0013a/12(1)/ , /300f, DC-Vo Checkliste SCHWANGERSCHAFTSVERHÜTUNGS-PROGRAMM Checkliste für die Verordnung von Toctino für die ärztliche Dokumentation Name der Patientin 2
2 Bestätigungsformular für behandelnde Ärzte Die Patientin geboren am kam am zur Konsultation in meine Praxis. Sie leidet an einer schweren Form von (Familienname, Vorname) Ich habe die Notwendigkeit einer wirksamen Empfängnisverhütung aufgrund des teratogenen Risikos besprochen. Die Patientin wurde zur Auswahl von mindestens einer, vorzugsweise 2 geeigneten Verhütungsmethoden und über ihre Anwendung vom Hausarzt aufgeklärt und beraten an einen Gynäkologen überwiesen und von diesem aufgeklärt und beraten die Behandlung mit (Diagnose angeben), das/die auf Nach meiner Ansicht verfügt diese Patientin über ein angemessenes Verantwortungsbewusstsein mangelndes Verantwortungsbewusstsein (vorhergegangene Therapien angeben) nicht anspricht. Aus diesem Grund wurde quasi als Ultimo Ratio eine Behandlung mit Toctino in Betracht gezogen. Der Patientin wurden bei ihrem letzten Besuch die Dokumente «Informations broschüre für Patientinnen und Patienten» und «Toctino Wichtige Patienteninformationen zur Empfängnisverhütung» gegeben. Beim heutigen Arztbesuch habe ich die Patientin ausführlich über alle für die Behandlung mit Toctino erforderlichen Vorsichtsmassnahmen und die Risiken einer potenziellen Schwangerschaft im Zusammenhang mit der Toctino - Behandlung informiert. Die Patientin hatte Gelegenheit, alle anfallenden Fragen zu klären. Nach meiner Einschätzung sind die Kenntnisse der Patientin über das Risiko umfassend nicht ausreichend Die Patientin wurde über die Behandlung und alle damit zusammenhängenden Risiken informiert und ist bereit, die Behandlung mit Toctino zu beginnen. Infolgedessen willige ich ein, diese Patientin mit Toctino zu behandeln. werde ich diese Patientin nicht mit Toctino behandeln. Datum: Unterschrift (des Arztes): 2 3
3 Toctino und Schwangerschaftsprävention Toctino gehört zu einer Arzneimittelklasse, von der eine hohe Teratogenität bekannt ist. Falls Toctino während der Schwangerschaft selbst nur für kurze Zeit eingenommen wird, besteht für das ungeborene Kind im Mutterleib ein sehr hohes Risiko von Missbildungen. Toctino ist deshalb bei schwangeren Frauen absolut kontraindiziert. Bei Frauen, bei denen die Möglichkeit einer Schwangerschaft besteht, ist Toctino ebenfalls kontraindiziert, es sei denn, alle Bedingungen des Schwangerschaftsverhütungs-Programms werden eingehalten. Als verordnender Arzt müssen Sie sicherstellen, dass die folgenden Bedingungen vor Beginn (oder der Fortsetzung) der Behandlung mit Toctino erfüllt sind. Checkliste für die Verordnung von Toctino Vor der Verordnung Prüfung der Indikation: Toctino ist zugelassen zur Behandlung von Patientinnen/Patienten mit therapierefraktärem, schwerem chronischem Handekzem, die eine ausgebaute lokale Behandlung für mindestens 4 Wochen erhalten und nicht darauf angesprochen haben. Die Vorbehandlung schliesst die Vermeidung von Kontakten mit der auslösenden Noxe, Hautschutz und potente topische Kortikosteroide ein. Toctino wird zur Behandlung von Patientinnen/Patienten unter 18 Jahren nicht empfohlen. Prüfung der Kontraindikationen: Toctino ist in folgenden Fällen kontraindiziert: bei schwangeren oder stillenden Frauen bei Leberinsuffizienz bei schwerer Niereninsuffizienz bei unkontrollierter Hypercholesterinämie bei unkontrollierter Hypertriglyzeridämie bei unkontrolliertem Hypothyreoidismus bei Hypervitaminose A bei Überempfindlichkeit gegenüber Alitretinoin, gegenüber anderen Retinoiden oder einem der Hilfsstoffe, insbesondere im Falle einer Allergie gegenüber Erdnüssen oder Soja bei Patienten mit einer seltenen vererbbaren Fruktoseintoleranz bei Patienten, die gleichzeitig eine Behandlung mit Tetrazyklinen oder Methotrexat erhalten 4 5
4 Schwangerschaftsprävention: Stellen Sie sicher, dass Ihre Patientinnen über das teratogene Risiko von Toctino (mündlich und schriftlich) informiert wurden und es verstehen. Weisen Sie Ihre Patientinnen darauf hin, dass sie während der Behandlung mit Toctino und 1 Monat nach Beendigung der Behandlung kein Blut spenden und das Arzneimittel keinesfalls mit anderen Personen teilen dürfen. Geben Sie allen Patientinnen die «Informationsbroschüre für Patientinnen und Patienten» für Toctino. Händigen Sie allen Patientinnen im gebärfähigen Alter die Toctino - Broschüre «Wichtige Patienteninformationen zur Verhütung» aus. Sorgen Sie dafür, dass alle Patientinnen im gebärfähigen Alter die Notwendigkeit von monatlichen Kontrolluntersuchungen verstehen. Stellen Sie sicher, dass Ihre Patientinnen die Notwendigkeit einer ununterbrochenen Empfängnisverhütung im Sinne des Schwangerschaftsverhütungs- Programms einen Monat vor Beginn der Behandlung, während der Behandlung und einen Monat nach Beendigung der Behandlung verstehen und diese praktizieren. Achten Sie darauf, dass Patientinnen mit Amenorrhö und Patientinnen, die sexuell nicht aktiv sind, die Anweisungen in der Broschüre «Wichtige Patienteninformationen zur Empfängnisverhütung» ebenfalls befolgen. Ausnahme: Patientinnen, bei denen eine Hysterektomie vorgenommen wurde. Erster Schwangerschaftstest: Führen Sie den ersten Schwangerschaftstest mit einer Mindestempfindlichkeit von 25 miu/ml während der ersten drei Tage des Zyklus oder bei unregelmässiger Periode 3 Wochen nach dem letzten ungeschützten Geschlechtsverkehr durch. Fällt dieser negativ aus, sollte die Patientin mit der Anwendung der gewählten Verhütungsmethoden beginnen. Wegen verbleibenden Restrisiken einer Einzelmethode sollten Sie darauf hinwirken, dass die Patientin zwei komplementäre Formen der Verhütung verwendet. Zweiter Schwangerschaftstest: Nach mindestens vier Wochen wirksamer Verhütung ist am Tag der Erstverordnung oder innerhalb der letzten 3 Tage vor dem Arztbesuch ein weiterer Schwangerschaftstest unter ärztlicher Überwachung durchzuführen. Stellen Sie sicher, dass die Patientin die Konsequenzen einer potenziellen Schwangerschaft kennt und im Falle eines Verdachts auf Schwangerschaft sofort die Einnahme von Toctino abbricht und Ihren behandelnden Hautarzt, Gynäkologen oder Hausarzt aufsucht. Sorgen Sie dafür, dass die Patientin die Notwendigkeit monatlicher Schwangerschaftstests während der Behandlung sowie eines Schwangerschaftstests 5 Wochen nach Beendigung der Behandlung versteht und akzeptiert. Sorgen Sie dafür, dass die Patientin alle mündlichen und schriftlichen Informationen über die Risiken und Vorsichtsmassnahmen im Zusammenhang mit der Anwendung von Toctino erhalten hat und dies durch Unterzeichnung des dafür vorgesehenen Formulars bestätigt. Bewahren Sie dieses Bestätigungsformular bei Ihren Akten auf. Die Behandlung mit Toctino darf erst begonnen werden, wenn die Patientin mindestens 4 Wochen lang Verhütungsmethoden konsequent angewendet hat und zwei ärztlich überwachte Schwangerschaftstests innerhalb von 4 Wochen negativ ausgefallen sind. 6 7
5 Während der Behandlung Wenn alle oben angegebenen Voraussetzungen erfüllt sind, kann Toctino verordnet werden. Die Verschreibung an Frauen im gebärfähigen Alter muss innerhalb von 3 Tagen nach dem letzten Schwangerschaftstest erfolgen und auf jeweils eine Behandlungsdauer von 30 Tagen beschränkt werden. Die Abgabe durch den Apotheker an Frauen im gebärfähigen Alter muss innerhalb von 7 Tagen nach dem Verordnungsdatum erfolgt sein. Weisen Sie die Patientin darauf hin, dass sie das Rezept innerhalb von 7 Tagen einlösen muss. Weitere Schwangerschaftstests: Es müssen jeden Monat am Tag der Verordnung oder innerhalb der letzten 3 Tage davor ärztlich überwachte Schwangerschaftstests mit einer Mindestempfindlichkeit von 25 miu/ml durchgeführt werden. Weisen Sie erneut auf das teratogene Risiko hin und beantworten Sie etwaige Fragen zur Schwangerschaftsverhütung. Sollte trotz aller Vorsichtsmassnahmen während der Behandlung oder im darauf folgenden Monat eine Schwangerschaft eintreten, muss die Behandlung sofort abgebrochen werden. Die Patientin sollte einen Arzt konsultieren, um das weitere Vorgehen zu besprechen. Melden Sie unter Toctino - Behandlung eingetretene Schwangerschaften sowie unerwünschte Wirkungen sowohl dem regionalen Pharmacovigilance-Zentrum (Adressen hinten im Arzneimittel-Kompendium der Schweiz), als auch der GlaxoSmithKline AG. Telefon Fax pv.swiss@gsk.com Bei Behandlungsende Weisen Sie nochmals darauf hin, dass Patientinnen die Verhütungsmassnahmen noch einen Monat nach Behandlungsende fortsetzen müssen und dass alle Patientinnen ebenfalls einen Monat lang noch kein Blut spenden dürfen. Nicht verwendete Kapseln dürfen keinesfalls an andere Personen weitergegeben, sondern müssen an die Apotheke oder den verordnenden Arzt zurückgegeben werden. Fordern Sie die Patientin auf, 5 Wochen nach Beendigung der Behandlung nochmals zu einem abschliessenden Schwangerschaftstest zu kommen. Schwangerschaftstests Die Durchführung von Schwangerschaftstests ist nicht erforderlich, falls bei der Patientin eine nachgewiesene, dokumentierte, irreversible Sterilität besteht. Für alle Schwangerschaftstests ist eine Mindestempfindlichkeit von 25 mlu/ml vorgeschrieben. Sie sind unter ärztlicher Überwachung durchzuführen. Das Datum und Ergebnis soll in die nachfolgende Tabelle eingetragen werden. Vor der Behandlung Ein erster, ärztlich überwachter Schwangerschaftstest ist vor Beginn der Anwendung der Verhütungsmethoden durchzuführen (es sei denn, Schwangerschaftsverhütung wurde bereits seit längerer Zeit praktiziert). Bei unregelmässiger Periode der Patientin sollte der Test etwa 3 Wochen nach dem letzten ungeschützten Geschlechtsverkehr durchgeführt werden. Der zweite Schwangerschaftstest ist zum Zeitpunkt der Verschreibung von Toctino oder innerhalb der letzten 3 Tage vor Beginn der Behandlung und nachdem 4 Wochen lang mindestens eine, vorzugsweise 2 wirksame Verhütungsmethoden angewendet wurden, durchzuführen. Während der Behandlung Monatliche Schwangerschaftstests sind für jede neue Verordnung zum Zeitpunkt des Arztbesuchs oder innerhalb der letzten 3 Tage vor einer erneuten Verordnung durchzuführen. Am Ende der Behandlung Die Empfängnisverhütung muss nach Beendigung der Behandlung mindestens einen Monat lang fortgesetzt werden. Ein abschliessender Schwangerschaftstest muss 5 Wochen nach Beendigung der Behandlung mit Toctino erfolgen. 8 9
6 chaftstests it einer Mindestempfindlichkeit von wachung durchgeführt werden. und die Ergebnisse in folgende Tabelle ein: Ich habe den Eindruck, Ich habe nicht den Eindruck*, dass die Patientin diese Empfängnisverh während und 1 Monat nach Behandlun bewusst anwenden wird. er tion Datum des Schwangerschaftstests Ergebnis des Schwangerschaftstests Unterschrift (des Arztes) ort, Datum: Unterschrift des Hausarztes/des Gynäkologen: Praxisstempel: Dieses Formular bitte ausgefüllt und v Dermatologen weiterleiten. * Weitere Bemerkungen: 11
7 TOCTINO. W: Alitretinoin. I: Zur Behandlung von Erwachsenen mit therapierefraktärem, schwerem, chronischem Handekzem, die auf eine ausgebaute lokale Behandlung (einschliesslich Vermeidung von Kontakten mit auslösender Noxe, Hautschutz und potente topische Kortikosteroide) für mindestens 4 Wochen nicht angesprochen haben. D: 10 mg - 30 mg. Einnahme der Kapseln 1x täglich mit einer Mahlzeit. Behandlungsdauer Wochen. Nicht zur Anwendung unter 18 Jahren empfohlen. KI: Toctino ist TERATOGEN und bei schwangeren Frauen absolut kontraindiziert (siehe SS). Toctino ist bei Frauen im gebärfähigen Alter kontraindiziert, es sei denn, alle Bedingungen des Schwangerschaftsverhütungsprogramms werden eingehalten (siehe SS). Keine Blutspenden während und bis 1 Monat nach Behandlung (potentielles Risiko für Foetus bei Transfusionen während SS). Toctino ist zudem kontraindiziert bei stillenden Frauen, Leberinsuffizienz, schwerer Niereninsuffizienz, unkontrollierter Hypercholesterinamie, unkontrollierter Hypertriglyceridämie, unkontrolliertem Hypothyroidismus, Hypervitaminose A; bei Überempfindlichkeit gegenüber Alitretinoin, anderen Retinoiden oder einem der Hilfsstoffe (insbesondere Erdnuss- oder Soja-Allergie); bei seltener vererbbarer Fruktoseintoleranz sowie bei gleichzeitiger Behandlung mit Tetrazyklinen oder Methotrexat. VM: Psychische Störungen (unter Therapie mit systemischen Retinoiden wurde über Depressionen, Verstärkung von Depressionen, Angst, Aggressivität, Gemütsschwankungen, psychotische Symptome und selten über Suizidversuche / Suizide berichtet). Mit Toctino behandelte Patienten sollen auf Anzeichen einer Depression überwacht und nötigenfalls einer angemessenen Behandlung zugeführt werden. Patienten mit Depression oder Suizidalität in Anamnese sollen vor/ während Behandlung psychologisch/psychiatrisch betreut werden; verstärkte Wirkung von UV-Strahlung; Knochenveränderungen (u.a. vorzeitiger Epiphysenschluss, Kalzifizierung von Sehnen und Bändern); Myalgie; Arthralgie; CPK-Erhöhung; trockene Augen, Beeinträchtigung des Nachtsehens. Patienten mit Sehstörungen sollen an Augenarzt verwiesen werden; Bei Auftreten von benigner Erhöhung des Schädelinnendrucks (Pseudotumor cerebri) soll Behandlung abgebrochen werden; Senkung von TSH und T4 (meist reversibel); Anstieg der Lebertransaminasen; entzündliche Darmerkrankungen; Überwachung von Plasmacholesterin und Triglyceriden: bei nicht kontrollierbarer Hyperlipidämie oder Symptomen von Pankreatitis muss Behandlung abgebrochen werden; bei Patienten mit Diabetes mellitus, starkem Übergewicht, kardiovaskulären Risikofaktoren oder Fettstoffwechselstörungen sind häufigere Kontrollen der Serumlipide erforderlich (diese Patienten sollten initial mit 10 mg 1x täglich behandelt und falls erforderlich bis zur Maximaldosis von 30 mg hochtitriert werden). Selten allergische Reaktionen inkl. allergischer Vaskulitis. IA: starke CYP3A4- oder PgP-Inhibitoren (z.b. Ketoconazol); Simvastatin; andere Retinoide; Tetrazykline; Methotrexat; Johanniskraut. SS: Toctino ist bei schwangeren Frauen absolut kontraindiziert (siehe KI). Wenn trotz Massnahmen zur Empfängnisverhütung während oder 1 Monat nach Behandlung SS eintritt, besteht hohes Risiko schwerwiegender Missbildungen des Fötus. Bei SS muss Behandlung abgebrochen werden und Zuweisung an auf Teratologie spezialisierten Arzt erfolgen. KI besteht auch bei Frauen im gebärfähigen Alter, ausser alle Konditionen des Schwangerschaftsverhütungsprogramms werden eingehalten. Dieses umfasst Patientenaufklärung, Verhütungsberatung, Schwangerschaftstests (vor, während, 5 Wochen nach Behandlung) und zuverlässige, unterbrechungsfreie Empfängnisverhütung ab 1 Monat vor, während, und bis 1 Monat nach Behandlung. Toctino Verschreibung an Frauen im gebärfähigen Alter ist auf Behandlungsdauer von 30 Tagen begrenzt, Fortsetzung bedarf neuer Verschreibung. Abgabe v. Toctino bis spätestens 7 Tage nach Verschreibung (Details siehe Fachinformation). UW: Sehr häufig: Kopfschmerzen; erhöhte Triglycerid-, und Cholesterin Werte, erniedrigte Lipoproteine (HDL). Häufig: Augenreizung, Konjunktivitis, Trockenheit von Augen, Haut und/oder Lippen, Gesichtsröte, Ekzem, Dermatitis, Erythem, Cheileitis, Alopezie, Arthralgie, Myalgie; erhöhte CPK und Transaminasen, Anämie, erhöhte EBK, Thrombozytose, Monozytopenie, erniedrigtes TSH und ft4. Gelegentlich: verschwommenes Sehen, Katarakt; Epistaxis; Pruritus, Hautexfoliation, asteatotisches Exzem; Exostose, Hyperostose, Spondylitis ankylosans. Selten: Vaskulitis, Pseudotumor Cerebri. P: Kaps à 10/30 mg: 30. Kassenzulässig (AK A). Stand der Information: Oktober GlaxoSmithKline AG. Ausführliche Angaben finden Sie unter Unerwünschte Arzneimittelwirkungen melden Sie bitte unter pv.swiss@gsk.com. GlaxoSmithKline AG Talstrasse 3-5 CH-3053 Münchenbuchsee Telefon Fax CH/ART/0014/12 Checkliste SCHWANGERSCHAFTSVERHÜTUNGS-PROGRAMM 2 Checkliste für die von Toctino für die ärztliche Dokumenta Name der Patientin
8 TOCTINO. W: Alitretinoin. I: Zur Behandlung von Erwachsenen mit therapierefraktärem, schwerem, chronischem Handekzem, die auf eine ausgebaute lokale Behandlung (einschliesslich Vermeidung von Kontakten mit auslösender Noxe, Hautschutz und potente topische Kortikosteroide) für mindestens 4 Wochen nicht angesprochen haben. D: 10 mg - 30 mg. Einnahme der Kapseln 1x täglich mit einer Mahlzeit. Behandlungsdauer Wochen. Nicht zur Anwendung unter 18 Jahren empfohlen. KI: Toctino ist TERATOGEN und bei schwangeren Frauen absolut kontraindiziert (siehe SS). Toctino ist bei Frauen im gebärfähigen Alter kontraindiziert, es sei denn, alle Bedingungen des Schwangerschaftsverhütungsprogramms werden eingehalten (siehe SS). Keine Blutspenden während und bis 1 Monat nach Behandlung (potentielles Risiko für Foetus bei Transfusionen während SS). Toctino ist zudem kontraindiziert bei stillenden Frauen, Leberinsuffizienz, schwerer Niereninsuffizienz, unkontrollierter Hypercholesterinamie, unkontrollierter Hypertriglyceridämie, unkontrolliertem Hypothyroidismus, Hypervitaminose A; bei Überempfindlichkeit gegenüber Alitretinoin, anderen Retinoiden oder einem der Hilfsstoffe (insbesondere Erdnuss- oder Soja-Allergie); bei seltener vererbbarer Fruktoseintoleranz sowie bei gleichzeitiger Behandlung mit Tetrazyklinen oder Methotrexat. VM: Psychische Störungen (unter Therapie mit systemischen Retinoiden wurde über Depressionen, Verstärkung von Depressionen, Angst, Aggressivität, Gemütsschwankungen, psychotische Symptome und selten über Suizidversuche / Suizide berichtet). Mit Toctino behandelte Patienten sollen auf Anzeichen einer Depression überwacht und nötigenfalls einer angemessenen Behandlung zugeführt werden. Patienten mit Depression oder Suizidalität in Anamnese sollen vor/ während Behandlung psychologisch/psychiatrisch betreut werden; verstärkte Wirkung von UV-Strahlung; Knochenveränderungen (u.a. vorzeitiger Epiphysenschluss, Kalzifizierung von Sehnen und Bändern); Myalgie; Arthralgie; CPK-Erhöhung; trockene Augen, Beeinträchtigung des Nachtsehens. Patienten mit Sehstörungen sollen an Augenarzt verwiesen werden; Bei Auftreten von benigner Erhöhung des Schädelinnendrucks (Pseudotumor cerebri) soll Behandlung abgebrochen werden; Senkung von TSH und T4 (meist reversibel); Anstieg der Lebertransaminasen; entzündliche Darmerkrankungen; Überwachung von Plasmacholesterin und Triglyceriden: bei nicht kontrollierbarer Hyperlipidämie oder Symptomen von Pankreatitis muss Behandlung abgebrochen werden; bei Patienten mit Diabetes mellitus, starkem Übergewicht, kardiovaskulären Risikofaktoren oder Fettstoffwechselstörungen sind häufigere Kontrollen der Serumlipide erforderlich (diese Patienten sollten initial mit 10 mg 1x täglich behandelt und falls erforderlich bis zur Maximaldosis von 30 mg hochtitriert werden). Selten allergische Reaktionen inkl. allergischer Vaskulitis. IA: starke CYP3A4- oder PgP-Inhibitoren (z.b. Ketoconazol); Simvastatin; andere Retinoide; Tetrazykline; Methotrexat; Johanniskraut. SS: Toctino ist bei schwangeren Frauen absolut kontraindiziert (siehe KI). Wenn trotz Massnahmen zur Empfängnisverhütung während oder 1 Monat nach Behandlung SS eintritt, besteht hohes Risiko schwerwiegender Missbildungen des Fötus. Bei SS muss Behandlung abgebrochen werden und Zuweisung an auf Teratologie spezialisierten Arzt erfolgen. KI besteht auch bei Frauen im gebärfähigen Alter, ausser alle Konditionen des Schwangerschaftsverhütungsprogramms werden eingehalten. Dieses umfasst Patientenaufklärung, Verhütungsberatung, Schwangerschaftstests (vor, während, 5 Wochen nach Behandlung) und zuverlässige, unterbrechungsfreie Empfängnisverhütung ab 1 Monat vor, während, und bis 1 Monat nach Behandlung. Toctino Verschreibung an Frauen im gebärfähigen Alter ist auf Behandlungsdauer von 30 Tagen begrenzt, Fortsetzung bedarf neuer Verschreibung. Abgabe v. Toctino bis spätestens 7 Tage nach Verschreibung (Details siehe Fachinformation). UW: Sehr häufig: Kopfschmerzen; erhöhte Triglycerid-, und Cholesterin Werte, erniedrigte Lipoproteine (HDL). Häufig: Augenreizung, Konjunktivitis, Trockenheit von Augen, Haut und/oder Lippen, Gesichtsröte, Ekzem, Dermatitis, Erythem, Cheileitis, Alopezie, Arthralgie, Myalgie; erhöhte CPK und Transaminasen, Anämie, erhöhte EBK, Thrombozytose, Monozytopenie, erniedrigtes TSH und ft4. Gelegentlich: verschwommenes Sehen, Katarakt; Epistaxis; Pruritus, Hautexfoliation, asteatotisches Exzem; Exostose, Hyperostose, Spondylitis ankylosans. Selten: Vaskulitis, Pseudotumor Cerebri. P: Kaps à 10/30 mg: 30. Kassenzulässig (AK A). Stand der Information: Oktober GlaxoSmithKline AG. Ausführliche Angaben finden Sie unter Unerwünschte Arzneimittelwirkungen melden Sie bitte unter pv.swiss@gsk.com. GlaxoSmithKline AG Talstrasse 3-5 CH-3053 Münchenbuchsee Telefon Fax CH/ART/0014/12 Checkliste SCHWANGERSCHAFTSVERHÜTUNGS-PROGRAMM 2 Checkliste für die von Toctino für die ärztliche Dokumenta Name der Patientin
Anwendungsrichtlinien und Therapieleitfaden für Ärztinnen/Ärzte und Apothekerinnen/Apotheker
 TOCTINO. W: Alitretinoin. I: Zur Erwachsenen mit therapierefraktärem, schwerem, chronischem Handekzem, die auf eine ausgebaute lokale (einschliesslich Vermeidung Kontakten mit auslösender Noxe, TOCTINO.
TOCTINO. W: Alitretinoin. I: Zur Erwachsenen mit therapierefraktärem, schwerem, chronischem Handekzem, die auf eine ausgebaute lokale (einschliesslich Vermeidung Kontakten mit auslösender Noxe, TOCTINO.
Checkliste für die Verschreibung an Patientinnen
 Cutterguide: No Printing Process: Offset GD: SD428639 Size: 148 X 210 mm Pages: 10 Colors: C M Y K (4 Colors) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller XI Checkliste SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM
Cutterguide: No Printing Process: Offset GD: SD428639 Size: 148 X 210 mm Pages: 10 Colors: C M Y K (4 Colors) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller XI Checkliste SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM
Checkliste für die Verordnung von Tocino
 Wirkstoff: Alitretinoin. Indikation: Zur Behandlung von Erwachsenen mit therapierefraktärem, schwerem chronischem Handekzem, die eine ausgebaute lokale Behandlung für mindestens 4 Wochen erhalten und nicht
Wirkstoff: Alitretinoin. Indikation: Zur Behandlung von Erwachsenen mit therapierefraktärem, schwerem chronischem Handekzem, die eine ausgebaute lokale Behandlung für mindestens 4 Wochen erhalten und nicht
Leitfaden für Ärzte und Apotheker
 SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
Leitfaden für Ärzte und Apotheker
 SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
Leitfaden für verschreibende Ärzte und Apotheker
 Cutterguide: N/A Printing Process: Offset GD: SD428639 Size: A5 (148 X 210 mm) Pages: 14 Colors: C M Y K (4 Colors) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller XI Leitfaden SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM
Cutterguide: N/A Printing Process: Offset GD: SD428639 Size: A5 (148 X 210 mm) Pages: 14 Colors: C M Y K (4 Colors) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller XI Leitfaden SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM
Checkliste für die Verordnung von Toctino
 SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Checkliste für die Verordnung von Toctino für die ärztliche Dokumentation Name der Patientin Alitretinoin Bestätigungsformular für behandelnde Ärzte Die Patientin kam
SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Checkliste für die Verordnung von Toctino für die ärztliche Dokumentation Name der Patientin Alitretinoin Bestätigungsformular für behandelnde Ärzte Die Patientin kam
Informationsbroschüre für Patientinnen und Patienten. Schwangerschaftsverhütungs-Programm
 Cutterguide: NO Printing Process: Offset; GD: SB32430 Size: 210 (W) x 297 (H) mm Pages:8 Colors: C M Y K (4 Colors); Native File: Indesign CC Windows Generated in: Acrobat Distiller 11.0 Informationsbroschüre
Cutterguide: NO Printing Process: Offset; GD: SB32430 Size: 210 (W) x 297 (H) mm Pages:8 Colors: C M Y K (4 Colors); Native File: Indesign CC Windows Generated in: Acrobat Distiller 11.0 Informationsbroschüre
Checkliste für den Arzt / Bestätigungsformular zur Verschreibung an Patientinnen
 Checkliste für den Arzt / Bestätigungsformular zur Verschreibung an Patientinnen Für alle Frauen, denen TOCTINO verschrieben wurde, muss das Schwangerschaftsrisiko beurteilt werden. Ist die Patientin gebärfähig?
Checkliste für den Arzt / Bestätigungsformular zur Verschreibung an Patientinnen Für alle Frauen, denen TOCTINO verschrieben wurde, muss das Schwangerschaftsrisiko beurteilt werden. Ist die Patientin gebärfähig?
Dokumentationsbroschüre mit Checkliste für die Verordnung von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms
 für den Arzt: Dokumentationsbroschüre mit Checkliste für die Verordnung von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms Isotretinoin ist sehr teratogen. Selbst während der Einnahme über
für den Arzt: Dokumentationsbroschüre mit Checkliste für die Verordnung von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms Isotretinoin ist sehr teratogen. Selbst während der Einnahme über
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von. Isoderm. Wirkstoff: Isotretinoin. Teil des Schwangerschaftsverhütungsprogramms
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isoderm Wirkstoff: Isotretinoin Teil des Schwangerschaftsverhütungsprogramms Stand: August 2004 Anweisungen für den Arzt zur Verordnung von
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isoderm Wirkstoff: Isotretinoin Teil des Schwangerschaftsverhütungsprogramms Stand: August 2004 Anweisungen für den Arzt zur Verordnung von
Isotretinoin-ratiopharm
 Isotretinoin-ratiopharm Dokumentation für Ärzte & Apotheker zur Verordnung und Abgabe VIELMEHRWERT Isotretinoin-ratiopharm 10 mg Weichkapseln Isotretinoin-ratiopharm 20 mg Weichkapseln Dokumentationsbroschüre
Isotretinoin-ratiopharm Dokumentation für Ärzte & Apotheker zur Verordnung und Abgabe VIELMEHRWERT Isotretinoin-ratiopharm 10 mg Weichkapseln Isotretinoin-ratiopharm 20 mg Weichkapseln Dokumentationsbroschüre
Dokumentationsbroschüre mit Checkliste für die Verordnung von Acitretin-haltigen Arzneimitteln
 für den Arzt: Dokumentationsbroschüre mit Checkliste für die Verordnung von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des
für den Arzt: Dokumentationsbroschüre mit Checkliste für die Verordnung von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des
ISOTRETINOIN BASICS. Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe. - Teil des Schwangerschaftsverhütungsprogramms -
 ISOTRETINOIN BASICS Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe behördlich genehmigtes Schulungsmaterial - Teil des Schwangerschaftsverhütungsprogramms - Dieser Leitfaden ist verpflichtender
ISOTRETINOIN BASICS Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe behördlich genehmigtes Schulungsmaterial - Teil des Schwangerschaftsverhütungsprogramms - Dieser Leitfaden ist verpflichtender
Hinweise für Apotheker zur Abgabe von Ciscutan (Isotretinoin)
 Hinweise für Apotheker zur Abgabe von Ciscutan (Isotretinoin) Einführung Ciscutan (Isotretinoin) ist stark teratogen. Aufgrund des hohen Risikos für ernsthafte und sehr schwerwiegende Missbildungen beim
Hinweise für Apotheker zur Abgabe von Ciscutan (Isotretinoin) Einführung Ciscutan (Isotretinoin) ist stark teratogen. Aufgrund des hohen Risikos für ernsthafte und sehr schwerwiegende Missbildungen beim
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des Schwangerschaftsverhütungsprogramms
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des Schwangerschaftsverhütungsprogramms
Leitfaden für Ärzte und Apotheker. zur Verordnung und Abgabe von Isotretinoin. - Teil des Schwangerschaftsverhütungsprogramms
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms Anweisungen für den Arzt zur Verordnung von Isotretinoin Bitte lesen Sie diesen
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms Anweisungen für den Arzt zur Verordnung von Isotretinoin Bitte lesen Sie diesen
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des Schwangerschaftsverhütungsprogramms
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des Schwangerschaftsverhütungsprogramms
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von. Acicutan. - Teil des Schwangerschaftsverhütungsprogramms
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acicutan - Teil des Schwangerschaftsverhütungsprogramms - Stand: Mai 2012 Anweisungen für den Arzt zur Verordnung von Acitretin Bitte lesen
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acicutan - Teil des Schwangerschaftsverhütungsprogramms - Stand: Mai 2012 Anweisungen für den Arzt zur Verordnung von Acitretin Bitte lesen
Dokumentationsbroschüre mit Checkliste für den Arzt für die Verordnung von
 Dokumentationsbroschüre mit Checkliste für den Arzt für die Verordnung von behördlich genehmigtes Schulungsmaterial ISOTRETINOIN BASICS - Teil des Schwangerschaftsverhütungsprogramms - Diese Dokumentationsbroschüre
Dokumentationsbroschüre mit Checkliste für den Arzt für die Verordnung von behördlich genehmigtes Schulungsmaterial ISOTRETINOIN BASICS - Teil des Schwangerschaftsverhütungsprogramms - Diese Dokumentationsbroschüre
Toctino Bestätigungsformular für Patienten
 Cutterguide: N/A Printing Process: Offset GD: SD428639 Size: A5: 148 X 210 mm Pages: 12 Colors: C M Y K (4 Color) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller XI Datum Name des Patienten
Cutterguide: N/A Printing Process: Offset GD: SD428639 Size: A5: 148 X 210 mm Pages: 12 Colors: C M Y K (4 Color) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller XI Datum Name des Patienten
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm
 Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Anhang III Änderungen der relevanten Abschnitte der Produktinformation
 Anhang III Änderungen der relevanten Abschnitte der Produktinformation Hinweis: Diese Änderungen in den relevanten Abschnitten der Produktinformation sind das Ergebnis des Referrals. Die Produktinformation
Anhang III Änderungen der relevanten Abschnitte der Produktinformation Hinweis: Diese Änderungen in den relevanten Abschnitten der Produktinformation sind das Ergebnis des Referrals. Die Produktinformation
Toctino Bestätigungsformular für Patienten
 * Toctino wird zur Behandlung von Patientinnen/Patienten unter 18 Jahren nicht empfohlen. Datum Unterschrift des Patienten Geburtsdatum Name des Patienten (Druckschrift) Mein behandelnder Dermatologe hat
* Toctino wird zur Behandlung von Patientinnen/Patienten unter 18 Jahren nicht empfohlen. Datum Unterschrift des Patienten Geburtsdatum Name des Patienten (Druckschrift) Mein behandelnder Dermatologe hat
Anwendungsrichtlinien für Ärztinnen und Ärzte
 CURAKNE Isotretinoin Anwendungsrichtlinien für Ärztinnen und Ärzte Dieses Arzneimittel ist teratogen, daher ist während der Behandlung eine zuverlässige Schwangerschaftsverhütung zwingend erforderlich.
CURAKNE Isotretinoin Anwendungsrichtlinien für Ärztinnen und Ärzte Dieses Arzneimittel ist teratogen, daher ist während der Behandlung eine zuverlässige Schwangerschaftsverhütung zwingend erforderlich.
Direkte Mitteilung an Angehörige der Heilberufe
 81829 München München, August 2013 Direkte Mitteilung an Angehörige der Heilberufe Wir möchten Sie über wichtige Aspekte der klinischen Anwendung von Imnovid (Pomalidomid) informieren, das nun in Kombination
81829 München München, August 2013 Direkte Mitteilung an Angehörige der Heilberufe Wir möchten Sie über wichtige Aspekte der klinischen Anwendung von Imnovid (Pomalidomid) informieren, das nun in Kombination
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen
 Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
PHV-issue: Retinoide (Acitretin, Adapalen, Alitretinoin, Bexaroten, Isotretinoin, Tazaroten, Tretinoin) Sehr geehrte Damen und Herren,
 BASG / AGES MEA Traiseng. 5, 1200 Wien, Österreich Datum: 27.06.2018 Kontakt: Ing. Veronika Heimlich, B.Sc. T: +43 505 55-36247 E-Mail: pv-implementation@basg.gv.at Unser Zeichen: PHV-11118339 -A-180626-EUIM
BASG / AGES MEA Traiseng. 5, 1200 Wien, Österreich Datum: 27.06.2018 Kontakt: Ing. Veronika Heimlich, B.Sc. T: +43 505 55-36247 E-Mail: pv-implementation@basg.gv.at Unser Zeichen: PHV-11118339 -A-180626-EUIM
Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern
 Mycophenolat (z.b. CellCept ) Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern Bonn (26. Oktober 2015) - Die Europäische Arzneimittel Agentur (EMA) warnt, dass der in der
Mycophenolat (z.b. CellCept ) Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern Bonn (26. Oktober 2015) - Die Europäische Arzneimittel Agentur (EMA) warnt, dass der in der
Erivedge Schwangerschaftsverhütungs-Programm:
 Erivedge Schwangerschaftsverhütungs-Programm: Wichtige Informationen zu Empfängnisverhütung und Verhütungsmethoden für männliche und weibliche Patienten, die Erivedge einnehmen. Erivedge kann schwere Geburtsfehler
Erivedge Schwangerschaftsverhütungs-Programm: Wichtige Informationen zu Empfängnisverhütung und Verhütungsmethoden für männliche und weibliche Patienten, die Erivedge einnehmen. Erivedge kann schwere Geburtsfehler
Informationsbroschüre für Patienten Was Sie wissen müssen
 Europa hat Bedingungen für die Markteinführung des Arzneimittels VOLIBRIS gestellt (europaweit eingetragen). Dieser in Belgien und Luxemburg obligatorische Risikomanagementplan, zu dem dieses Informationsschreiben
Europa hat Bedingungen für die Markteinführung des Arzneimittels VOLIBRIS gestellt (europaweit eingetragen). Dieser in Belgien und Luxemburg obligatorische Risikomanagementplan, zu dem dieses Informationsschreiben
Toctino Wichtige Patienteninformationen zur Empfängnisverhütung
 Wirkstoff: Alitretinoin. Indikation: Zur Behandlung von Erwachsenen mit therapierefraktärem, schwerem chronischem Handekzem, die eine ausgebaute lokale Behandlung für mindestens 4 Wochen erhalten und nicht
Wirkstoff: Alitretinoin. Indikation: Zur Behandlung von Erwachsenen mit therapierefraktärem, schwerem chronischem Handekzem, die eine ausgebaute lokale Behandlung für mindestens 4 Wochen erhalten und nicht
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen
 Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN
 MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN. Information über die Risiken für das ungeborene Baby
 MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
Mitteilung des Bundesamts für Sicherheit im Gesundheitswesen über Maßnahmen zur Gewährleistung der Arzneimittelsicherheit:
 Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Isoderm. Dokumentationsbroschüre für den Arzt. nur für Frauen. Dermapharm Umweltschutz
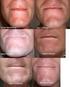 Isoderm Dermapharm Umweltschutz Hauterkrankungen und Umwelt stehen in einem engen Zusammenhang. Gerade in der heutigen Zeit wird dies immer mehr erkennbar. Dermapharm sieht es als ihre Verpflichtung an,
Isoderm Dermapharm Umweltschutz Hauterkrankungen und Umwelt stehen in einem engen Zusammenhang. Gerade in der heutigen Zeit wird dies immer mehr erkennbar. Dermapharm sieht es als ihre Verpflichtung an,
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE
 MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Teratogenes Risiko Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln wurde als Teil der Zulassungsauflagen
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Teratogenes Risiko Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln wurde als Teil der Zulassungsauflagen
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
VORICONAZOL-haltige Arzneimittel: Checkliste für medizinisches Fachpersonal
 VORICONAZOL-haltige Arzneimittel: Checkliste für medizinisches Fachpersonal Bitte füllen Sie diese Checkliste bei jedem Besuch Ihres Patienten, der mit VORICONAZOL-haltigen Arzneimitteln behandelt wird,
VORICONAZOL-haltige Arzneimittel: Checkliste für medizinisches Fachpersonal Bitte füllen Sie diese Checkliste bei jedem Besuch Ihres Patienten, der mit VORICONAZOL-haltigen Arzneimitteln behandelt wird,
Bezeichnung des Arzneimittels: Vom Pharmazeutischen Unternehmer auszufüllen Pharmazeutischen Unternehmer:
 Fragebogen für Angehörige der Gesundheitsberufe zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln (z. B. CellCept, Myfortic und andere Arzneimittelnamen) während einer Schwangerschaft
Fragebogen für Angehörige der Gesundheitsberufe zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln (z. B. CellCept, Myfortic und andere Arzneimittelnamen) während einer Schwangerschaft
Toctino 10 mg Weichkapseln Toctino 30 mg Weichkapseln
 FACHINFORMATION November 2015 493033PD001E 1. BEZEICHNUNG DER ARZNEIMITTEL 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Toctino 10 mg Weichkapseln Eine Weichkapsel enthält 10 mg Alitretinoin Toctino
FACHINFORMATION November 2015 493033PD001E 1. BEZEICHNUNG DER ARZNEIMITTEL 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Toctino 10 mg Weichkapseln Eine Weichkapsel enthält 10 mg Alitretinoin Toctino
Dokumentation Broschüre mit Checkliste für die Verordnung von Neotigason Patientin/Patient Teil des Schwangerschafts- verhütungsprogramms
 Dokumentation Broschüre mit Checkliste für die Verordnung von Neotigason für den Arzt Patientin/Patient Teil des Schwangerschaftsverhütungsprogramms Acitretin ist sehr teratogen. Selbst während der Einnahme
Dokumentation Broschüre mit Checkliste für die Verordnung von Neotigason für den Arzt Patientin/Patient Teil des Schwangerschaftsverhütungsprogramms Acitretin ist sehr teratogen. Selbst während der Einnahme
Valdoxan (Agomelatin)
 Valdoxan (Agomelatin) Zur Behandlung von Episoden einer Major Depression bei Erwachsenen Informationen für Ärzte Empfehlungen zu: berprüfung der Leberfunktion Ü (Transaminasenkontrollen) Interaktion mit
Valdoxan (Agomelatin) Zur Behandlung von Episoden einer Major Depression bei Erwachsenen Informationen für Ärzte Empfehlungen zu: berprüfung der Leberfunktion Ü (Transaminasenkontrollen) Interaktion mit
Valdoxan (Agomelatin)
 Valdoxan (Agomelatin) Zur Behandlung von Episoden einer Major Depression bei Erwachsenen Informationen für Ärzte Empfehlungen zu: Überprüfung der Leberfunktion (Transaminasenkontrollen) Interaktion mit
Valdoxan (Agomelatin) Zur Behandlung von Episoden einer Major Depression bei Erwachsenen Informationen für Ärzte Empfehlungen zu: Überprüfung der Leberfunktion (Transaminasenkontrollen) Interaktion mit
Erivedge Schwangerschaftsverhütungs-Programm
 behördlich genehmigtes Schulungsmaterial Erivedge Schwangerschaftsverhütungs-Programm Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer
behördlich genehmigtes Schulungsmaterial Erivedge Schwangerschaftsverhütungs-Programm Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer
Anhang III. Änderungen der relevanten Abschnitte der Produktinformation
 Anhang III Änderungen der relevanten Abschnitte der Produktinformation Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage sind
Anhang III Änderungen der relevanten Abschnitte der Produktinformation Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage sind
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung
 Die Gesundheitsbehörden der Europäischen Union haben für das Medikament Erivedge eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung in Belgien
Die Gesundheitsbehörden der Europäischen Union haben für das Medikament Erivedge eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung in Belgien
MEDIKAMENTE, DIE MYCOPHENOLAT ENTHALTEN Informationsbroschüre für Patienten. Informationen über die Risiken für den Fötus
 Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
MAVENCLAD. Informationsmaterial für verschreibende Ärzte. Version 1.0, [Stand Juli 2017]
![MAVENCLAD. Informationsmaterial für verschreibende Ärzte. Version 1.0, [Stand Juli 2017] MAVENCLAD. Informationsmaterial für verschreibende Ärzte. Version 1.0, [Stand Juli 2017]](/thumbs/77/74803261.jpg) MAVENCLAD Informationsmaterial für verschreibende Ärzte Version 1.0, [Stand Juli 2017] Inhalt Einführung Behandlungsschemata Überwachung während der Behandlung Lymphozytenzahlen Schwere Infektionen Progressive
MAVENCLAD Informationsmaterial für verschreibende Ärzte Version 1.0, [Stand Juli 2017] Inhalt Einführung Behandlungsschemata Überwachung während der Behandlung Lymphozytenzahlen Schwere Infektionen Progressive
Toctino (Alitretinoin) Was Sie wissen müssen
 SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Toctino (Alitretinoin) Was Sie wissen müssen Informationsbroschüre für Patientinnen und Patienten mit wichtigen Informationen zur Empfängnisverhütung behördlich genehmigtes
SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Toctino (Alitretinoin) Was Sie wissen müssen Informationsbroschüre für Patientinnen und Patienten mit wichtigen Informationen zur Empfängnisverhütung behördlich genehmigtes
- Teil des Schwangerschaftsverhütungsprogramms -
 für den Arzt: Acicutan Dokumentationsbroschüre mit Checkliste für die Verordnung von Acicutan - Teil des Schwangerschaftsverhütungsprogramms - Patientin / Patient: Acitretin ist sehr teratogen. Selbst
für den Arzt: Acicutan Dokumentationsbroschüre mit Checkliste für die Verordnung von Acicutan - Teil des Schwangerschaftsverhütungsprogramms - Patientin / Patient: Acitretin ist sehr teratogen. Selbst
'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine
 'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende
'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende
MEDIKAMENTE, DIE MYCOPHENOLAT ENTHALTEN Informationsbroschüre für Patienten. Informationen über die Risiken für den Fötus
 Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Die sichere Anwendung von Retinoiden in der Dermatologie
 Bern, im Januar 2017 Die sichere Anwendung von Retinoiden in der Dermatologie Angesichts des hohen teratogenen Potenzials der Retinoide ist eine strikte Einhaltung der Vorsichtsmassnahmen bei Frauen im
Bern, im Januar 2017 Die sichere Anwendung von Retinoiden in der Dermatologie Angesichts des hohen teratogenen Potenzials der Retinoide ist eine strikte Einhaltung der Vorsichtsmassnahmen bei Frauen im
MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE
 MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln
MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln
LEITFADEN FÜR PATIENTINNEN
 LEITFADEN FÜR PATIENTINNEN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
LEITFADEN FÜR PATIENTINNEN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
Mycophenolat SANDOZ. Mycophenolathaltige Arzneimittel. Leitfaden für Angehörige der Gesundheitsberufe
 Mycophenolat SANDOZ Mycophenolathaltige Arzneimittel Leitfaden für Angehörige der Gesundheitsberufe 1 Teratogenes Risiko Dieser Leitfaden zur Anwendung von mycophenolathaltigen Arzneimitteln wurde als
Mycophenolat SANDOZ Mycophenolathaltige Arzneimittel Leitfaden für Angehörige der Gesundheitsberufe 1 Teratogenes Risiko Dieser Leitfaden zur Anwendung von mycophenolathaltigen Arzneimitteln wurde als
Ihre Verantwortung: Verhinderung von Missbildungen Wichtige Informationen für weibliche Patienten und ihre Partner
 Über diese Broschüre Was Sie wissen müssen: Missbildungen Wieso wurde mir Isotretinoin-ratiopharm verschrieben? Über Akne Ihre Verantwortung: Verhinderung von Missbildungen Wichtige Informationen für weibliche
Über diese Broschüre Was Sie wissen müssen: Missbildungen Wieso wurde mir Isotretinoin-ratiopharm verschrieben? Über Akne Ihre Verantwortung: Verhinderung von Missbildungen Wichtige Informationen für weibliche
Formular zum Nachweis der Beratung
 Erivedge Formular zum Nachweis der Beratung Initialen WARNUNG: EMBRYOFETALER TOD UND SCHWERE GEBURTSFEHLER Die Anwendung von Erivedge bei Schwangeren kann zu embryofetalem Tod oder schweren Geburtsfehlern
Erivedge Formular zum Nachweis der Beratung Initialen WARNUNG: EMBRYOFETALER TOD UND SCHWERE GEBURTSFEHLER Die Anwendung von Erivedge bei Schwangeren kann zu embryofetalem Tod oder schweren Geburtsfehlern
Wichtige Informationen für Ärzte und Apotheker zur Minimierung des Teratogenitätsrisikos von Odomzo -Kapseln (Sonidegib)
 Wichtige Informationen für Ärzte und Apotheker zur Minimierung des Teratogenitätsrisikos von Odomzo -Kapseln (Sonidegib) Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Wichtige Informationen für Ärzte und Apotheker zur Minimierung des Teratogenitätsrisikos von Odomzo -Kapseln (Sonidegib) Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Behandlung mit. was Sie darüber wissen müssen
 Information für Patienten, denen Volibris verschrieben wurde Behandlung mit was Sie darüber wissen müssen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung um sicherzustellen, dass Angehörige
Information für Patienten, denen Volibris verschrieben wurde Behandlung mit was Sie darüber wissen müssen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung um sicherzustellen, dass Angehörige
Spezielle Informationen bei Kinderwunsch und Schwangerschaft
 Spezielle Informationen bei Kinderwunsch und Schwangerschaft Patientenbroschüre Beauflagtes Schulungsmaterial 2 Diese Informationsbroschüre für Patienten zur Anwendung von Leflunomid medac ist eine Auflage
Spezielle Informationen bei Kinderwunsch und Schwangerschaft Patientenbroschüre Beauflagtes Schulungsmaterial 2 Diese Informationsbroschüre für Patienten zur Anwendung von Leflunomid medac ist eine Auflage
Produktprofil. * refraktär gegen potente topische Kortikosteroide
 Produktprofil Toctino ist die einzig zugelassene Therapie bei allen Formen des schweren chronischen Handekzems*, wenn potente topische Kortikosteroide nicht weiterhelfen. * refraktär gegen potente topische
Produktprofil Toctino ist die einzig zugelassene Therapie bei allen Formen des schweren chronischen Handekzems*, wenn potente topische Kortikosteroide nicht weiterhelfen. * refraktär gegen potente topische
behördlich genehmigtes Schulungsmaterial ISOTRETINOIN BASICS Was Sie wissen müssen Informationsbroschüre für Patientinnen und Patienten
 ISOTRETINOIN BASICS Was Sie wissen müssen Informationsbroschüre für Patientinnen und Patienten behördlich genehmigtes Schulungsmaterial Inhaltsverzeichnis ÜBER DIESE BROSCHÜRE 3 WAS SIE WISSEN MÜSSEN:
ISOTRETINOIN BASICS Was Sie wissen müssen Informationsbroschüre für Patientinnen und Patienten behördlich genehmigtes Schulungsmaterial Inhaltsverzeichnis ÜBER DIESE BROSCHÜRE 3 WAS SIE WISSEN MÜSSEN:
PATIENTEN- INFORMATIONSKARTE
 PATIENTEN- INFORMATIONSKARTE Diese Patienteninformationskarte ist ein verpflichtender Teil der Zulassung, um sicherzustellen, dass Angehörige der Heilberufe, sowie Patienten die besonderen Sicherheitsanforder
PATIENTEN- INFORMATIONSKARTE Diese Patienteninformationskarte ist ein verpflichtender Teil der Zulassung, um sicherzustellen, dass Angehörige der Heilberufe, sowie Patienten die besonderen Sicherheitsanforder
Patienteninformation zur systemischen Behandlung mit Acitretin
 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur systemischen Behandlung mit Acitretin Lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Acitretin erläutern. Noch
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur systemischen Behandlung mit Acitretin Lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Acitretin erläutern. Noch
Patientenbroschüre. Behandlung mit Valproat. Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten
 Patientenbroschüre Behandlung mit Valproat (Depakine, Depakine Chrono, Valproate Chrono Sanofi, Orfiril, Valproat Chrono Desitin, Valproat Sandoz, Convulex ) Empfängnisverhütung und Schwangerschaft: Was
Patientenbroschüre Behandlung mit Valproat (Depakine, Depakine Chrono, Valproate Chrono Sanofi, Orfiril, Valproat Chrono Desitin, Valproat Sandoz, Convulex ) Empfängnisverhütung und Schwangerschaft: Was
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION
 ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
Thalidomid / Lenalidomide
 Thalidomid / Lenalidomide Bedingungen für das Inverkehrbringen aus den zentralen Zulassungsverfahren R Zugelassene Indikationen Lenalidomide (Revlimid ): Revlimid ist in Kombination mit Dexamethason indiziert
Thalidomid / Lenalidomide Bedingungen für das Inverkehrbringen aus den zentralen Zulassungsverfahren R Zugelassene Indikationen Lenalidomide (Revlimid ): Revlimid ist in Kombination mit Dexamethason indiziert
Broschüre zur Aufklärung von Patienten
 Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
Geschäftsführer: Michael Pehl, Aart Brouwer
 München, Juni 2009 Wichtige Hinweise an alle Angehörigen der Gesundheitsberufe über die zu beachtenden Sicherheitsvorkehrungen und das verpflichtende Schwangerschaftsverhütungsprogramm zu Thalidomide Celgene
München, Juni 2009 Wichtige Hinweise an alle Angehörigen der Gesundheitsberufe über die zu beachtenden Sicherheitsvorkehrungen und das verpflichtende Schwangerschaftsverhütungsprogramm zu Thalidomide Celgene
Fragebogen für Patienten zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln während der Schwangerschaft.
 Fragebogen für Patienten zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln während der Schwangerschaft. Bezeichnung des Arzneimittels: Vom Pharmazeutischen Unternehmer auszufüllen
Fragebogen für Patienten zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln während der Schwangerschaft. Bezeichnung des Arzneimittels: Vom Pharmazeutischen Unternehmer auszufüllen
LEITFADEN FÜR PATIENTINNENN
 LEITFADEN FÜR PATIENTINNENN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
LEITFADEN FÜR PATIENTINNENN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
Wichtige Patienteninformationen zur Empfängnisverhütung
 Weitere wichtige Informationen über Toctino, unter anderem über die Einnahme, die Nebenwirkungen und spezielle Warnhinweise, finden Sie in der Packungsbeilage. Bitte lesen Sie auch diese vor der ersten
Weitere wichtige Informationen über Toctino, unter anderem über die Einnahme, die Nebenwirkungen und spezielle Warnhinweise, finden Sie in der Packungsbeilage. Bitte lesen Sie auch diese vor der ersten
ISOCURAL Weichkapseln, zum Einnehmen (Isotretinoin)
 Die Markteinführung von ISOCURAL wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende Informationsblatt
Die Markteinführung von ISOCURAL wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende Informationsblatt
Therapiepass IMNOVID (Pomalidomid)
 Hinweis: Dieser Therapiepass gilt allein für die Verordnung und Anwendung der darin aufgeführten Originalprodukte von Celgene und darf nur dafür verwendet werden. Insbesondere unsere Empfehlungen zu Anwendungsgebieten,
Hinweis: Dieser Therapiepass gilt allein für die Verordnung und Anwendung der darin aufgeführten Originalprodukte von Celgene und darf nur dafür verwendet werden. Insbesondere unsere Empfehlungen zu Anwendungsgebieten,
Patienteninformation Lamotrigin Desitin 04/2007
 Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
Gebrauchsinformation: Information für Anwender. TOCTINO 30 mg Weichkapseln. Wirkstoff: Alitretinoin
 Gebrauchsinformation: Information für Anwender TOCTINO 30 mg Weichkapseln Wirkstoff: Alitretinoin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation: Information für Anwender TOCTINO 30 mg Weichkapseln Wirkstoff: Alitretinoin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Therapiepass Revlimid (Lenalidomid)
 Celgene GmbH Joseph-Wild-Straße 20 81829 München www.celgene.de info@celgene.de Telefon 0 89 / 45 15 19-010 Telefax 0 89 / 45 15 19-019 Hinweis: Dieser Therapiepass gilt allein für die Verordnung und Anwendung
Celgene GmbH Joseph-Wild-Straße 20 81829 München www.celgene.de info@celgene.de Telefon 0 89 / 45 15 19-010 Telefax 0 89 / 45 15 19-019 Hinweis: Dieser Therapiepass gilt allein für die Verordnung und Anwendung
TOCTINO 10 mg: Braune ovale Kapsel mit einer Länge von ungefähr 11 mm und einer Breite von 7 mm mit der Markierung A1.
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS TOCTINO 10 mg Weichkapseln TOCTINO 30 mg Weichkapseln 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Weichkapsel enthält
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS TOCTINO 10 mg Weichkapseln TOCTINO 30 mg Weichkapseln 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Weichkapsel enthält
Gebrauchsinformation: Information für den Anwender. Koreanischer Reiner Roter Ginseng Kapseln
 Gebrauchsinformation: Information für den Anwender Koreanischer Reiner Roter Ginseng Kapseln Wirkstoff: Ginsengwurzel-Pulver 1 Hartkapsel enthält 300 mg rote (wasserdampfbehandelte) Ginsengwurzel, pulverisiert.
Gebrauchsinformation: Information für den Anwender Koreanischer Reiner Roter Ginseng Kapseln Wirkstoff: Ginsengwurzel-Pulver 1 Hartkapsel enthält 300 mg rote (wasserdampfbehandelte) Ginsengwurzel, pulverisiert.
WICHTIGE INFORMATIONEN FÜR PATIENTEN
 WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bzw. aktiven psoriatischen Arthritis verschrieben wurde 2 Version 5 (Stand: Februar 2017)
WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bzw. aktiven psoriatischen Arthritis verschrieben wurde 2 Version 5 (Stand: Februar 2017)
JINARC (Tolvaptan) Broschüre zur Aufklärung von Patienten. rz_jin_patientenbroschuere_a4_2017.indd :58
 JINARC (Tolvaptan) Broschüre zur Aufklärung von Patienten 1 rz_jin_patientenbroschuere_a4_2017.indd 1 01.03.17 11:58 rz_jin_patientenbroschuere_a4_2017.indd 2 01.03.17 11:58 Inhalt 5 Welchen Zweck erfüllt
JINARC (Tolvaptan) Broschüre zur Aufklärung von Patienten 1 rz_jin_patientenbroschuere_a4_2017.indd 1 01.03.17 11:58 rz_jin_patientenbroschuere_a4_2017.indd 2 01.03.17 11:58 Inhalt 5 Welchen Zweck erfüllt
