Ferienkurs Experimentalphysik 4
|
|
|
- Alma Busch
- vor 6 Jahren
- Abrufe
Transkript
1 Ferienkurs Experimentalphysik 4 Vorlesung 4 Emission und Absorption elektromagnetischer Strahlung Stephan Huber, Markus Kotulla, Markus Perner
2 Inhaltsverzeichnis 1 Emission und Absorption elektromagnetischer Strahlung Induzierte und spontane Übergänge Übergangswahrscheinlichkeiten und Matrixelemente Auswahlregeln für Dipolstrahlung Lebensdauern angeregter Zustände Linienbreiten der Spektrallinien Exotische Atome 4 3 Rotation und Schwingung von zweiatomigen Molekülen Der starre Rotator Schwingung zweiatomiger Moleküle Kombinierte Anregungen Abbildungsverzeichnis 1 Strahlungsübergänge und Besetzungsverteilung im Zweiniveau-System Zweiatomiges Molekül als starrer Rotator
3 1 Emission und Absorption elektromagnetischer Strahlung 1.1 Induzierte und spontane Übergänge Befindet sich ein Atom im Zustand E k in einem elektromagnetischen Strahlungsfeld mit der spektralen Energiedichte w ν (ν) = n(ν) hν (n(ν) ist die Anzahl der Photonen pro Frequenzintervall), kann ein Hüllenelektron durch Absorption eines Photons hν in einen energetisch höheren Zustand E i = E k + hν angeregt werden. Die Wahrscheinlichkeit pro Zeiteinheit für diese induzierte Absorption (vgl. Abb. 1a) ist W ki = B ki w ν (ν). (1) Der Faktor B ki ist dabei der Einstein-Koeffizient der induzierten Absorption. Der angeregte Zustand kann nun spontan oder unter Einwirkung des äußeren Strahlungsfeldes wieder zerfallen. Die spontane Emission (vgl. Abb. 1a), die völlig statistisch und in eine beliebige Raumrichtung erfolgt, wird beschrieben durch den Einstein-Koeffizienten der spontanen Emission A ik. Die Wahrscheinlichkeit pro Zeiteinheit ist allein durch diesen Koeffizienten gegeben W spontan ik = A ik (2) und somit unabhängig vom äußeren Strahlungsfeld. Bei der stimulierten Emission (vgl. Abb. 1a) hingegen stimmen Polarisation und Richtung der stimulierenden und emittierten Welle überein und die Wahrscheinlichkeit ist wieder proportional zur spektralen Energiedichte Wik induziert = B ik w ν (ν). (3) Abb. 1: a) Absorption, induzierte Emission und spontane Emission in einem Zweiniveau-System, b) Besetzungsverteilung der Zustände im thermischen Gleichgewicht 1
4 Befinden sich N i Atome im Zustand E i und N k Atome im Zustand E k in einem Strahlungsfeld, so müssen im stationären Gleichgewicht diese Zustandsbesetzungen zeitlich konstant sein, d.h. die Emissionsrate muss gleich der Absorptionsrate sein (vgl. Abb. 1b) (A ik + B ik w ν (ν))n i = B ki w ν (ν)n k. (4) Zwischen den Einstein-Koeffizienten gelten außerdem folgende Beziehungen, die sich aus der Boltzmann-Verteilung für die Besetzungszahlen im thermischen Gleichgewicht und der Planck-Formel für die spektrale Energiedichte ergeben: B ik B ki = g k g i, A ik = 8πhν3 c 3 B ik. (5) Dabei steht der Faktor g = 2J + 1 für das statistische Gewicht (d.h. die Zahl der energetisch entarteten Unterniveaus) eines Zustandes mit Gesamtdrehimpulsquantenzahl J. Bei gleichen statistischen Gewichten g i = g k sind die Einstein-Koeffizienten für induzierte Emission und Absorption gleich groß! 1.2 Übergangswahrscheinlichkeiten und Matrixelemente In der klassischen Elektrodynamik lässt sich das Dipolmoment eines Hertzschen Dipols durch p = q r berechnen. In der Quantenmechanik wird der Mittelwert des elektrischen Dipolmomentes des Leuchtelektrons eines Atoms durch den Erwartungswert ˆ p = e r = e d 3 r Ψ r Ψ (6) beschrieben, wobei r den Ortsvektor und Ψ die Wellenfunktion des Elektrons beschreibt. In erster Näherung (Dipolstrahlung) lassen sich nun die Übergangswahrscheinlichkeiten mit Hilfe von sog. Matrixelementen (hier: Dipolmatrixelement oder Übergangsdipolmoment) M ik = 1 ˆ e p ik = r ik = d 3 r Ψ i r Ψ k = k r i (7) ausdrücken, wobei im Erwartungswert r die Wellenfunktionen beider Zustände berücksichtigt werden müssen. Nach etwas Rechnung erhält man für die Einsteinkoeffizienten der spontanen Emission und induzierten Absorption/Emission A ik = 2 e 2 ωik 3 3 ε 0 c 3 h M ik 2, B ki = 2 π 2 e 2 3 ε 0 M ki 2. (8) 2 2
5 1.3 Auswahlregeln für Dipolstrahlung Mithilfe der Matrixelemente lassen sich auch die Auswahlregeln für die Änderungen der Quantenzahlen l, m und s begründen. Es ergibt sich, dass nur solche Übergänge möglich sind, für welche die Einstein-Koeffizienten ungleich Null sind, d.h. für die die Dipolmatrixelemente M ik mindestens eine von Null verschiedene Komponente besitzen. Man gelangt zu folgenden Auswahlregeln: Paritätsauswahlregel: Es sind nur Übergänge erlaubt, bei denen für die Drehimpulsquantenzahl l = ±1 gilt. Die Wellenfunktionen, die am Matrixelement beteiligt sind, müssen unterschiedliche Parität Π (Verhalten der Wellenfunktion unter Rauminversion) besitzen. Auswahlregel für die magnetische Quantenzahl: Es sind nur Übergänge erlaubt, bei denen für die magnetische Quantenzahl m = 0, ±1 gilt. Für m = 0 handelt sich um linear polarisiertes Licht, für m = ±1 um zirkular polarisiertes Licht. Auswahlregel für die Spinquantenzahl: Es sind nur Übergänge erlaubt, bei denen für die Spinquantenzahl s = 0 gilt (kein Spinflip). Diese Regel gilt aber nur für leichte Atome, bei schweren Atomen gibt es auf Grund der starken Spin- Bahn-Kopplung Ausnahmen. Auswahlregel für die Gesamtdrehimpulsquantenzahl: Es sind nur Übergänge erlaubt, bei denen für die Gesamtdrehimpulsquantenzahl j = 0, ±1 gilt. Jedoch ist der Übergang j = 0 j = 0 verboten, da bei s = 0 die notwendige Änderung l = ±1 durch eine entgegengesetzte Änderung m s = 1 kompensiert werden kann. 1.4 Lebensdauern angeregter Zustände Befinden sich N i (t = 0) Atome zum Zeitpunkt t = 0 im angeregten Zustand E i, so sind es nach einer Zeit t noch N i (t) = N i (t = 0) e A it, (9) wobei A i = j A ij die Summe der Einstein-Koeffizienten für alle tieferliegenden Niveaus j, in die das Atom übergehen kann, ist. Die Konstante τ i = 1/A i ist die mittlere Lebensdauer des Zustandes E i. Tragen noch andere Prozesse, z.b. inelastische Stöße, mit einer Wahrscheinlichkeit R i zur Abnahme von N i bei, so gilt wobei die Konstante τ eff i N i (t) = N i (t = 0) e (A i+r i )t, (10) = 1/(A i + R i ) als effektive Lebensdauer bezeichnet wird. 3
6 1.5 Linienbreiten der Spektrallinien Die beim Übergang von einem Zustand E i zu einem anderen E k abgegebene elektromagnetische Strahlung ist nicht monochromatisch sondern besitzt eine gewisse spektrale Verteilung um eine Mittenfrequenz ν 0. Dabei unterscheidet man folgende Beiträge zur Linienbreite: Natürliche Linienbreite: Aufgrund der endlichen Abstrahldauer des Atoms folgt aus den Lebensdauern und der Energie-Zeit-Unschärfe über E = hν eine Frequenzunschärfe: ν nat = 1 ( ). (11) 2π τ i τ k Doppler-Verbreiterung: Die Bewegung des angeregten Atoms führt auf Grund des Dopplereffektes zu einer Verschiebung der Mittenfrequenz ω = ω 0 + k v. Daraus resultiert ebenfalls eine Verbreiterung der Spektrallinien: ν D = ν 0 c 8 ln 2kB T m (12) Stoßverbreiterung: Aufgrund von Wechselwirkungen mit benachbarten Gasatomen werden Niveaus verschoben. Bei statistisch verteilten Abständen führt dies zu einer Linienverbreiterung und Verschiebung. 2 Exotische Atome Es ist, für zumindest kurze Zeiten möglich, exotische Atome zu erzeugen bei denen meist Elektronen durch andere geladene Teilchen (z.b. µ, π ) ersetzt werden. Es können auch Kombinationen aus Antiteilchen wie z.b. Antiwasserstoff (p + e + ) oder Positronium (p + p + ) entstehen. Für die Berechnung der bohrschen Radien und Energien sind vor allem folgende Beziehungen nützlich: r n = n2 Z a 0 mit a 0 = 4πɛ 0 e 2 2 µ e 0.5 Å und µ e = m em K m e + m K m K m e m e (13) E n = Z2 n Ry* mit Ry* = µ e e ev. (14) 2 (4πɛ 0 ) Obige Formeln gelten nur für Elektronen. Für eine andere Teilchensorte müssen die Bohrradien und die Rydbergenergie aufgrund der veränderten reduzierten Masse modifiziert werden. 4
7 Für die radiale Aufenthaltswahrscheinlichkeit (d.h. die Wahrscheinlichkeit, dass das Teilchen sich in einer Kugel mit Radius R befindet) gilt P nl (R) = ˆR 0 dr r 2 R nl (r) 2. (15) 3 Rotation und Schwingung von zweiatomigen Molekülen Bei der Beschreibung der Energiezustände von Molekülen, müssen abgesehen von der elektrischen Wechselwirkung, auch die Freiheitsgrade des Moleküls berücksichtigt werden, welche Rotation und Schwingung ermöglichen. Beide Möglichkeiten werden hierbei zunächst einzeln behandelt und danach linear addiert. 3.1 Der starre Rotator Klassisch betrachtet kann ein zweiatomiges Molekül mit den Atommassen M 1 und M 2 um eine Achse durch den Schwerpunkt S rotieren (s. Abb. 2). Seine Rotationsenergie bei einer Winkelgeschwindigkeit ω ist dann wobei E rot = 1 2 Iω2 = J 2 2I, (16) I = M 1 R M 2 R 2 2 = MR 2 mit M = M 1M 2 M 1 + M 2 (17) das Trägheitsmoment des Moleküls bezüglich seiner Rotationsachse und J = Iω sein Drehimpulsbetrag ist. Abb. 2: Zweiatomiges Molekül als starrer Rotator. 5
8 Wendet man die Born-Oppenheimer-Näherung für die quantenmechanische Beschreibung der Bewegung von Kernen und Elektronen an, so erhält man letztendlich ein Äquivalent zur Schrödingergleichung für das Wasserstoffatom und findet, dass die Rotationsenergie auch quantisiert ist, bzw. dass J 2 = J(J + 1) 2 gilt. Charakterisiert wird die Rotationsenergie E rot also durch J = 0, 1, 2,... und man erhält E rot = J(J + 1) 2. (18) 2MRe 2 Dabei ist R e der Gleichgewichtsabstand des Moleküls. Für die spektralen Übergänge zwischen den Rotationsniveaus erhält man dann E rot = E rot (J + 1) E rot (J) = (J + 1) 2 /I. (19) Der Abstand der Niveaus nimmt also linear mit J zu. In der Spektroskopie werden meist die Termwerte F (J) = E(J)/(hc) der Energieniveaus in der Einheit cm 1 angegeben. Man erhält dann mit der Rotationskonstanten F rot (J) = J(J + 1) 2 2hcMR 2 e = B e J(J + 1) (20) B e =, 4πcMRe 2 (21) die durch die reduzierte Masse M und den Gleichgewichtsabstand R e zwischen den Atomkernen bestimmt ist. Elektromagnetische Wellen können auch hier wieder Übergänge zwischen den verschiedenen Rotationsniveaus induzieren, allerdings sind hier folgende Dinge zu beachten: 1. Die Auswahlregel für die Übergänge lautet J = ±1. 2. Nur Moleküle mit einem permanenten Dipolmoment können Strahlung auf reinen Rotationsübergängen absorbieren. 3.2 Schwingung zweiatomiger Moleküle Stellt man sich ein zweiatomigen Molekül als zwei Atome vor, die mit einer Feder verbunden sind, so liegt bei einer Schwingung der beiden Atome klassischerweise ein parabelförmiges Potential vor. Wendet man dieses auf Moleküle mit J = 0, also auf nichtrotierende Moleküle, an so findet man die schon bekannten Energieniveaus des quantenmechanischen harmonischen Oszillators: 6
9 ( E(ν) = ν + 1 ) ω 0. (22) 2 Dabei hängt die Frequenz ω 0 = k/m von der Federkonstanten k im Parabelpotential E pot (R) = 1 2 k(r R 0) 2 und von der reduzierten Masse M der beiden schwingenden Atome ab. Auch hier gilt für Übergänge ν = ±1. Auffällig ist hierbei, dass benachbarte Energieniveaus offenbar immer die gleichen Abstände zueinander haben. Problematisch ist allerdings, dass die Näherung mittels des harmonischen Oszillators allgemein eher schlecht ausfällt. Abhilfe schafft hier das Morse-Potential E pot (R) = D e [ 1 e a(r R e) ] 2 (23) mit der Dissoziationsenergie D e, welches für R > R e eine sehr gute Näherung ergibt. 3.3 Kombinierte Anregungen Da im Allgemeinen E ν E rot gilt (die Rotationsenergien liegen im Bereich von einigen mev, die Vibrationsenergien im Bereich von einigen Hundert mev), entkoppeln beide Anregungsformen in guter Näherung zu E ν,rot = E ν + E rot = (ν ) ω 0 + J(J + 1) 2 2I. (24) Die Regeln zu den möglichen Übergängen bleiben hierbei erhalten. 7
z n z m e 2 WW-Kern-Kern H = H k + H e + H ek
 2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
Ferienkurs Experimentalphysik 4
 Ferienkurs Experimentalphysik 4 Probeklausur Markus Perner, Markus Kotulla, Jonas Funke Aufgabe 1 (Allgemeine Fragen). : (a) Welche Relation muss ein Operator erfüllen damit die dazugehörige Observable
Ferienkurs Experimentalphysik 4 Probeklausur Markus Perner, Markus Kotulla, Jonas Funke Aufgabe 1 (Allgemeine Fragen). : (a) Welche Relation muss ein Operator erfüllen damit die dazugehörige Observable
Einführung in die Schwingungsspektroskopie
 Einführung in die Schwingungsspektroskopie Quelle: Frederik Uibel und Andreas Maurer, Uni Tübingen 2004 Molekülbewegungen Translation: Rotation: Die Bewegung des gesamten Moleküls ls in die drei Raumrichtungen.
Einführung in die Schwingungsspektroskopie Quelle: Frederik Uibel und Andreas Maurer, Uni Tübingen 2004 Molekülbewegungen Translation: Rotation: Die Bewegung des gesamten Moleküls ls in die drei Raumrichtungen.
Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten oder in Festkörpern vor.
 phys4.025 Page 1 13. Moleküle Nur eine kleine Anzahl von Elementen kommt natürlich in Form von einzelnen Atomen vor. Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten
phys4.025 Page 1 13. Moleküle Nur eine kleine Anzahl von Elementen kommt natürlich in Form von einzelnen Atomen vor. Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten
5. Elektronen- und Rotations- Spektren von Molekülen
 5. Elektronen- und Rotations- Spektren von Molekülen Absorptionsspektren Optische Dichte Elektronischer Übergang S 0 S von Benzol: In der Gasphase: Rotations-Schwingungsstruktur Im Kristall: Spektrale
5. Elektronen- und Rotations- Spektren von Molekülen Absorptionsspektren Optische Dichte Elektronischer Übergang S 0 S von Benzol: In der Gasphase: Rotations-Schwingungsstruktur Im Kristall: Spektrale
Atommodell. Atommodell nach Bohr und Sommerfeld Für sein neues Atommodell stellte Bohr folgende Postulate auf:
 Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Elemente der Quantenmechanik III 9.1. Schrödingergleichung mit beliebigem Potential 9.2. Harmonischer Oszillator 9.3. Drehimpulsoperator
 VL 8 VL8. VL9. VL10. Das Wasserstoffatom in der klass. Mechanik 8.1. Emissions- und Absorptionsspektren der Atome 8.2. Quantelung der Energie (Frank-Hertz Versuch) 8.3. Bohrsches Atommodell 8.4. Spektren
VL 8 VL8. VL9. VL10. Das Wasserstoffatom in der klass. Mechanik 8.1. Emissions- und Absorptionsspektren der Atome 8.2. Quantelung der Energie (Frank-Hertz Versuch) 8.3. Bohrsches Atommodell 8.4. Spektren
Physik für Maschinenbau. Prof. Dr. Stefan Schael RWTH Aachen
 Physik für Maschinenbau Prof. Dr. Stefan Schael RWTH Aachen Vorlesung 11 Brechung b α a 1 d 1 x α b x β d 2 a 2 β Totalreflexion Glasfaserkabel sin 1 n 2 sin 2 n 1 c arcsin n 2 n 1 1.0 arcsin
Physik für Maschinenbau Prof. Dr. Stefan Schael RWTH Aachen Vorlesung 11 Brechung b α a 1 d 1 x α b x β d 2 a 2 β Totalreflexion Glasfaserkabel sin 1 n 2 sin 2 n 1 c arcsin n 2 n 1 1.0 arcsin
(2.65 ev), da sich die beiden Elektronen gegenseitig abstossen.
 phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
Das quantenmechanische Atommodell
 Ende 93 konzipierte de Broglie seine grundlegenden Ideen über die Dualität von Welle und Korpuskel. Albert Einstein hatte schon 905 von den korpuskularen Eigenschaften des Lichtes gesprochen; de Broglie
Ende 93 konzipierte de Broglie seine grundlegenden Ideen über die Dualität von Welle und Korpuskel. Albert Einstein hatte schon 905 von den korpuskularen Eigenschaften des Lichtes gesprochen; de Broglie
Grundlagen der Quantentheorie
 Grundlagen der Quantentheorie Ein Schwarzer Körper (Schwarzer Strahler, planckscher Strahler, idealer schwarzer Körper) ist eine idealisierte thermische Strahlungsquelle: Alle auftreffende elektromagnetische
Grundlagen der Quantentheorie Ein Schwarzer Körper (Schwarzer Strahler, planckscher Strahler, idealer schwarzer Körper) ist eine idealisierte thermische Strahlungsquelle: Alle auftreffende elektromagnetische
Aufbau von Atomen. Atommodelle Spektrum des Wasserstoffs Quantenzahlen Orbitalbesetzung Periodensystem
 Aufbau von Atomen Atommodelle Spektrum des Wasserstoffs Quantenzahlen Orbitalbesetzung Periodensystem Wiederholung Im Kern: Protonen + Neutronen In der Hülle: Elektronen Rutherfords Streuversuch (90) Goldatome
Aufbau von Atomen Atommodelle Spektrum des Wasserstoffs Quantenzahlen Orbitalbesetzung Periodensystem Wiederholung Im Kern: Protonen + Neutronen In der Hülle: Elektronen Rutherfords Streuversuch (90) Goldatome
FERIENKURS EXPERIMENTALPHYSIK 4
 FERIENKURS EXPERIMENTALPHYSIK 4 Musterlösung 3 - Mehrelektronensysteme Hannah Schamoni 1 Hundsche Regeln Ein Atom habe die Elektronenkonfiguration Ne3s 3p 6 3d 6 4s. Leite nach den Hundschen Regeln die
FERIENKURS EXPERIMENTALPHYSIK 4 Musterlösung 3 - Mehrelektronensysteme Hannah Schamoni 1 Hundsche Regeln Ein Atom habe die Elektronenkonfiguration Ne3s 3p 6 3d 6 4s. Leite nach den Hundschen Regeln die
Ferienkurs Experimentalphysik Probeklausur - Musterlösung
 Ferienkurs Experimentalphysik 4 2010 Probeklausur - Musterlösung 1 Allgemeine Fragen a) Welche Relation muss ein Operator erfüllen damit die dazugehörige Observable eine Erhaltungsgröße darstellt? b) Was
Ferienkurs Experimentalphysik 4 2010 Probeklausur - Musterlösung 1 Allgemeine Fragen a) Welche Relation muss ein Operator erfüllen damit die dazugehörige Observable eine Erhaltungsgröße darstellt? b) Was
Atome - Moleküle - Kerne
 Atome - Moleküle - Kerne Band I Atomphysik Von Univ.-Professor Dr. Gerd Otter und Akad.-Direktor Dr. Raimund Honecker III. Physikalisches Institut der Rheinisch-Westfälischen Technischen Hochschule Aachen
Atome - Moleküle - Kerne Band I Atomphysik Von Univ.-Professor Dr. Gerd Otter und Akad.-Direktor Dr. Raimund Honecker III. Physikalisches Institut der Rheinisch-Westfälischen Technischen Hochschule Aachen
FERIENKURS EXPERIMENTALPHYSIK 4. Mehrelektronensysteme
 FERIENKURS EXPERIMENTALPHYSIK 4 Vorlesung 3 am 04.09.2013 Mehrelektronensysteme Hannah Schamoni, Susanne Goerke Inhaltsverzeichnis 1 Das Helium-Atom 2 1.1 Grundlagen und Ortswellenfunktion........................
FERIENKURS EXPERIMENTALPHYSIK 4 Vorlesung 3 am 04.09.2013 Mehrelektronensysteme Hannah Schamoni, Susanne Goerke Inhaltsverzeichnis 1 Das Helium-Atom 2 1.1 Grundlagen und Ortswellenfunktion........................
2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten
 Inhalt: 1. Regeln und Normen Modul: Allgemeine Chemie 2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten 3.Bausteine der Materie Atomkern: Elementarteilchen, Kernkräfte,
Inhalt: 1. Regeln und Normen Modul: Allgemeine Chemie 2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten 3.Bausteine der Materie Atomkern: Elementarteilchen, Kernkräfte,
Klausur zum Modul PC-3-P - Matrie und Strahlung
 Klausur zum Modul PC-3-P - Matrie und Strahlung Nils Bartels 8. September 008 Formaldehyd 1 Spektroskopischer Nachweis von Formaldehyd in der Raumluft 1.1 Rotationsspektrum Die übergeordnete Auswahlregel
Klausur zum Modul PC-3-P - Matrie und Strahlung Nils Bartels 8. September 008 Formaldehyd 1 Spektroskopischer Nachweis von Formaldehyd in der Raumluft 1.1 Rotationsspektrum Die übergeordnete Auswahlregel
c = Ausbreitungsgeschwindigkeit (2, m/s) λ = Wellenlänge (m) ν = Frequenz (Hz, s -1 )
 2.3 Struktur der Elektronenhülle Elektromagnetische Strahlung c = λ ν c = Ausbreitungsgeschwindigkeit (2,9979 10 8 m/s) λ = Wellenlänge (m) ν = Frequenz (Hz, s -1 ) Quantentheorie (Max Planck, 1900) Die
2.3 Struktur der Elektronenhülle Elektromagnetische Strahlung c = λ ν c = Ausbreitungsgeschwindigkeit (2,9979 10 8 m/s) λ = Wellenlänge (m) ν = Frequenz (Hz, s -1 ) Quantentheorie (Max Planck, 1900) Die
PHYSIK. Studienbrief Moleküle. AUTOR: Dr. Johannes Bernardi
 PHYSIK AUTOR: Dr. Johannes Bernardi Inhalt: 1 Einführung...3 2 Ionenbindung (heteropolare Bindung): A + B...4 3 Kovalente Bindung (chemische Bindung): AB...6 4 Van der Waals Bindung...7 5 Wasserstoffbindung...8
PHYSIK AUTOR: Dr. Johannes Bernardi Inhalt: 1 Einführung...3 2 Ionenbindung (heteropolare Bindung): A + B...4 3 Kovalente Bindung (chemische Bindung): AB...6 4 Van der Waals Bindung...7 5 Wasserstoffbindung...8
Molekülphysik. Theoretische Grundlagen und experimentelle Methoden Von Wolfgang Demtröder. Oldenbourg Verlag München Wien
 Molekülphysik Theoretische Grundlagen und experimentelle Methoden Von Wolfgang Demtröder Oldenbourg Verlag München Wien Vorwort XI 1 1.1 1.2 1.3 1.4 2 2.1 2.2 2.3 2.4 2.5 2.6 2.7 Einleitung 1 Kurzer historischer
Molekülphysik Theoretische Grundlagen und experimentelle Methoden Von Wolfgang Demtröder Oldenbourg Verlag München Wien Vorwort XI 1 1.1 1.2 1.3 1.4 2 2.1 2.2 2.3 2.4 2.5 2.6 2.7 Einleitung 1 Kurzer historischer
2 Spektroskopie. 2.1 Einleitung
 2.1 Einleitung Mikrowellen-Spektroskopie ist ein Teil der Molekular-Spektroskopie, welche die Wechselwirkung von elektromagnetischer Strahlung mit Materie untersucht. Ein Ziel der Spektroskopie ist es
2.1 Einleitung Mikrowellen-Spektroskopie ist ein Teil der Molekular-Spektroskopie, welche die Wechselwirkung von elektromagnetischer Strahlung mit Materie untersucht. Ein Ziel der Spektroskopie ist es
Abb.15: Experiment zum Rutherford-Modell
 6.Kapitel Atommodelle 6.1 Lernziele Sie kennen die Entwicklung der Atommodelle bis zum linearen Potentialtopf. Sie kennen die Bohrschen Postulate und können sie auch anwenden. Sie wissen, wie man bestimmte
6.Kapitel Atommodelle 6.1 Lernziele Sie kennen die Entwicklung der Atommodelle bis zum linearen Potentialtopf. Sie kennen die Bohrschen Postulate und können sie auch anwenden. Sie wissen, wie man bestimmte
3. Geben Sie ein Bespiel, wie man Bra und Ket Notation nützen kann.
 Fragen zur Vorlesung Einführung in die Physik 3 1. Was ist ein quantenmechanischer Zustand? 2. Wenn die Messung eines quantenmechanischen Systems N unterscheidbare Ereignisse liefern kann, wie viele Parameter
Fragen zur Vorlesung Einführung in die Physik 3 1. Was ist ein quantenmechanischer Zustand? 2. Wenn die Messung eines quantenmechanischen Systems N unterscheidbare Ereignisse liefern kann, wie viele Parameter
Der Gesamtbahndrehimpuls ist eine Erhaltungsgrösse (genau wie in der klassischen Mechanik).
 phys4.017 Page 1 10.4.2 Bahndrehimpuls des Elektrons: Einheit des Drehimpuls: Der Bahndrehimpuls des Elektrons ist quantisiert. Der Gesamtbahndrehimpuls ist eine Erhaltungsgrösse (genau wie in der klassischen
phys4.017 Page 1 10.4.2 Bahndrehimpuls des Elektrons: Einheit des Drehimpuls: Der Bahndrehimpuls des Elektrons ist quantisiert. Der Gesamtbahndrehimpuls ist eine Erhaltungsgrösse (genau wie in der klassischen
Dr. Jan Friedrich Nr
 Übungen zu Experimentalphysik 4 - Lösungsvorschläge Prof. S. Paul Sommersemester 2005 Dr. Jan Friedrich Nr. 7 06.06.2005 Email Jan.Friedrich@ph.tum.de Telefon 089/289-2586 Physik Department E8, Raum 3564
Übungen zu Experimentalphysik 4 - Lösungsvorschläge Prof. S. Paul Sommersemester 2005 Dr. Jan Friedrich Nr. 7 06.06.2005 Email Jan.Friedrich@ph.tum.de Telefon 089/289-2586 Physik Department E8, Raum 3564
Für Geowissenschaftler. EP WS 2009/10 Dünnweber/Faessler
 Für Geowissenschaftler Termin Nachholklausur Vorschlag Mittwoch 14.4.10 25. Vorlesung EP V. STRAHLUNG, ATOME, KERNE 27. Wärmestrahlung und Quantenmechanik Photometrie Plancksches Strahlungsgesetze, Welle/Teilchen
Für Geowissenschaftler Termin Nachholklausur Vorschlag Mittwoch 14.4.10 25. Vorlesung EP V. STRAHLUNG, ATOME, KERNE 27. Wärmestrahlung und Quantenmechanik Photometrie Plancksches Strahlungsgesetze, Welle/Teilchen
Übungsblatt 02. PHYS4100 Grundkurs IV (Physik, Wirtschaftsphysik, Physik Lehramt) Othmar Marti,
 Übungsblatt 2 PHYS4 Grundkurs IV (Physik, Wirtschaftsphysik, Physik Lehramt) Othmar Marti, (othmar.marti@physik.uni-ulm.de) 2. 4. 25 22. 4. 25 Aufgaben. Das Plancksche Strahlungsgesetz als Funktion der
Übungsblatt 2 PHYS4 Grundkurs IV (Physik, Wirtschaftsphysik, Physik Lehramt) Othmar Marti, (othmar.marti@physik.uni-ulm.de) 2. 4. 25 22. 4. 25 Aufgaben. Das Plancksche Strahlungsgesetz als Funktion der
Aufgaben zum Wasserstoffatom
 Aufgaben zum Wasserstoffatom Hans M. Strauch Kurfürst-Ruprecht-Gymnasium Neustadt/W. Aufgabenarten Darstellung von Zusammenhängen, Abgrenzung von Unterschieden (können u.u. recht offen sein) Beantwortung
Aufgaben zum Wasserstoffatom Hans M. Strauch Kurfürst-Ruprecht-Gymnasium Neustadt/W. Aufgabenarten Darstellung von Zusammenhängen, Abgrenzung von Unterschieden (können u.u. recht offen sein) Beantwortung
Ferienkurs Experimentalphysik 4 - SS 2008
 Physik Departement Technische Universität München Karsten Donnay (kdonnay@ph.tum.de) Musterlösung latt 3 Ferienkurs Experimentalphysik - SS 28 1 Verständnisfragen (a) Was ist eine gute Quantenzahl? Was
Physik Departement Technische Universität München Karsten Donnay (kdonnay@ph.tum.de) Musterlösung latt 3 Ferienkurs Experimentalphysik - SS 28 1 Verständnisfragen (a) Was ist eine gute Quantenzahl? Was
Experimentelle Physik II
 Experimentelle Physik II Sommersemester 08 Vladimir Dyakonov (Lehrstuhl Experimentelle Physik VI) VL#8 07-05-2008 Tel. 0931/888 3111 dyakonov@physik.uni-wuerzburg.de Experimentelle Physik II 2. Rotationen
Experimentelle Physik II Sommersemester 08 Vladimir Dyakonov (Lehrstuhl Experimentelle Physik VI) VL#8 07-05-2008 Tel. 0931/888 3111 dyakonov@physik.uni-wuerzburg.de Experimentelle Physik II 2. Rotationen
Strukturaufklärung (BSc-Chemie): Einführung
 Strukturaufklärung (BSc-Chemie): Einführung Prof. S. Grimme OC [TC] 13.10.2009 Prof. S. Grimme (OC [TC]) Strukturaufklärung (BSc-Chemie): Einführung 13.10.2009 1 / 25 Teil I Einführung Prof. S. Grimme
Strukturaufklärung (BSc-Chemie): Einführung Prof. S. Grimme OC [TC] 13.10.2009 Prof. S. Grimme (OC [TC]) Strukturaufklärung (BSc-Chemie): Einführung 13.10.2009 1 / 25 Teil I Einführung Prof. S. Grimme
Ferienkurs Experimentalphysik 4
 Ferienkurs Experimentalphysik 4 Vorlesung 5 Quantenstatistik Florian Lippert & Andreas Trautner 31.08.2012 Inhaltsverzeichnis 1 Quantenstatistik 1 1.1 Vorüberlegungen............................... 1 1.2
Ferienkurs Experimentalphysik 4 Vorlesung 5 Quantenstatistik Florian Lippert & Andreas Trautner 31.08.2012 Inhaltsverzeichnis 1 Quantenstatistik 1 1.1 Vorüberlegungen............................... 1 1.2
Absorption und Emission
 Absorption und Emission Wir wiederholen aus V4 die Anwendung der Bose-Statistik auf ein Photonengas und berücksichtigen nun eine mögliche entartung der Zustände. Diese äußert sich im statistischen Gewicht
Absorption und Emission Wir wiederholen aus V4 die Anwendung der Bose-Statistik auf ein Photonengas und berücksichtigen nun eine mögliche entartung der Zustände. Diese äußert sich im statistischen Gewicht
Entwicklung der Atommodelle
 Entwicklung der Atommodelle Entwicklung der Atommodelle Demokrit 460 v Chr. Nur scheinbar hat ein Ding eine Farbe, nur scheinbar ist es süß oder bitter; in Wirklichkeit gibt es nur Atome im leeren Raum.
Entwicklung der Atommodelle Entwicklung der Atommodelle Demokrit 460 v Chr. Nur scheinbar hat ein Ding eine Farbe, nur scheinbar ist es süß oder bitter; in Wirklichkeit gibt es nur Atome im leeren Raum.
8.3 Die Quantenmechanik des Wasserstoffatoms
 Dieter Suter - 409 - Physik B3 8.3 Die Quantenmechanik des Wasserstoffatoms 8.3.1 Grundlagen, Hamiltonoperator Das Wasserstoffatom besteht aus einem Proton (Ladung +e) und einem Elektron (Ladung e). Der
Dieter Suter - 409 - Physik B3 8.3 Die Quantenmechanik des Wasserstoffatoms 8.3.1 Grundlagen, Hamiltonoperator Das Wasserstoffatom besteht aus einem Proton (Ladung +e) und einem Elektron (Ladung e). Der
Feynman Vorlesungen über Physik
 Feynman Vorlesungen über Physik Band llhouantenmechanik. Definitive Edition von Richard R Feynman, Robert B. Leighton und Matthew Sands 5., verbesserte Auflage Mit 192 Bildern und 22Tabellen Oldenbourg
Feynman Vorlesungen über Physik Band llhouantenmechanik. Definitive Edition von Richard R Feynman, Robert B. Leighton und Matthew Sands 5., verbesserte Auflage Mit 192 Bildern und 22Tabellen Oldenbourg
A. Mechanik (18 Punkte)
 Prof. Dr. A. Hese Prof. Dr. G. v. Oppen Dipl.-Phys. G. Hoheisel Dipl.-Phys. R. Jung Technische Universität Berlin Name: Vorname: Matr. Nr.: Fachbereich: Platz Nr.: Tutor: A. Mechanik (18 Punkte) 1. Wie
Prof. Dr. A. Hese Prof. Dr. G. v. Oppen Dipl.-Phys. G. Hoheisel Dipl.-Phys. R. Jung Technische Universität Berlin Name: Vorname: Matr. Nr.: Fachbereich: Platz Nr.: Tutor: A. Mechanik (18 Punkte) 1. Wie
Experimentalphysik II Elektromagnetische Schwingungen und Wellen
 Experimentalphysik II Elektromagnetische Schwingungen und Wellen Ferienkurs Sommersemester 2009 Martina Stadlmeier 10.09.2009 Inhaltsverzeichnis 1 Elektromagnetische Schwingungen 2 1.1 Energieumwandlung
Experimentalphysik II Elektromagnetische Schwingungen und Wellen Ferienkurs Sommersemester 2009 Martina Stadlmeier 10.09.2009 Inhaltsverzeichnis 1 Elektromagnetische Schwingungen 2 1.1 Energieumwandlung
Ferienkurs Quantenmechanik I WKB-Näherung und Störungstheorie
 Ferienkurs Quantenmechanik I WKB-Näherung und Störungstheorie Sebastian Wild Freitag, 6.. Inhaltsverzeichnis Die WKB-Näherung. Grundlegendes............................. Tunnelwahrscheinlichkeit.......................
Ferienkurs Quantenmechanik I WKB-Näherung und Störungstheorie Sebastian Wild Freitag, 6.. Inhaltsverzeichnis Die WKB-Näherung. Grundlegendes............................. Tunnelwahrscheinlichkeit.......................
Rotationsspektren von Molekülen
 CO 1 Rotationsspektren von Molekülen Bisher haben wir uns ein punkt- oder kugelförmiges Teilchen angeschaut, Moleküle können aber vielfältige Formen (Symmetrien) haben Um die Eigenschaften eines Moleküls
CO 1 Rotationsspektren von Molekülen Bisher haben wir uns ein punkt- oder kugelförmiges Teilchen angeschaut, Moleküle können aber vielfältige Formen (Symmetrien) haben Um die Eigenschaften eines Moleküls
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Das (wellen-) quantenchemische Atommodell Orbitalmodell Beschreibung atomarer Teilchen (Elektronen) durch Wellenfunktionen, Wellen, Wellenlänge, Frequenz, Amplitude,
Wiederholung der letzten Vorlesungsstunde: Das (wellen-) quantenchemische Atommodell Orbitalmodell Beschreibung atomarer Teilchen (Elektronen) durch Wellenfunktionen, Wellen, Wellenlänge, Frequenz, Amplitude,
10 Teilchen und Wellen. 10.1 Strahlung schwarzer Körper
 10 Teilchen und Wellen Teilchen: m, V, p, r, E, lokalisierbar Wellen: l, f, p, E, unendlich ausgedehnt (harmonische Welle) Unterscheidung: Wellen interferieren 10.1 Strahlung schwarzer Körper JEDER Körper
10 Teilchen und Wellen Teilchen: m, V, p, r, E, lokalisierbar Wellen: l, f, p, E, unendlich ausgedehnt (harmonische Welle) Unterscheidung: Wellen interferieren 10.1 Strahlung schwarzer Körper JEDER Körper
Teil 1 Schwingungsspektroskopie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17
 Teil 1 Schwingungsspektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality Themenüberblick Schwingungsspektroskopie Physikalische Grundlagen: Mechanisches Bild
Teil 1 Schwingungsspektroskopie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality Themenüberblick Schwingungsspektroskopie Physikalische Grundlagen: Mechanisches Bild
Ferienkurs Experimentalphysik Probeklausur - Musterlösung
 Ferienkurs Experimentalphysik 4 010 Probeklausur - Musterlösung 1 Allgemeine Fragen a) Welche Relation muss ein Operator erfüllen damit die dazugehörige Observable eine Erhaltungsgröße darstellt? b) Was
Ferienkurs Experimentalphysik 4 010 Probeklausur - Musterlösung 1 Allgemeine Fragen a) Welche Relation muss ein Operator erfüllen damit die dazugehörige Observable eine Erhaltungsgröße darstellt? b) Was
Atommodell führte Rutherford den nach ihm benannten Streuversuch durch. Dabei bestrahlte er eine dünne Goldfolie mit α Teilchen.
 Atommodell nach Rutherford 1911 führte Rutherford den nach ihm benannten Streuversuch durch. Dabei bestrahlte er eine dünne Goldfolie mit α Teilchen. Beobachtung: Fast alle Teilchen fliegen ungestört durch.
Atommodell nach Rutherford 1911 führte Rutherford den nach ihm benannten Streuversuch durch. Dabei bestrahlte er eine dünne Goldfolie mit α Teilchen. Beobachtung: Fast alle Teilchen fliegen ungestört durch.
10.7 Moderne Atommodelle
 10.7 Moderne Atommodelle Zu Beginn des 20. Jahrhunderts entwickelte Niels Bohr sein berühmtes Bohrsches Atommodell. Mit diesem Modell konnten die Atomhüllen von einfachen Atomen wie dem Wasserstoffatom
10.7 Moderne Atommodelle Zu Beginn des 20. Jahrhunderts entwickelte Niels Bohr sein berühmtes Bohrsches Atommodell. Mit diesem Modell konnten die Atomhüllen von einfachen Atomen wie dem Wasserstoffatom
Wärmestrahlung. Einfallende Strahlung = absorbierte Strahlung + reflektierte Strahlung
 Wärmestrahlung Gleichheit von Absorptions- und Emissionsgrad Zwei Flächen auf gleicher Temperatur T 1 stehen sich gegenüber. dunkelgrau hellgrau Der Wärmefluss durch Strahlung muss in beiden Richtungen
Wärmestrahlung Gleichheit von Absorptions- und Emissionsgrad Zwei Flächen auf gleicher Temperatur T 1 stehen sich gegenüber. dunkelgrau hellgrau Der Wärmefluss durch Strahlung muss in beiden Richtungen
10. Der Spin des Elektrons
 10. Elektronspin Page 1 10. Der Spin des Elektrons Beobachtung: Aufspaltung von Spektrallinien in nahe beieinander liegende Doppellinien z.b. die erste Linie der Balmer-Serie (n=3 -> n=2) des Wasserstoff-Atoms
10. Elektronspin Page 1 10. Der Spin des Elektrons Beobachtung: Aufspaltung von Spektrallinien in nahe beieinander liegende Doppellinien z.b. die erste Linie der Balmer-Serie (n=3 -> n=2) des Wasserstoff-Atoms
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde. Sommersemester VL #42 am
 Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 2007 VL #42 am 11.07.2007 Vladimir Dyakonov Resonanz Damit vom Sender effektiv Energie abgestrahlt werden
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 2007 VL #42 am 11.07.2007 Vladimir Dyakonov Resonanz Damit vom Sender effektiv Energie abgestrahlt werden
8 Das Bohrsche Atommodell. 8. Das Bohrsche Atommodell
 1. Einführung 1.1. Quantenmechanik versus klassische Theorien 1.2. Historischer Rückblick 2. Kann man Atome sehen? Größe des Atoms 3. Weitere Eigenschaften von Atomen: Masse, Isotopie 4. Atomkern und Hülle:
1. Einführung 1.1. Quantenmechanik versus klassische Theorien 1.2. Historischer Rückblick 2. Kann man Atome sehen? Größe des Atoms 3. Weitere Eigenschaften von Atomen: Masse, Isotopie 4. Atomkern und Hülle:
r r : Abstand der Kerne
 Skript zur 10. Vorlesung Quantenmechanik, Freitag den 0. Mai, 011. 7.6 Anwendung Kernschwingungen in einem zweiatomigen Molekül. V ( r ) r 0 V 0 h ω 1 h ω r r : Abstand der Kerne Für Schwingungen kleiner
Skript zur 10. Vorlesung Quantenmechanik, Freitag den 0. Mai, 011. 7.6 Anwendung Kernschwingungen in einem zweiatomigen Molekül. V ( r ) r 0 V 0 h ω 1 h ω r r : Abstand der Kerne Für Schwingungen kleiner
Eigenschaften des Photons
 Eigenschaften des Photons Das Photon ist das Energiequant der elektromagnetischen Wellen, d.h. Licht hat wie von Einstein postuliert nicht nur Wellencharakter, sondern auch Teilchencharakter mit den oben
Eigenschaften des Photons Das Photon ist das Energiequant der elektromagnetischen Wellen, d.h. Licht hat wie von Einstein postuliert nicht nur Wellencharakter, sondern auch Teilchencharakter mit den oben
a) Zählen Sie alle Symmetrieelemente dieser Moleküle auf und geben Sie ihre Punktgruppe an! (5 Punkte)
 . Aufgabe Die folgenden Aufgaben beziehen sich auf die Moleküle: H H H H Sn Br C N H Pyridin, Z-Dichlorethen, Sn 4, CHBr und E-Dichlorethen. a) Zählen Sie alle Symmetrieelemente dieser Moleküle auf und
. Aufgabe Die folgenden Aufgaben beziehen sich auf die Moleküle: H H H H Sn Br C N H Pyridin, Z-Dichlorethen, Sn 4, CHBr und E-Dichlorethen. a) Zählen Sie alle Symmetrieelemente dieser Moleküle auf und
Übungen Physik VI (Kerne und Teilchen) Sommersemester 2010
 Übungen Physik VI (Kerne und Teilchen) Sommersemester 21 Übungsblatt Nr. 3 Bearbeitung bis 6.5.21 Aufgabe 1: Neutronensterne Im Allgemeinen kann man annehmen, dass die Dichte in Zentrum von Neutronensternen
Übungen Physik VI (Kerne und Teilchen) Sommersemester 21 Übungsblatt Nr. 3 Bearbeitung bis 6.5.21 Aufgabe 1: Neutronensterne Im Allgemeinen kann man annehmen, dass die Dichte in Zentrum von Neutronensternen
Einführung in die Quantentheorie der Atome und Photonen
 Einführung in die Quantentheorie der Atome und Photonen 23.04.2005 Jörg Evers Max-Planck-Institut für Kernphysik, Heidelberg Quantenmechanik Was ist das eigentlich? Physikalische Theorie Hauptsächlich
Einführung in die Quantentheorie der Atome und Photonen 23.04.2005 Jörg Evers Max-Planck-Institut für Kernphysik, Heidelberg Quantenmechanik Was ist das eigentlich? Physikalische Theorie Hauptsächlich
2 Spektroskopie. 2.1 Einleitung
 2.1 Einleitung Mikrowellen-Spektroskopie ist ein Teil der Molekular-Spektroskopie, welche die Wechselwirkung von elektromagnetischer Strahlung mit Materie untersucht. Ein Ziel der Spektroskopie ist es
2.1 Einleitung Mikrowellen-Spektroskopie ist ein Teil der Molekular-Spektroskopie, welche die Wechselwirkung von elektromagnetischer Strahlung mit Materie untersucht. Ein Ziel der Spektroskopie ist es
Physikalisches Praktikum A 5 Balmer-Spektrum
 Physikalisches Praktikum A 5 Balmer-Spektrum Versuchsziel Es wird das Balmer-Spektrum des Wasserstoffatoms vermessen und die Rydberg- Konstante bestimmt. Für He und Hg werden die Wellenlängen des sichtbaren
Physikalisches Praktikum A 5 Balmer-Spektrum Versuchsziel Es wird das Balmer-Spektrum des Wasserstoffatoms vermessen und die Rydberg- Konstante bestimmt. Für He und Hg werden die Wellenlängen des sichtbaren
Proseminar: Theoretische Physik. und Astroteilchenphysik. Fermi- und Bose Gase. Thermodynamisches Gleichgewicht
 Proseminar: Theoretische Physik und Astroteilchenphysik Thermodynamisches Gleichgewicht Fermi- und Bose Gase Inhalt 1. Entropie 2. 2ter Hauptsatz der Thermodynamik 3. Verteilungsfunktion 1. Bosonen und
Proseminar: Theoretische Physik und Astroteilchenphysik Thermodynamisches Gleichgewicht Fermi- und Bose Gase Inhalt 1. Entropie 2. 2ter Hauptsatz der Thermodynamik 3. Verteilungsfunktion 1. Bosonen und
Daltonsche Atomhypothese (1808)
 Daltonsche Atomhypothese (1808) Chemische Elemente bestehen aus kleinsten, chemisch nicht weiter zerlegbaren Teilchen, den Atomen. Alle Atome eines Elementes haben untereinander gleiche Masse, während
Daltonsche Atomhypothese (1808) Chemische Elemente bestehen aus kleinsten, chemisch nicht weiter zerlegbaren Teilchen, den Atomen. Alle Atome eines Elementes haben untereinander gleiche Masse, während
Theoretische Biophysikalische Chemie
 Theoretische Biophysikalische Chemie Thermochemie (und Schwingungsspektroskopie) Christoph Jacob DFG-CENTRUM FÜR FUNKTIONELLE NANOSTRUKTUREN 0 KIT 17.12.2012 Universität deschristoph Landes Baden-Württemberg
Theoretische Biophysikalische Chemie Thermochemie (und Schwingungsspektroskopie) Christoph Jacob DFG-CENTRUM FÜR FUNKTIONELLE NANOSTRUKTUREN 0 KIT 17.12.2012 Universität deschristoph Landes Baden-Württemberg
Thema heute: Aufbau der Materie: Das Bohr sche Atommodell
 Wiederholung der letzten Vorlesungsstunde: Erste Atommodelle, Dalton Thomson, Rutherford, Atombau, Coulomb-Gesetz, Proton, Elektron, Neutron, weitere Elementarteilchen, atomare Masseneinheit u, 118 bekannte
Wiederholung der letzten Vorlesungsstunde: Erste Atommodelle, Dalton Thomson, Rutherford, Atombau, Coulomb-Gesetz, Proton, Elektron, Neutron, weitere Elementarteilchen, atomare Masseneinheit u, 118 bekannte
Eigenschaften des Photons
 Eigenschaften des Photons Das Photon ist das Energiequant der elektromagnetischen Wellen, d.h. Licht hat wie von Einstein postuliert nicht nur Wellencharakter, sondern auch Teilchencharakter mit den oben
Eigenschaften des Photons Das Photon ist das Energiequant der elektromagnetischen Wellen, d.h. Licht hat wie von Einstein postuliert nicht nur Wellencharakter, sondern auch Teilchencharakter mit den oben
Klausur Bachelorstudiengang Prüfung Modul Physikalische Chemie und Thermodynamik. Teil 1: Physikalische Chemie
 Bachelorstudiengang / Diplomstudiengang CBI - Teil Physikalische Chemie - WS0809 - Blatt 1 / 16 Klausur Bachelorstudiengang Prüfung Modul Physikalische Chemie und Thermodynamik Teil 1: Physikalische Chemie
Bachelorstudiengang / Diplomstudiengang CBI - Teil Physikalische Chemie - WS0809 - Blatt 1 / 16 Klausur Bachelorstudiengang Prüfung Modul Physikalische Chemie und Thermodynamik Teil 1: Physikalische Chemie
2.1. Das Wasserstoffatom Atommodelle (vor 1900)
 2.1. Das Wasserstoffatom 2.1.1. Atommodelle (vor 1900) 105 2.1.2. Eigenzustände des Wasserstoffatoms Ein einfaches Beispiel: Wasserstoff in Wechselwirkung mit einem klassischen Feld. Eigenenergien wasserstoffähnlicher
2.1. Das Wasserstoffatom 2.1.1. Atommodelle (vor 1900) 105 2.1.2. Eigenzustände des Wasserstoffatoms Ein einfaches Beispiel: Wasserstoff in Wechselwirkung mit einem klassischen Feld. Eigenenergien wasserstoffähnlicher
Dieter Suter Physik B3
 Dieter Suter - 421 - Physik B3 9.2 Radioaktivität 9.2.1 Historisches, Grundlagen Die Radioaktivität wurde im Jahre 1896 entdeckt, als Becquerel feststellte, dass Uransalze Strahlen aussenden, welche den
Dieter Suter - 421 - Physik B3 9.2 Radioaktivität 9.2.1 Historisches, Grundlagen Die Radioaktivität wurde im Jahre 1896 entdeckt, als Becquerel feststellte, dass Uransalze Strahlen aussenden, welche den
Ferienkurs Experimentalphysik Lösung zur Übung 2
 Ferienkurs Experimentalphysik 4 01 Lösung zur Übung 1. Ermitteln Sie für l = 1 a) den Betrag des Drehimpulses L b) die möglichen Werte von m l c) Zeichnen Sie ein maßstabsgerechtes Vektordiagramm, aus
Ferienkurs Experimentalphysik 4 01 Lösung zur Übung 1. Ermitteln Sie für l = 1 a) den Betrag des Drehimpulses L b) die möglichen Werte von m l c) Zeichnen Sie ein maßstabsgerechtes Vektordiagramm, aus
1. Allgemeine Grundlagen Quantenmechanik
 1. Allgemeine Grundlagen 1.3. Quantenmechanik Klassische Mechanik vs Quantenmechanik Klassische (Newton sche) Mechanik klassischer harmonischer Oszillator Quantenmechanik quantenmechanischer harmonischer
1. Allgemeine Grundlagen 1.3. Quantenmechanik Klassische Mechanik vs Quantenmechanik Klassische (Newton sche) Mechanik klassischer harmonischer Oszillator Quantenmechanik quantenmechanischer harmonischer
9. Das Wasserstoff-Atom. 9.1 Das Spektrum des Wasserstoff-Atoms. im Bohr-Modell:
 09. Wasserstoff-Atom Page 1 9. Das Wasserstoff-Atom 9.1 Das Spektrum des Wasserstoff-Atoms im Bohr-Modell: Bohr-Modell liefert eine ordentliche erste Beschreibung der grundlegenden Eigenschaften des Spektrums
09. Wasserstoff-Atom Page 1 9. Das Wasserstoff-Atom 9.1 Das Spektrum des Wasserstoff-Atoms im Bohr-Modell: Bohr-Modell liefert eine ordentliche erste Beschreibung der grundlegenden Eigenschaften des Spektrums
Atome mit mehreren Elektronen
 Atome mit mehreren Elektronen In diesem Kapitel wollen wir uns in die reale Welt stürzen und Atome mit mehr als einem Elektron untersuchen. Schließlich besteht sie Welt nicht nur aus Wasserstoff. Die wesentlichen
Atome mit mehreren Elektronen In diesem Kapitel wollen wir uns in die reale Welt stürzen und Atome mit mehr als einem Elektron untersuchen. Schließlich besteht sie Welt nicht nur aus Wasserstoff. Die wesentlichen
c. Bestimme die Gesamtenergie der im Objekt gespeicherten elektromagnetischen Strahlung durch Aufsummieren der Energie der einzelnen Moden.
 phys4.05 Page 1 3.5.1 Der 1D schwarze Strahler: Objekt der Länge L und Durchmesser D
phys4.05 Page 1 3.5.1 Der 1D schwarze Strahler: Objekt der Länge L und Durchmesser D
B-Praktikum Rotationsspektroskopie
 B-Praktikum Rotationsspektroskopie Versuchsanleitung I. Physikalisches Institut, Universität zu Köln Betreuer: Kristina Jansen kjansen2@uni-koeln.de Inhaltsverzeichnis 1 Motivation 3 2 Vorbereitung 4 3
B-Praktikum Rotationsspektroskopie Versuchsanleitung I. Physikalisches Institut, Universität zu Köln Betreuer: Kristina Jansen kjansen2@uni-koeln.de Inhaltsverzeichnis 1 Motivation 3 2 Vorbereitung 4 3
Ferienkurs Experimentalphysik 4
 Ferienkurs Experimentalphysik 4 4. Vorlesung Mehrelektronensysteme Felix Bischoff, Christoph Kastl, Max v. Vopelius 27.08.2009 1 Atome mit mehreren Elektronen 1.1 Das Heliumatom Das Heliumatom besteht
Ferienkurs Experimentalphysik 4 4. Vorlesung Mehrelektronensysteme Felix Bischoff, Christoph Kastl, Max v. Vopelius 27.08.2009 1 Atome mit mehreren Elektronen 1.1 Das Heliumatom Das Heliumatom besteht
Experimentalphysik 2
 Ferienkurs Experimentalphysik 2 Sommer 2014 Vorlesung 4 Thema: Elektromagnetische Schwingungen, elektromagnetische Wellen und Spezielle Relativitätstheorie Technische Universität München 1 Fakultät für
Ferienkurs Experimentalphysik 2 Sommer 2014 Vorlesung 4 Thema: Elektromagnetische Schwingungen, elektromagnetische Wellen und Spezielle Relativitätstheorie Technische Universität München 1 Fakultät für
Quantenchemie WS 2008/2009 Zusammenfassung 1. Teil
 Quantenchemie WS 2008/2009 Zusammenfassung 1. Teil 1. Grundlagen der Quantenmechanik (a) Wellenfunktion: Die Wellenfunktion Ψ(x, t) beschreibt den quantenmechanischen Zustand eines Teilchens am Ort x zur
Quantenchemie WS 2008/2009 Zusammenfassung 1. Teil 1. Grundlagen der Quantenmechanik (a) Wellenfunktion: Die Wellenfunktion Ψ(x, t) beschreibt den quantenmechanischen Zustand eines Teilchens am Ort x zur
11. Vorlesung Wintersemester
 11. Vorlesung Wintersemester 1 Ableitungen vektorieller Felder Mit Resultat Skalar: die Divergenz diva = A = A + A y y + A z z (1) Mit Resultat Vektor: die Rotation (engl. curl): ( rota = A Az = y A y
11. Vorlesung Wintersemester 1 Ableitungen vektorieller Felder Mit Resultat Skalar: die Divergenz diva = A = A + A y y + A z z (1) Mit Resultat Vektor: die Rotation (engl. curl): ( rota = A Az = y A y
N.BORGHINI Version vom 20. November 2014, 21:56 Kernphysik
 II.4.4 b Kernspin und Parität angeregter Zustände Im Grundzustand besetzen die Nukleonen die niedrigsten Energieniveaus im Potentialtopf. Oberhalb liegen weitere Niveaus, auf welche die Nukleonen durch
II.4.4 b Kernspin und Parität angeregter Zustände Im Grundzustand besetzen die Nukleonen die niedrigsten Energieniveaus im Potentialtopf. Oberhalb liegen weitere Niveaus, auf welche die Nukleonen durch
Experimentalphysik 4 - SS11 Physik der Atome und Kerne
 Experimentalphysik 4 - SS Physik der Atome und Kerne Prof. Dr. Tilman Pfau 5. Physikalisches Institut Übungsblatt 06 Besprechung: 8. Juni Aufgabe : Koeffizient a C des Coulomb-Terms 4 Punkte In dieser
Experimentalphysik 4 - SS Physik der Atome und Kerne Prof. Dr. Tilman Pfau 5. Physikalisches Institut Übungsblatt 06 Besprechung: 8. Juni Aufgabe : Koeffizient a C des Coulomb-Terms 4 Punkte In dieser
Molekülphysik und Quantenchemie
 Hermann Haken Hans Christoph Wolf Molekülphysik und Quantenchemie Einführung in die experimentellen und theoretischen Grundlagen Mit 245 Abbildungen und 43 Tabellen Physikalische Bibliothek Fachbereich
Hermann Haken Hans Christoph Wolf Molekülphysik und Quantenchemie Einführung in die experimentellen und theoretischen Grundlagen Mit 245 Abbildungen und 43 Tabellen Physikalische Bibliothek Fachbereich
Übungen zur Vorlesung Physikalische Chemie II Lösungsvorschlag zu Blatt 5
 Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Klausur Bachelorstudiengang CBI / LSE. Physikalische Chemie
 Bachelorstudiengang CBI / LSE - Teil Physikalische Chemie SS10 - Blatt 1 / 15 Klausur Bachelorstudiengang CBI / LSE Physikalische Chemie 27.09.2010 Name: Vorname: geb. am: in: Studienfach: Matrikelnummer:
Bachelorstudiengang CBI / LSE - Teil Physikalische Chemie SS10 - Blatt 1 / 15 Klausur Bachelorstudiengang CBI / LSE Physikalische Chemie 27.09.2010 Name: Vorname: geb. am: in: Studienfach: Matrikelnummer:
Aufspaltung der Energieniveaus von Atomen im homogenen Magnetfeld
 Simon Lewis Lanz 2015 simonlanzart.de Aufspaltung der Energieniveaus von Atomen im homogenen Magnetfeld Zeeman-Effekt, Paschen-Back-Effekt, Fein- und Hyperfeinstrukturaufspaltung Fließt elektrischer Strom
Simon Lewis Lanz 2015 simonlanzart.de Aufspaltung der Energieniveaus von Atomen im homogenen Magnetfeld Zeeman-Effekt, Paschen-Back-Effekt, Fein- und Hyperfeinstrukturaufspaltung Fließt elektrischer Strom
ν und λ ausgedrückt in Energie E und Impuls p
 phys4.011 Page 1 8.3 Die Schrödinger-Gleichung die grundlegende Gleichung der Quantenmechanik (in den bis jetzt diskutierten Fällen) eine Wellengleichung für Materiewellen (gilt aber auch allgemeiner)
phys4.011 Page 1 8.3 Die Schrödinger-Gleichung die grundlegende Gleichung der Quantenmechanik (in den bis jetzt diskutierten Fällen) eine Wellengleichung für Materiewellen (gilt aber auch allgemeiner)
lichen auf sehr engem Raum konzentriert ist und die positive Ladung trägt
 lichen auf sehr engem Raum konzentriert ist und die positive Ladung trägt Kanalstrahlexperimente hatten schwere, positiv geladene Teilchen beim Wasserstoff nachgewiesen Aufgrund von Streuexperimenten postulierte
lichen auf sehr engem Raum konzentriert ist und die positive Ladung trägt Kanalstrahlexperimente hatten schwere, positiv geladene Teilchen beim Wasserstoff nachgewiesen Aufgrund von Streuexperimenten postulierte
RT N j Mit den Potentialen unter Standardbedingungen können wir die Energien der beiden Zustände identifizieren: = e Ei
 im Gleichgewicht wechseln genauso viele Teilchen aus dem einen Zustand in den zweiten wie umgekehrt, die chemischen Potentiale µ i sind also gleich) N i = e µ i µ N Mit den Potentialen unter Standardbedingungen
im Gleichgewicht wechseln genauso viele Teilchen aus dem einen Zustand in den zweiten wie umgekehrt, die chemischen Potentiale µ i sind also gleich) N i = e µ i µ N Mit den Potentialen unter Standardbedingungen
8.2 Aufbau der Atome. auch bei der Entdeckung der Kathodenstrahlen schienen die Ladungsträger aus den Atomen herauszukommen.
 Dieter Suter - 404 - Physik B3 8.2 Aufbau der Atome 8.2.1 Grundlagen Wenn man Atome als Bausteine der Materie i- dentifiziert hat stellt sich sofort die Frage, woraus denn die Atome bestehen. Dabei besteht
Dieter Suter - 404 - Physik B3 8.2 Aufbau der Atome 8.2.1 Grundlagen Wenn man Atome als Bausteine der Materie i- dentifiziert hat stellt sich sofort die Frage, woraus denn die Atome bestehen. Dabei besteht
Nachklausur zur Vorlesung Theoretische Physik in zwei Semestern II. Musterlösungen
 UNIVERSITÄT ZU KÖLN Institut für Theoretische Physik Wintersemester 005/006 Nachklausur zur Vorlesung Theoretische Physik in zwei Semestern II Musterlösungen 1. Welche experimentellen Tatsachen weisen
UNIVERSITÄT ZU KÖLN Institut für Theoretische Physik Wintersemester 005/006 Nachklausur zur Vorlesung Theoretische Physik in zwei Semestern II Musterlösungen 1. Welche experimentellen Tatsachen weisen
Bohrsches Atommodell / Linienspektren. Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
 Bohrsches Atommodell / Linienspektren Quantenstruktur der Atome: Atomspektren Emissionslinienspektren von Wasserstoffatomen im sichtbaren Bereich Balmer Serie (1885): 1 / λ = K (1/4-1/n 2 ) 656.28 486.13
Bohrsches Atommodell / Linienspektren Quantenstruktur der Atome: Atomspektren Emissionslinienspektren von Wasserstoffatomen im sichtbaren Bereich Balmer Serie (1885): 1 / λ = K (1/4-1/n 2 ) 656.28 486.13
7 Zwei- und Dreidimensionale Probleme in kartesischen Koordinaten
 7 Zwei- und Dreidimensionale Probleme in kartesischen Koordinaten 7.1 Das Teilchen im -Dimensionalen Kasten Slide 119 Das Teilchen im Kasten Das Teilchen soll sich zwischen = 0 und = L und = 0 und = L
7 Zwei- und Dreidimensionale Probleme in kartesischen Koordinaten 7.1 Das Teilchen im -Dimensionalen Kasten Slide 119 Das Teilchen im Kasten Das Teilchen soll sich zwischen = 0 und = L und = 0 und = L
Gruppentheorie ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD. Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE
 ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Physikalische Chemie Prof. Dr. Walter Langel Gruppentheorie Molekülschwingungen
ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Physikalische Chemie Prof. Dr. Walter Langel Gruppentheorie Molekülschwingungen
Zeichnen Sie qualitativ jeweils das dahinter und das seitlich aufgenommene Spektrum im Vergleich zum Spektrum der Quelle für die Fälle, dass i) die
 UNIVERSITÄT KONSTANZ Fachbereich Physik Prof. Dr. Elke Scheer (Experimentalphysik) Raum P 1007, Tel. 4712 E-mail: elke.scheer@uni-konstanz.de Prof. Dr. Guido Burkard (Theoretische Physik) Raum P 807, Tel.
UNIVERSITÄT KONSTANZ Fachbereich Physik Prof. Dr. Elke Scheer (Experimentalphysik) Raum P 1007, Tel. 4712 E-mail: elke.scheer@uni-konstanz.de Prof. Dr. Guido Burkard (Theoretische Physik) Raum P 807, Tel.
Hauptseminar Quantenmechanisches Tunneln WS 2010/2011. Thema: Tunneln durch einfache Potentialbarrieren und Alphazerfall
 Hauptseminar Quantenmechanisches Tunneln WS 2010/2011 Thema: Tunneln durch einfache Potentialbarrieren und Alphazerfall Torben Kloss, Manuel Heinzmann Gliederung Was ist tunneln? Tunneln durch ein beliebiges
Hauptseminar Quantenmechanisches Tunneln WS 2010/2011 Thema: Tunneln durch einfache Potentialbarrieren und Alphazerfall Torben Kloss, Manuel Heinzmann Gliederung Was ist tunneln? Tunneln durch ein beliebiges
Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt.
 12 Moleküle Slide 267 Vorbemerkungen Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt. Je 2 Elektronen
12 Moleküle Slide 267 Vorbemerkungen Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt. Je 2 Elektronen
 Übungen zu Experimentalphysik 4 - Lösungsvorschläge Prof. S. Paul Sommersemester 005 Dr. Jan Friedrich Nr. 5 16.05.005 Email Jan.Friedrich@ph.tum.de Telefon 089/89-1586 Physik Department E18, Raum 3564
Übungen zu Experimentalphysik 4 - Lösungsvorschläge Prof. S. Paul Sommersemester 005 Dr. Jan Friedrich Nr. 5 16.05.005 Email Jan.Friedrich@ph.tum.de Telefon 089/89-1586 Physik Department E18, Raum 3564
Magnetresonanztomographie (MRT) * =
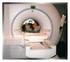 γ * γ π Beispiel: - Protonen ( H) Messung - konstantes B-Feld (T) in -Richtung - Gradientenfeld (3mT/m) in -Richtung - bei 0: f 00 4,6 MH Wie stark ist Frequenveränderung Df der Spins bei 0 mm? f (0mm)
γ * γ π Beispiel: - Protonen ( H) Messung - konstantes B-Feld (T) in -Richtung - Gradientenfeld (3mT/m) in -Richtung - bei 0: f 00 4,6 MH Wie stark ist Frequenveränderung Df der Spins bei 0 mm? f (0mm)
I. Physikalisches Institut der Justus-Liebig-Universität Giessen
 I. Physikalisches Institut der Justus-Liebig-Universität Giessen Versuch 1.2 Bandenspektrum von Jod A. Aufgabenstellung Im Bereich von 500-600 nm soll die Absorption von Joddampf photoelektrisch registriert
I. Physikalisches Institut der Justus-Liebig-Universität Giessen Versuch 1.2 Bandenspektrum von Jod A. Aufgabenstellung Im Bereich von 500-600 nm soll die Absorption von Joddampf photoelektrisch registriert
VL Spin-Bahn-Kopplung Paschen-Back Effekt. VL15. Wasserstoffspektrum Lamb Shift. VL16. Hyperfeinstruktur
 VL 16 VL14. Spin-Bahn-Kopplung (III) 14.1. Spin-Bahn-Kopplung 14.2. Paschen-Back Effekt VL15. Wasserstoffspektrum 15.1. Lamb Shift VL16. Hyperfeinstruktur 16.1. Hyperfeinstruktur 16.2. Kernspinresonanz
VL 16 VL14. Spin-Bahn-Kopplung (III) 14.1. Spin-Bahn-Kopplung 14.2. Paschen-Back Effekt VL15. Wasserstoffspektrum 15.1. Lamb Shift VL16. Hyperfeinstruktur 16.1. Hyperfeinstruktur 16.2. Kernspinresonanz
Physik für Mediziner im 1. Fachsemester
 Physik für Mediziner im 1. Fachsemester #26 08/12/2010 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Atomphysik Teil 1 Atommodelle, Atomspektren, Röntgenstrahlung Atomphysik Die Atomphysik ist ein
Physik für Mediziner im 1. Fachsemester #26 08/12/2010 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Atomphysik Teil 1 Atommodelle, Atomspektren, Röntgenstrahlung Atomphysik Die Atomphysik ist ein
Vorlesung Theoretische Chemie I
 Institut für Physikalische and Theoretische Chemie, Goethe-Universität, Frankfurt am Main 20. Dezember 2013 Teil I Energieeinheiten Joule E kin = 1 2 mv 2 E pot = mgh [E] = kg m2 s 2 = J Verwendung: Energie/Arbeit
Institut für Physikalische and Theoretische Chemie, Goethe-Universität, Frankfurt am Main 20. Dezember 2013 Teil I Energieeinheiten Joule E kin = 1 2 mv 2 E pot = mgh [E] = kg m2 s 2 = J Verwendung: Energie/Arbeit
16 Elektromagnetische Wellen
 16 Elektromagnetische Wellen In den folgenden Kapiteln werden wir uns verschiedenen zeitabhängigen Phänomenen zuwenden. Zunächst werden wir uns mit elektromagnetischen Wellen beschäftigen und sehen, dass
16 Elektromagnetische Wellen In den folgenden Kapiteln werden wir uns verschiedenen zeitabhängigen Phänomenen zuwenden. Zunächst werden wir uns mit elektromagnetischen Wellen beschäftigen und sehen, dass
