Energie und Energieumwandlung
|
|
|
- Sven Dunkle
- vor 6 Jahren
- Abrufe
Transkript
1 Schulversuchspraktikum Anonym_16 Sommersemester 2016 Klassenstufen 7 & 8 Energie und Energieumwandlung
2 Auf einen Blick: Dieses Protokoll enthält vier Versuche zum Thema Energie und Energieumwandlung, die exotherme oder endotherme Reaktionen zeigen. Die Lehrerversuche V1 und V2 zeigen exotherme Reaktionen, in denen Energie in Form von Wärme frei wird. Beide Reaktionen sind eindrucksvoll und können als Wunderexperiment eingesetzt werden. In Versuch 2 wird die Reaktion mit Wasser iniziiert, wodurch die Schülerfehlvorstellung Wasser kann Feuer nur löschen thematisiert wird. Die Schülerversuche Versuche 3 und 4 thematisieren endotherme Reaktionen. In Versuch 3 wird die Bedeutung von Kristallwasser anhand der Reaktion eines Salzes und des Hydrates dieses Salzes mit Wasser gezeigt. Versuch 4 zeigt ein spontan ablaufendes endothermes Experiment. Inhalt 1 Beschreibung des Themas und zugehörige Lernziele Relevanz des Themas für SuS der 7 und 8. Klasse und didaktische Reduktion Lehrerversuche V1 Der Feuerblitz V2 Mit Wasser Feuer machen Schülerversuche V3 Lösungswärme von Salzen V4 Kristallisation einer Schmelze Didaktischer Kommentar zum Schülerarbeitsblatt Erwartungshorizont (Kerncurriculum) Erwartungshorizont (Inhaltlich)... 11
3 1 Beschreibung des Themas und zugehörige Lernziele 1 Beschreibung des Themas und zugehörige Lernziele Energie ist die Fähigkeit Arbeit zu leisten. Sie kann in verschiedenen Formen auftreten. Es gibt die Bewegungsenergie (oder auch kinetische Energie), elektrische Energie, chemische Energie und Wärmeenergie. Jeder Stoff verfügt über einen bestimmten Energiegehalt, die innere Energie U. Bei chemischen Reaktionen reagieren die Edukte zu Produkten. Es entstehen somit neue Stoffe mit einer anderen spezifischen inneren Energie. Die Energiedifferenz zwischen Produkten und Edukten wird mit ΔU bezeichnet. Wird Energie frei, ist diese Energiedifferenz negativ. Die Reaktion ist exotherm. Wenn Energie aufgenommen wird, ist die Energiedifferenz positiv und man spricht von einer endothermen Reaktion. Die Energie, die notwendig ist, um eine Reaktion zu starten nennt sich Aktivierungsenergie E A. Bei exothermen Reaktionen ist die Aktivierungsenergie kleiner, als die freiwerdende, während die Aktivierungsenergie bei endothermen Reaktionen größer ist, als die benötigte Energie. Ein Katalysator ist ein Stoff, der die Aktivierungsenergie, die einer Reaktion benötigt reduzieren kann, ohne selbst bei der Reaktion verbraucht zu werden. Das Thema Energie findet sich im Kerncurriculum der Chemie für die 7. und 8. Klasse direkt im Basiskonzept Energie wieder. Die fachwissenschaftlichen Kompetenzen basieren auf dem übergeordneten Lernziel, dass sich chemische Systeme in ihrem Energiegehalt unterscheiden. Explizit wird gefordert, dass die SuS beschreiben, dass Stoffe und Systeme bei chemischen Reaktionen Energie mit ihrer Umgebung austauschen können und ihren Energiegehalt auf diese Weise verändern. Außerdem sollen die SuS exotherme und endotherme Reaktionen unterscheiden und erkennen können. Zur Förderung des Kompetenzbereichs Erkenntnisgewinnung sollen die SuS experimentelle Untersuchungen zur Energieübertragung zwischen verschiedenen Systemen durchführen und üben. Diese Kompetenzen werden durch die vier folgenden Experimente gefördert. In Versuch 3 und 4 wird zusätzlich die erkenntnisgewinnende Kompetenz Energiediagramme erstellen unterstützt, indem die SuS den Temperaturverlauf während der Versuche messen und in Form einer Temperatur-Zeit-Kurve protokollieren sollen. Der 4. Versuch beinhaltet außerdem, dass die SuS lernen die Wirkung eines Katalysators auf die Aktivierungsenergie und somit auch die Beeinflussbarkeit chemischer Reaktionen durch Katalysatoren verstehen und beschreiben zu können Bezüglich der Förderung der Bewertungskompetenz ermöglicht die Unterrichtseinheit zum Thema Energie den SuS die Chemie als bedeutsame Wissenschaft zu erkennen und Bezüge zu verschiedenen Themen aus Physik und Biologie mit Hilfe ihres Fachwissens herzustellen. Sie können Anwendungen von Energieübertragungsprozessen im Alltag aufzeigen und den energetischen Vorteil katalysierter chemischer Prozesse in der Industrie erkennen. 1
4 Relevanz des Themas für SuS der 7 und 8. Klasse und didaktische Reduktion 2 Relevanz des Themas für SuS der 7 und 8. Klasse und didaktische Reduktion Die SuS kommen in ihrem Alltag mit verschiedenen energetischen Phänomenen in Kontakt. Die Unterrichtseinheit zum Thema Energie hilft ihnen diese Phänomene als solche zu erkennen und zu verstehen. Die Überhitzung von Elektrogeräten kann z. B. als Umwandlung von elektrischer in Wärmeenergie erfasst werden. Außerdem unterstützt das Wissen über energetische Prozesse das Verständnis von biologischen Vorgängen. Die Fotosynthese ist beispielsweise die Umwandlung von Lichtenergie in chemische Energie. Zuletzt erfahren die SuS Enzyme als Biokatalysatoren und verstehen, welchen wirtschaftlichen Nutzen Katalysatoren in diesen Prozessen haben. Die didaktische Reduktion für SuS der 7. und 8. Klasse besteht darin, dass die Reaktionen nicht anhand von Reaktionsgleichungen erklärt werden, da diese erst Ende der 8. Klasse eingeführt werden. Die ablaufende Reaktion wird beschrieben und die Produkte benannt. Außerdem werden die Energieumwandlungen mit Hilfe von Wärmeabgabe oder aufnahme als endotherm o- der exotherm beschrieben. 2
5 3 Lehrerversuche 3 Lehrerversuche 3.1 V1 Der Feuerblitz Dieser Versuch zeigt anschaulich eine exotherme Reaktion. Außerdem wird den SuS eine Selbstentzündung gezeigt und damit verdeutlicht, dass die exotherme Reaktion nicht durch die Flamme sichtbar ist, sondern dass die Flamme eine Folge der freigesetzten Energie der exothermen Reaktion ist. Durch die schnelle Selbstentzündung ist der Versuch eher als Lehrerversuch geeignet. Er kann von SuS durchgeführt werden, wenn diese in ihren Experimentierfähigkeiten bereits gut geübt sind und eine Gefährdung beinahe ausgeschlossen werden kann. Die SuS müssen die charakteristische Flammenfärbung verschiedener Metalle kennen, um Natrium identifizieren zu können. Außerdem müssen sie anhand der Wärmeentwicklung erkennen können, dass die Reaktion exotherm abläuft. Gefahrenstoffe Kaliumpermanganat H: P: Glycerin H: P: Wasser - - Kohlenstoffdioxid H: 280 P: 403 Kaliumcarbonat H: P: Mangan(IV)-oxid H: P: 221 Materialien: Chemikalien: Durchführung: Mörser und Pistill, feuerfeste Unterlage, Pipette, Spatel Kaliumpermanganat, Glycerin Ein Spatel Kaliumpermanganat wird in der Reibschale zu Pulver zerrieben und auf der feuerfesten Unterlage kegelförmig aufgehäuft. Auf diesem Kegel wird eine leichte Kuhle in der Oberfläche geschaffen. In diese werden mit der Pipette vorsichtig wenige Tropfen Glycerin getropft. 3
6 Lehrerversuche Beobachtung: Anfangs ist ein Rauch zu sehen, dann glüht die Substanz auf und eine violette Flamme entsteht. Abbildung 1: Violett gefärbte Flamme der Selbstentzündung von Kaliumpermanganat und Glycerin. Deutung: Glycerin wird durch Kaliumpermanganat oxidiert. Dabei entstehen Kohlenstoffdioxid, Braunstein, Kaliumoxid und Wasser. Es handelt sich um eine exotherme Reaktion, d.h. es kommt zu starker Wärmeentwicklung. Wenn die Zündtemperatur überschritten ist, folgt die Selbstentzündung. Die violette Färbung weist darauf hin, dass Kalium verbrennt. 3 C 3 H 8 O 3 (l) + 14 KMnO 4 (s) 12 H 2 O (g) + 9 CO 2 (g) + 7 K 2 O (s) + 14 MnO 2 (s). Kaliumoxid reagiert direkt mit Kohlenstoffdioxid zu Kaliumcarbonat: 3 C 3 H 8 O 3 (l) + 14 KMnO 4 (s) 12 H 2 O (g) + 2 CO 2 (g) + 7 K 2 CO 3 (s) + 14 MnO 2 (s). Literatur: H. Schmidkunz, Chemische Freihandversuche, Kleine Versuche mit großer Wirkung, Aulis Verlag, 2011, S. 70. Das Experiment kann im Einstieg als Überraschungsexperiment eingesetzt werden. Der Begriff Aktivierungsenergie kann eingeführt werden, da zur Selbstentzündung die freiwerdende Wärmeenergie notwendig ist. Anschließend kann besprochen werden, inwiefern sich der Energiegehalt der beteiligten Systeme verändert hat. Es ist zu beachten, dass wasserfreies Glycerin eingesetzt wird, da der Versuch sonst misslingt. Sollte dieser Versuch von SuS durchgeführt werden, sollte nur ein Tropfen Glycerin hinzugegeben werden. Der Reaktionseintritt kann einen Moment dauern. 4
7 Lehrerversuche 3.1 V2 Mit Wasser Feuer machen Durch diesen Versuch sollen die SuS die entzündliche Wirkung von Wasser, das sie als Löschmittel kennenlernten, erfahren. Sie lernen, dass nicht nur eine Flamme ein Feuer starten kann. Der Versuch kann also einen kognitiven Konflikt bezüglich dieser Fehlvorstellung wecken. Die Sus müssen die Begriffe Aktivierungsenergie und Katalysator erklären können, außerdem müssen sie erkennen, dass eine exotherme Reaktion abläuft, da Wärmeenergie frei wird. Gefahrenstoffe Zink - - Wasser - - Ammoniumnitrat H: 272 P: 210 Ammoniumchlorid H: P: Wasserstoff H: P: Materialien: Chemikalien: Durchführung: Beobachtung: Filterpapier, feuerfeste Unterlage, Pipette Zink, Wasser, Ammoniumnitrat, Ammoniumchlorid 3 g pulverförmiges Zink, 4 g Ammoniumnitrat und eine Spatelspitze Ammoniumchlorid werden zusammengegeben und auf einem trockenen Filterpapier vermengt. Auf einer feuerfesten Unterlage wird die Mischung zu einem Kegel aufgehäuft und mittels der Pipette wenig Wasser dazu getropft. Das Substanzgemisch entzündet sich nach kurzer Zeit selbst. 5
8 Lehrerversuche Abbildung 2: Blau gefärbte Flamme der Selbstentzündung von Zink, Ammoniumnitrat und Ammoniumchlorid mit Wasser. Deutung: Das Metall hat eine katalytische Wirkung auf die Reaktion. Ohne das Zink ist die Aktivierungsenergie zu hoch, um die Reaktion spontan zu starten. Das Wasser bewirkt, die Reaktion von Zink mit den Ammonium-Ionen. Stickstoff und Wasserstoff entstehen. Die Reaktionsenergie wird in Form von Wärme frei und entzündet den Wasserstoff. Zn (s) + NH 4 NO 3 (s) 2 H 2 O (l) + N 2 (s) + ZnO (s) Zn (s) + 2 H 2 O (l) 2 OH (aq) + H 2 (g) + Zn 2+ (aq) Entsorgung: Literatur: Das Filterpapier sollte zuerst abgespült werden und dann im Feststoffabfall entsorgt werden. Das Produkt wird in den Schwermetallabfall gegeben. H. Schmidkunz, Chemische Freihandversuche, Kleine Versuche mit großer Wirkung, Aulis Verlag, 2011, S. 72. Cornelsen Verlag GmbH (Hrsg.), Prof. Blumes Bildungsserver für Chemie, (Zuletzt abgerufen am ) Es muss beachtet werden, dass Ammoniumnitrat, Zinkstaub und Ammoniumchlorid nicht in einem Mörser gemischt werden. Dieser Versuch kann beispielsweise eingesetzt werden, um einen Zusammenhang zwischen den Begriffen Aktivierungsenergie und Katalysator zu schaffen. 6
9 Temperatur T [ C] Schülerversuche 4 Schülerversuche 4.1 V3 Lösungswärme von Salzen Die SuS erfahren, dass ein Salz und sein Hydrat mit Wasser entweder endotherm oder exotherm reagieren können. Sie müssen anhand der Temperaturentwicklung erkennen können, ob eine Reaktion exo- oder endotherm ist. Gefahrenstoffe Wasser - - Calciumchlorid H: 319 P: Calciumchlorid Hexahydrat H: 319 P: Materialien: Chemikalien: Durchführung: Beobachtung: 2 Bechergläser 100 ml, Thermometer, Rührstab, Waage, Spatel, Styroporkalorimeter Wasser, Calciumchlorid, Calciumchlorid-Hexahydrat In ein Becher werden 11,1 g Calciumchlorid gegeben und mit 40 ml Wasser aufgegossen. Das Becherglas wird in ein Styroporkalorimeter gestellt und die Temperatur gemessen. Alle 30 s soll ein Messwert aufgenommen und anschließend aufgetragen werden. Mit der Masse von 21,9 g Calciumchlorid-Hexahydrat wird ebenso vorgegangen. Während die Temperatur des Calciumchlorid-Ansatzes zunimmt, sinkt die des Calciumchlorid-Hexahydrat-Ansatzes. Lösungswärme von CaCl 2 60 Start Zeit t [s] Abbildung 3: Temperatur-Zeit-Kurve der Lösungsreaktion von CaCl2. 7
10 Temperatur T[ C] Schülerversuche Lösungswärme von CaCl 2 6H 2 O 27 Start Zeit t [s] Abbildung 4: Temperatur-Zeit-Kurve der Lösungsreaktion von CaCl2. 6H2O. Deutung: Entsorgung: Literatur: Die Reaktionen führen zu Wärmeaustausch der jeweiligen Systeme mit der Umwelt. Das endotherm reagierende Calciumchlorid-Hexahydrat zieht die Energie aus der Umwelt. Der Energiegehalt in diesem System nimmt zu. Die zweite Reaktion erfolgt exotherm. Der Energiegehalt von Calciumchlorid sinkt, da es Wärmeenergie an die die Umwelt abgibt. Die Lösungen können mit Wasser verdünnt in den Abfluss gegeben werden. R. Herbst-Irmer, Anorganisch-Chemisches Praktikum, Praktikumsskript 2013, Georg-August Universität Göttingen, S. 32ff. Es muss berücksichtigt werden, dass die Salze nicht zu lange der Luft ausgesetzt werden, da sie wasserziehend sind. Sollte kein Calciumchlorid-Hexahydrat verfügbar sein, kann auch Calciumchlorid-Tetrahydrat verwendet werden. Wird dieser Versuch in Klasse 9/10 durchgeführt, kann er für folgenden Sachverhalt verwendet werden: Der Begriff Enthalpie und die Zusammensetzung der Lösungsenthalpie aus Gitter- und Hydratationsenergie muss bekannt sein oder mittels dieses Experiments eingeführt werden. Die Lösungsenthalpie (ΔH L) kann aus der Summe der Gitterenergie(ΔH G) und der Hydratationsenthalpie(ΔH H) berechnet werden. Ist die Gitterenergie höher, als die Hydratationsenthalpie, ist die Lösungsenthalpie negativ und die Reaktion ist endotherm. Ist die Gitterenergie niedriger, als die Hydratationsenthalpie, ist die Lösungsenthalpie positiv und die Reaktion ist exotherm. Daraus lässt sich schlussfolgern, dass das die Hydratationsenergie von Calciumchlorid größer ist, als die Gitterenergie. Äquivalent dazu, ist die Hydratationsenergie von Calciumchlorid- Hexahydrat kleiner, als seine Gitterenergie. 8
11 Temperatur T [ C] Schülerversuche 4.2 V4 Kristallisation einer Schmelze Dieser Versuch zeigt, dass auch durch das erschütterungsinduzierte, aber temperaturabhängige Erstarren einer Schmelze die Temperatur der Umgebung beeinflusst wird. Die SuS kennen die Funktion eines Impfkristalls. Außerdem erkennen sie anhand der Temperaturzunahme, dass eine exotherme Reaktion abläuft. Gefahrenstoffe Natriumthiosulfat-Pentahydrat - - Materialien: Chemikalien: Duranreagenzglas, Stativ und Klemmen, Thermometer, Brenner, Glasstab, Feuerzeug Natriumthiosulfat-Pentahydrat Durchführung: Beobachtung: Das kristalline Natriumthiosulfat-Pentahydrat wird etwa 3 cm hoch in das Duranreagenzglas eingefüllt und vorsichtig geschmolzen. Das Thermometer wird in das erwärmte Natriumthiosulfat-Pentahydrat gestellt. Wenn dieses auf etwa Zimmertemperatur abgekühlt ist, kann ein Impfkristall hinein gegeben werden. Der Temperatur-Zeit-Verlauf wird gemessen und grafisch dargestellt. Während die Schmelze kristallisiert, steigt ihre Temperatur. 55 Kristallisationswärme bei Kristallisation einer Schmelze Start Zeit t [s] Abbildung 5: Temperatur-Zeit-Kurve der Kristallisationsreaktion von Natriumthiosulfat- Pentahydrat. 9
12 Schülerversuche Deutung: Entsorgung: Literatur: Natriumthiosulfat-Pentahydrat ist ein leicht lösliches Salz. Wird die Natriumthiosulfat-Pentahydrat-Schmelze nun bis unter ihren Schmelzpunkt von 48 C abgekühlt, entsteht eine übersättigte Lösung. Durch Erschütterung oder Impfkristalle kristallisiert das Natriumthiosulfat aus. Wärme, die beim Schmelzen zugeführt wurde, wird wieder freigesetzt. Die Temperatur steigt wieder etwa bis zum Schmelzpunkt an. Die Reaktion ist exotherm. Natriumthiosulfat-Pentahydrat kann entweder in kristalliner Form aufgehoben werden, um den Versuch erneut durchzuführen oder im Behältnis für schwermetallhaltige Abfälle entsorgt werden. R. Herbst-Irmer, Anorganisch-Chemisches Praktikum, Praktikumsskript 2013, Georg-August Univeristät Göttingen, S. 29ff. Dieser Versuch kann außer für die Behandlung des Themas Kristallisationswärme auch genutzt werden, um den SuS eine reversible Reaktion vorzuführen. Außerdem kann als Eigenschaft von Salzen ihr hoher Schmelzpunkt thematisiert werden. 10
13 Lösungswärme von Salzen Aufgabe 1: Zeichnet den Verlauf der Temperatur-Zeit-Kurven anhand der vorgegebenen Messwerte. Nehmt dafür je ein separates Blatt, nutzt den verfügbaren Platz aus und beschriftet die Achsen. Calciumchlorid t [s] T [ C] ,9 24,4 24,6 29,8 35,2 39,7 48,4 55,1 56,8 55,6 54,5 53,9 53,1 Calciumchlorid Hexahydrat t [s] T [ C] ,0 24,9 25,1 23,3 20,2 17,7 16,3 16,2 16,2 16,9 17,5 18,3 18,7 Aufgabe 2: Erklärt den Kurvenverlauf des von euch gezeichneten Diagramms. Nutzt die Worte Maximum oder Minimum. Aufgabe 3: Beurteilt, ob es sich bei den Reaktionen um endotherme oder exotherme Reaktionen handelt.
14 Temperatur T [ C] 5 Didaktischer Kommentar zum Schülerarbeitsblatt Mit Hilfe dieses Arbeitsblatts kann der Versuch Lösungswärme von Salzen ausgewertet werden. Wenn die SuS selbst Messungen vorgenommen haben, kann die Tabelle geleert werden und die SuS nutzen ihre eigenen Messwerte. 5.1 Erwartungshorizont (Kerncurriculum) Aufgabe 1 entspricht dem Anforderungsbereich I: Wiedergeben und beschreiben. Die SuS sollen die fachspezifische Arbeitsweise Diagramme anzufertigen schulen. Um zu gewährleisten, dass bestimmte Kriterien erfüllt werden, sind diese als Aufgabenzusatz genannt. Zur Bearbeitung der Aufgabe 2 müssen die SuS ihre selbsterstellten Diagramme versprachlichen und strukturiert darstellen. Damit ist diese Aufgabe in den Anforderungsbreich II: Anwenden und strukturieren einzuordnen. Außerdem kann mit den ersten beiden Aufgaben die Diagrammkompetenz der SuS gefördert werden. Die dritte Aufgabe zählt zum Anforderungsbereich III: Transferieren und verknüpfen und fördert die Bewertungskompetenz. Die SuS sollen die Versuchsergebnisse fachlich auswerten, indem sie begründen, ob die Reaktionen endotherm oder exotherm ablaufen und müssen dafür ihre fachspezifischen Erkenntnisse als Basis heranziehen. Im Kerncurriculum ist der Anspruch diese Fertigkeiten in der 7. und 8. Klasse zu fördern unter dem Basiskonzept Stoff-Teilchen, innerhalb der kommunikativen Kompetenzen zu finden. Die SuS lernen gewonnene Daten in Diagrammen darzustellen und erhaltene Messwerte zu diskutieren. 5.2 Erwartungshorizont (Inhaltlich) Aufgabe 1: Zeichnet den Verlauf der Temperatur-Zeit-Kurven anhand der vorgegebenen Messwerte. Nehmt dafür je ein separates Blatt, nutzt den verfügbaren Platz aus und beschriftet die Achsen Lösungswärme von Calciumchlorid Start Zeit t [s] 11
15 Temperatur T[ C] Lösungswärme von Calciumchlorid-Hexahydrat 27 Start Zeit t [s] Aufgabe 2: Erklärt den Kurvenverlauf des von euch gezeichneten Diagramms. Nutzt die Worte Maximum oder Minimum. Lösungswärme von Calciumchlorid: Ehe das Wasser bei t=0 hinzugegeben wird bleibt die Temperatur gleich. Dann steigt die Temperatur an, bis bei 180 s das Maximum von 56,8 C erreicht wird. Danach sinkt die Temperatur langsam wieder. Lösungswärme von Calciumchlorid Hexahydrat: Ehe das Wasser bei t=0 hinzugegeben wird bleibt die Temperatur gleich. Dann sinkt die Temperatur, bis bei 150 s das Minimum von 16,2 C erreicht wird. Danach steigt die Temperatur langsam wieder. Aufgabe 3: Beurteilt, ob es sich bei den Reaktionen um endotherme oder exotherme Reaktionen handelt. Bei der Reaktion von Calciumchlorid mit Wasser steigt die Temperatur der Lösung an, Energie wird also in Form von Wärme frei. Die Reaktion ist exotherm. Die Reaktion von Calciumchlorid-Hexahydrat mit Wasser ist endotherm. Der Temperaturabfall zeigt, dass der Umgebung Energie in Form von Wärme entzogen wird. 12
Energie und Energieumwandlung
 Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum. Name: Tobias Piotrowski. Semester: Sommersemester 2013. Klassenstufen 9 & 10. ph-wert
 Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen 9 & 10 ph-wert 1 Beschreibung des Themas und zugehörige Lernziele (Max. 1 Seite) 2 Auf einen Blick: Dieses Protokoll
Aktivierungsenergie und Katalyse
 1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
Schulversuchspraktikum. Name Thomas Polle. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Reaktionen von Metallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Endotherm und Exotherm
 Schulversuchspraktikum Anne Steinkuhle Sommersemester 2013 Klassenstufen 7 & 8 Endotherm und Exotherm 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In dem folgenden Protokoll sind
Schulversuchspraktikum Anne Steinkuhle Sommersemester 2013 Klassenstufen 7 & 8 Endotherm und Exotherm 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In dem folgenden Protokoll sind
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 7/8. Sauerstoff. Das Gas des Lebens
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Schulversuchspraktikum. Sommersemester 2013. Klassenstufen 7 & 8. Katalysatoren
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt, die drei inhaltliche Lernziele verfolgen: Sie zeigen,
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt, die drei inhaltliche Lernziele verfolgen: Sie zeigen,
Wir untersuchen Mineralwasser
 Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 7 & 8. Reaktionen von Metallen mit Sauerstoff und mit Luft.
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum. Julia Müller. Klassenstufen 5/6. Feuer und Kerzen
 Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Vom Alkohol zum Alken
 1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
C1 Erhitzen von Kupfer(II)-sulfat-Pentahydrat
 Chemische Reaktionen lassen sich anhand einiger charakteristischer Kennzeichen erkennen. Produkte einer Reaktion haben gegenüber den Ausgangsstoffen veränderte chemische Eigenschaften, bei Reaktionen wird
Chemische Reaktionen lassen sich anhand einiger charakteristischer Kennzeichen erkennen. Produkte einer Reaktion haben gegenüber den Ausgangsstoffen veränderte chemische Eigenschaften, bei Reaktionen wird
Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen 1 Beschreibung des Themas und zugehörige Lernziele
Haushaltsreiniger und Waschmittel
 Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Haushaltsreiniger und Waschmittel 3 Schülerversuche 2 Auf einen Blick: Dieses Protokoll befasst sich mit
Schulversuchspraktikum Name: Tobias Piotrowski Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Haushaltsreiniger und Waschmittel 3 Schülerversuche 2 Auf einen Blick: Dieses Protokoll befasst sich mit
Erwartete Kompetenzen. Kompetenzbereich Erkenntnisgewinnung Die Schülerinnen und Schüler E1 E2 E3 E4 E5 E6 E7 E8 E9 E10 E11 E12 E13 E14 E15 E16 E17
 Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Praktikum Chemie für Mediziner und Zahnmediziner 125
 Praktikum Chemie für Mediziner und Zahnmediziner 125 10. Studieneinheit Lernziele Endotherme und exotherme Prozesse Temperaturabhängige Verschiebung von Gleichgewichten Zeitlicher Verlauf chemischer Reaktionen
Praktikum Chemie für Mediziner und Zahnmediziner 125 10. Studieneinheit Lernziele Endotherme und exotherme Prozesse Temperaturabhängige Verschiebung von Gleichgewichten Zeitlicher Verlauf chemischer Reaktionen
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Thermodynamik & Kinetik
 Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Mehrprotonige Säuren; als Beispiel Cola
 Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Mehrprotonige Säuren; als Beispiel Cola Arbeitsauftrag: Führe den nachstehenden Versuch Titration von Cola gemäß der Durchführung durch und notiere deine Messwerte: Materialien: 2 Bechergläser (230 ml),
Versuch: Qualitativer Nachweis von Kohlenstoff und Wasserstoff
 Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
2. Chemische Reaktionen und chemisches Gleichgewicht
 2. Chemische Reaktionen und chemisches Gleichgewicht 2.1 Enthalpie (ΔH) Bei chemischen Reaktionen reagieren die Edukte zu Produkten. Diese unterscheiden sich in der inneren Energie. Es gibt dabei zwei
2. Chemische Reaktionen und chemisches Gleichgewicht 2.1 Enthalpie (ΔH) Bei chemischen Reaktionen reagieren die Edukte zu Produkten. Diese unterscheiden sich in der inneren Energie. Es gibt dabei zwei
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Der Schmelzpunkt von Salzen
 Der Schmelzpunkt von Salzen Vergleich die Smp. der Salze (links). Welche Rolle könnten die Ionenradien bzw. die Ladung der enthaltenen Ionen spielen? Der Schmelzpunkt von Salzen ist i.d.r. sehr hoch. Er
Der Schmelzpunkt von Salzen Vergleich die Smp. der Salze (links). Welche Rolle könnten die Ionenradien bzw. die Ladung der enthaltenen Ionen spielen? Der Schmelzpunkt von Salzen ist i.d.r. sehr hoch. Er
3.11 Zerlegung von Wasser durch Reduktionsmittel. Aufgabe. Aus welchen Elementen besteht Wasser?
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
Schulversuchspraktikum. Dörte Hartje. Sommersemester 2013. Klassenstufen 7 & 8. Vom Erz zum Metall
 Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 7 & 8 Vom Erz zum Metall Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll enthält drei Lehrer- und
Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 7 & 8 Vom Erz zum Metall Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll enthält drei Lehrer- und
Schulversuchspraktikum. Sommersemester 2014. Klassenstufen 11 & 12. Batterien und Akkus
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
Reaktion und Energie
 Reaktion und Energie Grundsätzliches Bei chemischen Reaktionen werden die Atome der Ausgangsstoffe neu angeordnet, d. h. Bindungen werden gespalten und neu geknüpft. Die Alltasgserfahrung legt nahe, dass
Reaktion und Energie Grundsätzliches Bei chemischen Reaktionen werden die Atome der Ausgangsstoffe neu angeordnet, d. h. Bindungen werden gespalten und neu geknüpft. Die Alltasgserfahrung legt nahe, dass
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Schulversuchspraktikum. Anna Hille. Sommersemester 2013. Klassenstufen 9 & 10. Salz und Salzbildung
 Schulversuchspraktikum Anna Hille Sommersemester 2013 Klassenstufen 9 & 10 Salz und Salzbildung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll enthält verschiedene
Schulversuchspraktikum Anna Hille Sommersemester 2013 Klassenstufen 9 & 10 Salz und Salzbildung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll enthält verschiedene
1 Beschreibung des Themas und zugehörige Lernziele 1. Schulversuchspraktikum. Till Beuermann. Sommersemester 2013. Klassenstufen 7 & 8.
 1 Beschreibung des Themas und zugehörige Lernziele 1 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 7 & 8 Strom aus Obst 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf
1 Beschreibung des Themas und zugehörige Lernziele 1 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 7 & 8 Strom aus Obst 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf
Arbeitsblatt Wasserkreislauf der Erde
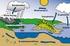 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Quantitative Analyse von Kohlenwasserstoffen
 Schulversuchspraktikum SoSe 2013 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 2 Auf einen Blick: Im Folgenden werden zunächst drei Versuche vorgestellt, welche die benötigten Teilschritte
Schulversuchspraktikum SoSe 2013 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 2 Auf einen Blick: Im Folgenden werden zunächst drei Versuche vorgestellt, welche die benötigten Teilschritte
Schulversuchspraktikum. Sommersemester 2012 Klassenstufen 7 & 8. Katalysatoren
 1 Schulversuchspraktikum Sommersemester 2012 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 7 & 8 enthält 2 Schüler- und 2 Lehrerversuche zum Thema Katalysator.
1 Schulversuchspraktikum Sommersemester 2012 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 7 & 8 enthält 2 Schüler- und 2 Lehrerversuche zum Thema Katalysator.
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 9 & 10. Reaktionen von Metallen und Metallverbindungen sowie von Nichtmetallen (Ammoniak)
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9 & 10 Reaktionen von Metallen und Metallverbindungen sowie von Nichtmetallen (Ammoniak) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9 & 10 Reaktionen von Metallen und Metallverbindungen sowie von Nichtmetallen (Ammoniak) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf
Säuren und Laugen im Haushalt
 Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Schulversuchspraktikum. Michaela Micke. Sommersemester Klassenstufen 9 & 10. Chemie der Kohlenwasserstoffe. Methan & Erdgas
 Schulversuchspraktikum Michaela Micke Sommersemester 2012 Klassenstufen 9 & 10 Chemie der Kohlenwasserstoffe Methan & Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Die vorliegende Unterrichtseinheit für
Schulversuchspraktikum Michaela Micke Sommersemester 2012 Klassenstufen 9 & 10 Chemie der Kohlenwasserstoffe Methan & Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Die vorliegende Unterrichtseinheit für
Schulversuchspraktikum. Anne Bergmann. Sommersemester Klassenstufen 9 & 10. Alkalimetalle
 Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird zunächst fachlich
Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird zunächst fachlich
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: 2012. Klassenstufen: 11/12. Tenside
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 11/12 Tenside 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit der Tenside in der
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 11/12 Tenside 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit der Tenside in der
Moderne Methoden der Chemie - die Differenz-Thermo- Analyse (DTA)
 Moderne Methoden der Chemie - die Differenz-Thermo- Analyse (DTA) Einleitung Moderne Anaylsemethoden haben die Chemie - insbesondere in den letzten 50 Jahren - stark verändert. Sie ermöglichen völlig neue
Moderne Methoden der Chemie - die Differenz-Thermo- Analyse (DTA) Einleitung Moderne Anaylsemethoden haben die Chemie - insbesondere in den letzten 50 Jahren - stark verändert. Sie ermöglichen völlig neue
4. Anorganisch-chemische Versuche
 4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
4. Anorganisch-chemische Versuche o 4.4 Redoxreaktionen 4.4.1 Reduktion von Mangan(VII) in schwefelsaurer Lsg. 4.4.2 Oxidation von Mangan(II) in salpetersaurer Lsg. 4.4.3 Oxidation von Chrom(III) in alkalischer
Homogene und Heterogene Gemische
 Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser
 HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser DIE ZERDRÜCKTE ALUDOSE LEERE Alu-Getränkedose (1/2 Liter!) Tiegelzange Schüssel mit kaltem Wasser 1. Fülle die leere Getränkedose mit wenig Wasser 2. Stelle die
HTBL-PINKAFELD Arbeitsblatt A4/1 Wasser DIE ZERDRÜCKTE ALUDOSE LEERE Alu-Getränkedose (1/2 Liter!) Tiegelzange Schüssel mit kaltem Wasser 1. Fülle die leere Getränkedose mit wenig Wasser 2. Stelle die
Vom Schwefel zur Schwefelsäure
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9&10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll wurde die Herstellung
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9&10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll wurde die Herstellung
Verbrennung einer Kerze
 Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann und dessen Teilchen(Atome oder Moleküle) aus einer einzigen Atomart (d.h. Teilchen mit gleicher Ordnungszahl) besteht. Verbindung Reinstoff,
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann und dessen Teilchen(Atome oder Moleküle) aus einer einzigen Atomart (d.h. Teilchen mit gleicher Ordnungszahl) besteht. Verbindung Reinstoff,
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure
 Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Versuchsprotokoll: Reaktion von Zucker mit Schwefelsäure Zeitaufwand: Aufbau: Durchführung: Abbau/Entsorgung: 5 Minuten 10 Minuten 5 Minuten Chemikalien: Chemikalie Menge RSätze SSätze Gefahrensymbol Schwefelsäure
Ablauf des Praktikums
 Ablauf des Praktikums Demoexperimente, Gruppenexperimente, chemisches Rechnen Nach jeder Übung ist ein Protokoll zu fertigen und zum nächsten Übungstermin abzugeben!! Das Protokoll ist handschriftlich
Ablauf des Praktikums Demoexperimente, Gruppenexperimente, chemisches Rechnen Nach jeder Übung ist ein Protokoll zu fertigen und zum nächsten Übungstermin abzugeben!! Das Protokoll ist handschriftlich
Metabolismus Umwandlung von Stoffen und Energie nach den Gesetzen der Thermodynamik
 Metabolismus Umwandlung von Stoffen und Energie nach den Gesetzen der Thermodynamik Der Metabolismus oder Stoffwechsel ist die Gesamtheit der in einem Organismus ablaufenden (bio)chemischen Prozesse Der
Metabolismus Umwandlung von Stoffen und Energie nach den Gesetzen der Thermodynamik Der Metabolismus oder Stoffwechsel ist die Gesamtheit der in einem Organismus ablaufenden (bio)chemischen Prozesse Der
Experimentelle Ermittlung der molaren Lösungswärme von Kaliumchlorid
 Experimentelle Ermittlung der molaren Lösungswärme von Kaliumchlorid Versuchsaufbau : Um den Versuch durchzuführen, benötigen wir 180 g Wasser, welches in ein Becherglas gefüllt wird. Die Temperatur ermitteln
Experimentelle Ermittlung der molaren Lösungswärme von Kaliumchlorid Versuchsaufbau : Um den Versuch durchzuführen, benötigen wir 180 g Wasser, welches in ein Becherglas gefüllt wird. Die Temperatur ermitteln
Lehrplan Chemie Grobziele
 Kantonsschule Rychenberg Winterthur Lehrplan Chemie Grobziele 1. und 2. Klasse Die Naturwissenschaft Chemie, Betrachtung der Materie, naturwissenschaftliche Arbeitsweise und Modell-Begriff, Grundteilchen-Modell,
Kantonsschule Rychenberg Winterthur Lehrplan Chemie Grobziele 1. und 2. Klasse Die Naturwissenschaft Chemie, Betrachtung der Materie, naturwissenschaftliche Arbeitsweise und Modell-Begriff, Grundteilchen-Modell,
Siede- und Schmelztemperatur
 Schulversuchspraktikum Name: Anna Elisabeth Gulyas Semester: Sommersemester 2013 Klassenstufen 5 & 6 Siede- und Schmelztemperatur Auf einen Blick: In dieser Unterrichtseinheit lernen die SuS Siede- und
Schulversuchspraktikum Name: Anna Elisabeth Gulyas Semester: Sommersemester 2013 Klassenstufen 5 & 6 Siede- und Schmelztemperatur Auf einen Blick: In dieser Unterrichtseinheit lernen die SuS Siede- und
Fragenkatalog für die 9. Klasse des sprachlichen Zweiges in Chemie
 Fragenkatalog für die 9. Klasse des sprachlichen Zweiges in Chemie Alle Fragen beziehen sich auf das Grundwissen (Karten 1-18) Die angegeben Karten hinter dem Thema der Frage bezeichnen nur den Schwerpunkt
Fragenkatalog für die 9. Klasse des sprachlichen Zweiges in Chemie Alle Fragen beziehen sich auf das Grundwissen (Karten 1-18) Die angegeben Karten hinter dem Thema der Frage bezeichnen nur den Schwerpunkt
Bildungsplan 2004 Allgemein bildendes Gymnasium
 Bildungsplan 2004 Allgemein bildendes Gymnasium Niveaukonkretisierung für Naturwissenschaft und Technik Klasse 10 Landesinstitut für Schulentwicklung Experimente Themenkreis Wasser Qualitätsentwicklung
Bildungsplan 2004 Allgemein bildendes Gymnasium Niveaukonkretisierung für Naturwissenschaft und Technik Klasse 10 Landesinstitut für Schulentwicklung Experimente Themenkreis Wasser Qualitätsentwicklung
Schulversuchspraktikum. Sina Bachsmann. Sommersemester. Klassenstufen 11 &12. Kosmetikartikel
 Schulversuchspraktikum Sina Bachsmann Sommersemester Klassenstufen 11 &12 Kosmetikartikel 1 Lehrerversuche 1 Auf einen Blick: Dieses Protokoll enthält einen Lehrerversuch und vier Schülerversuche zum Thema
Schulversuchspraktikum Sina Bachsmann Sommersemester Klassenstufen 11 &12 Kosmetikartikel 1 Lehrerversuche 1 Auf einen Blick: Dieses Protokoll enthält einen Lehrerversuch und vier Schülerversuche zum Thema
E2-1-2 Beispiel Experiment Biologie 1/6 Entwicklung von kompetenzorientiertem Unterricht am Beispiel eines Experiments
 E2-1-2 Beispiel Experiment Biologie 1/6 Entwicklung von kompetenzorientiertem Unterricht am Beispiel eines Experiments Nachweis von Stärke in Blättern: (aus Westermann; BIO 2 Rheinlandpfalz, Saarland;
E2-1-2 Beispiel Experiment Biologie 1/6 Entwicklung von kompetenzorientiertem Unterricht am Beispiel eines Experiments Nachweis von Stärke in Blättern: (aus Westermann; BIO 2 Rheinlandpfalz, Saarland;
Die Brandbekämpfung (Gruppenversuche)
 Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik
 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Sicherheitsvorkehrungen im Chemieunterricht
 Thema.: Sicherheitsvorkehrungen im Chemieunterricht Kompetenz: LehramtsanwärterInnen kennen und beachten die grundlegenden gesetzlichen Sicherheitsbestimmungen. die geltenden Sicherheitsbestimmungen: rechtliche
Thema.: Sicherheitsvorkehrungen im Chemieunterricht Kompetenz: LehramtsanwärterInnen kennen und beachten die grundlegenden gesetzlichen Sicherheitsbestimmungen. die geltenden Sicherheitsbestimmungen: rechtliche
Von Arrhenius zu Brönsted
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 9 & 10 Von Arrhenius zu Brönsted dem Fehler! 2 Auf einen Blick: In diesem Protokoll werden Versuche vorgestellt, durch die die Notwendigkeit der
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 9 & 10 Von Arrhenius zu Brönsted dem Fehler! 2 Auf einen Blick: In diesem Protokoll werden Versuche vorgestellt, durch die die Notwendigkeit der
Reaktion von Säuren und Basen mit Metallen und Nichtmetallen
 Schulversuchspraktikum Name: Benjamin Heuer Semester: SS2013 Klassenstufen 9&10 Reaktion von Säuren und Basen mit Metallen und Nichtmetallen 1 Beschreibung des Themas und zugehörige Lernziele 1 1 Auf einen
Schulversuchspraktikum Name: Benjamin Heuer Semester: SS2013 Klassenstufen 9&10 Reaktion von Säuren und Basen mit Metallen und Nichtmetallen 1 Beschreibung des Themas und zugehörige Lernziele 1 1 Auf einen
!!! Du darfst eine Teilaufgabe von Nr. 2 und zwei der Teilaufgaben von Nr 4 streichen!!!
 1 Klassenarbeit Chemie 1/5 A TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! In der Tabelle links stehende Elemente haben eher die maximale Wertigkeit! In der Tabelle rechts stehende Elemente
1 Klassenarbeit Chemie 1/5 A TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! In der Tabelle links stehende Elemente haben eher die maximale Wertigkeit! In der Tabelle rechts stehende Elemente
B Chemisch Wissenwertes. Arrhénius gab 1887 Definitionen für Säuren und Laugen an, die seither öfter erneuert wurden.
 -I B.1- B C H E M I S C H W ISSENWERTES 1 Säuren, Laugen und Salze 1.1 Definitionen von Arrhénius Arrhénius gab 1887 Definitionen für Säuren und Laugen an, die seither öfter erneuert wurden. Eine Säure
-I B.1- B C H E M I S C H W ISSENWERTES 1 Säuren, Laugen und Salze 1.1 Definitionen von Arrhénius Arrhénius gab 1887 Definitionen für Säuren und Laugen an, die seither öfter erneuert wurden. Eine Säure
Katalysator vor und nach der Reaktion
 Katalysator vor und nach der Reaktion Braunstein als Katalysator bei der Zersetzung von Wasserstoffperoxid Wasserstoffperoxid ist wenig stabil und zerfällt leicht. Dabei entsteht Sauerstoff, der mit Hilfe
Katalysator vor und nach der Reaktion Braunstein als Katalysator bei der Zersetzung von Wasserstoffperoxid Wasserstoffperoxid ist wenig stabil und zerfällt leicht. Dabei entsteht Sauerstoff, der mit Hilfe
Curriculum Fach: Chemie Klasse: 8 Hölderlin-Gymnasium Nürtingen. Chemie
 Klassenstufe 8 BS (nach S. 196/197) Curriculum Fach: Chemie Klasse: 8 Chemie Kerncurriculum Inhalte Zeit Kompetenzen: die Schülerinnen und Schüler können Stoffe und ihre Eigenschaften Bemerkungen Wichtige
Klassenstufe 8 BS (nach S. 196/197) Curriculum Fach: Chemie Klasse: 8 Chemie Kerncurriculum Inhalte Zeit Kompetenzen: die Schülerinnen und Schüler können Stoffe und ihre Eigenschaften Bemerkungen Wichtige
Speisen und Getränke alles Chemie Inhaltsfeld: Stoffe und Stoffveränderungen
 Speisen und Getränke alles Chemie Inhaltsfeld: Stoffe und Stoffveränderungen Umfang: Jgst.: 2 WS 7/1 Gemische und Reinstoffe Stoffeigenschaften Stofftrennverfahren Einfache Teilchenvorstellung Kennzeichen
Speisen und Getränke alles Chemie Inhaltsfeld: Stoffe und Stoffveränderungen Umfang: Jgst.: 2 WS 7/1 Gemische und Reinstoffe Stoffeigenschaften Stofftrennverfahren Einfache Teilchenvorstellung Kennzeichen
Praktikumsrelevante Themen
 Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
Schulcurriculum Chemie am KGH Jg. 7. 1. Stoffe und Stoffänderungen. Fachliche Kontexte/methodische Hinweise
 Schulcurriculum Chemie am KGH Jg. 7 Inhaltsfelder und fachliche Kontexte des Kernlehrplans Richtlinien zur Sicherheit im Unterricht an allgemein bildenden Schulen in Nordrhein- Westfalen (RISU-NRW) 1.
Schulcurriculum Chemie am KGH Jg. 7 Inhaltsfelder und fachliche Kontexte des Kernlehrplans Richtlinien zur Sicherheit im Unterricht an allgemein bildenden Schulen in Nordrhein- Westfalen (RISU-NRW) 1.
Grundwissen Chemie 8I
 1) Stoffe, Experimente Chemie ist die Lehre von den Stoffen, ihren Eigenschaften, ihrem Aufbau, ihren Veränderungen und ihrer Herstellung. Einfache Möglichkeiten der Stofferkennung (Farbe, Glanz, Kristallform,
1) Stoffe, Experimente Chemie ist die Lehre von den Stoffen, ihren Eigenschaften, ihrem Aufbau, ihren Veränderungen und ihrer Herstellung. Einfache Möglichkeiten der Stofferkennung (Farbe, Glanz, Kristallform,
1 Stoffe in Alltag und Technik
 Schülerband Blickpunkt Chemie 1 Niedersachsen (978-3-507-77292-2) Basiskonzept inhaltsbezogene Kompetenzen: Fachwissen prozessbezogene Kompetenzen: Erkenntnisgewinnung, Kommunikation, Bewertung Die Schülerinnen
Schülerband Blickpunkt Chemie 1 Niedersachsen (978-3-507-77292-2) Basiskonzept inhaltsbezogene Kompetenzen: Fachwissen prozessbezogene Kompetenzen: Erkenntnisgewinnung, Kommunikation, Bewertung Die Schülerinnen
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Reaktion von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad
 Schulversuchspraktikum Name: Philie Kiecksee Semester: SS2012 Klassenstufen 7&8 Reaktion von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad Auf einen Blick: Das Protokoll stellt eine Sammlung von
Schulversuchspraktikum Name: Philie Kiecksee Semester: SS2012 Klassenstufen 7&8 Reaktion von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad Auf einen Blick: Das Protokoll stellt eine Sammlung von
Schulversuchspraktikum. Miriam Jarrar. Sommersemester Klassenstufen 7 & 8. Korrosion
 Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 7 & 8 Korrosion 1 Kontext und Ziele 1 Auf einen Blick: Dieses Protokoll beinhaltet 2 Lehrerversuche und 4 Schülerversuche für die
Schulversuchspraktikum Miriam Jarrar Sommersemester 2012 Klassenstufen 7 & 8 Korrosion 1 Kontext und Ziele 1 Auf einen Blick: Dieses Protokoll beinhaltet 2 Lehrerversuche und 4 Schülerversuche für die
Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium
 Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium Unterrichtsfach Themenbereich/e Schulstufe (Klasse) Fachliche Vorkenntnisse Sprachliche Kompetenzen Zeitbedarf Material- & Medienbedarf
Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium Unterrichtsfach Themenbereich/e Schulstufe (Klasse) Fachliche Vorkenntnisse Sprachliche Kompetenzen Zeitbedarf Material- & Medienbedarf
Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl)
 Abhängigkeit der Reaktionsgeschwindigkeit Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl) Beim Lösen von Kalk in Salzsäure bildet sich ein gut wasserlösliches
Abhängigkeit der Reaktionsgeschwindigkeit Abhängigkeit der Reaktionsgeschwindigkeit (RG) von der Konzentration: Kalk (CaCO 3 ) + Salzsäure (HCl) Beim Lösen von Kalk in Salzsäure bildet sich ein gut wasserlösliches
Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat
 Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat Zeitaufwand: Aufbau: 5 Minuten Durchführung: 10 Minuten Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
Versuchsprotokoll: Zuckerwürfel in Kaliumchlorat Zeitaufwand: Aufbau: 5 Minuten Durchführung: 10 Minuten Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm
 Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Welche Eigenschaften besitzen Calcium- und Magnesiumlaugen?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Aufgaben verändern Beispiele zur Chemie
 A2-2-2 Aufgaben verändern Beispiele zur Chemie 1 Aufgaben verändern Beispiele zur Chemie Die folgenden beiden Varianten einer Aufgabe zeigen exemplarisch, wie unterschiedlich Frage- und Aufgabenstellungen,
A2-2-2 Aufgaben verändern Beispiele zur Chemie 1 Aufgaben verändern Beispiele zur Chemie Die folgenden beiden Varianten einer Aufgabe zeigen exemplarisch, wie unterschiedlich Frage- und Aufgabenstellungen,
Schulversuchspraktikum. Johanna Schakowske Sommersemester 2013 Klassenstufen 9 & 10. Methan und Erdgas
 Schulversuchspraktikum Johanna Schakowske Sommersemester 2013 Klassenstufen 9 & 10 Methan und Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Diese Unterrichtseinheit zum Thema Methan und Erdgas enthält
Schulversuchspraktikum Johanna Schakowske Sommersemester 2013 Klassenstufen 9 & 10 Methan und Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Diese Unterrichtseinheit zum Thema Methan und Erdgas enthält
CHEMISCHE REAKTIONEN (SEKP)
 KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 6 Kalorimetrie Aufgabe: Mittels eines Flüssigkeitskalorimeters ist a) die Neutralisationsenthalpie von säure b) die ösungsenthalpie
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 6 Kalorimetrie Aufgabe: Mittels eines Flüssigkeitskalorimeters ist a) die Neutralisationsenthalpie von säure b) die ösungsenthalpie
Die vorliegenden Arbeitsblätter enthalten vor allem experimentelle Zugänge zum Projektthema.
 Hinweise für die Lehrkräfte Der Inhalt der Arbeitsblätter orientiert sich vor allem am Lehrplan des G8 für die 8. und 9. Klasse Chemie im Rahmen der Unterrichtsgegenstände Teilchenmodell und Aggregatzustandsänderungen
Hinweise für die Lehrkräfte Der Inhalt der Arbeitsblätter orientiert sich vor allem am Lehrplan des G8 für die 8. und 9. Klasse Chemie im Rahmen der Unterrichtsgegenstände Teilchenmodell und Aggregatzustandsänderungen
spaltet. Der Sauerstoff entflammt den Glimmspan. Bei der katalytischen Substanz handelt es sich um das Enzym Katalase.
 ENZYMATIK 1. Vorversuch Versuch Spaltung von Wasserstoffperoxid (H 2 O 2 ) Material: Bäckerhefe, Braunstein (MnO 2 ), Wasserstoffperoxid, Rundkolben, Stativ, Brenner, Glimmspan Durchführung 1: 5ml Wasserstoffperoxid
ENZYMATIK 1. Vorversuch Versuch Spaltung von Wasserstoffperoxid (H 2 O 2 ) Material: Bäckerhefe, Braunstein (MnO 2 ), Wasserstoffperoxid, Rundkolben, Stativ, Brenner, Glimmspan Durchführung 1: 5ml Wasserstoffperoxid
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg
 TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
Schriftliche Abschlussprüfung Chemie
 Sächsisches Staatsministerium für Kultus Schuljahr 2002/2003 Geltungsbereich: für Klassen 10 an Mittelschulen Förderschulen Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss Allgemeine
Sächsisches Staatsministerium für Kultus Schuljahr 2002/2003 Geltungsbereich: für Klassen 10 an Mittelschulen Förderschulen Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss Allgemeine
Betriebsanweisung nach 20 Gefahrstoffverordnung. Verwendete Chemikalien /37/ Kupfer (Pulver) - -
 Versuche 85-91 3 Problemfeld Stoffkreisläufe Betriebsanweisung nach 20 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeits merkmale Ammoniumdiammintetrathiocyanatochromat(III)
Versuche 85-91 3 Problemfeld Stoffkreisläufe Betriebsanweisung nach 20 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeits merkmale Ammoniumdiammintetrathiocyanatochromat(III)
Alle Experimente dürfen nur unter Aufsicht eines Erwachsenen und im Freien durchgeführt werden!
 Alle Experimente dürfen nur unter Aufsicht eines Erwachsenen und im Freien durchgeführt werden! Verhaltensregeln für alle Experimente: - Lange Haare müssen zusammengebunden werden - Tragen von Tüchern
Alle Experimente dürfen nur unter Aufsicht eines Erwachsenen und im Freien durchgeführt werden! Verhaltensregeln für alle Experimente: - Lange Haare müssen zusammengebunden werden - Tragen von Tüchern
Laborführerschein. Dieses Skript gehört:
 Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
Laborführerschein Dieses Skript gehört: Laborführerschein Seite 2 Station 1: Laborgeräte, ein Muss für jeden Chemiker Welche Laborgeräte des Titelbildes findest Du in der Liste wieder? Suche an deinem
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT. Abitur April/Mai 2002. Chemie (Grundkurs) Thema 1 Wasserstoff
 KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur April/Mai 2002 Chemie (Grundkurs) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Thema 1 Wasserstoff Thema 2 Organische Verbindungen und ihr Reaktionsverhalten
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur April/Mai 2002 Chemie (Grundkurs) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Thema 1 Wasserstoff Thema 2 Organische Verbindungen und ihr Reaktionsverhalten
Kapitel 13: Laugen und Neutralisation
 Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Schulversuchspraktikum. SoSe 2013. Klassenstufen 7 & 8. Dichte
 Schulversuchspraktikum SoSe 2013 Klassenstufen 7 & 8 Dichte 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche und vier Schülerversuche vorgestellt, die sich mit der Dichte von Gasen und Flüssigkeiten,
Schulversuchspraktikum SoSe 2013 Klassenstufen 7 & 8 Dichte 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche und vier Schülerversuche vorgestellt, die sich mit der Dichte von Gasen und Flüssigkeiten,
Kompetenzen Natur und Technik Check S2/S3
 Institut für Bildungsevaluation Assoziiertes Institut der Universität Zürich Kompetenzen Natur und Technik Check S2/S3 Informationen für Lehrpersonen und Eltern 1. Wie sind die Ergebnisse dargestellt?
Institut für Bildungsevaluation Assoziiertes Institut der Universität Zürich Kompetenzen Natur und Technik Check S2/S3 Informationen für Lehrpersonen und Eltern 1. Wie sind die Ergebnisse dargestellt?
Erhitzen von Lithium, Natrium und Kalium
 Reaktionsgleichungen 4 Li s + O 2 g 2 Li 2 O s 2 Na s + O 2 g Na 2 O 2 s K s + O 2 (g) KO 2 (s) Zeitbedarf Vorbereitung: 10 min. Durchführung: 10 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Reaktionsgleichungen 4 Li s + O 2 g 2 Li 2 O s 2 Na s + O 2 g Na 2 O 2 s K s + O 2 (g) KO 2 (s) Zeitbedarf Vorbereitung: 10 min. Durchführung: 10 min. Nachbereitung: 5 min. Chemikalienliste Edukte Chemikalien
Naturwissenschaft Vermutungswissen Alles ist Chemie!!! Analyse Synthese
 SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
Trennverfahren auf Basis der Dichte
 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 7 & 8 Dichte und dessen Abhängigkeit von der Temperatur; Trennverfahren auf Basis der Dichte 2 Auf einen Blick: Diese Unterrichtseinheit
Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 7 & 8 Dichte und dessen Abhängigkeit von der Temperatur; Trennverfahren auf Basis der Dichte 2 Auf einen Blick: Diese Unterrichtseinheit
Rein oder nicht rein?
 Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Oliver Gerdau FOS-T Lerngebiert: Energieressourcen schonen
 Oliver Gerdau FOS-T Lerngebiert: Energieressourcen schonen 15.05.2011 1 Energiespeicherung (Versuch) Latentwärmespeicher Phasenwechselmaterialien (PCM) Versuch Phasenumwandlung eines Wärmekissens Anwendungsgebiete
Oliver Gerdau FOS-T Lerngebiert: Energieressourcen schonen 15.05.2011 1 Energiespeicherung (Versuch) Latentwärmespeicher Phasenwechselmaterialien (PCM) Versuch Phasenumwandlung eines Wärmekissens Anwendungsgebiete
Chemikalien: Salzsäure (Schwefelsäure) Magnesiumspäne, Eisen-, Zink-, Kupfer-Späne, Silberstreifen
 I) Verhalten von Säuren gegenüber Metallen II) Der Saure Regen in Modellversuchen III) Neutralisation a) Neutralisation ( Salzsäure mit Natronlauge) b) Eindampfen der Salzlösung c) Elektrische Leitfähigkeitsmessung
I) Verhalten von Säuren gegenüber Metallen II) Der Saure Regen in Modellversuchen III) Neutralisation a) Neutralisation ( Salzsäure mit Natronlauge) b) Eindampfen der Salzlösung c) Elektrische Leitfähigkeitsmessung
