9ST Sciences naturelles. Chimie
|
|
|
- Waltraud Waltz
- vor 6 Jahren
- Abrufe
Transkript
1 MJS ST Sciences naturelles Chimie Ce cours est basé sur les anciens cours interactifs de 8 e et de 9 e EST: L'édition 2016 est générée à partir de la version HTML et mise au point par: Schaeffer Marcel Steil Robert (un grand merci à Steffen Martine pour les animations flash)
2 Inhaltsverzeichnis Seite 1. Wiederholung: a. Chemische und physikalische Vorgänge 1 b. Stoffe und Stoffeigenschaften 3 c. Synthese und Analyse 4 d. Einteilung der Stoffe 7 2. Stoffteilchen: a. Atome - Chemische Symbole 8 b. Das Periodensystem der Elemente (PSE) 11 c. Eigenschaften von Metallen und Nichtmetallen 12 d. Verbindungen 13 e. Summenformel Zusammensetzung der Luft 4. Reaktionen mit Sauerstoff, Bildung von Oxiden 5. Chemische Reaktion - Chemische Gleichung: a. Chemische Reaktion (Modelldarstellung und Reaktionsschema) 22 b. Chemische Gleichung (Ausgleichen) Verbrennung: a. Die Verbrennungsreaktion 28 b. Voraussetzungen für eine Verbrennung 29 c. Brände und Brandbekämpfung 31 d. Feuerlöscher und Brandklassen
3 1 1. Wiederholung a. Chemische und physikalische Vorgänge Versuch 1: Eisenwolle wird in die Flamme des Bunsenbrenners gehalten und dann entfernt. Versuch 2: In einem Reagenzglas wird etwas Wachs erhitzt.
4 2 Versuch 3: In einem Reagenzglas wird etwas Zucker stark erhitzt. Versuch 4: In einem Erlenmeyerkolben wird etwas Kochsalz vollständig aufgelöst. Bei den Versuchen 2 und 4 ändern die Eigenschaften der Stoffe, die Stoffe selbst bleiben aber unverändert (physikalischer Vorgang). Bei den Versuchen 1 und 3 entstehen neue Stoffe mit neuen Eigenschaften (chemischer Vorgang). Merke: Bei einem physikalischen Vorgang bleiben die Stoffe erhalten, ihre chemische Zusammensetzung bleibt unverändert. Bei einem chemischen Vorgang (chemische Reaktion) entstehen neue Stoffe, die chemische Zusammensetzung ändert.
5 3 b. Stoffe: Merke: Jeder Gegenstand (Körper) besteht aus einem bestimmten Material. Dieses Material nennt man auch noch Stoff. Jeder Stoff hat charakteristische Stoffeigenschaften in denen er sich von anderen Stoffen unterscheidet. Beispiele: Gegenstand Stoff(e) Stoffeigenschaften Tasse Kabel Fensterscheibe Handschuh für Schweißer Winterhandschuh Säureschutzhandschuh Bemerkung: Neben den Stoffeigenschaften hat jeder Gegenstand auch noch andere Eigenschaften, die nicht vom Stoff abhängig sind
6 4 c. Analyse und Synthese: zwei verschiedene chemische Reaktionen Zersetzung (Analyse) von Wasser durch elektrischen Strom. Versuch: Man füllt den Hofmann'schen Zersetzungsapparat mit destilliertem Wasser. Über zwei Platinelektroden wird eine elektrische Gleichspannung von etwa 15 V an das Wasser angelegt.
7 + Die Reinstoffe Sauerstoff und Wasserstoff lassen sich nicht mehr in einfachere Stoffe zerlegen. Solche Reinstoffe bezeichnet man als chemische Grundstoffe oder chemische Elemente. Reinstoffe, die sich, wie das Wasser, in verschiedene Grundstoffe zerlegen lassen, bezeichnet man als chemische Verbindungen. Auf ähnliche Weise wie das Wasser können auch andere chemische Verbindungen in Grundstoffe zerlegt werden. 5 Herstellung einer chemischen Verbindung. Versuch: ln einem Mörser werden 14 g Eisenpulver und 8 g Schwefelpulver zu einem feinen Gemisch zerrieben. Das Gemisch wird auf zwei Reagenzgläser verteilt. Das eine Reagenzglas wird stark erhitzt, das andere wird nicht erhitzt. (a) nicht erhitztes Reagenzglas (b) erhitztes Reagenzglas
8 6 Aussehen nicht erhitztes Reagenzglas erhitztes Reagenzglas mit einem Magneten prüfen mit Wasser schütteln Reaktion mit Salzsäure Gemenge oder Verbindung Name
9 7 d. Einteilung der Stoffe Aufgabe: Trage die Begriffe Analyse, Elemente, Gemenge, Reinstoffe, Synthese, Trennen, Verbindungen und Vermischen in folgendes Schema ein! (Hinweis: Die Definitionen der verschiedenen Begriffe im Merketext sorgfältig lesen!) Merke: Ein Reinstoff (reiner Stoff) besteht aus einer einzelnen Stoffart. Ein Gemisch (Stoffgemenge, Mischung) besteht aus mehreren Stoffarten, die nebeneinander vorliegen. Gemische kann man durch physikalische Trennverfahren in Reinstoffe trennen. Durch Vermischen (physikalischer Vorgang) von Reinstoffen erhält man Gemische. Die Elemente (Grundstoffe) sind die einfachsten Reinstoffe, die man kennt. Man kann sie mit keiner Methode mehr zersetzen. Verbindungen sind Reinstoffe, die man in andere einfachere Stoffe zerlegen kann. Die Herstellung von chemischen Verbindungen aus Elementen nennt man chemische Synthese. Die Synthese ist ein chemischer Vorgang. Die Zersetzung einer Verbindung in Elemente nennt man chemische Analyse. Die Analyse ist ein chemischer Vorgang.
10 8 2. Atome - Chemische Symbole + Um zu erklären, dass die Grundstoffe nicht weiter zerlegbar sind, nahm der englische Wissenschaftler John Dalton um 1800 an, dass die chemischen Elemente aus unteilbaren Teilchen bestehen. Er nannte diese Teilchen Atome, so wie man schon im Altertum die kleinsten Bausteine aller Stoffe genannt hatte (griechisch: atomos = unteilbar). Merke: 1. Die Atome sind die kleinsten Bausteine der Stoffe. Sie sind unveränderlich und unteilbar. 2. Jedes chemische Element besteht aus einer bestimmten Atomart. Man kennt heute 92 natürliche und fast zwei Dutzend künstliche, von Wissenschaftlern hergestellte Atomarten. 3. Die Atome der einzelnen Atomarten sind kugelförmig. Sie unterscheiden sich durch ihre Größe und ihre Masse. Für John Dalton war jeder Grundstoff aus einer bestimmten Art von Atomen aufgebaut. Er stellte sich die Atome als winzig kleine Kugeln vor. Obwohl es im Prinzip überholt ist kann das Dalton'sche Atommodell auch heute noch viele chemische Vorgänge erklären. Beispiele: - Wasserstoffatom (leichtestes Atom): Radius: r 0,5 x m = 0, m = 0, mm Masse: m 1,6 x g = 0, g - Uranatom (schwerstes Atom in der Natur): Radius: r 1,4 x m = 0, m = 0, mm Masse: m 381 x g = 0, g + Diese Winzigkeit der Atome ist für uns unvorstellbar. Durch die folgenden Vergleiche und Gedankenexperimente wollen wir versuchen einen Eindruck von der Winzigkeit der kleinsten Stoffteilchen zu gewinnen: Millionen Eisenatome in einer Reihe ergeben eine Kette von gerade 1 cm Länge. - Bei milliardenfacher Vergrößerung wäre ein Atom so groß wie ein Kinderspielball. Ein Staubkorn würde bei gleicher Vergrößerung eine ganze Großstadt bedecken. - Wäre ein Atom so groß wie ein Tennisball, so müsste bei gleichem Maßstab ein Mensch 2 Millionen km groß sein. Er würde dann so weit in den Weltraum hinausragen, dass der Mond etwa unterhalb seiner Knie stehen würde.
11 + Einfachheitshalber verwendet der Chemiker für jede einzelne Atomart ein internationales Kurzzeichen oder Symbol. Diese Atomsymbole wurden 1818 vom Chemiker J.J. Berzelius aus den lateinischen oder griechischen Namen der Elemente abgeleitet. 9 Merke: Jede Atomart wird mit einem chemischen Symbol abgekürzt. Das Elementsymbol besteht aus einem oder zwei Druckbuchstaben, wobei der erste immer groß, der zweite immer klein geschrieben wird. Beispiele: Wasserstoff = Hydrogenium; Symbol: H Gold = Aurum; Symbol: Au + Tabelle einiger wichtiger Atomarten und ihrer Symbole Atom Symbol Metalle Atom Symbol Nichtmetalle Aluminium Barium Blei (plomb) Calcium Cadmium Chrom (chrome) Eisen (fer) Gold (or) Kalium (potassium) Kobalt (cobalte) Kupfer (cuivre) Lithium Magnesium Mangan (manganèse) Natrium (sodium) Nickel Platin (platine) Quecksilber (mercure) Silber (argent) Titan Uran (uranium) Vanadium Zink (zinc) Zinn (étain) Al Ba Pb Ca Cd Cr Fe Au K Co Cu Li Mg Mn Na Ni Pt Hg Ag Ti U V Zn Sn Brom (brome) Chlor (chlore) Fluor (fluor) lod (iode) Kohlenstoff (carbone) Phosphor (phosphore) Sauerstoff (oxygène) Schwefel (soufre) Stickstoff (azote) Wasserstoff (hydrogène) Halbmetalle: Arsen (arsenic) Bor Silicium Edelgase: Argon Helium Neon Br Cl F I C P O S N H As B Si Ar He Ne
12 + Das Symbol kann nicht nur benutzt werden um den Elementnamen abzukürzen, sondern auch noch um Atome zu zählen: Werden mehrere einzelne Atome der gleichen Art angeschrieben, so stellt man die entsprechende Zahl als Koeffizient vor das Symbol. 10 Beispiele: Fe bedeutet: 5 He bedeutet: 13 S bedeutet: 10 Au bedeutet: 1. das Element Eisen 2. ein Eisenatom 5 Heliumatome 13 Schwefelatome 10 Goldatome Merke: Das Symbol steht für das Element selbst und für ein Atom des Elementes. Werden mehrere gleiche Teilchen angegeben, so schreibt man ihre Zahl als Koeffizient vor das Symbol. Aufgabe: Gib die Bedeutung der folgenden Ausdrücke an: Ausdruck Bedeutung P 15 Ag 23 Na Zn + 3 Sn 5 K + 9 Ne + Obwohl es auf der Erde nur 92 natürlich vorkommende Arten von Atomen gibt, sind zur Zeit ungefähr 15 Millionen verschiedene Reinstoffe bekannt, die jeder aus einer bestimmten Stoffart bestehen. Dies lässt sich dadurch erklären, dass die meisten Stoffe aus Verbindungen bestehen, Teilchen in denen mehrere verschiedene Atome miteinander verbunden sind. Eine Analogie findet man in der Sprache: Die Elementsymbole sind gleichzusetzen mit den. Verbindungen bestehen aus mehreren Atomen die zusammenhängen. Es sind sozusagen die. Genau wie bei Wörtern kommt es bei Verbindungen nicht nur darauf an, wie viele Atome jeder Art in der Verbindung enthalten sind (Verbindung Veeerbiiindung), sondern auch noch auf die richtige Reihenfolge (Verbindung Dungverbin)
13 11 b. Das Periodensystem der Elemente (PSE) Im PSE sind die Elementsymbole aller bekannten Elemente angegeben. Die Elemente sind im PSE in Gruppen eingeordnet: Alle Elemente einer Gruppe haben ähnliche Eigenschaften. Das PSE besteht aus Hauptgruppen (Spalten I - II und III - VII) und aus Nebengruppen. Die Zeilen werden als Perioden bezeichnet (1-7). Mit Hilfe des PSE kann man problemlos Elemente von Verbindungen unterscheiden: nur solche Reinstoffe welche man im PSE vorfindet sind Elemente. Reintoffe welche aus zwei oder mehreren Elementen aufgebaut sind, entsprechen Verbindungen. Oft benutzt man auch eine vereinfachte Version des PSE, welches nur die 8 Hauptgruppen angibt: Ausser dass das PSE angibt, welche Reinstoffe Elemente sind, kann man leicht noch andere Informationen erhalten, zum Beispiel ob ein Element ein Metall, ein Nichtmetall oder ein Halbmetall ist. In sehr grober Aufteilung, links die Metalle (Ausnahme: Wasserstoff, das erste Element), rechts die Nichtmetalle und eine treppenartige Trennung welche die Halbmetalle angibt. Die Elemente der Nebengruppen sind alle Metalle (zum Beispiel: Eisen, Silber, Kupfer...) Die Elemente einer Hauptgruppe haben ähnliche Eigeschaften, einige Hauptgruppennamen solte man kennen: Hauptgruppe I: Alkalimetalle Hauptgruppe II: Erdalkalimetalle Hauptgruppe VII: Halogene Hauptgruppe VIII: Edelgase
14 12 c. Eigenschaften von Metallen und Nichtmetallen Versuch: Wir untersuchen an größeren Probestücken der Metalle Eisen, Zink, Kupfer, Magnesium und Platin den Aggregatzustand, die Oberfläche (glänzend oder matt), die elektrische Leitfähigkeit, die Wärmeleitfähigkeit, die Sprödigkeit (Verformbarkeit), die Brennbarkeit an der Luft, das Verhalten gegenüber von verdünnter Salzsäure und die Korrosion (Rosten, Anlaufen). Anschließend werden die gleichen Eigenschaften an größeren Probestücken der Nichtmetalle Schwefel und Kohlenstoff (Graphit) untersucht. Bemerkungen zur Versuchsdurchführung: - der Glanz kann nur an einer frisch polierten Oberfläche geprüft werden; - die Wärmeleitfähigkeit wird geprüft indem man (zum Vergleich) jeweils dünne Stangen von einem Metall und einem Nichtmetall in ein Gefäß mit siedendem Wasser taucht; - zur Untersuchung der Korrosion lässt man das entsprechende Element mit blanker angefeuchteter Oberfläche einige Zeit an der Luft liegen. Fe Zn Cu Mg Pt S C Aggregatzustand Oberfläche Elektrische Leitfähigkeit Wärmeleitfähigkeit Sprödigkeit Brennbarkeit Verhalten gegen verdünnte Säure Korrosion Merke: Metalle sind feste Stoffe mit glänzender Oberfläche; sie sind gute Strom- und Wärmeleiter. Die unedlen Metalle werden von den Säuren angegriffen und laufen an der Luft an, rosten, korrodieren, überziehen sich mit einer matten Oxidschicht. Edelmetalle korrodieren nur sehr langsam oder gar nicht. Metalle sind nicht spröde, sie sind leicht verformbar. Feste Nichtmetalle besitzen keine glänzende Oberfläche; sie sind schlechte Strom- und Wärmeleiter (außer Kohlenstoff in Form von Graphit), sie werden nicht von Säuren angegriffen und sie laufen nicht an der Luft an Nichtmetalle sind spröde, sie sind nicht gut verformbar.
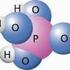
15 13 d. Verbindungen Merke: Verbindungen sind kleinste Stoffteilchen, die aus zwei oder mehreren verschiedenen Atomen aufgebaut sind. Die Atome sind in der Verbindung fest aneinander gebunden. Sie werden von starken Anziehungskräften, den Bindungskräften zusammengehalten. Beispiele: - Wasser Das kleinste Wasserteilchen ist eine Verbindung welche aus drei Atomen besteht: einem Sauerstoffatom und zwei Wasserstoffatomen, welche an das Sauerstoffatom gebunden sind. ein Wasserteilchen zwei Wasserteilchen Chemische Schreibweise: - Methan Methan (im Erdgas enthalten) ist eine Verbindung. in Methanteilchen besteht aus Atomen: Chemische Schreibweise: - Alkohol Alkohol (Ethanol) ist eine Verbindung. Ein Ethanolteilchen besteht aus Atomen: Chemische Schreibweise: Merke: Chemische Verbindungen
16 14 e. Summenformel Die Zusammensetzung von Reinstoffen wird mit einer chemischen Formel (Sumneformel) angegeben. Name Summenformel Wasserstoff H 2 Sauerstoff Kohlenstoffdioxid Ethanol (Alkohol) Traubenzucker Dimethylether Merke: Das Teilchenmodell Die Summenformel
17 + Summenformel Sie besteht aus den chemischen Symbolen, der im Molekül miteinander verbundenen Atomarten; die Zahl der Atome im Molekül wird, jeweils unten rechts am chemischen Symbol, als Index angeschrieben; wenn es sich nur um ein Atom handelt, wird keine Zahl angeschrieben. Beispiele: 4 Wassermoleküle: 15 3 Kohlenstoffdioxidmoleküle: 3 CO 2 7 Sauerstoffmoleküle: 7 O 2 13 Traubenzuckermoleküle: 13 C 6 H 12 O 6 (Die Gesamtzahl an Atomen einer bestimmten Atomart kann durch die Multiplikation des Koeffizienten mit der entsprechenden Indexzahl errechnet werden.) Merke: Genau wie bei den Atomen können Koeffizienten verwendet werden um mehrere Teilchen der gleichen Art anzuschreiben. Die Indexzahlen welche hinter einem Atom in der chemischen Formel stehen, geben an wie viele dieser Atome im Teilchen vorkommen. Aufgaben: 1. Schreibe die chemische Formel an: a. Ein Molekül Chlor: es besteht aus 2 Chloratomen. b. 3 Moleküle Schwefelsäure: sie bestehen jeweils aus 2 Wasserstoffatomen, einem Schwefelatom und 4 Sauerstoffatomen. c. 6 Moleküle Rübenzucker (Saccharose): sie bestehen jeweils aus 12 Kohlenstoffatomen, 22 Wasserstoffatomen und 11 Sauerstoffatomen. d. Ein Molekül Schwefeldioxid: es besteht aus einem Schwefelatom und zwei Sauerstoffatomen. e. Fünf Atome Helium und dreizehn Moleküle Alkohol: jedes Alkoholmolekül besteht aus zwei Kohlenstoffatomen, sechs Wasserstoffatomen und einem Sauerstoffatom. f. Dreizehn Moleküle Kohlenstoffdioxid, drei Atome Neon und elf Moleküle Essigsäure: Ein Essigsäuremolekül besteht aus zwei Kohlenstoffatomen, vier Wasserstoffatomen und zwei Sauerstoffatomen.
18 16 2. Fülle folgende Tabelle aus! Beispiel Anzahl Atome jeder Atomart Moleküle Bedeutung (Zahl und Aufbau) 7 Au 7. 1 = 7 Au 0 7 (unabhängige) Goldatome 3 H 2 O NH 3 Ammoniak 3. 2 = 6 H 3. 1 = 3 O 3 3 Moleküle Wasser Ein Molekül Wasser besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom. 4 HCl Chlorwasserstoff 2 F F 2 5 H 3 PO 4 Phosphorsäure CHCl 3 Chloroform Pb CO 2 Kohlenstoffdioxid 3 He 12 HNO 3 Salpetersäure 11 CH 2 O Formaldehyd H 2 + O 2 5 H 2 O + 3 CO 2
19 17 3. Zusammensetzung der Luft Versuch: Die Kolbenprober im untenstehenden Versuchsaufbau werden mit insgesamt 100mL Luft befüllt. Die Eisenwolle wird mit dem Bunsenbrenner erhitzt und die Luft mit Hilfe der Kolbenprober mehrmals über die heiße Eisenwolle gedrückt. Merke: Der Teil der Luft, welcher bei der Verbrennung verbraucht wird, ist der Sauerstoff: er unterhält die Verbrennung. Die Restluft, in der jede Flamme erstickt, besteht hauptsächlich aus Stickstoff. Die Luft besteht hauptsächlich aus zwei Gasen: Stickstoff (4/5 oder 80%) und Sauerstoff (1/5 oder 20%).
20 18 4. Reaktionen mit Sauerstoff, Bildung von Oxiden Versuch 1: Ein wenig Schwefelpulver wird in einen Verbrennungslöffel gegeben und dann mit Hilfe des Bunsenbrenners entzündet. Dann wird der brennende Schwefel in einen Standzylinder, welcher reinen Sauerstoff enthält, getaucht. Aussehen Vor der Reaktion Nach der Reaktion Name Formel Aufstellen der chemischen Gleichung: Edukte Produkte Reaktionsbeschreibung: Wortgleichung: Formelgleichung: Schwefel reagiert mit Sauerstoff zu Schwefeldioxid. Schwefel + Sauerstoff Schwefeldioxid. +
21 Versuch 2: Ein Stück getrocknete Holzkohle wird in einen Verbrennungslöffel gegeben und dann mit Hilfe des Bunsenbrenners entzündet. Dann wird die glühende Holzkohle in einen Standzylinder, welcher reinen Sauerstoff enthält, getaucht. 19 Aussehen Vor der Reaktion Nach der Reaktion Name Formel Aufstellen der chemischen Gleichung: Edukte Produkte Reaktionsbeschreibung: Wortgleichung: Formelgleichung: Kohlenstoff reagiert mit Sauerstoff zu Kohlenstoffdioxid. Kohlenstoff + Sauerstoff Kohlenstoffdioxid. +
22 Versuch 3: In der Flamme des Bunsenbrenners verbrennt man Aluminium-, Eisen-, Zink-, Kupfer- und Magnesiumpulver. 20 Nicht alle Metalle regieren mit Sauerstoff, Gold findet man in der Natur als reines Metall. Solche Metalle welche keine Reaktion mit Sauerstoff eingehen nennt man Edelmetalle. Gib jeweils die Reaktionsbeschreibung und die Wortgleichung für die Bildung der Oxide von Aluminium-, Eisen-, Zink-, Kupfer- und Magnesiumpulver an. Aluminium Eisen Zink Kupfer Magnesium
23 Merke: Nichtmetalle reagieren mit Sauerstoff zu neuen Verbindungen den Nichtmetalloxiden. Nichtmetalloxide sind oft gasförmige Reinstoffe. Metalle reagieren mit Sauerstoff zu neuen Verbindungen den Metalloxiden. Metalloxide sind Feststoffe. Edelmetalle wie Gold bilden keine Oxide. Wenn Elemente miteinander reagieren um neue Verbindungen zu bilden spricht man Synthese. Aus Nichtmetallen und Sauerstoff kann man Nichtmetalloxide synthetisieren. Aus Metallen und Sauerstoff kann man Metalloxide synthetisieren Metalloxide Metalloxide die in der Natur vorkommen dienen als Erze zur Metallgewinnung. Um das reine Metall zu gewinnen muss man dem Eisenoxid den Sauerstoff entziehen, dies geschieht im Hochofen durch Verhüttung. Metalloxide werden als Erdfarben oder Erdpigmnete bezeichnet und wurden schon in der Steinzeit als Pigmente benutzt (Höhlenmalerei). Die Minette (Land der Roten Erde) im Süden Luxembourgs erhält die typische rote Farbe von einem Eisenoxid: Eisen(III)-oxid. + Nichtmetalloxide Umweltprobleme durch Nichtmetalloxide sind auf die Reaktion von Nichtmetalloxiden mit Wasser zurückzuführen, dabei entstehen harmlose (Kohlensäure) sowie sehr stark ätzende Säuren (Salpetersäure und Schwefelsäure). Herkunft der Oxide: Vor den 1970er Jahren wurde Benzin benutzt, welches kleine Mengen an Schwefelverbindungen besaß. In den Abgasen befand sich deshalb immer Schwefeldioxid. Stickstoff ist ein träges Gas, aber bei den hohen Temperaturen der Motoren reagieren sie trotzdem mit Sauerstoff zu Stickoxiden. In den Abgasen waren also zusätzlich Stickoxide vorhanden. In Industrieanlagen wo Kohle oder Petroleum (beide schwefelhaltig) verwendet wurden, wurden die Verbrennungsgase durch hohe Schornsteine in die Atmosphäre geleitet, auch hier wurden grosse Mengen an Schwefel- und Stickoxiden freigsetzt. Bei Vulkanausbrüchen werden riesige Mengen an Schwefeldioxid und anderen Gasen freigesetzt. Abhilfe: Durch Benutzen von schwefelfreiem Kraftstoff kann man die Bildung von Schwefeldioxid bei Motoren verhindern. Katalysatoren verwandeln Stickoxide in unschädliches Stickstoffgas. In Industrieanlagen werden die Abgase gefiltert. Die vom Menschen verursachten Emissionen kann man größtenteils unterbinden, auf Vulkanausbrüche aber hat man keinen Einfluß.
24 22 5. Chemische Reaktion - Chemische Gleichung + Durch Analyse werden Verbindungen wieder in Elemente oder einfachere Verbindungen zerlegt. Aus den chemischen Verbindungen entstehen neue, einfachere Stoffe mit ganz anderen Eigenschaften. Die Analyse ist also auch ein chemischer Vorgang, eine chemische Reaktion. Versuch 1: Ein wenig Silbersulfid (schwarzes Pulver) wird in ein Reagenzglas eingefüllt. Nach genauem Abwägen wird das Reagenzglas stark erhitzt. Danach wird erneut abgewogen. Aussehen Name Formel Vor der Reaktion Nach der Reaktion Interpretation: 1.Handelt es sich um einen chemischen oder einen physikalischen Vorgang?
25 2. Vergleiche die Gesamtmasse der Stoffe vor der Reaktion und nach der Reaktion. Hat die Gesamtmasse geändert? Was kann man daraus über die Zahl der Atome vor und nach der Reaktion schlussfolgern? 23 Merke: Gesetz von der Erhaltung der Masse Die Gesamtmasse der Stoffe ist vor und nach der Reaktion gleich; da die Atomarten gleich bleiben, bedeutet dies, dass die Zahl der Atome vor und nach der Reaktion gleich sind. Das Einrichten erfolgt, indem man entsprechende Koeffizienten vor die Formeln der beteiligten Stoffe einfügt. Aufstellen der chemischen Gleichung: Stoffe vor der Reaktion (Ausgangsstoffe, Edukte) Stoffe nach der Reaktion (Endstoffe, Produkte) Reaktionsbeschreibung: Silbersulfid wird zu Silber und Schwefel zersetzt. Wortgleichung: Silbersulfid Silber + Schwefel zersetzt. Formelgleichung: + Modelldarstellung: Silbersulfid (Feststoff) Silber (Feststoff) + Schwefel (Feststoff) Kleinstes Teilchen: + Ausgleichen: + Beispiel: Man geht von 12 Silbersulfid- Teilchen aus (* 12): +
26 + Durch Synthese verbinden sich Elemente zu chemischen Verbindungen. Die Grundstoffe reagieren zu neuen Stoffen mit ganz anderen Eigenschaften. Die Synthese ist eine chemische Reaktion. Versuch 2: Ein Stück Magnesiumband (leichtes Metall, leicht entzündlich) wird an der Flamme des Bunsenbrenners angezündet und dann in einen mit Sauerstoffgas (farbloses Gas) gefüllten Zylinder eingeführt. 24 Aussehen Vor der Reaktion Nach der Reaktion Name Formel
27 25 Aufstellen der chemischen Gleichung: Edukte Produkte Reaktionsbeschreibung: Wortgleichung: Formelgleichung: Magnesium reagiert mit Sauerstoff zu Magnesiumoxid. Magnesium + Sauerstoff Magnesiumoxid. + Modelldarstellung: Magnesium (Feststoff) + Sauerstoff (Gas) Magnesiumoxid (Feststoff) Kleinstes Teilchen: Ausgleichen: + + Beispiel: Man geht von 6 Magnesium- Teilchen aus (* 3): + Aufgaben: 1. Richte ein (gleiche aus): a. N 2(g) + H 2(g) NH 3(g) b. Na (s) + Cl 2(g) NaCl (s) c. HgO (s) Hg (l) + O 2(g) 2. Versuche mit Hilfe der Modelldarstellungen (S. 23 und oben) zu erkennen, welche wesentliche Veränderung bei chemischen Reaktionen eintritt.
28 26 Merke: Entstehen bei Veränderungen neue Stoffe, so spricht man von chemischen Veränderungen: chemischen Reaktionen. Bei chemischen Reaktionen werden die Bindungen zwischen den Atomen in den Ausgangsstoffen aufgebrochen, und es werden neue Bindungen in den Endstoffen geknüpft. Die Art und die Anzahl der Atome bleibt unverändert. Bei chemischen Reaktionen wechseln die Atome ihre Bindungspartner. Eine chemische Reaktion wird in einer chemischen Gleichung kurz und übersichtlich beschrieben. Da die Anzahl der Atome bei einer chemischen Reaktion unverändert bleibt, muss die Gleichung immer eingerichtet werden: es müssen sich gleich viele Atome jeder Atomart auf beiden Seiten des Reaktionspfeils befinden. + Eine Reaktionsgleichung wird in mehreren Schritten aufgestellt: 1. die chemischen Formeln der Edukte und der Produkte werden aufgestellt; 2. die Edukte werden links und die Produkte rechts des Reaktionspfeils angeschrieben (Edukte Produkte); 3. die Gleichung wird durch Einsetzen der richtigen Koeffizienten ausgeglichen; 4. es wird überprüft, ob die Zahl der einzelnen Atome in den Ausgangs- und Endstoffen die gleiche ist. - Beispiel : Thermolyse von Silbersulfid Silbersulfid zerfällt in Silber und Schwefel 1. Silbersulfid: Ag 2 S Silber: Ag; Schwefel: S; 2. Ag 2 S Ag + S 3. Ag 2 S 2 Ag + S 4. Ausgangsstoffe: Endstoffe: Ag: 2 Atome Ag: 2 Atome S: 1 Atom S: 1 Atom Aufgaben: 1. Stelle die Reaktionsgleichungen auf: a. Wasserstoff verbrennt mit Sauerstoff zu Wasser. b. Kupfer reagiert mit Sauerstoff zu Kupfer(II)-oxid (CuO). c. Stickstoff (N 2 ) reagiert mit Wasserstoff zu Ammoniak (NH 3 ).
29 27 d. Aluminium reagiert mit Sauerstoff zu Aluminiumoxid (Al 2 O 3 ). e. Schwefeldioxid (SO 2 ) reagiert mit Sauerstoff zu Schwefeltrioxid (SO 3 ). 2. Gleiche folgende Beispiele aus: K + O 2 K 2 O Al + S Al 2 S 3 N 2 + O 2 N 2 O 5 Fe 2 O 3 + Al Fe + Al 2 O 3 Al + HBr AlBr 3 + H 2 HCl + MgO MgCl 2 + H 2 O CH 4 + O 2 CO 2 + H 2 O C 2 H 6 + O 2 CO + H 2 O C 2 H 6 + O 2 CO 2 + H 2 O CH 4 + Cl 2 CHCl 3 + HCl H 2 O + Na NaOH + H 2 H 2 SO 4 + NaOH Na 2 SO 4 + H 2 O H 3 PO 4 + Ca(OH) 2 Ca 3 (PO 4 ) 2 + H 2 O
30 28 6. Verbrennung + Das Feuer spielte eine wichtige Rolle in der Entwicklungsgeschichte des Menschen. Es diente unter Anderem zum Garen von Speisen, zum Schutz vor Raubtieren, als Hilfsmittel bei der Treibjagd, zum Brennen von Keramik oder zum Herstellen von Metallen. a. Die Verbrennungsreaktion Versuch: Ein Stück Eisenwolle (m 2.5 g) wird abgewogen und die Masse notiert. Die Eisenwolle wird mit dem Bunsenbrenner entzündet und über einem Uhrglas verglühen gelassen. Kleine abfallende Metallstücke werden auf dem Uhrglas gesammelt. Nach dem Versuch wird die Masse des erhaltenen Stoffs bestimmt. Vor der Reaktion Nach der Reaktion Aussehen: Verformbarkeit: Masse: g g Stoff:
31 29 b. Voraussetzungen für eine Verbrennung Versuch 1: Eine Kerze wird in eine Schale mit etwas Wasser gestellt. Dann wird ein Becherglas über die Kerze gestülpt. Der Versuch wird noch einmal mit einem größeren Becherglas wiederholt.
32 Versuch 2: (a) In eine Abdampfschale werden einige Tropfen Benzin gegeben. Dann taucht man langsam einen brennenden (langen) Holzspan in die Abdampfschale. (b) Der gleiche Versuch wird mit einigen Tropfen Heizöl wiederholt. (c) Das Heizöl wird auf einer Heizplatte vorsichtig erwärmt und der Versuch dann wiederholt. 30
33 Ein Stoff der mit Flammenbildung verbrennt benötigt zur Reaktion eine bestimmte Mindesttemperatur. Erst ab dieser Temperatur entwickelt der Stoff genügend brennbare Gase, die mit Sauerstoff reagieren können. Aus den Beobachtungen aus den Versuchen 1 und 2 kann man das Verbrennungsdreieck ableiten: 31 Merke: Damit eine Verbrennung ablaufen kann müssen drei Voraussetzungen gleichzeitig erfüllt sein: 1. Es muss ein brennbarer Stoff vorhanden sein. 2. Es muss genügend Sauerstoff für eine Verbrennung vorhanden sein. 3. Der brennbare Stoff muss eine bestimmte Mindesttemperatur aufweisen. c. Brände und Brandbekämpfung Brände Ein Brand ist ein Feuer das sich unkontrolliert ausbreitet. Brandbekämpfung I. Allgemeines: Versuch 1: Ein Reagenzglas wird mit einigen ml Alkohol (Ethanol) befüllt. Das Ethanol wird leicht erhitzt und die austretenden Dämpfe entzündet. Das Reagenzglas wird dann in ein Becherglas mit kaltem Wasser getaucht.
34 32 Versuch 2: In einer Abdampfschale wird etwas Ethanol entzündet. Die Abdampfschale wird dann mit einer Metallplatte abgedeckt. Bemerkung: (Man darf die Metallplatte nicht zu schnell entfernen, da sich der brennbare Stoff sonst bei erneuter Luftzufuhr wieder entzünden kann) Merke: Um einen Brand zu löschen genügt es prinzipiell, eine der Voraussetzungen für die Verbrennung zu unterbinden: den Brennstoff entfernen den brandfördernden Stoff entfernen, die Temperatur unterhalb der für die Verbrennung notwendigen Temperatur halten.
35 33 II. Löschmittel - Wasser Versuch: Auf einer Metallplatte werden einige Holzspäne entzündet. Mit einer Sprühflasche wird dann Wasser auf das Feuer gegeben. Erklärung: Wenn Wasser auf den Brandherd gelangt dann verdampft es dort. Dabei nimmt das Wasser Wärme auf und der brennbare Stoff wird bis unter seinen Brennpunkt abgekühlt. Zusätzlich verdrängt der entstehende Wasserdampf die Luft aus der Umgebung des Brandherds. Das Feuer hat dann nicht mehr genügend Sauerstoff und die Flamme erlischt. - Kohlenstoffdioxid Versuch: In ein großes Becherglas werden drei verschieden hohe, brennende Kerzen gestellt. Durch einen Schlauch wird Kohlenstoffdioxidgas in das Becherglas geleitet. Erklärung: Kohlenstoffdioxid ist ein farbloses Gas mit hoher Dichte ("schwerer" als Luft), welches die Verbrennung nicht unterhält. Wenn das Becherglas sich mit Kohlenstoffdioxid füllt dann wird die Luft daraus verdrängt. Das Becherglas füllt sich von unten nach oben mit Kohlenstoffdioxid und die Flammen werden nacheinander erstickt.
36 34 - Schaum Versuch: Eine kleine Abdampfschale wird auf eine Metallplatte gestellt und ca. zur Hälfte mit Alkohol (Ethanol) befüllt. Das Ethanol wird entzündet. Um das Feuer zu löschen wir zunächst mit einer Spritzflasche Wasser zum Alkohol gegeben. Versuch: In einem kleinen Erlenmeyerkolben wird etwas Spülmittel aufgeschäumt und der Schaum auf das brennende Ethanol gegeben. Erklärung: - Pulver Löschpulver greift in die chemische Vorgänge beim Verbrennungsprozess ein. Man bezeichnet dies als "antikatalytische Wirkung".
37 35 d. Feuerlöscher und Brandklassen Brandklassen Um schnell zu erkennen, für welche Brände ein bestimmtes Löschmittel benutzt werden kann wurden die brennbaren Stoffe in verschiedene Brandklassen unterteilt: A Feste, glutbildende Stoffe Holz, Papier, Kohle, Textilien,... B Flüssige Stoffe Benzin, Heizöl, Alkohol,... C Gase Erdgas, Wasserstoff, Acetylen,... D Metalle Aluminium, Eisen,... E Speiseöl und Fett Frittieröl Auf jedem Feuerlöscher sind die Brandklassen vermerkt, für die er eingesetzt werden kann: Pulverlöscher für die Brandklassen A, B und C CO 2 -Löscher für Brandklasse B
Atome - Chemische Symbole
 Atome - Chemische Symbole Um zu erklären, dass die Grundstoffe nicht weiter zerlegbar sind, nahm der englische Wissenschaftler John Dalton um 1800 an, dass die chemischen Elemente aus unteilbaren Teilchen
Atome - Chemische Symbole Um zu erklären, dass die Grundstoffe nicht weiter zerlegbar sind, nahm der englische Wissenschaftler John Dalton um 1800 an, dass die chemischen Elemente aus unteilbaren Teilchen
Wasserstoff. Helium. Bor. Kohlenstoff. Standort: Name: Ordnungszahl: Standort: Name: Ordnungszahl: 18. Gruppe. Standort: Ordnungszahl: Name:
 H Wasserstoff 1 1. Gruppe 1. Periode He Helium 2 18. Gruppe 1. Periode B Bor 5 13. Gruppe C Kohlenstoff 6 14. Gruppe N Stickstoff 7 15. Gruppe O Sauerstoff 8 16. Gruppe Ne Neon 10 18. Gruppe Na Natrium
H Wasserstoff 1 1. Gruppe 1. Periode He Helium 2 18. Gruppe 1. Periode B Bor 5 13. Gruppe C Kohlenstoff 6 14. Gruppe N Stickstoff 7 15. Gruppe O Sauerstoff 8 16. Gruppe Ne Neon 10 18. Gruppe Na Natrium
Einführung. KLASSE: 9TE NAME: Vorname: Datum: LTAM Naturwissenschaften 9e Chemische Gleichungen 1 -
 Einführung Ein Gärtner bestellt beim Großhändler Blumen. Dort werden Tulpen in Dreier-Sträußen und Vergissmeinnichtchen in Zweier-Sträußen angeboten. Für Valentinstag, möchte der Gärtner ein Sonderangebot
Einführung Ein Gärtner bestellt beim Großhändler Blumen. Dort werden Tulpen in Dreier-Sträußen und Vergissmeinnichtchen in Zweier-Sträußen angeboten. Für Valentinstag, möchte der Gärtner ein Sonderangebot
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen. Didaktikpool
 Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen Didaktikpool Periodensystem der Elemente für blinde und hochgradig sehgeschädigte Laptop-Benutzer Reinhard Apelt 2008 Technische
Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen Didaktikpool Periodensystem der Elemente für blinde und hochgradig sehgeschädigte Laptop-Benutzer Reinhard Apelt 2008 Technische
1 Chemische Elemente und chemische Grundgesetze
 1 Chemische Elemente und chemische Grundgesetze Die Chemie ist eine naturwissenschaftliche Disziplin. Sie befasst sich mit der Zusammensetzung, Charakterisierung und Umwandlung von Materie. Unter Materie
1 Chemische Elemente und chemische Grundgesetze Die Chemie ist eine naturwissenschaftliche Disziplin. Sie befasst sich mit der Zusammensetzung, Charakterisierung und Umwandlung von Materie. Unter Materie
Grundwissenskatalog Chemie G8 8. Klasse nt
 Grundwissenskatalog Chemie G8 8. Klasse nt 1. Wissenschaft Chemie: Chemie ist die Lehre von den Stoffen. Chemischer Vorgang: Stoffänderung Physikalischer Vorgang: Zustandsänderung 2. Unterteilung Stoffe:
Grundwissenskatalog Chemie G8 8. Klasse nt 1. Wissenschaft Chemie: Chemie ist die Lehre von den Stoffen. Chemischer Vorgang: Stoffänderung Physikalischer Vorgang: Zustandsänderung 2. Unterteilung Stoffe:
Periodensystem der Elemente - PSE
 Periodensystem der Elemente - PSE Historische Entwicklung Möglichkeiten der Reindarstellung seit 18. Jhdt. wissenschaftliche Beschreibung der Elemente 1817 Johann Wolfgang Döbereiner: ähnliche Elemente
Periodensystem der Elemente - PSE Historische Entwicklung Möglichkeiten der Reindarstellung seit 18. Jhdt. wissenschaftliche Beschreibung der Elemente 1817 Johann Wolfgang Döbereiner: ähnliche Elemente
Grundlagen Chemie. Dipl.-Lab. Chem. Stephan Klotz. Freiwill ige Feuerwehr Rosenheim
 Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
Eigenschaften Reinstoffe Elemente Kugelteilchen Elementes Atom
 Einstieg: Atom Der Chemiker will alles genau untersuchen, um die Eigenschaften von Stoffen heraus zu finden. Er trennt Gemische in Reinstoffe. Er analysiert Reinstoffe, so dass sie in ihre Elemente zerfallen.
Einstieg: Atom Der Chemiker will alles genau untersuchen, um die Eigenschaften von Stoffen heraus zu finden. Er trennt Gemische in Reinstoffe. Er analysiert Reinstoffe, so dass sie in ihre Elemente zerfallen.
Aufgabe: Wiegen Sie vor und nach der Reaktion die Gesamtmasse des Reagenzglases mit den beteiligten Stoffen. Ändert sich die Masse? Beobachtung 1:...
 1.2 Stoffumsatz 1.2.1 Grundgesetze chemischer Reaktionen a) Gesetz von V1: Reaktion von Kupfer mit Schwefel im Reagenzglas Aufgabe: Wiegen Sie vor und nach der Reaktion die Gesamtmasse des Reagenzglases
1.2 Stoffumsatz 1.2.1 Grundgesetze chemischer Reaktionen a) Gesetz von V1: Reaktion von Kupfer mit Schwefel im Reagenzglas Aufgabe: Wiegen Sie vor und nach der Reaktion die Gesamtmasse des Reagenzglases
Was haben wir gelernt?
 Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
Wasser à. Nachweis: Wasser ist
 Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
10TG. Training II2. 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene.
 Training II2 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene. (4X4=1 X4=16P) a. Verbrennung von Kohlenstoff C + O2 CO2 Kohlenstoffdioxid b. Thermolyse
Training II2 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene. (4X4=1 X4=16P) a. Verbrennung von Kohlenstoff C + O2 CO2 Kohlenstoffdioxid b. Thermolyse
6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Wortschema Reaktionsschema Beispiel 1: Kupfer und Schwefel Vorzahlen
 6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Das Wortschema benennt die Ausgangsstoffe und die Reaktionsprodukte einer chemischen Reaktion. Das Reaktionsschema sagt zusätzlich etwas über das
6. Reaktionsgleichungen 6.1 Chemisches Reaktionsschema Das Wortschema benennt die Ausgangsstoffe und die Reaktionsprodukte einer chemischen Reaktion. Das Reaktionsschema sagt zusätzlich etwas über das
Grundlagen Chemischer Gleichungen
 Grundlagen Chemischer Gleichungen Lehrprogramm zum Erlernen der Grundlagen zum Aufstellen und verstehen Chemischer Gleichungen und Formeln. Björn Schulz, Berlin 2004 www.lernmaus.de www.polarographie.de
Grundlagen Chemischer Gleichungen Lehrprogramm zum Erlernen der Grundlagen zum Aufstellen und verstehen Chemischer Gleichungen und Formeln. Björn Schulz, Berlin 2004 www.lernmaus.de www.polarographie.de
Grundkenntnisse der Chemie und der Physik. Was ihr hier findet
 Grundkenntnisse der hemie und der Physik P Was ihr hier findet Wissensgebiete der hemie und der Physik Formeln Elemente Metalle Kohlenstoff Analyse Synthese Basen Laugen Salze Atome Moleküle Akustik Optik
Grundkenntnisse der hemie und der Physik P Was ihr hier findet Wissensgebiete der hemie und der Physik Formeln Elemente Metalle Kohlenstoff Analyse Synthese Basen Laugen Salze Atome Moleküle Akustik Optik
Übungen zum Kapitel I, Grundlagen chemischer Gleichungen
 Übungen zum Kapitel I, Grundlagen chemischer Gleichungen Übersicht der Übungen: Übung Nr. 1 (Bedeutungen und Ausgleichen von Gleichungen) Übung Nr. 2 (Bedeutungen und Ausgleichen von Gleichungen) Übung
Übungen zum Kapitel I, Grundlagen chemischer Gleichungen Übersicht der Übungen: Übung Nr. 1 (Bedeutungen und Ausgleichen von Gleichungen) Übung Nr. 2 (Bedeutungen und Ausgleichen von Gleichungen) Übung
Verbrennung einer Kerze
 Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
11. Klasse Heft 1. Maximilian Ernestus September/Oktober 2007. Chemie 11. Klasse Heft 1 1
 1 GRUNDLAGEN 11. Klasse Heft 1 Maximilian Ernestus September/Oktober 2007 Chemie 11. Klasse Heft 1 1 1. Chemische Elemente Elemente haben allgemein folgende Eigenschaften: sie sind nicht weiter zerlegbar
1 GRUNDLAGEN 11. Klasse Heft 1 Maximilian Ernestus September/Oktober 2007 Chemie 11. Klasse Heft 1 1 1. Chemische Elemente Elemente haben allgemein folgende Eigenschaften: sie sind nicht weiter zerlegbar
Wozu das Fach Chemie?
 Einführung 1a Lektüre Wozu das Fach Chemie? Was ist Chemie? Welchen Nutzen bringt uns die Anwendung der Chemie? Die Chemie ist die Naturwissenschaft, welche sich mit den Stoffen und den Stoffumwandlungen
Einführung 1a Lektüre Wozu das Fach Chemie? Was ist Chemie? Welchen Nutzen bringt uns die Anwendung der Chemie? Die Chemie ist die Naturwissenschaft, welche sich mit den Stoffen und den Stoffumwandlungen
Calcium. Calcium fest. Ordnungszahl. Siedepunkt. Siedepunkt Atommasse Dichte. Kohlenstoff. Carbon fest. Ordnungszahl 3642!
 Al Aluminium Aluminium fest 13 660.32 2519 2.375 5000 74.92160 B Bor Cl Boron fest 5 10.811 2.08 3.515 2076 3927 16,200 Co 58.933195 18,350 Chlorine gasförmig 17 35.453 1.5625-101.5-34.04 206 7.75 Cu 1907
Al Aluminium Aluminium fest 13 660.32 2519 2.375 5000 74.92160 B Bor Cl Boron fest 5 10.811 2.08 3.515 2076 3927 16,200 Co 58.933195 18,350 Chlorine gasförmig 17 35.453 1.5625-101.5-34.04 206 7.75 Cu 1907
Kapitel 4: Chemische. Woher stammen die chemischen Symbole?
 Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
8.1. Wie werden naturwissenschaftliche Erkenntnisse gewonnen? 8.2. Wie erstellt man ein Versuchsprotokoll? 8.3
 1) Beobachtung von Umwelterscheinungen Problem Vermutung: Hypothese zur Lösung des Problems 8.1 Wie werden naturwissenschaftliche Erkenntnisse gewonnen? 2) Die Hypothese wird durch ein ausgewähltes Experiment
1) Beobachtung von Umwelterscheinungen Problem Vermutung: Hypothese zur Lösung des Problems 8.1 Wie werden naturwissenschaftliche Erkenntnisse gewonnen? 2) Die Hypothese wird durch ein ausgewähltes Experiment
man sagt : Phosphor + Sauerstoff reagieren Tetraphosphorzu dekaoxid
 Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Lösungen Thema: Stoffe und ihre Eigenschaften
 Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
1. Einteilung von Stoffen
 1. Einteilung von Stoffen Reinstoffe Stoffe Trennverfahren (physikalisch) Stoffgemische Verbindungen Analyse Synthese Element e homogene Gemische heterogene Gemische Molekulare Stoffe; z.b. Wasser Moleküle:
1. Einteilung von Stoffen Reinstoffe Stoffe Trennverfahren (physikalisch) Stoffgemische Verbindungen Analyse Synthese Element e homogene Gemische heterogene Gemische Molekulare Stoffe; z.b. Wasser Moleküle:
Verbrennung einer Kerze
 Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Klausur 1 Basiswissen I. Chemie. Klasse 11c. Erwartungshorizont
 Paula Fürst Schule (Gemeinschaftsschule) Berlin Klausur 1 Basiswissen I Chemie Klasse 11c Erwartungshorizont Vor und Nachname: Zeitvorgabe: 80 min Liebe Schülerin, lieber Schüler, tragen Sie bitte auf
Paula Fürst Schule (Gemeinschaftsschule) Berlin Klausur 1 Basiswissen I Chemie Klasse 11c Erwartungshorizont Vor und Nachname: Zeitvorgabe: 80 min Liebe Schülerin, lieber Schüler, tragen Sie bitte auf
Elektronenpaarbindung (oder Atombindung) Nichtmetallatom + Nichtmetallatom Metallatom + Nichtmetallatom 7. Welche Bindungsart besteht jeweils?
 LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
FOS: Radioaktivität und Strahlenschutz. Chemische Elemente und ihre kleinsten Teilchen
 R. Brinkmann http://brinkmann-du.de Seite 5..03 Chemische Elemente FOS: Radioaktivität und Strahlenschutz Chemische Elemente und ihre kleinsten Teilchen Der Planet Erde besteht aus 9 natürlich vorkommenden
R. Brinkmann http://brinkmann-du.de Seite 5..03 Chemische Elemente FOS: Radioaktivität und Strahlenschutz Chemische Elemente und ihre kleinsten Teilchen Der Planet Erde besteht aus 9 natürlich vorkommenden
1.11 Welcher Stoff ist es?
 L *** 1.11 Welcher Stoff ist es? Didaktisch-methodische Hinweise Im Arbeitsblatt wird der Versuch des Lösens von vier verschiedenen Salzen in Wasser in einem Labor beschrieben. Aus Zahlenangaben müssen
L *** 1.11 Welcher Stoff ist es? Didaktisch-methodische Hinweise Im Arbeitsblatt wird der Versuch des Lösens von vier verschiedenen Salzen in Wasser in einem Labor beschrieben. Aus Zahlenangaben müssen
KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor
 1 KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "METALLE" 1. Einleitung...03 2. Reaktionen von Metallen... 05 3. Gewinnung von Metallen... 07 4. Domino: Eigenschaften der
1 KSO METALLE (SEKP) Skript Metalle (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "METALLE" 1. Einleitung...03 2. Reaktionen von Metallen... 05 3. Gewinnung von Metallen... 07 4. Domino: Eigenschaften der
Chemie Stoffe: Gemenge Reinstoffe Grundstoffe Verbindungen physikalische Trennverfahren chemische Trennverfahren
 Chemie Stoffe: Gemenge Reinstoffe Grundstoffe Verbindungen physikalische Trennverfahren chemische Trennverfahren heterogenes Gemenge Granit: heterogenes Gemenge Salzlösung: homogenes Gemenge Elektrolyse
Chemie Stoffe: Gemenge Reinstoffe Grundstoffe Verbindungen physikalische Trennverfahren chemische Trennverfahren heterogenes Gemenge Granit: heterogenes Gemenge Salzlösung: homogenes Gemenge Elektrolyse
Fragen zum Thema chemische Reaktionen Klasse 4 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion
 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
A. Allgemeine Chemie. 1 Aufbau der Materie 2 Trennverfahren für Stoffgemenge 3 Grundgesetze der Chemie 4 Atomaufbau 5 Periodensystem
 A. Allgemeine Chemie 1 Aufbau der Materie 2 Trennverfahren für Stoffgemenge 3 Grundgesetze der Chemie 4 Atomaufbau 5 Periodensystem Periodensystem der Elemente - PSE Historische Entwicklung Möglichkeiten
A. Allgemeine Chemie 1 Aufbau der Materie 2 Trennverfahren für Stoffgemenge 3 Grundgesetze der Chemie 4 Atomaufbau 5 Periodensystem Periodensystem der Elemente - PSE Historische Entwicklung Möglichkeiten
Reaktionsgleichungen und was dahinter steckt
 Reaktionsgleichungen und was dahinter steckt Prinzipien Bestehende Formeln dürfen nicht verändert werden. Bei Redoxreaktionen kann H, OH oder H 2 O ergänzt werden. Links und rechts vom Reaktionspfeil muss
Reaktionsgleichungen und was dahinter steckt Prinzipien Bestehende Formeln dürfen nicht verändert werden. Bei Redoxreaktionen kann H, OH oder H 2 O ergänzt werden. Links und rechts vom Reaktionspfeil muss
CHEMISCHE REAKTIONEN (SEKP)
 KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
Chemie 8. In der Jahrgangsstufe 8 erwerben die Schüler folgendes Grundwissen:
 In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
LB1 Stoffe. LB1 Stoffe. LB1 Stoffe. Womit beschäftigt sich die Chemie?
 Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
N & T (R) 5 Periodensystem der Elemente 01 Name: Vorname: Datum:
 N & T (R) 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
N & T (R) 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
Allgemeine und anorganische Chemie. Chemie ist die Lehre von den Stoffen und den stofflichen Veränderungen.
 Allgemeine und anorganische Chemie 1. Inhalte und Aufgaben der Chemie - Chemische Grundbegriffe Chemie ist die Lehre von den Stoffen und den stofflichen Veränderungen. Chemische Verbindungen setzen sich
Allgemeine und anorganische Chemie 1. Inhalte und Aufgaben der Chemie - Chemische Grundbegriffe Chemie ist die Lehre von den Stoffen und den stofflichen Veränderungen. Chemische Verbindungen setzen sich
Vom Atombau zum Königreich der Elemente
 Vom Atombau zum Königreich der Elemente Wiederholung: Elektronenwellenfunktionen (Orbitale) Jedes Orbital kann durch einen Satz von Quantenzahlen n, l, m charakterisiert werden Jedes Orbital kann maximal
Vom Atombau zum Königreich der Elemente Wiederholung: Elektronenwellenfunktionen (Orbitale) Jedes Orbital kann durch einen Satz von Quantenzahlen n, l, m charakterisiert werden Jedes Orbital kann maximal
4. Chemische Reaktion
 Chemie GU 9 4. Chemische Reaktion 4.1 Stoffe wandeln sich um Aus Kupfer und Schwefel entsteht ein neuer Stoff Metalle reagieren mit Schwefel zu Metallsulfiden o Edukte und Produkte Das Reaktionsschema
Chemie GU 9 4. Chemische Reaktion 4.1 Stoffe wandeln sich um Aus Kupfer und Schwefel entsteht ein neuer Stoff Metalle reagieren mit Schwefel zu Metallsulfiden o Edukte und Produkte Das Reaktionsschema
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT Elementfamilien
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT Elementfamilien
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Aufgabenblatt 10 Übungsblatt Stöchiometrie
 Name: Datum: Aufgabenblatt 10 Übungsblatt Stöchiometrie Berechnung von Stoffmengen bei chemischen Reaktionen II _ 20091005 Dr. Hagen Grossholz A1 Zusammenhang zwischen den verschiedenen Größen. Masse m
Name: Datum: Aufgabenblatt 10 Übungsblatt Stöchiometrie Berechnung von Stoffmengen bei chemischen Reaktionen II _ 20091005 Dr. Hagen Grossholz A1 Zusammenhang zwischen den verschiedenen Größen. Masse m
Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag
 2.1.1 Aufbau der Materie (Arbeitsaufträge) Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag 1. Beim Bearbeiten
2.1.1 Aufbau der Materie (Arbeitsaufträge) Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag 1. Beim Bearbeiten
Grundwissen Chemie 8. Jahrgangsstufe
 Grundwissen Chemie 8. Jahrgangsstufe 1. Stoffeigenschaften und Teilchenmodell Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, die man sich am einfachsten als Kugeln vorstellen kann (Kugelteilchenmodell).
Grundwissen Chemie 8. Jahrgangsstufe 1. Stoffeigenschaften und Teilchenmodell Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, die man sich am einfachsten als Kugeln vorstellen kann (Kugelteilchenmodell).
Unterschied zwischen Physik und Chemie:
 Unterschied zwischen Physik und Chemie: Der Begriff Physik bezeichnet die Lehre über Zustände und Zustandsänderungen die Chemie hingegen beschäftigt sich mit Stoffen und stofflichen Veränderungen. Unterteilung
Unterschied zwischen Physik und Chemie: Der Begriff Physik bezeichnet die Lehre über Zustände und Zustandsänderungen die Chemie hingegen beschäftigt sich mit Stoffen und stofflichen Veränderungen. Unterteilung
Die chemische Reaktion
 Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Beobachtung : Der gelbe Schwefel verbrennt mit blauer Flamme. Dabei wird Wärme frei und
Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Beobachtung : Der gelbe Schwefel verbrennt mit blauer Flamme. Dabei wird Wärme frei und
Grundwissen Chemie 9. Jahrgangsstufe Sprachlicher Zweig
 Grundwissen Chemie 9. Jahrgangsstufe Sprachlicher Zweig 1. Stoffeigenschaften und modell a) modell Alle Stoffe bestehen aus kleinsten Die eines Stoffes sind untereinander gleich. Die verschiedener Stoffe
Grundwissen Chemie 9. Jahrgangsstufe Sprachlicher Zweig 1. Stoffeigenschaften und modell a) modell Alle Stoffe bestehen aus kleinsten Die eines Stoffes sind untereinander gleich. Die verschiedener Stoffe
Themenheft. Chemie. chemische Gesetze, Atombau und Formeln. Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen
 Themenheft Chemie chemische Gesetze, Atombau und Formeln Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen Inhaltsverzeichnis: Blatt 1: Die Masse bei chemischen Reaktionen Blatt
Themenheft Chemie chemische Gesetze, Atombau und Formeln Arbeitsblätter für den deutschsprachigen Fachunterricht an Auslandsschulen Inhaltsverzeichnis: Blatt 1: Die Masse bei chemischen Reaktionen Blatt
Grundwissen Chemie 8. Jahrgangsstufe G8
 Grundwissen Chemie 8. Jahrgangsstufe G8 1. Stoffeigenschaften und Teilchenmodell - Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, am einfachsten aus Kugeln (Kugelteilchenmodell). Die Teilchen
Grundwissen Chemie 8. Jahrgangsstufe G8 1. Stoffeigenschaften und Teilchenmodell - Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, am einfachsten aus Kugeln (Kugelteilchenmodell). Die Teilchen
Alle Stoffe bestehen aus kleinen Teilchen, die sich bewegen. Je mehr Energie sie besitzen, desto mehr bewegen sie sich.
 Grundwissen 8. Klasse 1. Stoffe und Teilchen Teilchenmodell: Atome Ionen Alle Stoffe bestehen aus kleinen Teilchen, die sich bewegen. Je mehr Energie sie besitzen, desto mehr bewegen sie sich. von atomos
Grundwissen 8. Klasse 1. Stoffe und Teilchen Teilchenmodell: Atome Ionen Alle Stoffe bestehen aus kleinen Teilchen, die sich bewegen. Je mehr Energie sie besitzen, desto mehr bewegen sie sich. von atomos
2. Schreiben Sie für folgende Atome das Bohrsche Atommodell auf. a) Aluminium
 Übungsaufgaben 1.Seminar Atome 1. Ergänzen Sie die nachfolgende Tabelle Elementsymbol Elementname Ordnungszahl Massenzahl Bsp. H Wasserstoff 1 1 He Au 7 56 2. Schreiben Sie für folgende Atome das Bohrsche
Übungsaufgaben 1.Seminar Atome 1. Ergänzen Sie die nachfolgende Tabelle Elementsymbol Elementname Ordnungszahl Massenzahl Bsp. H Wasserstoff 1 1 He Au 7 56 2. Schreiben Sie für folgende Atome das Bohrsche
Das Formelpuzzle Kopiervorlage
 Das Formelpuzzle Kopiervorlage Die Vorlage wird foliert, die einzelnen Bausteine werden ausgeschnitten. Durch einfaches Aneinanderlegen von Kationen und Anionen können die Formeln von Säuren, Basen und
Das Formelpuzzle Kopiervorlage Die Vorlage wird foliert, die einzelnen Bausteine werden ausgeschnitten. Durch einfaches Aneinanderlegen von Kationen und Anionen können die Formeln von Säuren, Basen und
Stoffeigenschaften. Aggregatzustände und ihre Übergänge
 2 2 Stoffeigenschaften - Dichte - Siedetemperatur - Schmelztemperatur - Härte - elektrische Leitfähigkeit - Wärmeleitfähigkeit - Farbe, Geruch, Geschmack - Brennbarkeit - Löslichkeit - Kristallform 4 4
2 2 Stoffeigenschaften - Dichte - Siedetemperatur - Schmelztemperatur - Härte - elektrische Leitfähigkeit - Wärmeleitfähigkeit - Farbe, Geruch, Geschmack - Brennbarkeit - Löslichkeit - Kristallform 4 4
Aluminium. Eisen. Gold. Lithium. Platin. Neodym
 Fe Eisen Al Aluminium Li Lithium Au Gold Pt Platin Nd Neodym Zn Zink Sn Zinn Ni Nickel Cr Chrom Mo Molybdän V Vanadium Co Cobalt In Indium Ta Tantal Mg Magnesium Ti Titan Os Osmium Pb Blei Ag Silber
Fe Eisen Al Aluminium Li Lithium Au Gold Pt Platin Nd Neodym Zn Zink Sn Zinn Ni Nickel Cr Chrom Mo Molybdän V Vanadium Co Cobalt In Indium Ta Tantal Mg Magnesium Ti Titan Os Osmium Pb Blei Ag Silber
N & T 5 Periodensystem der Elemente 01 Name: Vorname: Datum:
 N & T 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
N & T 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Grundwissen C8 NTG. 1. Stoffe und Reaktionen. Reinstoff
 Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann und dessen Teilchen(Atome oder Moleküle) aus einer einzigen Atomart (d.h. Teilchen mit gleicher Ordnungszahl) besteht. Verbindung Reinstoff,
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann und dessen Teilchen(Atome oder Moleküle) aus einer einzigen Atomart (d.h. Teilchen mit gleicher Ordnungszahl) besteht. Verbindung Reinstoff,
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1. Grundwissen 8.Klasse 2 Grundwissen 8.Klasse 2. Stoffebene. Teilchen -ebene
 Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Lösungen Kap. 4 Die chemische Reaktion
 Elemente Grundlagen der Chemie für Schweizer Maturitätsschulen Klett und Balmer Verlag Zug 2007 Verwendung für den Gebrauch in der eigenen Klasse gestattet Lösungen Kap. 4 Die chemische Reaktion Lösungen
Elemente Grundlagen der Chemie für Schweizer Maturitätsschulen Klett und Balmer Verlag Zug 2007 Verwendung für den Gebrauch in der eigenen Klasse gestattet Lösungen Kap. 4 Die chemische Reaktion Lösungen
N & T (R) 4 Chemische Verfahren 01 Name: Vorname: Datum:
 N & T (R) 4 Chemische Verfahren 01 Name: Vorname: Datum: Schon zur Zeit der Griechen (vor 2500 Jahren) wurde geglaubt, dass alle Dinge auf der Erde aus kleinsten Teilchen bestehen. Auch wenn er sie zu
N & T (R) 4 Chemische Verfahren 01 Name: Vorname: Datum: Schon zur Zeit der Griechen (vor 2500 Jahren) wurde geglaubt, dass alle Dinge auf der Erde aus kleinsten Teilchen bestehen. Auch wenn er sie zu
1. Einteilung von Stoffen
 1. Einteilung von Stoffen Reinstoffe Stoffe Trennverfahren (physikalisch) Stoffgemische Verbindungen Analyse Synthese Element e homogene Gemische heterogene Gemische Molekulare Stoffe; z.b. Wasser Moleküle:
1. Einteilung von Stoffen Reinstoffe Stoffe Trennverfahren (physikalisch) Stoffgemische Verbindungen Analyse Synthese Element e homogene Gemische heterogene Gemische Molekulare Stoffe; z.b. Wasser Moleküle:
Chemie, Kapitel 4 : Chemische Reaktionen und Luft
 Lesen Sie aufmerksam das Kapitel 4.4 und lösen Sie die folgenden Aufgaben: a) Definieren Sie die drei Begriffe in jeweils einem Satz b) Geben Sie ein Beispiel aus dem Alltag Exotherme Reaktion: Endotherme
Lesen Sie aufmerksam das Kapitel 4.4 und lösen Sie die folgenden Aufgaben: a) Definieren Sie die drei Begriffe in jeweils einem Satz b) Geben Sie ein Beispiel aus dem Alltag Exotherme Reaktion: Endotherme
Grundwissen 8. Klasse Chemie
 Grundwissen 8. Klasse Chemie 1. Gefahrstoffkennzeichnung 2. Wie werden naturwissenschaftliche Erkenntnisse gewonnen? 1. Beobachtung von Umwelterscheinungen => Problem => Hypothese (Vermutung) zur Problemlösung
Grundwissen 8. Klasse Chemie 1. Gefahrstoffkennzeichnung 2. Wie werden naturwissenschaftliche Erkenntnisse gewonnen? 1. Beobachtung von Umwelterscheinungen => Problem => Hypothese (Vermutung) zur Problemlösung
http://www.fmg-brk.de/fachschaften/chemie/grundwissen Grundwissen Chemie 8. Jahrgangsstufe (NTG)
 Grundwissen Chemie 8. Jahrgangsstufe (NTG) 1 1. Stoffeigenschaften und Teilchenmodell http://www.fmg-brk.de/fachschaften/chemie/grundwissen Stoffeigenschaften: Stoffe haben bestimmte charakteristische
Grundwissen Chemie 8. Jahrgangsstufe (NTG) 1 1. Stoffeigenschaften und Teilchenmodell http://www.fmg-brk.de/fachschaften/chemie/grundwissen Stoffeigenschaften: Stoffe haben bestimmte charakteristische
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm
 Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Kochsalz-Kristalle (Halit) Wichtige Stoffgruppen Atomverband Stoffgruppe Metall Metall: Metallische Stoffe Salzartige Stoffe Metall Nichtmetall:
 Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Chemische Reaktionen
 Ein paar Worte zuvor 7 Stoffe und ihre Eigenschaften 1 Reine Stoffe und Gemische 10 2 Aggregatzustände, Dichte, Löslichkeit, Brennbarkeit und Leitfähigkeit 12 3 Trennverfahren 19 Auf einen Blick: Stoffe
Ein paar Worte zuvor 7 Stoffe und ihre Eigenschaften 1 Reine Stoffe und Gemische 10 2 Aggregatzustände, Dichte, Löslichkeit, Brennbarkeit und Leitfähigkeit 12 3 Trennverfahren 19 Auf einen Blick: Stoffe
Die chemische Reaktion
 Die chemische Reaktion Die Chemie beschäftigt sich mit Stoffen und ihren Eigenschaften. Die Dinge in unserer Umwelt bestehen aus vielen verschiedenen Stoffen, die häufig miteinander vermischt sind. Mit
Die chemische Reaktion Die Chemie beschäftigt sich mit Stoffen und ihren Eigenschaften. Die Dinge in unserer Umwelt bestehen aus vielen verschiedenen Stoffen, die häufig miteinander vermischt sind. Mit
Element. Verbindung. Reinstoff. Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1 Stoffe und ihre Eigenschaften Stoffe: Gegenstände bzw. Körper bestehen aus Stoffen. Eine Stoffportion hat ein bestimmtes Volumen und eine bestimmte Masse. Fest, flüssig
Grundwissen Chemie 9. Jahrgangsstufe 1 Stoffe und ihre Eigenschaften Stoffe: Gegenstände bzw. Körper bestehen aus Stoffen. Eine Stoffportion hat ein bestimmtes Volumen und eine bestimmte Masse. Fest, flüssig
Grundwissenkarten Hans-Carossa-Gymnasium. 9. Klasse. Chemie SG
 Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Kapitel 03. Aufbau der Materie (Buch ab Seite 17)
 Kapitel 03 Aufbau der Materie (Buch ab Seite 17) ATOME SIND DIE BAUSTEINE DER CHEMIE Film1 Geschichtliches Kern-Hülle-Modell 8min ATOME SIND DIE BAUSTEINE DER CHEMIE Alle Stoffe im Universum (Sonne, Mond,
Kapitel 03 Aufbau der Materie (Buch ab Seite 17) ATOME SIND DIE BAUSTEINE DER CHEMIE Film1 Geschichtliches Kern-Hülle-Modell 8min ATOME SIND DIE BAUSTEINE DER CHEMIE Alle Stoffe im Universum (Sonne, Mond,
Chemiefragen 9.Klasse:
 Hausaufgaben bitte entweder: - auf Papier schriftlich erledigen oder - per email an Herrn Apelt senden: Reinhard.Apelt@web.de Chemiefragen 9.Klasse: A) Stoffe und ihre Erkennung B) Anwendung des Teilchenmodells
Hausaufgaben bitte entweder: - auf Papier schriftlich erledigen oder - per email an Herrn Apelt senden: Reinhard.Apelt@web.de Chemiefragen 9.Klasse: A) Stoffe und ihre Erkennung B) Anwendung des Teilchenmodells
Lösung. Gasgemisch. Legierung. Suspension. Ein löslicher Stoff (z.b. Salz) ist in einem Lösungsmittel (z.b. Wasser) gelöst.
 Ein löslicher Stoff (z.b. Salz) ist in einem Lösungsmittel (z.b. Wasser) gelöst. Lösung 8C1 Jede Lösung ist ein homogenes Stoffgemisch: Feststofflösung: Feststoff ist in Flüssigkeit gelöst (Zuckerwasser)
Ein löslicher Stoff (z.b. Salz) ist in einem Lösungsmittel (z.b. Wasser) gelöst. Lösung 8C1 Jede Lösung ist ein homogenes Stoffgemisch: Feststofflösung: Feststoff ist in Flüssigkeit gelöst (Zuckerwasser)
Definiere den Begriff Chemischer Vorgang! Definiere den Begriff Physikalischer Vorgang!
 Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Endstoffe (Produkte) Aus dem Reaktionsgemisch entweichendes Gas, z. B. 2 Welche Informationen kann man einer Reaktionsgleichung entnehmen?
 Reaktionsgleichungen Reaktionsgleichungen Blatt 1/5 1 Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von Stoffen, also einen chemischen Prozeß. Auf der einen Seite steht,
Reaktionsgleichungen Reaktionsgleichungen Blatt 1/5 1 Was ist eine Reaktionsgleichung? Eine Reaktionsgleichung beschreibt die Umwandlung von Stoffen, also einen chemischen Prozeß. Auf der einen Seite steht,
Helmut Stapf Grundlagenchemie für technische Berufe. Neunte, verbesserte und erweiterte Auflage 149 Bilder und 4 Tafeln Fachbuchverlag Leipzig, 1955
 Helmut Stapf Grundlagenchemie für technische Berufe Neunte, verbesserte und erweiterte Auflage 149 Bilder und 4 Tafeln Fachbuchverlag Leipzig, 1955 Inhaltsverzeichnis I. Allgemeine Chemie A. Gebietsabgrenzung
Helmut Stapf Grundlagenchemie für technische Berufe Neunte, verbesserte und erweiterte Auflage 149 Bilder und 4 Tafeln Fachbuchverlag Leipzig, 1955 Inhaltsverzeichnis I. Allgemeine Chemie A. Gebietsabgrenzung
Teilchenmodell. Aggregatzustände. Diffusion. Spezifische Eigenschaften = Stoffeigenschaften
 Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Chemie Grundwissen der neunten Jahrgangsstufe (SG)
 hemie Grundwissen der neunten Jahrgangsstufe (SG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
hemie Grundwissen der neunten Jahrgangsstufe (SG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
Grundwissen Chemie 9. Klasse SG
 Grundwissen Chemie 9. Klasse SG Stoffe und Reaktionen - bestehen aus kleinsten Teilchen - lassen sich aufgliedern in Reinstoffe und Stoffgemische Stoffe Reinstoff Stoffe Stoffgemisch Atome Moleküle heterogen
Grundwissen Chemie 9. Klasse SG Stoffe und Reaktionen - bestehen aus kleinsten Teilchen - lassen sich aufgliedern in Reinstoffe und Stoffgemische Stoffe Reinstoff Stoffe Stoffgemisch Atome Moleküle heterogen
Übung zu den Vorlesungen Organische und Anorganische Chemie
 Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 07.11.08 - Lösungen - 1. Vervollständigen Sie die Reaktionsgleichungen und benennen Sie alle Verbindungen und
Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 07.11.08 - Lösungen - 1. Vervollständigen Sie die Reaktionsgleichungen und benennen Sie alle Verbindungen und
Verschiedene feste Stoffe werden auf ihre Leitfähigkeit untersucht, z.b. Metalle, Holz, Kohle, Kunststoff, Bleistiftmine.
 R. Brinkmann http://brinkmann-du.de Seite 1 26/11/2013 Leiter und Nichtleiter Gute Leiter, schlechte Leiter, Isolatoren Prüfung der Leitfähigkeit verschiedener Stoffe Untersuchung fester Stoffe auf ihre
R. Brinkmann http://brinkmann-du.de Seite 1 26/11/2013 Leiter und Nichtleiter Gute Leiter, schlechte Leiter, Isolatoren Prüfung der Leitfähigkeit verschiedener Stoffe Untersuchung fester Stoffe auf ihre
Lösung Sauerstoff: 1s 2 2s 2 2p 4, Bor: 1s 2 2s 2 2p 1, Chlor: 1s 2 2s 2 2p 6 3s 2 3p 5 Neon: 1s 2 2s 2 2p 6
 1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
Physik/Chemie 4.Klasse: Alle Fragen für den letzten PC Test
 Physik/Chemie 4.Klasse: Alle Fragen für den letzten PC Test 1 Nenne fünf Bereiche, mit denen sich die Physik beschäftigt. 2 Wie nennt man einen Stoff, der den Strom leiten kann? 3 Wie nennt man einen Stoff,
Physik/Chemie 4.Klasse: Alle Fragen für den letzten PC Test 1 Nenne fünf Bereiche, mit denen sich die Physik beschäftigt. 2 Wie nennt man einen Stoff, der den Strom leiten kann? 3 Wie nennt man einen Stoff,
Magnesium + Sauerstoff + Aktivierungsenergie 2 Mg + O 2 + E A. Oxidation = Reaktion mit Sauerstoff. Magnesiumoxid + Energie 2 MgO + E
 Chemie. Redoxreaktionen 1. Redoxreaktionen 1. Definition der Redoxbegriffe Versuch: Verbrennung eines Stücks Magnesiumband Es entsteht ein weißes Pulver mit Namen Magnesiumoxid Magnesium Sauerstoff Aktivierungsenergie
Chemie. Redoxreaktionen 1. Redoxreaktionen 1. Definition der Redoxbegriffe Versuch: Verbrennung eines Stücks Magnesiumband Es entsteht ein weißes Pulver mit Namen Magnesiumoxid Magnesium Sauerstoff Aktivierungsenergie
Grundwissen Chemie 8I
 1) Stoffe, Experimente Chemie ist die Lehre von den Stoffen, ihren Eigenschaften, ihrem Aufbau, ihren Veränderungen und ihrer Herstellung. Einfache Möglichkeiten der Stofferkennung (Farbe, Glanz, Kristallform,
1) Stoffe, Experimente Chemie ist die Lehre von den Stoffen, ihren Eigenschaften, ihrem Aufbau, ihren Veränderungen und ihrer Herstellung. Einfache Möglichkeiten der Stofferkennung (Farbe, Glanz, Kristallform,
Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch. Reinstoff, Element, Verbindung. Zweiatomige Elemente.
 1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
Die Brandbekämpfung (Gruppenversuche)
 Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Chemische Reaktionen ergeben neue Stoffe mit neuen Eigenschaften
 1 Grundbegriffe 1.1 Die Entwicklung der Chemie Im Vergleich zu anderen Naturwissenschaften wie der Physik oder der Biologie ist die Chemie eine junge Wissenschaft. Denn erst vor etwa 200 Jahren gelangten
1 Grundbegriffe 1.1 Die Entwicklung der Chemie Im Vergleich zu anderen Naturwissenschaften wie der Physik oder der Biologie ist die Chemie eine junge Wissenschaft. Denn erst vor etwa 200 Jahren gelangten
N & T 4 Chemische Verfahren 01 Name: Vorname: Datum:
 N & T 4 Chemische Verfahren 01 Name: Vorname: Datum: Schon zur Zeit der Griechen (vor 2500 Jahren) wurde geglaubt, dass alle Dinge auf der Erde aus kleinsten Teilchen bestehen. Auch wenn er sie zu dieser
N & T 4 Chemische Verfahren 01 Name: Vorname: Datum: Schon zur Zeit der Griechen (vor 2500 Jahren) wurde geglaubt, dass alle Dinge auf der Erde aus kleinsten Teilchen bestehen. Auch wenn er sie zu dieser
Naturwissenschaft Vermutungswissen Alles ist Chemie!!! Analyse Synthese
 SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
SPF 2 Chemie Was ist Chemie? - Chemie ist eine Naturwissenschaft Wie schafft eine Naturwissenschaft wissen? - Vermutungswissen; naturwissenschaftlicher Erkenntnisgang Womit beschäftigt sich die Chemie?
