Ein kurzer Hinweis vorab:
|
|
|
- Karin Stieber
- vor 6 Jahren
- Abrufe
Transkript
1 Ein kurzer inweis vorab: Die Folien 1 18 sind lediglich eine lockere Einführung in die Materie. Konzentriert lesen und mitdenken sollten Sie ab Folie 19. und ein Ratschlag für diejenigen, die massive Probleme mit dem Stoff haben: Arbeiten Sie auf jeden Fall zumindest die letzten fünf Folien r konzentriert durch!
2 Um welches seltsame Tier handelt es sich hier?
3 Ein Axolotl (Ambystoma mexicanum) ist ein Lurch, der in Mexiko beheimatet ist und ausschließlich im Wasser lebt. Auch nach Erreichen des geschlechtsreifen Stadiums behält dieser Lurch zeitlebens seine Kiemen, d.h. er verbleibt im Larvenstadium. Er ist also mit einer großen Kaulquappe zu vergleichen, die nie die Metamorphose zum erwachsenen Tier vollzieht.
4 Axolotl galten bei den indigenen Völkern des heutigen Mittelamerika zwar als heilig, wurden aber dennoch gerne als Delikatesse verspeist. eute stehen Axolotl unter strengem aturschutz und werden für Aquarienfreunde gezüchtet.
5 2 3,3',5-Triiod-L-thyronin (= T 3 ) Axolotl haben ein Defizit der Schilddrüsenfunktion und sind nicht in der Lage, die typischen ormone der Schilddrüse wie das Triiodthyronin (= T 3 ) herzustellen. Solche ormone sind aber die Voraussetzung für die Metamorphose z.b. einer Kaulquappe zum Frosch.
6 2 L-Tyrosin 2 3,3',5-Triiod-L-thyronin (= T 3 ) Der Ursprung der Biosynthese des Triiodthyronin ist die aromatische Aminosäure L-Tyrosin (vgl. Biosynthese Adrenalin / Folien zur ucleophilen Substitution).
7 4' 3' 2' 1' ' 6' 3,3',5-Triiod-L-thyronin (= T 3 ) Die Abbildung zeigt die umerierung der C-Atome der aromatischen Ringe und erklärt den intergrund des Apostrophs bei der zweiten Ziffer 3 in der omenklatur.
8 2 3,3',5-Triiod-L-thyronin (= T 3 ) Auf den ersten Blick fallen uns die beiden aromatischen Ringsysteme im Molekül des Triiodthyronins auf.
9 2 3,3',5-Triiod-L-thyronin (= T 3 ) Einer dieser beiden Ringe trägt sogar eine freie -Gruppe. Eine solche -Gruppe an einem aromatischen Sechsring kennzeichnet die Verbindungsklasse der Phenole.
10 Quelle: essen-und-trinken.de Quelle: herz-wl.de Rinderschilddrüse Abbildung: 8: Kehlkopf 9: Schilddrüse Quelle: grundhof-city.ch Ein gewisser Bezug von Schilddrüsenhormonen zur Landwirtschaft beruht auf dem Umstand, daß von Menschen nicht verzehrte Schlacht abfälle, unter anderem auch die Schilddrüsen von Rindern, als Bestandteil von undefutter verwertet werden. Die ormonkonzentration im Gemisch des undefutters wird in der Regel nicht bestimmt. Dieser Umstand kann beim und zu hormonbedingten Komplikationen führen.
11 Quelle: wikipedia Quelle: kleinepause.net 2 3,3',5,5'-Tetraiod-L-thyronin (= T 4 ) Aus genau dem gleichen Grund, nämlich der schwierigen Kontrolle der ormonkonzentration, wird die früher gängige Therapie von Schilddrüsenpatienten mit Schweinethyroxin (Thyroxin = 3,3',5,5'-Tetraiodthyronin = T 4 ) seit Mitte der 80er Jahre des letzten Jahrhunderts nicht mehr praktiziert.
12 Quelle: stadtwerke-bliestal.de Ein weiterer Bezug der Landwirtschaft zu aromatischen Verbindungen ergibt sich aus der Spurenanalyse von Biogas. Biogas enthält hauptsächlich Methan (C 4 ; 40-75%) und Kohlendioxid (C 2 ; 25-55%). Wasserdampf kann in einem Anteil von bis zu 10% enthalten sein. Daneben treten noch in Spuren auf: Schwefelwasserstoff ( 2 S) ppm Ammoniak ( 3 ) 0-1% Stickstoff ( 2 ) 0-5% Sauerstoff ( 2 ) 0-2% Wasserstoff ( 2 ) 0-1% Quelle: renewable-energy-concepts.com
13 Schematischer Aufbau eines Gaschromatographen Quelle: chemwiki.ucdavis.edu Benzol (Benzen) Toluol (Toluen) o-xylol (o-xylen) m-xylol (m-xylen) p-xylol (p-xylen) Aromatische Verbindungen wie die hier abgebildeten sind gesundheitsschädlich und sollten im Biogas nur in extrem geringen Spuren vorkommen. Die Bestimmung ihrer Konzentration ist daher wichtig für die Beurteilung der Qualität des Biogases.
14 Schematischer Aufbau eines Gaschromatographen Quelle: chemwiki.ucdavis.edu Benzol (Benzen) Toluol (Toluen) o-xylol (o-xylen) m-xylol (m-xylen) p-xylol (p-xylen) n Mikro-Gaschromatographen werden Spurenkomponenten wie die hier angegebenen Aromaten auf einem sogenannten Konzentratorchip angereichert. Danach wird das angereicherte Analysengut durch rasches Aufheizen in die Trennsäule geschickt, welche die einzelnen Komponenten je nach ihren physikalisch-chemischen Eigenschaften unterschiedlich schnell durchwandern. Somit kann man die Konzentrationen von BTX (Benzol, Toluol, Xylol)-Kohlenwasserstoffen im Biogas auch im ppm-maßstab (ppm = parts per million) bestimmen.
15 U Quelle: welt.de W Q X X Y Pyrrol T Pyrrol-Verbindungen mit starker herbizider Wirkung werden in der Landwirtschaft als Pflanzenschutzmittel eingesetzt. Die links abgebildete Verbindung ist unter der ummer EP B1 als Patent geschützt. Die rechte Abbildung zeigt Pyrrol, ein aromatisches Fünfringsystem.
16 Quelle: wattenrat.de 2 L-Tryptophan 3-Methylindol (= Skatol) ndol 3-Methylindol (auch Skatol genannt) ist als Abbauprodukt der Aminosäure L-Tryptophan eine der Komponenten von Fäkalien und für deren penetranten Geruch verantwortlich.
17 Elektrophile aromatische Substitution Benzol Die für einen Aromaten typische Reaktion ist die elektrophile Substitution. Ein Aromat wie z.b. Benzol ist ein vergleichsweise stabiles System. Wenn ein Aromat eine Reaktion eingeht, dann möchte er diese Stabilität nicht aufgeben und aus dieser Reaktion nach Möglichkeit wieder als Aromat hervorgehen. Wie wir in der Abbildung rechts erkennen, ist ein aromatischer Ring planar, d.h. sämtliche Ringatome liegen in der gleichen Ebene.
18 Benzol Würde ein Aromat die für Alkene typische Addition eingehen, dann wäre er am Ende der Reaktion kein Aromat mehr. Unter bestimmten Bedingungen kann aber auch ein Aromat wie Benzol ausnahmsweise Additionsreaktionen eingehen, so z.b. bei der katalytischen ydrierung, bei der pro Molekül Benzol drei Moleküle Wasserstoff 2 addiert werden. Das Endprodukt dieser Reaktion ist Cyclohexan. Cyclohexan gehört als Cycloalkan zu den (gesättigten) Kohlenwasserstoffen, aber nicht zu den (ungesättigten) Aromaten!
19 Br Substitution ( gegen Br) Benzol Benzol Brombenzol Die typische Reaktion für einen Aromaten ist hingegen die elektrophile Substitution. m Rahmen einer solchen Reaktion wird am aromatischen Ring ein -Atom gegen ein anderes Atom oder eine andere Atomgruppe ausgetauscht (im obigen Beispiel gegen ein Brom-Atom). Dieses andere Atom (bzw. Atomgruppe) nähert sich dem elektronenreichen aromatischen Ring als Elektrophil (also als Reaktionspartner, der ein Defizit an Elektronendichte aufweist) daher das Adjektiv elektrophil in der Bezeichnung der Reaktion. Das Reaktionsprodukt (hier: Brombenzol) ist nach wie vor ein (stabiler!) Aromat.
20 Phenol n den Schilddrüsenhormonen Tri- bzw. Tetraiodthyronin liegen Phenol-Bausteine als aromatische Komponenten vor. Die Abbildung rechts zeigt uns (wie bereits auf einer der vorhergehenden Folien), daß das Ringsystem planar ist (im Gegensatz z.b. zum Cyclohexan, das bevorzugt in der Sesselkonformation vorliegt). Die sechs C-Atome sind sp 2 -hybridisiert, d.h. pro C-Atom bleibt ein p-rbital übrig *), das nicht in die ybridisierung einbezogen wird und senkrecht zur planaren Ringebene steht. *) d.h., daß in der Außenschale eines jeden C-Atoms neben dem einen 2s-rbital nur zwei der insgesamt drei 2p-rbitale zu insgesamt drei sp 2 -ybriden kombiniert werden [für die Bindungen zu den drei achbarn C, C und (bzw. C, C und im Fall von C-1)].
21 Überlappungszone oberhalb und unterhalb der Ringebene Phenol Diese zueinander parallele Anordnung ermöglicht es den sechs p-rbitalen, oberhalb und unterhalb der Ringebene eine jeweils ununterbrochene ringförmige Überlappungszone auszubilden (Abbildung rechts). Die insgesamt sechs π Elektronen können sich dadurch, salopp ausgedrückt völlig losgelöst (und wissenschaftlich ausgedrückt: delokalisiert ), d.h. ohne konkrete Zuordnung zu einem der C-Atome, relativ frei innerhalb der Überlappungszone bewegen. Sie bilden dadurch eine sogenannte π Elektronenwolke. Diese Delokalisierung beweglicher Elektronen ist der Grund für die Stabilität eines aromatischen Systems.
22 Phenol Beim Phenol kommt noch der Umstand hinzu, dass eines der freien Elektronenpaare am -Atom räumlich so ausgerichtet werden kann, dass eine Überlappung des entsprechenden sp 3 -ybridorbitals mit dem aromatischen π-elektronensystem möglich ist. Diese elektronische Wechselwirkung, die auf der Überlappung parallel zueinander ausgerichteter rbitale beruht, also über -Bindungssysteme hinweg, bezeichnet man als Mesomeren Effekt (M-Effekt). Wenn der M-Effekt wie im Fall der -Gruppe die Elektronendichte im Ring erhöht, so spricht man von einem positiven mesomeren Effekt (+M-Effekt) der -Gruppe.
23 Exkurs: Elektronische Effekte von Substituenten auf den aromatischen Ring +M-Effekt der -Gruppe Phenol M-Effekt der 2 -Gruppe itrobenzol Die Abbildung zeigt den direkten Vergleich zweier Substituenten mit entgegengesetzten Mesomeren Effekten: Die -Gruppe übt ebenso wie die 2 -Gruppe einen positiven Mesomeren Effekt (+M-Effekt) aus, weil das -Atom über zwei freie Elektronenpaare verfügt, die sich jeweils in einem sp 3 -ybridorbital aufhalten.
24 Exkurs: Elektronische Effekte von Substituenten auf den aromatischen Ring +M-Effekt der -Gruppe Elektronendichte wird hin zum Ring verschoben Phenol Elektronendichte wird hin zum Substituenten verschoben M-Effekt der 2 -Gruppe itrobenzol Eines jener sp 3 -ybridorbitale ist in der Lage, sich räumlich so auszurichten, daß es in einer Ebene mit den sechs p-rbitalen des aromatischen Rings zu liegen kommt und mit diesen überlappen kann. Da jenes sp 3 -ybridorbital mit zwei Elektronen voll besetzt ist, werden in der Überlappungszone (in der Abbildung durch schwarze Balken gekennzeichnet) insgesamt acht -Elektronen auf sieben rbitale verteilt, so daß diese Überlappung für eine Erhöhung der -Elektronendichte im Ring im Vergleich zum unsubstituierten Benzol, also für einen +M-Effekt, sorgt.
25 Exkurs: Elektronische Effekte von Substituenten auf den aromatischen Ring +M-Effekt der -Gruppe Elektronendichte wird hin zum Ring verschoben Phenol Elektronendichte wird hin zum Substituenten verschoben M-Effekt der 2 -Gruppe itrobenzol Wir merken uns: Verfügt das eteroatom (,, S, F, Cl, Br, ), welches direkt mit dem aromatischen Ring verbunden ist, über mindestens ein freies Elektronenpaar, so liegt ein +M-Effekt vor.
26 Exkurs: Elektronische Effekte von Substituenten auf den aromatischen Ring +M-Effekt der -Gruppe Elektronendichte wird hin zum Ring verschoben Phenol Elektronendichte wird hin zum Substituenten verschoben M-Effekt der 2 -Gruppe itrobenzol Die 2 -Gruppe übt ebenso wie z.b. die C-Gruppe einen negativen Mesomeren Effekt ( M-Effekt) aus, weil das -Atom in diesem Fall über kein einziges freies Elektronenpaar verfügt. Das entsprechende p-rbital am -Atom (siehe Abbildung unten links) ist daher leer. ichtsdestotrotz ist es in der Lage, mit den sechs p-rbitalen des aromatischen Rings zu überlappen. Diese Überlappung mit einem leeren rbital bringt eine Verringerung der -Elektronendichte im Ring im Vergleich zum unsubstituierten Benzol mit sich (sechs -Elektronen werden auf sieben rbitale verteilt), also einen M-Effekt.
27 Exkurs: Elektronische Effekte von Substituenten auf den aromatischen Ring +M-Effekt der -Gruppe Elektronendichte wird hin zum Ring verschoben Phenol Elektronendichte wird hin zum Substituenten verschoben M-Effekt der 2 -Gruppe itrobenzol Wir merken uns: Verfügt das Atom (C oder ), welches direkt mit dem aromatischen Ring verbunden ist, über ein leeres p-rbital, so liegt ein M-Effekt vor. Ein leeres p-rbital liegt am betreffenden C- oder am -Atom dann vor, wenn dieses Atom im Fall von Substituenten wie C, CR, C, C, 2 sp 2 -hybridisiert ist (in dem Fall wird ja dieses eine entscheidende p-rbital nicht mit in die ybridisierung einbezogen und bleibt so, wie es ist) und über kein freies Elektronenpaar verfügt.
28 p - rbitale (mit jeweils einem Elektron besetzt) Exkurs: Elektronische Effekte von Substituenten auf den aromatischen Ring C C 3 Überlappung zwischen sp 2 -ybridorbital (Ring) und sp 3 -ybridorbital (C 3 -Gruppe) Toluol Zur Erinnerung: Alkylgruppen wie C 3, C 2 5, C 3 7 haben am C-Atom, welches direkt mit dem Ring verbunden ist, eine sp 3 -ybridisierung vorliegen und daher keine p-rbitale. Eines der vier sp 3 -ybridorbitale des C-Atoms der Methylgruppe muß natürlich mit einem sp 2 -ybridorbital eines Ring-C-Atoms überlappen (siehe Abbildung; Markierung mit dem breiten weißen Pfeil). Andernfalls käme ja keine chemische Bindung zwischen dem aromatischen Ring und der C 3 -Gruppe zustande.
29 Exkurs: Elektronische Effekte von Substituenten auf den aromatischen Ring C 3 +-Effekt der C 3 -Gruppe Elektronendichte wird hin zum Ring verschoben Toluol Die restlichen drei ybridorbitale sind bereits in eine Überlappung einbezogen, und zwar mit jeweils einem 1s-rbital eines -Atoms (siehe Abbildung). Eine Überlappung mit den p-rbitalen des Rings, wie dies im Fall der freien Elektronenpaare z.b. des -Atoms der -Gruppe von Phenol der Fall ist, ist hier nicht mehr möglich. Alkylgruppen können daher keinen Mesomeren Effekt ausüben. Sie müssen sich mit dem (schwächeren) nduktiven Effekt begnügen im Fall der Alkylgruppen einem elektronenschiebenden positiven nduktiven Effekt (+-Effekt; siehe Folien zur ucleophilen Substitution). Ein solcher -Effekt beruht also auf einer elektronischen Wechselwirkung, die auf der Überlappung längs der Kernverbindungsachse beruht, also über eine -Bindung hinweg (und nicht über -Bindungen wie im Fall des M-Effekts).
30 Exkurs: Elektronische Effekte von Substituenten auf den aromatischen Ring 3 -Effekt der 3+ -Gruppe Anilinium-on Elektronendichte wird hin zum Substituenten verschoben Den eher seltenen Fall eines negativen nduktiven Effekts (also eines Elektronenzugs weg vom Ring über eine -Bindung hinweg und nicht über -Bindungen) haben wir im protonierten Anilin, auch Anilinium-on genannt, vorliegen. Die positive Ladung am -Atom sorgt für einen gewissen Abzug von Elektronendichte über die -Bindung zwischen C und hinweg (= -Effekt). Je nach p-wert hat Anilin also einen +M-Effekt (wenn die 2 -Gruppe unprotoniert ist und das -Atom sein freies Elektronenpaar zur Verfügung hat) oder einen -Effekt, nämlich dann, wenn eine Protonierung stattgefunden hat und das -Atom in der dann vorliegenden 3+ -Gruppe kein freies Elektronenpaar mehr hat.
31 Zurück zur Substitution am Phenol: Elektronegativitätswerte: E (Cl) = 3,16 E () = 2,66 Der Austausch eines -Atoms durch ein od-atom am aromatischen Ring der Aminosäure L-Thyronin kann im Laborversuch durch den Austausch eines -Atoms gegen ein -Atom im Phenol simuliert werden. Als Partner des Phenols für diese Reaktion wählt man in der Regel odmonochlorid -Cl. Aufgrund der Differenz der Elektronegativitätswerte beider Elemente von (3,16 2,66 =) 0,5 ist die Bindung zwischen dem Chlor- und dem od-atom leicht polarisiert. Der negative Ladungsschwerpunkt liegt dabei beim elektronegativeren Chlor-Atom. Das weniger elektronegative od-atom ist in diesem Fall das positiv polarisierte Elektrophil.
32 Logischerweise erfolgt ein nucleophiler Angriff aus dem aromatischen π Elektronensystem heraus auf dieses positiv polarisierte od-atom (siehe rechter Elektronenverschiebungspfeil in beiden Abbildungen). Gleichzeitig mit dem Angriff von zwei der sechs π Elektronen auf das positiv polarisierte od-atom kommt es zum Bruch der Bindung zwischen dem od- und dem Chlor-Atom. Das negativ polarisierte Atom (hier: das Chlor-Atom) nimmt bei seinem Abgang als Chlorid-on das Bindungselektronenpaar als nunmehr freies Elektronenpaar mit. Die Übernahme des Bindungselektronenpaars zwischen und Cl durch das abgehende Chlorid-on wird durch den (kürzeren) linken Elektronenverschiebungspfeil in beiden Abbildungen symbolisiert.
33 Als Ergebnis dieses Reaktionsschritts entsteht ein positiv geladenes Zwischenprodukt, in welchem ein C-Atom des Sechsrings mit dem od-atom verbunden ist. Das Ringsystem hat hier vorübergehend seinen aromatischen Charakter aufgegeben nur vorübergehend, wohlgemerkt, denn am Ende der Reaktion möchte der Ring auf jeden Fall wieder als stabiler Aromat vorliegen!
34 Wie die Abbildungen links und rechts zeigen, ist das mit dem od-atom verbundene C-Atom hier vierbindig (es ist ja nach wie vor zusätzlich noch mit einem -Atom verbunden!!!). Die ursprüngliche sp 2 -ybridisierung dieses C-Atoms im planaren Ring des Phenols muß in diesem Zwischenprodukt zumindest vorübergehend gegen eine sp 3 -ybridisierung ausgetauscht werden.
35 Die rechte Abbildung verdeutlicht uns die folgenden beiden Umstände: 1) Die sechs C-Atome des Rings liegen zwar nach wie vor in der gleichen Ebene, aber das od-atom und das eine - Atom liegen außerhalb dieser Ebene (oberhalb bzw. unterhalb). 2) Die Überlappungszone der p-rbitale ist unterbrochen worden. Sie erstreckt sich nicht mehr ringförmig über das gesamte System hinweg (wie dies im Aromaten der Fall war), sondern nur noch über die verbliebenen fünf p-rbitale (das sechste mußte ja für die Um-ybridisierung von sp 2 nach sp 3 herangezogen werden).
36 Exkurs: Einfluß des Erstsubstituenten auf den rt der Zweitsubstitution Frage: Warum haben wir ausgerechnet das C-Atom r. 4 für die Bindung zum elektrophilen Reaktionspartner (hier: dem od-atom) gewählt? C-Atom r. 4 Antwort: Dies hängt mit dem +M-Effekt des bereits vorhandenen Erstsubstituenten (hier: der -Gruppe) zusammen.
37 Exkurs: Einfluß des Erstsubstituenten auf den rt der Zweitsubstitution V Betrachten wir in diesem Zusammenhang die mesomeren Grenzformen des Phenols. Sie lassen einen Rückschluß auf die jeweils etwas unterschiedliche -Elektronendichte an den C-Atomen des Rings zu. n den Grenzformen,, und V im linken Teil der Abbildung sind die p-rbitale der C-Atome r. 2, 4 und 6 nicht nur mit einem Elektron, sondern mit zwei Elektronen belegt. Diese C-Atome erhalten in der jeweiligen Grenzform eine negative Ladung.
38 Exkurs: Einfluß des Erstsubstituenten auf den rt der Zweitsubstitution V m rechten Teil der Abbildung sind die mit jeweils zwei Elektronen doppelt belegten rbitale in der Überlappungszone [also das eine sp 3 -ybridorbital des Sauerstoffs (Grenzform ) sowie die p-rbitale der C-Atome r. 2, 4 und 6 (Grenzformen, und V)] mit einem breiten weißen Pfeil markiert. Unter dem Strich bedeutet dies für die Ring-C-Atome r. 2, 4 und 6 eine etwas höhere Ladungsdichte als für die übrigen C-Atome des Rings. Sie sind daher die bevorzugten Positionen für eine Annäherung an den elektrophilen Reaktionspartner und für das Knüpfen einer Bindung mit ihm.
39 Exkurs: Einfluß des Erstsubstituenten auf den rt der Zweitsubstitution V Dieser Einfluß der -Gruppe auf den bevorzugten rt der Substitution durch den elektrophilen Reaktionspartner gilt für alle Substituenten mit mindestens einem freien Elektronenpaar (also alle Substituenten mit einem +M-Effekt). Den gleichen Einfluß haben Substituenten, die ausschließlich einen +-Effekt zeigen (also Alkylgruppen wie C 3 ). Da die Ring-Positionen r. 2 und 6, vom Erstsubstituenten (hier: der -Gruppe) aus betrachtet, als ortho-positionen bezeichnet werden und die Ring-Position r. 4 als para-position, werden alle Erstsubstituenten mit +M-Effekt bzw. ausschließlichem +-Effekt als ortho-para-dirigierende Substituenten bezeichnet.
40 Exkurs: Einfluß des Erstsubstituenten auf den rt der Zweitsubstitution V Umgekehrt sieht es freilich bei den Substituenten mit M-Effekt (also z.b. der 2 - oder der C-Gruppe) oder ausschließlichem -Effekt (z.b. der 3+ -Gruppe des Anilinium-ons) aus. ier zeigen uns die Grenzformen, und V des itrobenzols im linken Teil der Abbildung, daß gerade diese Ring-C- Atome in ortho- und para-position weniger elektronenreich sind als die übrigen C-Atome. Diese Atome haben in den betrachteten Grenzformen nämlich leere p-rbitale (in der Abbildung rechts mit schwarzen Pfeilen markiert), demzufolge wird ihnen in den Grenzformen eine positive Ladung zugeteilt.
41 Exkurs: Einfluß des Erstsubstituenten auf den rt der Zweitsubstitution V Dies bedeutet, daß ortho-und para-positionen im itrobenzol und allen übrigen Aromaten mit einem Substituenten mit M-Effekt (also Benzoesäure, Benzoesäureester, Benzaldehyd, Acetophenon, ) sowie die Aromaten mit einer protonierten Aminogruppe (also z.b. Aniliniumchlorid C Cl ) für die Wechselwirkung und anschließende Bindung mit dem elektrophilen Reaktionspartner ungeeignet sind. Besser geeignet sind hier die beiden sogenannten meta-positionen des Rings an den C-Atomen r. 3 und 5 (in der Abbildung rechts oben sind deren p-rbitale mit breiten weißen Pfeilen markiert).
42 Exkurs: Einfluß des Erstsubstituenten auf den rt der Zweitsubstitution Erstsubstituenten wie 2, C, CR, C (= Aldehyd), C=(R) (= Keton), S 3 (= Sulfonsäure), 3 + werden daher als meta-dirigierende Substituenten bezeichnet.
43 Exkurs: Einfluß des Erstsubstituenten auf den rt der Zweitsubstitution Erstsubstituent Effekt M Effekt Dirigierende Wirkung + Effekt +M Effekt ortho / para, R, 2, R 2 Effekt +M Effekt ortho / para Alkyl + Effekt (nicht exist.) ortho / para F, Cl, Br, Effekt +M Effekt ortho / para C, CR, C, C 2, C, 2 Effekt M Effekt meta + 3, R + 3 Effekt (nicht exist.) meta Quelle: wikipedia Diese leicht modifizierte Form einer Tabelle aus #Substituenteneffekte soll hnen den Überblick über die elektronischen Effekte von Erst-Substituenten am aromatischen Ring und deren dirigierender Wirkung erleichtern.
44 Zurück zur Substitution des Phenols mit od. Wir haben hier die para-position gewählt (wir hätten aber auch eine der beiden ortho-positionen nehmen können). Cl Chlorid-on Das Zwischenprodukt ist mesomeriestabilisiert. -Komplex in insgesamt vier mesomeren Grenzformen Diese Mesomeriestabilisierung beruht auf dem Umstand, daß die positive Ladung über den Großteil des Rings bis hin zum benachbarten -Atom delokalisiert ist (d.h. die positive Ladung ist nicht auf ein einzelnes C-Atom beschränkt).
45 Cl Chlorid-on -Komplex in insgesamt vier mesomeren Grenzformen Das hier kurzfristig vorliegende Zwischenprodukt (σ-komplex genannt) hat zwar keinen aromatischen Charakter mehr aber es ist immerhin zu einem gewissen Grad stabilisiert und gewinnt durch die anschließende Abspaltung eines Protons die aromatischen Eigenschaften und somit die maximale Stabilität wieder zurück.
46 Die Abbildung links zeigt die Deprotonierung, bei der das Bindungselektronenpaar zwischen C und in das System der π-elektronen des Rings verschoben wird. atte der (nicht aromatische) σ-komplex nur vier solcher π-elektronen im Ring, so ist das Sextett an π-elektronen, das den aromatischen Charakter ausmacht, jetzt wieder komplett.
47 Die Abbildung rechts zeigt das wieder hergestellte aromatische System mit den sechs π-elektronen und deren Überlappung hin zum benachbarten -Atom. Das anorganische ebenprodukt der Reaktion ist Chlorwasserstoffsäure + Cl.
48 Die untere Abbildung zeigt diesen Reaktionsschritt in der Sicht von oben auf den Ring. Die geschweifte Klammer soll die Delokalisierung der positiven Ladung im -Komplex wiedergeben.
49 Wird odmonochlorid im Überschuß eingesetzt, so kommt es zu weiteren Substitutionen in den beiden ortho-positionen des Rings. Wir erinnern uns: die bereits vorhandene -Gruppe am aromatischen Ring sorgt aufgrund ihres +M-Effekts dafür, daß elektrophile Substitutionen (wie hier durch od) bevorzugt an den Ringpositionen ortho und para, also an den C-Atomen r. 2, 4 und 6 ablaufen.
50 Br Br Br Br (Blick von oben) nucleophiler Angrif f auf das elektrophile Bromatom Völlig analog verläuft übrigens die Umsetzung von Phenol mit elementarem Brom. n direkter ähe elektronenreicher Bereiche wie dem -Elektronensystem eines Aromaten kommt es nämlich zu einer Polarisierung des Brom-Moleküls (siehe Partialladungen + und an den beiden Brom-Atomen). Das partial positiv geladene Brom-Atom wird von zwei der insgesamt sechs -Elektronen angegriffen, und es kommt zur Spaltung des Brom-Moleküls unter Abspaltung eines negativ geladenen Bromid-ons
51 n diesem Fall entstehen 4-Bromphenol (und 2-Bromphenol) als bevorzugte Produkte der Mono-Substitution.
52 Das Produkt der dreifachen Substitution von Phenol mit Brom ist 2,4,6-Tribromphenol.
53 Abschließend betrachten wir noch zwei elektrophile aromatische Substitutionen am Benzol selbst. Benzol Brombenzol Benzol hat aufgrund des fehlenden +M-Effekts keine so hohe Dichte an -Elektronen wie das Phenol. Es ist demnach etwas reaktionsträger als Phenol und benötigt für den Austausch eines -Atoms gegen ein Br-Atom die Unterstützung durch einen Katalysator.
54 Abschließend betrachten wir noch zwei elektrophile aromatische Substitutionen am Benzol selbst. Benzol Brombenzol Brom Brom-Eisen()-bromid-Komplex Eisen()-bromid Der in diesem Fall gerne verwendete Katalysator ist Eisen()-bromid FeBr 3. Durch die Anlagerung des Brom-Moleküls an das zentrale Fe-Atom wird das endständige Br-Atom relativ stark positiv polarisiert auf jeden Fall so stark, daß es nun mit den -Elektronen des aromatischen Rings in Wechselwirkung tritt und im Verlauf der Reaktion eines der -Atome am Ring ersetzt.
55 Abschließend betrachten wir noch zwei elektrophile aromatische Substitutionen am Benzol selbst. Benzol itrobenzol Auch für die Synthese von itrobenzol durch Austausch eines -Atoms gegen die 2 -Gruppe bedarf es eines Katalysators. Das in diesem Fall benötigte Elektrophil ist das 2+ - on (itronium-on genannt).
56 Abschließend betrachten wir noch zwei elektrophile aromatische Substitutionen am Benzol selbst. Benzol itrobenzol Wasser Salpetersäure protonierte Salpetersäure itronium-on Es wird aus der konzentrierten Salpetersäure freigesetzt, in das -Atom der -Gruppe an einem Proton der als Katalysator zugesetzten konzentrierten Schwefelsäure angreift. Dadurch wird die Abspaltung eines Wasser-Moleküls ermöglicht. Übrig bleibt das relativ starke Elektrophil 2+.
57 Auf der definitiv letzten Folie soll eine der Möglichkeiten zur erstellung von Phenol als Reaktionsschema gezeigt werden. Eine direkte Phenolsynthese aus Benzol durch Umsetzung des Benzols mit einem Elektrophil des Typs + ist nicht möglich, da dieses Elektrophil extrem energiereich ist und nur in interstellarer Materie vorkommt. Eine Möglichkeit für eine Phenolsynthese im kleineren Labormaßstab (also nicht industriell) ist der Umweg über itrobenzol. Dessen Reduktion zu Anilin mit sogenanntem nascierendem Wasserstoff (also im Reaktionsgefäß frisch hergestellten -Atomen aus Eisenschrott und Salzsäure, wobei das Proton der Salzsäure ein Elektron vom metallischen Eisen aufnimmt und dadurch zum ungeladenen -Atom wird) entspricht der großtechnischen Synthese der Zwischenstufe Anilin (vgl. BASF * ). Anilin kann im Labor (wo es wegen der geringeren Mengen nicht so sehr auf den Preis ankommt wie in der großtechnischen erstellung) mit frisch hergestellter Salpetriger Säure 2 zu Phenol umgesetzt werden ( Phenolverkochung ** ). itrobenzol + 6 Reduktion -2 2 Anilin Achtung: Salpetrige Säure 2 darf nicht mit der Salpetersäure 3 verwechselt werden! Die Salpetrige Säure 2 setzt nach der Protonierung mit + das Kation = + frei (itrosonium-on oder auch itrosyl-kation genannt), dessen -Atom zusammen mit dem -Atom der 2 -Gruppe des Anilins als elementarer Stickstoff 2 abgeht **). Die -Gruppe des Phenols stammt aus dem Lösungsmittel Wasser **). *) BASF = Badische Anilin- und Sodafabrik **) Details dazu: siehe Lehrbücher oder Wikipedia unter Verkochung. Phenol
3. Aromatische Verbindungen Benzol(en)
 3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang
 Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
1.4 Die elektrophile aromatische Substitution
 1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte
 Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Bundesrealgymnasium Imst. Chemie Klasse 8. Aromaten und deren Reaktionen
 Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Reaktionstypen der Aromate
 Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
Ein kurzer Hinweis vorab:
 Ein kurzer Hinweis vorab: Die Folien 1 18 sind lediglich eine lockere Einführung in die Materie. Konzentriert lesen und mitdenken sollten Sie ab Folie 19, auf der die Überschrift ucleophile Substitution:
Ein kurzer Hinweis vorab: Die Folien 1 18 sind lediglich eine lockere Einführung in die Materie. Konzentriert lesen und mitdenken sollten Sie ab Folie 19, auf der die Überschrift ucleophile Substitution:
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 Carbonylgruppen und eine C=C Doppelbindung.
 rganische hemie I Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 arbonylgruppen und eine = Doppelbindung. 3 () 3 3 Progesteron Das Molekül hat 6 hiralitätszentren (mit * bezeichnet).
rganische hemie I Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 arbonylgruppen und eine = Doppelbindung. 3 () 3 3 Progesteron Das Molekül hat 6 hiralitätszentren (mit * bezeichnet).
 hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
1. Umwandlung funktioneller Gruppen Geben Sie Reagenzien an, mit denen Sie die folgenden Umwandlungen durchführen würden!
 Übung r. 8 Mi. 25.04.2012 bzw. Fr. 7.05.2 1. Umwandlung funktioneller Gruppen Geben Sie Reagenzien an, mit denen Sie die folgenden Umwandlungen durchführen würden! 2 CH 3 H a) b) I H c) d) C F e) f) H
Übung r. 8 Mi. 25.04.2012 bzw. Fr. 7.05.2 1. Umwandlung funktioneller Gruppen Geben Sie Reagenzien an, mit denen Sie die folgenden Umwandlungen durchführen würden! 2 CH 3 H a) b) I H c) d) C F e) f) H
Nucleophile Substitution: S N 2-Reaktion
 Nucleophile Substitution: S N 2-Reaktion Diese teilweise Verschiebung von Elektronendichte und die damit einhergehende Polarisierung kann z.b. durch den griechischen Buchstaben und das hochgestellte entsprechende
Nucleophile Substitution: S N 2-Reaktion Diese teilweise Verschiebung von Elektronendichte und die damit einhergehende Polarisierung kann z.b. durch den griechischen Buchstaben und das hochgestellte entsprechende
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
Die Verknüpfung zweier kleinerer Bausteine zu einem größeren läuft in diesem Fall über eine sogenannte Aldoladdition.
 Quelle: www.helpster.de Quelle: www.fotocommunity.de Quelle: www.hobbybrauer.de Das Gehirn benötigt ständig Traubenzucker als Energieträger. Im Fall von Traubenzuckermangel kann der Körper über die Gluconeogenese
Quelle: www.helpster.de Quelle: www.fotocommunity.de Quelle: www.hobbybrauer.de Das Gehirn benötigt ständig Traubenzucker als Energieträger. Im Fall von Traubenzuckermangel kann der Körper über die Gluconeogenese
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
9 Aromaten. 1 Elemente Chemie Oberstufe NRW Ernst Klett Verlag GmbH, Stuttgart Lösungen zu den Durchblick-Seiten
 Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Organische Chemie für MST 5. Lienkamp/ Prucker/ Rühe
 Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
1. a) Geben sie den Reaktionsmechanismus für die Nitrierung und die Sulfonierung von Benzol an. Beginnen sie mit der Erzeugung des Elektrophils.
 Übungsblatt 05 - C I - SoSe 2014 (Prof. Bunz) 1. a) Geben sie den Reaktionsmechanismus für die itrierung und die Sulfonierung von Benzol an. Beginnen sie mit der rzeugung des lektrophils. I) rzeugung lektrophil:
Übungsblatt 05 - C I - SoSe 2014 (Prof. Bunz) 1. a) Geben sie den Reaktionsmechanismus für die itrierung und die Sulfonierung von Benzol an. Beginnen sie mit der rzeugung des lektrophils. I) rzeugung lektrophil:
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Seminar zum Organisch-Chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016. Aromatische Substitution. Dr. Florian Achrainer AK Zipse
 Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Name, Vorname: Matrikelnummer: Studienrichtung: Fragen auf den folgenden Seiten: Musterlösung zur Klausur zur Experimentalvorlesung Organische Chemie
 rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
Claisen-Kondensation
 Quelle: gerlicher.de In dieser Datei soll der Mechanismus der Biosynthese wichtiger Bausteine von Ölen und festen Fetten näher betrachtet werden, nämlich die Biosynthese der Fettsäuren. Quelle: gerlicher.de
Quelle: gerlicher.de In dieser Datei soll der Mechanismus der Biosynthese wichtiger Bausteine von Ölen und festen Fetten näher betrachtet werden, nämlich die Biosynthese der Fettsäuren. Quelle: gerlicher.de
Übungen zur VL Chemie für Biologen und Humanbiologen
 Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
N N. Chinolin. Pyridin. Imidazol
 6. eterocyclische Verbindungen 51 Als carbocyclisch bezeichnet man ingmoleküle, deren inge nur aus Kohlenstoffatomen aufgebaut sind. In den sogenannten eterocyclen ist mindestens ein Kohlenstoff des ings
6. eterocyclische Verbindungen 51 Als carbocyclisch bezeichnet man ingmoleküle, deren inge nur aus Kohlenstoffatomen aufgebaut sind. In den sogenannten eterocyclen ist mindestens ein Kohlenstoff des ings
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 CE 102.1: Grundlagen der Chemie - rganische Chemie Prof Dr. E. Landau und Prof. Dr. J. A. obinson 6. eterocyclische Verbindungen Als carbocyclisch bezeichnet man ingmoleküle, deren inge nur aus Kohlenstoffatomen
CE 102.1: Grundlagen der Chemie - rganische Chemie Prof Dr. E. Landau und Prof. Dr. J. A. obinson 6. eterocyclische Verbindungen Als carbocyclisch bezeichnet man ingmoleküle, deren inge nur aus Kohlenstoffatomen
Inhaltsverzeichnis zu Kapitel 6. Aromaten
 Inhaltsverzeichnis zu Kapitel 6. Aromaten 6. Aromaten 6.1 Aromatizität 73 6.2 omenklatur 75 6.3 Darstellung 76 6.4 lektrophile Substitution am Aromaten 76 6.5 Beispiele für S -Reaktionen (was ist?) 77
Inhaltsverzeichnis zu Kapitel 6. Aromaten 6. Aromaten 6.1 Aromatizität 73 6.2 omenklatur 75 6.3 Darstellung 76 6.4 lektrophile Substitution am Aromaten 76 6.5 Beispiele für S -Reaktionen (was ist?) 77
Elektrophile Additionen von HX an die CC-Doppelbindung (Vollhardt, 3. Aufl., S , 4. Aufl., S ; Hart, S ; Buddrus, S.
 Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Radikalische Substitution von Alkanen
 adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
Indanon ist das Produkt einer Friedel-Crafts-Acylierung Geben Sie die Reaktionsgleichung zu seiner Synthese an.
 Aromatenchemie für Fortgeschrittene 1.Wiederholung: Elektrophile aromatische Substitutionen 1.1. Geben Sie die Bruttogleichung für die zweistufige Synthese von Styren an. 1.2. Formulieren Sie die Reaktionsgleichung
Aromatenchemie für Fortgeschrittene 1.Wiederholung: Elektrophile aromatische Substitutionen 1.1. Geben Sie die Bruttogleichung für die zweistufige Synthese von Styren an. 1.2. Formulieren Sie die Reaktionsgleichung
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
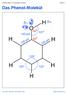 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
a81 a Carbonylverbindungen (I)
 Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
a81 a Carbonylverbindungen (I)
 Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
Lösungen 3. Übungsblatt SS 2002
 Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Additionsreaktionen an die C=C-Doppelbindung
 Triolein C 57 H 104 O 6 Schmelzpunkt: 5 C Siedebereich: 235-240 C Tetradecan C 14 H 30 Quelle: bioltec.de Schmelzpunkt: 5,5 C Siedepunkt: 253 C Quelle: oerlikon.com Die Formeln in der Abbildung geben das
Triolein C 57 H 104 O 6 Schmelzpunkt: 5 C Siedebereich: 235-240 C Tetradecan C 14 H 30 Quelle: bioltec.de Schmelzpunkt: 5,5 C Siedepunkt: 253 C Quelle: oerlikon.com Die Formeln in der Abbildung geben das
Herstellung des Benzoldiazoniumchlorids aus Anilin, Natriumnitrit und Salzsäure. Benzoldiazonium-Ion
 Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Organische Chemie I Molekül der Woche - Azulen
 I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2016
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Aromatische Kohlenwasserstoffe
 Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
Versuch: Bromierung von Phenol
 Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Energie. 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital
 sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Nucleophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte
 Nucleophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Nucleophile Reak:onen Signale: Das organischen Molekül besitzt ein posi:v polarisiertes C- Atom in der KohlenstoKeLe.
Nucleophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Nucleophile Reak:onen Signale: Das organischen Molekül besitzt ein posi:v polarisiertes C- Atom in der KohlenstoKeLe.
Quelle: Walter Reppe
 Einleitung Quelle: www.intermediates.basf.com/chemicals/kundenreportage/reppe-chemie Walter Reppe 1892 1969 Direktor des auptlaboratoriums der BASF Vater der Acetylen-hemie ( Reppe-Synthesen ) harakteristisch
Einleitung Quelle: www.intermediates.basf.com/chemicals/kundenreportage/reppe-chemie Walter Reppe 1892 1969 Direktor des auptlaboratoriums der BASF Vater der Acetylen-hemie ( Reppe-Synthesen ) harakteristisch
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2018
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser und Dr. Martin Sumser September
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser und Dr. Martin Sumser September
Chemische Bindung in Kohlenwasserstoffen / Orbitalhybridisierung
 Quelle: www.fotocommunity.de C Methan Der einfachste Kohlenwasserstoff, das Methan, gehört zu den gasförmigen Ausscheidungsprodukten von Wiederkäuern. Das Methanmolekül weist die Struktur eines idealen
Quelle: www.fotocommunity.de C Methan Der einfachste Kohlenwasserstoff, das Methan, gehört zu den gasförmigen Ausscheidungsprodukten von Wiederkäuern. Das Methanmolekül weist die Struktur eines idealen
Zusammenfassung 2. Teil
 Zusammenfassung 2. Teil Aromaten Wichtigste Vertreter: C 3 Vorkommen und Isolation: rdöl Verwendung: Lösungsmittel, Ausgangsmaterial für Synthesen Benzol (krebserregend) Toluol Bestandteil im Benzin, Benzolfreie
Zusammenfassung 2. Teil Aromaten Wichtigste Vertreter: C 3 Vorkommen und Isolation: rdöl Verwendung: Lösungsmittel, Ausgangsmaterial für Synthesen Benzol (krebserregend) Toluol Bestandteil im Benzin, Benzolfreie
Beispiele. Polysubstituierte Benzole. Chapter 16. Organic Chemistry. Reaktionen of Substituierter Benzole. Bezeichnung durch Numerierung oder Präfix
 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Beispiele Chapter 16 Reaktionen of Substituierter Benzole Irene Lee Case Western Reserve University Cleveland, OH 2004, Prentice Hall Bezeichnung durch
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Beispiele Chapter 16 Reaktionen of Substituierter Benzole Irene Lee Case Western Reserve University Cleveland, OH 2004, Prentice Hall Bezeichnung durch
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
LMPG 2, ÜB21, Molekülbau & UV/VIS-Absorption LÖSUNG 1 von 11
 LMPG 2, ÜB21, Molekülbau & UV/VISAbsorption LÖSUG 1 von 11 Übung 1: Charakterisierung von Absorptionsbanden Veränderungen der Molekülstruktur können zu Verschiebungen der einzelnen Absorptionsbanden im
LMPG 2, ÜB21, Molekülbau & UV/VISAbsorption LÖSUG 1 von 11 Übung 1: Charakterisierung von Absorptionsbanden Veränderungen der Molekülstruktur können zu Verschiebungen der einzelnen Absorptionsbanden im
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Br 1. Auch bei der folgenden Kombination, sind die Strukturen nicht identisch, sie lassen sich durch Drehung nicht ineinander überführen.
 Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME Drill&Practice: Arene. Sind folgende Strukturpaare zueinander identisch? Die Frage ist möglicherweise nicht so simpel, wie sie sich anhört. Gemeint
Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME Drill&Practice: Arene. Sind folgende Strukturpaare zueinander identisch? Die Frage ist möglicherweise nicht so simpel, wie sie sich anhört. Gemeint
Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt
 Chemisches Praktikum für Studierende der umanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 2. Klausur zum 2. Praktikumsteil (C) vom 25.07.17 NAME;
Chemisches Praktikum für Studierende der umanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 2. Klausur zum 2. Praktikumsteil (C) vom 25.07.17 NAME;
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
2 Nucleophile Substitutionen am gesättigten Kohlenstoff
 2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!)
 . Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
. Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
3. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2000
 Prof. Dr. B. König Prof. Dr. Th. Troll 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Donnerstag, dem 27. Juli 2000 ame: Mustermann...Vorname: Max...
Prof. Dr. B. König Prof. Dr. Th. Troll 3. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Donnerstag, dem 27. Juli 2000 ame: Mustermann...Vorname: Max...
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Darstellung von Phenolphthalein und Fluorescein
 Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Chemie für Biologen SS Georg Jansen AG Theoretische Organische Chemie Universität Duisburg Essen. (Teil 11: Alkine / Polyene / Aromaten)
 hemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische hemie Universität Duisburg Essen (Teil 11: Alkine / Polyene / Aromaten) Bindungen mit sp ybridobitalen Bindungen mit sp ybridorbitalen
hemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische hemie Universität Duisburg Essen (Teil 11: Alkine / Polyene / Aromaten) Bindungen mit sp ybridobitalen Bindungen mit sp ybridorbitalen
Bromierung von Cycloalkenen
 hemie Q1 / 4. Reaktionswege der organischen hemie / 4.2 Alkene und elektrophile Addition 1/ omierung von ycloalkenen Zufällig kommt ein 2-Molekül in die Nähe der elektronenreichen Doppelbindung. Ulrich
hemie Q1 / 4. Reaktionswege der organischen hemie / 4.2 Alkene und elektrophile Addition 1/ omierung von ycloalkenen Zufällig kommt ein 2-Molekül in die Nähe der elektronenreichen Doppelbindung. Ulrich
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. Christoffers, Vorlesung rganische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 6. Aromaten 6.1 Aromatizität Benzol ist eine Verbindung mit der Summenformel
Prof. Christoffers, Vorlesung rganische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 6. Aromaten 6.1 Aromatizität Benzol ist eine Verbindung mit der Summenformel
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Arzneistoff der Woche. Alkohole. Eliminierungen. Organische Chemie Agenda. Johann Wolfgang Goethe -Universität Frankfurt am Main
 Agenda Arzneistoff der Woche Alkohole Eliminierungen 1 Prof. Dr. Manfred Schubert-Zsilavecz Dabigatran - Struktur 2 Prof. Dr. Manfred Schubert-Zsilavecz Lucas-Test 3 Prof. Dr. Manfred Schubert-Zsilavecz
Agenda Arzneistoff der Woche Alkohole Eliminierungen 1 Prof. Dr. Manfred Schubert-Zsilavecz Dabigatran - Struktur 2 Prof. Dr. Manfred Schubert-Zsilavecz Lucas-Test 3 Prof. Dr. Manfred Schubert-Zsilavecz
10. Jahrgangsstufe Organische Chemie Skript Einführungsklasse
 4. Die Eigenschaften von Alkanen 4.1 Der Aggregatszustand bzw. die Siedetemperatur Der Aggregatszustand von Alkanen bei Raumtemperatur ist von der Siedetemperatur abhängig und steht in Zusammenhang mit
4. Die Eigenschaften von Alkanen 4.1 Der Aggregatszustand bzw. die Siedetemperatur Der Aggregatszustand von Alkanen bei Raumtemperatur ist von der Siedetemperatur abhängig und steht in Zusammenhang mit
Schulversuch (Gruppe 6/Assistentenversuch): Vergleich aliphatischer Alkohole und Phenole
 Philipps-Universität Marburg 26.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 6/Assistentenversuch):
Philipps-Universität Marburg 26.11.2008 rganisch-chemisches Praktikum für das Lehramt (LA) Torsten Lasse Leitung: Dr. P. Reiß WS 2008/09 Assistentin: Beate Abé Schulversuch (Gruppe 6/Assistentenversuch):
Chemie II. Vorlesung: Mo Uhr, HPT C103 Übungen: Mo Uhr, HCI H2.1, HCI J4
 hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
13. Amine und ihre Derivate
 Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
Fragen aus dem ersten Abschnitt der pharmazeutischen Prüfung
 Agenda Molekül der Woche Fragen aus dem ersten Abschnitt der pharmazeutischen Prüfung Elektrophile und nucleophile Substitution am Aromaten Molekül der Woche Rolle von Kathepsin K bei der Knochenresorption
Agenda Molekül der Woche Fragen aus dem ersten Abschnitt der pharmazeutischen Prüfung Elektrophile und nucleophile Substitution am Aromaten Molekül der Woche Rolle von Kathepsin K bei der Knochenresorption
Die Strukturabhängigkeit der chemischen Verschiebung
 Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
Organische Chemie. Kapitel 1. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Organische Verbindungen enthalten Kohlenstoff
 rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
Organische Chemie im Überblick
 Evelyne Chelain Nadeqe Lubin-Germain Jacques Uziel Organische Chemie im Überblick Grundwissen in Lerneinheiten Aus dem Französischen übersetzt von Karin Beifuss ~ Springer Spektrum Inhaltsverzeichnis 1
Evelyne Chelain Nadeqe Lubin-Germain Jacques Uziel Organische Chemie im Überblick Grundwissen in Lerneinheiten Aus dem Französischen übersetzt von Karin Beifuss ~ Springer Spektrum Inhaltsverzeichnis 1
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
5. Aromatische Kohlenwasserstoffe
 Inhalt Index 5. Aromatische Kohlenwasserstoffe Aufgrund der starken Aromas, das viele Benzolderivate ausströmen, nennt man sie aromatische Verbindungen. Deshalb gilt Benzol als Stammverbindung der Aromaten.
Inhalt Index 5. Aromatische Kohlenwasserstoffe Aufgrund der starken Aromas, das viele Benzolderivate ausströmen, nennt man sie aromatische Verbindungen. Deshalb gilt Benzol als Stammverbindung der Aromaten.
Prüfungsaufgaben von und zu Aromaten (incl. Aryldiazoniumsalzen)
 Prüfungsaufgaben von und zu Aromaten (incl. Aryldiazoniumsalzen) Die Aufgaben lehnen sich an Prüfungsaufgaben aus der Abschlussprüfung für Chemielaboranten der vergangenen Jahre an. äufig erstrecken sich
Prüfungsaufgaben von und zu Aromaten (incl. Aryldiazoniumsalzen) Die Aufgaben lehnen sich an Prüfungsaufgaben aus der Abschlussprüfung für Chemielaboranten der vergangenen Jahre an. äufig erstrecken sich
Organische Chemie, Reaktionsmechanismen
 , Reaktionen, Teil 3-1 - hemieskript Dr. R. Steiger rganische hemie, Reaktionsmechanismen Das Lernziel dieser Unterrichtseinheit beinhaltet folgende Punkte: Wie können funktionelle Gruppen ineinander überführt
, Reaktionen, Teil 3-1 - hemieskript Dr. R. Steiger rganische hemie, Reaktionsmechanismen Das Lernziel dieser Unterrichtseinheit beinhaltet folgende Punkte: Wie können funktionelle Gruppen ineinander überführt
Reak%onen an der Carbonylgruppe
 Reak%onen an der Carbonylgruppe H. Wünsch 2013 1.1 Struktur der Carbonylgruppe Die Carbonylgruppe entsteht bei der OxidaBon primärer und sekundärer Alkohole. Kohlenstoff und Sauerstoff sind doppelt gebunden,
Reak%onen an der Carbonylgruppe H. Wünsch 2013 1.1 Struktur der Carbonylgruppe Die Carbonylgruppe entsteht bei der OxidaBon primärer und sekundärer Alkohole. Kohlenstoff und Sauerstoff sind doppelt gebunden,
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Organische Chemie I. OC I Lehramt F. H. Schacher 1
 Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
