Homologe Reihe der unverzweigten Alkane C n H (2n+2)
|
|
|
- Peter Lorentz
- vor 5 Jahren
- Abrufe
Transkript
1 Organische hemie I 3.01 Homologe Reihe der unverzweigten Alkane n H (2n+2) (Paraffine) (veraltet: normale Alkane = n-alkane) Name Konstitution Siedepunkt ausführliche Schreibweise Stenographie [ ] Methan H Ethan - 89 Propan Butan Pentan Hexan Heptan und so weiter Stand SS 2010 Seite 19
2 Organische hemie I 3.02 Konstitutionsoisomere acyclischer Alkane n H (2n+2) mit vier und mehr Kohlenstoffatomen Zahl der Name Konstitution Isomere (veraltete Namen) ausführliche Schreibweise Stenographie 4 2 Butan (n-butan) 2-Methylpropan (Isobutan, i-butan) H 5 3 Pentan (n-pentan) 2-Methylbutan (Isopentan, i-pentan) H 6 5 2,2-Dimethylpropan (Neopentan) > > Stand SS 2010 Seite 20
3 Organische hemie I 3.03 Physikalische Eigenschaften konstitutionsisomerer 5 -Alkane 5 H 12 Schmelzpunkt Siedepunkt [ ] Pentan Methylbutan H ,2-Dimethylpropan Bildungsenthalpie ΔH 0 f [kj mol 1 ] des Methans aus Verbrennungsenthalpien ΔH 0 v O 2 ΔH 0 f = 74,9 H O 2 ΔH 0 v = Enthalpie ΔH 0 v = ΔH 0 [kj mol -1 ] O O + O 2 O 2 ΔH 0 v = O 2 2 O ΔH 0 v = Stand SS 2010 Seite 21
4 Organische hemie I 3.05 Mechanismus der radikalischen Substitution von Methan mit hlor Start l l h. v oder Δ l + l ΔH = 239 kj/mol Kette l + H l H + Methylradikal + l l l + l Abbruch 2 l l l 2 l + l Ausgewählte Bindungsdissoziationsenergie, BDE (kj/mol) Bindung BDE (kj/mol) Bindung BDE (kj/mol) H H 432 F F 155 H OH 499 I l 239 H l 428 Br Br 190 I I 149 H 435 F 444 H 411 I 339 H H( ) Br 289 H ( ) I 222 H 6 H H 6 H N N 253 H H= 371 HO O14 ( ) 3 O O( ) H 5 (O)O O(O) 6 Hs 126 Stand SS 2010 Seite 22
5 Organische hemie I 3.06 Substitutionsgrad von Kohlenstoff-, Stickstoff- und Sauerstoffatomen Atom in Bezeichnung Verbindungsklasse primär sekundär tertiär quartär Kohlenstoffatom in Alkanen H in hloralkanen l H l l in Alkoholen OH H OH Kohlenstoffatom / / / in arbenium- H Ionen OH Stickstoffatom in Aminen N NH N in Ammonium- Ionen / / / / N N N H N Sauerstoffatom in Oxonium-Ionen / / / O OH O Stand SS 2010 Seite 23
6 Organische hemie I 3.07 Zusammensetzung von Erdgas (schwankt je nach Herkunft) [Vol.%] Methan H Ethan 2 H Propan 3 H Butan 4 H Alkane und höhere 0 1 Kohlendioxid O Schwefelwasserstoff S 0 6 Stickstoff N Helium He 0 7 Zusammensetzung von Erdöl Verbindungsklassen Elemente [Gew.%] Alkane ycloalkane (Naphthene) H aromatische Kohlenwasserstoffe S Alkene (Spuren) N, O, Metalle Spuren Schwefelverbindungen Stand SS 2010 Seite 24
7 Organische hemie I 3.08 Weltverbrauch nach Energieträgern Reichweite der fossilen Energieträger Jahre Erdöl Erdgas Braun- und Steinkohle Quelle: Bundesanstalt für Geow issenschaften und Rohstoffe, 2005 Uran Stand SS 2010 Seite 25
8 Organische hemie I Destillation von Erdöl in einer Raffinerie 3.09 Quelle: MINERALÖLWIRTSHAFTSVERBAND, Hamburg Stand SS 2010 Seite 26
9 Organische hemie I 3.10 Thermische Spaltung acyclischer Alkane Spaltung von -H-Bindungen Dehydrierung R H H R + R R homolytische Spaltung einer --Bindung hochreaktive Radikale R H R Disproportionierung R H + H R 3.11 hemische Umwandlung von Rohbenzin durch den Reforming-Prozess 4 yclisierung und Aromatierung H H H H H H Benzol Hexan Platin- Katalysator yclisierung Isomerisierung H 2 H H 3 H2 Methylcyclopentan H 2-Methylpentan + + H Hydrogenolyse 3 Propan Stand SS 2010 Seite 27
10 Organische hemie I Produkte der Petrochemie 3.12 Anlagen Primärchemikalien Zwischenprodukte Kunststoffe, veredelte hemikalien, z.b. Rücklauf in Vergaser- Kraftstoff Ethylen Polyethylen Ethylenoxid Folien, Verpackungsmittel, Flaschen, Spritzgußteile, Haushaltsartikel Wasch- und Reinigungsmittel, Frostschutzmittel, Lacke, Farbstoffe, Faserrohstoffe Rohbenzin (Naphtha) Olefinanlage (Steamcracker) Propylen Ethanol Propylenoxid Acrylnitril Lösungsmittel, Zwischenprodukte für Pharmazeutika, Lacke Weich- und Hartschaumstoffe für Polstermöbel und Kühlschränke Acrylfasern, Synthesekautschuk, schlagfeste Kunststoffe 4 -Gemisch Butadien Synthesekautschuk, z. B. für Autoreifen Pyrolysebenzin Benzol Polystyrol Nylon Formteile und Schaumstoffe für Verpackungs- und Bauindustrie Synthesefasern für die Textilindustrie Rücklauf in Vergaser- Kraftstoff Reformatbenzin Aromatenanlage Toluol Xylol Polyurethane Polyester Alkydharze Elektroisolier- und Metallacke, Polstermaterialien, Schaumstoffe Glasfaserverstärkte Kunststoffe Synthesefasern, Möbellacke Außenbeständige Anstriche, Anstrichmittel für Kraftfahrzeuge Naphtha oder Erdgas Synthesegasanlage Synthesegase Methanol Ammoniak Zusatz für Kraftstoffe, Pflanzenschutzmittel Düngemittel, Salpetersäure (Sprengstoffe) Zwischenprodukte für Pharmazeutika Stand SS 2010 Seite 28
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
Illustration des Crack-Prozesses am Beispiel der Pentan-Pyrolyse
 Vorlesung 9. Erdölverarbeitung. (Vollhardt, 3. Aufl., S. 92-95, 4. Aufl., S. 108-111; art, S. 127-129; Buddrus, S.87-88) Nach Entfernung von Wasser, Feststoffen und Erdgas (Erhitzen) erfolgt eine fraktionierte
Vorlesung 9. Erdölverarbeitung. (Vollhardt, 3. Aufl., S. 92-95, 4. Aufl., S. 108-111; art, S. 127-129; Buddrus, S.87-88) Nach Entfernung von Wasser, Feststoffen und Erdgas (Erhitzen) erfolgt eine fraktionierte
Inhaltsverzeichnis ARTIKELLISTE
 Inhaltsverzeichnis 26 Seite 1,2 Ammoniak NH 3 3 Acetylen C 2 H 2 19 Argon Ar 18 Benzol C 6 H 6 19 Butan C 4 H 10 und i-butan i-c 4 H 10 5 Chlor Cl 2 18 Chlorwasserstoff HCl 18 Cyanwasserstoff HCN 18 Dreigas-Gemische
Inhaltsverzeichnis 26 Seite 1,2 Ammoniak NH 3 3 Acetylen C 2 H 2 19 Argon Ar 18 Benzol C 6 H 6 19 Butan C 4 H 10 und i-butan i-c 4 H 10 5 Chlor Cl 2 18 Chlorwasserstoff HCl 18 Cyanwasserstoff HCN 18 Dreigas-Gemische
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Kohlenwasserstoffe. Benzol Naphthalin usw. Alkane Alkene Alkine Cycloaliphaten. Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w.
 OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
2. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
Alkane und Cycloalkane
 Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Einführung in die Nomenklatur der organischen Chemie. Einteilung der Kohlenwasserstoffe
 organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
Fossile Rohstoffe. Erdöl
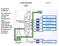 Fraktionierte Destillation Die stufenweise Abtrennung einzelner Komponenten eines Stoffgemisches aufgrund der unterschiedlichen Siedepunkte wird als fraktionierte Destillation bezeichnet. 1 Fraktionierte
Fraktionierte Destillation Die stufenweise Abtrennung einzelner Komponenten eines Stoffgemisches aufgrund der unterschiedlichen Siedepunkte wird als fraktionierte Destillation bezeichnet. 1 Fraktionierte
2. Alkane. Allgemeines. Nomenklatur + Konstitutionsisomerie. Konformationsisomerie. Industrielle Bedeutung. Synthetische Darstellung
 2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane Organische Chemie I LA / J. C. Brendel 1 Allgemeines
2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane Organische Chemie I LA / J. C. Brendel 1 Allgemeines
Übungen Kapitel 1 Alkane- Radikalische Substitution
 Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
2. Alkane. Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane
 2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane OC I Lehramt F. H. Schacher 1 Allgemeines Kohlenwasserstoffe
2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane OC I Lehramt F. H. Schacher 1 Allgemeines Kohlenwasserstoffe
II. Halogenalkane, radikalische und nukleophile Substitution
 II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Kohlenwasserstoffe. sp 3 -Orbitale. Alkane. Alkene. sp 2 - Orbitale p z - Orbital. sp -Orbitale p y, p z - Orbitale. Alkine
 Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
1. Aspekte der Energie- und Rohstoffversorgung Gegenwärtiger und absehbarer Energiebedarf 2
 Inhalt 1. Aspekte der Energie- und Rohstoffversorgung 1 1.1. Gegenwärtiger und absehbarer Energiebedarf 2 1.2. Verfügbarkeit einzelner Energieträger 3 1.2.1. Erdöl 3 1.2.2. Erdgas 4 1.2.3. Kohle 4 1.2.4.
Inhalt 1. Aspekte der Energie- und Rohstoffversorgung 1 1.1. Gegenwärtiger und absehbarer Energiebedarf 2 1.2. Verfügbarkeit einzelner Energieträger 3 1.2.1. Erdöl 3 1.2.2. Erdgas 4 1.2.3. Kohle 4 1.2.4.
Abituraufgaben Alkane 1980/II/3 1981/II/1
 Abituraufgaben Alkane 1980/II/3 3 Skizzieren Sie das Energiediagramm für die Konformationen des n-butans bei der Rotation (Rotationswinkel 0 bis 180 ) um die Bindung zwischen dem zweiten und dritten Kohlenstoffatom.
Abituraufgaben Alkane 1980/II/3 3 Skizzieren Sie das Energiediagramm für die Konformationen des n-butans bei der Rotation (Rotationswinkel 0 bis 180 ) um die Bindung zwischen dem zweiten und dritten Kohlenstoffatom.
Chemie Alkohole, Aldehyde & Ketone, Carbonsäuren
 Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Kohlenstoffverbindungen
 Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Organische Chemie. Einstieg. Chemie-Formeldarstellungen. Formeldarstellungen der Chemie: Bei Ionenverbindungen: Verhältnisformeln. , AlF 3. etc.
 Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Vorlesung 5. Alkane. Experimentalchemie, Prof. H. Mayr 20 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. Anzahl C-Atome im n-alkan
 Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
v = - = - = = k [R] [S]
![v = - = - = = k [R] [S] v = - = - = = k [R] [S]](/thumbs/81/82977406.jpg) Vorlesung 7 Die hemische Kinetik (Vollhardt, 3 Aufl, S 70-72, 4 Aufl, S 54-58; art, S 107-110; Buddrus, S 26-29) befasst sich mit Geschwindigkeit, mit der eine Reaktion abläuft R S P Geschwindigkeit einer
Vorlesung 7 Die hemische Kinetik (Vollhardt, 3 Aufl, S 70-72, 4 Aufl, S 54-58; art, S 107-110; Buddrus, S 26-29) befasst sich mit Geschwindigkeit, mit der eine Reaktion abläuft R S P Geschwindigkeit einer
Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen
 2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 2.
 Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 4
 Prof. Dr. ashmi, Sommersemester 2005 33 rganische hemie für Technische Biologen, rganische hemie für Lehramtskandidaten, Teil 4 Anders als das Methan weisen die meisten Kohlenwasserstoffe verschiedene
Prof. Dr. ashmi, Sommersemester 2005 33 rganische hemie für Technische Biologen, rganische hemie für Lehramtskandidaten, Teil 4 Anders als das Methan weisen die meisten Kohlenwasserstoffe verschiedene
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Organische Chemie. 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8. Lehrstuhl für Organische Chemie
 Organische Chemie 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8 Lehrstuhl für Organische Chemie (ivanov43@gmail.com) Prof. Dr. Ivo C. Ivanov 1 1. Gegenstand der Organischen Chemie,
Organische Chemie 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8 Lehrstuhl für Organische Chemie (ivanov43@gmail.com) Prof. Dr. Ivo C. Ivanov 1 1. Gegenstand der Organischen Chemie,
Fossile Rohstoffe. Kohlenwasserstoffe als Energieträger
 Kohlenwasserstoffe als Energieträger, Kohle, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da
Kohlenwasserstoffe als Energieträger, Kohle, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da
Butanol Butanal Butansäure
 Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Organische Experimentalchemie
 PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und
PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und
1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2
 A l k a n e 1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2 2. Die homologe Reihe der Alkane 2 2.1. Beispiele: Butan, exan und Eicosan (Paraffin)
A l k a n e 1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2 2. Die homologe Reihe der Alkane 2 2.1. Beispiele: Butan, exan und Eicosan (Paraffin)
Eigenschaften, Vorkommen und Anwendungen einiger C 5 -C 10 -Alkane
 Eigenschaften, Vorkommen und Anwendungen einiger C 5 -C 10 -Alkane C 5 H 12 : Pentane (3 Konstitutions-Isomere) n-pentan: SdT 36 C SmT - 130 C Dichte 0,63g/cm 3 (20 C) F +, X n, N R 12-65-66-51/53 S (2)-9-16-29-33-61-62
Eigenschaften, Vorkommen und Anwendungen einiger C 5 -C 10 -Alkane C 5 H 12 : Pentane (3 Konstitutions-Isomere) n-pentan: SdT 36 C SmT - 130 C Dichte 0,63g/cm 3 (20 C) F +, X n, N R 12-65-66-51/53 S (2)-9-16-29-33-61-62
Industrielle Organische Chemie
 Hans-Jürgen Arpe Industrielle Organische Chemie Bedeutende Vor- und Zwischenprodukte Sechste, vollständig überarbeitete Auflage B1CENTENNIAL B1CENTENNIAL WILEY-VCH Verlag GmbH & Co. KGaA Inhaltsverzeichnis
Hans-Jürgen Arpe Industrielle Organische Chemie Bedeutende Vor- und Zwischenprodukte Sechste, vollständig überarbeitete Auflage B1CENTENNIAL B1CENTENNIAL WILEY-VCH Verlag GmbH & Co. KGaA Inhaltsverzeichnis
Grundwissen Chemie Mittelstufe (10 MNG)
 Grundwissen hemie Mittelstufe (10 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Grundwissen hemie Mittelstufe (10 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Stationenlernen Chemie im Paket. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Stationenlernen Chemie im Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Bestellnummer: 59149 Stationenlernen:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Stationenlernen Chemie im Paket Das komplette Material finden Sie hier: School-Scout.de Titel: Bestellnummer: 59149 Stationenlernen:
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Dreifach koordiniertes Kohlenstoffatom mit ebener Anordnung der Liganden. Beispiel Alkene
 5.0 Dreifach koordiniertes Kohlenstoffatom mit ebener Anordnung der Liganden Beispiel Alkene Kohlenstoffatom im Grundzustand Kohlenstoffatom mit drei sp 2 -ybrid-atomorbitalen 2p-rbitale 2s-rbital fiktive
5.0 Dreifach koordiniertes Kohlenstoffatom mit ebener Anordnung der Liganden Beispiel Alkene Kohlenstoffatom im Grundzustand Kohlenstoffatom mit drei sp 2 -ybrid-atomorbitalen 2p-rbitale 2s-rbital fiktive
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
Die Herstellung von Alkenen aus Chloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen.
 Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
9. Alkohole. Alkohole können als Derivate des Wassers betrachtet werden, bei denen ein Wasserstoff durch einen Alkylrest ausgetauscht wurde: IOMC
 9. Alkohole Als ALKOHOLE (Alkanole) bezeichnet man organische Verbindungen, die mindestens eine Hydroxygruppe (-OH) (als Gruppe höchster Priorität) besitzen. Bei den Resten R handelt es sich um ALKYLGRUPPEN!
9. Alkohole Als ALKOHOLE (Alkanole) bezeichnet man organische Verbindungen, die mindestens eine Hydroxygruppe (-OH) (als Gruppe höchster Priorität) besitzen. Bei den Resten R handelt es sich um ALKYLGRUPPEN!
ORGANISCHE CHEMIE. Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen
 ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden?
 Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
Grundwissen Chemie 10. Klasse NTG
 Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
OSZ Körperpflege Chemie Fachhochschulreife FOS 2009/10
 Name: Klasse: GASCHROMATOGRAFIE Experiment 08 1. Aufgabe: a) Nehmen Sie ein Gaschromatogramm ihres Feuerzeuggases auf. (Füllen Sie dazu 2 ml des Feuerzeuggases in die Spritze!) Siehe Anlage Durchführung!!!
Name: Klasse: GASCHROMATOGRAFIE Experiment 08 1. Aufgabe: a) Nehmen Sie ein Gaschromatogramm ihres Feuerzeuggases auf. (Füllen Sie dazu 2 ml des Feuerzeuggases in die Spritze!) Siehe Anlage Durchführung!!!
Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. Dr. J. Christoffers Institut für Organische Chemie Universität Stuttgart 29.04.2003 Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. Einführung 2.
Prof. Dr. J. Christoffers Institut für Organische Chemie Universität Stuttgart 29.04.2003 Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. Einführung 2.
Chemie. für die Berufsmaturität. Günter Baars. Chemie. Baars. Unter Mitarbeit von Franz Heini, Markus Isenschmid und Doris Kohler
 www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
2.1 Homologe Reihe, Nomenklatur, Konstitution, Konformation CH 2
 Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
Organische Stofflehre
 Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Halogenalkane. Radikalische Halogenierung von Alkanen. Addition von Halogenwasserstoffen an Alkene. H 3 C + HBr H C C C H.
 alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Homologe Reihe der Alkane. Benennung der Alkane. Konstitutionsisomerie. Isomerie. Was versteht man unter der Homologen Reihe der Alkane?
 Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Ein Alkan, dem ein H-Atom fehlt, wird Alkyl-Rest genannt. Der Name ergibt sich aus dem Alkan, jedoch mit der Endung yl:
 Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Grundkurs Chemie Alkane
 Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Chemiefragen 10.Klasse:
 Hausaufgaben bitte entweder: - auf Papier schriftlich erledigen oder - per email an Herrn Apelt senden: Reinhard.Apelt@web.de Chemiefragen 10.Klasse: A) Organische Verbindungen Kohlenwasserstoffe B) Erdöl
Hausaufgaben bitte entweder: - auf Papier schriftlich erledigen oder - per email an Herrn Apelt senden: Reinhard.Apelt@web.de Chemiefragen 10.Klasse: A) Organische Verbindungen Kohlenwasserstoffe B) Erdöl
Zahl der C-Atome Allgemeine Summenformel C n H 2n+ ₂
 1 Kohlenwasserstoffe Übungsaufgaben zum Kapitel sauerstoffhaltige organische Verbindungen mit Hilfe des Lernprogramms Isomerer 1.1 Ergänze mit Hilfe des Programms "Isomerer" die folgende Tabelle für nur
1 Kohlenwasserstoffe Übungsaufgaben zum Kapitel sauerstoffhaltige organische Verbindungen mit Hilfe des Lernprogramms Isomerer 1.1 Ergänze mit Hilfe des Programms "Isomerer" die folgende Tabelle für nur
REAKTIONEN DER ORGANISCHEN CHEMIE
 REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
Stoffliche Nutzung von Biomasse in der chemischen Industrie Perspektiven für Biomethan
 3. Dezember 2015 Stoffliche Nutzung von Biomasse in der chemischen Industrie Perspektiven für Biomethan Dr. Jörg Rothermel, DENA Biogaspartner, Berlin, 3. Dezember 2015 Agenda Rohstoffe in der Chemie Biomasse
3. Dezember 2015 Stoffliche Nutzung von Biomasse in der chemischen Industrie Perspektiven für Biomethan Dr. Jörg Rothermel, DENA Biogaspartner, Berlin, 3. Dezember 2015 Agenda Rohstoffe in der Chemie Biomasse
Alkene / Additions-, Eliminierungsreaktionen
 2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
A. ANPASSUNG DER MOLMASSE EINES KOHLENWASSERSTOFFS AN DIE EXPERIMENTELLEN DATEN
 ANHANG A. ANPASSUNG DER MOLMASSE EINES KOHLENWASSERSTOFFS AN DIE EXPERIMENTELLEN DATEN M Al (τ) =27.073 0.10469τ +0.000810729τ 2 M Ar (τ) =33.8098 0.202791τ +0.000927588τ 2 Tab. A.1: Anpassung der Molmasse
ANHANG A. ANPASSUNG DER MOLMASSE EINES KOHLENWASSERSTOFFS AN DIE EXPERIMENTELLEN DATEN M Al (τ) =27.073 0.10469τ +0.000810729τ 2 M Ar (τ) =33.8098 0.202791τ +0.000927588τ 2 Tab. A.1: Anpassung der Molmasse
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
Schulcurriculum für die Einführungsphase Chemie Jahrgang 11
 Helene-Lange-Schule Hannover Schulcurriculum für die Einführungsphase Chemie Jahrgang 11 ganzjähriger Unterricht: ca. 64 Unterrichtsstd. Hinweis: Folgende grundlegende Kompetenzen aus dem Bereich Kommunikation
Helene-Lange-Schule Hannover Schulcurriculum für die Einführungsphase Chemie Jahrgang 11 ganzjähriger Unterricht: ca. 64 Unterrichtsstd. Hinweis: Folgende grundlegende Kompetenzen aus dem Bereich Kommunikation
Grundwissen der 10.Klasse NTG
 Grundwissen der 10.Klasse NTG 1. Kohlenwasserstoffe 1.1 Alkane 1.1.1 Organische Stoffe = Verbindungen, die Kohlenstoffatome enthalten Ausnahme: Kohlenstoffoxide, Kohlensäure, Carbonate 1.1.2 Kohlenwasserstoffe
Grundwissen der 10.Klasse NTG 1. Kohlenwasserstoffe 1.1 Alkane 1.1.1 Organische Stoffe = Verbindungen, die Kohlenstoffatome enthalten Ausnahme: Kohlenstoffoxide, Kohlensäure, Carbonate 1.1.2 Kohlenwasserstoffe
Kapitel 02: Erdgas und Erdöl
 Kapitel 02: Erdgas und Erdöl 1 Kapitel 02: Erdgas und Erdöl Kapitel 02: Erdgas und Erdöl 2 Inhalt Kapitel 02: Erdgas und Erdöl...1 Inhalt... 2 Einige Produkte aus Erdöl...3 Erdöl ist nicht gleich Erdöl...3
Kapitel 02: Erdgas und Erdöl 1 Kapitel 02: Erdgas und Erdöl Kapitel 02: Erdgas und Erdöl 2 Inhalt Kapitel 02: Erdgas und Erdöl...1 Inhalt... 2 Einige Produkte aus Erdöl...3 Erdöl ist nicht gleich Erdöl...3
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
,,Effizienzsteigerung bei der stofflichen Nutzung von Braunkohle - Etablierung einer Stoffveredelungskette''
 ,,Effizienzsteigerung bei der stofflichen Nutzung von Braunkohle - Etablierung einer Stoffveredelungskette'' Innovative Braunkohlen Integration in Mitteldeutschland (ibi) Martin Naundorf InfraLeuna GmbH
,,Effizienzsteigerung bei der stofflichen Nutzung von Braunkohle - Etablierung einer Stoffveredelungskette'' Innovative Braunkohlen Integration in Mitteldeutschland (ibi) Martin Naundorf InfraLeuna GmbH
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Alkane - eine vielseitige Stoffgruppe. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Alkane - eine vielseitige Stoffgruppe Das komplette Material finden Sie hier: School-Scout.de RAAbits Hauptschule 7 9 Naturwissenschaften
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Alkane - eine vielseitige Stoffgruppe Das komplette Material finden Sie hier: School-Scout.de RAAbits Hauptschule 7 9 Naturwissenschaften
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT. Abitur Januar/Februar Chemie (Grundkurs) Thema 1 Chemische Grundreaktionen
 KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur Januar/Februar 2003 Chemie (Grundkurs) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Thema 1 Chemische Grundreaktionen Thema 2 Alkanole Thema
KULTUSMINISTERIUM DES LANDES SACHSEN-ANHALT Abitur Januar/Februar 2003 Chemie (Grundkurs) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Thema 1 Chemische Grundreaktionen Thema 2 Alkanole Thema
Selbsteinschätzungstest zum Vorkurs Organische Chemie
 WS 15/16 1/16 Selbsteinschätzungstest zum Vorkurs rganische hemie Liebe Studierende! Der Vorkurs frischt Ihr Schulwissen auf, vermittelt aber NIT die späteren Studieninhalte. Die Inhalte des Vorkurses
WS 15/16 1/16 Selbsteinschätzungstest zum Vorkurs rganische hemie Liebe Studierende! Der Vorkurs frischt Ihr Schulwissen auf, vermittelt aber NIT die späteren Studieninhalte. Die Inhalte des Vorkurses
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Organische Chemie II. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )
![Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 ) Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )](/thumbs/74/69784240.jpg) 1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Fossile Rohstoffe. Kohlenwasserstoffe als Energieträger
 nwasserstoffe als Energieträger Erdöl,, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da sie
nwasserstoffe als Energieträger Erdöl,, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da sie
Inhaltsverzeichnis zu Kapitel 2. Alkane
 Inhaltsverzeichnis zu Kapitel 2. Alkane 2. Alkane 2.1. Valenzstrichformel, omologe Reihe, Nomenklatur, Konstitution, 22 Konformation 2.1.1. Valenzstrichformel 22 2.1.2. omologe Reihe 23 2.1.3. Konstitutionsisomere
Inhaltsverzeichnis zu Kapitel 2. Alkane 2. Alkane 2.1. Valenzstrichformel, omologe Reihe, Nomenklatur, Konstitution, 22 Konformation 2.1.1. Valenzstrichformel 22 2.1.2. omologe Reihe 23 2.1.3. Konstitutionsisomere
Grundwissen Chemie Jahrgangsstufe 10 (NTG)
 Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig
 26 sisomerie (Stereoisomerie I) Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig Isomerie II: sisomere: sisomere (bzw. Konformere) sind Isomere, die sich durch
26 sisomerie (Stereoisomerie I) Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig Isomerie II: sisomere: sisomere (bzw. Konformere) sind Isomere, die sich durch
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Nutzung von CO 2 in fossilen Energieumwandlungskreisläufen 13. Brandenburger Energietag. K. Büker Cottbus, 15. September 2011
 Nutzung von CO 2 in fossilen Energieumwandlungskreisläufen 13. Brandenburger Energietag K. Büker Cottbus, 15. September 2011 2 Mehr als 2.000 von Uhde gebaute Anlagen auf allen Kontinenten. Düngemittel
Nutzung von CO 2 in fossilen Energieumwandlungskreisläufen 13. Brandenburger Energietag K. Büker Cottbus, 15. September 2011 2 Mehr als 2.000 von Uhde gebaute Anlagen auf allen Kontinenten. Düngemittel
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten Eine Gruppe mischt Spiritus mit Wasser. Füllt dazu zunächst zwei Messzylinder mit je exakt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten Eine Gruppe mischt Spiritus mit Wasser. Füllt dazu zunächst zwei Messzylinder mit je exakt
