16. Januar 2015 Wichtige Informationen für medizinisches Fachpersonal
|
|
|
- Lucas Arthur Beyer
- vor 5 Jahren
- Abrufe
Transkript
1 16. Januar 2015 Wichtige Informationen für medizinisches Fachpersonal zur Markteinführung von Vibativ (Telavancin): Anwendungsempfehlungen und bedeutende Risiken (Nephrotoxizität, QTc-Verlängerung, Reproduktionstoxizität und Verwendung außerhalb der zugelassenen Anwendung) Sehr geehrte Damen und Herren, Mit diesem Schreiben sollen Ihnen die wichtigen Sicherheitsbedenken in Zusammenhang mit der Anwendung von Vibativ und der Umgang mit diesen mitgeteilt werden, um so das Risiko für den Patienten zu minimieren. Clinigen stellt diese Informationen aufgrund einer Anforderung der Europäischen Arzneimittel-Agentur zur Verfügung. Dieses Schreiben ist ein obligatorischer Bestandteil der Arzneimittelzulassung. Zusammenfassung: Telavancin ist ein neuer antibiotischer Wirkstoff, der in der Europäischen Union zur Behandlung von nosokomialer Pneumonie (einschließlich beatmungsassoziierter Pneumonie), die bekanntlich oder vermutlich durch Methicillin-resistenten Staphylococcus aureus (MRSA) verursacht wird, zugelassen ist, wenn alternative Behandlungen ungeeignet sind oder fehlgeschlagen haben. Das Nutzen-Risiko-Verhältnis von Telavancin bei der Behandlung von komplizierten Haut- und Weichgewebeinfektionen wurde vom Ausschuss für Humanarzneimittel (CHMP), dem EU-Komitee, das wissenschaftliche Gutachten für Zulassungsanträge von Arzneimitteln erstellt, negativ bewertet. Daher soll Televancin bei dieser und anderen nicht zugelassenen Indikationen nicht angewendet werden. In klinischen Studien hatten Patienten mit einem bereits bestehenden akuten Nierenversagen, die Telavancin erhielten, ein erhöhtes Mortalitätsrisiko im Vergleich zu den Patienten, die Vancomycin erhielten. Die Anwendung von Telavancin ist daher bei Patienten mit schwerer Niereninsuffizienz (Kreatinin-Clearance < 30 ml/min, einschließlich hämodialysepflichtiger Patienten) kontraindiziert. Bei allen Patienten, die mit Telavancin behandelt werden, sollte die Nierenfunktion zumindest während der ersten 3 bis 5 Tage der Therapie täglich und danach alle 48 bis 72 Stunden überprüft werden.
2 Eine QTc-Verlängerung wurde in klinischen Studien beobachtet. Vorsicht ist geboten bei der Anwendung von Telavancin zusammen mit anderen Arzneimitteln, die das QTc-Intervall verlängern, und bei Patienten, bei denen ein hohes Risiko einer QTc-Verlängerung besteht. Die Anwendung von Telavancin während der Schwangerschaft ist kontraindiziert. Es liegen keine Daten zur Anwendung von Telavancin bei Schwangeren vor. In tierexperimentellen Studien wurden reproduktionstoxische Effekte (einschließlich teratogener Effekte) gesehen. Daher muss vor der Verabreichung von Vibativ an Frauen im gebärfähigen Alter der ein negativer Schwangerschaftsstatus festgestellt und dokumentiert werden. Weitere Informationen zu korrekter Anwendung, Sicherheitsbedenken und Empfehlungen Zur Minimierung der klinisch bedeutenden Risiken, die mit der Anwendung von Telavancin assoziiert sind und von denen die wichtigsten im Folgenden aufgeführt sind, wurde in Abstimmung mit dem Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur (EMA) und dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) ein Leitfaden für medizinisches Fachpersonal etabliert, der in elektronischem Format öffentlich zugänglich ist unter: Telavancin ist eine neues Lipoglykopeptid-Antibiotikum, das als eine intravenöse Infusion verabreicht wird und zur Behandlung von Erwachsenen mit nosokomialer Pneumonie (NP), einschließlich beatmungsassoziierter Pneumonie, die nachweislich oder vermutlich durch Methicillin-resistenten Staphylococcus aureus (MRSA) verursacht wird, indiziert ist. In zwei randomisierten, kontrollierten Studien bei Patienten mit nosokomialer Pneumonie (NP), einschließlich beatmungsassoziierter Pneumonie, konnte die Wirksamkeit von Telavancin gegenüber Methicillin-empfindlichen Staphylococcus aureus (MSSA) und MRSA gezeigt werden. Nephrotoxizität In klinischen Studien hatten Patienten mit einem bereits bestehenden akuten Nierenversagen, die Telavancin erhielten, ein erhöhtes Mortalitätsrisiko im Vergleich zu den Patienten, die Vancomycin erhielten. Die Gesamtsterblichkeit betrug 32/73 (44 %) in der Telavancin-Gruppe und 16/64 (25 %) in der Vancomycin-Gruppe. Bei Patienten ohne ein akutes Nierenversagen bei Therapiebeginn lag die Gesamtsterblichkeit bei 118/687 (17 %) bzw. 124/688 (18 %). Die Anwendung von Telavancin ist daher kontraindiziert bei Patienten mit einem bereits bestehenden akuten Nierenversagen und bei Patienten mit schwerer Niereninsuffizienz (Kreatinin-Clearance <30 ml/min, einschließlich hämodialysepflichtiger Patienten).
3 In den zusammengefasst ausgewerteten klinischen Studien (nosokomiale Pneumonie und komplizierte Haut- und Weichgewebeinfektionen) wurden renale Nebenwirkungen im Vergleich zu Vancomycin häufiger bei Patienten beobachtet, die Vibativ erhielten (entsprechend 3,8 % vs. 2,2 %). Bei allen Patienten, die mit Telavancin behandelt werden, sollte die Nierenfunktion (Serum- Kreatinin und die Urinmenge zur Erfassung von Oligurie/Anurie) zumindest während der ersten 3 bis 5 Tage der Therapie täglich und danach alle 48 bis 72 Stunden überprüft werden. Die Anfangsdosis und Dosisanpassungen während der Therapie sollten basierend auf den errechneten oder gemessenen Werten für die Kreatinin-Clearance gemäß dem Dosierungsschema in Abschnitt 4.2 der Zusammenfassung der Merkmale des Arzneimittels gewählt werden. Wenn die Nierenfunktion während der Therapie merklich abfällt, sollte der Nutzen einer Fortsetzung der Telavancin-Therapie überprüft werden. Vorsicht ist geboten bei der Anwendung von Telavancin bei Patienten, die nephrotoxische Begleitmedikamente erhalten, solchen mit einer bereits bestehenden Nierenerkrankung oder mit Begleiterkrankungen, die bekanntermaßen prädisponierend für Nierenfunktionsstörungen sind (z. B. Diabetes mellitus, kongestive Herzinsuffizienz, Bluthochdruck). Wenn die Nierenfunktion beeinträchtigt wird, sind die vorstehend dargelegten Maßnahmen zu ergreifen. QTc-Verlängerung In einer klinischen QT-Studie zeigte Telavancin eine mittlere Erhöhung des QTcF um 4,1 bzw. 4,5 ms gegenüber dem Therapiebeginn bei Dosen von 7,5 bzw. 15 mg/kg. Vorsicht ist geboten bei der Anwendung von Telavancin bei Patienten, die Arzneimittel einnehmen, die bekanntermaßen das QT- Intervall verlängern, und bei Patienten mit angeborenem verlängertem QT-Syndrom, einer nachgewiesenen Verlängerung des QTc-Intervalls, einer dekompensierten Herzinsuffizienz oder einer schweren Linksherzhypertrophie. Die Angehörigen der Heilberufe sollten auf alle möglichen Symptome einer Arrhythmia achten, z. B. Ohnmacht, Herzrasen, Kurzatmigkeit oder Brustschmerzen. Wenn Symptome auftreten, muss die Therapie mit Telavancin abgebrochen werden und es müssen die Symptome untersucht werden. Reproduktionstoxizität Telavancin ist während der Schwangerschaft kontraindiziert. Es liegen keine Daten zur Anwendung von Telavancin bei Schwangeren vor. In tierexperimentellen Studien wurden reproduktionstoxische Effekte, einschließlich teratogener Effekte, gesehen. Vor der Behandlung mit Telavancin muss bei Frauen im gebärfähigen Alter ein Schwangerschaftstest durchgeführt werden. Zur Dokumentation ist jeder Flasche ein Checklisten-Aufkleber beigefügt, der vor der Verabreichung von Telavancin ausgefüllt und in die Patientenakte geklebt werden soll. Wenn es aus klinischer Sicht angebracht ist, müssen Frauen im gebärfähigen Alter darauf hingewiesen werden, während der Behandlung eine zuverlässige Verhütungsmethode anzuwenden. Es ist ein Schwangerschaftsregister eingerichtet, in dem die Ergebnisse der
4 Schwangerschaften von Frauen, die während ihrer Schwangerschaft unbeabsichtigt Telavancin ausgesetzt wurden, überwacht werden. Die Informationen können telefonisch unter +44 (0) oder per an abgerufen werden. Eine Webseite zu diesem Register ist derzeit im Aufbau. Meldung von Verdachtsfällen von Nebenwirkungen Vermutete Nebenwirkungen sollten Clinigen per Fax unter +44 (0) oder per an sowie der lokalen Aufsichtsbehörde mitgeteilt werden: Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D Bonn Website: Weitere Informationen über Vibativ stehen in Form der genehmigten Produktinformation auf der Website der EMA ( zur Verfügung. Mit freundlichen Grüßen Professor Alan Boyd BSc MB ChB FFPM Chief Medical Officer Clinigen Group plc
5
(Telavancin) Leitfaden für medizinisches Fachpersonal. 16. Januar 2015
 VIBATIV (Telavancin) Leitfaden für medizinisches Fachpersonal 16. Januar 2015 Dieser Leitfaden zur Anwendung von Telavancin wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen des Risikomanagement-Plans
VIBATIV (Telavancin) Leitfaden für medizinisches Fachpersonal 16. Januar 2015 Dieser Leitfaden zur Anwendung von Telavancin wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen des Risikomanagement-Plans
Anwendung von Tenofovirdisoproxil und Emtricitabin/Tenofovirdisoproxil bei Jugendlichen
 HINWEISE FÜR ANGEHÖRIGE DER HEILBERUFE ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL UND TENOFOVIRDISOPROXIL-HALTIGEN ARZNEIMITTELN ZUR BEHANDLUNG HIV-1-INFIZIERTER JUGENDLICHER Diese Informationsbroschüre zur
HINWEISE FÜR ANGEHÖRIGE DER HEILBERUFE ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL UND TENOFOVIRDISOPROXIL-HALTIGEN ARZNEIMITTELN ZUR BEHANDLUNG HIV-1-INFIZIERTER JUGENDLICHER Diese Informationsbroschüre zur
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN. Information über die Risiken für das ungeborene Baby
 MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
PATIENTEN- INFORMATIONSKARTE
 PATIENTEN- INFORMATIONSKARTE Diese Patienteninformationskarte ist ein verpflichtender Teil der Zulassung, um sicherzustellen, dass Angehörige der Heilberufe, sowie Patienten die besonderen Sicherheitsanforder
PATIENTEN- INFORMATIONSKARTE Diese Patienteninformationskarte ist ein verpflichtender Teil der Zulassung, um sicherzustellen, dass Angehörige der Heilberufe, sowie Patienten die besonderen Sicherheitsanforder
HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN
 HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN Dieses Informationsmaterial zur Anwendung von Tenofovirdisoproxil wurde als Teil der Zulassungsauflagen
HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN Dieses Informationsmaterial zur Anwendung von Tenofovirdisoproxil wurde als Teil der Zulassungsauflagen
Informationsbroschüre zu HBV bei Patienten mit eingeschränkter Nierenfunktion mit Kreatinin-Clearance-Rechner
 Wichtig: Informationsbroschüre zu HBV bei Patienten mit eingeschränkter Nierenfunktion mit Kreatinin- Kontrollieren Sie bei allen Patienten vor Beginn der Behandlung mit die Kreatinin-Clearance. Während
Wichtig: Informationsbroschüre zu HBV bei Patienten mit eingeschränkter Nierenfunktion mit Kreatinin- Kontrollieren Sie bei allen Patienten vor Beginn der Behandlung mit die Kreatinin-Clearance. Während
Direkte Mitteilung an Angehörige der Heilberufe
 81829 München München, August 2013 Direkte Mitteilung an Angehörige der Heilberufe Wir möchten Sie über wichtige Aspekte der klinischen Anwendung von Imnovid (Pomalidomid) informieren, das nun in Kombination
81829 München München, August 2013 Direkte Mitteilung an Angehörige der Heilberufe Wir möchten Sie über wichtige Aspekte der klinischen Anwendung von Imnovid (Pomalidomid) informieren, das nun in Kombination
Bundesinstitut für Arzneimittel und Medizinprodukte
 Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn pharmazeutische Unternehmer (s. Verteiler) Postanschrift: Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn http://www.bfarm.de
Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn pharmazeutische Unternehmer (s. Verteiler) Postanschrift: Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn http://www.bfarm.de
WICHTIGE SICHERHEITSHINWEISE
 WICHTIGE SICHERHEITSHINWEISE Für Verordner von Truvada zur Prä-Expositions-Prophylaxe (PrEP) Dieses Informationsmaterial zur Anwendung von Truvada zur Prä-Expositions-Prophylaxe (PrEP) wurde als Teil der
WICHTIGE SICHERHEITSHINWEISE Für Verordner von Truvada zur Prä-Expositions-Prophylaxe (PrEP) Dieses Informationsmaterial zur Anwendung von Truvada zur Prä-Expositions-Prophylaxe (PrEP) wurde als Teil der
Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern
 Mycophenolat (z.b. CellCept ) Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern Bonn (26. Oktober 2015) - Die Europäische Arzneimittel Agentur (EMA) warnt, dass der in der
Mycophenolat (z.b. CellCept ) Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern Bonn (26. Oktober 2015) - Die Europäische Arzneimittel Agentur (EMA) warnt, dass der in der
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen
 Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Sicherheitsrelevante Hinweise für medizinische Fachkreise
 Sicherheitsrelevante Hinweise für medizinische Fachkreise für die Therapie des multiplen Myeloms mit Bortezomib in Abhängigkeit von den unterschiedlichen Indikationen im Rahmen der Indikationserweiterung
Sicherheitsrelevante Hinweise für medizinische Fachkreise für die Therapie des multiplen Myeloms mit Bortezomib in Abhängigkeit von den unterschiedlichen Indikationen im Rahmen der Indikationserweiterung
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION
 ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
Wichtige Mitteilung über ein Arzneimittel
 Zulassungsinhaber Mitsubishi Tanabe Pharma Europe Ltd. Dashwood House 69 Old Broad Street London EC2M 1QS Vereinigtes Königreich Wichtige Mitteilung über ein Arzneimittel 06.08.2018 Argatroban 1 mg/ml
Zulassungsinhaber Mitsubishi Tanabe Pharma Europe Ltd. Dashwood House 69 Old Broad Street London EC2M 1QS Vereinigtes Königreich Wichtige Mitteilung über ein Arzneimittel 06.08.2018 Argatroban 1 mg/ml
WICHTIGE SICHERHEITSHINWEISE
 WICHTIGE SICHERHEITSHINWEISE Für Verordner von Truvada (Emtricitabin/Tenofovirdisoproxilfumarat) zur Prä-Expositions-Prophylaxe (PrEP) Dieses Informationsmaterial zur Anwendung von Truvada zur Prä-Expositions-Prophylaxe
WICHTIGE SICHERHEITSHINWEISE Für Verordner von Truvada (Emtricitabin/Tenofovirdisoproxilfumarat) zur Prä-Expositions-Prophylaxe (PrEP) Dieses Informationsmaterial zur Anwendung von Truvada zur Prä-Expositions-Prophylaxe
HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE
 HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE ERWINASE 10.000 I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung BEI DER ANWENDUNG DER CHARGEN 174aG116 UND 177aG116 IST
HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE ERWINASE 10.000 I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung BEI DER ANWENDUNG DER CHARGEN 174aG116 UND 177aG116 IST
MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE
 MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln
MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln
Medikationsleitfaden für Patienten
 Mitoxantron Mitoxantron Medikationsleitfaden für Patienten Wichtige obligatorische Informationen zur Risikominimierung für Patienten, die eine Therapie mit RALENOVA /NOVANTRON (Wirkstoff: Mitoxantron)
Mitoxantron Mitoxantron Medikationsleitfaden für Patienten Wichtige obligatorische Informationen zur Risikominimierung für Patienten, die eine Therapie mit RALENOVA /NOVANTRON (Wirkstoff: Mitoxantron)
Wichtige Arzneimittelinformation
 05. Oktober 2018 Wichtige Arzneimittelinformation OZURDEX 700 Mikrogramm intravitreales Implantat (Dexamethason): Silikonpartikel während einer Fertigungskontrolle auf Implantat identifiziert Sehr geehrte
05. Oktober 2018 Wichtige Arzneimittelinformation OZURDEX 700 Mikrogramm intravitreales Implantat (Dexamethason): Silikonpartikel während einer Fertigungskontrolle auf Implantat identifiziert Sehr geehrte
nachrichtlich: Stufenplanbeteiligte, Zul mit DE= CMS
 - 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn pharmazeutische Unternehmer mit DE=RMS, nat. Zul, Parallelimp nachrichtlich: Stufenplanbeteiligte,
- 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn pharmazeutische Unternehmer mit DE=RMS, nat. Zul, Parallelimp nachrichtlich: Stufenplanbeteiligte,
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm
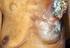 Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
ANHANG III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine
 'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende
'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende
Stufenplanbeteiligte. Citalopram, Escitalopram, Fluoxetin, Fluvoxamin, Paroxetin, Sertralin
 - 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn pharmazeutische Unternehmer Unachrichtlich: Stufenplanbeteiligte Postanschrift: Kurt-Georg-Kiesinger-Allee
- 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn pharmazeutische Unternehmer Unachrichtlich: Stufenplanbeteiligte Postanschrift: Kurt-Georg-Kiesinger-Allee
Kombinierte hormonale Kontrazeptiva Dienogest/Ethinylestradiol: Informationen über ein leicht erhöhtes Risiko für venöse Thromboembolien (VTE) bei
 Jena, Dezember 2018 Kombinierte hormonale Kontrazeptiva Dienogest/Ethinylestradiol: Informationen über ein leicht erhöhtes Risiko für venöse Thromboembolien (VTE) bei Frauen, die Dienogest/Ethinylestradiol
Jena, Dezember 2018 Kombinierte hormonale Kontrazeptiva Dienogest/Ethinylestradiol: Informationen über ein leicht erhöhtes Risiko für venöse Thromboembolien (VTE) bei Frauen, die Dienogest/Ethinylestradiol
Aliskiren-haltige Arzneimittel sind jetzt in Kombination mit ACE-Hemmern oder Angiotensin-Rezeptor-Blockern (ARB) kontraindiziert bei Patienten mit:
 GmbH Novartis Pharma Postfachadresse 90327 Nürnberg Tel 0911/273-0 Fax 0911/273-12653 www.novartis.de 27. Februar 2012 Wichtige Informationen zu neuen Gegenanzeigen und Warnhinweisen bei der Anwendung
GmbH Novartis Pharma Postfachadresse 90327 Nürnberg Tel 0911/273-0 Fax 0911/273-12653 www.novartis.de 27. Februar 2012 Wichtige Informationen zu neuen Gegenanzeigen und Warnhinweisen bei der Anwendung
Wortlaut der für die Packungsbeilage vorgesehenen Angaben
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für Anwender Hylan 0,015%, Augentropfen Wirkstoff: Natriumhyaluronat (biotechnologisch hergestellt mit Hilfe
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für Anwender Hylan 0,015%, Augentropfen Wirkstoff: Natriumhyaluronat (biotechnologisch hergestellt mit Hilfe
Gebrauchsinformation: Information für Anwender. Zur Anwendung bei Säuglingen und Kleinkindern
 Gebrauchsinformation: Information für Anwender Peditrace, Infusionslösungskonzentrat Zur Anwendung bei Säuglingen und Kleinkindern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für Anwender Peditrace, Infusionslösungskonzentrat Zur Anwendung bei Säuglingen und Kleinkindern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Wirkstoff: Eschenrinde-Auszug, Zitterpappelrinde und -blätter-auszug, Goldrutenkraut-Auszug Pflanzliches Arzneimittel Zur Anwendung bei Erwachsenen
 Gebrauchsinformation: Bitte aufmerksam lesen! Wirkstoff: Eschenrinde-Auszug, Zitterpappelrinde und -blätter-auszug, Goldrutenkraut-Auszug Pflanzliches Arzneimittel Zur Anwendung bei Erwachsenen Was in
Gebrauchsinformation: Bitte aufmerksam lesen! Wirkstoff: Eschenrinde-Auszug, Zitterpappelrinde und -blätter-auszug, Goldrutenkraut-Auszug Pflanzliches Arzneimittel Zur Anwendung bei Erwachsenen Was in
Neue Einschränkungen zur Minimierung der Risiken für Auswirkungen auf den Herzrhythmus bei Hydroxyzin enthaltenden Arzneimitteln
 Freitag, 27. März 2015 EMA/149624/2015 Neue Einschränkungen zur Minimierung der Risiken für Auswirkungen auf den Herzrhythmus bei Hydroxyzin enthaltenden Arzneimitteln Die Anwendung ist bei Patienten mit
Freitag, 27. März 2015 EMA/149624/2015 Neue Einschränkungen zur Minimierung der Risiken für Auswirkungen auf den Herzrhythmus bei Hydroxyzin enthaltenden Arzneimitteln Die Anwendung ist bei Patienten mit
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN
 MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
LEITFADEN FÜR PATIENTINNEN
 LEITFADEN FÜR PATIENTINNEN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
LEITFADEN FÜR PATIENTINNEN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
WICHTIGE SICHERHEITSHINWEISE
 WICHTIGE SICHERHEITSHINWEISE Für Verordner von Emtricitabin/Tenofovir disoproxil Accord zur Prä-Expositions- Prophylaxe (PrEP) Dieses Informationsmaterial zur Anwendung von Emtricitabin/Tenofovir disoproxil
WICHTIGE SICHERHEITSHINWEISE Für Verordner von Emtricitabin/Tenofovir disoproxil Accord zur Prä-Expositions- Prophylaxe (PrEP) Dieses Informationsmaterial zur Anwendung von Emtricitabin/Tenofovir disoproxil
Bezeichnung des Arzneimittels: Vom Pharmazeutischen Unternehmer auszufüllen Pharmazeutischen Unternehmer:
 Fragebogen für Angehörige der Gesundheitsberufe zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln (z. B. CellCept, Myfortic und andere Arzneimittelnamen) während einer Schwangerschaft
Fragebogen für Angehörige der Gesundheitsberufe zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln (z. B. CellCept, Myfortic und andere Arzneimittelnamen) während einer Schwangerschaft
AKTUELLE BROSCHÜRE ZU FRAGEN & ANTWORTEN FÜR MEDIZINISCHES FACHPERSONAL. VORICONAZOL-haltige Arzneimittel oral/intravenös
 AKTUELLE BROSCHÜRE ZU FRAGEN & ANTWORTEN FÜR MEDIZINISCHES FACHPERSONAL VORICONAZOL-haltige Arzneimittel oral/intravenös Diese Informationsbroschüre zur Anwendung von VORICONAZOL-haltigen Arzneimitteln
AKTUELLE BROSCHÜRE ZU FRAGEN & ANTWORTEN FÜR MEDIZINISCHES FACHPERSONAL VORICONAZOL-haltige Arzneimittel oral/intravenös Diese Informationsbroschüre zur Anwendung von VORICONAZOL-haltigen Arzneimitteln
Wortlaut der für die Packungsbeilage vorgesehenen Angaben
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender POTABA-GLENWOOD Pulver 3 g Wirkstoff: Kalium-4-aminobenzoat Lesen Sie die gesamte Packungsbeilage
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender POTABA-GLENWOOD Pulver 3 g Wirkstoff: Kalium-4-aminobenzoat Lesen Sie die gesamte Packungsbeilage
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP)
 INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP) Wichtige Informationen zu Truvada (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko einer Infektion mit dem
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP) Wichtige Informationen zu Truvada (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko einer Infektion mit dem
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE
 MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Teratogenes Risiko Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln wurde als Teil der Zulassungsauflagen
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Teratogenes Risiko Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln wurde als Teil der Zulassungsauflagen
Zu den wichtigsten Nebenwirkungen gehören schwere Nierenfunktionsstörungen und Kieferosteonekrosen.
 Zoledronsäure AL (Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte Dieser Leitfaden für Ärzte zur Anwendung von Zoledronsäure 5 mg wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen
Zoledronsäure AL (Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte Dieser Leitfaden für Ärzte zur Anwendung von Zoledronsäure 5 mg wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 13 Wissenschaftliche Schlussfolgerungen Haldol, das den Wirkstoff Haloperidol enthält, ist ein Antipsychotikum aus der Gruppe der Butyrophenone. Es handelt
Anhang II Wissenschaftliche Schlussfolgerungen 13 Wissenschaftliche Schlussfolgerungen Haldol, das den Wirkstoff Haloperidol enthält, ist ein Antipsychotikum aus der Gruppe der Butyrophenone. Es handelt
MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko
 MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln
MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln
Mycophenolat SANDOZ. Mycophenolathaltige Arzneimittel. Leitfaden für Angehörige der Gesundheitsberufe
 Mycophenolat SANDOZ Mycophenolathaltige Arzneimittel Leitfaden für Angehörige der Gesundheitsberufe 1 Teratogenes Risiko Dieser Leitfaden zur Anwendung von mycophenolathaltigen Arzneimitteln wurde als
Mycophenolat SANDOZ Mycophenolathaltige Arzneimittel Leitfaden für Angehörige der Gesundheitsberufe 1 Teratogenes Risiko Dieser Leitfaden zur Anwendung von mycophenolathaltigen Arzneimitteln wurde als
Wortlaut der für die Packungsbeilage vorgesehenen Angaben. Gebrauchsinformation: Information für den Anwender. POTABA-GLENWOOD Kapseln 500 mg
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender POTABA-GLENWOOD Kapseln 500 mg Wirkstoff: Kalium-4-aminobenzoat Lesen Sie die gesamte Packungsbeilage
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender POTABA-GLENWOOD Kapseln 500 mg Wirkstoff: Kalium-4-aminobenzoat Lesen Sie die gesamte Packungsbeilage
Gelenk Albin, 50 ml Mischung
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Gelenk Albin, 50 ml Mischung Wirkstoffe: Colchicum Dil. D3, Actaea Dil. D3, Spiraea ulmaria Urtinktur, Bryonia Dil. D3, Ruta Dil. D1 Lesen Sie bitte die
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Gelenk Albin, 50 ml Mischung Wirkstoffe: Colchicum Dil. D3, Actaea Dil. D3, Spiraea ulmaria Urtinktur, Bryonia Dil. D3, Ruta Dil. D1 Lesen Sie bitte die
Gebrauchsinformation: Information für Anwender
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für Anwender AKNICHTHOL 1% Emulsion zur Anwendung auf der Haut (Lotio) Wirkstoff: Natriumbituminosulfonat (ICHTHYOL
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für Anwender AKNICHTHOL 1% Emulsion zur Anwendung auf der Haut (Lotio) Wirkstoff: Natriumbituminosulfonat (ICHTHYOL
Ringer-Lösung DAB 7 Infusionslösung
 Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Ringer-Lösung DAB 7 Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist Ringer-Lösung DAB 7
Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Ringer-Lösung DAB 7 Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist Ringer-Lösung DAB 7
1. Was ist octenisept Vaginaltherapeutikum und wofür wird es angewendet?
 Gebrauchsinformation: Information für den Anwender OCTENISEPT VAGINALTHERAPEUTIKUM Lösung zum Einsprühen in die Vagina mit Vaginalapplikator 0.1 g Octenidindihydrochlorid 2.0 g Phenoxyethanol (Ph.Eur.)/100
Gebrauchsinformation: Information für den Anwender OCTENISEPT VAGINALTHERAPEUTIKUM Lösung zum Einsprühen in die Vagina mit Vaginalapplikator 0.1 g Octenidindihydrochlorid 2.0 g Phenoxyethanol (Ph.Eur.)/100
Fachinformation. Sonstige Bestandteile mit bekannter Wirkung:Enthält u.a. Macrogolglycerolhydroxystearat und Ethanol.
 Fachinformation 1. Bezeichnung des Arzneimittels Thymian Hustenlösung Flüssigkeit zum Einnehmen 2. Qualitative und quantitative Zusammensetzung 100 ml (entsprechend 97 g) Flüssigkeit enthalten: Wirkstoff:
Fachinformation 1. Bezeichnung des Arzneimittels Thymian Hustenlösung Flüssigkeit zum Einnehmen 2. Qualitative und quantitative Zusammensetzung 100 ml (entsprechend 97 g) Flüssigkeit enthalten: Wirkstoff:
VORICONAZOL-haltige Arzneimittel: Checkliste für medizinisches Fachpersonal
 VORICONAZOL-haltige Arzneimittel: Checkliste für medizinisches Fachpersonal Bitte füllen Sie diese Checkliste bei jedem Besuch Ihres Patienten, der mit VORICONAZOL-haltigen Arzneimitteln behandelt wird,
VORICONAZOL-haltige Arzneimittel: Checkliste für medizinisches Fachpersonal Bitte füllen Sie diese Checkliste bei jedem Besuch Ihres Patienten, der mit VORICONAZOL-haltigen Arzneimitteln behandelt wird,
LEITFADEN FÜR PATIENTINNENN
 LEITFADEN FÜR PATIENTINNENN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
LEITFADEN FÜR PATIENTINNENN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS VIBATIV 250 mg Pulver zur Herstellung eines Konzentrats zur Herstellung einer Infusionslösung 2. QUALITATIVE UND
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS VIBATIV 250 mg Pulver zur Herstellung eines Konzentrats zur Herstellung einer Infusionslösung 2. QUALITATIVE UND
Silicea D3 Biochemisches Funktionsmittel Nr. 11
 Registriertes homöopathisches Arzneimittel, daher ohne Angabe einer therapeutischen Indikation. Gebrauchsinformation: Information für den Anwender Silicea D3 Biochemisches Funktionsmittel Nr. 11 Tabletten
Registriertes homöopathisches Arzneimittel, daher ohne Angabe einer therapeutischen Indikation. Gebrauchsinformation: Information für den Anwender Silicea D3 Biochemisches Funktionsmittel Nr. 11 Tabletten
Fachinformation 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Echinacin Salbe Madaus 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: 100 g Salbe enthalten: Presssaft aus frischem blühendem Purpursonnenhutkraut
Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Echinacin Salbe Madaus 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: 100 g Salbe enthalten: Presssaft aus frischem blühendem Purpursonnenhutkraut
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
 Gebrauchsinformation: Information für den Anwender Gargarisma zum Gurgeln 9,6 g/100 ml Lösung Wirkstoff: Aluminiumchlorid-Hexahydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält
Gebrauchsinformation: Information für den Anwender Gargarisma zum Gurgeln 9,6 g/100 ml Lösung Wirkstoff: Aluminiumchlorid-Hexahydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält
Wichtige Informationen zur Assoziation von Sprycel (Dasatinib) mit pulmonaler arterieller Hypertonie (PAH)
 2. August 2011 Wichtige Informationen zur Assoziation von Sprycel (Dasatinib) mit pulmonaler arterieller Hypertonie (PAH) Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, sehr geehrte Frau Apothekerin,
2. August 2011 Wichtige Informationen zur Assoziation von Sprycel (Dasatinib) mit pulmonaler arterieller Hypertonie (PAH) Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, sehr geehrte Frau Apothekerin,
Homöopathisches Arzneimittel bei Erkrankungen des Bewegungsapparates Tabletten zum Einnehmen
 Gebrauchsinformation: Information für Patienten Rheumagil Homöopathisches Arzneimittel bei Erkrankungen des Bewegungsapparates Tabletten zum Einnehmen Wirkstoffe: Causticum Hahnemanni Trit. D6, Ferrum
Gebrauchsinformation: Information für Patienten Rheumagil Homöopathisches Arzneimittel bei Erkrankungen des Bewegungsapparates Tabletten zum Einnehmen Wirkstoffe: Causticum Hahnemanni Trit. D6, Ferrum
: Schulungsmaterial (Educational Material) für medizinisches Fachpersonal
 Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 10 Wissenschaftliche Schlussfolgerungen Solu-Medrol 40 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung (im Folgenden Solu-Medrol genannt)
Anhang II Wissenschaftliche Schlussfolgerungen 10 Wissenschaftliche Schlussfolgerungen Solu-Medrol 40 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung (im Folgenden Solu-Medrol genannt)
(Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte
 Clastizol (Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte Dieser Leitfaden für Ärzte zur Anwendung von Zoledronsäure 5 mg wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen des Risikomanagement-Plans
Clastizol (Zoledronsäure 5 mg/100 ml Infusionslösung) Leitfaden für Ärzte Dieser Leitfaden für Ärzte zur Anwendung von Zoledronsäure 5 mg wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen des Risikomanagement-Plans
Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Kytril und zugehörige Bezeichnungen (siehe Anhang I)
 ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS, DER ETIKETTIERUNG UND DER PACKUNGSBEILAGE
ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS, DER ETIKETTIERUNG UND DER PACKUNGSBEILAGE
Wichtige Information zur Risikominimierung bei der Anwendung von Hydroxyethylstärke-haltigen Infusionslösungen. Schulung
 Pflicht-Schulung Wichtige Information zur Risikominimierung bei der Anwendung von Hydroxyethylstärke-haltigen Infusionslösungen Schulung Anwendung von Hydroxyethylstärke-Lösungen in Übereinstimmung mit
Pflicht-Schulung Wichtige Information zur Risikominimierung bei der Anwendung von Hydroxyethylstärke-haltigen Infusionslösungen Schulung Anwendung von Hydroxyethylstärke-Lösungen in Übereinstimmung mit
Wichtige Informationen für medizinische Fachkräfte über die ernsten Risiken im Zusammenhang mit CAPRELSA -Tabletten
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
GEBRAUCHSINFORMATION: Information für den Anwender. Ringer-Lösung DELTAMEDICA Infusionslösung
 GEBRAUCHSINFORMATION: Information für den Anwender Ringer-Lösung DELTAMEDICA Infusionslösung Wirkstoffe: Natriumchlorid, Kaliumchlorid, Calciumchlorid 2 H 2O Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: Information für den Anwender Ringer-Lösung DELTAMEDICA Infusionslösung Wirkstoffe: Natriumchlorid, Kaliumchlorid, Calciumchlorid 2 H 2O Lesen Sie die gesamte Packungsbeilage sorgfältig
Stillzeit Es ist nicht bekannt, ob Bosentan in die Muttermilch übergeht. Stillen wird während einer Behandlung mit Bosentan nicht empfohlen.
 Bosentan 62,5 mg oder 125 mg, Filmtabletten Information für Verordner Dieses Informationsmaterial zu Bosentan wurde als Teil der Zulassungsauflagen erstellt und durch das BUNDESINSTITUT FÜR ARZNEIMITTEL
Bosentan 62,5 mg oder 125 mg, Filmtabletten Information für Verordner Dieses Informationsmaterial zu Bosentan wurde als Teil der Zulassungsauflagen erstellt und durch das BUNDESINSTITUT FÜR ARZNEIMITTEL
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender Hylak plus acidophilus Flüssigkeit zum Einnehmen Zur Anwendung bei Kindern und Erwachsenen. Wirkstoff: Substrat der Stoffwechselprodukte von Lactobacillus
Gebrauchsinformation: Information für den Anwender Hylak plus acidophilus Flüssigkeit zum Einnehmen Zur Anwendung bei Kindern und Erwachsenen. Wirkstoff: Substrat der Stoffwechselprodukte von Lactobacillus
Wortlaut der für die Packungsbeilage vorgesehenen Angaben
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender GRANU FINK BLASE Wirkstoffe: 1 Hartkapsel enthält: Kürbissamen, zerkleinert 400 mg Kürbissamenöl
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender GRANU FINK BLASE Wirkstoffe: 1 Hartkapsel enthält: Kürbissamen, zerkleinert 400 mg Kürbissamenöl
Wortlaut der für die Packungsbeilage vorgesehenen Angaben. Gebrauchsinformation: Information für Patienten. POTABA-GLENWOOD Kapseln 500 mg
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für Patienten POTABA-GLENWOOD Kapseln 500 mg Wirkstoff: Kalium-4-aminobenzoat Lesen Sie die gesamte Packungsbeilage
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für Patienten POTABA-GLENWOOD Kapseln 500 mg Wirkstoff: Kalium-4-aminobenzoat Lesen Sie die gesamte Packungsbeilage
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.10.2017 Ing. Veronika Iro, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.10.2017 Ing. Veronika Iro, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
/ November 2008
 - 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Zweites Deutsches Fernsehen Redaktion Frontal 21 Unter den Linden 36-38 10117 Berlin Postanschrift:
- 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Zweites Deutsches Fernsehen Redaktion Frontal 21 Unter den Linden 36-38 10117 Berlin Postanschrift:
Rivanol Lösung 0,1 % Ethacridinlactat-Monohydrat. Zul.-Nr ml/300 ml/500 ml/1000 ml Lösung. Zur Anwendung auf der Haut
 Booklet-ET, Seite 1 von 5 Rivanol Lösung 0,1 % Ethacridinlactat-Monohydrat Zul.-Nr. 6499.97.97 100 ml/300 ml/500 ml/1000 ml Lösung Zur Anwendung auf der Haut Antiseptikum zur lokalen Anwendung 1 ml Lösung
Booklet-ET, Seite 1 von 5 Rivanol Lösung 0,1 % Ethacridinlactat-Monohydrat Zul.-Nr. 6499.97.97 100 ml/300 ml/500 ml/1000 ml Lösung Zur Anwendung auf der Haut Antiseptikum zur lokalen Anwendung 1 ml Lösung
Gebrauchsinformation: Information für Anwender. Lora-ADGC 10 mg, Tabletten. Wirkstoff: Loratadin
 Gebrauchsinformation: Information für Anwender Lora-ADGC 10 mg, Tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender Lora-ADGC 10 mg, Tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Erivedge Schwangerschaftsverhütungs-Programm
 behördlich genehmigtes Schulungsmaterial Erivedge Schwangerschaftsverhütungs-Programm Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer
behördlich genehmigtes Schulungsmaterial Erivedge Schwangerschaftsverhütungs-Programm Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Jasimenth C 0,45 mg / 20 mg Pastillen Wirkstoffe: Dequaliniumchlorid, Ascorbinsäure Für Erwachsene und Kinder ab 6 Jahren Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Jasimenth C 0,45 mg / 20 mg Pastillen Wirkstoffe: Dequaliniumchlorid, Ascorbinsäure Für Erwachsene und Kinder ab 6 Jahren Lesen Sie die gesamte Packungsbeilage
RoACTEMRA (Tocilizumab) Patientenpass
 RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
RoACTEMRA (Tocilizumab) Patientenpass Dieser Patientenpass ist eine Auflage im Rahmen der Zulassung von RoACTEMRA und enthält wichtige Sicherheitsinformationen, über die Patienten bzw. deren Eltern/gesetzliche
Gebrauchsinformation: Information für den Anwender Hustenreizstiller Pastillen
 Gebrauchsinformation: Information für den Anwender Hustenreizstiller Pastillen Wirkstoff: Eibischwurzel-Trockenextrakt Traditionelles pflanzliches Arzneimittel Zur Anwendung bei Erwachsenen und Kindern
Gebrauchsinformation: Information für den Anwender Hustenreizstiller Pastillen Wirkstoff: Eibischwurzel-Trockenextrakt Traditionelles pflanzliches Arzneimittel Zur Anwendung bei Erwachsenen und Kindern
Ringer-Laktat-Lösung Infusionslösung
 Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Ringer-Laktat-Lösung Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist Ringer-Laktat-Lösung
Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Ringer-Laktat-Lösung Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist Ringer-Laktat-Lösung
Bekanntmachung über die Registrierung und Zulassung von Arzneimitteln
 Bekanntmachung über die Registrierung und Zulassung von Arzneimitteln vom 6. Dezember 2010 Abwehr von Gefahren durch Arzneimittel, Stufe II 1. SSRI und TCA: Risiko von Knochenbrüchen 2. SSRI, Venlafaxin
Bekanntmachung über die Registrierung und Zulassung von Arzneimitteln vom 6. Dezember 2010 Abwehr von Gefahren durch Arzneimittel, Stufe II 1. SSRI und TCA: Risiko von Knochenbrüchen 2. SSRI, Venlafaxin
