Das Serum aus peripherem Blut von 73 Tumorpatienten sowie 10 gesunden Probanden wurde auf seine Zytokin- und Chemokinkonzentration hin untersucht.
|
|
|
- Hertha Ritter
- vor 5 Jahren
- Abrufe
Transkript
1 3. Ergebnisse 3.1. Untersuchung peripherer Blutlymphozyten Zytokin- und Chemokinkonzentration im Patientenserum Das Serum aus peripherem Blut von 73 Tumorpatienten sowie 10 gesunden Probanden wurde auf seine Zytokin- und Chemokinkonzentration hin untersucht. Tumorpatienten wiesen im Vergleich zu gesunden Probanden eine erhöhte Expression für IL-2, IL- 2R, IL-4, -5, -6, -10, -13, IFN-γ, TNF-α, TNFR I und TNFR II auf. Einzig IFN-α war dagegen in allen Tumorstadien der Patienten erniedrigt nachweisbar. Für die meisten Zytokinen (IL-2, IL-2R, IL-4, IL-5, IL-6, IL-10, IFN-γ, TNF-α, TNFR I und II) fand sich eine deutlich schwächere Expression Konzentrationsrückgang bei Progression der Krankheit von frühen zu späten Stadien. Für IL-2R, IL-6, IL-10, IFN-α und TNF-α war die Konzentration im Serum fortgeschrittener Tumorpatienten niedriger als das Niveau gesunder Probanden (Abbildung 3.1). Dies deutet auf eine Aktivierung des gesamten Immunsystems während der Anfangsstadien der Tumorentwicklung hin. Diese Aktivierung führt aber nicht zur Tumorabwehr, stattdessen wird die Immunantwort im weiteren Verlauf der Tumorprogression herabreguliert. 60 Konzentration, pg/ml IL-2 IL-2R IL-4 IL-5 IL-6 IL-10 IL-13 IFN-α IFN-γ TNF-α TNF-R I TNF-R II I/II Stadium (n=53) 37,14 454,31 9,31 3,00 80,43 32,02 12,67 58,30 15,00 68, , ,28 III/IV Stadium (n=20) 27,49 332,04 8,89 2,74 48,26 6,73 18,28 59,83 12,27 8, , ,55 Gesunde Probanten (n=10) 21,05 339,35 5,80 2,26 60,84 13,67 10,35 106,27 9,20 23,08 939, ,11 Abbildung 3.1. Zytokin- und Chemokinproduktion im Serum von Tumorpatienten. Für IL-2, IL-2R, IL-4, -5, -6, -10, -13, IFN-γ, TNF-α, TNFR I und TNFR II zeigte sich eine angestiegene Konzentration im Serum der Tumorpatienten im Vergleich zu gesunden Probanden. 69
2 Zytokinproduktion peripherer Blutlymphozyten Mittels Immunfluoreszenz-Doppelfärbung wurden zytokinexprimierende T-Lymphozyten untersucht. Mit Ausnahme von IL-10 und IFN-γ positiver CD8 Zellen, deren Anteil keinen signifikanten stadienabhängigen Unterschied aufwies (Abbildung 3.3.), fand sich in fortgeschrittenen Tumoren eine deutliche Reduktion IL-2, IL-10, IFN-γ und TNF-α positiver T- Lymphozyten im peripheren Blut (Abbildung 3.2.). In der CD4+ T-Zellpopulation überwogen in frühen Tumorstadien IL-2 (36,3±4,1%) und IL-10 (35±5%) positive Zellen über den IFN-γ (18,8±5,5%) und TNF-α (16,3±6,5%) positiven Lymphozyten. Dieselbe Tendenz wurde auch für die CD4+ T-Zellen von Patienten später Tumorstadien festgestellt. Gesunde Probanden wiesen keine signifikanten Unterschiede in der Verteilung IL-2, IL-10, IFN-γ und TNF-α positiver CD4+ Zellen auf. Der Anteil jeder Population betrug etwa 7,5% der Gesamtanzahl der CD4+ T-Zellen (Abbildungen 3.2. und ). Die Verteilung in der CD8+ T-Zellpopulation im peripheren Blut der Tumorpatienten zeigte ein entgegengesetztes Bild. Im allen Tumorstadien lagen die TNF-α und IFN-γ exprimierenden CD8+ Zellen in grösserer Anzahl als IL-2 und IL-10 exprimierende CD8+ Zellen vor. Während der Anteil der TNF-α und IFN-γ exprimierenden CD8+ PBLs in Patienten früher Stadien 7,5±2,5% und 6,3±2,2% betrug, lag die Rate der IL-2 und IL-10 positiven CD8+ PBLs bei 3,8±4,1% und 3,8±2,2%. In PBLs gesunder Probanden überwogen die TNF-α (10±2,7%) sowie IL-2 und IFN-γ (7,5±2%) exprimierenden CD8+ Zellen über den IL-10 positiven CD8+ Zellen (5±1,5%) (Abbildung 3.3.). Beim Vergleich der untersuchten T-Zellpopulationen zeigte sich, dass die CD4+ T-Zellen während der Tumorentwicklung signifikant anstiegen, während die CD8+ Zellen in der Zahl leicht abfielen. Eine hohe Anzahl IL-2 exprimirender CD4+ T-Zellen während der Tumorentwicklung korrelierte mit einer angestiegenen IL-10 Expression. 70
3 Ratio CD4+ peripherer Blutlymphozyten 0,45 0,4 0,35 0,3 0,25 0,2 0,15 0,1 0,05 0 IL-2/CD4 IL-10/CD4 IFN-γ/CD4 TNFα/CD4 Stadien I/II (n=5) 0,3625 0,35 0,1875 0,1625 Stadien III/IV (n=5) 0,26 0,27 0,11 0,11 Gesunde Probanden (n=5) 0,075 0,075 0,075 0,075 Abbildung 3.2. Anteil CD4 positiver PBLs mit verschiedenen Zytokinprofilen. In der CD4+ T-Zellpopulation überwogen in frühen Tumorstadien IL-2 (36,3±4,1%) und IL-10 (35±5%) positive Zellen über den IFN-γ (18,8±5,5%) und TNF-α (16,3±6,5%) positiven Lymphozyten. Dieselbe Tendenz wurde für die CD4+ T-Zellen von Patienten später Tumorstadien festgestellt. Gesunde Probanden wiesen keine signifikanten Unterschiede in der Verteilung IL-2, IL-10, IFN-γ und TNF-α positiver CD4+ Zellen auf. Der Anteil jeder Population betrug etwa 7,5% der Gesamtanzahl der CD4+ T-Zellen. Die CD4+ Zellen stiegen während der Tumorentwicklung signifikant an. 0,45 Ratio CD8+ peripherer Blutlymphozyten 0,4 0,35 0,3 0,25 0,2 0,15 0,1 0,05 0 IL-2/CD8 IL-10/CD8 IFNγ/CD8 TNFα/CD8 Stadien I/II (n=5) 0,0375 0,0375 0,0625 0,075 Stadien III/IV (n=5) 0,03 0,03 0,04 0,04 Gesunde Probanden (n=5) 0,075 0,05 0,075 0,1 Abbildung 3.3. Anteil CD8 positiver PBLs mit verschiedenen Zytokinprofilen. Im allen Tumorstadien lagen die TNF-α und IFN-γ exprimierenden CD8+ Zellen in grösserer Anzahl als IL-2 und IL-10 exprimierende CD8+ Zellen vor. Während der Anteil der TNF-α und IFN-γ exprimierenden CD8+ PBLs in Patienten früher Stadien 7,5±2,5% und 6,3±2,2% betrug, lag die Rate der IL-2 und IL-10 positiven CD8+ PBLs bei 3,8±4,1% und 3,8±2,2%. In PBLs gesunder Probanden überwogen die TNF-α (10±2,7%) sowie IL-2 und IFN-γ (7,5±2%) exprimierenden CD8+ Zellen über den IL-10 positiven CD8+ Zellen (5±1,5%). während der Tumorentwicklung signifikant anstiegen während die CD8+ Zellen in der Zahl leicht abfielen. 71
4 In weiteren Färbungen wurde gezeigt, dass die Anzahl an CD8+CD28+ Zellen, CD4+CD25+ Zellen und CD56+ Zellen im peripheren Blut von Tumorpatienten wesentlich höher war als bei gesunden Probanden. Ein besonders deutlicher Unterschied der Anzahl wurde für CD4+CD25+ Zellen gesehen. Für alle drei Zellpopulationen zeigte sich bei Progression des Tumors ein Abfall in der Zellzahl. 0,45 0,4 Ratio peripherer Blutlymphozyten 0,35 0,3 0,25 0,2 0,15 0,1 0,05 0 CD28/CD8 CD25/CD4 CD56 Stadien I/II (n=5) 0,25 0,3 0,1 Stadien III/IV (n=5) 0,15 0,2 0,05 Gesunde Probanden (n=5) 0,1 0,075 0,025 Abbildung 3.4. Anteil CD28+/CD8+, CD25+/CD4+ und CD56+ positiver PBLs. Die Anzahl an CD8+/CD28+, CD4+/CD25+ und CD56+ Zellen war im peripheren Blut von Tumorpatienten wesentlich höher als bei gesunden Probanden. Ein besonders deutlicher Unterschied der Anzahl wurde für CD4+/CD25+ Zellen gesehen. Für alle drei Zellpopulationen zeigte sich bei Progression des Tumors ein Abfall in der Zellzahl Apoptose peripherer Blutlymphozyten Aus dem peripheren Blut von zehn Tumorpatienten verschiedener Stadien sowie von fünf gesunden Probanden gewonnene CD4+ und CD8+ T-Zellen wurden auf Zeichen der Apoptose hin untersucht. Mittels Immunfluoreszenz wurde sowohl der TNFR I gefärbt als auch ein TUNEL Assay durchgeführt. In beiden Färbungen wies die CD4+ T-Zellpopulation einen grösseren Anteil an TNFR I und TUNEL positiven Zellen verglichen mit dem CD8+ T-Zellanteil auf. Der Anteil an TNFR I exprimierenden Zellen in beiden T-Zellpopulationen zeigte einen stadienabhängigen Charakter mit einer höheren Anzahl positiver Zellen in frühen Stadien (25±6% für CD4+ T-Zellen und 16,3±4,1% für CD8+ T-Zellen) im Vergleich zu fortgeschrittene Stadien (17±4,5% für CD4+ T-Zellen und 12±2,5% für CD8+ T-Zellen). Die TNFR I Expression zeigten 5±2,5% der CD4+ T- Zellen und keine CD8+ T-Zellen aus peripherem Blut gesunder Probanden. 72
5 Der TUNEL Assay zeigte dieselbe Tendenz in den T-Zellpopulationen bei Tumorprogression. CD4+ Zellen zeigten eine wesentlich höhere Anzahl an TUNEL positiven Zellen (22,5±4,3%) als CD8+ Zellen (15±3,5% bei Patienten früher Stadien). Interessanterweise ergab geringere Anzahl an TNFR I positiven PBLs eine positive TUNEL Färbung. Dies galt sowohl für CD4+ als auch CD8+ T-Lymphozyten in Patienten aller Tumorstadien (Abbildungen 3.5., , ). Da im peripheren Blut gesunder Probanden doppelt so wenige TUNEL positive Zellen als TNFR I positive CD4+ Zellen gefunden wurden, ist zu vermuten, dass die TNFR I Expression auf der Zelloberfläche nicht unbedingt zur Apoptose der Zelle führte. 0,35 Ratio peripherer Blutlymphozyten 0,3 0,25 0,2 0,15 0,1 0,05 0 TNFRI/CD4 TNFRI/CD8 TUNEL/CD4 TUNEL/CD8 Stadien I/II (n=5) 0,25 0,1625 0,225 0,15 Stadien III/IV (n=5) 0,17 0,12 0,15 0,12 Gesunde Probanden (n=5) 0,05 0 0,025 0 Abbildung 3.5. Anteil TNFR I und TUNEL positiver PBLs. In beiden Färbungen wies die CD4+ T-Zellpopulation einen größeren Anteil an TNFRI und TUNEL positiven Zellen verglichen mit dem CD8+ T-Zellanteil auf. Der Anteil an TNFRI exprimierenden Zellen in beiden T-Zellpopulationen zeigte einen stadienabhängigen Charakter mit einer höheren Anzahl positiver Zellen in frühen Stadien 25±6% für CD4+ T-Zellen und 16,3±4,1% für CD8+ T-Zellen) im Vergleich zu fortgeschrittene Stadien (17±4,5% für CD4+ T-Zellen und 12±2,5% für CD8+ T-Zellen). Der TUNEL Assay zeigte dieselbe Tendenz in den T-Zellpopulationen bei Tumorprogression. CD4+ Zellen zeigten eine wesentlich höhere Anzahl an TUNEL positiven Zellen (22,5±4,3%) als CD8+ Zellen (15±3,5% bei Patienten früher Stadien) 73
6 FACS Analyse p33ing1b- und p29ing4-exprimierender peripherer Blutlymphozyten Aus dem peripheren Blut von 20 Patienten mit NZK verschiedener Stadien sowie fünf gesunden Probanden gewonnene mononukleäre Zellen wurden im FACS auf CD3- und p33ing1b- bzw. p29ing4-doppelt positive Zellen hinuntersucht. Sowohl T-Lymphozyten aus dem Blut gesunder Probanden als auch aus dem Blut der Tumorpatienten verschiedener Stadien exprimierten oberflächige p33ing1b und p29ing4 Proteine, wobei sich die Anzahl p33ing1b- und p29ing4-positiver T-Lymphozyten in Tumorpatienten stadienabhängig unterschied. p33ing1b-positive T-Zellen fanden sich bei Tumorpatienten früher Tumorstadien (0,9±0,3%) wie in gesunden Probanden in deutlich geringer Anzahl (2,0±0,6%), in fortgeschrittenen Stadien nahm diese Anzahl zu (2,9±0,9%). Der Anteil p29ing4-positiver T-Zellen betrug 3,1±1,6% bei gesunden Probanden; Patienten sowohl früher als auch später Tumorstadien zeigten dagegen einen angestiegenen Anteil von 9,0±2,7% bzw. 14,3±3,4% p29ing4-positiver T-Zellen. Die Gesamtanzahl p29ing4-positiver T-Lymphozyten in Patienten aller Stadien lag signifikant höher als die Anzahl p33ing1b-positiver T-Lymphozyten (Abbildung 3.6.). 20 Anzahl doppelt positiver Zellen, % p33ing1b/cd3 p29ing4/cd3 Stadien I/II (n=10) 0,88 8,96 Stadien III/IV (n=10) 2,91 14,33 Gesunde Probanden (n=5) 1,95 3,13 Abbildung 3.6. FACS Analyse CD3-positiver T-Zellen im peripheren Blut. Sowohl T-Lymphozyten aus dem Blut gesunder Probanden als auch von Tumorpatienten verschiedener Stadien exprimierten oberflächige p33ing1b und p29ing4 Proteine, wobei sich die Anzahl p33ing1b- und p29ing4-positiver T-Lymphozyten in Tumorpatienten stadienabhängig unterschied. Die Gesamtanzahl p29ing4-positiver T-Lymphozyten bei Patienten aller Stadien war im Vergleich p33ing1b-positiven T-Lymphozyten signifikant höher. 74
7 Mittel der p33ing1b/cd4- sowie p29ing4/cd8-doppelfärbungen konnten wir zeigen, dass es keine wesentliche Unterschiede in der Anzahl der p33ing1b- oder p29ing4- exprimierenden CD4- und CD8 T-Zellen im peripherem Blut vorliegt Analyse der Immunantwort peripherer Blutlymphozyten nach Stimulation mit p33ing1b und p29ing4 Peptiden Die aus dem peripheren Blut von Tumorpatienten und gesunden Probanden gewonnenen mononukleären Zellen wurden in vitro mit p33ing1b- und p29ing4-peptiden stimuliert. Dabei wurde die IFN-γ Expression nach Stimulation im ELISPOT gemessen. Für die Messung weiterer Zytokine und Chemokine wurden die ELISPOT-Überstände im LUMINEX untersucht. In verschiedenen experimentellen Ansätzen wurden die Zellen mit den Peptidpools der vollen Proteinlänge (10 Oligomere pro Pool) sowie mit einzelnen Oligomeren stimuliert. Für die Berechnung der Stimulationsindizes wurden die Negativkontrollwerte (nicht stimulierte mononukleäre Zellen) in allen Ansätzen subtrahiert und Positivkontrollwerte (mit PHA stimulierte mononukleäre Zellen) mit 100% gleichgesetzt Stimulation mit p33ing1b und p29ing4 Peptidpools voller Proteinlänge IFN-γ Expression Nach der Stimulation mit beiden ING-Peptiden zeigten die peripheren Blutlymphozyten aus Tumorpatienten stadienunabhängig eine höhere IFN-γ Expression verglichen mit entsprechenden Zellen gesunder Probanden. Bei Stimulation mit den p33ing1b Peptidpools zeigten sich stadienabhängig unterschiedlich starke IFN-γ-Antworten auf Sequenzen aa (23,3±4,5% in den Stadien I/II und 15,5±3,4% in den Stadien III/IV) und aa (31,4±4,7% in den Stadien I/II und 46,6±5,5% in den Stadien III/IV). Andere Pools riefen in allen Stadien eine vergleichbare IFN-γ Immunantwort peripherer Blutlymphozyten der Tumorpatienten hervor. Die höchsten Stimulations-Indizes wurden für Patienten der Stadien I/II nach Stimulation mit den Peptiden aa (23,3±4,5%) und aa (31,4±4,7%) erreicht (Abbildung 3.7.). 75
8 Pos. Neg. aa 1-58 aa aa aa aa aa Stadien I/II (n=9) 10 15,69 14,07 15,99 13,20 23,27 31,44 Stadien III/IV (n=9) 10 16,21 13,31 15,59 14,32 15,47 46,62 Gesunde Probanden (n=4) 10 0,30 0,30 2,27 1,36 2,42 1,36 Abbildung 3.7. Die IFN-γ Produktion nach der Stimulation mit p33ing1b-peptiden. Die höchsten Stimulations- Indizes wurden für Patienten der Stadien I/II nach Stimulation mit aa (23,3±4,5%) und aa (31,4±4,7%) erreicht. Im Falle der Stimulation mit p29ing4 wies die IFN-γ Immunantwort stadienabhängige Unterschiede mit einer Ausnahme des Peptidpools aa auf. Die höchsten Stimulations- Indizes wurden für Tumorpatienten der Stadien I/II nach Stimulation mit den Peptidpools aa (39,4±5,9%) sowie aa (40±5%) erreicht (Abbildung 3.8.) Pos. Neg. aa 1-58 aa Stadien I/II (n=9) 10 26,03 34,80 39,39 33,19 4 Stadien III/IV (n=9) 10 26,16 20,22 23,11 18,80 38,42 Gesunde Probanden (n=4) 10 2,51 1,96 1,68 0,84 1,12 76 aa aa aa Abbildung 3.8. Die IFN-γ Produktion nach der Stimulation mit p29ing4-peptiden. Die höchsten Stimulations- Indizes wurden für Tumorpatienten der Stadien I/II nach der Stimulation mit den Peptidpools aa (39,4±5,9%) und aa (40±5%) erreicht.
9 Mit Ausnahme des Peptidpools aa scheinen p33ing1b-peptidpools weniger stimulierend zu wirken (Indizes < 23,3%) als p29ing4-peptide, die Stimulations-Indizes zwischen 18,8% und 40,0% aufwiesen IL-10 Expression Im Falle der Stimulation mit p33ing1b zeigten periphere Blutlymphozyten der Tumorpatienten stadienunabhängig eine stärkere IL-10 Antwort verglichen mit entsprechenden Zellen gesunder Probanden. Die Stärke der IL-10 Antwort wies keine signifikante stadienabhängige Unterschiede gegenüber allen p33ing1b-peptidpools. Die IL-10 Expression war nach Stimulation mit den Peptidpools aa und aa in frühen Tumorstadien weniger stark erhöht als bei den anderen Pools (Abbildung 3.9.) Pos. Neg. aa 1-58 aa aa aa aa aa Stadien I/II (n=9) 10 54,30 53,03 8,95 39,71 25,40 10,09 Stadien III/IV (n=9) 10 54,68 57,85 28,95 47,43 30,95 15,95 Gesunde Probanden (n=4) 10 12,03 6,96 5,87 4,43 0,63 6,09 Abbildung 3.9. Die IL-10 Produktion nach Stimulation mit p33ing1b Peptiden. Die IL-10 Expression war nach Stimulation mit den Peptidpools aa und aa in allen Tumorstadien weniger stark erhöht im Vergleich zu den anderen Peptidpools. In Antwort auf p29ing4 exprimierten periphere Blutlymphozyten der Tumorpatienten mehr IL-10 als solche Lymphozyten gesunder Probanden. Eine Ausnahme stellte das Peptidpool aa dar. Diese Sequenz rief eine signifikant höhere Stimulation von IL-10 in Patienten der Stadien III/IV und in gesunden Probanden hervor (49,8±3,4% und 52,8±6,5% entsprechend) als in den Patienten der Stadien I/II (28,8±7,6%). Beim Vergleich aller p29ing4 Peptidpools war die IL-10 Produktion nach Stimulation mit den Peptidpools aa und aa in peripheren Blutlymphozyten von Tumorpatienten der Stadien I/II signifikant reduziert (Abbildung 3.10.). 77
10 Pos. Neg. aa 1-58 aa aa aa aa Stadien I/II (n=9) 10 68,59 90,07 28,29 55,85 28,78 Stadien III/IV (n=9) 10 53,28 88,48 39,33 49,80 Gesunde Probanden (n=4) 10 3,24 2,16 16,72 2,88 52,85 Abbildung Die IL-10 Produktion nach Stimulation mit p29ing4 Peptiden. Die IL-10 Produktion war in periphere Blutlymphozyten von Tumorpatienten der Stadien I/II nach Stimulation mit den Peptidpools aa und aa signifikant reduziert. Zusammenfassend ruft p33ing1b (ausgenommen aa ) in frühen Tumorstadien eine verminderte Produktion von IFN-γ (13,2 bis 23,3%) im Vergleich zu p29ing4 (26 bis 40%) hervor. Die Stimulation mit p33ing1b Peptidpools führt dagegen zu einer reduzierten Produktion von IL-10 (8,95 bis 53,03%) vergleichbar der mit p29ing4 Sequenzen (28,3 bis 90,1%). Interessanterweise zeigen zwei Peptidpools des p33ing1b Proteins (aa und aa ) und zwei Peptidpools des p29ing4 Proteins (aa und aa ) eine angestiegene IFN-γ Produktion sowie eine signifikant reduzierte IL-10 Produktion. Die Zellüberstände der Patienten mit deutlicher IFN-γ Überexpression nach Stimulation mit diesen Sequenzen (66% der Patienten im Falle p33ing1b und 55% im Falle p29ing4 aller untersuchten Fälle) wurden im Luminex zusätzlich auf IL-2, IL-2R, IL-4, -5, -6, -13 und TNF-α untersucht IL-2 und IL-2R Expression In Patienten der Stadien I/II führte ausschließlich die Stimulation mit p29ing4 zur IL-2R Expression. Dabei lösten beide p29ing4 Sequenzen eine vergleichbar hohe IL-2 Rezeptor Expression aus. In den späten Tumorstadien zeigte sich gegenüber p33ing1b (aa ) sowie p29ing4 (aa ) eine IL-2 Antwort und deutliche Expression des IL-2 Rezeptors. 78
11 In gesunden Probanden riefen sowohl p33ing1b als auch p29ing4 eine hohe IL-2 Antwort und IL-2R Expression hervor (Abbildung 3.11., 3.12.) Pos. Neg Stadien I/II (n=4) 10 Stadien III/IV (n=4) 10 0,08 0,56 0,14 0,16 3,78 Gesunde Probanden (n=3) 10 2,74 2,74 4,08 Abbildung Die IL-2 Produktion nach Stimulation mit spezifischen p33ing1b und p29ing4-peptidpools. Die Produktion von IL-2 war in PBL der Tumorpatienten (Stadien III/IV) nach Stimulation mit den Sequenzen aa des p33ing1b und aa des p29ing4 deutlich erhöht Pos. Neg Stadien I/II (n=4) 22,39 22,39 Stadien III/IV (n=4) ,99 42,99 Gesunde Probanden (n=3) 10 25,32 13,30 26,09 Abbildung Die IL-2R Expression nach Stimulation mit spezifischen p33ing1b- und p29ing4- Peptidpools. Die Produktion von IL-2R war in PBLs früher Tumorpatienten der Stimulation mit aa von p33ing1b und aa von p29ing4 und in PBLs fortgeschrittener Tumorpatienten nach Stimulation mit den Sequenzen aa von p33ing1b sowie aa von p29ing4 deutlich erhöht. 79
12 IL-4, -5, -6, -13 und TNF-α Zytokin-Expression Sowohl die p33ing1b- als auch p29ing4-peptidpools spielten eine Rolle für den Anstieg der Expression von IL-4, -5 und -13 bei Tumorpatienten später Stadien, nicht aber bei Patienten früherer Stadien und gesunden Probanden. Dabei wurden vergleichsweise starke Antworten in PBLs von Patienten später Stadien bei Stimulation mit dem p33ing1b-peptidpool aa (IL- 5, -13, TNF-α) und Peptidpool p (IL-4, -5, -6, -13, TNF-α) hervorgerufen (Abbildung bis 3.17.). Eine Ausnahme bildete die IL-6 Expression in PBLs der Patienten früher Stadien. Beide Sequenzen des p33ing1b- und p29ing4-peptidpools riefen eine IL-6 Produktion hervor. Dabei erreichte der Stimulations-Index beider p29ing4 Sequenzen ca. 98% (Abbildung 3.15.) Pos. Neg Stadien I/II (n=4) 10 Stadien III/IV (n=4) 10 12,32 Gesunde Probanden (n=3) 10 Abbildung Die IL-4 Produktion nach Stimulation mit spezifischen p33ing1b- und p29ing4-peptidpools. In PBLs von Patienten später Stadien wurde durch Inkubation mit aa des p29ing4 ein höherer Stimulations- Index erreicht. 80
13 Pos. Neg Stadien I/II (n=4) 0,23 0,28 Stadien III/IV (n=4) 100,03 3,96 10,11 Gesunde Probanden (n=3) 10 2,82 Abbildung Die IL-5 Produktion nach Stimulation mit spezifischen p33ing1b- und p29ing4-peptidpools. In PBLs von Patienten später Stadien wurde durch Inkubation mit aa des p33ing1b und aa des p29ing4 ein höherer Stimulations-Index erreicht Pos. Neg Stadien I/II (n=4) 100,13 16,86 17,61 98,98 98,24 Stadien III/IV (n=4) 10 49,40 43,87 54,21 10 Gesunde Probanden (n=3) 100, ,16 80,30 10 Abbildung Die IL-6 Produktion nach Stimulation mit spezifischen p33ing1b- und p29ing4- Peptidpools. Beide Sequenzen von p33ing1b und p29ing4 riefen eine IL-6 Produktion bei PBLs von Patienten früher Stadien hervor. Dabei erreichte der Stimulations-Index von beiden p29ing4 Sequenzen 80% bzw. 82% 81
14 Pos. Neg Stadien I/II (n=4) 10 Stadien III/IV (n=4) 99,99 48,98 45,10 46,18 55,08 Gesunde Probanden (n=3) 10 1,09 16,28 94,12 Abbildung Die IL-13 Produktion nach Stimulation mit spezifischen p33ing1b- und p29ing4-peptidpools. In PBLs von Patienten später Stadien wurde durch Inkubation mit aa des p33ing1b und aa des p29ing4 ein höherer Stimulations-Index erreicht Pos. Neg Stadien I/II (n=4) ,00 Stadien III/IV (n=4) 100,01 53,63 30,32 26,25 83,57 Gesunde Probanden (n=3) 10 Abbildung Die TNF-α Produktion nach Stimulation mit spezifischen p33ing1b- und p29ing4- Peptidpools. In PBLs von Patienten später Stadien wurde durch Inkubation mit aa des p33ing1b und aa des p29ing4 ein höherer Stimulations-index erreicht. 82
15 Stimulation mit spezifischen p33ing1b und p29ing4 Peptidpools der CD4+ bzw. CD8+ depletierten peripheren Blutlymphozyten Um die durch Stimulation mit ING Peptiden entstehende Polarisation der T-Zellen festzustellen wurden Splenozyten analysiert, die entweder ihres CD4+ oder CD8+ Anteil depletiert waren IFN-γ Expression Sowohl CD4+ als auch CD8+ Lymphozyten von Patienten fortgeschrittener Tumorstadien wiesen nach Stimulation sowohl mit den p33ing1b Peptidpools aa und aa ) als auch mit dem p29ing4 Peptidpool aa keine signifikant unterschiedliche Stimulations-Indizes für IFN-γ Produktion innerhalb jeder Zellpopulation auf. Der p29ing4 Peptidpool aa rief eine stärkere Antwort bei CD4-Zellen (52,7±5,7%) als bei CD8-Zellen (35,9±4,3%) in frühen Stadien hervor (Abbildung 3.18., 3.20.). Dieser Pool wies aber keine signifikant unterschiedliche Aktivierung zwischen CD8-Zellen (72,7±8,1%) und CD4-Zellen (67,7±8,9%) von Patienten fortgeschrittener Stadien auf. Dieses spricht für eine potentiell induzierbare CD8 T-Zellantwort in frühen und späten Tumorstadien des Nierenzellkarzinoms (p ) Pos. Neg Stadien I/II (n=5) 10 18,02 11,77 15,52 35,94 Stadien III/IV (n=5) 10 59,25 37,67 51,83 72,67 Gesunde Probanden (n=4) 10 3,33 2,39 3,87 4,67 Abbildung Die IFN-γ Produktion durch CD8 positive Zellen (CD4 Depletion) nach Stimulation mit den p33ing1b und p29ing4 Peptidpools. Sowohl p33ing1b als auch p29ing4 Pools riefen die Aktivierung der CD8- Zellen von Tumorpatienten später Stadien in größerem Maß als der CD8-Zellen von Tumorpatienten früher Stadien hervor. 83
16 Pos. Neg Stadien I/II (n=5) 10 12,71 4,58 13,13 52,71 Stadien III/IV (n=5) 10 14,25 10,17 20,33 67,75 Gesunde Probanden (n=4) 10 1,67 3,33 2,33 3,33 Abbildung Die IFN-γ Produktion durch CD4 positive Zellen (CD8 Depletion) zeigt eine signifikant angestiegene stadienunabhängige Aktivierung der CD4-Zellen durch Peptidpool aa von p29ing IL-10 Expression Die Stimulation mit den ING-Peptidpools rief in beiden CD4 und CD8 Zellpopulationen überwiegend bei Patienten später Stadien eine Aktivierung von IL-10 positiven Zellen hervor. Die IL-10 Produktion war in CD8 positiven Zellen von Patienten aller Tumorstadien angestiegen, wobei in frühen Stadien nur leicht angestiegen in Antwort auf aa und aa CD4+ T-Zellen dagegen exprimierten IL-10, wenn sie aussliesslich aus Patienten später Tumorstadien stammten. Im Gegensatz zu den CD4+ T-Zellen zeigten CD8+ T-Zellen die höchste IL-10 Expression nach Stimulation mit den Pools aa von p33ing1b (71,6±7,9%) und aa von p29ing4 (63,2± 6,8%). Die p29ing4 Sequenz aa ergab die geringste IL-10 Expression sowohl in CD8+ (16,1±4,9%) als auch in CD4+ (3,0±1,6%) T-Zellen von Patienten fortgeschrittener Stadien. In Patienten früher Stadien wurde keine IL-10 Expression durch stimulierte CD4+ T-Zellen gefunden (Abbildung 3.20., 3.21.). 84
17 Pos. Neg Stadium I/II (n=5) 10 3,55 2,97 Stadium III/IV (n=5) 10 71,59 33,85 63,16 16,14 Gesunde Probanden (n=4) 10 Abbildung Die IL-10 Produktion durch CD8 positive Zellen (CD4 Depletion) nach Stimulation mit den p33ing1b und p29ing4 Peptidenpools. Sowohl p33ing1b als auch p29ing4 Pools bewirkten die Aktivierung der CD8-Zellen von Tumorpatienten später Stadien in größerem Maß als der CD8-Zellen von Tumorpatienten früher Stadien. 85
18 Pos. Neg Stadium I/II (n=5) 10 Stadium III/IV (n=5) 10 3,55 17,38 20,08 3,03 Gesunde Probanden (n=4) 10 Abbildung Die IL-10 Produktion durch CD4 positive Zellen (CD8 Depletion) nach Stimulation mit den p33ing1b und p29ing4 Peptidenpools. Sowohl p33ing1b als auch p29ing4 Pools ergaben die Aktivierung IL-10 positiver CD4 Zellen ausschließlich von Tumorpatienten später Stadien IL-2 und IL-2R Expression T-Zellen, die entweder ihres CD4+ oder CD8+ Anteil depletiert waren, und mit p33ing1b bzw. p29ing4 stimuliert wurden, sezernierten verhältnismäßig weniger IL-2 als nicht stimulierte T- Zellen. Dieses wurde für PBLs aus Tumorpatienten und auch aus gesunden Probanden beobachtet. Stimulierte T-Zellen aus Patienten früher Tumorstadien und aus gesunden Probanden zeigte auch keine angestiegene IL-2R Expression. Der Vergleich der CD8+ und der CD4+ T-Zell- Immunreaktivität in Patienten mit einem fortgeschrittenen Tumor deutete darauf hin, dass die IL- 2R Expression in CD8+ T-Zellen durch alle ING-Peptide hervorrufen wird, wogegen CD4+ T- Zellen ausschließlich durch Peptid aa des p33ing1b stimuliert werden (Abbildung 3.22., 3.23.). 86
19 Pos. Neg Stadium I/II (n=5) 10 Stadium III/IV (n=5) 10 80,43 17,46 17,46 4,00 Gesunde Probanden (n=4) 10 Abbildung Die IL-2R Produktion durch CD8 positive Zellen (CD4 Depletion) zeigt sich sowohl nach der Stimulation mit p33ing1b als auch mit p29ing4 Pools ausschließlich bei Tumorpatienten später Stadien Pos. Neg Stadium I/II (n=5) 10 Stadium III/IV (n=5) 10 8,00 Gesunde Probanden (n=4) 10 Abbildung Die IL-2R Produktion durch CD4 positive Zellen (CD8 Depletion) zeigt sich nach der Stimulation mit aa von p33ing1b ausschließlich bei Tumorpatienten später Stadien. 87
20 IL-4, -5, -6 und -13 Expression T-Zellen, die entweder ihres CD4+ oder CD8+ Anteil depletiert waren, und mit p33ing1b bzw. p29ing4 stimuliert wurden, sezernierten verhältnismässig wenig IL-4, -5 und -13. Dieses konnte für PBLs sowohl von Tumorpatienten als auch von gesunden Probanden gezeigt werden. Die IL-6 Expression wurde dagegen sowohl in CD4+ als auch in CD8+ T-Zellen gesehen. PBLs von Tumorpatienten verschiedener Stadien waren durch ING-Peptide stimuliert. PBLs von Patienten früher Tumorstadien antworteten auf Stimulation mit ING-Peptiden mit geringeren Stimulations-Indizes: 5,3% für CD8- und 7,3% für CD4-Zellen (aa ). Dabei wies die Stimulation mit ING-Peptidpools in beiden CD4+ und CD8+ Zellpopulationen von Patienten später Stadien eine stärkere Aktivierung von CD8- (Stimulations-Indizes 9,4% bis 82,5%) und CD4-Zellen (Stimulations-Indizes 14,1% bis 82,1%) auf. Die Sequenz aa von p29ing4 zeigte auch vergleichbare stimulierende Wirkung auf CD4+ bzw. CD8+ T-Zellen gesunder Probanden (Abbildung 3.24., 3.25.) Pos. Neg Stadium I/II (n=5) 10 5,30 5,08 0,72 2,16 Stadium III/IV (n=5) 10 82,48 32,77 19,39 9,43 Gesunde Probanden (n=4) 10 5,63 Abbildung IL-6 Produktion durch CD8 positive Zellen (CD4 Depletion). Höhere IL-6 Produktion wurde nach Stimulation in CD8-Zellen von Tumorpatienten später Stadien gezeigt. 88
21 Pos. Neg Stadium I/II (n=5) 10 7,25 5,15 1,67 2,49 Stadium III/IV (n=5) 10 62,50 59,27 82,10 14,06 Gesunde Probanden (n=4) 10 7,48 Abbildung IL-6 Produktion durch CD4 positive Zellen (CD8 Depletion). Höhere IL-6 Produktion wurde nach Stimulation in CD4-Zellen von Tumorpatienten später Stadien gezeigt TNF-α, TNFR I und TNFR II Expression Die TNF-α Expression wurde sowohl in CD4+ als auch in CD8+ T-Zellen gesehen. PBLs von Tumorpatienten verschiedener Stadien waren durch ING-Peptide stimuliert. Dabei erreichte die Stimulation mit den ING-Peptidpools eine stärkere Aktivierung von CD8- (Stimulations-Indizes 43,6% bis 88,2%) und CD4-Zellen (Stimulations-Indizes 17,4% bis 47,3%) in Zellpopulationen von Patienten später Stadien. PBLs von Patienten früher Tumorstadien antworteten auf ING Stimulation mit geringeren Stimulations-Indizes (unter 22,9% für CD8- und 5,9% für CD4- Zellen). Die Immunreaktivität von CD8-Zellen stieg in allen Tumorstadien in größerem Ausmaß an als CD4-Zellen. Die Sequenz aa von p29ing4 hatte ebenfalls vergleichbare mit den Tumorstadien I/II stimulierende Wirkung auf CD4+ bzw. CD8+ T-Zellen gesunder Probanden (Abbildung 3.26, 3.27.). 89
22 Pos. Neg Stadium I/II (n=5) 10 22,90 19,76 2,55 6,09 Stadium III/IV (n=5) 10 88,21 77,63 43,58 55,53 Gesunde Probanden (n=4) 10 5,01 Abbildung TNF-α Produktion durch CD8 positive Zellen (CD4 Depletion). PBLs von Tumorpatienten verschiedener Stadien konnten durch ING Peptide stimuliert werden. Dabei erreichte die Stimulation mit den ING- Peptidpools in der CD8 Zellpopulation von Patienten später Stadien eine höhere Aktivierung von CD8- (Stimulations- Indizes von 43,6% bis 88,2%). PBLs von Patienten früher Tumorstadien antworteten auf ING Stimulation mit geringeren Stimulations-Indizes: unter 22,9% für CD8-Zellen Pos. Neg Stadium I/II (n=5) 10 5,95 3,98 1,00 1,86 Stadium III/IV (n=5) 10 39,26 38,99 47,28 17,37 Gesunde Probanden (n=4) 10 5,05 Abbildung TNF-α Produktion durch CD4 positive Zellen (CD8 Depletion). PBLs von Tumorpatienten verschiedener Stadien konnten durch ING Peptide stimuliert werden. Dabei erreichte die Stimulation mit den ING- Peptidpools in der CD4 Zellpopulationen von Patienten später Stadien eine höhere Aktivierung von CD4-Zellen (Stimulations-Indizes von 17,4% bis 47,3%). PBLs von Patienten früher Tumorstadien antworteten auf ING Stimulation mit geringeren Stimulations-Indizes: unter 6,0% für CD4-Zellen. 90
23 Depletierte CD4+ und CD8+ Zellpopulationen wiesen nach der Stimulation keine erhöhte TNFR I Expression auf. Die TNFR II Expression sowohl durch CD4+ als auch CD8+ PBLs zeigte bei Patienten früher Stadien dagegen einen leichten Anstieg (maximal bis auf 2,8±1,3%) bei CD8+ T- Zellen. CD8+ PBLs aus Patienten später Stadien wiesen eine signifikant erhöhte TNFR II Expression auf (19,4±5,8% im Falle aa von p33ing1b). Die ING-Pepidpools zeigten dafür bei den CD4 positiven PBLs nur einen unbedeutenden Anstieg der TNFR II Expression. Bei gesunden Probanden wurde keine durch Stimulation angestiegene TNFR II Expression gesehen Pos. Neg Stadium I/II (n=5) 10 2,71 2,84 2,21 1,98 Stadium III/IV (n=5) 10 8,94 19,35 15,15 4,50 Gesunde Probanden (n=4) 10 2,53 Abbildung Die TNFR II Produktion durch CD8 positive Zellen (CD4 Depletion) zeigte einen leichten Anstieg (maximal bis auf 2,8±1,3%) bei Patienten früher Stadien und einen signifikanten Anstieg (19,4±5,8% im Falle aa von p33ing1b) bei Patienten später Stadien. 91
24 Pos. Neg Stadium I/II (n=5) 10 2,33 2,21 2,09 1,69 Stadium III/IV (n=5) 10 3,93 3,65 5,09 1,55 Gesunde Probanden (n=4) 10 2,34 Abbildung Der TNFR II Produktion durch CD4 positive Zellen (CD8 Depletion) zeigte einen leichten Anstieg, maximal bis auf 2,3±1,0% bei Patienten früher Stadien und 5,1±2,7% bei Patienten später Stadien Stimulation mit einzelnen Peptiden der p33ing1b und p29ing4 Proteine Ferner wurde die Immunreaktivität der PBLs von zwölf Tumorpatienten und sechs gesunden Probanden mittels ELISPOT und LUMINEX untersucht. Um für die Immunaktivierung entscheidende p33ing1b bzw. p29ing4 Epitope zu identifizieren, wurde die Stimulation mit einzelnen neunzehn Aminosäuren langen Peptiden durchgeführt. Es wurden nur die Peptide getestet, die in den immunaktivierenden Peptidpools enthalten waren (siehe ) IFN-γ Expression Im Vergleich zu den PBLs gesunder Probanden zeigte sich für alle p33ing1b und p29ing4 Epitope eine signifikant stärkere Sekretion von IFN-γ in PBLs der Tumorpatienten. IFN-γ zeigte dabei in PBLs aus Patienten fortgeschrittener Tumorstadien im Allgemein eine stärkere Sekretion als bei Patienten früher Stadien. Einzelne p33ing1b Epitope (aa , aa und aa ) und p29ing4 Epitope (aa und aa ) aktivierten die PBLs der Patienten aller Stadien besonders ausgeprägt. 92
25 Der höchste Stimulations-Index wurde bei der Stimulation mit aa des p29ing4 Proteins (55,4±6,0%) erreicht (Abbildung 3.30.) Pos. Neg Stadien I/II (n=6) Stadien III/IV (n=6) Gesunde Probanden (n=6) Abbildung INF-γ Produktion nach der Stimulation mit den p33ing1b- und p29ing4 Peptiden. Die höchsten Stimulations-Indizes für Patienten der Stadien I/II wurden nach Stimulation mit aa , aa und aa des p33ing1b Proteins bzw. aa und aa des p29ing4 Proteins erreicht IL-10 Expression Als potenziell bedeutsam für eine Immunaktivierung waren die Sequenzen, die zu einer geringen IL-10 Expression in PBLs führen. Diese sind für die Tumorstadien I/II das p33ing1b-peptid aa sowie das p29ing4 Peptid aa und Diese Epitope riefen keine oder nur geringe IL-10 Expression in PBLs gesunder Probanden hervor. Für Patienten später Stadien wirkten nur die Sequenzen aa des p33ing1b, aa und des p29ing4 hoch stimulierend (Abbildung 3.31.). 93
26 Stadien I/II (n=6) Stadien III/IV (n=6) Gesunde Probanden (n=6) Pos. Neg Abbildung IL-10 Produktion in PBLs der Tumorpatienten. Geringere Stimulation der IL-10 Expression wiesen aa von p33ing1b und aa und von p29ing4 für die Stadien I/II des NZKs auf. Diese Epitope riefen keine oder nur geringe IL-10 Expression in PBLs gesunder Probanden hervor IL-2 und IL-2R Expression Die Produktion von IL-2 war in PBLs der Tumorpatienten nach Stimulation mit der p29ing4 Sequenz aa deutlich verstärkt nachweisbar. Andere Epitope riefen sowohl in PBLs der Tumorpatienten als auch gesunder Probanden keine angestiegene IL-2 Expression hervor (Abbildung 3.32.). 10 Stadien I/II (n=6), Stadien III/IV (n=6), Gesunde Probanden (n=6) Pos. Neg Abbildung Die Produktion von IL-2 war in PBL der Tumorpatienten nach Stimulation mit der Sequenz aa von p29ing4 deutlich angestiegen. Andere Epitope riefen in PBLs sowohl von Tumorpatienten als auch von gesunden Probanden keine angestiegene IL-2 Expression hervor. 94
27 Eine verstärkte Expression des IL-2 Rezeptors wurde nach Stimulation mit mehreren Peptiden beobachtet. Die höchsten Stimulations-Indizes zeigten sich in PBLs der Patienten früher Stadien nach Stimulation mit p (82,0±8,4%) und aa (64,5±7,7%) und in PBLs der Patienten fortgeschrittener Stadien nach Stimulation mit p (74,6±11,4%). Interessanterweise wirkte die Sequenz aa des p29ing4 Proteins für PBLs aus Tumorpatienten aller Stadien hoch stimulierend. Die Stimulations-Indizes betrugen dabei 73,5±7,1% für die Patienten früher Stadien und 69,2±4,4% für die Patienten fortgeschrittener Stadien. In PBLs gesunder Probanden ergab sich dagegen keine Stimulation (Abbildung 3.33.). 10 Stadien I/II (n=6), Stadien III/IV (n=6), Gesunde Probanden (n=6) Pos. Neg Abbildung Die Expression von IL-2R war in PBLs der Tumorpatienten nach Stimulation mit der p29ing4 Sequenz aa deutlich verstärkt. Es wurden die höchste Stimulations-Indizes in PBLs der Patienten früher Stadien nach Stimulation mit p und aa sowie in PBLs der Patienten fortgeschrittener Stadien nach Stimulation mit p erreicht. Diese Epitope riefen in PBLs gesunder Probanden keine angestiegene IL-2R Expression hervor IL-4, IL-5, IL-6 und IL-13 Expression Der Expressionsanstieg von IL-4, -5, -6 und -13 hatte dagegen weniger deutlichen Charakter. Die Sequenz aa des p29ing4 Proteins spielte dabei eine besonders wichtige Rolle für die Stimulation von IL-4, -5 und -13 in PBLs der Patienten früher Stadien und für die Stimulation von IL-4, -5, -6 und -13 in PBLs der Patienten später Stadien. Weiterhin zeigte sich ein deutlicher Anstieg der IL-4 Expression in PBLs der Patienten früher Stadien nach Stimulation mit den p33ing1b Peptiden aa , aa und mit dem p29ing4 Peptid aa Ferner wurde ein deutlicher Anstieg der IL-5 und IL-6 Expression mit den p33ing1b Peptiden aa
28 119, aa (nur für IL-5), aa und mit dem p29ing4 Peptid aa detektiert. In PBLs gesunder Probanden fand sich lediglich eine erhöhte IL-6 Expression bei Stimulation mit dem p33ing1b Peptid aa und p29ing4 Peptid aa (Abbildungen bis 3.37.). 10 Stadien I/II (n=6), Stadien III/IV (n=6), Gesunde Probanden (n=6) Pos. Neg Abbildung Die Produktion von IL-4 zeigte in PBL der Tumorpatienten nach Stimulation mit der Sequenz aa von p29ing4 einen deutlichen Anstieg. In PBLs gesunder Probanden fand sich keine IL-4 Expression. 10 Stadien I/II (n=6), Stadien III/IV (n=6), Gesunde Probanden (n=6) Pos. Neg Abbildung Die Produktion von IL-5 war in PBL der Patienten früher Stadien nach Stimulation mit der Sequenz aa von p29ing4 deutlich angestiegen. In PBLs gesunder Probanden fand sich keine IL-5 Expression. 96
29 Stadien I/II (n=6) Stadien III/IV (n=6) Gesunde Probanden (n=6) Pos. Neg Abbildung Die Produktion von IL-6 war in PBLs der Patienten früher Stadien nach Stimulation mit den Sequenzen aa von p33ing1b und aa von p29ing4 deutlich angestiegen. Diese Epitope spielten keine Rolle für die IL-6 Stimulation in PBLs gesunder Probanden. 10 Stadien I/II (n=6), Stadien III/IV (n=6), Gesunde Probanden (n=6) Pos. Neg Abbildung Die Produktion von IL-13 war in PBLs der Tumorpatienten nach Stimulation mit der Sequenz aa von p29ing4 deutlich angestiegen. In PBLs gesunder Probanden konnte keine IL-13 Expression festgestellt werden TNF-α, TNFR I und TNFR II Expression Eine Stimulation der TNF-α Expression war in PBLs der Patienten früher Stadien durch die p33ing1b Sequenzen aa , aa und p29ing4 Sequenzen aa und aa hervorrufen. Die Sequenz aa des p33ing1b rief auch eine verstärkte TNF-α 97
30 Expression bei Patienten fortgeschrittener Stadien. In PBLs gesunder Probanden bewirkten diese Sequenzen eine vergleichsweise geringe TNF-α Antwort (Abbildung 3.38.) Pos. Neg Stadien I/II (n=6) Stadien III/IV (n=6) Gesunde Probanden (n=6) Abbildung Produktion von TNF-α in PBLs der Tumorpatienten. Eine Stimulation der TNF-α Expression war in PBLs der Patienten früher Stadien durch die Sequenzen aa , aa des p33ing1b und aa des p29ing4 hervorrufen. Die Sequenz aa des p33ing1b rief auch eine verstärkte TNF-α Expression bei Patienten fortgeschrittener Stadien. In PBLs gesunder Probanden bewirkten diese Sequenzen eine vergleichsweise geringe TNF-α Antwort. Eine Expression von TNFR I war durch Stimulation mit allen Peptiden in PBLs bei 56% der Patienten früher Stadien hervorrufen. 44% der Patienten früher Stadien wiesen dagegen keinen Expressionsanstieg durch die Stimulation mit den ING Peptiden auf. In 52% der Patienten fortgeschrittener Stadien waren PBLs nicht in der Lage TNFR I zu exprimieren. Bei den 48% der Patienten fortgeschrittener Stadien konnte die TNFR I Expression durch Stimulation mit dem p33ing1b Peptid aa und allen p29ing4 Peptiden in PBLs aktiviert werden. Die Expressionshöhe zeigte in beiden Fällen keinen signifikanten Unterschied. In PBLs gesunder Probanden wurde kein Expressionsanstieg des TNF Rezeptors I unter dem Einfluss von ING- Peptiden beobachtet (Abbildung 3.39.). Die Expression von TNFR II wies dagegen verschiedene Werte auf. Effektive Stimulationen von PBLs aus Patienten aller Stadien zeigte sich für die Peptide aa des p33ing1b, aa und aa des p29ing4. Die höchsten TNFR II Stimulations-Indizes wurden durch das p33ing1b Peptid aa in PBLs der Patienten früher Stadien (70,6±5,9%) und durch das p29ing4 Peptid aa in PBLs der Patienten später Stadien (61,4±5,4%) erreicht. PBLs gesunder Probanden reagierten auf Sequenzen aa und aa von p33ing1b mit den TNFR II Stimulations-Indizes 9,7±3,8% und 18,8±4,1% (Abbildung 3.40.). 98
31 Stadien I/II (n=6) Stadien III/IV (n=6) Gesunde Probanden (n=6) Pos. Neg Abbildung Expression von TNFR I in PBLs der Tumorpatienten. Eine Expression von TNFR I war durch Stimulation mit allen Peptiden in PBLs von Patienten früher Stadien (in 56% der Patienten) bzw. durch Stimulation mit dem p33ing1b Peptid aa und allen p29ing4 Peptiden in PBLs aus Patienten fortgeschrittener Stadien (in 48% der Patienten) hervorgerufen. In PBLs gesunder Probanden wurde kein TNFR I Expressionsanstieg unter dem Einfluss von ING-Peptiden beobachtet Stadien I/II (n=6) Stadien III/IV (n=6) Gesunde Probanden (n=6) Pos. Neg Abbildung Expression von TNFR II in PBLs der Tumorpatienten. Eine effektive Stimulation von PBLs der Patienten aller Stadien zeigte sich für die Peptide aa des p33ing1b, aa und aa des p29ing4. Die höchsten TNFR II Stimulations-Indizes wurden durch das p33ing1b Peptid aa in PBLs der Patienten früher Stadien (70,6±5,9%) und durch das Peptid p29ing4aa in PBLs der Patienten später Stadien (61,4±5,4%) erreicht. PBLs gesunder Probanden reagierten auf die Sequenzen aa und aa des p33ing1b mit den TNFR II Stimulations-Indizes 9,7±3,8% und 18,2±4,1%. Zusammenfassend lässt sich sagen, dass die aa Sequenz von p29ing4 in frühen Stadien eine Aktivierung der Th1- und Th2-Zellen bewirkt, wobei in späten Stadien ein Gleichgewicht der CD4/CD8 Zellen erreicht wird. Eine suppressive Funktion bei der Stimulation mit der aa Sequenz von p29ing4 erfüllen bei Patienten aller Tumorstadien überwiegend die CD8-Zellen. 99
32 p29ing4 Epitop aa zeigt eine stimulierende Wirkung auf IFN-γ exprimierende CD4+ und CD8+ T-Zellen in den PBLs der Patienten mit einem NZK. Das gilt aber nicht für gesunde Probanden Untersuchung des Tumorgewebes Analyse tumor-infiltrierender Lymphozyten Real Time PCR Analyse der Genexpression immunologischer Marker Die RNA aus Tumorgewebe von 32 Patienten wurde auf die Expression folgender Gene untersucht: CD4, CD8, CD25, CTLA4, Foxp3, CD56, IFN-γ und IL-10. Im Tumor ergab die Analyse eine erhöhte Expression aller Marker im Vergleich zu normalem Gewebe. Davon ausgenommen waren Foxp3 und CD56 in den Stadien III/IV. Dabei wurde eine erniedrigte Anzahl an CD4 positiven Zellen bzw. T-Helfer (Th) Zellen und T-regulatorischen Zellen (Treg) sowie Natural Killer Zellen (NK) im Tumor fortgeschrittener Stadien festgestellt. Dieselbe Tendenz konnte für die Produktion von IFN-γ und IL-10 nachgewiesen werden. CD8 Expression Level war stark variierend von Patient zu Patient (Abbildung 3.41.).. 5,00 4,00 Fold Difference 3,00 2,00 1,00 CD4 CD8 IL10 IFN-γ CD25 Foxp3 CTLA-4 CD56 Stadien I/II (n=15) 1,93 1,11 2,01 2,50 2,66 2,05 4,22 1,11 Stadien III/IV (n=15) 1,18 1,70 1,32 1,11 2,50 0,71 3,46 0,68 Niere normal (n=30) 1,00 1,00 1,00 1,00 1,00 1,00 1,00 1,00 Abbildung Die Real Time PCR Analyse der Genexpression immunologischer Marker im Tumorgewebe ergab in fortgeschrittenen Stadien der Krankheit eine erniedrigte Anzahl von CD4 positiven Zellen bzw. T-Helfer Zellen und T-regulatorischen Zellen, Natural Killer Zellen, IFN-γ und IL-10 Expression. 100
33 Immunhistochemische Analyse immunologischer Marker im Tumorgewebes und in tumor-infiltrierenden Lymphozyten Bei der immunhistologischen Auswertung von 10 Tumorpatienten wurde der prozentuale Anteil von Tumorzellen mit Positivität für spezifische immunologische Marker und tumor-infiltrierender Lymphozyten im Tumorgewebe semiquantitativ bestimmt. Alle untersuchten Marker (CD4, CD8, CD25, CTLA4, Foxp3, CD56, IFN-γ und IL-10) zeigten hinsichtlich ihres Expressionsmusters eine erhöhte Expression im Tumorgewebe im Vergleich zum Normalgewebe. Der Rückgang in der Anzahl CD4-, CD8-, CD25-, CTLA4-, Foxp3-, CD56-, IFN-γ- und IL-10-positiver Zellen bei Vergleich früher mit fortgeschrittenen Stadien war deutlich erkennbar (Abbildungen bis ). Die gemittelten Werte der immunhistologischen Analyse aller verwendeten Marker sind in Tabelle 3.1. dargestellt. Tabelle 3.1. Die semiquantitative immunhistologische Analyse des Nierentumorgewebes von CD4, CD8, CD25, CTLA4, Foxp3, CD56, IFN-γ und IL-10 zeigten hinsichtlich ihres Expressionsmusters eine erhöhte Expression im Tumorgewebe im Vergleich zum Normalgewebe. Der Rückgang in der Anzahl CD4-, CD8-, CD25-, CTLA4-, Foxp3-, CD56-, IFN-γ- und IL-10-positiver Zellen bei Vergleich früher mit fortgeschrittenen Stadien war deutlich erkennbar. Marker Normale Niere (%) NZK, Stadien I/II (%) NZK, Stadien III/IV (%) CD4/CD25 5±1,9 23±4,8 15,5±3,5 CD4/CTLA-4 5±2,4 21,5±5,3 12,5±2,9 CD4/Foxp3 5±2,1 22,3±5,1 13,8±3,2 IL-10 4±1,3 25,5±4,3 18,1±3,3 IFN-γ 4,5±1,8 20,5±3,9 15,5±2,7 CD4 10±2,1 30±4,6 22,5±3,8 CD8 10±1,8 29,2±5,3 19,5±3,4 CD56 4,5±1,3 22,0±4,2 12,5±2,6 101
34 Bei semiquantitativer immunhistologischer Auswertung konnte gezeigt werden, dass tumorinfiltrierende CD4 positive Zellen im Tumorgewebe aller Stadien und CD4 positive Zellen in der gesunden Niere im Vergleich zu CD8 und CD56 positiven Zellen dominieren. Dabei wurde für CD4+, CD8+ und CD56+ Zellen sowohl ein bedeutender Anstieg im Tumorgewebe in früher Stadien der Krankheit festgestellt, als auch eine rückgängige Tendenz beim weiteren Tumorwachstum. Am wenigsten veränderte sich bei der Tumorentwicklung die Anzahl an CD56 positiven Zellen im Vergleich zu der gesunden Niere (Abbildung 3.42.). Ratio von tumorinfiltrirenden Lymphozyten 0,5 0,4 0,3 0,2 0,1 0 CD4 CD8 CD56 Stadien I/II (n=5) 0,39 0,27 0,08 Stadien III/IV (n=5) 0,28 0,23 0,06 Niere normal (n=5) 0,125 0,075 0,05 Abbildung Der Anteil von tumor- bzw. gewebeinfiltrierenden CD4+, CD8+, CD56+ Zellen nimmt im Tumorgewebe beim Vergleich Patienten früherer Stadien, späterer Stadien und normalem Nierenparenchym ab. 102
35 Immunhistologische Analyse CD4+ Lymphozyten Immunhistochemisch fanden sich im Tumorgewebe Th1 (CD4/IL-2 und CD4/IFN-γ doppelt positive Zellen), CD4 bzw. Treg (CD4/IL-10) und CD4/TNF-α exprimierende Zellen. Für diese Zellpopulationen zeigte sich ein stadienabhängiger Anstieg in der Zellanzahl bei der Entstehung des Nierenzellkarzinoms. In fortgeschrittenen Stadien ging die Anzahl CD4 positiver Zellen im Vergleich zu früher Tumorstadien zurück. Die gesunde Niere wies eine vergleichbare Anzahl an diesen Zellen auf, während im Tumor diese Zellpopulationen in unterschiedlichem Ausmaß auftraten. So stieg die Anzahl IL-10 positiver CD4+ T-Zellen bis auf 38±4% in den Stadien I/II des Tumors und bis auf 29±3,7 % in den Stadien III/IV an. IL-2 positive CD4+ Zellen erreichten 35±4,5% in frühen Stadien und 26%±4,9% in späteren Stadien. Dagegen betrug die Reduktion für INF-γ positive CD4+ Zellen bei Progression des Tumors von frühen Stadien zu fortgeschrittenen Stadien nur 6% und für CD4/TNF-α doppelt positive Zellen nur 3% (Abbildung 3.43.).. 0,45 0,4 Ratio von CD4 positiven TILs 0,35 0,3 0,25 0,2 0,15 0,1 0,05 0 IL-2/CD4 IL-10/CD4 IFN-γ/CD4 TNFα/CD4 Stadien I/II (n=5) 0,35 0,38 0,17 0,15 Stadien III/IV (n=5) 0,26 0,29 0,11 0,12 Niere normal (n=5) 0,075 0,075 0,075 0,075 Abbildung Anteil von tumor- bzw. gewebeinfiltrierenden CD4 positiven Zellpopulationen. Diese Zellpopulationen weisen einen Anstieg der Zellanzahl im Tumorgewebe im Vergleich zu gesunder Niere auf. Stadienabhängig ging die Zellzahl dieser Population bei der Entwicklung des Tumors zurück. 103
36 Immunhistologische Analyse CD8+ Lymphozyten CD8 positive tumor-infiltrierende Lymphozyten lagen im Tumorgewebe aller Stadien und in Präparaten gesunder Nieren in signifikant geringeren Mengen als CD4 positive Zellen vor. Immunhistologisch wurden IL-2, IL-10, IFN-γ und TNF-α positive CD8+ Zellen im Tumorgewebe im Vergleich zum Nierennormalgewebe verstärkt nachgewiesen. Stadienabhängig nahmen diese Populationen bei Progression des Tumors ab. Die Anordnung der Zytokine nach dem Anteil der sie exprimierenden CD8+ Zellen ergibt die Reihenfolge: IL-2, TNF-α, IFN-γ und IL-10. Hierbei liegt eine absteigende Tendenz vor, d.h. IL-2 wird in dieser Zytokingruppe von dem größten Anteil, während IL-10 vom geringsten Anteil an CD8+ Zellen exprimiert wird. Bei Vergleich CD8/IFN-γ doppelt positiver (vermutlich zytotoxische Tc1-Zellen) und CD8/IL-10 doppelt positiver Zellen (vermutlich Suppressor Tc2-Zellen) konnte ein leichter Shift zu zytotoxischen Zellen gesehen werden (Abbildung 3.44.). 0,45 0,4 Ratio von CD8 positiven TILs 0,35 0,3 0,25 0,2 0,15 0,1 0,05 0 IL-2/CD8 IL-10/CD8 IFNγ/CD8 TNFα/CD8 Stadien I/II (n=5) 0,09 0,05 0,06 0,07 Stadien III/IV (n=5) 0,07 0,03 0,05 0,05 Niere normal (n=5) 0,025 0,025 0,025 0,025 Abbildung Anteil von tumor- bzw. gewebe-infiltrierenden CD8 positiven Zellpopulationen. Alle dieser Zellpopulationen weisen einen Anstieg der Zellanzahl im Tumorgewebe im Vergleich zu gesunder Niere auf. Stadienabhängig ging die Zellzahl dieser Population bei der Entwicklung des Tumors zurück. 104
37 Analyse apoptotischer tumor-infiltrierender Lymphozyten Als weiteres wurden CD4+ und CD8+ T-Zellen im Tumorgewebe auf Zeichen der Apoptose und Expression des TNFR I auf ihrer Zelloberfläche untersucht. CD4+ T-Zellen wiesen in beiden Färbungen einen grösseren Anteil an TUNEL- und TNFR I positiver Zellen verglichen mit der CD8+ T-Zellpopulation auf. Der Anteil an TNFR I exprimierenden Zellen in beiden T- Zellpopulationen zeigte einen stadienabhängigen Charakter. T-Lymphozyten in Tumoren früher Stadien zeigten eine höhere Rate an TNFR I positiven Zellen (27,5±3% für CD4+ und 20±2,8% für CD8+ T-Zellen) als die in fortgeschrittenen Stadien (20±1,7% % für CD4+ T-Zellen und 17,1±2% für CD8+ T-Zellen). Keine signifikanten Unterschiede in der Anzahl TNFR I positiver TILs wurden in Tumoren später Stadien festgestellt. Der TUNEL Assay wies dieselbe stadienabhängige Reduktion der Anzahl an positiven T-Zellen bei Tumorprogression auf. CD4+ Zellen zeigten eine wesentlich höhere Anzahl an TUNEL positiven Zellen (30±3%) als die CD8+ Zellen (22,5±2,8% bei Patienten früher Stadien) (Abbildung 3.45.). Eine höhere Anzahl tumor-infiltrierender Lymphozyten wies eine apoptotische TUNEL Färbung verglichen mit einer TNFR I Färbung in Tumoren früher Stadien auf. Dagegen zeigten TILs im Tumorgewebe später Stadien keine signifikanten Unterschiede in beiden Färbungen. 105
38 0,35 Ratio tumor-infiltrierender Lymphozyten 0,3 0,25 0,2 0,15 0,1 0,05 0 TNFRI/CD4 TNFRI/CD8 Tunel/CD4 Tunel/CD8 Stadien I/II (n=5) 0,275 0,2 0,3 0,225 Stadien III/IV (n=5) 0,2 0,175 0,175 0,175 Abbildung Anteil TNFR I- und TUNEL- positiver TILs. Der Anteil an TNFR I exprimierenden Zellen in beiden T-Zellpopulationen zeigte einen stadienabhängigen Charakter. T-Lymphozyten in Tumoren früher Stadien zeigten eine höhere Rate an TNFR I positiven Zellen (27,5±3% für CD4+ und 20±2,8% für CD8+ T-Zellen) als die in fortgeschrittenen Stadien (20±1,7% % für CD4+ T-Zellen und 17,1±2% für CD8+ T-Zellen). Keine signifikanten Unterschiede in der Anzahl TNFR I positiver TILs wurden in Tumoren später Stadien festgestellt. Der TUNEL Assay wies dieselbe stadienabhängige Reduktion der Anzahl an positiven T-Zellen bei Tumorprogression auf. CD4+ Zellen zeigten eine wesentlich höhere Anzahl an TUNEL positiven Zellen (30±3%) als die CD8+ Zellen (22,5±2,8% bei Patienten früher Stadien). 106
39 Immunhistochemische Analyse p33ing1b und p29ing4 exprimierender Lymphozyten Als weiteres wurden CD4+ und CD8+ tumor-infiltrierende T-Zellen auf die Anwesenheit von p33ing1b und p29ing4 Antigenen auf ihrer Zelloberfläche untersucht. Im Nierennormalgewebe fanden sich 2,5% der CD4+ und CD8+ Zellen positiv für beide ING Proteine. Während der Entwicklung des Tumors stiegt die Anzahl dieser Zellen signifikant an und sinkte teilweise wieder während der weiteren Tumorprogression. Der Anteil p33ing1b und p29ing4 positiver CD4 Zellen überwiegt mit 28,8±2,2% bzw. 27,5±2,5% deutlich von einem unbedeutenden Anteil entsprechender CD8+ T-Zellen (Abbildungen 3.46, und ). 0,45 Ratio von tumorinfiltrierten Lymphozyten 0,4 0,35 0,3 0,25 0,2 0,15 0,1 0,05 0 ING1/CD4 ING1/CD8 ING4/CD4 ING4/CD8 Stadien I/II (n=5) 0,2875 0,1875 0,275 0,15 Stadien III/IV (n=5) 0,16 0,13 0,16 0,13 Niere normal (n=5) 0,025 0,025 0,025 0,025 Abbildung Ratio von p33ing1b und p29ing4 positiven CD4+ bzw. CD8+ tumor-infiltrierenden Lymphozyten stiegt im Tumorgewebe von Tumorpatienten stadienabhängig an. 107
40 Untersuchung der p53, p33ing1b und p29ing4 Expression im Tumorgewebe Real time PCR Analyse der p53, ING1b und ING4 Genexpression Bei der Berechnung der Real-Time PCR Ergebnisse wurden die Daten von drei unabhängigen Probeläufen sowie Doppelansätzen berücksichtigt. Für die graphische Darstellung wurde die Genexpression im Tumor anhand solcher im Normalgewebe normalisiert. Die Daten für normales Gewebe wurden später abgezogen und sind in den Graphiken nicht dargestellt. Für die Bestimmung des relativen p53, ING1b und ING4 Genexpressionsniveaus im Tumorgewebe der Tumorpatienten wurden Gewebeproben von 41 Patienten verschiedener Stadien nach der Robson Klassifikation untersucht. Die Genexpression dieser Proteine wurde stadienabhängig reguliert. Das p53-gen wurde im Tumor herabreguliert. Beide ING1b- und ING4-Gene wurden dagegen in frühen Tumorstadien hochreguliert. Die Genexpression von ING4 erreichte dabei viel höhere Werte als die des ING1b. Die Expression der beiden Gene im Tumorgewebe fortgeschrittener Karzinomen zeigten eine Herrunterregulation (Abbildung 3.47.). 2,00 Fold Difference 1,50 1,00 0,50 p53 ING1b INg4 Stadien I/II (n=26) 0,81 1,19 1,66 Stadien III/IV (n=15) 0,94 0,59 0,63 Niere normal (n=30) 1,00 1,00 1,00 Abbildung p53, ING1b und ING4 Genexressionsanalyse. Die Genexpression dieser Proteine wurde stadienabhängig reguliert. Das p53-gen wurde im Tumor herabreguliert. Beide ING1- und ING4-Gene wurden dagegen in frühen Tumorstadien hochreguliert. Die Genexpression von ING4 erreichte dabei viel höhere Werte als die des ING1. Nicht alle Tumore wiesen eine eindeutige stadienabhängige Tendenz für ING1b und ING4 Expression auf. In frühen Stadien zeigten 41% der Patienten eine signifikante Überexpression von ING1b und 31% der Patienten eine signifikante Überexpression von ING4 (Abbildung 3.49.); in späten Stadien waren es 40% und entsprechend 33% (Abbildung 3.50.). 108
41 41% 59% ING1b überexprimiert ING1b herrunterreguliert 31% ING4 überexprimiert ING4 herrunterreguliert 69% Abbildung Prozentuelle Anzahl von Tumorpatienten frühen Stadien mit verschiedener p33ing1b und p29ing4 Expressionshöhe. 40% ING1b überexprimiert ING1b herrunterreguliert 60% 33% 67% ING4 überexprimiert ING4 herrunterreguliert Abbildung Prozentuelle Anzahl von Tumorpatienten späten Stadien mit verschiedener p33ing1b und p29ing4 Expressionshöhe Immunhistologische Analyse der p53, p33ing1b und p29ing4 Immunhistologische Schnitte von neun Tumorpatienten (n=5 Stadien I/II und n=4 Stadien III/IV) wurden semiquantitativ analysiert. In höhen Tumorstadien fand sich eine Anreichung von p53, p33ing1b und p29ing4 Proteinen. p53 wurde in frühen und fortgeschrittenen Stadien der Krankheit in 5±1,5% und entsprechend 15±3,6% der Tumorzellen detektiert, nicht aber im Normalgewebe oder. Dagegen wurden beide ING Proteine verglichen mit Normalgewebe verstärkt im Tumorgewebe nachgewiesen. Die Anzahl p33ing1b positiver Tumorzellen betrug in frühen 109
42 Stadien 13,2±2,7% und in späten Stadien 22,2±5,1%, wobei die Anzahl p29ing4 positiver Tumorzellen entsprechend 21±4% und 38,4±7,3% war. Tabelle 3.2. Semiquantitative immunhistologische Analyse des Nierengewebes von Tumorpatienten auf p53, p33ing1b und p29ing4 Proteinexpression Normale Niere (%) Stadien I/II (%) Stadien III/IV (%) p53 - (0) + (5±1,5) + (15±3,6) p33ing1 + (5±1) + (13,2±2,7) ++ (22,2±5,1) p29ing4 + (5±1,4) ++ (21±4) +++ (38,4±7,3) A Abbildung p53 immunhistologische Färbung bei einem Tumorpatient im Stadium I (A) und Stadium III (B). Einige der Tumorpatienten in hohen Tumorstadien wiesen eine Anreichung des p53 Proteins auf. B A B Abbildung p33ing1b immunhistologische Färbung bei einem Tumorpatient im Stadium I (A) und Stadium III (B). Einige der Tumorpatienten in hohen Tumorstadien wiesen eine Anreichung des p33ing1 Proteins auf. 110
43 A Abbildung p29ing4 immunhistologische Färbung bei einem Tumorpatient im Stadium I (A) und Stadium III (B). Einige der Tumorpatienten in hohen Tumorstadien wiesen eine Anreichung des p29ing4 Proteins auf. B Dabei zeigte sich für beide ING Proteinen sowohl ein zytoplasmatisches als auch ein nukleäres Expressionsmuster, wobei in Karzinomen der Stadien I/II ein nukleäres Färbemuster dominierte und in Patienten vorgeschrittener Stadien sich auch zytoplasmatisches p33ing1b und p29ing4 Protein zunehmend zeigte. Die Immunfluoreszenz und immunhistologische Färbung des p29ing4 Proteins waren wesentlich intensiver als p33ing1 im Tumorgewebe aller Stadien. DAB x1000 DAB x1000 DAB x1000 DAB x1000 DAPI+Cy3 x1000 DAPI+Cy3 x1000 DAPI+Cy3 x1000 DAPI+Cy3 x1000 A B C D Abbildung Immunfluoreszenz und immunhistologische Färbung des p33ing1b Proteins im Tumorgewebe eines Tumorpatienten Stadium I (A) und III (C); Immunfluoreszenz und immunhistologische Färbung des p29ing4 Proteins im Tumorgewebe eines Tumorpatienten Stadium I (B) und III (D). Die Immunfluoreszenz und immunhistologische Färbung des p29ing4 Proteins waren wesentlich intensiver als p33ing1 im Tumorgewebe aller Stadien. Dabei zeigte sich für beide ING Proteinen sowohl ein zytoplasmatisches als auch ein nukleäres Expressionsmuster, wobei in Karzinomen der Stadien I/II ein nukleäres Färbemuster dominierte und in Patienten vorgeschrittener Stadien sich auch zytoplasmatisches p33ing1b und p29ing4 Protein zunehmend zeigte. 111
4. Diskussion DISKUSSION Immuntherapie von Tumoren
 4. Diskussion 4.1. Immuntherapie von Tumoren Immunologische Therapieansätze stellen bei der Behandlung von Tumoren ein attraktives Konzept dar, vor allem wegen der Möglichkeit eines selektiven Angriffs
4. Diskussion 4.1. Immuntherapie von Tumoren Immunologische Therapieansätze stellen bei der Behandlung von Tumoren ein attraktives Konzept dar, vor allem wegen der Möglichkeit eines selektiven Angriffs
p33ing1b und p29ing4 Tumorsuppressorproteine beim Nierenzellkarzinom: Analyse T-Zell-vermittelter Tumorimmunantworten
 p33ing1b und p29ing4 Tumorsuppressorproteine beim Nierenzellkarzinom: Analyse T-Zell-vermittelter Tumorimmunantworten Dissertation zur Erlangung des naturwissenschaftlichen Doktorgrades der Bayerischen
p33ing1b und p29ing4 Tumorsuppressorproteine beim Nierenzellkarzinom: Analyse T-Zell-vermittelter Tumorimmunantworten Dissertation zur Erlangung des naturwissenschaftlichen Doktorgrades der Bayerischen
III. Ergebnisteil CD8 CD4. III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut
 27 III. Ergebnisteil III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut Durch Anwendung des vorher schon im Material- und Methodenteil beschriebenen MACS-Systems konnten CD4 + bzw.
27 III. Ergebnisteil III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut Durch Anwendung des vorher schon im Material- und Methodenteil beschriebenen MACS-Systems konnten CD4 + bzw.
3.1 Ergebnisse des endoskopischen Screenings. Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals-
 32 3. Ergebnisse 3.1 Ergebnisse des endoskopischen Screenings Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals- Tumorpatienten eine einmalige Videoösophagoskopie mit routinemäßigen
32 3. Ergebnisse 3.1 Ergebnisse des endoskopischen Screenings Im Zeitraum von Mai 2000 bis August 2001 wurde bei insgesamt 148 Kopf-Hals- Tumorpatienten eine einmalige Videoösophagoskopie mit routinemäßigen
Inaugural-Dissertation zur Erlangung der medizinischen Doktorwürde an der Charité - Universitätsmedizin Berlin
 Charité - Universitätsmedizin Berlin Campus Benjamin Franklin Aus der Medizinischen Klinik III Direktor: Prof. Dr. med. Eckhard Thiel Unterschiede in der T-Zell-Immunität gegen die Tumorantigene EpCAM,
Charité - Universitätsmedizin Berlin Campus Benjamin Franklin Aus der Medizinischen Klinik III Direktor: Prof. Dr. med. Eckhard Thiel Unterschiede in der T-Zell-Immunität gegen die Tumorantigene EpCAM,
Tumorimmunologie. Querschnitt Immunologie-Infektiologie Mittwochs Uhr Hörsaal 3 (Pathologie) Bergmannsheil. Albrecht Bufe
 Querschnitt Immunologie-Infektiologie Mittwochs 10.15 Uhr Hörsaal 3 (Pathologie) Bergmannsheil Tumorimmunologie Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Eigenschaften von Tumorzellen Fehlerhafte/keine
Querschnitt Immunologie-Infektiologie Mittwochs 10.15 Uhr Hörsaal 3 (Pathologie) Bergmannsheil Tumorimmunologie Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Eigenschaften von Tumorzellen Fehlerhafte/keine
Die immunsuppressive Wirkung von Tumormetaboliten auf humane T-Zellen
 Die immunsuppressive Wirkung von Tumormetaboliten auf humane T-Zellen Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften (Dr. rer. nat.) der Naturwissenschaftlichen Fakultät III - Biologie
Die immunsuppressive Wirkung von Tumormetaboliten auf humane T-Zellen Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften (Dr. rer. nat.) der Naturwissenschaftlichen Fakultät III - Biologie
Natürliche Killerzellen. Welche Rolle spielen Sie in der Immunabwehr?
 6. Februar 2013 Natürliche Killerzellen Welche Rolle spielen Sie in der Immunabwehr? Dr. med. Volker von Baehr Institut für Medizinische Diagnostik Berlin, Nicolaistraße 22, 12247 Berlin +49 3077001-220,
6. Februar 2013 Natürliche Killerzellen Welche Rolle spielen Sie in der Immunabwehr? Dr. med. Volker von Baehr Institut für Medizinische Diagnostik Berlin, Nicolaistraße 22, 12247 Berlin +49 3077001-220,
Immunbiologie. Teil 3
 Teil 3 Haupthistokompatibilitätskomplex (1): - es gibt einen grundlegenden Unterschied, wie B-Lymphozyten und T-Lymphozyten ihr relevantes Antigen erkennen - B-Lymphozyten binden direkt an das komplette
Teil 3 Haupthistokompatibilitätskomplex (1): - es gibt einen grundlegenden Unterschied, wie B-Lymphozyten und T-Lymphozyten ihr relevantes Antigen erkennen - B-Lymphozyten binden direkt an das komplette
3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome
 3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome Untersucht wurden insgesamt 26 Melanome, die zwischen 1991 und 1997 in der Universitätsklinik und Poliklinik für Dermatologie und Venerologie
3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome Untersucht wurden insgesamt 26 Melanome, die zwischen 1991 und 1997 in der Universitätsklinik und Poliklinik für Dermatologie und Venerologie
22. Februar Wie wirken immunstimulierende Präparate im Organismus? Wie kann man den Therapieerfolg messen?
 22. Februar 2012 Wie wirken immunstimulierende Präparate im Organismus? Wie kann man den Therapieerfolg messen? Dr. med. Volker von Baehr Institut für Medizinische Diagnostik Berlin, Nicolaistraße 22,
22. Februar 2012 Wie wirken immunstimulierende Präparate im Organismus? Wie kann man den Therapieerfolg messen? Dr. med. Volker von Baehr Institut für Medizinische Diagnostik Berlin, Nicolaistraße 22,
EliSpot in der Borreliose-Diagnostik
 EliSpot in der Borreliose-Diagnostik 27.02.2016 Update Lyme Disease for Practitioners BCA-clinic Augsburg Infektion - Infektionserkrankung Invasion und Vermehrung von Mikroorganismen im menschlichen Organismus
EliSpot in der Borreliose-Diagnostik 27.02.2016 Update Lyme Disease for Practitioners BCA-clinic Augsburg Infektion - Infektionserkrankung Invasion und Vermehrung von Mikroorganismen im menschlichen Organismus
Veränderungen des Immunsystems im Alter
 Veränderungen des Immunsystems im Alter Prof. Ulrich Sack Institut für Klinische Immunologie und Transfusionsmedizin Universitätsklinikum Leipzig Immunseneszenz Altersabhängige Restrukturierung nahezu
Veränderungen des Immunsystems im Alter Prof. Ulrich Sack Institut für Klinische Immunologie und Transfusionsmedizin Universitätsklinikum Leipzig Immunseneszenz Altersabhängige Restrukturierung nahezu
Charakterisierung von CD25+ regulatorischen T Zellen
 Charakterisierung von CD25+ regulatorischen T Zellen Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften (Dr. rer. nat.) eingereicht im Fachbereich Biologie, Chemie,
Charakterisierung von CD25+ regulatorischen T Zellen Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften (Dr. rer. nat.) eingereicht im Fachbereich Biologie, Chemie,
Bedeutung der Zytokindiagnostik bei Tumorpatienten Dr. rer. nat. Cornelia Doebis IMD Berlin
 Bedeutung der Zytokindiagnostik bei Tumorpatienten Dr. rer. nat. Cornelia Doebis IMD Berlin Zytokine Interferone Tumornekrosefaktoren IFN-g Interleukine IL-2 Chemokine RANTES TNF-a Wachstumsfaktoren GM-CSF
Bedeutung der Zytokindiagnostik bei Tumorpatienten Dr. rer. nat. Cornelia Doebis IMD Berlin Zytokine Interferone Tumornekrosefaktoren IFN-g Interleukine IL-2 Chemokine RANTES TNF-a Wachstumsfaktoren GM-CSF
Zusammenfassung. Bei Patienten mit PAH zeigte sich in Lungengewebe eine erhöhte Expression von PAR-1 und PAR-2. Aktuelle Arbeiten weisen darauf
 Zusammenfassung Die pulmonal arterielle Hypertonie (PAH) ist eine schwerwiegende, vaskuläre Erkrankung, die mit einer hohen Sterblichkeit einhergeht. Die zugrundeliegenden Pathomechanismen sind multifaktoriell
Zusammenfassung Die pulmonal arterielle Hypertonie (PAH) ist eine schwerwiegende, vaskuläre Erkrankung, die mit einer hohen Sterblichkeit einhergeht. Die zugrundeliegenden Pathomechanismen sind multifaktoriell
Kulturen von humanen Nabelschnur-Endothelzellen (HUVEC) produzieren konstant Endothelin-1 (ET-1) und geben dieses in das Kulturmedium ab.
 4 ERGEBNISSE 4.1 Endothelin Kulturen von humanen Nabelschnur-Endothelzellen (HUVEC) produzieren konstant Endothelin-1 (ET-1) und geben dieses in das Kulturmedium ab. 4.1.1 Dosisabhängige Herabregulation
4 ERGEBNISSE 4.1 Endothelin Kulturen von humanen Nabelschnur-Endothelzellen (HUVEC) produzieren konstant Endothelin-1 (ET-1) und geben dieses in das Kulturmedium ab. 4.1.1 Dosisabhängige Herabregulation
Medium CCL21. BALB/c 129Sv
 1 CCL21 1 Medium 75 5 75 5 BALB/c 129Sv 25 25 Abbildung 12: Chemotaktisches Antwortprofil verschiedener zytokinproduziererender CD4 + T- Zellsubpopulationen ex vivo zu CCL21 von BALB/c und 129Sv-Mäusen.
1 CCL21 1 Medium 75 5 75 5 BALB/c 129Sv 25 25 Abbildung 12: Chemotaktisches Antwortprofil verschiedener zytokinproduziererender CD4 + T- Zellsubpopulationen ex vivo zu CCL21 von BALB/c und 129Sv-Mäusen.
5 Ergebnisse. 5.1 Statistik. 5.2 Kalibrierung. Ergebnisse 49
 Ergebnisse 49 5 Ergebnisse 5.1 Statistik Der Kolmogorov-Smirnow-Test ist ein statistischer Test auf Übereinstimmung zweier Wahrscheinlichkeitsverteilungen. Das kann ein Vergleich der Verteilungen zweier
Ergebnisse 49 5 Ergebnisse 5.1 Statistik Der Kolmogorov-Smirnow-Test ist ein statistischer Test auf Übereinstimmung zweier Wahrscheinlichkeitsverteilungen. Das kann ein Vergleich der Verteilungen zweier
4.2 Kokulturen Epithelzellen und Makrophagen
 Ergebnisse 4.2 Kokulturen Epithelzellen und Makrophagen Nach der eingehenden Untersuchung der einzelnen Zelllinien wurden die Versuche auf Kokulturen aus den A549-Epithelzellen und den Makrophagenzelllinien
Ergebnisse 4.2 Kokulturen Epithelzellen und Makrophagen Nach der eingehenden Untersuchung der einzelnen Zelllinien wurden die Versuche auf Kokulturen aus den A549-Epithelzellen und den Makrophagenzelllinien
Immunologie. Entwicklung der T- und B- Lymphozyten. Vorlesung 4: Dr. Katja Brocke-Heidrich. Die Entwicklung der T-Lymphozyten
 Immunologie Vorlesung 4: Entwicklung der T- und B- Lymphozyten T-Zellen entwickeln sich im Thymus B-Zellen entwickeln sich im Knochenmark (engl. bone marrow, aber eigentlich nach Bursa fabricius) Dr. Katja
Immunologie Vorlesung 4: Entwicklung der T- und B- Lymphozyten T-Zellen entwickeln sich im Thymus B-Zellen entwickeln sich im Knochenmark (engl. bone marrow, aber eigentlich nach Bursa fabricius) Dr. Katja
Anhang 130. Viral oder immunologisch induzierte, zytokinvermittelte Myokarditis im Tiermodell 9
 Anhang 130 Anhang I. Abbildungsverzeichnis Abbildung 1: Abbildung 2: Abbildung 3: Abbildung 4: Abbildung 6: Abbildung 7: Abbildung 8: Abbildung 9: Abbildung 10: Abbildung 11: Viral oder immunologisch induzierte,
Anhang 130 Anhang I. Abbildungsverzeichnis Abbildung 1: Abbildung 2: Abbildung 3: Abbildung 4: Abbildung 6: Abbildung 7: Abbildung 8: Abbildung 9: Abbildung 10: Abbildung 11: Viral oder immunologisch induzierte,
3. Ergebnisse. 3.1 Zytokinkonzentrationen
 3. Ergebnisse 3.1 Zytokinkonzentrationen Die gemessenen Zytokinkonzentrationen für alle drei Messzeitpunkte (Mittelwert mit Standardfehler, Median) sind dem Tabellenanhang zu entnehmen. Es sind Werte für
3. Ergebnisse 3.1 Zytokinkonzentrationen Die gemessenen Zytokinkonzentrationen für alle drei Messzeitpunkte (Mittelwert mit Standardfehler, Median) sind dem Tabellenanhang zu entnehmen. Es sind Werte für
Ergebnisse und Interpretation 54
 Ergebnisse und Interpretation 54 4 Ergebnisse In den Abbildungen 24/4.1 bis 29/4.1 werden die Laktat-Geschwindigkeits-Kurve und die Herzfrequenzwerte der beiden Schwimmgruppen (Männer: n=6, Frauen: n=8)
Ergebnisse und Interpretation 54 4 Ergebnisse In den Abbildungen 24/4.1 bis 29/4.1 werden die Laktat-Geschwindigkeits-Kurve und die Herzfrequenzwerte der beiden Schwimmgruppen (Männer: n=6, Frauen: n=8)
4 Ergebnisse. 4.1 Charakterisierung der Probanden
 30 4 Ergebnisse 4.1 Charakterisierung der Probanden Das untersuchte Kollektiv von 16 Probanden bestand aus gesunden, glukosetoleranten, nicht stark übergewichtigen Personen. Die demographischen Charakteristika
30 4 Ergebnisse 4.1 Charakterisierung der Probanden Das untersuchte Kollektiv von 16 Probanden bestand aus gesunden, glukosetoleranten, nicht stark übergewichtigen Personen. Die demographischen Charakteristika
Diskussion. 4. Diskussion
 4. Diskussion Das Nierenzellkarzinom (NZK) ist in den westlichen Industriestaaten das 10. häufigste solide Malignom mit einer derzeitigen Inzidenz von ca. 8 pro 100.000 und steigender Tendenz. Die weltweite
4. Diskussion Das Nierenzellkarzinom (NZK) ist in den westlichen Industriestaaten das 10. häufigste solide Malignom mit einer derzeitigen Inzidenz von ca. 8 pro 100.000 und steigender Tendenz. Die weltweite
Gewebeproben von 52 Tumoren der Niere und 52 Proben von Nierennormalgewebe wurden mittels TRAP-Assay auf Telomeraseaktivität untersucht.
 37 3 ERGEBNISSE 3.1 Telomeraseaktivität bei Nierentumoren Gewebeproben von 52 Tumoren der Niere und 52 Proben von Nierennormalgewebe wurden mittels TRAP-Assay auf Telomeraseaktivität untersucht. Die histologische
37 3 ERGEBNISSE 3.1 Telomeraseaktivität bei Nierentumoren Gewebeproben von 52 Tumoren der Niere und 52 Proben von Nierennormalgewebe wurden mittels TRAP-Assay auf Telomeraseaktivität untersucht. Die histologische
Chicago News: Aktuelles vom ACR 2011: B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß
 Chicago News: Aktuelles vom ACR 2011 B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß Frankfurt am Main (22. November 2011) - Auf dem diesjährigen ACR-Kongress untermauerten gleich drei Studien
Chicago News: Aktuelles vom ACR 2011 B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß Frankfurt am Main (22. November 2011) - Auf dem diesjährigen ACR-Kongress untermauerten gleich drei Studien
Von der Gemeinsamen Naturwissenschaftlichen Fakultät. der Technischen Universität Carolo-Wilhelmina. zu Braunschweig. zur Erlangung des Grades einer
 Untersuchungen zu molekularen und zellulären Interaktionen im Prozeß der Eliminierung von Lebermetastasen in einem murinen Zell-vermittelten Therapiemodell Von der Gemeinsamen Naturwissenschaftlichen Fakultät
Untersuchungen zu molekularen und zellulären Interaktionen im Prozeß der Eliminierung von Lebermetastasen in einem murinen Zell-vermittelten Therapiemodell Von der Gemeinsamen Naturwissenschaftlichen Fakultät
5 Zusammenfassung. Zusammenfassung 76
 Zusammenfassung 76 5 Zusammenfassung 1. Aminosäuren sind als Bausteine der Proteine essentiell zur Aufrechterhaltung vitaler Prozesse. Eine besondere Rolle im Zellmetabolismus der Haut spielen dabei kationische
Zusammenfassung 76 5 Zusammenfassung 1. Aminosäuren sind als Bausteine der Proteine essentiell zur Aufrechterhaltung vitaler Prozesse. Eine besondere Rolle im Zellmetabolismus der Haut spielen dabei kationische
Tab.3: Kontrollgruppe: Glukose- und Insulin-Serumkonzentration sowie Insulinbindung pro 1 Million Monozyten (n=3) während der Infusion von 0,9% NaCl
 4 Ergebnisse 4.1 Kontrollgruppe Bei den Untersuchungen der Kontrollgruppe wurde keine Veränderung der Insulinbindung der Monozyten festgestellt. (P>,; n.s.; t-test für verbundene Stichproben) Während der
4 Ergebnisse 4.1 Kontrollgruppe Bei den Untersuchungen der Kontrollgruppe wurde keine Veränderung der Insulinbindung der Monozyten festgestellt. (P>,; n.s.; t-test für verbundene Stichproben) Während der
Medizinische Immunologie. Vorlesung 6 Effektormechanismen
 Medizinische Immunologie Vorlesung 6 Effektormechanismen Effektormechanismen Spezifische Abwehrmechanismen Effektormechanismen der zellulären Immunantwort - allgemeine Prinzipien - CTL (zytotoxische T-Lymphozyten)
Medizinische Immunologie Vorlesung 6 Effektormechanismen Effektormechanismen Spezifische Abwehrmechanismen Effektormechanismen der zellulären Immunantwort - allgemeine Prinzipien - CTL (zytotoxische T-Lymphozyten)
4.1 Untersuchungen zur Validität der p24-bestimmung im Stuhl mittels ELISA und Säuredissoziation
 4 ERGEBNISSE 4.1 Untersuchungen zur Validität der p24-bestimmung im Stuhl mittels ELISA und Säuredissoziation Für den Nachweis von p24 im Stuhl wurde ein ELISA-Testkit verwendet, der primär zur p24-bestimmung
4 ERGEBNISSE 4.1 Untersuchungen zur Validität der p24-bestimmung im Stuhl mittels ELISA und Säuredissoziation Für den Nachweis von p24 im Stuhl wurde ein ELISA-Testkit verwendet, der primär zur p24-bestimmung
4 Ergebnisse. 4.1 Patienten und Kontrollgruppe. 4.2 Gesamt-IgE und spezifisches IgE Gesamt-IgE Spezifisches IgE.
 4 Ergebnisse 4.1 Patienten und Kontrollgruppe Das in die Untersuchung aufgenommene Patientenkollektiv (AD-Patienten) umfasste 27 Patienten im Alter von 19 61 Jahren (Mittelwert: 33,9 Jahre) mit der Diagnose
4 Ergebnisse 4.1 Patienten und Kontrollgruppe Das in die Untersuchung aufgenommene Patientenkollektiv (AD-Patienten) umfasste 27 Patienten im Alter von 19 61 Jahren (Mittelwert: 33,9 Jahre) mit der Diagnose
Grundlagen der Immunologie
 Grundlagen der Immunologie 11. Vorlesung Zytokine und ihre Rezeptoren Fundamentale Eigenschaften der Zytokine Niedriges Molekulargewicht (10-40 kda) Glykoproteine werden von isolierten Zellen nach Aktivierung
Grundlagen der Immunologie 11. Vorlesung Zytokine und ihre Rezeptoren Fundamentale Eigenschaften der Zytokine Niedriges Molekulargewicht (10-40 kda) Glykoproteine werden von isolierten Zellen nach Aktivierung
Wie interpretiert man den quantitativen Immunstatus?
 Wie interpretiert man den quantitativen Immunstatus? Vorstellung von Befunden aus den Bereichen Tumorimmunität, chronische Infektion und Autoimmunerkrankungen 18. Mai 2016 Dr. med. Volker von Baehr Institut
Wie interpretiert man den quantitativen Immunstatus? Vorstellung von Befunden aus den Bereichen Tumorimmunität, chronische Infektion und Autoimmunerkrankungen 18. Mai 2016 Dr. med. Volker von Baehr Institut
Ergebnisse Immunhistochemie
 3.2.2.6 Immunhistochemie Zum Nachweis von Mikrometasasen wurden Antikörper gegen humanes Zytokeratin verwendet. Da alle implantierten Tumorgewebe epithelialen Ursprungs waren, konnte dieser Marker bei
3.2.2.6 Immunhistochemie Zum Nachweis von Mikrometasasen wurden Antikörper gegen humanes Zytokeratin verwendet. Da alle implantierten Tumorgewebe epithelialen Ursprungs waren, konnte dieser Marker bei
Immunologische Laboruntersuchung bei Tumorpatienten. 9. November Dr. med. Volker von Baehr
 Immunologische Laboruntersuchung bei Tumorpatienten 9. November 2016 Dr. med. Volker von Baehr Institut für Medizinische Diagnostik Berlin www.imd-berlin.de Unspezifisches Immunsystem (angeboren) Spezifisches
Immunologische Laboruntersuchung bei Tumorpatienten 9. November 2016 Dr. med. Volker von Baehr Institut für Medizinische Diagnostik Berlin www.imd-berlin.de Unspezifisches Immunsystem (angeboren) Spezifisches
Übersicht: T-Zell-unabhängige und T-Zellabhängige. Humorales Gedächtnis
 Übersicht: T-Zell-unabhängige und T-Zellabhängige B-Zellaktivierung Humorales Gedächtnis Fachmodul Immunologie November 2010 Melanie Haars Übersicht I. Einleitung II. B-Zellaktivierung T-Zell-unabhängige
Übersicht: T-Zell-unabhängige und T-Zellabhängige B-Zellaktivierung Humorales Gedächtnis Fachmodul Immunologie November 2010 Melanie Haars Übersicht I. Einleitung II. B-Zellaktivierung T-Zell-unabhängige
3. ERGEBNISSE. 3.1 Kontrollgruppe
 3. ERGEBNISSE 3.1 Kontrollgruppe In der Kontrollgruppe standen 20 Serumproben von 20 gesunden Personen zur Verfügung. Die Altersspanne betrug 19 60 Jahre (Mittelwert: 33,5). Das Verhältnis männlich zu
3. ERGEBNISSE 3.1 Kontrollgruppe In der Kontrollgruppe standen 20 Serumproben von 20 gesunden Personen zur Verfügung. Die Altersspanne betrug 19 60 Jahre (Mittelwert: 33,5). Das Verhältnis männlich zu
Stellungnahme zur Ernährung von Tumorpatienten auf der Grundlage der "Anti TKTL1 - Diät"
 Deutsche Krebsgesellschaft Stellungnahme zur Ernährung von Tumorpatienten auf der Grundlage der "Anti TKTL1 - Diät" Berlin (18. März 2010) - Tumorpatienten wird derzeit ein neues Ernährungsprinzip mit
Deutsche Krebsgesellschaft Stellungnahme zur Ernährung von Tumorpatienten auf der Grundlage der "Anti TKTL1 - Diät" Berlin (18. März 2010) - Tumorpatienten wird derzeit ein neues Ernährungsprinzip mit
3. Ergebnisse Charakterisierung des Untersuchungsmaterials
 - 14-3. Ergebnisse 3.1. Charakterisierung des Untersuchungsmaterials Untersucht wurden 76 Basaliome von Patienten, die in der Hautklinik der Martin- Luther-Universität Halle-Wittenberg operativ entfernt
- 14-3. Ergebnisse 3.1. Charakterisierung des Untersuchungsmaterials Untersucht wurden 76 Basaliome von Patienten, die in der Hautklinik der Martin- Luther-Universität Halle-Wittenberg operativ entfernt
Angeborene und erworbene Immunantwort
 Molekulare Mechanismen der Pathogenese bei Infektionskrankheiten Angeborene und erworbene Immunantwort Hans-Georg Kräusslich Abteilung Virologie, Hygiene Institut INF 324, 4.OG http://www.virology-heidelberg.de
Molekulare Mechanismen der Pathogenese bei Infektionskrankheiten Angeborene und erworbene Immunantwort Hans-Georg Kräusslich Abteilung Virologie, Hygiene Institut INF 324, 4.OG http://www.virology-heidelberg.de
Grundlagen der Immunologie
 Grundlagen der Immunologie 10. Vorlesung Zytokine und ihre Rezeptoren Es gibt 2 typen der Zell-Zell-Interaktion in dem Immunabwehr 1. Direkt Zell-Zell Verbindung durch Adhäsionmolekülen 2. Wechselwirkung
Grundlagen der Immunologie 10. Vorlesung Zytokine und ihre Rezeptoren Es gibt 2 typen der Zell-Zell-Interaktion in dem Immunabwehr 1. Direkt Zell-Zell Verbindung durch Adhäsionmolekülen 2. Wechselwirkung
KREBS-RISIKO (TUMORMARKER)
 KREBS-RISIKO ((TUMORMARKER)) Deutschland gehört zu den Ländern mit der höchsten Lebenserwartung. Jeder Mensch ist vermutlich besorgt, ob er dieses in Aussicht stehende hohe Alter auch bei guter Gesundheit
KREBS-RISIKO ((TUMORMARKER)) Deutschland gehört zu den Ländern mit der höchsten Lebenserwartung. Jeder Mensch ist vermutlich besorgt, ob er dieses in Aussicht stehende hohe Alter auch bei guter Gesundheit
Immunbiologie. Teil 4
 Teil 4 Funktion der lymphatischen Organe: - es werden drei Arten von lymphatischen Organen unterschieden: - primäre, sekundäre und tertiäre lymphatische Organe - die Organe unterscheiden sich in ihrer
Teil 4 Funktion der lymphatischen Organe: - es werden drei Arten von lymphatischen Organen unterschieden: - primäre, sekundäre und tertiäre lymphatische Organe - die Organe unterscheiden sich in ihrer
Grundlagen der Immunologie
 Grundlagen der Immunologie 11-12. Vorlesung Erster Schritt der spezifischen Immunantwort: T-Zell-Aktivierung, Signaltransduktionswege T-Zell-Polarisierung, Lymphozyten Rezirkulation, Homing Haupstadien
Grundlagen der Immunologie 11-12. Vorlesung Erster Schritt der spezifischen Immunantwort: T-Zell-Aktivierung, Signaltransduktionswege T-Zell-Polarisierung, Lymphozyten Rezirkulation, Homing Haupstadien
Zusammenfassung... I. Abkürzungsverzeichnis... III. Abbildungsverzeichnis... VI. Tabellenverzeichnis... IX. 1 Einleitung... 1
 Inhaltsverzeichnis Zusammenfassung... I Abkürzungsverzeichnis... III Abbildungsverzeichnis... VI Tabellenverzeichnis... IX 1 Einleitung... 1 1.1 Die Leber als zentrales Organ des Stoffwechsels... 2 1.2
Inhaltsverzeichnis Zusammenfassung... I Abkürzungsverzeichnis... III Abbildungsverzeichnis... VI Tabellenverzeichnis... IX 1 Einleitung... 1 1.1 Die Leber als zentrales Organ des Stoffwechsels... 2 1.2
Fläche Stratum. Dicke vitale Epi-
 4. Ergebnisse 4.1. Dicke und Fläche der vitalen Epidermis und des Stratum corneum Um das Ausmaß der Verhornung und der Hyperplasie der Epidermis zu ermitteln, wurden in jedem der fünf unterschiedlich gefärbten
4. Ergebnisse 4.1. Dicke und Fläche der vitalen Epidermis und des Stratum corneum Um das Ausmaß der Verhornung und der Hyperplasie der Epidermis zu ermitteln, wurden in jedem der fünf unterschiedlich gefärbten
CCL5 mediiert Target-Kinase unabhängige Resistenz gegenüber FLT3-Inhibitoren in FLT3-ITD-positive AML
 CCL5 mediiert Target-Kinase unabhängige Resistenz gegenüber FLT3-Inhibitoren in FLT3-ITD-positive AML Silvia Waldeck 1, Michael P. Rassner 1, Philip Keye 1, Miguel Waterhouse 1, Justus Duyster 1,2, Nikolas
CCL5 mediiert Target-Kinase unabhängige Resistenz gegenüber FLT3-Inhibitoren in FLT3-ITD-positive AML Silvia Waldeck 1, Michael P. Rassner 1, Philip Keye 1, Miguel Waterhouse 1, Justus Duyster 1,2, Nikolas
The Journal Club. Immun-Check-Point-Blockade (I-C-P-Blockade) Überlebensbenefit bei kastrationsresistentem Prostatakrebs
 The Journal Club Immun-Check-Point-Blockade (I-C-P-Blockade) Überlebensbenefit bei kastrationsresistentem Prostatakrebs Derzeitige Therapieansätze bei CRPC Doxetacel Cabazitacel (Dreifach-)Hormon-Blockade
The Journal Club Immun-Check-Point-Blockade (I-C-P-Blockade) Überlebensbenefit bei kastrationsresistentem Prostatakrebs Derzeitige Therapieansätze bei CRPC Doxetacel Cabazitacel (Dreifach-)Hormon-Blockade
S erum -C reatinin unter T orasem id. A E Mittelwert+/- Stabw. am Beob.-anfang
 3. Ergebnisse Allgemein soll bereits an dieser Stalle darauf hingewiesen werden, dass neben den in den folgenden Abschnitten gezeigten Abbildungen weitere Tabellen und graphische Darstellungen zur Verbildlichung
3. Ergebnisse Allgemein soll bereits an dieser Stalle darauf hingewiesen werden, dass neben den in den folgenden Abschnitten gezeigten Abbildungen weitere Tabellen und graphische Darstellungen zur Verbildlichung
Tabelle 22: Aktivität der Glutamat-Dehydrogenase im Serum (U/l) aller Tiere über den gesamten Zeitraum.
 4.2.5. Glutamat-Dehydrogenase (GlDH) Tiere mit zystischer Ovardegeneration unterschieden sich auch hinsichtlich der GlDH-Aktivität nicht signifikant von den Tieren, die keine derartige Veränderung aufwiesen.
4.2.5. Glutamat-Dehydrogenase (GlDH) Tiere mit zystischer Ovardegeneration unterschieden sich auch hinsichtlich der GlDH-Aktivität nicht signifikant von den Tieren, die keine derartige Veränderung aufwiesen.
Referat und bibliographische Beschreibung
 Referat und bibliographische Beschreibung Zielsetzung: Bei chronischer Herzinsuffizienz (CHI) könnte bakterielle Translokation vom Darmlumen aus in das portale Stromgebiet vorkommen und als Konsequenz
Referat und bibliographische Beschreibung Zielsetzung: Bei chronischer Herzinsuffizienz (CHI) könnte bakterielle Translokation vom Darmlumen aus in das portale Stromgebiet vorkommen und als Konsequenz
kappa Gensegmente x J Segmente : 40 x 5 = 200 lambda Gensegmente x J Segmente : 30 x 4 = Vh x 27 Dh x 6 Jh Segmente : 65 x 27 x 6 = 11000
 Gene der variablen Regionen werden aus Gensegmenten e DJ-verknüpfte e VJ- oder VDJ-verküpfte aufgebaut leichte Ketten n Die Anzahl funktioneller Gensegmente für die variablen Regionen der schweren und
Gene der variablen Regionen werden aus Gensegmenten e DJ-verknüpfte e VJ- oder VDJ-verküpfte aufgebaut leichte Ketten n Die Anzahl funktioneller Gensegmente für die variablen Regionen der schweren und
IN-VITRO- UND IN-VIVO-STUDIEN ZU IL-12-DEFIZIENTEN DENDRITISCHEN ZELLEN VON PRIMATEN
 IN-VITRO- UND IN-VIVO-STUDIEN ZU IL-12-DEFIZIENTEN DENDRITISCHEN ZELLEN VON PRIMATEN Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften (Dr. rer. nat.) eingereicht im
IN-VITRO- UND IN-VIVO-STUDIEN ZU IL-12-DEFIZIENTEN DENDRITISCHEN ZELLEN VON PRIMATEN Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften (Dr. rer. nat.) eingereicht im
Vitamin D - eine Chance bei Organtransplantationen?
 Vitamin D - eine Chance bei Organtransplantationen? Abschlussbericht der Kooperationsphase 2016/2017 Durchgeführt in Kooperation mit dem Institut für Immunologie: Transplantationsimmunologie, Universität
Vitamin D - eine Chance bei Organtransplantationen? Abschlussbericht der Kooperationsphase 2016/2017 Durchgeführt in Kooperation mit dem Institut für Immunologie: Transplantationsimmunologie, Universität
Die folgende Tabelle 3 zeigt die Basisdaten der 18 Versuchstiere (Tab.3)
 38 7. Ergebnisse 7.1. Basisdaten der Versuchstiere Die folgende Tabelle 3 zeigt die Basisdaten der 18 Versuchstiere (Tab.3) Tab.3: Basisdaten der Versuchstiere Tiere Anzahl n = 18 Alter (Wochen) 20,4 ±
38 7. Ergebnisse 7.1. Basisdaten der Versuchstiere Die folgende Tabelle 3 zeigt die Basisdaten der 18 Versuchstiere (Tab.3) Tab.3: Basisdaten der Versuchstiere Tiere Anzahl n = 18 Alter (Wochen) 20,4 ±
Grundlagen der Immunologie
 Grundlagen der Immunologie 9. Vorlesung Die zentrale (thymische) T-Zell-Entwicklung Alle Blutzellen stammen von der multipotenten hämatopoetischen Stammzelle des Knochenmarks Figure 1-3 Zentrale Lymphozytenentwicklung
Grundlagen der Immunologie 9. Vorlesung Die zentrale (thymische) T-Zell-Entwicklung Alle Blutzellen stammen von der multipotenten hämatopoetischen Stammzelle des Knochenmarks Figure 1-3 Zentrale Lymphozytenentwicklung
Die RT-PCR Untersuchungen wurden anhand 27 Struma nodosa- (siehe Tab. 7) und 15 Adenom- (siehe Tab. 11) Präparaten durchgeführt.
 - 22-4 Ergebnisse 4.1 RT-PCR Die RT-PCR Untersuchungen wurden anhand 27 Struma nodosa- (siehe Tab. 7) und 15 Adenom- (siehe Tab. 11) Präparaten durchgeführt. 4.1.1 Struma nodosa Histologie Fas Fas CD 97
- 22-4 Ergebnisse 4.1 RT-PCR Die RT-PCR Untersuchungen wurden anhand 27 Struma nodosa- (siehe Tab. 7) und 15 Adenom- (siehe Tab. 11) Präparaten durchgeführt. 4.1.1 Struma nodosa Histologie Fas Fas CD 97
Klinische Relevanz des PD-1 Rezeptors beim malignen Melanom
 TECHNISCHE UNIVERSITÄT MÜNCHEN III. Medizinische Klinik und Poliklinik, Klinikum rechts der Isar Klinische Relevanz des PD-1 Rezeptors beim malignen Melanom Kathrin Julia Falchner Vollständiger Abdruck
TECHNISCHE UNIVERSITÄT MÜNCHEN III. Medizinische Klinik und Poliklinik, Klinikum rechts der Isar Klinische Relevanz des PD-1 Rezeptors beim malignen Melanom Kathrin Julia Falchner Vollständiger Abdruck
Regulatorische T-Zellen Funktionsweise und Bedeutung im Kontext verschiedener Erkrankungen. 24. Juni 2015, 15:00 Uhr
 Regulatorische T-Zellen Funktionsweise und Bedeutung im Kontext verschiedener Erkrankungen 24. Juni 2015, 15:00 Uhr Dr. rer. nat. Cornelia Doebis Die Immunantwort ist eine Team-Leistung Leukozyten Granulozyten
Regulatorische T-Zellen Funktionsweise und Bedeutung im Kontext verschiedener Erkrankungen 24. Juni 2015, 15:00 Uhr Dr. rer. nat. Cornelia Doebis Die Immunantwort ist eine Team-Leistung Leukozyten Granulozyten
Abkürzungen...VI. 1 Einleitung Das Immunorgan Darm Das Immunsystem des Darms (GALT)...2
 Inhaltsverzeichnis Abkürzungen...VI 1 Einleitung... 1 1.1 Das Immunorgan Darm... 1 1.1.1 Anatomischer und histologischer Aufbau des Darms... 1 1.1.2 Das Immunsystem des Darms (GALT)...2 1.1.3 Das intestinale
Inhaltsverzeichnis Abkürzungen...VI 1 Einleitung... 1 1.1 Das Immunorgan Darm... 1 1.1.1 Anatomischer und histologischer Aufbau des Darms... 1 1.1.2 Das Immunsystem des Darms (GALT)...2 1.1.3 Das intestinale
4 Ergebnisse. 4.1 Bindung von Peptiden an T2-Zellen Punktwerte der Peptide
 36 4 Ergebnisse 4. Bindung von Peptiden an T2-Zellen 4.. Punktwerte der Peptide Im Rahmen der vorliegenden Arbeit wurden verschiedene Modellantigene herangezogen, um Peptide aus diesen Antigenen für Bindungsstudien
36 4 Ergebnisse 4. Bindung von Peptiden an T2-Zellen 4.. Punktwerte der Peptide Im Rahmen der vorliegenden Arbeit wurden verschiedene Modellantigene herangezogen, um Peptide aus diesen Antigenen für Bindungsstudien
Pathohysiologie und Androgendeprivationtstherapie(ADT) des kastrationsresistenten Prostatakarzinoms
 Pathohysiologie und Androgendeprivationtstherapie(ADT) des kastrationsresistenten Prostatakarzinoms KASTRATIONSRESISTENTES PROSTATAKARZINOM (CRPC) Patienten sprechen im Allgemeinen gut auf eine ADT an.
Pathohysiologie und Androgendeprivationtstherapie(ADT) des kastrationsresistenten Prostatakarzinoms KASTRATIONSRESISTENTES PROSTATAKARZINOM (CRPC) Patienten sprechen im Allgemeinen gut auf eine ADT an.
5 Zusammenfassung und Schlussfolgerung
 5 Zusammenfassung und Schlussfolgerung Einleitung In der Schwangerschaft vollziehen sich Veränderungen des Kohlenhydratstoffwechsels im Sinne einer Insulinresistenz sowie eines Anstieges der Blutfettwerte.
5 Zusammenfassung und Schlussfolgerung Einleitung In der Schwangerschaft vollziehen sich Veränderungen des Kohlenhydratstoffwechsels im Sinne einer Insulinresistenz sowie eines Anstieges der Blutfettwerte.
Untersuchungen zur Zytokinexpression von Patienten mit fortgeschrittenen gynäkologischen Tumoren und Tumoren im Kopf-Hals-Bereich
 Aus der Universitätsklinik und Poliklinik für Strahlentherapie an der Martin-Luther-Universität Halle-Wittenberg (Komm.Direktorin: Frau PD Dr. med. Gabriele Hänsgen) Untersuchungen zur Zytokinexpression
Aus der Universitätsklinik und Poliklinik für Strahlentherapie an der Martin-Luther-Universität Halle-Wittenberg (Komm.Direktorin: Frau PD Dr. med. Gabriele Hänsgen) Untersuchungen zur Zytokinexpression
4 Diskussion. 4.1 Etablierung eines modifizierten ELISPOT-Assays zum ex-vivo Nachweis Tumor-reaktiver T-Zellen
 39 4 Diskussion 4.1 Etablierung eines modifizierten ELISPOT-Assays zum ex-vivo Nachweis Tumor-reaktiver T-Zellen Für den direkten ex-vivo Nachweis von spezifischen T-Zellen stehen inzwischen verschiedene
39 4 Diskussion 4.1 Etablierung eines modifizierten ELISPOT-Assays zum ex-vivo Nachweis Tumor-reaktiver T-Zellen Für den direkten ex-vivo Nachweis von spezifischen T-Zellen stehen inzwischen verschiedene
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten. lymphatische Organe. Erkennungsmechanismen. Lymphozytenentwicklung
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 159 Basale Aufgabe
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 159 Basale Aufgabe
5 Diskussion. 5.1 Synovialgewebe und Synovialflüssigkeit
 5 Diskussion Das Ziel dieser Arbeit war es, die Akkumulation von B-Zellen im chronisch entzündeten Synovialgewebe von Patienten mit RA zu analysieren. Dazu wurde die Verteilung der B-Zellen im Synovialgewebe
5 Diskussion Das Ziel dieser Arbeit war es, die Akkumulation von B-Zellen im chronisch entzündeten Synovialgewebe von Patienten mit RA zu analysieren. Dazu wurde die Verteilung der B-Zellen im Synovialgewebe
männlich 75,7% Abb.1: Geschlechtsverteilung der PAVK Patienten
 5. Ergebnisse 5.1. Alters- und Geschlechtsverteilung Das untersuchte Krankengut umfasste 325 Patienten. 246 (75,7 %) waren männlichen, 79 (24,3 %) weiblichen Geschlechts (Abb. 1). Das Durchschnittsalter
5. Ergebnisse 5.1. Alters- und Geschlechtsverteilung Das untersuchte Krankengut umfasste 325 Patienten. 246 (75,7 %) waren männlichen, 79 (24,3 %) weiblichen Geschlechts (Abb. 1). Das Durchschnittsalter
3.2 Posttranslationelle Modifikation von Wt1 durch Phosphorylierung
 3.2 Posttranslationelle Modifikation von Wt1 durch Phosphorylierung Transkriptionsfaktoren erfahren oft eine posttranslationelle Modifikation in Form von Phosphorylierung und werden dadurch in ihrer Aktivität
3.2 Posttranslationelle Modifikation von Wt1 durch Phosphorylierung Transkriptionsfaktoren erfahren oft eine posttranslationelle Modifikation in Form von Phosphorylierung und werden dadurch in ihrer Aktivität
Wie wirken immunstimulierende Präparate? Wie kann man den Therapieerfolg messen?
 Wie wirken immunstimulierende Präparate? Wie kann man den Therapieerfolg messen? Dr. med. Volker von Baehr Institut für Medizinische Diagnostik Berlin IMD-Berlin.de Immunrestauration oder Immunstimulation?
Wie wirken immunstimulierende Präparate? Wie kann man den Therapieerfolg messen? Dr. med. Volker von Baehr Institut für Medizinische Diagnostik Berlin IMD-Berlin.de Immunrestauration oder Immunstimulation?
T-Zell. Prolymphozytenleukämie
 T-Zell Prolymphozytenleukämie Zytologie Histologie Durchflusszytometrie Prof. Dr. med. Dr. phil. T. Haferlach PD. Dr. med. S. Höller Dr. med. M. Herling, Dr. rer. nat. A. Schrader, P. Mayer Klassische
T-Zell Prolymphozytenleukämie Zytologie Histologie Durchflusszytometrie Prof. Dr. med. Dr. phil. T. Haferlach PD. Dr. med. S. Höller Dr. med. M. Herling, Dr. rer. nat. A. Schrader, P. Mayer Klassische
6. Diskussion. Diskussion
 6. Nachdem Studien gezeigt hatten, das GM-CSF ein geeignetes Adjuvants für genetische Impfstoffe ist, um zelluläre und humorale Immunantworten zu induzieren, wurde dies hier vergleichend für DNA-Impfstoffe
6. Nachdem Studien gezeigt hatten, das GM-CSF ein geeignetes Adjuvants für genetische Impfstoffe ist, um zelluläre und humorale Immunantworten zu induzieren, wurde dies hier vergleichend für DNA-Impfstoffe
Die Analyse TAA-spezifischer T-Zellen ist weder Selbstzweck noch ein rein akademisches Anliegen, sondern soll einerseits helfen, geeignete
 5 1. EINLEITUNG Die Immunogenität von Tumoren und der Einfluss des Immunsystems auf das Tumorwachstum sind seit vielen Jahren Gegenstand intensiver wissenschaftlicher Debatten (1, 2). Seit Jahrzehnten
5 1. EINLEITUNG Die Immunogenität von Tumoren und der Einfluss des Immunsystems auf das Tumorwachstum sind seit vielen Jahren Gegenstand intensiver wissenschaftlicher Debatten (1, 2). Seit Jahrzehnten
5 Diskussion. 5.1 Korrelationen zwischen den verschiedenen Phasen der Insulinsekretion
 55 5 Diskussion Für die Charakterisierung des metabolischen Phänotyps genügt nicht alleine die Feststellung der Glukosetoleranz und die Messung der Insulinwirkung (resistent oder empfindlich), es muß auch
55 5 Diskussion Für die Charakterisierung des metabolischen Phänotyps genügt nicht alleine die Feststellung der Glukosetoleranz und die Messung der Insulinwirkung (resistent oder empfindlich), es muß auch
Monoklonale Antikörper sind Antikörper, immunologisch aktive Proteine, die von einer auf einen einzigen B-Lymphozyten zurückgehenden Zelllinie
 Monoklonale AK Monoklonale Antikörper sind Antikörper, immunologisch aktive Proteine, die von einer auf einen einzigen B-Lymphozyten zurückgehenden Zelllinie (Zellklon) produziert werden und die sich gegen
Monoklonale AK Monoklonale Antikörper sind Antikörper, immunologisch aktive Proteine, die von einer auf einen einzigen B-Lymphozyten zurückgehenden Zelllinie (Zellklon) produziert werden und die sich gegen
6. Anhang ANHANG Immunhistologie und Immunfluoreszenz
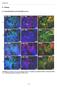 6. nhang 6.1. Immunhistologie und Immunfluoreszenz - FITC IL-2 Cy3 merge IL-2 - FITC IL-2 Cy3 merge IL-2 - FITC IL-10 Cy3 merge IL-10 C - FITC IL-10 Cy3 merge) IL-10 D bbildung 6.1.1. Die IL-2 bzw. IL-10
6. nhang 6.1. Immunhistologie und Immunfluoreszenz - FITC IL-2 Cy3 merge IL-2 - FITC IL-2 Cy3 merge IL-2 - FITC IL-10 Cy3 merge IL-10 C - FITC IL-10 Cy3 merge) IL-10 D bbildung 6.1.1. Die IL-2 bzw. IL-10
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten. lymphatische Organe. Erkennungsmechanismen. Lymphozytenentwicklung
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Basale Aufgabe eines
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Basale Aufgabe eines
2. An&asthma&ka Omalizumab Xolair /Novar&s CHO K1
 2. Antiasthmatika 2. An&asthma&ka Omalizumab Xolair /Novar&s CHO K1 Bei der Typ-I-Allergie oder der Überempfindlichkeit vom Soforttyp ist das zentrale Ereignis die Aktivierung von Mastzellen durch IgE.
2. Antiasthmatika 2. An&asthma&ka Omalizumab Xolair /Novar&s CHO K1 Bei der Typ-I-Allergie oder der Überempfindlichkeit vom Soforttyp ist das zentrale Ereignis die Aktivierung von Mastzellen durch IgE.
3 Ergebnisse zur Prävalenz nach ICD-10
 ICD-C10 C00 C14 Ergebnisse zur 13 3 Ergebnisse zur nach ICD-10 3.1 Mundhöhle und Rachen Kernaussagen Inzidenz und Mortalität: Seit der tausendwende erkrankten jährlich etwa 2.800 und etwa 7.600 an bösartigen
ICD-C10 C00 C14 Ergebnisse zur 13 3 Ergebnisse zur nach ICD-10 3.1 Mundhöhle und Rachen Kernaussagen Inzidenz und Mortalität: Seit der tausendwende erkrankten jährlich etwa 2.800 und etwa 7.600 an bösartigen
Der Haupthistokompatibilitätskomplex (MHC) AG-Erkennung von Ly. Doppelspezifität der T-Ly: AG-Spezifität und MHC-Spezifität
 Der Haupthistokompatibilitätskomplex (MHC) Major Histocompatibility Complex AG-Erkennung von Ly B-Ly: Erkennung unmittelbar der Determinanten von intakten AG T-Ly: in Komplex mit eigenen MHC- Molekülen
Der Haupthistokompatibilitätskomplex (MHC) Major Histocompatibility Complex AG-Erkennung von Ly B-Ly: Erkennung unmittelbar der Determinanten von intakten AG T-Ly: in Komplex mit eigenen MHC- Molekülen
Th1-Th2-Zytokine bei entzündlicher Herzmuskelerkrankung
 Aus der medizinischen Klinik II, Abteilung für Kardiologie und Pulmonologie des Universitätsklinikums Benjamin Franklin der Freien Universität Berlin Direktor: Univ.-Prof. Dr. med. H.-P. Schultheiss Th1-Th2-Zytokine
Aus der medizinischen Klinik II, Abteilung für Kardiologie und Pulmonologie des Universitätsklinikums Benjamin Franklin der Freien Universität Berlin Direktor: Univ.-Prof. Dr. med. H.-P. Schultheiss Th1-Th2-Zytokine
Ergebnisse. Das Rollen polymorphkerniger Granulozyten
 29 Ergebnisse Das Rollen polymorphkerniger Granulozyten Wie in Abb. 9 graphisch dargestellt betrug in der ersten intravitalmikroskopischen Aufnahme der postkapillären Venole, die im Anschluss an die Halsgefäß-
29 Ergebnisse Das Rollen polymorphkerniger Granulozyten Wie in Abb. 9 graphisch dargestellt betrug in der ersten intravitalmikroskopischen Aufnahme der postkapillären Venole, die im Anschluss an die Halsgefäß-
APS, Pathogenese und klinischer Impact auf das spezifische Immunsystems. Dr. Sebastian Pfeiffer, Düsseldorf
 APS, Pathogenese und klinischer Impact auf das spezifische Immunsystems Dr. Sebastian Pfeiffer, Düsseldorf Paul Ehrlich beschrieb schon 1920 mit seinem Horror autotoxicus die Möglichkeit, dass die effizienten
APS, Pathogenese und klinischer Impact auf das spezifische Immunsystems Dr. Sebastian Pfeiffer, Düsseldorf Paul Ehrlich beschrieb schon 1920 mit seinem Horror autotoxicus die Möglichkeit, dass die effizienten
Identifizierung von Zellen des mononukleären phagozytierenden Systems (MPS)
 63 Die Milzen der mit dem Adenovirus FAV1 infizierten Jungmasthühner (Positivkontrollen) wiesen unter Einsatz der Lymphozytenmarker CD3 (Dako), CD3 (Biozol), IgM und IgG deutlich oberflächengefärbte Lymphozyten
63 Die Milzen der mit dem Adenovirus FAV1 infizierten Jungmasthühner (Positivkontrollen) wiesen unter Einsatz der Lymphozytenmarker CD3 (Dako), CD3 (Biozol), IgM und IgG deutlich oberflächengefärbte Lymphozyten
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten. lymphatische Organe. Erkennungsmechanismen. Lymphozytenentwicklung
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Dendritische Zellen
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Dendritische Zellen
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten. lymphatische Organe. Erkennungsmechanismen. Lymphozytenentwicklung
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Makrophagen werden
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Makrophagen werden
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten. lymphatische Organe. Erkennungsmechanismen. Lymphozytenentwicklung
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Dendritische Zellen
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 1 Dendritische Zellen
3.1 Altersabhängige Expression der AGE-Rezeptoren auf mrna und Proteinebene
 3 Ergebnisse 3.1 Altersabhängige Expression der AGE-Rezeptoren auf mrna und Proteinebene 3.1.1 Altersabhängige Genexpression der AGE-Rezeptoren Es wurde untersucht, ob es am menschlichen alternden Herzen
3 Ergebnisse 3.1 Altersabhängige Expression der AGE-Rezeptoren auf mrna und Proteinebene 3.1.1 Altersabhängige Genexpression der AGE-Rezeptoren Es wurde untersucht, ob es am menschlichen alternden Herzen
3.1 Studie A: Genetisch determinierte Hypertonie. Spontan hypertensive Ratte (SHR/Mol) versus Wistar/Han-Ratte
 3 Ergebnisse 3.1 Studie A: Genetisch determinierte Hypertonie Spontan hypertensive Ratte (SHR/Mol) versus Wistar/Han-Ratte 3.1.1 Körper- und Organgewichte Die Daten zu Körpergewicht, linksventrikulärem
3 Ergebnisse 3.1 Studie A: Genetisch determinierte Hypertonie Spontan hypertensive Ratte (SHR/Mol) versus Wistar/Han-Ratte 3.1.1 Körper- und Organgewichte Die Daten zu Körpergewicht, linksventrikulärem
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten. lymphatische Organe. Erkennungsmechanismen. Lymphozytenentwicklung
 Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 142 Basale Aufgabe
Komponenten und Aufbau des Immunsystems Initiation von Immunantworten lymphatische Organe Erkennungsmechanismen Lymphozytenentwicklung Entstehung und Verlauf adaptiver Immunantworten 142 Basale Aufgabe
T-Zellen werden zur Kontrolle intrazellulärer Pathogene benötigt und um B Zellen gegen die meisten Antigene zu aktivieren
 Komponenten und Aufbau des Immunsystems bakterielle Toxine spezifische Antikörper Bakterien im extrazellulären Raum Bakterien im Plasma Antikörper können auf drei Arten an der Immunabwehr beteiligt sein
Komponenten und Aufbau des Immunsystems bakterielle Toxine spezifische Antikörper Bakterien im extrazellulären Raum Bakterien im Plasma Antikörper können auf drei Arten an der Immunabwehr beteiligt sein
Antikörpertherapie beim Mammakarzinom
 Antikörpertherapie beim Mammakarzinom (Dr. S. Rückert) Trastuzumab (Herceptin ) ist ein gentechnisch hergestellter Antikörper, welcher gegen das HER2/neu-Protein gerichtet ist. Dieser Wachstumsfaktor kommt
Antikörpertherapie beim Mammakarzinom (Dr. S. Rückert) Trastuzumab (Herceptin ) ist ein gentechnisch hergestellter Antikörper, welcher gegen das HER2/neu-Protein gerichtet ist. Dieser Wachstumsfaktor kommt
Mechanismen der Pasteurella multocida Toxin vermittelten Modulation des Osteoimmunsystems
 Mechanismen der Pasteurella multocida Toxin vermittelten Modulation des Osteoimmunsystems Gutachter Prof. Dr. Alexander Dalpke Prof. Dr. Ralf Bartenschlager Inhaltsverzeichnis 1 Zusammenfassung 1 2 Einleitung
Mechanismen der Pasteurella multocida Toxin vermittelten Modulation des Osteoimmunsystems Gutachter Prof. Dr. Alexander Dalpke Prof. Dr. Ralf Bartenschlager Inhaltsverzeichnis 1 Zusammenfassung 1 2 Einleitung
Das spezifische Immunsystem. T-Lymphozyten und deren Effektormechanismen
 Das spezifische Immunsystem T-Lymphozyten und deren Effektormechanismen Dr. med. Volker von Baehr Zelluläre Elemente des Immunsystems Unspezifisches Immunsystem (angeboren, nicht lernfähig) Monozyten Gewebemakrophagen
Das spezifische Immunsystem T-Lymphozyten und deren Effektormechanismen Dr. med. Volker von Baehr Zelluläre Elemente des Immunsystems Unspezifisches Immunsystem (angeboren, nicht lernfähig) Monozyten Gewebemakrophagen
