Schulversuchspraktikum. Name: Jana Pfefferle. Semester: SoSe Klassenstufen 7 & 8. Smog und Abgase
|
|
|
- Katarina Bachmeier
- vor 5 Jahren
- Abrufe
Transkript
1 Schulversuchspraktikum Name: Jana Pfefferle Semester: SoSe 2014 Klassenstufen 7 & 8 Smog und Abgase
2 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 7 & 8 besteht aus 3 Lehrerversuchen und 2 Schülerversuchen zu dem Thema Smog und Abgase. Diese Versuche erlauben SuS, die Effekte von Smog auf die Umwelt zu sehen, die Bildung von Smog und die Entstehung von saurem Regen zu verstehen und die Bestandteile von Smog qualitativ und quantitativ zu untersuchen. Das Arbeitsblatt Smog und Autoabgase kann als Wiederholung des Themas oder als Vertiefung für Versuch 3, die Untersuchung von Zigarettenrauch, eingesetzt werden. Inhalt 1 Beschreibung des Themas und zugehörige Lernziele Lehrerversuch V 1 Inversionswetterlage V 2 Schwefeldioxid in der Umwelt V 3 Untersuchung von Zigarettenrauch Schülerversuche V 4 Wo entsteht Ozon? V 5 Messung der Kohlenstoffdioxid Konzentration Reflexion des Arbeitsblattes Erwartungshorizont (Kerncurriculum) Erwartungshorizont (Inhaltlich)... 16
3 1 Beschreibung des Themas und zugehörige Lernziele 2 1 Beschreibung des Themas und zugehörige Lernziele Das Thema Smog und Abgase ist für SuS sehr relevant, da es in den letzten Jahren regelmäßig in den Medien diskutiert und problematisiert wurde. In vielen Städten ist Smog inzwischen ein beobachtbares Phänomen, welches ein Gesundheitsrisiko darstellt. Auch Abgase, die SuS aus ihrem Alltag kennen, sind ein wichtiger Faktor im Diskurs über Umweltverschmutzung, saurer Regen, globale Erderwärmung und die Zukunft unseres Planeten. Demnach sind SuS mit Smog und Abgase schon vertraut und bringen dementsprechend ein Vorwissen über das Thema mit, welches von ihren Erfahrungen und den Medien geprägt ist. Daher ist es einfach, chemisch an dieses Vorwissen anzuknüpfen. Das Niedersächsische Kerncurriculum erwartet von den Jahrgangstufen 7 und 8 im Basiskonzept Chemische Reaktion unter dem Kompetenzbereich Bewertung, dass Schülerinnen und Schüler 1 die Bedeutung von chemischen Reaktionen, die in der Alltagswelt stattfinden, erkennen. Des Weiteren sollen sie auch die Bedeutung von chemischen Reaktionen für Natur und Technik erkennen. Bezüglich des Kompetenzbereichs Erkenntnisgewinnung sollen SuS Überprüfungsexperimente entwickeln, untersuchen und sie unter Beachtung von Sicherheitsaspekten durchführen. Zuletzt sollen sie chemische Reaktionen auf Atomebene deuten. Im Basiskonzept Stoff- Teilchen gibt das Kerncurriculum für die Kompetenz Fachwissen vor, dass SuS das Vorhandensein von Stoffen anhand ihrer Kenntnisse über Nachweisreaktionen erklären sollen. Durch die folgenden Versuche sollen SuS ein tieferes Verständnis von der Entstehung von Smog erreichen sowie dessen Effekte auf ihre Umwelt erkennen. Des Weiteren sollen sie bestimmte Smog-Gase nachweisen können und die Konzentrationen von Ozon (qualitativ) und Kohlenstoffdioxoid (quantitativ) messen. Der erste Lehrerversuch (V1) Inversionswetterlage soll als Einführung in das Thema den SuS zeigen, wie das Phänomen Smog entsteht. Der zweite Lehrerversuch Schwefeldioxid in der Umwelt untersucht die Effekte von Schwefeldioxid auf die Umwelt. In dem dritten Lehrerversuch (V3) Untersuchung von Zigarettenrauch werden unterschiedliche schädliche Gase in Zigarettenrauch nachgewiesen, um SuS auch die Giftigkeit von Zigaretten zu zeigen. Die zwei Schülerversuche Wo entsteht Ozon? (V4) und Messung der Kohlenstoffdioxidkonzentration (V5) erlauben SuS erst qualitativ durch Herstellung eines Ozonindikatorpapiers und zuletzt quantitativ mit Hilfe eines CO 2 Gasprüfers die Konzentrationen von Ozon und Kohlenstoffdioxid an verschiedenen Alltagsstellen zu überprüfen. 1 Im weiteren Bericht mit SuS abgekürzt.
4 2 Lehrerversuch 3 2 Lehrerversuch 2.1 V 1 Inversionswetterlage In diesem Versuch wird gezeigt, auf Grund welcher Wettersituation Winter-Smog entstehen kann und wie Schadstoffe in die Atmosphäre gelangen. Dies erlaubt es SuS, die Bildung des Phänomens Smog zu verstehen und ein tieferes Verständnis für die Problematik der Luftverschmutzung zu erreichen. Für diesen Versuch brauchen die SuS kein spezielles Vorwissen, sollten jedoch eine Vorstellung von dem Begriff Luftverschmutzung haben. Der Versuch ist einfach mit ein paar Glasgeräten durchführbar. Es werden keine Gefahrenstoffe in diesem Versuch eingesetzt. Materialien: Chemikalien: Durchführung: 2 große Bechergläser, 1 Standzylinder, 1 Wärmebad, Feuerzeug, Thermometer, Wasserkocher 2 Räucherkegel, Eis, Kochsalz, Wasser Ein Wärmebad wird zur Hälfte mit heißem Wasser (80 C) und ein Becherglas wird mit einer Kältemischung aus Kochsalz und Eis gefüllt (Kältebad). In das Wärmebad wird ein Becherglas und in das Kältebad wird ein Standzylinder gestellt. Nach 3 Minuten wird die Lufttemperatur im unteren und oberen Bereich der Standzylinder gemessen und notiert. In jeden Standzylinder wird ein glimmender Räucherkegel gegeben. Die Beobachtungen werden notiert. Abbildung 1: Der Versuchsaufbau für den Versuch Inversionswetterlage. Links der Standzylinder im Eisbad und rechts im Wärmebad. Beobachtung: Im Standzylinder (Eisbad) kann im unteren Bereich eine Temperatur von 0 C und im oberen Bereich eine Temperatur von 13 C gemessen werden. Im Becherglas (Wärmebad) liegt die Temperatur im unteren Bereich bei
5 2 Lehrerversuch 4 36 C und im oberen Bereich bei 34 C. Der Rauch des Standzylinders im Eisbad sammelt sich im unteren Bereich und entweicht nicht. Aus dem Becherglas im Wärmebad steigt der Rauch auf. Abbildung 2: Die Inversionswetterlage links. Der Rauch sammelt sich im unteren Bereich des Standzylinders. Die normale Wetterlage rechts. Der Rauch entweicht. Deutung: Entsorgung: Literatur: Da warme Luft nach oben steigt, steigt der Rauch des Becherglases im Wärmbad auf, da die Luft nach oben kühler wird. Im Standzylinder im Kältebad sammelt sich der Rauch unten und entweicht nicht, da warme Luft über der kalten Luft lagert, und die kalte, verrauchte Luft nicht aufsteigen kann. Diese Inversionswetterlage ist verantwortlich für die bodennahe Ansammlung von Schadstoffen d.h. für die Bildung von Smog. Die Räucherkegel können in den Hausmüll entsorgt werden. [1] A. Rieker, N. Rücker, S. Wolf, (Zuletzt abgerufen am um 18:38 Uhr).
6 2 Lehrerversuch 5 Unterrichtsanschlüsse Dieser Versuch bietet sich in einer Einheit über Luftverschmutzung, speziell Smog an, um zu zeigen, wie dieser entsteht. Der Versuchsaufbau ist relativ einfach weswegen er gut als Einführung in das Thema genutzt werden kann. Da er phänomenologisch ist, wäre er auch ein guter Demonstrationsversuch. Dennoch könnte er auch bedenkenlos von SuS durchgeführt werden. Die benötigten Chemikalien sind ungefährlich und günstig. Alternativ könnte dieser Versuch auch mit Bechergläsern und einem Bügeleise als Wärmequelle von Oben durchgeführt werden. 2.2 V 2 Schwefeldioxid in der Umwelt In diesem Versuch können SuS die schädlichen Effekte von SO 2 auf die Umwelt sehen und die Rolle, die SO 2 bei saurem Regen spielt. Da das Gas beim Einatmen giftig ist und Verätzungen verursachen kann, sollte dieser Versuch als Demonstrationsversuch durchgeführt werden. Die SuS sollten wissen, dass SO 2 ein Bestandteil von Smog ist. Für den Versuch wird Schwefel, Marmor und Rosen benötigt. Gefahrenstoffe Schwefeldioxid H: P: Materialien: Chemikalien: Durchführung: 3 Standzylinder, 3 Verbrennungslöffel, 3 Deckgläser, Bunsenbrenner, Spritzflasche, Universalindikatorpapier Schwefel, Rosen, Marmor, Wasser Schwefel wird auf einen Verbrennungslöffel gegeben und mit der rauschenden Brennerflamme unter dem Abzug entzündet und in den Standzylinder gehoben. Der Zylinder wird danach mit einem Deckglas abgedeckt. Der Vorgang wird für alle drei Standzylinder wiederholt. In den ersten Standzylinder wird eine Rose gegeben. In den zweiten Standzylinder wird mit der Spritzflasche Wasser in den Standzylinder gegeben und danach ein Streifen Universalindikatorpapier. In den dritten Standzylinder wird Wasser gegeben und ein Stück Marmor. Alle drei Standzylinder werden nach Zugabe der Objekte wieder mit dem Deckglas abgedeckt. Die Beobachtun-
7 2 Lehrerversuch 6 gen von Standzylinder 1 und 2 werden nach fünf Minuten protokolliert. Die Beobachtungen von Standzylinder 3 nach 2 Tagen. Abbildung 3: Versuchsaufbau für den Versuch Schwefeldioxid in der Umwelt. Abbildung 4: Verbrennung von Schwefel. Beobachtung: Die Rose ist weiß und komplett entfärbt. Das Universalindikatorpapier färbt sich pink. Die glatten Flächen des Marmors sind uneben geworden. Abbildung 5: Die Rose vor dem Versuch. Abbildung 6: Die Rose nach dem Versuch. Abbildung 7: Das pink verfärbte Universalindikatorpapier. Deutung: Die Rose wird von dem SO 2 komplett entfärbt, da das Gas den Farbstoff zerstört. Im zweiten Standzylinder bildet sich durch die Zugabe von Wasser Schwefelsäure, welche das Universalindikatorpapier pink färbt. S (s) + O 2 (g) SO 2 (g) Schwefel reagiert mit Sauerstoff zu Schwefeldioxid (SO 2(g) + H 2O (l) H 2SO 3 (aq)) (Schwefeldioxid reagiert mit Wasser zu schwefeliger Säure) 2 H 2SO 3 (aq) + O 2(g) 2H 2SO 4 (aq) Schwefelige Säure reagiert mit Sauerstoff zu Schwefelsäure
8 2 Lehrerversuch 7 Der Marmor, CaCO 3 (s), wird von der Schwefelsäure zersetzt. Marmor reagiert mit Schwefelsäure zu Calcium-Ionen, Kohlenstoffdioxid, Wasser und Sulfat-Ionen. CaCO 3 (s) + H 2SO 4 (aq) Ca 2+ (aq) + CO 2 (g) + H 2O (l) + SO 4 2- (aq) Entsorgung: Literatur Die Feststoffe können in den Hausmüll entsorgt werden, die entstandene Säure kann mit viel Wasser in den Abfluss gegossen werden. Schwefelreste im Verbrennungslöffel unter dem Abzug verbrennen. [1] egietr_exp/fw_experiment.pdf (letzter Zugang am um 18 Uhr). Unterrichtsanschlüsse Dieser Versuch erlaubt SuS, die Effekte von saurem Regen und SO 2, ein signifikanter Bestandteil von Smog, auf die Umwelt zu sehen. Auf Grund der Giftigkeit des Gases und der Notwendigkeit den Versuch unter dem Abzug durchzuführen, ist es sinnvoll ihn als Lehrerversuch einzusetzen, da es nicht genügend Abzüge in der Schule gibt und die SuS somit nicht mit dem gefährlichen Gas hantieren müssen. Die Alternative zu diesem Versuch, die Untersuchung der Effekte von Stickoxiden auf die Umwelt, ist nicht wünschenswert, da Stickoxide umweltschädlicher und giftiger sind. Eine saure Regen Variante für SuS wäre Kohle auf einem Verbrennungslöffel in einem Standzylinder, der zu 5 cm mit einer Lösung von Thymolblau gefüllt ist, verbrennen zu lassen. Durch Schütteln lässt sich die Lösung pink färben und Säure nachweisen. 2.3 V 3 Untersuchung von Zigarettenrauch In diesem Versuch kann untersucht werden, welche schädlichen Gase beim Verbrennen von Tabak entstehen. Diese Gase, die Bestandteile von Smog sind, können nachgewiesen werden. Der Versuch hat eine hohe Alltagsrelevanz, da SuS selbst sehen können, welche schädlichen Gase beim Rauchen einer Zigarette entstehen können. Der Versuch sollte nur als Lehrerversuch eingesetzt werden, da sowohl die Gase als auch die Nachweislösungen teils giftig sind. Gefahrenstoffe Lackmus Lösung H:351 P: 281 Sulfanilsäure H: P:
9 2 Lehrerversuch 8 Naphtylamin H: P: 273 Calciumhydroxid H: 315, 318, 335 Silbernitrat H: Ammoniak H: Kohlenstoffmonooxid H: D Stickstoffdioxid H: Schwefeldioxid H: P: P: P: P: P: P: Kohlenstoffdioxid H: 280 P: 403 Materialien: Chemikalien: Durchführung: 8 Reagenzgläser, 4 Septen, Reagenzglasständer, 4 x 10 ml Spritzen mit Kanüle Zigarette, blaue Lackmuslösung, Saltzman Reagenz (Essigsäure, Sulfanilsäure, Napthylamin), Calciumhydroxid, Silbernitrat, Ammoniak Es werden 0,5 g Sulfanilsäure und 0,005g Naphtylamin in 4 ml Essigsäure gelöst und mit 100 ml destilliertem Wasser verdünnt. Daraufhin werden 5 ml dieser Saltzman Reagenz in das erste Reagenzglas gegeben. In das zweite Reagenzglas werden fünf Tropfen Lackmuslösung in 5 ml destilliertes Wasser gegeben. In das dritte Reagenzglas wird eine klare Calciumhydroxid Lösung gegeben und in dem vierten Reagenzglas werden 5 ml Silbernitratlösung mit fünf Tropfen Ammoniak versetzt. Unter dem Abzug wird eine Zigarette angezündet. Ein Reagenzglas wird über die Zigarette gehalten, um den Rauch aufzufangen. Wenn das Reagenzglas voll mit Rauch ist, wird es mit einem Septum verschlossen. Dies wird mit drei weiteren Reagenzgläsern wiederholt. Zuletzt werden die vier Reagenzgläser mit jeweils einer der Nachweislösungen mit einer Spritze und Kanüle versetzt. Daraufhin wird jedes Reagenzglas gut geschüttelt und die Beobachtungen aufgeschrieben.
10 2 Lehrerversuch 9 Abbildung 8: Materialien für den Versuch Abbildung 9: Auffangen des Zigarettenrauchs. Beobachtung: Nachweise Lackmus (SO 2 (g)) Salzmann Reagenz (NO 2 (g)) Calciumhydroxid (CO 2 (g)) Ammoniakalisches Silbernitrat (CO (g)) Beobachtung Keine Verfärbung, kein Niederschlag Gelbe Färbung Weißer Niederschlag Schwarzer, feiner Niederschlag Deutung: Die Nachweise für Kohlenstoffdioxid, Kohlenstoffmonoxid und Stickstoffdioxid sind positiv. Demnach sind diese Gase im Zigarettenrauch enthalten. Der Nachweis für Schwefeldioxid ist negativ. Schwefeldioxid entsteht nicht beim Anzünden einer Zigarette.
11 2 Lehrerversuch 10 Abbildung 10: Links die gelbe Färbung des positiven Saltzman Nachweises. Dann die positive Kalkwasserprobe (weißer Niederschlag). Das zweite von rechts, der negative Nachweis für SO2 (g) (Lackmus) und rechts der positive Kohlenstoffmonoxid Nachweis (schwarzer Niederschlag). Entsorgung: Der Zigarettenrauch muss im Abzug entsorgt werden. Die Silbernitratlösung wird in den Schwermetallbehälter und die Saltzman Reagenz und die Lackmus Lösung in den organischen Abfall entsorgt. Literatur: [1] Professor Blume, (Zuletzt abgerufen am um 14 Uhr). Unterrichtsanschlüsse Dieser Versuch kann in der Einheit Abgase, Luftverschmutzung oder Gase durchgeführt werden. Der Versuch ist sehr anschaulich und von besonderem Interesse für SuS, da die Giftigkeit von Zigaretten direkt gezeigt werden kann. Der Versuch ist gut als Demonstrationsversuch durchzuführen, da die Effektstärke sehr hoch ist. Alternativ könnten auch Abgase untersucht werden, dies ist jedoch schwierig, da die heutigen Autos so gute Katalysatoren haben, dass nur CO 2 nachgewiesen werden kann. Es könnte jedoch auch Benzin verbrannt werden, was jedoch gefährlicher ist als eine Zigarette.
12 2 Lehrerversuch Schülerversuche 3.1 V 4 Wo entsteht Ozon? In diesem Versuch stellen SuS ein Indikatorpapier für Ozon her, um qualitativ zu überprüfen, wo Ozonkonzentrationen am höchsten sind. Da Ozon ein schädlicher Bestandteil von Smog ist, sollen SuS selbst entscheiden, wo eventuell Quellen für bodennahes Ozon zu finden sind. Hier wäre es wichtig, dass SuS bereits mit Ozon und seiner Rolle in der Stratosphäre, sowie mit der Giftigkeit von Ozon am Boden vertraut wären. Für diesen Versuch wird kein Ozon hergestellt, sondern nur die bereits bestehende Konzentration an bestimmten Stellen untersucht. Gefahrenstoffe Ozon Es liegen noch keine Gefahrenhinweise nach GHS vor. Kaliumcarbonat H: P: Materialien: Chemikalien: 5 Petrischalen, 5 Filterpapiere, Erlenmeyerkolben (100 ml), Trockenschrank Stärke, Kaliumiodid, Kaliumcarbonat, destilliertes Wasser Durchführung: 50 ml destilliertes Wasser werden in einen Erlenmeyerkolben gegeben. 2,5 g Stärke, 0,5g Kaliumcarbonat und 5 g Kaliumiodid werden in dem destillierten Wasser gelöst. Alle 5 Filterpapiere werden in der Lösung in einer Petrischale getränkt und daraufhin im Trockenschrank bei 60 C getrocknet. Daraufhin werden die Filterpapier an fünf verschiedenen Orten verteilt (Bsp. draußen in der Sonne, draußen im Schatten, neben einem Kopierer, im Labor, im Seminarraum). Die Beobachtungen werden einen Tag später protokolliert.
13 2 Lehrerversuch 12 Abbildung 11: Versuchsaufbau für die Herstellung des Ozonpapiers. Beobachtung: Die Ozonpapiere haben sich in unterschiedlichen Maßen braun verfärbt. Abbildung 12: Die Ozonpapiere nach 24 Stunden. Von links nach rechts: im Seminarraum, im Lampenlicht, neben dem Kopierer, im Labor, im Sonnenlicht. Deutung: Entsorgung: Je dunkler die Verfärbung des Ozonpapiers, desto höher die Ozonkonzentration an der Stelle. Die niedrigste Ozonkonzentration wird im Seminarraum gemessen, da dort keine Ozonquellen vorhanden sind. Im Lampenlicht ist die Konzentration höher, da bodennahe Ozonbildung durch Wärme gebildet wird. Neben dem Kopierer ist die Ozonkonzentration noch höher, da beim Kopieren Ozon entsteht. Im Labor entstehen noch höhere Ozonkonzentrationen und am höchsten ist die Konzentration im Sonnenlicht, da Sonnenlicht die Ozonproduktion katalysiert. Die Lösung zur Herstellung von Ozonpapieren kann in den Abfluss gegeben werden. Die Ozonpapiere können in den Hausabfall entsorgt werden.
14 2 Lehrerversuch 13 Literatur: [1] H. Böhland et al., Chemische Schulexperimente Band 3 Allgemeine, physikalische und analytische Chemie Chemie und Umwelt, Volk und Wissen, 2002, S [2] C.M. Erbar, Das Thema Luft im Chemieunterricht, (Zuletzt zugegriffen am um 16:09 Uhr). Unterrichtsanschlüsse Dieser Versuch bietet sich als Einführung in bodennahes Ozon oder als Ergänzung zu Smog an, um die Konzentration von Ozon in Bodennähe qualitativ zu untersuchen. Die Herstellung des Ozonpapiers kann von SuS durchgeführt werden, solange diese vorsichtig mit dem Gefahrenstoff Kaliumcarbonat umgehen. Die Messung der Konzentration des giftigen und ätzenden Ozons geschieht in der Abwesenheit der SuS, weshalb dies unproblematisch ist. Der quantitative Ozontest kann auch mit Kaliumiodidpulver bestrichenen Kartoffelscheiben durchgeführt werden. Alternativ können Ozonteststäbchen im Internet gekauft werden. Es ist jedoch eindrucksvoller für SuS die Testpapiere selbst herzustellen. 3.2 V 5 Messung der Kohlenstoffdioxid Konzentration In diesem Versuch können SuS die Kohlenstoffdioxid Konzentration an verschiedenen Stellen und Quellen messen. Dies ist von Alltagsrelevanz, da die Kohlenstoffdioxid Konzentration im Diskurs über Umwelt, globale Erderwärmung und der Industrie eine der Hauptrollen spielt. Für diesen Versuch werden das Programm Measure und eine CO 2 Gasprüfer (hier den Cobra 4 CO 2 von PHYWE) benötigt. Gefahrenstoffe Kohlenstoffdioxid H: 280 P: 403 Materialien: Cobra 4 CO 2 Gasprüfer von PHYWE, Laptop mit dem Programm Measure Chemikalien: - Durchführung: Mit dem Gasprüfer wird die Kohlenstoffdioxid Konzentration im Raum, im Freien und vom Atem gemessen und verglichen.
15 2 Lehrerversuch 14 Beobachtung: Abbildung 13: Cobra 4 Gasprüfer mit Laptop (Programm Measure). Ort Konzentration von CO 2 (g) (ppm) Im Raum 1850 Im Freien 955 Atem 8273 Im Abzug(Labor) 192 Deutung: Entsorgung: Literatur: Im Raum ist die Kohlenstoffdioxid Konzentration höher als draußen, da mehrere Menschen schon den Sauerstoff im Raum eingeatmet und Kohlenstoffdioxid ausgeatmet haben. Da wir mit dem Atem Kohlenstoffdioxid aus dem Körper scheiden, ist in diesem die Konzentration am höchsten. Im Abzug im Labor, wo die Luft ausgesaugt wird, ist die Konzentration am niedrigsten. Es gibt keine Chemikalien, die entsorgt werden müssen. Für diesen Versuch wurde keine Literatur zur Rate gezogen. Unterrichtsanschlüsse Dieser Versuch kann in der Unterrichtseinheit Gase, Luftverschmutzung oder Kohlenstoffdioxid eingesetzt werden. Alternativ könnte er im Biologie Unterricht in der Einheit Atmung eingesetzt werden. Da der Versuch Gasprüfer und einen Computer benötigt, müssten die Geräte für alle SuS vorhanden sein. Es wäre auch interessant, Gasprüfgeräte für andere Gase benutzen zu können.
16 2 Lehrerversuch 15 Arbeitsblatt Smog und Autoabgase 1. Nenne vier Gase, die in Smog enthalten sind und beschreibe, wie sich Winter-Smog bildet. 2. Jenny hat am Wochenende in der Garage ihr Fahrrad geputzt während ihr Vater den Motor seines Autos hat laufen lassen. Nachdem sie im Chemieunterricht über Smog gelernt und ihre Lehrerin verschiedene schädliche Gase in Zigarettenrauch nachgewiesen hat, möchte sie überprüfen, ob diese Gase auch in Autoabgasen vorhanden sind. a) Nenne, auf welche Gase Jenny die Autoabgase untersuchen könnte. b) Erkläre, welche Nachweisreaktionen bei ihrer Untersuchung hilfreich sein könnten. c) Beurteile, welche Gase Jenny in Autoabgasen nachweisen können wird.
17 4 Reflexion des Arbeitsblattes Reflexion des Arbeitsblattes Das Thema des Arbeitsblattes ist Smog und Autoabgase und soll den SuS die Möglichkeit geben, das Phänomen Smog selbst zu erklären und ihr gelerntes Wissen über Smog-Gase zu vertiefen. Dabei müssen sie Nachweisreaktionen wiederholen, um zu überlegen, wie sie selbst Autoabgase untersuchen können. Die Lernziele, die dabei verfolgt werden, sind folgende: (1) SuS erkennen, welche Gase durch chemische Reaktion im Smog eine Rolle spielen, (2) SuS beschreiben, wie Smog entsteht, (3) SuS erkennen die Bedeutung von Smog-Gasen für die Natur und (4) SuS überlegen und bewerten welche Nachweisreaktionen sie für die Untersuchung von Autoabgasen benutzen können. Das Arbeitsblatt kann als Wiederholung der Einheit eingesetzt werden oder als Vertiefung für Versuch 3 Untersuchung von Zigarettenrauch. 4.1 Erwartungshorizont (Kerncurriculum) Das Arbeitsblatt setzt Kompetenzen voraus, die notwendig sind, um das Arbeitsblatt lösen zu können. Bezüglich Fachkenntnisse müssen SuS Kenntnisse über Nachweisreaktionen haben, um erklären zu können wie man bestimmte Gase als Bestandteile von Autoabgasen nachweisen kann (Frage 2 b). Die Kompetenz Bewertung ist notwendig, um in Aufgabe 2 die Bedeutung von chemischen Reaktionen in der Alltagswelt und auch deren Bedeutung für die Natur erkennen zu können. Des Weiteren ist noch Fachwissen bezüglich der Bestandteile und der Formation von Smog notwendig, welches jedoch nicht explizit im KC erwähnt wird. Frage 1 und Frage 2 a entsprechen dem Anforderungsbereich I, da SuS lediglich Wissen, welche Gase Smog bilden und wie dieser entsteht, reproduzieren müssen. Frage 2 fällt in den Anforderungsbereich II und III in den Kompetenzen Fachwissen und Bewertung. Frage 2 b ist Anforderungsbereich II, da SuS Information von ihrem eigenen Wissen so darstellen müssen, dass sie eine kohärente Untersuchung anhand Nachweisreaktionen darstellen können. Anforderungsbereich III wird von Frage 2 c gedeckt, da SuS hier beurteilen bzw. eine Aussage über mögliche Ergebnisse der Autoabgasuntersuchung machen müssen. 4.2 Erwartungshorizont (Inhaltlich) 1. Nenne vier Gase, die in Smog enthalten sind und beschreibe, wie sich Winter-Smog bildet. Gase: NO 2, CO 2, CO, SO 2, O 3 Wenn die Luft am Erdboden kälter ist als die Luft darüber, kann die kalte Luft nicht aufsteigen, da sie von warmer Luft überlagert wird. Dadurch bleiben alle Abgase und Schadstoffe in der Luft in Bodennähe, wodurch Smog, eine Art Nebel aus verschiedenen schädlichen Gasen, entsteht. Dieses Wetterphänomen nennt sich Inversionswetterlage und führt zu Winter-Smog. Bei einer normalen Wetterlage ist die Luft in Bodennähe am wärmsten und steigt somit auf, wodurch die schädlichen Abgase in die Atmosphäre getragen werden.
18 4 Reflexion des Arbeitsblattes Jenny hat am Wochenende in der Garage ihr Fahrrad geputzt während ihr Vater den Motor seines Autos hat laufen lassen. Nachdem sie im Chemieunterricht über Smog gelernt und ihre Lehrerin verschiedene schädliche Gase in Zigarettenrauch nachgewiesen hat, möchte sie überprüfen, ob diese Gase auch in Autoabgasen vorhanden sind. a) Nenne, auf welche Gase Jenny die Autoabgase untersuchen könnte. NO 2, CO 2, CO, SO 2, O 3 b) Erkläre, welche Nachweisreaktionen bei ihrer Untersuchung hilfreich sein könnten. Jenny könnte bei ihrer Untersuchung Ozonpapier herstellen, um zu überprüfen ob Ozon in den Abgasen vorhanden ist (Braunfärbung). Kohlenstoffdioxid könnte sie mit der Kalkwasserprobe nachweisen (weißer Niederschlag) oder, wenn schon behandelt, mit einem Gasprüfgerät messen. Kohlenstoffmonoxid kann mit ammoniakalischer Silbernitratlösung nachgewiesen werden (Fällung von schwarzem Silbernitrat). Stickstoffdioxid wird mit der Saltzman-Reagenz überprüft (gelbe bzw. rote Färbung). Zuletzt kann Schwefeloxid mit blauer Lackmus-Lösung nachgewiesen werden (rote Färbung). c) Beurteile, welche Gase Jenny in Autoabgasen nachweisen können wird. Jenny wird wahrscheinlich nur CO 2 nachweisen können, da Autos heutzutage alle einen Katalysator haben, der die Abgase des Autos reinigt wodurch nur Wasser und Kohlenstoffdioxid entstehen. Ohne Katalysator müsste Jenny CO 2, CO, SO 2, O 3 und NO 2 nachweisen können.
V 1 Herstellung von Natriumchlorid
 1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
Warum korrodiert Eisen?
 Warum korrodiert Eisen? Korrodiertes Eisen bzw. Rost findet sich überall. An Brücken, Autos, an unseren Fahrrädern und an altem Werkzeug. Es richtet in Deutschland jährlich Schäden im Wert von 100 Millionen
Warum korrodiert Eisen? Korrodiertes Eisen bzw. Rost findet sich überall. An Brücken, Autos, an unseren Fahrrädern und an altem Werkzeug. Es richtet in Deutschland jährlich Schäden im Wert von 100 Millionen
Von Arrhenius zu Brönsted
 Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Thema: Sauerstoff Klasse 7 / 8. Schulversuchspraktikum. Bastian Hollemann. Sommersemester Klassenstufen 7 & 8. Sauerstoff
 Thema: Sauerstoff Klasse 7 / 8 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 7 & 8 Sauerstoff Thema: Sauerstoff Klasse 7 / 8 Auf einen Blick: Diese Unterrichtseinheit für die
Thema: Sauerstoff Klasse 7 / 8 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 7 & 8 Sauerstoff Thema: Sauerstoff Klasse 7 / 8 Auf einen Blick: Diese Unterrichtseinheit für die
Dichte und Nachweis von Kohlenstoffdioxid
 Schulversuchspraktikum Name: Lydia Reinhardt Semester: Sommersemester 2014 Klassenstufen 7 & 8 Dichte und Nachweis von Kohlenstoffdioxid 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Name: Lydia Reinhardt Semester: Sommersemester 2014 Klassenstufen 7 & 8 Dichte und Nachweis von Kohlenstoffdioxid 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Reaktion von Nichtmetallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 7 & 8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 7 & 8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Arbeitsblatt Ist groß besser als klein?
 Arbeitsblatt Ist groß besser als klein? Aufgabe 1: Führe folgendes Experiment durch und notiere deine Beobachtungen. Materialien: 4 Reagenzgläser, Reagenzglasständer, Spatel Chemikalien: Gefahrenstoffe
Arbeitsblatt Ist groß besser als klein? Aufgabe 1: Führe folgendes Experiment durch und notiere deine Beobachtungen. Materialien: 4 Reagenzgläser, Reagenzglasständer, Spatel Chemikalien: Gefahrenstoffe
Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser?
 http://www.kostenloseausmalbilder.de/media/.gallery/main606.jpg (02.08.2015) Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser? Pip, die kleine Maus, benötigt zum Atmen Luft, vor allem den Sauerstoff,
http://www.kostenloseausmalbilder.de/media/.gallery/main606.jpg (02.08.2015) Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser? Pip, die kleine Maus, benötigt zum Atmen Luft, vor allem den Sauerstoff,
Chemisches Gleichgewicht
 Schulversuchspraktikum Name: Jana Pfefferle Semester: SoSe 2014 Klassenstufen 11 & 12 Chemisches Gleichgewicht 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit
Schulversuchspraktikum Name: Jana Pfefferle Semester: SoSe 2014 Klassenstufen 11 & 12 Chemisches Gleichgewicht 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit
Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer
 Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer chemischen Reaktion? In der letzten Chemiestunde hast du eine Hypothese zu der Frage formuliert: Verändert sich die Masse von
Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer chemischen Reaktion? In der letzten Chemiestunde hast du eine Hypothese zu der Frage formuliert: Verändert sich die Masse von
Merkmale einer chemischen Reaktion
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale einer chemischen Reaktion 1 Auf Beschreibung einen Blick: des Themas und zugehörige Lernziele Im Folgenden werden
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale einer chemischen Reaktion 1 Auf Beschreibung einen Blick: des Themas und zugehörige Lernziele Im Folgenden werden
Reaktion von Nichtmetallen mit Sauerstoff
 Schulversuchspraktikum Name: Benjamin Heuer Semester: SS2013 Klassenstufen 7&8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Name: Benjamin Heuer Semester: SS2013 Klassenstufen 7&8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Elementfamilien - Nachweise in Alltagsprodukten
 Schulversuchspraktikum Sissy Freund Sommersemester 2013 Klassenstufen 9 & 10 Elementfamilien - Nachweise in Alltagsprodukten 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Die Elementfamilien
Schulversuchspraktikum Sissy Freund Sommersemester 2013 Klassenstufen 9 & 10 Elementfamilien - Nachweise in Alltagsprodukten 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Die Elementfamilien
Nährstoffe und Nahrungsmittel
 1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
Schwefeldioxid. Schwefel (S) verbindet sich bei der Verbrennung mit Sauerstoff (O 2 ). Das Ergebnis ist Schwefeldioxid: SO 2.
 Standzylinder Verbrennungslöffel Deckglas Schwefel Brenner Gib etwas Schwefel auf den Verbrennungslöffel und entzünde ihn mit der rauschenden Brennerflamme. Baue den Versuch nach der Abbildung auf und
Standzylinder Verbrennungslöffel Deckglas Schwefel Brenner Gib etwas Schwefel auf den Verbrennungslöffel und entzünde ihn mit der rauschenden Brennerflamme. Baue den Versuch nach der Abbildung auf und
Konsequenzen der Ozeanversauerung
 Thema: Stoffkreisläufe Jahrgang 9 & 10 Konsequenzen der Ozeanversauerung Lies den Ausschnitt aus dem nachfolgenden Zeitungsartikel eines Wissenschaftsmagazins aufmerksam durch und betrachte im Diagramm
Thema: Stoffkreisläufe Jahrgang 9 & 10 Konsequenzen der Ozeanversauerung Lies den Ausschnitt aus dem nachfolgenden Zeitungsartikel eines Wissenschaftsmagazins aufmerksam durch und betrachte im Diagramm
Fluoreszierende Verbindungen
 Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
Merkmale chemischer Reaktionen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung
 V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung Bei diesem Versuch geht es darum, die Geschwindigkeit
V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung Bei diesem Versuch geht es darum, die Geschwindigkeit
Arbeitsblatt Bestimmung der Reaktionsgeschwindigkeit
 Arbeitsblatt Bestimmung der Reaktionsgeschwindigkeit Aufgabe 1: Definieren Sie die folgenden Begriffe: a)reaktionsgeschwindigkeit:. b) Reaktionsordnung: :. Aufgabe 2: Nennen Sie mindestens zwei Beispiele
Arbeitsblatt Bestimmung der Reaktionsgeschwindigkeit Aufgabe 1: Definieren Sie die folgenden Begriffe: a)reaktionsgeschwindigkeit:. b) Reaktionsordnung: :. Aufgabe 2: Nennen Sie mindestens zwei Beispiele
Schulversuchspraktikum. Alexander König. Sommersemester Klassenstufen 11 & 12. Katalysatoren
 Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 11 & 12 Katalysatoren Auf einen Blick: Diese Unterrichtseinheit für die Klassen 11 und 12 enthält einen Schülerversuch und einen
Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 11 & 12 Katalysatoren Auf einen Blick: Diese Unterrichtseinheit für die Klassen 11 und 12 enthält einen Schülerversuch und einen
Schulversuchspraktikum Großtechnische Elektrolyseverfah- ren/galvanisierung Kurzprotokoll
 Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 11 & 12 Großtechnische Elektrolyseverfahren/Galvanisierung Kurzprotokoll Auf einen Blick: Das folgende Protokoll enthält einen
Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 11 & 12 Großtechnische Elektrolyseverfahren/Galvanisierung Kurzprotokoll Auf einen Blick: Das folgende Protokoll enthält einen
Chemisches Gleichgewicht
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 11 & 12 Chemisches Gleichgewicht Kurzprotokoll Auf einen Blick: Die Unterrichtseinheit,,Chemisches Gleichgewicht für die Klassenstufen
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 11 & 12 Chemisches Gleichgewicht Kurzprotokoll Auf einen Blick: Die Unterrichtseinheit,,Chemisches Gleichgewicht für die Klassenstufen
Endotherm und Exotherm
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
Schulversuchspraktikum. Ansgar Misch. Sommersemester Klassenstufen 7 & 8. Stickstoff. Kurzprotokoll
 Schulversuchspraktikum Ansgar Misch Sommersemester 2016 Klassenstufen 7 & 8 Stickstoff Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll zum Thema Stickstoff enthält weitere Versuche, die die Eigenschaften
Schulversuchspraktikum Ansgar Misch Sommersemester 2016 Klassenstufen 7 & 8 Stickstoff Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll zum Thema Stickstoff enthält weitere Versuche, die die Eigenschaften
Brennbarkeit und Löslichkeit
 Schulversuchspraktikum Theresa Beck Sommersemester 2017 Klassenstufen 5 & 6 Brennbarkeit und Löslichkeit Kurzprotokoll Auf einen Blick: Dieses Protokoll beschäftigt sich mit den Eigenschaften Brennbarkeit
Schulversuchspraktikum Theresa Beck Sommersemester 2017 Klassenstufen 5 & 6 Brennbarkeit und Löslichkeit Kurzprotokoll Auf einen Blick: Dieses Protokoll beschäftigt sich mit den Eigenschaften Brennbarkeit
Schulversuchspraktikum. Constanze Koch. Sommersemester Klassenstufen 5 & 6. Wasser als Lösungsmittel. Kurzprotokoll
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden?
 Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden? Beschrifte die Kästchen mit je einem Aggregatzustand. Benenne die Nummern, es handelt sich dabei um Fachbegriffe für die Übergänge
Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden? Beschrifte die Kästchen mit je einem Aggregatzustand. Benenne die Nummern, es handelt sich dabei um Fachbegriffe für die Übergänge
Aggregatzustände und deren Temperaturabhängigkeit
 Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Reaktionen von Metallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
1 Lehrerversuch Alkalimetalle in Wasser
 1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
Schulversuchspraktikum. Name Thomas Polle. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Wasser als Lösungsmittel
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Versuche zum Thema Wasser
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Versuche zum Thema Wasser
Die SuS erklären die Entstehung saurer Lösungen mit dem Konzept von Arrhenius als Dissoziation von Chlorwasserstoff zu Hydoniumionen und
 1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert sind, da die SuS über diese
1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert sind, da die SuS über diese
Schulversuchspraktikum. Name: Niklas Heier. Semester: Sommersemester Klassenstufen 7 & 8. Smog und Abgase
 Schulversuchspraktikum Name: Niklas Heier Semester: Sommersemester 2013 Klassenstufen 7 & 8 Smog und Abgase 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden
Schulversuchspraktikum Name: Niklas Heier Semester: Sommersemester 2013 Klassenstufen 7 & 8 Smog und Abgase 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden
Schulversuchspraktikum. Johanna Osterloh. Sommersemester Klassenstufen 9 & 10. Stoffkreisläufe. Kurzprotokoll
 Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 9 & 10 Stoffkreisläufe Kurzprotokoll Auf einen Blick: Dieses Protokoll enthält vier Schülerversuche, die zum Thema Kohlenstoffdioxidkreislauf
Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 9 & 10 Stoffkreisläufe Kurzprotokoll Auf einen Blick: Dieses Protokoll enthält vier Schülerversuche, die zum Thema Kohlenstoffdioxidkreislauf
Wir untersuchen Mineralwasser
 Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Carbonsäuren, Ester und Ether
 Schulversuchspraktikum Jannik Nöhles Sommersemester 2016 Klassenstufen 11,12 & 13 Carbonsäuren, Ester und Ether 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll beinhaltet
Schulversuchspraktikum Jannik Nöhles Sommersemester 2016 Klassenstufen 11,12 & 13 Carbonsäuren, Ester und Ether 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll beinhaltet
Schulversuchspraktikum. Olga Streck. Sommersemester Klassenstufen 5 & 6. Papier
 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 5 & 6 Papier 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Lehrerversuche und 2 Schülerversuche zum Thema
Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 5 & 6 Papier 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Lehrerversuche und 2 Schülerversuche zum Thema
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Säuren und Basen im Haushalt
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 9 & 10 Säuren und Basen im Haushalt Kurzprotokoll Auf einen Blick: Die Unterrichtseinheit,,Säuren und Basen im Haushalt für die
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 9 & 10 Säuren und Basen im Haushalt Kurzprotokoll Auf einen Blick: Die Unterrichtseinheit,,Säuren und Basen im Haushalt für die
Energie und Energieumwandlung
 Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration
 SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration Der Versuch sollte mindestens zu zweit oder in einer Gruppe durchgeführt werden, damit die Messung so genau wie möglich erfolgt. Als
SV: Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration Der Versuch sollte mindestens zu zweit oder in einer Gruppe durchgeführt werden, damit die Messung so genau wie möglich erfolgt. Als
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 9/10. Salze
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum. Isabel Großhennig. Sommersemester Klassenstufen 11 & 12. Farbstoffe. Kurzprotokoll
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll für die Klassenstufen 11 und 12 zum Thema Farbstoffe enthält
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 11 & 12 Farbstoffe Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll für die Klassenstufen 11 und 12 zum Thema Farbstoffe enthält
Korrosion und Korrosionsschutz
 Schulversuchspraktikum Christian Köhler Sommersemester 2016 Klassenstufen 7&8 Korrosion und Korrosionsschutz Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll beinhaltet drei weitere Schülerversuche
Schulversuchspraktikum Christian Köhler Sommersemester 2016 Klassenstufen 7&8 Korrosion und Korrosionsschutz Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll beinhaltet drei weitere Schülerversuche
Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen. Kurzprotokoll. Schulversuchspraktikum.
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Nichtmetalle mit Sauerstoff und mit Luft
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 7 und 8 Nichtmetalle mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das folgende
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 7 und 8 Nichtmetalle mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das folgende
Schulversuchspraktikum. Jans Manjali. Sommersemester. Klassenstufen 11 & 12. Löslichkeitsprodukt
 Schulversuchspraktikum Jans Manjali Sommersemester Klassenstufen 11 & 12 Löslichkeitsprodukt 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird das Thema Löslichkeit
Schulversuchspraktikum Jans Manjali Sommersemester Klassenstufen 11 & 12 Löslichkeitsprodukt 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird das Thema Löslichkeit
Umwelt und Recycling
 Schulversuchspraktikum Anonym_16 Sommersemester 2016 Klassenstufen 5 & 6 Umwelt und Recycling Kurzprotokoll Auf einen Blick: Versuch 1 und 2 behandeln die Problematik der Meeresverschmutzung mit Ölen.
Schulversuchspraktikum Anonym_16 Sommersemester 2016 Klassenstufen 5 & 6 Umwelt und Recycling Kurzprotokoll Auf einen Blick: Versuch 1 und 2 behandeln die Problematik der Meeresverschmutzung mit Ölen.
Metalle und Nichtmetalle
 Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Schulversuchspraktikum. Moritz Pemberneck. Sommersemester Klassenstufen 7 & 8. Fällungsreaktionen. Kurzprotokoll
 Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 7 & 8 Fällungsreaktionen Kurzprotokoll Auf einen Blick: In diesem Protokoll werden weitere Schülerversuche zum Thema Fällungsreaktionen
Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 7 & 8 Fällungsreaktionen Kurzprotokoll Auf einen Blick: In diesem Protokoll werden weitere Schülerversuche zum Thema Fällungsreaktionen
1.9 Darstellung und Eigenschaften von schwefliger Säure. Aufgabe. Welche Eigenschaften besitzt schweflige Säure?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757800).9 Darstellung und Eigenschaften von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :43:57 intertess (Version 3.06 B200,
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757800).9 Darstellung und Eigenschaften von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :43:57 intertess (Version 3.06 B200,
Schulversuchspraktikum. Sommersemester Klassenstufen 7 & 8. Fällungsreaktionen
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Fällungsreaktionen 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden zwei Lehrerversuche und drei Schülerversuche zum
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Fällungsreaktionen 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden zwei Lehrerversuche und drei Schülerversuche zum
Schulversuchspraktikum. Isabel Böselt. Sommersemester Klassenstufen 5 & 6. Aggregatzustände. und deren Temperaturabhängigkeit
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Messung der Reaktionsgeschwindigkeit
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 11 & 12 Messung der Reaktionsgeschwindigkeit 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 11 & 12 Messung der Reaktionsgeschwindigkeit 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum. Friederike Kellner. Sommersemester Klassenstufen 11 & 12. Alkanone
 Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 11 & 12 Alkanone 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte Unterrichtseinheit
Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 11 & 12 Alkanone 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte Unterrichtseinheit
Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad
 Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum. Jans Manjali. Sommersemester Klassenstufen 9 & 10. Titration. Kurzprotokoll
 Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 9 & 10 Titration Kurzprotokoll Auf einen Blick: Die hier vorgestellte Argentometrie ist eine Fällungstitration, bei der Silberionen
Schulversuchspraktikum. Name: Jennifer Ahrens. Semester: Sommersemester Klassenstufen 9 & 10. Alkalimetalle
 Schulversuchspraktikum Name: Jennifer Ahrens Semester: Sommersemester 2012 Klassenstufen 9 & 10 Alkalimetalle Auf einen Blick: In dieser Unterrichtseinheit werden Versuche zu den Alkalimetallen der ersten
Schulversuchspraktikum Name: Jennifer Ahrens Semester: Sommersemester 2012 Klassenstufen 9 & 10 Alkalimetalle Auf einen Blick: In dieser Unterrichtseinheit werden Versuche zu den Alkalimetallen der ersten
Versuch: Qualitativer Nachweis von Kohlenstoff und Wasserstoff
 Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Arbeitsblatt Wasserkreislauf der Erde
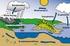 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Untersuche an einigen Beispielen, welche Grundstoffe am Aufbau unserer Nahrung beteiligt sind.
 Naturwissenschaften - Biologie - Allgemeine Biologie - 4 Unsere Nahrungsmittel und ihre Verdauung (P802200) 4. Nahrungsmittel und Nährstoffe Experiment von: Phywe Gedruckt: 07.0.203 5:36:8 intertess (Version
Naturwissenschaften - Biologie - Allgemeine Biologie - 4 Unsere Nahrungsmittel und ihre Verdauung (P802200) 4. Nahrungsmittel und Nährstoffe Experiment von: Phywe Gedruckt: 07.0.203 5:36:8 intertess (Version
Schulversuchspraktikum. Jannik Nöhles. Sommersemester Klassenstufen 9 & 10. Erdalkalimetalle
 Schulversuchspraktikum Jannik Nöhles Sommersemester 2016 Klassenstufen 9 & 10 Erdalkalimetalle Auf einen Blick: Dieses Protokoll beinhaltet vier Versuche zum Thema Erdalkalimetalle für die 9. & 10. Klassenstufe.
Schulversuchspraktikum Jannik Nöhles Sommersemester 2016 Klassenstufen 9 & 10 Erdalkalimetalle Auf einen Blick: Dieses Protokoll beinhaltet vier Versuche zum Thema Erdalkalimetalle für die 9. & 10. Klassenstufe.
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 7 & 8. Dichte und Nachweis von CO2
 Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 7 & 8 Dichte und Nachweis von CO2 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll sind
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 7 & 8 Dichte und Nachweis von CO2 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll sind
Farbenspiel der Redoxreaktionen
 Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 7-8 Farbenspiel der Redoxreaktionen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In
Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 7-8 Farbenspiel der Redoxreaktionen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 7/8. Sauerstoff. Das Gas des Lebens
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Fällungsreaktionen und Fotografie
 Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 7 & 8 Fällungsreaktionen und Fotografie 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst
Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 7 & 8 Fällungsreaktionen und Fotografie 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst
Anhand welcher Eigenschaften lässt sich Wasserstoff identifizieren?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75500) 5.2 Nachweis von Wasserstoff Experiment von: Phywe Gedruckt:.0.203 3:02:34 intertess (Version 3.06 B200, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75500) 5.2 Nachweis von Wasserstoff Experiment von: Phywe Gedruckt:.0.203 3:02:34 intertess (Version 3.06 B200, Export 2000) Aufgabe
Es liegt was in der Luft Emissionen, Schadstoffe und Grenzwerte
 Emissionen, Schadstoffe und Grenzwerte Definitionen: Emission: (= Aussendung ) Alle von einer Anlage ausgehenden Abgaben an die Umgebung. Emissionen können Stoffe sein, aber auch Energien: Stoffe: feste
Emissionen, Schadstoffe und Grenzwerte Definitionen: Emission: (= Aussendung ) Alle von einer Anlage ausgehenden Abgaben an die Umgebung. Emissionen können Stoffe sein, aber auch Energien: Stoffe: feste
Gruppe I : Darstellung und Nachweis von Säuren
 Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
Rein oder nicht rein?
 Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Korrosion und Korrosionsschutz
 Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 7 & 8 Korrosion und Korrosionsschutz Auf einen Blick: Diese Unterrichtseinheit für die Klassen 7 & 8 enthält 1 Schülerversuch und
Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 7 & 8 Korrosion und Korrosionsschutz Auf einen Blick: Diese Unterrichtseinheit für die Klassen 7 & 8 enthält 1 Schülerversuch und
Schulversuchspraktikum. Dennis Roggenkämper. Sommersemester Klassenstufen 11 & 12. Kohlenhydrate. Kurzprotokoll
 Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 11 & 12 Kohlenhydrate Kurzprotokoll Auf einen Blick: Das Kurzprotokoll umfasst vier Lehrer- und zwei Schülerexperimente, die
Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 11 & 12 Kohlenhydrate Kurzprotokoll Auf einen Blick: Das Kurzprotokoll umfasst vier Lehrer- und zwei Schülerexperimente, die
STICKOXIDE. Braunes Giftgas
 STICKOXIDE Braunes Giftgas Stativmaterial Standzylinder, Deckglas Brenner Reagenzglas, gebohrter Stopfen Winkelrohr Spatel weißes Papier Aktivkohle, Blei(II)-nitrat, Glycerin Baue das Experiment nach Abbildung
STICKOXIDE Braunes Giftgas Stativmaterial Standzylinder, Deckglas Brenner Reagenzglas, gebohrter Stopfen Winkelrohr Spatel weißes Papier Aktivkohle, Blei(II)-nitrat, Glycerin Baue das Experiment nach Abbildung
Merkmale Chemischer Reaktionen (qualitativ)
 Schulversuchspraktikum Carolin Schilling Sommersemester 2016 Klassenstufen 7&8 Merkmale Chemischer Reaktionen (qualitativ) Kurzprotokoll Auf einen Blick: Die beiden Schülerexperimente dieses Kurzprotokolls
Schulversuchspraktikum Carolin Schilling Sommersemester 2016 Klassenstufen 7&8 Merkmale Chemischer Reaktionen (qualitativ) Kurzprotokoll Auf einen Blick: Die beiden Schülerexperimente dieses Kurzprotokolls
3.3.1 Basiskonzept: Stoff-Teilchen
 3.3.1 Basiskonzept: Stoff-Teilchen Schuljahrgänge 7 und 8 Fachwissen Erkenntnisgewinnung Kommunikation Bewertung Chemische Fragestellungen entwickeln, untersuchen und einfache Ergebnisse aufbereiten Die
3.3.1 Basiskonzept: Stoff-Teilchen Schuljahrgänge 7 und 8 Fachwissen Erkenntnisgewinnung Kommunikation Bewertung Chemische Fragestellungen entwickeln, untersuchen und einfache Ergebnisse aufbereiten Die
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Sina Bachsmann Sommersemester 2014 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Im Folgenden
Schulversuchspraktikum Sina Bachsmann Sommersemester 2014 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Im Folgenden
Schulversuchspraktikum. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Gefahrenstoffe. 7 Bechergläser (100 ml), 1 Becherglas (1 L), Spatel, Wasser, Messzylinder, Glaswanne, Kartoffel
 1.1 Zersetzung von H 2O 2 mithilfe verschiedener Katalysatoren [4] Der Zerfall von Wasserstoffperoxid kann mithilfe vieler verschiedener Katalysatoren beschleunigt werden. In diesem Versuch sollen einige
1.1 Zersetzung von H 2O 2 mithilfe verschiedener Katalysatoren [4] Der Zerfall von Wasserstoffperoxid kann mithilfe vieler verschiedener Katalysatoren beschleunigt werden. In diesem Versuch sollen einige
Verbrennung einer Kerze
 Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Von Arrhenius zu Brønsted
 Schulversuchspraktikum Annika Münch Sommersemester 2015 Klassenstufe 9/10 Von Arrhenius zu Brønsted 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Thema Von
Schulversuchspraktikum Annika Münch Sommersemester 2015 Klassenstufe 9/10 Von Arrhenius zu Brønsted 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Thema Von
Licht und Farben. Kurzprotokoll
 Schulversuchspraktikum Name: Annika Münch Semester: 2. Mastersemester Klassenstufen 5/6 Licht und Farben Kurzprotokoll Auf einen Blick: Für eine Unterrichtseinheit zum Thema Licht und Farben im naturwissenschaftlichen
Schulversuchspraktikum Name: Annika Münch Semester: 2. Mastersemester Klassenstufen 5/6 Licht und Farben Kurzprotokoll Auf einen Blick: Für eine Unterrichtseinheit zum Thema Licht und Farben im naturwissenschaftlichen
Schulversuchspraktikum. Isabelle Faltiska. Sommersemester Klassenstufen 11 & 12. Quantitative Analyse von. Kohlenwasserstoffen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Im Folgenden
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Im Folgenden
Vom Alkohol zum Alken
 Schulversuchspraktikum Sabine Wolff SoSe 2013 Klassenstufen 9 & 10 Vom Alkohol zum Alken 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche vorgestellt, die die Darstellung von gasförmigen Alkenen
Schulversuchspraktikum Sabine Wolff SoSe 2013 Klassenstufen 9 & 10 Vom Alkohol zum Alken 2 Auf einen Blick: Im Folgenden werden zwei Lehrerversuche vorgestellt, die die Darstellung von gasförmigen Alkenen
3.3.1 Basiskonzept: Stoff-Teilchen
 3.3.1 Basiskonzept: Stoff-Teilchen 1 Fachwissen Erkenntnisgewinnung Kommunikation Bewertung Stoffeigenschaften lassen sich nutzen erklären Trennverfahren mit Hilfe ihrer Kenntnisse über Stoffeigenschaften.
3.3.1 Basiskonzept: Stoff-Teilchen 1 Fachwissen Erkenntnisgewinnung Kommunikation Bewertung Stoffeigenschaften lassen sich nutzen erklären Trennverfahren mit Hilfe ihrer Kenntnisse über Stoffeigenschaften.
Schulversuchspraktikum. Dennis Roggenkämper. Sommersemester Klassenstufen 5 & 6. Brandbekämpfung
 Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 5 & 6 Brandbekämpfung 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst ein Lehrer-
Schulversuchspraktikum Dennis Roggenkämper Sommersemester 2015 Klassenstufen 5 & 6 Brandbekämpfung 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Das Protokoll umfasst ein Lehrer-
Verbrennung einer Kerze
 Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Erscheinungsformen und Eigenschaften des Wassers
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 5 & 6 Erscheinungsformen und Eigenschaften des Wassers 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 5 & 6 Erscheinungsformen und Eigenschaften des Wassers 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In
Schulversuchspraktikum. Anne Steinkuhle. Sommersemester Klassenstufen 11 & 12. Alkanone
 Schulversuchspraktikum Anne Steinkuhle Sommersemester 2013 Klassenstufen 11 & 12 Alkanone 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In dem folgenden Protokoll zu dem Thema Alkanone
Schulversuchspraktikum Anne Steinkuhle Sommersemester 2013 Klassenstufen 11 & 12 Alkanone 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In dem folgenden Protokoll zu dem Thema Alkanone
Chemie-Lehrerin muss Knallgas-Explosion mit 1800 Euro büßen
 Überschrift 1 dem Text zuzuweisen, der hier angezeigt werden soll. 1 Name: Elektrolyse von Wasser Datum: Chemie-Lehrerin muss Knallgas-Explosion mit 1800 Euro büßen Göttingen. Eine Chemie-Lehrerin (48)
Überschrift 1 dem Text zuzuweisen, der hier angezeigt werden soll. 1 Name: Elektrolyse von Wasser Datum: Chemie-Lehrerin muss Knallgas-Explosion mit 1800 Euro büßen Göttingen. Eine Chemie-Lehrerin (48)
Bildung und Eigenschaften von Nichtmetalloxiden
 Problem: Bildung und Eigenschaften von Nichtmetalloxiden a) Umsetzung von Phosphor mit Sauerstoff: Phosphor (rot) [F], Sauerstoff [O] 250ml-Schraubdeckelglas, Verbrennungslöffel, Bierdeckel, Spatel, Gasbrenner,
Problem: Bildung und Eigenschaften von Nichtmetalloxiden a) Umsetzung von Phosphor mit Sauerstoff: Phosphor (rot) [F], Sauerstoff [O] 250ml-Schraubdeckelglas, Verbrennungslöffel, Bierdeckel, Spatel, Gasbrenner,
Verfahren zur Stofftrennung
 Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Verfahren zur Stofftrennung Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll enthält
Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Verfahren zur Stofftrennung Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll enthält
Erweiterter Redoxbegriff (Einführung)
 Schulversuchspraktikum Sissy Freund Sommersemester 2013 Klassenstufen 7 & 8 Erweiterter Redoxbegriff (Einführung) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die Versuche in diesem
Schulversuchspraktikum Sissy Freund Sommersemester 2013 Klassenstufen 7 & 8 Erweiterter Redoxbegriff (Einführung) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die Versuche in diesem
Aktivierungsenergie und Katalysatoren
 Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalysatoren Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll enthält weitere Schülerversuche
Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalysatoren Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll enthält weitere Schülerversuche
Reinstoffe und Stoffgemische, Verfahren zur Stofftrennung
 Schulversuchspraktikum Name: Jana Pfefferle Semester: SoSe 2014 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische, Verfahren zur Stofftrennung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen
Schulversuchspraktikum Name: Jana Pfefferle Semester: SoSe 2014 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische, Verfahren zur Stofftrennung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen
Protokoll Tag 3. C. Kationennachweise. C.1. Nachweis von Na +, Mg 2+, Ca 2+, Sr 2+, BA 2+ sowie NH + 4
 Protokoll Tag 3 C. Kationennachweise C.1. Nachweis von Na +, Mg 2+, Ca 2+, Sr 2+, BA 2+ sowie NH + 4 V16 Nachweis von Na +, K +, Ca 2+, Sr 2+ und Ba 2+ durch Flammenfärbung Bei der Flammenprobe geht es
Protokoll Tag 3 C. Kationennachweise C.1. Nachweis von Na +, Mg 2+, Ca 2+, Sr 2+, BA 2+ sowie NH + 4 V16 Nachweis von Na +, K +, Ca 2+, Sr 2+ und Ba 2+ durch Flammenfärbung Bei der Flammenprobe geht es
Heizwert. 1 Brenner. Nach dem Erlöschen der Flammen rührst du das Wasser um und liest die Temperatur ab:
 Heizwert 2 leere Konservendosen (ca. ¼ l Inhalt) 3 g Trockenspiritus 1 Brenner 2 Thermometer 3 g Brennspiritus Wasser (2 mal 1 / 8 l) Nach dem Erlöschen der Flammen rührst du das Wasser um und liest die
Heizwert 2 leere Konservendosen (ca. ¼ l Inhalt) 3 g Trockenspiritus 1 Brenner 2 Thermometer 3 g Brennspiritus Wasser (2 mal 1 / 8 l) Nach dem Erlöschen der Flammen rührst du das Wasser um und liest die
