6.2 Kovalente Bindung + + r B. r AB. πε0. Ĥ Nicht separierbar. Einfachstes Molekül: Hamiltonoperator: Kinetische Energie. Potentielle Energie
|
|
|
- Joseph Kohler
- vor 5 Jahren
- Abrufe
Transkript
1 6. Kovalente indung Einfachstes Molekül: - r H + r + + r e Hamiltonoperator: Ĥ ħ ħ ħ = + m m Kern Kern e me Elektron Kinetische Energie + e πε r r r Kern Kern e nziehung bstoßung Kern Kern e nziehung Potentielle Energie Ĥ Nicht separierbar Ĥψ = Eψ nicht analytisch lösbar Näherungen
2 6.3 orn-oppenheimer Näherung Kernbewegung viel langsamer als e -ewegung m, 18 m e E kin von, vernachlässigbar klein gegenüber E kin des e r konstant auf Zeitskala der Elektronenbewegung ħ e 1 1 e 1 Ĥψ = e + + ψ = Eψ me 4πε r r 4πε r Kons tan te ħ e 1 1 e 1 Ĥψ = e E + ψ = ψ me 4 r r πε 4πε r E el E = E (r ) el el Energie des Elektrons bei Kernabstand Lösung der SGL für verschiedene r ( r als Parameter) r
3 Separation von orn-oppenheimer Näherung - formal ˆ ˆ H : H = Ĥ (X) + Ĥ ( X, r ) X = (x y z, x y z ),,,, K el e r = (x y z ) e e, e, e Kernkoordinaten Elektronenkoordinaten Produktansatz: ψ = ψ ) X, r ) (X ψ ( K el e Separation in SGL: Elektron. SGL: Ĥ el( X, r e) ψel( X, r e) = E el ( X) ψel ( X, r e) Kern SGL: Ĥ K (X) ψ K (X) = E ψk (X) Koordinatentransformation: m, m µ K X r ρ = r r Reduzierte Masse d. Kerne Gleichgewichtsabstand d. Kerne
4 orn-oppenheimer Näherung - formal Elektron. SGL: Ĥ el( ρ, r e) ψ el( ρ, r e) = E el( ρ) ψel( ρ, r e) Kern SGL: Ĥ K ( ρ) ψk ( ρ) = E ψk ( ρ) Ĥ K ħ = K + Ee l( ρ) µ Elektronische Energie = potentielle Energie der Kernbewegung. nnahme: Kernbewegung = harmonische Oszillation 1 E el = fρ K Eel Harmonische Näherung: 1 E el( ρ ) = fρ ρ = r r o o r r
5
6 * *
7 * * * * * * * * * * * * * * * * * * * *
8 * * * * Korrekt: ψi Hψ ˆ jdτ = j ( ˆ i ) ψ i reell ψ Hψ dτ Eigenfunktionen orthogonal ψψ dτ i j
9
10
11
12
13 * (c ψ + c ψ )(c ψ + c ψ )dτ * * * * * *
14
15
16 Form der Molekülorbitale LCO-MO Ergebnisse für H + 1 ψ + = ψ + 1+ S ( ψ ) ψ ψ ψ ψ ψ = 1 1 S ( ψ ψ )
17 LCO-MO Ergebnisse für H + ufenthaltswahrscheinlichkeiten ψ g ψ + ψ u ψ - "Höhenlinien ψ = konstant
18 LCO-MO Ergebnisse für H + Energien der Molekülorbitale E = E u E = E u E = + E g antibindend E H E H bindend E = + E g r o r E E + H + H e C + EH 1+ S 4πε r 1+ S = = + + H H e C EH 1 S 4πε r 1 S = = C = 4πε 1 = 4πε ψ ψ e r e r ψ ψ dτ dτ
19 edeutung der Terme in E+ und E Hamilton-Operator von H + in der orn-oppenheimer-näherung: Hˆ = ħ m 1 4πε e r 1 4πε e r + 1 4πε e r = Hˆ H 1 4πε e r + 1 4πε e r Hamilton-Operator des H-toms Kernabstoßung V KK = const Einsetzen von Ĥ : (i) Coulombintegral α = H = H = ψ Hˆ ψ dτ = 1 e 1 e = ψ H ψ dτ ψ ψ dτ + ψ ψ dτ ˆ H 4πε r 4πε r = E H Energie des H-toms im Grundzustand = C Coulomb-nziehung des Kerns auf Elektron an Kern = V KK Coulomb-bstoßung der tomkerne = const
20 edeutung der Terme in E+ und E (ii) ustausch-integral β = H = H = ψ Hˆ ψ dτ = ψ Hˆ ψ dτ = H 1 e 1 e = E ψ ψ dτ ψ ψ dτ + ψ ψ dτ 4πε r 4πε r = E H S Energie des H-toms im Grundzustand S = Zusatzbeitrag zur elektrostatischen WW durch ustausch des Elektrons zwischen ψ und ψ = V KK S Coulomb-bstoßung der tomkerne S (iii) Überlappungsintegral S = ψ ψ dτ = Maß für die Überlappung der S Wellenfunktionen ψ und ψ r S 1 r
21 nschauliche edeutung von S, C,
22 nschauliche edeutung von S, C, C
23 Verlauf von V KK, C, V KK C
24 Vergleich der MO-Theorie mit der exakten Lösung des H + Exakt E E antibindend 13 pm ev = E H.7 ev 1.76 ev E+ bindend LCO-MO experimentell indungsabstand = Gleichgewichts- bstand im Grundzustand r r = ohr. ohr = 16 pm indungsenergie = Dissoziationsenergie im Grundzustand D e =.16 Hartree =.79 ev = 7 kj mol 1 17 pm MO-Theorie in einfachster Form weicht quantitativ deutlich von der exakten Lösung und vom Experiment ab Verbesserung?
25 6.8 Molekülorbitale für angeregte Zustände von H + pproximative Wellenfunktionen für angeregte H + -Zustände höher als σ1s* Startpunkt für Diskussion des ufbaus von zweiatomigen Molekülen mit mehreren Elektronen (ufbauprinzip analog zur Konstruktion von Wellenfunktionen für Mehrelektronenatome aus H-ähnlichen O s) Methode 1: Paarweises Mischen von identischens O s φ MO,1( 1) = c1, 1s ± c1, 1s φ MO,( ) = c, s ± c, s φ MO,3( 3) = c3, p z, ± c3, pz, usw. Homonukleare Moleküle: ci, = ci, + = gerades φ - = ungerades φ
26 ngeregte Zustände von H + : MO s aus angeregten H-O s Paarweise Kombination von Os z z σs und σ*s: ussehen wie σ1s und σ*1s nur zusätzliche Knotenebene
27 ngeregte Zustände von H + : MO s aus angeregten H-O s Paarweise Kombination von Os πp π-indung indungsachse liegt in Knoteneben; zusätzliche e Dichte in Ebene senkrecht zur indung. π*p antibind. MO mit zwei Knotenebenen.
28 pproximative Wellenfunktionen für angeregte H + -Zustände höher als σ1s* Startpunkt für Diskussion des ufbaus von zweiatomigen Molekülen mit mehreren Elektronen (ufbauprinzip analog zur Konstruktion von Wellenfunktionen für Mehrelektronenatome aus H-ähnlichen O s) Methode : Mischen von O s gleicher Symmetrie (LCO) sp.: z 1s-, s- und p z -O s haben identische Symmetrie (Rotationssymm. zur z-chse) φ MO = c1, 1s + c, s + c3, p z, ± c1, 1s + c, s + c3, p z, Homonukleare Moleküle: ci, = ci, + = gerades φ - = ungerades φ
29 ngeregte Zustände von H + : MO s aus angeregten H-O s LCO von Os gleicher Symmetrie edingungen für das Mischen Verschiedener Os: 1.) Energien der Os ψ 1 und ψ müssen von vergleichbarer Größe sein.) ψ 1 und ψ müssen hinreichend überlappen 3.) ψ 1 und ψ müssen gleiche Symmetrie bezüglich der indungsachse haben s + p x nicht mischbar s + p z mischbar wenn edingungen 1.) und.) nicht erfüllt 1 e = ψ ψdτ = 4πε r Keine Energieabsenkung
30 Mögliche MO-Konfigurationen zweiatomiger Moleküle Paarweise Kombination von Os LCO von Os gleicher Symmetrie E(σp) < E(πp): ab O E(πp) < E(σp): bis N Expt. Klärung über Verhalten im Magnetfeld
31 6.9 MO-Konfigurationen zweiatomiger Moleküle - indungsordnung indungsordnung O = (n n ) / bind antibind E u E u H 11 H 11 E g E g + H : O = (1 ) / =.5 H : O = ( ) / = 1
32 MO-Konfigurationen zweiatomiger Moleküle He +, He indungsordnung O = (n n ) / bind antibind E u E u H 11 H 11 E g E g + He : O = ( 1) / =.5 He : O = ( ) / = He + stabil (in Gasphase nachgewiesen) In der Lewis-Theorie nicht erklärbar Eu > Eg He nicht stabil
33 MO-Konfigurationen zweiatomiger Moleküle Li [He] σs Li : O = ( ) / = 1 ( # ( # Der Einfachheit halber werden die 1s-Elektronen bei der erechnung der indungsordnung ignoriert werden; beim MO-Schema sind sie aber zu berücksichtigen. 1s-O s und MO s ab hier aus Platzgründen nicht mehr gezeichnet)
34 MO-Konfigurationen zweiatomiger Moleküle e, e + [He] σs σ*s [He] σs σ*s 1 e : O = ( ) / = nicht stabil e + : O = ( 1) / =.5 stabil (Gasphase) In der Lewis-Theorie nicht erklärbar
35 MO-Konfigurationen zweiatomiger Moleküle [He]σs σ*s σp z - diamagnetisch [He]σs σ*s πp x1 πp y 1 - paramagnetisch O = (4 ) / = 1 Expt. Klärung über E(σp) < E(πp): ab O E(πp) < E(σp): bis N Verhalten im Magnetfeld Gepaarte Spins Diamagnetisches Molekül Molekül wird vom H-Feld abgestoßen Ungepaarte Spins Paramagnetisches Molekül Molekül wird in externes H-Feld gezogen
36 MO-Konfigurationen zweiatomiger Moleküle C [He]σs σ*s σp z πp x1 πp y 1 - paramagnetisch [He]σs σ*s πp x πp y - diamagnetisch O = (6 ) / = Expt. Klärung über E(σp) < E(πp): ab O E(πp) < E(σp): bis N Verhalten im Magnetfeld
37 MO-Konfigurationen zweiatomiger Moleküle N [He]σs σ*s σp z πp x πp y - diamagnetisch [He]σs σ*s πp x πp y σp z - diamagnetisch O = (8 ) / = 3 Keine expt. Klärung über E(σp) < E(πp): ab O E(πp) < E(σp): bis N Verhalten im Magnetfeld
38 MO-Konfigurationen zweiatomiger Moleküle O [He]σs σ*s σp z πp x πp y π*p x1 π*p y1 - paramagnetisch [He] σs σ*s πp x πp y σp z π*p x1 π*p y1 - paramagnetisch O = (8 4) / = O ist ein Diradikal In Lewis-Theorie nicht erklärbar Keine expt. Klärung über E(σp) < E(πp): ab O E(πp) < E(σp): bis N Verhalten im Magnetfeld
39 MO-Konfigurationen zweiatomiger Moleküle F [He]σs σ*s σp z πp x πp y π*p x π*p y - diamagnetisch [He]σs σ*s πp x πp y σp z π*p x π*p y - diamagnetisch O = (8 6) / = 1 Keine expt. Klärung über E(σp) < E(πp): ab O E(πp) < E(σp): bis N Verhalten im Magnetfeld
40 MO-Konfigurationen zweiatomiger Moleküle Ne [He]σs σ*s σp z πp x πp y π*p x π*p y σ*p z - diamagnetisch O = (8 8) / = Ne nicht stabil E(σp) < E(πp): ab O
41 Heteronukleare zweiatomige Moleküle naloge Os nicht mehr isoenergetisch c c elektronegativeres tom zieht e - stärker an dipolarer Charakter der indung c >> c ionogene indung
Drehimpuls Allgemeine Behandlung
 Drehimpuls llgemeine Behandlung Klassisch: L = r p = r mv L β m p Kreuzprodukt zweier Vektoren: L = r p = r p sinβ Drehimpuls llgemeine Behandlung 1 i 1 k j Einheitsvektoren 1 Vektordarstellung: L= Lxi
Drehimpuls llgemeine Behandlung Klassisch: L = r p = r mv L β m p Kreuzprodukt zweier Vektoren: L = r p = r p sinβ Drehimpuls llgemeine Behandlung 1 i 1 k j Einheitsvektoren 1 Vektordarstellung: L= Lxi
: Quantenmechanische Lösung H + 2. Molekülion und. Aufstellen der Schrödingergleichung für das H + 2
 H + 2 Die molekulare Bindung : Quantenmechanische Lösung Aufstellen der Schrödingergleichung für das H + 2 Molekülion und Lösung Wichtige Einschränkung: Die Kerne sind festgehalten H Ψ(r) = E Ψ(r) (11)
H + 2 Die molekulare Bindung : Quantenmechanische Lösung Aufstellen der Schrödingergleichung für das H + 2 Molekülion und Lösung Wichtige Einschränkung: Die Kerne sind festgehalten H Ψ(r) = E Ψ(r) (11)
Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt.
 12 Moleküle Slide 267 Vorbemerkungen Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt. Je 2 Elektronen
12 Moleküle Slide 267 Vorbemerkungen Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt. Je 2 Elektronen
Bahndrehimpuls des H-Atoms
 ahndhimpuls ds H-toms H L L z L L x L y ahndhimpuls-quantnzahl Symmti d Obital Quantisiung ds Dhimpulss ds Elktons L ( ) s-obital: kin ahndhimpuls p,d,f,... ahndhimpuls m Magntisch Quantnzahl Rotation
ahndhimpuls ds H-toms H L L z L L x L y ahndhimpuls-quantnzahl Symmti d Obital Quantisiung ds Dhimpulss ds Elktons L ( ) s-obital: kin ahndhimpuls p,d,f,... ahndhimpuls m Magntisch Quantnzahl Rotation
9. Moleküle. 9.1 Wasserstoff-Molekül Ion H Wasserstoff-Molekül H Schwerere Moleküle 9.4 Angeregte Moleküle. Physik IV SS
 9.1 Wasserstoff-Molekül Ion H + 9. Wasserstoff-Molekül H 9.3 Schwerere Moleküle 9.4 Angeregte Moleküle 9.1 9.1 Wasserstoff-Molekül Ion H + Einfachstes Molekül: H + = p + e p + Coulomb-Potenzial: Schrödinger-Gleichung:
9.1 Wasserstoff-Molekül Ion H + 9. Wasserstoff-Molekül H 9.3 Schwerere Moleküle 9.4 Angeregte Moleküle 9.1 9.1 Wasserstoff-Molekül Ion H + Einfachstes Molekül: H + = p + e p + Coulomb-Potenzial: Schrödinger-Gleichung:
Gesamtdrehimpuls Spin-Bahn-Kopplung
 Gesamtdrehimpuls Spin-Bahn-Kopplung > 0 Elektron besitzt Bahndrehimpuls L und S koppeln über die resultierenden Magnetfelder (Spin-Bahn-Kopplung) Vektoraddition zum Gesamtdrehimpuls J = L + S Für J gelten
Gesamtdrehimpuls Spin-Bahn-Kopplung > 0 Elektron besitzt Bahndrehimpuls L und S koppeln über die resultierenden Magnetfelder (Spin-Bahn-Kopplung) Vektoraddition zum Gesamtdrehimpuls J = L + S Für J gelten
Quantenzahlen. A B z. Einführung in die Struktur der Materie 67
 Quantenzahlen Wir haben uns bis jetzt nur mit dem Grundzustand des H + 2 Moleküls beschäftigt Wie sieht es aus mit angeregten Zuständen wie z.b. 2p Zuständen im H Atom? Bezeichnung der Molekülorbitale
Quantenzahlen Wir haben uns bis jetzt nur mit dem Grundzustand des H + 2 Moleküls beschäftigt Wie sieht es aus mit angeregten Zuständen wie z.b. 2p Zuständen im H Atom? Bezeichnung der Molekülorbitale
Das H + 2 -Molekülion
 Das Näherungen für das elektronische Problem und Kernbewegungen 7. Dezember 2011 Schrödinger-Gleichung des s Abbildung: Arthur Beiser; Atome, Moleküle, Festkörper; Vieweg, Braunschweig 1983 ( K/E 2 2 +
Das Näherungen für das elektronische Problem und Kernbewegungen 7. Dezember 2011 Schrödinger-Gleichung des s Abbildung: Arthur Beiser; Atome, Moleküle, Festkörper; Vieweg, Braunschweig 1983 ( K/E 2 2 +
TC1 Grundlagen der Theoretischen Chemie
 TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Sarah Römer (roemer@em.uni-frankfurt.de) Simona Scheit (simona.scheit@googlemail.com) Juanma
TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Sarah Römer (roemer@em.uni-frankfurt.de) Simona Scheit (simona.scheit@googlemail.com) Juanma
Gliederung. Potentialenergieflächen für chemische Reaktionen. und konische Durchschneidungen. 1 Born-Oppenheimer-Näherung
 Gliederung Potentialenergieflächen für chemische Reaktionen 1 2 adiabatische und diabatische Potentialflächen 3 Kreuzungsverbot für Potentialflächen, nicht-adiabatische Übergänge und konische Durchschneidungen
Gliederung Potentialenergieflächen für chemische Reaktionen 1 2 adiabatische und diabatische Potentialflächen 3 Kreuzungsverbot für Potentialflächen, nicht-adiabatische Übergänge und konische Durchschneidungen
Experimentalphysik Modul PH-EP4 / PH-DP-EP4
 6 Moleküle Universität Leipzig, Fakultät für Physik und Geowissenschaften Experimentalphysik Modul PH-EP4 / PH-DP-EP4 Script für Vorlesung 08. Juni 009 Nach der Beschreibung Ein- und Mehrelektronen-Atomen
6 Moleküle Universität Leipzig, Fakultät für Physik und Geowissenschaften Experimentalphysik Modul PH-EP4 / PH-DP-EP4 Script für Vorlesung 08. Juni 009 Nach der Beschreibung Ein- und Mehrelektronen-Atomen
Theoretische Chemie (TC II) Computational Chemistry
 Theoretische Chemie (TC II) Computational Chemistry Lecture 2 28/10/2011 Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Vorlesung: Mi 11h30-13h, Fr 8h-9h30 Praktikum (gemäß Ankündigung, statt Vorlesung):
Theoretische Chemie (TC II) Computational Chemistry Lecture 2 28/10/2011 Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Vorlesung: Mi 11h30-13h, Fr 8h-9h30 Praktikum (gemäß Ankündigung, statt Vorlesung):
2. Linear Combination of Atomic Orbitals
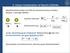 . Linear Combination of Atomi Orbitals Molekülorbitale werden mit ilfe des Variationsansatzes erhalten. Beispiel: -atomiges Molekül Atom, ϕ Atom, ϕ amilton-operator: Orthonormierung: ˆ ϕ El. Atom ϕ = =
. Linear Combination of Atomi Orbitals Molekülorbitale werden mit ilfe des Variationsansatzes erhalten. Beispiel: -atomiges Molekül Atom, ϕ Atom, ϕ amilton-operator: Orthonormierung: ˆ ϕ El. Atom ϕ = =
WAS FEHLT? STATISCHE KORRELATION UND VOLLE KONFIGURATIONSWECHSELWIRKUNG
 31 besetzen als die β Elektronen. Wenn man dies in der Variation der Wellenfunktion zulässt, also den Satz der Orbitale verdoppelt und α und β Orbitale gleichzeitig optimiert, so ist i. A. die Energie
31 besetzen als die β Elektronen. Wenn man dies in der Variation der Wellenfunktion zulässt, also den Satz der Orbitale verdoppelt und α und β Orbitale gleichzeitig optimiert, so ist i. A. die Energie
Vertiefende Theoretische Chemie Übungen
 Universität eipzig Studiengang Chemie (Bachelor) Sommersemester 5 Vertiefende Theoretische Chemie Übungen Inhaltsverzeichnis Teilchen im Kasten. Translation: Teilchen im Kasten............................................
Universität eipzig Studiengang Chemie (Bachelor) Sommersemester 5 Vertiefende Theoretische Chemie Übungen Inhaltsverzeichnis Teilchen im Kasten. Translation: Teilchen im Kasten............................................
Übungen zur Vorlesung Theoretische Chemie II Übungsblatt 1 SoSe 2015 Lösungen Ĥ Ψ = E Ψ (1) c b
 Übungen zur Vorlesung Theoretische Chemie II Übungsblatt SoSe 205 Lösungen. H 2 + Molekülion a) Konstruieren Sie die Schrödingergleichung in Matrixdarstellung. Zunächst geht man von der stationären Schrödinger-Gleichung
Übungen zur Vorlesung Theoretische Chemie II Übungsblatt SoSe 205 Lösungen. H 2 + Molekülion a) Konstruieren Sie die Schrödingergleichung in Matrixdarstellung. Zunächst geht man von der stationären Schrödinger-Gleichung
Das H + 2 -Molekül. Das Wasserstoffmolekülion H + 2 ist das einfachste
 Moleküle Wir haben in den vergangenen Wochen gelernt, wie sich Atome, zusammengesetzt aus elektrisch geladenen Kernen und Elektronen, verhalten. Wie aber verbinden sich elektrisch neutrale Atome zu Molekülen
Moleküle Wir haben in den vergangenen Wochen gelernt, wie sich Atome, zusammengesetzt aus elektrisch geladenen Kernen und Elektronen, verhalten. Wie aber verbinden sich elektrisch neutrale Atome zu Molekülen
Das Bohrsche Atommodell
 Das Bohrsche Atommodell Auf ein Elektron, welches im elektrischen Feld eines Atomkerns kreist wirkt ein magnetisches Feld. Der Abstand zum Atomkern ist das Ergebnis, der elektrostatischen Coulomb-Anziehung
Das Bohrsche Atommodell Auf ein Elektron, welches im elektrischen Feld eines Atomkerns kreist wirkt ein magnetisches Feld. Der Abstand zum Atomkern ist das Ergebnis, der elektrostatischen Coulomb-Anziehung
Übungen zu Physik 2 für Maschinenwesen
 Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Einleitung nichtrel. Wasserstoatom (spinlos) rel. Wasserstoatom (für spin 1 2 -Teilchen) Orbitale des (rel.) Wasserstoatoms Ausblick und oene Fragen
 Florian Wodlei Seminar aus höherer QM Überblick 1 Einleitung Motivation Was ist ein Orbital? Überblick 1 Einleitung Motivation Was ist ein Orbital? 2 Überblick 1 Einleitung Motivation Was ist ein Orbital?
Florian Wodlei Seminar aus höherer QM Überblick 1 Einleitung Motivation Was ist ein Orbital? Überblick 1 Einleitung Motivation Was ist ein Orbital? 2 Überblick 1 Einleitung Motivation Was ist ein Orbital?
Chemische Bindung zweiatomiger Moleküle
 Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
Theoretische Chemie / Computerchemie
 Theoretische Chemie / Computerchemie Bernd Hartke Theoretische Chemie Institut für Physikalische Chemie Christian-Albrechts-Universität Kiel Max-Eyth-Straße 2 Erdgeschoß, Raum 29 Tel.: 43/88-2753 hartke@pctc.uni-kiel.de
Theoretische Chemie / Computerchemie Bernd Hartke Theoretische Chemie Institut für Physikalische Chemie Christian-Albrechts-Universität Kiel Max-Eyth-Straße 2 Erdgeschoß, Raum 29 Tel.: 43/88-2753 hartke@pctc.uni-kiel.de
5. Atomaufbau und Periodensystem der Elemente
 5. Atomaufbau und Periodensystem der lemente 5.1 Historie: 1869 Meyer&Mendeleev: Konstruktion des Periodensystems aus der Periodizität chemischer und physikalischer igenschaften Wertigkeit der Ionen formale
5. Atomaufbau und Periodensystem der lemente 5.1 Historie: 1869 Meyer&Mendeleev: Konstruktion des Periodensystems aus der Periodizität chemischer und physikalischer igenschaften Wertigkeit der Ionen formale
TC1 Grundlagen der Theoretischen Chemie
 TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Konstantin Falahati (k.falahati@yahoo.com) Jan von Cosel (jvcosel@theochem.uni-frankfurt.de)
TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Konstantin Falahati (k.falahati@yahoo.com) Jan von Cosel (jvcosel@theochem.uni-frankfurt.de)
(Der Festkörper als Riesenmolekül)
 AFP-Semina, CR Bandstuktuen I: LCAO-Ansat (De Festköpe als Riesenmolekül) AFP-Semina, CR Bandstuktuen I: LCAO-Ansat. 0-dimensionale Fall: Atome und Moleküle =.. Atomobitale =.2. Molekülobitale = 2. -dimensionale
AFP-Semina, CR Bandstuktuen I: LCAO-Ansat (De Festköpe als Riesenmolekül) AFP-Semina, CR Bandstuktuen I: LCAO-Ansat. 0-dimensionale Fall: Atome und Moleküle =.. Atomobitale =.2. Molekülobitale = 2. -dimensionale
Aufgabe 1: Wellenfunktion und Aufenthaltswahrscheinlichkeit
 Lösungsvorschlag Übung 8 Aufgabe : Wellenfunktion und Aufenthaltswahrscheinlichkeit a) Die Wahrscheinlichkeitsdichte ist eine Wahrscheinlichkeit pro Volumenelement. Die Wahrscheinlichkeit selbst ist eine
Lösungsvorschlag Übung 8 Aufgabe : Wellenfunktion und Aufenthaltswahrscheinlichkeit a) Die Wahrscheinlichkeitsdichte ist eine Wahrscheinlichkeit pro Volumenelement. Die Wahrscheinlichkeit selbst ist eine
Moleküle und Wärmestatistik
 Moleküle und Wärmestatistik Musterlösung.08.008 Molekülbindung Ein Molekül bestehe aus zwei Atomkernen A und B und zwei Elektronen. a) Wie lautet der Ansatz für die symmetrische Wellenfunktion in der Molekülorbitalnäherung?
Moleküle und Wärmestatistik Musterlösung.08.008 Molekülbindung Ein Molekül bestehe aus zwei Atomkernen A und B und zwei Elektronen. a) Wie lautet der Ansatz für die symmetrische Wellenfunktion in der Molekülorbitalnäherung?
Quantenchemie WS 2008/2009 Zusammenfassung 1. Teil
 Quantenchemie WS 2008/2009 Zusammenfassung 1. Teil 1. Grundlagen der Quantenmechanik (a) Wellenfunktion: Die Wellenfunktion Ψ(x, t) beschreibt den quantenmechanischen Zustand eines Teilchens am Ort x zur
Quantenchemie WS 2008/2009 Zusammenfassung 1. Teil 1. Grundlagen der Quantenmechanik (a) Wellenfunktion: Die Wellenfunktion Ψ(x, t) beschreibt den quantenmechanischen Zustand eines Teilchens am Ort x zur
Ein Lehrbuch für Studierende der Chemie im 2. Studienabschnitt
 Atom- und Molekülbau Ein Lehrbuch für Studierende der Chemie im 2. Studienabschnitt Von Peter C. Schmidt und Konrad G. Weil 147 Abbildungen, 19 Tabellen Georg Thieme Verlag Stuttgart New York 1982 Vorwort
Atom- und Molekülbau Ein Lehrbuch für Studierende der Chemie im 2. Studienabschnitt Von Peter C. Schmidt und Konrad G. Weil 147 Abbildungen, 19 Tabellen Georg Thieme Verlag Stuttgart New York 1982 Vorwort
Molekülphysik. April Grundzustand und angeregte Zustände eines Moleküls
 Molekülphysik April 2010 1 Grundzustand und angeregte Zustände eines Moleküls 1.1 Hamiltonoperator für das Gesamtproblem Die Quantenmechanik ist die fundamentale Theorie der Materie. Sowohl die Koordinaten
Molekülphysik April 2010 1 Grundzustand und angeregte Zustände eines Moleküls 1.1 Hamiltonoperator für das Gesamtproblem Die Quantenmechanik ist die fundamentale Theorie der Materie. Sowohl die Koordinaten
Lösung 14. Allgemeine Chemie II Frühjahrsemester 2013
 Lösung 14 Allgemeine Chemie II Frühjahrsemester 2013 1. Aufgabe Bohr hat für das Wasserstoffatom ein Modell erstellt, das der klassischen Mechanik gehorcht und gewisse Ähnlichkeiten mit dem Planetenmodell
Lösung 14 Allgemeine Chemie II Frühjahrsemester 2013 1. Aufgabe Bohr hat für das Wasserstoffatom ein Modell erstellt, das der klassischen Mechanik gehorcht und gewisse Ähnlichkeiten mit dem Planetenmodell
z n z m e 2 WW-Kern-Kern H = H k + H e + H ek
 2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
Übungen Physik VI (Kerne und Teilchen) Sommersemester 2010
 Übungen Physik VI (Kerne und Teilchen) Sommersemester 21 Übungsblatt Nr. 3 Bearbeitung bis 6.5.21 Aufgabe 1: Neutronensterne Im Allgemeinen kann man annehmen, dass die Dichte in Zentrum von Neutronensternen
Übungen Physik VI (Kerne und Teilchen) Sommersemester 21 Übungsblatt Nr. 3 Bearbeitung bis 6.5.21 Aufgabe 1: Neutronensterne Im Allgemeinen kann man annehmen, dass die Dichte in Zentrum von Neutronensternen
Grundlagen der Theoretischen Chemie (TC 1)
 Grundlagen der Theoretischen Chemie (TC 1) Vorlesung: Mo 10h-12h, Do 9h-10h Übungen: Do 8h-9h (2 Gruppen: H1, B3; Betreuung: J. Plötner, IB) Vorlesungsmaterial + Übungen: http://www.chimie.ens.fr/umr8642/quantique/tc1-l6.pdf
Grundlagen der Theoretischen Chemie (TC 1) Vorlesung: Mo 10h-12h, Do 9h-10h Übungen: Do 8h-9h (2 Gruppen: H1, B3; Betreuung: J. Plötner, IB) Vorlesungsmaterial + Übungen: http://www.chimie.ens.fr/umr8642/quantique/tc1-l6.pdf
Übungen zur Vorlesung Physikalische Chemie II Lösungsvorschlag zu Blatt 5
 Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Schwingungen (Vibrationen) zweiatomiger Moleküle
 Schwingungen (Vibrationen) zweiatomiger Moleküle Das Molekülpotential ist die Potentialkurve für die Schwingung H 2 Molekül 0.0 2.5 4 5 6 H( 1s) + H( 3l ) Energie in ev 5.0 7.5 H( 1s) + H( 2l ) H( 1s)
Schwingungen (Vibrationen) zweiatomiger Moleküle Das Molekülpotential ist die Potentialkurve für die Schwingung H 2 Molekül 0.0 2.5 4 5 6 H( 1s) + H( 3l ) Energie in ev 5.0 7.5 H( 1s) + H( 2l ) H( 1s)
Ausarbeitung zum Theoretischen Seminar
 Ausarbeitung zum Theoretischen Seminar Kovalente Molekübindungen 28.01.2015 Robin.Stegmueller@googlemail.com Inhaltsverzeichnis 1 Einführung 1 1.1 Molekulare Bindungen......................... 1 1.2 Beispiel:
Ausarbeitung zum Theoretischen Seminar Kovalente Molekübindungen 28.01.2015 Robin.Stegmueller@googlemail.com Inhaltsverzeichnis 1 Einführung 1 1.1 Molekulare Bindungen......................... 1 1.2 Beispiel:
Theoretische Chemie (TC II) Computational Chemistry
 Theoretische Chemie (TC II) Computational Chemistry Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Dr. Matthias Ruckenbauer (matruc@theochem.uni-frankfurt.de) Dr. Haleh Hashemi
Theoretische Chemie (TC II) Computational Chemistry Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Dr. Matthias Ruckenbauer (matruc@theochem.uni-frankfurt.de) Dr. Haleh Hashemi
Die Erwartungswerte von Operatoren sind gegeben durch. (x, t)a (x, t) =h A i
 Die Wahrscheinlichkeit, das System zu einem bestimmten Zeitpunkt in einem bestimmten Zustand anzutreffen, ist durch das Betragsquadrat der Wellenfunktion (x, t) 2 gegeben Die Erwartungswerte von Operatoren
Die Wahrscheinlichkeit, das System zu einem bestimmten Zeitpunkt in einem bestimmten Zustand anzutreffen, ist durch das Betragsquadrat der Wellenfunktion (x, t) 2 gegeben Die Erwartungswerte von Operatoren
Das Hartree-Fock-Verfahren
 Das Hartree-Fock-Verfahren Seminar zur Theorie der Atome, Kerne und kondensierten Materie Jan Kaspari Westfälische Wilhelms-Universität Münster Fachbereich Physik Einführung Unter der Hartree-Fock-Methode
Das Hartree-Fock-Verfahren Seminar zur Theorie der Atome, Kerne und kondensierten Materie Jan Kaspari Westfälische Wilhelms-Universität Münster Fachbereich Physik Einführung Unter der Hartree-Fock-Methode
TC1 Grundlagen der Theoretischen Chemie
 TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Topic: Helium-Atom Vorlesung: Mo 10h-12h, Do9h-10h Übungen: Do 8h-9h Web site: http://www.theochem.uni-frankfurt.de/tc1
TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Topic: Helium-Atom Vorlesung: Mo 10h-12h, Do9h-10h Übungen: Do 8h-9h Web site: http://www.theochem.uni-frankfurt.de/tc1
Valenz-Bindungstheorie H 2 : s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie
 Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Physikalische Ursachen der Molekülbindung
 Physikalische Ursachen der Molekülbindung Molekülbindungen können auf verschiedene Arten entstehen: gemeinsame Elektronen durch räumliche Umrodnung der W keitverteilung - - + + Verringerung der kinetischen
Physikalische Ursachen der Molekülbindung Molekülbindungen können auf verschiedene Arten entstehen: gemeinsame Elektronen durch räumliche Umrodnung der W keitverteilung - - + + Verringerung der kinetischen
4.2.2.Das Wasserstoff-Molekül H 2 Vergleich der Wellenfunktionen für antiparallele Spinkonfiguration
 g 4.2.2.Das Wasserstoff-Molekül H 2 Vergleich der Wellenfunktionen für antiparallele Spinkonfiguration a () ϕ ( 2) ϕ ( 2) ϕ ( 1) ψ = ϕ + 1 b a b Heitler-London ( ) ϕ ( 2) + ϕ ( 2) ϕ ( 1) + [ ϕ ( 1) ϕ (
g 4.2.2.Das Wasserstoff-Molekül H 2 Vergleich der Wellenfunktionen für antiparallele Spinkonfiguration a () ϕ ( 2) ϕ ( 2) ϕ ( 1) ψ = ϕ + 1 b a b Heitler-London ( ) ϕ ( 2) + ϕ ( 2) ϕ ( 1) + [ ϕ ( 1) ϕ (
Die Hartree-Fock-Methode
 February 11, 2016 1 Herleitung der Hartree-Fock-Gleichung 2 Das Heliumatom Gauß sche s-basis Roothaan-Hall-Gleichung Moleküle Herleitung der Hartree-Fock-Gleichung Betrachten wir zunächst das H 2 -Molekül:
February 11, 2016 1 Herleitung der Hartree-Fock-Gleichung 2 Das Heliumatom Gauß sche s-basis Roothaan-Hall-Gleichung Moleküle Herleitung der Hartree-Fock-Gleichung Betrachten wir zunächst das H 2 -Molekül:
Chern-Simons Theorie. Thomas Unden, Sabrina Kröner 01. Feb Theorie der kondensierten Materie. Fraktionaler Quanten-Hall-Effekt
 Chern-Simons Theorie Thomas Unden, Sabrina Kröner 01. Feb. 2012 Theorie der kondensierten Materie Fraktionaler Quanten-Hall-Effekt Seite 2 Chern-Simons Theorie Thomas Unden, Sabrina Kröner 01. Feb. 2012
Chern-Simons Theorie Thomas Unden, Sabrina Kröner 01. Feb. 2012 Theorie der kondensierten Materie Fraktionaler Quanten-Hall-Effekt Seite 2 Chern-Simons Theorie Thomas Unden, Sabrina Kröner 01. Feb. 2012
Die chemische Bindung
 Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Moleküle. Zweiatomige Moleküle: H 2+
 Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
UNIVERSITÄT GREIFSWALD. Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE. Arbeitskreis Biophysikalische Chemie
 UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Biophysikalische Chemie Prof. Dr. Walter Langel Modelle für elektronische Zustände Einfachstes klassisches
UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Biophysikalische Chemie Prof. Dr. Walter Langel Modelle für elektronische Zustände Einfachstes klassisches
Protokoll Physikalisch-Chemisches Praktikum für Fortgeschrittene
 K.B. Datum des Praktikumstags: 23.10.2007 Matthias Ernst Protokoll-Datum: 24.10.2007 Gruppe 11 Assistent: A. Bihlmeier Testat: 1. Versuch (C1) - Berechnung kleiner Moleküle Aufgabenstellung Mithilfe des
K.B. Datum des Praktikumstags: 23.10.2007 Matthias Ernst Protokoll-Datum: 24.10.2007 Gruppe 11 Assistent: A. Bihlmeier Testat: 1. Versuch (C1) - Berechnung kleiner Moleküle Aufgabenstellung Mithilfe des
Elektronenstrukturrechnungen an Molekülen
 Elektronenstrukturrechnungen an Molekülen Seminar zur Theorie der Atome, Kerne und kondensierten Materie WS 13/14 Frank Lengers Westfälische Wilhelms-Universität Münster Fachbereich Physik 20. Januar 2014
Elektronenstrukturrechnungen an Molekülen Seminar zur Theorie der Atome, Kerne und kondensierten Materie WS 13/14 Frank Lengers Westfälische Wilhelms-Universität Münster Fachbereich Physik 20. Januar 2014
7 Zwei- und Dreidimensionale Probleme in kartesischen Koordinaten
 7 Zwei- und Dreidimensionale Probleme in kartesischen Koordinaten 7.1 Das Teilchen im -Dimensionalen Kasten Slide 119 Das Teilchen im Kasten Das Teilchen soll sich zwischen = 0 und = L und = 0 und = L
7 Zwei- und Dreidimensionale Probleme in kartesischen Koordinaten 7.1 Das Teilchen im -Dimensionalen Kasten Slide 119 Das Teilchen im Kasten Das Teilchen soll sich zwischen = 0 und = L und = 0 und = L
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
8 Das Wasserstoffatom
 8DAS WASSERSTOFFATOM 41 Nomenklatur von Rotations-Vibrations-Übergängen. Bei den Spektroskopikern hat sich folgender Code eingebürgert: J := J J = 1 0 1 Code O P Q R S Hinter diese Buchstaben schreibt
8DAS WASSERSTOFFATOM 41 Nomenklatur von Rotations-Vibrations-Übergängen. Bei den Spektroskopikern hat sich folgender Code eingebürgert: J := J J = 1 0 1 Code O P Q R S Hinter diese Buchstaben schreibt
VL 22 VL Periodensystem VL Röntgenstrahlung VL Homonukleare Moleküle VL Heteronukleare Moleküle
 VL 22 VL 20 20.1. Periodensystem VL 21 21.1. Röntgenstrahlung VL 22 22.1. Homonukleare Moleküle VL 23 23.1. Heteronukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 10.07.2012 1 Vorlesung 22:
VL 22 VL 20 20.1. Periodensystem VL 21 21.1. Röntgenstrahlung VL 22 22.1. Homonukleare Moleküle VL 23 23.1. Heteronukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 10.07.2012 1 Vorlesung 22:
Chemie für Biologen SS Georg Jansen AG Theoretische Organische Chemie Universität Duisburg Essen. (Teil 3: Kovalente Bindungen)
 Chemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische Chemie Universität Duisburg Essen (Teil 3: Kovalente Bindungen) (3) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung
Chemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische Chemie Universität Duisburg Essen (Teil 3: Kovalente Bindungen) (3) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung
Grundlagen der Chemie Allgemeine Chemie Teil 2
 Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
9 WOODWARD-HOFFMANN-REGELN 92
 9 WOODWARD-HOFFMANN-REGELN 92 Die SMOs des Reaktanden und der Produkte (die nach Idealisierung nicht mehr unterschieden werden) müssen konstruiert und nach ihrer Knotenstruktur energetisch klassifiziert
9 WOODWARD-HOFFMANN-REGELN 92 Die SMOs des Reaktanden und der Produkte (die nach Idealisierung nicht mehr unterschieden werden) müssen konstruiert und nach ihrer Knotenstruktur energetisch klassifiziert
Molekulare Kerndynamik. Grundlagen
 Grundlagen Bei der Bestimmung der elektronischen Struktur von Molekülen haben wir bis jetzt den Fall betrachtet, daß die Kerne fest sind. Lösung der elektronischen Schrödingergleichung in einem festen
Grundlagen Bei der Bestimmung der elektronischen Struktur von Molekülen haben wir bis jetzt den Fall betrachtet, daß die Kerne fest sind. Lösung der elektronischen Schrödingergleichung in einem festen
Atom-, Molekül- und Festkörperphysik
 Atom-, Molekül- und Festkörperphysik für LAK, SS 2013 Peter Puschnig basierend auf Unterlagen von Prof. Ulrich Hohenester 5. Vorlesung, 25. 4. 2013 Born Oppenheimernäherung, Molekülrotation, Molekülschwingungen
Atom-, Molekül- und Festkörperphysik für LAK, SS 2013 Peter Puschnig basierend auf Unterlagen von Prof. Ulrich Hohenester 5. Vorlesung, 25. 4. 2013 Born Oppenheimernäherung, Molekülrotation, Molekülschwingungen
Atome im elektrischen Feld
 Kapitel 3 Atome im elektrischen Feld 3.1 Beobachtung und experimenteller Befund Unter dem Einfluss elektrischer Felder kommt es zur Frequenzverschiebung und Aufspaltung in optischen Spektren. Dieser Effekt
Kapitel 3 Atome im elektrischen Feld 3.1 Beobachtung und experimenteller Befund Unter dem Einfluss elektrischer Felder kommt es zur Frequenzverschiebung und Aufspaltung in optischen Spektren. Dieser Effekt
Oktett-Theorie von Lewis
 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Theoretische Biophysikalische Chemie
 Theoretische Biophysikalische Chemie Thermochemie (und Schwingungsspektroskopie) Christoph Jacob DFG-CENTRUM FÜR FUNKTIONELLE NANOSTRUKTUREN 0 KIT 17.12.2012 Universität deschristoph Landes Baden-Württemberg
Theoretische Biophysikalische Chemie Thermochemie (und Schwingungsspektroskopie) Christoph Jacob DFG-CENTRUM FÜR FUNKTIONELLE NANOSTRUKTUREN 0 KIT 17.12.2012 Universität deschristoph Landes Baden-Württemberg
Dynamik von Molekülen. Rotationen und Schwingungen von Molekülen
 Rotationen und Schwingungen von Molekülen Schwingungen und Rotationen Bis jetzt haben wir immer den Fall betrachtet, daß die Kerne fest sind Was geschieht nun, wenn sich die Kerne bewegen können? Zwei
Rotationen und Schwingungen von Molekülen Schwingungen und Rotationen Bis jetzt haben wir immer den Fall betrachtet, daß die Kerne fest sind Was geschieht nun, wenn sich die Kerne bewegen können? Zwei
11. Quantenchemische Methoden
 Computeranwendung in der Chemie Informatik für Chemiker(innen) 11. Quantenchemische Methoden Jens Döbler 2004 "Computer in der Chemie", WS 2003-04, Humboldt-Universität VL11 Folie 1 Grundlagen Moleküle
Computeranwendung in der Chemie Informatik für Chemiker(innen) 11. Quantenchemische Methoden Jens Döbler 2004 "Computer in der Chemie", WS 2003-04, Humboldt-Universität VL11 Folie 1 Grundlagen Moleküle
VL 21 VL Periodensystem VL Röntgenstrahlung VL Homonukleare Moleküle VL Heteronukleare Moleküle
 VL 21 VL 19 20.1. Periodensystem VL 20 21.1. Röntgenstrahlung VL 21 22.1. Homonukleare Moleküle VL 22 23.1. Heteronukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 02.07.2013 1 Vorlesung 22:
VL 21 VL 19 20.1. Periodensystem VL 20 21.1. Röntgenstrahlung VL 21 22.1. Homonukleare Moleküle VL 22 23.1. Heteronukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 02.07.2013 1 Vorlesung 22:
Elektronenstrukturrechungen
 Seminar zur Theorie der Atome, Kerne und kondensierten Materie WS 13/14 Elektronenstrukturrechungen Basissätze und Elektronenkorrelation Bastian Schäfer 9.1.014 Inhaltsverzeichnis 1 Einleitung 1 Lösung
Seminar zur Theorie der Atome, Kerne und kondensierten Materie WS 13/14 Elektronenstrukturrechungen Basissätze und Elektronenkorrelation Bastian Schäfer 9.1.014 Inhaltsverzeichnis 1 Einleitung 1 Lösung
Vorlesung 20+21: Folien auf dem Web:
 Vorlesung 20+21: Roter Faden: Mehratomige Moleküle Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ Siehe auch: http://www.wmi.badw.de/teaching/lecturenotes/index.html und Alonso-Finn:
Vorlesung 20+21: Roter Faden: Mehratomige Moleküle Folien auf dem Web: http://www-ekp.physik.uni-karlsruhe.de/~deboer/ Siehe auch: http://www.wmi.badw.de/teaching/lecturenotes/index.html und Alonso-Finn:
ORGANISCHE CHEMIE 1. Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO...
 Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO... ORGANISCHE CHEMIE 1 16. Vorlesung, Freitag, 14. Juni 2013 I. Hybridorbitale im Kohlenstoff - Regeln für Wechselwirkung von Orbitalen - σ und π MO s
Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO... ORGANISCHE CHEMIE 1 16. Vorlesung, Freitag, 14. Juni 2013 I. Hybridorbitale im Kohlenstoff - Regeln für Wechselwirkung von Orbitalen - σ und π MO s
UNIVERSITÄT LEIPZIG INSTITUT FÜR THEORETISCHE PHYSIK
 UNIVERSITÄT LEIPZIG INSTITUT FÜR THEORETISCHE PHYSIK Quantenmechanik II Übungsblatt 10 Solutions 7. Wenn die zeitabhängige Störung periodisch in der Zeit ist, V = αx cos(ωt), mit einer Zahl α und einem
UNIVERSITÄT LEIPZIG INSTITUT FÜR THEORETISCHE PHYSIK Quantenmechanik II Übungsblatt 10 Solutions 7. Wenn die zeitabhängige Störung periodisch in der Zeit ist, V = αx cos(ωt), mit einer Zahl α und einem
[ H, L 2 ]=[ H, L z. ]=[ L 2, L z. U r = Warum haben wir soviel Zeit mit L 2 verbracht? = x 2 2. r 1 2. y 2 2. z 2 = 2. r 2 2 r
![[ H, L 2 ]=[ H, L z. ]=[ L 2, L z. U r = Warum haben wir soviel Zeit mit L 2 verbracht? = x 2 2. r 1 2. y 2 2. z 2 = 2. r 2 2 r [ H, L 2 ]=[ H, L z. ]=[ L 2, L z. U r = Warum haben wir soviel Zeit mit L 2 verbracht? = x 2 2. r 1 2. y 2 2. z 2 = 2. r 2 2 r](/thumbs/71/65107015.jpg) Warum haben wir soviel Zeit mit L 2 verbracht? = x 2 2 y 2 2 z 2 = 2 r 2 2 r r 1 2 L r 2 ħ 2 11. Das Wasserstoffatom H = p2 2 U r μ = Masse (statt m, da m später als Quantenzahl verwendet wird) U r = e2
Warum haben wir soviel Zeit mit L 2 verbracht? = x 2 2 y 2 2 z 2 = 2 r 2 2 r r 1 2 L r 2 ħ 2 11. Das Wasserstoffatom H = p2 2 U r μ = Masse (statt m, da m später als Quantenzahl verwendet wird) U r = e2
Der nichtrelativistische Hamiltonoperator für ein System aus N k Atomkernen (mit Ladung +Z n ) und N e = N k. n=1 Z n Elektronen lautet: z n z m e 2
 2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
3.7. Coulomb-Loch und FERMI-Loch Eigenschaften der Slater-Determinante: antisymmetrisches Produkt von Einelektronenfunktionen ( )" 2.
 3.7. Coulomb-Loch und FERMI-Loch Eigenschaften der Slater-Determinante: antisymmetrisches Produkt von Einelektronenfunktionen!( x 1,x ) = 1 ( ) " ( 1) ( ) " ( ) = 1 $ " 1 1 " 1 1 " 1 ( )" ( ) " 1 ( )"
3.7. Coulomb-Loch und FERMI-Loch Eigenschaften der Slater-Determinante: antisymmetrisches Produkt von Einelektronenfunktionen!( x 1,x ) = 1 ( ) " ( 1) ( ) " ( ) = 1 $ " 1 1 " 1 1 " 1 ( )" ( ) " 1 ( )"
UNIVERSITÄT LEIPZIG, ITP Quantenmechanik II, WS2009/2010
 UNIVERSITÄT LEIPZIG, ITP Quantenmechanik II, WS009/00 Übungsblatt 5: Musterlösungen Aufgabe 3 Die Lösung des ungestörten Problems ist wohl bekannt; wir führen die dimensionslose Koordinate: und finden
UNIVERSITÄT LEIPZIG, ITP Quantenmechanik II, WS009/00 Übungsblatt 5: Musterlösungen Aufgabe 3 Die Lösung des ungestörten Problems ist wohl bekannt; wir führen die dimensionslose Koordinate: und finden
Chemie für Biologen WS 2005/6 Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen (Teil 5: )
 Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
H LS = W ( r) L s, (2)
 Vorlesung 5 Feinstruktur der Atomspektren Wir betrachten ein Wasserstoffatom. Die Energieeigenwerte des diskreten Spektrums lauten E n = mα c n, (1 wobei α 1/137 die Feinstrukturkonstante, m die Elektronmasse
Vorlesung 5 Feinstruktur der Atomspektren Wir betrachten ein Wasserstoffatom. Die Energieeigenwerte des diskreten Spektrums lauten E n = mα c n, (1 wobei α 1/137 die Feinstrukturkonstante, m die Elektronmasse
ORGANISCHE CHEMIE 1. Stoff der 15. Vorlesung: Atommodell, Bindungsmodell...
 Stoff der 15. Vorlesung: Atommodell, Bindungsmodell... ORGANISCHE CHEMIE 1 15. Vorlesung, Dienstag, 07. Juni 2013 - Einelektronensysteme: H-Atom s,p,d Orbital - Mehrelektronensysteme: He-Atom Pauli-Prinzip,
Stoff der 15. Vorlesung: Atommodell, Bindungsmodell... ORGANISCHE CHEMIE 1 15. Vorlesung, Dienstag, 07. Juni 2013 - Einelektronensysteme: H-Atom s,p,d Orbital - Mehrelektronensysteme: He-Atom Pauli-Prinzip,
1.3 Mehrelektronensysteme
 .3 Mehrelektronensysteme.3. Helium Dies ist ein Drei-Teilchen-System. Hamilton-Operator: Näherung: unendlich schwerer Kern nicht relativistisch Ĥ = ˆ p m + ˆ p m e e + e 4πɛ 0 r 4πɛ 0 r }{{ 4πɛ } 0 r }{{
.3 Mehrelektronensysteme.3. Helium Dies ist ein Drei-Teilchen-System. Hamilton-Operator: Näherung: unendlich schwerer Kern nicht relativistisch Ĥ = ˆ p m + ˆ p m e e + e 4πɛ 0 r 4πɛ 0 r }{{ 4πɛ } 0 r }{{
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 4 Molekülstruktur Ausnahmen von der Oktettregel Hypervalente Verbindungen VSEPR Hybridisierung Molekülorbitale
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 4 Molekülstruktur Ausnahmen von der Oktettregel Hypervalente Verbindungen VSEPR Hybridisierung Molekülorbitale
Physik IV - Schriftliche Sessionsprüfung Sommer 2009
 Physik IV - Schriftliche Sessionsprüfung Sommer 2009 9:00 11:00, Samstag, 8. August 2009, HG F1 & HG F3 Bitte zur Kenntnis nehmen: Es befinden sich insgesamt SECHS Aufgaben auf VIER SEITEN. Es können insgesamt
Physik IV - Schriftliche Sessionsprüfung Sommer 2009 9:00 11:00, Samstag, 8. August 2009, HG F1 & HG F3 Bitte zur Kenntnis nehmen: Es befinden sich insgesamt SECHS Aufgaben auf VIER SEITEN. Es können insgesamt
Zusammenfassung Wasserstoffatom
 Ach ja... ter Teil der Vorlesung Prof. Dr. Tobias Hertel Lehrstuhl II für Physikalische Chemie Institut für Physikalische und Theoretische Chemie Raum 13 Tel.: 0931 318 6300 e-mail: tobias.hertel@uni-wuerzburg.de
Ach ja... ter Teil der Vorlesung Prof. Dr. Tobias Hertel Lehrstuhl II für Physikalische Chemie Institut für Physikalische und Theoretische Chemie Raum 13 Tel.: 0931 318 6300 e-mail: tobias.hertel@uni-wuerzburg.de
Spin- und Ortsraum-Wellenfunktion
 Spin- und Ortsraum-Wellenfunktion Der Spin,,lebt in einem unabhängigen abstrakten Raum. 02.07.2013 Michael Buballa 1 Spin- und Ortsraum-Wellenfunktion Der Spin,,lebt in einem unabhängigen abstrakten Raum.
Spin- und Ortsraum-Wellenfunktion Der Spin,,lebt in einem unabhängigen abstrakten Raum. 02.07.2013 Michael Buballa 1 Spin- und Ortsraum-Wellenfunktion Der Spin,,lebt in einem unabhängigen abstrakten Raum.
Formelsammlung. Wichtige Gleichungen der PC II. σ = spezifischer Widerstand. = κ = spezifische Leitfähigkeit. Λ = molare Leitfähigkeit
 ektocheme Fomesammung Wchtge Gechungen de PC R σ σ spezfsche Wdestand L κ κ spezfsche Letfähgket σ κ c moae Letfähgket υ υ υ z u F υ z u F. Kohausch sches Gesetz - - - k c. Kohausch sches Gesetz υ υ Genzetfähgket
ektocheme Fomesammung Wchtge Gechungen de PC R σ σ spezfsche Wdestand L κ κ spezfsche Letfähgket σ κ c moae Letfähgket υ υ υ z u F υ z u F. Kohausch sches Gesetz - - - k c. Kohausch sches Gesetz υ υ Genzetfähgket
Teilchen im elektromagnetischen Feld
 Kapitel 5 Teilchen im elektromagnetischen Feld Ausgearbeitet von Klaus Henrich, Mathias Dubke und Thomas Herwig Der erste Schritt zur Lösung eines quantenmechanischen Problems ist gewöhnlich das Aufstellen
Kapitel 5 Teilchen im elektromagnetischen Feld Ausgearbeitet von Klaus Henrich, Mathias Dubke und Thomas Herwig Der erste Schritt zur Lösung eines quantenmechanischen Problems ist gewöhnlich das Aufstellen
Seminar: ESR-Spektroskopie Spektroskopie in Flüssigkeiten. Florian Hupka Timo Wattjes
 Seminar: SR-Spektroskopie Spektroskopie in Flüssigkeiten Florian Hupka Timo Wattjes 30.05.2005 Inhaltserzeichnis inführung in die SR Wechselwirkungen in der SR lektron-zeeman Zeeman- Wechselwirkung Kern-Zeeman
Seminar: SR-Spektroskopie Spektroskopie in Flüssigkeiten Florian Hupka Timo Wattjes 30.05.2005 Inhaltserzeichnis inführung in die SR Wechselwirkungen in der SR lektron-zeeman Zeeman- Wechselwirkung Kern-Zeeman
Übungen zur Vorlesung Physikalische Chemie 2 (B. Sc.) Lösungsvorschlag zu Blatt 12
 Übungen zur Vorlesung Physikalische Chemie B. Sc. ösungsvorschlag zu Blatt 1 Prof. Dr. Norbert Hampp Jens Träger Wintersemester 7/8. 1. 8 Aufgabe 1 Welche Schwingungsübergänge in einem elektronischen Spektrum
Übungen zur Vorlesung Physikalische Chemie B. Sc. ösungsvorschlag zu Blatt 1 Prof. Dr. Norbert Hampp Jens Träger Wintersemester 7/8. 1. 8 Aufgabe 1 Welche Schwingungsübergänge in einem elektronischen Spektrum
Nachklausur: Quantentheorie I, WS 07/08
 Nachklausur: Quantentheorie I, WS 7/8 Prof. Dr. R. Friedrich Aufgabe : [ P.] Betrachten Sie die Bewegung eines Teilchens im konstanten Magnetfeld B = [,, b] a)[p.] Zeigen Sie, dass ein zugehöriges Vektorpotential
Nachklausur: Quantentheorie I, WS 7/8 Prof. Dr. R. Friedrich Aufgabe : [ P.] Betrachten Sie die Bewegung eines Teilchens im konstanten Magnetfeld B = [,, b] a)[p.] Zeigen Sie, dass ein zugehöriges Vektorpotential
Festkörperelektronik 4. Übung
 Festkörperelektronik 4. Übung Felix Glöckler 23. Juni 2006 1 Übersicht Themen heute: Feedback Spin Drehimpuls Wasserstoffatom, Bohr vs. Schrödinger Wasserstoffmolekülion, kovalente Bindung Elektronen in
Festkörperelektronik 4. Übung Felix Glöckler 23. Juni 2006 1 Übersicht Themen heute: Feedback Spin Drehimpuls Wasserstoffatom, Bohr vs. Schrödinger Wasserstoffmolekülion, kovalente Bindung Elektronen in
3 Moleküle. X = (R 1,R 2,...R M ) und x = (r 1,s 1,r 2,s 2,...r N,s N ).
 3 Moleküle Bei M gebundenen Atomen werden die gleichen Näherungen wie bei den Atomen zugrunde gelegt, wobei aber die Koordinaten R J der Atomkerne, ihre Massen M J und Ladungen Z J e 0 mit J = 1,2,...M
3 Moleküle Bei M gebundenen Atomen werden die gleichen Näherungen wie bei den Atomen zugrunde gelegt, wobei aber die Koordinaten R J der Atomkerne, ihre Massen M J und Ladungen Z J e 0 mit J = 1,2,...M
(2.65 ev), da sich die beiden Elektronen gegenseitig abstossen.
 phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
Übersicht Teil 1 - Atomphysik
 Übersicht Teil - Atomphysik Datum Tag Thema Dozent VL 3.4.3 Mittwoch Einführung Grundlegende Eigenschaften von Atomen Schlundt ÜB 5.4.3 Freitag Ausgabe Übung Langowski VL 8.4.3 Montag Kernstruktur des
Übersicht Teil - Atomphysik Datum Tag Thema Dozent VL 3.4.3 Mittwoch Einführung Grundlegende Eigenschaften von Atomen Schlundt ÜB 5.4.3 Freitag Ausgabe Übung Langowski VL 8.4.3 Montag Kernstruktur des
Arbeitsblatt: Bindungsarten & ihre Beschreibung durch AOs 3 (EVA geeignet)
 Ph/Ch UE Quantenchemie Datum: Arbeitsblatt: Bindungsarten & ihre Beschreibung durch AOs 3 (EVA geeignet) 5 Ziel: Darstellung von MOs aus AOs erklärt Bindungsarten Man kann an den elektrischen Ladungsdichten
Ph/Ch UE Quantenchemie Datum: Arbeitsblatt: Bindungsarten & ihre Beschreibung durch AOs 3 (EVA geeignet) 5 Ziel: Darstellung von MOs aus AOs erklärt Bindungsarten Man kann an den elektrischen Ladungsdichten
Cluster-Struktur in Kernen. Cluster: Aus mehr als einem Nukleon zusammengesetzten und identifizierbarem Subsystem
 Cluster-Struktur in Kernen Cluster: Aus mehr als einem Nukleon zusammengesetzten und identifizierbarem Subsystem Die Struktur von 11 Li Beim Aufbruch von 11 Li wird nicht nur ein Neutron herausgeschlagen
Cluster-Struktur in Kernen Cluster: Aus mehr als einem Nukleon zusammengesetzten und identifizierbarem Subsystem Die Struktur von 11 Li Beim Aufbruch von 11 Li wird nicht nur ein Neutron herausgeschlagen
Physikdepartment. Ferienkurs zur Experimentalphysik 4. Daniel Jost 09/09/15
 Physikdepartment Ferienkurs zur Experimentalphysik 4 Daniel Jost 09/09/15 Inhaltsverzeichnis Technische Universität München 1 Nachtrag: Helium-Atom 1 2 Röntgen-Spektren 2 3 Approximationen 6 3.1 Linear
Physikdepartment Ferienkurs zur Experimentalphysik 4 Daniel Jost 09/09/15 Inhaltsverzeichnis Technische Universität München 1 Nachtrag: Helium-Atom 1 2 Röntgen-Spektren 2 3 Approximationen 6 3.1 Linear
Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten oder in Festkörpern vor.
 phys4.025 Page 1 13. Moleküle Nur eine kleine Anzahl von Elementen kommt natürlich in Form von einzelnen Atomen vor. Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten
phys4.025 Page 1 13. Moleküle Nur eine kleine Anzahl von Elementen kommt natürlich in Form von einzelnen Atomen vor. Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten
Vorlesung 21. Identische Teilchen und das Pauli-Prinzip
 Vorlesung 1 Identische Teilchen und das Pauli-Prinzip Identische Teilchen: Jede Art von Teilchen in der Natur definieren wir durch ihre Eigenschaften, z.b. Massen, Spins, Ladungen usw. Das bedeutet, dass
Vorlesung 1 Identische Teilchen und das Pauli-Prinzip Identische Teilchen: Jede Art von Teilchen in der Natur definieren wir durch ihre Eigenschaften, z.b. Massen, Spins, Ladungen usw. Das bedeutet, dass
