Wirkstoffdossiers für externe dermatologische Rezepturen
|
|
|
- Busso Hummel
- vor 7 Jahren
- Abrufe
Transkript
1 Information zur Qualitätssicherung Wirkstoffdossiers für externe dermatologische Rezepturen GD Gesellschaft für Dermopharmazie Gustav-Heinemann-Ufer Köln Tel.: 02162/67454 Fax: 02162/ Inhaltsverzeichnis: Präambel 1 Definition Wirkstoffdossier 2 Zielgruppe und Zweck 3 Wirkstoffdossiers 3.1 Chlorhexidin-Salze [Chlorhexidindigluconat, Chlorhexidindiacetat] 3.2 Ciclopirox-Olamin 3.3 Clioquinol 3.4 Clotrimazol 3.5 Dithranol 3.6 Glucocorticosteroide Hydrocortison / Hydrocortisonacetat Prednisolon / Prednisolonacetat Dexamethason Triamcinolonacetonid Hydrocortisonbutyrat Prednicarbat Mometasonfuroat Betamethasonvalerat Clobetasolpropionat 3.7 Harnstoff 3.8 Lauromacrogol Methoxsalen 3.10 Metronidazol 3.11 Miconazolnitrat 3.12 Minoxidil 3.13 Octenidindihydrochlorid 3.14 Salicylsäure 3.15 Steinkohlenteerlösung 3.16 Tretinoin 3.17 Triclosan 3.18 Zinkoxid 3.99 Archiv: topische Antibiotika Chloramphenicol Erythromycin Gentamicinsulfat 4 Glossar 5 Literaturverzeichnis 6 Autoren GD - Gesellschaft für Dermopharmazie e.v August 2013
2 Zu den Grundforderungen an Arzneimittel einschließlich der Rezepturarzneimittel zählen Wirksamkeit, Unbedenklichkeit und pharmazeutische Qualität. Die Individualrezeptur erfordert insofern detaillierte, galenische und pharmakologische Kenntnisse, weil überwiegend Mehrphasensysteme vorliegen, deren und Wirksamkeit über den Anwendungszeitraum schwierig zu beurteilen sind. Dies gilt insbesondere für nicht standardisierte Rezepturen und Wirkstoffkombinationen. Die vorliegenden Information berücksichtigt schwerpunktmäßig die in der allgemein zugänglichen Fachliteratur zur Verfügung stehenden Daten. Wesentliche Bedeutung kommen in diesem Zusammenhang dem Qualitätsmanagement entsprechend der GD-Leitlinie Dermatologische Rezepturen, den Empfehlungen der Deutschen Dermatologischen Gesellschaft (DDG) und der Leitlinie der Bundesapothekerkammer zur von Rezepturen zu. Leitlinien und Empfehlungen bedürfen der regelmäßigen Überprüfung und gegebenenfalls der Änderung im Hinblick auf den wissenschaftlichen Erkenntnisstand und die praktische Relevanz. Verordnung werden beispielsweise die topischen Antibiotika kritisch beurteilt. Sie sollen durch geeignete Antiseptika ersetzt werden. Um sie im begründeten Einzelfall unter ärztlicher Nutzen- Risiko-Beurteilung dennoch in Betracht ziehen zu können, werden sie vorläufig noch in dem als Archiv bezeichneten, gesonderten Abschnitt 3.99 aufgeführt. 2 Zielgruppe und Zweck Die Information zur Qualitätssicherung richtet sich an Ärzte und Apotheker, falls bei der dermatologischen Verschreibung nicht auf geeignete Fertigarzneimittel oder auf standardisierte Rezepturarzneimittel zurückgegriffen werden kann. Solche Ad-hoc- Verordnungen sind hinsichtlich Sicherheit und Qualität der Rezepturarzneimittel einer Plausibilitätsprüfung zu unterziehen. 1 Definition Wirkstoffdossier Unter Wirkstoffdossier im Sinne dieser Information werden praxisorientierte Angaben zu häufig verordneten Dermatika- Wirkstoffen verstanden. Die relevanten chemischen, physikalischen und galenischen Eigenschaften sind in tabellarischer Übersicht zusammengestellt, anwendungsorientierte Informationen eingeschlossen. Die Auswahl der Stoffe für die Erstellung der Wirkstoffdossiers erhebt keinen Anspruch auf Vollständigkeit und lässt keine Rückschlüsse auf den therapeutischen Wert zu. Trotz häufiger GD - Gesellschaft für Dermopharmazie e.v August 2013
3 3. Wirkstoffdossiers 3.1 Chlorhexidin-Salze (Chlorhexidindigluconat, Chlorhexidindiacetat) Chlorhexidingluconat bzw. Chlorhexidinacetat Ph. Eur. Hautantiseptikum mit bakteriostatischen, virustatischen (umhüllte Viren) und fungistatischen Eigenschaften Breites antimikrobielles Wirkspektrum gegen die meisten gramnegativen und grampositiven Bakterien. Gering wirksam gegen Pseudomonas- und Proteus- Arten, Hefen, Dermatophyten und Mykobakterien. Großflächige Anwendung bei stark geschädigter Haut sowie bei schlecht durchblutetem Gewebe und Ulzera kontraindiziert. Von großflächiger Anwendung in Schwangerschaft und Stillzeit ist abzuraten. Als Wundantiseptikum obsolet, da die Wundheilung gehemmt wird. Wirkoptimum im neutralen bis leicht alkalischen (ph 6 8). 0,05 % 1 % Chlorhexidin-digluconat: 20%ige wässrige Lösung (m/v), farblos bis schwach gelblich, klar und geruchlos, bitterer Geschmack. Chlorhexidindiacetat: weißes bis fast weißes, kristallines, geruchloses, bitter schmeckendes Pulver. Löslichkeit Chlorhexidindigluconat: sehr leicht wasserlöslich Chlorhexidindiacetat: Wasser(20 C): 1,8 1,9 in 100 Ethanol: 6,6 in 100 Photoinstabil. Unter Lichtschutz gute chemische. ph-abhängige Zersetzung (Hydrolyse) durch Abspaltung von 4-Chloranilin (toxikologisch relevant), Zersetzungsgeschwindigkeit steigt bei Temperaturen > 110 C rasch an. Autoklavierbarkeit von Lösungen nach Einstellung auf ph 5-6 möglich. In Kombination mit weiteren Wirkstoffen Löslichkeitseinschränkungen und mögliche Fällungen beachten. ph 4 8 (35) (am günstigsten Neutralbereich) Fällungen mit fast allen anionischen Wirk- und Hilfsstoffen (Ausnahme u.a. Acetat). Graufärbungen mit Sorbinsäure konservierten Cremes. Nicht verschreibungspflichtig. Häufigste Anwendung als Mundspülung, in nichtionischen Hydro-Gelen, in nichtionischen hydrophilen Cremes und Emulsionen. Bei Chlorhexidin-Salzen kann eine Einwaagekorrektur aufgrund der Arzneibuchspezifikation erforderlich sein, siehe NRF I Rezeptur-Empfehlung Chlorhexidingluconat-Mundspülung 0,1% / 0,2% (NRF 7.2.) Hydrophile Chlorhexidindigluconat-Creme 0,5 / 0,1 % (NRF ) Ethanolhaltige Chlorhexidindigluconat-Lösung 0,5 / 1 % (NRF ) Hydrophile Triamcinolonacetonid-Creme 0,025 / 0,05 / 0,1 % mit Chlorhexidindigluconat 1 % (NRF ) Hydrophiles Calciumgluconat-Gel 2,5 % mit Chlorhexidingluconat 0,5 % (NRF 19.6.) Freie Rezeptur: Chlorhexidindigluconat 1 % in Kombination mit Fuchsin 0,4 % in 5 % Aceton-haltiger wässriger Lsg. als Ersatz für Solutio Castellani. Konservierung Chlorhexidin ist antimikrobiell wirksam. Konservierung nicht erforderlich. GD - Gesellschaft für Dermopharmazie e.v August 2013
4 3.2 Ciclopirox-Olamin - Ph. Eur. Antimykotikum mit antibakteriellen Eigenschaften. 1 % (als Ciclopirox oder als Salz) Weißes oder blassgelbes Pulver Löslichkeit Wasser: wenig löslich (schwer löslich als Ciclopirox) Ethanol 96 %: sehr leicht löslich (löslich als Ciclopirox) Rezeptur-Empfehlung Konservierung Lichtempfindlich. ph 2 10 (geschätzt) Ciclopirox-Fällung bei ph-erniedrigung (ggf. erwünscht als gezielte Fällung). Nicht verschreibungspflichtig. Bei Ciclopirox-Olamin kann eine Einwaagekorrektur aufgrund der Substanzspezifikation erforderlich sein, siehe NRF I Noch keine offizinellen standardisierten Vorschriften. Plausible Kombination mit Glucocorticosteroiden oder Salicylsäure nach Fällung als Ciclopirox im Sauren. Unsicher. Möglicherweise nicht erforderlich. GD - Gesellschaft für Dermopharmazie e.v August 2013
5 3.3 Clioquinol Clioquinolum, Iodochloroxychinolinum, Chloriodhydroxychinolinum, Vioform Clioquinol Ph. Eur. Als Antiseptikum, besonders bei Staphylokokken und Streptokokken-Infektion sowie bei durch Dermatophyten und Hefen verursachten Hauterkrankungen. Chelatbildner in Hautschutzsalben. Vorsicht: potentes Allergen (Epikutantest). Starke kutane Resorption. Nicht bei Säuglingen! 0,5 % 2% in Cremes, Salben, Pasten und Schüttelmixturen, in Pudern bis 25 %. Obere Richtkonzentration: 2%! (kleinflächig) Hellgelbes bis graubraungelbes, feinkristallines Pulver Löslichkeit Wasser und Vaselin: praktisch unlöslich Ethanol, Glycerol 85: sehr schwer löslich Propylenglycol: < 1 löslich Hydriertes Erdnussöl: 1 in Instabil gegenüber Licht und Feuchtigkeit (Verfärbung). Bei ph 5 liegt Clioquinol überwiegend undissoziiert als freies Phenol vor und ist in dieser Form ausreichend lipophil und somit wirksam. < ph 8 Stark oxidierende Stoffe (Zersetzung) sowie basisch und sauer reagierende Stoffe (Iodabspaltung). Gelbe Verfärbung mit Zinkoxid und Eisensalzen. Nichtionische Tenside vom Macrogol-Typ. Nicht verschreibungspflichtig. Kombination mit Zinkoxid, z. B. Zinkoxidschüttelmixtur, möglichst nicht rezeptieren bzw. verarbeiten. Als weniger stabilitätsgefährdete Alternative kommen Zinkoxidfreie Schüttelmixturen und ölige Suspensionen unter Verwendung von Titandioxid in Frage. Clioquinol verursacht auf der Kleidung schwer entfernbare Flecke. Clioquinol ist in den meisten Dermatika-Bestandteilen nur geringfügig löslich und liegt in suspendierter Form vor. Zubereitungen nur in lichtdichten Packmitteln (Aluminiumtuben) abfüllen. Arbeitsgeräte gleich nach der spülen, da sonst schwer entfernbare Verfärbungen entstehen. Bei Clioquinol kann eine Einwaagekorrektur aufgrund der Arzneibuchspezifikation erforderlich sein, siehe NRF I Rezeptur-Empfehlung Clioquinol-Salicyl-Vaselin 5 % / 2 % Zinkoxidfreie Schüttelmixturen und ölige Suspensionen unter Verwendung von Titandioxid Konservierung Zusätzliche Konservierung ist wegen der Lipophilie (schlechte Wasserlöslichkeit) der Substanz sinnvoll: Kaliumsorbat 0,07 % + Sorbinsäure 0,05 % Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % GD - Gesellschaft für Dermopharmazie e.v August 2013
6 3.4 Clotrimazol Clotrimazolum, Clotrimazole Clotrimazol Ph. Eur. Antimykotikum. Breites sspektrum mit schwach antibakterieller Wirksamkeit. Therapiedauer: 3 4 Wochen (sonst Rezidiv-Gefahr), ggf. auch länger; in der Regel mehrmals täglich auftragen. 1 % und 2 % in Cremes, Salben, Pasten, Lösungen. 1% in der Pädiatrie. weißes bis blassgelbes, feinkristallines oder mikronisiertes Pulver Clotrimazol 10 % Cordes RK: Suspensionskonzentrat mit Basis Cordes RK, Ichthyol-Gesellschaft Cordes Hermanni & Co KG Löslichkeit löslich in Macrogolsalbe DAC und fetten Ölen, wie z. B. Raffiniertes Erdnussöl Ethanol, 2-Propanol: 9,5 in 100 Macrogole (Polyethylenglycol 400): 6,0 in 100 Propylenglycol: 3,5 in 100 Wasser, Glycerol 85 % u. Paraffinen: praktisch unlöslich Schwach hygroskopisch. In Lösung ist die ph-abhängig (> ph 5 stabil, < ph 5 instabil). ph 5 10 Inaktivierung (Hydrolyse) durch saure Wirk- und Hilfsstoffe, z. B. Salicylsäure, Sorbinsäure. Nicht verschreibungspflichtig. In wasserhaltigen Zubereitungen Kombination mit sauren Bestandteilen (z.b. Salicylsäure) vermeiden. Zur Keratolyse Salicylsäure gegen Harnstoff austauschen. Für Suspensionszubereitungen mikronisierte Rezeptursubstanz oder Rezepturkonzentrat (s.o.) verwenden. Bei Clotrimazol kann eine Einwaagekorrektur aufgrund der Arzneibuchspezifikation erforderlich sein, siehe NRF I Rezeptur-Empfehlung Harnstoffpaste 40 % mit Clotrimazol 1 % (NRF ) z.b. Rezepturempfehlungen mit Rezepturkonzentrat der Ichthyol- Gesellschaft Cordes Hermanni & Co KG Konservierung PHB-Ester 0,1 % GD - Gesellschaft für Dermopharmazie e.v August 2013
7 3.5 Dithranol Dithranolum, Cignolin (ehemaliges Wz. der Fa. Bayer), Anthralin Dithranol Ph. Eur. Antipsoriatikum 0,05 % 3 % in Cremes, Salben, Pasten und Lösungen. Obere Richtkonzentration bei Behandlungsbeginn: 0,1 %! Obere Richtkonzentration bei Weiterbehandlung: 3,0 %! Gelbes, feinkristallines Pulver Löslichkeit Wasser: praktisch unlöslich Ethanol: sehr schwer löslich fette Öle und Octyldodecanol: löslich Photoinstabil; oxidative Zersetzung unter Sauerstoffeinfluss möglich. Färbt sich unter Sauerstoff-Einfluss über orange nach braun unter Bildung des unwirksamen Danthron. Als phenolischer Wirkstoff nur im sauren Milieu stabil, ausreichend lipophil und wirksam. ph 7 Basisch reagierende Stoffe, wie Zinkoxid (in wasserhaltigen Vehikeln als Zink-Kation); oxidierende Stoffe, wie Iod; Kombination von Dithranol und Steinkohlenteer bzw. Steinkohlenteerlösung führt zur raschen Oxidation des Dithranol, Wasser Verschreibungspflichtig. Dithranol nicht zusammen mit Zinkoxid in wasserhaltigen Grundlagen, Steinkohlenteer bzw. Steinkohlenteer-Lösung rezeptieren bzw. verarbeiten. Oxidationsschutz durch Salicylsäure-Zusatz 2 % insbesondere bei niedrigen en von Dithranol notwendig; bei > 2-prozentigen Zubereitungen nicht unbedingt erforderlich; Zubereitungen nur in lichtdichten Packmitteln (Aluminiumtuben) abfüllen. Rezeptur-Empfehlung Warzensalbe (Dithranol 1 %, Salicylsäure 25 %) (NRF ) Dithranol-Vaselin 0,05 2 % (NRF ) Dithranol-Vaselin 0,05 2 % mit Salicylsäure 2 % (NRF ) Abwaschbare Dithranol-Salbe 0,05 2 % (NRF ) Abwaschbare Dithranol-Salbe 0,05 2 % mit Salicylsäure 2 % (NRF ) Dithranol-Macrogol-Salbe 0,25 3 % (NRF ) Weiche Dithranol-Zinkpaste 0,05/0,1/0,5/1/2 % (NRF ) Konservierung Wasserfreie Zubereitungen sind mikrobiell nicht anfällig. Salicylsäure als enthaltener Wirkstoff bzw. Hilfsstoff ist antimikrobiell wirksam. Konservierungsstoff nicht erforderlich. GD - Gesellschaft für Dermopharmazie e.v August 2013
8 3.6 Topische Glucocorticosteroide Hydrocortison / -acetat Löslichkeit Hydrocortison: Hydrocortisonum, Cortisol Hydrocortisonacetat: Hydrocortisoni acetas, Hydrocortisone acetate Hydrocortison Ph. Eur. Hydrocortisonacetat Ph. Eur. Kortikoid-empfindliche chronische Dermatosen. Schwach wirksames, nichthalogeniertes Glucocorticosteroid (Wirkstärkeklasse I). r Index (TIX): 1,019) Pädiatrie: nicht mehr empfehlenswert, da TIX nur 1,0 Therapiedauer: in der Regel Kurztherapie; zu Behandlungsbeginn 1- bis 3-mal täglich dünn auftragen, Fortsetzung als Intervall- oder Stufentherapie oder als proaktive Therapie 0,25 1 % in Salben, Cremes, Hautemulsionen und Lösungen. Weißes kristallines, mikronisiertes Pulver, geruchlos Hydrocortison Wasser: praktisch unlöslich (0,028 g in 100 ml) 2-Propanol 70 % (V/V): 3 g in 100 g Ethanol: 1,5 g in 100 ml Propylenglycol: 1,27 g in 100 ml Hydrocortisonacetat Wasser: praktisch unlöslich (0,001 mg in 100 ml) Ethanol: 0,45 g in 100 ml (38) Hauptzersetzungsreaktion Hydrocortisonacetat: Hydrolyse der Ester-Funktion an C-21 zum kutan etwa gleich stark wirksamen Hydrocortison und Isomerisierung bei ph > 4 zu geringen Mengen Hydrocortison-17-acetat mit nachfolgender Oxidation der C-17- Dihydroxyaceton-Seitenkette. Vorteil Hydrocortison gegenüber dem Ester Hydrocortisonacetat ist die höhere Löslichkeit bei der von Hautspiritus-Rezepturen. Vorteil von Hydrocortisonacetat im Vergleich zur Alkoholform Hydrocortison ist die bessere Oxidationsstabilität in Rezepturen mit höheren ph-werten oder prooxidativen Faktoren (z.b. in Kombinationen mit Erythromycin, Harnstoff- oder Zinkoxid-haltigen Systemen). Haltbarkeit von Hydrocortisonacetat in hydrophilen Zubereitungen mit Zinkoxid zusammen bei RT auf 4 Monate beschränken (22). Hydrocortison: ph 3,5 4,5 (38), 3 6,5 Hydrocortisonacetat: ph 4,5 (24), (38), [3 7] Basisch reagierende Wirk- oder Hilfsstoffe, Metallionen, Oxidationsmittel. Verschreibungspflichtig, ausgenommen 0,5 % bis 30 g und 0,25 % bis 50 g. Siehe Hydrocortison und Hydrocortisonacetat im Vergleich. nicht unbedingt erforderlich; Zubereitungen nur in lichtdichten Packmitteln (Aluminiumtuben) abfüllen. Rezeptur-Empfehlung Hydrophile Hydrocortison-Creme 0,25/0,5/1 % (NRF ) Hydrophile Hydrocortisonacetat-Creme 0,25/0,5/1 % (NRF ) Hydrocortisonacetat-Suspension 0,5% mit Lidocainhydrochlorid und Dexpanthenol (NRF 7.14.) Hydrocortison, acetat-rezepturen der Ichthyol-Gesellschaft Konservierung Kaliumsorbat 0,07 % + Sorbinsäure 0,05 % Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % Propylenglycol 20 % (bezogen auf die Wassermenge) PHB-Ester 0,1 % GD - Gesellschaft für Dermopharmazie e.v August 2013
9 3.6.2 Prednisolon / Prednisolonacetat Prednisolonum, Prednisolone, 1,2-Dehydrocortison Prednisoloni acetas, Prednisolon-21-acetat Prednisolon Ph. Eur., Prednisolonacetat Ph. Eur. Kortikoid-empfindliche chronische Dermatosen. Schwach wirksames Glucocorticosteroid (Wirkstärkeklasse I). Im Vergleich zu Hydrocortison 4- bis 5-mal höhere glucocorticoide, unerwünschte mineralocorticoide 1/3 geringer. r Index (TIX): 1,019) Therapiedauer: in der Regel Kurztherapie; zu Behandlungsbeginn 1- bis 3-mal täglich dünn auftragen, Fortsetzung als Intervall- oder Stufentherapie Pädiatrie: nicht mehr empfehlenswert, da TIX nur 1,0 0,1 % 0,5 % in Salben, Cremes, Hautemulsionen und Lösungen weißes, mikronisiertes Pulver Prednisolon-Verreibung 10 % (pulverförmiges Konzentrat mit Reisstärke) Prednisolonacetat-Verreibung 1 % (Nichtionische hydrophile Creme SR DAC) (PKH-Halle) Prednisolonacetat-Konzentrat 2 % (Suspension; Weißes Vaselin) Löslichkeit Prednisolon: Wasser: 0,077 in 100 Ethanol 96 %: 3,3 in 100 Rizinusöl und Glycerol 85 %: 0,1 in 100 Dickflüssiges Paraffin und Erdnussöl: < 0,01 in 100 Prednisolonacetat: In Wasser praktisch unlöslich Ethanol 96 %: 0,74 in 100 Photoinstabil. Oxidative Zersetzung des Prednisolon durch basische Wirk- und Hilfsstoffe. Prednisolon ist in wasserhaltigen Zubereitungen instabil: Umkristallisation zum Hydrat in Form langer, nadelförmiger Kristalle. Prednisolonacetat zeigt keine Modifikation der Kristallform und ist deshalb zu bevorzugen. Prednisolonacetat ist in schwach sauren und neutralen, wässrigen Zubereitungen stabil. Prednisolon: ph 3 6,5 Prednisolonacetat: ph 4 7, ph 4,5 (24), (38) Prednisolon: Basisch reagierende Wirk- oder Hilfsstoffe (Harnstoff, Zinkoxid) beschleunigter Abbau; Schwermetallsalze, Oxidationsmittel. In wasserfreien lipophilen Zinkoxid-Zubereitungen (z.b. Weiche Zinkpaste) nur geringe Zersetzung. Prednisolonacetat in wasserhaltigen Zinkoxid-haltigen Zubereitungen stabiler als Prednisolon22). Haltbarkeit bei RT auf 4 Monate begrenzen22). Prednisolonacetat: in Bentonit-Gelen, hydrophilen Zinkoxid- Pasten, Polyacrylat-Gelen innerhalb von 4 Wochen signifikante Gehaltsabnahmen. Verschreibungspflichtig. Prednisolon sollte nicht zusammen mit anderen Wirkstoffen in wasserhaltigen Zubereitungen rezeptiert werden, deren ph-soptima stark abweichen. In wasserhaltigen Zubereitungen, wie O/W-Emulsionen bzw. Hautemulsionen, Prednisolonacetat in gleicher oder Rezepturkonzentrat (siehe ) einsetzen. Bei Prednisolon / Prednisolonacetat kann eine Einwaagekorrektur aufgrund der Arzneibuchspezifikation erforderlich sein, siehe NRF I Rezeptur-Empfehlung Hydrophile Prednisolonacetat-Creme 0,25 % / 0,5 % (NRF ) Konservierung Kaliumsorbat 0,07 % + Sorbinsäure 0,05 % Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % Propylenglycol 20 % (bezogen auf die Wassermenge) PHB-Ester 0,1 % GD - Gesellschaft für Dermopharmazie e.v August 2013
10 3.6.3 Dexamethason Dexamethasonum, Dexamethasone Dexamethason Ph. Eur. Glucokortikoid -empfindliche chronische Dermatosen. Schwach bis mittelstark wirksam (Wirkstärke I II) Therapiedauer: in der Regel Kurztherapie; zu Behandlungsbeginn 1- bis 3-mal täglich dünn auftragen, Fortsetzung als Intervall- oder Stufentherapie. Nicht bei Säuglingen und Kleinkindern anwenden. 0,01 % 0,05 % in Salben, Cremes und Lösungen. Obere Richtkonzentration: 0,1 % (Dexamethason und -acetat) weißes, mikronisiertes Pulver Dexamethason-Verreibung 1 % (hydrophiles Suspensionskonzentrat auf Basis der Nichtionischen hydrophilen Creme SR DAC (NRF S.26.)(PKH) Dexamethason-Verreibung 10 % (pulverförmiges Konzentrat mit Reisstärke [Fa. Fagron, Barsbüttel]) Löslichkeit Wasser: praktisch unlöslich Ethanol 96 %: 1 in 42 Teilen Propylenglycol: 1 in 100 Teilen ph 3,0 3,5 (38) (Dexamethason gelöst). Zersetzung im Basischen (24). In 0,1-prozentiger traten in 3- bis 10-prozentigen Harnstoff- Cremes und Emulsionen vom Typ W/O bei etwa ph 8,0 8,5 rasch starke Verluste an Dexamethason auf. Abbau ist auch über Erhöhung der Löslichkeit und temperaturabhängig vermittelt. Zubereitungen mit ph-werten 6,5 7,5 zeigen innerhalb von 3 Monaten keine Gehaltsminderungen. Rezeptur-Empfehlung Sauer bis neutral. ph 2 7. ph-optimum 3,5 (39) Basisch reagierende Wirk- oder Hilfsstoffe, Metallionen, Oxidationsmittel. Verschreibungspflichtig. Basisch reagierende wasserhaltige Dexamethason-Rezepturen nicht herstellen. Dies gilt besonders für Zubereitungen mit niedriger (z.b. 0,01 % 0,05 % Dexamethason), bei denen der gelöste Wirkstoffanteil im Vergleich zum suspendierten Anteil relativ höher ist als bei höher dosierten Rezepturen. Für Suspensionszubereitungen mikronisierte Rezeptursubstanz oder Rezepturkonzentrat (s.o.) verwenden. Keine standardisierten Rezepturen bekannt. Konservierung Kaliumsorbat 0,07 % + Sorbinsäure 0,05 % Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % Propylenglycol 20 % (bezogen auf die Wassermenge) PHB-Ester 0,1 % GD - Gesellschaft für Dermopharmazie e.v August 2013
11 3.6.4 Triamcinolonacetonid Triamcinolonum acetonatum, Triamcinoloni acetonidum, Triamcinolone acetonide Triamcinolonacetonid Ph. Eur. Kortikoid-empfindliche chronische Dermatosen. Mittelstark wirksames Glucocorticosteroid (Wirkstärkeklasse II); r Index (TIX): 1,06 (19) Therapiedauer: in der Regel Kurztherapie; zu Behandlungsbeginn 1- bis 3-mal täglich dünn auftragen, Fortsetzung als Intervall- oder Stufentherapie. Pädiatrie: Einschränkungen nach Körperoberfläche (10 %) 0,025 % 0,1 % in Salben, Cremes, Hydrogelen und Haftpasten zur Anwendung auf der Haut und Schleimhaut, 0,2 % in alkoholischen Lösungen. Obere Richtkonzentration: 0,2 %! Weißes bis cremeweißes, mikronisiertes Pulver. Triamcinolonacetonid-Verreibung 10 % (pulverförmiges Konzentrat mit Reisstärke [Fa. Fagron, Barsbüttel]). Triamcinolonacetonid- Konzentrat 2 % (Weißes Vaselin [Fa. Caelo]). Triamcinolonacetonid-Verreibung 1 % [Fa. PKH Halle]. Löslichkeit Wasser: praktisch unlöslich Ethanol 96 %: 5 in 100 Ethanol 40 % (V/V): 0,144 in Propanol: 4 in 100 Alkoholische Lösungen photoinstabil. Triamcinolonacetonid ist säureempfindlich. Bei rezepturmäßiger bestehen jedoch derzeit keine durch experimentelle Befunde begründete Bedenken gegen die Kombination mit Salicylsäure. Hydrolyse bei ph 2 zu Triamcinolon und Aceton38). Zwischen ph 6 und ph 9 ändert sich die Zersetzungsgeschwindigkeit nur wenig. Für Triamcinolonacetonid legen diese Befunde einen rezeptierbaren Bereich zwischen ph 1,5 und 9,0 nahe bei niedriger Triamcinolonacetonid- oder hohem gelösten Anteil den Bereich zwischen ph 2,0 und 6,0. ph 2,0 9,0; möglichst im schwach Sauren. Rezeptur-Empfehlung Basisch und stark sauer reagierende Wirk- oder Hilfsstoffe. Hydrolytische und oxidative Zersetzung in Kombination mit dem schwach basisch reagierenden Zinkoxid sind wahrscheinlich (Haltbarkeitsbegrenzung auf weniger als 3 Monate (38)). Oxidationsmittel. Keine physikalischen en innerhalb von 2 Monaten wurden in einer 0,1%igen Creme bei Kombinationen mit 2 % Salicylsäure, 5 % LCD, 0,25 % Kampfer, 0,25 % Menthol und 0,25 % Phenol (34) festgestellt. Beim Mischen mit 10 % Urea (nicht stabilisiert) fand sich im gleichen Zeitraum ein Gehaltsverlust von 45 %! (34) Verschreibungspflichtig. Triamcinolon (Alkoholform) bei kutaner Anwendung kaum wirksam, deshalb bei Verschreibung auf genaue Bezeichnung des Wirkstoffes achten: Triamcinolonacetonid! Mit anderen Wirkstoffen nicht in fixen Kombinationen rezeptieren, sondern nur rational im begründeten Einzelfall. Therapeutisch begründete, aber inkompatible Wirkstoff-Kombinationen als getrennte Rezepturen verordnen und Applikation alternierend in zeitlichem Abstand. Für Suspensionszubereitungen mikronisierte Rezeptursubstanz oder Rezepturkonzentrat (s.o.) verwenden. Bei Triamcinolonacetonid kann eine Einwaagekorrektur aufgrund der Arzneibuchspezifikation erforderlich sein, siehe NRF I Hydrophile Triamcinolonacetonid-Creme 0,025 / 0,05 / 0,1 % (NRF ). Triamcinolonacetonid- Hautspiritus 0,2 % mit Salicylsäure 2 % (NRF ). Hydrophile Triamcinolonacetonid-Emulsion 0,025 / 0,05 / 0,1 % (NRF ). Salicylsäure-Öl 2/5/10 % mit Triamcinolonacetonid 0,1 % (NRF ). Abwaschbares Salicylsäure-Öl 2 / 5 / 10 % mit Triamcinolonacetonid 0,1 % (NRF ) Hydrophile Triamcinolonacetonid-Creme 0,025 / 0,05 / 0,1 % mit Chlorhexidindigluconat 1 % (NRF ). Triamcinolonacetonid-Haftpaste 0,1 % (NRF 7.10.) Konservierung Kaliumsorbat 0,07 % + Sorbinsäure 0,05 %. Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 %. Propylenglycol 20 % (bezogen auf die Wassermenge). PHB-Ester 0,1 % GD - Gesellschaft für Dermopharmazie e.v August 2013
12 3.6.5 Hydrocortisonbutyrat Hydrocortisoni butyras, Hydrocortison-17-butyrat Hydrocortisonbutyrat DAC Mittelstark wirksames topisches Glukokortikoid (Klasse II). r Index: TIX 219). Zur Behandlung von Dermatosen und Ekzemen. 0,1 % in Salben, Cremes und Lösungen. Weißes bis fast weißes mikronisiertes Pulver Löslichkeit Wasser: praktisch unlöslich Ethanol 96 %: wenig löslich Rezeptur-Empfehlung Hydrolyse- und oxidationsempfindlich in Analogie zu verwandten Glucocorticoiden ph 3 5 ( der Creme nach USP: 3,5 4,5) Basisch reagierende Wirk- oder Hilfsstoffe ohne ph-korrektur (Zinkoxid, Erythromycin, Dexpanthenol, Natriumfusidat), Metallionen, Oxidationsmittel. Verschreibungspflichtig. Ggf. für Kleinkinder und Säuglinge auch in en unter 0,1 %. Kombination mit Octenidindihydrochlorid in nichtionischer hydrophiler Creme ist plausibel. Keine standardisierten Rezepturen bekannt. Konservierung Kaliumsorbat 0,07 % + Sorbinsäure 0,05 % Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % Propylenglycol 20 % (bezogen auf die Wassermenge) PHB-Ester 0,1 % GD - Gesellschaft für Dermopharmazie e.v August 2013
13 3.6.6 Prednicarbat Prednicarbatum Prednicarbat Ph. Eur. Mittelstark wirksames topisches Glukokortikoid (Klasse II). r Index: TIX 2 (19). Zur Behandlung von Dermatosen und Ekzemen. 0,25 % in Salben, Cremes und Lösungen. Bei Kleinkindern und Säuglingen auch 0,08 bis 0,15 % in hydrophilen Cremes. Weißes bis fast weißes mikronisiertes Pulver Löslichkeit Wasser: praktisch unlöslich Ethanol 96 %: leicht löslich Propylenglycol: wenig löslich Hydrolyse- und oxidationsempfindlich in Analogie zu verwandten Glucocorticoiden Möglichst < ph 4 Basisch reagierende Wirk- oder Hilfsstoffe (Zinkoxid, Erythromycin, Dexpanthenol, Natriumfusidat), Metallionen, Oxidationsmittel. Verschreibungspflichtig. Kombination mit Octenidindihydrochlorid in nichtionischen hydrophilen Cremes und Emulsionen ist plausibel. Rezeptur-Empfehlung Hydrophile Prednicarbat-Creme 0,08% / 0,15% / 0,25% (NRF ). Konservierung Kaliumsorbat 0,07 % + Sorbinsäure 0,05 % Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % Propylenglycol 20 % (bezogen auf die Wassermenge) PHB-Ester 0,1 % GD - Gesellschaft für Dermopharmazie e.v August 2013
14 3.6.7 Mometasonfuroat Löslichkeit Rezeptur-Empfehlung Mometasoni furoas Mometasonfuroat Ph. Eur. Stark wirksames (Klasse III), in der Therapie der atopischen Dermatitis. Mittelstarkes topisches Glucocorticoid. r Index: TIX 2 (19). Zur Behandlung von Dermatosen und Ekzemen 0,1 % in Salben, Cremes und Lösungen. Weißes bis fast weißes mikronisiertes Pulver Wasser: praktisch unlöslich Ethanol 96 %: schwer löslich Hydrolyse- und oxidationsempfindlich in Analogie zu verwandten Glucocorticoiden Möglichst < ph 4 Basisch reagierende Wirk- oder Hilfsstoffe (Zinkoxid, Erythromycin, Dexpanthenol, Natriumfusidat), Metallionen, Oxidationsmittel. Verschreibungspflichtig. Kombination mit Octenidindihydrochlorid in nichtionischen hydrophilen Cremes und Emulsionen ist plausibel. Kombination mit Ciclopirox in hydrophilen Cremes ist nach Fällung als Ciclopirox im Sauren plausibel. Keine standardisierten Rezepturen bekannt. Konservierung Kaliumsorbat 0,07 % + Sorbinsäure 0,05 % Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % Propylenglycol 20 % (bezogen auf die Wassermenge) PHB-Ester 0,1 % GD - Gesellschaft für Dermopharmazie e.v August 2013
15 3.6.8 Betamethasonvalerat Betamethasoni valeras, Betamethasonum valerianicum, Betamethason-17-valerat, Betamethasone valerate Betamethasonvalerat Ph. Eur. Glucocorticoid-empfindliche chronische Dermatosen. Die Alkoholform (Betamethason) ist kutan unwirksam. mittelstark wirksames Glucocorticoid (Wirkstärkeklasse II) 0,05 % stark wirksames Glucocorticoid (Wirkstärkeklasse III) 0,1 % r Index (TIX): 1,2 (19) Therapiedauer: in der Regel Kurztherapie; zu Behandlungsbeginn 1- bis 3-mal täglich dünn auftragen, Fortsetzung als Intervall- oder Stufentherapie. 0,05 % 0,1 % in Salben, Cremes, Lösungen (Hautspiritus) und Haftpasten zur Anwendung auf der Haut und Schleimhaut. Obere Richtkonzentration 0,15 %! weißes bis cremeweißes, geruch- und geschmackloses, mikronisiertes Pulver Betamethason-V 1,22 % Cordes RK: Suspensionskonzentrat mit Basis Cordes RK (Ichthyol-Gesellschaft Cordes Hermanni & Co KG) Betamethasonvalerat-Verreibung 10 % mit Reisstärke (Fa. Fagron, Barsbüttel) Betamethasonvalerat Verreibung 1 % mit Basiscreme [Fa. PKH, Halle] Löslichkeit Wasser: praktisch unlöslich Ethanol 96 %: 6 bis 8 in Propanol: 2 in 100 Mittelkettige Triglyceride und Paraffin: schwer löslich (7) Photoinstabil. Instabilitäten durch oxidierende Substanzen. Instabil im stark sauren und schwach bis stark basischen Milieu. Bei Kombination mit Salicylsäure in Cremes keine Zersetzung bei üblicher Anwendungsdauer. Isomerisierung zum Betamethason-21-valerat ( 85 % sverlust), dann Hydrolyse zum Betamethason (extern unwirksam). In wasserfreien Salbengrundlagen sehr stabil; in hydrophilen Cremes, Emulsionen und alkoholischen Lösungen Risiko der Zersetzung und Umkristallisation. ph 2 5 (7) ph-optimum 3,5 (38) Instabilität durch basisch reagierende Bestandteile und Schwermetalle. Betamethasonvalerat + Zink-Pasten: nach 7 Tagen 10 % Wirkstoff-Verlust (38) Verschreibungspflichtig. Betamethason (Alkoholform) bei kutaner Anwendung kaum wirksam, deshalb bei Verschreibung auf genaue Bezeichnung des Wirkstoffes achten: Betamethasonvalerat! Betamethasonvalerat sollte nicht mit anderen Wirkstoffen in fixen Kombinationen rezeptiert werden (nur im rational begründeten Einzelfall). Therapeutisch begründete, aber inkompatible Wirkstoff-Kombinationen als getrennte Rezepturen verordnen und Applikation alternierend in zeitlichem Abstand. Für Suspensionszubereitungen mikronisierte Rezeptursubstanz oder Rezepturkonzentrat (s.o.) verwenden. Bei Betamethasonvalerat kann eine Einwaagekorrektur aufgrund der Arzneibuchspezifikation erforderlich sein, siehe NRF I Rezeptur-Empfehlung Betamethasonvalerat-Haftpaste 0,1 % (NRF 7.11.) Hydrophile Betamethasonvalerat-Creme 0,025/0,05/0,1 % (NRF ) Hydrophile Betamethasonvalerat-Hautemulsion 0,025 / 0,05 / 0,1 % (NRF ) z.b. Rezepturempfehlungen mit Rezepturkonzentrat der Ichthyol-Gesellschaft Cordes Hermanni & Co KG Konservierung Kaliumsorbat 0,07 % + Sorbinsäure 0,05 % Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % PHB-Ester Propylenglycol 20 % (bezogen auf die Wassermenge) GD - Gesellschaft für Dermopharmazie e.v August 2013
16 3.6.9 Clobetasolpropionat Clobetasoli propionas, Clobetasolum propionicum, Clobetasol-17-propionat, Clobetasol Propionate Clobetasolpropionat Ph. Eur. Kortikoid-empfindliche chronische Dermatosen. Strenge Indikationsstellung (Aufbereitungsmonographie). Die Alkoholform (Clobetasol) ist kutan unwirksam. sehr stark wirksames Glucocorticoid (Wirkstärkeklasse IV) 0,05 % r Index (TIX): 1,5 Therapiedauer: in der Regel Kurztherapie; zu Behandlungsbeginn 1- bis 3-mal täglich dünn auftragen, Fortsetzung als Intervall- oder Stufentherapie. Pädiatrie: nicht bei Säuglinge und Kleinkindern. Obere Richtkonzentration 0,05 %! weißes bis schwach gelbliches, mikronisiertes Pulver Clobetasol 0,5 % Cordes RK: Suspensionskonzentrat mit Basis Cordes RK (Ichthyol-Gesellschaft Cordes Hermanni & Co KG) Clobetasol-17-propionat-Verreibung 10 % (pulverförmiges Konzentrat mit Reisstärke [Fa. Fagron, Barsbüttel]) Clobetasolpropionat-Verreibung 0,5 % in Basiscreme [Fa. PKH] Löslichkeit Wasser: praktisch unlöslich Ethanol: schwer löslich Propylenglycol 0,7 in 100 Hydrolyseempfindlich. Substanz nicht über 25 C lagern. ph 3 6 Inaktivierung durch basisch oder stark sauer reagierende Wirk- oder Hilfsstoffe. Verschreibungspflichtig. Zusatz von Harnstoff oder Salicylsäure zur Keratolyse ist therapeutisch umstritten. Bei Verarbeitung von Clobetasolpropionat in wässrigen Zubereitungen ansäuern. Dazu geeignet ist ein Citratpuffer (Citronensäure-Lösung 0,5 % + Natriumcitrat-Lösung 0,5 % zu gleichen Teilen) in 5-prozentiger bezogen auf die Gesamtmasse der Zubereitung. Für Suspensionszubereitungen mikronisierte Rezeptursubstanz oder Rezepturkonzentrat (s.o.) verwenden. Bei Clobetasolpropionat kann eine Einwaagekorrektur aufgrund der Arzneibuchspezifikation erforderlich sein, siehe NRF I Rezeptur-Empfehlung Hydrophile Clobetasolpropionat-Creme 0,05 % (NRF ). Konservierung Kaliumsorbat 0,07 % + Sorbinsäure 0,05 % Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % Propylenglycol 20 % (bezogen auf die Wassermenge) PHB-Ester 0,1 % GD - Gesellschaft für Dermopharmazie e.v August 2013
17 3.7 Harnstoff Urea pura, Carbamidum, Carbonyldiamid Harnstoff Ph. Eur. Bei trockener Haut und chronischen Dermatosen zur Hydratisierung der Hornschicht (Moisturizer). Als Keratolytikum und Penetrationsbeschleuniger oft in Kombination mit Glucocorticosteroiden. Pädiatrie: Wegen Stinging-Effekts nicht bei Kindern < 2 Jahre. 3 % 10 % bei trockener Haut, selten 20 %. 40 % 50 % als starkes Keratolytikum zur Nagelablösung. Grobe, farblose Kristalle oder feinkristallines Pulver. Schwach hygroskopisch. Rasche Verklumpung bei Lagerung ohne Trockenmittel. Löslichkeit Wasser: sehr leicht löslich (1 in 1) Glycerol 85 %: 50 in 100 Ethanol 95 %: 10 in 100 Fette Öle, Wachse und andere Lipide: praktisch unlöslich Wasserfreie Salben: Harnstoff ist suspendiert. Chemisch und physikalisch sehr stabil. Wasserhaltige Grundlagen: Harnstoff ist gelöst. Ohne Pufferung allmählich hydrolytische Zersetzung (beschleunigt durch Wärme), dabei deutlicher ph-anstieg. Zersetzungsprodukte: Ammoniumcyanat, Ammoniak, Kohlendioxid. ph 4 8 ph 6,2 (24) Rezeptur-Empfehlung Konservierung Wirk- und Hilfsstoffe, deren ph-soptima im stark sauren Bereich liegen. Nicht verschreibungspflichtig. Wasserfreie Salben: suspendiert als fein zerkleinerter Harnstoff, Homogenisierung mit dem Dreiwalzenstuhl, ggf. Rezepturkonzentrat verwenden, z.b. Harnstoff-Stammverreibung 50 % (NRF S.8.); Feingemahlene Handelsware auf durchgehende Pulverfeinheit prüfen (Teilchengröße mikroskopisch kontrollieren), ggf. erneut verreiben.wasserhaltige Grundlagen: gelöst im Wasseranteil. 1. W/O: Harnstoff vorher lösen, dann einarbeiten 2. O/W: Harnstoff aufstreuen und einarbeiten. Wärmeanwendung vermeiden! ph-anstieg lässt sich durch Zusatz schwach saurer Pufferlösungen verzögern (üblicherweise Lactat- Puffer ph 4,2 bei NRF-Vorschriften, aber auch Citrat-Puffer ph 4,2 oder Phosphat- Puffer ph 6). Pufferzusatz bei Wirkstoffkombinationen mit basenempfindlichen Substanzen (z.b. Glucocorticosteroide und bei sauren Konservierungsmitteln wie Sorbinsäure und Benzoesäure). Auskristallisieren von Harnstoff ( Sandeffekt ). Durch Abfüllung in Aluminiumtuben (Verdunstungsschutz!) verhindern. Bei Harnstoff kann eine Einwaagekorrektur aufgrund der Arzneibuchspezifikation erforderlich sein, siehe NRF I Harnstoff-Paste 40 % (NRF ). Harnstoff-Paste 40 % mit Clotrimazol 1 % (NRF ). Hydrophile Harnstoff-Creme 5 / 10 % (NRF ) Hydrophile Harnstoff- Emulsion 5 / 10 % (NRF ). Harnstoff-Cetomacrogolsalbe creme 10 % (NRF ). Harnstoff-Wollwachsalkoholcreme 5 / 10 % (NRF ). Lipophile Harnstoff-Natriumchlorid Creme (NRF ). Lipophile Polidocanol-Creme 5 % mit Harnstoff 5 % (NRF ). Lipophile Harnstoff-Creme 5/10 % (NRF ) Antimikrobielle von Harnstoff unsicher. Konservierung wasserhaltiger Zubereitungen vorzugsweise mit Kaliumsorbat 0,14 % bei saurer Pufferung PHB-Ester GD - Gesellschaft für Dermopharmazie e.v August 2013
18 3.8 Lauromacrogol 400 Lauromacrogolum 400, Polidocanol 600, Thesit, Macrogol-9-laurylether (Ph. Eur.; als Hilfsstoff), Laureth-9 (INCI,) techn. und in Kosmetik. Kennzahl 400 steht für den mittleren Anteil des Macrogol-Anteils, 600 für die mittlere Molekülmasse der Substanz, 9 für die Anzahl der Ethylenoxideinheiten. Lauromacrogol 400 Ph. Eur. Oberflächenanästhetikum und Antipruriginosum. Zur Sklerosierungstherapie (Proktologie). 0,5 % 10 % in hydrophilen und wasserarmen, lipophilen Cremes, 3 10 % in abwaschbaren Ölen und Ölbädern, bis 10 % in Injektionslösungen zur Sklerosierungs- Therapie (Proktologie). Halbfeste, weiße oder fast weiße Substanz, über 25 C klare, farblose, höchstens schwach gelbe und viskose Flüssigkeit. Höhere Reinheit als für den synonymen O/W-Emulgator Macrogol-9-laurylether (Ph. Eur.) gefordert. Die unter dem Warenzeichen angebotene Thesit -Rezeptursubstanz muss nach der Wirkstoffmonographie geprüft sein. Löslichkeit Wasser, Propylenglycol: mischbar Ethanol 96%: sehr leicht mischbar Glycerol 85%: wenig mischbar Fette Öle: zum Teil mischbar Gelbfärbung während der Lagerzeit möglich (Oxidation der Macrogolgruppen), hygroskopisch. ph-unabhängig W/O-Grundlagen mit > 10 20% Wasseranteil (z.b. Wasserhaltige Wollwachsalkoholsalbe DAB), nichtionische Emulgatoren (möglicherweise Creme- Verflüssigung durch Mischmizell-Bildung mit dem nichtionischen Tensid Polidocanol, HLB 14,3). Nicht verschreibungspflichtig. Entmischung während der Lagerung bei Raumtemperatur in festen und flüssigen Anteil möglich. Aufbewahrung kühl bzw. im Kühlschrank oder vor Entnahme einer Teilmenge die Substanz durch Aufschmelzen im Wasserbad (40 50 C) homogenisieren. Augenkontakt durch Verspritzen vermeiden (Schutzbrille). Verarbeitung in lipophilen Cremes ist nur mit sehr geringem Wasseranteil möglich, vorzugsweise in standardisierter Vorschrift des NRF auf Basis der Hydrophoben Basiscreme DAC (NRF ) mit reduziertem Wasseranteil (s.u.). Rezeptur-Empfehlung Polidocanol-600-Zinkoxidschüttelmixtur 3/5/10 % (NRF ) Hydrophiles Polidocanol-Gel 5 % (NRF ) Hydrophile Polidocanol-Creme 5/10 % (NRF ) Lipophile Polidocanol-Creme 5/10 % (NRF ) Lipophile Polidocanol-Creme 5/10 % mit Harnstoff 5 % (NRF ) Ethanolhaltige Polidocanol-600-Sklerotisierungslösung 10 % (m/v) (NRF 5.8.) Konservierung Polidocanol ist nicht ausreichend antimikrobiell wirksam. Zusätzliche Konservierung ist erforderlich Propylenglycol (20 % bezogen auf die Wassermenge) Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % PHB-Ester GD - Gesellschaft für Dermopharmazie e.v August 2013
19 3.9 Methoxsalen 8-Methoxypsoralen, 8-MOP, Ammoidin Methoxsalen DAC Lokale PUVA-Therapie vor allem bei Psoriasis vulgaris und beim Atopischen Ekzem: PUVA-Creme-Therapie PUVA-Bad-Therapie (Vollbäder, Folienbäder, Teilbäder für Hand oder Fuss, PUVA-Turban) Hauptwirkung: photosensibilisierender Effekt. Antiproliferativer Effekt durch Hemmwirkung auf die epidermale DNA-Synthese und Zellteilung. Immunmodulierende (down-regulierung der Lymphozyten). Kontraindikation: maligne Hauttumore, gleichzeitige Anwendung von Immunsuppressiva, Zytostatika oder potentiell phototoxischen Arzneimitteln, Patienten mit Immundefekten, Lupus erythematodes, Schwangerschaft und Stillzeit, Kinder und Jugendliche < 13 Jahre. PUVA-Creme-Therapie: 0,0006-0,005 % PUVA-Bad-Therapie: 0,5 1,0 mg/l Badewasser 37 C Obere Richtkonzentration: 0,005 % Weiße bis schwach gelbliche Kristallnadeln. Stark elektrostatische Faser- Konglomerate. Methoxsalen 0,006 % Cordes RK: Lösungskonzentrat mit Basis Cordes RK (Ichthyol-Gesellschaft Cordes Hermanni & Co KG) Löslichkeit Wasser: praktisch unlöslich Ethanol (kalt): 0,01 in 100; Ethanol (siedend): löslich, vgl. NRF Propanol: 0,7 in 100 Propylenglycol, pflanzliche Öle: löslich Aceton: löslich (2,5 in 100) Photoinstabil. Unter Lichtausschluss chemisch stabil. Abfüllung der Rezepturen ausschließlich in Aluminiumtuben bzw. braun gefärbte Kunststoffflasche (kein Glas wegen Bruchgefahr). Im Alkalischen (ph 9) Hydrolyse durch Ringspaltung. ph 5 7 Alkalien; stärker saure Lösungen (ph < 2) Verschreibungspflichtig. Arbeitsschutz: Zur halbfester Zubereitungen halbfestes Rezepturkonzentrat verwenden, vgl. NRF Beim Umgang mit Methoxsalen-Kristallen zur Entnahme der Substanz und Einbringung in sgefäß Pinzette verwenden. Rezeptur-Empfehlung Methoxsalen-Badekonzentrat 0,5 % (m/v) (NRF ) Hydrophile Methoxsalen-Creme 0,0006 % (NRF ) Rezeptur-Vorschläge der Ichthyol-Gesellschaft, Hamburg Konservierung Propylenglycol 20 % (bezogen auf die Wassermenge) Ethanol, vgl. NRF GD - Gesellschaft für Dermopharmazie e.v August 2013
20 3.10 Metronidazol Metronidazolum, Metronidazole Metronidazol Ph. Eur. Rosacea. Chemotherapeutikum. Metronidazol wirkt unter aeroben Bedingungen in der dermatologischen Externa-Therapie antiphlogistisch, antiproliferativ und immunmodulierend. Die antimikrobielle (nur unter anaeroben Bedingungen) spielt bei der Therapie der Rosazea keine Rolle. Pädiatrie: kaum Indikationen. 2-mal täglich dünn auftragen. 0,5 3 % in Cremes, Gelen und Lösungen. Obere Richtkonzentration 3,0 %! weißes, kristallines oder mikronisiertes Pulver; bitterer, leicht salziger Geschmack Metronidazol-Verreibung 10 % mit Nichtionischer hydrophiler Creme SR DAC (PKH Halle) Metronidazol Verreibung 25 % mit Weißem Vaselin Löslichkeit Wasser (25 C): 1 in 100 verdünnte Säuren: 10 in 100 Ethanol (25 C): 1,5 in 100 Ethanol (20 C): 0,5 in 100 Photoinstabil. Bei Lichteinwirkung dunkle Verfärbung. Erhitzen und Lichteinfluss fördern Zersetzung. Substanz lichtgeschützt bei RT > 5 Jahre stabil. Wässrige Lösung auf ph 5 mit Citronensäure/Phosphat-Puffer eingestellt > 3 Jahre haltbar. Im neutralen und alkalischen Milieu Zersetzung. ph 4 6 Basisch reagierende Wirkstoffe. Verschreibungspflichtig. Metronidazol soll nicht ohne weiteres mit anderen Wirkstoffen zusammen rezeptiert und verarbeitet werden, deren soptima weit von ph 5 abweichen. Bei Einarbeitung von Metronidazol in wasserhaltige Zubereitungen wie O/W-Cremes, insbesondere bei 1 %-igen Zubereitungen, Wärmeanwendung vermeiden. Es entstehen übersättigte Lösungen, aus denen beim Abkühlen Metronidazol auskristallisiert. Bei Einsatz von automatischen Salbenrührsystemen muss die erzeugte Reibungswärme durch Kühlung effektiv abgeführt werden. NRF empfiehlt per Hand. Für Suspensionszubereitungen mikronisierte Rezeptursubstanz oder Rezepturkonzentrat (s.o.) verwenden. Rezeptur-Empfehlung Hydrophile Metronidazol-Creme 1 / 2 % (NRF ) Hydrophiles Metronidazol-Gel 0,75 % (NRF ) Hydrophile Erythromycin-Creme 2 % mit Metronidazol 1 % (NRF ) Konservierung Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % Propylenglycol 20 % (bezogen auf die Wassermenge) GD - Gesellschaft für Dermopharmazie e.v August 2013
21 3.11 Miconazolnitrat - Miconazolnitrat Ph.Eur. Fungistatische und fungizide, antibakterielle gegen einige grampositive Bakterien Lokal bei Pilzinfektionen der Haut und Schleimhaut wie z.b. Candidose, Mundsoor, Dermatophytose, Pityriasis versicolor Einsatz gegen Leishmania-protozoa-Arten sowie Acanthamoeba keratitis beschrieben, Wirksamkeit fraglich. Perorale und vaginale Anwendung in Schwangerschaft und Stillzeit kontraindiziert. Perorale Aufnahme durch Mundgele führt zu Interaktionen mit Antikoagulanzien vom Warfarin-Typ, Hydantoinen, Terbinafin, Midazolam, Statinen, Cyclosporin u.a. Auch bei Zubereitungen zur vaginalen Anwendung sind diese Interaktionen möglich. 1 % 2 % Weißes bis fast weißes, geruchloses bis fast geruchloses, kristallines oder mikronisiertes Pulver Löslichkeit Wasser: 1 in 3000 Ethanol 96 %: 1 in 140 Chemisch stabil ph Nicht verschreibungspflichtig. Suspensionszubereitungen mit mikrofeiner Pulversubstanz. Zubereitung ohne Wärmeanwendung (Rekristallisation) Rezeptur-Empfehlung Hydrophile Miconazolnitrat-Creme 2 % (NRF ) Konservierung Kaliumsorbat 0,07 % + Sorbinsäure 0,05 % Sorbinsäure 0,1 % entsprechend Kaliumsorbat 0,14 % + Citronensäure, wasserfrei 0,07 % Propylenglycol 20 % (bezogen auf die Wassermenge) PHB-Ester 0,1 % GD - Gesellschaft für Dermopharmazie e.v August 2013
22 3.12 Minoxidil - Minoxidil Ph. Eur. Haarwuchsmittel, androgenetische Alopezie, Kombination mit Estrogenen kann therapeutisch sinnvoll sein. sweise nicht geklärt, verzögerter seintritt. Maximum der erst nach 1 Jahr. Kontraindikation: Jugendliche < 18 Jahre aufgrund fehlender klinischer Erfahrungen, Schwangerschaft und Stillzeit. 2 % 5 % Weißes oder fast weißes, geruchloses, feinkristallines Pulver Löslichkeit Wasser: 1 in 500 Ethanol: 1 2 in 100 Propylenglycol: löslich (mehr als 2 g / 100 ml) Löslichkeit ist bei geringem Wasseranteil im Mehrkomponentengemisch, z.b. für Propylenglycol-Ethanol-Wasser-Mischungen, maximal. Photoinstabil. Nicht reproduzierbare Gelb- oder Orangefärbung begrenzt die Haltbarkeit; Ursache und Möglichkeiten zur Vermeidung sind nicht bekannt. Nicht < 20 C aufbewahren, da Minoxidil wegen Übersättigung auskristallisiert. ph 4 6 Ausfällung, Kristallwachstum aufgrund begrenzter Wirkstofflöslichkeit in zu gering konzentriertem Ethanol-Propylenglycol-Wasser-Gemisch. Nicht verschreibungspflichtig. Fertigarzneimittel mit Minoxidil 2 % und Minoxidil 5 % zugelassen. Bei der ist auf ein optimales Verhältnis der Lösungsmittel Alkohol, Wasser und Propylenglycol zu achten! Rezeptur-Empfehlung Minoxidil-Haarspiritus 2 % / 5 % (NRF ) Individualrezeptur: Minoxidil 2 %, Propylenglycol 15 g, Gereinigtes Wasser 15 g, Ethanol 96 % zu 100,0 g [Achtung! Reihenfolge: Minoxidil in Propylenglycol/Ethanol-Mischung lösen; zum Schluss Wasser hinzugeben] Konservierung Konservierungsmittel-Zusatz bei Minoxidil-Haarspiritus wegen antimikrobieller Eigenschaft des Alkohols nicht erforderlich. GD - Gesellschaft für Dermopharmazie e.v August 2013
23 3.13 Octenidindihydrochlorid Octenidinhydrochlorid in Vorbereitung für DAC Haut-, Wund- und Schleimhautantiseptikum vom Bispyridin-Typ; breite mikrobizide und fungizide, nicht sporozid (35). Kein Eiweißfehler (35). Ersatz für Triclosan und Erythromycin bei der topischen Anwendung gegen Staphylokokken. 0,1 % 0,2 % Weißes oder fast weißes Pulver Löslichkeit Wasser: löslich Photostabil (35). Autoklvierbar (35). Rezeptur-Empfehlung Konservierung ph 2 12 (35) Als Kation Fällungen mit anionischen Gelbildnern, Tensiden und bestimmten Wirkstoffen. Nicht verschreibungspflichtig. Bei Octenidindihydrochlorid kann eine Einwaagekorrektur aufgrund der Substanzspezifikation erforderlich sein, siehe NRF I Noch keine offizinellen standardisierten Vorschriften. Nasensalben, Lösungen, nichtionische hydrophile Cremes. Wahrscheinlich nicht erforderlich. GD - Gesellschaft für Dermopharmazie e.v August 2013
24 3.14 Salicylsäure Acidum salicylicum, Salicylic acid, 2-Hydroxybenzoesäure Salicylsäure Ph. Eur. Keratolytikum und Antiseptikum. sabhängig ausgeprägte keratolytische, antiinflammatorische, antibakterielle und fungizide. Salicylatvergiftungen durch perkutane Resorption möglich, insbesondere bei verletzter Haut und bei Babys und Kleinkindern. 0,5 20 % in Salben, Cremes, Lösungen (Hautspiritus), Kopföle und Schälpasten. Obere Richtkonzentration: 3 % (großflächige Anwendung)! Pädiatrie: 1 3% nur kleinflächig weißes, geruchloses, unterschiedlich fein gepulvertes, kristallines Pulver oder Kristallnadeln; handelsübliche Pulverware (Acidum salicylicum plv. subt.) sollte mikroskopisch auf durchgängige Pulverfeinheit beurteilt werden. Salicylsäure-Verreibung 50 % DAC: hydrophobes Suspensions-konzentrat (PKH Halle, Caesar & Loretz, Hilden, Fa. Fagron, Barsbüttel) Salicylsäure-Verreibung 50 %: hydrophiles Suspensions-Konzentrat (PKH Halle) Löslichkeit Wasser, siedendes: 0,2 in 100. Ethanol 96 %: 7 in 100. Octyldodecanol: 8 in 100 Glycerol 85 % und Mittelkettige Triglyceride: 4,8 in 100. Erdnussöl, Olivenöl und Oleyloleat: 2,2 2,5 in 100. Rizinusöl: 12 in 100. Mischungen Rizinusöl/Oliven- oder Erdnussöl: (3+1) 9,9 in 100; (1+1) 8,4 in 100; (1+3) 5,4 in 100. Macrogol-4-laurylether: 2 in 10. Vaselin und Dickflüssiges Paraffin: 0,03 0,06 in 100 Rekristallisiert aus übersättigten Lösungen nach dem Abkühlen. Gefahr von Kristallwachstum, insbesondere in hydrophilen Cremes durch Anlösen der Salicylsäure mit Rizinusöl oder Ethanol. Gesättigte wässrige Lösung: ph = 2,4. ph < 3 Eisen(III)-Salze (Rotfärbung), Iod (Fällung), Macrogole, Zinksalze (Komplexverbindungen), ggf. Zinkoxid gegen Titandioxid austauschen. Nicht verschreibungspflichtig (Salicylsäure-Monorezeptur). Suspensionssalben: Gefahr von Kristallwachstum, deshalb Salicylsäure nicht mit Bestandteilen mit gutem Lösevermögen anreiben, z.b. Rizinusöl, Alkohole oder Tenside sowie Wärmeanwendung bei vermeiden. Bevorzugt hydrophile und lipophile Salicylsäure- Rezepturkonzentrate 50 (siehe ) einsetzen. Bei Salicylsäure- kann eine Einwaagekorrektur aufgrund der Arzneibuchspezifikation erforderlich sein, siehe NRF I Salicylsäure-Öle: Lösevermögen und unterschiedlicher Öl-Grundlagen beachten. Salicylsäure- soll nicht höher als 2/3 der Sättigungslöslichkeit (siehe NRF ) sein. Hydrophile Salicylsäure-Lösungen: alkoholisch und glycolisch (Propylenglycol). Octyldodecanol als rückfettender Fettalkohol. Rezeptur-Empfehlung Milchsäure-haltiges Salicylsäure-Collodium 10 % (NRF ). Salicylsäure-Aknespiritus 5/10 % (NRF ). Salicylsäure-Vaselin 1/2/3/5/10/20 % (NRF ). Salicylsäure-Öl 2/5/10 % (NRF ). Fettender Salicylsäure-Hautspiritus 1/2/3/5 % (NRF ). Ethanolhaltiges Salicylsäure-Gel 6 % (NRF ). 2-Propanolhaltiger Salicylsäure- Hautspiritus 1/2/3/5/10 % (NRF ). Abwaschbares Salicylsäure-Öl 2/5/10 % (NRF ). Hydrophile Salicylsäure-Creme 5 % (NRF ). Hydrophile Salicylsäure-Creme 5 % mit Steinkohlenteerspiritus 10 % (NRF ). Salicylsäure-Öl 2/5/10 % mit Triamcinolonacetonid 0,1 % (NRF ). Abwaschbares Salicylsäure-Öl 2/5/10 % mit Triamcinolonacetonid 0,1 % (NRF ) Konservierung Salicylsäure ist antimikrobiell wirksam. Konservierung nicht erforderlich bei 1 Salicylsäure. GD - Gesellschaft für Dermopharmazie e.v August 2013
Wirkstoffdossiers für externe dermatologische Rezepturen
 Empfehlung zur Qualitätssicherung Wirkstoffdossiers für externe dermatologische Rezepturen GD Gesellschaft für Dermopharmazie Gustav-Heinemann-Ufer 92 50968 Köln Tel.: 02162/67454 Fax: 02162/80589 E-Mail:
Empfehlung zur Qualitätssicherung Wirkstoffdossiers für externe dermatologische Rezepturen GD Gesellschaft für Dermopharmazie Gustav-Heinemann-Ufer 92 50968 Köln Tel.: 02162/67454 Fax: 02162/80589 E-Mail:
Wirkstoffdossiers für externe dermatologische Rezepturen
 Empfehlung zur Qualitätssicherung Wirkstoffdossiers für externe dermatologische Rezepturen GD Gesellschaft für Dermopharmazie Gustav-Heinemann-Ufer 92 50968 Köln Tel.: 02162/67454 Fax: 02162/80589 E-Mail:
Empfehlung zur Qualitätssicherung Wirkstoffdossiers für externe dermatologische Rezepturen GD Gesellschaft für Dermopharmazie Gustav-Heinemann-Ufer 92 50968 Köln Tel.: 02162/67454 Fax: 02162/80589 E-Mail:
Inhaltsverzeichnis. Allgemeiner Teil. Individualrezeptur Systematik und Herstellung. Vorwortzur ersten Auflage...
 IX Vorwortzur dritten Auflage... Vorwortzur ersten Auflage... Abkürzungen... Wichtige Begriffe... VII VIII XV XVI I Allgemeiner Teil 1 Therapeutische und wirtschaftliche Aspekte der Individualrezeptur...
IX Vorwortzur dritten Auflage... Vorwortzur ersten Auflage... Abkürzungen... Wichtige Begriffe... VII VIII XV XVI I Allgemeiner Teil 1 Therapeutische und wirtschaftliche Aspekte der Individualrezeptur...
Wirkstoffdossiers für externe dermatologische Rezepturen
 Empfehlung der GD Gesellschaft für Dermopharmazie e. V. Wirkstoffdossiers für externe dermatologische Rezepturen GD Gesellschaft für Dermopharmazie Gustav-Heinemann-Ufer 92 50968 Köln Tel.: 02162/67454
Empfehlung der GD Gesellschaft für Dermopharmazie e. V. Wirkstoffdossiers für externe dermatologische Rezepturen GD Gesellschaft für Dermopharmazie Gustav-Heinemann-Ufer 92 50968 Köln Tel.: 02162/67454
1.1 Qualitätsanforderungen an 1.3 Überholte Traditionen des dermatologische Rezeptur- dermatologischen Rezeptierens 17 arzneimittel...
 Inhaltsverzeichnis 1 Warum rezeptieren? 1.1 Qualitätsanforderungen an 1.3 Überholte Traditionen des dermatologische Rezeptur- dermatologischen Rezeptierens 17 arzneimittel... 15 1.3.1 Traditionalistisches
Inhaltsverzeichnis 1 Warum rezeptieren? 1.1 Qualitätsanforderungen an 1.3 Überholte Traditionen des dermatologische Rezeptur- dermatologischen Rezeptierens 17 arzneimittel... 15 1.3.1 Traditionalistisches
Zusammensetzung der Salben/-grundlagen und Konzentratverreibungen der PKH GmbH
 Zusammensetzung der Salben/-grundlagen und Konzentratverreibungen der PKH GmbH Alle Nennungen von Arzneibüchern beziehen sich auf die jeweils aktuellen Fassungen, sofern nichts anderes angegeben ist. Hautpflegesalbe
Zusammensetzung der Salben/-grundlagen und Konzentratverreibungen der PKH GmbH Alle Nennungen von Arzneibüchern beziehen sich auf die jeweils aktuellen Fassungen, sofern nichts anderes angegeben ist. Hautpflegesalbe
Dermatologische Rezepturen
 Dermatologische Rezepturen Richtig verschreiben - individuell therapieren Bearbeitet von Claus Garbe, Holger Reimann 3., aktualisierte Auflage 2017. Buch inkl. Online-Nutzung. 176 S. Softcover ISBN 978
Dermatologische Rezepturen Richtig verschreiben - individuell therapieren Bearbeitet von Claus Garbe, Holger Reimann 3., aktualisierte Auflage 2017. Buch inkl. Online-Nutzung. 176 S. Softcover ISBN 978
ÜBERSICHT VERARBEITUNGS- EMPFEHLUNGEN
 VERARBEITUNGS- EMPFEHLUNGEN GUTEN TAG, sehr geehrtes Apotheken-Team, mit dieser Übersicht der Verarbeitungsempfehlungen möchten wir Ihnen einen schnellen Überblick über unsere abgeprüften Herstellungsempfehlungen
VERARBEITUNGS- EMPFEHLUNGEN GUTEN TAG, sehr geehrtes Apotheken-Team, mit dieser Übersicht der Verarbeitungsempfehlungen möchten wir Ihnen einen schnellen Überblick über unsere abgeprüften Herstellungsempfehlungen
Fit für die Plausibilitätsprüfung. Ingrid Tieke Caesar & Loretz GmbH
 Fit für die Plausibilitätsprüfung Ingrid Tieke Caesar & Loretz GmbH Hilden, 22. Juni 2016 Gliederung 1. Dosierung 2. Applikationsart 3. Wirkstoffart 4. Menge 5. Bedenkliche Arzneistoffe? 6. Kompatibilitätsprüfung
Fit für die Plausibilitätsprüfung Ingrid Tieke Caesar & Loretz GmbH Hilden, 22. Juni 2016 Gliederung 1. Dosierung 2. Applikationsart 3. Wirkstoffart 4. Menge 5. Bedenkliche Arzneistoffe? 6. Kompatibilitätsprüfung
Einführung Einführung <Kolumnentitel>
 Einführung Laut 7 Apothekenbetriebsordnung (ApBetrO) ist vor der Anfertigung eines Rezepturarzneimittels eine Plausibilitätsprüfung durchzuführen, die neben Dosierung und Applikationsart insbesondere auch
Einführung Laut 7 Apothekenbetriebsordnung (ApBetrO) ist vor der Anfertigung eines Rezepturarzneimittels eine Plausibilitätsprüfung durchzuführen, die neben Dosierung und Applikationsart insbesondere auch
ÜBERSICHT VERARBEITUNGS- EMPFEHLUNGEN
 VERARBEITUNGS- EMPFEHLUNGEN GUTEN TAG, sehr geehrtes Apotheken-Team, mit dieser Übersicht der Verarbeitungsempfehlungen möchten wir Ihnen einen schnellen Überblick über unsere abgeprüften Herstellungsempfehlungen
VERARBEITUNGS- EMPFEHLUNGEN GUTEN TAG, sehr geehrtes Apotheken-Team, mit dieser Übersicht der Verarbeitungsempfehlungen möchten wir Ihnen einen schnellen Überblick über unsere abgeprüften Herstellungsempfehlungen
Inhaltsverzeichnis. Standardisierte Rezepturen 19
 Inhaltsverzeichnis Einleitung 1 Angaben bei den Rezepturformeln 2 Richtig und rationell Rezeptieren 3 Die Gebrauchsanweisung 5 Bedenkliche Rezepturarzneimittel 7 Normkonzentrationen, pädiatrische Konzentrationen
Inhaltsverzeichnis Einleitung 1 Angaben bei den Rezepturformeln 2 Richtig und rationell Rezeptieren 3 Die Gebrauchsanweisung 5 Bedenkliche Rezepturarzneimittel 7 Normkonzentrationen, pädiatrische Konzentrationen
REZEPTUREN / DEFEKTUREN (Dermatologie Campus Kiel und Campus Lübeck)
 UNIVERSITÄTSKLINIKUM Schleswig-Holstein Campus Lübeck Dezernat Apotheke REZEPTUREN / DEFEKTUREN (Dermatologie Campus Kiel und Campus Lübeck) in der Apotheke des Universitätsklinikums Schleswig-Holstein
UNIVERSITÄTSKLINIKUM Schleswig-Holstein Campus Lübeck Dezernat Apotheke REZEPTUREN / DEFEKTUREN (Dermatologie Campus Kiel und Campus Lübeck) in der Apotheke des Universitätsklinikums Schleswig-Holstein
2.4 Pasten. Halbfeste Arzneiformen
 104 Halbfeste Arzneiformen 2.4 Pasten Suspensionssalben, die einen Feststoffanteil größer als 10% aufweisen, werden als Pasten bezeichnet. Diese hochkonzentrierten Suspensionssalben stellen den Übergang
104 Halbfeste Arzneiformen 2.4 Pasten Suspensionssalben, die einen Feststoffanteil größer als 10% aufweisen, werden als Pasten bezeichnet. Diese hochkonzentrierten Suspensionssalben stellen den Übergang
Vortragszusammenfassungen
 13. Jahrestagung der Gesellschaft für Dermopharmazie Heidelberg, 1. April 2009 en Symposium der GD-Fachgruppe Magistralrezepturen Klinische Erfahrungen und therapeutischer Nutzen von dermatologischen Rezepturen
13. Jahrestagung der Gesellschaft für Dermopharmazie Heidelberg, 1. April 2009 en Symposium der GD-Fachgruppe Magistralrezepturen Klinische Erfahrungen und therapeutischer Nutzen von dermatologischen Rezepturen
Leitlinie Dermatologische Rezepturen der Gesellschaft für Dermopharmazie
 Leitlinie Dermatologische Rezepturen der Gesellschaft für Dermopharmazie Leitfaden für bessere Rezepturqualität Warum eine Leitlinie? 1997 Untersuchung zum Verordnungsverhalten in der Dermatologie in Deutschland
Leitlinie Dermatologische Rezepturen der Gesellschaft für Dermopharmazie Leitfaden für bessere Rezepturqualität Warum eine Leitlinie? 1997 Untersuchung zum Verordnungsverhalten in der Dermatologie in Deutschland
Hydrophile Betamethasonvalerat- Emulsion 0,05 % (NRF ) UNGUATOR 2100
 Hydrophile Betamethasonvalerat- Emulsion 0,05 % (NRF 11.47.) UNGUATOR 2100 Betamethasonvalerat (mikrofein gepulvert) 0,0375 g Hydrophile Hautemulsionsgrundlage ad 75,0000 g In der tarierten UNGUATOR Kruke
Hydrophile Betamethasonvalerat- Emulsion 0,05 % (NRF 11.47.) UNGUATOR 2100 Betamethasonvalerat (mikrofein gepulvert) 0,0375 g Hydrophile Hautemulsionsgrundlage ad 75,0000 g In der tarierten UNGUATOR Kruke
Individualrezepturen in der Dermatologie aus der Sicht des Apothekers
 Lilienapotheke Seiersberg Tel.: 0316/ 25-30-05 Mag. Wegscheider & Co KG Fax.: 0316/ 25-30-05-5 Kärntner Straße 537 e-mail: lilienapo@aponet.at Individualrezepturen in der Dermatologie aus der Sicht des
Lilienapotheke Seiersberg Tel.: 0316/ 25-30-05 Mag. Wegscheider & Co KG Fax.: 0316/ 25-30-05-5 Kärntner Straße 537 e-mail: lilienapo@aponet.at Individualrezepturen in der Dermatologie aus der Sicht des
GALENISCHE BESONDERHEITEN
 GALENISCHE BESONDERHEITEN ERYTHROMYCIN Erythromycin und andere agglomeriert vorliegende Wirkstoffe lassen sich schlecht von hydrophilen Grundlagen benetzten und sind daher nur schwer gleichmäßig zu verteilen.
GALENISCHE BESONDERHEITEN ERYTHROMYCIN Erythromycin und andere agglomeriert vorliegende Wirkstoffe lassen sich schlecht von hydrophilen Grundlagen benetzten und sind daher nur schwer gleichmäßig zu verteilen.
VALIDIERTE REZEPTUREMPFEHLUNGEN, MODELL-REZEPTUREN
 VALIDIERTE REZEPTUREMPFEHLUNGEN, MODELL-REZEPTUREN Die nachfolgenden Rezepturempfehlungen basieren auf Untersuchungen im Zentrallaboratorium Deutscher Apotheker, die im Rahmen der seit 2004 stattfindenden
VALIDIERTE REZEPTUREMPFEHLUNGEN, MODELL-REZEPTUREN Die nachfolgenden Rezepturempfehlungen basieren auf Untersuchungen im Zentrallaboratorium Deutscher Apotheker, die im Rahmen der seit 2004 stattfindenden
Hydrophile Betamethasonvalerat- Emulsion 0,05 % (NRF ) UNGUATOR B/R
 Hydrophile Betamethasonvalerat- Emulsion 0,05 % (NRF 11.47.) UNGUATOR B/R Betamethasonvalerat (mikrofein gepulvert) 0,0375 g Hydrophile Hautemulsionsgrundlage ad 75,0000 g In der tarierten UNGUATOR Kruke
Hydrophile Betamethasonvalerat- Emulsion 0,05 % (NRF 11.47.) UNGUATOR B/R Betamethasonvalerat (mikrofein gepulvert) 0,0375 g Hydrophile Hautemulsionsgrundlage ad 75,0000 g In der tarierten UNGUATOR Kruke
Für Sie untersucht: Stabilitätsuntersuchungen
 Für Sie untersucht: Stabilitätsuntersuchungen Die Wirk- und Hilfsstoffstabilität in Rezepturen wird durch verschiedenste Faktoren wie dem ph- Wert, der Temperatur, dem Licht, der stofflichen Zusammensetzung
Für Sie untersucht: Stabilitätsuntersuchungen Die Wirk- und Hilfsstoffstabilität in Rezepturen wird durch verschiedenste Faktoren wie dem ph- Wert, der Temperatur, dem Licht, der stofflichen Zusammensetzung
Ihre Dr. Wolff- Rezepturen Stand 2016
 Ihre Dr. Wolff- Rezepturen Stand 2016 Hinweise zu Rezepturen mit Wolff -Dermatika Die eprüften Konzentrationen sind in % aneeben. Die Haltbarkeiten beziehen sich auf die chemische Stabilität der Wirkstoffe
Ihre Dr. Wolff- Rezepturen Stand 2016 Hinweise zu Rezepturen mit Wolff -Dermatika Die eprüften Konzentrationen sind in % aneeben. Die Haltbarkeiten beziehen sich auf die chemische Stabilität der Wirkstoffe
Neues Rezeptur-Formularium ABDA Bundesvereinigung Deutscher Apothekerverbände Pharmazeutisches Laboratorium Govi-Verlag Pharmazeutischer Verlag GmbH
 Neues Rezeptur-Formularium ABDA Bundesvereinigung Deutscher Apothekerverbände Pharmazeutisches Laboratorium Govi-Verlag Pharmazeutischer Verlag GmbH Carl-Mannich-Straße 20 Postfach 5360 Telefax: 06196/928-330
Neues Rezeptur-Formularium ABDA Bundesvereinigung Deutscher Apothekerverbände Pharmazeutisches Laboratorium Govi-Verlag Pharmazeutischer Verlag GmbH Carl-Mannich-Straße 20 Postfach 5360 Telefax: 06196/928-330
Spirig Pharma GmbH Schertlinstr. 27 D Augsburg Stand: Februar 2013
 Schertlinstr. 27 D-86159 Augsburg Stand: Februar 2013 Omega - ab Charge M041 ab Charge M041 - Neue Formel ab Charge M064 - Neue Formel ab Charge M181 - Neue Formel ab Charge N016 - Neue Formel - ab Charge
Schertlinstr. 27 D-86159 Augsburg Stand: Februar 2013 Omega - ab Charge M041 ab Charge M041 - Neue Formel ab Charge M064 - Neue Formel ab Charge M181 - Neue Formel ab Charge N016 - Neue Formel - ab Charge
VALIDIERTE REZEPTUREMPFEHLUNGEN, MODELL-REZEPTUREN
 VALIDIERTE REZEPTUREMPFEHLUNGEN, MODELL-REZEPTUREN Die nachfolgenden Rezepturempfehlungen basieren auf Untersuchungen im Zentrallaboratorium Deutscher Apotheker e.v., die im Rahmen der seit 2004 stattfindenden
VALIDIERTE REZEPTUREMPFEHLUNGEN, MODELL-REZEPTUREN Die nachfolgenden Rezepturempfehlungen basieren auf Untersuchungen im Zentrallaboratorium Deutscher Apotheker e.v., die im Rahmen der seit 2004 stattfindenden
Unterschied von Salben, Cremes und Lotionen. Vortrag von Apothekerin Andrea Findeisen
 Unterschied von Salben, Cremes und Lotionen Vortrag von Apothekerin Andrea Findeisen 1 Definition von Salben im DAB*: halbfeste Zubereitungen Anwendung auf der Haut oder Schleimhaut lokale oder systemische
Unterschied von Salben, Cremes und Lotionen Vortrag von Apothekerin Andrea Findeisen 1 Definition von Salben im DAB*: halbfeste Zubereitungen Anwendung auf der Haut oder Schleimhaut lokale oder systemische
Für Sie untersucht: Stabilitätsuntersuchungen
 Für Sie untersucht: Stabilitätsuntersuchungen Die Wirk- und Hilfsstoffstabilität in Rezepturen wird durch verschiedenste Faktoren wie dem ph- Wert, der Temperatur, dem Licht, der stofflichen Zusammensetzung
Für Sie untersucht: Stabilitätsuntersuchungen Die Wirk- und Hilfsstoffstabilität in Rezepturen wird durch verschiedenste Faktoren wie dem ph- Wert, der Temperatur, dem Licht, der stofflichen Zusammensetzung
Praktische Probleme bei Rezeptur und Defektur
 Praktische Probleme bei Rezeptur und Defektur Begleitende Unterrichtsveranstaltung für Pharmazeuten im Praktikum, 15. März 2017 Johann-Wolfgang-Goethe-Universität Campus Riedberg Dr. Stefanie Melhorn,
Praktische Probleme bei Rezeptur und Defektur Begleitende Unterrichtsveranstaltung für Pharmazeuten im Praktikum, 15. März 2017 Johann-Wolfgang-Goethe-Universität Campus Riedberg Dr. Stefanie Melhorn,
Dermatologische Externatherapie
 M. Gloor K. Thoma J. Fluhr Dermatologische Externatherapie Unter besonderer Beriicksichtigung der Magistralrezeptur Mit 102 Abbildungen und 96 Tabellen Springer Inhaltsverzeichnis 1 Behandlung mit Spezialitaten
M. Gloor K. Thoma J. Fluhr Dermatologische Externatherapie Unter besonderer Beriicksichtigung der Magistralrezeptur Mit 102 Abbildungen und 96 Tabellen Springer Inhaltsverzeichnis 1 Behandlung mit Spezialitaten
Für Sie untersucht: Stabilitätsuntersuchungen
 Für Sie untersucht: Stabilitätsuntersuchungen Die Wirk- und Hilfsstoffstabilität in Rezepturen wird durch verschiedenste Faktoren wie dem ph- Wert, der Temperatur, dem Licht, der stofflichen Zusammensetzung
Für Sie untersucht: Stabilitätsuntersuchungen Die Wirk- und Hilfsstoffstabilität in Rezepturen wird durch verschiedenste Faktoren wie dem ph- Wert, der Temperatur, dem Licht, der stofflichen Zusammensetzung
2 Obsolete, aber nicht bedenkliche Ausgangsstoffe und Rezepturen
 11 2 Obsolete, aber nicht bedenkliche Ausgangsstoffe und Rezepturen Andreas S. Ziegler Immer wieder verordnen Ärzte obsolete Wirkstoffe, die zwar nicht als bedenklich eingestuft sind, deren Wirksamkeit
11 2 Obsolete, aber nicht bedenkliche Ausgangsstoffe und Rezepturen Andreas S. Ziegler Immer wieder verordnen Ärzte obsolete Wirkstoffe, die zwar nicht als bedenklich eingestuft sind, deren Wirksamkeit
Standardisierte Rezepturen
 E-BOOK Hrsg. Pharmazeutisches Laboratorium des DAC/NRF Standardisierte Rezepturen Formelsammlung für Ärzte 8., überarbeitete Auflage 2015 inkl. CD-ROM Govi-Verlag Standardisierte Rezepturen Formelsammlung
E-BOOK Hrsg. Pharmazeutisches Laboratorium des DAC/NRF Standardisierte Rezepturen Formelsammlung für Ärzte 8., überarbeitete Auflage 2015 inkl. CD-ROM Govi-Verlag Standardisierte Rezepturen Formelsammlung
Andreas S. Ziegler. Wirkstoffe inder Rezeptur. 2. Auflage
 Andreas S. Ziegler Wirkstoffe inder Rezeptur 2. Auflage Einführung Laut 7 Apothekenbetriebsordnung (ApBetrO) ist vor der Anfertigung eines Rezepturarzneimittels eine Plausibilitätsprüfung durchzuführen,
Andreas S. Ziegler Wirkstoffe inder Rezeptur 2. Auflage Einführung Laut 7 Apothekenbetriebsordnung (ApBetrO) ist vor der Anfertigung eines Rezepturarzneimittels eine Plausibilitätsprüfung durchzuführen,
Behandlung mit einer wirkstofffreien Grundlage Intervallbehandlung, Basistherapie, leichte Entzündung. indifferente Therapie:
 1 Lokaltherapie indifferente Therapie: Behandlung mit einer wirkstofffreien Grundlage Intervallbehandlung, Basistherapie, leichte Entzündung differente Therapie: Behandlung mit Arzneimitteln, die in eine
1 Lokaltherapie indifferente Therapie: Behandlung mit einer wirkstofffreien Grundlage Intervallbehandlung, Basistherapie, leichte Entzündung differente Therapie: Behandlung mit Arzneimitteln, die in eine
Dermatologische Rezepturen
 Dermatologische Rezepturen Richtig verschreiben individuell therapieren Claus Garbe, Holger Reimann 3., aktualisierte Auflage 9 Abbildungen Georg Thieme Verlag Stuttgart New York Prof. Dr. med. Claus Garbe
Dermatologische Rezepturen Richtig verschreiben individuell therapieren Claus Garbe, Holger Reimann 3., aktualisierte Auflage 9 Abbildungen Georg Thieme Verlag Stuttgart New York Prof. Dr. med. Claus Garbe
TOPITEC Journal: Herstellungsempfehlungen
 HYDROPHILE ERYTHROMYCIN-CREME 2 % (NRF 11.77.) 30,0 g Erythromycin (mikrofein gepulvert) Citronensäure-Lsg. 0,5 % Propylenglykol 0,6 g 0,6 g 14,4 g 3,6 g 3,0 g 7,8 g Bitte beachten Sie die Informationen
HYDROPHILE ERYTHROMYCIN-CREME 2 % (NRF 11.77.) 30,0 g Erythromycin (mikrofein gepulvert) Citronensäure-Lsg. 0,5 % Propylenglykol 0,6 g 0,6 g 14,4 g 3,6 g 3,0 g 7,8 g Bitte beachten Sie die Informationen
Caelo-Info 316 Salbengrundlagen
 Seit der Novellierung der Apothekenbetriebsordnung, gültig seit dem 12.6.2012, sind Apotheken verpflichtet, auf Abgabegefäßen auch die Inhaltstoffe der verwendeten Grundlage aufzuführen. Diese Tabelle
Seit der Novellierung der Apothekenbetriebsordnung, gültig seit dem 12.6.2012, sind Apotheken verpflichtet, auf Abgabegefäßen auch die Inhaltstoffe der verwendeten Grundlage aufzuführen. Diese Tabelle
Neues Rezeptur-Formularium ABDA Bundesvereinigung Deutscher Apothekerverbände Pharmazeutisches Laboratorium Govi-Verlag Pharmazeutischer Verlag GmbH
 Neues Rezeptur-Formularium ABDA Bundesvereinigung Deutscher Apothekerverbände Pharmazeutisches Laboratorium Govi-Verlag Pharmazeutischer Verlag GmbH Carl-Mannich-Straße 20 Postfach 5360 Telefax: 06196/928-330
Neues Rezeptur-Formularium ABDA Bundesvereinigung Deutscher Apothekerverbände Pharmazeutisches Laboratorium Govi-Verlag Pharmazeutischer Verlag GmbH Carl-Mannich-Straße 20 Postfach 5360 Telefax: 06196/928-330
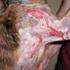
Therapie des atopischen Ekzems. akutes Stadium (erosive Veränderungen)
 (erosive Veränderungen) Hautbefund: entzündlich infiltrierte, stark gerötete, nässende, erosive, verkrustete, kratzexkoriierte Herde, häufig superinfiziert Therapieprinzip: austrocknend, desinfizierend,
(erosive Veränderungen) Hautbefund: entzündlich infiltrierte, stark gerötete, nässende, erosive, verkrustete, kratzexkoriierte Herde, häufig superinfiziert Therapieprinzip: austrocknend, desinfizierend,
Lokaltherapie Grundlagen von Lokaltherapeutika. Welche Salbe?
 Lokaltherapie Grundlagen von Lokaltherapeutika Welche Salbe? Lokaltherapie indifferente Therapie: Behandlung mit einer wirkstofffreien Grundlage Intervallbehandlung, Basistherapie, leichte Entzündung differente
Lokaltherapie Grundlagen von Lokaltherapeutika Welche Salbe? Lokaltherapie indifferente Therapie: Behandlung mit einer wirkstofffreien Grundlage Intervallbehandlung, Basistherapie, leichte Entzündung differente
Fischer /Schüler. Rezeptur - Qualität in 7 Schritten. Ulrike Fischer, Dresden Katrin Schüler, Dresden. Mit 55 Abbildungen und 101 Tabellen
 Fischer /Schüler Rezeptur - Qualität in 7 Schritten Ulrike Fischer, Dresden Katrin Schüler, Dresden Mit 55 Abbildungen und 101 Tabellen Ä Checklisten, Arbeitsblätter und Fallbeispiele unterwww.online-plusbase.de
Fischer /Schüler Rezeptur - Qualität in 7 Schritten Ulrike Fischer, Dresden Katrin Schüler, Dresden Mit 55 Abbildungen und 101 Tabellen Ä Checklisten, Arbeitsblätter und Fallbeispiele unterwww.online-plusbase.de
Neues Rezeptur-Formularium ABDA Bundesvereinigung Deutscher Apothekerverbände Pharmazeutisches Laboratorium Govi-Verlag Pharmazeutischer Verlag GmbH
 Neues Rezeptur-Formularium ABDA Bundesvereinigung Deutscher Apothekerverbände Pharmazeutisches Laboratorium Govi-Verlag Pharmazeutischer Verlag GmbH Carl-Mannich-Straße 20 Postfach 5360 Telefax: 06196/928-330
Neues Rezeptur-Formularium ABDA Bundesvereinigung Deutscher Apothekerverbände Pharmazeutisches Laboratorium Govi-Verlag Pharmazeutischer Verlag GmbH Carl-Mannich-Straße 20 Postfach 5360 Telefax: 06196/928-330
Wirkstoff. hydrolyseempfindlich. in therapeutischer Konzentration konservierend. grenzflächenaktiv
 Einführung Laut 7 Apothekenbetriebsordnung (ApBetrO) ist vor der Anfertigung eines Rezepturarzneimittels eine Plausibilitätsprüfung durchzuführen, die insbesondere folgende Gesichtspunkte zu berücksichtigen
Einführung Laut 7 Apothekenbetriebsordnung (ApBetrO) ist vor der Anfertigung eines Rezepturarzneimittels eine Plausibilitätsprüfung durchzuführen, die insbesondere folgende Gesichtspunkte zu berücksichtigen
Herstellung und Analytik
 Mometasonfuroat 0,05% in Polihexanid-Wundgel Herstellung und Analytik Dr. Frauke Braeschke Krankenhausapotheke der Asklepios Kliniken Hamburg GmbH Tangstedter Landstraße 400, 22417 Hamburg e-mail: f.braeschke@asklepios.com
Mometasonfuroat 0,05% in Polihexanid-Wundgel Herstellung und Analytik Dr. Frauke Braeschke Krankenhausapotheke der Asklepios Kliniken Hamburg GmbH Tangstedter Landstraße 400, 22417 Hamburg e-mail: f.braeschke@asklepios.com
Clotrimazol 1,0% in Unguentum Cordes mit einem Wasseranteil von 20% - UNGUATOR QMS
 Clotrimazol 1,0% in Unguentum Cordes mit einem Wasseranteil von 20% - UNGUATOR QMS Clotrimazol (mikrofein) 0,80 g Aqua purificata 16,00 g Unguentum Cordes ad 80,00 g In der tarierten UNGUATOR Kruke werden
Clotrimazol 1,0% in Unguentum Cordes mit einem Wasseranteil von 20% - UNGUATOR QMS Clotrimazol (mikrofein) 0,80 g Aqua purificata 16,00 g Unguentum Cordes ad 80,00 g In der tarierten UNGUATOR Kruke werden
ANWENDUNG und WIRKUNG dermatologischer GRUNDLAGEN
 Tabelle 01 ANWENDUNG und WIRKUNG dermatologischer GRUNDLAGEN Feuchter Umschlag Puder Schüttelmixtur nicht stabilisiert: Zinkoxidschüttelmixtur DAC weiß od. hautfarben (NRF 11.22.) Ethanolhaltige Zinkoxidschüttelmixtur
Tabelle 01 ANWENDUNG und WIRKUNG dermatologischer GRUNDLAGEN Feuchter Umschlag Puder Schüttelmixtur nicht stabilisiert: Zinkoxidschüttelmixtur DAC weiß od. hautfarben (NRF 11.22.) Ethanolhaltige Zinkoxidschüttelmixtur
UNGUATOR Technologie - Kurzanleitung! Die richtigen Rührparameter abgestimmt auf den! UNGUATOR B/R!
 UNGUATOR Technologie - Kurzanleitung Die richtigen Rührparameter abgestimmt auf den UNGUATOR B/R Bestimmen Sie die erforderlichen Rührparameter in nur zwei Schritten 1. Ordnen Sie Ihre vorliegende Rezeptur
UNGUATOR Technologie - Kurzanleitung Die richtigen Rührparameter abgestimmt auf den UNGUATOR B/R Bestimmen Sie die erforderlichen Rührparameter in nur zwei Schritten 1. Ordnen Sie Ihre vorliegende Rezeptur
Rezepturen. praktische Tipps und Beispiele für Arzt und Apotheker
 Rezepturen praktische Tipps und Beispiele für Arzt und Apotheker P. Staubach Universitätsmedizin Mainz Gesellschaft für Dermopharmazie/ Fachgruppe Magistralrezepturen Unklare Rezepturen Hilfen für das
Rezepturen praktische Tipps und Beispiele für Arzt und Apotheker P. Staubach Universitätsmedizin Mainz Gesellschaft für Dermopharmazie/ Fachgruppe Magistralrezepturen Unklare Rezepturen Hilfen für das
Dermatologische Rezepturen
 Dermatologische Rezepturen Schlüssel zur individualisierten topischen Therapie Bearbeitet von Claus Garbe überarbeitet 2005. Taschenbuch. 320 S. Paperback ISBN 978 3 13 107292 4 Format (B x L): 12,5 x
Dermatologische Rezepturen Schlüssel zur individualisierten topischen Therapie Bearbeitet von Claus Garbe überarbeitet 2005. Taschenbuch. 320 S. Paperback ISBN 978 3 13 107292 4 Format (B x L): 12,5 x
Zertifikatsrelevant zur Erteilung des Ringversuchs-Zertifikat sind folgende Prüfkriterien: Identität Metronidazol
 1. Analytische Prüfkriterien Zertifikatsrelevant zur Erteilung des Ringversuchs-Zertifikat sind folgende Prüfkriterien: Identität Metronidazol Wirkstoffverteilung Wirkstoffgehalt zweier Einzelproben Partikelgröße
1. Analytische Prüfkriterien Zertifikatsrelevant zur Erteilung des Ringversuchs-Zertifikat sind folgende Prüfkriterien: Identität Metronidazol Wirkstoffverteilung Wirkstoffgehalt zweier Einzelproben Partikelgröße
Sebexol Emulsionen Rezepturempfehlungen
 ÜBERSICHT TIPP: Die roten Textzeilen sind Links (Verweise). Durch Klicken auf diese Zeilen gelangen Sie direkt zu den ausgesuchten internen und externen Informationen. Informationen zu Sebexol -Emulsionen
ÜBERSICHT TIPP: Die roten Textzeilen sind Links (Verweise). Durch Klicken auf diese Zeilen gelangen Sie direkt zu den ausgesuchten internen und externen Informationen. Informationen zu Sebexol -Emulsionen
Weitere Bezeichnung Artikelnummer Monographie Zusammensetzung
 -Info 317 Seit der Novellierung der Apothekenbetriebsordnung, gültig seit dem 12.06.2012, sind Apotheken verpflichtet, auf Abgabegefäßen auch die Inhaltsstoffe der verwendeten Grundlagen aufzuführen. Sie
-Info 317 Seit der Novellierung der Apothekenbetriebsordnung, gültig seit dem 12.06.2012, sind Apotheken verpflichtet, auf Abgabegefäßen auch die Inhaltsstoffe der verwendeten Grundlagen aufzuführen. Sie
Sebexol Emulsionen Rezepturempfehlungen
 ÜBERSICHT TIPP: Die roten Textzeilen sind Links (Verweise). Durch Klicken auf diese Zeilen gelangen Sie direkt zu den ausgesuchten internen und externen Informationen. Informationen zu Sebexol -Emulsionen
ÜBERSICHT TIPP: Die roten Textzeilen sind Links (Verweise). Durch Klicken auf diese Zeilen gelangen Sie direkt zu den ausgesuchten internen und externen Informationen. Informationen zu Sebexol -Emulsionen
Gebrauchsinformation: Information für den Anwender
 Seite 1 von 4 Gebrauchsinformation: Information für den Anwender Zur Anwendung in der Mundhöhle Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie ent hält wichtige Informationen für Sie.
Seite 1 von 4 Gebrauchsinformation: Information für den Anwender Zur Anwendung in der Mundhöhle Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie ent hält wichtige Informationen für Sie.
X Inhaltsverzeichnis 5 Offizinelle Grundlagen mit Indikationen und Rezepturbeispielen Salben Hydrophobe Salben Wass
 IX Inhaltsverzeichnis 1 Warum rezeptieren?... 1 1.1 Qualitätsanforderungen an dermatologische Rezepturen.. 1 1.2 Überholte Traditionen des dermatologischen Rezeptierens 3 1.2.1 Traditionalistisches Konzept...
IX Inhaltsverzeichnis 1 Warum rezeptieren?... 1 1.1 Qualitätsanforderungen an dermatologische Rezepturen.. 1 1.2 Überholte Traditionen des dermatologischen Rezeptierens 3 1.2.1 Traditionalistisches Konzept...
-1HS7-0?LiJ. STANDARDISIERTE, REZEPTUREN : Formelsammlung für Ärzte
 i -1HS7-0?LiJ STANDARDISIERTE, REZEPTUREN : Formelsammlung für Ärzte Redaktion und Herausgeber: Pharmazeutisches Laboratorium Neues Rezeptur-Formularium 7., überarbeitete Auflage GOVI ^ Govi-Verlag Inhaltsverzeichnis
i -1HS7-0?LiJ STANDARDISIERTE, REZEPTUREN : Formelsammlung für Ärzte Redaktion und Herausgeber: Pharmazeutisches Laboratorium Neues Rezeptur-Formularium 7., überarbeitete Auflage GOVI ^ Govi-Verlag Inhaltsverzeichnis
Arzneimittel-Richtlinien
 Arzneimittel-Richtlinien Der Bundesausschuß der Ärzte und Krankenkassen hat in seine Sitzung am 16. Februar 2000 beschlossen, die Anlage 2 der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen
Arzneimittel-Richtlinien Der Bundesausschuß der Ärzte und Krankenkassen hat in seine Sitzung am 16. Februar 2000 beschlossen, die Anlage 2 der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen
ZUSAMMENSETZUNG VON REZEPTURGRUNDLAGEN. Achtung ja nach Hersteller können bei einigen Grundlagen die Inhaltstoffe variieren
 ZUSAMMENSETZUNG VON REZEPTURGRUNDLAGEN Achtung ja nach Hersteller können bei einigen Grundlagen die Inhaltstoffe variieren Deutsche Bezeichnung Markenname Anionische hydrophile Creme SR (NRF S.27) Asche
ZUSAMMENSETZUNG VON REZEPTURGRUNDLAGEN Achtung ja nach Hersteller können bei einigen Grundlagen die Inhaltstoffe variieren Deutsche Bezeichnung Markenname Anionische hydrophile Creme SR (NRF S.27) Asche
ARBEITSBOGEN 11: ARZNEIMITTELBERATUNG ÄRZTLICHE VERORDNUNGEN
 I Hinweis zur Bearbeitung des Arbeitsbogens Informieren und beraten Sie einen Patienten über ein Fertigarzneimittel (FAM) bei der Abgabe im Rahmen einer ärztlichen Verordnung. Grundlage des Arbeitsbogens
I Hinweis zur Bearbeitung des Arbeitsbogens Informieren und beraten Sie einen Patienten über ein Fertigarzneimittel (FAM) bei der Abgabe im Rahmen einer ärztlichen Verordnung. Grundlage des Arbeitsbogens
HERSTELLUNG VON REZEPTUR-GRUNDLAGEN
 INHALTSVERZEICHNIS Creme Fest: 100 g Kühlcreme DAB 10 Unguentum Leniens 91 Creme Fest: 100 g Wollwachsalkoholcreme DAB 92 Creme Fest: 500 g Wollwachsalkoholcreme DAB 93 Creme Fest: 800 g Wollwachsalkoholcreme
INHALTSVERZEICHNIS Creme Fest: 100 g Kühlcreme DAB 10 Unguentum Leniens 91 Creme Fest: 100 g Wollwachsalkoholcreme DAB 92 Creme Fest: 500 g Wollwachsalkoholcreme DAB 93 Creme Fest: 800 g Wollwachsalkoholcreme
Einfluss der Formulierung auf Interaktionen mit der Primärverpackung
 Einfluss der Formulierung auf Interaktionen mit der Primärverpackung J.B. Haverkamp A. Dittmer Dr. Uwe Lipke, Dr. Thomas Zapf, Dr. Cornelia Lipperheide GD-Symposium BfArM, Bonn - 21.10.2008 Tubenherstellung
Einfluss der Formulierung auf Interaktionen mit der Primärverpackung J.B. Haverkamp A. Dittmer Dr. Uwe Lipke, Dr. Thomas Zapf, Dr. Cornelia Lipperheide GD-Symposium BfArM, Bonn - 21.10.2008 Tubenherstellung
Dermatologische Rezepturen
 Dermatologische Rezepturen Schlüssel zur individualisierten topischen Therapie - Praxis der einfachen und sicheren Verschreibung mittels NRF-Kürzel Claus Garbe Holger Reimann 2., vollständig neu bearbeitete
Dermatologische Rezepturen Schlüssel zur individualisierten topischen Therapie - Praxis der einfachen und sicheren Verschreibung mittels NRF-Kürzel Claus Garbe Holger Reimann 2., vollständig neu bearbeitete
Wortlaut der für die Packungsbeilage vorgesehenen Angaben. Gebrauchsinformation: Information für den Anwender
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender Clotrimazol-CT Pumpspray 10 mg/ml, Spray zur Anwendung auf der Haut, Lösung Wirkstoff: Clotrimazol
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender Clotrimazol-CT Pumpspray 10 mg/ml, Spray zur Anwendung auf der Haut, Lösung Wirkstoff: Clotrimazol
Externatherapie von. Beitrag der Galenik zum Therapieerfolg TECHNOLOGIE
 Externatherapie von Hauterkrankungen Beitrag der Galenik zum Therapieerfolg Münster, 12. Januar 2010 1 1 Gliederung der Externagrundlagen Einfluss der Galenik am Beispiel harnstoffhaltiger Zubereitungen
Externatherapie von Hauterkrankungen Beitrag der Galenik zum Therapieerfolg Münster, 12. Januar 2010 1 1 Gliederung der Externagrundlagen Einfluss der Galenik am Beispiel harnstoffhaltiger Zubereitungen
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels) Mitosyl N 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels) Mitosyl N 1. BEZEICHNUNG DES ARZNEIMITTELS Mitosyl N 27 %, Salbe Wirkstoff: Zinkoxid 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 100
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels) Mitosyl N 1. BEZEICHNUNG DES ARZNEIMITTELS Mitosyl N 27 %, Salbe Wirkstoff: Zinkoxid 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 100
Dermatologische Rezepturen
 Dermatologische Rezepturen Richtig verschreiben - individuell therapieren Bearbeitet von Claus Garbe, Holger Reimann 3., aktualisierte Auflage 2017. Buch inkl. Online-Nutzung. 176 S. Softcover ISBN 978
Dermatologische Rezepturen Richtig verschreiben - individuell therapieren Bearbeitet von Claus Garbe, Holger Reimann 3., aktualisierte Auflage 2017. Buch inkl. Online-Nutzung. 176 S. Softcover ISBN 978
Auf die Galenik kommt es an! E. Paul Scheidegger
 Auf die Galenik kommt es an! E. Paul Scheidegger Funktion und Aufbau der Haut Galenik Pflegeprnizipien allergieundhaut.ch Galenik Dermatologische Pharmazeutik Dermatotherapie Externatherapie Formulierung
Auf die Galenik kommt es an! E. Paul Scheidegger Funktion und Aufbau der Haut Galenik Pflegeprnizipien allergieundhaut.ch Galenik Dermatologische Pharmazeutik Dermatotherapie Externatherapie Formulierung
1 Schritt 1: Hygienestandards einhalten
 31 1 Schritt 1: Hygienestandards einhalten So wie die Liebe zur Ordnung, so ist auch die Liebe zur Reinlichkeit eine Kardinaltugend eines guten Receptarius. Diese Tugend ist bei all seinen Verrichtungen
31 1 Schritt 1: Hygienestandards einhalten So wie die Liebe zur Ordnung, so ist auch die Liebe zur Reinlichkeit eine Kardinaltugend eines guten Receptarius. Diese Tugend ist bei all seinen Verrichtungen
Gebrauchsinformation: Information für Anwender. Optiderm Creme Harnstoff, Macrogollaurylether 6.5
 Gebrauchsinformation: Information für Anwender Optiderm Creme Harnstoff, Macrogollaurylether 6.5 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender Optiderm Creme Harnstoff, Macrogollaurylether 6.5 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Checkliste Dermatologie
 Checklisten Medizin Checkliste Dermatologie Venerologie, Allergologie, Phlebologie, Andrologie Bearbeitet von Walter Burgdorf, Ralf Paus, Wolfram Sterry, Marc Beyer, Ulrike Blume-Peytavi 6. vollst. überarb.
Checklisten Medizin Checkliste Dermatologie Venerologie, Allergologie, Phlebologie, Andrologie Bearbeitet von Walter Burgdorf, Ralf Paus, Wolfram Sterry, Marc Beyer, Ulrike Blume-Peytavi 6. vollst. überarb.
Topische Therapie. Lokaltherapie. Lokaltherapie The preferred route of drug administration in dermatology is?
 The preferred route of drug administration in dermatology is? Topische Therapie 1. Oral 2. Intravenous 3. Topical DDr. Ahmad Jalili 28.01.2013, Vienna 4. Subcutaneous Ihre Empfehlung zur lokalen Therapie?
The preferred route of drug administration in dermatology is? Topische Therapie 1. Oral 2. Intravenous 3. Topical DDr. Ahmad Jalili 28.01.2013, Vienna 4. Subcutaneous Ihre Empfehlung zur lokalen Therapie?
die Spanne ist jedoch relativ klein. Für weitere Recherchen ruft sie im Internet unter www.dac-nrf.de die NRF-Rezepturhinweise
 Apothekenbetriebsordnung Praxisbeispiel Teil 2 Rezepturarzneimittel Von Stefanie Döhring / In den kommenden Wochen wird die DAC/NRF-Kommission in der Pharmazeutischen Zeitung Rezepturverordnungen und eine
Apothekenbetriebsordnung Praxisbeispiel Teil 2 Rezepturarzneimittel Von Stefanie Döhring / In den kommenden Wochen wird die DAC/NRF-Kommission in der Pharmazeutischen Zeitung Rezepturverordnungen und eine
P H A R M A S C H W E I Z. W i r k s t o f f e
 P H A R M A W i r k s t o f f e Inhaltsverzeichnis Analgetika 3 Antiphlogistika 3 Antiseptika 4 Antibiotika 4 Keratolytika 5 Sekretolytika 5 Anästhetika 5 Elektrolyte 6 Säure bindende Mittel 6 2 Analgetika
P H A R M A W i r k s t o f f e Inhaltsverzeichnis Analgetika 3 Antiphlogistika 3 Antiseptika 4 Antibiotika 4 Keratolytika 5 Sekretolytika 5 Anästhetika 5 Elektrolyte 6 Säure bindende Mittel 6 2 Analgetika
Rationelle dermatologische Rezeptur
 Rationelle dermatologische Rezeptur Grundlagen und kommentierte Rezeptursammlung aus DAB, DAC, NRF und mit Preiskalkulation Claus Garbe, Holger Reimann, Christine Sander-Bähr 108 kommentierte Rezepturen,
Rationelle dermatologische Rezeptur Grundlagen und kommentierte Rezeptursammlung aus DAB, DAC, NRF und mit Preiskalkulation Claus Garbe, Holger Reimann, Christine Sander-Bähr 108 kommentierte Rezepturen,
Gebrauchsinformation: Information für den Anwender. Wund- und Heilsalbe. Mit 5% Dexpanthenol
 Gebrauchsinformation: Information für den Anwender Wund- und Heilsalbe Mit 5% Dexpanthenol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für den Anwender Wund- und Heilsalbe Mit 5% Dexpanthenol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
MEDISEPTA 1% (m/m) Puder
 PACKUNGSBEILAGE GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER MEDISEPTA 1% (m/m) Puder Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses
PACKUNGSBEILAGE GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER MEDISEPTA 1% (m/m) Puder Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses
Deutscher Arzneimittel-Codex (DAC) Neues Rezeptur-Formularium (NRF)
 Deutscher Arzneimittel-Codex (DAC) Neues Rezeptur-Formularium (NRF) DAC-NRF-Herstellungsvorschriften Rifampicin-Suspensionen zum Einnehmen Eschborn, 30. Juli 2014 Anlässlich eines Defektes bei einem Fertigarzneimittel
Deutscher Arzneimittel-Codex (DAC) Neues Rezeptur-Formularium (NRF) DAC-NRF-Herstellungsvorschriften Rifampicin-Suspensionen zum Einnehmen Eschborn, 30. Juli 2014 Anlässlich eines Defektes bei einem Fertigarzneimittel
Bakterizide im Kühlschmierstoff Definition nach DIN 51385 Bearbeitungsmedien für die Zerspanung von Werkstoffen
 Bakterizide im Kühlschmierstoff Definition nach DIN 51385 Bearbeitungsmedien für die Zerspanung von Werkstoffen Bakterizide im KSS Mikrobielles Wachstum beeinträchtigt die Qualität des Kühlschmierstoffs
Bakterizide im Kühlschmierstoff Definition nach DIN 51385 Bearbeitungsmedien für die Zerspanung von Werkstoffen Bakterizide im KSS Mikrobielles Wachstum beeinträchtigt die Qualität des Kühlschmierstoffs
Mirfulan. Salbe. täglich auftragen. Vitaminreiche Wund- und Heilsalbe
 1 Mirfulan Salbe Dosierung: Je nach Bedarf mehrmals täglich auftragen. Patienteninformation Bitte aufmerksam lesen! Vitaminreiche Wund- und Heilsalbe 2 Liebe Patientin, lieber Patient! Bitte lesen Sie
1 Mirfulan Salbe Dosierung: Je nach Bedarf mehrmals täglich auftragen. Patienteninformation Bitte aufmerksam lesen! Vitaminreiche Wund- und Heilsalbe 2 Liebe Patientin, lieber Patient! Bitte lesen Sie
Optiderm Fett-Creme. Wirkstoffe: Harnstoff, Polidocanol
 Gebrauchsinformation: Information für Anwender Optiderm Fett-Creme Wirkstoffe: Harnstoff, Polidocanol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender Optiderm Fett-Creme Wirkstoffe: Harnstoff, Polidocanol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Hydro Heumann Hautcreme 0,5 % Creme
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Hydro Heumann Hautcreme 0,5 % Creme Hydrocortison Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Hydro Heumann Hautcreme 0,5 % Creme Hydrocortison Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für
Version 3.0, 04/2013 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 Version 3.0, 04/2013 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Chlorhexidindigluconat Sage 20 mg/ml imprägniertes Tuch 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Version 3.0, 04/2013 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Chlorhexidindigluconat Sage 20 mg/ml imprägniertes Tuch 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Informationen zur Verordnung von Cannabis auf einen BTM- Rezept/Musterrezepte
 Informationen zur Verordnung von Cannabis auf einen BTM- Rezept/Musterrezepte Auf dem BTM-Rezept muss, neben den allgemein bekannten Angaben, die genaue Sorte Cannabis und natürlich auch die individuelle
Informationen zur Verordnung von Cannabis auf einen BTM- Rezept/Musterrezepte Auf dem BTM-Rezept muss, neben den allgemein bekannten Angaben, die genaue Sorte Cannabis und natürlich auch die individuelle
01[Geben Sie Text ein] Ausfüllhinweise bei Cannabisverordnungen. 1. Verordnung von Cannabisblüten zur Teezubereitung (Beispiel) ❹ ❺
![01[Geben Sie Text ein] Ausfüllhinweise bei Cannabisverordnungen. 1. Verordnung von Cannabisblüten zur Teezubereitung (Beispiel) ❹ ❺ 01[Geben Sie Text ein] Ausfüllhinweise bei Cannabisverordnungen. 1. Verordnung von Cannabisblüten zur Teezubereitung (Beispiel) ❹ ❺](/thumbs/68/58104119.jpg) 1. Verordnung von Cannabisblüten zur Teezubereitung (Beispiel) Cannabisblüten [Sorte] (NRF 22.14.) 15,0 g 1 x tägl. 0,5 g in 0,5 l Wasser 15 min abkochen 3 x tgl. 150 ml trinken ❺ Die Angabe Cannabisblüten
1. Verordnung von Cannabisblüten zur Teezubereitung (Beispiel) Cannabisblüten [Sorte] (NRF 22.14.) 15,0 g 1 x tägl. 0,5 g in 0,5 l Wasser 15 min abkochen 3 x tgl. 150 ml trinken ❺ Die Angabe Cannabisblüten
Rezepturhinweise: Hydrogele
 N eues R ezeptur-f ormularium ABDA Bundesvereinigung Deutscher Apothekerverbände Pharmazeutisches Laboratorium Govi-Verlag Pharmazeutischer Verlag GmbH Carl-Mannich-Straße 20 Postfach 5360 Telefax: 06196/928-330
N eues R ezeptur-f ormularium ABDA Bundesvereinigung Deutscher Apothekerverbände Pharmazeutisches Laboratorium Govi-Verlag Pharmazeutischer Verlag GmbH Carl-Mannich-Straße 20 Postfach 5360 Telefax: 06196/928-330
Gebrauchsinformation: Information für den Anwender
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender MYKO CORDES 1% Creme Wirkstoff: Clotrimazol Lesen Sie die gesamte Packungsbeilage sorgfältig
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender MYKO CORDES 1% Creme Wirkstoff: Clotrimazol Lesen Sie die gesamte Packungsbeilage sorgfältig
HERSTELLUNG VON REZEPTUR-GRUNDLAGEN
 INHALTSVERZEICHNIS Creme Fest: 100 g Kühlcreme DAB 10* Unguentum Leniens 83 Creme Fest: 100 g Wollwachsalkoholcreme DAB* 84 Creme Fest: 500 g Wollwachsalkoholcreme DAB* 85 Creme Fest: 800 g Wollwachsalkoholcreme
INHALTSVERZEICHNIS Creme Fest: 100 g Kühlcreme DAB 10* Unguentum Leniens 83 Creme Fest: 100 g Wollwachsalkoholcreme DAB* 84 Creme Fest: 500 g Wollwachsalkoholcreme DAB* 85 Creme Fest: 800 g Wollwachsalkoholcreme
octenisept Wund-Desinfektion ist ein Antiseptikum zur wiederholten, zeitlich begrenzten unterstützenden antiseptischen Wundbehandlung.
 Gebrauchsinformation: Information für den Anwender OCTENISEPT WUND-DESINFEKTION Antiseptikum zur unterstützenden Wundbehandlung Lösung zum Aufsprühen auf die Wunde Wirkstoffe: 0.1 g Octenidinhydrochlorid
Gebrauchsinformation: Information für den Anwender OCTENISEPT WUND-DESINFEKTION Antiseptikum zur unterstützenden Wundbehandlung Lösung zum Aufsprühen auf die Wunde Wirkstoffe: 0.1 g Octenidinhydrochlorid
Ggf. Auswahl der Hilfsstoffe (Rizinusöl als Anreibemittel für Ichthyol, Aerosil als Aufziehmittel, )
 Unabgeteilte Pulver oder Puder Herstellung: Ggf. Auswahl der Hilfsstoffe (Rizinusöl als Anreibemittel für Ichthyol, Aerosil als Aufziehmittel, ) Mit indifferenter Substanz, die in höchster Menge vorliegt
Unabgeteilte Pulver oder Puder Herstellung: Ggf. Auswahl der Hilfsstoffe (Rizinusöl als Anreibemittel für Ichthyol, Aerosil als Aufziehmittel, ) Mit indifferenter Substanz, die in höchster Menge vorliegt
2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON LIVOCAB DIREKT NASENSPRAY BEACHTEN?
 Gebrauchsinformation: Information für den Anwender Livocab direkt Nasenspray 0,05 % Nasenspray, Suspension Zur Anwendung bei Kindern ab 1 Jahr, Jugendlichen und Erwachsenen Wirkstoff: Levocabastin (vorliegend
Gebrauchsinformation: Information für den Anwender Livocab direkt Nasenspray 0,05 % Nasenspray, Suspension Zur Anwendung bei Kindern ab 1 Jahr, Jugendlichen und Erwachsenen Wirkstoff: Levocabastin (vorliegend
Seite 1 von 5. Merkblatt. betreffend die
 Seite 1 von 5 Landesuntersuchungsamt Rheinland-Pfalz Institut für Lebensmittelchemie und Arzneimittelprüfung, Mainz Merkblatt betreffend die Kennzeichnung von Arzneimitteln, die in öffentlichen Apotheken
Seite 1 von 5 Landesuntersuchungsamt Rheinland-Pfalz Institut für Lebensmittelchemie und Arzneimittelprüfung, Mainz Merkblatt betreffend die Kennzeichnung von Arzneimitteln, die in öffentlichen Apotheken
2 Ermittlung des Gesamtrisikoscores
 2 Das hier umgesetzte Konzept zur Risikobeurteilung von Defekturarzneimitteln basiert auf den Empfehlungen der Resolution CM/ResAP(2011)1 des Europarats (Europarat, 2011). Es geht konform mit den gesetzlichen
2 Das hier umgesetzte Konzept zur Risikobeurteilung von Defekturarzneimitteln basiert auf den Empfehlungen der Resolution CM/ResAP(2011)1 des Europarats (Europarat, 2011). Es geht konform mit den gesetzlichen
Tab. 3.1 Was muss im Einzelnen dokumentiert werden? A Ausgangsstoff/Bezeichnung. B Lieferdatum/Herstellungsdatum. C Lieferant/Hersteller
 51 3.1 Prüfung von Ausgangsstoffen und Defekturarzneimitteln Tab. 3.1 Was muss im Einzelnen dokumentiert werden? Was Wer Apothekenbetriebsordnung 6 Allgemeine Vorschriften über die Herstellung und Prüfung
51 3.1 Prüfung von Ausgangsstoffen und Defekturarzneimitteln Tab. 3.1 Was muss im Einzelnen dokumentiert werden? Was Wer Apothekenbetriebsordnung 6 Allgemeine Vorschriften über die Herstellung und Prüfung
Zusätzliche Hinweise: Der Wortlaut der angeführten Gefahrenhinweise ist dem Punkt 16 zu entnehmen.
 1. Angaben zum Produkt Handelsname: Verwendung des Stoffes / der Zubereitung: Lieferant: The Pinball Cleaner Reiniger (tensidische Formulierung) Pinballcenter GmbH Römerstr. 11 D- 89077 Ulm Tel.: +49 (0)731
1. Angaben zum Produkt Handelsname: Verwendung des Stoffes / der Zubereitung: Lieferant: The Pinball Cleaner Reiniger (tensidische Formulierung) Pinballcenter GmbH Römerstr. 11 D- 89077 Ulm Tel.: +49 (0)731
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender Ledermix, Paste zur Anwendung in Zahnkavitäten Wirkstoffe: Demeclocyclin-Calcium (1:1) (30,21 mg/g), Triamcinolonacetonid (10 mg/g) Lesen Sie die gesamte
Gebrauchsinformation: Information für den Anwender Ledermix, Paste zur Anwendung in Zahnkavitäten Wirkstoffe: Demeclocyclin-Calcium (1:1) (30,21 mg/g), Triamcinolonacetonid (10 mg/g) Lesen Sie die gesamte
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender Ichtholan 50% - Salbe Wirkstoff: Ammoniumbituminosulfonat (Ichthyol ) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für den Anwender Ichtholan 50% - Salbe Wirkstoff: Ammoniumbituminosulfonat (Ichthyol ) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
