Eine Brennstoffzelle, die Umkehr der Wasserelektrolyse
|
|
|
- Claus Egger
- vor 7 Jahren
- Abrufe
Transkript
1 Wasserelektrolyse Peter Bützer Inhalt Eine Brennstoffzelle, die Umkehr der Wasserelektrolyse 1 Einleitung/Theorie Datenbasis Aufgabenstellung Durchführung Beobachtungen/Messungen Reaktionsgleichungen/Berechnungen Folgerungen Simulation, Systemdynamik Simulationsdiagramm Zeitdiagramm Dokumentation (Gleichungen, Parameter) Vergleich Interpretation Einleitung/Theorie Die Elektrolyse von Wasser besteht aus zwei Teilreaktionen, die an den zwei Elektroden ablaufen. Die Elektroden tauchen in Wasser ein, welches durch die Zugabe von etwas Schwefelsäure besser leitend gemacht wird. In dieser elektrisch leitenden Flüssigkeit, dem sogenannten Elektrolyten, kommt es bei einem von aussen erzwungenen Stromfluss (Gleichstrom) zur Zersetzung des Elektrolyten und einer Abscheidung von Stoffen an den Elektroden. Prof. Dr. Peter Bützer, Pädagogische Hochschule St.Gallen
2 2 Datenbasis 2.1 Aufgabenstellung Die Geschwindigkeit der Wasserstoff- und der Sauerstoffbildung soll gemessen und verglichen werden. Die Abhängigkeit von der Spannung ist zu überprüfen. 2.2 Durchführung Abbildung 1: Hofmannscher Apparat (2 mol/l Schwefelsäure) Der Hofmannsche Apparat wird mit mit 2, 4, 6 und 8 Volt betrieben und die Geschwindigkeit der Gasbildung bestimmt. 2.3 Beobachtungen/Messungen Abbildung 2: Oberer Teil der Apparatur Der dynamische Prozess läuft ab, wenn man auf dieses Bild und dann auf klickt. An den Platin-Elektroden der Hofmannschen Apparatur steigen in der verdünnten Schwefelsäure Gasbläschen auf: Am Minuspol entsteht Wasserstoff und am Pluspol Sauerstoff, im Volumen-Verhältnis von (annähernd) 2 : 1. Das Volumen-Verhältnis ist nicht exakt 2 : 1, weil sich Sauerstoff in Wasser etwas besser löst als Wasserstoff. Es bildet sich etwa doppelt so rasch Wasserstoffgas, wie sich Sauerstoffgas bildet.
3 2.4 Reaktionsgleichungen/Berechnungen Bekannte Summengleichung: 2 H 2 O 2 H 2 + O 2 Reaktion im Detail: Positiv geladene Hydronium-Ionen wandern im elektrischen Feld zu der negativ geladenen Elektrode (Kathode), wo sie jeweils ein Elektron aufnehmen. Dabei entstehen Wasserstoff-Atome, die sich mit einem weiteren, durch Reduktion entstandenen H-Atom zu einem Wasserstoff-Molekül vereinigen. Übrig bleiben Wasser-Moleküle. 2 H 3 O e - H H 2 O Der abgeschiedene, gasförmige Wasserstoff steigt an der Kathode auf. Dieser Wasserstoff verursacht ein Kratzen im Hals, wenn er kurze Zeit nach der Herstellung eingeatmet wird. Er ist also viel reaktiver, als der übliche, molekulare Wasserstoff aus der Flasche. Man könnte davon ausgehen, dass er zum Teil nicht molekular, sondern noch atomar ist. Zur positiv geladenen Elektrode (Anode) wandern die negativ geladenen Hydroxid- Ionen. Jedes Hydroxid-Ion gibt zwei Elektronen an den Plus-Pol ab, so dass Sauerstoff-Atome entstehen, die sich zu Sauerstoff-Molekülen vereinigen. Die übrig bleibenden H + -Ionen werden umgehend von Hydroxid-Ionen zu Wasser-Molekülen neutralisiert. 2 OH - 1/2 O 2 + H 2 O Bei der Elektrolyse von Wasser bildet sich aus H 3 O + -Ionen Wasserstoff und aus OH - - Ionen Sauerstoff: 4 H 3 O e - 2 H H 2 O 4 OH - O H 2 O + 4 e - Auch hier steigt der abgeschiedene Sauerstoff als farbloses Gas an der Anode auf. Besonders interessant ist, dass dieser Sauerstoff sehr reaktiv ist. Er lässt sich mit KI/I 2 -Papier nachweisen (wie Ozon), auch greift er Gummi rasch an. Wir können davon ausgehen, dass dieser Sauerstoff teilweise noch atomar sein könnte. Die Gesamtreaktionsgleichung der Elektrolyse von Wasser lautet: 4 H 3 O OH - 2 H 2 + O H 2 O Wasserelektrolyse n = I t /(z F) daraus folgt für die Geschwindigkeit der Gasbildung: n/t = I /(z F) 2.5 Folgerungen Der Wirkungsgrad der Elektrolyse von Wasser liegt bei ca. 70 %. Bei der alkalischen Elektrolyse bei etwa 90 %. Die energetische Betrachtung ist beispielsweise bei der Nutzung von Wasserstoff als Energieträger wichtig (Brennstoffzellen).
4 mol 3 Simulation, Systemdynamik 3.1 Simulationsdiagramm H2 O2 F RGH2 I RGO2 z H H2O z O Abbildung 3: Simulationsdiagramm der Geschwindigkeit der Wasserstoff und Sauerstoffbildung durch Elektrolyse aus Wasser 3.2 Zeitdiagramm GRAPH H2 : Current Time (Second) O2 : Current Abbildung 4: Zeitdiagramm der Gasbildung bei der Elektrolyse von Wasser 3.3 Dokumentation (Gleichungen, Parameter) (01) F=96840 (02) FINAL TIME = 600 Units: Second The final time for the simulation. (03) H2= INTEG ( RGH2, 0)
5 (04) H2O= INTEG (-RGH2-RGO2,1) (05) I= 1 (06) INITIAL TIME = 0 Units: Second The initial time for the simulation. (07) O2= INTEG ( RGO2, 0) (08) RGH2= I/(z H*F) (09) RGO2= I/(z O*F) (10) SAVEPER = TIME STEP The frequency with which output is stored. (11) TIME STEP = 1 The time step for the simulation. (12) z H= 1 (13) z O= Vergleich Aus sehr vielen Experimenten mit der Hofmannschen Apparatur ist bekannt, dass das Volumenverhältnis von Wasserstoff zu Sauerstoff, unabhängig von der Elektrolysezeit ziemlich genau 2/1 beträgt. 4 Interpretation Das Verhältnis von Wasserstoff zu Sauerstoff bei der Wasserelektrolyse ist bestimmt durch die Geschwindigkeit der Gasbildung. Diese wiederum ist nur von den übertragenen Elektronen bestimmt. Die Geschwindigkeit der Gasbildung ist von der Spannung U, und damit bei gleichem Widerstand R auch von der Stromstärke I abhängig (I = U/R)
Titration einer Säure mit einer Base
 Titration einer Säure mit einer Base Peter Bützer Inhalt 1 Einleitung... 1 2 Modellannahmen (Systemdynamik)... 2 3 Simulationsdiagramm (Typ 1)... 2 4 Dokumentation (Gleichungen, Parameter)... 3 5 Simulation...
Titration einer Säure mit einer Base Peter Bützer Inhalt 1 Einleitung... 1 2 Modellannahmen (Systemdynamik)... 2 3 Simulationsdiagramm (Typ 1)... 2 4 Dokumentation (Gleichungen, Parameter)... 3 5 Simulation...
Atmung, Dissimilation
 Atmung, Dissimilation Peter Bützer Abbildung 1: Atmung Inhalt 1 Physiologisches... 1 2 Atmung, eine Reaktion 0. Ordnung... 2 3 Simulation... 2 4 Interpretation... 4 5 Mikroökologie im Zimmer... 4 6 Interpretation...
Atmung, Dissimilation Peter Bützer Abbildung 1: Atmung Inhalt 1 Physiologisches... 1 2 Atmung, eine Reaktion 0. Ordnung... 2 3 Simulation... 2 4 Interpretation... 4 5 Mikroökologie im Zimmer... 4 6 Interpretation...
Kohlendioxidfreisetzung aus Champagner. 1 Einleitung/Theorie. Peter Bützer. Inhalt
 Kohlendioxidfreisetzung aus Champagner Inhalt 1 Einleitung/Theorie... 1 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 2 2.4 Reaktionsgleichungen/Berechnungen...
Kohlendioxidfreisetzung aus Champagner Inhalt 1 Einleitung/Theorie... 1 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 2 2.4 Reaktionsgleichungen/Berechnungen...
Michaelis-Menten-Kinetik
 Michaelis-Menten-Kinetik Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Modellannahmen... 2 2.2 Drei Fälle... 2. Simulationsdiagramm (Typ ), Systemdynamik... 2.4 Dokumentation (Gleichungen, Parameter)...
Michaelis-Menten-Kinetik Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Modellannahmen... 2 2.2 Drei Fälle... 2. Simulationsdiagramm (Typ ), Systemdynamik... 2.4 Dokumentation (Gleichungen, Parameter)...
Ethanolbildung in Bananen
 Ethanolbildung in Bananen Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Annahmen:... 2 2.2 Simulation(Typ 1)... 2 2.3 Dokumentation (Gleichungen, Parameter)... 3 2.4 Vergleich der Simulation
Ethanolbildung in Bananen Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Annahmen:... 2 2.2 Simulation(Typ 1)... 2 2.3 Dokumentation (Gleichungen, Parameter)... 3 2.4 Vergleich der Simulation
GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN
 10. Einheit: GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 17 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Galvanische Elemente, Batterien und
10. Einheit: GALVANISCHE ELEMENTE, BATTERIEN UND BRENNSTOFFZELLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 17 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Galvanische Elemente, Batterien und
Kohlenmonoxid aus Ethanal, CH 3 -CHO
 Kohlenmonoxid aus Ethanal, CH 3 -CHO Peter Bützer Chemiker haben viele nette Reaktionen! Inhalt 1 Einleitung/Theorie... 1 2 Aufgabenstellung... 2 2.1 Beobachtungen/Messungen, Datenbasis... 2 2.2 Reaktionsgleichungen/Berechnungen...
Kohlenmonoxid aus Ethanal, CH 3 -CHO Peter Bützer Chemiker haben viele nette Reaktionen! Inhalt 1 Einleitung/Theorie... 1 2 Aufgabenstellung... 2 2.1 Beobachtungen/Messungen, Datenbasis... 2 2.2 Reaktionsgleichungen/Berechnungen...
1. Elektrolysen 1.1. Chemikalien: Zn-Pulver Bromwasser (T) dest. Wasser
 1. Elektrolysen 1.1 Elektrolysen Redoxreaktion und Elektrolyse Redoxreaktionen und Elektrolysen hängen eng miteinander zusammen. Die folgenden Versuche mögen dies verdeutlichen: Redoxreaktion Zn + Bromwasser
1. Elektrolysen 1.1 Elektrolysen Redoxreaktion und Elektrolyse Redoxreaktionen und Elektrolysen hängen eng miteinander zusammen. Die folgenden Versuche mögen dies verdeutlichen: Redoxreaktion Zn + Bromwasser
Gipshärtung Energiefreisetzung, Systemdynamik
 Gipshärtung Energiefreisetzung, Systemdynamik Inhalt 1 Reaktion... 1 2 Experiment... 2 3 Simulation... 3 3.1 Simulationsdiagramm... 3 3.2 Dokumentation (Gleichungen, Parameter)... 3 3.3 Zeitdiagramm...
Gipshärtung Energiefreisetzung, Systemdynamik Inhalt 1 Reaktion... 1 2 Experiment... 2 3 Simulation... 3 3.1 Simulationsdiagramm... 3 3.2 Dokumentation (Gleichungen, Parameter)... 3 3.3 Zeitdiagramm...
Hefewachstum. Peter Bützer
 Hefewachstum Peter Bützer Inhalt 1 Hefe... 1 2 Das System als Black Box... 2 3 Messung des... 2 4 Modell... 3 5 Simulation (Typ 9)... 3 5.1 Simulationsdiagramm... 4 5.2 Messung... 4 5.3 Dokumentation (Gleichungen,
Hefewachstum Peter Bützer Inhalt 1 Hefe... 1 2 Das System als Black Box... 2 3 Messung des... 2 4 Modell... 3 5 Simulation (Typ 9)... 3 5.1 Simulationsdiagramm... 4 5.2 Messung... 4 5.3 Dokumentation (Gleichungen,
Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle. Inhaltsfeld: Elektrochemie
 Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle Inhaltsfeld: Elektrochemie Inhaltliche Schwerpunkte: Mobile Energiequellen Elektrochemische Gewinnung von Stoffen Zeitbedarf: ca. 5 Std. à 45
Thema/Kontext: Von der Wasserelektrolyse zur Brennstoffzelle Inhaltsfeld: Elektrochemie Inhaltliche Schwerpunkte: Mobile Energiequellen Elektrochemische Gewinnung von Stoffen Zeitbedarf: ca. 5 Std. à 45
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg
 TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
TU Bergakademie Freiberg Institut für Werkstofftechnik Schülerlabor science meets school Werkstoffe und Technologien in Freiberg GRUNDLAGEN Modul: Versuch: Elektrochemie 1 Abbildung 1: I. VERSUCHSZIEL
Säureangriff auf die Zähne
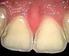 Säureangriff auf die Zähne Eine erfolgreiche Reduktion ist vielleicht die erfolgreichste Form aller wissenschaftlichen Erklärungen, die man sich vorstellen kann. 1 Karl R. Popper, (1902-199) britischer
Säureangriff auf die Zähne Eine erfolgreiche Reduktion ist vielleicht die erfolgreichste Form aller wissenschaftlichen Erklärungen, die man sich vorstellen kann. 1 Karl R. Popper, (1902-199) britischer
Monod-Kinetik. Peter Bützer
 Monod-Kinetik Peter Bützer Inhalt 1 Einleitung... 1 1.1 Modell... 1 1.2 Modellannahmen... 2 1. Gleichung... 2 1.4 Drei Fälle... 2 Simulation, Systemdynamik... 2.1 Simulationsdiagramm (Typ 1)... 2.2 Dokumentation
Monod-Kinetik Peter Bützer Inhalt 1 Einleitung... 1 1.1 Modell... 1 1.2 Modellannahmen... 2 1. Gleichung... 2 1.4 Drei Fälle... 2 Simulation, Systemdynamik... 2.1 Simulationsdiagramm (Typ 1)... 2.2 Dokumentation
Daisyworld. Peter Bützer. 1 Eine kurze Theorie. Inhalt
 Daisyworld Peter Bützer Inhalt 1 Eine kurze Theorie... 1 2 Aufgabe... 2 3 Simulation, Lösung (Typ 3), Systemdynamik... 3 3.1 Annahmen... 3 3.2 Simulationsdiagramm... 3 3.3 Zeitdiagramm... 4 3.4 Dokumentation
Daisyworld Peter Bützer Inhalt 1 Eine kurze Theorie... 1 2 Aufgabe... 2 3 Simulation, Lösung (Typ 3), Systemdynamik... 3 3.1 Annahmen... 3 3.2 Simulationsdiagramm... 3 3.3 Zeitdiagramm... 4 3.4 Dokumentation
Chlor-Alkali-Elektrolyse
 Chlor-Alkali-Elektrolyse 1. Allgemeine Erklärung der Elektrolyse 2. Verfahren 2.1 Diaphragmaverfahren 2.2 Membranverfahren 2.3 Amalgamverfahren 3.Vorteile und Nachteile der Verfahren 4. Überspannung 1.
Chlor-Alkali-Elektrolyse 1. Allgemeine Erklärung der Elektrolyse 2. Verfahren 2.1 Diaphragmaverfahren 2.2 Membranverfahren 2.3 Amalgamverfahren 3.Vorteile und Nachteile der Verfahren 4. Überspannung 1.
Wasserstoff als Energieträger Gliederung:
 Wasserstoff als Energieträger Gliederung: Wasserstoff: Energie speichern und verteilen Die Brennstoffzelle Wasserstoff aus der Ptm6 Alge Wasserstoff als Energiespeicher Der umweltfreundliche Akku: Um Wasserstoff
Wasserstoff als Energieträger Gliederung: Wasserstoff: Energie speichern und verteilen Die Brennstoffzelle Wasserstoff aus der Ptm6 Alge Wasserstoff als Energiespeicher Der umweltfreundliche Akku: Um Wasserstoff
Sauerstoffbindung im Blut
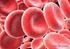 Sauerstoffbindung im Blut Die Fähigkeit uns zu wundern, ist das Einzige, was wir brauchen, um gute Philosophen zu werden. Gaarder Jostein, Sofies Welt 1 Inhalt 1 Einleitung/Theorie... 1 2 Aufgabenstellung...
Sauerstoffbindung im Blut Die Fähigkeit uns zu wundern, ist das Einzige, was wir brauchen, um gute Philosophen zu werden. Gaarder Jostein, Sofies Welt 1 Inhalt 1 Einleitung/Theorie... 1 2 Aufgabenstellung...
Galvanoplastik. Elektrochemie B. Lukas Woolley, Rafael Adamek, Peter Krack. 24 Februar ETH Zürich
 Elektrochemie B Lukas Woolley Rafael Adamek Peter Krack ETH Zürich 24 Februar 2017 Programm 1 2 3 4 Garfield Elektrolysezelle + - e e Anode Kathode e Cu CuSO 4 Cu 2+ Cu 2+ e Programm 1 2 3 4 Zelltypen
Elektrochemie B Lukas Woolley Rafael Adamek Peter Krack ETH Zürich 24 Februar 2017 Programm 1 2 3 4 Garfield Elektrolysezelle + - e e Anode Kathode e Cu CuSO 4 Cu 2+ Cu 2+ e Programm 1 2 3 4 Zelltypen
Versuch 6: Bestimmung der FARADAY-Konstanten Seite 1. Bestimmung der FARADAY-Konstanten mit dem HOFMANNschen Wasserzersetzungsapparat.
 Versuch 6: Bestimmung der FARADAY-Konstanten Seite 1 Aufgaben: Bestimmung der FARADAY-Konstanten mit dem HOFMANNschen Wasserzersetzungsaarat. Messverfahren: Vorkenntnisse: Lehrinhalt: Literatur: Elektrolyse
Versuch 6: Bestimmung der FARADAY-Konstanten Seite 1 Aufgaben: Bestimmung der FARADAY-Konstanten mit dem HOFMANNschen Wasserzersetzungsaarat. Messverfahren: Vorkenntnisse: Lehrinhalt: Literatur: Elektrolyse
KORROSION UND KORROSIONSSCHUTZ VON METALLEN
 11. Einheit: KORROSION UND KORROSIONSSCHUTZ VON METALLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 16 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Korrosion und Korrosionsschutz von Metallen..
11. Einheit: KORROSION UND KORROSIONSSCHUTZ VON METALLEN Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 16 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Korrosion und Korrosionsschutz von Metallen..
JUFOTech. wko.at/tirol/jufotech DATENBLATT. Jugend forscht in der Technik. Titel der Projektarbeit: Fachgebiet:
 Datenblatt (dient als Titelblatt für die Projektarbeit) Seite 1/2 JUFOTech Jugend forscht in der Technik wko.at/tirol/jufotech DATENBLATT Wir nehmen am Wettbewerb Jugend forscht in der Technik Auf den
Datenblatt (dient als Titelblatt für die Projektarbeit) Seite 1/2 JUFOTech Jugend forscht in der Technik wko.at/tirol/jufotech DATENBLATT Wir nehmen am Wettbewerb Jugend forscht in der Technik Auf den
Elektrolyse Basics III
 Elektrolyse Basics III Funktionsprinzip der Elektrolyse Funktionsprinzip der elektrochemischen Wasserspaltung (Elektrolyse) Für alle erneuerbaren Energiewandler, die elektrische Energie erzeugen, ist die
Elektrolyse Basics III Funktionsprinzip der Elektrolyse Funktionsprinzip der elektrochemischen Wasserspaltung (Elektrolyse) Für alle erneuerbaren Energiewandler, die elektrische Energie erzeugen, ist die
Phototrope Gläser. Dr. Peter Bützer. Inhalt
 1 Phototrope Gläser Inhalt 1 Einleitung/Theorie... 2 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 3 2.4 Reaktionsgleichungen/Berechnungen... 3 3 Simulation,
1 Phototrope Gläser Inhalt 1 Einleitung/Theorie... 2 2 Experiment... 2 2.1 Aufgabenstellung... 2 2.2 Durchführung... 2 2.3 Beobachtungen/Messungen... 3 2.4 Reaktionsgleichungen/Berechnungen... 3 3 Simulation,
Grundlagen: Galvanische Zellen:
 E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
Zink, ein wichtiges Spurenelement
 Zink, ein wichtiges Spurenelement Peter Bützer Inhalt 1 Einleitung... 1 2 Aufgaben... 2 3 Lösungen... 3 3.1 Simulationsdiagramm (Typ 1)... 3 3.2 Dokumentation (Gleichungen, Parameter)... 3 3.3 Zeitdiagramm...
Zink, ein wichtiges Spurenelement Peter Bützer Inhalt 1 Einleitung... 1 2 Aufgaben... 2 3 Lösungen... 3 3.1 Simulationsdiagramm (Typ 1)... 3 3.2 Dokumentation (Gleichungen, Parameter)... 3 3.3 Zeitdiagramm...
Die Faradayschen Gesetze zur Elektrolyse
 Ines Caspers, 25.11.2008 Aussbildungsseminar: Elektrodynamik im 19. Jahrhundert Die Faradayschen Gesetze zur Elektrolyse 1. Michael Faradays Werdegang geboren am 22. September 1791 im Westen Londons als
Ines Caspers, 25.11.2008 Aussbildungsseminar: Elektrodynamik im 19. Jahrhundert Die Faradayschen Gesetze zur Elektrolyse 1. Michael Faradays Werdegang geboren am 22. September 1791 im Westen Londons als
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde. Sommersemester 2007
 Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 2007 VL #35 am 28.06.2007 Vladimir Dyakonov Leitungsmechanismen Ladungstransport in Festkörpern Ladungsträger
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 2007 VL #35 am 28.06.2007 Vladimir Dyakonov Leitungsmechanismen Ladungstransport in Festkörpern Ladungsträger
Die alkalische Brennstoffzelle (AFC)
 Die alkalische Brennstoffzelle (AFC) von Mathis Fomferra Fachoberschule Winsen/Luhe Mai 2010 Index Vorwort Wieso die Brennstoffzelle Die Geschichte der Brennstoffzelle Die alkalische Brennstoffzelle Quellenangaben
Die alkalische Brennstoffzelle (AFC) von Mathis Fomferra Fachoberschule Winsen/Luhe Mai 2010 Index Vorwort Wieso die Brennstoffzelle Die Geschichte der Brennstoffzelle Die alkalische Brennstoffzelle Quellenangaben
Chemie-Lehrerin muss Knallgas-Explosion mit 1800 Euro büßen
 Überschrift 1 dem Text zuzuweisen, der hier angezeigt werden soll. 1 Name: Elektrolyse von Wasser Datum: Chemie-Lehrerin muss Knallgas-Explosion mit 1800 Euro büßen Göttingen. Eine Chemie-Lehrerin (48)
Überschrift 1 dem Text zuzuweisen, der hier angezeigt werden soll. 1 Name: Elektrolyse von Wasser Datum: Chemie-Lehrerin muss Knallgas-Explosion mit 1800 Euro büßen Göttingen. Eine Chemie-Lehrerin (48)
Die elektrische Energie wird durch Ionen transportiert. Ionen sind elektrisch geladene Atome bzw. Elektrolyt
 Galvanische Elemente Galvanische (Galvani ital.physiker) Elemente wandeln chemische in elektrische um. Sie bestehen aus zwei Elektroden (Anode, Kathode) und einer elektrisch leitenden Flüssigkeit, dem
Galvanische Elemente Galvanische (Galvani ital.physiker) Elemente wandeln chemische in elektrische um. Sie bestehen aus zwei Elektroden (Anode, Kathode) und einer elektrisch leitenden Flüssigkeit, dem
Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13
 Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Fachhochschule Konstanz Verfahrens- und Umwelttechnik - - Laborbericht Chemie VUB3. Versuch 2. Elektrogravimetrie. Klaus Vochezer
 Fachhochschule Konstanz Verfahrens- und Umwelttechnik - - Laborbericht Chemie VUB3 Versuch 2 Elektrogravimetrie Gruppe 5: Christian Mayr Klaus Vochezer Datum: 7.12.2005 - 1 - Inhalt 1 Einführung...3 2
Fachhochschule Konstanz Verfahrens- und Umwelttechnik - - Laborbericht Chemie VUB3 Versuch 2 Elektrogravimetrie Gruppe 5: Christian Mayr Klaus Vochezer Datum: 7.12.2005 - 1 - Inhalt 1 Einführung...3 2
E5: Faraday-Konstante
 E5: Faraday-Konstante Theoretische Grundlagen: Elektrischer Strom ist ein Fluss von elektrischer Ladung; in Metallen sind Elektronen die Ladungsträger, in Elektrolyten übernehmen Ionen diese Aufgabe. Befinden
E5: Faraday-Konstante Theoretische Grundlagen: Elektrischer Strom ist ein Fluss von elektrischer Ladung; in Metallen sind Elektronen die Ladungsträger, in Elektrolyten übernehmen Ionen diese Aufgabe. Befinden
Elektrochemie. Grundbegriffe. Oxidation: Ist die Teilreaktion bei der Elektronen abgegeben werden.
 Grundbegriffe Elektrochemische Reaktionen sind Redoxreaktionen, d.h Reaktionen mit Elektronenübergang. Sie können freiwillig ablaufen (galvanische Zelle) oder durch anlegen einer Spannung erzwungen werden
Grundbegriffe Elektrochemische Reaktionen sind Redoxreaktionen, d.h Reaktionen mit Elektronenübergang. Sie können freiwillig ablaufen (galvanische Zelle) oder durch anlegen einer Spannung erzwungen werden
Chemie Zusammenfassung JII.2 #1
 Chemie Zusammenfassung JII.2 #1 Oxidation/Reduktion/Oxidationsmittel/Reduktionsmittel/Redoxpaar In einer elektrochemischen Reaktion gehen Elektronen von einem Stoff zu einem anderen über. Wenn ein Stoff
Chemie Zusammenfassung JII.2 #1 Oxidation/Reduktion/Oxidationsmittel/Reduktionsmittel/Redoxpaar In einer elektrochemischen Reaktion gehen Elektronen von einem Stoff zu einem anderen über. Wenn ein Stoff
Physikalische Grundlagen Inhalt
 Physikalische Grundlagen Inhalt Das Atommodell nach Bohr Die Gleichspannung Der Gleichstrom Der Stromfluss in Metallen Der Stromfluss in Flüssigkeiten Die Elektrolyse Die Wechselspannung Der Wechselstrom
Physikalische Grundlagen Inhalt Das Atommodell nach Bohr Die Gleichspannung Der Gleichstrom Der Stromfluss in Metallen Der Stromfluss in Flüssigkeiten Die Elektrolyse Die Wechselspannung Der Wechselstrom
Elektrolyse. Zelle.. Bei der Elektrolyse handelt es sich im Prinzip um eine Umkehrung der in einer galvanischen Zelle Z ablaufenden Redox-Reaktion
 (Graphit) Cl - Abgabe von Elektronen: Oxidation Anode Diaphragma H + Elektrolyse Wird in einer elektrochemischen Zelle eine nicht-spontane Reaktion durch eine äußere Stromquelle erzwungen Elektrolyse-Zelle
(Graphit) Cl - Abgabe von Elektronen: Oxidation Anode Diaphragma H + Elektrolyse Wird in einer elektrochemischen Zelle eine nicht-spontane Reaktion durch eine äußere Stromquelle erzwungen Elektrolyse-Zelle
IIE3. Modul Elektrizitätslehre II. Faraday-Konstante
 IIE3 Modul Elektrizitätslehre II Faraday-Konstante Bei diesem Versuch soll mit Hilfe eines Coulombmeters die FARADAY- Konstante bestimmt werden. Das Coulombmeter besteht aus drei Kupferelektroden die in
IIE3 Modul Elektrizitätslehre II Faraday-Konstante Bei diesem Versuch soll mit Hilfe eines Coulombmeters die FARADAY- Konstante bestimmt werden. Das Coulombmeter besteht aus drei Kupferelektroden die in
Martin Raiber 21.02.07 Elektrolyse: Strom - Spannungskurven
 Martin Raiber 21.02.07 Elektrolyse: Strom - Spannungskurven Geräte: U-Rohr, verschiedene Platin-Elektroden (blank, platiniert), Graphit-Elektroden, spannungsstabilisierte Gleichspannungsquelle, CASSY-Spannungs/Stromstärkemessgerät
Martin Raiber 21.02.07 Elektrolyse: Strom - Spannungskurven Geräte: U-Rohr, verschiedene Platin-Elektroden (blank, platiniert), Graphit-Elektroden, spannungsstabilisierte Gleichspannungsquelle, CASSY-Spannungs/Stromstärkemessgerät
-1 (außer in Verbindung mit Sauerstoff: variabel) Sauerstoff -2 (außer in Peroxiden: -1)
 1) DEFINITIONEN DIE REDOXREAKTION Eine Redoxreaktion = Reaktion mit Elektronenübertragung sie teilt sich in Oxidation = Elektronenabgabe Reduktion = Elektronenaufnahme z.b.: Mg Mg 2 + 2 e z.b.: Cl 2 +
1) DEFINITIONEN DIE REDOXREAKTION Eine Redoxreaktion = Reaktion mit Elektronenübertragung sie teilt sich in Oxidation = Elektronenabgabe Reduktion = Elektronenaufnahme z.b.: Mg Mg 2 + 2 e z.b.: Cl 2 +
EinFaCh 1. Studienvorbereitung Chemie. Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie.
 Studienvorbereitung Chemie EinFaCh 1 Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie www.tu-freiberg.de http://tu-freiberg.de/fakultaet2/einfach Was ist eine
Studienvorbereitung Chemie EinFaCh 1 Einstieg in Freibergs anschauliches Chemiewissen Teil 1: Redoxreaktionen und Elektrochemie www.tu-freiberg.de http://tu-freiberg.de/fakultaet2/einfach Was ist eine
Probleme sind Gelegenheiten zu zeigen, was man kann. Duke Ellington, amerikanischer Jazz-Musiker (1899-1974)
 1 H 2 -Atemtest (Lactose-Toleranztest) Inhalt Probleme sind Gelegenheiten zu zeigen, was man kann. Duke Ellington, amerikanischer Jazz-Musiker (1899-1974) 1 Lactose-Intoleranz: Einführung... 1 2 Wasserstoff...
1 H 2 -Atemtest (Lactose-Toleranztest) Inhalt Probleme sind Gelegenheiten zu zeigen, was man kann. Duke Ellington, amerikanischer Jazz-Musiker (1899-1974) 1 Lactose-Intoleranz: Einführung... 1 2 Wasserstoff...
E7 Elektrolyse. Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch. Münster, den
 E7 Elektrolyse Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch Münster, den 18.12.2000 INHALTSVERZEICHNIS 1. Einleitung 2. Theoretische Grundlagen 2.1 Elektrolyse 2.2 Die FARADAYschen Gesetze der
E7 Elektrolyse Versuchsprotokoll von Thomas Bauer und Patrick Fritzsch Münster, den 18.12.2000 INHALTSVERZEICHNIS 1. Einleitung 2. Theoretische Grundlagen 2.1 Elektrolyse 2.2 Die FARADAYschen Gesetze der
Praktikum Physikalische Chemie I 26. November Zersetzungsspannung. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum Physikalische Chemie I 26. November 2015 Zersetzungsspannung Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 Aufgabenstellung Die Zersetzungsspannung von HCl und HI wird mit Hilfe einer Strom-Spannungskurve
Praktikum Physikalische Chemie I 26. November 2015 Zersetzungsspannung Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 Aufgabenstellung Die Zersetzungsspannung von HCl und HI wird mit Hilfe einer Strom-Spannungskurve
Zerlegung der Verbindung Wasser. Weiterbildung für fachfremd unterrichtende Lehrkräfte
 Zerlegung der Verbindung Wasser Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Titration Herstellung von Natronlauge Öltröpfchen versuch
Zerlegung der Verbindung Wasser Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Titration Herstellung von Natronlauge Öltröpfchen versuch
Was ist wichtig für die siebte Kursarbeit?
 Was ist wichtig für die siebte Kursarbeit? Redoxreaktion: Oxidation (Elektronen-Donator) und Reduktion (Elektronen-Akzeptor) korrespondierende Redoxpaare. Prinzip der Lösungstension, Betrachtung der Halbzellenreaktion
Was ist wichtig für die siebte Kursarbeit? Redoxreaktion: Oxidation (Elektronen-Donator) und Reduktion (Elektronen-Akzeptor) korrespondierende Redoxpaare. Prinzip der Lösungstension, Betrachtung der Halbzellenreaktion
Elektrolysekammer mit Kohle-Elektroden Best.- Nr. MD04073
 Elektrolysekammer mit Kohle-Elektroden Best.- Nr. MD04073 1. Beschreibung Die Elektrolysekammern sind in drei Varianten lieferbar: MD04071 MD04072 MD04073 mit Nickel-Elektroden mit Platin-Elektroden mit
Elektrolysekammer mit Kohle-Elektroden Best.- Nr. MD04073 1. Beschreibung Die Elektrolysekammern sind in drei Varianten lieferbar: MD04071 MD04072 MD04073 mit Nickel-Elektroden mit Platin-Elektroden mit
2. Verhalten der Elemente bei einer Reaktion: Warum funkt s bei unterschiedlichen
 1. Atombau und Periodensystem 1a) Nach welchem Gesichtspunkt sind die Elemente im Periodensystem von 1- ca. 103 angeordnet? 1b) Nach welchem Gesichtspunkt ist ein Element einer PERIODE zugeordnet? 1c)
1. Atombau und Periodensystem 1a) Nach welchem Gesichtspunkt sind die Elemente im Periodensystem von 1- ca. 103 angeordnet? 1b) Nach welchem Gesichtspunkt ist ein Element einer PERIODE zugeordnet? 1c)
Stefan Reißmann ANORGANISCH-CHEMISCHES TUTORIUM WS 2000/2001
 7. ELEKTROCHEMIE Im Prinzip sind alle chemischen Reaktionen elektrischer Natur, denn an allen chemischen Bindungen sind Elektronen beteiligt. Unter Elektrochemie versteht man jedoch vorrangig die Lehre
7. ELEKTROCHEMIE Im Prinzip sind alle chemischen Reaktionen elektrischer Natur, denn an allen chemischen Bindungen sind Elektronen beteiligt. Unter Elektrochemie versteht man jedoch vorrangig die Lehre
Indigokarmin, Indigotin - Metabolismus
 Indigokarmin, Indigotin - Metabolismus Inhalt 1.1 Chemische Charakterisierung,... 1 1.2 Verwendung und physiologische Eigenschaften... 3 1.3 Simulation des Metabolismus (Simulations-Typ 4), Systemdynamik...
Indigokarmin, Indigotin - Metabolismus Inhalt 1.1 Chemische Charakterisierung,... 1 1.2 Verwendung und physiologische Eigenschaften... 3 1.3 Simulation des Metabolismus (Simulations-Typ 4), Systemdynamik...
6.1 Elektrodenpotenzial und elektromotorische Kraft
 6.1 Elektrodenpotenzial und elektromotorische Kraft Zinkstab Kupferstab Cu 2+ Lösung Cu 2+ Lösung Zn + 2e Cu Cu 2+ + 2e Cu 2+ Eine Elektrode ist ein metallisch leitender Gegenstand, der zur Zu oder Ableitung
6.1 Elektrodenpotenzial und elektromotorische Kraft Zinkstab Kupferstab Cu 2+ Lösung Cu 2+ Lösung Zn + 2e Cu Cu 2+ + 2e Cu 2+ Eine Elektrode ist ein metallisch leitender Gegenstand, der zur Zu oder Ableitung
Elektrizität. = C J m. Das Coulomb Potential φ ist dabei:
 Elektrizität Die Coulombsche potentielle Energie V einer Ladung q im Abstand r von einer anderen Ladung q ist die Arbeit, die aufgewendet werden muss um die zwei Ladungen aus dem Unendlichen auf den Abstand
Elektrizität Die Coulombsche potentielle Energie V einer Ladung q im Abstand r von einer anderen Ladung q ist die Arbeit, die aufgewendet werden muss um die zwei Ladungen aus dem Unendlichen auf den Abstand
Schulversuchspraktikum Großtechnische Elektrolyseverfah- ren/galvanisierung Kurzprotokoll
 Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 11 & 12 Großtechnische Elektrolyseverfahren/Galvanisierung Kurzprotokoll Auf einen Blick: Das folgende Protokoll enthält einen
Schulversuchspraktikum Johanna Osterloh Sommersemester 2015 Klassenstufen 11 & 12 Großtechnische Elektrolyseverfahren/Galvanisierung Kurzprotokoll Auf einen Blick: Das folgende Protokoll enthält einen
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12
 Seminar zum Quantitativen Anorganischen Praktikum WS 211/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 9.1.212, 8-1 Uhr, HS III Allgemeine Einführung in die Quantitative
Seminar zum Quantitativen Anorganischen Praktikum WS 211/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 9.1.212, 8-1 Uhr, HS III Allgemeine Einführung in die Quantitative
Brennstoffzellen. Schüler: Julia Schürkamp Fach: Technik Thema: Brennstoffzellen Lehrer: Herr Menne
 Brennstoffzellen Schüler: Julia Schürkamp Fach: Technik Thema: Brennstoffzellen Lehrer: Herr Menne Inhaltsangabe Was ist sind Brennstoffzellen? 1 Wie funktionieren Brennstoffzellen? 2-3 Anwendung der verschiedenen
Brennstoffzellen Schüler: Julia Schürkamp Fach: Technik Thema: Brennstoffzellen Lehrer: Herr Menne Inhaltsangabe Was ist sind Brennstoffzellen? 1 Wie funktionieren Brennstoffzellen? 2-3 Anwendung der verschiedenen
Stoffwechsel bei Mehlkäferlarven
 Stoffwechsel bei Mehlkäferlarven Franziskus Graber, Peter Bützer 1 Inhalt 1 Einleitung... 1 2 Warum gerade der Mehlwurm als Versuchstier?... 2 3 Das Experiment... 2 3.1 Einige Bilder von Mehlkäferlarven...
Stoffwechsel bei Mehlkäferlarven Franziskus Graber, Peter Bützer 1 Inhalt 1 Einleitung... 1 2 Warum gerade der Mehlwurm als Versuchstier?... 2 3 Das Experiment... 2 3.1 Einige Bilder von Mehlkäferlarven...
Gleichstromtechnik. Vorlesung 3: Ladung und elektrischer Strom. Fakultät für Elektro- und Informationstechnik, Manfred Strohrmann
 Gleichstromtechnik Vorlesung 3: Ladung und elektrischer Strom Fakultät für Elektro und Informationstechnik, Manfred Strohrmann Leiter, Halbleiter und Isolatoren Unterschiedliche Stoffe können elektrischen
Gleichstromtechnik Vorlesung 3: Ladung und elektrischer Strom Fakultät für Elektro und Informationstechnik, Manfred Strohrmann Leiter, Halbleiter und Isolatoren Unterschiedliche Stoffe können elektrischen
Zementhärtung. Peter Bützer
 Zementhärtung Peter Bützer Vollkommenheit entsteht offensichtlich nicht dann, wenn man nichts mehr hinzuzufügen hat, sondern, wenn man nichts mehr wegnehmen kann. Antoine de Saint-Exupéry, französischer
Zementhärtung Peter Bützer Vollkommenheit entsteht offensichtlich nicht dann, wenn man nichts mehr hinzuzufügen hat, sondern, wenn man nichts mehr wegnehmen kann. Antoine de Saint-Exupéry, französischer
Spannungsquellen. Grundpraktikum I. Mittendorfer Stephan Matr. Nr Übungsdatum: Abgabetermin:
 Grundpraktikum I Spannungsquellen 1/5 Übungsdatum: 7.11. Abgabetermin: 3.1. Grundpraktikum I Spannungsquellen stephan@fundus.org Mittendorfer Stephan Matr. Nr. 9956335 Grundpraktikum I Spannungsquellen
Grundpraktikum I Spannungsquellen 1/5 Übungsdatum: 7.11. Abgabetermin: 3.1. Grundpraktikum I Spannungsquellen stephan@fundus.org Mittendorfer Stephan Matr. Nr. 9956335 Grundpraktikum I Spannungsquellen
Lösungen, Salze, Ionen und Elektrolyte
 Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
2. Übung Grundlagen der Hauptgruppenchemie AC02
 Allgemeine und Anorganische Chemie 2. Übung Grundlagen der Hauptgruppenchemie AC02 Aufgabe 1: Vervollständigen und gleichen Sie die folgenden Gleichungen aus: a) CaO + H 2 O Ca(OH) 2 b) Al 2 O 3 + 6 H
Allgemeine und Anorganische Chemie 2. Übung Grundlagen der Hauptgruppenchemie AC02 Aufgabe 1: Vervollständigen und gleichen Sie die folgenden Gleichungen aus: a) CaO + H 2 O Ca(OH) 2 b) Al 2 O 3 + 6 H
Elektrische Leitung. Leitung in Flüssigkeit
 Elektrische Leitung 1. Leitungsmechanismen Bändermodell 2. Ladungstransport in Festkörpern i) Temperaturabhängigkeit Leiter ii) Eigen- und Fremdleitung in Halbleitern iii) Stromtransport in Isolatoren
Elektrische Leitung 1. Leitungsmechanismen Bändermodell 2. Ladungstransport in Festkörpern i) Temperaturabhängigkeit Leiter ii) Eigen- und Fremdleitung in Halbleitern iii) Stromtransport in Isolatoren
Experimentalphysik 2
 Repetitorium zu Experimentalphysik 2 Ferienkurs am Physik-Department der Technischen Universität München Gerd Meisl 5. August 2008 Inhaltsverzeichnis 1 Übungsaufgaben 2 1.1 Übungsaufgaben....................................
Repetitorium zu Experimentalphysik 2 Ferienkurs am Physik-Department der Technischen Universität München Gerd Meisl 5. August 2008 Inhaltsverzeichnis 1 Übungsaufgaben 2 1.1 Übungsaufgaben....................................
Die Wirkungsweise einer Brennstoffzelle. Ein Vortrag von Bernard Brickwedde
 Die Wirkungsweise einer Brennstoffzelle Ein Vortrag von Bernard Brickwedde Inhalt Allgemein Definition Geschichte Anwendungsgebiete Aufbau Theoretische Grundlagen Redoxreaktion Wirkungsgrad Elektrochemische
Die Wirkungsweise einer Brennstoffzelle Ein Vortrag von Bernard Brickwedde Inhalt Allgemein Definition Geschichte Anwendungsgebiete Aufbau Theoretische Grundlagen Redoxreaktion Wirkungsgrad Elektrochemische
Redoxgleichungen: Massenerhaltung Elektronenaufnahme/ -abgabe Halbreaktion: Getrennter Prozess (Reduktion, Oxidation getrennt anschauen)
 AChe 2 Kapitel 20: Elektrochemie Oxidationszahlen: Ladung des Atomes wenn es als Ion vorliegen würde. Oxidation: OX-Zahl steigt, Reduktion: OX-Zahl sinkt. Redoxgleichungen: Massenerhaltung Elektronenaufnahme/
AChe 2 Kapitel 20: Elektrochemie Oxidationszahlen: Ladung des Atomes wenn es als Ion vorliegen würde. Oxidation: OX-Zahl steigt, Reduktion: OX-Zahl sinkt. Redoxgleichungen: Massenerhaltung Elektronenaufnahme/
Elektrolyse einer Zinkiodidlösung Lehrerversuch, Versuchsvariante Thomas Seilnacht Geräte 2 Kohlelektroden im Stopfen 2 Krokoklemmen
 1 Elektrolyse einer Zinkiodidlösung Lehrerversuch, Versuchsvariante Thomas Seilnacht Geräte 2 Kohlelektroden im Stopfen 2 Krokoklemmen 2 Kabel Stromquelle U-Rohr mit Seitenrohren Stoffe Zinkiodid-Lösung
1 Elektrolyse einer Zinkiodidlösung Lehrerversuch, Versuchsvariante Thomas Seilnacht Geräte 2 Kohlelektroden im Stopfen 2 Krokoklemmen 2 Kabel Stromquelle U-Rohr mit Seitenrohren Stoffe Zinkiodid-Lösung
Korrosion: Lösungsdruck, Halb-Element, Galvanisches Element Seite 1 von 7
 Korrosion: Lösungsdruck, Halb-Element, Galvanisches Element Seite 1 von 7 A Metalle lösen sich im Wasser Lösungs-Druck 1 B Beim Lösen werden Ladungen getrennt Halb-Element 1 C Unterschiedliche Metalle
Korrosion: Lösungsdruck, Halb-Element, Galvanisches Element Seite 1 von 7 A Metalle lösen sich im Wasser Lösungs-Druck 1 B Beim Lösen werden Ladungen getrennt Halb-Element 1 C Unterschiedliche Metalle
Brennstoffzelle. Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes. Schüler-Skript und Versuchsanleitung
 Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes Bearbeitet von Markus Beckert, Sheila Sabock Stand 12.09.2013 Inhaltsverzeichnis 1 Einführung... 3 1.1 Vorbereitung, Vorwissen, Vorüberlegungen...
Versuch im Physikalischen Praktikum des Mathematik/Informatik-Gebäudes Bearbeitet von Markus Beckert, Sheila Sabock Stand 12.09.2013 Inhaltsverzeichnis 1 Einführung... 3 1.1 Vorbereitung, Vorwissen, Vorüberlegungen...
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10. Die Brennstoffzelle
 Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10 Die Brennstoffzelle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll sind drei Lehrerversuche
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10 Die Brennstoffzelle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll sind drei Lehrerversuche
Säuren und Basen. Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17.
 Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
SS Thomas Schrader. der Universität Duisburg-Essen. (Teil 8: Redoxprozesse, Elektrochemie)
 Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 8: Redoxprozesse, Elektrochemie) Oxidation und Reduktion Redoxreaktionen: Ein Atom oder
Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 8: Redoxprozesse, Elektrochemie) Oxidation und Reduktion Redoxreaktionen: Ein Atom oder
Kapitel 4: Chemische. Woher stammen die chemischen Symbole?
 Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
Kapitel 4: Chemische Symbole Woher stammen die chemischen Symbole? Das sind die Anfangsbuchstaben (manchmal auch die ersten beiden Anfangsbuchstaben) der lateinischen oder griechischen Namen der Elemente.
1.) Skizzierieren Sie den Aufbau einer PEM Brennstoffzelle und erläutern Sie deren Funktionsweise.
 E50 Name: Brennstoffzelle Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Dieser Fragebogen muss von jedem Teilnehmer eigenständig (keine Gruppenlösung!)
E50 Name: Brennstoffzelle Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Dieser Fragebogen muss von jedem Teilnehmer eigenständig (keine Gruppenlösung!)
Geht dir ein Licht auf?
 Geht dir ein Licht auf? Im folgenden Experiment wirst du erfahren, wie du mit einfachen Mitteln ein Lämpchen zum Leuchten bringst. Materialien - Glühlämpchen - Flachbatterie Auftrag Die folgenden Abbildungen
Geht dir ein Licht auf? Im folgenden Experiment wirst du erfahren, wie du mit einfachen Mitteln ein Lämpchen zum Leuchten bringst. Materialien - Glühlämpchen - Flachbatterie Auftrag Die folgenden Abbildungen
10.Teil Redoxreaktionen
 Definitionen für Oxidationen und Reduktionen Oxidationszahl, Redoxgleichungen Galvanische Zellen, Redoxpotentiale Standard-Elektrodenpotentiale, Redoxreihe Nernst-Gleichung Leclanché-Batterie, andere Batterien
Definitionen für Oxidationen und Reduktionen Oxidationszahl, Redoxgleichungen Galvanische Zellen, Redoxpotentiale Standard-Elektrodenpotentiale, Redoxreihe Nernst-Gleichung Leclanché-Batterie, andere Batterien
Der Mensch kann ohne Gold, nicht aber ohne Salz leben.
 Text aus Schroedel, Chemieheute: Chloralkali-Elektrolyse "Der Mensch kann ohne Gold, nicht aber ohne Salz leben." Dieser Satz stammt von dem römischen Geschichtsschreiber CASSIODORUS, der vor etwa 1500
Text aus Schroedel, Chemieheute: Chloralkali-Elektrolyse "Der Mensch kann ohne Gold, nicht aber ohne Salz leben." Dieser Satz stammt von dem römischen Geschichtsschreiber CASSIODORUS, der vor etwa 1500
Schulversuchspraktikum. Birte Zieske. Sommersemester Klassenstufen 9&10. Elektrolyse
 Schulversuchspraktikum Birte Zieske Sommersemester 2012 Klassenstufen 9&10 Elektrolyse Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 & 10 enthält 2 Lehrerversuche und 2 Schülerversuche zum
Schulversuchspraktikum Birte Zieske Sommersemester 2012 Klassenstufen 9&10 Elektrolyse Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 & 10 enthält 2 Lehrerversuche und 2 Schülerversuche zum
Erklärt euch die Aufgabe. Erklärt euch die Aufgabe gegenseitig noch einmal in euren eigenen Worten. euren eigenen Worten.
 Erklärt euch die Aufgabe gegenseitig noch einmal in euren eigenen Worten. Klärt dabei, wie ihr die Aufgabe verstanden habt und was euch noch unklar ist. Erklärt euch die Aufgabe gegenseitig noch einmal
Erklärt euch die Aufgabe gegenseitig noch einmal in euren eigenen Worten. Klärt dabei, wie ihr die Aufgabe verstanden habt und was euch noch unklar ist. Erklärt euch die Aufgabe gegenseitig noch einmal
Aufgaben zur Elektrolyse
 Aufgaben zur Elektrolyse TechGymJ2 1. Allgemeine Aufgaben (einige davon sind Klausuraufgaben vergangener Jahre) 1.1. Kupfer wird elektrolytisch aus Cu 2+ -Ionen gewonnen. In einer Elektrolysezelle wird
Aufgaben zur Elektrolyse TechGymJ2 1. Allgemeine Aufgaben (einige davon sind Klausuraufgaben vergangener Jahre) 1.1. Kupfer wird elektrolytisch aus Cu 2+ -Ionen gewonnen. In einer Elektrolysezelle wird
Lernmaterial Lernfeld 1 Grundlagen Physik und Chemie. Chemische Grundlagen, Bindungsarten. Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms
 Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
MacGyver Batterie. Wer ist MacGyver?
 MacGyver Batterie Wer ist MacGyver? Angus Mac Gyvers auffälligste Fähigkeit ist die praktische Anwendung der Naturwissenschaften und die damit verbundene erfinderische Nutzung alltäglicher Gegenstände.
MacGyver Batterie Wer ist MacGyver? Angus Mac Gyvers auffälligste Fähigkeit ist die praktische Anwendung der Naturwissenschaften und die damit verbundene erfinderische Nutzung alltäglicher Gegenstände.
Galvanische Zellen aus Nichtmetallen (Artikelnr.: P )
 Lehrer-/Dozentenblatt Galvanische Zellen aus Nichtmetallen (Artikelnr.: P7400900) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 10-13 Lehrplanthema: Physikalische Chemie Unterthema:
Lehrer-/Dozentenblatt Galvanische Zellen aus Nichtmetallen (Artikelnr.: P7400900) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 10-13 Lehrplanthema: Physikalische Chemie Unterthema:
Chemieepoche Klasse 11. Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen
 Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Was ist Elektrochemie? Elektrochemie. Elektrochemie ist die Lehre von der Beziehung
 Was ist Elektrochemie? Elektrochemie Elektrochemie ist die Lehre von der Beziehung zwischen elektrischen und chemischen Prozessen. 131 Stromleitung in einem Metall Wir haben gelernt, dass die Stromleitung
Was ist Elektrochemie? Elektrochemie Elektrochemie ist die Lehre von der Beziehung zwischen elektrischen und chemischen Prozessen. 131 Stromleitung in einem Metall Wir haben gelernt, dass die Stromleitung
Ich schwitze sagte die Solarzelle. Bei Dir piepst s wohl antwortete der Geigerzähler.
 Ich schwitze sagte die Solarzelle. Bei Dir piepst s wohl antwortete der Geigerzähler. Eine strahlende Reise von der Brennstoffzelle zum Urgestein. Hartmut Abele, Jacqueline Erhart, Christoph Gösselsberger,
Ich schwitze sagte die Solarzelle. Bei Dir piepst s wohl antwortete der Geigerzähler. Eine strahlende Reise von der Brennstoffzelle zum Urgestein. Hartmut Abele, Jacqueline Erhart, Christoph Gösselsberger,
2.5 Strom in Flüssigkeiten. 2.5 Strom in Flüssigkeiten. 2.5 Strom in Flüssigkeiten. 2.5 Strom in Flüssigkeiten. 2.5 Strom in Flüssigkeiten
 Leitungsversuche: Destilliertes Wasser Leitungswasser NaCl i Wasser Abhängigkeiten: Vorhandensein von Ladungsträgern Beweglichkeit der Ladungsträger ("Häufigkeit von Stößen", " Reibung") Anode + Kathode
Leitungsversuche: Destilliertes Wasser Leitungswasser NaCl i Wasser Abhängigkeiten: Vorhandensein von Ladungsträgern Beweglichkeit der Ladungsträger ("Häufigkeit von Stößen", " Reibung") Anode + Kathode
Erklärt euch die Aufgabe. Erklärt euch die Aufgabe gegenseitig noch einmal in euren eigenen Worten. euren eigenen Worten.
 Erklärt euch die Aufgabe gegenseitig noch einmal in euren eigenen Worten. Klärt dabei, wie ihr die Aufgabe verstanden habt und was euch noch unklar ist. Erklärt euch die Aufgabe gegenseitig noch einmal
Erklärt euch die Aufgabe gegenseitig noch einmal in euren eigenen Worten. Klärt dabei, wie ihr die Aufgabe verstanden habt und was euch noch unklar ist. Erklärt euch die Aufgabe gegenseitig noch einmal
Kapitel 2 Repetitionen Chemie und Werkstoffkunde. Thema 6 Oxidation und Reduktion
 BEARBEITUNGSTECHNIK REPETITONEN LÖSUNGSSATZ Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772
BEARBEITUNGSTECHNIK REPETITONEN LÖSUNGSSATZ Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772
LEISTUNGSTEST ELEKTROLYSE-STACK
 LEISTUNGSTEST ELEKTROLYSE-STACK Energetischer und Faradayscher Wirkungsgrad HHO-Generator HG21 Elektrolyse-Stack von Alexander Weis Travelnova TN-S1 Elektrolyse-Stack von Saša Smolčić Dieses Material steht
LEISTUNGSTEST ELEKTROLYSE-STACK Energetischer und Faradayscher Wirkungsgrad HHO-Generator HG21 Elektrolyse-Stack von Alexander Weis Travelnova TN-S1 Elektrolyse-Stack von Saša Smolčić Dieses Material steht
Grundlagen der Chemie Elektrochemie
 Elektrochemie Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Elektrischer Strom Ein elektrischer Strom ist ein
Elektrochemie Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Elektrischer Strom Ein elektrischer Strom ist ein
CHEMIE KAPITEL 4 SÄURE- BASE. Timm Wilke. Georg- August- Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
CHEMIE KAPITEL 4 SÄURE- BASE Timm Wilke Georg- August- Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Historisches Im 17. Jahrhundert wurden von Robert Boyle Gemeinsamkeiten verschiedener Verbindungen
Chemie die stimmt! Klassenstufe 9 2. Runde Landesendrunde 2001
 Chemie die stimmt! Klassenstufe 9 2. Runde Landesendrunde 2001 1. Eine auch in Haushalt und Medizin verwendete Natriumverbindung wird durch Wärme zersetzt. Beim Erhitzen von 1,009g der Verbindung entstehen
Chemie die stimmt! Klassenstufe 9 2. Runde Landesendrunde 2001 1. Eine auch in Haushalt und Medizin verwendete Natriumverbindung wird durch Wärme zersetzt. Beim Erhitzen von 1,009g der Verbindung entstehen
Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Chemische Gleichgewichte, Säuren und
 Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Stoffe oder Teilchen, die Protonen abgeben kånnen, werden als SÄuren bezeichnet (Protonendonatoren).
 5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten Eine Gruppe mischt Spiritus mit Wasser. Füllt dazu zunächst zwei Messzylinder mit je exakt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten Eine Gruppe mischt Spiritus mit Wasser. Füllt dazu zunächst zwei Messzylinder mit je exakt
