1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden.
|
|
|
- Fritzi Beyer
- vor 7 Jahren
- Abrufe
Transkript
1 6. Bindungslehre 6.2 Wie verbinden sich Atome? 1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden. 6.3 Metallbindung 1. Nennen Sie fünf charakteristische Eigenschaften von metallischen Stoffen. 2. Wie halten die Metallatome in Metallen zusammen? 3. Erklären Sie, weshalb in Metallen ein Elektronengas vorhanden ist. 4. Lösen sie folgende Aufgaben im Buch (S ): A2, A3, Ü1, Ü2 5. Ein Metall besitzt das rechts dargestellte Metallgitter. Weisen Sie anhand des Gitters nach, ob es sich um eine dichteste Kugelpackung handelt, oder nicht. Gehen Sie von den Kugeln 1a oder 1b aus. 1a 1b 6. Quecksilber und Silber werden zusammen verschmolzen, so dass ein einheitlicher Stoff entsteht. Wobei handelt es sich dabei? 7. Nennen Sie 3 Gründe, warum man in einigen Fällen Legierungen elementaren Metallen bevorzugt. 6.4 Atomgrösse und Elektronegativität 1. Bestimmen Sie für Na bis Ar den detaillierten Aufbau der Atomrümpfe (alle Elementarteilchen in Kern und Schalen) und geben Sie die Ladungen der Atomrümpfe an. 2. Wie lässt sich aus der Lage im PSE auf die Anzahl Valenzelektronen schliessen? 3. Geben Sie bei folgenden Paaren an, welches Atom seine Valenzelektronen schwächer anzieht und begründen Sie: a) Mg & Ba b) Cl & Al c) K & F 4. Wie verhält sich die Elektronegativität innerhalb der Erdalkalimetalle? Erklären Sie dieses Verhalten. 5. Worin unterscheidet sich ein Metallatom von einem Nichtmetallatom? 6. Lösen Sie folgende Aufgaben im Buch: Ü3 (S. 103), Ü14 (S. 104) / A17, A18, A19 (S. 102) S. Dolder S. 1
2 6.5 Ionenbindung 1. Welche Ionen entstehen aus folgenden Elementarstoffen (Bsp.: Na! Na + ): Calcium, Fluor F 2, Kalium, Aluminium, Sauerstoff O 2, Xenon, Stickstoff N Heben Sie in folgenden Verbindungen rot die Kationen und blau die Anion hervor. Schreiben Sie darunter die Formel der Ionen mit ihrer Ladung auf: MgBr 2 Al 2 O 3 CuCl 2 NaOH 3. Formulieren sie die vollständigen Reaktionsgleichungen folgender Reaktionen: Magnesium und Brom (Br 2 ), Kalium und Sauerstoff (O 2 ), Lithium und Iod (I 2 ), Aluminium und Schwefel (S), Natrium und Stickstoff (N 2 ) 4. Schauen Sie sich die Namen folgender Salze an: Natriumchlorid (NaCl), Magnesiumfluorid (MgF 2 ), Lithiumoxid (Li 2 O), Aluminiumnitrid (AlN), Calciumsulfid (CaS). Leiten sie aus diesen Beispielen eine Regel für die Benennung von Salzen ab. Benennen Sie damit die Salze aus Aufgabe Erklären sie die Unterschiede in folgenden Beobachtungen: a) Bei der Bildung von Natriumchlorid wird 780 kj/mol Energie und bei Magnesiumchlorid 2501 kj/mol frei. b) Bei der Bildung von Lithiumfluorid wird 1039 kj/mol Energie und bei Rubidiumfluorid 780 kj/mol frei. 6. Nennen sie die vier charakteristischen Merkmale von Salzen. 7. Weshalb sind Salze spröde? 8. Destilliertes Wasser hat eine tiefere elektrische Leitfähigkeit als Meerwasser. Erklären sie den Unterschied. 9. Schlagen sie einen Versuch vor, um aus Kaliumchlorid metallisches Kalium zu gewinnen. 6.6 Elektronenpaarbindung 1. Zwei zuerst weit voneinander entfernte Fluor-Atome (F) werden einander angenähert. Zeichnen Sie ein Energie-(y-Achse) Abstand-(x-Achse) Diagramm. a) Woran lässt sich erkennen, dass eine Elektronenpaarbindung entstanden ist? b) Zeichen Sie die Bindungsenergie und den Bindungsabstand im Diagramm ein. 2. Zeichnen Sie mit der Lewis-Schreibweise die Verteilung der Valenzelektronen in den Elektronenwolken folgender Nichtmetalle. H, C, O, Cl, N, He, S, B 3. Zeichnen sie zu folgenden Summenformeln alle möglichen Strukturformeln und kontrollieren sie die Richtigkeit mit der Edelgasregel: CH 4, H 2 O, HNO, HCN, C 2 H 2, C 2 H 4, C 2 H 4 Cl 2, C 2 H 6 O, C 4 H Welche der folgenden Strukturformeln entsprechen den Regeln, welche nicht? S. Dolder S. 2
3 5. Luftschadstoffe mit exotischen Molekülen. Versuchen Sie die Strukturformeln folgender Schadstoffe zu zeichnen: Kohlenstoffmonoxid (CO), Ozon (O 3 ), Stickstoffdioxid (NO 2 ), Schwefelige Säure (H 2 SO 3 ) 6.7 Räumlicher Bau von Molekülen 1. Beschreiben sie das Aussehen / die Geometrie folgender Moleküle: CH 4, HCN, C 2 H 4, CH 3 OH. Gehen Sie wie folgt vor: a) Heben Sie alle Zentralatome (Atome mit mehr als einem Bindungspartner) hervor b) Bestimmen Sie die Anzahl bindender und nicht-bindender Elektronenpaare um die Zentralatome c) Leiten Sie daraus die Bindungswinkel gemäss EPA-Modell ab d) Bestimmen Sie die Anzahl Bindungspartner um jedes Zentralatom e) Benennen Sie die Molekülgeometrie (-struktur) bei jedem Zentralatom f) Vergleichen Sie ihre Ergebnisse mit dem Molekülbaukasten. 2. Erklären Sie mit dem EPA-Modell weshalb H 2 O eine gewinkelte, CO 2 eine lineare Form besitzt. 3. Zeichne Sie die Keil-Strichformeln folgender Moleküle: CH 2 Cl 2, PH Polare Bindungen 1. Folgende Formeln sind gegeben: HCN CBr 4 ClCN KCl CH 2 Cl 2 a) Betrachten Sie die Formeln gut und überlegen Sie sich, welche Bindungstypen in diesen Verbindungen vorkommen. Welche Formeln kennzeichnen Moleküle, welche nicht? b) Zeichnen sie die Strukturformel aller Moleküle. c) Bestimmen sie die EN aller Atome in jedem Molekül. d) Berechnen sie ΔEN aller im Molekül vorhandenen Bindungen. e) Bestimmen sie die Polarität jeder Bindung in den Molekülen. f) Tragen sie wo möglich die Partialladungen ein. 2. Welche der fünf Verbindungen in Aufgabe 1 besitzen einen permanenten Dipol? Übersicht Atomart der Bindungspartner Metallbindung Ionenbindung Elektronenpaarbindung Metall-Metall Ablauf bei der Bildung der Bindung aus einzelnen Atomen Charakteristische Merkmale der Bindung Valenzschalen überlagern sich, Elektronen frei beweglich Ionen, hohe Gitterenergie, Ionengitter S. Dolder S. 3
4 8. Kohlenwasserstoffe 8.2 Alkane 1. Füllen sie folgende Tabelle aus C-Atome Summenformel Name Strukturformel Skelettformel Hexan C 4 H 10 8 Methan 2. Zeichnen Sie alle möglichen Strukturformeln zur Summenformel C 6 H Benennen Sie Isobutan (Abb. 23 rechts, S. 294) nach IUPAC-Nomenklatur 4. Zeichnen sie die Skelettformeln von 2,2-Dimethylbutan und 4-Ethyl-2,5-dimethylheptan 5. Schauen sie sich die Gefahrensymbole auf der Seite 444 ihres Buches an. Mit welchem Symbol würden sie flüssige Alkane kennzeichnen. Welches Symbol wäre bei luftvermischten Alkandämpfen angebracht? 6. In einer Campinggasflasche befindet sich Butangas. Wenn man die Flasche schüttelt, so hört man das Plätschern einer Flüssigkeit. Erklären Sie, weshalb Butan in der Flasche flüssig ist. 8.4 Energie aus Treibstoffen 1. Lesen Sie das Kap im Buch S (inkl. Abb. 17 und 18). Hinweis: Bindungsenergie (=enthalpie) von C=O in CO 2 beträgt 803kJ/mol (Anm. Tabellenende!) 2. In Campinggaskochern verwendet man statt Methan häufig Propan. a) Zeichnen Sie die Strukturformel von Propan auf, geben Sie die vollständige Reaktionsgleichung der Verbrennung von Propan an. b) Berechnen Sie die molare Reaktionswärme mit der Tabelle im Buch (Abb. 17, S. 169). Beachten Sie, dass die Doppelbindung C=O in CO 2 eine Bindungsenergie von 803kJ/mol besitzt. c) Wo ist mehr Energie gespeichert: in einem Liter Methangas oder Propangas? 3. a) Lesen sie im Buch S. 303 die Abschnitte "Die Verbrennung im Otto-Motor) und "Octanzahl". Hinweis: gebräuchliche Benzinzusätze: Bleitetraethyl (Pb(C 2 H 5 ) 2 ), Benzol und tert. Butylmethylether) b) Was bedeutet an der Tankstelle die Bezeichnung Super Bleifrei 98 S. Dolder S. 6
5 8.5 Alkene und Alkine 1. Lesen Sie im Buch S. 309 Homologe Reihe der Alkene & Cycloalkene und S. 317 den Abschnitt Polyene 2. Tragen sie in folgender Tabelle die systematischen IUPAC-Namen für die Verbindungen ein: 3. Zeichnen sie die Skelettformel folgender Moleküle: 2,3-Dimethyl-but-2-en, 4-Methyl-2-pentin, Octa-3,6-dien-1-in 4. Bestimmen sie die E/Z-Konfigurationen der vier letzten Beispiele auf dem zusätzlichen Übungsblatt zum IUPAC-Nomenklaturspiel 5. Lesen sie den Abschnitt Polymerisation im Buch S a) Nennen sie die drei Stufen der Polymerisation (Abb 67, S. 313). b) Der so genannte Kettenabbruch wird als Endstufe bezeichnet. Welche Vorgänge führen zum Abbruch der Polymerisation? 6. Lesen sie im Buch S. 314 das Kap Nennen Sie die drei wichtigen Stoffeigenschaften, nach denen sich Kunststoffe einteilen lassen. 7. Zeichnen sie das Produkt auf, das bei der Polymerisation von drei (1-)Buten-Monomeren entsteht (siehe Abb. 63, S.312) 8. Lesen Sie im Buch S. 306 das Kap Exkurs: Halogenalkane a) Halogenalkane (und auch andere organische Halogenverbindungen) sind oder waren als Alltagsstoffe weit verbreitet. Welche Nutzen bringen sie? b) Der Einsatz vieler Halogenalkane ist heute streng reguliert. Welche Gefahren bergen sie? S. Dolder S. 7
6. Bindungslehre 6.1 Eigenschaften des PSE
 6. Bindungslehre 6.1 Eigenschaften des PSE 1. Berechnen sie die mittlere Atommasse von Chlor (Cl) und vergleichen sie ihren Wert mit dem PSE im Buch. Natürliche Isotope und ihr Anteil: 35 Cl: 75.8%, 37
6. Bindungslehre 6.1 Eigenschaften des PSE 1. Berechnen sie die mittlere Atommasse von Chlor (Cl) und vergleichen sie ihren Wert mit dem PSE im Buch. Natürliche Isotope und ihr Anteil: 35 Cl: 75.8%, 37
1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden.
 6. Bindungslehre 6.1 Wie verbinden sich Atome? 1. ennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden. 6.2 Atomeigenschaften im PSE 1. Bestimmen Sie für a bis Ar den
6. Bindungslehre 6.1 Wie verbinden sich Atome? 1. ennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden. 6.2 Atomeigenschaften im PSE 1. Bestimmen Sie für a bis Ar den
Lernzielkontrolle Sekunda
 Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (15) Richtzeit: 25 Minuten 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) Manche
Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (15) Richtzeit: 25 Minuten 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) Manche
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1. Grundwissen 8. Klasse 2 Grundwissen 8. Klasse 2. Stoffebene
 Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
08.12.2013. Wichtige Stoffgruppen. Stoffgruppe. Atomverband. Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Metall Metall:
 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1. Grundwissen 8.Klasse 2 Grundwissen 8.Klasse 2. Stoffebene. Teilchen -ebene
 Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Kochsalz-Kristalle (Halit) Wichtige Stoffgruppen Atomverband Stoffgruppe Metall Metall: Metallische Stoffe Salzartige Stoffe Metall Nichtmetall:
 Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Vom Atom zum Molekül
 Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen
![[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen [ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen](/thumbs/68/58264490.jpg) 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1. Grundwissen 9.Klasse SG 2 Grundwissen 9.Klasse SG 2. Stoffebene.
 Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
Anorganische Chemie I
 Anorganische Chemie I PRÜFUNG B. Sc. Chemieingenieurwesen 14. September 2016 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse.
Anorganische Chemie I PRÜFUNG B. Sc. Chemieingenieurwesen 14. September 2016 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse.
Wiederholungsthema: Ionenbindung und Salze. Zusammenfassung: Ionen und Ionenbildung
 Wiederholungsthema: Ionenbindung und Salze Zusammenfassung: Ionen und Ionenbildung Wie sich Atome auch immer verbinden mögen, so versuchen sie doch stets dabei die Edelgaskonfiguration (Abb.3) zu erhalten,
Wiederholungsthema: Ionenbindung und Salze Zusammenfassung: Ionen und Ionenbildung Wie sich Atome auch immer verbinden mögen, so versuchen sie doch stets dabei die Edelgaskonfiguration (Abb.3) zu erhalten,
Grundpraktikum für Biologen 2016
 Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
1.8. Aufgaben zur Elektronenpaarbindung
 1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung
 1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
Learn4Med. Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall
 6. Chemische Bindung Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall Atombindung: zwischen zwei Nichtmetallen, es entsteht
6. Chemische Bindung Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall Atombindung: zwischen zwei Nichtmetallen, es entsteht
Welche beiden Metalle prägten eine Epoche?
 Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Oktett-Theorie von Lewis
 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Atomverbände. In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die Elektronenkonfiguration
 Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die
Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die
Elektronenpaarbindung (oder Atombindung) Nichtmetallatom + Nichtmetallatom Metallatom + Nichtmetallatom 7. Welche Bindungsart besteht jeweils?
 LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität
 Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem?
 2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
Name: Punktzahl: von 57 Note:
 Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Welche Arten von Formeln stehen dem Chemiker zur Verfügung?
 Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Stoffgemisch. Reinstoff. Homogenes Gemisch. Heterogenes Gemisch. ( 8. Klasse NTG 1 / 48 ) ( 8. Klasse NTG 2 / 48 ) ( 8. Klasse NTG 3 / 48 )
 Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
Ionenbindungen. Chemie. Library
 Chemie Ionenbindungen Library IONENBINDUNGEN Begriffserklärung 1 Formeltabelle 1 Ladungsermittlung 2 Formale Ladung 3 Hydrogen-Ionen 3 Verhältnisformeln 4 Nomenklatur 4 Gitterenthalpie 4 Eigenschaften
Chemie Ionenbindungen Library IONENBINDUNGEN Begriffserklärung 1 Formeltabelle 1 Ladungsermittlung 2 Formale Ladung 3 Hydrogen-Ionen 3 Verhältnisformeln 4 Nomenklatur 4 Gitterenthalpie 4 Eigenschaften
Vorlesung Chemie für Biologen: Klausur 1 WS Sa
 1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Die 3 Stoffklassen der Elemente
 Die Art der Bindung hängt davon ab, wie stark die Atome ihre Valenzelektronen anziehen. Elektronegativität (Abb. 17, S. 114) Qualitative Angabe, wie stark die Atomrümpfe die Elektronen in der Valenzschale
Die Art der Bindung hängt davon ab, wie stark die Atome ihre Valenzelektronen anziehen. Elektronegativität (Abb. 17, S. 114) Qualitative Angabe, wie stark die Atomrümpfe die Elektronen in der Valenzschale
Grundwissenkarten Hans-Carossa-Gymnasium. 9. Klasse. Chemie SG
 Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Chemie Grundwissen der achten Jahrgangsstufe (NTG)
 hemie Grundwissen der achten Jahrgangsstufe (NTG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
hemie Grundwissen der achten Jahrgangsstufe (NTG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
Grundwissen Chemie 8. Klasse NTG
 Grundwissen Chemie 8. Klasse NTG Reinstoff hat gleich bleibende Eigenschaften (Stoffebene) besteht aus einer Sorte gleichartiger Teilchen z.b.: dest. Wasser, Kupfer, Gold, Salz 8.1 C NTG Element sind nicht
Grundwissen Chemie 8. Klasse NTG Reinstoff hat gleich bleibende Eigenschaften (Stoffebene) besteht aus einer Sorte gleichartiger Teilchen z.b.: dest. Wasser, Kupfer, Gold, Salz 8.1 C NTG Element sind nicht
0.6 Einfache Modelle der chemischen Bindung
 0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
Chemie für Bauingenieure Uebung 2
 Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
Musterprüfung Welche der Elemente Lithium, Kohlenstoff, Wasserstoff, Sauerstoff, Magnesium, Aluminium und Calcium sind Nichtmetalle?
 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Übung zu den Vorlesungen Organische und Anorganische Chemie
 Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 12.11.08 1. Stellen sie die Reaktionsgleichung für die Herstellung von Natriumsulfid aus den Elementen auf. Wieviel
Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 12.11.08 1. Stellen sie die Reaktionsgleichung für die Herstellung von Natriumsulfid aus den Elementen auf. Wieviel
Grundwissen C8 NTG. 1. Stoffe und Reaktionen. Reinstoff
 Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Bohrsches Atommodell
 Atome und ihre Bindungen Atomaufbau Im Atomkern befinden sich die Protonen (positiv geladen) und die Neutronen (neutral). P und N sind ungefähr gleich schwer und machen 99% der Atommasse aus. Um den Kern
Atome und ihre Bindungen Atomaufbau Im Atomkern befinden sich die Protonen (positiv geladen) und die Neutronen (neutral). P und N sind ungefähr gleich schwer und machen 99% der Atommasse aus. Um den Kern
NH 3. CCl 4 CO 2. Lösungen zur Lernzielkontrolle Sekunda. Hilfsmittel: PSE, Taschenrechner
 Lösungen zur Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (1) 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) leitfähig,
Lösungen zur Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (1) 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) leitfähig,
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität
 Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Übungsaufgaben zur Atombindung, zum EPA-Modell und zur Polarität 1. Strukturformeln aufstellen, Grundlagen zu polaren Bindungen 1.1 a) Weshalb ist Wasserstoff in Molekülverbindungen einbindig (d.h. geht
Musterprüfung Welche der Elemente Lithium, Kohlenstoff, Wasserstoff, Sauerstoff, Magnesium, Aluminium und Calcium sind Nichtmetalle?
 1 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
1 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Kovalenzbindungen und zwischenmolekulare Kräfte
 Chemie Kovalenzbindungen und zwischenmolekulare Kräfte Zusammenfassungen Prüfung Donnerstag, 11. Mai 2017 _ Kovalenzbindungen 1 _ Elektronenpaar-Abstossungsmodell 2 _ Polare und apolare Bindungen 3 _ Dipolmoleküle
Chemie Kovalenzbindungen und zwischenmolekulare Kräfte Zusammenfassungen Prüfung Donnerstag, 11. Mai 2017 _ Kovalenzbindungen 1 _ Elektronenpaar-Abstossungsmodell 2 _ Polare und apolare Bindungen 3 _ Dipolmoleküle
Übungsaufgaben zur Atombindung, EPA-Modell und zur Polarität
 Übungsaufgaben zur Atombindung, EPA-Modell und zur Polarität TGE Zulässige ilfsmittel: Periodensystem der Elemente mit Angaben zu den Elektronegativitäten. Taschenrechner. 1. Zeichnen Sie zuerst die Strukturformel
Übungsaufgaben zur Atombindung, EPA-Modell und zur Polarität TGE Zulässige ilfsmittel: Periodensystem der Elemente mit Angaben zu den Elektronegativitäten. Taschenrechner. 1. Zeichnen Sie zuerst die Strukturformel
Zuusammenfassung Klasssenarbeit Chemie
 Zuusammenfassung Klasssenarbeit Chemie Moritz F. Kuntze 10. November 2016 1 Inhaltsverzeichnis 1 Wertigkeit 3 1.1 Bestimmung der Wertigkeit......................... 3 1.2 Nutzen der Wertigkeit............................
Zuusammenfassung Klasssenarbeit Chemie Moritz F. Kuntze 10. November 2016 1 Inhaltsverzeichnis 1 Wertigkeit 3 1.1 Bestimmung der Wertigkeit......................... 3 1.2 Nutzen der Wertigkeit............................
Polare Bindungen. Die Elektronen eines bindenden. Elektronenpaares sind in Wirklichkeit eher zwei Elektronen, die sich mehrheitlich
 Moleküle Polare Bindungen Die Elektronen eines bindenden (gemeinsamen) Elektronenpaares sind in Wirklichkeit eher zwei Elektronen, die sich mehrheitlich zwischen den beiden Atomkernen der Bindungspartner
Moleküle Polare Bindungen Die Elektronen eines bindenden (gemeinsamen) Elektronenpaares sind in Wirklichkeit eher zwei Elektronen, die sich mehrheitlich zwischen den beiden Atomkernen der Bindungspartner
Zusammenfassung Prüfung Chemie vom
 Zusammenfassung Prüfung Chemie vom 27.10.10 Eigenheiten und Merkmale des Kugelwolkenmodells erklären können Ort und Zeit des Elektrons können nicht exakt bestimmt werden. Der Aufenthaltsort eines Elektrons
Zusammenfassung Prüfung Chemie vom 27.10.10 Eigenheiten und Merkmale des Kugelwolkenmodells erklären können Ort und Zeit des Elektrons können nicht exakt bestimmt werden. Der Aufenthaltsort eines Elektrons
Leitfähigkeit von Flüssigkeiten Wasser (H 2 O 6. O) und Zucker (C 6 H 12
 Leitfähigkeit von Flüssigkeiten Wasser (H 2 ) und Zucker (C 6 H 12 6 ) sind Verbindungen mehrerer Nichtmetalle. Natriumchlorid (NaCl, Kochsalz) ist eine MetallNichtmetallVerbindung. a) Gib an, welche der
Leitfähigkeit von Flüssigkeiten Wasser (H 2 ) und Zucker (C 6 H 12 6 ) sind Verbindungen mehrerer Nichtmetalle. Natriumchlorid (NaCl, Kochsalz) ist eine MetallNichtmetallVerbindung. a) Gib an, welche der
2. Schreiben Sie für folgende Atome das Bohrsche Atommodell auf. a) Aluminium
 Übungsaufgaben 1.Seminar Atome 1. Ergänzen Sie die nachfolgende Tabelle Elementsymbol Elementname Ordnungszahl Massenzahl Bsp. H Wasserstoff 1 1 He Au 7 56 2. Schreiben Sie für folgende Atome das Bohrsche
Übungsaufgaben 1.Seminar Atome 1. Ergänzen Sie die nachfolgende Tabelle Elementsymbol Elementname Ordnungszahl Massenzahl Bsp. H Wasserstoff 1 1 He Au 7 56 2. Schreiben Sie für folgende Atome das Bohrsche
Grundtypen der Bindung. Grundtypen chemischer Bindung. Oktettregel. A.8.1. Atombindung
 Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie
 Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Bau der Metalle Eigenschaften plastisch verformbar elektrisch leitfähig hohe Siede- und Schmelztemperaturen
 Metallbindungen Bau der Metalle bestehen aus positiv geladene Atomrümpfe (= Atomkern und alle Elektrone auβer den Vallenzelektronen) + frei beweglichen Auβenelektronen Atomrümpfe sind sehr fest angeordnet
Metallbindungen Bau der Metalle bestehen aus positiv geladene Atomrümpfe (= Atomkern und alle Elektrone auβer den Vallenzelektronen) + frei beweglichen Auβenelektronen Atomrümpfe sind sehr fest angeordnet
Chemie 8. In der Jahrgangsstufe 8 erwerben die Schüler folgendes Grundwissen:
 In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
Grundwissen Chemie 8. Jahrgangsstufe
 Grundwissen Chemie 8. Jahrgangsstufe 1. Stoffeigenschaften und Teilchenmodell Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, die man sich am einfachsten als Kugeln vorstellen kann (Kugelteilchenmodell).
Grundwissen Chemie 8. Jahrgangsstufe 1. Stoffeigenschaften und Teilchenmodell Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, die man sich am einfachsten als Kugeln vorstellen kann (Kugelteilchenmodell).
4.Teil Kovalente Bindung
 4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
Die Stoffteilchen (II): Ionengruppen und ihre Ionen
 Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Bist Du nicht "FIT", dann musst Du nacharbeiten.
 Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
ELEMENTARSTOFFE, VERBINDUNGEN und chemische Formeln LÖSUNG. Hinweis: In den Salzen kommen die Metallatome stets als einatomige Kationen vor.
 Hinweis: In den Salzen kommen die Metallatome stets als einatomige Kationen vor. Aufgabe 1: a) Tragen Sie die folgenden chemischen Formeln in die richtige Spalte der Tabelle ein. Beachten Sie, dass mehrere
Hinweis: In den Salzen kommen die Metallatome stets als einatomige Kationen vor. Aufgabe 1: a) Tragen Sie die folgenden chemischen Formeln in die richtige Spalte der Tabelle ein. Beachten Sie, dass mehrere
Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s 2 3p 6. Geben Sie isoelektronische Ionen zu den folgenden Atomen an
 Übung 05.11.13 Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 Ne / F - / O 2- / N 3- / Na + / Mg 2+ / Al 3+. Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s
Übung 05.11.13 Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 Ne / F - / O 2- / N 3- / Na + / Mg 2+ / Al 3+. Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s
Auf der rechten Seite sind Beispiele für kovalente Bindungen.
 Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Atomaufbau. Elektronen e (-) Atomhülle
 Atomaufbau Institut für Elementarteilchen Nukleonen Protonen p (+) Neutronen n (o) Elektronen e (-) Atomkern Atomhülle Atom WIBA-NET 2005 Prof. Setzer 1 Elementarteilchen Institut für Name Symbol Masse
Atomaufbau Institut für Elementarteilchen Nukleonen Protonen p (+) Neutronen n (o) Elektronen e (-) Atomkern Atomhülle Atom WIBA-NET 2005 Prof. Setzer 1 Elementarteilchen Institut für Name Symbol Masse
Chemie Grundwissen der neunten Jahrgangsstufe (SG)
 hemie Grundwissen der neunten Jahrgangsstufe (SG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
hemie Grundwissen der neunten Jahrgangsstufe (SG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
Thematische Aufgliederung der Prüfungsfragen
 Seite 1 Thematische Aufgliederung der Prüfungsfragen (gemäss Abschlussprüfungen im Fach Chemie der Eidgenössischen Berufsmaturitätsprüfung Technischer Richtung) 1. Heterogene Mischungen; Trennmethoden
Seite 1 Thematische Aufgliederung der Prüfungsfragen (gemäss Abschlussprüfungen im Fach Chemie der Eidgenössischen Berufsmaturitätsprüfung Technischer Richtung) 1. Heterogene Mischungen; Trennmethoden
Werkstoffkunde Chemische Bindungsarten
 Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
bestimmte mehratomige Anionen mit Sauerstoff werden mit dem lateinischen Namen benannt und enden auf at.
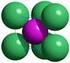 DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
Lernmaterial Lernfeld 1 Grundlagen Physik und Chemie. Chemische Grundlagen, Bindungsarten. Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms
 Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Chemische Bindung. Chemische Bindung
 Chemische Bindung Atome verbinden sich zu Molekülen oder Gittern, um eine Edelgaskonfiguration zu erreichen. Es gibt drei verschiedene Arten der chemischen Bindung: Atombindung Chemische Bindung Gesetz
Chemische Bindung Atome verbinden sich zu Molekülen oder Gittern, um eine Edelgaskonfiguration zu erreichen. Es gibt drei verschiedene Arten der chemischen Bindung: Atombindung Chemische Bindung Gesetz
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten Eine Gruppe mischt Spiritus mit Wasser. Füllt dazu zunächst zwei Messzylinder mit je exakt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten Eine Gruppe mischt Spiritus mit Wasser. Füllt dazu zunächst zwei Messzylinder mit je exakt
Definiere den Begriff Chemischer Vorgang! Definiere den Begriff Physikalischer Vorgang!
 Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Atomverbände. Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner SALZE
 Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE 1 Einstieg: Schreck lass nach! Dieser Winter hat viele Teile der Schweiz mit seinen
Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE 1 Einstieg: Schreck lass nach! Dieser Winter hat viele Teile der Schweiz mit seinen
Naturwissenschaftliches Arbeiten. Aggregatzustände. Einteilung der Stoffe. Einteilung der Stoffe. Reinstoff
 1 1 Naturwissenschaftliches Arbeiten Beschreibe den Weg der naturwissenschaftlichen Erkenntnisgewinnung. Untersuchung Untersuchungen Regeln/ Gesetze gelten so lange, bis sie durch Untersuchungen widerlegt
1 1 Naturwissenschaftliches Arbeiten Beschreibe den Weg der naturwissenschaftlichen Erkenntnisgewinnung. Untersuchung Untersuchungen Regeln/ Gesetze gelten so lange, bis sie durch Untersuchungen widerlegt
Schweizerische Maturitätsprüfung Gruppe / Kandidat/in Nr:... Winter 2010, Zürich Name/Vorname:...
 Gruppe / Kandidat/in Nr:... Name/Vorname:... Grundlagenfach Bereich Teil: NATURWISSENSCHAFTEN Chemie Verfasser: Richtzeit: Hilfsmittel: Hinweise: R. Guenin, J. Lipscher, S. Steiner 80 Minuten (von total
Gruppe / Kandidat/in Nr:... Name/Vorname:... Grundlagenfach Bereich Teil: NATURWISSENSCHAFTEN Chemie Verfasser: Richtzeit: Hilfsmittel: Hinweise: R. Guenin, J. Lipscher, S. Steiner 80 Minuten (von total
Chemie-Grundwissen der 9.Klasse
 Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Das Tetraeder-Bällchen/Oktaeder-Bällchen
 H-Atome: klein, weiß Edelgas-Atome: He, Ne, Ar, Kr, Xe, Rn: verschiedene Lila-Töne Metalle: Natrium, Calcium: eher Dunkelblau-Töne Nichtmetalle: C N O F P S Cl grau (kopiert) hellblau rot hellgelb orange
H-Atome: klein, weiß Edelgas-Atome: He, Ne, Ar, Kr, Xe, Rn: verschiedene Lila-Töne Metalle: Natrium, Calcium: eher Dunkelblau-Töne Nichtmetalle: C N O F P S Cl grau (kopiert) hellblau rot hellgelb orange
Grundwissen 9.Klasse NTG 1 Grundwissen 9.Klasse NTG 1. Bsp.: Grundwissen 9.Klasse NTG 2 Grundwissen 9.Klasse NTG 2
 Grundwissen 9.Klasse NTG 1 Grundwissen 9.Klasse NTG 1 Die Stoffmenge n = 1mol ist die Stoffportion, die 6,022 10 23 Teilchen enthält. Die Stoffmenge n n(he) = 1 mol n(h 2 ) = 1 mol enthält 6,022 10 23
Grundwissen 9.Klasse NTG 1 Grundwissen 9.Klasse NTG 1 Die Stoffmenge n = 1mol ist die Stoffportion, die 6,022 10 23 Teilchen enthält. Die Stoffmenge n n(he) = 1 mol n(h 2 ) = 1 mol enthält 6,022 10 23
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Homogene und heterogene Stoffgemische Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Homogene und heterogene Stoffgemische Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar
Bindungstypen und zwischenmolekulare Kräfte
 Bindungstypen und zwischenmolekulare Kräfte 1 Metallbindung a) Eigenschaften der Metalle c silbriger Glanz d elektrische Leitfähigkeit e Verformbarkeit b) Elektronengasmodell 1 Kraft 3 A 2 Freie Elektronen:
Bindungstypen und zwischenmolekulare Kräfte 1 Metallbindung a) Eigenschaften der Metalle c silbriger Glanz d elektrische Leitfähigkeit e Verformbarkeit b) Elektronengasmodell 1 Kraft 3 A 2 Freie Elektronen:
1. Standortbestimmung, Januar Chemie. Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung,
 1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
GRUNDWISSEN CHEMIE 8. KLASSE
 GRUDWISSE CEMIE 8. KLASSE (LS Marquartstein September 2013) 2006 Wagner/Gottschalk LS Marquartstein 1 I. Stoffe und Reaktionen: Physikalische Vorgänge sind begleitet von Energieumwandlungen (Wärme- Licht-
GRUDWISSE CEMIE 8. KLASSE (LS Marquartstein September 2013) 2006 Wagner/Gottschalk LS Marquartstein 1 I. Stoffe und Reaktionen: Physikalische Vorgänge sind begleitet von Energieumwandlungen (Wärme- Licht-
4.2 Kovalente Bindung. Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916)
 4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
Chemie 8. In der Jahrgangsstufe 8 erwerben die Schüler folgendes Grundwissen:
 In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
Orientierungstest für angehende Industriemeister. Vorbereitungskurs Chemie
 Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Weiterbildung Technologie Erlaubte Hilfsmittel: Periodensystem der Elemente Taschenrechner Maximale Bearbeitungszeit: 60 Minuten
Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Weiterbildung Technologie Erlaubte Hilfsmittel: Periodensystem der Elemente Taschenrechner Maximale Bearbeitungszeit: 60 Minuten
Schwerpunktfach BIOLOGIE und CHEMIE. Chemie-Teil
 Maturaprüfung 2010 Note: Name:... Klasse:... Punktzahl:... Schwerpunktfach BIOLOGIE und CHEMIE Chemie-Teil Lehrpersonen: Dr. Zoltàn Molnar, Dr. Małgorzata Simson Prüfungsdatum und -Zeit:..tag,. Mai 2010,..
Maturaprüfung 2010 Note: Name:... Klasse:... Punktzahl:... Schwerpunktfach BIOLOGIE und CHEMIE Chemie-Teil Lehrpersonen: Dr. Zoltàn Molnar, Dr. Małgorzata Simson Prüfungsdatum und -Zeit:..tag,. Mai 2010,..
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Mit Tandemkarten in der Sekundarstufe I wiederholen
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Das komplette Material finden Sie hier: School-Scout.de 38. 1 von 12 Birte Bathen, Duisburg Niveau: Sek. I Dauer: 1 Unterrichtsstunde
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Das komplette Material finden Sie hier: School-Scout.de 38. 1 von 12 Birte Bathen, Duisburg Niveau: Sek. I Dauer: 1 Unterrichtsstunde
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Robert-Koch-Gymnasium Deggendorf. Grundwissen Chemie. 8. Jahrgangsstufe
 Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Schriftliche Abschlussprüfung Chemie
 Sächsisches Staatsministerium für Kultus Schuljahr 1999/ Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Sächsisches Staatsministerium für Kultus Schuljahr 1999/ Geltungsbereich: für Klassen 10 an - Mittelschulen - Förderschulen - Abendmittelschulen Schriftliche Abschlussprüfung Chemie Realschulabschluss
Stoffgemisch. Reinstoff. Homogenes Gemisch. Heterogenes Gemisch. ( 9. Kl. SG - WSG 1 / 56 ) ( 9. Kl. SG - WSG 2 / 56 ) ( 9. Kl.
 Stoffgemisch ( 9. Kl. SG - WSG 1 / 56 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 9. Kl.
Stoffgemisch ( 9. Kl. SG - WSG 1 / 56 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 9. Kl.
Station 1: Nomenklatur von Alkanen
 Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
2. Verhalten der Elemente bei einer Reaktion: Warum funkt s bei unterschiedlichen
 1. Atombau und Periodensystem 1a) Nach welchem Gesichtspunkt sind die Elemente im Periodensystem von 1- ca. 103 angeordnet? 1b) Nach welchem Gesichtspunkt ist ein Element einer PERIODE zugeordnet? 1c)
1. Atombau und Periodensystem 1a) Nach welchem Gesichtspunkt sind die Elemente im Periodensystem von 1- ca. 103 angeordnet? 1b) Nach welchem Gesichtspunkt ist ein Element einer PERIODE zugeordnet? 1c)
