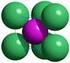
Kochsalz-Kristalle (Halit) Wichtige Stoffgruppen Atomverband Stoffgruppe Metall Metall: Metallische Stoffe Salzartige Stoffe Metall Nichtmetall:
|
|
|
- Henriette Kopp
- vor 7 Jahren
- Abrufe
Transkript
1 Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall: Halbmetallverbindungen: Flüchtige Stoffe (Moleküle) Diamantartige Stoffe (Gitter) Hochmolekulare Stoffe Gitter (metallische Stoffe) und Moleküle 2 1
2 Experimente: Metalle reagieren mit Nichtmetallen Zink (Zn, Metall) reagiert exotherm mit Schwefel (S, Nichtmetall). Es entsteht ein sprödes weisses Pulver Zinksulfid Natrium (Na, Metall) reagiert sehr heftig mit Chlorgas (Cl 2, Nichtmetall). Es entsteht Kochsalz (siehe Abb. 13, S.142) Reagieren Metalle mit Nichtmetallen, entstehen meist salzartige Stoffe 3 Experimente: Metalle reagieren mit Nichtmetallen Magnesium verbrennt hell leuchtend: Aus Magnesium und Sauerstoff entsteht ein weisses Pulver: Magnesiumoxid Reagieren Metalle mit Nichtmetallen, entstehen meist salzartige Stoffe 4 2
3 Salze sind Ionenverbindungen: - Bei der Reaktion geben die Metallatome ihre Valenzelektronen voll- ständig ab. Sie bilden positiv geladene Atome Metallatome bilden positiv geladene Ionen (Kationen) - 1 e - Na Na Bei der Reaktion nehmen die Nichtmetallatome Elektronen auf und ergänzen ihre Valenzschale auf 8 Elektronen Sie bilden negativ geladene Atome Nichtmetallatome bilden negativ geladene Ionen (Anionen) + 1 e - Cl Cl Salze Salze bestehen aus positiv und negativ geladenen Teilchen, den Ionen. Sie werden zusammengehalten durch starke anziehende Kräfte zwischen den Ionen. Kationen: positiv geladene Ionen Anionen: negativ geladene Ionen 6 3
4 7 Ionenbindung Ionengitter (Buch S ) Die unterschiedlich geladenen Ionen ziehen sich an. Dabei bildet sich eine regelmässige Gitterstruktur. Salze bilden häufig Kristalle, bei denen die regelmässige Form diese Gitteranordnung wiederspiegelt. 8 4
5 Edelgasregel (auch Oktett-/Dublett-Regel) Atome der Hauptgruppenelemente sind bestrebt, durch Aufnahme oder Abgabe von Elektronen vollständig gefüllte (Valenz-) Schalen zu erreichen. 1. Schale (K-Schale) voll mit 2 Elektronen (Dublett) Ab 2. Schale voll mit 8 Elektronen (Oktett) 9 Edelgasregel (auch Oktett-/Dublett-Regel) Atome der Hauptgruppenelemente sind bestrebt, durch Aufnahme oder Abgabe von Elektronen vollständig gefüllte (Valenz-) Schalen zu erreichen. 1. Schale (K-Schale) voll mit 2 Elektronen (Dublett) Ab 2. Schale voll mit 8 Elektronen (Oktett) Aufgabe (mit PSE) Welche Ionen entstehen aus folgenden Elementen: Calcium, Fluor, Kalium, Aluminium, Sauerstoff, Xenon, Stickstoff Beispiel: Na Na
6 Ionenbindung Ionengitter (Buch S ) Die unterschiedlich geladenen Ionen ziehen sich an. Dabei bildet sich eine regelmässige Gitterstruktur. Gitterenergie (Buch Seiten ) Die Bildung des Ionen-Gitters ist ein exothermer Prozess: Energie wird an die Umgebung abgegeben. Beispiel: Verbrennung von Magnesium zu Magnesiumoxid. Die gleiche Energiemenge muss aufgewendet werden, um die Ionen wieder vollständig aus einem Gitter zu lösen: die elektrostatischen Anziehungskräfte zwischen den Ionen müssen überwunden werden. 11 Ungleich geladene Teilchen ziehen sich an, gleich geladene Teilchen stossen sich ab. Coulomb Gesetz: Die anziehende / abstossende Kraft F zwischen 2 geladenen Teilchen mit den Ladungen q1 und q2 im Abstand r (Buch Seite 88): Charles Augustin de Coulomb
7 Je grösser die Ladung der Ionen, desto grösser die Gitterenergie (stärkere Anziehungskräfte gemäss Coulomb-Gesetz). 13 Je grösser die Ladung, desto grösser die Gitterenergie Je grösser die Ionen, desto kleiner die Gitterenergie 14 7
8 Salze Formeln und Namen von Molekül-Ionen NO - 3 SO 2-4 PO 3-4 CO 2-3 HCO - 3 OH - Nitrat-Ion Sulfat-Ion Phosphat-Ion Carbonat-Ion Hydrogencarbonat-Ion Hydroxid-Ion 15 Bezeichnungen von Ionen Buch Seite
9 Buch Seite Das Lösen von Salzen Buch Seite
10 19 Löslichkeit von Salzen Faustregel: Wenn beide Ionen eine Ladung von 2 oder mehr haben, ist das Salz unlöslich. Beispiele von unlöslichen Salzen: MgO Mg 2+ O 2- Magnesiumoxid Kreide, «Magnesia» im Turnen Fe 2 O 3 Fe 3+ O 2- Eisen(III)-oxid Bestandteil von Rost CaCO 3 Ca 2+ CO 3 2- Calciumcarbonat Kalk Ausnahmen AgCl Silberchlorid weiss AgI Silberiodid gelblich Für den Nachweis von Chlorid- und Iodid-Ionen wird Silbernitrat-Lösung zugegeben
11 Aufgabe Ergänzen Sie die folgenden Reaktionsgleichungen K + S K + + S 2- K S Kaliumsulfid Mg + O Mg 2+ + O 2- MgO Magnesiumoxid Al + O Al 3+ + O 2- Al O Aluminiumoxid Ca + P Ca 2+ + P 3- Ca P Calciumphosphid Ge + O Ge 4+ + O 2- GeO Germaniumoxid Na + N Na + + N 3- Na N Natriumnitrid 21 Lösungen 2 K + S 2 K + + S 2- K 2 S Kaliumsulfid Mg + O Mg 2+ + O 2- MgO Magnesiumoxid 2 Al + 3 O 2 Al O 2- Al 2 O 3 Aluminiumoxid 3 Ca + 2 P 3 Ca P 3- Ca 3 P 2 Calciumphosphid Ge + 2 O Ge O 2- GeO 2 Germaniumoxid 3 Na + N 3 Na + + N 3- Na 3 N Natriumnitrid 22 11
12 Zusatzaufgabe Aus welchen Ionen besteht: FeCl 2 Fe Cl - Eisen chlorid FeCl 3 Fe Cl - Eisen chlorid Cr 2 O 3 Cr O Chrom oxid Cu 2 S Cu S Kupfer sulfid CuS Cu S Kupfer sulfid 23 Lösungen zur Zusatzaufgabe FeCl 2 Fe 2+ 2 Cl - Eisen(II)-chlorid FeCl 3 Fe 3+ 3 Cl - Eisen(III)-chlorid Cr 2 O 3 2 Cr 3+ 3 O 2- Chrom(III)-oxid Cu 2 S 2 Cu + S 2- Kupfer(I)-sulfid CuS Cu 2+ S 2- Kupfer(II)-sulfid 24 12
13 25 Atom- und Ionenradien Metalle Nichtmetalle Atom Kation Anion Atom Li Li + O 2 O Be Be 2+ F F Na Na + Cl Cl 26 13
14 NaCl-Typ energetisch günstig schwache Abstossung zwischen Anionen starke Anziehung zwischen Anionen und Kationen Grenzfall Abstossung zwischen Anionen Anziehung zwischen Anionen und Kationen energetisch ungünstig starke Abstossung zwischen Anionen schwache Anziehung zwischen Anionen und Kationen 27 Salzgitter r r K A 0.41 r r K A 0.73 Koordinationszahl 4 ZnS-Typ Koordinationszahl 6 NaCl-Typ Koordinationszahl 8 CsCl-Typ 28 14
15 Salze sind spröde Schlag 29 Salze haben einen hohen Schmelzpunkt Wärmezufuhr Die Ionen haben die Gitterkräfte überwunden ScW 30 15
16 Elektrolyse Salze lassen sich in ihre Elemente aufspalten, wenn die Elektronenübertragung durch Anlegen eines elektrischen Stroms rückgängig gemacht wird. Die Aufspaltung einer chemischen Verbindung mit einem elektrischen Strom heisst Elektrolyse. 31 Elektrolyse Buch Seite
17 Elektrolyse einer CuCl 2 -Lösung Cu 2+ (aq) Cu(s) 2 Cl (aq) Cu 2+ (aq) 33 Elektrolyse von geschmolzenem Kochsalz +Pol Pol Metalldraht e e NaCl-Schmelze (> 801 C) Elektrode gibt ein e ab nimmt ein e auf 34 17
18 Elektrolyse Salze lassen sich in ihre Elemente aufspalten, wenn die Elektronenübertragung durch Anlegen eines elektrischen Stroms rückgängig gemacht wird. Die Aufspaltung einer chemischen Verbindung mit einem elektrischen Strom heisst Elektrolyse. Downs Zelle 35 Nichtmetalle: 2-atomige Moleküle Folgende Nichtmetalle kommen als 2-atomige Moleküle vor: H 2, N 2, O 2 und alle Halogene: F 2, Cl 2, Br 2, I ScW 36 18
19 Animationen Auflösen von Salz in Wasser Elektrolyse von CuCl 2 Ionenbindung und Elektron Links Impressum Präsentation von Dr. Walter Schär Basierend auf Unterlagen von Dr. Stefan Dolder Dr. Susanna Stieger Thomas Seilnacht Buch «Elemente», Klett-Verlag Grundlagenfach Chemie Tertia 2013/
Learn4Med. Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall
 6. Chemische Bindung Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall Atombindung: zwischen zwei Nichtmetallen, es entsteht
6. Chemische Bindung Es gibt in der Chemie drei verschiedene Arten von Bindungen: Metallische Bindung: zwischen zwei Metallen, es entsteht ein Metall Atombindung: zwischen zwei Nichtmetallen, es entsteht
Die Stoffteilchen (II): Ionengruppen und ihre Ionen
 Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Ionenbindungen. Chemie. Library
 Chemie Ionenbindungen Library IONENBINDUNGEN Begriffserklärung 1 Formeltabelle 1 Ladungsermittlung 2 Formale Ladung 3 Hydrogen-Ionen 3 Verhältnisformeln 4 Nomenklatur 4 Gitterenthalpie 4 Eigenschaften
Chemie Ionenbindungen Library IONENBINDUNGEN Begriffserklärung 1 Formeltabelle 1 Ladungsermittlung 2 Formale Ladung 3 Hydrogen-Ionen 3 Verhältnisformeln 4 Nomenklatur 4 Gitterenthalpie 4 Eigenschaften
Die Stoffteilchen (II): Ionengruppen und ihre Ionen
 Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Schmelzpunkt als NaI (660 C)? Antworten: a) Brom ist giftiger als Iod (=> Posten 5c) b) Ladungenn sind grösser beim Brom als
 Posten 1a Wieso hat NaBr (747 C) einen höheren Schmelzpunkt als NaI (660 C)? a) Brom ist giftiger als Iod (=> Posten 5c) b) Ladungenn sind grösser beim Brom als beim Iod (=> Posten 13q) c) Abstand zwischen
Posten 1a Wieso hat NaBr (747 C) einen höheren Schmelzpunkt als NaI (660 C)? a) Brom ist giftiger als Iod (=> Posten 5c) b) Ladungenn sind grösser beim Brom als beim Iod (=> Posten 13q) c) Abstand zwischen
Posten 1a. Was gilt immer. bei einer Oxidation?
 Posten 1a Was gilt immer bei einer Oxidation? a) Es werden Elektronen aufgenommen. (=> Posten 3c) b) Es wird mit Sauerstoff reagiert. (=> Posten 6b) c) Sie kann alleine in einer Reaktions- 9k) gleichungg
Posten 1a Was gilt immer bei einer Oxidation? a) Es werden Elektronen aufgenommen. (=> Posten 3c) b) Es wird mit Sauerstoff reagiert. (=> Posten 6b) c) Sie kann alleine in einer Reaktions- 9k) gleichungg
Name: Punktzahl: von 57 Note:
 Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie
 Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
Vorkurs Allgemeine Chemie für Ingenieure und Biologen 20. Oktober 2015 Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie DIE CHEMISCHE BINDUNG Ionische Bindung, Beispiel Natriumchlorid Trifft
bestimmte mehratomige Anionen mit Sauerstoff werden mit dem lateinischen Namen benannt und enden auf at.
 DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem?
 2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1. Grundwissen 8.Klasse 2 Grundwissen 8.Klasse 2. Stoffebene. Teilchen -ebene
 Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Grundwissenkarten Hans-Carossa-Gymnasium. 9. Klasse. Chemie SG
 Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Atomverbände. In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die Elektronenkonfiguration
 Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die
Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die
Chemie Grundwissen der achten Jahrgangsstufe (NTG)
 hemie Grundwissen der achten Jahrgangsstufe (NTG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
hemie Grundwissen der achten Jahrgangsstufe (NTG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
Posten 1a. Welche beiden Metalle / Legierungen prägten eine Epoche?
 Posten 1a Welche beiden Metalle / Legierungen prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten
Posten 1a Welche beiden Metalle / Legierungen prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten
Chemieepoche Klasse 11. Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen
 Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Chemieepoche Klasse 11 Aufbau der Stoffe und die Grundgesetze chemischer Reaktionen Eisengewinnung (Schülervortrag) Fortsetzung Chemische Bindungen Warum sind im Wassermolekül zwei Wasserstoffatome mit
Atomverbände. Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner SALZE
 Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE 1 Einstieg: Schreck lass nach! Dieser Winter hat viele Teile der Schweiz mit seinen
Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE 1 Einstieg: Schreck lass nach! Dieser Winter hat viele Teile der Schweiz mit seinen
Leitfähigkeit von Flüssigkeiten Wasser (H 2 O 6. O) und Zucker (C 6 H 12
 Leitfähigkeit von Flüssigkeiten Wasser (H 2 ) und Zucker (C 6 H 12 6 ) sind Verbindungen mehrerer Nichtmetalle. Natriumchlorid (NaCl, Kochsalz) ist eine MetallNichtmetallVerbindung. a) Gib an, welche der
Leitfähigkeit von Flüssigkeiten Wasser (H 2 ) und Zucker (C 6 H 12 6 ) sind Verbindungen mehrerer Nichtmetalle. Natriumchlorid (NaCl, Kochsalz) ist eine MetallNichtmetallVerbindung. a) Gib an, welche der
Kapitel 2 Repetitionen Chemie und Werkstoffkunde. Thema 6 Oxidation und Reduktion
 BEARBEITUNGSTECHNIK REPETITONEN LÖSUNGSSATZ Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772
BEARBEITUNGSTECHNIK REPETITONEN LÖSUNGSSATZ Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 6 Oxidation und Reduktion Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772
0.6 Einfache Modelle der chemischen Bindung
 0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1. Grundwissen 9.Klasse SG 2 Grundwissen 9.Klasse SG 2. Stoffebene.
 Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
ELEMENTARSTOFFE, VERBINDUNGEN und chemische Formeln LÖSUNG. Hinweis: In den Salzen kommen die Metallatome stets als einatomige Kationen vor.
 Hinweis: In den Salzen kommen die Metallatome stets als einatomige Kationen vor. Aufgabe 1: a) Tragen Sie die folgenden chemischen Formeln in die richtige Spalte der Tabelle ein. Beachten Sie, dass mehrere
Hinweis: In den Salzen kommen die Metallatome stets als einatomige Kationen vor. Aufgabe 1: a) Tragen Sie die folgenden chemischen Formeln in die richtige Spalte der Tabelle ein. Beachten Sie, dass mehrere
1.6. Die Ionenbindung
 1.6. Die Ionenbindung 1.6.1. Die Edelgasregel Die Edelgase gehen kaum Verbindungen ein und zeigen in ihrer Periode jeweils die höchsten Ionisierungsenergien. Ihre Elektronenkonfiguration mit jeweils Außenelektronen
1.6. Die Ionenbindung 1.6.1. Die Edelgasregel Die Edelgase gehen kaum Verbindungen ein und zeigen in ihrer Periode jeweils die höchsten Ionisierungsenergien. Ihre Elektronenkonfiguration mit jeweils Außenelektronen
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1. Grundwissen 8. Klasse 2 Grundwissen 8. Klasse 2. Stoffebene
 Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
Lösungen, Salze, Ionen und Elektrolyte
 Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Chemie 8. In der Jahrgangsstufe 8 erwerben die Schüler folgendes Grundwissen:
 In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Homogene und heterogene Stoffgemische Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Homogene und heterogene Stoffgemische Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar
Bohrsches Atommodell
 Atome und ihre Bindungen Atomaufbau Im Atomkern befinden sich die Protonen (positiv geladen) und die Neutronen (neutral). P und N sind ungefähr gleich schwer und machen 99% der Atommasse aus. Um den Kern
Atome und ihre Bindungen Atomaufbau Im Atomkern befinden sich die Protonen (positiv geladen) und die Neutronen (neutral). P und N sind ungefähr gleich schwer und machen 99% der Atommasse aus. Um den Kern
Eine Einführung in die Stoffklasse der Salze
 Kapitel 6 Eine Einführung in die Stoffklasse der Salze Abb. 6.1: Aus Steinsalz werden auch Lampen gefertigt. Der Aufbau von salzartigen Stoffen unterscheidet sich grundsätzlich von anderen Stoffen. Sie
Kapitel 6 Eine Einführung in die Stoffklasse der Salze Abb. 6.1: Aus Steinsalz werden auch Lampen gefertigt. Der Aufbau von salzartigen Stoffen unterscheidet sich grundsätzlich von anderen Stoffen. Sie
Wiederholungsthema: Ionenbindung und Salze. Zusammenfassung: Ionen und Ionenbildung
 Wiederholungsthema: Ionenbindung und Salze Zusammenfassung: Ionen und Ionenbildung Wie sich Atome auch immer verbinden mögen, so versuchen sie doch stets dabei die Edelgaskonfiguration (Abb.3) zu erhalten,
Wiederholungsthema: Ionenbindung und Salze Zusammenfassung: Ionen und Ionenbildung Wie sich Atome auch immer verbinden mögen, so versuchen sie doch stets dabei die Edelgaskonfiguration (Abb.3) zu erhalten,
08.12.2013. Wichtige Stoffgruppen. Stoffgruppe. Atomverband. Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Metall Metall:
 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
Musterprüfung Welche der Elemente Lithium, Kohlenstoff, Wasserstoff, Sauerstoff, Magnesium, Aluminium und Calcium sind Nichtmetalle?
 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen 1 Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen
![[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen [ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen](/thumbs/68/58264490.jpg) 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
Teilchenmodell. Aggregatzustände. Diffusion. Spezifische Eigenschaften = Stoffeigenschaften
 Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Grundwissen Chemie 8. Klasse NTG
 Grundwissen Chemie 8. Klasse NTG Reinstoff hat gleich bleibende Eigenschaften (Stoffebene) besteht aus einer Sorte gleichartiger Teilchen z.b.: dest. Wasser, Kupfer, Gold, Salz 8.1 C NTG Element sind nicht
Grundwissen Chemie 8. Klasse NTG Reinstoff hat gleich bleibende Eigenschaften (Stoffebene) besteht aus einer Sorte gleichartiger Teilchen z.b.: dest. Wasser, Kupfer, Gold, Salz 8.1 C NTG Element sind nicht
Metallbindung und Metalle Ionenbindung und Salze
 Metallbindung und Metalle Ionenbindung und Salze Patrick Bucher 18. Juli 2011 Inhaltsverzeichnis 1 Metalle 1 1.1 Metallgitter und metallische Bindung...................... 2 1.2 Chemische Eigenschaften
Metallbindung und Metalle Ionenbindung und Salze Patrick Bucher 18. Juli 2011 Inhaltsverzeichnis 1 Metalle 1 1.1 Metallgitter und metallische Bindung...................... 2 1.2 Chemische Eigenschaften
Redox - Übungsaufgaben:
 Redox - Übungsaufgaben: Schwierigkeitsgrad I: 1.Magnesium reagiert mit Sauerstoff zu Magnesiumoxid. Ox: Mg Mg 2+ + 2e - /*2 Red: O 2 + 4e - 2 O 2- Redox: 2 Mg + O 2 2 MgO 2.Kalium Reagiert mit Schwefel
Redox - Übungsaufgaben: Schwierigkeitsgrad I: 1.Magnesium reagiert mit Sauerstoff zu Magnesiumoxid. Ox: Mg Mg 2+ + 2e - /*2 Red: O 2 + 4e - 2 O 2- Redox: 2 Mg + O 2 2 MgO 2.Kalium Reagiert mit Schwefel
Musterprüfung Welche der Elemente Lithium, Kohlenstoff, Wasserstoff, Sauerstoff, Magnesium, Aluminium und Calcium sind Nichtmetalle?
 1 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
1 Module: Atombau und Periodensystem Chemische Bindungen Chemische Reaktionen Musterprüfung 1. Teil: Atombau und Periodensystem 1.1. Welche Art von Teilchen befinden sich a) im Atomkern b) in der Elektronenhülle
Atomverband mit festem Atomzahlverhältnis. Anzahl der Atome veränderlich? (bei festem Atomzahlverhältnis) Elektrisch Leitend?
 L3 1 Atomverband mit festem Atomzahlverhältnis. Ja Anzahl der Atome veränderlich? (bei festem Atomzahlverhältnis) Nein Ja Elektrisch Leitend? Nur in der Schmelze? Nein Ionenkristall Beliebig erweiterbar
L3 1 Atomverband mit festem Atomzahlverhältnis. Ja Anzahl der Atome veränderlich? (bei festem Atomzahlverhältnis) Nein Ja Elektrisch Leitend? Nur in der Schmelze? Nein Ionenkristall Beliebig erweiterbar
2. Übung Allgemeine Chemie AC01
 Allgemeine und Anorganische Chemie Aufgabe 1: 2. Übung Allgemeine Chemie AC01 Chlor lässt sich gemäß der folgenden Reaktionsgleichung herstellen: MnO 2 + 4 HCl MnCl 2 + Cl 2 + 2 H 2 O 86,9368 g 145,8436
Allgemeine und Anorganische Chemie Aufgabe 1: 2. Übung Allgemeine Chemie AC01 Chlor lässt sich gemäß der folgenden Reaktionsgleichung herstellen: MnO 2 + 4 HCl MnCl 2 + Cl 2 + 2 H 2 O 86,9368 g 145,8436
Chemie Grundwissen der neunten Jahrgangsstufe (SG)
 hemie Grundwissen der neunten Jahrgangsstufe (SG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
hemie Grundwissen der neunten Jahrgangsstufe (SG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
Thema heute: Chemische Bindungen - Ionenbindung
 Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, Doppelbindungsregel, VSEPR-Theorie Thema heute: Chemische Bindungen - Ionenbindung Vorlesung Allgemeine Chemie, Prof. Dr. Martin Köckerling
Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, Doppelbindungsregel, VSEPR-Theorie Thema heute: Chemische Bindungen - Ionenbindung Vorlesung Allgemeine Chemie, Prof. Dr. Martin Köckerling
6. Die Chemische Bindung
 6. Die Chemische Bindung Hauptbindungsarten Kovalente Bindung I Kovalente Bindung II Ionenbindung Metallische Bindung Nebenbindungsarten Van der Waals Wechselwirkung Wasserstoffbrückenbindung Salzartige
6. Die Chemische Bindung Hauptbindungsarten Kovalente Bindung I Kovalente Bindung II Ionenbindung Metallische Bindung Nebenbindungsarten Van der Waals Wechselwirkung Wasserstoffbrückenbindung Salzartige
Integrationsphase der MSS 11
 Integrationsphase der MSS 11 Atombau, PSE und Salze Kennzeichnung eines Atoms und seines Kerns Energiestufen- / Schalenmodell der Atomhülle Zusammenhang zwischen Atombau und PSE Bildung und Ladung von
Integrationsphase der MSS 11 Atombau, PSE und Salze Kennzeichnung eines Atoms und seines Kerns Energiestufen- / Schalenmodell der Atomhülle Zusammenhang zwischen Atombau und PSE Bildung und Ladung von
Unterschied zwischen Physik und Chemie:
 Unterschied zwischen Physik und Chemie: Der Begriff Physik bezeichnet die Lehre über Zustände und Zustandsänderungen die Chemie hingegen beschäftigt sich mit Stoffen und stofflichen Veränderungen. Unterteilung
Unterschied zwischen Physik und Chemie: Der Begriff Physik bezeichnet die Lehre über Zustände und Zustandsänderungen die Chemie hingegen beschäftigt sich mit Stoffen und stofflichen Veränderungen. Unterteilung
Teilchenmodell. Aggregatzustände. Diffusion. Spezifische Eigenschaften = Stoffeigenschaften
 Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Teilchenmodell (1) Alle Stoffe bestehen aus kleinsten Teilchen. (2) Zwischen den Teilchen wirken Anziehungskräfte. (3) Alle Teilchen befinden sich in ständiger, regelloser Bewegung (Brownsche Bewegung),
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Grundtypen der Bindung. Grundtypen chemischer Bindung. Oktettregel. A.8.1. Atombindung
 Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Lernaufgabe: Periodensystem Erklärung von Tendenzen in der Reaktionsfähigkeit der Alkali-, Erdalkalimetalle und der Halogene
 ETH Institut für Verhaltenswissenschaften Seite 1/5 Lernaufgabe: Periodensystem Erklärung von Tendenzen in der Reaktionsfähigkeit der Alkali-, Erdalkalimetalle und der Halogene Hilfreiche Angaben: 1. Unterrichtsfach:
ETH Institut für Verhaltenswissenschaften Seite 1/5 Lernaufgabe: Periodensystem Erklärung von Tendenzen in der Reaktionsfähigkeit der Alkali-, Erdalkalimetalle und der Halogene Hilfreiche Angaben: 1. Unterrichtsfach:
Das Formelpuzzle Kopiervorlage
 Das Formelpuzzle Kopiervorlage Die Vorlage wird foliert, die einzelnen Bausteine werden ausgeschnitten. Durch einfaches Aneinanderlegen von Kationen und Anionen können die Formeln von Säuren, Basen und
Das Formelpuzzle Kopiervorlage Die Vorlage wird foliert, die einzelnen Bausteine werden ausgeschnitten. Durch einfaches Aneinanderlegen von Kationen und Anionen können die Formeln von Säuren, Basen und
Werkstoffkunde Chemische Bindungsarten
 Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
Elektronenpaarbindung (oder Atombindung) Nichtmetallatom + Nichtmetallatom Metallatom + Nichtmetallatom 7. Welche Bindungsart besteht jeweils?
 LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
GRUNDWISSEN CHEMIE 8. KLASSE
 GRUDWISSE CEMIE 8. KLASSE (LS Marquartstein September 2013) 2006 Wagner/Gottschalk LS Marquartstein 1 I. Stoffe und Reaktionen: Physikalische Vorgänge sind begleitet von Energieumwandlungen (Wärme- Licht-
GRUDWISSE CEMIE 8. KLASSE (LS Marquartstein September 2013) 2006 Wagner/Gottschalk LS Marquartstein 1 I. Stoffe und Reaktionen: Physikalische Vorgänge sind begleitet von Energieumwandlungen (Wärme- Licht-
Alle Stoffe bestehen aus kleinen Teilchen, die sich bewegen. Je mehr Energie sie besitzen, desto mehr bewegen sie sich.
 Grundwissen 8. Klasse 1. Stoffe und Teilchen Teilchenmodell: Atome Ionen Alle Stoffe bestehen aus kleinen Teilchen, die sich bewegen. Je mehr Energie sie besitzen, desto mehr bewegen sie sich. von atomos
Grundwissen 8. Klasse 1. Stoffe und Teilchen Teilchenmodell: Atome Ionen Alle Stoffe bestehen aus kleinen Teilchen, die sich bewegen. Je mehr Energie sie besitzen, desto mehr bewegen sie sich. von atomos
Qualitative anorganische Analyse
 Dirk Häfner Arbeitsbuch Qualitative anorganische Analyse für Pharmazie- und Chemiestudenten unter Mitarbeit von Alice Stephan Gyyi Govi-Verlag Inhalt Vorwort zur 5. Auflage 9 Vorwort zur 4. Auflage 10
Dirk Häfner Arbeitsbuch Qualitative anorganische Analyse für Pharmazie- und Chemiestudenten unter Mitarbeit von Alice Stephan Gyyi Govi-Verlag Inhalt Vorwort zur 5. Auflage 9 Vorwort zur 4. Auflage 10
Ionenbindung Lehrerinformation
 Lehrerinformation 1/5 Arbeitsauftrag Ziel Material Sozialform Zeit Die SuS erarbeiten sich chemische Informationen zu Kochsalz. Sie kennen die Bestandteile und wissen, wie Salz chemisch aufgebaut ist.
Lehrerinformation 1/5 Arbeitsauftrag Ziel Material Sozialform Zeit Die SuS erarbeiten sich chemische Informationen zu Kochsalz. Sie kennen die Bestandteile und wissen, wie Salz chemisch aufgebaut ist.
Lösungen III Silizium; von innen nach außen: 2 bzw. 8 bzw. 4 Elektronen auf den Schalen
 Lösungen III.1 1. wenn man für die Atomgröße 10-10 m und für die Kerngröße 10-15 m annimmt, ergibt sich: a) 16 000 km (also größer als die Erde!) bzw. 0,4 m, also ist der Kern nicht sichtbar b) der gezeigte
Lösungen III.1 1. wenn man für die Atomgröße 10-10 m und für die Kerngröße 10-15 m annimmt, ergibt sich: a) 16 000 km (also größer als die Erde!) bzw. 0,4 m, also ist der Kern nicht sichtbar b) der gezeigte
CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2013 / 2014
 CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Einführung Brennendes Magnesiumband reagiert mit Sauerstoff
CHEMIE WIEDERHOLUNG: KAPITEL 5 REAKTIONEN DER ANORGANISCHEN CHEMIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2013 / 2014 Folie 2 Einführung Brennendes Magnesiumband reagiert mit Sauerstoff
8.1. Wie werden naturwissenschaftliche Erkenntnisse gewonnen? 8.2. Wie erstellt man ein Versuchsprotokoll? 8.3
 1) Beobachtung von Umwelterscheinungen Problem Vermutung: Hypothese zur Lösung des Problems 8.1 Wie werden naturwissenschaftliche Erkenntnisse gewonnen? 2) Die Hypothese wird durch ein ausgewähltes Experiment
1) Beobachtung von Umwelterscheinungen Problem Vermutung: Hypothese zur Lösung des Problems 8.1 Wie werden naturwissenschaftliche Erkenntnisse gewonnen? 2) Die Hypothese wird durch ein ausgewähltes Experiment
Erläutere den CO 2 -Nachweis. Definiere den Begriff exotherme Reaktion und zeichne ein passendes Energiediagramm. Grundwissenskatalog Chemie 8 NTG
 Erläutere den CO 2 -Nachweis. Wird das Gas in Kalkwasser (Ca(OH) 2 ) eingeleitet bildet sich ein schwerlöslicher Niederschlag von Calciumcarbonat (CaCO 3 ). Abgabe von innerer Energie (Wärme, Knall,...)
Erläutere den CO 2 -Nachweis. Wird das Gas in Kalkwasser (Ca(OH) 2 ) eingeleitet bildet sich ein schwerlöslicher Niederschlag von Calciumcarbonat (CaCO 3 ). Abgabe von innerer Energie (Wärme, Knall,...)
2. Verhalten der Elemente bei einer Reaktion: Warum funkt s bei unterschiedlichen
 1. Atombau und Periodensystem 1a) Nach welchem Gesichtspunkt sind die Elemente im Periodensystem von 1- ca. 103 angeordnet? 1b) Nach welchem Gesichtspunkt ist ein Element einer PERIODE zugeordnet? 1c)
1. Atombau und Periodensystem 1a) Nach welchem Gesichtspunkt sind die Elemente im Periodensystem von 1- ca. 103 angeordnet? 1b) Nach welchem Gesichtspunkt ist ein Element einer PERIODE zugeordnet? 1c)
Wie gross ist die Stoffmenge von 344g Aluminiumhydrogencarbonat (Al(HCO 3 ) 3 )?
 Posten 1a Wie gross ist die Stoffmenge von 344g Aluminiumhydrogencarbonat (Al(HCO 3 ) 3 )? a) 0.35 mol (=> Posten 9m) b) 1.64 mol (=> Posten 12d) c) 1.33 mol (=> Posten 5n) d) 1.21 mol (=> Posten 13g)
Posten 1a Wie gross ist die Stoffmenge von 344g Aluminiumhydrogencarbonat (Al(HCO 3 ) 3 )? a) 0.35 mol (=> Posten 9m) b) 1.64 mol (=> Posten 12d) c) 1.33 mol (=> Posten 5n) d) 1.21 mol (=> Posten 13g)
Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch. Reinstoff, Element, Verbindung. Zweiatomige Elemente.
 1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Hybridisierung und Molekülstruktur, sp 3 -Hybridorbitale (Tetraeder), sp 2 - Hybridorbitale (trigonal planare Anordnung), sp-hybridorbitale (lineare Anordnung),
Wiederholung der letzten Vorlesungsstunde: Hybridisierung und Molekülstruktur, sp 3 -Hybridorbitale (Tetraeder), sp 2 - Hybridorbitale (trigonal planare Anordnung), sp-hybridorbitale (lineare Anordnung),
GRUNDLAGEN MINERALISCHER BAUSTOFFE
 3. Einheit: GRUNDLAGEN MINERALISCHER BAUSTOFFE Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 24 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Untersuchung von Grundlagen mineralischer Baustoffe....kennen
3. Einheit: GRUNDLAGEN MINERALISCHER BAUSTOFFE Sebastian Spinnen, Ingrid Reisewitz-Swertz 1 von 24 ZIELE DER HEUTIGEN EINHEIT Am Ende der Einheit Untersuchung von Grundlagen mineralischer Baustoffe....kennen
Vom Atom zum Molekül
 Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
NH 3. CCl 4 CO 2. Lösungen zur Lernzielkontrolle Sekunda. Hilfsmittel: PSE, Taschenrechner
 Lösungen zur Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (1) 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) leitfähig,
Lösungen zur Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (1) 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) leitfähig,
2 Bindung, Struktur und Eigenschaften von Stoffen. 2.1 Ionenbindung und Ionenkristall s Modell der Ionenbindung
 2 Bindung, Struktur und Eigenschaften von Stoffen 2.1 Ionenbindung und Ionenkristall s. 0.6 Modell der Ionenbindung 8 - Bindung zwischen typischen Metallen und Nichtmetallen, EN > 1,7 - stabile Edelgaskonfiguration
2 Bindung, Struktur und Eigenschaften von Stoffen 2.1 Ionenbindung und Ionenkristall s. 0.6 Modell der Ionenbindung 8 - Bindung zwischen typischen Metallen und Nichtmetallen, EN > 1,7 - stabile Edelgaskonfiguration
10TG. Training II2. 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene.
 Training II2 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene. (4X4=1 X4=16P) a. Verbrennung von Kohlenstoff C + O2 CO2 Kohlenstoffdioxid b. Thermolyse
Training II2 1. Schreibe die Reaktionsgleichungen folgender Reaktionen. Benenne die Produkte. Erkläre die Teilchenebene. (4X4=1 X4=16P) a. Verbrennung von Kohlenstoff C + O2 CO2 Kohlenstoffdioxid b. Thermolyse
Besetzung der Orbitale
 Frage Beim Wiederholen des Stoffes bin ich auf die Rechnung zur Energie gestoßen. Warum und zu welchem Zweck haben wir das gemacht? Was kann man daran jetzt erkennen? Was beschreibt die Formel zu E(n),
Frage Beim Wiederholen des Stoffes bin ich auf die Rechnung zur Energie gestoßen. Warum und zu welchem Zweck haben wir das gemacht? Was kann man daran jetzt erkennen? Was beschreibt die Formel zu E(n),
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Chemische Bindung. Chemische Bindung
 Chemische Bindung Atome verbinden sich zu Molekülen oder Gittern, um eine Edelgaskonfiguration zu erreichen. Es gibt drei verschiedene Arten der chemischen Bindung: Atombindung Chemische Bindung Gesetz
Chemische Bindung Atome verbinden sich zu Molekülen oder Gittern, um eine Edelgaskonfiguration zu erreichen. Es gibt drei verschiedene Arten der chemischen Bindung: Atombindung Chemische Bindung Gesetz
Chemie 8. In der Jahrgangsstufe 8 erwerben die Schüler folgendes Grundwissen:
 In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
In der Jahrgangsstufe 8 erwerben die Schüler folgendes : Die Schüler können Stoffe aufgrund wichtiger Kenneigenschaften ordnen Sie sind mit wichtigen Aussagen des Teilchenmodells vertraut Sie können chemische
Grundwissen. Chemie 9 MuG. Gymnasium Höhenkirchen-Siegertsbrunn. In der Jahrgangsstufe 9 MuG erwerben die Schüler folgendes Grundwissen:
 Gymnasium Höhenkirchen-Siegertsbrunn In der Jahrgangsstufe 9 MuG erwerben die Schüler folgendes : Die Schüler können das Stoff-Teilchen Konzept auf Stoffe aus ihrer Lebenswelt anwenden. Sie können chemische
Gymnasium Höhenkirchen-Siegertsbrunn In der Jahrgangsstufe 9 MuG erwerben die Schüler folgendes : Die Schüler können das Stoff-Teilchen Konzept auf Stoffe aus ihrer Lebenswelt anwenden. Sie können chemische
Oktett-Theorie von Lewis
 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
KSO SALZE UND DIE IONENBINDUNG GF TEIL 1
 KSO SALZE UND DIE IONENBINDUNG GF TEIL 1 Skript Salze und Ionenbindung Teil 1 GF V1.0 8/15 MMo, edited by Bor 1 INHALTSVERZEICHNIS "SALZE UND IONENBINDUNG Teil 1" 1. Natriumchlorid; DAS Salz... 02 1.1
KSO SALZE UND DIE IONENBINDUNG GF TEIL 1 Skript Salze und Ionenbindung Teil 1 GF V1.0 8/15 MMo, edited by Bor 1 INHALTSVERZEICHNIS "SALZE UND IONENBINDUNG Teil 1" 1. Natriumchlorid; DAS Salz... 02 1.1
1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden.
 6. Bindungslehre 6.2 Wie verbinden sich Atome? 1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden. 6.3 Metallbindung 1. Nennen Sie fünf charakteristische Eigenschaften
6. Bindungslehre 6.2 Wie verbinden sich Atome? 1. Nennen Sie die drei wichtigen Bindungstypen und die zwei wichtigen Typen von Atomverbänden. 6.3 Metallbindung 1. Nennen Sie fünf charakteristische Eigenschaften
Einheiten und Einheitenrechnungen
 Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 1: allgemeine Chemie, einfache Berechnungen, Periodensystem, Orbitalbesetzung, Metalle und Salze Einheiten und Einheitenrechnungen
Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 1: allgemeine Chemie, einfache Berechnungen, Periodensystem, Orbitalbesetzung, Metalle und Salze Einheiten und Einheitenrechnungen
Wasserstoff. Helium. Bor. Kohlenstoff. Standort: Name: Ordnungszahl: Standort: Name: Ordnungszahl: 18. Gruppe. Standort: Ordnungszahl: Name:
 H Wasserstoff 1 1. Gruppe 1. Periode He Helium 2 18. Gruppe 1. Periode B Bor 5 13. Gruppe C Kohlenstoff 6 14. Gruppe N Stickstoff 7 15. Gruppe O Sauerstoff 8 16. Gruppe Ne Neon 10 18. Gruppe Na Natrium
H Wasserstoff 1 1. Gruppe 1. Periode He Helium 2 18. Gruppe 1. Periode B Bor 5 13. Gruppe C Kohlenstoff 6 14. Gruppe N Stickstoff 7 15. Gruppe O Sauerstoff 8 16. Gruppe Ne Neon 10 18. Gruppe Na Natrium
Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch. Reinstoff, Element, Verbindung. Zweiatomige Elemente.
 Einteilung der Stoffe: Stoff Reinstoff Mischen Gemisch Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b. Farbe,
Einteilung der Stoffe: Stoff Reinstoff Mischen Gemisch Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b. Farbe,
Kantonsschule Freudenberg. Chemie. Aufgaben zum Grundlagenfach. Übungen zum Unterricht von A. Bärtsch
 Kantonsschule Freudenberg Chemie Aufgaben zum Grundlagenfach Übungen zum Unterricht von A. Bärtsch Dez. 2013 Inhalt 1. Atombau 2. Radioaktivität 3. Kovalente Bindungen 4. Salze 5. Polarität und zwischenmolekulare
Kantonsschule Freudenberg Chemie Aufgaben zum Grundlagenfach Übungen zum Unterricht von A. Bärtsch Dez. 2013 Inhalt 1. Atombau 2. Radioaktivität 3. Kovalente Bindungen 4. Salze 5. Polarität und zwischenmolekulare
Robert-Koch-Gymnasium Deggendorf. Grundwissen Chemie. 8. Jahrgangsstufe
 Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Verhältnisformel von Salzen
 Verhältnisformel von Salzen Stand: 01.07.2018 Jahrgangsstufen 11/12 Fach/Fächer Übergreifende Bildungsund Erziehungsziele Zeitrahmen Chemie Alltagskompetenz und Lebensökonomie Technische Bildung 45 Minuten
Verhältnisformel von Salzen Stand: 01.07.2018 Jahrgangsstufen 11/12 Fach/Fächer Übergreifende Bildungsund Erziehungsziele Zeitrahmen Chemie Alltagskompetenz und Lebensökonomie Technische Bildung 45 Minuten
Chemie 9 SG. In der Jahrgangsstufe 9 erwerben die Schüler folgendes Grundwissen:
 SG In der Jahrgangsstufe 9 erwerben die Schüler folgendes Grundwissen: (1) Die Schüler können das Stoff-Teilchen-Konzept auf Stoffe aus ihrer Lebenswelt anwenden. (2) Sie können chemische Formeln und Reaktionsgleichungen
SG In der Jahrgangsstufe 9 erwerben die Schüler folgendes Grundwissen: (1) Die Schüler können das Stoff-Teilchen-Konzept auf Stoffe aus ihrer Lebenswelt anwenden. (2) Sie können chemische Formeln und Reaktionsgleichungen
Kerncurriculum und Schulcurriculum (2 Wochenstunden) Themen und Inhalte. Bezug zu den Standards. Kerncurriculum / Schulcurriculum
 Chemie: Klasse 9 Kerncurriculum und Schulcurriculum (2 Wochenstunden) Zeit Themen und Inhalte Umsetzung Bezug zu den Standards Kerncurriculum / Schulcurriculum 10 Atombau und Periodensystem - Das Kern-Hülle-Modell
Chemie: Klasse 9 Kerncurriculum und Schulcurriculum (2 Wochenstunden) Zeit Themen und Inhalte Umsetzung Bezug zu den Standards Kerncurriculum / Schulcurriculum 10 Atombau und Periodensystem - Das Kern-Hülle-Modell
Grundwissen C8 NTG. 1. Stoffe und Reaktionen. Reinstoff
 Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Grundwissen Chemie 8. Jahrgangsstufe
 Grundwissen Chemie 8. Jahrgangsstufe 1. Stoffeigenschaften und Teilchenmodell Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, die man sich am einfachsten als Kugeln vorstellen kann (Kugelteilchenmodell).
Grundwissen Chemie 8. Jahrgangsstufe 1. Stoffeigenschaften und Teilchenmodell Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, die man sich am einfachsten als Kugeln vorstellen kann (Kugelteilchenmodell).
Lösung. Gasgemisch. Legierung. Suspension. Ein löslicher Stoff (z.b. Salz) ist in einem Lösungsmittel (z.b. Wasser) gelöst.
 Ein löslicher Stoff (z.b. Salz) ist in einem Lösungsmittel (z.b. Wasser) gelöst. Lösung 8C1 Jede Lösung ist ein homogenes Stoffgemisch: Feststofflösung: Feststoff ist in Flüssigkeit gelöst (Zuckerwasser)
Ein löslicher Stoff (z.b. Salz) ist in einem Lösungsmittel (z.b. Wasser) gelöst. Lösung 8C1 Jede Lösung ist ein homogenes Stoffgemisch: Feststofflösung: Feststoff ist in Flüssigkeit gelöst (Zuckerwasser)
1. Einteilung von Stoffen
 1. Einteilung von Stoffen Reinstoffe Stoffe Trennverfahren (physikalisch) Stoffgemische Verbindungen Analyse Synthese Element e homogene Gemische heterogene Gemische Molekulare Stoffe; z.b. Wasser Moleküle:
1. Einteilung von Stoffen Reinstoffe Stoffe Trennverfahren (physikalisch) Stoffgemische Verbindungen Analyse Synthese Element e homogene Gemische heterogene Gemische Molekulare Stoffe; z.b. Wasser Moleküle:
Stoffgemisch. Reinstoff. Homogenes Gemisch. Heterogenes Gemisch. ( 8. Klasse NTG 1 / 48 ) ( 8. Klasse NTG 2 / 48 ) ( 8. Klasse NTG 3 / 48 )
 Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
Stoffgemisch ( 8. Klasse NTG 1 / 48 ) besteht aus zwei oder mehr verschiedenen Reinstoffen Gemisch unterschiedlicher kleinster Teilchen Trennung durch physikalische Methoden möglich Reinstoff ( 8. Klasse
6. Bindungslehre 6.1 Eigenschaften des PSE
 6. Bindungslehre 6.1 Eigenschaften des PSE 1. Berechnen sie die mittlere Atommasse von Chlor (Cl) und vergleichen sie ihren Wert mit dem PSE im Buch. Natürliche Isotope und ihr Anteil: 35 Cl: 75.8%, 37
6. Bindungslehre 6.1 Eigenschaften des PSE 1. Berechnen sie die mittlere Atommasse von Chlor (Cl) und vergleichen sie ihren Wert mit dem PSE im Buch. Natürliche Isotope und ihr Anteil: 35 Cl: 75.8%, 37
Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s 2 3p 6. Geben Sie isoelektronische Ionen zu den folgenden Atomen an
 Übung 05.11.13 Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 Ne / F - / O 2- / N 3- / Na + / Mg 2+ / Al 3+. Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s
Übung 05.11.13 Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 Ne / F - / O 2- / N 3- / Na + / Mg 2+ / Al 3+. Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s
Anorganische Chemie macchiato Cartoonkurs für Schüler und Studenten
 Kurt Haim Johanna Lederer-Gamberger Illustriert von Klaus Müller Anorganische Chemie macchiato Cartoonkurs für Schüler und Studenten Higher Education München Harlow Amsterdam Madrid Boston San Francisco
Kurt Haim Johanna Lederer-Gamberger Illustriert von Klaus Müller Anorganische Chemie macchiato Cartoonkurs für Schüler und Studenten Higher Education München Harlow Amsterdam Madrid Boston San Francisco
Grundpraktikum für Biologen 2016
 Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
