Aus dem Departement für Pathologie. Institut für Klinische Pathologie. der Albert-Ludwigs-Universität Freiburg i. Br.
|
|
|
- Gertrud Adler
- vor 7 Jahren
- Abrufe
Transkript
1 Aus dem Departement für Pathologie Institut für Klinische Pathologie der Albert-Ludwigs-Universität Freiburg i. Br. Analyse der CD34-Expression in Megakaryozyten bei verschiedenen hämatologischen Erkrankungen INAUGURAL-DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg i. Br. vorgelegt 2014 von Julian Benckendorff geboren in Stuttgart
2 Dekanin: Erstgutachter: Zweitgutachter: Prof. Dr. Kerstin Krieglstein Prof. Dr. Martin Werner Prof. Dr. Ralph Wäsch Jahr der Promotion: 2014
3 Inhaltsverzeichnis 1. Einleitung Myeloische Neoplasien Myeloproliferative Neoplasien Myelodysplastische Syndrome Myelodysplastische/Myeloproliferative Neoplasien Der Megakaryozyt Morphologie und Funktion des Megakaryozyten Ablauf und Regulation der Megakaryopoese CD Struktur des CD34-Antigens Vorkommen des CD34-Antigens Funktion des CD34-Antigens Zielsetzung der Arbeit Material und Methoden Das Patientenkollektiv Systematik der Auswertung der Knochenmarkbiopsien Chemikalien, Reagenzien und Geräte Histologische Färbungen der Knochenmarkbiopsien Naphtol-AS-D-Chlorazetatesterase (NACE)-Färbung CD34-Färbung Systematik der Datenauswertung und statistischen Analyse
4 3. Ergebnisse Auswertung der CD34-Färbung Darstellung der Häufigkeitsverteilungen im Kollektiv Auswertung der megakaryozytären CD34-Expression Auswertung der Laborparamter Auswertung der Überlebenszeiten Überlebenszeiten in Abhängigkeit von der Erkrankungsentität Überlebenszeiten in Abhängigkeit von der megakaryozytären CD34-Expression Diskussion Megakaryopoese bei myeloischen Neoplasien Analyse der Häufigkeitsverteilungen im Kollektiv Analyse der CD34-Färbung Analyse der megakaryozytären CD34-Expression Megakaryozytäre CD34-Expression als diagnostischer Marker für die Gruppen der myeloischen Neoplasien Analyse der Laborparameter Megakaryozytäre CD34-Expression als prognostischer Marker für die Gruppen der myeloischen Neoplasien Zusammenfassung Anhang Fragebogen Auswertungsbogen Abkürzungsverzeichnis Tabellenverzeichnis
5 9. Abbildungsverzeichnis Literaturverzeichnis Danksagung
6 1. Einleitung 1.1. Myeloische Neoplasien Der Begriff "myeloisch" bezeichnet alle Zellen, welche der Linie der Granulozyten, Monozyten, Erythrozyten, Megakaryozyten und Mastzellen angehören. Eine Neoplasie ist eine Neubildung von Körpergewebe und beschreibt in diesem Zusammenhang die autonome, pathologische Gewebevermehrung eines Tumors. Die Weltgesundheitsorganisation (WHO) gibt Kriterien vor, welche für die Diagnosestellung einer myeloischen Neoplasie erfüllt sein müssen. Dabei bezieht sich die Diagnostik neben klinischen Aspekten auch auf Untersuchungen des peripheren Bluts und des Knochenmarks. Letztere beinhalten eine morphologische, zytochemische und immunphänotypische Charakterisierung der neoplastischen Zellen [Vardiman et al.]. Zudem werden Genmutationen als wichtige diagnostische und prognostische Marker nachgewiesen [Vardiman et al.]. Myeloische Neoplasien werden in chronische und akute Formen unterteilt. Die chronischen Formen der myeloischen Neoplasien lassen sich in vier große Kategorien einteilen (Tabelle 1.1.). Neben den myeloproliferativen Neoplasien (MPN) handelt es sich um die myelodysplastischen Syndrome (MDS), die myelodysplastischen/myeloproliferativen Neoplasien (MDS/MPN) und um die MPN mit Eosinophilie und Anomalien von Thrombozytenwachstumsfaktor-Rezeptor (PDGFR), Thrombozytenwachstumsfaktor-Rezeptor Typ-β (PDGFRB) oder Fibroblastenwachstumsfaktor-Rezeptor (FGFR) [Schmitt-Graef]. Eine myeloische Neoplasie mit 20% Blasten im peripheren Blut oder im Knochenmark wird als eine akute myeloische Leukämie (AML) bezeichnet. Eine AML kann sowohl de novo, als auch im Rahmen eines früher diagnostizierten MDS, einer MPN oder einer MDS/MPN auftreten [Vardiman et al.]. Zudem gibt es akute myeloische Leukämien, die nach einer vorangegangenen Chemo- oder Radiotherapie auftreten, sogenannte therapieassoziierte AMLs (tamls). Myeloproliferative Neoplasien (MPN) Chronische myeloische Leukämie, BCR-ABL1-positiv (CML) Chronische Neutrophilen Leukämie (CNL) Polyzythämia vera (PV) Primäre Myelofibrose (PMF) (Fortsetzung auf Seite 7) 6
7 Myeloproliferative Neoplasien (MPN) (Fortsetzung von Seite 6) Essentielle Thrombozythämie (ET) Chronische Eosinophilen Leukämie; nicht anderweitig spezifiziert (CEL) Mastozytose Myeloproliferative Neoplasien; nicht klassifizierbar (MPN, U) Myeloische und lymphoide Neoplasien, die mit Eosinophilie und Anomalien von PDGFRB oder FGFR1 assoziiert sind Myelodsysplastische/Myeloproliferative Neoplasien (MDS/MPN) Chronische myelomonozytäre Leukämie (CMML) Atypische chronische myeloische Leukämie, BCR-ABL1-negativ Juvenile myelomonozytäre Leukämie Myelodysplastische/myeloproliferative Neoplasie; nicht klassifizierbar Myelodysplastische Syndrome (MDS) Refraktäre Zytopenie mit unilineärer Dysplasie (RCUD) Refraktäre Anämie (RA) Refraktäre Neutropenie (RN) Refraktäre Thrombozytopenie (RT) Refraktäre Anämie mit Ringsideroblasten (RARS) Refraktäre Zytopenie mit multilineärer Dysplasie (RCMD) Refraktäre Anämie mit Blastenexzess (RAEB) Myelodysplastisches Syndrom mit isolierter Deletion 5q (MDS, 5q-) Myelodysplastisches Syndrom; nicht klassifizierbar (MDS, U) Myelodysplastisches Syndrom in der Kindheit Akute myeloische Leukämie und verwandte Neoplasien Akute Leukämien unklarer Linienzugehörigkeit B-lymphoblastische Leukämien/Lymphome T-lymphoblastische Leukämien/Lymphome Tab (Seiten 6, 7) Gruppen und Untergruppen der myeloischen Neoplasien und akuten Leukämien entsprechend der aktuellen WHO Klassifikation [Vardiman et al.]. 7
8 Myeloproliferative Neoplasien Die Erkrankungen aus der Gruppe der MPN gehen von einer maligne entarteten, klonal proliferierenden myeloischen Stammzelle aus. Diese Zelle ist fähig Erythrozyten, Granulozyten, Thrombozyten oder Mastzellen zu bilden [Swerdlow et al.]. Das klinische Merkmal der MPN sind erhöhte Zellzahlen im peripheren Blut. Die einzelnen Erkrankungen weisen üblicherweise in mehr als nur einer Zelllinie eine abnorme Proliferation auf. Der normale Stammzellenpool im Knochenmark wird dabei nicht völlig durch die maligne entarteten Zellen ersetzt, deren Tochterzellen können jedoch normale Blutzellen bis zu einem solch hohen Grad verdrängen, dass im peripheren Blut komplette Klonalität beobachtet wird [Skoda et al.]. Das mediane Erkrankungsalter liegt bei 65 Jahren. Die einzelnen Erkrankungen innerhalb der Gruppe der MPN unterscheiden sich in vielerlei Hinsicht: dem klinischen Erscheinungsbild, der Neigung eine Knochenmarkfibrose zu entwickeln, der Wahrscheinlichkeit der Transformation und des Übergangs in eine Leukämie sowie dem Gesamtüberleben [Skoda et al., Bock et al.]. Die abnorme Proliferation einer Zelle bei MPN beruht meist auf einer Umlagerung oder Mutation von Genen, die Protein-Tyrosin-Kinasen kodieren. Die häufigste genetische Veränderung, p210 BCR-ABL1, ist das Charakteristikum der chronischen myeloischen Leukämie (CML) und kann bei über 90% der Patienten mit CML nachgewiesen werden [Huettner et al.]. Dabei werden aufgrund der Translokation t (9;22) Teile des BCR-Gens auf Chromosom 22 mit Regionen des ABL1-Gens auf Chromosom 9 verbunden. Das abnorme Fusionsprotein, p210, welches daraus hervorgeht ist verantwortlich für eine dauerhafte Aktivierung mehrerer Signalübertragungswege. Dies bewirkt bei den betroffenen Zellen eine nicht regulierte Proliferation, eine reduzierte Stromaanbindung und eine defekte apoptotische Antwort auf mutagene Stimuli [Huettner et al., Swerdlow et al.]. Die am häufigsten beobachtete Mutation der BCR-ABL1-negativen MPN ist die JAK2 V617F Mutation. Diese Mutation wird bei mehr als 90% der Patienten mit PV und bei fast der Hälfte der Patienten mit PMF oder ET gefunden [Vardiman et al.]. JAK2 bindet den Erythropoetinrezeptor und den Thrombopoetinrezeptor und ist für die Signalübermittlung durch diese beiden Rezeptoren essentiell. Direkte Konsequenzen der JAK2 V617F Mutation beim Menschen ergeben sich aus einer konstitutiven Aktivierung dieses Rezeptorkomplexes und beinhalten eine erythropoetische und megakaryozytäre Proliferation [Skoda et al., Beer et al.]. 8
9 Chronische Myeloische Leukämie Die chronische myeloische Leukämie (CML) ist eine myeloproliferative Neoplasie, welche obligat mit dem auf dem Philadelphia Chromosom lokalisierten BCR-ABL1-Fusionsgen assoziiert ist. Die Erkrankung hat eine weltweite jährliche Inzidenz von 1-2 Fällen pro Einwohner [Swerdlow et al.]. Fast 20-40% der Patienten sind bei Diagnosestellung asymptomatisch. Sie fallen oftmals erst während medizinischer Routineuntersuchungen mit einer Leukozytose im Blutbild auf. Symptomatische Patienten klagen über Beschwerden wie Müdigkeit, Gewichtsverlust, Nachtschweiß, Splenomegalie oder Anämie. Ohne Therapie geht die Erkrankung von einer chronischen Phase meist über eine akzelerierte Phase in eine Blastenphase über. Der Allgemeinzustand des Patienten verschlechtert sich und es treten Symptome einer schweren Anämie, Thrombozytopenie oder einer Splenomegalie auf [Swerdlow et al.]. In der chronischen Phase findet man im peripheren Blut eine Leukozytose von x 10 9 /l. Das Knochenmark ist hyperzellulär, die Anzahl der Blasten liegt normalerweise unter 5% der Knochenmarkszellen [Schmitt-Graef, Swerdlow et al.]. Bei therapieresistenter, persistierender oder steigender Leukozytose über 10x 10 9 /l mit oder ohne Splenomegalie, Thrombozytose über 1000x 10 9 /l oder therapieunabhängiger Thrombozytopenie unter 100 x 10 9 /l und einer im Vergleich zu dem initial diagnostizierten Karyotyp veränderten Zytogenetik des neoplastischen Klons, kann von einer Progression der chronischen Phase in eine akzelerierte Phase ausgegangen werden [Swerdlow et al.]. Das morphologische Bild der akzelerierten Phase ist in der Regel assoziiert mit dysplastischen Veränderungen der Hämatopoese, abnormen megakaryozytären Clustern und einem Blastenanteil von 10-19% im Blut und/oder im Knochenmark [Schmitt-Graef]. Abbildung 1.1. zeigt ein Beispiel für abnorme Megakaryozyten bei CML. Die CML-Blastenphase (CML-BP) ist durch einen Blastenanteil im Blut und/oder im Knochenmark von 20% definiert, entspricht also einer AML. Ebenso liegt im Falle von fokalen Blastenrasen im Knochenmark oder eines extramedullären blastären Myelosarkoms eine BP vor [Schmitt-Graef, Swerdlow et al.]. In der Behandlung der CML werden die Moleküle Imatinib sowie dessen Nachfolger Dasatinib und Nilotinib erfolgreich eingesetzt. Imatinib konkurriert mit ATP kompetitiv um 9
10 die Bindungsstelle der BCR-ABL-1-Kinase Domäne und führt so zu einer Unterbrechung des onkogenen Signals. Das Ansprechen der Patienten auf die Proteinkinaseinhibitortherapie ist zugleich der wichtigste prognostische Faktor für den weiteren Verlauf der Erkrankung und das Überleben der Patienten [Swerdlow et al.]. Abb Megakaryozyten bei CML. NACE-Färbung, 400x Vergrößerung. Megakaryozyten sind pfeilmarkiert. Im Allgemeinen ist die Megakaryopoese deutlich proliferiert und mit überwiegend kleinen, locker über die Markräume verteilten Zellformen vertreten. Diese kleinen Megakaryozyten mit hypolobulierten Zellkernen, welche allerdings nicht die dysplastischen Veränderungen von Mikromegakaryozyten bei MDS zeigen, gelten als typisches Merkmal der BCR-ABL-positiven CML. Das Auftreten von großen polymorphen Megakaryozyten in Gruppen, welches in vereinzelten CML-Fällen beobachtet werden kann, gilt als Hinweis auf eine zusätzliche JAK2-V617F-Mutation [Schmitt-Graef]. Polyzythämia vera Die Polyzythämia vera (PV) ist durch eine erhöhte Erythrozytenproduktion gekennzeichnet, welche unabhängig von jenen Vorgängen stattfindet, die normalerweise die Erythropoese regulieren. Zusätzlich besteht häufig auch eine Proliferation der granulozytären und megakaryozytären Zellreihen. Die häufigste genetische Veränderung ist die JAK2 V617F Mutation. Diese tritt bei ungefähr 95% der Patienten mit PV auf. Die jährliche Inzidenz der PV nimmt mit dem Alter zu und liegt bei 0,7 bis 2,6 pro Einwohner [Swerdlow et al.]. Die Hauptsymptome der PV resultieren aus Hypertension und Gefäßveränderungen, welche von der erhöhten Erythrozytenzahl mitverursacht werden. 20% der Patienten erleiden eine venöse oder arterielle Thrombose [Swerdlow et al.]. 10
11 Zur Diagnose einer PV bedarf es der Einbeziehung von Parametern aus Klinik, Labor und histologischen Untersuchungen. Die Diagnosekriterien erfordern zur sicheren Diagnosestellung entsprechend der aktuellen WHO-Klassifikation beide Hauptkriterien und ein Nebenkriterium oder das erste Hauptkriterium und zwei Nebenkriterien [Swerdlow et al.] (Tabelle 1.2.). Hauptkriterien 1. Hämoglobin >18,5 g/dl bei Männern und >16,5 g/dl bei Frauen oder ein anderer Hinweis auf ein erhöhtes Volumen der roten Blutkörperchen* 2. JAK2 V617F Mutation oder eine andere in ihrer Funktion ähnliche Mutation wie die JAK2 Exon 12 Mutation. Nebenkriterien 1. Hyperzellularität in der Knochenmarkbiopsie und Panmyelose 2. Erniedrigtes Serum Erythropoetinlevel 3. Endogene erythroide Koloniebildung in vitro *Hämoglobin oder Hämatokrit des Patienten liegen über der 99ten Perzentile des Referenzbereichs einer Methode. *Hämoglobin >17 g/dl bei Männer und >15 g/dl bei Frauen, assoziiert mit einem dokumentierten und dauerhaften Anstieg des Hämoglobins von mindestens 2 g/dl über der Norm des Patienten, welcher nicht auf die Behebung eines Eisenmangels zurückzuführen ist. *Die Menge roter Blutkörperchen ist um >25% des durchschnittlich zu veranschlagenden Wertes erhöht. Tab Diagnosekriterien für eine PV nach aktueller WHO Klassifikation [Vardiman et al.]. Es werden drei Phasen der PV unterschieden [Swerdlow et al.]: (1) Eine prodromale, praepolyzythämische Phase mit nur milder Erythrozytose. (2) Eine polyzythämische Phase mit signifikant erhöhter Zahl roter Blutkörperchen. (3) Eine fakultative postpolyzythämische, myelofibrotische Phase mit Zytopenie, Knochenmarkfibrose, extramedullärer Hämatopoese und Hypersplenismus. In der Beckenkammbiopsie zeichnet sich bereits in der frühen Phase der PV eine trilineäre myeloische Proliferation ab, die neben der Erythropoese auch die Granulopoese und die Megakaryopoese betrifft (Abbildung 1.2.). In den späteren Krankheitsphasen nimmt die Erythropoese kontinuierlich ab. Es kann fakultativ zu der Entwicklung einer 11
12 Knochenmarkfibrose kommen, die von einer zunehmenden megakaryozytären und granulozytären Reifungsstörung begleitet ist. Die morphologische Abgrenzung zu einer PMF ist dann nicht mehr in allen Fällen sicher möglich [Schmitt-Graef, Swerdlow et al.]. Abb Megakaryozyten bei PV. NACE-Färbung, 400x Vergrößerung. Zwei Megakaryozyten sind pfeilmarkiert. Die Megakaryopoese weist bei der PV Merkmale auf, die für eine MPN sprechen und eine reaktive Veränderung wenig wahrscheinlich machen. Polymorphe Megakaryozyten sind mit kleinen bis zu erheblich vergrößerten Zellformen vertreten, einzeln über die Markräume verteilt oder in lockeren Gruppen angeordnet [Schmitt-Graef]. Die Therapie ist im mittleren und höheren Lebensalter palliativ und beinhaltet die Reduktion des Risikos thromboembolischer Ereignisse und die Verhinderung später Komplikationen wie Myelofibrose oder Blastentransformation. Eine Heilung der PV ist nur durch eine allogene Stammzelltherapie möglich [Lengfelder et al.]. Mit den heute zur Verfügung stehenden Therapie-möglichkeiten kann im Allgemeinen ein medianes Überleben von >10 Jahren erreicht werden [Swerdlow et al.]. Primäre Myelofibrose Die Primäre Myelofibrose (PMF) ist in einem frühen Stadium durch die Proliferation von Megakaryozyten und eine gesteigerte Granulopoese im Knochenmark gekennzeichnet. Das voll ausgeprägte Krankheitsbild ist mit einer reaktiven Knochenmarkfibrose und einer extramedullären Hämatopoese assoziiert. Dieses entwickelt sich schrittweise aus einem noch nicht fibrosierten, hyperzellulären Knochenmark [Swerdlow et al.]. Bei der PMF wird die 12
13 Entwicklung der Fibrose als paraneoplastischer Stromaeffekt aufgefasst. Die Fibrose wird dabei durch Zytokine, die von der klonalen hämatopoetischen Zellpopulation freigesetzt werden induziert und ist zum Teil auch auf Autoimmunreaktionen zurückzuführen [Schmitt- Graef]. Symptomatische Patienten klagen über Müdigkeit, Luftnot, Gewichtsverlust, Nachtschweiß, Fieber oder Blutungen [Swerdlow et al.]. Seltener kommt es zu Knochenschmerzen, Ikterus oder Lymphknotenvergrößerung [Renz-Polster]. Diese Symptome resultieren aus Anämie, Leukozytose und/oder Thrombozytose. Bei fast 90% der Patienten ist eine Splenomegalie feststellbar [Swerdlow et al., Renz-Polster]. Zur Diagnosestellung einer PMF bedarf es entsprechend der aktuellen WHO-Klassifikation aller drei Hauptkriterien und zweier Nebenkriterien (Tabelle 1.3.) [Swerdlow et al.]. Hauptkriterien 1. Megakaryozytäre Proliferation und Atypie, gewöhnlich mit Retikulin-/oder Kollagenfibrose verbunden. In Abwesenheit einer deutlichen Retikulinfibrose müssen die Veränderungen der Megakaryozyten mit einer erhöhten Zellularität des Knochenmarks einhergehen, welche durch eine granulozytäre Proliferation und oftmals eine verminderte Erythropoese gekennzeichnet wird. 2. WHO Diagnosekriterien für PV, BCR-ABL1-positive CML, MDS oder andere myeloische Neoplasien werden nicht erfüllt. 3. Nachweis einer JAK2 V617F Mutation oder anderer klonaler Marker. Bei Abwesenheit eines klonalen Markers kann die Diagnose nur nach Ausschluss einer sekundären Genese der morphologischen Veränderung gestellt werden. Nebenkriterien 1. Leukoerythroblastose 2. Erhöhtes Serum Laktat Dehydrogenase Level 3. Anämie 4. Splenomegalie Tab Diagnosekriterien für eine PMF nach aktueller WHO Klassifikation [Vardiman et al.]. Die PMF kann unterteilt werden in ein frühes präfibrotisches Stadium, ein beginnend fibrotisches Stadium und ein fibrotisches Stadium [Swerdlow et al.]. In frühen Krankheitsstadien findet sich in der Beckenkammbiopsie ein gesteigerter Zellgehalt, der auf eine Proliferation der linksverschobenen Granulopoese wie auch auf eine Proliferation der Megakaryopoese zurückzuführen ist [Swerdlow et al.]. 13
14 Abbildung 1.3. zeigt ein Beispiel für Megakaryozyten bei PMF. Abb Megakaryozyten bei PMF. NACE-Färbung, 400x Vergrößerung. Einzelne Megakaryozyten bzw. Megakaryozyten-Cluster sind pfeilmarkiert. Im Allgemeinen ist die Megakaryopoese bei PMF in großen dichten Haufen angeordnet, die zum Teil in die Markraumperipherie in den Bereich der endostalen Nischen verlagert sind. Diese Cluster setzen sich aus teils kleinen dysplastischen, teils riesigen Megakaryozyten mit bizarr konfigurierten Kernen zusammen [Schmitt-Graef]. In den späteren Krankheitsstadien ist die PMF durch eine diffuse Verdichtung des argyrophilen Gitterfasergerüsts gekennzeichnet und weist gelegentlich bereits fokale Zonen eines endostalen Knochenanbaus auf. Der Zellgehalt ist oftmals normo- oder hypozellulär. [Schmitt-Graef]. Die offensichtlich fibrotische Phase der PMF hat eine geschätzte Inzidenz von 0,5-1,5 pro Einwohner pro Jahr [Swerdlow et al.]. Bis jetzt wurde noch kein genetischer Defekt identifiziert, der für die PMF spezifisch ist. In ungefähr 50% der Patienten ist eine JAK2 V617F Mutation nachweisbar. Eine in ihrer Wirkung ähnliche Mutation, MPL W515K/L, wurde bei 5% der Fälle mit PMF berichtet [Swerdlow et al.]. Die einzige kurative Therapie der PMF ist die allogene Stammzelltransplantation. Patienten, für die eine kurative Therapie nicht zur Verfügung steht, sollten entsprechend ihres individuellen Risikos entweder einer watch&wait Strategie zugeführt werden, oder palliativ behandelt werden, unter anderem durch die Substitution von Erythrozyten und gegebenenfalls auch Thrombozyten [Grießhammer et al., Renz-Polster]. Unter geeigneter Therapie beträgt das mediane Überleben ungefähr 3 bis 7 Jahre für Patienten, welche bereits in einem fibrotischen Stadium diagnostiziert werden. Dagegen steht eine relative 14
15 Überlebenswahrscheinlichkeit von Jahren für Patienten, bei denen ein beginnend fibrotisches Stadium oder ein frühes präfibrotisches Stadium vorliegt [Swerdlow et al.]. Essentielle Thrombozythämie Die ET ist eine maligne Erkrankung der Megakaryozyten, welche prinzipiell durch eine abnorme Proliferation eines megakaryozytären Klons und eine persistierende Thrombozytose gekennzeichnet ist [Tenedini et al.]. Die Inzidenz der ET liegt schätzungsweise bei 0,6-2,5 pro Einwohner pro Jahr [Swerdlow et al.]. Mehr als die Hälfte der Patienten sind bei Diagnosestellung asymptomatisch und werden durch eine erhöhte Thrombozytenzahl während einer Routineuntersuchung des Blutes auffällig. Die restlichen Patienten werden meist aufgrund klinisch manifester Gefäßverschlüsse oder Hämorrhagien auffällig [Swerdlow et al., Renz-Polster]. Für die Diagnosestellung der ET liefern der morphologische Befund und der Nachweis einer persistierenden Thrombozytose die entscheidenden Kriterien [Schmitt-Graef]. Zur Diagnosestellung einer ET bedarf es entsprechend der aktuellen WHO-Klassifikation der Erfüllung aller vier Diagnosekriterien (Tabelle 1.4.) [Swerdlow et al.]. Diagnosekriterien 1. Dauerhaft erhöhte Thrombozytenzahl von >450 x 10 9 /l 2. Nachweis einer Proliferation der megakaryozytären Linie mit einer vermehrten Anzahl vergrößerter und reifer Megakaryozyten in der Knochenmarkbiopsie. Keine deutliche Erhöhung oder Linksverschiebung der Neutrophilen Granulopoese oder Erythropoese 3. WHO-Diagnosekriterien für PV, PMF, BCR-ABL1 + CML, MDS oder andere myeloische Neoplasien werden nicht erfüllt 4. Nachweis einer JAK2 V617F Mutation oder anderer klonaler Marker. In Abwesenheit einer JAK2 V617F Mutation: kein Hinweis auf eine reaktive Genese der Thrombozytose. Tab Diagnosekriterien für eine ET nach aktueller WHO Klassifikation [Vardiman et al.]. Die augenscheinlichste Veränderung des peripheren Blutes ist eine deutliche Thrombozytose [Swerdlow et al.]. Die krankheitstypische morphologische Veränderung betrifft die 15
16 Megakaryopoese, welche deutlich gesteigert und diffus verteilt ist und häufig stark verzweigte Kerne zeigt (Abbildung 1.4.) [Schmitt-Graef]. Abb Megakaryozyten bei ET (pfeilmarkiert). NACE-Färbung, 400x Vergrößerung. Der für eine ET als charakteristisch geltende Megakaryozyt ist sehr groß, besitzt ein reifes Zytoplasma und hyperlobulierte Zellkerne, deren Konfiguration an Hirschgeweihe erinnern kann [Schmitt-Graef]. Auf molekularer Ebene wird die ET durch zwei verschiedene Gruppen von Mutationen charakterisiert, die einerseits Moleküle wie JAK2, MPL und LNK betreffen, welche bei der zytokinvermittelten Signalübertragung eine Rolle spielen, andererseits auf Übertragungswege der transkriptionellen Regulation einwirken wie: TET2, IDH1/2, ASXL1 sowie wiederum JAK2 [Tenedini et al., Beer et al., Akiyama et al.]. Es ist jedoch keine für die ET spezifische molekulargenetische oder zytogenetische Veränderung bekannt [Swerdlow et al.]. Die ET ist eine relativ indolente Erkrankung, welche durch lange symptomfreie Erkrankungsintervalle gekennzeichnet ist. Diese werden gelegentlich von lebensbedrohlichen thromboembolischen oder hämorrhagischen Komplikationen unterbrochen [Swerdlow et al.]. Eine kurative Therapie der ET existiert nicht. Die palliative Therapie unterscheidet zwischen antiaggregierender und zytoreduktiver Therapie [Petrides et al., Renz-Polster]. Nur wenige Patienten mit ET entwickeln eine Myelofibrose. Die Transformation in eine AML oder ein MDS ist mit weniger als 5% der Erkrankten seltener als in anderen MPN. Das mediane Überleben liegt bei Jahren. Die Lebenserwartung ist nur leicht reduziert [Swerdlow et al.]. 16
17 Weitere MPN Neben diesen Hauptgruppen myeloproliferativer Neoplasien existieren noch einige kleinere Untergruppen seltener MPNs. Dazu gehört die chronische Eosinophilen-Leukämie, welche mit einer autonomen klonalen Proliferation eosinophiler Vorgängerzellen einhergeht. Sie ist eine Systemerkrankung, in welcher das periphere Blut und das Knochenmark immer betroffen sind. Man findet eine erhöhte Anzahl Eosinophiler in peripherem Blut, Knochenmark und peripheren Geweben. Organschäden entstehen als Folge einer leukämischen Infiltration, Zytokin-, Enzym- oder Proteinfreigabe durch eosinophile Zellen [Swerdlow et al.]. Daneben gibt es auch nichtklassische myeloproliferative Neoplasien wie die chronische Neutrophilen Leukämie (CNL), das Hypereosinophiliesyndrom (HES), die nicht näher klassifizierbare chronische Eosinophilen Leukämie (CEL, NOS), unklassifizierbare MPN- Formen (MPN-U) und Mastzellerkrankungen. Als gemeinsame Merkmale dieser Gruppen wurden definiert: kein Nachweis von BCR-ABL, fehlende Dysplasie der Erythropoese und der Granulopoese sowie Monozytenwerte von 1x 10 9 /l [Schmitt-Graef]. Die chronische Neutrophilen Leukämie (CNL) ist eine seltene myeloproliferative Neoplasie. Es wurden bisher nur ungefähr 150 Fälle mit CNL beschrieben. Sie ist gekennzeichnet durch eine anhaltende Neutrophilie des peripheren Blutes, eine Hyperzellularität des Knochenmarks aufgrund der Proliferation von neutrophilen Granulozyten und durch eine Hepatosplenomegalie [Swerdlow et al.]. Die Mastozytose gründet auf einer klonalen, neoplastischen Proliferation von Mastzellen. Diese reichern sich in einem oder mehreren Organsystemen an. Die Einteilung der Mastozytose erfolgt hauptsächlich anhand der klinischen Manifestationsform und ihrer Verteilung innerhalb der einzelnen Organsysteme: Bei der kutanen Mastozytose beschränkt sich die Mastzellinfiltration auf die Haut, wohingegen bei der systemischen Mastozytose zumindest ein Organ außerhalb der Haut betroffen sein muss. Die hämatologischen Veränderungen bei systemischer Mastozytose können Anämie, Leukozytose, Eosinophilie des Blutes, Neutropenie und Thrombozytopenie beinhalten. Zur Diagnose einer Mastozytose bedarf es des Nachweises von multifokalen Clustern oder Mastzellinfiltraten in der Knochenmarkbiopsie [Swerdlow et al.]. 17
18 Die Mastozytose ist häufig mit einer somatischen aktivierenden Punktmutation des KIT assoziiert. Dabei ist in den meisten Fällen eine Mutation des Codon 816 in der Tyrosinkinase- Domäne nachweisbar (D816V Mutation) [Swerdlow et al.]. Als MPN-U sollten nur Fälle eingeordnet werden, die nicht die eindeutigen Kriterien einer gut definierten MPN-Kategorie erfüllen oder überlappende Merkmale mehrerer MPN-Kategorien aufweisen [Schmitt-Graef]. Die meisten Fälle der MPN-U Kategorie fallen in eine der drei Gruppen: (1) Frühe Stadien der PV, ET oder PMF. (2) Fortgeschrittene Stadien der MPN, in welchen eine vorherrschende Myelofibrose, eine Osteosklerose oder eine Transformation in ein aggressiveres Stadium die zugrunde liegende Ursache verbirgt. (3) Patienten mit überzeugenden Hinweisen auf eine MPN, bei welchen eine zusätzlich bestehende neoplastische oder entzündliche Veränderung die zur Diagnose notwendigen klinischen und morphologischen Kriterien verbirgt [Swerdlow et al.]. 18
19 Myelodysplastische Syndrome Myelodysplastische Syndrome (MDS) sind eine weitere Gruppe klonaler hämatopoetischer Stammzellerkrankungen [Pecci et al.]. Im Gegensatz zu MPN, die mit erhöhten Zellzahlen im peripheren Blut einhergehen, sind MDS gekennzeichnet durch Zytopenien und Dysplasien in einer oder mehreren der myeloischen Zellreihen, eine ineffektive Hämatopoese und ein erhöhtes Risiko der Entwicklung einer AML [Swerdlow et al., Fontenay-Roupie et al., Hofman et al. 2000]. MDS treten vorwiegend bei älteren Erwachsenen auf. Das mediane Erkrankungsalter liegt bei 70 Jahren. Die Inzidenz beträgt dabei 3-5 pro Einwohner und erhöht sich auf >20 pro Einwohner für Menschen über 79 Jahre. Primäre oder de novo MDS treten ohne eine vorhergehende Chemotherapie oder Bestrahlung auf, entsprechend umgekehrt verhält es sich für sekundäre MDS [Swerdlow et al.]. Die Pathogenese der Knochenmarkdysfunktion bei MDS ist multifaktoriell. Sie beinhaltet Veränderungen in den molekularen Expressionsmustern der hämatopoetischen Stammzelle (HSC) und ihrer Nachkommen, aber auch die Beeinflussung dieser Zellen durch ein abnormes Mikroenvironment im Knochenmark [Greenberg et al.]. Mehrere Studien belegen, dass bei MDS erhöhte Level an apoptotischen hämatopoetischen Vorläuferzellen für die ineffektive Hämatopoese und die periphere Zytopenie hauptverantwortlich sind [Pecci et al., Hofman et al. 2000]. Die erhöhten Apoptoselevel konnten sowohl in CD34 + Vorläuferzellen als auch in differenzierteren CD34 - Zellen nachgewiesen werden [Pecci et al.]. Dennoch werden bei MDS, wie auch im normalen Knochenmark vorzugsweise die differenzierteren Zellen apoptotisch. Ein vermehrtes Überleben der Vorläuferzellen findet sich hingegen beim Fortschreiten der Erkrankung und einer Transformation in eine AML [Greenberg et al.]. Ein alternatives Modell beschreibt eine vermehrte DNA-Schädigung bei MDS. Es sieht einen Defekt vor, der eine effektive Apoptose bei DNA-Schäden verhindert. Dadurch akkumulieren Zellen mit nicht reparierten DNA-Schäden im Knochenmark und es entsteht die bei MDS typische Hyperzellularität in der Knochenmarkbiopsie, die im Gegensatz zu der oftmals nachweisbaren peripheren Zytopenie steht [Head et al.]. Korrelierend zu den peripheren Blutwerten stehen bei den Patienten meist eine Anämiesymptomatik, seltener Infektionen oder Blutungen im Vordergrund [Hofman et al. 2011, Renz-Polster]. Die morphologische Klassifikation der MDS basiert auf dem Prozentsatz an Blasten in peripherem Blut und Knochenmark, der Anzahl der dysplastischen Zellreihen und dem 19
20 Vorhandensein von Ringsideroblasten. Der Anteil an Myeloblasten liegt dabei immer unter 20% und korreliert direkt mit der Wahrscheinlichkeit einer Transformation in eine AML [Swerdlow et al.]. Der für die Bezeichnung dysplastisch erforderliche Prozentsatz an dysplastischen Zellen einer bestimmten Zellreihe liegt bei 10%. Eine Dyserythropoese manifestiert sich dabei im Allgemeinen an Veränderungen des Nukleus wie Knospenbildung, internukleärer Brückenbildung, Karyorrhexis, Multinuklearität oder megaloblastischen Veränderungen sowie an Veränderungen des Zytoplasmas, wie eingeschlossenen zytoplasmatischen Vakuolen oder PAS-Positivität. Die Dysplasie der neutrophilen Zellen wird als Hypolubulation oder Hypogranulation manifest. Hypolobulierte, binukleäre und multinukleäre Megakaryozyten, sowie Mikromegakaryozyten sind die sichersten und nachvollziehbarsten Merkmale der megakaryozytären Dysplasie [Swerdlow et al.]. Gründe für eine sekundäre Dysplasie im Rahmen von Mangelernährung, Medikamenteneinnahme, Toxinen, Wachstumsfaktortherapie, Entzündungen oder Infektionen müssen vor Diagnosestellung ausgeschlossen sein [Vardiman et al., Ramos et al.]. Die empfohlenen Grenzwerte der Laborparameter für die Diagnose einer Zytopenie liegen bei <10g/dl für Hämoglobin, einer absoluten Neutrophilenzahl von <1,8x 10 9 /l und einer Thrombozytenzahl von <100x 10 9 /l. Es folgt eine Übersicht über die einzelnen Erkrankungsgruppen der MDS sowie deren charakteristische Befunde in Blutbild und Knochenmark entsprechend der aktuellen WHO Klassifikation [Swerdlow et al.]. Erkrankung Blutbildbefund Knochenmarksbefund Refraktäre Zytopenie mit unilineärer Dysplasie (RCUD): Refraktäre Anämie (RA), Refraktäre Neutropenie (RN), Refraktäre Thrombozytopenie (RT) Refraktäre Anämie mit Ringsideroblasten (RARS) Uni- oder Bizytopenie¹ Blasten <1% Anämie Blasten <1% Unilineäre Dysplasie <5% Blasten <15% der Erythrozytenvorläufer sind Ringsideroblasten 15% der Erythrozytenvorläufer sind Ringsideroblasten Dysplasie der erythropoetischen Reihe <5% Blasten (Fortsetzung auf Seite 21) 20
21 Erkrankung Blutbildbefund Knochenmarksbefund (Fortsetzung von Seite 20) Refraktäre Zytopenie mit multilineärer Dysplasie (RCMD) Refraktäre Anämie mit Blastenexzess-1 (RAEB-1)/ Refraktäre Anämie mit Blastenexzess-2 (RAEB-2) Nichtklassifizierbares Myelodysplastisches Syndrom (MDS-U) Myelodysplastisches Syndrom 5q - (MDS, 5q - Syndrom) Zytopenie(n) Blasten <1%² Keine Auerstäbchen <1 x 10 9 /l Monozyten Zytopenie(n) Blasten <5%²/Blasten 5-19% keine Auerstäbchen/± Auerstäbchen³ <1 x 10 9 /l Monozyten Zytopenie(n) Blasten <1%² Anämie Meist normale oder erhöhte Thrombozytenzahl Blasten<1% Dysplasien in 2 myeloischen Linien <5% Blasten keine Auerstäbchen ±15% Ringsideroblasten Uni- oder Multilineäre Dysplasie 5-9% Blasten²/Blasten 10-19% keine Auerstäbchen/± Auerstäbchen³ Unausgeglichene Dysplasie in <10% der Zellen einer oder mehrerer myeloischer Zelllinien. Daneben besteht eine zytogenetische Unregelmäßigkeit, welche einen mutmaßlichen Hinweis auf die Diagnose einer MDS liefert. <5% Blasten Normale bis leicht vermehrte Anzahl an Megakaryozyten mit hypolobulierten Nuklei <5% Blasten Isolierte Deletion (5q) keine Auerstäbchen ¹Bizytopenien können gelegentlich auftreten. Fälle mit Panzytopenien sollten als MDS-U klassifiziert werden. ²Falls der Blastenanteil des Knochenmarks bei <5% liegt, jedoch 2-4% Myeloblasten im peripheren Blut vorkommen, liegt eine RAEB-1 vor. Fälle von RCUD und RCMD mit 1% Myeloblasten im Blut sollten als MDS-U klassifiziert werden. ³Fälle mit Auerstäbchen und <5% Myeloblasten im Blut und <10% Myeloblasten im Knochenmark sollten als RAEB-2 klassifiziert werden. Tab (Seiten 20, 21) Erkrankungsgruppen der MDS sowie deren charakteristische Befunde in Blutbild und Knochenmark nach aktueller WHO Klassifikation [Swerdlow et al.]. 21
22 Der Nutzen der Knochenmarkbiopsie bei MDS ist gut etabliert [Swerdlow et al.]. Bei MDS ist das Knochenmark typischerweise hyperzellulär, jedoch kann man bei ungefähr 15% der Patienten ein hypozelluläres Knochenmark vorfinden [Hofman et al. 2000]. Grundsätzlich finden sich bei MDS drei verschiedene Kompartimente im Knochenmark: die verbleibende normale Hämatopoese, die monoklonal proliferierenden Zellen und (prä-)leukämische Blasten [Bene et al.]. Klonale zytogenetische Veränderungen werden bei ungefähr 50% der Fälle beobachtet. Diese reichen von isolierten Veränderungen bis hin zu komplexen Karyotypen mit 3 zytogenetischen Veränderungen. Oftmals können sie mit einer bestimmten morphologischen Veränderung oder einem bestimmten klinischen Verlauf in Verbindung gebracht werden [Swerdlow et al.]. Die Morbidität und Mortalität der jeweiligen Erkrankung steht entweder mit der Dysfunktion des Knochenmarks oder mit der Transformation der Erkrankung in eine AML in Verbindung [Greenberg et al.]. Zur Evaluation der Prognose werden mehrere Faktoren berücksichtigt. Dazu zählen: die morphologische Untergruppe, das Alter der Patienten, der Blastenanteil, zytogenetische Veränderungen und der Grad der Zytopenien. Die drei zuletzt genannten Faktoren werden in dem Internationalen Scoring System für die Prognose der MDS (IPSS) berücksichtigt [Swerdlow et al., Bene et al.]. Zudem können durch histologische Parameter wie einer abnormen Lokalisation unreifer Vorläuferzellen (ALIP) oder der CD34- Immunhistochemie von Knochenmarkzellen Patienten mit einem erhöhten Progressionsrisiko innerhalb der Untergruppen des IPSS erkannt werden [Verburgh et al.]. Die Therapieindikation wird in Abhängigkeit des individuellen Risikoprofils gestellt. Bei einem kleinen Teil der MDS Patienten ist aufgrund einer nur geringgradigen Zytopenie eine watch&wait Strategie ausreichend. Die supportive Therapie bei Patienten mit Niedrigrisiko- MDS schließt sowohl Transfusionen, als auch Antibiotikagabe sowie suffiziente Behandlung von Begleiterkrankungen mit ein. Bei allen Patienten mit Hochrisiko-MDS sollte zunächst die Möglichkeit einer allogenen Stammzelltransplantation geprüft werden. Patienten, für die dieses Verfahren nicht geeignet ist, sollten eine chemotherapeutische Behandlung erhalten, z.b. mit 5-Azacytidin und bei Progress in Studien eingeschlossen werden [Hofman et al. 2011, Renz-Polster]. Das Gesamtüberleben von Patienten mit MDS beträgt 2-3 Jahre und reicht je nach Untergruppe und IPSS-Score von weniger als 3 Monaten bis hin zu 10 Jahren oder länger. In 22
23 Tabelle 1.6. ist die Prognose verschiedener MDS-Typen entsprechend der WHO Klassifikation der 3. Auflage aufgeführt. Patienten, welche chemotherapiert wurden oder eine allogene Stammzelltherapie erhalten haben wurden darin nicht berücksichtigt [Germing et al.]. MDS-Typ entsprechend der WHO Klassifikation der 3. Auflage Medianes Überleben (Monate) Kumulatives Risiko der Transformation in eine AML nach 2 Jahren (%) Refraktäre Anämie (RA) 67 4 Refraktäre Anämie mit Ringsideroblasten (RARS) 68 2 Refraktäre Zytopenie mit multilineärer Dysplasie (RCMD) Refraktäre Zytopenie mit multilineärer Dysplasie und Ringsideroblasten (RCMD-RS) Refraktäre Anämie mit Blastenexzess-1 (RAEB-1) Refraktäre Anämie mit Blastenexzess-2 (RAEB-2) Myelodysplastisches Syndrom 5q Tab Prognose verschiedener MDS-Typen (nach WHO Klassifikation der 3. Auflage) [Germing et al.]. Refraktäre Zytopenie mit unilineärer Dysplasie Die refraktäre Zytopenie mit unilineärer Dysplasie (RCUD) macht etwa 10%-20% aller MDS Fälle aus. Die RCUD enthält jene myelodysplastischen Syndrome, die eine refraktäre Zytopenie mit einer unilineären Dysplasie aufweisen und beinhaltet Fälle mit refraktärer Anämie (RA) und selten auch refraktärer Neutropenie (RN) und refraktärer Thrombozytopenie (RT). Die von den Patienten beschriebenen Symptome stehen mit dem Typ der Zytopenie in Zusammenhang. Das Vorhandensein von Blasten im peripheren Blut schließt eine RCUD aus. Der Anteil an Ringsideroblasten im Knochenmark beträgt immer <15%, der Anteil an Myeloblasten immer <5% [Swerdlow et al.]. Refraktäre Anämie mit Ringsideroblasten Die refraktäre Anämie mit Ringsideroblasten (RARS) ist durch Anämie und eine Dysplasie der erythroiden Linie mit einem Anteil von >15% Ringsideroblasten gekennzeichnet. Die 23
24 RARS macht etwa 3-11% der MDS Fälle aus. Die Symptomatik der Patienten gleicht häufig einer moderaten Anämie. Ringsideroblasten sind erythroide Vorläuferzellen, die aufgrund eines vermuteten Defekts des mitochondrialen Eisenmetabolismus eine ungewöhnliche Anhäufung von Eisen innerhalb der Mitochondrien aufweisen und über eine vermehrte ringförmige Eisenablagerung um den Nukleus definiert werden. [Swerdlow et al.] Refraktäre Zytopenie mit multilineärer Dysplasie Die refraktäre Zytopenie mit multilineärer Dysplasie (RCMD) ist ein MDS mit einer oder mehreren Zytopenien sowie dysplastischen Veränderungen in mindestens zwei myeloischen Zellreihen. Der Anteil der RCMD an allen MDS-Fällen beträgt ungefähr 30%. Die meisten Patienten haben Symptome des Knochenmarkversagens, jedoch ist auch hier das Knochenmark gewöhnlich hyperzellulär. Wie bei der RCUD und der RARS beträgt der Blastenanteil <1% im peripheren Blut und <5% im Knochenmark [Swerdlow et al.]. Wie bei anderen Entitäten aus der Gruppe der MDS, so kann auch bei der RCMD eine verminderte Anzahl reifer Megakaryozyten sowie das gehäufte Auftreten dysplastischer Megakaryozyten die Diagnose in unklaren Fällen unterstützen [Hofman et al. 2000] (Abbildungen 1.5. und 1.6.). Die verlässlichsten Anzeichen für eine Dysplasie der Megakaryozyten sind Mikromegakaryozyten und multinukleäre Megakaryozyten [Swerdlow et al.]. Eine abnormale Lokalisation der Megakaryozyten in der Nähe von Trabekeln und ihre Anordnung in Clustern ist ein weiteres Indiz [Li et al.]. Abb Megakaryozyten bei RCMD (pfeilmarkiert). NACE-Färbung, 200x Vergrößerung. 24
25 Abb Megakaryozyten bei RCMD (pfeilmarkiert). NACE-Färbung, 400x Vergrößerung. Refraktäre Anämie mit Blastenexzess Die Gruppe der Refraktäre Anämie mit Blastenexzess (RAEB) macht ungefähr 40% aller Fälle mit MDS aus. Es werden zwei Kategorien der RAEB unterschieden. Die RAEB-1 wird durch 5-9% Blasten im Knochenmark und/oder 2-4% Blasten im peripheren Blut definiert. Die RAEB-2 wird durch 10-19% Blasten im Knochenmark und/oder 5-19% Blasten im peripheren Blut definiert. Bei Vorhandensein von Auerstäbchen in Blasten wird ein Fall immer als RAEB-2 definiert, unabhängig von dem Anteil der Blasten in PB oder KM [Swerdlow et al.]. Gewöhnlich findet man in allen drei myeloischen Zelllinien dysplastische Veränderungen. Die Anordnung der Blasten in Clustern ist ein für die RAEB charakteristischer morphologischer Befund. Hier ist die immunhistochemische CD34-Färbung von histologischen Knochenmarkschnitten von Nutzen, da sie diese charakteristische Anordnung besonders deutlich zeigen kann. Eine erhöhte Anzahl von Megakaryozyten kommt vor allem bei Fällen mit erhöhter Knochenmarkfibrose vor (RAEB-F) [Swerdlow et al.]. MDS mit isolierter Deletion 5q Das MDS mit isolierter Deletion 5q (5q - -Syndrom) ist durch eine Anämie und weitere fakultative Zytopenien gekennzeichnet. Typisch sind eine relativ normale Anzahl an Thrombozyten, eine Bevorzugung des weiblichen Geschlechts sowie charakteristische morphologische Veränderungen der Megakaryozyten [Hofman et al. 2000] (Abbildung 1.7.). 25
26 Die namensgebende zytogenetische Veränderung betrifft eine spezifische Deletion im Chromosom 5. Die Größe der Deletion sowie die Bruchpunkte sind unterschiedlich, jedoch beinhaltet die Deletion immer die Banden q31-q33. Als mutmaßliche Ursache des 5q - - Syndroms wird das Fehlen eines bislang noch nicht eindeutig identifizierten Tumor Suppressor Gens in der durch die Deletion verlorengegangenen Region vermutet [Swerdlow et al.]. Abb Typische morphologische Veränderungen der Megakaryozyten bei MDS, 5q - Syndrom. NACE- Färbung, 400x Vergrößerung. Megakaryozyten sind pfeilmarkiert. Die Megakaryozyten sind üblicherweise mit einem Diameter von 30μm normal groß und besitzen einen einzigen exzentrischen runden Nukleus[Hofman et al. 2000]. Myelodysplastisches Syndrom; nicht klassifizierbar In die Untergruppe Myelodysplastisches Syndrom; nicht klassifizierbar (MDS-U) werden jene Patienten eingeordnet, welche die Kriterien für eine Einordnung in eine der anderen Untergruppen nicht erfüllen (siehe auch: Tabelle 1.5.) [Swerdlow et al.]. 26
27 Myelodysplastische/Myeloproliferative Neoplasien Die Kategorie der myelodysplastischen/myeloproliferativen Neoplasien (MDS/MPN) umfasst eine Gruppe von myeloischen Neoplasien, die überlappende Merkmale zwischen einem MDS und einer MPN aufweisen. Zu dieser Gruppe gehören die chronische myelomonozytäre Leukämie (CMML), die juvenile myelomonozytäre Leukämie (JMML), die atypische CML (acml) und die provisorische Entität eines unklassifizierbaren MDS/MPN [Vardiman et al., Schmitt-Graef]. Die acml ist BCR-ABL1 negativ. Sie zeigt neben den Charakteristika einer klassischen CML auch Dysplasiezeichen [Swerdlow et al.]. Die JMML ist eine klonale hämatologische Erkrankung der Kindheit. Sie ist durch eine Proliferation der granulozytären und der monozytären Linie gekennzeichnet [Swerdlow et al.]. Chronische myelomonozytäre Leukämie Die CMML ist durch eine dauerhafte Monozytose des peripheren Bluts von >1 x 10 9 /l, die Abwesenheit des Philadelphia Chromosoms, ein fehlendes Rearrangement von PDGFRA oder PDGFRB, weniger als 20% Blasten in peripherem Blut und Knochenmark sowie eine Dysplasie in einer oder mehreren myeloischen Linien gekennzeichnet. Es gibt keine zuverlässigen Daten über die Inzidenz der CMML. Die häufigsten Symptome sind Müdigkeit, Gewichtsverlust, Fieber und Nachtschweiß sowie Infektionen und Blutungen aufgrund von Thrombozytopenie. Das mediane Überleben der Patienten mit CMML beträgt Monate [Swerdlow et al.]. Zur Diagnosestellung müssen entsprechend der aktuellen WHO- Klassifikation alle 5 Diagnosekriterien erfüllt sein [Swerdlow et al.] (Tabelle 1.7.). Diagnosekriterien 1. Dauerhafte Monozytose im peripheren Blut von >1 x 10 9 /l 2. Kein Nachweis eines Philadelphia Chromosoms oder eines BCR-ABL1 Fusionsgens 3. Keine Umlagerung von PDFGRA oder PDFGRB 4. <20% Blasten* in Blut und Knochenmark. (Fortsetzung auf Seite 28) 27
28 Diagnosekriterien (Fortsetzung von Seite 27) 5. Dysplasien in einer oder mehreren myeloischen Zelllinien. In Abwesenheit von Myelodysplasien kann die Diagnose einer CMML gestellt werden, falls in den hämatopoetischen Zellen ein erworbener, klonaler zytogenetischer oder molekularer Defekt vorliegt, oder die Monozytose für mindestens 3 Monate vorliegt und alle anderen Gründe für eine Monozytose ausgeschlossen wurden. * Blasten schließen Myeloblasten, Monoblasten und Promonozyten mit ein. Tab (Seiten 27, 28) Diagnosekriterien für eine CMML nach aktueller WHO Klassifikation [Swerdlow et al.]. Das Charakteristikum der CMML ist eine Monozytose des peripheren Bluts. Der Monozytenanteil liegt per Definition immer >1x 10 9 /l und bei >10% der Gesamt-Leukozyten. Die Monozyten sind im Allgemeinen ausgereift und morphologisch unauffällig. Weiterhin können Blasten und Promonozyten nachgewiesen werden [Swerdlow et al.]. Das Knochenmark ist in mehr als 75% der Fälle hyperzellulär. Mikromegakaryozyten oder Megakaryozyten mit abnormen Nuklei werden bei über 80% der Patienten mit CMML gefunden [Swerdlow et al., Orazi et al.200swerdlow et al.] (Abbildung 1.8.). Die Anzahl der Blasten und Promonozyten im Knochen-mark korreliert mit einer schlechten Prognose und einem erhöhten Risiko der Transformation in eine akute Leukämie [Swerdlow et al.]. Zytogenetische Veränderungen werden in 20%-40% der Fälle mit CMML beobachtet, sind aber unspezifisch. Im Gegensatz zu den BCR-ABL1-negativen MPN ist die Mutation JAK2 V617F bei CMML selten[swerdlow et al.]. Abb Megakaryozyten bei CMML (pfeilmarkiert). NACE-Färbung, 400x Vergrößerung. 28
29 1.2. Der Megakaryozyt Morphologie und Funktion des Megakaryozyten Megakaryozyten sind mit einem Durchmesser von μm die größten Zellen des Knochenmarks. Die enorme Größe der Zelle und der einzelne multilobulierte polyploide Nukleus sind für Megakaryozyten besonders charakteristisch. Ihr Anteil innerhalb der Zellen des Knochenmarks liegt bei 0,05-0,5 % [Vainchenker et al., Szalai et al.]. Die Funktion des Megakaryozyten besteht in der Bildung von Thrombozyten. Während seiner Lebensspanne kann ein reifer Megakaryozyt bis zu 10 4 Thrombozyten bilden. Thrombozyten sind mit einer Größe von 3,6 x 0,7 μm die kleinsten Zellen im menschlichen Blut und spielen neben der Hämostase eine wichtige Rolle bei Wundheilung, Entzündung und Tumormetastasierung. Jeden Tag werden im Knochenmark des Erwachsenen 1x Thrombozyten gebildet. Diese Zahl kann bei Bedarf auf das Zehnfache ansteigen [Szalai et al.]. 29
30 Ablauf und Regulation der Megakaryopoese Abbildung 1.9. zeigt wichtige Schritte und regulatorische Vorgänge während der Megakaryopoese: Abb Überblick über die Megakaryopoese. Die Abbildung zeigt die Entwicklung reifer Megakaryozyten und Thrombozyten aus der HSC nach dem klassischen Weg über die gemeinsame myeloische Vorläuferzelle (CMP) und nach dem direkten Weg (gestrichelter Pfeil). Dazugehörige Oberflächenantigene werden in gelben Pfeilen dargestellt und zeigen das Entwicklungsstadium an, in welchem sie exprimiert werden. Grüne Pfeile stehen für die Rolle von spezifischen Zytokinen während der Megakaryopoese. (Modifiziert, in Anlehnung an Szalai et al. [Szalai et al.]). 30
31 Von der hämatopoetischen Stammzelle zum High Proliferative Potential-Colony Forming Unit-Megakaryocyte Bei der Entwicklung der einzelnen hämatopoetischen Zelllinien kann sich die HSC in zwei unterschiedliche Richtungen differenzieren: in die allgemeine lymphoide Vorläuferzelle (CLP) sowie in die allgemeine myeloische Vorläuferzelle (CMP). Aus der CLP entwickeln sich Lymphozyten (NK-, B- und T-Zellen). Aus der CMP entwickeln sich sowohl die Granulozyten/Makrophagen Vorläuferzelle (GMP) wie auch die Erythrozyten/Megakaryozyten Vorläuferzelle (MEP). Einige Studien lassen vermuten, dass die MEP auch direkt aus der HSC entstehen könnte [Szalai et al.]. Der High Proliferative Potential-Colony Forming Unit-Megakaryocyte (HPP-CFU-MK) ist die erste Vorläuferzelle, welche eindeutig der megakaryozytären Zelllinie zugeordnet werden kann (Abbildung 1.9.). Von dem High Proliferative Potential-Colony Forming Unit-Megakaryocyte zum Megakaryozyten Eine typische megakaryozytäre Vorläuferzelle durchläuft 3 bis 6 diploide Zellzyklen, woraus 8 bis 64 Nachkommen entstehen [Kaushansky et al.]. Die Klassifikation der einzelnen Vorläuferzellen basiert auf ihrem Vermögen zur Zellproliferation. Der High Proliferative Potential-Colony Forming Unit-Megakaryocyte (HPP-CFU-MK) und der Burst Forming Unit-Megakaryocyte (BFU-MK) sind die am wenigsten differenzierten Vorläufer welche der megakaryozytären Linie zugeordnet werden können. Der Colony Forming Unit- Megakaryocyte (CFU-MK) ist im Vergleich zu Letzterem differenzierter. Aus dem CFU-MK entstehen unreife Megakaryozyten oder Megakaryoblasten [Chang et al., Szalai et al.]. Diese Zellen sind Übergangszellen hin zu ausgereiften Megakaryozyten [Szalai et al.] (Abbildung 1.9.). Die Ausreifung der Megakaryozyten ist durch eine Zunahme des Zytoplasmas und die Synthese von typischen Organellen und Thrombozytenproteinen gekennzeichnet [Vainchenker et al., Szalai et al.]. Nach Abschluss der diploiden Zellzyklen erhöhen Megakaryozytenvorläufer ihre Ploidie durch einen Vorgang, welcher Endomitose genannt wird. Dabei entspricht der endomitotische Zellzyklus einer Mitose ohne Anaphase B und wird vielfach durchlaufen [Chang et al.]. Sind die endomitotischen Zellzyklen beendet, weisen einzelne Megakaryozyten ein Vielfaches der normalen Chromosomenzahl in einem einzigen 31
32 hochlobulierten polyploiden Nukleus auf. Dieser zeigt einen Chromosomensatz von bis zu 256n [Kaushansky et al., Chang et al.]. Gegen Ende ihrer Ausreifung formen Megakaryozyten durch Caspase-anonzierte Fragmentation ihres Zytoplasmas Thrombozyten. Die Anordnung der Blutplättchen und ihre Freigabe werden heute als miteinander gekoppelte Ereignisse betrachtet und folgen der Entstehung sogenannter Proplatelets [Schulze et al.]. Dieser Prozess muss ausnahmslos in der Blutzirkulation stattfinden. Aus diesem Grund weisen reife Megakaryozyten im Knochenmark eine direkte Assoziation zu Blutgefäßen auf. Anderweitig wären die Thrombozyten im Knochenmark festgesetzt [Chang et al.]. Die Bildung der Thrombozyten und ihre Freigabe ist der letzte Schritt in der Entwicklung des Megakaryozyten und endet mit dessen Apoptose und Phagozytose durch Makrophagen [Szalai et al.] (Abbildung 1.9.). Expression von Oberflächenproteinen während der Megakaryopoese Hierarchien der hämatopoetischen Zellen, welche sich auf die Expression von Oberflächenproteinen während einzelner Differenzierungsstufen beziehen sind beim Menschen nicht eindeutig definiert [Chang et al.]. Alle hämatopoetischen Vorläuferzellen exprimieren auf ihrer Oberfläche CD34 und auch CD41 [Schulze et al.]. HSC können durch die Expression von CD34, CD133, Thy-1 und c-kit Antigenen sowie durch die Abwesenheit von CD38 und Markern der einzelnen hämatopoetischen Zelllinien definiert werden [Chang et al.]. Die Megakaryozyten/Erythrozyten-Vorläuferzelle kann bei Menschen als Lin - CD34 + CD38 + IL3Ra - CD45Ra - definiert werden [Chang et al.]. Die Expression von CD38 korreliert dabei direkt mit dem Reifegrad der Zelle [Szalai et al.]. Die am weitesten verbreiteten Marker, um die Ausreifung der MK zu untersuchen sind die Antigene CD61, CD41 und CD42. Die Differenzierung der Megakaryozyten wird durch die Expression von CD61 (Integrin β3) und die vermehrte Expression von CD41 (Integrin αiib) charakterisiert, welche zusammen einen heterodimeren Rezeptorkomplex bilden, der als Glykoprotein (gp) IIb/IIIa bekannt ist [Szalai et al.]. Der GPIIb/IIIa Komplex ist auf den Vorläufern der Megakaryozyten noch nicht vorhanden und wird erst auf Zwischenzellen exprimiert, welche unreifen Megakaryozyten entsprechen und begonnen haben 32
33 endomitotische Zellzyklen zu durchlaufen [Schulze et al.]. Die Expression von CD42 (gp Ib, vwf-rezeptor) erfolgt wenige Zeit später [Szalai et al.]. Expression von CD34 während der Megakaryopoese Viele Studien beschreiben, dass der BFU-MK und der CFU-MK das CD34-Antigen exprimieren [Szalai et al., Chang et al., Oertel et al.1996, Debili et al.]. Daneben gibt es Anhaltspunkte dafür, dass ein weiterer CD34 + megakaryozytärer Vorläufer existiert, welcher zwischen diesen beiden Vorläufern und ausreifenden Megakaryozyten steht [Debili et al.]. Während der megakaryozytären Differenzierung kommt es zu einer gesteigerten Expression des GPIIb/IIIa Komplexes. Gleichzeitig sinkt der Expressionslevel von CD34. Das CD34- Antigen scheint dann auf der Stufe einer 2N Vorläuferzelle mit verminderter Teilungsfähigkeit verloren zu gehen und ist kurz vor der Polyploidisierung der Megakaryozyten nicht mehr nachweisbar [Debili et al.]. Regulation der Megakaryopoese durch Zytokine Von einer Vielzahl von hämatopoetischen Wachstumsfaktoren einschließlich Interleukin-3 (IL-3), Granulozyten/Monozyten-Colony Stimulating Factor (GM-CSF), Interleukin-6 (IL-6), Interleukin-11 (IL-11), Leukemia Inhibitory Factor (LIF), Stem Cell Factor (SCF) und Thrombopoetin (TPO) wurde nachgewiesen, dass sie das Wachstum und die Reifung von Megakaryozyten stimulieren. Allerdings scheinen alle außer SCF und TPO für die normale und auch die stimulierte Megakaryopoese in vivo entbehrlich zu sein [Vainchenker et al., Szalai et al., Kaushansky et al., Jackson et al.]. Viele weitere Zytokine wie Interleukin-1 (IL- 1), Interleukin-12 (IL-12), Stromal Derived Factor 1 (SDF-1) und CXCL12 (PF4) steuern ebenfalls zur Megakaryopoese bei [Szalai et al., Schulze et al., Liu et al.]. Thrombopoetin (TPO) scheint mit Abstand der wichtigste positive physiologische Regulator der Megakaryopoese [Vainchenker et al., Szalai et al., Jackson et al.]. Die Menge an zirkulierenden TPOs wird durch Metabolisierung durch Thrombozyten und Megakaryozyten reguliert [Jackson et al.]. TPO beeinflusst nahezu alle Stadien der Megakaryopoese [Hofman et al. 2000, Vainchenker et al.]. Für die finalen Schritte der megakaryozytären Ausreifung, die Formation der Blutblättchen und deren Ausschüttung, scheint TPO jedoch nicht gebraucht zu 33
34 werden [Jackson et al.]. Der Thrombopoetin Rezeptor c-mpl wird neben Megakaryozyten und Thrombozyten auch auf anderen hämatopoetischen Geweben, wie z.b. primitiven hämatopoetischen Stammzellen und der erythroiden Linie exprimiert [Bock et al.]. Zytokine, welche die Megakaryopoese inhibieren sind Transforming Growth Factor-β (TGFβ) und Interferon α (Ifα) [Hofman et al. 2000]. Das autokrin produzierte TGF-β scheint dabei die megakaryozytäre Differenzierung durch einen negativen Feedbackmechanismus zu regulieren [Akiyama et al., Vainchenker et al., Teofili et al.]. Die Megakaryopoese wird darüber hinaus noch über andere Wege reguliert. So wurde z.b. beobachtet, dass eine transfusionsbedingte Thrombozytose die Zahl, Größe und Ploidie der Megakaryozyten reduziert [Jackson et al.]. Regulation der Megakaryopoese durch Transkriptionsfaktoren Eine Vielzahl an Tierexperimenten deutet darauf hin, dass Transkriptionsfaktoren die Megakaryopoese auf zwei Ebenen positiv regulieren. Die erste Ebene betrifft die Differenzierung der Vorläuferzellen. Die zweite Ebene beinhaltet alle Schritte der terminalen Differenzierung, Proplateletbildung und Thrombozytenabgabe [Vainchenker et al., Chang et al.]. Für die einzelnen Stadien der megakaryozytären Differenzierung haben sich 4 Transkriptionsfaktoren als besonders wichtig herausgestellt: GATA-1, NF-E2, FOG-1 und Fli-1 [Tenedini et al., Chang et al.]. GATA-1 und NF-E2 scheinen für Megakaryozyten absolut notwendig zu sein, um ihre Ausreifung abzuschließen und Blutblättchen freizusetzen. Der heterodimere Transkriptionsfaktor NF-E2 wird dabei als der primäre Regulator der terminalen MK-Differenzierung und Ausschüttung der Blutplättchen betrachtet [Szalai et al., Schulze et al.]. FOG-1 ist ein Transkriptionsfaktor dessen Expressionsmuster auf Erythrozyten und Megakaryozyten dem des GATA-1 gleicht. Man vermutet, dass FOG-1 eine entscheidende Rolle in der frühen Entwicklung der Megakaryozyten zukommt. Fli-1 scheint als positiver Regulator der Megakaryopoese viele für die Megakaryopoese benötigten Gene zu aktivieren. Der Transkriptionsfaktor TEL soll als Inhibitor der von Fli-1 vermittelten transkriptionellen und biologischen Aktivität wirken [Szalai et al.]. 34
35 1.3. CD34 Das CD34-Antigen ist einer der am häufigsten verwendeten Marker für hämatopoetische Stammzellen. Große Bedeutung gewann es durch den Nachweis, dass die CD34-positive Zellfraktion des Knochenmarks Menschen erfolgreich transplantiert werden kann [Nielsen et al.2008]. Zusammen mit den Proteinen Podocalyxin und Endoglycan gehört CD34 zur CD34- Familie, einer Untergruppe der Sialomuzine [Furness et al.]. 35
36 Struktur des CD34-Antigens Das CD34-Antigen ist ein Typ I Transmembranprotein. Informationen über die molekulare Struktur stützen sich vor allem auf biochemische und sequenzanalytische Erkenntnisse (Abbildung 1.10). Das CD34-Protein setzt sich zusammen aus einem extrazellulären Anteil, welcher eine stark glykosylierte und sialylierte Muzindomäne, eine cysteinhaltige globuläre Domäne und eine juxtamembranöse Region beinhaltet, einem transmembranären Anteil und einem kurzen zytoplasmatischen Ende. Das CD34-Gen liegt auf dem langen Arm von Chromosom 1 (1q32) und wird von acht Exons kodiert [Furness et al., Nielsen et al.2009]. Abb Proteinstruktur des CD34-Antigens. Glykosilierterte (horizontale Linien) und sialylierte (Dreiecke) Serin-Threonin-Prolin-reiche Muzindomäne (pink); cysteinhaltige globuläre Domäne (dunkelblau); juxtamembranöse Stielregion (hellblau); transmembranäre Domäne (lila); zytoplasmatisches Ende (grün). (Modifiziert, in Anlehnung an Nielson et al. [Nielsen et al.2009]). 36
37 Vorkommen des CD34-Antigens Das CD34-Molekül wird von nahezu allen hämatopoetischen Vorläuferzellen exprimiert. Dabei beschränkt sich die Expression von CD34 ausschließlich auf die Gruppe der Stammund Vorläuferzellen und ist auf differenzierten Zellen der hämatopoetischen Linien nicht mehr vorhanden. Neben der Expression auf hämatopoetischen Stammzellen wird das CD34- Antigen auch auf Gefäßendothelien des Erwachsenen exprimiert. Zudem gibt es Hinweise, dass Typen von frühen stromalen und mesenchymalen Stammzellen das CD34-Antigen exprimieren [Furness et al., Nielsen et al.2009, Wilson et al., Oertel et al.1996]. Abbildung zeigt die Verteilung des CD34-Antigens in verschiedenen Zellen des menschlichen Organismus. Abb Verteilungsmuster der CD34-Expression in verschiedenen Zellen des menschlichen Organismus. Das + Zeichen zeigt dabei die CD34-Expression an, das Zeichen weist auf eine fehlende CD34-Expression hin. (Modifiziert, in Anlehnung an Nielsen et al [Nielsen et al.2008]). 37
38 Funktion des CD34-Antigens Die genaue Funktion des CD34-Antigens ist trotz zahlreicher CD34-assoziierter Publikationen noch weitgehend unbekannt [Torlakovic et al.]. Folgende Überlegungen haben sich aus der Analyse der molekularen Struktur des CD34-Antigens ergeben: Da der extrazelluläre Anteil des CD34-Rezeptors viele Eigenschaften mit mehreren bereits bekannten Adhäsionsmolekülen gemeinsam hat, werden dem CD34 Molekül Adhäsions- Eigenschaften zugesprochen [Egeland et al.]. So ist die am besten dokumentierte Funktion des CD34-Antigens dessen Rolle bei der Adhäsion von Lymphozyten an Gefäßendothel in lymphatischen Geweben: wird das CD34-Antigen auf diesen spezialisierten Gefäßen, sogenannten high endothelial vessels (HEV) exprimiert, dient es als ein proadhäsives Molekül für Leukozyten-Homing. Dabei bindet die Muzin Domäne des CD34-Antigens den Leukozyten-Homing-Rezeptor L-Selektin. Diese Interaktion ist jedoch sehr stark von Glykosylierungsvorgängen abhängig, welche nur in HEV beobachtet werden. Dennoch untermauert diese Erkenntnis die Vermutung, dass die Proteine der CD34-Familie Zell-Zell- Adhäsion vermitteln [Furness et al.]. Im Gegensatz dazu zeigen andere Studien, dass Proteine der CD34-Familie in den meisten Situationen als Blocker der Adhäsion agieren [Furness et al., Nielsen et al.2009]. Man vermutet, dass diese antiadhäsive Eigenschaft von CD34 wichtig sein könnte für die Fähigkeit von mobilisierten HSC in das Knochenmark zu immigrieren, um dort ihre geeignete Nische zu finden [Nielsen et al.2009]. So scheint CD34 ein essentielles Molekül für die Mobilität der HSC zu sein und nach Stammzelltransplantation dafür verantwortlich, dass die HSC das Knochenmark auffinden und dort heranwachsen können [Nielsen et al.2008]. Der intrazelluläre Anteil des CD34-Antigens enthält mehrere bekannte oder mögliche Stellen für Phosphorylierung von Proteinkinasen. Dies könnte auf eine Rolle des CD34-Antigens in der transmembranären Signaltransduktion hinweisen [Egeland et al.]. Experimentelle Studien lassen erkennen, dass das CD34-Antigen eine Rolle bei der Erhaltung des Phänotyps undifferenzierter hämatopoetischer Stamm- und Vorläuferzellen spielt, deren natürliche Proliferation fördert sowie deren Differenzierung verhindert. So ist die Expression des CD34- Antigens auf der Zelloberfläche der HSC eines der ersten Ereignisse nach der Aktivierung der HSC aus dem ruhenden Status und deutet auf eine beginnende Proliferation der HSC hin [Nielsen et al.2008, Furness et al.]. 38
39 1.4. Zielsetzung der Arbeit Viele Studien haben gezeigt, dass das CD34-Antigen bis auf wenige Ausnahmen auf differenzierten hämatopoetischen Zellen nicht mehr vorhanden ist. Bei Megakaryozyten fällt mit fortschreitender Differenzierung der Expressionslevel des CD34-Antigens und geht unter physiologischen Bedingungen mit dem Stadium einer megakaryozytären 2n-Vorläuferzelle verloren [Debili et al.]. Bei bestimmten reaktiven und krankhaften Veränderungen des Knochenmarks ist allerdings eine Expression von CD34 in reif erscheinenden Megakaryozyten beschrieben. Die megakaryozytäre CD34-Expression scheint dabei vor allem bei Erkrankungen aus dem Kreis der myeloischen Neoplasien vermehrt vorhanden. Das Auftreten CD34 + Megakaryozyten bei Erkrankungen aus dem Kreis der myeloischen Neoplasien wird jedoch in verschiedenen Studien unterschiedlich auffällig. Beispielsweise konnten Torlakovic et al bei Erkrankungen aus dem Kreis der myeloischen Neoplasien keine vermehrte Präsenz oder Anzahl von CD34 + Megakaryozyten nachweisen [Torlakovic et al.]. Andererseits wurde gezeigt, dass eine CD34- Expression von mehr als 20% in reif erscheinenden Megakaryozyten mit einem aggressiven klinischen Erscheinungsbild verbunden ist und einen unabhängigen, schlechten Prognosefaktor bei MDS darstellt [Tang et al.]. In der Publikation von Pellegrini et al. korrelierte die CD34-Positivität der Megakaryozyten direkt mit der Thrombozytenzahl von MDS-Patienten [Pellegrini et al.]. Zielsetzung dieser Arbeit war es die megakaryozytäre CD34-Expression bei verschiedenen reaktiven und krankhaften Veränderungen des Knochenmarks zu untersuchen. Dabei sollte geprüft werden, ob bei myeloischen Neoplasien eine vermehrte megakaryozytäre CD34- Expression im Knochenmark vorhanden ist, und ob CD34 als zusätzlicher diagnostischer Parameter für die Gruppen der myeloischen Neoplasien etabliert werden kann, welcher bei Fällen mit schwieriger Diagnosefindung für das Vorliegen dieser Erkrankungen spricht. Darüber hinaus sollte überprüft werden, ob eine vermehrte megakaryozytäre CD34- Expression als ein möglicher Marker dienen könnte, der einen unabhängigen Prognosefaktor für das weitere Überleben der Patienten darstellt. Für diese Studie waren daher folgende Fragestellungen besonders interessant: 1. Besteht zwischen reaktiven und neoplastischen Veränderungen des Knochenmarks ein signifikanter Unterschied in der megakaryozytären CD34-Expression? 39
40 2. Besteht bei Patienten mit myeloischen Neoplasien ein signifikanter Unterschied in der Überlebenszeit zwischen Fällen mit vermehrter megakaryozytärer CD34-Expression und Fällen ohne megakaryozytäre CD34-Expression? 40
41 2. Material und Methoden 2.1. Das Patientenkollektiv Die Analysen am Patientengewebe wurden durch ein Votum der Ethikkommission der Universitätsklinik Freiburg (EA324/09) abgedeckt. Für diese Studie wurde ein Kollektiv mit 303 Patienten erstellt. Alle Patienten erhielten in den Jahren 2007 und 2008 eine Knochenmarkbiopsie, entweder im Rahmen einer Erstdiagnose oder zur Beurteilung des Verlaufs einer bei ihnen bereits bestehenden Erkrankung. Diese wurde im Pathologischen Institut der Albert-Ludwigs-Universität Freiburg untersucht und beurteilt. Der entsprechende Befund wurde in einem Arztbrief dokumentiert. Die Auswahl der einzelnen Fälle erfolgte nach Durchsicht der Arztbriefe in der elektronischen Datenbank PathoPro des Pathologischen Instituts Freiburg. Anhand der darin vermerkten Journalnummern wurden aus dem Archiv des Instituts die den Patienten zugehörigen Gewebeblöcke und Objektträger herausgesucht und letztere erneut fachärztlich beurteilt, ausgewählt und unter Berücksichtigung der endgültigen Diagnose in Hauptgruppen und Untergruppen eingeteilt (Tabelle 2.1.). 1. Reaktive Veränderungen der Hämatopoese 1.1. Nichtneoplastische Störungen der Erythropoese 1.2. Nichtneoplastische Störungen der Granulopoese, Monozytopoese, Lymphopoese 1.3. Nichtneoplastische Störungen der Megakaryopoese 1.4. Infektionen und sonstige reaktive Veränderungen 2. Malignome im Knochenmark 2.1. Hodgkin Lymphom (HL) 2.2. Non Hodgkin Lymphom (NHL) 2.3. Karzinom 2.4. Plasmazellmyelom 3. Myeloproliferative Neoplasien 3.1. Chronische myeloische Leukämie (CML) 3.2. Polyzythämia vera (PV) 3.3. Primäre Myelofibrose (PMF) (Fortsetzung auf Seite 42) 41
42 3. Myeloproliferative Neoplasien (Fortsetzung von Seite 41) 3.4. Essentielle Thrombozythämie (ET) 3.5. Myeloproliferative Neoplasie; nicht näher klassifizierbar (MPN; U) 4. Myelodysplastische Syndrome 4.1. Refraktäre Anämie (RA) 4.2. Refraktäre Anämie mit Ringsideroblasten (RA-RS) 4.3. Refraktäre Zytopenie mit multilineärer Dysplasie (RCMD) 4.4. Refraktäre Zytopenie mit multilineärer Dysplasie und Ringsideroblasten (RCMD-RS) 4.5. Refraktäre Anämie mit Blastenexzess-1 (RAEB-1) 4.6. Refraktäre Anämie mit Blastenexzess-2 (RAEB-2) 4.7. Myelodysplastisches Syndrom; nicht näher klassifizierbar (MDS; U) 4.8. Myelodysplastisches Syndrom, 5q - (MDS;5q - ) 5. Myelodysplastische/ Myeloproliferative Neoplasien 5.1. Chronische myelomonozytäre Leukämie (CMML) Tab (Seiten 41, 42) Gruppeneinteilung des Kollektivs. Insgesamt wurden 303 Fälle mit reaktiven Erkrankungen, Malignomen im Knochenmark und myeloischen Neoplasien in das Kollektiv aufgenommen und in die jeweiligen Gruppen und Untergruppen unterteilt (Abbildung 2.1.). 42
43 Abb Übersicht über den Aufbau des Kollektivs unter Angabe der Fallzahlen in den einzelnen Haupt- und Untergruppen. In Klammern gesetzt findet sich die jeweilige Erkrankungsentität (siehe Tabelle 2.1.) Nach Auswahl der Fälle wurde versucht für jeden einzelnen Patienten des Kollektivs folgende Parameter zu erfassen: - Das Geburtsdatum - Das Geschlecht - Das Datum der Erstdiagnose der Erkrankung - Das Alter bei Biopsieentnahme - Eine bei Biopsieentnahme bestehende und auf das Knochenmark wirkende Arzneimitteltherapie - Die histologische Diagnose - Die endgültige klinische Diagnose der Erkrankung - Die Anzahl der in der Biopsie ausgezählten Megakaryozyten o Die Anzahl CD34-positiver Megakaryozyten o Die Anzahl CD34-negativer Megakaryozyten - Die Laborwerte der Patienten zum Zeitpunkt der Biopsieentnahme 43
44 - Die Dauer des weiteren Überlebens der Patienten nach Biopsieentnahme und bei Ableben: o Das Datum des Todeseintritts o Die Ursache des Todes Diese Parameter wurden den Arztbriefen und Einsendescheinen entnommen, welche in der elektronischen Datenbank PathoPro des Pathologischen Instituts Freiburg angelegt waren. Weiterhin wurden die jeweiligen Einsender der Biopsien kontaktiert und gebeten entweder in Form eines beigelegten und auszufüllenden Fragebogens (Anhang 6.1.) oder anhand eines aktuellen Arztbriefs Auskunft über die Erkrankung und den weiteren klinischen Verlauf der Patienten zu geben. 44
45 2.2. Systematik der Auswertung der Knochenmarkbiopsien Alle in dieser Studie berücksichtigten Patienten hatten ein für ihre Erkrankung repräsentatives Knochenmarkbiopsat. Um eine für die Erkrankung repräsentative Anzahl an Zellen der Hämatopoese sowie eine für die Auszählung ausreichende Anzahl an Megakaryozyten zu gewährleisten, wurden folgende Ausschlusskriterien für die Auswahl der Biopsien festgelegt: - Minimale Größe des Biopsats von 10 mm - Maximaler Fettzellgehalt von 70 % Die Auswertung der CD34-Färbung erfolgte am Lichtmikroskop unter 400-facher Vergrößerung. Als interne Kontrolle für eine ausreichende Anfärbung des CD34-Antigens in der Knochenmarkbiopsie dienten hierbei CD34 + Endothelzellen sowie CD34 + Blasten. Es wurde versucht pro Biopsie mindestens 50 Megakaryozyten auszuzählen. Enthielt eine Knochenmarkbiopsie weniger als 50 Megakaryozyten, so wurde die Anzahl sämtlicher in dieser Biopsie enthaltenen Megakaryozyten ausgezählt. Die Charakterisierung einer Zelle als Megakaryozyt erfolgte anhand morphologischer Merkmale. In die Auswertung wurden sowohl morphologisch normal erscheinende Megakaryozyten, wie auch dysplastische Megakaryozyten eingeschlossen. Megakaryozyten wurden unterteilt in jene mit CD34-Expression und jene ohne CD34- Expression. Megakaryozyten, welche das CD34-Antigen exprimierten, wurden anhand ihres Färbemusters in Megakaryozyten mit membranärer und Megakaryozyten mit zytoplasmatischer Anfärbung unterteilt. Die jeweilige Intensität der Färbung wurde mit Hilfe einer Skala von 1 (schwache Anfärbung) bis 3 (sehr kräftige Anfärbung) beurteilt (Anhang 6.2.). Die erfassten Laborwerte wurden in zeitlicher Nähe zu der Biopsieentnahme bestimmt und nur dann gewertet, wenn der Patient zu diesem Zeitpunkt keine die Hämatopoese verändernde Medikation einnahm. Bei der Analyse einer bestehenden Arzneimitteltherapie wurden sämtliche Medikamente berücksichtigt, die im Arztbrief oder Einsendeschein vermerkt waren und deren Wirkung oder Nebenwirkungen nachweislich das Knochenmark betreffen kann. Die Laborwerte wurden dem Einsendeschein, dem Arztbrief oder dem beantworteten Fragebogen entnommen. Wurde aus dem Einsendeschein das Datum der Laborentnahme nicht ersichtlich, so wurde für dieses das Datum des Biopsieeingangs angenommen. 45
46 Die berücksichtigten Labordaten beinhalteten: - Hämoglobin (g/dl) - MCV (fl) - Leukozyten (Anzahl/µL) - Thrombozyten (Anzahl/µL) Bei der Analyse der Überlebenszeiten wurde der Zeitraum zwischen dem Zeitpunkt der Erstdiagnose der Erkrankung und dem Endpunkt der Beobachtung ( ) berücksichtigt. Verstarben die Patienten vor dem , so wurden das Todesdatum sowie die Todesursache vermerkt. 46
47 2.3. Chemikalien, Reagenzien und Geräte Eine Auflistung der in der Studie verwendeten Chemikalien, Antikörper, Software und Geräte zeigen die Tabellen 2.2, 2.3, und 2.4. Chemikalie/Reagenz Aquatex Dako REAL (Antikörperverdünnung) Dako REAL AP Substrate Buffer Dako REAL Chromogen Red 1 Dako REAL Chromogen Red 1 Dako REAL Chromogen Red 1 Dako REAL Levamisole Dako REAL Streptavidin Alkaline Phosphatase (AP) Dako Target Retrieval Solution, ph9 (Kochpuffer) Dako Wash Buffer DMSO (Dimethylsulfoxid) Ethanol Hämalaun Hexazoniumlösung KGF (Beckenkamm-Fixationslösung) Naphtol-AS-D-Chlorazetat Paraffin PBS-Puffer (Phosphat gepufferte Salzlösung) Hersteller Merck, Darmstadt Dako, Glostrup, Dänemark Dako, Glostrup, Dänemark Dako, Glostrup, Dänemark Dako, Glostrup, Dänemark Dako, Glostrup, Dänemark Dako, Glostrup, Dänemark Dako, Glostrup, Dänemark Dako, Glostrup, Dänemark Dako, Glostrup, Dänemark Laboransatz, Pathologisches Institut Albert-Ludwigs- Universität Freiburg Merck, Darmstadt Laboransatz, Pathologisches Institut Albert-Ludwigs- Universität Freiburg Laboransatz, Pathologisches Institut Albert-Ludwigs- Universität Freiburg Laboransatz, Pathologisches Institut Albert-Ludwigs- Universität Freiburg Sigma-Aldrich, Steinheim Engelbrecht, Edermünde Laboransatz, Pathologisches Institut Albert-Ludwigs- Universität Freiburg Triton X100 Fluka, Buchs, Schweiz (Fortsetzung auf Seite 48) 47
48 Chemikalie/Reagenz Hersteller (Fortsetzung von Seite 47) Xylol Carl Roth GmbH, Karlsruhe Tab (Seite 47, 48) Die in der Studie verwendeten Chemikalien. Antikörper Klonalität/Tierquelle Hersteller Anti-Human CD34, Klasse II; QBEnd 10 Dako REAL Biotinylated Secondary Antibody (AB2) Monoklonal, Maus Polyklonal, Ziege Dako, Glostrup, Dänemark Dako, Glostrup, Dänemark Tab Die in der Studie verwendeten Antikörper. Gerät/ Labormaterial/ Software 3CCD-Color Video Camera Autostainer Plus (Immunfärbeautomat) Cell* Imaging Software Dampfgarer Deckgläschen Lichtmikroskop Axioskop 50 Lichtmikroskop Leica DM 2500 Medline Microsoft Office 2010 Mikrotom Leica RM 2255 Objektträger PathoPro5 Software Pipetten Hersteller Sony, Tokio, Japan Dako, Glostrup, Dänemark Olympus GmbH, Münster Braun GmbH, Kronberg R. Langenbrinck, Emmedingen Carl Zeiss GmbH, Jena Leica Microsystems GmbH, Wetzlar National Center for Biotechnology Information, U.S.A. Microsoft, Redmond, U.S.A. Leica Microsystems GmbH, Wetzlar R. Langenbrinck, Emmedingen Institut für medizinische Software, Saarbrücken Eppendorf AG, Wesseling-Berzdorf Pipettenspitzen Starlab GmbH, Ahrensburg (Fortsetzung auf Seite 49) 48
49 Gerät/ Labormaterial/ Software Hersteller (Fortsetzung von Seite 48) Tissue Stainer COT 20 (Entparaffinierungsautomat) Tissue-Tec SCA (Eindeckautomat) Medite Medizintechnik, Burgdorf Sakura, Heppenheim Tab (Seiten 48, 49) Die in der Studie verwendeten Geräte, Labormaterialien und Software. 49
50 2.4. Histologische Färbungen der Knochenmarkbiopsien In dieser Studie wurde das Knochenmark der Patienten hinsichtlich einer megakaryozytären CD34-Expression untersucht. Die Knochenmarkbiopsie gilt hierfür als ein adäquates Verfahren und hilft zudem bei der Charakterisierung und Beurteilung myeloischer Neoplasien [Orazi et al. 2007]. Es kamen konventionelle und immunhistochemische Methoden zum Einsatz. Die Knochenmarkbiopsien waren bereits als archivierte Gewebeblöcke in Paraffin eingebettet. Die Paraffineinbettung war nach einer Fixierung der Biopsien in einer Lösung aus Kalziumazetat, Glutaraldehyd und Formaldehyd (KGF), sowie einer Entkalkung in EDTA erfolgt. Die KGF-Fixation ist hierfür besonders geeignet, da sie jegliche Hämolyse vermeidet und eine gute zelluläre Strukturerhaltung bewirkt [Schaefer]. Von jedem der Gewebeblöcke wurden Schnitte von 2µm Dicke hergestellt und auf Objektträger aufgezogen. Anschließend wurden die Schnitte entparaffiniert und rehydriert. Die Entparaffinierung und Rehydratation erfolgte wie unten beschrieben im Tissue Stainer COT 20: - 15x in Xylol für je 1,5 min - 4x in 100% Alkohol für je 1,5 min - 1x in 96% Alkohol für 1,5 min - 1x in 75% Alkohol für 1,5 min - 2x in Aqua dest. für je 1,5 min Jede Biopsie wurde anschließend einmal mit konventioneller histologischer Färbung (NACE) und einmal mit immunhistochemischer CD34-Färbung gefärbt. 50
51 Naphtol-AS-D-Chlorazetatesterase (NACE)-Färbung Die Naphtol-AS-D-Chlorazetatesterase-Färbung ist eine konventionelle histologische Färbung. Durch sie lassen sich die neutrophile granulozytopoetische Zellreihe sowie Gewebemastzellen besonders gut darstellen [Schaefer]. Die Färbung erfolgte wie im Folgenden beschrieben: 1. Ansetzen der Gebrauchslösung: ml PBS-Puffer Gebrauchslösung (1 PBS-Puffer-Stammlösung: 20 Aqua dest.) wird mit 0,5 ml Hexazoniumlösung gemischt g Naphtol-AS-D-Chlorazetat wird in 2,00 ml DMSO:Triton X-100 (9:1) gelöst. - Die beiden Reagenzien werden zusammengeführt und gut gemischt. Der kontrollierte ph-wert sollte 6,2-6,4 betragen. 2. Der Färbevorgang: Nach Entparaffinierung werden die Biopsien in der frisch angesetzten Gebrauchslösung für 11 Minuten bei 37 C inkubiert. Anschließend wird die Biopsie mit Leitungswasser gespült. Danach erfolgt die Kerngegenfärbung mit Hämalaun für 30 Sekunden und das Spülen unter fließendem Leitungswasser für weitere 2 Minuten. Zuletzt werden die Objektträger per Hand mit Aquatex eingedeckt. Nach dem Färbevorgang werden neutrophile Granulozyten und deren Vorstufen sowie Mastzellen leuchtend rot dargestellt, die Kerne sind blau angefärbt [Stacey et al.]. 51
52 CD34-Färbung Die CD34-Färbung ist eine immunhistochemische Färbung. Das hier angewandte Verfahren zur Detektion des CD34-Antigens beruht auf der LSAB-Methode (Labeled Streptavidin- Biotin) und beinhaltet mehrere Schritte (Abbildung 2.2.). Abb LSAB-Methode zur Detektion des CD34-Antigens. Modifiziert nach Key [Key et al.]. Nach Detektion des Antigens durch einen Primärantikörper wird dieser mit einem biotinylierten Sekundärantikörper markiert. Letzterer wird an ein Konjugat aus Streptavidin und Alkalische Phosphatase gebunden. Durch Applikation einer Chromogen-Substratlösung kann dann die Reaktion sichtbar gemacht werden. Dabei katalysiert Alkalische Phosphatase die Hydrolyse des Substrats. Die daraus entstehenden Verbindungen reagieren mit Chromogen zu einem roten Azofarbstoff, welcher ausfällt und so das zu detektierende Antigen farblich markiert [DAKO Handbuch]. Da jedes biotinylierte Antikörper-Molekül mit mehreren mit Alkalische Phosphatase konjugierten Streptavidin-Molekülen reagieren kann, ist der Primärantikörper letztendlich mit einer Vielzahl an Farbstoff-Molekülen assoziiert. Das dadurch verstärkte Signal erhöht die Sensitivität der Methode beträchtlich [Key et al.]. In dieser Studie wurde als Primärantikörper der monoklonale Maus-Antikörper QBEnd10 vom Isotyp IgG1 Kappa verwendet, welcher gegen O-Sialoglykoprotease sensitive Epitope 52
53 von CD34 gerichtet ist [Horny et al.]. Dieser wurde mit Hilfe von Verdünnungslösung auf eine Konzentration von 1:100 verdünnt (CD34/100). Als Sekundärantiköper dienten biotinylierte Ziege-Anti-Maus- und Ziege-Anti-Kaninchen-Immunglobuline, welche gegen IgG-Erken-nungsstrukturen des Primärantikörpers gerichtet sind. Nach hitzeinduzierter Epitop-demaskierung in verdünntem Kochpuffer wurden die entparaffinierten Biopsien mit Hilfe eines Immunfärbeautomaten gefärbt. Die anschließende Kerngegenfärbung erfolgte mit Hämalaun. Die einzelnen Schritte der Färbung stellen sich wie folgt dar: - Epitopdemaskierung: Die Biopsien werden in optimal verdünntem Kochpuffer (Kochpuffer 1: Aqua dest. 9) für 20 min bei 98 C vorbehandelt und anschließend für 10 min in einem kalten Wasserbad gekühlt. - Immunhistochemische Färbung: Die vorbehandelten Biopsien werden in den Immunfärbeautomaten eingelegt. Nach Applikation des Primärantikörpers werden erst der Sekundärantikörper, dann das Tertiärreagenz und zuletzt der in Substratpuffer verdünnte Chromogenansatz aufgetragen. Zwischen den einzelnen Schritten erfolgt jeweils ein Spülvorgang mit Waschpuffer sowie am Ende der Färbung ein Spülvorgang mit Aqua dest: µl CD34/100 für 30 min µl Sekundärantikörper für 15 min µl Tertiärreagenz für 15 min µl Chromogenansatz für 10 min Anschließend erfolgen die manuelle Kerngegenfärbung mit Hämalaun sowie die Dehydratation in Alkohol und Xylol: - 1x in Hämalaun für 30 sek - 1x unter warmen Leitungswasser für 2,5 min - 1x in Ethanol 75 % für 30 sek - 1x in Ethanol 96 % für 30 sek - 4x in Ethanol 100 % für je 30 sek - 2x in Xylol für je 30 sek 53
54 Zuletzt werden die Biopsien automatisch eingedeckt und können nun beurteilt werden: Das Substratchromogen sollte am Ort des CD34-Antigens zu einen kontrastreichen, roten Endpunkt führen. Die Kerne sollten blau angefärbt sein [Key et al.]. 54
55 2.5. Systematik der Datenauswertung und statistischen Analyse Für eine systematische EDV-gestützte Literaturrecherche wurde die Datenbank Medline verwendet. Die Auswertung der Daten erfolgte unter Berücksichtigung der bis dato veröffentlichten Studienergebnisse. Zur Erfassung und Verarbeitung der Daten, sowie zur Erstellung von Graphiken und Tabellen wurde die Software Microsoft Office 2010 verwendet. In der statistischen Auswertung wurden die experimentell erhobenen Daten sowie die zusammengetragenen Daten aus Einsendescheinen, Arztbriefen und den beantworteten Fragebögen berücksichtigt. Für die statistische Analyse wurde das Programm SPSS (Version 20) verwendet. Die Berechnungen erfolgten mittels des Chi-Quadrat-Tests zum Vergleich der Häufigkeitsverteilungen der megakaryozytären CD34-Expression im Kollektiv. Nichtparametrische Tests beinhalteten den Kruskal-Wallis-Test und den Mann-Whitney-U-Test. Hiermit wurde die megakaryozytäre CD34-Expression zwischen einzelnen Hauptgruppen verglichen. Für die Analyse des Gesamtüberlebens wurden der Log-Rank-Test sowie der Wilcoxon-Gehan-Test herangezogen. Die Irrtumswahrscheinlichkeit galt bei p 0,05 als nicht signifikant, bei p >0,05 als signifikant 55
56 3. Ergebnisse 3.1. Auswertung der CD34-Färbung Bedenkt man das natürliche Vorkommen des CD34-Antigens, welches als Oberflächenprotein auf der Plasmamembran von Zellen exprimiert wird, so könnte man erwarten, dass bei megakaryozytärer CD34-Expression eine stete membranäre Anfärbung der Megakaryozyten zu sehen ist. Die histologische Auswertung der einzelnen Fälle zeigte jedoch, dass CD34 + Megakaryozyten fast ausschließlich zytoplasmatisch angefärbt waren (Abbildungen ). Abb CML. CD34-Färbung, 400x Vergrößerung. CD34 + Megakaryozyten sind pfeilmarkiert. Abb RA. CD34-Färbung, 400x Vergrößerung. CD34 + Megakaryozyten sind pfeilmarkiert. 56
57 Abb RCMD. CD34-Färbung, 400x Vergrößerung. CD34 + Megakaryozyten sind pfeilmarkiert. Abb RAEB-1. CD34-Färbung, 400x Vergrößerung. Der CD34 + Megakaryozyt ist pfeilmarkiert. Abb MDS, 5q-. CD34-Färbung, 400x Vergrößerung. Der CD34 + Megakaryozyt ist pfeilmarkiert. 57
58 Megakaryozyten mit membranärer Anfärbung waren in ihrer Anzahl so gering, dass in der folgenden statistischen Analyse CD34 + Megakaryozyten nicht weiter nach der Art ihrer Anfärbung unterschieden wurden. Die Auswertung der membranären CD34-Färbung wurde zudem dadurch erschwert, dass die Immunpräzipitate oft nur auf einzelnen Abschnitten im Bereich der Plasmamembran detektiert werden konnten und dann dem Megakaryozyten nicht spezifisch zuzuordnen waren, da eine Unterscheidung von Gefäßanschnitten oder nebenliegenden Blasten nicht sicher möglich war (Abbildung 3.6.). Entsprechende Megakaryozyten mussten folglich als CD34-negativ bewertet werden. Abb MDS, 5q-. CD34-Färbung, 400x Vergrößerung. Von den 3 Megakaryozyten im Bild täuscht vor allem der pfeilmarkierte Megakaryozyt eine Membranfärbung vor, aber auch hier dürfte es sich wie bei den zwei sternmarkierten Megakaryozyten um einen dem Megakaryozyten anliegenden Gefäßanschnitt mit CD34- exprimierenden Endothelzellen handeln. Als interne Kontrolle einer gelungenen CD34-Färbung dienten leuchtend rot angefärbte Endothelzellen oder Blasten (Abbildung 3.7.). 58
59 Abb Endotheliale und blastäre CD34-Expression bei RAEB-2. CD34-Färbung, 400x Vergrößerung. Endothelzellen sind pfeilmarkiert, Blasten sind sternmarkiert. Die Intensität der megakaryozytären CD34-Expression zeigte keine eindeutige fall- oder entitätsbezogene Konstanz. Vielmehr zeigten sich eine starke intra- und interindividuelle Variabilität. 59
60 3.2. Darstellung der Häufigkeitsverteilungen im Kollektiv Das Kollektiv beinhaltete insgesamt 303 Fälle. Es setzte sich zusammen aus 141 Fällen der Kontrollgruppe, welche die Gruppen der reaktiven Veränderungen des Knochenmarks und der Malignominfiltrate im Knochenmark umfasste sowie aus 162 Fällen der Versuchsgruppe, bestehend aus den einzelnen Gruppen der myeloischen Neoplasien. Von allen 303 Fällen konnten folgende Parameter bestimmt werden: - Das Geburtsdatum der Patienten - Das Geschlecht der Patienten - Das Alter der Patienten bei Biopsieentnahme - Die histologische Diagnose - Die Anzahl der in der Biopsie ausgezählten Megakaryozyten o Die Anzahl CD34-positiver Megakaryozyten o Die Anzahl CD34-negativer Megakaryozyten Um die Vergleichbarkeit von Versuchs- und Kontrollgruppe zu ermöglichen, wurde auf eine ähnliche Fallzahl in den einzelnen Gruppen des Kollektivs sowie auf eine ähnliche Altersund Geschlechtsverteilung der Patienten geachtet (Tabellen ). Für Patienten der Versuchsgruppe wurde zudem das mittlere Alter bei Erstdiagnose untersucht (Tabelle 3.4.). Hauptgruppen Anzahl der Fälle (n) Anteil an allen Fällen (%) 1. Reaktive Veränderungen 2. Malignome im Knochenmark 3. Myeloproliferative Neoplasien 4. Myelodysplastische Syndrome 5. MPN/MDS ,4 22,1 22,8 26,1 4,6 Gesamt ,0 Tab Fallzahlen in den einzelnen Hauptgruppen des Kollektivs. Die Gruppe der MPN/MDS war mit 14 Fällen vergleichsweise klein. 60
61 Anzahl männlicher Patienten (n) Anzahl weiblicher Patienten (n) Gesamt (n) Kontrollgruppe Versuchsgruppe Kollektiv Tab Geschlechtsverteilung in Kontroll- und Versuchsgruppe. Das Verhältnis von weiblichen zu männlichen Patienten betrug in der Kontrollgruppe 1:1,2 und in der Versuchsgruppe 1:1,3. Mittleres Alter der Männer (Jahre) Mittleres Alter der Frauen (Jahre) Gesamt (Jahre) Kontrollgruppe Versuchsgruppe Kollektiv Tab Altersverteilung in Kontroll- und Versuchsgruppe. Das mittlere Alter lag zum Zeitpunkt der Biopsieentnahme bei 65 Jahren. Männliche Patienten waren mit durchschnittlich 65 Jahren um ein Jahr älter als weibliche Patientinnen. Die Patienten der Versuchsgruppe waren mit durchschnittlich 68 Jahren um 7 Jahre älter als die Patienten der Kontrollgruppe. Mittleres Alter der Männer (Jahre) Mittleres Alter der Frauen (Jahre) Gesamt (Jahre) Myeloproliferative Neoplasien (MPN) Myelodysplastische Syndrome (MDS) MPN/MDS Gesamt 67 Tab Mittleres Alter der Patienten der Versuchsgruppe bei Erstdiagnose. MPN-Patienten waren bei Erstdiagnose mit durchschnittlich 61 Jahren um 9 Jahre jünger als MDS-Patienten. Das mittlere Alter der MPN/MDS-Patienten bei Erstdiagnose betrug 68 Jahre. 61
62 Um eine für die jeweilige Erkrankungsgruppe repräsentative Anzahl an Megakaryozyten zu erhalten, wurde angestrebt pro Knochenmarkbiopsie mindestens 50 Megakaryozyten auszuzählen. Sobald eine Knochenmarkbiopsie weniger als 50 Megakaryozyten enthielt, wurde die Anzahl sämtlicher in dieser Biopsie enthaltenen Megakaryozyten ausgezählt (Abbildung 3.8.). Abb Die durchschnittliche Anzahl der ausgezählten Megakaryozyten pro Fall betrug 46. Von den 303 Fällen des Kollektivs konnten bei 207 Fällen mindestens 50 Megakaryozyten, bei 73 Fällen mindestens 30 Megakaryozyten und bei 23 Fällen weniger als 30 Megakaryozyten ausgezählt werden. Die Erfassung wichtiger klinischer Parameter beinhaltete die bei den entsprechenden Erkrankungen typischerweise veränderten Laborparameter: - Hämoglobin (g/dl) - MCV (fl) - Leukozyten (Anzahl/µl) - Thrombozyten (Anzahl/µl) Tabelle 3.5. zeigt die Anzahl der Patienten in den einzelnen Hauptgruppen, bei welchen die Laborwerte bestimmt werden konnten. 62
63 Anzahl der Patienten (n) Laborparameter Reaktive Malignome im MPN MDS MPN/ Gesamt (n) Veränderungen Knochenmark MDS Hämoglobin MCV Leukozyten Thrombozyten Tab Anzahl der Patienten in den einzelnen Hauptgruppen, bei welchen die Laborparameter erfasst werden konnten. Vollständige Follow-up Daten konnten bei 61 von 162 Patienten der Versuchsgruppe gewonnen werden (Tabelle 3.6.). Diese beinhalteten zusätzlich zu den oben erwähnten Parametern die Dauer des Überlebens und im Falle eines Exitus letalis: - Das Datum des Todes - Die Ursache des Versterbens und insbesondere ob ein ursächlicher Zusammenhang mit der diagnostizierten myeloischen Neoplasie bestand Hauptgruppen Gesamtzahl Anzahl der verstorbenen Anzahl der überlebenden (n) Patienten (n) Patienten (n) MPN MDS MPN/MDS Gesamt Tab Anzahl der Patienten in der Versuchsgruppe mit vollständigen Follow-up Daten. Von insgesamt 61 Patienten verstarben 29 vor dem Ende des Überwachungszeitraums ( ), 32 Patienten lebten über diesen Zeitpunkt hinaus. 63
64 3.3. Auswertung der megakaryozytären CD34-Expression Bei der Analyse der megakaryozytären CD34-Expression wurden die einzelnen Fälle des Kollektivs anhand des Anteils ihrer CD34 + Megakaryozyten (beschrieben als: Meg. positiv in %) unterteilt (Tabelle 3.7 und Abbildung 3.9.). Dabei war auffällig, dass mit steigendem Anteil an CD34 + Megakaryozyten die Anzahl der entsprechenden Fälle im Kollektiv fiel. Der Mittelwert der Verteilung lag bei 1,462, der Median bei <0,001. Meg. positiv Anzahl der Anteil an allen Meg. positiv Anzahl der Anteil an allen in % Fälle (n) Fällen (%) in % Fälle (n) Fällen (%) , , , , , , , , , , , , , , ,3 Gesamt Tab Unterteilung der Fälle des Kollektivs anhand des Anteils ihrer CD34 + Megakaryozyten. 228 der 303 Fälle enthielten keinen CD34 + Megakaryozyten, der Anteil an CD34 + Megakaryozyten in den restlichen 61 Fällen variierte zwischen 1,7% und 38,0%. 64
65 Abb Anzahl der Fälle im Kollektiv mit jeweils gleichem Anteil an CD34 + Megakaryozyten. Aufgrund des errechneten Medians von <0,001 war für die weitere statistische Analyse eine Einteilung der Fälle in Fälle ohne CD34 + Megakaryozyten und Fälle mit CD34 + Megakaryozyten sinnvoll (Tabelle 3.8.). Anzahl der Fälle (n) Anteil an allen Fällen (%) Fälle ohne CD34 + Megakaryozyten ,2 Fälle mit CD34 + Megakaryozyten 75 24,8 Gesamt ,0 Tab Anzahl der Fälle im Kollektiv ohne/mit megakaryozytärer CD34-Expression. Von den insgesamt 303 Fällen im Kollektiv enthielten 228 Fälle keinen CD34 + Megakaryozyten, in 75 Fällen exprimierte mindestens ein Megakaryozyt CD34. Um eine megakaryozytäre CD34-Expression als diagnostisch hilfreichen Marker validieren zu können, wurde anschließend die Verteilung der Fälle mit megakaryozytärer CD34-Expression in Versuchs- und Kontrollgruppe untersucht (Tabelle 3.9.). Dabei konnte festgestellt werden, dass sich die Wahrscheinlichkeit des Auftretens dieser Fälle in den beiden Gruppen signifikant voneinander unterschied. Die exakte 2-seitige Signifikanz lag nach einem Chi- Quadrat-Test nach Fischer bei p=0,
66 Kontrollgruppe Versuchsgruppe Gesamt Fälle ohne CD34 + Megakaryozyten 38,9% 3,3% 75,2% Fälle mit CD34 + Megakaryozyten 7,6% 17,2% 24,8% Gesamt 46,5% 53,5% 100% Tab Anteil an Fällen ohne/mit megakaryozytärer CD34-Expression in Kontroll- und Versuchsgruppe. 24,8% aller Fälle enthielten mindestens einen CD34 + Megakaryozyten. Hierbei fällt auf, dass der Anteil an Fällen mit CD34 + Megakaryozyten in der Kontrollgruppe (7,6%) im Vergleich zu dem Anteil an Fällen mit CD34 + Megakaryozyten in der Versuchsgruppe (17,2%) statistisch signifikant geringer ausfiel. In der Versuchsgruppe enthielten besonders die Gruppen der MPN und der MDS vermehrt Fälle mit CD34 + Megakaryozyten (Abbildung 3.10.). Die exakte 2-seitige Signifikanz lag nach einem Chi-Quadrat-Test nach Fischer bei p=0,014. Abb Anteil an Fällen ohne/mit megakaryozytärer CD34-Expression in den einzelnen Hauptgruppen. Die Gruppe der MPN und die Gruppe der MDS enthielten vermehrt Fälle mit CD34 + Megakaryozyten (1 Reaktive Veränderungen im Knochenmark; 2 Malignominfiltrate im Knochenmark; 3 Myeloproliferative Neoplasien; 4 Myelodysplastische Syndrome; 5 MPN/MDS). 66
67 Insgesamt enthielten 36% der MPN-Fälle [7/11 Fälle mit CML (64%), 2/18 Fälle mit PV (11%), 7/16 Fälle mit PMF (43%), 3/14 Fälle mit ET (21%) und 6/10 Fälle mit MPN,U (60%)], 30% der MDS-Fälle [4/9 Fälle mit RA (44%), 2/12 Fälle mit RARS (16%), 5/18 Fälle mit RCMD (27%), 2/4 Fälle mit RCMD-RS (50%), 6/16 Fälle mit RAEB-1 (38%), 3/12 Fälle mit RAEB-2 (25%) und 2/7 Fälle mit MDS 5q- (29%)] sowie 21% der MPN/MDS-Fälle [3/14 Fälle mit CMML (21%)] mindestens einen CD34 + Megakaryozyten. Anschließend wurde der Anteil an CD34 + Megakaryozyten innerhalb eines Falls in den jeweiligen Hauptgruppen untersucht (Abbildung 3.11.). Hierbei zeigte sich erneut, dass Fälle mit CD34 + Megakaryozyten in allen Hauptgruppen des Kollektivs auftraten. Auffällig war jedoch, dass Fälle mit mehr als 5-10% an CD34 + Megakaryozyten ausschließlich in den Hauptgruppen der MPN und der MDS zu finden waren. Die asymptotische Signifikanz lag nach einem Kruskal-Wallis-Test bei p=0,002. Abb Anteil an CD34 + Megakaryozyten (Megakaryozyten positiv in %) innerhalb eines Falls in den jeweiligen Hauptgruppen. Fälle mit mehr als 5-10% an CD34 + Megakaryozyten waren ausschließlich in den Hauptgruppen der MPN und der MDS zu finden (1 Reaktive Veränderungen im Knochenmark; 2 Malignominfiltrate im Knochenmark; 3 Myeloproliferative Neoplasien; 4 Myelodysplastische Syndrome; 5 MPN/MDS). 67
68 In einer weiteren Untersuchung sollte geklärt werden, ob sich ein Fall mit CD34 + Megakaryozyten in der Knochenmarkbiopsie einer spezifischen Erkrankungsgruppe zuordnen lässt, wenn zwei Erkrankungsgruppen miteinander verglichen werden. Dazu wurde in den jeweiligen Hauptgruppen der Anteil an CD34 + Megakaryozyten innerhalb eines Falls bestimmt. Anschließend wurden die Hauptgruppen untereinander verglichen. Es zeigte sich, dass sich die einzelnen Hauptgruppen weder innerhalb der Versuchsgruppe, noch innerhalb der Kontrollgruppe voneinander unterschieden. Die Gruppen der MPN und der MDS unterschieden sich jedoch deutlich von den einzelnen Gruppen der Kontrollgruppe. Die Gruppe der MPN/MDS unterschied sich weder von den einzelnen Gruppen der Kontrollgruppe, noch von den einzelnen Gruppen der Versuchsgruppe (Tabelle 3.10). Hauptgruppen Exakte Signifikanz (2-seitig) 1 und 2 p= 0,319 1 und 3 p= 0,005 1 und 4 p= 0,043 1 und 5 p= 0,729 2 und 3 p< 0,001 2 und 4 p= 0,005 2 und 5 p= 0,257 3 und 4 p= 0,457 3 und 5 p= 0,263 4 und 5 p= 0,480 Tab Vergleich zweier Hauptgruppen anhand des Anteils an CD34 + Megakaryozyten innerhalb eines Falls. Die linke Spalte nennt die jeweiligen Hauptgruppen, welche miteinander verglichen wurden. Die rechte Spalte zeigt die jeweilige statistisch exakte 2-seitige Signifikanz nach einem nichtparametrischen Mann-Whitney-Test (1 Reaktive Veränderungen im Knochenmark; 2 Malignominfiltrate im Knochenmark; 3 Myeloproliferative Neoplasien; 4 Myelodysplastische Syndrome; 5 MPN/MDS). 68
69 3.4. Auswertung der Laborparamter Bei der Analyse der Laborparameter zeigte sich, dass sich die Hauptgruppen in jedem der untersuchten Parameter statistisch signifikant voneinander unterschieden (Tabelle 3.11.). Hämoglobin MCV Leukozyten Thrombozyten Asymptotische Signifikanz <0,001 <0,001 <0,001 <0,001 Tab Die asymptotische Signifikanz nach einem Kruskal-Wallis-Test bei Vergleich der Laborparameter zwischen den einzelnen Hauptgruppen. Für die einzelnen Hauptgruppen der Versuchsgruppe wurden weiterhin die mittleren Thrombozytenzahlen errechnet (Tabelle 3.12.). Diese unterschieden sich zwischen den Hauptgruppen erwartungsgemäß signifikant. Jedoch zeigte sich in den jeweiligen Hauptgruppen kein Unterschied zwischen Fällen mit CD34 + Megakaryozyten in der Knochenmarkbiopsie und Fällen ohne CD34 + Megakaryozyten in der Knochenmarkbiopsie. Die entsprechenden p-werte lagen nach einem Mann-Whitney-Test für die Gruppe der MPN bei p=0,720 und für die Gruppe der MDS bei p=0,670. Gruppe Mittlere Thrombozytenzahl der Fälle mit CD34 + Megakaryozyten (n) Mittlere Thrombozytenzahl der Fälle ohne CD34 + Megakaryozyten (n) MPN MDS MPN/MDS Tab Vergleich der Thrombozytenzahlen in den jeweiligen Hauptgruppen zwischen Fällen mit/ohne megakaryozytärer CD34-Expression. 69
70 3.5. Auswertung der Überlebenszeiten Überlebenszeiten in Abhängigkeit von der Erkrankungsentität Bei jenen 61 Patienten der Versuchsgruppe, für welche vollständige Follow-Up Daten erhoben werden konnten wurde anschließend die weitere Überlebensdauer ermittelt. Das mittlere Überleben aller Patienten betrug innerhalb des Überwachungszeitraums 36 Monate. Das mittlere Überleben der MPN-Patienten betrug dabei 39 Monate, jenes der MPN/MDS- Patienten 36 Monate, jenes der MDS-Patienten 30 Monate. Verglich man die Überlebenszeiten der Patienten in den einzelnen Hauptgruppen, so zeigte sich eine Tendenz zu einem kürzeren Überleben der MDS-Patienten (Abbildung 3.12.). Der entsprechende p-wert lag nach einem Log-Rank (Mantel-Cox) Test bei 0,078. Wendete man den Wilcoxon-Gehan-Test an, welcher Ereignisse am Anfang und am Ende des Überwachungszeitraums schwächer wertet, so zeigte sich für die jeweiligen Gruppen ein statistisch signifikanter Unterschied in der Dauer des weiteren Überlebens (p=0,028). Es ist folglich anzunehmen, dass die ermittelten mittleren Überlebenszeiten die jeweilige Prognose der Erkrankungsgruppen reflektieren [Swerdlow et al.]. Abb Kaplan-Meyer Kurve des kumulierten Überlebens für die Patienten der Versuchsgruppe in Abhängigkeit von der Erkrankungsentität (blaue Kurve/3 Myeloproliferative Neoplasien; grüne Kurve/4 Myelodysplastische Syndrome; graue Kurve/5 MPN/MDS). 70
71 Überlebenszeiten in Abhängigkeit von der megakaryozytären CD34-Expression Um eine Aussage über die Eignung des CD34-Antigens als prognostischen Marker für das weitere Überleben der Patienten machen zu können, wurden anschließend diejenigen Patienten aus der Gruppe der myeloischen Neoplasien, welche in ihrer Knochenmarkbiopsie eine megakaryozytäre CD34-Expression aufwiesen mit denjenigen Patienten, welche in ihrer Knochenmarkbiopsie keine megakaryozytäre CD34-Expression aufwiesen verglichen, zunächst ohne Berücksichtigung der Erkrankungsentität (Tabelle und Abbildung 3.13.). Zwischen diesen beiden Gruppen konnte erwartungsgemäß kein signifikanter Unterschied in der Überlebensdauer festgestellt werden. Der entsprechende p-wert lag nach einem Log Rank (Mantel-Cox) Test bei 0,457. Gesamtzahl (n) Anzahl der verstorbenen Patienten (n) Anzahl der überlebenden Patienten (n) Fälle ohne CD34 + Megakaryozyten Fälle mit CD34 + Megakaryozyten Gesamt (n) Tab Anzahl der verstorbenen/überlebenden Patienten in der Versuchsgruppe in Abhängigkeit von der megakaryozytären CD34-Expression. Ein statistisch signifikanter Unterschied war nicht auszumachen. 71
72 Abb Kaplan-Meyer Kurve des kumulierten Überlebens für die Patienten der Versuchsgruppe in Abhängigkeit von der megakaryozytären CD34-Expression. In die Statistik gingen diejenigen Patienten als Sterbefälle ein, welche vor dem verstarben, alle anderen wurden als Überlebende gewertet (- zensiert). Ein statistisch signifikanter Unterschied zwischen Fällen ohne CD34 + Megakaryozyten (blaue Kurve) und Fällen mit CD34 + Megakaryozyten (grüne Kurve) war nicht auszumachen. Wurden in der statistischen Auswertung nur diejenigen Patienten, welche an der bei ihnen diagnostizierten myeloischen Neoplasie verstarben als Verstorbene gewertet, so war wiederum kein statistisch signifikanter Unterschied in der Überlebensdauer auszumachen. Der entsprechende p-wert lag nach einem Log-Rank (Mantel-Cox) Test bei 0,375 (Tabelle und Abbildung 3.14.). Gesamtzahl (n) Anzahl der verstorbenen Patienten (n) Anzahl der überlebenden Patienten (n) Fälle ohne CD Megakaryozyten Fälle mit CD Megakaryozyten Gesamt (n) Tab Anzahl der verstorbenen/überlebenden Patienten in der Versuchsgruppe in Abhängigkeit von der megakaryozytären CD34-Expression. Nur diejenigen Patienten wurden als Verstorbene gewertet, welche an der bei ihnen diagnostizierten myeloischen Neoplasie verstarben. Ein statistisch signifikanter Unterschied war nicht auszumachen. 72
73 Abb Kaplan-Meyer Kurve des kumulierten Überlebens für Patienten der Versuchsgruppe in Abhängigkeit von der megakaryozytären CD34-Expression. Nur diejenigen Patienten wurden als Verstorbene gewertet, welche an der bei ihnen diagnostizierten myeloischen Neoplasie verstarben. In die Statistik gingen diejenigen Patienten als Sterbefälle ein, welche vor dem verstarben, alle anderen wurden als Überlebende gewertet (-zensiert). Ein statistisch signifikanter Unterschied zwischen Fällen ohne CD34 + Megakaryozyten (blaue Kurve) und Fällen mit CD34 + Megakaryozyten (grüne Kurve) war nicht auszumachen. Wurden in der Auswertung nur Patienten mit MPN betrachtet, so war kein statistisch signifikanter Unterschied in der Überlebensdauer zwischen Fällen ohne CD34 + Megakaryozyten und Fällen mit CD34 + Megakaryozyten auszumachen. Der entsprechende p-wert lag nach einem Log-Rank (Mantel-Cox) Test bei 0,111 (Tabelle und Abbildung 3.15.). Gesamtzahl (n) Anzahl der verstorbenen Patienten (n) Anzahl der überlebenden Patienten (n) Fälle ohne CD34 + Megakaryozyten Fälle mit CD34 + Megakaryozyten Gesamt (n) Tab Anzahl der verstorbenen/überlebenden MPN-Patienten in Abhängigkeit von der megakaryozytären CD34-Expression. Ein statistisch signifikanter Unterschied war nicht auszumachen. 73
Myelodysplastisches Syndrom
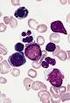 Myelodysplastisches Syndrom Diagnostik in 2014 Markus Radsak 25. Juni 2014 IIII. Medizinische Klinik und Poliklinik Mainzer Update MDS und AML Mit freundlicher Unterstützung von: 500,00 Im Rahmen eines
Myelodysplastisches Syndrom Diagnostik in 2014 Markus Radsak 25. Juni 2014 IIII. Medizinische Klinik und Poliklinik Mainzer Update MDS und AML Mit freundlicher Unterstützung von: 500,00 Im Rahmen eines
Forschungsprofil Molekularpathologie und Phänotypen der myeloproliferative Neoplasien
 Forschungsprofil Molekularpathologie und Phänotypen der myeloproliferative Neoplasien Der erste Schritt zur Identifizierung des molekularen Pathomechanismus bei myeloproliferativen Neoplasien (MPN) wurde
Forschungsprofil Molekularpathologie und Phänotypen der myeloproliferative Neoplasien Der erste Schritt zur Identifizierung des molekularen Pathomechanismus bei myeloproliferativen Neoplasien (MPN) wurde
Chronische Myeloproliferative Erkrankungen (CMPE)
 Chronische Myeloproliferative Erkrankungen (CMPE) Leitlinie Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen Herausgeber DGHO Deutsche Gesellschaft
Chronische Myeloproliferative Erkrankungen (CMPE) Leitlinie Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen Herausgeber DGHO Deutsche Gesellschaft
Myeloproliferative Neoplasien. Jakob R Passweg Chefarzt Klinik Hämatologie
 Myeloproliferative Neoplasien Jakob R Passweg Chefarzt Klinik Hämatologie Myeloproliferative Neoplasien (MPN) Polycythämie vera (PV) Essentielle Thrombozytose (ET) Osteo-Myelofibrose (OMF) Chronische Myeloische
Myeloproliferative Neoplasien Jakob R Passweg Chefarzt Klinik Hämatologie Myeloproliferative Neoplasien (MPN) Polycythämie vera (PV) Essentielle Thrombozytose (ET) Osteo-Myelofibrose (OMF) Chronische Myeloische
Referat Blut Teil 3: Leukämien
 n 1. Definition Bei einer handelt es sich um eine bösartige (maligne) Erkrankung der weißen Blutkörperchen, bei der es zu einer qualitativen und meist auch quantitativen Veränderung der Leukozyten kommt.
n 1. Definition Bei einer handelt es sich um eine bösartige (maligne) Erkrankung der weißen Blutkörperchen, bei der es zu einer qualitativen und meist auch quantitativen Veränderung der Leukozyten kommt.
Eosinophilie. Zytologie. Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV
 Eosinophilie Zytologie Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV Eosinophilie (> 500 /µl), lutausstrich, Papp. Drei morphologisch unauffällige eosinophile Granulozyten mit
Eosinophilie Zytologie Prof. Dr. med. Roland Fuchs Dr. med. Stefan Wilop Medizinische Klinik IV Eosinophilie (> 500 /µl), lutausstrich, Papp. Drei morphologisch unauffällige eosinophile Granulozyten mit
Der Fall des Halbjahres: Thrombozytose bei essenzieller Thrombozythämie (ET)
 Der Fall des Halbjahres: Thrombozytose bei essenzieller Thrombozythämie (ET) Xtra Vol. 16.1 2012 Nr. 5 Der Fall des Halbjahres zeigt Ihnen wieder ein Fallbeispiel aus dem XE-5000 Case Manager. Der erste
Der Fall des Halbjahres: Thrombozytose bei essenzieller Thrombozythämie (ET) Xtra Vol. 16.1 2012 Nr. 5 Der Fall des Halbjahres zeigt Ihnen wieder ein Fallbeispiel aus dem XE-5000 Case Manager. Der erste
Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML
 Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML Von Priv.-Doz. Dr. R. Liersch Gemeinschaftspraxis für Hämatologie und Onkologie, Münster Innere Medizin III (Hämatologie/Onkologie)Clemenshospital
Hämatologische Erkrankungen - Neue Behandlungsmöglichkeiten bei CLL / CML Von Priv.-Doz. Dr. R. Liersch Gemeinschaftspraxis für Hämatologie und Onkologie, Münster Innere Medizin III (Hämatologie/Onkologie)Clemenshospital
Fragen-Aufbaukurs Wilsede 2007
 Fragen-Aufbaukurs Wilsede 2007 1.) Bei welcher der aufgeführten Erkrankungen spielen vaso-okklusive Komplikationen eine wesentliche Rolle? A - Alpha-Thalassämie, Majorform B - Beta-Thalassämie, Majorform
Fragen-Aufbaukurs Wilsede 2007 1.) Bei welcher der aufgeführten Erkrankungen spielen vaso-okklusive Komplikationen eine wesentliche Rolle? A - Alpha-Thalassämie, Majorform B - Beta-Thalassämie, Majorform
Was ist denn nun das Hauptproblem AA, PNH, MDS oder?
 Was ist denn nun das Hauptproblem AA, PNH, MDS oder? Dr. med. Sixten Körper Abteilung für Blutspende, Apherese und Hämotherapie Institut für Klinische Transfusionsmedizin und Immungenetik Ulm gemeinnützige
Was ist denn nun das Hauptproblem AA, PNH, MDS oder? Dr. med. Sixten Körper Abteilung für Blutspende, Apherese und Hämotherapie Institut für Klinische Transfusionsmedizin und Immungenetik Ulm gemeinnützige
quer durch s rote Blutbild
 Eine Reise quer durch s rote Blutbild Interpretation und Differentialdiagnosen Dr. Elisabeth Dietl Abteilung Hämatologie, Onkologie und Palliativmedizin Systemerkrankungen Tumor-/Infekterkrankung, Niereninsuffizienz,
Eine Reise quer durch s rote Blutbild Interpretation und Differentialdiagnosen Dr. Elisabeth Dietl Abteilung Hämatologie, Onkologie und Palliativmedizin Systemerkrankungen Tumor-/Infekterkrankung, Niereninsuffizienz,
Leukämie. weißes Blut, Blutkrebs. bösartige Erkrankung der weißen Blutkörperchen
 Leukämie weißes Blut, Blutkrebs bösartige Erkrankung der weißen Blutkörperchen Genetische Veränderungen der Stammzellen durch folgende Risikofaktoren: radioaktive Strahlung (Hiroshima und Nagasaki) Röntgenstrahlung
Leukämie weißes Blut, Blutkrebs bösartige Erkrankung der weißen Blutkörperchen Genetische Veränderungen der Stammzellen durch folgende Risikofaktoren: radioaktive Strahlung (Hiroshima und Nagasaki) Röntgenstrahlung
Auswirkungen der Neuen WHO- Klassifikation auf die histologische Knochenmarksdiagnostik
 46. Symposion der Deutschen Abteilung der IAP e. V. vom 26. 28. Februar 2010 in Bonn Histologisches Schnittseminar: Auswirkungen der Neuen WHO- Klassifikation auf die histologische Knochenmarksdiagnostik
46. Symposion der Deutschen Abteilung der IAP e. V. vom 26. 28. Februar 2010 in Bonn Histologisches Schnittseminar: Auswirkungen der Neuen WHO- Klassifikation auf die histologische Knochenmarksdiagnostik
Einfluss der Lymphombehandlung auf das Blut. Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern
 Einfluss der Lymphombehandlung auf das Blut Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern Zusammensetzung des Blutes Blutgefäss Erythrozyten Blutkörperchen (Zellen) Blutflüssigkeit (Plasma)
Einfluss der Lymphombehandlung auf das Blut Michael Gregor Abteilung für Hämatologie Kantonsspital Luzern Zusammensetzung des Blutes Blutgefäss Erythrozyten Blutkörperchen (Zellen) Blutflüssigkeit (Plasma)
WHO-Klassifizierung hämatologische Neoplasien 2008. Catherine Mauderli ;medi Bildungsgang medizinisches Labor Max-Daetwyler-Platz 2 3014 Bern
 hämatologische Neoplasien 2008 Catherine Mauderli ;medi Bildungsgang medizinisches Labor Max-Daetwyler-Platz 2 3014 Bern 2 Programm WHO-Klassifizierung Grundlagen von Klassifikationen Definition der WHO-Klassifikation
hämatologische Neoplasien 2008 Catherine Mauderli ;medi Bildungsgang medizinisches Labor Max-Daetwyler-Platz 2 3014 Bern 2 Programm WHO-Klassifizierung Grundlagen von Klassifikationen Definition der WHO-Klassifikation
MPN PATIENTENTAG AM KLINIKUM RECHTS DER ISAR
 MPN PATIENTENTAG AM KLINIKUM RECHTS DER ISAR PATIENTENINFORMATION IM FOKUS: - DIE MPN ERKRANKUNGEN - VERSORGUNGSSTRUKTUREN AM KLINIKUM RD ISAR GLIEDERUNG Was sind Myeloproliferative Neoplasien (MPN)? Wie
MPN PATIENTENTAG AM KLINIKUM RECHTS DER ISAR PATIENTENINFORMATION IM FOKUS: - DIE MPN ERKRANKUNGEN - VERSORGUNGSSTRUKTUREN AM KLINIKUM RD ISAR GLIEDERUNG Was sind Myeloproliferative Neoplasien (MPN)? Wie
im 144. Durchgang des Rundversuches Hämatologie wurden folgende Ergebnisse erzielt:
 Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
Österreichische Gesellschaft für Qualitätssicherung und Standardisierung medizinisch - diagnostischer Untersuchungen 1090 Wien, Hörlgasse 18/5; Tel: +43 1 319 88 95; Fax: +43 1 319 88 97 office@oequasta.at
Systemische Mastozytose
 Systemische Mastozytose auf dem 5. Aachener Patienten- und Angehörigensymposium 2014 Aachen, 17.05.2014 Karla Bennemann & Jens Panse Blutbildung dynamischer Prozess täglich > 7 x 10 9 Blutzellen pro kg
Systemische Mastozytose auf dem 5. Aachener Patienten- und Angehörigensymposium 2014 Aachen, 17.05.2014 Karla Bennemann & Jens Panse Blutbildung dynamischer Prozess täglich > 7 x 10 9 Blutzellen pro kg
Bildungausstrich HD
 Februar 2012 Bildungausstrich 11-11-HD Mit dem Ringversuch 11-11-HD hat das CSCQ den Teilnehmern kostenlos einen zusätzlichen Ausstrich zu Weiterbildungszwecken angeboten. Dieses Dokument entspricht dem
Februar 2012 Bildungausstrich 11-11-HD Mit dem Ringversuch 11-11-HD hat das CSCQ den Teilnehmern kostenlos einen zusätzlichen Ausstrich zu Weiterbildungszwecken angeboten. Dieses Dokument entspricht dem
Klassifikationssysteme und Stadieneinteilung hämatologischer Neoplasien
 Klassifikationssysteme und Stadieneinteilung hämatologischer Neoplasien WHO-Klassifikation myeloischer Neoplasien nach Harris NL et al, Mod Pathol 2000 Feb;13(2):193-207 Myeloproliferative Erkrankungen
Klassifikationssysteme und Stadieneinteilung hämatologischer Neoplasien WHO-Klassifikation myeloischer Neoplasien nach Harris NL et al, Mod Pathol 2000 Feb;13(2):193-207 Myeloproliferative Erkrankungen
Chronische myeloproliferative Erkrankungen
 Chronische myeloproliferative Erkrankungen Weiterbildung Labmed 13.9.2007 Dr. Luzius Schmid Leitender Arzt für Hämatologie, IKCH luzius.schmid@ikch.ch Seite 1 13.09.2007 Allgemeines Seite 2 13.09.2007
Chronische myeloproliferative Erkrankungen Weiterbildung Labmed 13.9.2007 Dr. Luzius Schmid Leitender Arzt für Hämatologie, IKCH luzius.schmid@ikch.ch Seite 1 13.09.2007 Allgemeines Seite 2 13.09.2007
Klinische Chemie und Hämatologie Vorlesung: Allgemeine & Spezielle Hämatologie
 Klinische Chemie und Hämatologie Vorlesung: Allgemeine & Spezielle Hämatologie Prof. Dr. med. Th. Büchner Medizinische Klinik und Poliklinik - Innere Medizin A - Universitätsklinikum Münster Albert-Schweitzer-Straße
Klinische Chemie und Hämatologie Vorlesung: Allgemeine & Spezielle Hämatologie Prof. Dr. med. Th. Büchner Medizinische Klinik und Poliklinik - Innere Medizin A - Universitätsklinikum Münster Albert-Schweitzer-Straße
Myeloproliferative Neoplasien. Jakob R Passweg Chefarzt Klinik Hämatologie
 Myeloproliferative Neoplasien Jakob R Passweg Chefarzt Klinik Hämatologie Chronische Myeloische Erkrankungen Myeloproliferative Neoplasien (MPN) Polycythämie vera (PV) Essentielle Thrombozytose (ET) Osteo-Myelofibrose
Myeloproliferative Neoplasien Jakob R Passweg Chefarzt Klinik Hämatologie Chronische Myeloische Erkrankungen Myeloproliferative Neoplasien (MPN) Polycythämie vera (PV) Essentielle Thrombozytose (ET) Osteo-Myelofibrose
Klinische Chemie und Laboratoriumsdiagnostik Vorlesung: Allgemeine Hämatologie
 Klinische Chemie und Laboratoriumsdiagnostik Vorlesung: Allgemeine Hämatologie Priv.-Doz. Dr. med. Torsten Kessler Universitätsklinikum Münster Medizinische Klinik A Albert-Schweitzer-Campus 1 48149 Münster
Klinische Chemie und Laboratoriumsdiagnostik Vorlesung: Allgemeine Hämatologie Priv.-Doz. Dr. med. Torsten Kessler Universitätsklinikum Münster Medizinische Klinik A Albert-Schweitzer-Campus 1 48149 Münster
Niedrigrisiko MDS Therapeutische Optionen Wolf-Karsten Hofmann
 Niedrigrisiko MDS Therapeutische Optionen Wolf-Karsten Hofmann III. Medizinische Klinik, Universitätsmedizin Mannheim Therapie des Niedrigrisiko-MDS Heilung Nebenwirkungen Lebensqualität WHO Klassifikation
Niedrigrisiko MDS Therapeutische Optionen Wolf-Karsten Hofmann III. Medizinische Klinik, Universitätsmedizin Mannheim Therapie des Niedrigrisiko-MDS Heilung Nebenwirkungen Lebensqualität WHO Klassifikation
Akute Leukämien und das Myelodysplastische Syndrom
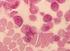 Akute Leukämien und das Myelodysplastische Syndrom Der Begriff Leukämie kommt aus dem Griechischen und bedeutet weißes Blut. Der Name rührt daher, dass bei Patienten mit Leukämie sehr viele weiße Blutzellen
Akute Leukämien und das Myelodysplastische Syndrom Der Begriff Leukämie kommt aus dem Griechischen und bedeutet weißes Blut. Der Name rührt daher, dass bei Patienten mit Leukämie sehr viele weiße Blutzellen
Neues vom ASH Rudolf Weide Koblenz. Chronisch Myeloische Leukämie
 Neues vom ASH 2016 Rudolf Weide Koblenz Chronisch Myeloische Leukämie 1 2 3 -Paper 627: -Dasatinib stimuliert die NK-Zellfunktion -Dasatinib induziert einen reiferen Immunphänotyp -Interferon induziert
Neues vom ASH 2016 Rudolf Weide Koblenz Chronisch Myeloische Leukämie 1 2 3 -Paper 627: -Dasatinib stimuliert die NK-Zellfunktion -Dasatinib induziert einen reiferen Immunphänotyp -Interferon induziert
Therapie von MDS mit Azactidin
 Therapie von MDS mit Azactidin 14 Fälle aus der Praxis Bearbeitet von Aristoteles Giagounidis 1. Auflage 21. Taschenbuch. 48 S. Paperback ISBN 978 3 13 153811 6 Format (B x L): 17 x 24 cm Weitere Fachgebiete
Therapie von MDS mit Azactidin 14 Fälle aus der Praxis Bearbeitet von Aristoteles Giagounidis 1. Auflage 21. Taschenbuch. 48 S. Paperback ISBN 978 3 13 153811 6 Format (B x L): 17 x 24 cm Weitere Fachgebiete
Akute Myelomonozytäre Leukämie
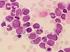 Akute Myelomonozytäre Leukämie Subtyp M4 o inv (16) Zytologie Prof. Dr. med. Roland Fuchs PD Dr. med. Oliver Galm Medizinische Klinik IV Zytogenetik FISH-Diagnostik Prof. Dr. med. Detlef Haase Dr. Katayoon
Akute Myelomonozytäre Leukämie Subtyp M4 o inv (16) Zytologie Prof. Dr. med. Roland Fuchs PD Dr. med. Oliver Galm Medizinische Klinik IV Zytogenetik FISH-Diagnostik Prof. Dr. med. Detlef Haase Dr. Katayoon
Ein Überblick ONKOTROP 11/2012
 Ein Überblick ONKOTROP 11/2012 Einteilung der cmpe Polycythaemia vera (PV) essentielle Thrombozythämie (ET) primäre Myelofibrose (PMF) chronische Eosinophilenleukämie Mastozytose Unklassifizierbare myeloproliferative
Ein Überblick ONKOTROP 11/2012 Einteilung der cmpe Polycythaemia vera (PV) essentielle Thrombozythämie (ET) primäre Myelofibrose (PMF) chronische Eosinophilenleukämie Mastozytose Unklassifizierbare myeloproliferative
Bluterkrankungen bei Menschen mit Down-Syndrom
 Bluterkrankungen bei Menschen mit Down-Syndrom oder Besonderheiten des Blutbildes bei Trisomie 21 Prim. Univ.-Prof. Dr. Milen Minkov Facharzt für Kinder- und Jugendheilkunde Pädiatrische Hämatologie und
Bluterkrankungen bei Menschen mit Down-Syndrom oder Besonderheiten des Blutbildes bei Trisomie 21 Prim. Univ.-Prof. Dr. Milen Minkov Facharzt für Kinder- und Jugendheilkunde Pädiatrische Hämatologie und
Aus der Klinik für Hämatologie, Onkologie. und Klinische Immunologie der Heinrich-Heine-Universität Düsseldorf. Direktor: Univ.-Prof. Dr. med. R.
 Aus der Klinik für Hämatologie, Onkologie und Klinische Immunologie der Heinrich-Heine-Universität Düsseldorf Direktor: Univ.-Prof. Dr. med. R. Haas Charakterisierung verschiender Typen der chronischen
Aus der Klinik für Hämatologie, Onkologie und Klinische Immunologie der Heinrich-Heine-Universität Düsseldorf Direktor: Univ.-Prof. Dr. med. R. Haas Charakterisierung verschiender Typen der chronischen
Die zufällige Leukämie
 Die zufällige Leukämie Elisabeth Schreier Landes-Frauen und Kinderklinik Linz Sysmex Expertentag: Pädiatrische Hämatologie am 15. März 2012 Landes-Frauen und Kinderklinik Linz Sehr bekannte Kinderonkologie
Die zufällige Leukämie Elisabeth Schreier Landes-Frauen und Kinderklinik Linz Sysmex Expertentag: Pädiatrische Hämatologie am 15. März 2012 Landes-Frauen und Kinderklinik Linz Sehr bekannte Kinderonkologie
Hämatopoese TITAN. Dezember 2005 S.Gärtner
 Hämatopoese Alle reifen Blutzellen stammen von pluripotenten hämatopoetischen Stammzellen ab, die sich von Geburt an im Knochenmark, in der Leber und der Milz befinden. Hämatopoese Die hämapoetischen Stammzelle
Hämatopoese Alle reifen Blutzellen stammen von pluripotenten hämatopoetischen Stammzellen ab, die sich von Geburt an im Knochenmark, in der Leber und der Milz befinden. Hämatopoese Die hämapoetischen Stammzelle
Direktor: Professor Dr. med. R. Haas. Untersuchungen zu Todesursachen von Patienten mit Myelodysplastischen Syndromen.
 Aus der Klinik für Hämatologie, Onkologie und Klinische Immunologie der Heinrich-Heine-Universität Düsseldorf Direktor: Professor Dr. med. R. Haas Untersuchungen zu Todesursachen von Patienten mit Myelodysplastischen
Aus der Klinik für Hämatologie, Onkologie und Klinische Immunologie der Heinrich-Heine-Universität Düsseldorf Direktor: Professor Dr. med. R. Haas Untersuchungen zu Todesursachen von Patienten mit Myelodysplastischen
Mikroskopie in Vollendung
 Mikroskopie in Vollendung Labmed Schweiz / Suisse / Svizzera Ambassadoren-Weiterbildung 2012 Henk Jansen Sysmex Europe GMBH Manuelle Blutausstrich Prozedur Platzieren Sie einen kleinen Tropfen des venösen
Mikroskopie in Vollendung Labmed Schweiz / Suisse / Svizzera Ambassadoren-Weiterbildung 2012 Henk Jansen Sysmex Europe GMBH Manuelle Blutausstrich Prozedur Platzieren Sie einen kleinen Tropfen des venösen
MYELODYSPLASTISCHES SYNDROM DR. VERONIKA PAPP
 MYELODYSPLASTISCHES SYNDROM DR. VERONIKA PAPP MDS; PRÄLEUKÄMIEN heterogene Gruppe klonaler neoplastischer Erkrankungen der hämatopoetischen Zellen qualitativ und quantitativ veränderte Zellproliferation
MYELODYSPLASTISCHES SYNDROM DR. VERONIKA PAPP MDS; PRÄLEUKÄMIEN heterogene Gruppe klonaler neoplastischer Erkrankungen der hämatopoetischen Zellen qualitativ und quantitativ veränderte Zellproliferation
Myelodysplastische Syndrome
 UPDATE: MYELODYSPLASTISCHE SYNDROME 37 Myelodysplastische Syndrome Katja Sockel und Uwe Platzbecker Nachdem die Myelodysplastischen Syndrome (MDS) noch vor einigen Jahren zu den seltenen hämatologischen
UPDATE: MYELODYSPLASTISCHE SYNDROME 37 Myelodysplastische Syndrome Katja Sockel und Uwe Platzbecker Nachdem die Myelodysplastischen Syndrome (MDS) noch vor einigen Jahren zu den seltenen hämatologischen
Stroma des roten Knochenmarks und der lymphatischen Organe. Zellen stehen über lange Fortsätze miteinander in Kontakt
 Stroma: - Retikulumzellen Stroma des roten s und der lymphatischen Organe Zellen stehen über lange Fortsätze miteinander in Kontakt weitmaschiges, dreidimensionales, interzelluläres Maschenwerk - fenestrierte
Stroma: - Retikulumzellen Stroma des roten s und der lymphatischen Organe Zellen stehen über lange Fortsätze miteinander in Kontakt weitmaschiges, dreidimensionales, interzelluläres Maschenwerk - fenestrierte
BEFUNDBEISPIEL DER XN-SERIE
 Nr. 06: Refraktäre Zytopenie mit multilineärer Dysplasie (RCMD) added value XN-DIFF added value PLT-F added value RET 1. KLINISCHER FALL Zwei Tage vor der hier dargestellten Blutuntersuchung suchte ein
Nr. 06: Refraktäre Zytopenie mit multilineärer Dysplasie (RCMD) added value XN-DIFF added value PLT-F added value RET 1. KLINISCHER FALL Zwei Tage vor der hier dargestellten Blutuntersuchung suchte ein
3.20 Leukämien. Kernaussagen
 148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
Medikamentöse Substanzen, die als mögliche Ursachen für die Entstehung einer Panzytopathie/ Panmyelopathie bzw. Panmyelophthise in Frage kommen
 Medikamentöse Substanzen, die als mögliche Ursachen für die Entstehung einer Panzytopathie/ Panmyelopathie bzw. Panmyelophthise in Frage kommen können M1- Leukämie : myeloblastisch ohne Reifung Akute
Medikamentöse Substanzen, die als mögliche Ursachen für die Entstehung einer Panzytopathie/ Panmyelopathie bzw. Panmyelophthise in Frage kommen können M1- Leukämie : myeloblastisch ohne Reifung Akute
Leukämie (CML) Was ist Chronische Myeloische Leukämie? Download. Published on Novartis Austria (https://www.novartis.at)
 Published on Novartis Austria (https://www.novartis.at) Home > Printer-friendly PDF > Leukämie (CML) Leukämie (CML) Was ist Chronische Myeloische Leukämie? Die chronische myeloische Leukämie (CML) ist
Published on Novartis Austria (https://www.novartis.at) Home > Printer-friendly PDF > Leukämie (CML) Leukämie (CML) Was ist Chronische Myeloische Leukämie? Die chronische myeloische Leukämie (CML) ist
Ergebnisbogen DF2/13 Differentialblutbild Mai 2013
 Ergebnisbogen DF2/13 Differentialblutbild Mai 2013 Zeichenerklärung: = 16. bis 84. Perzentile mit Median = auf Zählungen der Experten beruhender Toleranzbereich (TB) = Ihr Ergebnis/Beurteilung = richtige
Ergebnisbogen DF2/13 Differentialblutbild Mai 2013 Zeichenerklärung: = 16. bis 84. Perzentile mit Median = auf Zählungen der Experten beruhender Toleranzbereich (TB) = Ihr Ergebnis/Beurteilung = richtige
Forschungsbericht Institut für Pathologie MHH
 Forschungsbericht 2010 - Institut für Pathologie MHH Forschungsprofil Molekularpathologie und Phänotypen der myeloproliferative Neoplasien Der erste Schritt zur Identifizierung des molekularen Pathomechanismus
Forschungsbericht 2010 - Institut für Pathologie MHH Forschungsprofil Molekularpathologie und Phänotypen der myeloproliferative Neoplasien Der erste Schritt zur Identifizierung des molekularen Pathomechanismus
Erläuterungen zur 4. Änderungsverordnung zur VersMedV vom , in Kraft getreten zum Umsetzung im Schweb.
 Versorgungsamt Hamburg Fachliche Leitstelle FS 5138 Tel.: 428 63 3266 Erläuterungen zur 4. Änderungsverordnung zur VersMedV vom 28.10.2011, in Kraft getreten zum 05.11.2011 Umsetzung im Schweb.NET-Verfahren
Versorgungsamt Hamburg Fachliche Leitstelle FS 5138 Tel.: 428 63 3266 Erläuterungen zur 4. Änderungsverordnung zur VersMedV vom 28.10.2011, in Kraft getreten zum 05.11.2011 Umsetzung im Schweb.NET-Verfahren
Essenzielle Thrombozythämie, Polycythaemia Vera, Primäre Myelofibrose
 Essenzielle Thrombozythämie Polycythaemia Vera Primäre Myelofibrose Bundesverband der Selbsthilfeorganisationen zur Unterstützung von Erwachsenen mit Leukämien und Lymphomen e.v. Unter der Schirmherrschaft
Essenzielle Thrombozythämie Polycythaemia Vera Primäre Myelofibrose Bundesverband der Selbsthilfeorganisationen zur Unterstützung von Erwachsenen mit Leukämien und Lymphomen e.v. Unter der Schirmherrschaft
Chronische myeloische Leukämie. Chronische Phase
 Chronische myeloische Leukämie Chronische Phase Zytologie Prof. Dr. med. Roland Fuchs Prof. Dr. med. Tim Brümmendorf Medizinische Klinik IV Zytogenetik Molekulargenetik Prof. Dr. med. Detlef Haase Zentrum
Chronische myeloische Leukämie Chronische Phase Zytologie Prof. Dr. med. Roland Fuchs Prof. Dr. med. Tim Brümmendorf Medizinische Klinik IV Zytogenetik Molekulargenetik Prof. Dr. med. Detlef Haase Zentrum
3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome
 3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome Untersucht wurden insgesamt 26 Melanome, die zwischen 1991 und 1997 in der Universitätsklinik und Poliklinik für Dermatologie und Venerologie
3 Ergebnisse 3.1 Charakterisierung der untersuchten Melanome Untersucht wurden insgesamt 26 Melanome, die zwischen 1991 und 1997 in der Universitätsklinik und Poliklinik für Dermatologie und Venerologie
DISSERTATION. Zur Erlangung des akademischen Grades Doctor medicinae (Dr. med.)
 1 Aus der Medizinischen Klinik mit Schwerpunkt Hämatologie und Onkologie und dem Institut für Medizinische Genetik der Medizinischen Fakultät Charité Universitätsmedizin Berlin DISSERTATION Chromosomale
1 Aus der Medizinischen Klinik mit Schwerpunkt Hämatologie und Onkologie und dem Institut für Medizinische Genetik der Medizinischen Fakultät Charité Universitätsmedizin Berlin DISSERTATION Chromosomale
Diagnose und klinisches Management des MDS - mit oder ohne Zytogenetik?
 Diagnose und klinisches Management des MDS - mit oder ohne Zytogenetik? Detlef Haase Klinische Tumorzytogenetik, Abt. Hämatologie/Onkologie Universitätsmedizin, Georg-August-Universität Göttingen Jahrestagung
Diagnose und klinisches Management des MDS - mit oder ohne Zytogenetik? Detlef Haase Klinische Tumorzytogenetik, Abt. Hämatologie/Onkologie Universitätsmedizin, Georg-August-Universität Göttingen Jahrestagung
Anlage zur Akkreditierungsurkunde D-PL nach DIN EN ISO/IEC 17025:2005
 Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-13294-06-00 nach DIN EN ISO/IEC 17025:2005 Gültigkeitsdauer: 26.01.2017 bis 25.01.2022 Ausstellungsdatum: 26.01.2017 Urkundeninhaber:
Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-PL-13294-06-00 nach DIN EN ISO/IEC 17025:2005 Gültigkeitsdauer: 26.01.2017 bis 25.01.2022 Ausstellungsdatum: 26.01.2017 Urkundeninhaber:
III. Ergebnisteil CD8 CD4. III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut
 27 III. Ergebnisteil III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut Durch Anwendung des vorher schon im Material- und Methodenteil beschriebenen MACS-Systems konnten CD4 + bzw.
27 III. Ergebnisteil III.1. Separation von CD4 + und CD8 + T-Lymphozyten aus peripherem Blut Durch Anwendung des vorher schon im Material- und Methodenteil beschriebenen MACS-Systems konnten CD4 + bzw.
Chronische myeloische Leukämie
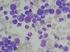 Chronische myeloische Leukämie Dr. med. Michaela Schwarz Medizinische Klinik m.s. Hämatologie/Onkologie U N I V E R S I T Ä T S M E D I Z I N B E R L I N Leukämien - Häufigkeit Akut Chronisch CML CLL Leukämie
Chronische myeloische Leukämie Dr. med. Michaela Schwarz Medizinische Klinik m.s. Hämatologie/Onkologie U N I V E R S I T Ä T S M E D I Z I N B E R L I N Leukämien - Häufigkeit Akut Chronisch CML CLL Leukämie
Ergebnisbogen DF4/14 Differentialblutbild Oktober 2014
 Ergebnisbogen DF4/14 Differentialblutbild Oktober 2014 S1 Zeichenerklärung: = 16. bis 84. Perzentile mit Median = auf Zählungen der Experten beruhender Toleranzbereich (TB) = Ihr Ergebnis/Beurteilung =
Ergebnisbogen DF4/14 Differentialblutbild Oktober 2014 S1 Zeichenerklärung: = 16. bis 84. Perzentile mit Median = auf Zählungen der Experten beruhender Toleranzbereich (TB) = Ihr Ergebnis/Beurteilung =
Untersuchung der differentiellen Genexpression mit DNA-Microarrays bei Akuter Lymphoblastischer Leukämie im Vergleich mit normalen B-Lymphozyten
 Untersuchung der differentiellen Genexpression mit DNA-Microarrays bei Akuter Lymphoblastischer Leukämie im Vergleich mit normalen B-Lymphozyten Dissertation zur Erlangung des akademischen Grades doctor
Untersuchung der differentiellen Genexpression mit DNA-Microarrays bei Akuter Lymphoblastischer Leukämie im Vergleich mit normalen B-Lymphozyten Dissertation zur Erlangung des akademischen Grades doctor
Pharmazeutische Biologie SS2011. Wie zielgerichtet sind Arzneimittel heute schon?
 Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Pharmazeutische Biologie SS2011 Wie zielgerichtet sind Arzneimittel heute schon? Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt am Main Dingermann@em.uni-frankfurt.de
Die verschiedenen Arten der Leukämie. Man unterscheidet vier Grundarten der Leukämie, die in zwei Gruppen aufgeteilt werden:
 Die Leukämien TEIL 1/4 Oft sprechen wir von der Leukämie im Singular. Diese hämatologische Krankheit existiert jedoch in verschiedenen Formen. Leukämien werden gemeinhin auch als Blutkrebs bezeichnet.
Die Leukämien TEIL 1/4 Oft sprechen wir von der Leukämie im Singular. Diese hämatologische Krankheit existiert jedoch in verschiedenen Formen. Leukämien werden gemeinhin auch als Blutkrebs bezeichnet.
Das Ende der Unsterblichkeit? Mitarbeiter des Ludwig Boltzmann Clusters Oncology (LB-CO) entdecken neue Zielstrukturen in Leukämischen Stammzellen
 Das Ende der Unsterblichkeit? Mitarbeiter des Ludwig Boltzmann Clusters Oncology (LB-CO) entdecken neue Zielstrukturen in Leukämischen Stammzellen Zusammenfassung: Tumor-Stammzellen zeichnen sich durch
Das Ende der Unsterblichkeit? Mitarbeiter des Ludwig Boltzmann Clusters Oncology (LB-CO) entdecken neue Zielstrukturen in Leukämischen Stammzellen Zusammenfassung: Tumor-Stammzellen zeichnen sich durch
Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr Bielefeld Ringversuchsleiter
 Ringversuch: DF1/14 im Monat: Februar 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 15.02.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Ringversuch: DF1/14 im Monat: Februar 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 15.02.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Reaktive Veränderungen und Anomalien. Weiterbildung Labmed 29.11.2007. Dr. Luzius Schmid. Leitender Arzt für Hämatologie, IKCH luzius.schmid@ikch.
 Reaktive Veränderungen und Anomalien Weiterbildung Labmed 29.11.2007 Dr. Luzius Schmid Leitender Arzt für Hämatologie, IKCH luzius.schmid@ikch.ch Allgemeines Hämopoietische Stamm - und Vorläuferzellen
Reaktive Veränderungen und Anomalien Weiterbildung Labmed 29.11.2007 Dr. Luzius Schmid Leitender Arzt für Hämatologie, IKCH luzius.schmid@ikch.ch Allgemeines Hämopoietische Stamm - und Vorläuferzellen
Städtisches Klinikum Braunschweig ggmbh IMIK - Labor S 2 Salzdahlumer Str Braunschweig Ringversuchsleiter
 Ringversuch: DF2/13 im Monat: Mai 2013 Teilnehmer-Nr.: 0001024 ausgestellt am: 11.05.13 Referenzinstitut für Bioanalytik Städtisches Klinikum Braunschweig ggmbh IMIK - Labor S 2 Salzdahlumer Str. 90 38126
Ringversuch: DF2/13 im Monat: Mai 2013 Teilnehmer-Nr.: 0001024 ausgestellt am: 11.05.13 Referenzinstitut für Bioanalytik Städtisches Klinikum Braunschweig ggmbh IMIK - Labor S 2 Salzdahlumer Str. 90 38126
Strahlenbiologische Grundlagen
 Strahlenbiologische Grundlagen Wolfgang-Ulrich MüllerM Häufigkeit von Tumoren im Kindesalter (auf der Basis der Jahre 1997-2006) (Quelle: Robert-Koch-Institut basierend auf den Daten des Deutschen Kinderkrebsregisters,
Strahlenbiologische Grundlagen Wolfgang-Ulrich MüllerM Häufigkeit von Tumoren im Kindesalter (auf der Basis der Jahre 1997-2006) (Quelle: Robert-Koch-Institut basierend auf den Daten des Deutschen Kinderkrebsregisters,
Aktuelle Aspekte der PARP-Inhibition: Wer profitiert, wer nicht?
 Ovarialkarzinom State of the Art AGO-Symposium Aktuelle Aspekte der PARP-Inhibition: Wer profitiert, wer nicht? Pauline Wimberger Klinik und Poliklinik für Gynäkologie und Geburtshilfe Technische Universität
Ovarialkarzinom State of the Art AGO-Symposium Aktuelle Aspekte der PARP-Inhibition: Wer profitiert, wer nicht? Pauline Wimberger Klinik und Poliklinik für Gynäkologie und Geburtshilfe Technische Universität
Akute Promyelozytenleukämie AML-M3
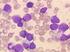 Akute Promyelozytenleukämie AML-M3 Zytologie Prof. Dr. med. Roland Fuchs PD Dr. med. Edgar Jost Medizinische Klinik IV Genetik Prof. Dr. med. Detlef Haase Zentrum Innere Medizin Göttingen AML M3. Knochenmark.
Akute Promyelozytenleukämie AML-M3 Zytologie Prof. Dr. med. Roland Fuchs PD Dr. med. Edgar Jost Medizinische Klinik IV Genetik Prof. Dr. med. Detlef Haase Zentrum Innere Medizin Göttingen AML M3. Knochenmark.
Gießener Kleintierabend Lymphknotenzytologie
 Klinikum Veterinärmedizin Klinik für Kleintiere klinische Laboratoriumsdiagnostik und Pathophysiologie Prof. Dr. A. Moritz Justus-Liebig-Universität Gießen Gießener Kleintierabend 12.11.2008 Lymphknotenzytologie
Klinikum Veterinärmedizin Klinik für Kleintiere klinische Laboratoriumsdiagnostik und Pathophysiologie Prof. Dr. A. Moritz Justus-Liebig-Universität Gießen Gießener Kleintierabend 12.11.2008 Lymphknotenzytologie
22. Onkologisches Symposium Große Fortschritte in der Leukämietherapie
 22. Onkologisches Symposium - 21.01.2017 Große Fortschritte in der Leukämietherapie Prof. Dr. Wolfgang Herr Klinik und Poliklinik für Innere Medizin III - Hämatologie und intern. Onkologie Leukämien (Patienten
22. Onkologisches Symposium - 21.01.2017 Große Fortschritte in der Leukämietherapie Prof. Dr. Wolfgang Herr Klinik und Poliklinik für Innere Medizin III - Hämatologie und intern. Onkologie Leukämien (Patienten
ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-C
 ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-C ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-Chromosom
ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-C ICLUSIG erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-Chromosom
135e. Ayalew Tefferi, Dan L. Longo Seltenere hämatologische Malignome. Für die deutsche Ausgabe Antonio Pezzutto
 135e Ayalew Tefferi, Dan L. Longo Seltenere hämatologische Malignome Für die deutsche Ausgabe Antonio Pezzutto Die häufigsten lymphatischen Neoplasien werden in Kapitel 134 besprochen, die myeloischen
135e Ayalew Tefferi, Dan L. Longo Seltenere hämatologische Malignome Für die deutsche Ausgabe Antonio Pezzutto Die häufigsten lymphatischen Neoplasien werden in Kapitel 134 besprochen, die myeloischen
Wir bestätigen Ihnen, dass Sie am Ringversuch für Differentialblutbild teilgenommen haben.
 Ringversuch: DF1/14 im Monat: Februar 2014 Teilnehmer-Nr.: 0727110 ausgestellt am: 15.02.14 Referenzinstitut für Bioanalytik Städt. Klinikum Braunschweig ggmbh Institut für Mikrobiologie Immunologie und
Ringversuch: DF1/14 im Monat: Februar 2014 Teilnehmer-Nr.: 0727110 ausgestellt am: 15.02.14 Referenzinstitut für Bioanalytik Städt. Klinikum Braunschweig ggmbh Institut für Mikrobiologie Immunologie und
Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr Bielefeld Ringversuchsleiter
 Ringversuch: DF2/14 im Monat: Mai 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 10.05.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Ringversuch: DF2/14 im Monat: Mai 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 10.05.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Zweigbibliothek Medizin
 Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
Aus dem Institut für Pathologie der Heinrich-Heine-Universität Düsseldorf
 Aus dem Institut für Pathologie der Heinrich-Heine-Universität Düsseldorf Direktor: Univ.-Prof. Dr. med. Helmut Erich Gabbert Untersuchungen zur Konkordanz der histologischen und zytologischen Diagnostik
Aus dem Institut für Pathologie der Heinrich-Heine-Universität Düsseldorf Direktor: Univ.-Prof. Dr. med. Helmut Erich Gabbert Untersuchungen zur Konkordanz der histologischen und zytologischen Diagnostik
Der Blast Ein diagnostisches Schwergewicht
 Der Blast Ein diagnostisches Schwergewicht Ursachen und zytologische Erscheinungsformen Xtra Vol. 17.2 2013 Nr. 01 Unter Blasten versteht man Vorläuferzellen mit den Fähigkeiten zur Selbsterhaltung durch
Der Blast Ein diagnostisches Schwergewicht Ursachen und zytologische Erscheinungsformen Xtra Vol. 17.2 2013 Nr. 01 Unter Blasten versteht man Vorläuferzellen mit den Fähigkeiten zur Selbsterhaltung durch
Akute myeloische Leukämie. Claudia Schelenz
 Akute myeloische Leukämie Claudia Schelenz 1 Die akuten myeloischen Leukämien sind klonale Stammzellerkrankungen, die durch einen Reifungsarrest mit Expansion meist unreifer myeloischer Zellen charakterisiert
Akute myeloische Leukämie Claudia Schelenz 1 Die akuten myeloischen Leukämien sind klonale Stammzellerkrankungen, die durch einen Reifungsarrest mit Expansion meist unreifer myeloischer Zellen charakterisiert
Unklare Leukozytosen bei Erwachsenen und Kindern Diagnostische Abklärung: Leukämie oder Epiphänomen
 Unklare Leukozytosen bei Erwachsenen und Kindern Diagnostische Abklärung: Leukämie oder Epiphänomen Urs Wehrli: Kunst aufräumen Persistierende Leukozytose Klinische Fragestellung: Persistierende Leukozytose?
Unklare Leukozytosen bei Erwachsenen und Kindern Diagnostische Abklärung: Leukämie oder Epiphänomen Urs Wehrli: Kunst aufräumen Persistierende Leukozytose Klinische Fragestellung: Persistierende Leukozytose?
Programm. Interdisziplinäre Diagnostik in der Hämatologie Einführung. Fallbeispiele
 Interdisziplinäre Diagnostik in der Hämatologie Dr. med. Urs Lüthi Dr. med. phil. nat Paula Fernandez Dr. rer. Nat. Sharareh Moshir Margrit Bader Ambassadoren Weiterbildug labmed Sektion Nordwestschweiz
Interdisziplinäre Diagnostik in der Hämatologie Dr. med. Urs Lüthi Dr. med. phil. nat Paula Fernandez Dr. rer. Nat. Sharareh Moshir Margrit Bader Ambassadoren Weiterbildug labmed Sektion Nordwestschweiz
Moderne und zielgerichtete Therapie der akuten Leukämie
 Universitätsklinikum Regensburg Moderne und zielgerichtete Therapie der akuten Leukämie Wolfgang Herr Innere Medizin III (Hämatologie u. internistische Onkologie) Klinik und Poliklinik für Innere Medizin
Universitätsklinikum Regensburg Moderne und zielgerichtete Therapie der akuten Leukämie Wolfgang Herr Innere Medizin III (Hämatologie u. internistische Onkologie) Klinik und Poliklinik für Innere Medizin
Myelofibrose: Krankheit, Diagnose, Beschwerden
 Myelofibrose: Krankheit, Diagnose, Beschwerden Wissenswertes über Myelofibrose Was ist eine Myelofibrose? Wie entsteht Myelofibrose? Welche Beschwerden verursacht die Erkrankung? Wie erkennt man die Myelofibrose?
Myelofibrose: Krankheit, Diagnose, Beschwerden Wissenswertes über Myelofibrose Was ist eine Myelofibrose? Wie entsteht Myelofibrose? Welche Beschwerden verursacht die Erkrankung? Wie erkennt man die Myelofibrose?
Inhalt. MANUAL Leukämien, myelodysplastische Syndrome und myeloproliferative Neoplasien
 MANUAL Leukämien, myelodysplastische Syndrome und myeloproliferative Neoplasien 2015 by Tumorzentrum München und W. Zuckschwerdt Verlag München VII Inhalt Allgemeine Diagnostik Koordiniert durch M. Starck
MANUAL Leukämien, myelodysplastische Syndrome und myeloproliferative Neoplasien 2015 by Tumorzentrum München und W. Zuckschwerdt Verlag München VII Inhalt Allgemeine Diagnostik Koordiniert durch M. Starck
Publikumsvortrag an der AndreasKlinik Cham Zug vom 30. Mai 2006 Leukämien bei älteren Patienten: Neue diagnostische und therapeutische Möglichkeiten
 Publikumsvortrag an der AndreasKlinik Cham Zug vom 30. Mai 2006 Leukämien bei älteren Patienten: Neue diagnostische und therapeutische Möglichkeiten PD Dr.med. Andreas Himmelmann PD Dr.med. Andreas Himmelmann
Publikumsvortrag an der AndreasKlinik Cham Zug vom 30. Mai 2006 Leukämien bei älteren Patienten: Neue diagnostische und therapeutische Möglichkeiten PD Dr.med. Andreas Himmelmann PD Dr.med. Andreas Himmelmann
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main
 Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Klinik für Hals-, Nasen-, Ohrenheilkunde Direktor. Prof. Dr. med. Timo Stöver Prävalenz der high-risk HP-Viren 16 und
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Klinik für Hals-, Nasen-, Ohrenheilkunde Direktor. Prof. Dr. med. Timo Stöver Prävalenz der high-risk HP-Viren 16 und
Diagnostik an Blutzellen
 Diagnostik an Blutzellen Was ist ein Blutbild? Was ist der Hämatokrit? Wie werden Zellen im Blut Untersucht? Marker zur Identifizierung von Zellen im Blut Diagnostik an Blutzellen Blut Plasma (ca. 55%)
Diagnostik an Blutzellen Was ist ein Blutbild? Was ist der Hämatokrit? Wie werden Zellen im Blut Untersucht? Marker zur Identifizierung von Zellen im Blut Diagnostik an Blutzellen Blut Plasma (ca. 55%)
M-T. Krauth, WR. Sperr Klinik für Innere Medizin I Abteilung Hämatologie & Hämostaseologie Medizinische Universität Wien
 Klinik für Innere Med. I Abt. f. Hämatologie & Hämostaseologie M-T. Krauth, WR. Sperr Klinik für Innere Medizin I Abteilung Hämatologie & Hämostaseologie Medizinische Universität Wien Inzidenz der AML
Klinik für Innere Med. I Abt. f. Hämatologie & Hämostaseologie M-T. Krauth, WR. Sperr Klinik für Innere Medizin I Abteilung Hämatologie & Hämostaseologie Medizinische Universität Wien Inzidenz der AML
Das komische Blutbild. André Tichelli Hämatologie
 Das komische Blutbild André Tichelli Hämatologie Zum lachend reizend, lustig, spasshaft Sonderbar, seltsam, eigenartig Unerwartet Blutbildanomalien aus Sicht des Klinikers (nicht-hämatologe) - Ein Kliniker
Das komische Blutbild André Tichelli Hämatologie Zum lachend reizend, lustig, spasshaft Sonderbar, seltsam, eigenartig Unerwartet Blutbildanomalien aus Sicht des Klinikers (nicht-hämatologe) - Ein Kliniker
AUS DEM PATHOLOGISCHEN INSTITUT ABTEILUNG ALLGEMEINE PATHOLOGIE UND PATHOLOGISCHE ANATOMIE DER ALBERT-LUDWIGS-UNIVERSITÄT FREIBURG I. BR.
 AUS DEM PATHOLOGISCHEN INSTITUT ABTEILUNG ALLGEMEINE PATHOLOGIE UND PATHOLOGISCHE ANATOMIE DER ALBERT-LUDWIGS-UNIVERSITÄT FREIBURG I. BR. MYELOSARKOM: ANALYSE HISTOPATHOLOGISCHER UND KLINISCHER PARAMETER
AUS DEM PATHOLOGISCHEN INSTITUT ABTEILUNG ALLGEMEINE PATHOLOGIE UND PATHOLOGISCHE ANATOMIE DER ALBERT-LUDWIGS-UNIVERSITÄT FREIBURG I. BR. MYELOSARKOM: ANALYSE HISTOPATHOLOGISCHER UND KLINISCHER PARAMETER
Hämatologisches Labor Köln
 Werte für Menschen, Tiere und Umwelt Centre of Excellence Hämatologisches Labor Köln synlab-kompetenzzentrum für die hämatologische Spezialdiagnostik Wer ist synlab? Die synlab-gruppe ist ein international
Werte für Menschen, Tiere und Umwelt Centre of Excellence Hämatologisches Labor Köln synlab-kompetenzzentrum für die hämatologische Spezialdiagnostik Wer ist synlab? Die synlab-gruppe ist ein international
Wir bestätigen Ihnen, dass Sie am Ringversuch für Differentialblutbild teilgenommen haben.
 Ringversuch: DF1/16 im Monat: Februar 2016 Teilnehmer-Nr.: 0003333 ausgestellt am: 13.02.16 Referenzinstitut für Bioanalytik Würmtal diagnostics GbR Labor - 2. Stock Kd. Nr. 0003333 Fraunhoferstr 11a 82152
Ringversuch: DF1/16 im Monat: Februar 2016 Teilnehmer-Nr.: 0003333 ausgestellt am: 13.02.16 Referenzinstitut für Bioanalytik Würmtal diagnostics GbR Labor - 2. Stock Kd. Nr. 0003333 Fraunhoferstr 11a 82152
Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr Bielefeld Ringversuchsleiter
 Ringversuch: DF4/14 im Monat: Oktober 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 18.10.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Ringversuch: DF4/14 im Monat: Oktober 2014 Teilnehmer-Nr.: 0004711 ausgestellt am: 18.10.14 Referenzinstitut für Bioanalytik Arbeitsgemeinschaft Ostwestfälischer Ärzte Dunlopstr. 50 33689 Bielefeld Ringversuchsleiter
Hämatologie. Blutkrankheiten
 Hämatologie Blutkrankheiten Wachstum und Differenzierung von Stammzellen durch Stromazellen Reifung der Erythropoese Knochenmark Erythropoetische Zellen Unreif Normoblasten Retikulozyten Supravitalfärbung
Hämatologie Blutkrankheiten Wachstum und Differenzierung von Stammzellen durch Stromazellen Reifung der Erythropoese Knochenmark Erythropoetische Zellen Unreif Normoblasten Retikulozyten Supravitalfärbung
3.1 Dauerhafter Hochdruck versus temporärer. 3.1 Dauerhafter Hochdruck versus temporärer Hochdruck
 3.1 Dauerhafter Hochdruck versus temporärer 9 3.1 Dauerhafter Hochdruck versus temporärer Hochdruck A Grundsätzlich muss zwischen den dauerhaften und den temporären Blutdrucksteigerungen unterschieden
3.1 Dauerhafter Hochdruck versus temporärer 9 3.1 Dauerhafter Hochdruck versus temporärer Hochdruck A Grundsätzlich muss zwischen den dauerhaften und den temporären Blutdrucksteigerungen unterschieden
Klassifikation und Dokumentation maligner hämatologischer Systemerkrankungen. PD Dr. Stefan A. Klein Medizinische Klinik IV Hämatologie / Onkologie
 Klassifikation und Dokumentation maligner hämatologischer Systemerkrankungen PD Dr. Stefan A. Klein Medizinische Klinik IV Hämatologie / Onkologie KLINIKUM BAYREUTH GmbH Solide Tumore: TMN-Klassifikation
Klassifikation und Dokumentation maligner hämatologischer Systemerkrankungen PD Dr. Stefan A. Klein Medizinische Klinik IV Hämatologie / Onkologie KLINIKUM BAYREUTH GmbH Solide Tumore: TMN-Klassifikation
(Imatinib) aufweisen. Durch die Zulassung von Tasigna können wir mehr Patienten mit CML helfen. Mit Glivec als Primärtherapie
 Tasigna (Nilotinib) erhält in der Europäischen Union die Zulassung für die Zweitlinientherapie von CML-Patienten Frankfurt am Main (17. Dezember 2007) - Tasigna führte zu einem guten zytogenetischen Ansprechen
Tasigna (Nilotinib) erhält in der Europäischen Union die Zulassung für die Zweitlinientherapie von CML-Patienten Frankfurt am Main (17. Dezember 2007) - Tasigna führte zu einem guten zytogenetischen Ansprechen
Tumorzentrum Regensburg e.v.
 Tumorzentrum Regensburg e.v. Gegenüberstellung der Kiel-/REAL-/ICD-O-3-/WHO-Klassifikation Erfahrungen der Umsetzung am Tumorzentrum Regensburg 18. Informationstagung Tumordokumentation Jena 2009 D. Weinberger
Tumorzentrum Regensburg e.v. Gegenüberstellung der Kiel-/REAL-/ICD-O-3-/WHO-Klassifikation Erfahrungen der Umsetzung am Tumorzentrum Regensburg 18. Informationstagung Tumordokumentation Jena 2009 D. Weinberger
LEUCOGNOST. Diagnostik-System zum Nachweis von Leukämien und myeloproliferativen Erkrankungen. Hämatologie Ihre Ziele im Fokus.
 LEUCOGNOST Diagnostik-System zum Nachweis von Leukämien und myeloproliferativen Erkrankungen Hämatologie Ihre Ziele im Fokus. LEUCOGNOST LEUCOGNOST ALPA Zytochemische Färbungen zur Leukämiedifferenzierung
LEUCOGNOST Diagnostik-System zum Nachweis von Leukämien und myeloproliferativen Erkrankungen Hämatologie Ihre Ziele im Fokus. LEUCOGNOST LEUCOGNOST ALPA Zytochemische Färbungen zur Leukämiedifferenzierung
RI *10/ Monate
 RI *10/2014 16 Monate CT-Thorax 3.9.2015. Großer Mediastinaltumor 13x8 cm, Perikarderguss, 1,5 cm mit einliegendem Pigtail-Katheter, Zustand nach Drainage vom 200 ml Erguss. RI *10/2014 16 Monate Labordiagnostik
RI *10/2014 16 Monate CT-Thorax 3.9.2015. Großer Mediastinaltumor 13x8 cm, Perikarderguss, 1,5 cm mit einliegendem Pigtail-Katheter, Zustand nach Drainage vom 200 ml Erguss. RI *10/2014 16 Monate Labordiagnostik
6. Aachener Mikroskopierkurs, Stufe III Spezielle Hämatologie
 Referenten PD Dr. med. Edgar Jost Prof. Dr. med. Steffen Koschmieder Dr. med. Katharina Lindemann-Docter Dr. med. Jens Panse Dr. rer. nat. Mirle Schemionek Klinik für Hämatologie, Einladung und Mitarbeiter
Referenten PD Dr. med. Edgar Jost Prof. Dr. med. Steffen Koschmieder Dr. med. Katharina Lindemann-Docter Dr. med. Jens Panse Dr. rer. nat. Mirle Schemionek Klinik für Hämatologie, Einladung und Mitarbeiter
Patientenpass CML. Für. (Name des Patienten) Bitte bei jedem Arztbesuch mitbringen
 Patientenpass CML Für (Name des Patienten) Bitte bei jedem Arztbesuch mitbringen 1 Inhaltsverzeichnis Seite Vorwort 3 Patientendaten und Ersterhebung 4-5 Übersicht Medikamenteneinnahme 6 Bedeutung der
Patientenpass CML Für (Name des Patienten) Bitte bei jedem Arztbesuch mitbringen 1 Inhaltsverzeichnis Seite Vorwort 3 Patientendaten und Ersterhebung 4-5 Übersicht Medikamenteneinnahme 6 Bedeutung der
