Verein Demokratischer Pharmazeutinnen und Pharmazeuten
|
|
|
- Ernst Hafner
- vor 7 Jahren
- Abrufe
Transkript
1 Verein Demokratischer Pharmazeutinnen und Pharmazeuten Geschäftsstelle Neptun-Apotheke Bramfelder Chaussee Hamburg Tel.: 040 / Fax.: 040 / info@vdpp.de Internet: Dr. Ulrich Hagemann Berlin, Stellungnahme zum Fachgespräch beim Ausschuss für Arbeit und Soziales des Landtages Sachsen-Anhalt im Zusammenhang mit den Anträgen der Fraktion Bündnis 90/Die Grünen zur Entlassung Levonorgestrel-haltiger Arzneimittel zur Notfallkontrazeption aus der Verschreibungspflicht Für den VdPP gebe ich folgende schriftliche Stellungnahme ab. Während des Fachgespräches nehme ich gerne zu weiteren Aspekten Stellung. 1. Rechtslage und Bedingungen für die Unterstellung von Wirkstoffen unter die oder die Entlassung aus der Verschreibungspflicht Entsprechend nationalem Arzneimittelrecht (AMG 48, 2, Nr. 2a und 2b), der Guideline on Changing the Classification for the Supply of a Medicinal Product for Human Use der Europäischen Kommission vom Januar 2006 sowie Art 70 ff. der Richtlinie 2001/83/EC (in der gültigen Fassung) sind nur zwei wesentliche Kriterien heranzuziehen, wenn über die Verschreibungspflicht von Arzneimittel zu entscheiden ist. (Ausnahme: Zulassung eines Arzneimittels mit einem völlig neuen Wirkstoff, dann besteht automatische Verschreibungspflicht). Diese sind: a. eine unmittelbare oder mittelbare gesundheitliche Gefährdung des Menschen bei bestimmungsgemäßem Gebrauch, oder b. ein häufiger nicht bestimmungsgemäßer Gebrauch in erheblichem Umfang (Missbrauchs- und Abhängigkeitspotential), wenn zuvor keine ärztliche Verordnung erfolgt ist. Andere, nichtmedizinische oder pharmazeutische Kriterien haben danach in Deutschland und in der EU keine Rechtsgrundlage bei der Entscheidung über die Verschreibungspflicht eines Arzneimittels. Zu a.: Ausschlaggebend und Voraussetzung für die Zulassung eines Arzneimittels überhaupt ist ein durch Daten bzw. Studien nachgewiesenes günstiges Nutzen-Schaden-Verhältnis. Im Zeitraum nach der Zulassung eines Arzneimittels und unter Alltagsbedingungen der medizinischen Versorgung kann die nicht-bestimmungsgemäße Anwendung Ursache einer gesundheitlichen Gefährdung des Menschen sein. Relevant sind vor allem 1
2 eine richtige Indikations- bzw. Diagnosestellung und eine korrekte Anwendung des Arzneimittels. Indikation für LNG-haltige Arzneimittel zur Notfallkontrazeption (im Folgenden: LNG-NF) Die Indikation ist nur die sog. Notfallverhütung, nicht die Senkung der Abbruchrate, wie gelegentlich angeführt wird. Diese ist ein wünschenswerter Nebeneffekt (aber nicht im Sinne einer Nebenwirkung). Bezogen auf LNG-haltige Arzneimittel zur Notfallkontrazeption ist evident, dass allein die Frau, ggf. zusammen mit dem Partner, die Situation kennt und benennen kann, aus der heraus von der betroffenen Frau oder dem Partner eine Anwendung LNG-haltiger Arzneimittel zur Notfallkontrazeption erwogen oder für notwendig gehalten wird (Indikationsstellung). Ärzte und Apotheker können in dieser Situation keine besser begründete Indikation stellen. Ebenso bedarf es keiner ärztlichen Überwachung oder Kontrolle der Wirksamkeit LNG-haltiger Arzneimittel zur Notfallkontrazeption im Einzelfall. Es handelt sich nicht um eine Anwendung über einen längeren Zeitraum mit notwendigen Therapiekontrollen und die belegte Effektivität dieser Arzneimittel ist sehr hoch. Völlig unabhängig davon und von der verschreibungsfreien Verfügbarkeit kann eine fachliche Beratung über Schwangerschaftsverhütung und Methoden dazu von Nutzen sein. Zu b.: Es ist wissenschaftlich unbestritten, dass LNG einerseits kein inhärentes Missbrauchs- oder Abhängigkeitspotential besitzt oder dass andererseits LNG-haltige Arzneimittel zur Notfallkontrazeption nicht häufig und in erheblichem Umfang missbräuchlich angewendet werden. Hinweise auf einen häufigen und in erheblichem Umfang betriebenen Missbrauch ergeben sich weder aus Untersuchungen der WHO und aus davon abgeleiteten Empfehlungen noch aus den Erfahrungen in anderen (EU-)Staaten, in denen LNG-haltige Arzneimittel zur Notfallkontrazeption seit längerem nicht mehr der Verschreibungspflicht unterstehen. 2. Der Vergleich zwischen zwei Behandlungsoptionen ist kein Kriterium (wenngleich interessant) bei Entscheidung über die Verschreibungspflicht. Es zählen nur die Fakten/Daten zu dem Wirkstoff/Arzneimittel, über dessen Freistellung zu entscheiden ist. Die in bisherigen Diskussionen angeführte Studie von Glasier et al. (Lancet 375 (2010): ), in der LNG und Ulipristal (ein neuer Wirkstoff zur postkoitalen Kontrazeption) miteinander verglichen wurden, ist eine Nicht-Unterlegenheitsstudie. In ihr sollte die Frage beantwortet werden, ob Ulipristal (Warenzeichen: EllaOne) schlechter (in Bezug auf verhinderte Schwangerschaften) ist als LNG-NF. Das Ergebnis war, dass Ulipristal nicht schlechter als LNG-NF ist, aber auch nicht besser. Mit Ulipristal trat bei 1.8% der Anwenderinnen eine Schwangerschaft ein, mit LNG-NF in 2.6% 2
3 der Anwendungen. Der Unterschied beträgt absolut also nur etwa 1%. In früheren Stellungnahmen, auch von Fachgesellschaften, wurde von einer besseren Wirksamkeit (besser: Effektivität) für Ulipristal von 30% bis 50% gesprochen, diese Zahlen benennen aber die relative Effektivität (nämlich den relativen Unterschied zwischen 2.6% und 1.8%), die hier nicht relevant und irreführend ist. (Zur Erläuterung: wenn ich bei 100 Patienten im Zeitraum X (ein Jahr z.b.) einmal eine Nebenwirkung feststelle, dann beträgt die Häufigkeit 1%. Wenn ich im Vergleichszeitraum Y (wieder ein Jahr) 2 Nebenwirkungen bei 100 Patienten feststelle, dann beträgt die Häufigkeit 2%. Das ist zwar relativ doppelt so viel, also 100% mehr, tatsächlich und absolut aber nur ein Häufigkeitsunterschied von 1%). 3. Dass ein Arzneimittel nur aus der V-Pflicht entlassen werden kann, wenn es keine Nebenwirkungen auslöst, ist falsch. In Deutschland (und in anderen Ländern) sind viele Arzneimittel verschreibungsfrei und können dennoch Nebenwirkungen auslösen (z.b. leicht wirksame Schmerzmittel, Hustenmittel, Abführmittel etc.). Es zählt hier vor allem das Kriterium, dass das rezeptfreie AM keine unmittelbare oder mittelbare Gesundheitsschädigung auslösen kann, wenn es ohne Verordnung (aber durchaus nach Beratung durch einen Apotheker) an Patienten abgegeben wird. 4. Verständlichkeit der Produktinformation (Packungsbeilage) Wie bei allen Arzneimitteln ist die Verständlichkeit der Produktinformation (Packungsbeilage) wichtig. Produktinformationen von Arzneimitteln sind Dokumente, die von den Zulassungsbehörden geprüft und genehmigt werden. Ihnen kommt deshalb besondere Bedeutung hinsichtlich Richtigkeit und Verständlichkeit (im Vergleich zu Werbetexten) zu. Hinsichtlich der Kontraindikationen für eine Anwendung LNG-haltiger Arzneimittel zur Notfallkontrazeption bestehen keine Einschränkungen derart, dass sie nur von einem Arzt und zudem in einem relativ kurzen Zeitraum ermittelt werden könnten. Es kann davon ausgegangen werden, dass die Anwenderin bestimmte Erkrankungen, bei denen LNG-haltige Arzneimittel zur Notfallkontrazeption laut Packungsbeilage nicht eingenommen werden dürfen (absolute Kontraindikationen), kennen oder bei der Abgabe in der Apotheke darauf aufmerksam gemacht werden und ggf. von einer Anwendung Abstand nehmen. Eine richtige Anwendung LNG-haltiger Arzneimittel zur Notfallkontrazeption, nämlich die einmalige Anwendung einer einzigen Tablette in einem Zeitraum von 72 Stunden nach ungeschütztem Geschlechtsverkehr, kann ernsthaft nicht als so schwierig bezeichnet werden, als dass zuvor eine ärztliche Verordnung und Beratung notwendig wäre, um die in den Packungsbeilagen beschriebenen Einnahmehinweise zu erläutern. 5. Wirksamkeit und Sicherheit, Studienergebnisse 3
4 Das Nutzen-Schaden-Verhältnis von LNG-NF ist positiv, da es sonst keine Zulassung von LNG-NF geben dürfte. Nach breiter Meinung und langjähriger Anwendungserfahrung ist LNG-NF sicher und wirksam bei Anwendung entsprechend der Zulassung. Es wird wiederholt von Wirksamkeit und Sicherheit von LNG-NF gesprochen und insbesondere von Sicherheit bezogen auf eine sichere Anwendung und Effektivität. Wenn üblicherweise von Sicherheit gesprochen wird, ist damit die Unbedenklichkeit eines Arzneimittels gemeint, also die fehlenden oder vertretbaren unerwünschten Effekte (z.b. toxische Wirkungen, teratogene Effekte und pharmakologischen Wirkungen). LNG- NF ist in diesem Sinne wirksam und sicher, anderenfalls wäre es bedenklich und müsste vom Markt genommen werden oder es hätte es keine Zulassung erhalten können. Vor der Zulassung eines Arzneimittels muss den Zulassungsbehörden wissenschaftliches Erkenntnismaterial zur Prüfung vorgelegt werden, das die Wirksamkeit, Unbedenklichkeit (s.o.) und pharmazeutische Qualität belegt. Es kann sich auch um sog. anderes wissenschaftliches Erkenntnismaterial handeln, also z.b. um Studien, die nicht vom Antragsteller selbst oder nicht in DE, sondern im Ausland durchgeführt wurden, oder um Erkenntnismaterial, das sich aus der anerkannten wissenschaftlichen Literatur ergibt. 6. Sind weitere Studien nötig? Das Erkenntnismaterial zu LNG-NF ist so groß, dass weitere Studien wahrscheinlich nichts Neues erbringen. Zu denken ist, unabhängig von der Frage der Freistellung von LNG-NF, an epidemiologische Studien oder Arzneimittel-Anwendungsstudien, von denen allerdings auch nicht viel Neues zu erwarten ist und die zudem, in diesem speziellen Fall, nicht ganz einfach durchzuführen sind. 7. Beratung durch pharmazeutisches Fachpersonal Mit der Entlassung LNG-haltiger Arzneimittel zur Notfallkontrazeption aus der Verschreibungspflicht rückt die Verfügbarkeit LNG-haltiger Arzneimittel zur Notfallkontrazeption in Apotheken und die Beratung durch pharmazeutisches Fachpersonal bei der Abgabe in den Mittelpunkt. In Deutschland besteht ein funktionierendes Versorgungssystem für Arzneimittel einschließlich eines Notdienstsystems, das jederzeit Zugang zu benötigten Arzneimitteln gewährleistet. Die Verfügbarkeit LNG-haltiger Arzneimittel zur Notfallkontrazeption in Apotheken ohne vorherige Verordnung durch einen Arzt verkürzt wesentlich den Zeitraum zwischen ungeschütztem Sexualkontakt und Einnahme dieser Arzneimittel. Dadurch kann die Effektivität dieser Arzneimittel deutlich verbessert werden. 4
5 In den Apotheken steht pharmazeutisches Fachpersonal zur Verfügung, das die in der konkreten Situation (Abgabe des verschreibungsfreien LNG-haltigen Arzneimittels zur Notfallkontrazeption) notwendigen Informationen zur sicheren Anwendung dieser Arzneimittel sachgerecht und verständlich geben kann. Es gehört zu den grundlegenden Pflichten des pharmazeutischen Fachpersonals, umfassende Arzneimittelberatung zu geben. Somit gibt es auch unter dem Gesichtspunkt der sachgerechten Abgabe an die Anwender kein Argument, das gegen die Entlassung dieser Arzneimittel aus der Verschreibungspflicht spricht. Es muss von den Apothekerkammern erwartet werden, dass sie die Information ihrer Mitglieder zu einer rezeptfreien hormonellen Notfallkontrazeption gewährleisten und eine qualitativ hochwertige Beratung der Patientinnen in den Apotheken in diesem Bereich aktiv fördern und wirksam überwachen. 8. Werbung für diese Arzneimittel außerhalb der Fachkreise Mit der Entlassung eines Wirkstoffes aus der Verschreibungspflicht bzw. der Arzneimittel, die diesen Wirkstoff enthalten, treten Änderungen hinsichtlich der zulässigen Werbung für diese Arzneimittel außerhalb der Fachkreise (sog. Laienwerbung) ein. Der VdPP vertritt die Auffassung, dass sog. Laienwerbung für LNG-haltige Arzneimittel zur Notfallkontrazeption nicht erlaubt sein sollte. Der VdPP regt an, in 10 Abs. 2 des Heilmittelwerbegesetzes (HWG) als zusätzliches Anwendungsgebiet die Worte oder eine hormonelle Kontrazeption vorzunehmen einzufügen. Dadurch könnte eine Werbung für Arzneimittel zur Notfallkontrazeption insgesamt untersagt werden. Stattdessen sollten behördlich geprüfte Informationen zur hormonellen Notfallkontrazeption, zum Beispiel durch die Bundeszentrale für gesundheitliche Aufklärung (BZgA) und das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), in allen Apotheken verfügbar sein, um so den rationalen Gebrauch dieser Arzneimittel zu unterstützen. Keiner der Befürworter einer Freistellung von LNG-NF stellt den Sinn und die Notwendigkeit einer Beratung in Zweifel. Aber die Aufklärung über sexuell übertragbare Infektionen (STI) betrifft einen Sachverhalt, der völlig unabhängig von der Anwendung von LNG-NF, anderen hormonellen Kontrazeptiva oder Barrieremethoden sinnvoll und nötig ist. Für LNG-NF wurde nie in Anspruch genommen, effektiv STI zu verhindern. Dr. Ulrich Hagemann Verein Demokratischer Pharmazeutinnen und Pharmazeuten Dezember
Levonoraristo 1,5 mg, Levonorgestrel STADA 1,5 mg, Navela 1,5 mg, Pidana 1,5 mg, Postinor 1500 µg, unofem HEXAL 1,5 mg
 Anhang 1 Notfallkontrazeptiva Levonorgestrel (LNG) und Ulipristalacetat (UPA) im Vergleich* Arzneistoff (Wirkstoffklasse) In Deutschland im Handel befindliche Präparate (Stand Februar 2018) Wirkungsmechanismus
Anhang 1 Notfallkontrazeptiva Levonorgestrel (LNG) und Ulipristalacetat (UPA) im Vergleich* Arzneistoff (Wirkstoffklasse) In Deutschland im Handel befindliche Präparate (Stand Februar 2018) Wirkungsmechanismus
ellaone Die wirksamste Pille für danach Jetzt rezeptfrei (Liste C)
 ellaone Die wirksamste Pille für danach Jetzt rezeptfrei (Liste C) 1 Pannen passieren: ellaone jetzt auf Liste C 2 ellaone jetzt auf Liste C warum ist sie die 1. Wahl? Agenda Notfallverhütung betrifft
ellaone Die wirksamste Pille für danach Jetzt rezeptfrei (Liste C) 1 Pannen passieren: ellaone jetzt auf Liste C 2 ellaone jetzt auf Liste C warum ist sie die 1. Wahl? Agenda Notfallverhütung betrifft
Thymian / Primel. Sachverständigen-Ausschuss für Apothekenpflicht 13. Juni Sachverständigen-Ausschuss für Apothekenpflicht 13.
 Thymian / Primel Sachverständigen-Ausschuss für Apothekenpflicht 13. Juni 2017 Sachverständigen-Ausschuss für Apothekenpflicht 13. Juni 2017 Seite 1 Antrag Thymiankraut und seine Zubereitungen, auch in
Thymian / Primel Sachverständigen-Ausschuss für Apothekenpflicht 13. Juni 2017 Sachverständigen-Ausschuss für Apothekenpflicht 13. Juni 2017 Seite 1 Antrag Thymiankraut und seine Zubereitungen, auch in
nachrichtlich: Stufenplanbeteiligte, Zul mit DE= CMS
 - 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn pharmazeutische Unternehmer mit DE=RMS, nat. Zul, Parallelimp nachrichtlich: Stufenplanbeteiligte,
- 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn pharmazeutische Unternehmer mit DE=RMS, nat. Zul, Parallelimp nachrichtlich: Stufenplanbeteiligte,
Die Stellungnahme des Bundesinstitutes für Arzneimittel und Medizinprodukte ist zu diesem Thema eindeutig:
 Händedesinfektionsmittel: Arzneimittel oder Biozide 2009 wurde mit der 15. Änderung des Arzneimitteländerungsgesetzes der Begriff Arzneimittel im AMG neu definiert. Während der bisherigen Arzneimitteldefinition
Händedesinfektionsmittel: Arzneimittel oder Biozide 2009 wurde mit der 15. Änderung des Arzneimitteländerungsgesetzes der Begriff Arzneimittel im AMG neu definiert. Während der bisherigen Arzneimitteldefinition
Antrag auf Freistellung aus der Verschreibungspflicht für Omeprazol 20 mg
 Antrag auf Freistellung aus der Verschreibungspflicht für Omeprazol 20 mg Sachverständigen-Ausschuss für Verschreibungspflicht 13. Januar 2009 Rationale des Antrags Omeprazol ist eine der effektivsten
Antrag auf Freistellung aus der Verschreibungspflicht für Omeprazol 20 mg Sachverständigen-Ausschuss für Verschreibungspflicht 13. Januar 2009 Rationale des Antrags Omeprazol ist eine der effektivsten
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017
 Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen
 Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Parenteralia. Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017
 Parenteralia Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Seite 1 Hintergrund Diskussion auf der 76. Sitzung
Parenteralia Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Seite 1 Hintergrund Diskussion auf der 76. Sitzung
Procain zur Anwendung am äußeren Gehörgang
 Procain zur Anwendung am äußeren Gehörgang Sachverständigen-Ausschuss für Verschreibungspflicht 27. Juni 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Juni 2017 Seite 1 Antrag Antrag auf
Procain zur Anwendung am äußeren Gehörgang Sachverständigen-Ausschuss für Verschreibungspflicht 27. Juni 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Juni 2017 Seite 1 Antrag Antrag auf
IQWiG Herbstsymposium / Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V)
 IQWiG Herbstsymposium 19.11./20.11.2010 Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V) Referent: Maximilian Grüne, Justiziar Gemeinsamer Bundesausschuss Seite
IQWiG Herbstsymposium 19.11./20.11.2010 Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V) Referent: Maximilian Grüne, Justiziar Gemeinsamer Bundesausschuss Seite
Die frühe Nutzenbewertung und ihre rechtlichen Herausforderungen
 und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
Verordnung zur Änderung der Arzneimittelverschreibungsverordnung und der Verordnung über apothekenpflichtige und freiverkäufliche Arzneimittel
 Bundesrat Drucksache 705/13 (Beschluss) 08.11.13 Beschluss des Bundesrates Verordnung zur Änderung der Arzneimittelverschreibungsverordnung und der Verordnung über apothekenpflichtige und freiverkäufliche
Bundesrat Drucksache 705/13 (Beschluss) 08.11.13 Beschluss des Bundesrates Verordnung zur Änderung der Arzneimittelverschreibungsverordnung und der Verordnung über apothekenpflichtige und freiverkäufliche
Notfallkontrazeption Die Pille danach für jeden Haushalt!
 Gesellschaft für Geburtshilfe und Gynäkologie Berlin 20.02.2013 Notfallkontrazeption Die Pille danach für jeden Haushalt! Julia Bartley Abteilung für gynäkologische Endokrinologie Charité Universitätsmedizin
Gesellschaft für Geburtshilfe und Gynäkologie Berlin 20.02.2013 Notfallkontrazeption Die Pille danach für jeden Haushalt! Julia Bartley Abteilung für gynäkologische Endokrinologie Charité Universitätsmedizin
Risikoüberwachung von Arzneimitteln - Aktuelle Situation
 Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
zu Punkt... der 916. Sitzung des Bundesrates am 8. November 2013
 Bundesrat Drucksache 705/1/13 24.10.13 E m p f e h l u n g e n der Ausschüsse G - AV zu Punkt.. der 916. Sitzung des Bundesrates am 8. November 2013 Verordnung zur Änderung der Arzneimittelverschreibungsverordnung
Bundesrat Drucksache 705/1/13 24.10.13 E m p f e h l u n g e n der Ausschüsse G - AV zu Punkt.. der 916. Sitzung des Bundesrates am 8. November 2013 Verordnung zur Änderung der Arzneimittelverschreibungsverordnung
Tragende Gründe. Vom 19. Juni 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Venlafaxin bei neuropathischen Schmerzen Vom 19. Juni 2014
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Venlafaxin bei neuropathischen Schmerzen Vom 19. Juni 2014
Einleitung und Leseanweisung
 VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
1. Welche Rückschlüsse zieht die Bundesregierung aus der Empfehlung des CHMP-Ausschusses?
 Deutscher Bundestag Drucksache 18/3690 18. Wahlperiode 06.01.2015 Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Kathrin Vogler, Cornelia Möhring, Sabine Zimmermann (Zwickau), weiterer
Deutscher Bundestag Drucksache 18/3690 18. Wahlperiode 06.01.2015 Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Kathrin Vogler, Cornelia Möhring, Sabine Zimmermann (Zwickau), weiterer
Tragende Gründe. Vom 27. November 2015
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Teil A Ziffer V. Valproinsäure bei der Migräneprophylaxe
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Teil A Ziffer V. Valproinsäure bei der Migräneprophylaxe
Dreizehnte Verordnung zur Änderung der Arzneimittelverschreibungsverordnung
 Bundesrat Drucksache 768/12 (Beschluss) 01.02.13 Beschluss des Bundesrates Dreizehnte Verordnung zur Änderung der Arzneimittelverschreibungsverordnung Der Bundesrat hat in seiner 906. Sitzung am 1. Februar
Bundesrat Drucksache 768/12 (Beschluss) 01.02.13 Beschluss des Bundesrates Dreizehnte Verordnung zur Änderung der Arzneimittelverschreibungsverordnung Der Bundesrat hat in seiner 906. Sitzung am 1. Februar
Der Leitfaden zur Beratung. Informations- und Beratungshinweise in öffentlichen Apotheken
 Informations- und shinweise in öffentlichen Apotheken Dieser Leitfaden dient zur Eigen- und Fremdbeurteilung der und Information bei der Abgabe von Arzneimitteln auf ärztliche Verordnung sowie im Rahmen
Informations- und shinweise in öffentlichen Apotheken Dieser Leitfaden dient zur Eigen- und Fremdbeurteilung der und Information bei der Abgabe von Arzneimitteln auf ärztliche Verordnung sowie im Rahmen
zur Umsetzung der Mo. Eder "Swissmedic-Zulassung eines Arzneimittels als erlaubtes Werbeelement" in der Arzneimittel-Werbeverordnung (AWV)
 Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Dezember 2014 Erläuternder Bericht zur Umsetzung der Mo. Eder 13.3393 "Swissmedic-Zulassung eines Arzneimittels als erlaubtes Werbeelement"
Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Dezember 2014 Erläuternder Bericht zur Umsetzung der Mo. Eder 13.3393 "Swissmedic-Zulassung eines Arzneimittels als erlaubtes Werbeelement"
Europäische Verfahren
 Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT
 UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
Was muss vor der ersten Verschreibung eines Cannabisarzneimittels beachtet werden?
 Hinweise für Ärzte Mit dem am 10.03.2017 in Kraft getretenen Gesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften hat der Gesetzgeber die Möglichkeiten zur Verschreibung von Cannabisarzneimitteln
Hinweise für Ärzte Mit dem am 10.03.2017 in Kraft getretenen Gesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften hat der Gesetzgeber die Möglichkeiten zur Verschreibung von Cannabisarzneimitteln
Pflanzliche und traditionelle Arzneimittel
 Pflanzliche und traditionelle Arzneimittel Dr. Friederike Stolte BfArM, Bonn Phytopharmaka Vollantrag (klinische Prüfungen und neue Tests) Bibliographischer Antrag (well-established, 10 Jahre) Mixed application
Pflanzliche und traditionelle Arzneimittel Dr. Friederike Stolte BfArM, Bonn Phytopharmaka Vollantrag (klinische Prüfungen und neue Tests) Bibliographischer Antrag (well-established, 10 Jahre) Mixed application
Dokumentationshilfe Einzelhändler - Arzneimittelrecht
 Dokumentationshilfe Einzelhändler - Arzneimittelrecht Besichtigung des Bestandes an Arzneimitteln Fertigarzneimittel Der Einzelhändler bringt nur freiverkäufliche Arzneimittel in den Verkehr ( 43 Abs.
Dokumentationshilfe Einzelhändler - Arzneimittelrecht Besichtigung des Bestandes an Arzneimitteln Fertigarzneimittel Der Einzelhändler bringt nur freiverkäufliche Arzneimittel in den Verkehr ( 43 Abs.
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V)
 Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Zulassungsüberschreitende Anwendung von Arzneimitteln im Rahmen klinischer Studien ( 35c SGB V) Berlin, 22. September 2009 Dr. Regina Skavron Abteilung Arzneimittel, Gemeinsamer Bundesausschuss Zulassungsüberschreitende
Doxylamin zur Behandlung von Schlafstörungen bei Kindern
 Doxylamin zur Behandlung von Schlafstörungen bei Kindern Sachverständigen-Ausschuss für Verschreibungspflicht 27. Juni 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Juni 2017 Seite 1 BfArM
Doxylamin zur Behandlung von Schlafstörungen bei Kindern Sachverständigen-Ausschuss für Verschreibungspflicht 27. Juni 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Juni 2017 Seite 1 BfArM
BREMISCHE BÜRGERSCHAFT Drucksache 18/992 Landtag 18. Wahlperiode
 BREMISCHE BÜRGERSCHAFT Drucksache 18/992 Landtag 18. Wahlperiode 02.07.13 Mitteilung des Senats vom 2. Juli 2013 über den vom Senat beschlossenen Beitritt zur anliegenden Bundesratsinitiative "Entschließung
BREMISCHE BÜRGERSCHAFT Drucksache 18/992 Landtag 18. Wahlperiode 02.07.13 Mitteilung des Senats vom 2. Juli 2013 über den vom Senat beschlossenen Beitritt zur anliegenden Bundesratsinitiative "Entschließung
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm
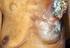 Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
APOTHEKIA SPECIAL DIE PILLE DANACH
 APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international
 Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international Dr. med. Dirk Mentzer Referatsleiter Arzneimittelsicherheit Facharzt für Kinder- und Jugendmedizin Paul-Ehrlich-Institut Bundesinstitut
Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international Dr. med. Dirk Mentzer Referatsleiter Arzneimittelsicherheit Facharzt für Kinder- und Jugendmedizin Paul-Ehrlich-Institut Bundesinstitut
Bezeichnung des Arzneimittels: Vom Pharmazeutischen Unternehmer auszufüllen Pharmazeutischen Unternehmer:
 Fragebogen für Angehörige der Gesundheitsberufe zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln (z. B. CellCept, Myfortic und andere Arzneimittelnamen) während einer Schwangerschaft
Fragebogen für Angehörige der Gesundheitsberufe zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln (z. B. CellCept, Myfortic und andere Arzneimittelnamen) während einer Schwangerschaft
Hochwertige Markenmedikamente müssen nicht teuer sein
 Hochwertige Markenmedikamente müssen nicht teuer sein So günstig? Das gleiche Medikament?! Ja. Import-Arzneimittel sind preiswert und sicher. Das gleiche Medikament importiert bis zu 30 % günstiger. Das
Hochwertige Markenmedikamente müssen nicht teuer sein So günstig? Das gleiche Medikament?! Ja. Import-Arzneimittel sind preiswert und sicher. Das gleiche Medikament importiert bis zu 30 % günstiger. Das
Diskrepanzen zwischen Zulassung und früher Nutzenbewertung Prof. Dr. Karl Broich
 Diskrepanzen zwischen Zulassung und früher Nutzenbewertung Prof. Dr. Karl Broich Gliederung Aufgaben der Zulassung Aktuelle und neue Zulassungswege Rolle des BfArM national/europäisch bei der Zusatznutzenbewertung
Diskrepanzen zwischen Zulassung und früher Nutzenbewertung Prof. Dr. Karl Broich Gliederung Aufgaben der Zulassung Aktuelle und neue Zulassungswege Rolle des BfArM national/europäisch bei der Zusatznutzenbewertung
Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 6 Racecadotril
 Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 6 Racecadotril Antrag auf Entlassung aus der Verschreibungspflicht Racecadotril bei Kindern ab 5 Jahren und Jugendlichen gemeinsam
Sachverständigenausschuss für Verschreibungspflicht (SVA) 72. Sitzung, TOP 6 Racecadotril Antrag auf Entlassung aus der Verschreibungspflicht Racecadotril bei Kindern ab 5 Jahren und Jugendlichen gemeinsam
Mitteilung. Aufruf der PEG zum umsichtigen Einsatz von Antibiotika aus Anlass der Veröffentlichung der Pariser WAAAR Deklaration
 Ihr Kontakt: Prof. Dr. Michael Kresken Geschäftsstelle der PEG Tel.: 02226/908 916 Fax: 02226/908 918 Email: geschaeftsstelle@p-e-g.org Rheinbach, 23. Juni 2014 Aufruf der PEG zum umsichtigen Einsatz von
Ihr Kontakt: Prof. Dr. Michael Kresken Geschäftsstelle der PEG Tel.: 02226/908 916 Fax: 02226/908 918 Email: geschaeftsstelle@p-e-g.org Rheinbach, 23. Juni 2014 Aufruf der PEG zum umsichtigen Einsatz von
Vorlesung Medizinrecht
 Vorlesung Medizinrecht Angewandte Gesundheitswissenschaften Teil 4: Arzneimittel- und Medizinprodukterecht Rechtsanwalt Wolfgang Wiefelspütz Fachanwalt für Medizinrecht Inhaltsangabe A. Einführung B. AMG
Vorlesung Medizinrecht Angewandte Gesundheitswissenschaften Teil 4: Arzneimittel- und Medizinprodukterecht Rechtsanwalt Wolfgang Wiefelspütz Fachanwalt für Medizinrecht Inhaltsangabe A. Einführung B. AMG
Die E-Zigarette eine neue Herausforderung
 Die E-Zigarette eine neue Herausforderung Christina Bethke, Volljuristin, Aktionsbündnis Nichtrauchen (ABNR) Vortrag anläßlich der Hauptstadtbündnissitzung der Fachstelle für Suchtprävention im Land Berlin
Die E-Zigarette eine neue Herausforderung Christina Bethke, Volljuristin, Aktionsbündnis Nichtrauchen (ABNR) Vortrag anläßlich der Hauptstadtbündnissitzung der Fachstelle für Suchtprävention im Land Berlin
Standardarbeitsanweisung (SOP) zur (Nicht)Einstufung von Studienvorhaben als klinische Prüfung nach AMG
 Standardarbeitsanweisung (SOP) zur (Nicht)Einstufung von Studienvorhaben als klinische Prüfung nach AMG Die folgende SOP basiert auf dem EU-Guidance Dokument vom März 2010 mit seinem Decision Tree (siehe
Standardarbeitsanweisung (SOP) zur (Nicht)Einstufung von Studienvorhaben als klinische Prüfung nach AMG Die folgende SOP basiert auf dem EU-Guidance Dokument vom März 2010 mit seinem Decision Tree (siehe
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten
 Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen
 Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen über die Einführung neuer Untersuchungs- und Behandlungsmethoden und die Überprüfung erbrachter vertragszahnärztlicher Leistungen (NUB-Richtlinien)
Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen über die Einführung neuer Untersuchungs- und Behandlungsmethoden und die Überprüfung erbrachter vertragszahnärztlicher Leistungen (NUB-Richtlinien)
Schwerpunkte zur Verbesserung der Arzneimittelsicherheit im Versorgungsprozess
 Schwerpunkte zur Verbesserung der Arzneimittelsicherheit im Versorgungsprozess Ministerialrat a. D. Dr. Horst Möller, ehem. Leiter des Referates Arzneimittelsicherheit des BMG, Außerordentliches Mitglied
Schwerpunkte zur Verbesserung der Arzneimittelsicherheit im Versorgungsprozess Ministerialrat a. D. Dr. Horst Möller, ehem. Leiter des Referates Arzneimittelsicherheit des BMG, Außerordentliches Mitglied
Sicherheitsrelevante Hinweise für medizinische Fachkreise
 Sicherheitsrelevante Hinweise für medizinische Fachkreise für die Therapie des multiplen Myeloms mit Bortezomib in Abhängigkeit von den unterschiedlichen Indikationen im Rahmen der Indikationserweiterung
Sicherheitsrelevante Hinweise für medizinische Fachkreise für die Therapie des multiplen Myeloms mit Bortezomib in Abhängigkeit von den unterschiedlichen Indikationen im Rahmen der Indikationserweiterung
Erivedge Schwangerschaftsverhütungs-Programm:
 Erivedge Schwangerschaftsverhütungs-Programm: Wichtige Informationen zu Empfängnisverhütung und Verhütungsmethoden für männliche und weibliche Patienten, die Erivedge einnehmen. Erivedge kann schwere Geburtsfehler
Erivedge Schwangerschaftsverhütungs-Programm: Wichtige Informationen zu Empfängnisverhütung und Verhütungsmethoden für männliche und weibliche Patienten, die Erivedge einnehmen. Erivedge kann schwere Geburtsfehler
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN
 MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
Lilly Jahressymposium 2008 zur Versorgung von Krebspatienten Nicht kommerzielle Studien in der Onkologie zu Lasten der GKV?
 Lilly Jahressymposium 2008 zur Versorgung von Krebspatienten Nicht kommerzielle Studien in der Onkologie zu Lasten der GKV? Ulrich Dietz Bundesministerium für Gesundheit Berlin, 26. Januar 2007 Arzneimittelversorgung
Lilly Jahressymposium 2008 zur Versorgung von Krebspatienten Nicht kommerzielle Studien in der Onkologie zu Lasten der GKV? Ulrich Dietz Bundesministerium für Gesundheit Berlin, 26. Januar 2007 Arzneimittelversorgung
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen
 Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Entschließung des Bundesrates zur Rezeptfreiheit von Notfallkontrazeptiva auf der Basis von Levonorgestrel - Pille danach -
 Bundesrat Drucksache 555/13 (Beschluss) 05.07.13 Beschluss des Bundesrates Entschließung des Bundesrates zur Rezeptfreiheit von Notfallkontrazeptiva auf der Basis von Levonorgestrel - Pille danach - Der
Bundesrat Drucksache 555/13 (Beschluss) 05.07.13 Beschluss des Bundesrates Entschließung des Bundesrates zur Rezeptfreiheit von Notfallkontrazeptiva auf der Basis von Levonorgestrel - Pille danach - Der
Diagnose MS. Leitfaden zur Therapieauswahl
 Diagnose MS Leitfaden zur Therapieauswahl Vorbereitung ist alles Vor einer Entscheidung für eine Behandlung stehen viele Fragen. Zum einzelnen Wirkstoff. Zum Behandlungsplan. Zur Krankheit generell. Alles
Diagnose MS Leitfaden zur Therapieauswahl Vorbereitung ist alles Vor einer Entscheidung für eine Behandlung stehen viele Fragen. Zum einzelnen Wirkstoff. Zum Behandlungsplan. Zur Krankheit generell. Alles
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP)
 INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP) Wichtige Informationen zu Truvada (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko einer Infektion mit dem
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP) Wichtige Informationen zu Truvada (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko einer Infektion mit dem
Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung
 Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Abteilung Pharmakovigilanz IQWiG im Dialog Köln, 19. Besuchen Sie unsere
Nutzen-Schaden-Bewertung von Arzneimitteln nach der Zulassung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Abteilung Pharmakovigilanz IQWiG im Dialog Köln, 19. Besuchen Sie unsere
Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre
 Gebrauchsinformation: Information für den Anwender Aspecton Eukaps 200 mg Weichkapseln Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre Wirkstoff: Eucalyptusöl Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für den Anwender Aspecton Eukaps 200 mg Weichkapseln Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre Wirkstoff: Eucalyptusöl Lesen Sie die gesamte Packungsbeilage
Beclometason, Fluticason, Mometason und ihre Ester
 Beclometason, Fluticason, Mometason und ihre Ester Sachverständigen-Ausschuss für Verschreibungspflicht 19.01.2016 Sachverständigen-Ausschuss für Verschreibungspflicht 19.01.2016 Seite 1 Hintergrund (I)
Beclometason, Fluticason, Mometason und ihre Ester Sachverständigen-Ausschuss für Verschreibungspflicht 19.01.2016 Sachverständigen-Ausschuss für Verschreibungspflicht 19.01.2016 Seite 1 Hintergrund (I)
Informationsbroschüre für Patientinnen und Patienten. Schwangerschaftsverhütungs-Programm
 Cutterguide: NO Printing Process: Offset; GD: SB32430 Size: 210 (W) x 297 (H) mm Pages:8 Colors: C M Y K (4 Colors); Native File: Indesign CC Windows Generated in: Acrobat Distiller 11.0 Informationsbroschüre
Cutterguide: NO Printing Process: Offset; GD: SB32430 Size: 210 (W) x 297 (H) mm Pages:8 Colors: C M Y K (4 Colors); Native File: Indesign CC Windows Generated in: Acrobat Distiller 11.0 Informationsbroschüre
Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke
 Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 23.11.2016 Inhaltsverzeichnis
Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 23.11.2016 Inhaltsverzeichnis
Tragende Gründe. Vom 21. April 2016
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie zur Empfängnisregelung und zum Schwangerschaftsabbruch: Änderung in Abschnitt B Empfängnisregelung hier:
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie zur Empfängnisregelung und zum Schwangerschaftsabbruch: Änderung in Abschnitt B Empfängnisregelung hier:
Grenzen der Bindungswirkung der Zulassung für die Nutzenbewertung nach 35 a SGB V
 Grenzen der Bindungswirkung der Zulassung für die Nutzenbewertung nach 35 a Rechtsanwalt Prof. Burkhard Sträter Sträter Rechtsanwälte Kronprinzenstraße 20 Fon: +49 (0) 228-934 54-0 mail@straeterlawyers.de
Grenzen der Bindungswirkung der Zulassung für die Nutzenbewertung nach 35 a Rechtsanwalt Prof. Burkhard Sträter Sträter Rechtsanwälte Kronprinzenstraße 20 Fon: +49 (0) 228-934 54-0 mail@straeterlawyers.de
Begutachtung 31 Abs. 6 neu
 Begutachtung 31 Abs. 6 neu Hinweise der SEG 6 Dr. Lili Grell Leiterin der SEG 6 Arzneimittelversorgung der MDK-Gemeinschaft beim MDK Westfalen-Lippe 22. Februar 2017 GKV-SV, Berlin Geschäftsführer: Dr.
Begutachtung 31 Abs. 6 neu Hinweise der SEG 6 Dr. Lili Grell Leiterin der SEG 6 Arzneimittelversorgung der MDK-Gemeinschaft beim MDK Westfalen-Lippe 22. Februar 2017 GKV-SV, Berlin Geschäftsführer: Dr.
Homöopathisches Arzneimittel bei Erkrankungen des Bewegungsapparates Tabletten zum Einnehmen
 Gebrauchsinformation: Information für Patienten Rheumagil Homöopathisches Arzneimittel bei Erkrankungen des Bewegungsapparates Tabletten zum Einnehmen Wirkstoffe: Causticum Hahnemanni Trit. D6, Ferrum
Gebrauchsinformation: Information für Patienten Rheumagil Homöopathisches Arzneimittel bei Erkrankungen des Bewegungsapparates Tabletten zum Einnehmen Wirkstoffe: Causticum Hahnemanni Trit. D6, Ferrum
Wortlaut der für die Packungsbeilage vorgesehenen Angaben
 Zulassungsnummer: 6312395.00.00 Seite 1 von 5 Apothekenpflichtig TUSSISANA Mischung 20 und 50 ml Stoff Darreichungsform Menge Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation:
Zulassungsnummer: 6312395.00.00 Seite 1 von 5 Apothekenpflichtig TUSSISANA Mischung 20 und 50 ml Stoff Darreichungsform Menge Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation:
Erivedge Schwangerschaftsverhütungs-Programm
 behördlich genehmigtes Schulungsmaterial Erivedge Schwangerschaftsverhütungs-Programm Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer
behördlich genehmigtes Schulungsmaterial Erivedge Schwangerschaftsverhütungs-Programm Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer
Der Bundesrat hat ferner die aus der Anlage ersichtliche Entschließung gefasst.
 Bundesrat Drucksache 169/14 (Beschluss) 23.05.14 Beschluss des Bundesrates Verordnung zur Umsetzung der Regelungen der Europäischen Union über die Anerkennung von in anderen Mitgliedstaaten ausgestellten
Bundesrat Drucksache 169/14 (Beschluss) 23.05.14 Beschluss des Bundesrates Verordnung zur Umsetzung der Regelungen der Europäischen Union über die Anerkennung von in anderen Mitgliedstaaten ausgestellten
Anwendungsgebiete Die Anwendungsgebiete leiten sich von den homöopathischen Arzneimittelbildern ab. Dazu gehören:
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER AFLUBIN -Grippetabletten Wirkstoffe: Gentiana lutea D1, Aconitum napellus D6, Bryonia cretica D6, Ferrum phosphoricum D12, Acidum lacticum D12. Lesen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER AFLUBIN -Grippetabletten Wirkstoffe: Gentiana lutea D1, Aconitum napellus D6, Bryonia cretica D6, Ferrum phosphoricum D12, Acidum lacticum D12. Lesen
ARBEITSBOGEN 11: ARZNEIMITTELBERATUNG ÄRZTLICHE VERORDNUNGEN
 I Hinweis zur Bearbeitung des Arbeitsbogens Informieren und beraten Sie einen Patienten über ein Fertigarzneimittel (FAM) bei der Abgabe im Rahmen einer ärztlichen Verordnung. Grundlage des Arbeitsbogens
I Hinweis zur Bearbeitung des Arbeitsbogens Informieren und beraten Sie einen Patienten über ein Fertigarzneimittel (FAM) bei der Abgabe im Rahmen einer ärztlichen Verordnung. Grundlage des Arbeitsbogens
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen
 Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Postkoitalverhütung Informationen für ÄrztInnen und BeraterInnen
 Postkoitalverhütung Informationen für ÄrztInnen und BeraterInnen Warum dieses Faltblatt? Postkoitalverhütung mit Hormonen ist eine seit vielen Jahren gebräuchliche Methode. Trotzdem ist sie bei Frauen
Postkoitalverhütung Informationen für ÄrztInnen und BeraterInnen Warum dieses Faltblatt? Postkoitalverhütung mit Hormonen ist eine seit vielen Jahren gebräuchliche Methode. Trotzdem ist sie bei Frauen
Merkblatt für Tierärzte (Stand )
 Merkblatt für Tierärzte (Stand 15.07.2014) Informationen für Tierärzte zu rechtlichen Bestimmungen zum Tierarzneimittelverkehr innerhalb von EU-Mitgliedstaaten bzw. EWR- Vertragsstaaten Grundsatz Verbringungsverbot
Merkblatt für Tierärzte (Stand 15.07.2014) Informationen für Tierärzte zu rechtlichen Bestimmungen zum Tierarzneimittelverkehr innerhalb von EU-Mitgliedstaaten bzw. EWR- Vertragsstaaten Grundsatz Verbringungsverbot
850 mg / Tablette Zur Anwendung bei Heranwachsenden über 12 Jahren und Erwachsenen Wirkstoff: Natriumhydrogencarbonat
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Original Bullrich Salz Magentabletten 850 mg / Tablette Zur Anwendung bei Heranwachsenden über 12 Jahren und Erwachsenen Wirkstoff: Natriumhydrogencarbonat
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Original Bullrich Salz Magentabletten 850 mg / Tablette Zur Anwendung bei Heranwachsenden über 12 Jahren und Erwachsenen Wirkstoff: Natriumhydrogencarbonat
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Wirkstoffe: Thymiantrockenextrakt, Eibischwurzelflüssigextrakt
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER BRONCHOSTOP sine Hustensaft Wirkstoffe: Thymiantrockenextrakt, Eibischwurzelflüssigextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER BRONCHOSTOP sine Hustensaft Wirkstoffe: Thymiantrockenextrakt, Eibischwurzelflüssigextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Wissenschaftliche Dienste. Sachstand. Einzelfragen zur Impfpflicht Deutscher Bundestag WD /14
 Einzelfragen zur Impfpflicht 2014 Deutscher Bundestag Seite 2 Einzelfragen zur Impfpflicht Aktenzeichen: Abschluss der Arbeit: 11.11.2014 Fachbereich: WD 9: Gesundheit, Familie, Senioren, Frauen und Jugend
Einzelfragen zur Impfpflicht 2014 Deutscher Bundestag Seite 2 Einzelfragen zur Impfpflicht Aktenzeichen: Abschluss der Arbeit: 11.11.2014 Fachbereich: WD 9: Gesundheit, Familie, Senioren, Frauen und Jugend
Was sind klinische Prüfungen Eine Einführung. Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa
 Was sind klinische Prüfungen Eine Einführung Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa Berlin, 28. Januar 2016 Klinische Studie vs. Klinische Prüfung Wie
Was sind klinische Prüfungen Eine Einführung Dr. Thorsten Ruppert Senior Referent Grundsatzfragen Forschung/Entwicklung/Innovation, vfa Berlin, 28. Januar 2016 Klinische Studie vs. Klinische Prüfung Wie
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Wirkstoffe: Thymiantrockenextrakt, Eibischwurzelflüssigextrakt
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER BRONCHOSTOP Thymian Eibisch sine Hustensaft Wirkstoffe: Thymiantrockenextrakt, Eibischwurzelflüssigextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER BRONCHOSTOP Thymian Eibisch sine Hustensaft Wirkstoffe: Thymiantrockenextrakt, Eibischwurzelflüssigextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig
Die Pille danach. Sandoz Pharmaceuticals AG Hinterbergstrasse Cham 2 Tel Fax a Novartis company
 Sandoz Pharmaceuticals AG Hinterbergstrasse 24 6330 Cham 2 Tel. 041 748 85 85 Fax 041 748 85 86 www.generika.ch Die Pille danach. a Novartis company 90681/November 2007 Was ist eine Notfallverhütung oder
Sandoz Pharmaceuticals AG Hinterbergstrasse 24 6330 Cham 2 Tel. 041 748 85 85 Fax 041 748 85 86 www.generika.ch Die Pille danach. a Novartis company 90681/November 2007 Was ist eine Notfallverhütung oder
WS 2009/2010 Vorlesung - Spezielles Arzneimittelrecht. Mittwoch, 11. November 2009 Schwerpunktthema: Pandemie-Teil IV
 Ministerium für,,, und WS 2009/2010 Vorlesung - Spezielles Arzneimittelrecht Mittwoch, 11. November 2009 Schwerpunktthema: Pandemie-Teil IV -Dr. Michael Cramer-2009-11-11 Folie 1 ÖGD-Weg Ministerium Ministerium
Ministerium für,,, und WS 2009/2010 Vorlesung - Spezielles Arzneimittelrecht Mittwoch, 11. November 2009 Schwerpunktthema: Pandemie-Teil IV -Dr. Michael Cramer-2009-11-11 Folie 1 ÖGD-Weg Ministerium Ministerium
TOP 14 Ipratropiumbromid
 TOP 14 Ipratropiumbromid 69. Sitzung SVA Verschreibungspflicht 26. Juni 2012 Aktueller Antrag Zusatz bei der Position Ipratropiumbromid : ausgenommen zur intranasalen Anwendung in einer Konzentration bis
TOP 14 Ipratropiumbromid 69. Sitzung SVA Verschreibungspflicht 26. Juni 2012 Aktueller Antrag Zusatz bei der Position Ipratropiumbromid : ausgenommen zur intranasalen Anwendung in einer Konzentration bis
Succimer. Sachverständigen-Ausschuss für Verschreibungspflicht 28. Juni 2016
 Succimer Sachverständigen-Ausschuss für Verschreibungspflicht 28. Juni 2016 Sachverständigen-Ausschuss für Verschreibungspflicht 28. Juni 2016 Seite 1 Hintergrund Nebenwirkungsmeldung zu einem anaphylaktischen
Succimer Sachverständigen-Ausschuss für Verschreibungspflicht 28. Juni 2016 Sachverständigen-Ausschuss für Verschreibungspflicht 28. Juni 2016 Seite 1 Hintergrund Nebenwirkungsmeldung zu einem anaphylaktischen
Anforderungen an die Aufbereitung von Medizinprodukten Gesundheitssystem Pflichten Reinigung Desinfektion Sterilisation Haftung
 Positionspapier Anforderungen an die Aufbereitung von Medizinprodukten Pflichten der Hersteller und Pflichten der GesundheitssystemAufbereitun Pflichten Reinigung Desinfektion Sterilisation Haftung Hygiene
Positionspapier Anforderungen an die Aufbereitung von Medizinprodukten Pflichten der Hersteller und Pflichten der GesundheitssystemAufbereitun Pflichten Reinigung Desinfektion Sterilisation Haftung Hygiene
Können Sie mir sagen, ob...? Arzneimittelinformation beim Krebsinformationsdienst, Deutsches Krebsforschungszentrum
 Anke Ernst 12.01.2013 Können Sie mir sagen, ob...? Arzneimittelinformation beim Krebsinformationsdienst, Deutsches Krebsforschungszentrum Dr. rer. nat. Anke Ernst Krebsinformationsdienst KID Deutsches
Anke Ernst 12.01.2013 Können Sie mir sagen, ob...? Arzneimittelinformation beim Krebsinformationsdienst, Deutsches Krebsforschungszentrum Dr. rer. nat. Anke Ernst Krebsinformationsdienst KID Deutsches
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 31 Schwindeltropfen Mag. Doskar Conium maculatum D4, Veratrum album D4, Anamirta cocculus D4, Secale cornutum D4, Cinchona pubescens D3. Lesen Sie die
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 31 Schwindeltropfen Mag. Doskar Conium maculatum D4, Veratrum album D4, Anamirta cocculus D4, Secale cornutum D4, Cinchona pubescens D3. Lesen Sie die
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Homvio-Em, Tabletten Wirkstoffe: Apomorphinum hydrochloricum Trit. D3, Cocculus Trit.
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Homvio-Em, Tabletten Wirkstoffe: Apomorphinum hydrochloricum Trit. D3, Cocculus Trit. D3 Lesen Sie bitte die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Homvio-Em, Tabletten Wirkstoffe: Apomorphinum hydrochloricum Trit. D3, Cocculus Trit. D3 Lesen Sie bitte die gesamte Packungsbeilage sorgfältig durch,
Beteiligung von Patienten an der Bewertung von Arzneimitteln bei der Zulassung und der Nutzen-Schaden- Bewertung
 Beteiligung von Patienten an der Bewertung von Arzneimitteln bei der Zulassung und der Nutzen-Schaden- Bewertung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte, Bonn Gesundheit e.v. 10.
Beteiligung von Patienten an der Bewertung von Arzneimitteln bei der Zulassung und der Nutzen-Schaden- Bewertung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte, Bonn Gesundheit e.v. 10.
octenisept Wund-Desinfektion ist ein Antiseptikum zur wiederholten, zeitlich begrenzten unterstützenden antiseptischen Wundbehandlung.
 Gebrauchsinformation: Information für den Anwender OCTENISEPT WUND-DESINFEKTION Antiseptikum zur unterstützenden Wundbehandlung Lösung zum Aufsprühen auf die Wunde Wirkstoffe: 0.1 g Octenidinhydrochlorid
Gebrauchsinformation: Information für den Anwender OCTENISEPT WUND-DESINFEKTION Antiseptikum zur unterstützenden Wundbehandlung Lösung zum Aufsprühen auf die Wunde Wirkstoffe: 0.1 g Octenidinhydrochlorid
Sichere Medikamentenverordnung auf der Intensivstation - was Apotheker und Intensivmediziner voneinander lernen können
 Sichere Medikamentenverordnung auf der Intensivstation - was Apotheker und Intensivmediziner voneinander lernen können 03.12.2015 Dr. Georg Langebartels Stabsabteilung Klinikangelegenheiten & Krisenmanagement
Sichere Medikamentenverordnung auf der Intensivstation - was Apotheker und Intensivmediziner voneinander lernen können 03.12.2015 Dr. Georg Langebartels Stabsabteilung Klinikangelegenheiten & Krisenmanagement
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Nr. 17 Schultropfen für Jugendliche Mag. Doskar Strophanthus gratus D4, Ambra grisea D3.
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 17 Schultropfen für Jugendliche Mag. Doskar Strophanthus gratus D4, Ambra grisea D3. Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 17 Schultropfen für Jugendliche Mag. Doskar Strophanthus gratus D4, Ambra grisea D3. Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Werbung von Ärzten Die Heilmittelwerbegesetz- Novelle
 Werbung von Ärzten Die Heilmittelwerbegesetz- Novelle Das Werbeverbot für Ärzte ist im Heilmittelwerbegesetz (HWG) geregelt. Bis zum Herbst 2012 unterlag das HWG strengen Anforderungen. Gemäß 11 HWG durfte
Werbung von Ärzten Die Heilmittelwerbegesetz- Novelle Das Werbeverbot für Ärzte ist im Heilmittelwerbegesetz (HWG) geregelt. Bis zum Herbst 2012 unterlag das HWG strengen Anforderungen. Gemäß 11 HWG durfte
Leitfaden für Ärzte und Apotheker
 SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
Leitfaden für Ärzte und Apotheker
 SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
Hinweise für Apotheker zur Abgabe von Ciscutan (Isotretinoin)
 Hinweise für Apotheker zur Abgabe von Ciscutan (Isotretinoin) Einführung Ciscutan (Isotretinoin) ist stark teratogen. Aufgrund des hohen Risikos für ernsthafte und sehr schwerwiegende Missbildungen beim
Hinweise für Apotheker zur Abgabe von Ciscutan (Isotretinoin) Einführung Ciscutan (Isotretinoin) ist stark teratogen. Aufgrund des hohen Risikos für ernsthafte und sehr schwerwiegende Missbildungen beim
MEDIKAMENTE, DIE MYCOPHENOLAT ENTHALTEN Informationsbroschüre für Patienten. Informationen über die Risiken für den Fötus
 Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Zubereitung aus Ibuprofen und Coffein
 Zubereitung aus Ibuprofen und Coffein Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Seite 1 Antrag Kombination
Zubereitung aus Ibuprofen und Coffein Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Januar 2017 Seite 1 Antrag Kombination
Bald in Deutschland erlaubt: Diese Pille schützt vor HIV
 Seite 1 von 7 Suchbegriff eingeben Adresse dieses Artikels: http://www.bildderfrau.de/gesundheit/article208318457/bald-in-deutschland-erlaubt-diese-pille-schuetzt-vor-hiv.html TRUVADA Bald in Deutschland
Seite 1 von 7 Suchbegriff eingeben Adresse dieses Artikels: http://www.bildderfrau.de/gesundheit/article208318457/bald-in-deutschland-erlaubt-diese-pille-schuetzt-vor-hiv.html TRUVADA Bald in Deutschland
Selbstmedikation - zwischen geeignet und problematisch
 Selbstmedikation - zwischen geeignet und problematisch Johanna Lederer, Stiftung Warentest 7.10.2016 2016 Stiftung Warentest Kurze Übersicht Teil 1: Medikamente haben in Deutschland eine hohe Qualität
Selbstmedikation - zwischen geeignet und problematisch Johanna Lederer, Stiftung Warentest 7.10.2016 2016 Stiftung Warentest Kurze Übersicht Teil 1: Medikamente haben in Deutschland eine hohe Qualität
Bekanntmachung über die Zulassung, Nachzulassung und Registrierung von Arzneimitteln (Empfehlungen der Kommission D
 Bekanntmachung über die Zulassung, Nachzulassung und Registrierung von Arzneimitteln (Empfehlungen der Kommission D nach 25 Abs. 6 und Abs. 7 des Arzneimittelgesetzes zur Planung und Durchführung homöopathischer
Bekanntmachung über die Zulassung, Nachzulassung und Registrierung von Arzneimitteln (Empfehlungen der Kommission D nach 25 Abs. 6 und Abs. 7 des Arzneimittelgesetzes zur Planung und Durchführung homöopathischer
Orphan Drugs. Arzneimitteltherapie seltener Krankheiten
 Orphan Drugs Arzneimitteltherapie seltener Krankheiten Seltene Krankheiten 30 Millionen Europäer, davon etwa 4 Millionen Deutsche, leiden an seltenen Krankheiten. Als selten gilt hier eine Krankheit, wenn
Orphan Drugs Arzneimitteltherapie seltener Krankheiten Seltene Krankheiten 30 Millionen Europäer, davon etwa 4 Millionen Deutsche, leiden an seltenen Krankheiten. Als selten gilt hier eine Krankheit, wenn
Zubereitung aus Ibuprofen und Coffein
 Zubereitung aus Ibuprofen und Coffein Sachverständigen-Ausschuss für Verschreibungspflicht 27. Juni 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Juni 2017 Seite 1 Antrag Kombination aus
Zubereitung aus Ibuprofen und Coffein Sachverständigen-Ausschuss für Verschreibungspflicht 27. Juni 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Juni 2017 Seite 1 Antrag Kombination aus
Rechtliche Aspekte zum Einsatz von Medizinprodukten bei Nagelpilzerkrankungen. Dr. Claudia Nawroth 26. März 2007
 Rechtliche Aspekte zum Einsatz von Medizinprodukten bei Nagelpilzerkrankungen Dr. Claudia Nawroth 26. März 2007 Nagelpilzerkrankungen in der Werbung Gestiegene Aufmerksamkeit der Verbraucher in Bezug auf
Rechtliche Aspekte zum Einsatz von Medizinprodukten bei Nagelpilzerkrankungen Dr. Claudia Nawroth 26. März 2007 Nagelpilzerkrankungen in der Werbung Gestiegene Aufmerksamkeit der Verbraucher in Bezug auf
Antrag auf Entlassung aus der Verschreibungspflicht. -Doramectin-
 Antrag auf Entlassung aus der Verschreibungspflicht Antrag auf Entlassung von Doramectin aus der Verschreibungspflicht für die topische Anwendung bei Königspython, Abgottschlange und Bartagame bei einem
Antrag auf Entlassung aus der Verschreibungspflicht Antrag auf Entlassung von Doramectin aus der Verschreibungspflicht für die topische Anwendung bei Königspython, Abgottschlange und Bartagame bei einem
