Brand- und Löschlehre
|
|
|
- Heiko Hochberg
- vor 6 Jahren
- Abrufe
Transkript
1 59 Seiten Lernunterlage Brand- und Löschlehre Dezernat 11: Grundlagen/ABC-Schutz Ausgabe: Autoren: Oliver Wegner, Frank Wenking, Jürgen Uphoff Urheberrecht IdF NRW, Münster 2007, alle Rechte vorbehalten. Die vorliegende Lernunterlage darf, auch auszugsweise, ohne die schriftliche Genehmigung des IdF NRW nicht reproduziert, übertragen, umgeschrieben, auf Datenträger gespeichert oder in eine andere Sprache bzw. Computersprache übersetzt werden, weder in mechanischer, elektronischer, magnetischer, optischer, chemischer oder manueller Form. Der Vervielfältigung für die Verwendung bei Ausbildungen der Feuerwehren des Landes Nordrhein- Westfalen wird zugestimmt. Inhalt In dieser Lernunterlage werden die naturwissenschaftlichen Grundlagen im Bereich der Brand- und Löschlehre behandelt. Der erste Teil umfasst die Brandlehre, wobei auf den Zusammenhang zwischen Oxidation und Verbrennung, den Brandklassen sowie im Besonderen auf die Voraussetzungen einer Verbrennung eingegangen wird. Der zweite Teil befasst sich mit der Löschlehre. Dort werden die einzelnen Löschmethoden näher beschrieben. Außerdem wird auf die Eignung und Wirkung der gebräuchlichen Löschmittel mit ihren Vor- und Nachteilen eingegangen. Anmerkung: Eine Schreibweise, die beiden Geschlechtern gleichermaßen gerecht wird, wäre sehr angenehm. Da aber entsprechende neuere Schreibweisen in der Regel zu großen Einschränkungen der Lesbarkeit führen, wurde darauf verzichtet. So gilt für die gesamte Lernunterlage, dass die maskuline Form, wenn nicht ausdrücklich anders benannt, für beide Geschlechter gilt.
2 Inhaltsverzeichnis 1 Einleitung Brandlehre Oxidation und Verbrennung Erscheinungsform einer Verbrennung Voraussetzungen einer Verbrennung Brennbare Stoffe Sauerstoff Mengenverhältnis (Stöchiometrische Zusammensetzung) Flammpunkt und Brennpunkt Zündtemperatur und Mindestverbrennungstemperatur Katalysator Verbrennungsgeschwindigkeit Flash over und Backdraft Löschlehre Löschmethoden Stickeffekt Kühleffekt Inhibition Die Löschmittel Löschmittel Wasser Physikalische Eigenschaften von Wasser Anwendung von Wasser Zusätze zum Löschwasser Einsatzverbote für das Löschmittel Wasser Die bedingte Anwendbarkeit von Wasser Umweltschutzmaßnahmen Löschmittel Schaum Allgemeines Zumischung Verschäumungszahl Wasserhalbzeit (50 % Wasserabscheidung) Zerstörungsrate Schaummittelarten Schaummittelklassen Leistungskenndaten Kennzeichnung der Schäume bzw. der Behälter Einsatzgrundsätze Schaummittelberechnung Netzmittel Class A Foam Druckluftschaum CAFS Compressed Air Foam System Löschmittel Pulver BC-Löschpulver ABC-Löschpulver D-Löschpulver Einsatzgrundsätze Löschmittel Kohlenstoffdioxid Sonstige Löschmittel Anwendungsbereiche der Löschmittel Zusammenfassung Literaturhinweise...59 LU Seite 2 / 59
3 1 Einleitung Das Feuerschutz- und Hilfeleistungsgesetz Nordrhein-Westfalen regelt die Zuständigkeit der Feuerwehr für die Bekämpfung von Schadenfeuern. In der heutigen Zeit fallen unter den Begriff Schadenfeuer eine Vielzahl von Bränden mit unterschiedlichen Materialien und Eigenschaften. Das Ziel dieser Lernunterlage ist es, dem Feuerwehrmann die Grundlagen der Brandlehre zu vermitteln, insbesondere die Voraussetzungen einer Verbrennung, um diese gezielt und sicher mit den bekannten Löschmethoden und den daraus resultierenden Löschmitteln zu bekämpfen. 2 Brandlehre 2.1 Oxidation und Verbrennung Eine Oxidation ist eine Verbindung eines Stoffes mit Sauerstoff (lateinisch: Oxygenium). Dabei handelt es sich um eine chemische Reaktion, bei dem der Sauerstoff als Oxidationsmittel dient. Das bei dieser Reaktion neu entstehende Produkt wird als Oxid bezeichnet, welches vollkommen andere Eigenschaften besitzt als die beiden Ausgangsstoffe. Oxidation Beispiel: C + O 2 => CO 2 Kohlenstoff (C) reagiert mit Sauerstoff (O 2 ) zu Kohlenstoffdioxid (CO 2 ) Bei der Oxidation wird ein Teil der in den Ausgangsstoffen enthaltenen chemischen Energie in Wärmeenergie umgesetzt. Man bezeichnet diesen Vorgang als exotherme Reaktion. Die Geschwindigkeit einer Oxidation ist sehr unterschiedlich. Bei langsam ablaufenden Oxidationen ist die freiwerdende Wärmemenge so gering, dass man sie nicht oder kaum nachweisen kann. Bei einer sehr schnellen Oxidation wird jedoch die Energieumsetzung soweit gesteigert, dass bei dieser Reaktion sehr viel Wärme frei wird. In der Regel tritt dabei auch eine Lichterscheinung auf. Diesen besonderen Oxidationsvorgang bezeichnet man Verbrennung. Verbrennung LU Seite 3 / 59
4 Oxidation Verbindung von Stoffen mit Sauerstoff Beispiel: langsamer Ablauf Rosten von Eisen Verwesung von organischen Stoffen Stoffwechsel im menschlichen Körper Beispiel: schneller Verlauf Verbrennungsreaktion Glühen von Kohle Gasflamme Explosion von aufgewirbeltem Staub Jede Verbrennung ist eine Oxidation, jedoch ist nicht jede Oxidation zwangsläufig eine Verbrennung. Der Unterschied liegt in der Reaktionsgeschwindigkeit. Eisen + Sauerstoff Eisen-(III)-oxid (Fe 2 O 3 ) insgesamt freigesetzte Wärmemenge Q = kj Ablauf als Rosten Dauer: 1Jahr v = 0,234 J/s Ablauf als Eisenstaubexplosion Dauer: 3 Sekunden Beispiel: Bildung von Eisen-(III)-Oxid aus 1 kg Eisen durch Sauerstoffaufnahme. Wärmefreisetzungsgeschwindigkeit: Wärmefreisetzungsgeschwindigkeit: v = J/s Der Vergrößerungsfaktor der Wärmefreisetzungsgeschwindigkeit beträgt etwa 10,6 Millionen. Dieses Kilogramm Eisen kann entweder langsam durch Rosten oder durch eine schnell ablaufende Eisenstaubexplosion oxidieren. LU Seite 4 / 59
5 2.2 Erscheinungsform einer Verbrennung Das Feuer ist die äußere, sichtbare Begleiterscheinung einer Verbrennung. Je nach Aggregatzustand des brennbaren Stoffes kann das Feuer in verschiedenen Erscheinungsformen, nämlich als Flamme und/oder Glut, auftreten. Nutzfeuer/Schadenfeuer Glut Flamme Dämpfe/Gase Flüssigkeiten verdampfen Feststoffe schmelzen sublimieren Abbildung 1: Erscheinungsformen der Verbrennung [Frank Wenking, IdF NRW] Gasförmige Stoffe verbrennen mit Flammenerscheinung (z.b.: Erdgas, Feuerzeuggas). Flüssige Stoffe verdampfen und gehen dabei in den gasförmigen Aggregatzustand über. Sie verbrennen mit Flammenbildung (z.b. Benzin, Alkohol). Bei festen Stoffen gibt es drei Möglichkeiten der Verbrennung. Sie können nur unter Flammenbildung verbrennen, indem sie erst schmelzen und danach verdampfen (z.b.: Wachs, Harz). Die Verbrennung unter Glutbildung ist ebenfalls möglich (z.b.: Eisen, Aluminium, Magnesium). Die meisten Feststoffe verbrennen aber mit Glut- und Flammenbildung. Die gasförmigen Bestandteile des Stoffes sublimieren und verbrennen mit Flamme, der feste Bestandteil bildet die Glut (z.b.: Holz, Papier, Kohle). 2.3 Voraussetzungen einer Verbrennung Die Verbrennung ist ein chemisch-physikalischer Vorgang, für den stoffliche und energetische Voraussetzungen erfüllt sein müssen. Die stofflichen Voraussetzungen einer Verbrennung sind: brennbarer Stoff Voraussetzung der Verbrennung Sauerstoff stöchiometrisches Mengenverhältnis (Verhältnis zwischen dem brennbaren Stoff und Sauerstoff) LU Seite 5 / 59
6 Die energetischen Voraussetzungen einer Verbrennung sind: Zündtemperatur (Aktivierungsenergie) bzw. Mindestverbrennungstemperatur Katalysator Voraussetzungen für eine Verbrennung stoffliche (chemische) Voraussetzungen brennbarer Stoff energetische (physikalische) Voraussetzungen Zündtemperatur bzw. Mindestverbrennungstemperatur Sauerstoff Katalysator Mengenverhältnis Brennbare Stoffe Brennbarer Stoff Brennbare Stoffe sind gasförmige, flüssige oder feste Stoffe einschließlich Dämpfe, Nebel und Stäube, die im Gemisch oder im Kontakt mit Sauerstoff zum Brennen angeregt werden können. vgl. [1] Ein brennbarer Stoff muss Bestandteile im Bereich der Atome und Moleküle besitzen, die in der Lage sein müssen, mit dem Sauerstoff zu reagieren. Beispiele: 2H 2 + O 2 2H 2 O Wasserstoff reagiert mit Sauerstoff zu Wasser. C + O 2 CO 2 Kohlenstoff reagiert mit Sauerstoff zu Kohlenstoffdioxid. He + O 2 keine Reaktion Helium ist ein Edelgas und reagiert nicht mit Sauerstoff. Helium ist kein brennbarer Stoff. Brennbare Stoffe können in drei verschiedenen Aggregatzuständen vorliegen. Unter Einwirkung von Wärme (Energie) kann ein Stoff seinen Aggregatzustand verändern. LU Seite 6 / 59
7 Abbildung 2: Aggregatzustände [Grafik: Frank Wenking, IdF NRW] Stoffe, die ein ähnliches Brandverhalten aufweisen, werden in Brandklassen nach DIN EN 2 zusammengefasst. Diese Einteilung dient der Zuordnung der Löschmittel zu den brennbaren Stoffen. Brandklassen Brandklassen Art der Brände Erscheinungsbild der Verbrennung Beispiele Brände fester Stoffe Brände flüssiger oder flüssig werdender Stoffe Flammenund/oder Glutbildung Flammenbildung Stroh, Holz, Papier, Textilien, Kunststoffe, Kohle Benzin, Diesel, Öl, Alkohol, Lack, Teer, Kerzenwachs Brände von Gasen Flammenbildung Erdgas, Acetylen, Propan, Butan, Methan Brände von Metallen und Legierungen Glutbildung Aluminium, Magnesium, Natrium, Stahlwolle Brände von Speiseölen und -fetten Flammenbildung Tabelle 1: Brandklassen [Frank Wenking, IdF NRW] Bildzeichen Brandklasse A,B,C,D in Spalte 1 nach DIN 14406; pflanzliche Öle oder Fette in Kücheneinrichtungen und -geräten. Bildzeichen Brandklasse F in Spalte 1 nach ISO 7195/Amd 1:2004 LU Seite 7 / 59
8 Brandklasse A: In diese Brandklasse gehören alle Brände fester brennbarer Stoffe, die normalerweise unter Glutbildung verbrennen. Aufgrund von Wärmeeinwirkung gehen feste brennbare Stoffe auch in den gasförmigen Zustand über und verbrennen daher auch mit Flammenbildung. vgl. [2][3] Brandklasse B: In die Brandklasse B fallen alle Brände flüssiger und bei Erwärmung flüssig werdender brennbarer Stoffe. Flüssige brennbare Stoffe verdampfen, flüssig werdende brennbare Stoffe schmelzen und verdampfen anschließend, wobei beide ausschließlich mit Flammenbildung verbrennen. Die Gefährlichkeit der Stoffe der Brandklasse B lässt sich an den sicherheitstechnischen Kennzahlen, wie zum Beispiel Verdunstungszahl, Flammpunkt, Explosionsgrenzen oder Zündtemperatur, erkennen. vgl. [2][3] Brandklasse C: Alle Brände brennbarer Gase, deren Siedepunkt bei Normaldruck unter 20 C liegt, gehören in die Brandklasse C. Auch für diese Brandklasse sind sicherheitstechnische Kennzahlen von Bedeutung. vgl. [2][3] Brandklasse D: Zur Brandklasse D gehören die Brände brennbarer Metalle. Außer den Edelmetallen und einigen anderen, sind fast alle Metalle, insbesondere Leichtmetalle, unter bestimmten Bedingungen brennbar. Die Metalle verbrennen mit Temperaturen von 2000 C bis 3000 C. Diese relativ hohen Verbrennungstemperaturen führen dazu, dass die Löschmittel der Brandklasse A hier nicht geeignet sind. vgl. [2][3] Brandklasse F: Die Brandklasse F betrifft Brände von Speiseölen/-fetten (pflanzliche oder tierische Öle und Fette) in Frittier- und Fettbackgeräten und anderen Kücheneinrichtungen und -geräten. vgl. [2] Diese Brände gehören grundsätzlich in die Brandklasse B, aber aufgrund besonderer Gefahren, die häufig zu Unfällen oder Problemen führten, sind spezielle Löschmittel entwickelt worden, die nur für diese Art von Bränden verwendbar sind Sauerstoff Sauerstoff Der Sauerstoff (chemisches Zeichen: O; lateinisch Oxygenium = Säurebilder) ist der Reaktionspartner jeder Verbrennung und somit neben dem brennbaren Stoff die zweite fundamentale Voraussetzung für eine Verbrennung. Es ist ein LU Seite 8 / 59
9 farbloses, geruchloses, geschmackloses und nicht brennbares Gas. Allerdings ist der Sauerstoff ein sehr reaktionsfreudiges Element. Sauerstoff, ein zweiatomiges Molekül, ist mit 21 Vol.-% ein elementarer Bestandteil der Luft. Sauerstoff kann aber auch in anderen Verbindungen in einem gebundenen Zustand vorliegen. (vgl. ADR/RID Klasse 5.1 und 5.2) Edelgase 0,93% Sauerstoff 20,94% Kohlendioxid 0,03% Stickstoff 78,10% Abbildung 3: Zusammensetzung der Luft [Frank Wenking, IdF NRW] Eine Verbrennung verläuft je nach Sauerstoffgehalt schneller oder langsamer. Während in gewöhnlicher Luft mit der gerade beschriebenen Zusammensetzung die meisten Verbrennungen beherrschbar bleiben, verlaufen sie in reinem Sauerstoff rascher und intensiver ab. Gleichzeitig erhöht sich auch die Entzündbarkeit eines brennbaren Stoffes soweit, dass es zu einer Selbstentzündung kommen kann. Das kann sogar dazu führen, dass schwer entzündbare Stoffe, wie beispielsweise Eisen, in reinem Sauerstoff brennbar sind. Bei einer Herabsetzung der Sauerstoffkonzentration verringert sich die Verbrennungsgeschwindigkeit, bis irgendwann die Verbrennungsreaktion stoppt. Zur Aufrechterhaltung einer Verbrennung ist demnach eine Mindestsauerstoffkonzentration notwendig. Die jeweiligen Sauerstoffgrenzen hängen von den vorliegenden brennbaren Stoffen sowie von dem Verhältnis Oberfläche zur Masse des brennbaren Stoffes ab. Die meisten brennbaren Stoffe benötigen eine Mindestsauerstoffkonzentration von etwa 15 Vol.-% O 2. Es gibt aber Stoffe, die noch weit unter dieser Konzentration zum Brennen angeregt werden können. Mindestsauerstoffkonzentration Beispiele: - Kerze (Wachs) 17 Vol.-% O 2 - Butan 12 Vol.-% O 2 - Wasserstoff 5 Vol.-% O 2 LU Seite 9 / 59
10 2.3.3 Mengenverhältnis (Stöchiometrische Zusammensetzung) Mengenverhältnis Explosionsgrenzen UEG Explosionsbereich OEG Unter dem Mengenverhältnis (stöchiometrische Zusammensetzung) versteht man das jeweils vorliegende Verhältnis der Menge des brennbaren Stoffes zu der Menge des Sauerstoffs. Damit eine optimale Verbrennung ablaufen kann, muss dem brennbaren Stoff eine ganz bestimmte Menge an Sauerstoff zur Verfügung stehen. Ist dies der Fall, dann ist die Verbrennungsgeschwindigkeit am größten. Beispielsweise benötigt ein Kilogramm Kohlenstoff zur vollständigen Verbrennung etwa Liter Sauerstoff bzw Liter Luft. Je besser die stöchiometrische Zusammensetzung aus dem brennbaren Stoff und dem Sauerstoff ist, desto rascher verläuft die Verbrennung. Je weiter man sich vom richtigen Mengenverhältnis entfernt, desto langsamer verläuft die Oxidation, bis schließlich die Grenze der Verbrennungsmöglichkeit erreicht ist. Diese Grenze bezeichnet man als untere und obere Explosionsgrenze (UEG, OEG). Den Bereich innerhalb dieser Explosionsgrenzen in dem eine Zündung und Verbrennung des Gemisches möglich ist, bezeichnet man als Explosionsbereich. Die untere Explosionsgrenze ist die niedrigste Konzentration eines brennbaren Stoffes im Gemisch von Gasen, Nebel, Dämpfen und/oder Stäuben in Luft, in der sich eine Verbrennung nach dem Zünden gerade nicht mehr selbstständig fortsetzt. vgl. [1] Wird diese Grenze überschritten ist ein selbstständiges Brennen bis zum Erreichen der oberen Explosionsgrenze möglich. vgl. [1] Bei Erreichen der oberen Explosionsgrenze liegt die höchste Konzentration eines brennbaren Stoffes im Gemisch von Gasen, Nebel, Dämpfen und/oder Stäuben in Luft vor, in dem sich nach dem Zünden ein selbstständiges Brennen gerade nicht fortsetzt. vgl. [1] Die in der Literatur angegebenen Werte für Explosionsgrenzen beziehen sich auf die Sauerstoffkonzentration in der Luft. Durch eine Erhöhung der Sauerstoffkonzentration kann man diesen Bereich erweitern. UEG OEG Gemisch zu mager Explosionsbereich Gemisch zu fett 0 Vol.-% brennbarer Stoff Vol.-% in Luft 100 Vol.-% Abbildung 4: Explosionsgrenzen [Frank Wenking, IdF NRW] Beim optimalen Gemisch (stöchiometrisches Mengenverhältnis) liegen Brennstoff und Sauerstoff in einem optimalen Verhältnis zueinander vor. Dieses Gemisch ist dadurch gekennzeichnet, dass ein zündfähiges Gemisch mit der niedrigsten notwendigen Zündenergie vorliegt. Die Verbrennung läuft mit der LU Seite 10 / 59
11 höchsten Flammentemperatur bzw. mit dem größten Explosionsdruck ab und besitzt die maximale Verbrennungsgeschwindigkeit. Beispiele: Acetylen 2,4% - 83% Benzin 0,6% - 8% CO 12,5% - 74% 0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100% Vol.-% Daten: LUA NRW, Informationssystem für gefährliche Stoffe, IGS-Fire 04/2004 Abbildung 5: Beispiele Ex-Bereiche [Frank Wenking, IdF NRW] Flammpunkt und Brennpunkt Das für einen Verbrennungsvorgang richtige Mischungsverhältnis zwischen dem brennbaren Stoff und dem Sauerstoff wird besonders bei der Verbrennung von Dämpfen brennbarer Flüssigkeiten deutlich. Brennbare Flüssigkeiten brennen nicht selber, sondern nur ihre Dämpfe. Flüssigkeiten geben bei jeder Temperatur Dämpfe ab (Verdunstung aufgrund des Dampfdruckes einer Flüssigkeit), d.h. sie verdunsten ständig. Bevor nun eine Zündung und Verbrennung erfolgen kann, muss eine ausreichende Dampfkonzentration über der Flüssigkeitsoberfläche vorhanden sein. Beispiel: Dieselkraftstoff Abbildung 6: Flammpunkt Diesel [Oliver Wegner, Fw Waltrop] 20 C: Es entwickeln sich zwar über der Flüssigkeitsoberfläche aufgrund der ständigen Verdunstung Dämpfe, deren Menge jedoch für eine Entzündung nicht ausreicht. LU Seite 11 / 59
12 60 C: Bei dieser Temperatur entwickeln sich so viele Dämpfe, dass über der Flüssigkeit ein zündfähiges Dampf-Luft-Gemisch vorliegt. Die untere Explosionsgrenze (UEG) ist somit erreicht. Flammpunkt Aus diesem Grund definiert man den sogenannten Flammpunkt, der eine besonders wichtige sicherheitstechnische Kennzahl darstellt. Definition: DIN 51755, Der Flammpunkt einer brennbaren Flüssigkeit ist die niedrigste Flüssigkeitstemperatur, bei der sich unter festgelegten Bedingungen Dämpfe in einer solchen Menge bilden, dass über dem Flüssigkeitsspiegel ein durch Fremdentzündung entzündbares Dampf-Luft-Gemisch entsteht. vgl. auch [1] Zur Gefahrbeurteilung ist der Flammpunkt von besonderer Bedeutung. So sind Flüssigkeiten mit niedrigen Flammpunkten besonders gefährlich, da sich beim Freiwerden dieser Stoffe in kurzer Zeit zündfähige Dampf/Luft-Gemische bilden können. Stoff Flammpunkt Stoff Flammpunkt C C Methanol 11 Schwefelkohlenstoff -30 Ethanol 12 Heizöl > 40 Glycerin 176 Dieselkraftstoff > 55 Aceton -19 Ottokraftstoff < -20 Terpentinöl 33 Kerosin > 38 Benzol -11 Leuchtpetroleum Daten: LUA NRW, Informationssystem für gefährliche Stoffe, IGS-Fire 04/2004 Tabelle 2: Beispiele für Flammpunkte [Frank Wenking, IdF NRW] Nach der Entzündung verbrennt die Dampfmenge mit kurzem Aufflammen, erlischt dann aber wieder, da die Dampfbildungsgeschwindigkeit kleiner als die Verbrennungsgeschwindigkeit ist. Brennpunkt Erst am Brennpunkt, der einige Temperaturgrade über dem Flammpunkt liegt, werden Dämpfe in solcher Menge gebildet, dass ein fortlaufendes Brennen möglich ist. Die Differenz dieser beiden Punkte beträgt nur wenige Grad Celsius ( C). Aus diesem Grund ist der Brennpunkt für die Feuerwehrpraxis von sekundärer Bedeutung. LU Seite 12 / 59
13 Definition: Der Brennpunkt einer brennbaren Flüssigkeit ist die niedrigste Flüssigkeitstemperatur, bei der sich Dämpfe in solchen Mengen entwickeln, dass nach ihrer Entzündung durch eine Zündquelle ein ständiges Brennen unterhalten bleibt. vgl. [1] Bis Ende 2002 wurden brennbare Flüssigkeiten durch die Verordnung über Anlagen zur Lagerung, Abfüllung und Beförderung brennbarer Flüssigkeiten zu Lande (VbF) in Gefahrklassen eingeteilt. Durch eine Anpassungsrichtlinie der Europäischen Union ist diese Einteilung nicht mehr zulässig. Die Einteilung findet nun durch die Richtlinie 67/548/EWG statt, die mit der Einführung der Betriebssicherheitsverordnung (BetrSichV) vom und der Gefahrstoffverordnung (GefStoffV) vom umgesetzt wurde. Vergleich VbF und Richtlinie 67/548/EWG: VbF bis A III Richtlinie 67/548/EWG vgl.: BetrSichV, GefStoffV wird nicht berücksichtigt 100 C Flammpunkte: Beispiele: Phenol 55 C Heizöl A II entzündlich Kerosin 21 C leicht entzündlich Spiritus A I und B* * mit Wasser mischbar leicht entzündlich wenn Siedepunkt < 35 C hoch entzündlich 0 C Benzin Siedepunkt: > 60 C Furan Siedepunkt: 32 C Tabelle 3: Vergleich VbF und RL 67/548/EWG [Frank Wenking, IdF NRW] Zündtemperatur und Mindestverbrennungstemperatur Damit bei Erfüllung der soeben genannten stofflichen Voraussetzungen eine Verbrennung stattfinden kann, bedarf es bei den meisten Reaktionen eines e- nergetischen Anstoßes, d.h. es muss eine Zündenergie (Aktivierungsenergie) zugeführt werden. Zur Abschätzung dieser erforderlichen Energie gibt man die Temperatur an, auf die das Gemisch aus dem brennbaren Stoff und dem Sauer- Zündtemperatur LU Seite 13 / 59
14 stoff erwärmt werden muss, um den Verbrennungsvorgang einzuleiten. Diese Temperatur bezeichnet man als Zündtemperatur (Zündpunkt). Definition: vgl. DIN Die Zündtemperatur einer explosionsfähigen Atmosphäre ist die niedrigste Temperatur einer erhitzten Oberfläche (z.b. Wand), an der dieses Gemisch gerade noch zum Brennen mit Flammenerscheinung angeregt wird. vgl. [1] Die Zündtemperatur ist ein weiteres Kriterium zur Abschätzung der Gefahr durch brennbare Stoffe, da die Zündtemperatur Aussagen über mögliche Zündquellen gestattet. Gas/Dampf C Temperatur einer Wand brennbare Flüssigkeit Abbildung 7: Zündtemperatur [Oliver Wegner, Fw Waltrop] Stoff Zündpunkt Stoff Zündpunkt C C Methan 595 Diethylether 170 Propan 470 Benzol 555 Methanol 455 Schwefelkohlenstoff 90 Ethanol 425 Wasserstoff 560 Aceton 540 Kohlenmonoxid 605 Daten: LUA NRW, Informationssystem für gefährliche Stoffe, IGS-Fire 04/2004 Tabelle 4: Zündtemperaturen ausgewählter Stoffe, [Oliver Wegner, Fw Waltrop] Die erforderliche Aktivierungsenergie kann entweder von außen zugeführt werden oder innerhalb des jeweiligen Systems entstehen. Man unterscheidet deshalb zwischen einer Fremd- und einer Selbstentzündung. LU Seite 14 / 59
15 Zuführung der notwendigen Aktivierungsenergie durch Fremdentzündung Selbstentzündung Die Fremdentzündung ist die Entzündung durch eine von außen zugeführte Zündenergie. Eine von außen zugeführte Energie ist von dem brennbaren Stoff unabhängig und kann zum Beispiel von einem Lichtbogen, einem Funken, einer offenen Flamme oder von einer heißen Oberfläche herrühren. Die Selbstentzündung ist dagegen die Entzündung ohne eine Energiezufuhr von außen. Sie kann beispielsweise infolge einer Oxidation, einer Zerfallsreaktion oder infolge einer Polymerisation erfolgen. Fremdentzündung Selbstentzündung Beispiele: Phosphor: starke Oxidationsprozesse bei Raumtemperatur Heu: Wärmeproduktion von Bakterien (Wärmestau) Braunkohle: grundlegende Selbsterhitzungsvorgänge sind bis heute immer noch nicht eindeutig geklärt Ist die Verbrennung eingeleitet, so ist eine Mindestenergie notwendig, damit die Verbrennungsreaktion selbständig weiterläuft. Zur Abschätzung dieser E- nergie gibt man die niedrigste Temperatur des reagierenden Brennstoff-Luft- Gemisches an, bei der das selbständige Brennen gerade noch möglich ist. Man spricht diesbezüglich von der sogenannten Mindestverbrennungstemperatur. Mindestverbrennungstemperatur Ab dem Erreichen der Mindestverbrennungstemperatur wird soviel Energie freigesetzt, dass der Bedarf für die Aufbereitung der brennbaren Stoffe, die Aktivierung der Reaktion und die Wärmeverluste an die Umgebung abgedeckt werden. Wird diese Temperatur unterschritten, dann stoppt die Verbrennungsreaktion, da das System in diesem Fall nicht mehr genügend Energie produziert. Entzündung Verbrennung Zündenergie Aufbereitung des Brennstoffes Aktivierung der Reaktion Wärmeverluste an die Umgebung Reaktionswärme Abbildung 8: Mindestverbrennungstemperatur [Oliver Wegner, Fw Waltrop] Aufgrund der überschüssigen Reaktionswärme steigt die Verbrennungstemperatur auf die Brandtemperatur an. LU Seite 15 / 59
16 Stoff Brandtemperatur Stoff Brandtemperatur C C Acetylen Stadtgas Holz / Kohle Streichholz 800 Koks Tabak Papier 800 Wasserstoff Ruß im Schornstein Tabelle 5: Brandtemperaturen ausgewählter Stoffe, [Oliver Wegner, Fw Waltrop] Die Temperaturen lassen sich wie folgt zusammenfassen: Brandtemperatur Mindestverbrennungstemperatur Zündtemperatur Brennpunkt Flammpunkt Katalysator Katalysator Die meisten Verbrennungsreaktionen sind gehemmte Systeme, d.h. auch bei der Erfüllung sämtlicher stofflichen Voraussetzungen bedarf es noch, wie bereits oben dargestellt, eines energetischen Anstoßes, damit es zu einer selbständig ablaufenden Verbrennung kommen kann. Dieser Anstoß wird als Aktivierungsenergie bezeichnet. Diese Energie ist eine spezifische Größe und hängt unter anderem von den an der Reaktion beteiligten Stoffen ab. Die meisten Verbrennungsreaktionen erfordern ohne das Vorhandensein eines Katalysators soviel Aktivierungsenergie, dass sie unter normalen Umständen nicht gezündet werden könnten bzw. bei der Fortnahme des Katalysators sofort verlöschen würden. Definition: Katalysatoren sind Stoffe, die mit mindestens einem der an der Reaktion beteiligten Ausgangsstoffe eine reaktionsfähigere Zwischenverbindung bilden, die dann mit anderen Stoffen so weiterreagieren, dass die Katalysatoren im Verlauf der Gesamtreaktion wieder zurückgebildet werden.vgl. [3] LU Seite 16 / 59
17 Modellbeispiel: A + B AB A + K AK Aus den beiden Stoffen A und B soll durch eine chemische Reaktion der Stoff AB entstehen. An dieser Reaktion ist ebenfalls ein Katalysator K beteiligt. Diese Reaktion sei gehemmt, d.h. damit die Atome des Stoffes A mit den Atomen des Stoffes B zu der neuen Verbindung AB zusammentreten können, muss eine bestimmte Aktivierungsenergie zugeführt werden. Diese Energie sei so groß, dass die Reaktion nur mit einer geringen Reaktionsgeschwindigkeit bzw. sogar gar nicht ablaufen kann. Der Katalysator K bildet mit mindestens einem der Ausgangsstoffe eine reaktionsfähigere Zwischenverbindung. Diese Zwischenverbindung AK benötigt für die Reaktion mit B zu der Endverbindung AB eine geringere Aktivierungsenergie. AK + B AB + K Bei der Reaktion AK + B wird neben dem Reaktionsprodukt AB der Katalysator K wieder vollständig zurückgebildet. Dieser kann nun weitere Zwischenverbindungen eingehen. Durch die Anwesenheit eines geeigneten Katalysators wird die Aktivierungsenergie und somit die Zündtemperatur sowie die Mindestverbrennungstemperatur stark herabgesetzt. Jedoch kann ein Katalysator unmögliche Reaktionen nicht möglich machen. Aktivierungsenergie ohne Katalysator Energieinhalt der Ausgangsstoffe Aktivierungsenergie m it Katalysator Energie Energieinhalt der Endprodukte Reaktionswärme Reaktionsverlauf Abbildung 9: Beispiel einer Reaktion mit und ohne Katalysator, [Frank Wenking, IdF NRW] LU Seite 17 / 59
18 Die Katalysatoren spielen bei Oxidationsreaktionen in der Gasphase (Flamme) eine besondere Rolle, da es sich bei diesen Flammenreaktionen um sogenannte»radikalreaktionen«handelt. Zur Aktivierung und zur Aufrechterhaltung solcher Reaktionen ist das Vorhandensein von Radikalen eine elementare Voraussetzung. In diesem Zusammenhang sind die Wasserstoff(H*)- und Hydroxyl(OH*)-Radikale, welche bei Energiezufuhr aus den Wassermolekülen (H 2 O) gebildet werden, für den Beginn und das weitere Fortlaufen der Radikalreaktion in der Flamme besonders erwähnenswert. Aus diesem Grund bezeichnet man diese Radikale auch als Katalysatoren einer Verbrennung. H 2 O + (Energie) H* + OH* Von der feuerwehrtechnischen Sichtweise aus betrachtet, laufen die meisten Verbrennungen in der Gegenwart von Luft ab, ein Gasgemisch, welches immer einen von den atmosphärischen Bedingungen abhängigen Prozentsatz Luftfeuchtigkeit (Wasser) enthält. Durch Übertragung von Energie (z.b. Strahlung, Stoßprozesse aufgrund der Wärmebewegung) auf die Wassermoleküle, ist ein Teil dieser Moleküle in Wasserstoff- und Hydroxylradikale gespalten. Demnach enthält die Luft unter atmosphärischen Bedingungen immer H*- und OH*-Radikale, so dass die Voraussetzung des Vorhandenseins eines Katalysators im Allgemeinen immer erfüllt ist Verbrennungsgeschwindigkeit Verbrennungsgeschwindigkeit Nach steigender Geschwindigkeit verschiedener Verbrennungsreaktionen geordnet, lassen sich die nachfolgend dargestellten Verbrennungsarten unterscheiden. V e r b r e n n u n g Verbrennungsgeschwindigkeit relativ gering bis relativ hoch Verbrennungsgeschwindigkeit relativ hoch bis relativ sehr hoch Brand Explosion relativ geringe Verbrennungsgeschwindigkeit relativ hohe Verbrennungsgeschwindigkeit relativ hohe Verbrennungsgeschwindigkeit relativ sehr hohe Verbrennungsgeschwindigkeit Beispiele: Beispiel: Beispiel: Beispiel: Schwelbrand Glimmbrand Glutbrand Flammenbrand Verpuffung bzw. Deflagration Detonation Abbildung 10: Verbrennungsgeschwindigkeiten, [Oliver Wegner, IdF NRW] LU Seite 18 / 59
19 Die Explosion, eine plötzliche Zerfalls- oder Oxidationsreaktion, ist eine außerordentlich schnell verlaufende Verbrennung eines Stoffes oder Stoffgemisches unter starker Wärme-, Druck-, Licht- und Geräuschentwicklung. Die sehr schnell verlaufende Umsetzung im Stoffgemisch erzeugt große Gas- und Wärmemengen. Diese Gase werden durch die Wärme in ihrem Volumen noch sehr stark vergrößert, wodurch hohe Drücke entstehen. Diese wirken auf Menschen und Sachen im unmittelbaren Nahbereich zerstörend. Die Explosion teilt man nach ihrer Reaktionsgeschwindigkeit in zwei Vorgänge ein, Deflagration und die Detonation. Die Deflagration ist eine rasch verlaufende Verbrennung, die man auch als eine schwache Explosion bezeichnen kann. Sie verläuft langsam mit mäßiger Druck- und Geräuschentwicklung. Die Verbrennungsgeschwindigkeit liegt unterhalb der Schallgeschwindigkeit und wird in (cm/s) bis (m/s) angegeben. Bei Deflagration treten Drücke bis zu 10 bar auf. vgl.[3] Deflagrationen mit einer niedrigen Verbrennungsgeschwindigkeit werden zuweilen auch als Verpuffung bezeichnet. Bei einer Verpuffung können Drücke bis 1 bar erreicht werden. Deflagration Verpuffung Beispiel: Benzin-Luft-Gemisch v 10 m/s p 7 bar Die Detonation ist eine mit einer Stoßwelle und einer Flammenreaktion verbundene Reaktion, die sich mit Geschwindigkeiten (km/s) über der Schallgeschwindigkeit fortpflanzt. Detonationsdrücke bis 100 bar und weit höher sind möglich. vgl. [3] Detonation Beispiel: Acetylen-Sauerstoff-Gemisch: v 2,4 km/s p 100 bar Trinitrotuluol (TNT) v 6,7 km/s p bar Art der Explosion Geschwindigkeit Druck Verpuffung cm/s < 1 bar Deflagration m/s 1 bar 10 bar Detonation km/s > 10 bar LU Seite 19 / 59
20 2.3.8 Flash over und Backdraft In diesem Zusammenhang werden häufig drei Begriffe, die völlig verschiedene Ereignisse beschreiben, verwechselt bzw. durcheinandergebracht. Stichflamme Stichflamme: Stichflammen sind kurzzeitig auftretende, sehr heiße lange Flammen (Länge: 30 Meter und mehr), die zu erheblichen Verbrennungen der vorgehenden Einsatzkräfte bzw. der zu rettenden Personen sowie zu einer Brandausbreitung führen können. Sie können auch als Folge des Berstens von Druckbehältnissen oder eines Rohrleitungsbruches auftreten. Die Voraussetzung für eine Stichflammenbildung ist in der Regel ein zu fettes Gemisch, welches sich beispielsweise in Räumen durch eine unvollkommene Verbrennung, unter Bildung von Brandrauch, Pyrolyseprodukten und brennbaren Gasen, entwickelt. Gelangt dieses Gemisch an der Frischluft mit Sauerstoff zusammen wird beim Vorhandensein einer Zündquelle eine heftige Verbrennungsreaktion auftreten. Rauchdurchzündung Flash over : Ein Flash over (Rauchdurchzündung) ist der Übergang eines Entstehungsbrandes zu einem vollentwickelten Brand, in dem die durch Wärmestrahlung und Konvektion im gesamten Raum gebildeten Pyrolyseprodukte innerhalb von wenigen Sekunden durchzünden. Eine Luftzufuhr kann diesen Vorgang begünstigen. Flash over Beispiel: Ein begrenzter Brandherd (z.b. brennendes Sofa in einem Wohnzimmer), verbunden mit einer unzureichenden Abfuhr der bei dieser Reaktion entstehenden Wärme und einer hinreichenden Luftzufuhr, erwärmt die außerhalb stehenden Gegenstände (z.b. Stühle, Schränke, elektrische Geräte). Diese geben dadurch brennbare Pyrolysegase (z.b. Kohlenstoffmonoxid) ab. Nach einiger Zeit erreichen diese Gase die untere Explosionsgrenze (UEG). Es kommt nun zu einer Durchzündung dieses Brennstoff-Luft-Gemisches im gesamten Raum. Merkliche Anzeichen für einen Flash over sind: sehr starker Temperaturanstieg innerhalb des Brandraums heißer und dichter dunkler Brandrauch Flammenzungen an der Grenze zwischen der Rauchschicht und der Luftschicht wenige Sekunden vor der Durchzündung Eine geeignete Maßnahme gegen die Gefahr eines Flash over ist das sofortige Sicherstellen eines Rauchabzuges durch RWA, Dachfenster, Lichtkuppeln LU Seite 20 / 59
21 u.ä.. Das vorsichtige Öffnen von Türen und Fenster von der Seite aus sind weitere unterstützende Maßnahmen. Die Verwendung geeigneter Strahlrohre (z.b. Hohlstrahlrohre) ist falls möglich im direkten Löschangriff zu gewährleisten. Backdraft : Kommt es nicht zu einem Flash over, da beispielsweise die Sauerstoffkonzentration im Brandraum nicht ausreichend ist, können sich die entstandenen Pyrolysegase abkühlen und somit zum Entstehen eines Unterdrucks führen. Sobald nun diesem zu fetten Gemisch Luft zugeführt wird, kann es zu einem Backdraft (auch Rauchexplosion genannt) kommen. Bei diesem Vorgang schlägt eine Flammenfront in Verbindung mit einer Druckwelle aus der Belüftungsöffnung heraus. Rauchgasexplosion Beispiel: In einem geschlossenen Raum (z.b. Wohnzimmer) ist ein Schwelbrand ohne offene Flammen bei einer unzureichenden Luftzufuhr vorhanden. Die Folge ist eine starke Entwicklung brennbarer Pyrolysegase bis weit oberhalb der oberen Explosionsgrenze (OEG). Wird nun plötzlich sauerstoffhaltige Luft zugeführt, kommt es zu einer Vermischung des Sauerstoffs und der Gase bis zu einem explosionsfähigen Mischungsverhältnis. Die Anwesenheit einer Zündquelle kann nun dieses Brennstoff-Luft- Gemisch zur Zündung bringen. Backdraft Merkliche Anzeichen für einen Backdraft sind: späte Branderkennung (dadurch ist ein spätes Eintreffen der Feuerwehr bedingt) geschlossener Brandraum mit einer warmen oder heißen Türklinke oder mit Ruß beschlagenen Glasscheiben Luftzug in den Raum nach dem Öffnen einer Tür, eines Fensters o.ä., durch die aufgrund der oben genannten Abkühlung der Gase verbundene Entwicklung eines Unterdrucks innerhalb des Brandraums (Öffnung sofort wieder verschließen!) Eine geeignete Maßnahme gegen die Gefahr eines Backdraft ist die Herstellung eines geeigneten Rauchabzugs unter Vornahme eines Strahlrohres, welches zudem auch zum Eigenschutz dient. Ein solcher Rauchabzug kann durch das Öffnen von Fenstern, Türen, o.ä. aus gesicherter Deckung heraus erfolgen. Bei einer akuten Gefahr ist ggfls. die Rauchexplosion durch ein gezieltes Einschlagen eines Fensters o.ä. einzuleiten. LU Seite 21 / 59
22 3 Löschlehre 3.1 Löschmethoden Wie bereits oben erwähnt, sind für einen Verbrennungsvorgang verschiedene Voraussetzungen erforderlich. Zu diesen Voraussetzungen gehören: Stoffliche Voraussetzungen: brennbarer Stoff Sauerstoff richtiges Mengenverhältnis zwischen dem brennbaren Stoff und dem Sauerstoff Energetische Voraussetzungen: Zündtemperatur und Mindestverbrennungstemperatur Katalysator Umgekehrt kann man nun sagen, dass die Beseitigung mindestens einer dieser fünf Vorbedingungen zwangsläufig bedeuten muss, dass der Verbrennungsvorgang abgebrochen bzw. zumindest gestört wird. Löschen Löschen ist das Stoppen bzw. das Stören eines Verbrennungsvorganges durch die Nichterfüllung bzw. den Entzug von mindestens einer der fünf Oxidationsvoraussetzungen. Aus dieser Definition leiten sich die verschiedenen Löschmethoden und die Löschmittel für die Feuerwehrpraxis ab, welche in der nachfolgenden Übersicht dargestellt sind. Löschmethoden Wirkung Vorgang Maßnahmen Stickeffekt Kühleffekt inhibierende Wirkung Verdünnung des Sauerstoffes Abmagerung des brennbaren Stoffes Trennung des brennbaren Stoffes vom Sauerstoff Erwärmung des Löschmittels Verdampfung des Löschmittels homogene Inhibition heterogene Inhibition z.b. Einsatz von CO 2 z.b. Entfernung des brennbaren Stoffes z.b. Luftabschluss mittels Schaum oder Pulver z.b. Einsatz von Wasser z.b. Einsatz von Wasser z.b. Einsatz von Halonen z.b. Einsatz von ABC- oder BC- Löschpulver LU Seite 22 / 59
23 3.1.1 Stickeffekt Für jede chemische Reaktion gibt es ein optimales Mengenverhältnis der reagierenden Stoffe (stöchiometrisches Mengenverhältnis). Nur beim Vorliegen dieses stöchiometrischen Mengenverhältnisses kann die höchstmögliche Verbrennungsgeschwindigkeit erreicht werden. Wird dieses optimale Mengenverhältnis gestört, kommt es zu einer Verlangsamung der Oxidationsgeschwindigkeit bzw. sogar zum Stillstand der Oxidation. Stickeffekt Das Löschen durch Ersticken kann erreicht werden durch: Verdünnen: Verdünnung des Sauerstoffes Verdünnen brennbarer Stoff Sauerstoff O Die Sauerstoffkonzentration wird durch Zugabe von Löschmittel herabgesetzt. Zum Fortschreiten der Reaktion fehlt der Sauerstoff, die Oxidation kommt zum Erliegen. Geeignete Löschmittel sind z.b. Kohlendioxid, Stickstoff, Argon, Inergen Abmagern: Abmagerung des brennbaren Stoffes Abmagern brennbarer Stoff Sauerstoff O Die Konzentration des brennbaren Stoffes wird herabgesetzt. Diese Löschmethode kann durch die Entfernung des brennbaren Stoffes oder Schließen von Ventilen oder Öffnungen auf einfache Weise durchgeführt werden. Auch das Verdünnen einer brennbaren Flüssigkeit (z.b. Alkohol) mit Wasser, und somit eine Erhöhung des Flammpunktes, ist denkbar. Auf diese Weise werden nicht mehr genügend brennbare Dämpfe über der Oberfläche gebildet und ein fortlaufendes Brennen ist nicht mehr möglich. LU Seite 23 / 59
24 Trennen: Trennung des brennbaren Stoffes vom Sauerstoff Trennen brennbarer Stoff Sauerstoff O Durch die Zugabe von Löschmitteln wie z.b. Schaum, D-Pulver oder ABC- Pulver (in der Brandklasse A) wird der brennbare Stoff vom Sauerstoff getrennt. Eine Reaktion zwischen beiden Stoffen ist nicht mehr möglich Kühleffekt Eine Verbrennung kann nur dann zustande kommen und fortbestehen, wenn in der Reaktionszone eine bestimmte Mindestverbrennungstemperatur vorliegt, die von der Natur und dem jeweiligen Zustand des brennbaren Stoffes abhängt. Durch eine Erhöhung der Temperatur wird die Oxidationsgeschwindigkeit erhöht, durch das Senken der Temperatur entsprechend vermindert. Kühleffekt Die Mindestverbrennungstemperatur stellt einen Grenzwert dar, da das System unterhalb dieser Grenze nicht mehr genügend Energie in Form von Wärme produziert, um die weitere Aufbereitung des brennbaren Stoffes, die Reaktivierung sowie die Wärmeverluste an die Umgebung abzudecken. [vgl. Seite 15, Abbildung 8] Die Folge einer Unterschreitung dieses Grenzwertes ist der Abbruch der Verbrennungsreaktion. Für die Feuerwehrpraxis ergibt sich daraus, dass die Verbrennungstemperatur unter die Mindestverbrennungstemperatur gebracht werden muss. Es wird demnach durch Abkühlung gelöscht. Dies erreicht man mittels des Kühleffektes, welcher sich durch zwei Methoden realisieren lässt: Erwärmung des Löschmittel Änderung des Aggregatzustandes des Löschmittels Geeignete Löschmittel zur Verwirklichung dieses Löscheffektes sind Wasser, und Wasser in Form von Schwerschaum und Mittelschaum Inhibition Inhibition Neben den bereits mehrmals beschriebenen Voraussetzungen einer Oxidation ist für eine Verbrennung in der Regel die Anwesenheit eines reaktionsbe- LU Seite 24 / 59
25 schleunigenden Katalysators erforderlich. Im Umkehrschluss ist die Abwesenheit reaktionshemmender Antikatalysatoren (Inhibitoren) nötig. Die löschtechnische Maßnahme ist demnach der Entzug des Katalysators bzw. das Einbringen von Inhibitoren in die Reaktionszone. Diese Inhibitoren stören die chemische Reaktion und hemmen bzw. stoppen sogar den Oxidationsvorgang. vgl. [4] Bei diesem Prozess der Inhibition unterscheidet man: homogene Inhibition: Der Inhibitor sowie alle reagierenden Stoffe liegen im gleichen Aggregatzustand (meistens gasförmig) vor. heterogene Inhibition: Der Inhibitor und die reagierenden Stoffe liegen nicht im gleichen Aggregatzustand (meistens fest und gasförmig) vor. Löschmittel sind ABC-Pulver (Brandklassen B und C) BC-Pulver, sowie zugelassene Halone. Anwendungsbeispiele: Wie löscht man Flammen? Die Flamme ist der Bereich brennender Gase oder Dämpfe, von dem eine sichtbare und auch fühlbare Wärmestrahlung ausgeht. Es ist leicht nachvollziehbar, dass man brennendem Gas oder Dampf so gut wie keine Wärme entziehen kann, weil er dem abkühlenden Löschmittel fast keine Angriffsfläche bietet. In diesem Fall kommt es nur zu einem Löscherfolg, wenn man das optimale Mengenverhältnis zwischen dem brennbaren Stoff und dem Sauerstoff stört, also die Löschmethode Ersticken anwendet. Wie löscht man Glut? Glut ist ein erwärmter fester Stoff mit einer sichtbaren und fühlbaren Wärmestrahlung. Es ist klar, dass beispielsweise bei einem festen brennbaren Stoff mit einer Gluterscheinung eine Störung des stöchiometrischen Mengenverhältnisses zwischen dem brennbaren Stoff und dem Sauerstoff nicht ausreicht, da dadurch dem brennenden Stoff nicht die relativ hohe Energie (Wärme), vor allem in seinem Inneren, entzogen wird. Hier kommt es nur zu einem Löscherfolg, wenn man dem brennbaren Stoff die Wärme entzieht, also die Löschmethode Abkühlung anwendet. LU Seite 25 / 59
26 Wie löscht man Flammen und Glut? Bei brennenden Stoffen, die gleichzeitig mit Flammen und Glut brennen, muss nur die Glut abgekühlt werden, da dann auch gleichzeitig die Bildung brennbarer Gase vermindert wird. 3.2 Die Löschmittel Als Löschmittel bezeichnet man alle diejenigen Stoffe und Gegenstände, die geeignet sind, einen Verbrennungsvorgang zu unterbrechen. Bei der Feuerwehr werden hauptsächlich folgende Löschmittel verwendet: Wasser Schaum Löschpulver Kohlenstoffdioxid (CO 2 ) sonstige Löschmittel 3.3 Löschmittel Wasser Wasser Wasser spielt bereits seit Urzeiten für die Brandbekämpfung eine große Rolle. Aber trotz neuer Löschmethoden und Löschtechniken ist Wasser heute weiterhin das wichtigste und bekannteste Löschmittel bei den Feuerwehren. Wasser ist eine geschmacks- und geruchlose, durchsichtige Flüssigkeit. Es ist das Verbrennungsprodukt des Wasserstoffs: 2H 2 + O 2 H 2 O Wasser verhält sich gegenüber anderen Stoffen weitgehend neutral. Es kann allerdings mit einigen Stoffen zu gefährlichen Reaktionen kommen. Der größte Anteil aller Brände ist der Brandklasse A zuzuordnen, für deren Bekämpfung es nichts besseres als Wasser gibt. Vorteile: - Wasser ist das billigste Löschmittel. - Es ist am leichtesten in großer Menge zu beschaffen, da es fast überall vorhanden ist (z.b. Hydranten, Kanäle, Seen, Löschwasserteiche). - Durch Feuerlöschkreiselpumpen und Schlauchleitungen ist es problemlos über große Entfernungen förderbar. - Wasser hat ein großes Wärmebindungsvermögen. - Wasser ist verschieden einsetzbar (Voll-, Sprühstrahl, Wassernebel). LU Seite 26 / 59
27 - Mit Wasser kann man hohe Wurfhöhen und große Wurfweiten erzielen. - Wasser ist ungiftig und chemisch neutral. Nachteile: - Wasser gefriert bei Temperaturen unter 0 C und wird somit im Winter zu einem problematischen Löschmittel: - Im gefrorenen Zustand vergrößert sich das Volumen des Wassers um etwa 10 %, so dass beispielsweise wasserführende Armaturen platzen können. - Durch gefrierendes Wasser besteht eine erhöhte Rutschgefahr. - Wasser ist aufgrund seiner hohen Dichte relativ schwer, so dass es bei einer unsachgemäßen Anwendung zu Gebäudeschäden (z.b. Einsturz) kommen kann. - Bestimmte Stoffe (z.b. Hülsenfrüchte, Getreide) quellen bei Wasseraufnahme auf und können beispielsweise Silowände auseinander drücken. - Schadstoffe können mit dem abfließenden Löschwasser umweltbelastend wirken Physikalische Eigenschaften von Wasser Ein besonderes physikalisches Phänomen ist die sogenannte Anomalie des Wassers, da seine größte Dichte bei der Temperatur von 4 C vorliegt. Bei der Erwärmung von Wasser bis zu der Temperatur von 4 C nimmt seine Dichte zunächst zu, um dann bei einer weiteren Temperaturerhöhung wieder abzunehmen. Diese Anomalie des Wassers hat in der Natur eine besonders wichtige Bedeutung, vor allem für die im Wasser lebenden Tiere, denn das Wasser mit der Temperatur von 4 C sinkt innerhalb eines Gewässers infolge seiner größeren Dichte nach unten auf den Boden, so dass kältere Wasserschichten nach oben an die Oberfläche steigen. Aus diesem Grund friert beispielsweise ein See von oben her zu. Aber auch für die Feuerwehrpraxis ist dieses bemerkenswerte Phänomen von Wichtigkeit, da sich anderenfalls die Wasserentnahme aus offenen Gewässern im Winter schwieriger gestalten würde als sie ohnehin schon ist. Anomalie des Wassers LU Seite 27 / 59
28 Physikalische Eigenschaften Weitere wichtige physikalische Eigenschaften von Wasser sind: mittlere Dichte: 1000 kg/m 3 (bei 4 C) Siedepunkt: 100 C (bei hpa) Gefrierpunkt: 0 C (bei hpa) spezifische Wärmekapazitäten: c Eis = 2,1 kj/(kg K) (Für die Erwärmung von 1 kg Wassereis um 1 K ist eine Energie von 2,1 kj notwendig.) c flüssig = 4,2 kj/(kg K) (Für die Erwärmung von 1 kg Wasser um 1 K ist eine Energie von 4,2 kj notwendig.) c Dampf = 2,1 kj/(kg K) (Für die Erwärmung von 1 kg Wasserdampf um 1 K ist eine Energie von 2,1 kj notwendig.) Schmelzwärme: q schmelz = 335 kj/kg (Für den Übergang von 1 kg Wassereis mit der Temperatur 0 C in flüssiges Wasser mit der Temperatur 0 C benötigt man eine Energie von 335 kj.) Verdampfungswärme: q verdampfen = kj/kg (Für den Übergang von 1 kg Wasser mit der Temperatur 100 C in Wasserdampf mit der Temperatur 100 C benötigt man eine Energie von kj.) Wärmekapazität Mit der Hilfe dieser Werte kann man theoretisch berechnen, wie viel Wärmeenergie eine bestimmte Menge Wasser aufnehmen kann. Beispiel: Um 1 kg Wasser von 10 C (Eis) auf 300 C (Wasserdampf) zu erwärmen, wird als Wärmemenge benötigt: Zustand Eis Wasser Wasserdampf Masse 1 kg 1 kg 1 kg 1 kg 1 kg Vorgang -10 C 0 C Schmelzen 0 C 100 C Verdampfen 100 C 300 C Temperaturdifferenz Wärmekapazität 10 K K K 2,1 kj/(kg K) 335 kj/kg 4,2 kj/(kg K) kj/kg 2,1 kj/(kg K) Energie [kj] Summe: 3453 kj (vgl.: Heizwert 1kg Holz ~ kj) Tabelle 6: Wärmeaufnahme von 1 kg Wasser, [Frank Wenking, IdF NRW] LU Seite 28 / 59
29 Wasser hat das größte Wärmebindungs- bzw. Wärmeaufnahmevermögen aller bekannten Löschmittel. Die meiste Wärmeenergie wird benötigt, um Wasser zu verdampfen. Beim Löschen mit Wasser wird dem Verbrennungsvorgang Wärme entzogen, weil sich das Wasser erwärmt und verdampft. Durch Abkühlen unter die Mindestverbrennungstemperatur wird somit eine Verbrennungsvoraussetzung entzogen. Löschwirkung Ein weiteres für die Feuerwehrpraxis besonders zu beachtendes Phänomen ist die Volumenausdehnung von der flüssigen in die dampfförmige Phase des Wassers. Bei der Verdampfung von einem Liter flüssigen Wasser entstehen schlagartig etwa Liter Wasserdampf. Bei einer falschen Anwendung und unsachgemäßer Schutzkleidung kann es daher, besonders im Innenangriff, zu gefährlichen Situationen kommen. Gefahr der Volumenausdehnung Anwendung von Wasser Wasser kann man verschieden anwenden und zwar als Vollstrahl, als Sprühstrahl und als Wassernebel. Vollstrahl: Vorteile: - große Wurfhöhen und weiten (wegen der kompakten Bündelung des Wassers) - höhere Eindringtiefe und Tiefenwirkung (unter hohem Druck dringt der Wasserstrahl in tiefere Glutschichten und sperriges Material ein) - höhere Auftreffkraft (lockeres Gut wird auseinandergerissen, wodurch eine insgesamt größere Kühlfläche entsteht) Nachteile: - größerer Wasserschaden - Staub kann aufgewirbelt werden (Gefahr: Staubexplosion) - empfindliche Stoffe und Geräte können zerstört werden Der Vollstrahl wird dort verwendet, wo es darauf ankommt, große Entfernungen zu überbrücken (Außenangriff), da der angreifende Trupp anderenfalls einer zu hohen Gefahr (z.b. Einsturz, Explosion) ausgesetzt wäre. Sprühstrahl: Beim Sprühstrahl entstehen durch die große Auffächerung des Wasserstrahls innerhalb des Strahlrohres viele kleine Wassertröpfchen (Durchmesser zwi- LU Seite 29 / 59
30 schen 0,5 mm und 1,5 mm) mit einer insgesamt größeren Oberfläche. Ein schnelleres Verdampfen des Wassers mit einer besseren Kühlwirkung gegenüber dem Vollstrahl ist die Folge. Vorteile: - Abdeckung einer größeren Fläche (geringerer Wasserschaden) - ideales Wärmebindungsvermögen wegen der feineren Verteilung des Wassers - geringere Aufwirbelung des Brandgutes (wegen einer geringeren Auftreffkraft) - großes Aufnahmevermögen bei Gasen, Säuren, Laugen und Dämpfen (Auffächerung des Strahls kann zum Niederschlagen dieser Stoffe benutzt werden) - geringere Sicherheitsabstände bei Bränden von elektrischen Anlagen (wegen der schlechteren elektrischen Leitfähigkeit) Nachteile: - geringere Wurfhöhen und weiten - geringere Eindringtiefe (wegen einer kleineren Auftreffkraft) - starke Wasserdampfbildung bei Bränden in geschlossenen Räumen (Verbrühungsgefahr) Der Sprühstrahl hat seine beste Löschwirkung bei der Bekämpfung von Bränden in geschlossenen Räumen (Innenangriff). Wassernebel: Die Vernebelung des Wassers erfolgt durch besondere Strahlrohre (z.b. Hohlstrahlrohre) und/oder durch Hochdruckpumpen mit Ausgangsdrücken bis zu 40 bar. Die Löschwirkung der Abkühlung wird voll ausgenutzt, da die Tropfen einen extrem kleinen Durchmesser (d < 0,1 mm) haben und so eine große O- berfläche des Wassers entsteht. Vorteile: - Die feinere Verteilung des Wassers führt wegen der insgesamt größeren Oberfläche zu einem hohen Wärmeaufnahmevermögen, da das Wasser sehr schnell in die Dampfform übergeht mal höhere Wärmeaufnahme im Vergleich zum herkömmlichen Sprühstrahl LU Seite 30 / 59
31 - geringer Wasserschaden, da wenig Wasser für einen Löscherfolg benötigt wird - geringer Umweltschaden, da wenig Wasser aus der Einsatzstelle zurückläuft Nachteile: - Die spontane Verdampfung des Wassernebels kann besonders in geschlossenen Räumen zu Verbrühungen bei den Einsatzkräften bzw. bei den zu rettenden Personen führen (Kopf-, Nacken- und Halsbereich). - geringe Wurfhöhen und weiten (wegen der geringen Masse der kleinen Tropfen) - erhebliche Sichtbehinderung durch den Wassernebel und den entstehenden Wasserdampf - Fortschleudern des Brandgutes und zusätzlicher Funkenflug (wegen des Hochdruckstrahls) Der Wassernebel hat sich besonders zum Schutz der Einsatzkräfte beim Vorgehen zur Menschenrettung im Innenangriff bewährt. Ferner ist er der einzige Schutz gegen einen drohenden Flash over Zusätze zum Löschwasser Frostschutzmittel: Löschmittelzusätze In ortsfesten Löschanlagen, fahrbaren Wasserbehältern und Feuerlöschern, die in nicht frostgeschützten Anlagen stationiert sind, kann es unter Umständen notwendig werden, Frostschutzzusätze zu verwenden, so dass das Wasser für den negativen Temperaturbereich bis etwa 30 C einsetzbar bleibt. korrosionshemmende Zusätze: Wird Wasser in nicht korrosionsgeschützten metallischen Behältern aufbewahrt, tritt bereits nach kurzer Zeit Korrosion ein, die zur Zerstörung des Behälters führen kann. Deshalb werden in der heutigen Zeit überwiegend Behälter aus rostbeständigem Stahl hergestellt. Für bereits existierende ältere Behälter verwendet man beispielsweise Natriumchlorid und Wasserglas als Korrosionsschutzmittel. Konservierungsmittel: Die im Wasser vorhandenen Bakterien können zu einer Schimmel-, Algenoder Fäulnisbildung führen. Aus diesem Grund verwendet man in der Regel Konservierungsmittel. Die oben genannten Frostschutzzusätze haben eine be- LU Seite 31 / 59
32 dingte konservierende Wirkung, so dass man zusätzlich übliche Desinfektionsmittel, soweit diese nicht stark korrodierend wirken, verwendet. löschwirksame Zusätze: Die Forschung und Wissenschaft hat in den vergangenen Jahren für Feuerlöscher und fahrbare Löschgeräte Zusätze zum Wasser bzw. gebrauchsfertige vorgemischte Lösungen entwickelt, welche den Einsatzwert eines Feuerlöschers erheblich steigern. Netzmittel: Wasser hat das Bestreben, seine Oberfläche so klein wie möglich zu halten. Daher nimmt das Wasser stets eine Kugelform an. Aufgrund dieser Oberflächenspannung wird das Wasser von fetthaltigen Stoffen schlecht bzw. gar nicht angenommen. Deshalb ist die Anwendung von Netzmitteln (z.b. Alkalien, Seifen, Seifenextrakte oder Mehrbereichsschaummittel) erforderlich bzw. zweckmäßig, um bei Bränden von Stäuben, Holzfaserstoffen, Textilballen, Torf, Braunkohle usw. die Einsatzzeiten sowie den Löschwasserverbrauch zu verringern. Zusätze zur Verringerung des Strömungswiderstandes: Ein negativer Nebeneffekt bei der Wasserförderung über lange Wegestrecken ist der aufgrund der turbulenten Wasserströmung innerhalb der Schlauchleitungen verbundene Reibungsverlust (Druckverlust). In den Vereinigten Staaten von Amerika ist deshalb ein Löschmittelzusatz entwickelt worden, welcher den nicht erwünschten Druckverlust verringert Einsatzverbote für das Löschmittel Wasser Es gibt Einsatzsituationen, in welchen Wasser keinesfalls bzw. nur unter besonderer Vorsicht eingesetzt werden darf. Metallbrände Metallbrände: Die wichtigsten brennbaren Metalle sind die Leichtmetalle (z.b. Aluminium, Magnesium, Titan). Bei den Bränden der Brandklasse D entstehen Verbrennungstemperaturen von C bis C. Aufgrund dieser hohen Temperaturen wird das Wasser thermisch in seine Bestandteile Wasserstoff (H 2 ) und Sauerstoff (O 2 ) aufgespalten (thermische Dissoziation). Der abgespaltene und nun wieder zur Verfügung stehende Sauerstoff trägt zur schnelleren Oxidation des Metalls bei. Die Menge an Sauerstoff, die durch die Dissoziation entsteht, ist aber besonders bei diesen Temperaturen noch relativ gering. Entscheidender ist, dass sich Wasser bei diesen Temperaturen wie ein brandfördernder Stoff LU Seite 32 / 59
33 verhält und direkt mit dem Metall reagiert, wobei Wasserstoff abgespalten wird. Metall + H 2 O Metalloxid + H 2 Diese Reaktion führt zu einer erheblichen Steigerung der Verbrennungsgeschwindigkeit. Brände von Metallen sollten daher niemals mit Wasser, sondern nur mit geeigneten Löschmittel wie beispielsweise D-Löschpulver, Natriumchlorid (Kochsalz), trockenem Sand oder Zement gelöscht werden. Schornstein- und Kaminbrände: Schornsteinbrände Etwaige Teer- und Rußablagerungen im Kamin können sich unter Umständen entzünden und verbrennen dann unter den Begleiterscheinungen des starken Funkenfluges und des Flammenaustritts. Innerhalb des Schornsteins liegen Verbrennungstemperaturen von etwa C vor. Würde Wasser in den Schornstein gegeben werden, entstünde aufgrund der hohen Verbrennungstemperaturen schlagartig aus jedem Liter flüssigem Wasser etwa Liter Wasserdampf. Der spontan entstehende Überdruck könnte den Schornstein auseinander sprengen. Ferner könnte die plötzliche Abkühlung der Schornsteinwandungen zu Temperaturspannungen innerhalb des Materials und somit zu Rissbildungen führen, so dass die Dichtheit des Kamins nicht mehr gewährleistet wäre. Außerdem kann der bei der Verbrennung des Rußes entstehende stark aufgeblähte sogenannte Rußkoks in Verbindung mit Wasser zur Verstopfung des Schornsteins führen. In der Regel werden Schornsteinbrände mit dem Reinigen des Kamins (Kaminkehrerwerkzeug) gelöscht. Ferner muss der Bezirksschornsteinfeger verständigt werden, spätestens dann, wenn der Schornstein kontrolliert ausbrennen soll. In Ausnahmefällen (z.b. starker Funkenflug) kann zur Brandbekämpfung auch ABC-Löschpulver verwendet werden. Brände von Stoffen, die mit Wasser reagieren: Neben Leichtmetallen existieren weitere Stoffe (z.b. Lithium, Natrium, Kalium, Calciumcarbid), die nicht mit Wasser in Berührung gebracht werden dürfen, da sie anderenfalls mit diesem Löschmittel reagieren. Es kann zu Explosionen, Entzündungen oder anderen heftigen Reaktionen kommen. Chemische Reaktionen Verhaltensmaßnahmen für den Umgang mit solchen Stoffen findet man in den üblichen Nachschlagewerken (z.b. Hommel, IGS fire ). LU Seite 33 / 59
34 3.3.5 Die bedingte Anwendbarkeit von Wasser Brände von flüssigen Stoffen der Brandklasse B Nicht alle Flüssigkeitsbrände können mit Wasser gelöscht werden. Wasser hat in der Regel eine höhere Dichte als die Mehrzahl der brennbaren Flüssigkeiten, so dass die brennenden Flüssigkeiten (z.b. Benzin), sofern sie nicht mit Wasser mischbar sind, auf der Löschwasserschicht schwimmen. In diesem Fall kann es schnell zu einer Brandausbreitung kommen. Zu einem Löscherfolg wird man jedoch dann kommen, wenn die brennende Flüssigkeit eine höhere Dichte als Wasser hat, da dann das Wasser die brennbare Flüssigkeit (z.b. Schwefelkohlenstoff) abdeckt. Sofern brennbare Flüssigkeiten mit Wasser mischbar sind (z.b. Alkohol), kann man durch Zugabe des Wassers den Flammpunkt heraufsetzen (Verdünnung der brennbaren Flüssigkeit). Befindet sich jedoch die Flüssigkeit in einem Behälter, muss unbedingt darauf geachtet werden, dass dieser nicht überläuft, da es dann wiederum zu einer Schadensausbreitung kommen kann. Bei allen Fällen bleibt aber die Möglichkeit Wasser von außen einzusetzen um die Behälterwandung und somit die Flüssigkeit herunter zu kühlen. Eine weitere Gefahr ist die sogenannte Fettexplosion, die bei Kontakt von Wasser mit erhitzten Ölen, Fetten und Teer, deren Siedepunkte über 100 C liegen, auftreten kann. Das Prinzip und der Ablauf einer Fettexplosion lässt sich wie folgt beschreiben: t = 0: Fett (ϑ > 100 C) Das Fett hat eine Temperatur weit über 100 C. z.b.: Friteuse t =1: Das Wasser hat eine größere Dichte als das Fett und bewegt sich im Fett nach unten auf den Boden. Aufgrund der Oberflächenspannung des Wassers bilden sich kleine Wassertröpfchen. LU Seite 34 / 59
35 t =2: Sobald die Oberflächenspannung überwunden und der Wassertropfen auf 100 C erwärmt wurde (Siedeverzug), verdampft das Wasser schlagartig (1 l flüssiges Wasser l Wasserdampf). t =3: Der Wasserdampf reißt auf seinem Weg an die Oberfläche das Fett mit. Die kleinen Fetttröpfchen stellen ein erhebliches Gefahrenpotential dar, da sie aufgrund ihrer grossen Oberfläche explosionsartig verbrennen (Fettexplosion) kön-. nen. Abbildung 11: Ablauf der Fettexplosion, [Oliver Wegner, Fw Waltrop] Solche Brände bekämpft man, indem man die Außenflächen der Behälter massiv kühlt und eine Brandbekämpfung mit den konventionellen Löschmitteln Schaum, Löschpulver oder Kohlenstoffdioxid durchführt (Sauerstoffabschluss). Bei einem Friteusenbrand reicht es beispielsweise auch schon in den meisten Fällen aus, den Deckel aufzulegen. Bei einigen Löschmitteln der Brandklasse F, die speziell für das Löschen dieser Fettbrände entwickelt wurden, reagiert das Löschmittel mit dem Fett/Öl. Das Löschmittel wird durch Löschgeräte in das Fett/Öl gegeben und reagiert aufgrund seiner chemischen Eigenschaft als Lauge mit dem Fett/Öl zu einem seifenartigen Stoff. Diese Seife hat eine kühlende Wirkung und setzt sich an die Oberfläche wo sie den Zutritt von Sauerstoff verhindert. Die Seife selbst ist nicht brennbar. Löschmittel Brandklasse F Brände von Gasen (Brandklasse C): Brennende Gase strömen in der Regel unter einem hohen Druck aus der Leckage aus, so dass es sehr schwierig ist, die Flammen mit Wasser zu löschen. Unter Umständen ist dieses mit dem Vollstrahl möglich, allerdings nicht ratsam, da dann das Gas ungehindert und unkontrolliert ausströmt und sich wieder entzünden kann. brennendes Gas LU Seite 35 / 59
36 Bei solchen Bränden sollen die Leitungen und die unmittelbare Umgebung mit dem Sprühstrahl gekühlt werden, um eine Brandausbreitung zu verhindern. Die Flammen bekämpft man mit Löschpulver, gekoppelt an ein gleichzeitiges Unterbinden der Gasströmung. Brände von elektrischen Anlagen: Elektrische Anlagen Das Löschmittel Wasser ist elektrisch leitend, so dass es für den eingesetzten Trupp beim Einsatz eines Strahlrohres mit Vollstrahl zu einer Gefährdung durch einen direkten Stromfluss kommen kann. Beim Einsatz eines Strahlrohres mit Sprühstrahl wird diese Gefahr erheblich minimiert. Da es in der Regel nicht sofort möglich ist, eine brennende elektrische Anlage spannungsfrei zu schalten, müssen bestimmte Mindestsicherheitsabstände vom vorgehenden Trupp eingehalten werden (vgl. LU 3301 Gefahren der Einsatzstelle ). Einsätze in Gegenwart von Säuren und Laugen: Säuren und Laugen Säuren und Laugen sind chemische Verbindungen die in der Lage sind, viele Stoffe anzugreifen oder sogar vollkommen aufzulösen. Säuren und Laugen können starke Verätzungen der menschlichen Haut bzw. eine Zerstörung des Gewebes verursachen. Die Konzentration einer Säure oder Lauge kann man durch die Zugabe von sehr großen Wasser verringern. Bei diesem Verdünnungsvorgang kann es jedoch zu einer starken Erhitzung und zu einem unkontrollierten Umherspritzen durch Aufkochen des ätzenden Stoffes kommen. Zersetzung von Düngemitteln: Düngemittel Künstliche Düngemittel (Handels- oder Mineraldünger) sind nicht brennbar. Unter einer starken Wärmeeinwirkung setzt jedoch bei diesen Düngemitteln ein Zersetzungsprozess ein, bei dem wiederum Wärme frei wird. Eine solche Zersetzungsreaktion kann nur durch eine Abkühlung unterbunden werden. Zwar kann man dazu das Löschmittel Wasser einsetzen, dennoch sollte man daran denken, dass die meisten Düngemittel wasserlöslich sind bzw. zusammen mit dem Wasser zusammenklumpen, so dass eine weitere Kühlung erschwert wird. Deshalb sollte mit dem Wasser in diesen Situationen sparsam umgegangen und zusätzlich spezielle Löschlanzen verwendet werden, um so direkt an den Zersetzungsherd zu gelangen. Brände in Gegenwart von ungelöschtem Kalk: ungelöschter Kalk Ungelöschter Kalk (Brandkalk, Baukalk, Kalkdünger) ist ebenfalls nicht brennbar. Bei der Berührung mit Wasser entwickeln solche Stoffe jedoch eine beträchtliche Wärme, so dass Temperaturen von bis zu 400 C entstehen können, die zur Entzündung von in der Umgebung befindlichen brennbaren Stoffen (z.b. Holzwände oder -fußböden) führen können. Ungelöschter Kalk ist hauptsächlich bei Bränden in der Landwirtschaft anzutreffen. LU Seite 36 / 59
37 Brände von weißem Phosphor Weißer Phosphor ist an der Luft selbstentzündlich. Solche Brände kann man mit Wasser zwar vorübergehend löschen, sobald das Wasser jedoch verdunstet ist, setzt die Reaktion erneut ein und es kommt zu einer Wiederentzündung. Ferner besteht beim Aufbringen von Wasser die Gefahr, dass Phosphor auseinanderspritzt und Personen verletzt werden können. Kleinere Teile können mit dem Löschwasser an unübersichtliche Stellen gelangen, wo es nach dem Verdunsten zu einer Brandentstehung kommen kann. Phosphorbrände löscht man durch Abdecken des Phosphors mit feuchtem Sand. Phosphor Staubbrände: Der wichtigste Gesichtspunkt bei der Bekämpfung von Staubbränden oder Bränden, bei denen in großem Maß Stäube auftreten können (z.b. Mühlenbetriebe, Möbelfabriken, Textilverarbeitungsbetriebe, Schreinereien), ist das Verhindern von Aufwirbelungen des Staubes. Der Einsatz von Wasser in Form des Vollstrahls muss deshalb ausgeschlossen werden, denn ein kurzzeitig, versehentlich abgegebener Vollstrahl kann unter Umständen zu einer Explosion des Staubes führen. Brennender oder glimmender Staub darf daher nur mit dem Sprühstrahl oder mit Schaum bekämpft werden. Es empfiehlt sich die Zumischung von Netz- oder Schaummitteln, um die bereits angesprochene Oberflächenspannung des Wassers zu vermindern und so den Löscherfolg zu steigern. Bei Braunkohlestäuben ist mit normalem Wasser ohne Netzmittel überhaupt kein Löscherfolg zu erzielen. Staub Koksbrände in geschlossenen Räumen: Bei sämtlichen größeren Glutbränden in geschlossenen Räumen, insbesondere in Kellern, ist bei der Verwendung von Wasser mit dem Aufkommen von großen Mengen heißen Wasserdampfes zu rechnen. Dieser Wasserdampf kann den vorgehenden Trupp und / oder die zu rettenden Personen verbrühen. Außerdem kann die Wärmestrahlung der Glutmassen so extrem sein, dass die Personen einen Hitzeschock erleiden. Koksbrand Kommt glühender Koks mit Wasser in Berührung, so kommt es nicht nur wie oben beschrieben zu einer Wasserdampfbildung, sondern auch zu einer Bildung von Wassergas, einem Gemisch aus Kohlenstoffmonoxid (CO) und Wasserstoff (H 2 ). Die Reaktionsgleichung sieht wie folgt aus: C + H 2 O CO + H 2 Da beide Gase brennbar sind, besteht in solchen Fällen akute Explosionsgefahr. Falls nur Sachwerte oder Tiere gefährdet sind, sollte man bei derartigen Bränden auf einen Innenangriff verzichten und die betroffenen Räume von außen mit Schaum fluten. LU Seite 37 / 59
38 Brände von quellfähigen und wasseraufsaugenden Stoffen: quellfähige und wasseraufsaugende Stoffe Quellfähige Stoffe sind zum Beispiel Getreide, Hülsenfrüchte, Baumwollballen, Flachs oder Hanf. Kommen diese Stoffe mit Wasser in Berührung, so nehmen sie das Löschwasser auf und quellen auf. Die damit verbundene Volumenausdehnung besitzt eine derartige Sprengkraft, die Wände und Silos auseinander drücken kann. Unter wasseraufsaugenden Stoffen versteht man schwammartige Stoffe, die viel Wasser aufnehmen können, ohne dabei ihr Volumen sonderlich zu verändern (z.b. Brandschutt). Diese Stoffe speichern jedoch das Wasser und werden dadurch entsprechend schwerer, so dass die statischen Gegebenheiten von Häusern oder Hallen überbeansprucht und gefährdet werden können. Bei der Brandbekämpfung solcher Stoffe ist Wasser als Löschmittel abzuwägen bzw. für einen ausreichenden Abfluss des Löschwassers zu sorgen Umweltschutzmaßnahmen Umweltschutz In der Regel handelt es sich beim Löschwasser um normales Trinkwasser, welches durch die Versorgungsbetriebe unter einem hohen technischen und finanziellen Einsatz zur Verfügung gestellt wird. Aus diesem Grund sollte man während eines Feuerwehreinsatzes darauf achten, dass das Trinkwasser nicht sinnlos verschwendet wird. Seit einer geraumen Zeit wird die Löschwasserrückhaltung immer wichtiger, vor allem dann, wenn das abfließende Wasser mit Chemikalien, Mineralölen oder sonstigen Giften (z.b. verbrannte oder unverbrannte Stoffe, Pyrolyseprodukte) kontaminiert ist. Ein unkontrollierter Eintritt dieses verschmutzten Wassers in die Umwelt kann das Oberflächen- und / oder Grundwasser schädigen bzw. die Kläranlagen überlasten. Die Industrie stellt speziell für den Feuerwehrdienst entwickelte Behältnisse zur Verfügung, in denen kontaminiertes Wasser aufgefangen und anschließend der Entsorgung durch eine Fachfirma zugeführt werden kann. 3.4 Löschmittel Schaum Allgemeines Allgemeine Wirkungen Der Schaum ist bei den Feuerwehren nach dem Wasser das am häufigsten eingesetzte Löschmittel für die Brandklassen A und B. Die Verwendbarkeit der Schaummittel (im folgenden mit SM abgekürzt) beruht auf den folgenden Effekten: LU Seite 38 / 59
39 Trenneffekt Die aufgebrachte Schaumdecke trennt den Luftsauerstoff vom Brandgut und unterbindet so die Verbrennungsreaktion. Kühleffekt Das aus dem gebildeten Schaum austretende Wasser kühlt das Brandgut. Deckeffekt Die geschlossene Schaumdecke verhindert Gasdurchbrüche und damit Rückzündungen durch heiße Behälterwände, u.ä. Verdrängungseffekt Die Verdrängung wirkt hauptsächlich beim Fluten mit Leicht- und Mittelschäumen. Der Luftsauerstoff (und auch andere brennbare Gase) werden verdrängt. Alle vorgenannten Effekte werden beim Einsatz grundsätzlich von allen Schäumen zur Wirkung gebracht, wobei je nach Art des Brandes, der Schaumart und der Qualität des Schaums/Schaummittels mal der eine, mal der andere Effekt in den Vordergrund rückt. Damit diese Wirkungen zur Entfaltung kommen, müssen bestimmte Anforderungen vom Schaummittel und vom Schaum erfüllt werden: Die Fließfähigkeit des Konzentrates: Bei der Ansaugung muss das Konzentrat im Behälter nachfließen, was bei alkoholbeständigen Schaummittel aufgrund der hohen Viskosität problematisch sein kann und zur Beeinträchtigung der Zumischrate führt. Allgemeine Anforderungen Fließfähigkeit des Schaums: Der Schaumteppich muss sich rasch über das Brandgut ausbreiten, um so einen raschen Löscheffekt oder Abdeckeffekt zu erzielen. Abbrandwiderstand: Der aufgebrachte Schaumteppich muss widerstandsfähig gegenüber Wärmestrahlung und Flammen sein. Dampfdichtheit: Der Schaumteppich muss den Austritt der Gase der heißen Flüssigkeit unterbinden, um eine Rückzündung zu verhindern. LU Seite 39 / 59
40 3.4.2 Zumischung Zumischung Unter der Zumischung (Z) versteht man den prozentualen Anteil vom Schaummittel an dem Wasser-Schaummittel-Gemisch. Beispiel: Wasser-Schaummittel-Gemisch Zumischung 5% Wasser 95% Schaummittel 5% Die übliche Zumischung liegt bei 2-6 Prozent, bei einigen Spezialschaummitteln sogar bis 10 Prozent. Im Allgemeinen werden bei Schwerschaummitteln 3-5% und bei Mehrbereichsschaummitteln 2-3% zugemischt. Es ist jedoch besonders zu erwähnen, dass diesbezüglich die Angaben des Herstellers beachtet werden müssen Verschäumungszahl Verschäumungszahl Das Löschmittel Schaum wird in der Feuerwehrpraxis als Schwer-, Mittel- und Leichtschaum eingesetzt. Einteilungskriterium für die einzelnen Schäume ist die Verschäumungszahl. Die Verschäumungszahl (VZ) ist das Verhältnis zwischen dem Flüssigkeitsvolumen (Wasser-Schaummittel-Gemisch: WSG) und dem erzeugten Schaumvolumen. Sie gibt an, wie vielfach sich die Flüssigkeitsmenge bei der Verschäumung vergrößert hat. Verschäumu ngszahl = Schaumvolumen Flüssigkeitsvolumen(WSG) Beispiel: 5 Liter Flüssigkeit (WSG) unter Zusatz von Luft ergeben 30 Liter Schaum. Das Verhältnis vom Schaumvolumen und Flüssigkeitsvolumen ist: 30 : 5 = Verschäumungszahl 6 LU Seite 40 / 59
41 Verschäumu ngszahl = Schaumvolumen 30 = = 6 Flüssigkeitsvolumen( WSG) 5 Für die verschiedenen Schaumarten gilt folgende Einteilung: Schaumart Verschäumungszahl Wasseranteil Luftanteil Schwerschaum 4 bis 20 hoch gering Mittelschaum 21 bis 200 mittel mittel Leichtschaum 201 bis gering hoch Wasserhalbzeit (50 % Wasserabscheidung) Als Wasserhalbzeit (WHZ) bezeichnet man die Zeit, in der die Hälfte des im Schaum enthaltenen Wassers ausgetreten ist. Sie ist somit ein Maß für die Beständigkeit des Schaums. Bei Schwer- und Mittelschäumen soll diese Zeit im Bereich von 15 bis 20 Minuten liegen (AFFF mindestens acht Minuten). Bei Leichtschäumen ist die Wasserhalbzeit erheblich höher. Wasserhalbzeit Zerstörungsrate Die Zerstörungsrate (ZR) ist der prozentuale Schaumverlust, der infolge direkter Flammenberührung, heißer Wandungen von Behältern, Strahlungswärme, heißen brennenden Flüssigkeiten u.ä. auftritt. Als Faustwert für Schwer- und Mittelschäume kann man ZR = 50 % annehmen. Wird bei Bränden eine bestimmte Menge an Schaum benötigt, muss bei diesem Faustwert die doppelte Menge an Schaum hergestellt werden. Zerstörungsrate ZR = 50% benötigte Menge 100% - ZR = 50% Gesamtvolumen 100% Allgemeine Formel zur Berechnung der Schaummittelmenge: ZM A H V SM = (100 ZR) VZ ZM = Zumischung in % A = einzuschäumende Fläche in m2 H = Schaumhöhe in m ZR = Zerstörungsrate in % VZ = Verschäumungszahl (-) LU Seite 41 / 59
42 Allgemeine Formel zur Berechnung der Beschäumungszeit: t = A H 100% (100 ZR) VZ V V = Gesamtdurchfluss aller eingesetzten Schaumrohre in m 3 / min Schaummittelarten Allgemeine Anforderungen nach DIN EN 1568 (2001/03) Schaummittelarten Schaummittelnorm Schaummittel sind in Deutschland prüf- und zulassungspflichtig. Die Prüfung erfolgt nach den Vorgaben und Anforderungen der seit dem Jahre 2000 gültigen Europäischen Norm DIN EN 1568 Teile 1,2,3,4. Die Deutsche Norm DIN , die lediglich als Entwurf vorlag, wird seit diesem Zeitpunkt nicht mehr angewandt. Die DIN EN 1568 T 1-4: 2000 teilt die Schäume nach dem Kriterium der Verschäumungszahl (VZ) in vier Schammittelarten ein: DIN EN 1568 Teil 1: DIN EN 1568 Teil 2: DIN EN 1568 Teil 3: DIN EN 1568 Teil 4: Anforderungen an Schaummittel zur Erzeugung von Mittelschaum zum Aufgeben auf nicht-polare Flüssigkeiten. Anforderungen an Schaummittel zur Erzeugung von Leichtschaum zum Aufgeben auf nichtpolare Flüssigkeiten. Anforderungen an Schaummittel zur Erzeugung von Schwerschaum zum Aufgeben auf nichtpolare Flüssigkeiten. Anforderungen an Schaummittel zur Erzeugung von Schwerschaum zum Aufgeben auf polare Flüssigkeiten. Leichtschaum (LS); VZ über 200 Leichtschaum Leichtschaum wird bevorzugt angewendet, wenn auf einen Kühleffekt verzichtet werden kann, wenn ein rascher Verdrängungseffekt erzielt werden muss (Raumflutung), wenn radioaktive Luftverunreinigungen gebunden werden müssen, LU Seite 42 / 59
43 wenn mit geringem Strahldruck gearbeitet werden muss (staubförmige Brandstoffe), wenn starke Rauch- und Flockenbildung (Kunststoffbrände) oder gefährliche Dämpfe (nitrose Gase) zurückgehalten werden sollen. Nachteile von Leichtschaum sind: aufgrund des äußerst geringen Wassergehaltes sehr geringe Kühlwirkung, großer apparativer Aufwand, denn für die Erzeugung des Leichtschaums muss ein Leichtschaumgenerator verwendet werden, nicht im Freien verwendbar, Förderung von LS ist problematisch, wenn Höhen von mehr als 10 m zu überwinden sind. Mittelschaum (MS); VZ Mittelschaum wird bevorzugt angewendet, Mittelschaum wenn vorwiegend mit Stickeffekt gelöscht werden muss, wenn mit geringem Strahldruck gearbeitet werden muss (staubförmige Brandstoffe), wenn hoher Wasserschaden vermieden werden muss, wenn relativ kleine Volumina rasch mit Schaum gefüllt werden müssen (Rohrleitungen, Kanäle, Schächte, u.ä.), Nachteile von Mittelschaum sind: aufgrund der geringen Schaumdichte kann der MS von der Thermik des Brandherdes fortgerissen werden im Freien nur bei relativ niedriger Windstärke verwendbar, Schwerschaum (SS); VZ 4 20 Schwerschaum wird bevorzugt angewendet, Schwerschaum wenn zur Abdeckung von Festkörpern oder Flüssigkeiten entweder eine gute Kühlwirkung oder eine gute Haftwirkung erforderlich ist, wenn möglichst große Wurfweiten erforderlich sind, wenn mögliche Rückzündungen verhindert werden müssen, LU Seite 43 / 59
44 bei Koksbränden, bei denen der Einsatz von Wasser problematisch sein kann, wenn große Glutmassen thermisch isoliert werden müssen, wenn Maßnahmen zur Vermeidung von Sekundärbränden getroffen werden müssen (Einschäumen von Mineralöltanks, Tankfahrzeugen, Schiffe, Lagerräume, ausgelaufene brennbare Flüssigkeiten, u.ä.) Schaummittelklassen Schaummittelklassen Schaummittel werden aufgrund ihrer Zusammensetzung in Schaummittelklassen eingeteilt (s. DIN EN 1568). Synthetische Schaummittel (S) S-SM Gemisch aus Tensiden (setzen die Oberflächenspannung des Wassers von ca. 70 mn/m auf unter 20 mn/m herab, wodurch eine bessere Benetzbarkeit erreicht wird), Lösungsvermittlern (Tenside können schwer löslich in Wasser sein), Frostschutzmittel (Frostschutz bis ca. 40 C möglich), Hilfsstoffe für bessere Fließeigenschaften, Korrosionsschutz und Konservierung. verwendbar als SS, MS und LS (Mehrbereichs-SM) zeichnen sich durch gute Verschäumungseigenschaften aus (als SS auch VZ von 9-15) Wasserfilm bildende Schaummittel (AFFF) AFFF-SM Aqueous Film Forming Foam, sind synthetische SM mit zusätzlichen Fluortensiden für die Bildung des Wasserfilms, verwendbar hauptsächlich als SS, aber auch als MS, erreichen aber nur etwa die Hälfte der VZ des MS, zeichnen sich durch die Ausbildung eines Wasserfilms zwischen brennender Flüssigkeitsoberfläche und Schaumdecke aus, so dass auch bei Zerstörung der Schaumdecke (z.b. durch Wind) der Abdeckeffekt bestehen bleibt, schützt besonders gut gegen Rückzündungen des Brandgutes, rasche Wasserabgabe (WHZ 5-10 min) und damit gute Kühlwirkung, relativ hohe Ausbreitungsgeschwindigkeit (fließfähig), LU Seite 44 / 59
45 Proteinschaummittel (P) Gemisch aus hydrolisierten ( zerkochten ) Eiweißstoffen wie Haare, Hufe, Nägel, Hörner, Federn, u.ä., Stabilisatoren zur Erhöhung der Abbrandfähigkeit und Konservierungsmitteln gegen bakterielle Zersetzung und zur besseren Haltbarkeit, P-SM verwendbar als SS (VZ 7-10), große Haftfähigkeit z.b. an senkrechten Wandungen hohe Schaumstabilität (WHZ bis zu 1 Stunde) Fluorproteinschaummittel (FP) sind Proteinschaummittel mit zusätzlichen Fluortensiden zur Verbesserung der Fließfähigkeit FP-SM verwendbar als Schwerschaummittel, rasche Schaumausbreitung und damit geringere Löschzeiten als bei Protein-SM, kann auch direkt auf den Brandherd aufgegeben werden (ohne Leitbleche, Gießkrümmer ), tauchfähig, d.h. eignet sich besonders gut für die Schaumzuführung von unten, z.b. vom Tankboden aus durch die zu löschende Flüssigkeit hindurch ( subsurface injection ), besitzt sehr gute Fließeigenschaften, da die Schaumdecke sehr elastisch ist und beim Umfließen von Hindernissen nicht aufreißt, Wasserfilm bildende Fluorproteinschaummittel (FFFP) Film Forming Fluor Proteine FFFP-SM vereinigt die Eigenschaften der Fluorprotein-SM und der AFFF-SM Alkoholbeständige Schaummittel AR Alle vorgenannten Schaummittel gibt es grundsätzlich auch in der alkoholbeständigen Ausführung. Der Begriff alkoholbeständig steht stellvertretend für geeignet zum Aufgeben auf Brände von polaren Flüssigkeiten (vgl. DIN EN 1568 Teil 4). Diese SM bekommen den Zusatz AR für Alcohol Resistant. Durch die Ausbildung eines unpolaren Polymerfilms wird die Schaumdecke gegen die zerstörende Wirkung der brennenden polaren Flüssigkeit geschützt. AR-SM LU Seite 45 / 59
46 Stoffklasse Funktionelle Beispiel Bezeichnung Gruppe Alkohole OH C 2 H 5 OH Ethanol (Äthylalkohol) Ketone C=O (CH 3 ) 2 =C=O Dimethylketon (Aceton) Aldehyde CHO CH 3 CHO Ethanal (Acetaldehyd) Ether C O C C 2 H 5 O C 2 H 5 Diethylether (Äther) Tabelle 7: Polare Stoffe Anm.: Die in Klammern angegebenen Bezeichnungen sind Trivialnamen Im Zweifelsfall Im Zweifelsfall, wenn nicht klar zu ermitteln ist, ob es sich bei einem Flüssigkeitsbrand um einen polaren oder unpolaren Stoff handelt, liegt man mit einem AFFF/AR immer richtig, da dieser, je nach Beschaffenheit der Flüssigkeit, entweder einen polaren Wasserfilm oder einen unpolaren Polymerfilm bildet Leistungskenndaten Leistungskenndaten von Schaummitteln Mit der Europäischen Norm DIN EN 1568 wurde für Schwerschäume nach Teil 3 und 4 ein Leistungsstufensystem eingeführt. Die Kennzahl für die Leistungseinstufung setzt sich aus einer römischen Ziffer (I, II, III) für die Löschleistung und einem Buchstaben (A, B, C, D) für die Rückbrandbeständigkeit zusammen, wobei folgende Reihe gilt (abnehmende Leistung): IA, IB, IC, ID, IIA, IIB, IIC, IID, IIIB, IIIC, IIID. SM-Klasse Löschleistungstufe Rückbrandfestigkeit Wasserfilm bildende Fluorprotein-SM (FFFP) I B Wasserfilm bildende synthetische SM (AFFF) I C Fluor-Protein-SM (FP) II A Protein-SM (P) III B Synthetische SM (S) III C Tabelle 8: Typische Leitungsklassen von nicht alkoholbeständigen Schaummitteln, DIN EN ,2,3,4:2000 Die Leistungseinstufung der alkoholbeständigen Schäume folgt einem ähnlichen Verfahren, so dass sich ein Leistungsspektrum von IA, IB, IC, IIA, IIB, IIC ergibt. LU Seite 46 / 59
47 SM-Klasse Löschleistungstufe Rückbrandfestigkeit Wasserfilm bildende Fluorprotein-SM (FFFP/AR) I A Wasserfilm bildende synthetische SM (AFFF/AR) I B Fluor-Protein-SM (FP/AR) II A Protein-SM (P/AR) II 1) B Synthetische SM (S/AR) II 1) C Tabelle 9: Typische Leitungsklassen von alkoholbeständigen Schaummitteln, DIN EN ,2,3,4:2000 1) in der Norm fälschlich mit der nicht definierten Einstufung III angegeben Kennzeichnung der Schäume bzw. der Behälter Die Kennzeichnung der Schammittelbehälter ist Bestandteil der Zulassung und wird ebenfalls durch die Norm geregelt. Kennzeichnung von Schaummitteln ALCOPOL Alkoholbeständiges und Film bildendes Schwer- und Mittelschaummittel nach DIN EN 1568 Teil 1, 3 und 4 Dieses pseudoplastische Schaummittel bedarf unterhalb von -5 C einer besonderen Dosierung Beim Ansprühen von Personen beachten, dass im Schaum keine Atmungsmöglichkeit besteht! Enthält Butoxyethanol Geeignet für Meerwasser Leistungsstufe IB (Teil 3; Leitungswasser) IC (Teil 3; Meerwasser) IIA (Teil 4) Zumischung: 3% (Teil 1,3) Zul.-Kenn-Nr.: DIN EN 1568 PL-xy/o6 Nennfüllmenge: 20 Liter 6% (Teil 4) Charge-Nr.: Lagerung: (- 30 bis + 60) C Herst.-Datum: Niedrigste Einsatztemperatur: - 15 C Chemische Fabrik Toledo Abbildung 12: Beispiel der Kennzeichnung der Schaummittelgebinde, [Jürgen Uphoff, IdF NRW] LU Seite 47 / 59
48 Einsatzgrundsätze Einsatzverbote: nicht einsetzen in Strom führende Anlagen (s. DIN VDE 0132); Spannung wegschalten! nicht einsetzen bei Metall- und Fettbränden! nicht einsetzen bei Lagerung von Stoffen, die mit Wasser gefährliche Reaktionen eingehen! nur bedingt einsetzen bei quellfähigen und Wasser aufsaugenden Stoffen Diese Einsatzverbote gelten vor allem für Schwer- und Mittelschaum! Beachte: Wasserfilm bildende und andere nicht alkoholbeständige Schaummittel zeigen bei Bränden polarer Flüssigkeiten keine Wirkung! unterschiedliche Schaummittelklassen dürfen nicht vermischt werden! vor dem Einsatz sicherstellen, dass genügend Schaummittel zur Verfügung steht! Zumischrate laut Angabe des Herstellers beachten! mit dem Beschäumen erst dann beginnen, wenn der Schaum in genügender Qualität erzeugt wird! den Schaumstrahl nicht direkt in die brennende Flüssigkeit richten, sondern an Wandungen o.ä. hineinfließen lassen! beim Ansprühen von Personen besteht im Schaum keine Atmungsmöglichkeit! bei einem kombinierten Löschangriff immer zuerst das Pulver, dann den Schaum aufgeben Faustwerte Faustformel für durchschnittliche Schaumhöhe h = 0,5 m Schwerschaum Mittelschaum 2 l SM pro m 2 0,5 l SM (0,4 l) pro m 2 berechnet sich aus: ZR = 50 % (Faustwert im Einsatz) ZM = 3 % (übliches Mehrbereichsschaummittel) VZ = 15 bzw. (75) (Verwendung S4-15 bzw. (M4-75)) LU Seite 48 / 59
49 Schaummittelberechnung Einer der wichtigsten Einsatzgrundsätze ist es, einen Schaumangriff erst dann zu beginnen, wenn klar ist, dass genügend Schaummittel an der Einsatzstelle zur Verfügung steht. Ob diese Bedingung erfüllt ist, kann man zum Beispiel im Rahmen der Einsatzplanung und -vorbereitung für bestimmte Objekte bereits im Vorfeld klären. Dieses ermittelt man mit der Hilfe einer Schaummittelberechnung. Berechnung Beispiel: In einer Lagerhalle, die eine Länge l = 10 m und eine Breite b = 5 m aufweist, läuft eine brennbare Flüssigkeit aus. Um einer Entzündung dieser Flüssigkeit vorzubeugen, soll der Hallenboden mit Mittelschaum (h Schaum = 1 m) bedeckt werden. Die Verschäumungszahl ist VZ = 75, die Zumischung beträgt Z = 3 %, die Zerstörungsrate liegt bei ZR = 30 %. Wie viele Liter Schaummittel werden insgesamt mindestens benötigt? Reicht dafür ein LF 20/16 aus? geg.: l = 10 m b = 5 m h Schaum = 1 m ZR = 30 % VZ = 75 Z = 3 % 1. Berechnung der einzuschäumenden Hallenfläche A Halle : A Halle = l b = 10m 5m = 50m 2 2. Berechnung des benötigten Schaumvolumens V* Schaum ohne Berücksichtigung der Zerstörungsrate ZR: V * 2 3 Schaum = AHalle hschaum = 50m 1m = 50m 3. Berechnung des Schaumvolumens V Schaum unter Berücksichtigung der Zerstörungsrate ZR: 70 % - 50 m3 (unzerstörtes Schaumvolumen) 100 % - x m3 (herzustellendes Schaumvolumen) 3 100% 50m V Schaum = x = = 71,43m 70% 4. Berechnung des Flüssigkeitsvolumens WSG: 3 Verschäumungszahl ( VZ ) = Schaumvolumen( VSchaum) Flüssigkeitsvolumen( WSG) 3 VSchaum 71,43m WSG = = = 0,95m VZ 75 3 LU Seite 49 / 59
50 5. Berechnung des Schaummittelbedarfs SM: 100 % - 0,95 m3 (WSG) 3 % - x m3 (SM) 3 3% 0,95m SM = x = = 0,0285m 100% SM = 0,0285m 3 = 28, 5l Es werden insgesamt 28,5 l Schaummittel benötigt. Da auf einem LF 20/16 insgesamt sechs Kanister Schaummittel à 20 Liter verlastet sind, reicht ein LF 20/16 für diesen Einsatz aus Netzmittel Class A Foam Class A Foam Löschwirkung Class A Foam wird, wie der Name schon zum Ausdruck bringt, bei Bränden der Brandklasse A eingesetzt. Die Löschwirkung von Class A Foam ist auf verschiedene Einzelphänome zurückzuführen. Zunächst verringert die Zumischung von Netzmitteln die Tropfengröße von Wasser, wenn Wasserstrahlrohre verwendet werden. Dadurch wird der Wärmeübergang vom Brandgut bzw. Brandrauch auf das Wasser verbessert. Weiterhin verringert sich die Oberflächenspannung des Wassers durch die Zugabe des Netzmittels. Dadurch ist das Wasser in der Lage, poriges Material (z.b. Stroh, Holz, u.a.) besser zu durchfeuchten und tief sitzende Glutnester zu löschen. Die Verringerung der Oberflächenspannung von Wasser durch Zumischung von Class A Foam Oberflächenspannung [dyn/cm] ,1 0,2 0,3 0,4 0,5 Zumischung [%] Abbildung 13: Oberflächenspannung von Wasser bei Zugabe von Netzmittel, [Oliver Wegner, Fw Waltrop] Der Schaum fixiert zudem das Wasser auf dem Brandgut, welches somit nicht sofort wieder abfließt. Die Zumischraten liegen bei heutigen Schaummitteln bei Werten unter 1%. LU Seite 50 / 59
51 Druckluftschaum CAFS Compressed Air Foam System Dieses System entwickelte sich aus dem oben beschriebenen Class A Foam, bei dem Netzmittel in geringer Konzentration dem Löschwasser zugegeben wird. Die nächste Stufe der Entwicklung war ein Kompressor mit der dazugehörenden Technik, der in das System eingebaut wurde. Somit wird das Wasser- Schaummittel-Gemisch bereits hinter der Pumpe mit der nötigen Luft angereichert. CAFS Schaummittel Druckluft Wasser WSM-Gemisch Schaum Durchflussrichtung Abbildung 14: Funktionsschema Druckluftschaumanlage, [Frank Wenking, IdF NRW] Dabei wird dem Löschwasserstrom, anders als beim üblichen Verfahren mit Zumischern keine Energie entzogen, sondern Energie zugefügt, so dass bessere Wurfweiten und -höhen erzielt werden. CAFS reduziert als Netzmittel die Oberflächenspannung des Wassers und bildet Schaumblasen. Durch die so entstandene größere Oberfläche kann ein intensiver Wärmeaustausch stattfinden und somit mehr Löschmittel verdampfen. Da durch höhere Wurfweiten und -höhen die Auftreffenergie höher ist, gelangt das Löschmittel weiter zum Brandherd. Es entfaltet dort seine kühlende Wirkung und nicht bereits außen an der Flammenzone. Der Schaum haftet gut an Gegenständen, wobei seine weiße Oberfläche die Wärmestrahlung reflektiert und somit die Gegenstände schützt. Der hergestellte Schaum besitzt in der Regel eine Verschäumungszahl VZ ~ 7. Durch die Wahl des Verhältnisses von Wasser und Luft kann auch relativ trockener Schaum hergestellt werden. Löschwirkung Vorteile: - geringer Wasserverbrauch, Verminderung von Wasserschäden - Vergrößerung der Wurfweiten und -höhen - kürzere Löschzeiten - Schutz vor Wärmestrahlung - leichte Schläuche, da mit 80% Luft gefüllt - gute Umweltverträglichkeit, da geringe Zumischung - Vergrößerung der Löschmittelmenge LU Seite 51 / 59
FwDV 2 Truppmannausbildung Teil 1 Brennen und Löschen. LM Steffen Kaspar LB 2
 FwDV 2 Truppmannausbildung Teil 1 Brennen und Löschen Themen des Unterrichts Verbrennungsvoraussetzungen Verbrennungsvorgang (Oxidation) Brandklassen Verbrennungsprodukte (Atemgifte) Hauptlöschwirkungen
FwDV 2 Truppmannausbildung Teil 1 Brennen und Löschen Themen des Unterrichts Verbrennungsvoraussetzungen Verbrennungsvorgang (Oxidation) Brandklassen Verbrennungsprodukte (Atemgifte) Hauptlöschwirkungen
Brennen und Löschen Truppmann I-Lehrgang 2010
 Brennen und Löschen Truppmann I-Lehrgang 2010 Michael Weißhaar, Dipl.-Ing. (FH) Lechleitnerweg 4 72401 Haigerloch Gliederung Brennen - Voraussetzungen für eine Verbrennung - Brennbare Stoffe - Brandklassen
Brennen und Löschen Truppmann I-Lehrgang 2010 Michael Weißhaar, Dipl.-Ing. (FH) Lechleitnerweg 4 72401 Haigerloch Gliederung Brennen - Voraussetzungen für eine Verbrennung - Brennbare Stoffe - Brandklassen
Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen. Es ist nur eine Antwortmöglichkeit richtig!
 Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen Es ist nur eine Antwortmöglichkeit richtig! 1. Welche Stoffe dehnen sich bei der Erwärmung aus? Nur flüssige
Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen Es ist nur eine Antwortmöglichkeit richtig! 1. Welche Stoffe dehnen sich bei der Erwärmung aus? Nur flüssige
Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen. Es ist nur eine Antwortmöglichkeit richtig!
 Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen Es ist nur eine Antwortmöglichkeit richtig! 1. Welche Stoffe dehnen sich bei Erwärmung aus? Nur flüssige Stoffe
Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen Es ist nur eine Antwortmöglichkeit richtig! 1. Welche Stoffe dehnen sich bei Erwärmung aus? Nur flüssige Stoffe
Freiwillige Feuerwehr Wald
 1. Löschvorgang Für die Entstehung eines Brandes müssen drei Vorraussetzungen erfüllt sein: Brennbarer Stoff Sauerstoff Wärme Das Feuer erlischt, wenn eine dieser drei Vorraussetzungen beseitigt wird.
1. Löschvorgang Für die Entstehung eines Brandes müssen drei Vorraussetzungen erfüllt sein: Brennbarer Stoff Sauerstoff Wärme Das Feuer erlischt, wenn eine dieser drei Vorraussetzungen beseitigt wird.
Brennen und Löschen. Brennen und Löschen. Ausbilderleitfaden für die Freiwilligen Feuerwehren Bayerns Modulare Truppausbildung.
 Basis 3 Folie 1 Brennen und Löschen Basis 3 Folie 2 Voraussetzung für die Verbrennung Voraussetzungen für die Verbrennung sind im richtigen Mischungsverhältnis gegeben Voraussetzungen für die Verbrennung
Basis 3 Folie 1 Brennen und Löschen Basis 3 Folie 2 Voraussetzung für die Verbrennung Voraussetzungen für die Verbrennung sind im richtigen Mischungsverhältnis gegeben Voraussetzungen für die Verbrennung
Fachbereich Ausbildung
 Zusammenfassung, Wiederholung, Lernkontrolle : Zur Wiederholung und Lernkontrolle können folgende Fragen gestellt werden. Die Fragen stellen Musterbeispiele dar und könnten in ähnlicher Art und Weise auch
Zusammenfassung, Wiederholung, Lernkontrolle : Zur Wiederholung und Lernkontrolle können folgende Fragen gestellt werden. Die Fragen stellen Musterbeispiele dar und könnten in ähnlicher Art und Weise auch
Fachbereich Ausbildung
 Zusammenfassung, Wiederholung, Lernkontrolle : Zur Wiederholung und Lernkontrolle können folgende Fragen gestellt werden. Die Fragen stellen Musterbeispiele dar und könnten in ähnlicher Art und Weise auch
Zusammenfassung, Wiederholung, Lernkontrolle : Zur Wiederholung und Lernkontrolle können folgende Fragen gestellt werden. Die Fragen stellen Musterbeispiele dar und könnten in ähnlicher Art und Weise auch
Brenne und Löschen Grundlagen
 Brennen und Löschen Jugendfeuerwehr Mühlheim Brenne und Löschen Grundlagen JFM / JG 2007 1 Brennen: Brennen ist durch eine Flamme und/oder Glut selbstständig ablaufende Reaktion zwischen einem brennbaren
Brennen und Löschen Jugendfeuerwehr Mühlheim Brenne und Löschen Grundlagen JFM / JG 2007 1 Brennen: Brennen ist durch eine Flamme und/oder Glut selbstständig ablaufende Reaktion zwischen einem brennbaren
Eigenschaften der brennbaren Stoffe
 Eigenschaften der brennbaren Stoffe TT.MM.JJJJ Referentenunterlage Eigenschaften der brennbaren Stoffe Inhalt: 1. Begrüßung 2. Kapitelpräsentation 3. Sicherheitstechnische Kennzahlen von entzündbaren Flüssigkeiten
Eigenschaften der brennbaren Stoffe TT.MM.JJJJ Referentenunterlage Eigenschaften der brennbaren Stoffe Inhalt: 1. Begrüßung 2. Kapitelpräsentation 3. Sicherheitstechnische Kennzahlen von entzündbaren Flüssigkeiten
LM Dennis Buroh JF Großenaspe, Brennen & Löschen
 LM Dennis Burh JF Grßenaspe, 20.01.11 Brennen & Löschen LM Dennis Burh JF Grßenaspe, 20.01.11 5 Minuten Wiederhlung: 1. Welche Mannschaftsstärke beinhaltet eine Trupp? 1/5 2. Wer fährt das Fahrzeug? Maschinist
LM Dennis Burh JF Grßenaspe, 20.01.11 Brennen & Löschen LM Dennis Burh JF Grßenaspe, 20.01.11 5 Minuten Wiederhlung: 1. Welche Mannschaftsstärke beinhaltet eine Trupp? 1/5 2. Wer fährt das Fahrzeug? Maschinist
Amt für Feuerschutz des Kantons St.Gallen. Handhabung und Einsatz von Klein-Löschgeräten
 Amt für Feuerschutz des Kantons St.Gallen Handhabung und Einsatz von Klein-Löschgeräten Klein-Löschgeräte wie Eimerspritzen, Handfeuerlöscher, Wasserlöschposten mit Gummischlauch und Mehrzweckstahlrohr
Amt für Feuerschutz des Kantons St.Gallen Handhabung und Einsatz von Klein-Löschgeräten Klein-Löschgeräte wie Eimerspritzen, Handfeuerlöscher, Wasserlöschposten mit Gummischlauch und Mehrzweckstahlrohr
- Verbrennungsreaktion und Löschverfahren -
 - Verbrennungsreaktion und Löschverfahren - Bedingungen für eine Verbrennungsreaktion 1. Vorhandensein eines brennbaren Stoffes und dem Reaktionspartner Luft/Sauerstoff 2. Richtiges Mengenverhältnis zwischen
- Verbrennungsreaktion und Löschverfahren - Bedingungen für eine Verbrennungsreaktion 1. Vorhandensein eines brennbaren Stoffes und dem Reaktionspartner Luft/Sauerstoff 2. Richtiges Mengenverhältnis zwischen
1. Feuer. 2. Flamme. 4. Brand. 3. Glut
 Brennen und Löschen Truppführerausbildung 2 h Lies mich Themen der Ausbildung Grundbegriffe Voraussetzungen für einen Brand Brandklassen und deren Eigenschaften Löschmittel und deren Wirkungen 1 Grundbegriffe
Brennen und Löschen Truppführerausbildung 2 h Lies mich Themen der Ausbildung Grundbegriffe Voraussetzungen für einen Brand Brandklassen und deren Eigenschaften Löschmittel und deren Wirkungen 1 Grundbegriffe
Löschen. einsetzen. Referentenunterlage TT.MM.JJJJ R
 Löschen Feuerlöscher einsetzen effektiv TT.MM.JJJJ R Referentenunterlage Feuerlöscher sind Selbsthilfemittel zur BekämpfunB ng von Entstehungs- bränden. Diese Schulung dientt der Vorbereitung eines Feuerlöschertrainings.
Löschen Feuerlöscher einsetzen effektiv TT.MM.JJJJ R Referentenunterlage Feuerlöscher sind Selbsthilfemittel zur BekämpfunB ng von Entstehungs- bränden. Diese Schulung dientt der Vorbereitung eines Feuerlöschertrainings.
Fragenkatalog zur Hessischen Feuerwehrleistungsübung Löschen. Es ist nur eine Antwortmöglichkeit richtig!
 Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung Löschen Es ist nur eine Antwortmöglichkeit richtig! 1. Welches Löschmittel eignet sich besonders zur Brandbekämpfung
Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung Löschen Es ist nur eine Antwortmöglichkeit richtig! 1. Welches Löschmittel eignet sich besonders zur Brandbekämpfung
Arbeitssicherheit. SG Arbeitssicherheit
 Arbeitssicherheit SG Arbeitssicherheit Arbeitsschutz Beratung Information Unterstützung Herr Schüller - 26631 Herr Doil - 26636 Herr Kuchenreuther - 26649 Frau Muchow-Eggers - 26768 Frau Pfattheicher -
Arbeitssicherheit SG Arbeitssicherheit Arbeitsschutz Beratung Information Unterstützung Herr Schüller - 26631 Herr Doil - 26636 Herr Kuchenreuther - 26649 Frau Muchow-Eggers - 26768 Frau Pfattheicher -
man sagt : Phosphor + Sauerstoff reagieren Tetraphosphorzu dekaoxid
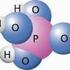 Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Die Verbrennung Grundlagen und Erscheinungsformen
 Thema Truppführerausbildung Brennen & Löschen Erzgebirgskreis T. Neumann 09/2011 Kreisausbildung Brennen & Löschen Thema behandelt: - Grundlagen der Verbrennung - Wirkung ausgesuchter Löschmittel HBM Tilo
Thema Truppführerausbildung Brennen & Löschen Erzgebirgskreis T. Neumann 09/2011 Kreisausbildung Brennen & Löschen Thema behandelt: - Grundlagen der Verbrennung - Wirkung ausgesuchter Löschmittel HBM Tilo
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C?
 A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
Brennen und Löschen Merkblatt für die Feuerwehren Bayerns. Stand: 10/2004 1
 Brennen und Löschen 5.01 Merkblatt für die Feuerwehren Bayerns Stand: 10/2004 1 Inhaltsverzeichnis I. Verbrennungsvorgang... 3 1. Voraussetzungen der Verbrennung... 3 1.1 Brennbarer Stoff... 4 1.2 Sauerstoff...
Brennen und Löschen 5.01 Merkblatt für die Feuerwehren Bayerns Stand: 10/2004 1 Inhaltsverzeichnis I. Verbrennungsvorgang... 3 1. Voraussetzungen der Verbrennung... 3 1.1 Brennbarer Stoff... 4 1.2 Sauerstoff...
Warum ist Feuer nützlich und warum sind Flammen heiß?
 Warum ist Feuer nützlich und warum sind Flammen heiß? Professor Dr.-Ing. Dieter Brüggemann KinderUniversität Bayreuth 1. Juli 2009 Wozu nutzen wir Feuer? Wir nutzen Feuer, um zu beleuchten Quelle: Wikipedia
Warum ist Feuer nützlich und warum sind Flammen heiß? Professor Dr.-Ing. Dieter Brüggemann KinderUniversität Bayreuth 1. Juli 2009 Wozu nutzen wir Feuer? Wir nutzen Feuer, um zu beleuchten Quelle: Wikipedia
Rechtsgrundlagen FSHG und ZSG
 Rechtsgrundlagen FSHG und ZSG FSHG = FeuerSchutzHilfeleistungsGesetz Aufgaben der Träger 1 Aufgaben der Gemeinden und Kreise 3 Aufgaben des Landes 4 Pflichtaufgaben zur Erfüllung nach Weisung 1 - Unterhalten
Rechtsgrundlagen FSHG und ZSG FSHG = FeuerSchutzHilfeleistungsGesetz Aufgaben der Träger 1 Aufgaben der Gemeinden und Kreise 3 Aufgaben des Landes 4 Pflichtaufgaben zur Erfüllung nach Weisung 1 - Unterhalten
B E I S P I E L A R B E I T / Aufgaben. Kultusministerium. Name, Vorname: Klasse: Schule: Seite 1 von 6
 B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
Alles was uns umgibt!
 Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Obergimpern
 www.freiwillige-feuerwehr-.de Die Tür Prozedur - So werden Türen zu Brandräumen geöffnet! Text: Jan Südmersen BF Osnabrück Fotos: Thomas Wachno Eines der wichtigsten Dinge in der Atemschutzausbildung ist
www.freiwillige-feuerwehr-.de Die Tür Prozedur - So werden Türen zu Brandräumen geöffnet! Text: Jan Südmersen BF Osnabrück Fotos: Thomas Wachno Eines der wichtigsten Dinge in der Atemschutzausbildung ist
Lehrabschlussprüfungs Vorbereitungskurs Rauchfangkehrer. Brennstoffe. Wir Unterscheiden grundsätzlich Brennstoffe in:
 Lehrabschlussprüfungs Vorbereitungskurs Rauchfangkehrer Wir Unterscheiden grundsätzlich in: Feste Flüssige Gasförmige Biomasse Feste Torf Holz Kohle Brikett Koks Anthrazit Holz: Anwendung: Kachelofen,
Lehrabschlussprüfungs Vorbereitungskurs Rauchfangkehrer Wir Unterscheiden grundsätzlich in: Feste Flüssige Gasförmige Biomasse Feste Torf Holz Kohle Brikett Koks Anthrazit Holz: Anwendung: Kachelofen,
Flamme gasförmig. Glut fest. Glut und Flamme. Fichtenholz
 Brandschutzforum Austria Verbrennungs- und Löschvorgang Teil 3 Phänomenologie Glut und Flamme copyright by Dr. Otto Dr. Widetschek, Otto Widetschek Graz Flamm- und Glutbrand Flamme gasförmig Glut fest
Brandschutzforum Austria Verbrennungs- und Löschvorgang Teil 3 Phänomenologie Glut und Flamme copyright by Dr. Otto Dr. Widetschek, Otto Widetschek Graz Flamm- und Glutbrand Flamme gasförmig Glut fest
Brandschutz - Feuerlöscher Startseite zurück vor. Feuerlöscher
 Feuerlöscher Brandklassen Arten Aufbau und Funktion Kennzeichnung Eignung Wartung und Prüfung Löschvermögen Berechnung der notwendigen Anzahl Erstellung: BSU GmbH & Co. KG, Engelskirchen, Tel.: 02263 /
Feuerlöscher Brandklassen Arten Aufbau und Funktion Kennzeichnung Eignung Wartung und Prüfung Löschvermögen Berechnung der notwendigen Anzahl Erstellung: BSU GmbH & Co. KG, Engelskirchen, Tel.: 02263 /
Brand- und Löschlehre
 TM1 Lehrgang Brand- und Löschlehre Brandlehre Oxidatin - Reaktin mit Sauerstff Exthermer Vrgang Energie wird in Frm vn Wärme freigesetzt, bei beschleunigter Oxidatin Licht der Feuer Brennen - chemischer
TM1 Lehrgang Brand- und Löschlehre Brandlehre Oxidatin - Reaktin mit Sauerstff Exthermer Vrgang Energie wird in Frm vn Wärme freigesetzt, bei beschleunigter Oxidatin Licht der Feuer Brennen - chemischer
Fachrichtung Klima- und Kälteanlagenbauer
 Fachrichtung Klima- und Kälteanlagenbauer 1-7 Schüler Datum: 1. Titel der L.E. : 2. Fach / Klasse : Fachrechnen, 3. Ausbildungsjahr 3. Themen der Unterrichtsabschnitte : 1. Zustandsänderung 2. Schmelzen
Fachrichtung Klima- und Kälteanlagenbauer 1-7 Schüler Datum: 1. Titel der L.E. : 2. Fach / Klasse : Fachrechnen, 3. Ausbildungsjahr 3. Themen der Unterrichtsabschnitte : 1. Zustandsänderung 2. Schmelzen
B E I S P I E L A R B E I T / Lösungen. Kultusministerium
 Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft Chemie untersucht u. a. die Eigenschaften der Stoffe und ordnet diese danach.
Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft Chemie untersucht u. a. die Eigenschaften der Stoffe und ordnet diese danach.
B E I S P I E L A R B E I T / Aufgaben. Kultusministerium
 B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
B E I S P I E L A R B E I T / Aufgaben Kultusministerium Name, Vorname: Klasse: Schule: Seite 1 von 6 B E I S P I E L A R B E I T / Aufgaben Aufgabe 1: Stoffe und ihre Eigenschaften a) Die Naturwissenschaft
Vorbeugender Brandschutz in Betrieben
 Vorbeugender Brandschutz in Betrieben BOI Oliver Schweder Gliederung Einführung Fakten zum Feuer Ursachen und Folgen Verbrennen und Löschen Verbrennungsvorgang Brandklassen und Löschmittel Gebäudebrände
Vorbeugender Brandschutz in Betrieben BOI Oliver Schweder Gliederung Einführung Fakten zum Feuer Ursachen und Folgen Verbrennen und Löschen Verbrennungsvorgang Brandklassen und Löschmittel Gebäudebrände
Truppführerausbildung
 Truppführerausbildung ABC - Gefahrstoffe Lernziel Maßnahmengruppen und Eigenschaften von Gefahrstoffen nennen Kennzeichnung beim Transport und ortsfesten Bereich wiedergeben Besonderheiten des ABC Einsatzes
Truppführerausbildung ABC - Gefahrstoffe Lernziel Maßnahmengruppen und Eigenschaften von Gefahrstoffen nennen Kennzeichnung beim Transport und ortsfesten Bereich wiedergeben Besonderheiten des ABC Einsatzes
Löschvorgang und Löschmittel
 Löschvorgang und Löschmittel A. Möglichkeiten des Löschens: Grundwissen als Voraussetzung Bedingungen für eine Verbrennung: a) Vorhandensein des brennbaren Stoffs b) Vorhandensein des Sauerstoffs c) richtiges
Löschvorgang und Löschmittel A. Möglichkeiten des Löschens: Grundwissen als Voraussetzung Bedingungen für eine Verbrennung: a) Vorhandensein des brennbaren Stoffs b) Vorhandensein des Sauerstoffs c) richtiges
Brennen und Löschen Ausbildungsunterlage
 Ausbildungsunterlage der Landesfeuerwehrschule Tirol Erstellt von: Noichl Madeleine Freigegeben von der: 199. SAS Ausbildungsunterlage Brennen und Löschen (Grundausbildung) Für den Inhalt verantwortlich:
Ausbildungsunterlage der Landesfeuerwehrschule Tirol Erstellt von: Noichl Madeleine Freigegeben von der: 199. SAS Ausbildungsunterlage Brennen und Löschen (Grundausbildung) Für den Inhalt verantwortlich:
Arbeitnehmerschutz und EX-Zonen eine Herausforderung für den Instandhalter Ing. Johann Kreimer
 Explosionsfähige Atmosphäre (exat) Gemisch aus brennbaren Gasen, Dämpfen, Nebeln oder Stäuben innerhalb der Explosionsgrenzen und oxidativer Atmosphäre, z.b. Luft Arbeitnehmerschutz und EX-Zonen eine Herausforderung
Explosionsfähige Atmosphäre (exat) Gemisch aus brennbaren Gasen, Dämpfen, Nebeln oder Stäuben innerhalb der Explosionsgrenzen und oxidativer Atmosphäre, z.b. Luft Arbeitnehmerschutz und EX-Zonen eine Herausforderung
Feuer. Naturwissenschaftliches Denken und Arbeiten. Methodische Fähigkeiten und Fertigkeiten beim Experimentieren
 Naturwissenschaftliches Denken und Arbeiten Methodische Fähigkeiten und Fertigkeiten beim Experimentieren Feuer Konzept der Erhaltung (chemische Reaktion) Konzept der Wechselwirkung 1. Grundlagen - Feuer
Naturwissenschaftliches Denken und Arbeiten Methodische Fähigkeiten und Fertigkeiten beim Experimentieren Feuer Konzept der Erhaltung (chemische Reaktion) Konzept der Wechselwirkung 1. Grundlagen - Feuer
Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen.
 1) DEFINITIONEN DIE CHEMISCHE REAKTION Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen. Der Massenerhalt: Die Masse ändert sich im Laufe einer Reaktion
1) DEFINITIONEN DIE CHEMISCHE REAKTION Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen. Der Massenerhalt: Die Masse ändert sich im Laufe einer Reaktion
Grundlagen im Feuerwehrwesen
 AGV Aargauische Gebäudeversicherung Grundlagen im Feuerwehrwesen Einführungskurs Angehörige der Feuerwehr AGV Aargauische Gebäudeversicherung Bleichemattstrasse 12/14 Postfach 5001 Aarau Inhalt Ehrenkodex
AGV Aargauische Gebäudeversicherung Grundlagen im Feuerwehrwesen Einführungskurs Angehörige der Feuerwehr AGV Aargauische Gebäudeversicherung Bleichemattstrasse 12/14 Postfach 5001 Aarau Inhalt Ehrenkodex
Feuerwehr Riegelsberg
 Feuerwehr Riegelsberg Brennen und Löschen Anlage zur Versuchsreihe Erstellt: Jörg Klein Folie 1 Löschmittel der Feuerwehr Wasser Schaum Pulver Kohlendioxid CO 2 Sonstige Sand Graugußspäne Zement u.a. Erstellt:
Feuerwehr Riegelsberg Brennen und Löschen Anlage zur Versuchsreihe Erstellt: Jörg Klein Folie 1 Löschmittel der Feuerwehr Wasser Schaum Pulver Kohlendioxid CO 2 Sonstige Sand Graugußspäne Zement u.a. Erstellt:
Versuch V1 - Viskosität, Flammpunkt, Dichte
 Versuch V1 - Viskosität, Flammpunkt, Dichte 1.1 Bestimmung der Viskosität Grundlagen Die Viskosität eines Fluids ist eine Stoffeigenschaft, die durch den molekularen Impulsaustausch der einzelnen Fluidpartikel
Versuch V1 - Viskosität, Flammpunkt, Dichte 1.1 Bestimmung der Viskosität Grundlagen Die Viskosität eines Fluids ist eine Stoffeigenschaft, die durch den molekularen Impulsaustausch der einzelnen Fluidpartikel
Verbrennung einer Kerze
 Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Temperatur. Temperaturmessung. Grundgleichung der Kalorik. 2 ² 3 2 T - absolute Temperatur / ºC T / K
 Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
u Ŏ0 ŏ1 8QTDGWIGPFGT $TCPFUEJWV\ KP $GVTKGDGP $1+ 1NKXGT 5EJYGFGT 56#&6 1.&'0$74) Feuerwehr
 Einführung Fakten zum Feuer Ursachen und Folgen Verbrennen und Löschen Verbrennungsvorgang Brandklassen und Löschmittel Gebäudebrände Brandschutzmaßnahmen Organisatorische Maßnahmen Bauliche Maßnahmen
Einführung Fakten zum Feuer Ursachen und Folgen Verbrennen und Löschen Verbrennungsvorgang Brandklassen und Löschmittel Gebäudebrände Brandschutzmaßnahmen Organisatorische Maßnahmen Bauliche Maßnahmen
Heizöl ist ein flüssiger Brennstoff und wird nach Ausgangsprodukt in. - Teeröle
 Zusammenfassung zur Vorlesung Optimierte Gebäudetechnik / Teil Wärmeversorgungssysteme ab 3.KW/00 Heizöl ist ein flüssiger Brennstoff und wird nach Ausgangsprodukt in zwei Hauptgruppen eingeteilt: - Mineralische
Zusammenfassung zur Vorlesung Optimierte Gebäudetechnik / Teil Wärmeversorgungssysteme ab 3.KW/00 Heizöl ist ein flüssiger Brennstoff und wird nach Ausgangsprodukt in zwei Hauptgruppen eingeteilt: - Mineralische
Flüssigkeitsthermometer Bimetallthermometer Gasthermometer Celsius Fahrenheit
 Wärme Ob etwas warm oder kalt ist können wir fühlen. Wenn etwas wärmer ist, so hat es eine höhere Temperatur. Temperaturen können wir im Bereich von etwa 15 Grad Celsius bis etwa 45 Grad Celsius recht
Wärme Ob etwas warm oder kalt ist können wir fühlen. Wenn etwas wärmer ist, so hat es eine höhere Temperatur. Temperaturen können wir im Bereich von etwa 15 Grad Celsius bis etwa 45 Grad Celsius recht
Verbrennung einer Kerze
 Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
LB1 Stoffe. LB1 Stoffe. LB1 Stoffe. Womit beschäftigt sich die Chemie?
 Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Lernkartei Klasse 7 LB1: Stoffe Womit beschäftigt sich die Chemie? LB1 Stoffe mit den Stoffen, ihren Eigenschaften und ihren Veränderungen (Stoffumwandlungen) Was sind Stoffe? LB1 Stoffe Stoffe sind die
Kettenreaktionen. Kapitel 2. In diesem Kapitel sollen die folgenden Fragen beantwortet werden:
 Kapitel 2 Kettenreaktionen In diesem Kapitel sollen die folgenden Fragen beantwortet werden: Was versteht man unter einer Kettenreaktion? Welches sind die verschiedenen Typen von Reaktionsschritten, die
Kapitel 2 Kettenreaktionen In diesem Kapitel sollen die folgenden Fragen beantwortet werden: Was versteht man unter einer Kettenreaktion? Welches sind die verschiedenen Typen von Reaktionsschritten, die
Chemische Verbrennung
 Christopher Rank Sommerakademie Salem 2008 Gliederung Die chemische Definition Voraussetzungen sgeschwindigkeit Exotherme Reaktion Reaktionsenthalpie Heizwert Redoxreaktionen Bohrsches Atommodell s Elektrochemie:
Christopher Rank Sommerakademie Salem 2008 Gliederung Die chemische Definition Voraussetzungen sgeschwindigkeit Exotherme Reaktion Reaktionsenthalpie Heizwert Redoxreaktionen Bohrsches Atommodell s Elektrochemie:
Sofern sich brennbare Dämpfe auf dem Flüssigkeitsspiegel bilden können. Nur, wenn sich mehr als 1 Liter brennbare Flüssigkeit im Behälter befindet
 Brandschutz Testbogen Nr. 002 Das Sachgebiet Brand- und Explosionsschutz umfasst 2 Testbogen. Es können eine oder mehrere Antworten richtig sein! 1 Was sind die Voraussetzungen jeder Verbrennung? Brennbarer
Brandschutz Testbogen Nr. 002 Das Sachgebiet Brand- und Explosionsschutz umfasst 2 Testbogen. Es können eine oder mehrere Antworten richtig sein! 1 Was sind die Voraussetzungen jeder Verbrennung? Brennbarer
GROSSES FEUER, WENIG WASSER!!!
 ÖBFV FÜHRUNGSSEMINAR 2016 GROSSES FEUER,!! WIE GEHT DAS??? Vizepräsident Armin Blutsch Meinen Dank für die fachliche Unterstützung zu diesem Vortrag möchte ich aussprechen an: BR Ing. Markus Jauk ÖBFV-SGL
ÖBFV FÜHRUNGSSEMINAR 2016 GROSSES FEUER,!! WIE GEHT DAS??? Vizepräsident Armin Blutsch Meinen Dank für die fachliche Unterstützung zu diesem Vortrag möchte ich aussprechen an: BR Ing. Markus Jauk ÖBFV-SGL
Abwehrender Brandschutz Folien Online
 Abwehrender Brandschutz Folien Online Abwehrenden Brandschutz einfach und mühelos unterweisen 1. Auflage WEKA 2007 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 3 8111 4421 7 schnell und portofrei
Abwehrender Brandschutz Folien Online Abwehrenden Brandschutz einfach und mühelos unterweisen 1. Auflage WEKA 2007 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 3 8111 4421 7 schnell und portofrei
BRENNEN UND LÖSCHEN. Eine Verbrennung ist ein chemischer Vorgang, bei dem durch Oxidation eines brennenden Stoffes Wärme freigesetzt wird.
 BRENNEN UND LÖSCHEN 1. Definition Eine Verbrennung ist ein chemischer Vorgang, bei dem durch Oxidation eines brennenden Stoffes Wärme freigesetzt wird. 2. Vorraussetzungen für eine Verbrennung sind: Brennbarer
BRENNEN UND LÖSCHEN 1. Definition Eine Verbrennung ist ein chemischer Vorgang, bei dem durch Oxidation eines brennenden Stoffes Wärme freigesetzt wird. 2. Vorraussetzungen für eine Verbrennung sind: Brennbarer
Brandlehre. Geschichtliches
 Brandlehre Beim Großen Preis von Deutschland 1994 in Hockenheim steht der Bennetton-Ford von Jos Verstappen (rechts) in Flammen, nachdem der Tankschlauch beim Auftanken verkanntet auf- gesetzt wurde und
Brandlehre Beim Großen Preis von Deutschland 1994 in Hockenheim steht der Bennetton-Ford von Jos Verstappen (rechts) in Flammen, nachdem der Tankschlauch beim Auftanken verkanntet auf- gesetzt wurde und
Verbrennung von Eisenwolle und Holz
 Name: Datum: Versuch: Verbrennung von Eisenwolle und Holz Geräte: 1 Stativ 2 Muffen 2 Klemmen 1 Laborboy (hier Holzklotz) 1 Porzellanschale 1 Analysetrichter 1 Gaswaschflasche 1 Wasserstrahlpumpe 1 Gummischlauch
Name: Datum: Versuch: Verbrennung von Eisenwolle und Holz Geräte: 1 Stativ 2 Muffen 2 Klemmen 1 Laborboy (hier Holzklotz) 1 Porzellanschale 1 Analysetrichter 1 Gaswaschflasche 1 Wasserstrahlpumpe 1 Gummischlauch
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Brennbare Flüssigkeiten. Arbeitshilfe für die betriebliche Unterweisung. Tätigkeiten mit Gefahrstoffen I I
 Brennbare Flüssigkeiten Arbeitshilfe für die betriebliche Unterweisung Tätigkeiten mit Gefahrstoffen I I Welche Gefährdungen können von brennbaren Flüssigkeiten ausgehen? Brennbare Flüssigkeiten besitzen
Brennbare Flüssigkeiten Arbeitshilfe für die betriebliche Unterweisung Tätigkeiten mit Gefahrstoffen I I Welche Gefährdungen können von brennbaren Flüssigkeiten ausgehen? Brennbare Flüssigkeiten besitzen
Vorbeugender Brandschutz - Brandschutzaufklärung -
 Präsentation Sekundarstufe Vorbeugender Brandschutz - Brandschutzaufklärung - erstellt von Heinz Pinkowski Stand Februar 2006 Vorbeugender Brandschutz - Brandschutzaufklärung - Was jeder hierzu wissen
Präsentation Sekundarstufe Vorbeugender Brandschutz - Brandschutzaufklärung - erstellt von Heinz Pinkowski Stand Februar 2006 Vorbeugender Brandschutz - Brandschutzaufklärung - Was jeder hierzu wissen
Grundlagen der Wärmelehre
 Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Mensch und Technik. Berechnungen und Beispiele
 1 Berechnungen und Beispiele Wärmekapazität Wird einem Stoff durch Erwärmen Energie zugeführt, so steigt deren Temperatur, dies ist stoffabhängig und der Temperaturanstieg ist proportional zur Wärmemenge:
1 Berechnungen und Beispiele Wärmekapazität Wird einem Stoff durch Erwärmen Energie zugeführt, so steigt deren Temperatur, dies ist stoffabhängig und der Temperaturanstieg ist proportional zur Wärmemenge:
LUFT CHEMIE DER VERBRENNUNG (SEKP)
 1 KSO LUFT CHEMIE DER VERBRENNUNG (SEKP) Skript Luft Chemie der Verbrennung (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "LUFT CHEMIE DER VERBRENNUNG" 1. Einleitung...03 2. Reaktionspartner Luft... 03 3.
1 KSO LUFT CHEMIE DER VERBRENNUNG (SEKP) Skript Luft Chemie der Verbrennung (SekP) V1.0 04/15 Bor 2 INHALTSVERZEICHNIS "LUFT CHEMIE DER VERBRENNUNG" 1. Einleitung...03 2. Reaktionspartner Luft... 03 3.
Fragenkatalog zur Hessischen Feuerwehrleistungsübung ABC-Gefahrstoffe. Es ist nur eine Antwortmöglichkeit richtig!
 Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung ABC-Gefahrstoffe Es ist nur eine Antwortmöglichkeit richtig! 1. Wie nennt man die Aufnahme von Gefahrstoffen in den
Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung ABC-Gefahrstoffe Es ist nur eine Antwortmöglichkeit richtig! 1. Wie nennt man die Aufnahme von Gefahrstoffen in den
Grundkenntnisse der Chemie und der Physik. Was ihr hier findet
 Grundkenntnisse der hemie und der Physik P Was ihr hier findet Wissensgebiete der hemie und der Physik Formeln Elemente Metalle Kohlenstoff Analyse Synthese Basen Laugen Salze Atome Moleküle Akustik Optik
Grundkenntnisse der hemie und der Physik P Was ihr hier findet Wissensgebiete der hemie und der Physik Formeln Elemente Metalle Kohlenstoff Analyse Synthese Basen Laugen Salze Atome Moleküle Akustik Optik
NWG2 C H E M I E. Arbeitsunterlagen. DI Dr. Daniela Seitz (SED) HBLVA f. Textilindustrie und Datenverarbeitung A-1050 Wien, Spengergasse 20
 NWG2 C H E M I E Arbeitsunterlagen DI Dr. Daniela Seitz (SED) HBLVA f. Textilindustrie und Datenverarbeitung A-1050 Wien, Spengergasse 20 Tel. 01/54615-194 e-mail: seitz@spengergasse.at Sprechstunde: jeden
NWG2 C H E M I E Arbeitsunterlagen DI Dr. Daniela Seitz (SED) HBLVA f. Textilindustrie und Datenverarbeitung A-1050 Wien, Spengergasse 20 Tel. 01/54615-194 e-mail: seitz@spengergasse.at Sprechstunde: jeden
.JÄHRLICHE BRANDSCHÄDEN UND BRANDFÄLLE IN ÖSTERREICH
 .JÄHRLICHE BRANDSCHÄDEN UND BRANDFÄLLE IN ÖSTERREICH 60 % 50 Brandschäden Brandfälle 40 30 20 10 0 Landwirtschaft Industrie Gewerbe Privatbereich Sonstige Brandschäden 18% 34% 22% 22% 4% Brandfälle 17%
.JÄHRLICHE BRANDSCHÄDEN UND BRANDFÄLLE IN ÖSTERREICH 60 % 50 Brandschäden Brandfälle 40 30 20 10 0 Landwirtschaft Industrie Gewerbe Privatbereich Sonstige Brandschäden 18% 34% 22% 22% 4% Brandfälle 17%
Oxidation ist eine Verbindung von Stoffen mit Sauerstoff
 Brennen + Löschen Ausbildungsinhalt Oxidation Erscheinungsformen der Verbrennung Die Voraussetzung einer Verbrennung Die Verbrennungsgeschwindigkeit Die Löschmethoden Die Löschmittel Oxidation Oxidation
Brennen + Löschen Ausbildungsinhalt Oxidation Erscheinungsformen der Verbrennung Die Voraussetzung einer Verbrennung Die Verbrennungsgeschwindigkeit Die Löschmethoden Die Löschmittel Oxidation Oxidation
Freiwillige Feuerwehr Hettensen. www.feuerwehr-hettensen.de. Brandlehre. Ingolf Wolter
 Ingolf Wolter Verbrennung Chemischer Vorgang, bei dem sich ein brennbarer Stoff unter Wärme- und Lichterscheinung (Feuer) mit Sauerstoff verbindet. Jede Verbindung mit Sauerstoff nennen wir auch Oxydation
Ingolf Wolter Verbrennung Chemischer Vorgang, bei dem sich ein brennbarer Stoff unter Wärme- und Lichterscheinung (Feuer) mit Sauerstoff verbindet. Jede Verbindung mit Sauerstoff nennen wir auch Oxydation
Füllstandanzeiger und Geräte für die explosionsgefährdeten Bereiche. Stäube. brennbare. mit ATEX Zulassung: II 1D oder II 1/2D oder II 1/3D
 liefert: Füllstandanzeiger und Geräte für die explosionsgefährdeten Bereiche brennbare Stäube mit ATEX Zulassung: II 1D oder II 1/2D oder II 1/3D Füllstandanzeiger und Geräte für die explosionsgefährdeten
liefert: Füllstandanzeiger und Geräte für die explosionsgefährdeten Bereiche brennbare Stäube mit ATEX Zulassung: II 1D oder II 1/2D oder II 1/3D Füllstandanzeiger und Geräte für die explosionsgefährdeten
Stellen Sie für die folgenden Reaktionen die Gleichgewichtskonstante K p auf: 1/2O 2 + 1/2H 2 OH H 2 + 1/2O 2 H 2 O
 Klausur H2004 (Grundlagen der motorischen Verbrennung) 2 Aufgabe 1.) Stellen Sie für die folgenden Reaktionen die Gleichgewichtskonstante K p auf: 1/2O 2 + 1/2H 2 OH H 2 + 1/2O 2 H 2 O Wie wirkt sich eine
Klausur H2004 (Grundlagen der motorischen Verbrennung) 2 Aufgabe 1.) Stellen Sie für die folgenden Reaktionen die Gleichgewichtskonstante K p auf: 1/2O 2 + 1/2H 2 OH H 2 + 1/2O 2 H 2 O Wie wirkt sich eine
Gasbeschaffenheit. Siegfried Bajohr. Engler-Bunte-Institut Bereich Gas, Erdöl, Kohle
 Gasbeschaffenheit Siegfried Bajohr 1 Inhalt Brenntechnische Kenndaten Brennwert H S und Heizwert H i Wobbe-Index W Anwendungsdaten Abgasvolumen Sicherheitskennwerte Zündgrenze Z 2 Brenntechnische Kenndaten
Gasbeschaffenheit Siegfried Bajohr 1 Inhalt Brenntechnische Kenndaten Brennwert H S und Heizwert H i Wobbe-Index W Anwendungsdaten Abgasvolumen Sicherheitskennwerte Zündgrenze Z 2 Brenntechnische Kenndaten
Verhalten im Brandfall
 1 Bevor die Feuerwehr eintrifft: Verhalten im Brandfall Wenn Sie einen Brand entdecken, ist ein ruhiges und besonnenes Handeln sehr wichtig um sich selbst und Andere in Sicherheit zu bringen. Angst dagegen
1 Bevor die Feuerwehr eintrifft: Verhalten im Brandfall Wenn Sie einen Brand entdecken, ist ein ruhiges und besonnenes Handeln sehr wichtig um sich selbst und Andere in Sicherheit zu bringen. Angst dagegen
Sicherheit und Umwelt Es brennt was tun?
 Es brennt was tun? Theorie zum Brandverhütungskurs Remo Huser Es brennt......was tun? 08.05.15 Es brennt - was tun?, Remo Huser Seite 3 Brandstatistik Schweiz Anzahl Brände pro Jahr Anzahl Tote pro Jahr
Es brennt was tun? Theorie zum Brandverhütungskurs Remo Huser Es brennt......was tun? 08.05.15 Es brennt - was tun?, Remo Huser Seite 3 Brandstatistik Schweiz Anzahl Brände pro Jahr Anzahl Tote pro Jahr
Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag
 2.1.1 Aufbau der Materie (Arbeitsaufträge) Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag 1. Beim Bearbeiten
2.1.1 Aufbau der Materie (Arbeitsaufträge) Empfohlene Hilfsmittel zum Lösen der Arbeitsaufträge: Arbeitsblätter, Theorieblätter, Fachbuch, Tabellenbuch und Ihr Wissen aus dem Praxisalltag 1. Beim Bearbeiten
Aus - und Fortbildung Brandbekämpfung mit Schaum
 Freiwillige Feuerwehr Freiwillige Feuerwehr Balduinstein Balduinstein Aus - und Fortbildung Brandbekämpfung mit Schaum Zielgruppe: Allgemein Zweck: Stand: Aus- und Fortbildung Juli 2008 Verfasser: Markus
Freiwillige Feuerwehr Freiwillige Feuerwehr Balduinstein Balduinstein Aus - und Fortbildung Brandbekämpfung mit Schaum Zielgruppe: Allgemein Zweck: Stand: Aus- und Fortbildung Juli 2008 Verfasser: Markus
Lösungen Thema: Stoffe und ihre Eigenschaften
 Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
Lösungen Thema: Stoffe und ihre Eigenschaften zu 1: Siedetemperatur, Schmelztemperatur, Dichte (Löslichkeit) zu 2: Brennbarkeit, Härte, Löslichkeit, Farbe, Geruch zu 3: zu 4: Bei der Flüssigkeit handelt
Brennen und Löschen 24.06.2006 1
 Brennen und Löschen 24.06.2006 1 Inhaltsverzeichnis Brennen Voraussetzungen einer Verbrennung Brandverlaufskurve Sauerstoff Mengenverhältnis Zündtemperatur Brandklassen Baustoffklassen Gefahrklassen 24.06.2006
Brennen und Löschen 24.06.2006 1 Inhaltsverzeichnis Brennen Voraussetzungen einer Verbrennung Brandverlaufskurve Sauerstoff Mengenverhältnis Zündtemperatur Brandklassen Baustoffklassen Gefahrklassen 24.06.2006
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
Die Brandbekämpfung (Gruppenversuche)
 Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Die Brandbekämpfung (Gruppenversuche) Führt die folgenden Versuche nacheinander durch. Lest die Versuchsbeschreibungen (Kopie) genau durch und klebt sie sofort in eure Haushefte ein. Notiert mit Bleistift
Basiskenntnistest - Chemie
 Basiskenntnistest - Chemie 1.) Welche Aussage trifft auf Alkohole zu? a. ) Die funktionelle Gruppe der Alkohole ist die Hydroxygruppe. b. ) Alle Alkohole sind ungiftig. c. ) Mehrwertige Alkohole werden
Basiskenntnistest - Chemie 1.) Welche Aussage trifft auf Alkohole zu? a. ) Die funktionelle Gruppe der Alkohole ist die Hydroxygruppe. b. ) Alle Alkohole sind ungiftig. c. ) Mehrwertige Alkohole werden
Kälte erzeugen. Warum ist es in hohen Luftschichten kälter als in tiefen? Verdunstungskälte. - frieren nach dem Bad - schwitzen zur Körperkühlung
 Kälte erzeugen Warum ist es in hohen Luftschichten kälter als in tiefen? Verdunstungskälte - frieren nach dem Bad - schwitzen zur Körperkühlung - Luft komprimieren -> Erwärmung - Luft dekomprimieren (
Kälte erzeugen Warum ist es in hohen Luftschichten kälter als in tiefen? Verdunstungskälte - frieren nach dem Bad - schwitzen zur Körperkühlung - Luft komprimieren -> Erwärmung - Luft dekomprimieren (
3.4 Energieumsatz bei Reaktionen
 3.4 Energieumsatz bei Reaktionen Versuch: Verbrennen eines Stückes Holz Beobachtung: Energie wird freigesetzt in Form von Wärme. Jede Reaktion ist mit einem Energieumsatz gekoppelt. Reaktionen, bei denen
3.4 Energieumsatz bei Reaktionen Versuch: Verbrennen eines Stückes Holz Beobachtung: Energie wird freigesetzt in Form von Wärme. Jede Reaktion ist mit einem Energieumsatz gekoppelt. Reaktionen, bei denen
Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung)
 Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Brennen & Löschen. Dauer: 3 Stunde. Lehrvortrag Unterrichtsgespräch. Erarbeitet: OBM B. Ratz. Stand: 04/16. - Berufsfeuerwehr Jena
 Brennen & Löschen Dauer: 3 Stunde Lehrvortrag Unterrichtsgespräch Erarbeitet: OBM B. Ratz Stand: 04/16 Berufsfeuerwehr Jena Gliederung 1. Grundlagen Verbrennung 2. Löschregeln 3. Löschmittel 3.1. Wasser
Brennen & Löschen Dauer: 3 Stunde Lehrvortrag Unterrichtsgespräch Erarbeitet: OBM B. Ratz Stand: 04/16 Berufsfeuerwehr Jena Gliederung 1. Grundlagen Verbrennung 2. Löschregeln 3. Löschmittel 3.1. Wasser
Steckbrief von Sauerstoff, O 2
 Steckbrief von Sauerstoff, O 2 farblos, d.h. unsichtbar, nur in sehr dicken Schichten himmelblau geruch- und geschmacklos - Etwas schwerer als Luft - notwendig für die Verbrennung, brennt aber nicht selbst
Steckbrief von Sauerstoff, O 2 farblos, d.h. unsichtbar, nur in sehr dicken Schichten himmelblau geruch- und geschmacklos - Etwas schwerer als Luft - notwendig für die Verbrennung, brennt aber nicht selbst
2.2 Spezifische und latente Wärmen
 1 Einleitung Physikalisches Praktikum für Anfänger - Teil 1 Gruppe 2 Wärmelehre 2.2 Spezifische und latente Wärmen Die spezifische Wärme von Wasser gibt an, wieviel Energie man zu 1 kg Wasser zuführen
1 Einleitung Physikalisches Praktikum für Anfänger - Teil 1 Gruppe 2 Wärmelehre 2.2 Spezifische und latente Wärmen Die spezifische Wärme von Wasser gibt an, wieviel Energie man zu 1 kg Wasser zuführen
Saurer Regen, was ist das?
 Saurer Regen, was ist das? 1. SO x (x=2,3) => SO 2 und SO 3 SO 2 + H 2 O H 2 SO 3 (schwefelige Säure) SO 3 + H 2 O H 2 SO 4 (Schwefelsäure) 2. NO x (x=1,2) 2 NO + H 2 O + ½O 2 2 H NO 2 (salpetrige Säure)
Saurer Regen, was ist das? 1. SO x (x=2,3) => SO 2 und SO 3 SO 2 + H 2 O H 2 SO 3 (schwefelige Säure) SO 3 + H 2 O H 2 SO 4 (Schwefelsäure) 2. NO x (x=1,2) 2 NO + H 2 O + ½O 2 2 H NO 2 (salpetrige Säure)
