weiteres Beispiel für Stereoisomere: Enantiomere Spiegelebene
|
|
|
- Kerstin Becker
- vor 6 Jahren
- Abrufe
Transkript
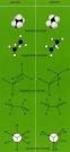
1 Stereoisomere - Isomerie I: Konstitutionsisomere (siehe oben) - Isomerie II: Konformationsisomere (Konformere, siehe oben) - Isomerie III: Stereoisomere; Stereoisomere weisen eine identische Konstitution (Art der Verknüpfung der Atome in Molekül) auf, unterscheiden sich aber in der räumlichen Anordnung der Atome Beispiel cis/trans-isomere (vgl. cis- und trans-decalin) trans-1,2-dichlorcyclobutan cis-1,2-dichlorcyclobutan weiteres Beispiel für Stereoisomere: Enantiomere I I omchloriodmethan auch omchloriodmethan Wenn Bild und Spiegelbild sich NIT zur Deckung bringen lassen, ist die Verbindung chiral und es existieren zwei Stereoisomere (namentlich Bild und Spiegelbild), die Enantiomere oder Spiegelbildisomere genannt werden. Lassen sich dagegen Bild und Spiegelbild zur Deckung bringen, ist die Verbindung achiral.
2 Befinden sich drei verschiedene Substituenten an einem tetraedrischen Kohlenstoffatom (also sind von den VIER Substituenten ZWEI gleich) besitzt das Molekül selbst eine und ist damit achiral. Dies gilt auch für mehr gleiche Substituenten., und liegen in der Ebene omchlormethan Nur wenn sich VIER verschiedene Substituenten an einem tetraedrischen Kohlenstoffatom befinden, liegt ein sogenanntes hiralitätszentrum vor. Eine Grundvoraussetzung für hiralität ist das fehlen einer und eines Symmetriezentrums im Molekül. Symmetriezentrum Spielt hiralität in der Natur eine Rolle? Viele Naturstoffe sind hiral (z.b. die Steroide, Arachidonsäure, Vitamin B 12, die Sie bereits kennen gelernt haben) und nur eines der Enantiomere (Stereoisomere) hat die gewünschte biologische Wirkung. Darum hat z.b. bei der Produktion von Arzneimitteln die erstellung enantiomerenreinen Materials eine hohe Priorität, das andere Enantiomer könnte z.b. unerwünschte Nebenwirkungen aufweisen. Entscheidend für die Erkennung eines Enantiomers
3 (sowohl im biologischen System als auch im Reagenzglas) ist eine DREIPUNKT- Wechselwirkung; nur wenn das Substrat an drei Punkte des chiralen Moleküls bindet, kann zwischen den beiden Enantiomeren unterschieden werden. z.b. Aminosäuren R 2-3 N + kennzeichnet ein hiralitätszentrum für R ungleich ; wenn R = liegt das achirale Glycin vor z.b. Milchsäure 3 2 z.b. D-Glycerinaldehyd Wie unterscheiden sich Enantiomeren? Enantiomere besitzten die gleichen skalaren physikalischen Eigenschaften (also Eigenschaften, die nur durch eine Zahl festgelegt werden, z.b. Schmelzpunkt, Siedepunkt, Dipolmoment, Moleküldurchmesser...), weisen aber unterschiedliche vektorielle physikalische Eigenschaften auf (dies läßt sich am besten anhand der Drehung der Polarisationsebene von Licht, der optischen Aktivität, zeigen).
4 normales Licht, beliebig orientiert polarisiertes Licht, orientiert polarisiertes Licht, aber die Polarisationsebene ist um den Winkel α gedreht a Lichtquelle d c b Polarisator, läßt nur Licht einer bestimmten Schwingungsrichtung durch Meßzelle mit optisch aktiver Substanz Analysator [α] λ Temp = α l. c [α] ist der spezifische Drehwert (bezogen auf eine bestimmte Temperatur und eine bestimmte Wellenlänge des Lichts) (Analysator: Ausgangsstellung wie der Polarisator. Das Licht geht durch. Wird nun die optisch aktive Verbindung eingefüllt, kommt kein Licht mehr durch den Analysator. Dieser wird nun soweit gedreht, bis er das Licht wieder durchläßt. Der Winkel, um den gedreht wird, ist der gemessene Drehwert α) Reaktionen, bei denen neue stereogene Zentren gebildet werden 2 h. ν : 1 - Gemisch, ein RAEMAT (der Begriff stammt von der Traubensäure, acidum racemicum, bei der dieses Phänomen der optischen Inaktivität trotz vorhandensein chiraler Verbindungen erstmalig beobachtet wurde)
5 Absolute Konfiguration Zur Beschreibung der räumlichen Anordnung der Substituenten am tetraedrischen Kohlenstoffatom, der absoluten Konfiguration, durch Stereodiskriptoren wurde von ahn, Ingold und Prelog das ahn-ingold-prelog-system (IP-System) entwickelt. Die IP-Regeln zum Auffinden des Stereodiskriptors (die Sequenzregeln) stellen Nomenklaturvorschriften dar. a a d b c c b d a a b c c b S R
6 Die Sequenzregeln Einteilung der Substituenten nach höchster und niedrigster Priorität. 1. öhere rdnungszahl => höhere Priorität >?? > 2. öhere Atommasse eines Isotops => höhere Priorität z.b. D > D = Deuterium 3. Bei gleicher Priorität in der Kette weitergehen, bis eine höhere Priorität aufgefunden wird. > > > Doppel- und Dreifachbindungen werden wie gesättigte Verbindungen behandelt R R R z.b. wird behandelt wie
7 Was, wenn in einer Verbindung mehrere hiralitätszentren vorliegen? 2 h. ν (Racemat) (Racemat) 2-hlor-3-brombutan (Gemisch von Stereoisomeren) (2R,3R) Enantiomere (2S,3S) Diastereomere Diastereomere Diastereomere (2R,3S) Enantiomere (2S,3R) Stereoisomere Enantiomere (Bild/Spiegelbild) Diastereomere (alle anderen Stereoisomere)
8 Bei n hiralitätszentren in einer Verbindung gibt es 2 n mögliche Stereoisomere! Ausnahme: Wenn eines der Stereoisomere eine meso-verbindung ist, reduziert sich die Zahl möglicher Stereoisomere wie man am Beispiel der Weinsäure, einer Dicarbonsäure mit zwei -Gruppen, zeigen kann: 2 2 Weinsäure (kommt in Wein und Früchten vor) Mischung aus (2S,3S) und (2R,3R) ist die Traubensäure (2S,3S) Enantiomere (2R,3R) (2S,3R) KEINE Enantiomere! Die Moleküle lassen sich zur Deckung bringen. (2S,3R) Da sich an beiden hiralitätszentren die gleichen Substituenten befinden, hat das Molekül selbst eine und es handelt sich damit um eine meso-verbindung Bei zwei hiralitätszentren mit den gleichen Substituenten gibt es also nur drei Stereoisomere
9 Genauere Betrachtung der oben bereits besprochenen Reaktionen a) Radikalische omierung von Butan Enantiomere und damit energiegleiche Übergangszustände (2S) 2 3 planares, achirales Radikal stereodifferenzierender Schritt (2R) b) Radikalische hlorierung von 2-ombutan. - Übergangszustand ÜZ Diastereomere und damit energetisch unterschiedliche Übergangszustände 2 3 (2S,3R) keine 75% chirales Radikal stereodifferenzierender Schritt (2R,3R) % Übergangszustand ÜZ2
10 Energie E ÜZ2 ÜZ1 Edukt Produkte Reaktionskoordinate RK
11 Trennung von Enantiomeren a) Spontane Kristallisation der Enantiomere (selten) b) Spaltung mit ilfe eines chiralen ilfstoffs (stöchiometrische Mengen des ilfsstoffs) 2 N Butin-2-amin racemisch, beide Enantiomere 1:1 2 (+)-Weinsäure N N diastereomere Salze kristallisiert aus und kann dann abfiltriert werden bleibt in Lösung K 2 3 K N 2 N (R)-(+)-3-Butin-2-amin (S)-(-)-3-Butin-2-amin
12 c) Katalytische Spaltung durch einen chiralen Katalysator Beispiel: Desymmetrierung einer meso-verbindung durch Schweineleberesterase (PLE) 2 3 PLE > 98.5% dieses Enantiomers < 1.5% des Spiegelbildes => Enantiomeren-Überschuß (enantiomeric excess) ee [%] = R - S R + S. 100 = 97% Beispiel: Racematspaltung durch die selektive ydrolyse nur eines Enantiomers eines Racemats Racemat PLE ee jedes der beiden Produkte (die jetzt keine Stereoisomere sondern völlig verschiedene Verbindungen darstellen) ist > 98%
13 Warum Trennt man Enantiomere? Ein vielzitiertes Musterbeispiel für die Notwendigkeit, Wirkstoffe in enantiomerenreiner Form herzustellen: N N N N (+)-Thalidomid (Schlafmittel) (-)-Thalidomid verursacht Mißbildungen ("ontergan-katastrophe")
14 Auch können verschiedene Enantiomere völlig unterschiedliche Eigenschaften besitzen, wie folgende Aromastoffe beweisen: (R)-(+)-Limonen rangenaroma (S)-(-)-Limonen Zitronenaroma (S)-(+)-arvon Minze (R)-(-)-arvon Kümmel Die obigen Aromastoffe dokumentieren eines: (+) und (-) kennzeichnen den optischen Drehsinn und sind experimentelle Größen. (R) und (S) sind nur Nomenklaturvorschriften. Es gibt keinen Zusammenhang zwischen (+)/(-) und (R)/(S), es ist nicht vorhersagbar ob z.b. das (R)-Isomer einen (+) oder einen (-)-Drehsinn aufweist.
Die absolute Konfiguration und ihre Zuordnung C H
 Die absolute Konfiguration und ihre Zuordnung estimmung der Konfiguration nach der R,S-omenklatur von ahn-ingold-prelog (IP-omenklatur) - einer omenklatur-konvention, deren Resultat keie absolute physikalische
Die absolute Konfiguration und ihre Zuordnung estimmung der Konfiguration nach der R,S-omenklatur von ahn-ingold-prelog (IP-omenklatur) - einer omenklatur-konvention, deren Resultat keie absolute physikalische
Stereochemie. mit Vitamin C. Süßstoff Aspartam (QWKlOWÃHLQHÃ3KHQ\ODODQLQTXHOOH. L(+)-Milchsäure. Zuckeraustauschstoff Sorbit
 Stereochemie mit Vitamin Süßstoff Aspartam (QWKlWÃLQÃ3KQ\DDQLQTX L(+)-Milchsäure Zuckeraustauschstoff Sorbit hemie für Mediziner Isomerie organischer Verbindungen Isomere Konstitutionsisomere Stereoisomere
Stereochemie mit Vitamin Süßstoff Aspartam (QWKlWÃLQÃ3KQ\DDQLQTX L(+)-Milchsäure Zuckeraustauschstoff Sorbit hemie für Mediziner Isomerie organischer Verbindungen Isomere Konstitutionsisomere Stereoisomere
ein Zweig der chemischen Wissenschaft, der sich mit der dreidimensionalen Struktur der Moleküle beschäftigt
 Stereochemie Stereochemie: ein Zweig der chemischen Wissenschaft, der sich mit der dreidimensionalen Struktur der Moleküle beschäftigt Stereoisomerie: unterschiedliche räumliche Anordnungen der Atome oder
Stereochemie Stereochemie: ein Zweig der chemischen Wissenschaft, der sich mit der dreidimensionalen Struktur der Moleküle beschäftigt Stereoisomerie: unterschiedliche räumliche Anordnungen der Atome oder
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 0-2, S04 T0 A02 Paul Rademacher Institut für rganische hemie der Universität Duisburg-Essen (Teil 2: 2.0.2005) MILESS: hemie für Biologen 28 Konstitutionsisomere:
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 0-2, S04 T0 A02 Paul Rademacher Institut für rganische hemie der Universität Duisburg-Essen (Teil 2: 2.0.2005) MILESS: hemie für Biologen 28 Konstitutionsisomere:
Chiralität in der Natur und synthetisch
 Chiralität in der Natur und synthetisch Universität Ulm Demonstrationskurs 09/10 Christine Ohmayer Folie 1 Beispiel Carvon Summenformel von Carvon : C 12 H 10 O Eigenschaften: farblose Flüssigkeit Geruch:
Chiralität in der Natur und synthetisch Universität Ulm Demonstrationskurs 09/10 Christine Ohmayer Folie 1 Beispiel Carvon Summenformel von Carvon : C 12 H 10 O Eigenschaften: farblose Flüssigkeit Geruch:
Organische Chemie für MST 6. Lienkamp/ Prucker/ Rühe
 Organische Chemie für MST 6 Lienkamp/ Prucker/ Rühe Valenzisomere Inhalt 6 Isomerie Konstitutionsisomere Tautomere/ Protonenisomere (= Strukturisomere) Skelett-Isomere Isomerie Isomere = Substanzen mit
Organische Chemie für MST 6 Lienkamp/ Prucker/ Rühe Valenzisomere Inhalt 6 Isomerie Konstitutionsisomere Tautomere/ Protonenisomere (= Strukturisomere) Skelett-Isomere Isomerie Isomere = Substanzen mit
Moleküle mit mehr als einem Chiralitätselement
 Moleküle mit mehr als einem hiralitätselement Natürlich kommt es häufig vor, dass Moleküle mehr als ein hiralitätselement enthalten. ierbei ist eine neue Art der Isomerie zu finden. Im Folgenden sind zunächst
Moleküle mit mehr als einem hiralitätselement Natürlich kommt es häufig vor, dass Moleküle mehr als ein hiralitätselement enthalten. ierbei ist eine neue Art der Isomerie zu finden. Im Folgenden sind zunächst
Isomerie organischer Verbindungen
 15 Isomerie organischer Verbindungen Organische Verbindungen können, bei gleicher Summenformel, sehr unterschiedliche Strukturen besitzen. Moleküle mit gleicher Summenformel aber unterschiedlicher Struktur
15 Isomerie organischer Verbindungen Organische Verbindungen können, bei gleicher Summenformel, sehr unterschiedliche Strukturen besitzen. Moleküle mit gleicher Summenformel aber unterschiedlicher Struktur
Spezielle Methoden der pharmazeutischen Chemie 2
 Spezielle thoden der pharmazeutischen Chemie 2 Asymmetrische Synthese (für Diplomanden und Dissertanten im Fach Pharmazeutischen Chemie/Synthese) Kapiteleinteilung: 1. Symmetrie, Asymmetrie, Chiralität
Spezielle thoden der pharmazeutischen Chemie 2 Asymmetrische Synthese (für Diplomanden und Dissertanten im Fach Pharmazeutischen Chemie/Synthese) Kapiteleinteilung: 1. Symmetrie, Asymmetrie, Chiralität
Vokabular zur Stereochemie
 Vokabular zur tereochemie Zwei Moleküle mit gleicher ummenformel sind: deckungsgleich = identisch Isomere Konstitutionsisomere tereoisomere Enantiomere Diastereomere Konstitutionsisomere: Moleküle mit
Vokabular zur tereochemie Zwei Moleküle mit gleicher ummenformel sind: deckungsgleich = identisch Isomere Konstitutionsisomere tereoisomere Enantiomere Diastereomere Konstitutionsisomere: Moleküle mit
Spektroskopie. im IR- und UV/VIS-Bereich. Optische Rotationsdispersion (ORD) und Circulardichroismus (CD) http://www.analytik.ethz.
 Spektroskopie im IR- und UV/VIS-Bereich Optische Rotationsdispersion (ORD) und Circulardichroismus (CD) Dr. Thomas Schmid HCI D323 schmid@org.chem.ethz.ch http://www.analytik.ethz.ch Enantiomere sind Stereoisomere,
Spektroskopie im IR- und UV/VIS-Bereich Optische Rotationsdispersion (ORD) und Circulardichroismus (CD) Dr. Thomas Schmid HCI D323 schmid@org.chem.ethz.ch http://www.analytik.ethz.ch Enantiomere sind Stereoisomere,
NMR-Methoden zur chiralen Erkennung
 Spektroskopie in der rganischen hemie NMR-Methoden zur chiralen Erkennung Mit Ausnahme der D-Spektroskopie (D = irculardichroismus) sind alle spektroskopischen Methoden auch die NMR achiral, d.h. sie können
Spektroskopie in der rganischen hemie NMR-Methoden zur chiralen Erkennung Mit Ausnahme der D-Spektroskopie (D = irculardichroismus) sind alle spektroskopischen Methoden auch die NMR achiral, d.h. sie können
Chiralitätszentrum X X
 hiralitätszentrum Die weitaus meisten chiralen Verbindungen ist deswegen chiral, weil sie sog. asymmetrische Kohlenstoffatome enthalten. Dies sind tetraedrisch konfigurierte -Atome mit vier verschiedenen
hiralitätszentrum Die weitaus meisten chiralen Verbindungen ist deswegen chiral, weil sie sog. asymmetrische Kohlenstoffatome enthalten. Dies sind tetraedrisch konfigurierte -Atome mit vier verschiedenen
Optische Aktivität und Spiegelbildisomerie
 Optische Aktivität und Spiegelbildisomerie Die optische Aktivität gibt Aufschluß über die chemische Struktur Zusammenfassung Dieses Script ist eine Einführung in die Spiegelbildisomerie von Molekülen.
Optische Aktivität und Spiegelbildisomerie Die optische Aktivität gibt Aufschluß über die chemische Struktur Zusammenfassung Dieses Script ist eine Einführung in die Spiegelbildisomerie von Molekülen.
Nachweis und Trennung von Stereoisomeren
 Nachweis und Trennung von Stereoisomeren Analyse von Stereoisomeren Problem: Unbekannte Verbindung Aufklärung der Struktur Diastereomere: Enantiomere: unterschiedliche physikalische und chemische Eigenschaften
Nachweis und Trennung von Stereoisomeren Analyse von Stereoisomeren Problem: Unbekannte Verbindung Aufklärung der Struktur Diastereomere: Enantiomere: unterschiedliche physikalische und chemische Eigenschaften
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Arbeitsheft Isomerie Inhalt Jakob 1 Inhaltsverzeichnis: Seite: Vorkenntnisse: 1 Grundlagen. Atombindung, Nichtmetalle, Valenzelektronen, Bindende und
 Arbeitsheft Isomerie Inhalt Jakob 1 Inhaltsverzeichnis: Seite: Vorkenntnisse: 1 Grundlagen Atombindung, Nichtmetalle, Valenzelektronen, Bindende und 1.1 Verkürzte Schreibweisen 2 Freie Elektronenpaare,
Arbeitsheft Isomerie Inhalt Jakob 1 Inhaltsverzeichnis: Seite: Vorkenntnisse: 1 Grundlagen Atombindung, Nichtmetalle, Valenzelektronen, Bindende und 1.1 Verkürzte Schreibweisen 2 Freie Elektronenpaare,
Konfigurationsisomerie (Stereoisomerie)
 Konfigurationsisomerie (Stereoisomerie) Komplexe, die dieselbe chemische Zusammensetzung (gleiche Summenformel) und Ladung, aber einen verschiedenen räumliche Anordnung (Konfiguration) der Atome haben,
Konfigurationsisomerie (Stereoisomerie) Komplexe, die dieselbe chemische Zusammensetzung (gleiche Summenformel) und Ladung, aber einen verschiedenen räumliche Anordnung (Konfiguration) der Atome haben,
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1
 Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Stereochemie. Allgemeines. Einteilung. Darstellung. Analytik. Was ist Chiralität Welche Relevanz hat sie
 Stereochemie Allgemeines Was ist Chiralität Welche elevanz hat sie Einteilung Zentrale Chiralität Axiale Chiralität elicale Chiralität Darstellung Fischer-Projektion CIP-Konvention Analytik Instrumentelle
Stereochemie Allgemeines Was ist Chiralität Welche elevanz hat sie Einteilung Zentrale Chiralität Axiale Chiralität elicale Chiralität Darstellung Fischer-Projektion CIP-Konvention Analytik Instrumentelle
3. Mit der Chiralität verwandte geometrische Moleküleigenschaften
 . Mit der hiralität verwandte geometrische Moleküleigenschaften In diesem Kapitel werden drei mit dem Konzept der hiralität verwandte Phänomene behandelt. In beiden Fällen handelt es sich um achirale Verbindungen,
. Mit der hiralität verwandte geometrische Moleküleigenschaften In diesem Kapitel werden drei mit dem Konzept der hiralität verwandte Phänomene behandelt. In beiden Fällen handelt es sich um achirale Verbindungen,
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Chemie der Kohlenhydrate
 Chemie der Kohlenhydrate Grundlegendes Der Begriff Kohlenhydrate: Wurde ursprünglich aus der Formel für Glukose abgeleitet. C 6 H 12 O 6 = C 6 (H 2 O) 6 Bzw. allgemein: C n (H 2 O) m Diese missleitende
Chemie der Kohlenhydrate Grundlegendes Der Begriff Kohlenhydrate: Wurde ursprünglich aus der Formel für Glukose abgeleitet. C 6 H 12 O 6 = C 6 (H 2 O) 6 Bzw. allgemein: C n (H 2 O) m Diese missleitende
Chemie für Studierende der Human- und Zahnmedizin WS 2013/14
 Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 4: Isomerie, Gibbs-Helmholtz-Gleichung, Katalysator, Addition an Alkene, funktionelle Gruppen, Säure/Base 1) Ordnen Sie die folgenden
Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 4: Isomerie, Gibbs-Helmholtz-Gleichung, Katalysator, Addition an Alkene, funktionelle Gruppen, Säure/Base 1) Ordnen Sie die folgenden
Auswahlverfahren Medizin Prüfungsgebiet Chemie. 6.Termin Organische Chemie Naturstoffe
 Auswahlverfahren Medizin Prüfungsgebiet Chemie 6.Termin Organische Chemie Naturstoffe Kursleiter Mag. Wolfgang Mittergradnegger IFS Kurs 2009 Organische Chemie Naturstoffe Fette Kohlenhydrate Proteine
Auswahlverfahren Medizin Prüfungsgebiet Chemie 6.Termin Organische Chemie Naturstoffe Kursleiter Mag. Wolfgang Mittergradnegger IFS Kurs 2009 Organische Chemie Naturstoffe Fette Kohlenhydrate Proteine
10. MODELLE VON MOLEKÜLEN
 73 10. MODELLE VON MOLEKÜLEN Durch die Kenntnis der dreidimensionalen Gestalt der Moleküle lassen sich ihre biologischen Funktionen und der oft überraschend große Einfluss kleiner Veränderungen der Struktur
73 10. MODELLE VON MOLEKÜLEN Durch die Kenntnis der dreidimensionalen Gestalt der Moleküle lassen sich ihre biologischen Funktionen und der oft überraschend große Einfluss kleiner Veränderungen der Struktur
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt
 Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 1. Nachschreibklausur zum 2. Praktikumsteil (OC) vom 07.07.09
Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 1. Nachschreibklausur zum 2. Praktikumsteil (OC) vom 07.07.09
OC 3 - Stereochemie. Allgemeine Hintergründe
 OC 3 - Stereochemie Allgemeine Hintergründe Einführung Folie Nr. 2 3-dimensionale Anordnung (relativ/absolut) in der realen Welt sind extrem wichtig Bild rechts: http://de.wikipedia.org/wiki/pfefferminz,
OC 3 - Stereochemie Allgemeine Hintergründe Einführung Folie Nr. 2 3-dimensionale Anordnung (relativ/absolut) in der realen Welt sind extrem wichtig Bild rechts: http://de.wikipedia.org/wiki/pfefferminz,
Stoffklassen in der Organischen Chemie. Nomenklaturfragen. Isomerie und sterischer Bau
 Stoffklassen in der Organischen Chemie Nomenklaturfragen Isomerie und sterischer Bau 1 Stoffklassen in der organischen Chemie Kohlenwasserstoffe Kohlenwasserstoffe mit Substituenten Y (eteroatom oder funktionelle
Stoffklassen in der Organischen Chemie Nomenklaturfragen Isomerie und sterischer Bau 1 Stoffklassen in der organischen Chemie Kohlenwasserstoffe Kohlenwasserstoffe mit Substituenten Y (eteroatom oder funktionelle
a) Vervollständigen Sie das Freie-Enthalpie-Diagramm der Reaktion, indem Sie den zutreffenden Buchstaben A D in die leeren Kreise setzen:
 1. Aufgabe Für die Reaktion R-X + u R-u + X findet man folgendes Reaktionsdiagramm: a) Vervollständigen Sie das Freie-Enthalpie-Diagramm der Reaktion, indem Sie den zutreffenden Buchstaben A D in die leeren
1. Aufgabe Für die Reaktion R-X + u R-u + X findet man folgendes Reaktionsdiagramm: a) Vervollständigen Sie das Freie-Enthalpie-Diagramm der Reaktion, indem Sie den zutreffenden Buchstaben A D in die leeren
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
CCl 3. 1,1,1-Trichlor-2,2-di(4-chlorphenyl)ethan Dichlordiphenyltrichlorethan
 V. alogenalkane 2 l 2, l 3, l 4 : wichtige Lösungsmittel l l 1,2-Dichlorethan Insektizid DDT l l 2 1 l 3 1,1,1-Trichlor-2,2-di(4-chlorphenyl)ethan Dichlordiphenyltrichlorethan - Insektizid (P. Müller,
V. alogenalkane 2 l 2, l 3, l 4 : wichtige Lösungsmittel l l 1,2-Dichlorethan Insektizid DDT l l 2 1 l 3 1,1,1-Trichlor-2,2-di(4-chlorphenyl)ethan Dichlordiphenyltrichlorethan - Insektizid (P. Müller,
Molekülsymmetrie und Kristallographie. Chiralität
 hiralität Die hiralität ist eines der wichtigsten Grundprinzipien der Natur überhaupt. Sie bezeichnet die Tatsache, dass es Gegenstände gibt, die sich zueinander wie Bild und Spiegelbild verhalten, sich
hiralität Die hiralität ist eines der wichtigsten Grundprinzipien der Natur überhaupt. Sie bezeichnet die Tatsache, dass es Gegenstände gibt, die sich zueinander wie Bild und Spiegelbild verhalten, sich
Versuchsprotokoll: Mutarotation von Glucose
 Versuchsprotokoll: Mutarotation von Glucose Zeitaufwand: Aufbau: 10 Minuten Durchführung: 24 Stunden Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Glucose
Versuchsprotokoll: Mutarotation von Glucose Zeitaufwand: Aufbau: 10 Minuten Durchführung: 24 Stunden Entsorgung: 5 Minuten Chemikalien: Chemikalie Menge R-Sätze S-Sätze Gefahrensymbol Schuleinsatz Glucose
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
N H H. Carbanionen Lewis-Basen Olefine (Alkane) Die Stärke der Nucleophilie wird von versch. Faktoren beeinflußt z.b.
 Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
13.12.2014. Chemie für Mediziner. Kapitel 9: Aufbau und Struktur organischer Verbindungen. Kapitel 9: Aufbau und Struktur organischer Verbindungen
 . 13.12.2014 Chemie für Mediziner Jun.-Prof. Dr. Michael Giese Raum S07 S04 C25 michael.giese@uni-due.de 9.1 Was ist Organische Chemie? 9.2 Das besondere am Kohlenstoff 9.3 Bindungsverhältnisse in organischen
. 13.12.2014 Chemie für Mediziner Jun.-Prof. Dr. Michael Giese Raum S07 S04 C25 michael.giese@uni-due.de 9.1 Was ist Organische Chemie? 9.2 Das besondere am Kohlenstoff 9.3 Bindungsverhältnisse in organischen
Stereochemie organischer Verbindungen
 Stereochemie organischer Verbindungen Stereochemische Prinzipien 1.1 Symmetrie, Symmetrieoperationen, Punktgruppen Der Begriff Stereochemie (griech: stereos = Feststoff) bezieht sich auf die Betrachtung
Stereochemie organischer Verbindungen Stereochemische Prinzipien 1.1 Symmetrie, Symmetrieoperationen, Punktgruppen Der Begriff Stereochemie (griech: stereos = Feststoff) bezieht sich auf die Betrachtung
Grundlagen der Chemie für Studierende der Humanmedizin und der Zahnheilkunde Wiederholungsklausur
 ame: Vorname: Geburtsort: Geburtsdatum: Matrikelnummer: Studiengruppe: Grundlagen der hemie für Studierende der umanmedizin und der Zahnheilkunde Wiederholungsklausur BITTE DEUTLI SREIBE ilfsmittel: Taschenrechner,
ame: Vorname: Geburtsort: Geburtsdatum: Matrikelnummer: Studiengruppe: Grundlagen der hemie für Studierende der umanmedizin und der Zahnheilkunde Wiederholungsklausur BITTE DEUTLI SREIBE ilfsmittel: Taschenrechner,
H 3 C. alphabetische Reihenfolge! kleinerer Ring wird zum Rest
 ycloalkane Kohlenwasserstoffe, die einfach geundene -Atome in ringförmiger Anordnung enthalten, werden als ycloalkane, cyclische Alkane oder arocyclen ezeichnet. Die Mehrzahl aller organischer Verindungen
ycloalkane Kohlenwasserstoffe, die einfach geundene -Atome in ringförmiger Anordnung enthalten, werden als ycloalkane, cyclische Alkane oder arocyclen ezeichnet. Die Mehrzahl aller organischer Verindungen
Studiengang Bsc Biowissenschaften. Modul-begleitende Prüfung. Organische Chemie
 Studiengang Bsc Biowissenschaften Modul-begleitende Prüfung Organische Chemie 26.07.2016 Name: Vorname: Matrikelnummer: Geboren am: in: Wiederholer/in dieser Klausur: Ja Nein Dauer der Klausur: 90 Minuten
Studiengang Bsc Biowissenschaften Modul-begleitende Prüfung Organische Chemie 26.07.2016 Name: Vorname: Matrikelnummer: Geboren am: in: Wiederholer/in dieser Klausur: Ja Nein Dauer der Klausur: 90 Minuten
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
1 Einleitung 1 2 Ziel der Arbeit 5 3 Allgemeiner theoretischer Teil 11
 I 1 Einleitung 1 2 Ziel der Arbeit 5 3 Allgemeiner theoretischer Teil 11 3.1 Optische Aktivität und chiroptische Analyse 11 3.1.1 Optische Aktivität 11 3.1.2 Enantiomere 12 3.1.3 Chirale und achirale Moleküle
I 1 Einleitung 1 2 Ziel der Arbeit 5 3 Allgemeiner theoretischer Teil 11 3.1 Optische Aktivität und chiroptische Analyse 11 3.1.1 Optische Aktivität 11 3.1.2 Enantiomere 12 3.1.3 Chirale und achirale Moleküle
Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig
 26 sisomerie (Stereoisomerie I) Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig Isomerie II: sisomere: sisomere (bzw. Konformere) sind Isomere, die sich durch
26 sisomerie (Stereoisomerie I) Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig Isomerie II: sisomere: sisomere (bzw. Konformere) sind Isomere, die sich durch
Organische Chemie. Einstieg. Chemie-Formeldarstellungen. Formeldarstellungen der Chemie: Bei Ionenverbindungen: Verhältnisformeln. , AlF 3. etc.
 Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
4-Butyl-2,5-dimethylheptan 5-Ethyl-4,8-dimethylundecan
 Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Seminar zum Praktikum Anorganische Chemie III III
 Seminar zum Praktikum Anorganische Chemie III III Metallorganische Chemie Dr. J. Wachter IR-Teil3 www.chemie.uni-regensburg.de/anorganische_chemie/scheer/lehre.html www.chemie.uniregensburg.de/anorganische_chemie/wachter/lehre.html
Seminar zum Praktikum Anorganische Chemie III III Metallorganische Chemie Dr. J. Wachter IR-Teil3 www.chemie.uni-regensburg.de/anorganische_chemie/scheer/lehre.html www.chemie.uniregensburg.de/anorganische_chemie/wachter/lehre.html
Polarimetrie - Deutschlands nationales Metrologieinstitut
 Polarimetrie - Deutschlands nationales Metrologieinstitut - 1 - Anwendungen der Polarimetrie In vielen Bereichen wird Polarimetrie eingesetzt, um optisch aktive Substanzen nachzuweisen und deren Konzentration
Polarimetrie - Deutschlands nationales Metrologieinstitut - 1 - Anwendungen der Polarimetrie In vielen Bereichen wird Polarimetrie eingesetzt, um optisch aktive Substanzen nachzuweisen und deren Konzentration
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2016
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Nachtrag Aromatische Substitution Sicherheitsbelehrung: Regeln für das Arbeiten im Labor Prof. r. Rasmus Linser September 2016
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Nachtrag Aromatische Substitution Sicherheitsbelehrung: Regeln für das Arbeiten im Labor Prof. r. Rasmus Linser September 2016
New approaches in asymmetric rhodium-catalyzed hydrogenations with monodentate phosphoramidites Hoen, Robert
 ew approaches in asymmetric rhodium-catalyzed hydrogenations with monodentate phosphoramidites Hoen, Robert IMPRTAT TE: You are advised to consult the publisher's version (publisher's PDF) if you wish
ew approaches in asymmetric rhodium-catalyzed hydrogenations with monodentate phosphoramidites Hoen, Robert IMPRTAT TE: You are advised to consult the publisher's version (publisher's PDF) if you wish
c: Geschwindigkeit im Medium Die optische Aktivität einer Substanz führt zu einer unterschiedlichen Brechung von rechts ) und links ( R
 4 Chiroptische Eigenschaften chiraler Verbindungen 4.1 Allgemeines Wenn ein ichtstrahl in ein anderes Medium eintritt, ändert sich seine Ausbreitungsgeschwindigkeit. Man spricht von ichtbrechung. Der Brechungsindex
4 Chiroptische Eigenschaften chiraler Verbindungen 4.1 Allgemeines Wenn ein ichtstrahl in ein anderes Medium eintritt, ändert sich seine Ausbreitungsgeschwindigkeit. Man spricht von ichtbrechung. Der Brechungsindex
Vorlesung 5. Alkane. Experimentalchemie, Prof. H. Mayr 20 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. Anzahl C-Atome im n-alkan
 Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zu Übung 22
 rganische hemie I Lösungen zu Übung 22 1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan
rganische hemie I Lösungen zu Übung 22 1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Chromatographische Racemattrennung neuer topologisch chiraler Isomere und Cycloenantiomere
 Chromatographische Racemattrennung neuer topologisch chiraler Isomere und Cycloenantiomere Dissertation zur Erlangung des Doktorgrades (Dr. rer. nat.) der Mathematisch-aturwissenschaftlichen Fakultät der
Chromatographische Racemattrennung neuer topologisch chiraler Isomere und Cycloenantiomere Dissertation zur Erlangung des Doktorgrades (Dr. rer. nat.) der Mathematisch-aturwissenschaftlichen Fakultät der
Ausflüge zu regio- und stereoselektiven Reaktionen an Naturstoffen
 Ausflüge zu regio- und stereoselektiven Reaktionen an Naturstoffen 26.03.2013 René Csuk Einleitung Naturstoffe: hohe molekulare Komplexizität mehrere/viele stereogene Zentren Zentren ähnlicher Reaktivität
Ausflüge zu regio- und stereoselektiven Reaktionen an Naturstoffen 26.03.2013 René Csuk Einleitung Naturstoffe: hohe molekulare Komplexizität mehrere/viele stereogene Zentren Zentren ähnlicher Reaktivität
Kurzklausur zum OC-Praktikum für Studierende der Biologie, 3. Sem. M U S T E R L Ö S U N G
 Universität Regensburg Institut für rganische hemie Prof. Dr. A. Geyer Kurzklausur zum -Praktikum für Studierende der Biologie, 3. Sem. am Samstag, dem 15. Dezember 001, 9 11 Uhr in den örsä1en 43/44 ame:...
Universität Regensburg Institut für rganische hemie Prof. Dr. A. Geyer Kurzklausur zum -Praktikum für Studierende der Biologie, 3. Sem. am Samstag, dem 15. Dezember 001, 9 11 Uhr in den örsä1en 43/44 ame:...
4 Chemische Gleichungen...3. 4.1.1 Anzahl der Atome...3. 4.1.2 Ladung...3. 4.1.3 Masse...4. 4.2 Redox-Formalismus...4. 4.3 Oxidationsstufe...
 4 Chemische Gleichungen...3 4.1 Erhaltung von Masse, Teilchen, Teilchenart, Ladung...3 4.1.1 Anzahl der Atome...3 4.1.2 Ladung...3 4.1.3 Masse...4 4.2 Redox-Formalismus...4 4.3 Oxidationsstufe...5 4.4
4 Chemische Gleichungen...3 4.1 Erhaltung von Masse, Teilchen, Teilchenart, Ladung...3 4.1.1 Anzahl der Atome...3 4.1.2 Ladung...3 4.1.3 Masse...4 4.2 Redox-Formalismus...4 4.3 Oxidationsstufe...5 4.4
Prüfungsfragenkatalog für Apparative Methoden der Strukturaufklärung (Prof. Kunert Olaf, Prof. Weis Robert)
 Prüfungsfragenkatalog für Apparative Methoden der Strukturaufklärung (Prof. Kunert laf, Prof. Weis Robert) Stand: Juni 2015 Termin: 30.06.2015 Gruppe A 2. Teilprüfung 1,5 STunden Zeit, ca. 75 erreichbare
Prüfungsfragenkatalog für Apparative Methoden der Strukturaufklärung (Prof. Kunert laf, Prof. Weis Robert) Stand: Juni 2015 Termin: 30.06.2015 Gruppe A 2. Teilprüfung 1,5 STunden Zeit, ca. 75 erreichbare
Theoretische Grundlagen Physikalisches Praktikum. Versuch 12: Fotometrie und Polarimetrie
 Theoretische Grundlagen Physikalisches Praktikum Versuch 12: Fotometrie und Polarimetrie Licht als elektromagnetische Welle sichtbares Licht ist eine elektromagnetische Welle andere elektromagnetische
Theoretische Grundlagen Physikalisches Praktikum Versuch 12: Fotometrie und Polarimetrie Licht als elektromagnetische Welle sichtbares Licht ist eine elektromagnetische Welle andere elektromagnetische
3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen.
 Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene
Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene
Chiralität und langreichweitige chirale Erkennung
 Hauptseminar Physik SS 08 Chiralität und langreichweitige chirale Erkennung von Simon Gordon 10.07.2008 [1] MPG [2] ÖZBP Inhalt Einleitung Grundlagen Cysteinmoleküle auf einer Goldoberfläche Zusammenfassung
Hauptseminar Physik SS 08 Chiralität und langreichweitige chirale Erkennung von Simon Gordon 10.07.2008 [1] MPG [2] ÖZBP Inhalt Einleitung Grundlagen Cysteinmoleküle auf einer Goldoberfläche Zusammenfassung
STEREOCHEMIE. Eine kurze Einführung für die AHS (Unterricht, WPG, Olympiade)
 STERECEMIE Eine kurze Einführung für die AS (Unterricht, WPG, lympiade) Manfred Kerschbaumer, 2006 Inhaltsverzeichnis A. Einleitung B. Die Struktur von Teilchen 1. Arten von Teilchen 2. Konstitution -
STERECEMIE Eine kurze Einführung für die AS (Unterricht, WPG, lympiade) Manfred Kerschbaumer, 2006 Inhaltsverzeichnis A. Einleitung B. Die Struktur von Teilchen 1. Arten von Teilchen 2. Konstitution -
1. Klausur zur Vorlesung. Einführung in die organische Chemie WS 03/04 11.12.2003
 1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
Wiederholungs-Klausur zur Vorlesung OC1 "Organischen Chemie 1" SS 2013 am
 Wiederholungs-Klausur zur Vorlesung OC1 "Organischen Chemie 1" SS 2013 am 11.10.2013 A Name...MUSTERLÖSUNG... Vorname... Matrikel-Nr... Studiengang... Viel Erfolg! Bitte schreiben Sie Ihren Namen in BLOCKSCHRIFT
Wiederholungs-Klausur zur Vorlesung OC1 "Organischen Chemie 1" SS 2013 am 11.10.2013 A Name...MUSTERLÖSUNG... Vorname... Matrikel-Nr... Studiengang... Viel Erfolg! Bitte schreiben Sie Ihren Namen in BLOCKSCHRIFT
Klausur Grundvorlesung Testat vom Seite 1 von 1 Punkte
 Klausur Grundvorlesung Testat vom 16.6.2004 Seite 1 von 1 Punkte Matrikelnummer: Name: Vorname: Bitte eintragen Fachsemester: Fachrichtung: Bitte ankreuzen: Chemie Biologie Biotechnologie Pharmazie Bitte
Klausur Grundvorlesung Testat vom 16.6.2004 Seite 1 von 1 Punkte Matrikelnummer: Name: Vorname: Bitte eintragen Fachsemester: Fachrichtung: Bitte ankreuzen: Chemie Biologie Biotechnologie Pharmazie Bitte
2. Bestimmen Sie die Geschwindigkeitskonstante k der Rohrzuckerinversion in s -1.
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 33 Spezifische Drehung von gelöstem Rohrzucker - Rohrzuckerinversion Aufgabe: 1. Bestimmen Sie den Drehwinkel α für Rohrzucker für
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 33 Spezifische Drehung von gelöstem Rohrzucker - Rohrzuckerinversion Aufgabe: 1. Bestimmen Sie den Drehwinkel α für Rohrzucker für
Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik
 Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik 34 Geben Sie die systematischen Namen jeder der folgenden Verbindungen an: Welche der Verbindungen aus Übung besitzen E- und
Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik 34 Geben Sie die systematischen Namen jeder der folgenden Verbindungen an: Welche der Verbindungen aus Übung besitzen E- und
Praktikum Chemie für Biologen SS Kurse SS
 1 Praktikum Chemie für Biologen SS 2001 - Kurse SS Klausur in Organischer Chemie (KlOC) Sa 28.07.2001 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
1 Praktikum Chemie für Biologen SS 2001 - Kurse SS Klausur in Organischer Chemie (KlOC) Sa 28.07.2001 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
2. Wiederholungsklausur Chemie für Studierende der Humanmedizin Teil 1 - Blatt Name: Vorname: SG: Matrikel-Nr.
 2. Wiederholungsklausur Chemie für Studierende der umanmedizin Teil 1 - Blatt 1 07. 10. 2004 Bitte beachten Sie: Außer Ihrem Schreibgerät sind keine weiteren ilfsmittel, wie z.b. Tafelwerk, Taschenrechner
2. Wiederholungsklausur Chemie für Studierende der umanmedizin Teil 1 - Blatt 1 07. 10. 2004 Bitte beachten Sie: Außer Ihrem Schreibgerät sind keine weiteren ilfsmittel, wie z.b. Tafelwerk, Taschenrechner
Physikalisches Praktikum O 1 Polarisation und optische Aktivität
 Versuchsziel Physikalisches Praktikum O 1 Polarisation und optische Aktivität Es soll das Malussche Gesetz überprüft und Wellenlängenabhängigkeit des spezifischen Drehvermögens einer Zuckerlösung untersucht
Versuchsziel Physikalisches Praktikum O 1 Polarisation und optische Aktivität Es soll das Malussche Gesetz überprüft und Wellenlängenabhängigkeit des spezifischen Drehvermögens einer Zuckerlösung untersucht
Polarisationsapparat
 1 Polarisationsapparat Licht ist eine transversale elektromagnetische Welle, d.h. es verändert die Länge der Vektoren des elektrischen und magnetischen Feldes. Das elektrische und magnetische Feld ist
1 Polarisationsapparat Licht ist eine transversale elektromagnetische Welle, d.h. es verändert die Länge der Vektoren des elektrischen und magnetischen Feldes. Das elektrische und magnetische Feld ist
Der Natur auf der Spur Möglichkeiten und Grenzen der Organokatalyse Lutz Ackermann
 3 rganokatalyse Der atur auf der Spur Möglichkeiten und Grenzen der rganokatalyse Lutz Ackermann Asymmetrische Katalyse 3.1 Einleitung B A Y A B Y A B A Y B Beispiel: thylphenidat (Ritalin ) 3 C 2 C (R,R):
3 rganokatalyse Der atur auf der Spur Möglichkeiten und Grenzen der rganokatalyse Lutz Ackermann Asymmetrische Katalyse 3.1 Einleitung B A Y A B Y A B A Y B Beispiel: thylphenidat (Ritalin ) 3 C 2 C (R,R):
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe
 1 Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe Warm Up 1) Erweitern Sie die Ihnen bekannten Regeln der Nomenklatur für Alkene und benennen danach folgende Verbindungen. Die Regel zur
1 Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe Warm Up 1) Erweitern Sie die Ihnen bekannten Regeln der Nomenklatur für Alkene und benennen danach folgende Verbindungen. Die Regel zur
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006
 Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen
 2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
a) Zeichnen Sie den Mechanismus für die säure-katalysierte Esterhydrolyse des unten gezeigten Carbonsäureesters.
 1. Aufgabe a) Zeichnen Sie den Mechanismus für die säure-katalysierte Esterhydrolyse des unten gezeigten Carbonsäureesters. 2 -shift - 2 P wenn nur die Produkte richtig sind: + b) Ein wichtiger Essigsäureester
1. Aufgabe a) Zeichnen Sie den Mechanismus für die säure-katalysierte Esterhydrolyse des unten gezeigten Carbonsäureesters. 2 -shift - 2 P wenn nur die Produkte richtig sind: + b) Ein wichtiger Essigsäureester
12 Naturstoffe. 1 Elemente Chemie Oberstufe NRW Ernst Klett Verlag GmbH, Stuttgart Lösungen zu den Durchblick-Seiten
 Lösungen zu den Durchblick-Seiten 12.27 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 a) Fette dienen im Körper als Speicherstoff ( Brennstoff ), Wärmeisolator, Stoßdämpfer, Baustoff und Stoffwechselbaustein.
Lösungen zu den Durchblick-Seiten 12.27 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 a) Fette dienen im Körper als Speicherstoff ( Brennstoff ), Wärmeisolator, Stoßdämpfer, Baustoff und Stoffwechselbaustein.
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015
 Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
ChO/OCI/ /A. Griesbeck. Chiralität optische Aktivität Stereoisomerie Enantiomere & Diastereomere Symmetrie Symmetrieelemente
 Ch/CI/25.5.07/A. Griesbeck Chiralität optische Aktivität Stereoisomerie Enantiomere & Diastereomere Symmetrie Symmetrieelemente Chiralität ptische Aktivität 3- und 2-dimensionale Chiralität echte Hand
Ch/CI/25.5.07/A. Griesbeck Chiralität optische Aktivität Stereoisomerie Enantiomere & Diastereomere Symmetrie Symmetrieelemente Chiralität ptische Aktivität 3- und 2-dimensionale Chiralität echte Hand
Enantiomerenanalytik und CE
 Quelle: www. quarks. de!geschichte!nomenklatur!eigenschaften von chiralen Arzneistoffen! enantiomeric excess!beispiele von chiralen Arzneistoffen!Anforderung an die Enantiomerenanalytik!Trennung durch
Quelle: www. quarks. de!geschichte!nomenklatur!eigenschaften von chiralen Arzneistoffen! enantiomeric excess!beispiele von chiralen Arzneistoffen!Anforderung an die Enantiomerenanalytik!Trennung durch
Die kleinsten Zuckermoleküle. Zucker zeigen gemeinsame funktionelle Gruppen
 Ein Kapitel Zuckerchemie Die Strukturen der Zucker Das Geheimnis aller Zucker ist: Stoffe mit mindestens 2 Hydroxygruppen (-OH) schmecken süß. Glykol (=Ethandiol) oder Glycerin (=Propantriol) schmecken
Ein Kapitel Zuckerchemie Die Strukturen der Zucker Das Geheimnis aller Zucker ist: Stoffe mit mindestens 2 Hydroxygruppen (-OH) schmecken süß. Glykol (=Ethandiol) oder Glycerin (=Propantriol) schmecken
Rohrzuckerinversion. Reaktionsgeschwindigkeitskonstante und Aktivierungsengergie -Kinetik-
 - 1 - V 6 Rohrzuckerinversion Reaktionsgeschwindigkeitskonstante und Aktivierungsengergie -Kinetik- - 2 - VERSUC 6 Untersuchung der Reaktionskinetik der Saccharose-Inversion durch Polarimetrie 1)Aufgabenstellung:
- 1 - V 6 Rohrzuckerinversion Reaktionsgeschwindigkeitskonstante und Aktivierungsengergie -Kinetik- - 2 - VERSUC 6 Untersuchung der Reaktionskinetik der Saccharose-Inversion durch Polarimetrie 1)Aufgabenstellung:
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
3. Wieviel bindig sind folgende Elemente in kovalenten Bindungen? Einige Elemente können auch verschiedene Bindigkeiten zeigen
 Übungen zur VL Chemie für Biologen und umanbiologen 26. 11.2010 1. ennen Sie mindestens 2 Arten der chemischen Bindungen und geben Sie je 2 Beispielverbindungen dafür an (Strukturformel). 1) Ionische Bindung:
Übungen zur VL Chemie für Biologen und umanbiologen 26. 11.2010 1. ennen Sie mindestens 2 Arten der chemischen Bindungen und geben Sie je 2 Beispielverbindungen dafür an (Strukturformel). 1) Ionische Bindung:
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Modul: BS Chemie II Organische Chemie Nachklausur zum Organisch-Chemischen Grundpraktikum für. Studierende der Biologie
 Chemisches Praktikum für Studierende der Biologie (Diplom und Bachelor) Universität zu Köln Institut für rganische Chemie Prof. Dr. A. G. Griesbeck Greinstr. 4 50939 Köln Modul: BS Chemie II rganische
Chemisches Praktikum für Studierende der Biologie (Diplom und Bachelor) Universität zu Köln Institut für rganische Chemie Prof. Dr. A. G. Griesbeck Greinstr. 4 50939 Köln Modul: BS Chemie II rganische
Homologe Reihe. Alkane. Alkene. Alkine
 GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
Kohlenstoffverbindungen
 Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Grundlagen der Chemie Lösungen Prof. Annie Powell
 Lösungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Inhalte Konzentrationsmaße Wasser als Lösungsmittel Solvatation,
Lösungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Inhalte Konzentrationsmaße Wasser als Lösungsmittel Solvatation,
Abschlussklausur Chemie für Studierende der Humanmedizin 2. Klausur
 Abschlussklausur hemie für Studierende der umanmedizin 2. Klausur 2006 17. 06. 2006 Name: Vorname: SG: Matrikel-Nr.: Bitte beachten Sie: Außer Ihrem Schreibgerät sind keine weiteren ilfsmittel, wie z.b.
Abschlussklausur hemie für Studierende der umanmedizin 2. Klausur 2006 17. 06. 2006 Name: Vorname: SG: Matrikel-Nr.: Bitte beachten Sie: Außer Ihrem Schreibgerät sind keine weiteren ilfsmittel, wie z.b.
Einführung in die Photochemie
 Einführung in die Photochemie Praktikum und Lernaufgaben von Roger Deuber Inhalt: Die Schüler/innen führen im Praktikum die thermische und photochemische Umlagerung von Azobenzen durch und erfahren dabei,
Einführung in die Photochemie Praktikum und Lernaufgaben von Roger Deuber Inhalt: Die Schüler/innen führen im Praktikum die thermische und photochemische Umlagerung von Azobenzen durch und erfahren dabei,
