Endotherm und Exotherm
|
|
|
- Elizabeth Dresdner
- vor 6 Jahren
- Abrufe
Transkript
1 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm
2 Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen Schülerversuch zum Thema Exotherm und Endotherm der Unterrichtseinheit Die chemische Reaktion. Der Lehrerversuch zeigt die stark exotherme Reaktion von Zink und Schwefel. Der Schülerversuch ist ein alternativer Versuch zum Demonstrationsversuch. Er demonstriert die eindrucksvolle Reaktion von Kupfer und Schwefel. Die Versuche veranschaulichen dabei nicht nur den Energieumsatz sehr schön, sondern auch die Stoffumwandlung der eingesetzten Stoffe. Das Schülerarbeitsblatt Reaktion von Kupfer und Schwefel dient als Unterrichtsmaterial zur Durchführung des Schülerversuchs. Inhalt 1 Beschreibung des Themas und zugehörige Lernziele Relevanz des Themas für SuS der 7. und 8. Jahrgangsstufe und didaktische Reduktion Lehrerversuch V 1 Exotherme Reaktion von Zink und Schwefel Schülerversuch V 2 Exotherme Reaktion von Kupfer und Schwefel Didaktischer Kommentar zum Schülerarbeitsblatt Erwartungshorizont (Kerncurriculum) Erwartungshorizont (Inhaltlich)... 8
3 1 Beschreibung des Themas und zugehörige Lernziele 1 1 Beschreibung des Themas und zugehörige Lernziele Das Thema Endotherm und Exotherm der Unterrichtseinheit Die chemische Reaktion ist ein wesentlicher Bestandteil des Chemieunterrichts der Klassenstufen 7 und 8. Mittels der Untersuchung und Definition einer chemischen Reaktion lernen die Schülerinnen und Schüler (SuS) neben der Stoffänderung und der Massenerhaltung den Energieumsatz als ein typisches Merkmal einer chemischen Reaktion kennen. Sie kann unter Energieabgabe exotherm oder unter Energieaufnahme endotherm ablaufen. Im Kerncurriculum für das Fach Chemie werden für die Klassenstufen 7 und 8 exotherme und endotherme Reaktionen sowohl im Basiskonzept Chemische Reaktion als auch im Basiskonzept Energie genannt. Dabei sollen die SuS beschreiben, dass chemische Reaktionen immer mit einem Energieumsatz verbunden sind und Systeme bei chemischen Reaktionen Energie mit der Umgebung, z. B. in Form von Wärme, austauschen können und dadurch ihren Energiegehalt verändern (Kompetenzbereich Fachwissen). Daneben sollen sie Energiediagramme erstellen, Prozesse der Energieübertragung mit dem einfachen Teilchenmodell deuten sowie experimentelle Untersuchungen zur Bestimmung einer Energieübertragung zwischen System und Umgebung durchführen (Kompetenzbereich Erkenntnisgewinnung). Außerdem sollen sie unter Anwendung energetischer Begriffe fachsprachlich kommunizieren und Anwendungen von Energieübertragungsprozessen im Alltag aufzeigen. Das Lehrerexperiment verdeutlicht auf eindrucksvoller Art die Eigenschaften einer chemischen Reaktion und hier insbesondere das Merkmal des Energieumsatzes. Die SuS erkennen anhand des Versuches, dass bei chemischen Reaktionen Energie in Form von Licht und Wärme freigesetzt werden kann und dass für ihre Initiierung Aktivierungsenergie benötigt wird. Das Schülerexperiment zeigt ähnlich wie das Lehrerexperiment die Eigenschaften einer chemischen Reaktion. Allerdings unterscheidet es sich vom Lehrerversuch darin, dass die Reaktion weniger stark exotherm verläuft und die Stoffumwandlung besser verdeutlicht wird. Die SuS erkennen ähnlich wie im Lehrerversuch, dass bei chemischen Reaktionen Energie in Form von Wärme freigesetzt werden kann und dass für ihre Initiierung Aktivierungsenergie benötigt wird. 2 Relevanz des Themas für SuS der 7. und 8. Jahrgangsstufe und didaktische Reduktion Das Thema ist schulrelevant, da die SuS der Klassenstufe 7 und 8 exotherme und endotherme Reaktionen in ihrer Umwelt nicht nur wahrnehmen, sondern mit ihnen auch selber in Berührung kommen. Sie begegnen dabei exotherme Reaktionen im Alltag, die beim Verbrennungsvorgang einer Kerze, beim Verbrennungsvorgang der Holzkohle eines Lagerfeuers, beim Entzünden eines
4 3 Lehrerversuch V 1 Exotherme Reaktion von Zink und Schwefel 2 Streichholzes, beim Aufleuchten von Wunderkerzen, beim Brennen von (Magnesium-)Fackeln, beim Leuchten von Knicklichtern sowie bei Explosionen von Silvesterraketen (Licht-, Wärmeenergie) stattfinden. Endotherme Reaktionen begegnen ihnen bei der Nahrungszubereitung (Backen, Kochen, Braten, etc.). Mit einer exothermen und endothermen Reaktion kommen sie beim Auf- und Entladen eines Taschenwärmers in Berührung. Zu dem Thema gibt es eine große Auswahl an Experimenten, die theoretisch durchgeführt werden könnten. Allerdings ist es empfehlenswert, Experimente mit einfachen Reaktionsgleichungen auszusuchen, so z. B. Elementarreaktionen, so dass die Reaktionsgleichungen von den SuS selber aufgestellt werden können. Hierzu ist voraussetzend, dass sie die Elementsymbole kennen sowie Wort- und Reaktionsgleichungen aufstellen können. Des Weiteren muss die Behandlung des Themas didaktisch reduziert erfolgen, was bedeutet, dass z. B. nicht auf die Redoxreaktionen der Versuche eingegangen wird, da die SuS den erweiterten Redoxbegriff noch nicht kennen. Außerdem wird die Energetik chemischer Reaktionen von einer Änderung der Gibbs-Energie auf eine Änderung der Enthalpie reduziert, wobei die Entropie unberücksichtigt bleibt. Darüber hinaus beschränken sich die Versuche auf die Energieform der Wärme. Daneben werden bei der Betrachtung von Lösungsenthalpien (Kurzprotokoll V1) lediglich die Temperaturänderung und nicht der genaue Lösungsvorgang der Salze ausgewertet. 3 Lehrerversuch V 1 Exotherme Reaktion von Zink und Schwefel Der Versuch zeigt die stark exotherme Reaktion von Zink und Schwefel. Er veranschaulicht sehr gut die Freisetzung einer größeren Menge an Energie in Form von Licht und Wärme. Achtung: Er ist ein Lehrerversuch, da es sich um eine stark exotherme Reaktion handelt, bei der es zu einem hellen Aufleuchten des Gemisches kommt und bei der außerdem eine größere Menge an giftigem Schwefeldioxid entsteht. Aufgrund der Schwefeldioxidbildung muss er im Abzug durchgeführt werden. Es ist kein spezielles Vorwissen der SuS notwendig, um den Versuch durchführen zu können. Gefahrenstoffe Zinkpulver H: P: Schwefelpulver H: 315 P:
5 3 Lehrerversuch V 1 Exotherme Reaktion von Zink und Schwefel 3 Materialien: Chemikalien: Durchführung: Beobachtung: 2 Urgläser, Waage, Porzellanschale, feuerfeste Unterlage, Gasbrenner. Zinkpulver, Schwefelpulver. 6 g Zinkpulver und 3 g Schwefelpulver werden auf einer Waage abgewogen, in die Porzellanschale gegeben und vorsichtig miteinander vermischt. Anschließend wird das Gemisch kegelförmig auf eine feuerfeste Unterlage gegeben und im Abzug mit dem Gasbrenner erhitzt. Achtung: Nicht direkt in die Flamme schauen! Die Reaktion darf wegen der Explosionsgefahr nicht in einem Reagenzglas gestartet werden. Das Gemisch glüht wie ein riesiger Feuerball bei gleichzeitiger Rauchentwicklung weiß auf (siehe Abb. 2). Das gelbe Schwefelpulver und das graue Zinkpulver sind nicht mehr vorhanden. Es ist ein weißer, pulverförmiger Feststoff entstanden. Abb. 1 - Graues Zinkpulver und gelbes Schwefelpulver vor der Reaktion. Abb. 2 - Reaktion zwischen Zink und Schwefel. Auswertung: Die Eigenschaften des Produktes sind anders als die der Edukte. Es ist ein neuer Stoff mit anderen Eigenschaften entstanden: Zinksulfid. Es hat also eine chemische Reaktion stattgefunden. Die Reaktion ist stark exotherm, d. h. dass bei der Reaktion viel Energie in Form von Licht und Wärme freigesetzt wird. Da die Edukte erhitzt werden müssen, wird für die Reaktion Aktivierungsenergie benötigt. Die Reaktionsgleichung lautet: Zn (s) + S (s) ZnS (s) Entsorgung: Literatur: Das Zinksulfid wird in den anorganischen Feststoffabfall gegeben. M. Northolz, & R. Herbst-Irmer, Praktikumsskript Allgemeine und Anorganische Chemie, WiSe 2009/2010, Göttingen: Universität Göttingen.
6 4 Schülerversuch V 2 Exotherme Reaktion von Kupfer und Schwefel 4 Das Gemisch kann auch alternativ mit einem glühenden Verbrennungslöffelstiel entzündet werden, indem der Verbrennungslöffel mit dem glühenden Ende in das Gemisch getaucht wird. Der Versuch kann auch alternativ mit anderen Metallen, wie z. B. Kupfer durchgeführt werden. Die Durchführung mit Kupfer darf auch im Reagenzglas erfolgen. Wird im Versuch Kupfer verwendet, kann er auch von den SuS durchgeführt werden (siehe hierzu den Schülerversuch V 2). Im Unterricht kann mithilfe des Versuches die Stoffumwandlung und der Energieumsatz als Merkmale einer chemischen Reaktion thematisiert werden. Daneben können energetische Begriffe definiert sowie Energiediagramme von den SuS erstellt werden. Aufgrund der Verwendung zweier elementarer Stoffe, ist die Reaktion recht einfach, weshalb die Reaktionsgleichung von den SuS selber aufgestellt werden kann. Des Weiteren kann auf die für die Reaktion benötigte Aktivierungsenergie eingegangen werden. Der Versuch ist zur Einführung von exothermen Reaktionen geeignet, da hier die Freisetzung von Energie gut beobachtet werden kann. 4 Schülerversuch V 2 Exotherme Reaktion von Kupfer und Schwefel Der Versuch zeigt die exotherme Reaktion von Kupfer und Schwefel. Er veranschaulicht in einer eindrucksvollen Reaktion nicht nur die Freisetzung von Energie durch das Aufglühen des Kupferblechs, sondern auch die Stoffumwandlung. Er ist ein Schülerversuch, da im Vergleich zur Reaktion von Zink und Schwefel eine geringere Menge an giftigem Schwefeldioxid entsteht. Für die Durchführung des Versuches ist erforderlich, dass die SuS mit dem Umgang eines Gasbrenners vertraut sind. Gefahrenstoffe Schwefelpulver H: 315 P: Materialien: Chemikalien: Reagenzglas, Spatel, Stativ, Klemme, Muffe, Gasbrenner. Kupferblech, Schwefelpulver.
7 4 Schülerversuch V 2 Exotherme Reaktion von Kupfer und Schwefel 5 Durchführung: Beobachtung: Ein Reagenzglas wird etwa 1-2 cm hoch mit Schwefelpulver gefüllt und leicht schräg in ein Stativ eingespannt. Anschließend wird ein ca. 5 cm langes Kupferblech so in das Reagenzglas gelegt, dass es 3-4 cm über dem Schwefel liegt. Es wird zunächst das Kupferblech solange erhitzt, bis es sehr heiß ist. Danach wird der Schwefel erhitzt, bis die Reaktion beendet ist. Nach dem Abkühlen des Reagenzglases wird das entstandene Produkt beschrieben. Der Schwefel schmilzt zunächst und verdampft anschließend. Das Kupferblech glüht tiefrot auf (siehe Abb. 4). Die Glühfront zieht durch das Kupferblech. Das gelbe Schwefelpulver und das rote biegsame Kupferblech sind nicht mehr vorhanden. Es ist ein schwarzblauer, brüchiger Feststoff entstanden. Abb. 3 - Gelber Schwefel und rotes Kupferblech vor der Reaktion. Abb. 4 - Reaktion zwischen Schwefel und Kupferblech. Auswertung: Die Eigenschaften des Produktes sind anders als die der Edukte. Es ist ein neuer Stoff mit neuen Eigenschaften entstanden: Kupfersulfid. Es hat also eine chemische Reaktion stattgefunden. Die Reaktion ist exotherm, d. h. dass bei der Reaktion Energie freigesetzt wird. Da die Edukte erhitzt werden müssen, wird für die Reaktion Aktivierungsenergie benötigt. Die Reaktionsgleichung lautet: Cu (s) + S (s) CuS (s) Entsorgung: Das Kupfersulfid wird in den anorganischen Feststoffabfall gegeben. Literatur: M. Riecken, , (Zuletzt abgerufen am um 21:02 Uhr).
8 4 Schülerversuch V 2 Exotherme Reaktion von Kupfer und Schwefel 6 Im Unterricht kann der Versuch ähnlich wie der Lehrerversuch eingesetzt werden, um die Stoffumwandlung und den Energieumsatz als Merkmale einer chemischen Reaktion zu thematisieren. Daneben können energetische Begriffe definiert sowie Energiediagramme von den SuS erstellt werden. Aufgrund der Verwendung zweier elementarer Stoffe, ist die Reaktion recht einfach, weshalb die Reaktionsgleichung von den SuS selber aufgestellt werden kann. Des Weiteren kann auf die für die Reaktion benötigte Aktivierungsenergie eingegangen werden. Der Versuch ist zur Einführung von exothermen Reaktionen geeignet, da hier die Freisetzung von Energie gut beobachtet werden kann. Außerdem kann er zur Vertiefung oder Wiederholung von exothermen Reaktionen eingesetzt werden, nachdem die energetischen Begriffe sowie Energiediagramme zuvor anhand anderer Versuche eingeführt wurden.
9 Arbeitsblatt Reaktion von Kupfer und Schwefel Achtung: Es entsteht giftiges Schwefeldioxid. Nicht einatmen! Trage eine Schutzbrille! Der entstehende Feststoff wird nach dem Experiment in den Sammelbehälter auf dem Pult gegeben. Materialien: Chemikalien: Durchführung: Beobachtung: Reagenzglas, Spatel, Stativ, Klemme, Muffe, Gasbrenner. Kupferblech, Schwefelpulver. Baut in Gruppen die Apparatur wie die Apparatur auf dem Lehrerpult auf. Füllt hierzu ein Reagenzglas etwa 1-2 cm hoch mit Schwefelpulver und spannt es schräg in ein Stativ ein. Legt nun ein ca. 5 cm langes Kupferblech so in das Reagenzglas, dass es 3-4 cm über dem Schwefel liegt. Erhitzt anschließend mit einem Gasbrenner zunächst das Kupferblech solange, bis es sehr heiß ist. Erhitzt danach nur noch den Schwefel. Beschreibt in eurer Beobachtung nach dem Abkühlen des Reagenzglases auch das entstandene Produkt. Nehmt hierzu das Produkt aus dem Reagenzglas und versucht es zu verbiegen. Auswertung: Aufgabe 1 Nenne die Merkmale einer chemischen Reaktion. Aufgabe 2 Erkläre, woran erkannt werden kann, dass im Versuch eine chemische Reaktion stattgefunden hat. Aufgabe 3 Begründe anhand des Energiediagramms, warum für die Rückreaktion Kupfersulfid reagiert zu Kupfer und Schwefel Energie benötigt wird.
10 5 Didaktischer Kommentar zum Schülerarbeitsblatt 8 5 Didaktischer Kommentar zum Schülerarbeitsblatt Das folgende Arbeitsblatt behandelt den Energieumsatz bei der Reaktion von Kupfer und Schwefel. Es kann daher unterstützend zum Schülerversuch Exotherme Reaktion von Kupfer und Schwefel zur Auswertung im Chemieunterricht verwendet werden. Wie im Versuch bereits beschrieben, kann er im Unterricht zur Einführung oder zur Vertiefung/ Wiederholung von exothermen Reaktionen eingesetzt werden, nachdem die energetischen Begriffe sowie Energiediagramme zuvor anhand anderer Versuche eingeführt wurden. Als Vorwissen für den Versuch sollten die SuS mit dem Umgang eines Gasbrenners vertraut sein und für die Auswertung Energiediagramme kennen. 5.1 Erwartungshorizont (Kerncurriculum) Fachwissen: Die SuS beschreiben, dass sich Stoffe in ihrem Energiegehalt unterscheiden (Aufgabe 3). Die SuS beschreiben, dass Systeme bei chemischen Reaktionen Energie mit der Umgebung, z. B. in Form von Wärme, austauschen können und dadurch ihren Energiegehalt verändern (Aufgabe 2 und 3). Erkenntnisgewinnung: Kommunikation: Die SuS führen experimentelle Untersuchungen zur Bestimmung einer Energieübertragung zwischen System und Umgebung durch (Versuch). Die SuS kommunizieren fachsprachlich unter Anwendung energetischer Begriffe (Aufgabe 2). Bei Aufgabe 1 des Arbeitsblattes handelt es sich um eine Aufgabe im Anforderungsbereich I, da hier von den SuS bereits bekanntes Wissen wiedergegeben werden soll. Aufgabe 2 ist eine Aufgabe des Anforderungsbereichs II, da die SuS ihr Wissen zur chemischen Reaktion nun anwenden, indem sie konkret sagen, woran im Versuch erkannt werden kann, dass eine chemische Reaktion stattgefunden hat. Bei Aufgabe 3 handelt es sich um eine Aufgabe im Anforderungsbereich III, da es sich um eine Transferaufgabe handelt. Das Ziel hierbei ist ein tieferes Verständnis für den Energieumsatz und hier insbesondere für den Energiegehalt der Edukte und des Produktes der chemischen Reaktion im Versuch.
11 5 Didaktischer Kommentar zum Schülerarbeitsblatt Erwartungshorizont (Inhaltlich) Aufgabe 1 Für diesen Versuch relevante Merkmale einer chemischen Reaktion sind die Bildung eines oder mehrerer neuer Stoffe (Stoffumwandlung), die Abgabe oder Aufnahme von Energie (Energieumsatz) und die Umlagerung von Teilchen (Teilchenumsatz). Aufgabe 2 Es ist ein neuer Stoff mit anderen Eigenschaften entstanden: Kupfersulfid. Er ist nicht mehr gelb wie Schwefel und auch nicht rot und biegsam wie Kupfer, sondern schwarzblau und brüchig. Es wird bei der Reaktion zwischen Kupfer und Schwefel Energie freigesetzt. Dies wird dadurch deutlich, dass das Kupferblech tiefrot aufglüht. Das Aufglühen setzt sich auch noch fort, wenn der Brenner schon entfernt worden ist. Daher kann die Wärmenergie, die die Stoffportion zum Glühen bringt, nicht von außen kommen. Das Erhitzen des Schwefels dient lediglich zur Aktivierung der Reaktion. Aufgabe 3 Für die Rückreaktion Kupfersulfid reagiert zu Kupfer und Schwefel wird Energie benötigt, da der Energiegehalt von Schwefel und Kupfer größer ist als der von Kupfersulfid. Dies wird im Energiediagramm dadurch verdeutlicht, dass sich die Edukte im Vergleich zum Produkt auf einem höheren Energieniveau befinden.
Reaktionen von Metallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Fluoreszierende Verbindungen
 Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer
 Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer chemischen Reaktion? In der letzten Chemiestunde hast du eine Hypothese zu der Frage formuliert: Verändert sich die Masse von
Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer chemischen Reaktion? In der letzten Chemiestunde hast du eine Hypothese zu der Frage formuliert: Verändert sich die Masse von
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 7 & 8. Reaktionen von Metallen mit Sauerstoff und mit Luft.
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Reaktion von Nichtmetallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 7 & 8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 7 & 8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum. Name Thomas Polle. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen. Kurzprotokoll. Schulversuchspraktikum.
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Dichte und Nachweis von Kohlenstoffdioxid
 Schulversuchspraktikum Name: Lydia Reinhardt Semester: Sommersemester 2014 Klassenstufen 7 & 8 Dichte und Nachweis von Kohlenstoffdioxid 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Name: Lydia Reinhardt Semester: Sommersemester 2014 Klassenstufen 7 & 8 Dichte und Nachweis von Kohlenstoffdioxid 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Energie und Energieumwandlung
 Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Metalle und Nichtmetalle
 Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Schulversuchspraktium Bastian Hollemann Sommersemester 2015 Klassenstufen 9 & 10 Metalle und Nichtmetalle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Diese Unterrichtseinheit für
Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad
 Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum Mona-Christin Maaß Sommersemester 2013 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft; Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele
Synthese, Analyse, Umsetzung
 Schulversuchspraktikum Carl Föst Sommersemester 2015 Klassenstufen 7&8 Synthese, Analyse, Umsetzung Auf einen Blick Die Thematik Synthese, Analyse und Umsetzung umfasst die Grundtypen chemischer Reaktionen.
Schulversuchspraktikum Carl Föst Sommersemester 2015 Klassenstufen 7&8 Synthese, Analyse, Umsetzung Auf einen Blick Die Thematik Synthese, Analyse und Umsetzung umfasst die Grundtypen chemischer Reaktionen.
Warum korrodiert Eisen?
 Warum korrodiert Eisen? Korrodiertes Eisen bzw. Rost findet sich überall. An Brücken, Autos, an unseren Fahrrädern und an altem Werkzeug. Es richtet in Deutschland jährlich Schäden im Wert von 100 Millionen
Warum korrodiert Eisen? Korrodiertes Eisen bzw. Rost findet sich überall. An Brücken, Autos, an unseren Fahrrädern und an altem Werkzeug. Es richtet in Deutschland jährlich Schäden im Wert von 100 Millionen
Basiskonzept: Stoff-Teilchen (3/7)
 Basiskonzept: Stoff-Teilchen (3/7) 1 Schuljahrgänge 7 und 8 Stoffe besitzen quantifizierbare Eigenschaften Die Schülerinnen und Schüler... unterscheiden Stoffe anhand von Schmelz- und Siedetemperatur.
Basiskonzept: Stoff-Teilchen (3/7) 1 Schuljahrgänge 7 und 8 Stoffe besitzen quantifizierbare Eigenschaften Die Schülerinnen und Schüler... unterscheiden Stoffe anhand von Schmelz- und Siedetemperatur.
Schulversuchspraktikum. Alexander König. Sommersemester Klassenstufen 11 & 12. Katalysatoren
 Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 11 & 12 Katalysatoren Auf einen Blick: Diese Unterrichtseinheit für die Klassen 11 und 12 enthält einen Schülerversuch und einen
Schulversuchspraktikum Alexander König Sommersemester 2015 Klassenstufen 11 & 12 Katalysatoren Auf einen Blick: Diese Unterrichtseinheit für die Klassen 11 und 12 enthält einen Schülerversuch und einen
Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser?
 http://www.kostenloseausmalbilder.de/media/.gallery/main606.jpg (02.08.2015) Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser? Pip, die kleine Maus, benötigt zum Atmen Luft, vor allem den Sauerstoff,
http://www.kostenloseausmalbilder.de/media/.gallery/main606.jpg (02.08.2015) Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser? Pip, die kleine Maus, benötigt zum Atmen Luft, vor allem den Sauerstoff,
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch und
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch und
1 Arbeitsblatt. 1.1 Erwartungshorizont
 1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert ist, ist die Deutung des
1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert ist, ist die Deutung des
Schulversuchspraktikum. Constanze Koch. Sommersemester Klassenstufen 5 & 6. Wasser als Lösungsmittel. Kurzprotokoll
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Aggregatzustände und deren Temperaturabhängigkeit
 Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum. Isabel Böselt. Sommersemester Klassenstufen 5 & 6. Aggregatzustände. und deren Temperaturabhängigkeit
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Enthalpie und Entropie
 Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 11 & 12 Enthalpie und Entropie 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Themenbereich
Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 11 & 12 Enthalpie und Entropie 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Themenbereich
1 Stoffe in Alltag und Technik
 Schülerband Blickpunkt Chemie 1 Niedersachsen (978-3-507-77292-2) Basiskonzept inhaltsbezogene Kompetenzen: Fachwissen prozessbezogene Kompetenzen: Erkenntnisgewinnung, Kommunikation, Bewertung Die Schülerinnen
Schülerband Blickpunkt Chemie 1 Niedersachsen (978-3-507-77292-2) Basiskonzept inhaltsbezogene Kompetenzen: Fachwissen prozessbezogene Kompetenzen: Erkenntnisgewinnung, Kommunikation, Bewertung Die Schülerinnen
Gruppe I : Darstellung und Nachweis von Säuren
 Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
Gruppe I : Darstellung und Nachweis von Säuren Behauptung: Säuren lassen sich durch die Reaktion von Nichtmetalloxiden mit Wasser darstellen. 1. Überprüfen Sie experimentell die aufgeführte Behauptung
Aktivierungsenergie und Katalyse
 1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
1 Beschreibung des Themas und zugehörige Lernziele Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 7 & 8 Aktivierungsenergie und Katalyse 1 Beschreibung des Themas und zugehörige
Schulversuchspraktikum. Julia Müller. Klassenstufen 5/6. Feuer und Kerzen
 Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Schulcurriculum Chemie - Jahrgang 7 (60 Std.)
 Schulcurriculum Chemie - Jahrgang 7 (60 Std.) Abkürzungen: F = Fachwissen E = Erkenntnisgewinnung K= Kommunikation B = Bewertung Unterrichtseinheit UE: Stoffe und ihre Eigenschaften (ca. 12 Stunden) ergänzend
Schulcurriculum Chemie - Jahrgang 7 (60 Std.) Abkürzungen: F = Fachwissen E = Erkenntnisgewinnung K= Kommunikation B = Bewertung Unterrichtseinheit UE: Stoffe und ihre Eigenschaften (ca. 12 Stunden) ergänzend
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 7/8. Sauerstoff. Das Gas des Lebens
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 7/8 Sauerstoff Das Gas des Lebens 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. Die Themeneinheit
Erweiterter Redoxbegriff
 Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 7 & 8 Erweiterter Redoxbegriff 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte
Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 7 & 8 Erweiterter Redoxbegriff 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte
Wir untersuchen Mineralwasser
 Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
CHEMISCHE REAKTIONEN (SEKP)
 KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
KSO CHEMISCHE REAKTIONEN (SEKP) Skript Chemische Reaktionen (SekP) V1.0 01/15 Bor 2 INHALTSVERZEICHNIS "CHEMISCHE REAKTIONEN" 1. Einleitung...03 2. Stoffe wandeln sich um... 04 2.1 Kupfer reagiert mit
Erwartete Kompetenzen. Kompetenzbereich Erkenntnisgewinnung Die Schülerinnen und Schüler E1 E2 E3 E4 E5 E6 E7 E8 E9 E10 E11 E12 E13 E14 E15 E16 E17
 Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Stoffverteilungsplan Kerncurriculum für die Oberschule in Niedersachsen (Schuljahrgänge 7/8) PRISMA Chemie Niedersachsen Differenzierende Ausgabe Band 7/8 Schule: Klettbuch ISBN 978-3-12-068537-1 Lehrer:
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Vom Alkohol zum Alken
 1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
1 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufe 9 & 10 Vom Alkohol zum Alken 2 Auf einem Blick: Diese Unterrichtseinheit für die Klasse 9 & 10 enthält Lehrerversuche und 1 Schülerversuch
Lösungen Kap. 4 Die chemische Reaktion
 Elemente Grundlagen der Chemie für Schweizer Maturitätsschulen Klett und Balmer Verlag Zug 2007 Verwendung für den Gebrauch in der eigenen Klasse gestattet Lösungen Kap. 4 Die chemische Reaktion Lösungen
Elemente Grundlagen der Chemie für Schweizer Maturitätsschulen Klett und Balmer Verlag Zug 2007 Verwendung für den Gebrauch in der eigenen Klasse gestattet Lösungen Kap. 4 Die chemische Reaktion Lösungen
Einfache Solaranlagen
 Thema: Solaranlagen Klasse 5 / 6 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 5 & 6 Einfache Solaranlagen Thema: Solaranlagen Klasse 5 / 6 Auf einen Blick: Diese Unterrichtseinheit
Thema: Solaranlagen Klasse 5 / 6 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 5 & 6 Einfache Solaranlagen Thema: Solaranlagen Klasse 5 / 6 Auf einen Blick: Diese Unterrichtseinheit
Schulversuchspraktikum. Dörte Hartje. Sommersemester 2013. Klassenstufen 7 & 8. Vom Erz zum Metall
 Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 7 & 8 Vom Erz zum Metall Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll enthält drei Lehrer- und
Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 7 & 8 Vom Erz zum Metall Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Dieses Protokoll enthält drei Lehrer- und
4.2 Reaktion von Kupfer und Schwefel. Aufgabe. Woran lassen sich chemische Reaktionen erkennen? (2)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75300) 4.2 Reaktion von Kupfer und Schwefel Experiment von: Phywe Gedruckt:.0.203 2:59:32 intertess (Version 3.06 B200, Export
Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75300) 4.2 Reaktion von Kupfer und Schwefel Experiment von: Phywe Gedruckt:.0.203 2:59:32 intertess (Version 3.06 B200, Export
Schulversuchspraktikum. Olga Streck. Sommersemester Klassenstufen 5 & 6. Papier
 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 5 & 6 Papier 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Lehrerversuche und 2 Schülerversuche zum Thema
Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 5 & 6 Papier 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Lehrerversuche und 2 Schülerversuche zum Thema
Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt VORANSICHT
 V Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) 1 von 30 Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt Tobias Dunst, Kißlegg Welche Verbindung besteht zwischen dem mysteriösen
V Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) 1 von 30 Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt Tobias Dunst, Kißlegg Welche Verbindung besteht zwischen dem mysteriösen
NWA-Tag Am 8.Juli 2009 am Staatlichen Seminar für Didaktik und Lehrerbildung (RS) Reutlingen
 NWA-Tag Am 8.Juli 2009 am Staatlichen Seminar für Didaktik und Lehrerbildung (RS) Reutlingen Erstellt von den Teilnehmern des Fachdidaktik-Chemie-Kurses 26 Elisabeth Holocher. Verena Jobke. Carolin Rehm.
NWA-Tag Am 8.Juli 2009 am Staatlichen Seminar für Didaktik und Lehrerbildung (RS) Reutlingen Erstellt von den Teilnehmern des Fachdidaktik-Chemie-Kurses 26 Elisabeth Holocher. Verena Jobke. Carolin Rehm.
Vom Schwefel zur Schwefelsäure
 Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 9 & 10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird
Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 9 & 10 Vom Schwefel zur Schwefelsäure 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll wird
NWA-Tag am 11.07.2007 am Staatlichen Seminar für Didaktik und Lehrerbildung (RS) Reutlingen. Thema: Stoffwechsel und Energieumwandlungsprozesse
 NWA-Tag am 11.07.2007 am Staatlichen Seminar für Didaktik und Lehrerbildung (RS) Reutlingen Thema: Stoffwechsel und Energieumwandlungsprozesse Aktivierungsenergie chemische Reaktion Erstellt von den Teilnehmern
NWA-Tag am 11.07.2007 am Staatlichen Seminar für Didaktik und Lehrerbildung (RS) Reutlingen Thema: Stoffwechsel und Energieumwandlungsprozesse Aktivierungsenergie chemische Reaktion Erstellt von den Teilnehmern
Endotherm und Exotherm
 Schulversuchspraktikum Anne Steinkuhle Sommersemester 2013 Klassenstufen 7 & 8 Endotherm und Exotherm 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In dem folgenden Protokoll sind
Schulversuchspraktikum Anne Steinkuhle Sommersemester 2013 Klassenstufen 7 & 8 Endotherm und Exotherm 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In dem folgenden Protokoll sind
Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen 1 Beschreibung des Themas und zugehörige Lernziele
Schulversuchspraktikum. Isabel Böselt. Sommersemester Klassenstufen 9 & 10. Alkalimetalle
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll sollen Versuche zum
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 9 & 10 Alkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll sollen Versuche zum
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10. Die Brennstoffzelle
 Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10 Die Brennstoffzelle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll sind drei Lehrerversuche
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10 Die Brennstoffzelle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll sind drei Lehrerversuche
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 9/10. Salze
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 9/10 Salze 1 Schulversuchspraktikum 1 Auf einen Blick:. Die Thematik der Salze ist sehr umfangreich. Die hier dargestellten
4.1 Vergleich von physikalischem Vorgang und chemischer Reaktion. Aufgabe. Woran lassen sich chemische Reaktionen erkennen? (1)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
Schulversuchspraktikum. Name: Jennifer Ahrens. Semester: Sommersemester Klassenstufen 9 & 10. Alkalimetalle
 Schulversuchspraktikum Name: Jennifer Ahrens Semester: Sommersemester 2012 Klassenstufen 9 & 10 Alkalimetalle Auf einen Blick: In dieser Unterrichtseinheit werden Versuche zu den Alkalimetallen der ersten
Schulversuchspraktikum Name: Jennifer Ahrens Semester: Sommersemester 2012 Klassenstufen 9 & 10 Alkalimetalle Auf einen Blick: In dieser Unterrichtseinheit werden Versuche zu den Alkalimetallen der ersten
Homogene und Heterogene Gemische
 Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 7 & 8 Homogene und Heterogene Gemische 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll
Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium
 Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium Unterrichtsfach Themenbereich/e Schulstufe (Klasse) Fachliche Vorkenntnisse Sprachliche Kompetenzen Zeitbedarf Material- & Medienbedarf
Reaktionsgleichungen verstehen anhand der Verbrennung von Magnesium Unterrichtsfach Themenbereich/e Schulstufe (Klasse) Fachliche Vorkenntnisse Sprachliche Kompetenzen Zeitbedarf Material- & Medienbedarf
Schwimmen, Schweben, Sinken
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 beinhaltet einen Lehrer- und vier Schülerversuche.
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 beinhaltet einen Lehrer- und vier Schülerversuche.
Reaktion von Nichtmetallen mit Sauerstoff
 Schulversuchspraktikum Name: Benjamin Heuer Semester: SS2013 Klassenstufen 7&8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Name: Benjamin Heuer Semester: SS2013 Klassenstufen 7&8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Arbeitsblatt Wie entstehen Farben?
 Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Arbeitsblatt Wie entstehen Farben? Der für das menschliche Auge sichtbare Wellenlängenbereich liegt bei 380-750 nm. Farbstoffe sind in der Lage bestimmte Wellenlängen des Lichts zu absorbieren und eine
Von Arrhenius zu Brønsted
 Schulversuchspraktikum Annika Münch Sommersemester 2015 Klassenstufe 9/10 Von Arrhenius zu Brønsted 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Thema Von
Schulversuchspraktikum Annika Münch Sommersemester 2015 Klassenstufe 9/10 Von Arrhenius zu Brønsted 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll zum Thema Von
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Sina Bachsmann Sommersemester 2014 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Im Folgenden
Schulversuchspraktikum Sina Bachsmann Sommersemester 2014 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Im Folgenden
Teilchenmodell, Diffusion & Brown sche Molekularbewegung
 Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 7 & 8 Teilchenmodell, Diffusion & Brown sche Molekularbewegung Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch erläutert,
Schulversuchspraktikum Anne Bergmann Sommersemester 2015 Klassenstufen 7 & 8 Teilchenmodell, Diffusion & Brown sche Molekularbewegung Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch erläutert,
Reinstoffe und Stoffgemische
 Schulversuchspraktikum Name: Birte Zieske Sommersemester 2012 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische 4 Schülerversuche 7 Auf einen Blick: Das Protokoll umfasst 2 Lehrerversuche und 3 Schülerversuche,
Schulversuchspraktikum Name: Birte Zieske Sommersemester 2012 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische 4 Schülerversuche 7 Auf einen Blick: Das Protokoll umfasst 2 Lehrerversuche und 3 Schülerversuche,
Curriculum Fach: Chemie Klasse: 8 Hölderlin-Gymnasium Nürtingen. Chemie
 Klassenstufe 8 BS (nach S. 196/197) Curriculum Fach: Chemie Klasse: 8 Chemie Kerncurriculum Inhalte Zeit Kompetenzen: die Schülerinnen und Schüler können Stoffe und ihre Eigenschaften Bemerkungen Wichtige
Klassenstufe 8 BS (nach S. 196/197) Curriculum Fach: Chemie Klasse: 8 Chemie Kerncurriculum Inhalte Zeit Kompetenzen: die Schülerinnen und Schüler können Stoffe und ihre Eigenschaften Bemerkungen Wichtige
Verfahren zur Stofftrennung
 Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Verfahren zur Stofftrennung Auf einen Blick: Dieses Protokoll enthält 3 Schülerversuche
Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Verfahren zur Stofftrennung Auf einen Blick: Dieses Protokoll enthält 3 Schülerversuche
Europäischer Chemielehrerkongress Leoben Österreich im April 2007
 Einfache und erprobte Experimente für den Anfangsunterricht im Fach Chemie 1. Stoffumwandlung Stoffe reagieren Aggregatzustandsänderung Zusammensetzung der Luft Gesetz von der Erhaltung der Masse Reaktion
Einfache und erprobte Experimente für den Anfangsunterricht im Fach Chemie 1. Stoffumwandlung Stoffe reagieren Aggregatzustandsänderung Zusammensetzung der Luft Gesetz von der Erhaltung der Masse Reaktion
C1 Erhitzen von Kupfer(II)-sulfat-Pentahydrat
 Chemische Reaktionen lassen sich anhand einiger charakteristischer Kennzeichen erkennen. Produkte einer Reaktion haben gegenüber den Ausgangsstoffen veränderte chemische Eigenschaften, bei Reaktionen wird
Chemische Reaktionen lassen sich anhand einiger charakteristischer Kennzeichen erkennen. Produkte einer Reaktion haben gegenüber den Ausgangsstoffen veränderte chemische Eigenschaften, bei Reaktionen wird
Voraussetzungen / Bezüge zu vergangenem und folgenden Unterricht Stoffeigenschaften, Stofftrennung, Reinstoffe, Gemische
 Entwurf für das Fach Chemie Jahrgangsstufe 7 (Klassenunterricht) Holzkamp-Gesamtschule, Witten (aktualisiert 2/2013) Unterrichtseinheit / Thema: Stoffe verändern sich und werden verändert Umfang Stunden:
Entwurf für das Fach Chemie Jahrgangsstufe 7 (Klassenunterricht) Holzkamp-Gesamtschule, Witten (aktualisiert 2/2013) Unterrichtseinheit / Thema: Stoffe verändern sich und werden verändert Umfang Stunden:
Schulversuchspraktikum. Sommersemester Klassenstufen 9 & 10. Erdalkalimetalle
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 9 & 10 Erdalkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden zwei Lehrerversuche und
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 9 & 10 Erdalkalimetalle 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden zwei Lehrerversuche und
Reaktion zwischen Aluminiumpulver und Iod
 Reaktionsgleichung 2 Al (s) + 3 2 (s) Al 2 6 (s) Zeitbedarf Vorbereitung: 5 min. Durchführung: 15 min. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel Menge R-Sätze S-Sätze Gefahrensymbole
Reaktionsgleichung 2 Al (s) + 3 2 (s) Al 2 6 (s) Zeitbedarf Vorbereitung: 5 min. Durchführung: 15 min. Nachbereitung: 20 min. Chemikalienliste Edukte Chemikalien Summenformel Menge R-Sätze S-Sätze Gefahrensymbole
Energie und Energiequellen
 Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 5 & 6 Energie und Energiequellen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte
Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 5 & 6 Energie und Energiequellen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte
Schulversuchspraktikum. Name: Jennifer Kölling. Sommersemester: Klassenstufen: 5/6. Die Luft. Das unsichtbare Gasgemisch
 Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 5/6 Die Luft Das unsichtbare Gasgemisch 1Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. In dieser
Schulversuchspraktikum Name: Jennifer Kölling Sommersemester: 2012 Klassenstufen: 5/6 Die Luft Das unsichtbare Gasgemisch 1Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:. In dieser
PÄDAGOGISCHES LANDESINSTITUT VIER VERSUCHE FÜR DEN CHEMIEUNTERRICHT AB SEKUNDARSTUFE I
 PÄDAGOGISCHES LANDESINSTITUT VIER VERSUCHE FÜR DEN CHEMIEUNTERRICHT AB SEKUNDARSTUFE I Passend zu den Versuchsanleitungen sind Videoaufnahmen im Rahmen eines Weiterbildungslehrgangs des Pädagogischen Landesinstituts
PÄDAGOGISCHES LANDESINSTITUT VIER VERSUCHE FÜR DEN CHEMIEUNTERRICHT AB SEKUNDARSTUFE I Passend zu den Versuchsanleitungen sind Videoaufnahmen im Rahmen eines Weiterbildungslehrgangs des Pädagogischen Landesinstituts
RAHMENRICHTLINIEN SEKUNDARSCHULE CHEMIE KULTUSMINISTERIUM. Schuljahrgänge 7 10
 RAHMENRICHTLINIEN SEKUNDARSCHULE (Ergänzung der RRL Sekundarschule Schuljahrgänge 7 10 in Umsetzung der Bildungsstandards für das Fach Chemie für den Mittleren Schulabschluss) CHEMIE Schuljahrgänge 7 10
RAHMENRICHTLINIEN SEKUNDARSCHULE (Ergänzung der RRL Sekundarschule Schuljahrgänge 7 10 in Umsetzung der Bildungsstandards für das Fach Chemie für den Mittleren Schulabschluss) CHEMIE Schuljahrgänge 7 10
Säuren und Laugen im Haushalt
 Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Schulversuchspraktikum Maximilian Konrad Sommersemester 2012 Klassenstufen 9 & 10 Säuren und Laugen im Haushalt Auf einen Blick: Diese Unterrichtseinheit für die Klassen 9 und 10 enthält 2 Lehrerversuche,
Reinstoffe und Stoffgemische, Verfahren zur Stofftrennung
 Schulversuchspraktikum Name: Jana Pfefferle Semester: SoSe 2014 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische, Verfahren zur Stofftrennung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen
Schulversuchspraktikum Name: Jana Pfefferle Semester: SoSe 2014 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische, Verfahren zur Stofftrennung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen
Schulversuchspraktikum. Lars Lichtenberg. Sommersemester Klassenstufen 5 und 6. Einfache Kraftwerke. Kurzprotokoll
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 5 und 6 Einfache Kraftwerke Kurzprotokoll Auf einen Blick: Die Versuche des Kurzprotokolls sind als Schülerversuche vorgesehen.
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 5 und 6 Einfache Kraftwerke Kurzprotokoll Auf einen Blick: Die Versuche des Kurzprotokolls sind als Schülerversuche vorgesehen.
Vom Erz zum Metall (oxidische Erze)
 Schulversuchspraktikum Name: Bastian Engelke Semester: Sommersemester 2012 Klassenstufen 7&8 Vom Erz zum Metall (oxidische Erze) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Das
Schulversuchspraktikum Name: Bastian Engelke Semester: Sommersemester 2012 Klassenstufen 7&8 Vom Erz zum Metall (oxidische Erze) 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Das
1.9 Darstellung und Eigenschaften von schwefliger Säure. Aufgabe. Welche Eigenschaften besitzt schweflige Säure?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757800).9 Darstellung und Eigenschaften von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :43:57 intertess (Version 3.06 B200,
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757800).9 Darstellung und Eigenschaften von schwefliger Säure Experiment von: Phywe Gedruckt: 5.0.203 :43:57 intertess (Version 3.06 B200,
Schulcurriculum Gymnasium Korntal-Münchingen
 Klasse: 8 Seite 1 Minimalanforderungskatalog; Themen des Schuljahres gegliedert nach Arbeitsbereichen m Schulcurriculum Themen, die dem Motto der jeweiligen Klassenstufe entsprechen und den Stoff des s
Klasse: 8 Seite 1 Minimalanforderungskatalog; Themen des Schuljahres gegliedert nach Arbeitsbereichen m Schulcurriculum Themen, die dem Motto der jeweiligen Klassenstufe entsprechen und den Stoff des s
Sicherheitsvorkehrungen im Chemieunterricht
 Thema.: Sicherheitsvorkehrungen im Chemieunterricht Kompetenz: LehramtsanwärterInnen kennen und beachten die grundlegenden gesetzlichen Sicherheitsbestimmungen. die geltenden Sicherheitsbestimmungen: rechtliche
Thema.: Sicherheitsvorkehrungen im Chemieunterricht Kompetenz: LehramtsanwärterInnen kennen und beachten die grundlegenden gesetzlichen Sicherheitsbestimmungen. die geltenden Sicherheitsbestimmungen: rechtliche
Aktivierungsenergie und Katalysatoren
 Schulversuchspraktikum Kristina Breithaupt Sommersemester 2016 Klassenstufen 7/8 Aktivierungsenergie und Katalysatoren 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Schulversuchspraktikum Kristina Breithaupt Sommersemester 2016 Klassenstufen 7/8 Aktivierungsenergie und Katalysatoren 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll
Arbeitsblatt Wasserkreislauf der Erde
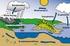 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
1 Beschreibung des Themas und zugehörige Lernziele 1. Schulversuchspraktikum. Till Beuermann. Sommersemester 2013. Klassenstufen 7 & 8.
 1 Beschreibung des Themas und zugehörige Lernziele 1 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 7 & 8 Strom aus Obst 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf
1 Beschreibung des Themas und zugehörige Lernziele 1 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 7 & 8 Strom aus Obst 1 Beschreibung des Themas und zugehörige Lernziele 2 Auf
Korrosion und Korrosionsschutz
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 11 & 12 Korrosion und Korrosionsschutz 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 11 & 12 Korrosion und Korrosionsschutz 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Schulinterne Lehrpläne Naturwissenschaften 7.1 Veränderungen von Stoffen/Chem. Reaktionen (Lehrwerk Prisma Naturwissenschaften 7/8)
 Schulinterne Lehrpläne Naturwissenschaften 7.1 Veränderungen von Stoffen/Chem. Reaktionen (Lehrwerk Prisma Naturwissenschaften 7/8) Unterrichtsvorhaben Kompetenz 1 Kompetenz 2 Methodische VERHALTEN IM
Schulinterne Lehrpläne Naturwissenschaften 7.1 Veränderungen von Stoffen/Chem. Reaktionen (Lehrwerk Prisma Naturwissenschaften 7/8) Unterrichtsvorhaben Kompetenz 1 Kompetenz 2 Methodische VERHALTEN IM
Schulversuchspraktikum. Sommersemester 2014. Klassenstufen 11 & 12. Batterien und Akkus
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Batterien und Akkus Auf einen Blick: In der folgenden Unterrichtseinheit Batterien und Akkus werden Schüler- und Lehrerversuche für die
Schulversuchspraktikum. Michaela Micke. Sommersemester Klassenstufen 9 & 10. Chemie der Kohlenwasserstoffe. Methan & Erdgas
 Schulversuchspraktikum Michaela Micke Sommersemester 2012 Klassenstufen 9 & 10 Chemie der Kohlenwasserstoffe Methan & Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Die vorliegende Unterrichtseinheit für
Schulversuchspraktikum Michaela Micke Sommersemester 2012 Klassenstufen 9 & 10 Chemie der Kohlenwasserstoffe Methan & Erdgas 1 Konzept und Ziele 1 Auf einen Blick: Die vorliegende Unterrichtseinheit für
1 Lehrerversuch Alkalimetalle in Wasser
 1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
3.11 Zerlegung von Wasser durch Reduktionsmittel. Aufgabe. Aus welchen Elementen besteht Wasser?
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P755500) 3. Zerlegung von Wasser durch Reduktionsmittel Experiment von: Seb Gedruckt: 24.03.204 :42:33
Schulversuchspraktikum. Sommersemester Klassenstufen 11 & 12. Chromatografie
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Chromatografie Auf einen Blick: Das Protokoll beschäftigt sich mit dem Thema Chromatografie und insbesondere dem Auftrennen von Blattfarbstoffen.
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 11 & 12 Chromatografie Auf einen Blick: Das Protokoll beschäftigt sich mit dem Thema Chromatografie und insbesondere dem Auftrennen von Blattfarbstoffen.
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm
 Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Curriculum Chemie Klasse 8 Albert-Einstein-Gymnasium Ulm Klasse 8 Themen Experimentieren im Chemieunterricht Grundregeln des Experimentierens 5. - mit Laborgeräten sachgerecht umgehen und die Sicherheitsmaßnahmen
Ch 9.2 Stoffe, Experimente: ein erster Blick in die Chemie
 Katalog Apps für 9 II/III (und auch 8I) Ch 9.2 Stoffe, Experimente: ein erster Blick in die Chemie Allgemeines: Laborgeräte 1. Chemische Laborgeräte: Paare zuordnen 2. Memory Laborgeräte 3. Laborgeräte
Katalog Apps für 9 II/III (und auch 8I) Ch 9.2 Stoffe, Experimente: ein erster Blick in die Chemie Allgemeines: Laborgeräte 1. Chemische Laborgeräte: Paare zuordnen 2. Memory Laborgeräte 3. Laborgeräte
GYMNASIUM ISERNHAGEN. Schulinternes Curriculum 5. Jg. (epochal) Fächerverbindende. Fachspezifische. Thema Kompetenzen Methoden
 Fachbereich CHEMIE GYMNASIUM ISERNHAGEN Schulinternes Curriculum 5. Jg. (epochal) Thema Kompetenzen Methoden Chemische Sachverhalte in der Lebenswelt beschreiben, dass Chemie sie in ihrer Lebenswelt umgibt.
Fachbereich CHEMIE GYMNASIUM ISERNHAGEN Schulinternes Curriculum 5. Jg. (epochal) Thema Kompetenzen Methoden Chemische Sachverhalte in der Lebenswelt beschreiben, dass Chemie sie in ihrer Lebenswelt umgibt.
Welche Elemente außer Kohlenstoff und Wasserstoff können in Polymeren enthalten sein?
 Naturwissenschaften - Chemie - Polymerchemie - Der Polymerbegriff (P78000).2 Polymerbestandteile (2) - Nachweis von Polymerbestandteilen - Beilsteinprobe Experiment von: Seb Gedruckt: 24.03.204 3:09:20
Naturwissenschaften - Chemie - Polymerchemie - Der Polymerbegriff (P78000).2 Polymerbestandteile (2) - Nachweis von Polymerbestandteilen - Beilsteinprobe Experiment von: Seb Gedruckt: 24.03.204 3:09:20
Fragen zum Thema chemische Reaktionen Klasse 4 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion
 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
Schulversuchspraktikum. Sommersemester 2013. Klassenstufen 7 & 8. Katalysatoren
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt, die drei inhaltliche Lernziele verfolgen: Sie zeigen,
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 7 & 8 Katalysatoren 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt, die drei inhaltliche Lernziele verfolgen: Sie zeigen,
!!! Du darfst eine Teilaufgabe von Nr. 2 und zwei der Teilaufgaben von Nr 4 streichen!!!
 1 Klassenarbeit Chemie 1/5 A TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! In der Tabelle links stehende Elemente haben eher die maximale Wertigkeit! In der Tabelle rechts stehende Elemente
1 Klassenarbeit Chemie 1/5 A TIPP alle Rechenaufgaben mit Einheit, Ergebnis und Antwortsatz! In der Tabelle links stehende Elemente haben eher die maximale Wertigkeit! In der Tabelle rechts stehende Elemente
Elektrische Leitfähigkeit; magnetische Eigenschaften
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Elektrische Leitfähigkeit; magnetische Eigenschaften 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Elektrische Leitfähigkeit; magnetische Eigenschaften 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Element. Verbindung. Reinstoff. homogenes Gemisch
 Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
Element Reinstoff, der chemisch nicht mehr zersetzt werden kann dessen Teilchen (Atome oder Moleküle) aus einer einzigen Atomart (gleiche Ordnungszahl) besteht Verbindung = Reinstoff, der sich in Elemente
