INFORMATIONEN FÜR DEN BEHANDELNDEN ARZT
|
|
|
- Thilo Theodor Kaufer
- vor 6 Jahren
- Abrufe
Transkript
1 <Bayer-Logo> Intravitreale Injektionen Empfehlungen für die Behandlung mit EYLEA <EYLEA-Logo> INFORMATIONEN FÜR DEN BEHANDELNDEN ARZT Weitere Informationen und Einzelheiten zu EYLEA entnehmen Sie bitte der Fachinformation. 1
2 VIDEO ZUR INTRAVITREALEN INJEKTION <Beschriftung der Video-CD> Video zur intravitrealen Injektion <EYLEA -Logo> Bayer 2016 Weitere Informationen und Einzelheiten zu EYLEA entnehmen Sie bitte der Fachinformation. 2
3 Inhaltsverzeichnis Diese Empfehlungen für die Behandlung mit EYLEA wurden als Teil der Zulassungsauflagen erstellt. Im Rahmen des Risikomanagement-Plans wurden über die Routinemaßnahmen hinaus zusätzliche risikominimierende Maßnahmen mit der Zulassung des Arzneimittels beauflagt, um das Risiko des Auftretens von schwerwiegenden Nebenwirkungen zu reduzieren und das Nutzen-Risiko-Verhältnis von EYLEA zu erhöhen. Diese Empfehlungen für die Behandlung mit EYLEA sind damit verpflichtender Teil der Zulassung um sicherzustellen, dass Angehörige der Heilberufe, die EYLEA verschreiben und zur Anwendung bringen, sowie Patienten die besonderen Sicherheitsanforderungen kennen und berücksichtigen. Allgemeine Informationen... 4 Anwendungsgebiete... 4 Informationen zum Arzneimittel... 4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung... 4 Dosierungsempfehlungen... 4 Gegenanzeigen... 5 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung... 5 Anweisungen zur Anwendung/Handhabung... 6 Vorbereitung der Injektion... 6 Anweisungen zur Anwendung/Handhabung: Fertigspritze... 7 Anweisungen zur Anwendung/Handhabung: Durchstechflasche... 9 Intravitreale Injektion Nach der Injektion Nebenwirkungen Überdosierung
4 Allgemeine Informationen Vor Beginn der Behandlung ist jedem Patienten, dem EYLEA verschrieben wurde, ein Patienten-Ratgeber einschließlich einer Audio-CD und der Packungsbeilage zur Verfügung zu stellen. Der Arzt ist dafür verantwortlich, dass der Patient diese Unterlagen erhält. Darüber hinaus sollten die Auswirkungen einer anti-vegf-behandlung erläutert werden. Insbesondere sind alle Anzeichen und Symptome von schwerwiegenden Nebenwirkungen und Fälle, in denen medizinische Hilfe benötigt wird, mit dem Patienten zu besprechen. Anwendungsgebiete EYLEA wird angewendet bei Erwachsenen zur Behandlung der neovaskulären (feuchten) altersabhängigen Makuladegeneration (AMD) einer Visusbeeinträchtigung aufgrund eines Makulaödems infolge eines retinalen Venenverschlusses (RVV) (Venenastverschluss [VAV] oder Zentralvenenverschluss [ZVV]) einer Visusbeeinträchtigung aufgrund eines diabetischen Makulaödems (DMÖ) einer Visusbeeinträchtigung aufgrund einer myopen choroidalen Neovaskularisation (mcnv) Informationen zum Arzneimittel Eine Einzeldosis EYLEA entspricht 50 µl (2 mg Aflibercept). Eine Fertigspritze/Durchstechflasche enthält ein entnehmbares Volumen von 90/100 µl. Die Injektion des gesamten Volumens der Fertigspritze oder der Durchstechflasche könnte in einer Überdosierung resultieren. EYLEA ist nur als intravitreale Injektion anzuwenden. Die Lösung ist eine klare, farblose bis blassgelbe und isoosmotische Lösung. Die Lösung sollte vor der Anwendung visuell auf Schwebstoffe und/oder Verfärbung oder jegliche Veränderung der äußeren Erscheinung überprüft werden und ist in diesem Falle zu verwerfen. Die Fertigspritze und Durchstechflasche ist nur für den einmaligen Gebrauch. Eine einzelne Fertigspritze oder Durchstechflasche EYLEA ist nicht für mehrfache Entnahmen, weitere Zubereitung oder Auseinzelung zugelassen. Die Verwendung von mehr als einer Injektion der Fertigspritze oder der Durchstechflasche kann zur Kontamination und nachfolgender Infektion führen. Besondere Vorsichtsmaßnahmen für die Aufbewahrung und Handhabung Im Kühlschrank lagern (2 C 8 C). Nicht einfrieren. Im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. Vor Anwendung kann die ungeöffnete EYLEA -Blisterpackung/Durchstechflasche bis zu 24 Stunden bei Raumtemperatur (unter 25 C) aufbewahrt werden. Handhabung unter aseptischen Bedingungen. Dosierungsempfehlungen Die empfohlene Dosis für EYLEA beträgt 2 mg Aflibercept, entsprechend 50 µl. Bitte beachten Sie, dass sich die Dosierungsempfehlungen für feuchte AMD, RVV (VAV und ZVV), DMÖ und mcnv voneinander unterscheiden. Sie sind im Folgenden beschrieben: 4
5 Feuchte AMD/Diabetisches Makulaödem Die Behandlung mit EYLEA wird o bei feuchter AMD mit drei aufeinanderfolgenden monatlichen Injektionen o beim diabetischen Makulaödem mit fünf aufeinander folgenden monatlichen Injektionen initiiert, gefolgt von einer Injektion alle zwei Monate. Nach den ersten 12 Monaten der Behandlung mit EYLEA kann das Behandlungsintervall basierend auf dem funktionellen und/oder morphologischen Befund entsprechend einem "Treat and Extend" Dosierungsschema angepasst werden. Das Kontrollintervall wird durch den behandelnden Arzt festgelegt. Makulaödem infolge eines retinalen Venenverschlusses (RVV) (Venenastverschluss [VAV] oder Zentralvenenverschluss [ZVV]) Nach der Initialinjektion wird die Behandlung monatlich fortgeführt bis der maximale Visus erreicht ist und/oder keine Anzeichen von Krankheitsaktivität mehr zu erkennen sind. Der Abstand zwischen zwei Dosierungen sollte nicht kürzer als ein Monat sein. Wenn der funktionelle und morphologische Befund darauf hinweisen, dass der Patient nicht von einer weiteren Behandlung profitiert, sollte die Behandlung mit EYLEA beendet werden. Unter Aufrechterhaltung des funktionellen und/oder morphologischen Befundes kann das Behandlungsintervall entsprechend einem "Treat and Extend"-Schema schrittweise verlängert werden. Wenn sich der funktionelle und/oder morphologische Befund verschlechtert, sollte das Behandlungsintervall entsprechend verkürzt werden. Myope choroidale Neovaskularisation Die Behandlung mit EYLEA wird als einmalige Injektion durchgeführt. Wenn der funktionelle und/oder morphologische Befund darauf hinweisen, dass die Erkrankung weiterhin besteht, können weitere Injektionen erfolgen. Ein wiederholtes Auftreten sollte als erneute Manifestation der Krankheit behandelt werden. Das Kontrollintervall sollte durch den behandelnden Arzt festgesetzt werden. Der Abstand zwischen zwei Injektionen sollte nicht kürzer als ein Monat sein. Gegenanzeigen Überempfindlichkeit gegen Aflibercept oder einen der in Abschnitt 6.1 der Fachinformation genannten sonstigen Bestandteile. Bestehende oder vermutete okulare oder periokulare Infektion. Bestehende schwere intraokulare Entzündung. Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Durch die intravitreale Injektion bedingte Reaktionen Intravitreale Injektionen, einschließlich solcher mit EYLEA, können zu einer Endophthalmitis, intraokularer Entzündung, rhegmatogener Netzhautablösung, Einriss der Netzhaut oder iatrogener traumatischer Katarakt führen. Bei der Anwendung von EYLEA sind immer angemessene aseptische Injektionsmethoden anzuwenden. Des Weiteren sollten die Patienten innerhalb der ersten Woche nach der Injektion überwacht werden, um im Falle einer Infektion eine frühzeitige Behandlung zu ermöglichen. Die Patienten sollten angewiesen werden, unverzüglich alle Symptome zu melden, die auf eine Endophthalmitis oder auf eines der oben genannten Ereignisse hinweisen. Ein Ansteigen des Augeninnendrucks wurde innerhalb von 60 Minuten nach intravitrealen Injektionen, einschließlich derer mit EYLEA, beobachtet. Besondere Vorsicht ist bei Patienten 5
6 mit einem schlecht eingestellten Glaukom geboten (EYLEA darf nicht injiziert werden, solange der Augeninnendruck bei 30 mmhg liegt). In allen Fällen müssen daher sowohl der Augeninnendruck als auch die Perfusion des Sehnervenkopfes überwacht und bei Bedarf angemessen behandelt werden. Immunogenität Da EYLEA ein therapeutisches Protein ist, besteht die Möglichkeit einer Immunogenität. Patienten sollen dazu angehalten werden, alle Anzeichen oder Symptome einer intraokularen Entzündung, z. B. Schmerzen, Photophobie oder Rötung, zu berichten, da diese klinische Anzeichen einer Überempfindlichkeit sein könnten. Systemische Effekte Systemische Nebenwirkungen inklusive nicht-okularer Hämorrhagien und arterieller thromboembolischer Ereignisse wurden nach intravitrealer Injektion von VEGF-Hemmern berichtet. Es besteht ein theoretisches Risiko, dass diese in Zusammenhang mit der VEGF- Hemmung stehen können. Es gibt begrenzte Daten zur Sicherheit bei der Behandlung von Patienten mit RVV (VAV und ZVV), DMÖ oder mcnv, die innerhalb der letzten 6 Monate einen Schlaganfall oder transitorische ischämische Attacken oder einen Myokardinfarkt in der Vorgeschichte hatten. Die Behandlung entsprechender Patienten sollte mit Umsicht erfolgen. Weitere Angaben Wie bei anderen intravitrealen anti-vegf-behandlungen einer AMD, eines RVV (VAV und ZVV), einer DMÖ und einer mcnv gilt auch Folgendes: Vorsicht ist geboten bei Patienten mit großflächigen und/oder hohen Abhebungen des retinalen Pigmentepithels, da diese Risikofaktoren für das Auftreten von retinalen Pigmentepitheleinrissen sind. Aussetzen der Therapie bei - rhegmatogener Netzhautablösung, - Makulalöchern Grad 3 oder 4, - Netzhauteinriss (bis der Riss adäquat verheilt ist), - Verminderung der Sehschärfe um 30 Buchstaben, - subretinaler Blutung mit fovealer Beteiligung oder Ausdehnung 50 % der betroffenen Läsion, - 28 Tage vor oder nach einem durchgeführten oder geplanten intraokularen Eingriff. EYLEA sollte während der Schwangerschaft nicht verabreicht werden, es sei denn der mögliche Nutzen überwiegt das potenzielle Risiko für den Fetus. Frauen im gebärfähigen Alter müssen während der Behandlung und für mindestens 3 Monate nach der letzten intravitrealen Injektion von Aflibercept eine zuverlässige Verhütungsmethode anwenden. Anweisungen zur Anwendung/Handhabung Vorbereitung der Injektion Intravitreale Injektionen sind entsprechend medizinischer Standards und geltenden Richtlinien nur von einem qualifizierten Arzt mit Erfahrung in der Durchführung intravitrealer Injektionen durchzuführen. Generell müssen eine adäquate Anästhesie und Asepsis, einschließlich des Einsatzes eines topischen Breitbandmikrobizids gewährleistet werden. Die chirurgische Händedesinfektion, sterile Handschuhe, ein steriles Abdecktuch und ein steriler Lidsperrer (oder ein vergleichbares Instrument) werden empfohlen. Für die intravitreale Injektion ist eine 30 G x 1 / 2 Zoll Injektionsnadel zu verwenden. 6
7 Anweisungen zur Anwendung/Handhabung: Fertigspritze 1 Erst vor der Anwendung von EYLEA den Umkarton öffnen und die sterile Blisterpackung entnehmen. Die Blisterpackung vorsichtig öffnen, so dass der Inhalt weiterhin steril bleibt. Die Spritze bis zum weiteren Gebrauch in der sterilen Ablage liegen lassen. 2 Unter sterilen Bedingungen die Spritze aus der sterilen Blisterpackung nehmen und die Kappe der Spritze entfernen. Die Kappe der Spritze muss abgebrochen werden (nicht drehen oder abschrauben). 3 Um die Sterilität des Arzneimittels nicht zu gefährden, darf der Spritzenkolben nicht herausgezogen werden. 4 Unter sterilen Bedingungen die Injektionsnadel fest auf die Spitze des Luer-Lock-Adapters aufschrauben. 5 Eine Fertigspritze enthält 90 µl, entsprechend 3,6 mg Aflibercept. Diese Menge reicht aus, um eine Einzeldosis von 50 µl, in denen 2 mg Aflibercept enthalten sind, anzuwenden. Das entnehmbare Volumen der Spritze (90 µl) darf nicht vollständig genutzt werden. Die überschüssige Menge ist vor der Injektion zu verwerfen. 6 Die Spritze mit der Nadel nach oben halten und auf Bläschen hin prüfen. Wenn Bläschen zu sehen sind, leicht mit dem Finger gegen die Spritze klopfen, bis die Bläschen nach oben steigen. 7
8 7 Um alle Bläschen und überschüssiges Arzneimittel zu entfernen, den Spritzenkolben langsam soweit eindrücken, bis die runde Grundfläche der kuppelförmigen Kolbenspitze auf derselben Höhe ist wie die schwarze Dosierungslinie der Spritze (entspricht 50 µl). Um eine Überdosierung zu vermeiden, muss vor der Injektion von EYLEA die überschüssige Menge verworfen werden. 8 Fertigspritze nur für den einmaligen Gebrauch. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen. 8
9 Anweisungen zur Anwendung/Handhabung: Durchstechflasche 1 Die Kunststoffkappe entfernen und den Gummistopfen der Durchstechflasche von außen desinfizieren. 2 Die 18 G, 5 Mikron-Filternadel, die dem Umkarton beiliegt, an einer mit einem Luer- Lock-Adapter ausgestatteten sterilen 1-ml- Spritze befestigen. 3 Die Filternadel durch die Mitte des Stopfens der Durchstechflasche stechen, bis die Nadel vollständig in die Durchstechflasche eingeführt ist und die Spitze den Boden oder die Unterkante der Durchstechflasche berührt. 4 Unter sterilen Bedingungen den gesamten Inhalt der EYLEA -Durchstechflasche in die Spritze aufnehmen, indem die Durchstechflasche aufrecht in einer leicht geneigten Position gehalten wird, um das vollständige Entleeren zu erleichtern. Um das Aufziehen von Luft zu verhindern, sollte darauf geachtet werden, dass die abgeschrägte Kante der Filternadel in die Lösung eintaucht. Um dies auch während der Entnahme zu gewährleisten, ist die Durchstechflasche schräg zu halten. 5 Eine Durchstechflasche enthält ein entnehmbares Volumen von 100 µl, entsprechend 4 mg Aflibercept. Diese Menge reicht aus, um eine Einzeldosis von 50 µl, in denen 2 mg Aflibercept enthalten sind, anzuwenden. Das entnehmbare Volumen der Durchstechflasche (100 µl) darf nicht vollständig genutzt werden. Die überschüssige Menge ist vor der Injektion zu verwerfen. Lösung abgeschrägte Kante der Filternadel zeigt nach unten 9
10 6 Bitte beachten, dass der Spritzenkolben beim Entleeren der Durchstechflasche ausreichend zurückgezogen wird, damit auch die Filternadel vollständig entleert wird. 7 Die Filternadel entfernen und diese vorschriftsmäßig entsorgen. Hinweis: Die Filternadel darf nicht für die intravitreale Injektion verwendet werden. 8 Unter sterilen Bedingungen eine 30 G x 1 / 2 Zoll Injektionsnadel fest auf die Luer-Lock-Spitze der Spritze aufschrauben. 9 Die Spritze mit der Nadel nach oben halten und auf Bläschen hin prüfen. Wenn Bläschen zu sehen sind, leicht mit dem Finger gegen die Spritze klopfen, bis die Bläschen nach oben steigen. 10
11 10 Um alle Bläschen und überschüssiges Arzneimittel zu entfernen, den Spritzenkolben langsam soweit eindrücken, bis die Kolbenspitze auf derselben Höhe wie die 0,05 ml-linie der Spritze liegt. 11 Durchstechflasche nur für den einmaligen Gebrauch. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen. 11
12 Intravitreale Injektion Anwendung topischer Antibiotika gemäß lokaler und nationaler Richtlinien. 1 Topisches Anästhetikum anwenden. 2 Desinfektionsmittel (z. B. 5 % Povidon-Iod-Lösung) auf das Augenlid und die Augenlidränder auftragen und in den Bindehautsack einträufeln. 3 Desinfektionsmittel (z. B. 10 % Povidon-Iod-Lösung) auf die periokulare Haut, die Augenlider und Wimpern auftragen, ohne zu starken Druck auf die Augenliddrüsen auszuüben. 4 Gesicht mit einem sterilen Abdecktuch bedecken und sterilen Lidsperrer einsetzen. 5 Den Patienten bitten, von der Injektionsstelle weg zu schauen. Das Auge entsprechend positionieren. Eine Injektionsstelle in einem Bereich von 3,5 bis 4,0 mm posterior zum Limbus markieren. 6 Die Injektionskanüle in den Glaskörperraum einbringen, dabei sollte der horizontale Meridian vermieden und in Richtung Bulbusmitte gezielt werden. Danach sollte das Injektionsvolumen von 0,05 ml injiziert werden; nachfolgende Injektionen sollten nicht an derselben skleralen Einstichstelle erfolgen. Weitere Informationen zur intravitrealen Injektion entnehmen Sie bitte: Empfehlung der Deutschen Ophthalmologischen Gesellschaft, der Retinologischen Gesellschaft und des Berufsverbandes der Augenärzte Deutschlands für die Durchführung von intravitrealen Injektionen (IVI), Stand April 2007 Stellungnahme der Deutschen Ophthalmologischen Gesellschaft, der Retinologischen Gesellschaft und des Berufsverbandes der Augenärzte Deutschlands. Endophthalmitis- Prophylaxe bei intravitrealer operativer Medikamenteneingabe (IVOM), Stand September 2013 Video zur intravitrealen Injektion 12
13 Nach der Injektion Unmittelbar das Sehvermögen des Patienten überprüfen (Handbewegungen oder Fingerzählen). Unmittelbar den Augeninnendruck und die Perfusion des Sehnervenkopfes überwachen und angemessen behandeln. Für den Bedarfsfall sollte steriles Besteck zur Durchführung einer Parazentese zur Verfügung stehen. Patienten sollten instruiert werden, unverzüglich alle Symptome zu melden, die auf eine schwerwiegende Nebenwirkung, insbesondere auf eine Endophthalmitis, hinweisen (z. B. Augenschmerzen, Augenrötung, Photophobie, verschwommenes Sehen). Bitte berücksichtigen Sie, dass einige Augenarztverbände nach intravitrealen Injektionen die Anwendung von antibiotischen Augentropfen empfehlen. Bitte informieren Sie Ihre Patienten, dass bei ihnen folgende Symptome auftreten könnten: - Bindehautblutung - Glaskörpertrübungen - Augenschmerzen Im Allgemeinen bilden sich diese Beschwerden in ein paar Tagen nach der Injektion von selbst zurück. Weisen Sie bitte Ihre Patienten an, sich in ärztliche Behandlung zu begeben, falls diese Beschwerden nicht innerhalb von ein paar Tagen verschwinden oder sich verschlimmern. Nebenwirkungen Eine vollständige Auflistung der Nebenwirkungen ist der beiliegenden Fachinformation zu entnehmen. Die häufigsten Nebenwirkungen bei der Behandlung mit EYLEA sind: Bindehautblutung verminderte Sehschärfe Augenschmerzen erhöhter Augeninnendruck Glaskörperabhebung Glaskörpertrübungen Katarakt Es besteht die Möglichkeit, dass u. a. folgende schwerwiegende Nebenwirkungen im Rahmen der intravitrealen Therapie auftreten: Erblindung Endophthalmitis (Augenschmerzen oder stärkere Beschwerden, vermehrte Augenrötung, Photophobie, Schwellungen, Veränderungen des Sehvermögens, wie plötzliche Abnahme des Sehvermögens oder verschwommenes Sehen) Netzhautablösung, -einriss (plötzliche Lichtblitze, plötzliches Auftauchen/vermehrte Anzahl von sich bewegenden Punkten, Vorhang über einem Teil des Gesichtsfeldes, Veränderungen des Sehvermögens) Katarakt und traumatische Katarakt (Verschwommensehen, vermehrte Blendeffekte, veränderte Farbwahrnehmung) Glaskörperblutung Glaskörperabhebung Anstieg des Augeninnendrucks 13
14 Weisen Sie Ihre Patienten an, unverzüglich alle Symptome zu melden, die auf schwerwiegende Nebenwirkungen hinweisen. Stellen Sie sicher, dass Ihren Patienten im Fall von Nebenwirkungen sofort ein Augenarzt zur Verfügung steht. Geeignete Maßnahmen und Behandlungen aller Nebenwirkungen sollten gemäß der gängigen klinischen Praxis erfolgen. Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8 der Fachinformation. Überdosierung Bei einer Überdosierung mit einem größeren Injektionsvolumen als üblich kann es zu einem Anstieg des Augeninnendrucks kommen. Daher sollten im Fall einer Überdosierung der Augeninnendruck überwacht und geeignete Maßnahmen eingeleitet werden. NOTIZEN Für weitere Informationen zu EYLEA besuchen Sie bitte auch die Internetseite < <Bayer-Logo> Bayer 14
Intravitreale Injektionen Empfehlungen für die Behandlung mit EYLEA
 ARZT Intravitreale Injektionen Empfehlungen für die Behandlung mit EYLEA Informationen für den behandelnden Arzt Weitere Informationen und Einzelheiten zu EYLEA entnehmen Sie bitte der Fachinformation.
ARZT Intravitreale Injektionen Empfehlungen für die Behandlung mit EYLEA Informationen für den behandelnden Arzt Weitere Informationen und Einzelheiten zu EYLEA entnehmen Sie bitte der Fachinformation.
PATIENT. Patienten-Ratgeber für die Behandlung mit EYLEA. (Aflibercept Injektionslösung)
 PATIENT Patienten-Ratgeber für die Behandlung mit EYLEA (Aflibercept Injektionslösung) Lesen Sie sich bitte vor Beginn Ihrer Behandlung mit EYLEA das gesamte Informationsmaterial, einschließlich der beiliegenden
PATIENT Patienten-Ratgeber für die Behandlung mit EYLEA (Aflibercept Injektionslösung) Lesen Sie sich bitte vor Beginn Ihrer Behandlung mit EYLEA das gesamte Informationsmaterial, einschließlich der beiliegenden
Gebrauchsinformation: Information für Patienten. Eylea 40 mg/ml Injektionslösung in einer Durchstechflasche Aflibercept
 Gebrauchsinformation: Information für Patienten Eylea 40 mg/ml Injektionslösung in einer Durchstechflasche Aflibercept Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine
Gebrauchsinformation: Information für Patienten Eylea 40 mg/ml Injektionslösung in einer Durchstechflasche Aflibercept Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine
Patienten-Ratgeber für die Behandlung der feuchten altersbedingten Makuladegeneration mit EYLEA. (Afl ibercept Injektionslösung)
 Patienten-Ratgeber für die Behandlung der feuchten altersbedingten Makuladegeneration mit EYLEA (Afl ibercept Injektionslösung) P Lesen Sie sich bitte vor Beginn Ihrer Behandlung mit EYLEA das gesamte
Patienten-Ratgeber für die Behandlung der feuchten altersbedingten Makuladegeneration mit EYLEA (Afl ibercept Injektionslösung) P Lesen Sie sich bitte vor Beginn Ihrer Behandlung mit EYLEA das gesamte
EYLEA 40 MG/ML. Injektionslösung. aflibercept PATIENTEN- INFORMATIONSPAKET
 Die europäischen Gesundheitsbehörden haben das Inverkehrbringen des Arzneimittels Eylea mit bestimmten Auflagen verbunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien und Luxemburg, zu dem
Die europäischen Gesundheitsbehörden haben das Inverkehrbringen des Arzneimittels Eylea mit bestimmten Auflagen verbunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien und Luxemburg, zu dem
Rekonstitution und Verabreichung von Cinryze (C1-Inhibitor [vom Menschen]) Hinweise für Ärzte und medizinisches Fachpersonal
![Rekonstitution und Verabreichung von Cinryze (C1-Inhibitor [vom Menschen]) Hinweise für Ärzte und medizinisches Fachpersonal Rekonstitution und Verabreichung von Cinryze (C1-Inhibitor [vom Menschen]) Hinweise für Ärzte und medizinisches Fachpersonal](/thumbs/67/57052806.jpg) Rekonstitution und Verabreichung von Cinryze (C1-Inhibitor [vom Menschen]) Hinweise für Ärzte und medizinisches Fachpersonal Diese Informationen werden Ihnen von der Shire Deutschland GmbH zur Verfügung
Rekonstitution und Verabreichung von Cinryze (C1-Inhibitor [vom Menschen]) Hinweise für Ärzte und medizinisches Fachpersonal Diese Informationen werden Ihnen von der Shire Deutschland GmbH zur Verfügung
Gebrauchsinformation: Information für Patienten. Lucentis 10 mg/ml Injektionslösung in einer Fertigspritze Ranibizumab
 Gebrauchsinformation: Information für Patienten Lucentis 10 mg/ml Injektionslösung in einer Fertigspritze Ranibizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit dem Arzneimittel
Gebrauchsinformation: Information für Patienten Lucentis 10 mg/ml Injektionslösung in einer Fertigspritze Ranibizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit dem Arzneimittel
Gebrauchsinformation: Information für Patienten. Lucentis 10 mg/ml Injektionslösung in einer Fertigspritze Ranibizumab
 Gebrauchsinformation: Information für Patienten Lucentis 10 mg/ml Injektionslösung in einer Fertigspritze Ranibizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit dem Arzneimittel
Gebrauchsinformation: Information für Patienten Lucentis 10 mg/ml Injektionslösung in einer Fertigspritze Ranibizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit dem Arzneimittel
Lucentis 10 mg/ml Injektionslösung
 Gebrauchsinformation: Information für Patienten Lucentis 10 mg/ml Injektionslösung Ranibizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit dem Arzneimittel behandelt werden, denn
Gebrauchsinformation: Information für Patienten Lucentis 10 mg/ml Injektionslösung Ranibizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit dem Arzneimittel behandelt werden, denn
weitere Störungen des Sehvermögens, die auf eine choroidale Neovaskularisation zurückzuführen sind;
 EMA/704742/2016 EMEA/H/C/000715 Zusammenfassung des EPAR für die Öffentlichkeit Ranibizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/704742/2016 EMEA/H/C/000715 Zusammenfassung des EPAR für die Öffentlichkeit Ranibizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU CHMP empfiehlt
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU CHMP empfiehlt
EINE INFORMATION FÜR PATIENTEN ÜBER DIE BEHANDLUNG MIT OZURDEX
 Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels OZURDEX Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels OZURDEX Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
Gebrauchsinformation: Information für Anwender. Euphrasia D3 Augentropfen Weleda
 1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN
 MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
OZURDEX Leitfaden für den injizierenden Augenarzt (Dexamethason intravitreales Implantat) 0,7 mg
 Dieser Leitfaden zur Anwendung von Ozurdex mit dem Wirkstoff Dexamethason wurde als Teil der Zulassungsauflagen für die sichere Anwendung des Arzneimittels erstellt und mit der Bundesbehörde abgestimmt.
Dieser Leitfaden zur Anwendung von Ozurdex mit dem Wirkstoff Dexamethason wurde als Teil der Zulassungsauflagen für die sichere Anwendung des Arzneimittels erstellt und mit der Bundesbehörde abgestimmt.
Gebrauchsinformation: Information für Anwender. Cineraria maritima D3 Augentropfen Weleda. Wirkstoff: Senecio cineraria (Cineraria maritima) D3
 1/5 Gebrauchsinformation: Information für Anwender Cineraria maritima D3 Augentropfen Weleda Wirkstoff: Senecio cineraria (Cineraria maritima) D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
1/5 Gebrauchsinformation: Information für Anwender Cineraria maritima D3 Augentropfen Weleda Wirkstoff: Senecio cineraria (Cineraria maritima) D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
SELBSTINJEKTIONS-TAGEBUCH Zur Unterstützung der Anwendung von Nplate zu Hause
 SELBSTINJEKTIONS-TAGEBUCH Zur Unterstützung der zu Hause Ihr Arzt soll Ihre aktuelle Dosis auf der Vorderseite dieses Selbstinjektions-ebuchs notieren. Ihr Arzt soll den Namen eines Ansprechpartners im
SELBSTINJEKTIONS-TAGEBUCH Zur Unterstützung der zu Hause Ihr Arzt soll Ihre aktuelle Dosis auf der Vorderseite dieses Selbstinjektions-ebuchs notieren. Ihr Arzt soll den Namen eines Ansprechpartners im
HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN
 HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN Dieses Informationsmaterial zur Anwendung von Tenofovirdisoproxil wurde als Teil der Zulassungsauflagen
HINWEISE FÜR MEDIZINISCHES FACHPERSONAL ZUR ANWENDUNG VON TENOFOVIRDISOPROXIL BEI HIV-INFIZIERTEN JUGENDLICHEN Dieses Informationsmaterial zur Anwendung von Tenofovirdisoproxil wurde als Teil der Zulassungsauflagen
Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn. Ophthalmologische Fortbildung für medizinische Fachangestellte 25.
 Neuigkeiten aus der IVOM-Sprechstunde Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn Ophthalmologische Fortbildung für medizinische Fachangestellte 25. März 2015 Altersabhängige
Neuigkeiten aus der IVOM-Sprechstunde Priv.-Doz. Dr. med. Monika Fleckenstein Universitäts-Augenklinik Bonn Ophthalmologische Fortbildung für medizinische Fachangestellte 25. März 2015 Altersabhängige
Behandlung der feuchten altersabhängigen Makuladegeneration (feuchte AMD) mit VEGF-Hemmern durch operative Medikamenteneingabe in das Auge
 Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
Augenarztpraxis AltenKirchen Dr. med. Thomas Wehler Facharzt für Augenheilkunde Wilhelmstr. 32 Schlossweg 2 57610 Altenkirchen Tel 02681-1651 Fax 02681-6094 Mail info@ak-augenarzt.de Net www.ak-augenarzt.de
Lucentis 10 mg/ml Injektionslösung
 Gebrauchsinformation: Information für Patienten Lucentis 10 mg/ml Injektionslösung Ranibizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit dem Arzneimittel behandelt werden, denn
Gebrauchsinformation: Information für Patienten Lucentis 10 mg/ml Injektionslösung Ranibizumab Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit dem Arzneimittel behandelt werden, denn
des beeinträchtigten Sehvermögens aufgrund eines durch Diabetes verursachten Makulaödems;
 EMA/677928/2015 EMEA/H/C/002392 Zusammenfassung des EPAR für die Öffentlichkeit Aflibercept Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/677928/2015 EMEA/H/C/002392 Zusammenfassung des EPAR für die Öffentlichkeit Aflibercept Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Gebrauchsinformation: Information für Anwender. Euphrasia D3 Augentropfen Weleda
 1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia officinalis D3 Dilution Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia officinalis D3 Dilution Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON LIVOCAB DIREKT AUGENTROPFEN BEACHTEN?
 Gebrauchsinformation: Information für den Anwender Livocab direkt Augentropfen 0,05 % Augentropfen, Suspension Zur Anwendung bei Kindern ab 1 Jahr, Jugendlichen und Erwachsenen Wirkstoff: Levocabastin
Gebrauchsinformation: Information für den Anwender Livocab direkt Augentropfen 0,05 % Augentropfen, Suspension Zur Anwendung bei Kindern ab 1 Jahr, Jugendlichen und Erwachsenen Wirkstoff: Levocabastin
1 Was ist Jetrea und wofür wird es angewendet?
 Gebrauchsinformation: Information für Patienten JETREA 0,5 mg/0,2 ml Ocriplasmin Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse
Gebrauchsinformation: Information für Patienten JETREA 0,5 mg/0,2 ml Ocriplasmin Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. AQUA STEROP AQUA STEROP FLEXO Lösungsmittel zur Herstellung von Parenteralia. Wasser zur Injektion
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AQUA STEROP AQUA STEROP FLEXO Lösungsmittel zur Herstellung von Parenteralia Wasser zur Injektion Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AQUA STEROP AQUA STEROP FLEXO Lösungsmittel zur Herstellung von Parenteralia Wasser zur Injektion Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion bei der feuchten altersbedingen Makuladegeneration (AMD)
 Patientendaten Arzt-/Klinikstempel Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion bei der feuchten altersbedingen Makuladegeneration (AMD) Die feuchte altersbedingte Makuladegeneration
Patientendaten Arzt-/Klinikstempel Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion bei der feuchten altersbedingen Makuladegeneration (AMD) Die feuchte altersbedingte Makuladegeneration
Anwendung von Bortezomib 3,5 mg nach Zubereitung: Subkutane oder intravenöse Injektion
 Wichtige sicherheitsrelevante Informationen zur Rekonstitution, Dosierung und Applikation/Anwendung für medizinische Fachkreise Anwendung von Bortezomib 3,5 mg nach Zubereitung: Subkutane oder intravenöse
Wichtige sicherheitsrelevante Informationen zur Rekonstitution, Dosierung und Applikation/Anwendung für medizinische Fachkreise Anwendung von Bortezomib 3,5 mg nach Zubereitung: Subkutane oder intravenöse
Gebrauchsinformation: Information für Patienten. Antiallergische Augentropfen Similasan Apis mellifica D 6, Euphrasia 3c D6, Sabadilla D 6.
 1 Gebrauchsinformation: Information für Patienten Antiallergische Augentropfen Similasan Apis mellifica D 6, Euphrasia 3c D6, Sabadilla D 6. Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
1 Gebrauchsinformation: Information für Patienten Antiallergische Augentropfen Similasan Apis mellifica D 6, Euphrasia 3c D6, Sabadilla D 6. Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen
 Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
WAS SIE ÜBER RIXATHON (RITUXIMAB) WISSEN SOLLTEN
 WAS SIE ÜBER RIXATHON (RITUXIMAB) WISSEN SOLLTEN WICHTIGE SICHERHEITSINFORMATIONEN FÜR PATIENTEN, DIE MIT RIXATHON BEHANDELT WERDEN Dieses Informationsmaterial zur Anwendung von Rixathon (Rituximab) wurde
WAS SIE ÜBER RIXATHON (RITUXIMAB) WISSEN SOLLTEN WICHTIGE SICHERHEITSINFORMATIONEN FÜR PATIENTEN, DIE MIT RIXATHON BEHANDELT WERDEN Dieses Informationsmaterial zur Anwendung von Rixathon (Rituximab) wurde
Übersicht der Verträge zur der intravitrealen operativen Medikamentenapplikation (IVOM) Stand:
 Übersicht der Verträge zur der intravitrealen operativen Medikamentenapplikation (IVOM) Stand: 01.09.2017 Wichtiger Hinweis: Für Krankenkassen, die nicht in dieser Kurzübersicht aufgeführt sind und somit
Übersicht der Verträge zur der intravitrealen operativen Medikamentenapplikation (IVOM) Stand: 01.09.2017 Wichtiger Hinweis: Für Krankenkassen, die nicht in dieser Kurzübersicht aufgeführt sind und somit
Gebrauchsinformation: Information für Patienten. Antiallergische Augentropfen Similasan Apis mellifica D 6, Euphrasia 3c D6, Sabadilla D 6.
 1 Gebrauchsinformation: Information für Patienten Antiallergische Augentropfen Similasan Apis mellifica D 6, Euphrasia 3c D6, Sabadilla D 6. Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
1 Gebrauchsinformation: Information für Patienten Antiallergische Augentropfen Similasan Apis mellifica D 6, Euphrasia 3c D6, Sabadilla D 6. Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
Heilsame Injektionen für das Auge Wie bringt man Medikamente sicher ins Innere des Augapfels? Wenn Augenärzte Augenleiden mit Medikamenten behandeln,
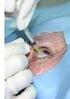 Augenärzte informieren: Intravitreale Injektion Operative Medikamenteneingabe in das Auge Berufsverband der Augenärzte Deutschlands e.v. (BVA) Deutsche Ophthalmologische Gesellschaft (DOG) Heilsame Injektionen
Augenärzte informieren: Intravitreale Injektion Operative Medikamenteneingabe in das Auge Berufsverband der Augenärzte Deutschlands e.v. (BVA) Deutsche Ophthalmologische Gesellschaft (DOG) Heilsame Injektionen
Gebrauchsinformation: Information für Patienten. Trobicin 2 g Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Spectinomycin
 Gebrauchsinformation: Information für Patienten Trobicin 2 g Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Spectinomycin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Gebrauchsinformation: Information für Patienten Trobicin 2 g Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Spectinomycin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab)
 Behördlich genehmigtes Schulungsmaterial Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Diese Patientenbroschüre zur Anwendung von Ipilimumab wurde als Teil der
Behördlich genehmigtes Schulungsmaterial Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Diese Patientenbroschüre zur Anwendung von Ipilimumab wurde als Teil der
Wortlaut der für die Packungsbeilage vorgesehenen Angaben. Gebrauchsinformation: Information für den Anwender
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben. Gebrauchsinformation: Information für den Anwender Floxal EDO 1 ml Augentropfen enthält 3 mg Ofloxacin Lesen Sie die gesamte Packungsbeilage sorgfältig
Wortlaut der für die Packungsbeilage vorgesehenen Angaben. Gebrauchsinformation: Information für den Anwender Floxal EDO 1 ml Augentropfen enthält 3 mg Ofloxacin Lesen Sie die gesamte Packungsbeilage sorgfältig
Intravitreale Injektionen OCT-Workshop 7. Hands-on Training am menschlichen Auge
 advanced phthalmic trainings Intravitreale Injektionen OCT-Workshop 7. Hands-on Training am menschlichen Auge 18. November 2016, AKH Wien Au Unterstützt von: Patronanz: Prim. Univ.-Prof. Dr. Ursula Schmidt-Erfurth
advanced phthalmic trainings Intravitreale Injektionen OCT-Workshop 7. Hands-on Training am menschlichen Auge 18. November 2016, AKH Wien Au Unterstützt von: Patronanz: Prim. Univ.-Prof. Dr. Ursula Schmidt-Erfurth
BAnz AT 04.04.2014 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Gebrauchsinformation: Information für den Anwender. Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium
 Gebrauchsinformation: Information für den Anwender Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem Antigenhalt)
 Zusammenfassung der Merkmale des Arzneimittels 1 Bezeichnung des Arzneimittels Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem
Zusammenfassung der Merkmale des Arzneimittels 1 Bezeichnung des Arzneimittels Td-IMMUN, Injektionssuspension, Einzeldosis-Fertigspritze. Diphtherie- und Tetanus-Impfstoff (adsorbiert, mit reduziertem
LUCENTIS. bei Visusbeeinträchtigung infolge eines Makulaödems aufgrund eines retinalen Venenverschlusses (RVV)
 LUCENTIS bei Visusbeeinträchtigung infolge eines Makulaödems aufgrund eines retinalen Venenverschlusses (RVV) Ihr Leitfaden für die Behandlung mit LUCENTIS Kapitel 1 Über LUCENTIS Die vorliegende Broschüre
LUCENTIS bei Visusbeeinträchtigung infolge eines Makulaödems aufgrund eines retinalen Venenverschlusses (RVV) Ihr Leitfaden für die Behandlung mit LUCENTIS Kapitel 1 Über LUCENTIS Die vorliegende Broschüre
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Nux vomica-homaccord -Tropfen
 1/5 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Nux vomica-homaccord -Tropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn
1/5 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Nux vomica-homaccord -Tropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn
Anhang III. Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Behandlung des Sehschärfenverlustes infolge eines diabetischen Makulaödems in der EU
 Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehsc Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehsc Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Gebrauchsinformation: Information für Patienten. Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12
 Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Multiresistente Tuberkulose Ein Leitfaden mit wichtigen Informationen über Ihre Krankheit und Ihre Behandlung mit Deltyba (Delamanid)
 Information für Patienten Multiresistente Tuberkulose Ein Leitfaden mit wichtigen Informationen über Ihre Krankheit und Ihre Behandlung mit Deltyba (Delamanid) Dieses Arzneimittel unterliegt einer zusätzlichen
Information für Patienten Multiresistente Tuberkulose Ein Leitfaden mit wichtigen Informationen über Ihre Krankheit und Ihre Behandlung mit Deltyba (Delamanid) Dieses Arzneimittel unterliegt einer zusätzlichen
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben
 Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben GEBRAUCHSINFORMATION: Information für den Anwender Floxal 3 mg/ml Augentropfen Wirkstoff: Ofloxacin Lesen Sie die gesamte Packungsbeilage
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben GEBRAUCHSINFORMATION: Information für den Anwender Floxal 3 mg/ml Augentropfen Wirkstoff: Ofloxacin Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Patienten
 1 Gebrauchsinformation: Information für Patienten Überanstrengte Augen Augentropfen Similasan Wirkstoffe: Senecio cineraria D6, Natrium chloratum D6, Ruta graveolens D6. Lesen Sie die gesamte Packungsbeilage
1 Gebrauchsinformation: Information für Patienten Überanstrengte Augen Augentropfen Similasan Wirkstoffe: Senecio cineraria D6, Natrium chloratum D6, Ruta graveolens D6. Lesen Sie die gesamte Packungsbeilage
Wichtige sicherheitsrelevante Infor mationen für Patienten für die Behandlung mit LUCENTIS (Ranibizumab)
 Wichtige sicherheitsrelevante Infor mationen für Patienten für die Behandlung mit LUCENTIS (Ranibizumab) Die vorliegende Broschüre vermittelt Ihnen wichtige Informationen über die Behandlung mit diesem
Wichtige sicherheitsrelevante Infor mationen für Patienten für die Behandlung mit LUCENTIS (Ranibizumab) Die vorliegende Broschüre vermittelt Ihnen wichtige Informationen über die Behandlung mit diesem
Gebrauchsinformation: Information für Patienten. Antiallergische Augentropfen Similasan Monodosen
 Gebrauchsinformation: Information für Patienten Antiallergische Augentropfen Similasan Monodosen Wirkstoffe: Apis mellifica D6, Euphrasia 3c D6, Schoenocaulon officinale D6 Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Patienten Antiallergische Augentropfen Similasan Monodosen Wirkstoffe: Apis mellifica D6, Euphrasia 3c D6, Schoenocaulon officinale D6 Lesen Sie die gesamte Packungsbeilage
PACKUNGSBEILAGE Carprogesic 50mg/ml Injektionslösung für Hunde und Katzen
 B. PACKUNGSBEILAGE PACKUNGSBEILAGE Carprogesic 50mg/ml Injektionslösung für Hunde und Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
B. PACKUNGSBEILAGE PACKUNGSBEILAGE Carprogesic 50mg/ml Injektionslösung für Hunde und Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
PHV-issue: Hydroxyethylstärke (HES) hältige Arzneispezialitäten (Infusionen) Änderungen der Fach- und Gebrauchsinformationen
 Datum: 03.01.2014 Kontakt: Mag. pharm. Dr. Ulrike Rehberger Abteilung: Tel. / Fax: +43 (0) 505 55 36258 E-Mail: ulrike.rehberger@ages.at Unser Zeichen: 16c-140103-00002-A-PHV Ihr Zeichen: PHV-issue: Hydroxyethylstärke
Datum: 03.01.2014 Kontakt: Mag. pharm. Dr. Ulrike Rehberger Abteilung: Tel. / Fax: +43 (0) 505 55 36258 E-Mail: ulrike.rehberger@ages.at Unser Zeichen: 16c-140103-00002-A-PHV Ihr Zeichen: PHV-issue: Hydroxyethylstärke
LUCENTIS. bei Visusbeeinträchtigung infolge eines diabetischen Makulaödems (DMÖ) Ihr Leitfaden für die Behandlung mit LUCENTIS
 LUCENTIS bei Visusbeeinträchtigung infolge eines diabetischen Makulaödems (DMÖ) Ihr Leitfaden für die Behandlung mit LUCENTIS Kapitel 1 Über LUCENTIS Die vorliegende Broschüre vermittelt Ihnen wichtige
LUCENTIS bei Visusbeeinträchtigung infolge eines diabetischen Makulaödems (DMÖ) Ihr Leitfaden für die Behandlung mit LUCENTIS Kapitel 1 Über LUCENTIS Die vorliegende Broschüre vermittelt Ihnen wichtige
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Lucentis 10 mg/ml Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Ein ml enthält 10 mg Ranibizumab*.
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Lucentis 10 mg/ml Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Ein ml enthält 10 mg Ranibizumab*.
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER VENODRIL Tropfen Wirkstoffe: Aesculus hippocastanum Dil. D6, Hamamelis virginiana Dil. D4, Melilotus officinalis Dil. D6, Silybum marianum Dil. D4 Lesen Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER VENODRIL Tropfen Wirkstoffe: Aesculus hippocastanum Dil. D6, Hamamelis virginiana Dil. D4, Melilotus officinalis Dil. D6, Silybum marianum Dil. D4 Lesen Sie
Gebrauchsinformation August 2008
 Gebrauchsinformation Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist ohne Verschreibung erhältlich. Um einen bestmöglichen
Gebrauchsinformation Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist ohne Verschreibung erhältlich. Um einen bestmöglichen
FAQ IVM Änderung IVM zum im EBM. GOP für die Injektion von Medikamenten in den hinteren Augenabschnitt:
 Die neuen EBM-Positionen im Kapitel 31 Abschnitt 31.2.13 sowie 36.2.13 für die IVM: GOP für die : GOP Kurzlegende OP-Kategorie Bewertung 31371 Eingriff am rechten Auge (ambulant) Z1 1.618 Punkte 36371
Die neuen EBM-Positionen im Kapitel 31 Abschnitt 31.2.13 sowie 36.2.13 für die IVM: GOP für die : GOP Kurzlegende OP-Kategorie Bewertung 31371 Eingriff am rechten Auge (ambulant) Z1 1.618 Punkte 36371
Die altersabhängige Makuladegeneration
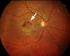 Die altersabhängige Makuladegeneration Die Makuladegeneration ist eine bei älteren Menschen sehr häufige Erkrankung der Netzhautmitte (Makula) und ist in den Industrieländern die häufigste Erblindungsursache
Die altersabhängige Makuladegeneration Die Makuladegeneration ist eine bei älteren Menschen sehr häufige Erkrankung der Netzhautmitte (Makula) und ist in den Industrieländern die häufigste Erblindungsursache
HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE
 HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE ERWINASE 10.000 I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung BEI DER ANWENDUNG DER CHARGEN 174aG116 UND 177aG116 IST
HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE ERWINASE 10.000 I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung BEI DER ANWENDUNG DER CHARGEN 174aG116 UND 177aG116 IST
Gebrauchsinformation: Information für Anwender. RheumaCare Tabletten
 Gebrauchsinformation: Information für Anwender RheumaCare Tabletten Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält wichtige
Gebrauchsinformation: Information für Anwender RheumaCare Tabletten Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält wichtige
Gebrauchsinformation: Information für Patienten. Entzündete Augen Augentropfen Similasan
 1 Gebrauchsinformation: Information für Patienten Entzündete Augen Augentropfen Similasan Wirkstoffe: Atropa bella-donna D6, Euphrasia 3c D6, Hepar sulfuris D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
1 Gebrauchsinformation: Information für Patienten Entzündete Augen Augentropfen Similasan Wirkstoffe: Atropa bella-donna D6, Euphrasia 3c D6, Hepar sulfuris D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
VPRIV (Velaglucerase alfa)
 VPRIV (Velaglucerase alfa) Schulungsmaterial für Ärzte Die hier aufgeführten Dokumente wurden von Shire im Rahmen der Verpflichtung zu Risikominimierungsmaβnahmen für VPRIV erstellt und dienen als Leitlinie
VPRIV (Velaglucerase alfa) Schulungsmaterial für Ärzte Die hier aufgeführten Dokumente wurden von Shire im Rahmen der Verpflichtung zu Risikominimierungsmaβnahmen für VPRIV erstellt und dienen als Leitlinie
behördlich genehmigtes Schulungsmaterial (Adalimumab) Patientenpass für Erwachsene
 behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
behördlich genehmigtes Schulungsmaterial HUMIRA (Adalimumab) Patientenpass für Erwachsene Juli 2017 Liebe Patienten, lieber Patient, Ihr behandelnder Arzt hat Ihnen HUMIRA verordnet. Dieser Patientenpass
GEBRAUCHSINFORMATION: Information für den Anwender
 Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben GEBRAUCHSINFORMATION: Information für den Anwender Dexagel 1 g viskosierte Augentropfen enthält 0,985 mg Dexamethasondihydrogenphosphat-Dinatrium
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben GEBRAUCHSINFORMATION: Information für den Anwender Dexagel 1 g viskosierte Augentropfen enthält 0,985 mg Dexamethasondihydrogenphosphat-Dinatrium
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Medivitan iv Fertigspritze 5mg, 1mg, 1,05mg Injektionslösung Wirkstoffe: Pyridoxinhydrochlorid / Cyanocobalamin / Folsäure Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Medivitan iv Fertigspritze 5mg, 1mg, 1,05mg Injektionslösung Wirkstoffe: Pyridoxinhydrochlorid / Cyanocobalamin / Folsäure Lesen Sie die gesamte Packungsbeilage
MAVENCLAD. Informationsmaterial für verschreibende Ärzte. Version 1.0, [Stand Juli 2017]
![MAVENCLAD. Informationsmaterial für verschreibende Ärzte. Version 1.0, [Stand Juli 2017] MAVENCLAD. Informationsmaterial für verschreibende Ärzte. Version 1.0, [Stand Juli 2017]](/thumbs/77/74803261.jpg) MAVENCLAD Informationsmaterial für verschreibende Ärzte Version 1.0, [Stand Juli 2017] Inhalt Einführung Behandlungsschemata Überwachung während der Behandlung Lymphozytenzahlen Schwere Infektionen Progressive
MAVENCLAD Informationsmaterial für verschreibende Ärzte Version 1.0, [Stand Juli 2017] Inhalt Einführung Behandlungsschemata Überwachung während der Behandlung Lymphozytenzahlen Schwere Infektionen Progressive
Eylea 40 mg/ml Injektionslösung in einer Durchstechflasche
 FACHINFORMATION 40 mg/ml August 2016 DE/8 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige
FACHINFORMATION 40 mg/ml August 2016 DE/8 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige
Schrittweise Anleitung zum Gebrauch des Enbrel 50 mg Fertigpens MYCLIC
 Schrittweise Anleitung zum Gebrauch des Enbrel 50 mg Fertigpens MYCLIC Diese Informationsbroschüre zur Anwendung von Etanercept wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen des Risikomanagement-Plans
Schrittweise Anleitung zum Gebrauch des Enbrel 50 mg Fertigpens MYCLIC Diese Informationsbroschüre zur Anwendung von Etanercept wurde als Teil der Zulassungsauflagen erstellt. Im Rahmen des Risikomanagement-Plans
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
Gebrauchsinformation: Information für Patienten. Tropfen gegen nervöse Herzbeschwerden Similasan
 1/5 Gebrauchsinformation: Information für Patienten Tropfen gegen nervöse Herzbeschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
1/5 Gebrauchsinformation: Information für Patienten Tropfen gegen nervöse Herzbeschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Wortlaut der für die Packungsbeilage vorgesehenen Angaben. Gebrauchsinformation: Information für den Anwender. Cromo-CT Augentropfen Einzeldosis
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender Cromo-CT Augentropfen Einzeldosis Wirkstoff: Natriumcromoglicat 10 mg/0,5 ml Lesen Sie die gesamte
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender Cromo-CT Augentropfen Einzeldosis Wirkstoff: Natriumcromoglicat 10 mg/0,5 ml Lesen Sie die gesamte
: Schulungsmaterial (Educational Material) für medizinisches Fachpersonal
 Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS
 [Version 7.3.2, 10/2011] ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1 1. BEZEICHNUNG DES TIERARZNEIMITTELS Theranekron D6 Injektionslösung für Tiere 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
[Version 7.3.2, 10/2011] ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1 1. BEZEICHNUNG DES TIERARZNEIMITTELS Theranekron D6 Injektionslösung für Tiere 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
TOBREX - Augentropfen
 Gebrauchsinformation: Information für Anwender TOBREX - Augentropfen Wirkstoff: Tobramycin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender TOBREX - Augentropfen Wirkstoff: Tobramycin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten. Eylea 40 mg/ml Injektionslösung in einer Durchstechflasche Aflibercept
 Gebrauchsinformation: Information für Patienten Eylea 40 mg/ml Injektionslösung in einer Durchstechflasche Aflibercept Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine
Gebrauchsinformation: Information für Patienten Eylea 40 mg/ml Injektionslösung in einer Durchstechflasche Aflibercept Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Viscosan - Augentropfen Wirkstoff: Hypromellose
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion nach retinalen Venenverschlüssen (RVV)
 Patientendaten Arzt-/Klinikstempel Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion nach retinalen Venenverschlüssen (RVV) Beim Makulaödem infolge eines retinalen Venenverschlusses
Patientendaten Arzt-/Klinikstempel Patientenaufklärung und Einverständniserklärung zur intravitrealen Injektion nach retinalen Venenverschlüssen (RVV) Beim Makulaödem infolge eines retinalen Venenverschlusses
Gebrauchsinformation: Information für Anwender. Choleodoron Tropfen Wirkstoffe: Chelidonium majus (Schöllkraut) Ø, Curcuma xanthorrhiza (Gelbwurz) Ø
 1 Gebrauchsinformation: Information für Anwender Choleodoron Tropfen Wirkstoffe: Chelidonium majus (Schöllkraut) Ø, Curcuma xanthorrhiza (Gelbwurz) Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
1 Gebrauchsinformation: Information für Anwender Choleodoron Tropfen Wirkstoffe: Chelidonium majus (Schöllkraut) Ø, Curcuma xanthorrhiza (Gelbwurz) Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
MEDICA HALSSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, Spray zur Anwendung in der Mundhöhle Chlorhexidingluconat - Lidocain Hydrochlorid
 MEDICA HALSSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, Spray zur Anwendung in der Mundhöhle Chlorhexidingluconat - Lidocain Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
MEDICA HALSSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, Spray zur Anwendung in der Mundhöhle Chlorhexidingluconat - Lidocain Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
LUCENTIS bei Visusbeeinträchtigung infolge eines Makulaödems aufgrund eines retinalen Venenverschlusses (RVV)
 DIE WELT IST WUNDERSCHÖN ANZUSEHEN LUCENTIS bei Visusbeeinträchtigung infolge eines Makulaödems aufgrund eines retinalen Venenverschlusses (RVV) Ihr Leitfaden für die Behandlung mit LUCENTIS Teil 1 Über
DIE WELT IST WUNDERSCHÖN ANZUSEHEN LUCENTIS bei Visusbeeinträchtigung infolge eines Makulaödems aufgrund eines retinalen Venenverschlusses (RVV) Ihr Leitfaden für die Behandlung mit LUCENTIS Teil 1 Über
Technik der subkutanen Injektion
 Technik der subkutanen Injektion Die folgende Anleitung wurde unter Verwendung einer Patienteninformation des Arzneimittelherstellers AMGEN Roche, der das Medikament Neupogen vertreibt, erstellt. Dieselbe
Technik der subkutanen Injektion Die folgende Anleitung wurde unter Verwendung einer Patienteninformation des Arzneimittelherstellers AMGEN Roche, der das Medikament Neupogen vertreibt, erstellt. Dieselbe
OlWIK Oldenburger Verlag für Wirtschaft, Informatik und
 Meike Appelrath Bewertung des Patientennutzens von Arzneimitteln in Deutschland Zulassung und frühe Nutzenbewertung am Beispiel von Aflibercept in der Augenheilkunde OlWIK Oldenburger Verlag für Wirtschaft,
Meike Appelrath Bewertung des Patientennutzens von Arzneimitteln in Deutschland Zulassung und frühe Nutzenbewertung am Beispiel von Aflibercept in der Augenheilkunde OlWIK Oldenburger Verlag für Wirtschaft,
Gebrauchsinformation: Information für Anwender. ALCAINE 0,5% Augentropfen, Lösung. Proxymetacainhydrochlorid
 Gebrauchsinformation: Information für Anwender ALCAINE 0,5% Augentropfen, Lösung Proxymetacainhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender ALCAINE 0,5% Augentropfen, Lösung Proxymetacainhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender. THILO-TEARS 3 mg/g Augengel. Carbomer
 Gebrauchsinformation: Information für Anwender THILO-TEARS 3 mg/g Augengel Carbomer Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
Gebrauchsinformation: Information für Anwender THILO-TEARS 3 mg/g Augengel Carbomer Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
Gebrauchsinformation: Information für Patienten Mundschleimhaut- und Gurgelmittel Similasan
 1/5 Gebrauchsinformation: Information für Patienten Mundschleimhaut- und Gurgelmittel Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
1/5 Gebrauchsinformation: Information für Patienten Mundschleimhaut- und Gurgelmittel Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
octenisept Wund-Desinfektion ist ein Antiseptikum zur wiederholten, zeitlich begrenzten unterstützenden antiseptischen Wundbehandlung.
 Gebrauchsinformation: Information für den Anwender OCTENISEPT WUND-DESINFEKTION Antiseptikum zur unterstützenden Wundbehandlung Lösung zum Aufsprühen auf die Wunde Wirkstoffe: 0.1 g Octenidinhydrochlorid
Gebrauchsinformation: Information für den Anwender OCTENISEPT WUND-DESINFEKTION Antiseptikum zur unterstützenden Wundbehandlung Lösung zum Aufsprühen auf die Wunde Wirkstoffe: 0.1 g Octenidinhydrochlorid
Gebrauchsinformation: Information für Anwender. PRANOX 0,1 %, Augentropfen. Pranoprofen
 Gebrauchsinformation: Information für Anwender PRANOX 0,1 %, Augentropfen Pranoprofen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender PRANOX 0,1 %, Augentropfen Pranoprofen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CRIMAX Haarvitaltropfen Wirkstoffe: Acidum hydrofluoricum Dil. D12, Graphites Dil. D8, Pel talpae Dil. D8, Selenium amorphum Dil. D12 Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CRIMAX Haarvitaltropfen Wirkstoffe: Acidum hydrofluoricum Dil. D12, Graphites Dil. D8, Pel talpae Dil. D8, Selenium amorphum Dil. D12 Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 29 Neuralgietropfen Mag. Doskar Aconitum napellus D6, Verbascum densiflorum D2, Citrullus colocynthis (Colocynthis) D4, Magnesium phosphoricum D12, Plantago
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 29 Neuralgietropfen Mag. Doskar Aconitum napellus D6, Verbascum densiflorum D2, Citrullus colocynthis (Colocynthis) D4, Magnesium phosphoricum D12, Plantago
Gebrauchsinformation: Information für Patienten. Graphites D 12, Jodum D 15, Petroleum rectificatum D 12, Thallium sulfuricum.
 Tropfen gegen Haarausfall und brüchige Nägel Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Haarausfall und brüchige Nägel Similasan Graphites D 12, Jodum D 15, Petroleum rectificatum
Tropfen gegen Haarausfall und brüchige Nägel Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Haarausfall und brüchige Nägel Similasan Graphites D 12, Jodum D 15, Petroleum rectificatum
Anästhesie (Vollnarkose)
 Anlage 3 zum Honorarvertrag 2017 über die Vergütung vertragsärztlicher Leistungen für das Vertragsgebiet Bremen für den Zeitraum vom 01. Januar 2017 bis 31. Dezember 2017 Lidkorrektur 5-096.02 U2 93101
Anlage 3 zum Honorarvertrag 2017 über die Vergütung vertragsärztlicher Leistungen für das Vertragsgebiet Bremen für den Zeitraum vom 01. Januar 2017 bis 31. Dezember 2017 Lidkorrektur 5-096.02 U2 93101
Gebrauchsinformation: Information für Patienten
 Tropfen gegen Heuschnupfen Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Heuschnupfen Similasan Cardiospermum halicacabum D 4, Luffa operculata D 6, Thryallis glauca (Galphimia
Tropfen gegen Heuschnupfen Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Heuschnupfen Similasan Cardiospermum halicacabum D 4, Luffa operculata D 6, Thryallis glauca (Galphimia
