Aluminiumoxid & Aluminate. von Anne Gerten & Sabrina Huesmann
|
|
|
- Evagret Maier
- vor 6 Jahren
- Abrufe
Transkript
1 Aluminiumoxid & Aluminate von Anne Gerten & Sabrina Huesmann
2 Inhalte Aluminiumoxid Eigenschaften Die Gewinnung α-al 2 O 3 γ-al 2 O 3 Aluminate Allgemein Natriumaluminat Calciumaluminat Quellen
3 Aluminiumoxid Summenformel: Al 2 O 3 weißes, geruchloses Pulver Molare Masse: 101,96 g mol -1 Schmelzpunkt: 2050 C Siedepunkt: 2980 C unlöslich in Wasser
4 Die Gewinnung Rohstoff: Bauxit Bayer-Verfahren: Bauxit wird gemahlen mit heißer NaOH umgesetzt Al(OH) 3 löst sich unter Bildung von Natriumaluminat Al(OH) 3 scheidet sich nach Verdünnen ab entwässern Ausbeute: aus 2 kg Bauxit wird 1 kg Al 2 O 3 gewonnen
5 Aluminiumoxid α-al 2 O 3 γ-al 2 O 3 Mineral Korund Rhomboedrische (triagonale) Anordnung Tonerde Kubische Anordnung
6 α-al 2 O 3 Korund ist ein Mineral Kommt relativ häufig vor Nach dem Diamant das zweithärteste Mineral Säuliger, tonnerförmiger Kristall
7 α-al 2 O 3 Kommt in natriumreichen, magmatischen Gesteinen vor Hauptsächlich in Australien, Indien, Kanada, Südafrika, Sri Lanka und den USA Seit dem 19. Jh können Korunde auch durch das Verneuil-Verfahren synthetisch produziert werden (künstliche Rubine) Durch Säuren und Basen nicht veränderbar, können erst bei 2050 C verflüssigt werden
8 α-al 2 O 3 Varietäten des Korunds sind: -Rubin kräftig rot -Saphir blau, braun, grau, rosa, gelb alles außer rot -Leukosaphir farblos -Schmirgel
9 Rubin Kommt vom lat. Rubens = rot Seit der Bronzezeit bekannt Spielte bereits in der Bibel eine Rolle Stein des Lebens und der Liebe
10 Farbe des Rubins Chrom-Ionen sitzen an den Stellen der Aluminium Atome Trotz des Chroms nicht grün, weil die Chromionen größere sind als die des Aluminiums Dadurch erfordern die d-d-übergänge mehr Energie und die Absorption wird in den kurzwelligeren Bereich verschoben Die Farberscheinung ändert sich von grün nach rot
11 Verwendung des Rubins Als Schmuckstein (mit Facetten- oder Cabochon-Schliff) Als aktives Medium in Rubinlasern Als Lagerstein in Uhrwerken Als Taststift in Koordinatenmessgerä ten
12 Saphir Kommt aus dem Griechischen und bedeutet blau Alle Farben außer rot Hohe Wärmeleitfähigkeit Können künstlich in perfekter Qualität und nahezu unbegrenzter Größe hergestellt werden
13 Farben des Saphirs Mit Eisen(II) und Titan blau Mit Eisen(III) gelb und grün Mit Vanadium violett Besonderheit: Padparadscha (Lotusblüte)
14 Verwendung des Saphirs Schmucksteine Schallplattenspieler als Tonabnehmernadel Titan-Saphir-Laser Uhrengläser Fenster von Weltraumflugkörpern
15 γ-al 2 O 3 Tonerde hygroskopisches, weißes Pulver in starken Säuren / Basen löslich ab 800 C: γ-al 2 O 3 α-al 2 O 3
16 γ-al 2 O 3 - Verwendung Als Katalysatorträger Tonerde wird in Kosmetik verwendet
17 Technische Anwendungen Elektrotechnik: Isolatoren Zündkerzen Werkzeuge: Schweißdüsen, Schleifwerkzeuge Chem. Industrie: Laborporzellan
18 Anwendung in der Medizintechnik Hüftgelenkimplantat besitzen Keramik- Kugelköpfe Festsitzender Zahnersatz
19 Aluminate Aluminium ist amphoter und löst sich daher in Säuren und Basen In Laugen gelöste Verbindungen nennt man Aluminate Sie entstehen unter anderem als Nebenprodukt beim Bayer-Verfahren Beispiele: - Natriumaluminat - Calciumaluminat - Kaliumaluminat
20 Natriumaluminat Zwei typische Reaktionen sind: - Das Auflösen von metallischem Aluminium - Die synthetische Herstellung von Aluminiumhydroxid durch Erhitzen mit Natronlauge
21 Natriumaluminat Man unterscheidet nun zwischen Natriumaluminat-Lösung und festem Natriummetaaluminat Das Natriummetaaluminat ist ein weißes, wasserunlösliches Pulver Es wird eingesetzt als Flockungsmittel in der Abwasserklärung, als Schnellhärter für Beton und zur Herstellung von Lacken und Seifen
22 Natriumaluminat Natriumaluminat-Lösungen enthalten normaler Weise 6-10% gelöstes Aluminium und ca. 20% NaOH Sie sind von größerer technischer Bedeutung Im besonderen für die Abwasserreinigung, wo sie als Fällungs- und Flockungsmittel dienen
23 Natriumaluminat Hierdurch können bei Fällungs- und Neutralisationsprozessen basische Salze entstehen Neben Chloriden auch basische Phosphate und Sulfate Natriumaluminat hat einen Sonderstatus, da bei der Verwendung keine zusätzlichen Anionen eingebracht werden und der ph-wert gehoben wird
24 Calciumaluminat Verbindungen von Calciumoxid und Aluminiumoxid unterschiedlicher Zusammensetzung Es wird unterschieden zwischem gebranntem (gesintertem) Calciumaluminat und chemisch gefälltem Calciumaluminat-Hydrat Beide Formen sind wichtig in der Bauchemie, insbesondere zum Anbinden und Verfestigen von Zement und Beton, sowie auf Grund ihrer hochen Festigkeit
25 Calciumaluminat Calciumaluminat-Hydrate: Ca 3 Al 2 (OH) 12 = Tricalciumaluminat-Hydrat Ca 4 Al 2 (OH) 14 = Tetracalciumaluminat-Hydrat Gebrannte Calciumaluminate: CaO * Al 2 O 3 [CA] 3CaO * Al 2 O 3 [C 3 A] CaO * 2 Al 2 O 3 [CA 2 ] 12CaO * 7 Al 2 O 3 [C 12 A 7 ]
26 Quellen für Materialforschung und prüfung.de Wissenschaft.de Chemie heute; Schrödel
Von Kim Schmitter und Vanessa Meslage
 Aluminiumoxid & Aluminate Von Kim Schmitter und Vanessa Meslage Gliederung Al 2 O 3 : Eigenschaften Modifikationen Verwendung Herstellung Aluminate: Mineralien Natriumaluminat Weitere Aluminate Al 2 O
Aluminiumoxid & Aluminate Von Kim Schmitter und Vanessa Meslage Gliederung Al 2 O 3 : Eigenschaften Modifikationen Verwendung Herstellung Aluminate: Mineralien Natriumaluminat Weitere Aluminate Al 2 O
Von Bauxit zum Aluminium
 Von Bauxit zum Aluminium 18.06.2010 1 Themenübersicht Geschichte Vorkommen von Bauxit Allgemeines zum Aluminium Verwendung Herstellungsverfahren Gewinnung des Oxids ( Bayer-Verfahren) Gewinnung des Aluminiums
Von Bauxit zum Aluminium 18.06.2010 1 Themenübersicht Geschichte Vorkommen von Bauxit Allgemeines zum Aluminium Verwendung Herstellungsverfahren Gewinnung des Oxids ( Bayer-Verfahren) Gewinnung des Aluminiums
Benennen Sie folgende Salze: 1. K 4 [Fe(CN) 6 ] 2. K 3 [AlF 6 ] 3. [Al(OH) 2 (H 2 O) 4 ]NO 3
![Benennen Sie folgende Salze: 1. K 4 [Fe(CN) 6 ] 2. K 3 [AlF 6 ] 3. [Al(OH) 2 (H 2 O) 4 ]NO 3 Benennen Sie folgende Salze: 1. K 4 [Fe(CN) 6 ] 2. K 3 [AlF 6 ] 3. [Al(OH) 2 (H 2 O) 4 ]NO 3](/thumbs/54/34171592.jpg) Kap. 11.5 - Komplexe u. Namen Frage 1 Kap. 11.5 - Komplexe u. Namen Antwort 1 Benennen Sie folgende Salze: 1. K 4 [Fe(CN) 6 ] 2. K 3 [AlF 6 ] 3. [Al(OH) 2 (H 2 O) 4 ]NO 3 Kap. 4.2 - Aufbau des PSE Frage
Kap. 11.5 - Komplexe u. Namen Frage 1 Kap. 11.5 - Komplexe u. Namen Antwort 1 Benennen Sie folgende Salze: 1. K 4 [Fe(CN) 6 ] 2. K 3 [AlF 6 ] 3. [Al(OH) 2 (H 2 O) 4 ]NO 3 Kap. 4.2 - Aufbau des PSE Frage
Aluminium. 1. Geschichte: 2. Vorkommen:
 Universität Regensburg 13.11.2009 Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Wintersemester 2009/2010 Dozentin: Frau Dr. M. Andratschke Referentinnen:
Universität Regensburg 13.11.2009 Institut für Anorganische Chemie - Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Wintersemester 2009/2010 Dozentin: Frau Dr. M. Andratschke Referentinnen:
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
Praktikum Materialwissenschaft Sol-Gel-Synthese keramischer Werkstoffe am Beispiel von SiO 2
 Praktikum Materialwissenschaft Sol-Gel-Synthese keramischer Werkstoffe am Beispiel von SiO 2 André Schwöbel 1328037, Max Fries 1407149, Jörg Schließer 1401598, Tobias Brink 1400670 (Gruppe 17) e-mail:
Praktikum Materialwissenschaft Sol-Gel-Synthese keramischer Werkstoffe am Beispiel von SiO 2 André Schwöbel 1328037, Max Fries 1407149, Jörg Schließer 1401598, Tobias Brink 1400670 (Gruppe 17) e-mail:
Mangan: Ein Chamäleon unter den Metallionen RG 1: RG 2: RG 3: + + +
 Chemie-Übung: Redoxreaktionen (Wiederholung) Datum: Mangan: Ein Chamäleon unter den Metallionen Material: Chemikalien: 3 RG, RG-Ständer, Pipette, Becherglas Kaliumpermanganat-Lsg. (KMnO 4 ), Salzsäure,
Chemie-Übung: Redoxreaktionen (Wiederholung) Datum: Mangan: Ein Chamäleon unter den Metallionen Material: Chemikalien: 3 RG, RG-Ständer, Pipette, Becherglas Kaliumpermanganat-Lsg. (KMnO 4 ), Salzsäure,
Kochsalz-Kristalle (Halit) Wichtige Stoffgruppen Atomverband Stoffgruppe Metall Metall: Metallische Stoffe Salzartige Stoffe Metall Nichtmetall:
 Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Kochsalz-Kristalle (Halit) 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter)
Crashkurs Säure-Base
 Crashkurs Säure-Base Was sind Säuren und Basen? Welche Eigenschaften haben sie?` Wie reagieren sie mit Wasser? Wie reagieren sie miteinander? Wie sind die Unterschiede in der Stärke definiert? Was ist
Crashkurs Säure-Base Was sind Säuren und Basen? Welche Eigenschaften haben sie?` Wie reagieren sie mit Wasser? Wie reagieren sie miteinander? Wie sind die Unterschiede in der Stärke definiert? Was ist
GFS: Gewinnung von Aluminium durch Schmelzflusselektrolyse
 Sarah Neuwirth Chemie 4std Klassenstufe 13 / 17.01.2006 GFS: Gewinnung von Aluminium durch Schmelzflusselektrolyse Aufbau: Ausgangsstoff für die Gewinnung: Bauxit Gewinnung von reinem Aluminiumoxid am
Sarah Neuwirth Chemie 4std Klassenstufe 13 / 17.01.2006 GFS: Gewinnung von Aluminium durch Schmelzflusselektrolyse Aufbau: Ausgangsstoff für die Gewinnung: Bauxit Gewinnung von reinem Aluminiumoxid am
SS 2010. Thomas Schrader. der Universität Duisburg-Essen. (Teil 7: Säuren und Basen, Elektrolyte)
 Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 7: Säuren und Basen, Elektrolyte) Definition Säure/Base Konjugierte Säure/Base-Paare Konjugierte
Chemie für Biologen SS 2010 Thomas Schrader Institut t für Organische Chemie der Universität Duisburg-Essen (Teil 7: Säuren und Basen, Elektrolyte) Definition Säure/Base Konjugierte Säure/Base-Paare Konjugierte
Standortbestimmung / Äquivalenzprüfung. Chemie. Mittwoch, 13. April 2016, Uhr
 Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
Name: Punktzahl: von 57 Note:
 Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
fest, nicht gelöst: Na + Cl -
 Salzsäure + Natriumlauge Natriumchlorid + Wasser / exotherm HCl + NaOH NaCl + H 2 O / exotherm H + (aq) + Cl (aq) + Na + (aq) + OH (aq) Na + (aq) + Cl (aq) + H 2 O / exotherm fest, nicht gelöst: Na + Cl
Salzsäure + Natriumlauge Natriumchlorid + Wasser / exotherm HCl + NaOH NaCl + H 2 O / exotherm H + (aq) + Cl (aq) + Na + (aq) + OH (aq) Na + (aq) + Cl (aq) + H 2 O / exotherm fest, nicht gelöst: Na + Cl
3. Säure-Base-Beziehungen
 3.1 Das Ionenprodukt des Wassers In reinen Wasser sind nicht nur Wassermoleküle vorhanden. Ein kleiner Teil liegt als Ionenform H 3 O + und OH - vor. Bei 25 C sind in einem Liter Wasser 10-7 mol H 3 O
3.1 Das Ionenprodukt des Wassers In reinen Wasser sind nicht nur Wassermoleküle vorhanden. Ein kleiner Teil liegt als Ionenform H 3 O + und OH - vor. Bei 25 C sind in einem Liter Wasser 10-7 mol H 3 O
Der Mensch kann ohne Gold, nicht aber ohne Salz leben.
 Text aus Schroedel, Chemieheute: Chloralkali-Elektrolyse "Der Mensch kann ohne Gold, nicht aber ohne Salz leben." Dieser Satz stammt von dem römischen Geschichtsschreiber CASSIODORUS, der vor etwa 1500
Text aus Schroedel, Chemieheute: Chloralkali-Elektrolyse "Der Mensch kann ohne Gold, nicht aber ohne Salz leben." Dieser Satz stammt von dem römischen Geschichtsschreiber CASSIODORUS, der vor etwa 1500
Fällung und Flockung. Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen. Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung
 Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 27.01.2017 Agenda Auffrischung Definition
Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 27.01.2017 Agenda Auffrischung Definition
ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen
 ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen ChemikerInnen verwenden den ph-wert um festzustellen, wie sauer oder basisch eine Lösung ist. Man verwendet eine Skala von 0-14:
ph-wert ph-wert eine Kenngröße für saure, neutrale oder basische Lösungen ChemikerInnen verwenden den ph-wert um festzustellen, wie sauer oder basisch eine Lösung ist. Man verwendet eine Skala von 0-14:
Lösungen, Salze, Ionen und Elektrolyte
 Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe
r 3 Verbundprojekt Rotschlamm
 r 3 Verbundprojekt Rotschlamm Dipl.-Ing. Bernd Jaspert REMONDIS Production GmbH, Lünen URBAN MINING Kongress & r³ Statusseminar Strategische Metalle. Innovative Ressourcentechnologien 11./12.06.2014, Messe
r 3 Verbundprojekt Rotschlamm Dipl.-Ing. Bernd Jaspert REMONDIS Production GmbH, Lünen URBAN MINING Kongress & r³ Statusseminar Strategische Metalle. Innovative Ressourcentechnologien 11./12.06.2014, Messe
1. Klausur Allgemeine und Anorganische Chemie B.Sc. Chemie
 1. Klausur Allgemeine und Anorganische Chemie B.Sc. Chemie Name: Vorname: Matrikel Nr.: 15.12.2010 Die Durchführung und Auswertung der 12 Aufgaben im zweiten Teil dieser Klausur mit je vier Aussagen (a-d)
1. Klausur Allgemeine und Anorganische Chemie B.Sc. Chemie Name: Vorname: Matrikel Nr.: 15.12.2010 Die Durchführung und Auswertung der 12 Aufgaben im zweiten Teil dieser Klausur mit je vier Aussagen (a-d)
Talk Apatit Feldspat Topas. Granat Halit Magnetit Turmalin Härte (Mohs): Härte (Mohs):
 Talk Apatit Feldspat Topas mittlere Volumen Lichtbrechung: Elementarzelle:.-. Talk ist das weichste Mineral, man kann es sogar mit dem Fingernagel ritzen. Zähne und Knochen des Körpers bestehen zu einem
Talk Apatit Feldspat Topas mittlere Volumen Lichtbrechung: Elementarzelle:.-. Talk ist das weichste Mineral, man kann es sogar mit dem Fingernagel ritzen. Zähne und Knochen des Körpers bestehen zu einem
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE
 SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
Stoffe oder Teilchen, die Protonen abgeben kånnen, werden als SÄuren bezeichnet (Protonendonatoren).
 5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
Gewinnung und Trennung von Lanthanoiden
 Gewinnung und Trennung von Lanthanoiden Inhaltsverzeichnis Allgemeines 1. Geschichte 2. Eigenschaften 3. Vorkommen Gewinnung Trennung Quellen Allgemeines 1. Geschichte 1794 wurde die Yttererde von finnischen
Gewinnung und Trennung von Lanthanoiden Inhaltsverzeichnis Allgemeines 1. Geschichte 2. Eigenschaften 3. Vorkommen Gewinnung Trennung Quellen Allgemeines 1. Geschichte 1794 wurde die Yttererde von finnischen
C Säure-Base-Reaktionen
 -V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
-V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
Urotropin-Ammoniumsulfid-Gruppe
 Urotropin-Ammoniumsulfid-Gruppe Lerninhalte zum Thema Chrom Vorkommen Darstellung (ausführlich) und Aufschluß, Dichromat-Zwischenstufe, kompaktes Chrom - Oxidationsbeständigkeit (aktiver, passiver Zustand)
Urotropin-Ammoniumsulfid-Gruppe Lerninhalte zum Thema Chrom Vorkommen Darstellung (ausführlich) und Aufschluß, Dichromat-Zwischenstufe, kompaktes Chrom - Oxidationsbeständigkeit (aktiver, passiver Zustand)
Modul Einführung in die Allgemeine und Anorganische Chemie Übungsblatt 12
 Modul Einführung in die Allgemeine und Anorganische Chemie Übungsblatt 12 Abgabe Montag, 25.01.2016 bis 12 Uhr im Gang Forschungsflügel Süd, 3. Stock Aluminium, Kohlenstoffgruppe Pflichtaufgaben: Aufgabe
Modul Einführung in die Allgemeine und Anorganische Chemie Übungsblatt 12 Abgabe Montag, 25.01.2016 bis 12 Uhr im Gang Forschungsflügel Süd, 3. Stock Aluminium, Kohlenstoffgruppe Pflichtaufgaben: Aufgabe
7. Woche. Gesamtanalyse (Vollanalyse) einfacher Salze. Qualitative Analyse anorganischer Verbindungen
 7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
Seminar zum Grundpraktikum Anorganische Chemie
 Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität Duisburg-Essen Analyse 2 (NH 4 ) 2 CO 3 -Gruppe Ba 2+ Sr 2+ Ca 2+ Lösliche Gruppe Na + Mg 2+ NH 4+ Eigenschaften
Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität Duisburg-Essen Analyse 2 (NH 4 ) 2 CO 3 -Gruppe Ba 2+ Sr 2+ Ca 2+ Lösliche Gruppe Na + Mg 2+ NH 4+ Eigenschaften
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Magische Kristalle Prof. Dr. R. Glaum
 Magische Kristalle Prof. Dr. R. Glaum Institut für Anorganische Chemie Universität Bonn http://www.glaum.chemie.uni-bonn.de email: rglaum@uni-bonn.de Dank Herr Michael Kortmann Herr Andreas Valder Deutsche
Magische Kristalle Prof. Dr. R. Glaum Institut für Anorganische Chemie Universität Bonn http://www.glaum.chemie.uni-bonn.de email: rglaum@uni-bonn.de Dank Herr Michael Kortmann Herr Andreas Valder Deutsche
3.2. Aufgaben zu Säure-Base-Gleichgewichten
 .. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
.. Aufgaben zu Säure-Base-Gleichgewichten Aufgabe : Herstellung saurer und basischer Lösungen Gib die Reaktionsgleichungen für die Herstellung der folgenden Lösungen durch Reaktion der entsprechenden Oxide
Wiederholung der letzten Vorlesungsstunde: Thema: Metallbindung
 Wiederholung der letzten Vorlesungsstunde: Thema: Metallbindung Chemische Bindungen in Metallen, Elektronengasmodell, elektronische Bänder, Bandstrukturmodell, Metalle, Halbleiter, Isolatoren, Bandlücke,
Wiederholung der letzten Vorlesungsstunde: Thema: Metallbindung Chemische Bindungen in Metallen, Elektronengasmodell, elektronische Bänder, Bandstrukturmodell, Metalle, Halbleiter, Isolatoren, Bandlücke,
Anorganische-Chemie. Michael Beetz Arbeitskreis Prof. Bein. Grundpraktikum für Biologen 2017
 Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Frage 1. Schreiben Sie die chemischen Symbole für nachfolgende Elemente an:
 Klausuraufgaben Grundvorlesung Testat vom 27.2.02, Seite 1 Punkte Bitte eintragen: Matrikelnummer: Name: Vorname: Bitte ankreuzen: Fachrichtung: Chemie Biotechnologie Pharmazie Frage 1 Schreiben Sie die
Klausuraufgaben Grundvorlesung Testat vom 27.2.02, Seite 1 Punkte Bitte eintragen: Matrikelnummer: Name: Vorname: Bitte ankreuzen: Fachrichtung: Chemie Biotechnologie Pharmazie Frage 1 Schreiben Sie die
Grundwissen Chemie Mittelstufe (9 MNG)
 Grundwissen Chemie Mittelstufe (9 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Grundwissen Chemie Mittelstufe (9 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung
 Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Salpetersäure. Herstellung und Bedeutung. von
 Salpetersäure Herstellung und Bedeutung von Patrick Götte Stefan Jovanovic Salpetersäure Herstellung und Bedeutung Salpetersäure und deren Eigenschaften Geschichtliches Herstellung Bedeutung / Verwendung
Salpetersäure Herstellung und Bedeutung von Patrick Götte Stefan Jovanovic Salpetersäure Herstellung und Bedeutung Salpetersäure und deren Eigenschaften Geschichtliches Herstellung Bedeutung / Verwendung
Ines von Hören Irina Nickel
 Ines von Hören Irina Nickel Kalk Gips Zement Kalk Allgemeines Vorkommen in Mineralien Vorkommen in Sedimentgestein Verwendung Kalkkreislauf Gebrannter/Gelöschter Kalk Gips Allgemeines Entstehung industrielle
Ines von Hören Irina Nickel Kalk Gips Zement Kalk Allgemeines Vorkommen in Mineralien Vorkommen in Sedimentgestein Verwendung Kalkkreislauf Gebrannter/Gelöschter Kalk Gips Allgemeines Entstehung industrielle
Aufgaben zum Umfeld: 7 Vergleichen Sie die Gitterenergien von NaF, NaCl und NaI bzw. MgO, CaO und BaO! Gitterenergien [kj/mol]
![Aufgaben zum Umfeld: 7 Vergleichen Sie die Gitterenergien von NaF, NaCl und NaI bzw. MgO, CaO und BaO! Gitterenergien [kj/mol] Aufgaben zum Umfeld: 7 Vergleichen Sie die Gitterenergien von NaF, NaCl und NaI bzw. MgO, CaO und BaO! Gitterenergien [kj/mol]](/thumbs/49/25486820.jpg) Seite 22 22 Auflösung von Si in NaOH-Lösung Weiterführende Infos Quarzsand und Alkalicarbonate werden bei ca. 1300 C zusammengeschmolzen und das Produkt ((Na/K) 2 O* n SiO 2 ) bei 150 C und 5 bar in Wasser
Seite 22 22 Auflösung von Si in NaOH-Lösung Weiterführende Infos Quarzsand und Alkalicarbonate werden bei ca. 1300 C zusammengeschmolzen und das Produkt ((Na/K) 2 O* n SiO 2 ) bei 150 C und 5 bar in Wasser
Grundlagen der Chemie Lösungen Prof. Annie Powell
 Lösungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Inhalte Konzentrationsmaße Wasser als Lösungsmittel Solvatation,
Lösungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Inhalte Konzentrationsmaße Wasser als Lösungsmittel Solvatation,
Säure-Base Titrationen. (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen)
 Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Analytische Chemie. B. Sc. Chemieingenieurwesen. 02. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:...LÖSUNGSSTICHPUNKTE... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:...LÖSUNGSSTICHPUNKTE... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Grundlagen der Chemie für Nichtchemiker AUFGABENSAMMLUNG
 AUFGABENSAMMLUNG 1. Chemische Grundlagen: Masse -Berechnungen 1-1. Berechnen Sie die molaren Massen folgender Stoffe: a)caco 3 ; b)caso 4 2H 2 O; c)agcl; d)al 2 O 3 ; e)phenol C 6 H 5 OH; f)magnesiumammoniumphosphat-
AUFGABENSAMMLUNG 1. Chemische Grundlagen: Masse -Berechnungen 1-1. Berechnen Sie die molaren Massen folgender Stoffe: a)caco 3 ; b)caso 4 2H 2 O; c)agcl; d)al 2 O 3 ; e)phenol C 6 H 5 OH; f)magnesiumammoniumphosphat-
Chemie der Metalle (Nachklausur)
 Aufgabe 1 2 3 4 5 6 7 8 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Abschlußklausur zur Vorlesung Chemie der Metalle
Aufgabe 1 2 3 4 5 6 7 8 Punkte (je 10) Ich bin damit einverstanden, dass mein Klausurergebnis unter Angabe der Matrikelnummer im Web bekanntgegeben wird: Abschlußklausur zur Vorlesung Chemie der Metalle
Das Chemische Gleichgewicht
 II. Gleichgewichte von Säuren S und Basen 13 Puffer-Lösungen Definition: Lösungen, die einen definierten ph-wert haben, der konstant bleibt, auch wenn Säuren S oder Basen in begrenzten Mengen zugesetzt
II. Gleichgewichte von Säuren S und Basen 13 Puffer-Lösungen Definition: Lösungen, die einen definierten ph-wert haben, der konstant bleibt, auch wenn Säuren S oder Basen in begrenzten Mengen zugesetzt
Aluminium. 1. Historisches [1]
![Aluminium. 1. Historisches [1] Aluminium. 1. Historisches [1]](/thumbs/27/11730352.jpg) Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Sommersemester 2008 04.06.2008 Dozentin: Frau Dr. M. Andratschke Referenten: Tim Drechsler,
Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Sommersemester 2008 04.06.2008 Dozentin: Frau Dr. M. Andratschke Referenten: Tim Drechsler,
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Vorkurs Chemie (NF) Säuren und Basen, Puffer Ulrich Keßler
 Vorkurs Chemie (NF) Säuren und Basen, Puffer Ulrich Keßler Alltagserfahrung: sauer Zitrone Essig junger Wein Welcher Stoff bewirkt saure Reaktion? http://www.simplyscience.ch/portal Data/1/Resources/Images_bis_10_
Vorkurs Chemie (NF) Säuren und Basen, Puffer Ulrich Keßler Alltagserfahrung: sauer Zitrone Essig junger Wein Welcher Stoff bewirkt saure Reaktion? http://www.simplyscience.ch/portal Data/1/Resources/Images_bis_10_
Fällung und Flockung. Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen. Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung
 Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 29.01.2016 Agenda Auffrischung Definition
Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Fällung und Flockung Übung zur Vorlesung Verfahrenstechnik der Abwasserreinigung Betül Morcali 29.01.2016 Agenda Auffrischung Definition
Die Stoffteilchen (II): Ionengruppen und ihre Ionen
 Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Abbildung 3: Kondensatoren und Beschriftung auf Leiterplatte C1 ist also der erste, C2 der zweite Kondensator in der Bauteilliste usw.
 Abbildung 3: Kondensatoren und Beschriftung auf Leiterplatte C1 ist also der erste, C2 der zweite Kondensator in der Bauteilliste usw. Beginnt ein Bauteilname mit einem anderen Kürzel als C kann man mit
Abbildung 3: Kondensatoren und Beschriftung auf Leiterplatte C1 ist also der erste, C2 der zweite Kondensator in der Bauteilliste usw. Beginnt ein Bauteilname mit einem anderen Kürzel als C kann man mit
Aluminium. Aluminium ist das dritthäufigste Element und das häufigste Metall in der Erdkruste. Dort tritt es allerdings nur in Verbindungen auf.
 Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Wintersemester 2007/2008 16.11.2007 Dozentin: Dr. M. Andratschke Referenten: Tamara Künzel,
Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsvorträge im Wintersemester 2007/2008 16.11.2007 Dozentin: Dr. M. Andratschke Referenten: Tamara Künzel,
Thema: Uran, vom Erz zum Brennelement
 Thema: Uran, vom Erz zum Brennelement Brennelement 1 Inhaltsangabe Uranerzgewinnung Uranerzverarbeitung Prinzip des Anreicherungsverfahren Anreicherung durch Zentrifugentechnik Weitere Anreicherungsverfahren
Thema: Uran, vom Erz zum Brennelement Brennelement 1 Inhaltsangabe Uranerzgewinnung Uranerzverarbeitung Prinzip des Anreicherungsverfahren Anreicherung durch Zentrifugentechnik Weitere Anreicherungsverfahren
Kapitel 13: Laugen und Neutralisation
 Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Qualitative Analyse. - Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch,
 - Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch, Löslichkeit - charakteristische Nachweisreaktionen für Einzelionen: - Fällungsreaktionen
- Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch, Löslichkeit - charakteristische Nachweisreaktionen für Einzelionen: - Fällungsreaktionen
Analytische Chemie. B. Sc. Chemieingenieurwesen. 03. Februar 2010. Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 03. Februar 2010 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 03. Februar 2010 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Abgestufte Lernhilfen
 Abgestufte Lernhilfen Checkliste für die Beobachtungen: o o o o o Farbe des Indikators bei bei Zugabe zu Natronlauge Temperatur vor Zugabe der Salzsäure Farbveränderungen bei Zugabe der Salzsäure Temperaturveränderungen
Abgestufte Lernhilfen Checkliste für die Beobachtungen: o o o o o Farbe des Indikators bei bei Zugabe zu Natronlauge Temperatur vor Zugabe der Salzsäure Farbveränderungen bei Zugabe der Salzsäure Temperaturveränderungen
6. Seminar. Prof. Dr. Christoph Janiak. Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002
 ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 6. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
ALBERT-LUDWIGS- UNIVERSITÄT FREIBURG 6. Seminar Prof. Dr. Christoph Janiak Literatur: Jander,Blasius, Lehrb. d. analyt. u. präp. anorg. Chemie, 15. Aufl., 2002 Riedel, Anorganische Chemie, 5. Aufl., 2002
Eine wässrige Kaliumdichromat-Lösung wird mit Salzsäure stark sauer gestellt. Dabei entstehen Chrom(III)-Ionen und Chlor.
 Kap. 10.3 Aufstellen RedOx-Gleichung Frage 81 Kap. 10.3 Aufstellen RedOx-Gleichung Antwort 81 Eine wässrige Kaliumdichromat-Lösung wird mit Salzsäure stark sauer gestellt. Dabei entstehen Chrom(III)-Ionen
Kap. 10.3 Aufstellen RedOx-Gleichung Frage 81 Kap. 10.3 Aufstellen RedOx-Gleichung Antwort 81 Eine wässrige Kaliumdichromat-Lösung wird mit Salzsäure stark sauer gestellt. Dabei entstehen Chrom(III)-Ionen
Kapitel II Säuren und Basen
 Kapitel II Säuren und Basen Björn Schulz, Berlin 2004, www.lernmaus.de Inhalt: Säuren Beispiele für Säuren: Herstellung von Säuren Laugen / Basen Herstellung von Säuren und Basen Säuren und Basen in chemischen
Kapitel II Säuren und Basen Björn Schulz, Berlin 2004, www.lernmaus.de Inhalt: Säuren Beispiele für Säuren: Herstellung von Säuren Laugen / Basen Herstellung von Säuren und Basen Säuren und Basen in chemischen
Faszination Farbe Über die Farben von Edelsteinen und deren Ursachen. Dr. Ulrich Henn Deutsche Gemmologische Gesellschaft Idar-Oberstein
 Faszination Farbe Über die Farben von Edelsteinen und deren Ursachen Dr. Ulrich Henn Deutsche Gemmologische Gesellschaft Idar-Oberstein Was ist Farbe? Farbe ist eine Sinnesempfindung Farbe ist keine physikalische
Faszination Farbe Über die Farben von Edelsteinen und deren Ursachen Dr. Ulrich Henn Deutsche Gemmologische Gesellschaft Idar-Oberstein Was ist Farbe? Farbe ist eine Sinnesempfindung Farbe ist keine physikalische
Glas und seine Rohstoffe
 Glas und seine Rohstoffe Version 1.8, Nov. 2001 Was ist Glas? Definition: Glas ist ein anorganisches Schmelzprodukt, welches aus verschiedenen Rohstoffen erschmolzen wird und beim Abkühlen nicht kristallisiert
Glas und seine Rohstoffe Version 1.8, Nov. 2001 Was ist Glas? Definition: Glas ist ein anorganisches Schmelzprodukt, welches aus verschiedenen Rohstoffen erschmolzen wird und beim Abkühlen nicht kristallisiert
Grundlagen Chemie. Dipl.-Lab. Chem. Stephan Klotz. Freiwill ige Feuerwehr Rosenheim
 Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
Seite 1 von Standortbestimmung / Äquivalenzprüfung. Chemie. Freitag, 23. Mai 2014, Uhr
 Seite 1 von 8 2. Standortbestimmung / Äquivalenzprüfung Chemie Freitag, 23. Mai 2014, 16.45-18.45 Uhr Dauer der Prüfung: 120 Minuten Erlaubte Hilfsmittel: Eine vom Dozenten visierte Formelsammlung, Ein
Seite 1 von 8 2. Standortbestimmung / Äquivalenzprüfung Chemie Freitag, 23. Mai 2014, 16.45-18.45 Uhr Dauer der Prüfung: 120 Minuten Erlaubte Hilfsmittel: Eine vom Dozenten visierte Formelsammlung, Ein
2.9 Reaktion von Laugen mit Aluminium - Laugenstärke. Aufgabe. Gibt es verschieden starke Laugen?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P7159300) 2.9 Reaktion von Laugen mit Aluminium - Laugenstärke Experiment von: Phywe Gedruckt: 15.10.2013 12:17:12 intertess (Version 13.06
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P7159300) 2.9 Reaktion von Laugen mit Aluminium - Laugenstärke Experiment von: Phywe Gedruckt: 15.10.2013 12:17:12 intertess (Version 13.06
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie)
 Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Abschlussklausur Allgemeine und Anorganische Chemie Teil 2 (Geologie, Geophysik und Mineralogie) Teilnehmer/in:... Matrikel-Nr.:... - 1. Sie sollen aus NaCl und Wasser 500 ml einer Lösung herstellen, die
Integrationsphase der MSS 11
 Integrationsphase der MSS 11 Atombau, PSE und Salze Kennzeichnung eines Atoms und seines Kerns Energiestufen- / Schalenmodell der Atomhülle Zusammenhang zwischen Atombau und PSE Bildung und Ladung von
Integrationsphase der MSS 11 Atombau, PSE und Salze Kennzeichnung eines Atoms und seines Kerns Energiestufen- / Schalenmodell der Atomhülle Zusammenhang zwischen Atombau und PSE Bildung und Ladung von
Gruppe 12: Untersuchungsabteilung Pharmazeutika Untersuchung von Maaloxan Magentabletten
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 12: Untersuchungsabteilung Pharmazeutika Untersuchung von Maaloxan
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 12: Untersuchungsabteilung Pharmazeutika Untersuchung von Maaloxan
Praktikum Chemie für Biologen, SS 2003/Kurse SS
 1 Praktikum Chemie für Biologen, SS 2003/Kurse SS Klausur in Anorganischer Chemie (KlAC) - Sa 14.06.2003 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
1 Praktikum Chemie für Biologen, SS 2003/Kurse SS Klausur in Anorganischer Chemie (KlAC) - Sa 14.06.2003 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
B Chemisch Wissenwertes. Arrhénius gab 1887 Definitionen für Säuren und Laugen an, die seither öfter erneuert wurden.
 -I B.1- B C H E M I S C H W ISSENWERTES 1 Säuren, Laugen und Salze 1.1 Definitionen von Arrhénius Arrhénius gab 1887 Definitionen für Säuren und Laugen an, die seither öfter erneuert wurden. Eine Säure
-I B.1- B C H E M I S C H W ISSENWERTES 1 Säuren, Laugen und Salze 1.1 Definitionen von Arrhénius Arrhénius gab 1887 Definitionen für Säuren und Laugen an, die seither öfter erneuert wurden. Eine Säure
Elemente des Periodensystems. Natürliche Häufigkeit der Elemente
 Elemente des Periodensystems Natürliche Häufigkeit der Elemente 1 Der Wasserstoff Vorkommen Eigenschaften Gewinnung Verwendung Verbindungen 2 Vorkommen Interstellare Wasserstoffwolken Orion-Nebel und auf
Elemente des Periodensystems Natürliche Häufigkeit der Elemente 1 Der Wasserstoff Vorkommen Eigenschaften Gewinnung Verwendung Verbindungen 2 Vorkommen Interstellare Wasserstoffwolken Orion-Nebel und auf
Günter Baars E-Lern- und Lehrmedium: Quantenchemie und Chemie farbiger Stoffe Modul: Quantenchemie und Pigmente Übungen mit Lösungen
 Günter Baars E-Lern- und Lehrmedium: Quantenchemie und Chemie farbiger Stoffe Modul: Quantenchemie und Pigmente Übungen mit Lösungen Korrektorat: Dina Baars, Bern Illustrationen: Christoph Frei, Bern 1.
Günter Baars E-Lern- und Lehrmedium: Quantenchemie und Chemie farbiger Stoffe Modul: Quantenchemie und Pigmente Übungen mit Lösungen Korrektorat: Dina Baars, Bern Illustrationen: Christoph Frei, Bern 1.
Dissoziation, ph-wert und Puffer
 Dissoziation, ph-wert und Puffer Die Stoffmengenkonzentration (molare Konzentration) c einer Substanz wird in diesem Text in eckigen Klammern dargestellt, z. B. [CH 3 COOH] anstelle von c CH3COOH oder
Dissoziation, ph-wert und Puffer Die Stoffmengenkonzentration (molare Konzentration) c einer Substanz wird in diesem Text in eckigen Klammern dargestellt, z. B. [CH 3 COOH] anstelle von c CH3COOH oder
Licht und Farbe mit Chemie
 Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farben: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farben: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Komplexbildung Beispiel wässrige Lösungen von Aluminium(III) Hydrate
 Komplexbildung Beispiel wässrige Lösungen von Aluminium(III) Al 3+ + 3 OH Al(OH) 3 Al(OH) 3 + OH - [Al(OH) 4 ] - Hydrate Amphoteres Verhalten von Hydroxiden (z.b. Al 3+, Sn 2+, Pb 2+, Zn 2+ ): löslich
Komplexbildung Beispiel wässrige Lösungen von Aluminium(III) Al 3+ + 3 OH Al(OH) 3 Al(OH) 3 + OH - [Al(OH) 4 ] - Hydrate Amphoteres Verhalten von Hydroxiden (z.b. Al 3+, Sn 2+, Pb 2+, Zn 2+ ): löslich
Themengebiet: 1 HA + H 2 O A - + H 3 O + H 3 O + : Oxonium- oder Hydroxoniumion. Themengebiet: 2 B + H 2 O BH + + OH - OH - : Hydroxidion
 1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
1 1 Säuren sind Protonendonatoren, d.h. Stoffe, die an einen Reaktionspartner ein oder mehrere Protonen abgeben können; Säuredefinition nach Brönsted Im Falle von Wasser: HA + H 2 O A - + H 3 O + H 3 O
Mittwoch, 7. Dezember 2016 um 17:00 Uhr im Hörsaal Stoff: Chemische Reaktionen, Chemisches Gleichgewicht.
 Mittwoch, 7. Dezember 2016 um 17:00 Uhr im Hörsaal 42 110. Stoff: Chemische Reaktionen, Chemisches Gleichgewicht. Künftig bitte alles tackern, mit Klebstreifen kleben oder große Blätter (A3) falten. Heftstreifen
Mittwoch, 7. Dezember 2016 um 17:00 Uhr im Hörsaal 42 110. Stoff: Chemische Reaktionen, Chemisches Gleichgewicht. Künftig bitte alles tackern, mit Klebstreifen kleben oder große Blätter (A3) falten. Heftstreifen
Licht und Farbe mit Chemie
 Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farbe: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Licht und Farbe mit Chemie Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farbe: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
1. Standortbestimmung, Januar Chemie. Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung,
 1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
Handbuch für das Eisenhüttenlaboratorium, Band 3, Teil 1 5. Inhaltsübersicht
 Handbuch für das Eisenhüttenlaboratorium, Band 3, Teil 1 5 Inhaltsübersicht Seite Vorwort zur dritten Ausgabe 1 Allgemeine Hinweise 17 Allgemein gebrauchte Reagenzien 22 Die Untersuchung der Erze Die Bestimmung
Handbuch für das Eisenhüttenlaboratorium, Band 3, Teil 1 5 Inhaltsübersicht Seite Vorwort zur dritten Ausgabe 1 Allgemeine Hinweise 17 Allgemein gebrauchte Reagenzien 22 Die Untersuchung der Erze Die Bestimmung
Teilnehmer/in:... Matrikel-Nr.:...
 Abschlussklausur Allgemeine und Anorganische Chemie Teil 1 (Modul BGEO1.3.1 Anorganische und Allgemeine Chemie für Geologen, Geophysiker und Mineralogen) Teilnehmer/in:... MatrikelNr.:... 1. Sie sollen
Abschlussklausur Allgemeine und Anorganische Chemie Teil 1 (Modul BGEO1.3.1 Anorganische und Allgemeine Chemie für Geologen, Geophysiker und Mineralogen) Teilnehmer/in:... MatrikelNr.:... 1. Sie sollen
Vom Bauxit zum Aluminium. Ein Beitrag von Sebastian Ehring und Thomas Surmann
 Vom Bauxit zum Aluminium Ein Beitrag von Sebastian Ehring und Thomas Surmann Vom Bauxit zum Aluminium Bauxittagebau in Australien Aluminium in Barrenform Fachhochschule Münster 2 Kurzübersicht 1. Geschichte
Vom Bauxit zum Aluminium Ein Beitrag von Sebastian Ehring und Thomas Surmann Vom Bauxit zum Aluminium Bauxittagebau in Australien Aluminium in Barrenform Fachhochschule Münster 2 Kurzübersicht 1. Geschichte
Orientierungstest für angehende Industriemeister. Vorbereitungskurs Chemie
 Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Production Technologies Erlaubte Hilfsmittel: Periodensystem der Elemente Maximale Bearbeitungszeit: 30 Minuten Provadis Partner
Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Production Technologies Erlaubte Hilfsmittel: Periodensystem der Elemente Maximale Bearbeitungszeit: 30 Minuten Provadis Partner
Klausur in Anorganischer Chemie
 1 Klausur in Anorganischer Chemie zum Praktikum Chemie für Biologen, SS2000 Kurse SS Sa 20.05.2000 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Geb. am in Semester des
1 Klausur in Anorganischer Chemie zum Praktikum Chemie für Biologen, SS2000 Kurse SS Sa 20.05.2000 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Geb. am in Semester des
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom 18.09.2009 A1 A2 A3 A4 A5 Σ Note 10 10 10 10 10 NAME:... VORNAME:...MUSTERLÖSUNG... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom 18.09.2009 A1 A2 A3 A4 A5 Σ Note 10 10 10 10 10 NAME:... VORNAME:...MUSTERLÖSUNG... Pseudonym für Ergebnisveröffentlichung:... Schreiben
STÖCHIOMETRIE. die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen
 1 STÖCHIOMETRIE die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen 1) STOFFMENGE n(x) reine Zählgröße Menge der Elementarteilchen
1 STÖCHIOMETRIE die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen 1) STOFFMENGE n(x) reine Zählgröße Menge der Elementarteilchen
bestimmte mehratomige Anionen mit Sauerstoff werden mit dem lateinischen Namen benannt und enden auf at.
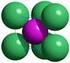 DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
DIE BINDUNGSARTEN UND DAS PERIODENSYSTEM 1) IONISCHE VERBINDUNGEN SALZE Wenn die Atome Ionen bilden, haben sie meist die gleiche Elektronenzahl, wie das nächstgelegene neutrale Edelgas. Na bildet dann
Titrationen. Experimentiermappe zum Thema. Lernwerkstatt Schülerlabor Chemie
 Lernwerkstatt Schülerlabor Chemie Experimentiermappe zum Thema Titrationen Friedrich-Schiller-Universität Jena Arbeitsgruppe Chemiedidaktik August-Bebel-Straße 6-8 07743 Jena Fonds der Chemischen Industrie
Lernwerkstatt Schülerlabor Chemie Experimentiermappe zum Thema Titrationen Friedrich-Schiller-Universität Jena Arbeitsgruppe Chemiedidaktik August-Bebel-Straße 6-8 07743 Jena Fonds der Chemischen Industrie
Aluminium O 3 + 3 H 2
 Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Sommersemester 2014 04.06.2014 Dozentin: Frau Dr. M. Andratschke Referenten: Josef Enggruber,
Universität Regensburg Institut für Anorganische Chemie Lehrstuhl Prof. Dr. A. Pfitzner Demonstrationsversuche im Sommersemester 2014 04.06.2014 Dozentin: Frau Dr. M. Andratschke Referenten: Josef Enggruber,
Wiederholungen. Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers. ph-wert-berechnungen. Titrationskurvenberechnung
 Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
Vorlesung 22: Wiederholungen Puffergleichung (Henderson-Hasselbalch) Ionenprodukt des Wassers ph-wert-berechnungen Titrationskurvenberechnung Säuren und Basen Hydroxonium + Chlorid Ammonium + Hydroxid
Trennungsmöglichkeit
 Trennungsmöglichkeit Erst Fällung mit Urotropin, dann mit (H 4 ) 2 S Was ist Urotropin? (H 2 S im basischen Milieu) 6 H 12 4 + 6 H 2 O 6 H 2 O + 4 H 3 Urotropin Formaldehyd H 2 H 2 H 2 H 2 H 2 H2 Adamantan-Gerüst
Trennungsmöglichkeit Erst Fällung mit Urotropin, dann mit (H 4 ) 2 S Was ist Urotropin? (H 2 S im basischen Milieu) 6 H 12 4 + 6 H 2 O 6 H 2 O + 4 H 3 Urotropin Formaldehyd H 2 H 2 H 2 H 2 H 2 H2 Adamantan-Gerüst
3-01. Triphenylmethan
 Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
1.3 Chemische Reaktionen des Wassers - Bildung von Säuren und Basen
 1.3 Chemische Reaktionen des Wassers Bildung von Säuren und Basen Säure und Basebegriff nach Arrhenius (1887) Wasser reagiert mit Nichtmetalloxiden (Säureanhydriden) zu Säuren. Die gebildete Säure löst
1.3 Chemische Reaktionen des Wassers Bildung von Säuren und Basen Säure und Basebegriff nach Arrhenius (1887) Wasser reagiert mit Nichtmetalloxiden (Säureanhydriden) zu Säuren. Die gebildete Säure löst
Redoxreaktionen. Redoxreaktionen: Reaktionen bei denen Elektronen zwischen den Komponenten übertragen werden
 Nach Lavoisier: : Redoxreaktionen Redoxreaktionen: Reaktionen bei denen Elektronen zwischen den Komponenten übertragen werden Aufnahme von Sauerstoff zb.: Verbrennen von Magnesium : Abgabe von Sauerstoff
Nach Lavoisier: : Redoxreaktionen Redoxreaktionen: Reaktionen bei denen Elektronen zwischen den Komponenten übertragen werden Aufnahme von Sauerstoff zb.: Verbrennen von Magnesium : Abgabe von Sauerstoff
3.5 Hydrolyse von Salzen. Aufgabe. Reagieren wässrige Salzlösungen neutral? Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze (P759800) 3.5 Hydrolyse von Salzen Experiment von: Phywe Gedruckt: 5.0.203 2:2:26 intertess (Version 3.06 B200, Export 2000) Aufgabe Aufgabe
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 3 Salze (P759800) 3.5 Hydrolyse von Salzen Experiment von: Phywe Gedruckt: 5.0.203 2:2:26 intertess (Version 3.06 B200, Export 2000) Aufgabe Aufgabe
