Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
|
|
|
- Lilli Gehrig
- vor 6 Jahren
- Abrufe
Transkript
1 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im Bsp. 2 ), 2. Schritt ist Abspaltung eines + von einem der C-Atome neben dem Carbenium-Ion und Ausbildung der Doppelbindung säurekatalysierte Eliminierungen wie das oben gezeigte Beispiel verlaufen immer nach E1 die konjugierte Base zur eingesetzten Säure darf NICT nucleophil sein, da sonst die Möglichkeit besteht, dass das cleophil das Carbenium-Ion im 2. Schritt angreift und eine S N 1-kt. abläuft. (z. Bsp. Cl als Säure ist ungeeignet, da hier Cl - als cleophil reagieren kann) die eaktion ist NICT stereospezifisch, d.h. die beiden eliminierten Gruppen ( und ) müssen NICT in einer festgelegten Stereochemie (syn oder anti) zueinander stehen. je nach Edukt stehen in manchen Fällen mehrere -Atome zur Auswahl, die im 2. Schritt abstrahiert werden können, was zu unterschiedlichen Produkten führt: auptprodukt, höher substituierte Dobi ist thermodynamisch günstiger - + Nebenprodukt 7
2 Eliminierung nach E2 (Konkurrenzreaktion zu S N 2) C 3 3 C Base B C 3 3 C - B C (Z) C 3 C 3 C 3 antiperiplanare Anordnung der beiden zu eliminierenden este Stichpunkte zum E2-Mechanismus: 1-Schritt-eaktion ohne Zwischenprodukt mit einem Übergangszustand, die Abspaltung des Protons durch die Base und die Abspaltung der Abgangsgruppe (hier - ) erfolgt gleichzeitig stereospezifische eaktion: durch die synchrone Abspaltung von + und - müssen diese beiden este anti zueinander angeordnet sein (anti bzw. trans- Eliminierung) eine starke, sterisch anspruchsvolle Base in hoher Konzentration abstrahiert das Proton besonders schnell, eine S N 2-eaktion verläuft aufgrund der großen este an der Base sehr viel langsamer (sterisch gehinderte Basen sind schlechte cleophile) schlechtes cleophil mäßiges cleophil gute cleophile C 3 3 C 3 C C 3 3 C Basizität sinkt von t-butanolat in ichtung ydroxid 8
3 Zusammenfassung mechanistischer Aspekte Start Bimolekulare eaktion (E2 bzw. S N 2) Ja Liegt eine starke Base/c vor? Nein Was für ein Substrat? sehr ungünstige eaktion (kein Umsatz) 1 2, 3 oder stabilisiert 1 Ist c/base sterisch anspruchsvoll? Ja Unimolekulare eaktion (E1 bzw. S N 1) Nein E2 3 Was für ein Substrat? Methyl oder 1 2 S N 2 + E2 meist E1 * Ja Ist c/base sterisch anspruchsvoll? Nein S N 2 meist S N 1 * * Unter Bedingungen, die eine unimolekulare eaktion begünstigen (schwache Base/c und polarprotische Lösungsmittel) treten in der egel Mischungen von S N 1 und E1 auf!
4 Elektrophile Addition (A E ) Beispiel: Addition von alogenwasserstoff an die Doppelbindung δ+ δ δ+ δ + Cl Cl Cl π-komplex Cl Stichpunkte zum Mechanismus der elektrophilen Addition: Das Alken wirkt als cleophil aufgrund der zusätzlichen Elektronen in der π- Bindung, das Proton der Salzsäure wirkt im ersten Schritt als Elektrophil 1. Schritt: Es bildet sich ein π-komplex aus: hierbei handelt es sich um eine Wechselwirkung von rbitalen zwischen den π-rbitalen des Alkens und dem Elektrophil (der π-komplex ist kein Zwischenprodukt sondern eher mit einem Übergangszustand vergleichbar) 2. Schritt: Das Elektrophil (im Beispiel + ) wird an die Doppelbindung addiert und es bildet sich als Zwischenprodukt ein Carbenium-Ion. Bei unsymmetrischen Alkanen wird das Elektrophil an das niedriger substituierte C-Atom addiert, damit erhält man die positive Ladung am höher subst. C-Atom der Dobi (stabileres Carbenium-Ion) 3. Schritt: Ein cleophil (im Beispiel Cl - ) greift am Carbenium-Ion an und es bildet sich das Endprodukt. Die Addition von Cl,, 2,, etc. (wie oben im Schema abgebildet) ist NICT stereospezifisch (im Gegensatz zur Addition von 2 ) 9
5 Spezialfall: Addition von 2 oder Cl 2 an die Doppelbindung δ+ δ + π-komplex X Bei der Addition von 2 wird nach Ausbildung des π-komplexes als Elektrophil + addiert. Das addierte omatom verfügt über freie Elektronenpaare, was zum Angriff auf das benachbarte positiv geladene Carbenium-Ion führt es bildet sich ein cyclisches omonium-ion. (Bei der Addition von + als Elektrophil, wie im ersten Beispiel, bildet sich kein Dreiring, da keine freien Elektronenpaare besitzt). Im letzten Schritt erfolgt der Angriff durch das omid-ion als cleophil. ierbei greift das - das cyclische omonium-ion immer von der ückseite an --> die beiden -este stehen im Endprodukt immer TANS zueinander! Stereospezifische eaktion: anti-addition, trans-produkt entsteht Bsp.: 2 Cyclohexen trans-1,2-dibromcyclohexan Quizfrage: Was könnte passieren, wenn die obige eaktion mit Wasser (großer Überschuß an 2 im Vergleich zur 2 -Menge) als LM durchgeführt wird? 10
6 Mechanismus Baeyer-Probe (Nachreaktion für Doppelbindungen) + Mn Cycloaddition Mn 2 Mn Mn + 2 Mn cis-diol Der Angriff des Permanganat-Ions an der Doppelbindung erfolgt als Cycloaddition. Daher erfolgt die Ausbildung der beiden Bindungen zu den - Atomen im ersten Schritt gleichzeitig und die -Atome werden von derselben Seite auf die Doppelbindung übertragen. Die beiden -Gruppen stehen im Endprodukt syn zueinander, es entsteht ein cis-diol. Abschätzen von Säurestärken in organischen Molekülen Ein Proton ist umso acider, je besser die entstehende negative Ladung stabilisiert werden kann. Diese Stabilisierung kann durch Delokalisierung erfolgen (mehrere mesomere Grenzstrukturen) und/oder durch Substituenten, die Elektronendichte von dem negativ geladenen Atom abziehen (Substituenten mit I-Effekt). Je kleiner der pk s -Wert, desto saurer ist das Proton, d.h. desto einfacher kann es abgespalten werden. Substituenten mit +I-Effekt erhöhen Protons. Bsp.: Deprotonierung von Nitroethan den pk -Wert des entsprechenden s 2 N N - N N 11
7 Weitere Beispiele zur Acidität pk s : 18 - negative Ladung nur am Sauerstoff lokalisiert, hylgruppe übt +I-Effekt aus, schiebt zusätzliche Elektronendichte zum bereits negativ geladenen Sauerstoff --> energetisch ungünstig 2 pk s : 16 - negative Ladung nur am Sauerstoff lokalisiert, Wasserstoff schiebt KEINE zusätzliche Elektronendichte zum bereits negativ geladenen Sauerstoff --> energetisch günstiger - pk s : 9 negative Ladung ist stark delokalisiert, 3 Mesomeriestrukturen sind möglich --> negative Ladung ist durch die Mesomerie gut stabilisiert --> günstig 3 C - 3 C 3 C negative Ladung ist delokalisiert (günstig), aber Methylgruppe übt + I-Effekt aus (ungünstig) pk s : 4,75 F 3 C - F 3 C F 3 C negative Ladung ist delokalisiert (günstig), und zusätzlich übt CF 3 -Gruppe einen -I-Effekt aus (günstig) pk s : 0,23 Quizfragen: Wo würden Sie Ameisensäure einordnen? Warum? Ist Phenol (= ydroxybenzol) acider als hanol oder nicht? Warum? 12
8 Chemie der Carbonylverbindungen Die meisten eaktionen mit Carbonylverbindungen lassen sich auf 2 grundlegende Eigenschaften dieser Verbindungsklasse zurückführen: 1. polarisierte C--Doppelbindung: C 2 vgl. δ δ+ C-C-Doppelbindung, nicht polarisiert C--Doppelbindung, polarisiert --> Angriff von cleophilen am Carbonyl-Kohlenstoff kann erfolgen Im Gegensatz zur Gruppe der Alkene liegt bei Carbonylverbindungen eine polarisierte C- Doppelbindung vor, so daß ein Angriff von cleophilen am positiv polarisierten C-Atom stattfinden kann. Das in dieser eaktion gebildete tetraedrische Produkt reagiert in der egel weiter, diese Folgereaktion ist abhängig von den esten und den jeweiligen eaktionsbedingungen. versch. Beispiele: Cl =, Alkyl = Alkyl =, Alkyl = Alkyl 13
9 2. Enolatbildung β Base α =, Alkyl Enolat Viele Carbonylverbindungen lassen sich durch starke Basen in α-stellung zur Carbonylgruppe deprotonieren, und es bildet sich ein Carbanion, welches durch Mesomerie stabilisiert ist, ein sogenanntes Enolat. Diese Enolate stellen cleophile dar und können dann in einem weiteren Schritt mit Elektrophilen, beispielsweise mit anderen Carbonylverbindungen reagieren (Angriff am positiv polarisierten Carbonyl- Kohlenstoff). Bsp. Aldoladdition + 3 C C 3 3 C C 3 3 C 3 C β-ydroxycarbonylverbindung Carbonylverbindungen, die KEINE Protonen in α-stellung aufweisen lassen sich nicht in ein Enolat überführen. Man bezeichnet diese Verbindungen daher als nicht enolisierbar. Bsp. Benzaldehyd 14
10 xidationsstufen der Alkohole 3 C 2 C x. 3 C x. 3 C prim. Alkohol Aldehyd Carbonsäure 3 C C 3 C x. 3 C C 3 x. Ketone lassen sich NICT weiter oxidieren! sek. Alkohol Keton 3 C C 3 x. tertiäre Alkohole lassen sich NICT weiter oxidieren! C 3 tert. Alkohol 15
ALDEHYDE & KETONE. Referat über die Carbonylverbindungen: Aldehyde und Ketone Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium
 ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Übung Nr. 13. Vorlesung Allgemeine Chemie II Teil Organische Chemie Frühjahrssemester Mi bzw. Fr
 Übung Nr. 13 Mi. 30.05.2012 bzw. Fr. 01.06.2012 1. Eliminierungen I Geben Sie für die untenstehenden Reaktionen die jeweiligen Produkte an! Um welche Namensreaktion handelt es sich? Welcher Typ Eliminierung
Übung Nr. 13 Mi. 30.05.2012 bzw. Fr. 01.06.2012 1. Eliminierungen I Geben Sie für die untenstehenden Reaktionen die jeweiligen Produkte an! Um welche Namensreaktion handelt es sich? Welcher Typ Eliminierung
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
Chemie für Biologen, Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema ) iii) Carbonsäure iv) Dicarbonsäure
 Chemie für Biologen, 2017 Übung 12 Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema 13.1 14.3) Aufgabe 1: a) Es gibt verschiedene Klassen von Carbonylverbindungen. Zeichnen Sie zu folgenden
Chemie für Biologen, 2017 Übung 12 Carbonylverbindungen / Carbonsäuren und ihre Derivate (Thema 13.1 14.3) Aufgabe 1: a) Es gibt verschiedene Klassen von Carbonylverbindungen. Zeichnen Sie zu folgenden
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
3 Eliminierungen. 3.1 Begriffe und mechanistische Einteilung. Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül
 3 Eliminierungen 3.1 Begriffe und mechanistische Einteilung Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül Einteilung nach den Positionen der abgespaltenen Gruppen 1,1-Eliminierung (α-eliminierung)
3 Eliminierungen 3.1 Begriffe und mechanistische Einteilung Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül Einteilung nach den Positionen der abgespaltenen Gruppen 1,1-Eliminierung (α-eliminierung)
Additionsreaktionen an die C=C-Doppelbindung
 Triolein C 57 H 104 O 6 Schmelzpunkt: 5 C Siedebereich: 235-240 C Tetradecan C 14 H 30 Quelle: bioltec.de Schmelzpunkt: 5,5 C Siedepunkt: 253 C Quelle: oerlikon.com Die Formeln in der Abbildung geben das
Triolein C 57 H 104 O 6 Schmelzpunkt: 5 C Siedebereich: 235-240 C Tetradecan C 14 H 30 Quelle: bioltec.de Schmelzpunkt: 5,5 C Siedepunkt: 253 C Quelle: oerlikon.com Die Formeln in der Abbildung geben das
N H H. Carbanionen Lewis-Basen Olefine (Alkane) Die Stärke der Nucleophilie wird von versch. Faktoren beeinflußt z.b.
 Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
Michael Pieper Universität-Oldenburg - SoSe 2003
 1. Klassifizierung (von : eliminare = aus dem Haus treiben). Allgemeinen Reaktionen bei denen zwei Gruppen (Atome, Ionen, Moleküle) aus einem Substrat abgespalten werden. Die Klassifizierung in α-, β-
1. Klassifizierung (von : eliminare = aus dem Haus treiben). Allgemeinen Reaktionen bei denen zwei Gruppen (Atome, Ionen, Moleküle) aus einem Substrat abgespalten werden. Die Klassifizierung in α-, β-
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
Halogenalkane. Radikalische Halogenierung von Alkanen. Addition von Halogenwasserstoffen an Alkene. H 3 C + HBr H C C C H.
 alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
Versuch: Reaktivität von primären, sekundären und tertiären Alkylbromiden gegenüber ethanolischer Silbernitratlösung. keine Reaktion.
 Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
8 Carbonsäuren und Derivate
 8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Übungen Kapitel 1 Alkane- Radikalische Substitution
 Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Alkene / Additions-, Eliminierungsreaktionen
 2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 2 cleophile Substitution Dr. ermann A. Wegner hermann.wegner@unibas.ch 1 Darauf wird aufgebaut... Atom-rbital & Molekül-rbital Theorie
eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 2 cleophile Substitution Dr. ermann A. Wegner hermann.wegner@unibas.ch 1 Darauf wird aufgebaut... Atom-rbital & Molekül-rbital Theorie
Radikalische Substitution von Alkanen
 adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Reaktionen der Alkene
 Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )
![Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 ) Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )](/thumbs/74/69784240.jpg) 1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
S N 2, S N 1 E1, E2 S N 2, S N 1, E1, E2
 S N vs. E S N 2, S N 1 - B: E1, E2 H E1, E2 C C - : Nu L S N 2, S N 1, E1, E2 Die vier durch Pfeile angedeutenden Reaktionsmöglichkeiten laufen mit unterschiedlichen Geschwindigkeiten ab. Wichtigste Einflussfaktoren:
S N vs. E S N 2, S N 1 - B: E1, E2 H E1, E2 C C - : Nu L S N 2, S N 1, E1, E2 Die vier durch Pfeile angedeutenden Reaktionsmöglichkeiten laufen mit unterschiedlichen Geschwindigkeiten ab. Wichtigste Einflussfaktoren:
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang
 Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Organische Chemie 1 Teil 2
 Inhalte der 7. Vorlesung: 2.4. Bildung & Reaktion von Enolen und Enolaten 2.5 Chemie des Enolatanions 2.6 Enolat-Analoga 2.8 1,3-Dicarbonylverbindungen/ß-Dicarbonylverbindungen 2.9 α,β-ungesättigte Carbonylverbindungen
Inhalte der 7. Vorlesung: 2.4. Bildung & Reaktion von Enolen und Enolaten 2.5 Chemie des Enolatanions 2.6 Enolat-Analoga 2.8 1,3-Dicarbonylverbindungen/ß-Dicarbonylverbindungen 2.9 α,β-ungesättigte Carbonylverbindungen
Claisen-Kondensation
 Quelle: gerlicher.de In dieser Datei soll der Mechanismus der Biosynthese wichtiger Bausteine von Ölen und festen Fetten näher betrachtet werden, nämlich die Biosynthese der Fettsäuren. Quelle: gerlicher.de
Quelle: gerlicher.de In dieser Datei soll der Mechanismus der Biosynthese wichtiger Bausteine von Ölen und festen Fetten näher betrachtet werden, nämlich die Biosynthese der Fettsäuren. Quelle: gerlicher.de
Eliminierungsreaktionen: E1- und E2- Mechanismen; Olefine
 Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Orbital. Atombindung, Bindung. Elektronegativität. Dipol
 GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
Kapitel 3. Nucleophile Substitution
 Kapitel 3. Nucleophile Substitution Reaktionsmechanismen - S N 1-Reaktion: Reaktionskoordinate-Energie-Diagramm; Kinetik, Struktur-Reaktivitätsbeziehungen (stabiles Carbokation, schwaches Nucleophil, gute
Kapitel 3. Nucleophile Substitution Reaktionsmechanismen - S N 1-Reaktion: Reaktionskoordinate-Energie-Diagramm; Kinetik, Struktur-Reaktivitätsbeziehungen (stabiles Carbokation, schwaches Nucleophil, gute
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Eine Auswahl typischer Carbonylreaktionen
 Eine Auswahl typischer Carbonylreaktionen Aldol-eaktion ( anschließende Aldol-Kondensation) Kondensation = Abspaltung von Wasser Aldol-eaktion kann basenkatalysiert oder säurekatalysiert durchgeführt werden.
Eine Auswahl typischer Carbonylreaktionen Aldol-eaktion ( anschließende Aldol-Kondensation) Kondensation = Abspaltung von Wasser Aldol-eaktion kann basenkatalysiert oder säurekatalysiert durchgeführt werden.
a81 a Carbonylverbindungen (I)
 Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
σ-bindung beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
 VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
Aldehyde und Ketone Carbonylverbindungen
 Aldehyde und Ketone Carbonylverbindungen Prof. Dr. Ivo C. Ivanov 1 Prof. Dr. Ivo C. Ivanov 2 Die Siedepunkte liegen höher als bei den jeweils zugrundeliegenden Alkanen, eine Folge des polaren Charakters
Aldehyde und Ketone Carbonylverbindungen Prof. Dr. Ivo C. Ivanov 1 Prof. Dr. Ivo C. Ivanov 2 Die Siedepunkte liegen höher als bei den jeweils zugrundeliegenden Alkanen, eine Folge des polaren Charakters
12. Die Carbonylgruppe : Reaktionen in a-stellung
 Inhalt Index 12. Die Carbonylgruppe : Reaktionen in a-stellung In Kapiteln 10 und 11 wurde gezeigt, dass die Carbonylgruppe von Elektrophilen am Sauerstoff und von Nucleophilen am Kohlenstoff angegriffen
Inhalt Index 12. Die Carbonylgruppe : Reaktionen in a-stellung In Kapiteln 10 und 11 wurde gezeigt, dass die Carbonylgruppe von Elektrophilen am Sauerstoff und von Nucleophilen am Kohlenstoff angegriffen
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen ch von. Brückner Kap. 12 Chemie der Enole und Enamine Dr. ermann A. Wegner hermann.wegner@unibas.ch Keto/Enol-Tautomerie; Enolgehalt von Carbonyl- und Carboxylverbindungen
eaktionsmechanismen nach dem gleichnahmigen ch von. Brückner Kap. 12 Chemie der Enole und Enamine Dr. ermann A. Wegner hermann.wegner@unibas.ch Keto/Enol-Tautomerie; Enolgehalt von Carbonyl- und Carboxylverbindungen
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
c) Gleichzeitiger Bruch der C-X-Bindung und der C-H-Bindung
 Eliminierungen Das Nucleophil mit seinem freien Elektronenpaar muß nicht am Kohlenstoffatom der C-- Bindung angreifen, es kann auch am nächsten Kohlenstoffatom ein Proton abstrahieren und somit als Base
Eliminierungen Das Nucleophil mit seinem freien Elektronenpaar muß nicht am Kohlenstoffatom der C-- Bindung angreifen, es kann auch am nächsten Kohlenstoffatom ein Proton abstrahieren und somit als Base
Inhaltsverzeichnis zu Kapitel 10. Aldehyde und Ketone
 Inhaltsverzeichnis zu Kapitel 10. Aldehyde und Ketone 10. Aldehyde und Ketone 106 10.1 Nomenklatur 106 10.2 Die arbonylgruppe 106 10.3 Darstellung 107 10.3.1 xidation von Alkoholen 107 10.3.2 eduktion
Inhaltsverzeichnis zu Kapitel 10. Aldehyde und Ketone 10. Aldehyde und Ketone 106 10.1 Nomenklatur 106 10.2 Die arbonylgruppe 106 10.3 Darstellung 107 10.3.1 xidation von Alkoholen 107 10.3.2 eduktion
Reaktionstypen der Aromate
 Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
1. Partner und Widersacher - Sterik und Stereoelektronik
 Prof. Dr. liver eiser, Institut für rganische Chemie, Universität egensburg 1 1. Partner und Widersacher - terik und tereoelektronik 1.1. Das Konzept der terischen Effekte ubstituenten in Molekülen stoßen
Prof. Dr. liver eiser, Institut für rganische Chemie, Universität egensburg 1 1. Partner und Widersacher - terik und tereoelektronik 1.1. Das Konzept der terischen Effekte ubstituenten in Molekülen stoßen
1.4 Die elektrophile aromatische Substitution
 1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
Die verschiedenen Mechanismen der Nucleophilen Substitution
 Die verschiedenen Mechanismen der Nucleophilen Substitution Dinah Shafry 21. Juni 2010 Inhalt Vom Alkan zum Alkohol...2 Struktur der Alkane...2 Die Lösung des Problems...2 Die nucleophile Substitution...2
Die verschiedenen Mechanismen der Nucleophilen Substitution Dinah Shafry 21. Juni 2010 Inhalt Vom Alkan zum Alkohol...2 Struktur der Alkane...2 Die Lösung des Problems...2 Die nucleophile Substitution...2
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 10. Aldehyde und Ketone 10.1 Nomenklatur ' Aldehyd Keton thanal "Formaldehyd" hanal
Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 10. Aldehyde und Ketone 10.1 Nomenklatur ' Aldehyd Keton thanal "Formaldehyd" hanal
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
1. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2000
 Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Organische Chemie I. OC I Lehramt F. H. Schacher 1
 Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Geänderter Termin zur Nachholklausur: 11.April, Uhr, H46. Klausur zur Vorlesung OCII Reaktionsmechanismen WS 2007/2008.
 liver eiser, Institut für rganische Chemie der Universität egensburg Geänderter Termin zur Nachholklausur: 11.April, 10-12 Uhr, 46 Klausur zur Vorlesung CII eaktionsmechanismen W 2007/2008 Lösungsblatt
liver eiser, Institut für rganische Chemie der Universität egensburg Geänderter Termin zur Nachholklausur: 11.April, 10-12 Uhr, 46 Klausur zur Vorlesung CII eaktionsmechanismen W 2007/2008 Lösungsblatt
13.1. Struktur der Carbonyl-Gruppe, Prinzipielle Reaktivität
 13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
Darstellung von Phenolphthalein und Fluorescein
 Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
13. Amine und ihre Derivate
 Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition
 Inhalt Index 10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition Die C=O Doppelbindung der Carbonylgruppe ist die wichtigste funktionelle Gruppe der organischen Chemie. Dieses Kapitel befasst
Inhalt Index 10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition Die C=O Doppelbindung der Carbonylgruppe ist die wichtigste funktionelle Gruppe der organischen Chemie. Dieses Kapitel befasst
Organische Chemie I/II. Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter!
 Organische Chemie I/II Name: Fachprüfung Vorname: 5. Februar 2003, 15 30-18 30 h Matr.-Nr.: Raum 250 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10
Organische Chemie I/II Name: Fachprüfung Vorname: 5. Februar 2003, 15 30-18 30 h Matr.-Nr.: Raum 250 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10
Verzeichnis der Wortabkürzungen... Verzeichnis der Zeichen und Symbole...XVII
 VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
7. Oxidationsreaktionen
 7. xidationsreaktionen xidation Entzug von Elektronen durch ein geeignetes eagens, das xidationsmittel entweder wird Wasserstoff aus dem Molekül entfernt oder Sauerstoff eingefügt Industriell bzw. optimal:
7. xidationsreaktionen xidation Entzug von Elektronen durch ein geeignetes eagens, das xidationsmittel entweder wird Wasserstoff aus dem Molekül entfernt oder Sauerstoff eingefügt Industriell bzw. optimal:
Stoff der Vorlesung 3
 Stoff der Vorlesung 3 Übungen zur Oxida0on von Alkoholen und Aldehyden unter dem Gesichtspunkt formaler β- Eliminierungen: Anwendung in der Synthese der Prostaglandine Thermisch induzierte syn- β- Eliminierungen
Stoff der Vorlesung 3 Übungen zur Oxida0on von Alkoholen und Aldehyden unter dem Gesichtspunkt formaler β- Eliminierungen: Anwendung in der Synthese der Prostaglandine Thermisch induzierte syn- β- Eliminierungen
Carbonyl- und Enolatchemie
 Carbonyl- und Enolatchemie 1 Addition von rganometall-eagenzien an Carbonylverbindungen eformatzky-eaktion: Zn-eagenz weniger reaktiv als Grignard, greift keine Ester an! Br 2 Zn ZnBr 2 Br Zn 2 1 2 Barbier-eaktion:
Carbonyl- und Enolatchemie 1 Addition von rganometall-eagenzien an Carbonylverbindungen eformatzky-eaktion: Zn-eagenz weniger reaktiv als Grignard, greift keine Ester an! Br 2 Zn ZnBr 2 Br Zn 2 1 2 Barbier-eaktion:
10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition
 Friday, February 2, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition Die C=O Doppelbindung der Carbonylgruppe ist die wichtigste funktionelle
Friday, February 2, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition Die C=O Doppelbindung der Carbonylgruppe ist die wichtigste funktionelle
Organische Chemie für Mediziner WS 2016/2017. Übungsblatt 3: Ausgewählte Substanzklassen
 1 rganische hemie für Mediziner WS 2016/2017 Übungsblatt 3: Ausgewählte Substanzklassen 01 Die Siedetemperatur von Alkoholen unterscheidet sich deutlich von der ungefähr gleich schwerer Alkane (z.b. 3
1 rganische hemie für Mediziner WS 2016/2017 Übungsblatt 3: Ausgewählte Substanzklassen 01 Die Siedetemperatur von Alkoholen unterscheidet sich deutlich von der ungefähr gleich schwerer Alkane (z.b. 3
1.) Organometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte).
 Lösung zur Übung 7 1.) rganometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte). a) para-bromtoluol A wird mit n-butyllithium
Lösung zur Übung 7 1.) rganometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte). a) para-bromtoluol A wird mit n-butyllithium
Inhaltsverzeichnis Phosphor- und Schwefel-Yliden
 Inhaltsverzeichnis 3.6 Enolate von Carbonylverbindungen als Nukleophile 3.6.1 Allgemeines 3.6.2 Zur Darstellung von Enolaten und verwandten Spezies 3.6.3 Zur Spaltung von β-dicarbonylverbindungen 3.6.4
Inhaltsverzeichnis 3.6 Enolate von Carbonylverbindungen als Nukleophile 3.6.1 Allgemeines 3.6.2 Zur Darstellung von Enolaten und verwandten Spezies 3.6.3 Zur Spaltung von β-dicarbonylverbindungen 3.6.4
9 Reaktionen CH acider Verbindungen
 9 eaktionen acider Verbindungen 9.1 Brønsted-Aciditäten Die Stärke von Brønsted-Säuren wird durch ihren pk a -Wert quantifiziert, der stark vom Lösungsmittel abhängt. Beachten Sie, dass die Konzentration
9 eaktionen acider Verbindungen 9.1 Brønsted-Aciditäten Die Stärke von Brønsted-Säuren wird durch ihren pk a -Wert quantifiziert, der stark vom Lösungsmittel abhängt. Beachten Sie, dass die Konzentration
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen
 KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
REAKTIONEN DER ORGANISCHEN CHEMIE
 REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
s- und p-orbitale MO-Schema des Wasserstoffmoleküls H 2 y z z x p x p y p z antibindendes MO bindendes MO
 s- und p-rbitale y y z z x x s p x p y p z M-Schema des Wasserstoffmoleküls 2 antibindendes M 1s 1s bindendes M Merkmale wichtiger ybridorbitale sp 3 -ybridisierung: Tetraedrische Ausrichtung der ybridorbitale,
s- und p-rbitale y y z z x x s p x p y p z M-Schema des Wasserstoffmoleküls 2 antibindendes M 1s 1s bindendes M Merkmale wichtiger ybridorbitale sp 3 -ybridisierung: Tetraedrische Ausrichtung der ybridorbitale,
Reaktionsmechanismen der Organischen Chemie
 Peter Sykes Reaktionsmechanismen der Organischen Chemie Eine Einführung Mit einem Geleitwort von Lord A. R. Todd Übersetzt von Hans F. Ebel und Henning Hopf 9., überarbeitete Auflage Inhalt 1 Struktur,
Peter Sykes Reaktionsmechanismen der Organischen Chemie Eine Einführung Mit einem Geleitwort von Lord A. R. Todd Übersetzt von Hans F. Ebel und Henning Hopf 9., überarbeitete Auflage Inhalt 1 Struktur,
3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen.
 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Gruppe 5 eigener Versuch. Hydrolyse von 2-Chlor-2-methylpropan
 Philipps- Universität Marburg FB 15 Chemie rganisch-chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. eiß Datum: 27.05.09 SS 09 Gruppe 5 eigener Versuch ydrolyse von 2-Chlor-2-methylpropan
Philipps- Universität Marburg FB 15 Chemie rganisch-chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. eiß Datum: 27.05.09 SS 09 Gruppe 5 eigener Versuch ydrolyse von 2-Chlor-2-methylpropan
Crom(VI)-Reagenzien. bzw. Reagenzien: a) K 2. SO 4 ( wasserhaltig ) b) CrO 3. CrO 7. , verd. H 2. , Aceton (Jones-Reagenz)
 xidationen 1. (xidation von aktivierten Methyl- u. Methylengruppen) 2. Prim. Alkohol Aldehyd Carbonsäure Sek. Alkohol Keton 3. xidation von Doppelbindungen 4. xidative Spaltungen 5. (xidationen an eteroatomen)
xidationen 1. (xidation von aktivierten Methyl- u. Methylengruppen) 2. Prim. Alkohol Aldehyd Carbonsäure Sek. Alkohol Keton 3. xidation von Doppelbindungen 4. xidative Spaltungen 5. (xidationen an eteroatomen)
Diene: C n H 2n-2 : 2 Doppelbindungen
 Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
Additionen an Carbonylverbindungen
 Beispielaufgaben Ih. unde 018 Additionen an arbonylverbindungen Additionen an arbonylverbindungen Beispiel 1: Aldolreaktionen finden zwischen zwei arbonylverbindungen statt. Ein Beispiel dafür ist die
Beispielaufgaben Ih. unde 018 Additionen an arbonylverbindungen Additionen an arbonylverbindungen Beispiel 1: Aldolreaktionen finden zwischen zwei arbonylverbindungen statt. Ein Beispiel dafür ist die
Grundlagen der Organischen Chemie
 Grundlagen der Organischen Chemie Vorlesung im WS 2010/2011 1. Einführung 1 1.1 Die wunderbare Welt der Organischen Chemie 1.2 Kohlenstoff ein ganz besonderes Element 4 2. Die kovalente Bindung 5 2.1 Atomorbitale
Grundlagen der Organischen Chemie Vorlesung im WS 2010/2011 1. Einführung 1 1.1 Die wunderbare Welt der Organischen Chemie 1.2 Kohlenstoff ein ganz besonderes Element 4 2. Die kovalente Bindung 5 2.1 Atomorbitale
Aldehyde und Ketone. Aldehyde C 2 H 5 H 3 C. H Propanal Propionaldehyd. H Ethanal Acetaldehyd. H Methanal Formaldehyd. Benzaldehyd.
 Aldehyde und Ketone Aldehyde Methanal Formaldehyd 3 Ethanal Acetaldehyd 2 5 Propanal Propionaldehyd Benzaldehyd Ketone 3 3 2 5 Propanon Aceton 3 2 5 2-Butanon 2 5 3-Pentanon Acetophenon 3 Natürliche Aldehyde
Aldehyde und Ketone Aldehyde Methanal Formaldehyd 3 Ethanal Acetaldehyd 2 5 Propanal Propionaldehyd Benzaldehyd Ketone 3 3 2 5 Propanon Aceton 3 2 5 2-Butanon 2 5 3-Pentanon Acetophenon 3 Natürliche Aldehyde
Vorlesung "Organische Chemie 1" Übungsblatt 4
 Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Kapitel 4: Eliminierung - Übersicht
 » Reaktionstypen - 1,1-, 1,2-, 1,3-, 1,4-Eliminierung (α-, β-, γ-, δ- Eliminierung), thermische Fragmentierung, cis-eliminierung» Regel - Eliminierung wird begünstigt durch hohe Temperatur, starke Basen,
» Reaktionstypen - 1,1-, 1,2-, 1,3-, 1,4-Eliminierung (α-, β-, γ-, δ- Eliminierung), thermische Fragmentierung, cis-eliminierung» Regel - Eliminierung wird begünstigt durch hohe Temperatur, starke Basen,
Aufgaben zur Chemie der Alkohole und Ether (incl. deren Herstellung)
 Aufgaben zur Chemie der Alkohole und Ether (incl. deren erstellung) TGJ Nucleophile Substitution 1.1. Warum verlaufen nucleophile Substitutionen an Alkoholen leicht in saurer, nicht aber in basischer Lösung?
Aufgaben zur Chemie der Alkohole und Ether (incl. deren erstellung) TGJ Nucleophile Substitution 1.1. Warum verlaufen nucleophile Substitutionen an Alkoholen leicht in saurer, nicht aber in basischer Lösung?
O O. O Collins-Reagenz. AcO. K 2 CO 3 (MeOH) DIBAL-H (Tol) -78 C. COOH AcOH (H 2 O) OTHP
 Übung zur Vorlesung rganische Chemie II Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 10.1-100 a) Zn(B ) 2 Collins-Reagenz = Cr 3 * 2 py Kap. 6 - xidation (Siehe Zusatzmaterial) Das Collins-Reagenz ermöglicht
Übung zur Vorlesung rganische Chemie II Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 10.1-100 a) Zn(B ) 2 Collins-Reagenz = Cr 3 * 2 py Kap. 6 - xidation (Siehe Zusatzmaterial) Das Collins-Reagenz ermöglicht
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Ether sind organische Verbindungen mit einer Sauerstoffbrücke (als funktionelle Gruppe) zwischen zwei Alkyl, Aryl oder Alkenylresten.
 10. Ether Ether sind organische Verbindungen mit einer Sauerstoffbrücke (als funktionelle Gruppe) zwischen zwei Alkyl, Aryl oder Alkenylresten. Ether besitzen die allgemeine Summenformel: C n H 2n+2 O
10. Ether Ether sind organische Verbindungen mit einer Sauerstoffbrücke (als funktionelle Gruppe) zwischen zwei Alkyl, Aryl oder Alkenylresten. Ether besitzen die allgemeine Summenformel: C n H 2n+2 O
Organische Chemie III
 Organische Chemie III Sommersemester 2011 Technische Universität München Klausur am 17.06.2011 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
Organische Chemie III Sommersemester 2011 Technische Universität München Klausur am 17.06.2011 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
Bundesrealgymnasium Imst. Chemie Klasse 8. Reaktionsmechanismen der Aliphate
 Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Std. Stoffklassen Konzepte & Methoden Reaktionen 2 Struktur und Bindung 2 Alkane Radikale Radikal-Reaktionen 2 Cycloalkane Konfiguration &
 Materialien (Version: 26.06.2001) Diese Materialien dienen zur Überprüfung des Wissens und sind keine detailierten Lernunterlagen. Vorschlag: fragen Sie sich gegenseitig entsprechend dieser Listen ab.
Materialien (Version: 26.06.2001) Diese Materialien dienen zur Überprüfung des Wissens und sind keine detailierten Lernunterlagen. Vorschlag: fragen Sie sich gegenseitig entsprechend dieser Listen ab.
Chemie II. Vorlesung: Mo Uhr, HPT C103 Übungen: Mo Uhr, HCI H2.1, HCI J4
 hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
O + + R' Die langsamere Weiterreaktion des Sulfoxids führt zum Sulfon:
 6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
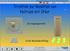
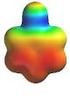
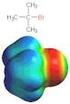
Organische Moleküle. Verschiedene Ansichten des Methans
 Organische Räumlicher Bau, Elektronendichteverteilungen Verschiedene Ansichten des Methans Ansicht des Methans mit seiner Elektronenhülle (Solid-Darstellung) Ansicht des Methans mit seiner Elektronenhülle
Organische Räumlicher Bau, Elektronendichteverteilungen Verschiedene Ansichten des Methans Ansicht des Methans mit seiner Elektronenhülle (Solid-Darstellung) Ansicht des Methans mit seiner Elektronenhülle
