DIAGNOSTIKA NACHRICHTEN
|
|
|
- Katrin Hoch
- vor 8 Jahren
- Abrufe
Transkript
1 Bio-Rad Laboratories CLINICAL DIAGNOSTICS dezember 2014 AUSGABE 59 getconnected DIAGNOSTIKA NACHRICHTEN Überarbeitung Rili-BÄK: das Wesentlichste für Sie zusammengefasst Am 19. September 2014 wurde eine überarbeitete Version der Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen (Rili-BÄK) veröffentlicht. Eines der Ziele der Überarbeitung war die Erstellung einer praxisnahen Tabelle B 1, die die Anwendung der Richtlinie in der Laborroutine widerspiegelt. Außerdem wurden textliche Änderungen und Ergänzungen vorgenommen. Diese betreffen unter anderem die Begriffsbestimmungen, die Anforderungen für die Ermittlung von laborinternen Fehlergrenzen sowie Ringversuche. Diese Änderungen haben wir für Sie zusammengefasst. Zusätzlich empfehlen wir Ihnen die Lektüre der Neufassung. Lesen Sie weiter auf Seite 2 > Nachgefragt: Qualitätskontrolle aus Sicht eines Fachgutachters Herr Dr. Schubert, Fachgutachter der DAkkS, beantwortet unsere Fragen zu den Anforderungen an Qualitätskontrollen in Bezug auf die ISO und Rili-BÄK. Troponin-T: mehr Sicherheit im Entscheidungsbereich Bei der Bestimmung von Troponin werden im niedrigen Konzentrationsbereich wichtige klinische Entscheidungen getroffen. Immunhämatologie: Praktische Tipps aus dem Servicelabor Wir nehmen die Themen, die Sie am häufigsten beschäftigen, genauer unter die Lupe. Lesen Sie weiter auf Seite 3 > Lesen Sie weiter auf Seite 4 > Lesen Sie weiter auf Seite 5 >
2 Bio-Rad Laboratories CLINICAL DIAGNOSTICS 2 Überarbeitung Rili-BÄK: das Wesentlichste für Sie zusammengefasst Tabelle B 1: Überarbeitet wurden für einige Parameter die Grenzen für die interne Qualitätssicherung (Spalte 3), die Gültigkeitsbereiche (Spalte 4) sowie die Grenzen für die Bewertung der Ringversuche (Spalte 5). Messgröße/Untersuchung Abweichung interne QS Gültigkeitsbereich Abweichung interne QS Gültigkeitsbereich Spalte 3 alt Spalte 4 alt Spalte 3 neu Spalte 4 neu ALT 11,5% 20 bis 300 U/I 11,5% 30 bis 300 U/l 0,33 bis 5,0 µkat/i 0,5 bis 5,0 µkat/l Alk. Phosphatase 13,0% 20 bis 600 U/I 11,0% 20 bis 600 U/l 0,33 bis 10 µkat/i 0,33 bis 10 µkat/l Neu: CA ,0% 10 bis 250 U/ml Neu: FSH 14,0% 4 bis 70 U/l pco 2 6,5% 15 bis 110 mmhg 7,5% 35 mmhg 6,5% > 35 mmhg Thyroxin, freies (ft4) 14,0% > 20 bis 85 ng/i 13,0% > 20 bis 85 ng/l > 26 bis 109 pmol/l > 26 bis 109 pmol/i 15,0% 2 bis 20 ng/i 2,6 bis 26 pmol/i Transferrin 9,5% 0,5 bis 6 g/l 8,0% 0,5 bis 6 g/l Trijodthyronin, freies (ft3) 14,5% 1 bis 25 ng/l 13,0% 1 bis 25 ng/l 1,5 bis 39 pmol/l 1,5 bis 39 pmol/l Vancomycin 13,0% > 15 bis 100 mg/l 12,0% 4 bis 100 mg/l 15,5% 4 bis 15 mg/l Neu aufgenommen wurden die Parameter CA 15-3 und FSH. Nicht mehr in Tabelle B 1 enthalten sind CA 19-9 und Lipase. Damit Sie auf einen Blick sehen, was sich geändert hat, sind alle Neuerungen der Tabelle B 1 a grün markiert. Tabelle B 1 a interne Qualitätssicherung Neben Änderungen in der Tabelle B 1 wurden auch textliche Unterschiede in den verschiedenen Teilen des Regelwerks angeglichen. So wurde beispielsweise der Kontrollzyklus einheitlich in Kontrollperiode umbenannt. Neu aufgenommen in die Begriffsbestimmungen unter Punkt 3 der Richtlinie wurden: Kontrollstamm, Standort und Validierung eines Untersuchungsergebnisses. Messgröße/Untersuchung Abweichung externe QS Abweichung externe QS Spalte 5 alt Spalte 5 neu Alk. Phosphatase 21,0% 18,0% Neu: CA ,0% Neu: FSH 21,0% Thyroxin, freies (ft4) 24,0% 20,0% Transferrin 15,0% 12,0% Trijodthyronin, freies (ft3) 24,0% 20,0% Vancomycin 21,0% 18,0% Tabelle B 1 a externe Qualitätssicherung Hilfreich ist auch der folgende Zusatz für die Ermittlung laborinterner Fehlergrenzen, der Ihnen einen größeren Handlungsspielraum bei der Anwendung der Rili-BÄK gibt: In begründeten Fällen kann die laboratoriumsinterne Fehlergrenze auch abweichend von diesem Verfahren festgelegt werden. Die Gründe und das gewählte Verfahren sind nachvollziehbar zu dokumentieren. B 1, (1) Weitere Ergänzungen erfolgten in den Richtlinienteilen B 1 und B 2 im Abschnitt Externe Qualitätssicherung (Ringversuche) : In Teil B 1 wurde die Aufbewahrung von Teilnahmebescheinigungen und Ringversuchszertifikaten hinzugefügt: B 1, 2.2 (5). Im Teil B 2 wurde ergänzt, dass die Teilnahmepflicht am Ringversuch für die in Tabelle B 2-2 gelisteten Untersuchungen unabhängig davon gilt, ob im Bericht oder Befund das Untersuchungsergebnis quantitativ oder qualitativ ausgewiesen wird: B 2, 2.2 (1). Darüber hinaus wurde in den Abschnitten Anforderungen an Ringversuche (E 1, E 2, E 4 und E 5) der Hinweis aufgenommen, dass Zertifikat und Teilnahmebescheinigung spätestens 4 Wochen vor dem nächsten Ringversuch an die Teilnehmer versendet werden sollen.
3 3 Die konsolidierte Fassung der Rili-BÄK wurde am 19. September 2014 im Deutschen Ärzteblatt veröffentlicht: Jahrgang 111, Heft 38, Seite A1583 A1618. Sie ist über die Homepage der Bundesärztekammer unter abrufbar. Dort finden Sie außerdem eine Version, in der alle Änderungen farblich markiert sind. Einfach und bequem gelangen Sie auch über unser Internetportal QCNet TM zu den Veröffentlichungen: Inkrafttreten: Die textlichen Anpassungen sind mit der Veröffentlichung am 19. September 2014 in Kraft getreten. Die Änderungen in der Tabelle B 1 treten am 1. Januar 2015 in Kraft. Fragen zur Richtlinie beantwortet Ihnen gerne Carmen Hansen. Schreiben Sie einfach eine an: [email protected] Carmen Hansen, Sales Consultants Manager Nachgefragt: Qualitätskontrolle aus Sicht eines Fachgutachters Herr Dr. Schubert, Fachgutachter der Deutschen Akkreditierungsstelle GmbH (DAkkS), beantwortet unsere Fragen zu den Anforderungen an Qualitätskontrollen in Bezug auf die ISO und Rili-BÄK. Herr Dr. Schubert, seit wann arbeiten Sie als Fachgutachter und was ist für Sie das Besondere an dieser Tätigkeit? Das medizinische Labor des Allgemeinen Krankenhauses Celle, in dem ich über 30 Jahre als Klinischer Chemiker tätig war, wurde 2001 nach ISO akkreditiert. Ich habe die Akkreditierung für unser Labor als sehr hilfreich empfunden. Ich selbst bin seit 2004 als Fachgutachter für den Bereich Klinische Chemie tätig. Diese Arbeit halte ich für sehr sinnvoll, denn die Begutachtung dient nicht nur der Kontrolle, sondern auch als Hilfestellung zur Verbesserung der Qualität. Die Akkreditierung medizinischer Laboratorien verlangt festgeschriebene Arbeitsabläufe und ein großes Maß an Disziplin von sämtlichen Mitarbeitern, auch denen der Leitungsebene. Dies steigert die Qualität und dient dem Schutz des Patienten. Die ISO verlangt zur Sicherstellung der Qualität der Untersuchungsergebnisse regelmäßige Qualitätskontrollmessungen. Wie lautet Ihre Empfehlung zur Häufigkeit von Kontrolluntersuchungen? Das Sektorkomitee Medizinische Laboratorien der DAkkS fordert bei Analysesystemen, die während eines Arbeitstages länger als 4 Stunden betrieben werden, zu Arbeitsbeginn zwei verschiedene Qualitätskontrollproben und zum Schluss mindestens eine Qualitätskontrollprobe. Somit sind mindestens drei Kontrollprobeneinzelmessungen durchzuführen. Ferner soll die Laborleitung über eine adäquate Zahl zwischengeschalteter Kontrollmessungen entscheiden. Aus fachlicher Sicht sollte auch bei kurzen Serien auf jeden Fall mit zwei Kontrollmessungen begonnen werden. Eine Endkontrolle wird häufig sinnvoll sein, auch wenn die Geräte keine vier Stunden betrieben werden. Bei hohem Probendurchsatz empfiehlt es sich, Kontrollmessungen zwischenzuschalten. Bei Grenzwertverletzungen der internen Qualitätskontrolle sind laut Beschluss des Sektorkomitees in der Regel alle Patientenproben rückwirkend bis zur letzten korrekten Qualitätskontrollmessung zu wiederholen. Abgesehen vom Qualitätsaspekt bedeutet das: Je weniger Kontrollmessungen zwischengeschaltet sind, umso mehr Arbeitszeit und Geld kostet die Wiederholung der Patientenmessungen. Die Forderungen der Rili-BÄK sind nicht ausreichend für die Akkreditierung. Die Akkreditierung nach ISO ist ein besonderes Qualitätsmerkmal, welches auch höhere Ansprüche stellt. Die ISO als auch die Rili-BÄK fordern den Einsatz von Kontrollen in medizinisch relevanten Konzentrationsbereichen. Was verstehen Sie darunter? Im Labor müssen grundsätzlich alle Messbereiche, die für ärztliche Entscheidungen relevant sind, mit Kontrollen in entsprechenden Konzentrationen abgesichert werden. Wenn sowohl ein Mangel als auch ein Überschuss einer bestimmten Substanz auf einen pathologischen Zustand hinweist, müssen beide Bereiche kontrolliert werden, da sie für ärztliche Entscheidungen wichtig sind. Auch das dazwischen liegende Referenzintervall ist medizinisch relevant und muss mit einer Qualitätskontrolle überprüft werden. Bei ausgesuchten Parametern ist es daher sehr sinnvoll, Kontrollmaterial in drei Konzentrationsbereichen einzusetzen. Können Sie Beispiele nennen? Bei Glukose sollte sowohl der hypo- und hyperglykämische Bereich als auch das Referenzintervall kontrolliert werden. Ähnliches gilt für TSH und Elektrolyte. Bei anderen Analyten wie den Transaminasen sind Kontrollen in zwei Konzentrationsbereichen ausreichend. Bei Troponin ist es sehr wichtig, eine Kontrolle im Entscheidungsbereich zu verwenden. Dann gibt es noch bestimmte Fälle, bei denen die medizinische Relevanz in ausgewählten Messbereichen liegt.
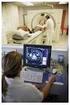
4 Bio-Rad Laboratories CLINICAL DIAGNOSTICS 4 So ist es zum Beispiel beim PSA nicht ausreichend, eine Kontrolle im Entscheidungsbereich zu verwenden. Vielmehr ist es hier zwingend notwendig, eine Kontrolle mit extrem niedriger Konzentration einzusetzen, da Urologen PSA zur Feststellung von Rezidiven von Prostata-Karzinomen anfordern. Gibt es Unterschiede zwischen den Anforderungen der Rili-BÄK und der ISO beim Einsatz von Kontrollen in medizinisch relevanten Konzentrationen? Nein, beides sehe ich gleich. Ich möchte aber auch anmerken, dass es nicht nur darum geht, Normen und Paragraphen zu erfüllen. Es ist wichtig, im Sinne des Patienten zu handeln und deshalb gerade in den für Diagnose und Therapie wichtigen Messbereichen zuverlässige Werte zu produzieren. Auch die MTAs müssen sich darauf verlassen können, dass die an Arzt und Einsender herausgegebenen Werte medizinisch sicher sind. Überprüfen Sie bei der Begutachtung den Einsatz von Kontrollen in medizinisch relevanten Bereichen? Ja, vor allem bei ausgesuchten Parametern wie der Glukose. Inwieweit tolerieren Sie generell Abweichungen bei der Begutachtung? Abweichungen bei den Anforderungen der Rili-BÄK, die bei der Begutachtung auch Teil der Checkliste sind, werden nicht akzeptiert. Ich habe auch keinen Spielraum bei den Forderungen des Sektorkomitees. Die Beschlüsse müssen beachtet werden. Haben Sie weitere Empfehlungen für medizinische Laboratorien? Wie schon gesagt, ist es wichtig, Kontrollen in medizinisch relevanten Konzentrationsbereichen einzusetzen, auch im Sinne der Patientensicherheit. Es ist auch sehr sinnvoll, unabhängige Kontrollen zu verwenden. Man sollte nicht unbedingt Kontrollmaterialien der Hersteller von Geräten und Reagenzien einsetzen, mit denen die Patientenproben abgearbeitet werden. Der Gebrauch von unabhängigen Kontrollen wird in der neuen Version der ISO 15189:2013 empfohlen. Ich halte das für einen guten Hinweis. Eine unabhängige Bewertung ist mir lieber als aufeinander abgestimmte Reagenzien, Kalibratoren und Kontrollen. Wichtig ist mir auch eine kritische Auseinandersetzung mit den Analyseverfahren. Dies bezieht sich auf Verifikation und Validation. Es sollte zum Beispiel mit Datum und Unterschrift dokumentiert werden, ob die beschriebenen Spezifikationen in der praktischen Erprobung auch erreicht werden und die Methode freigegeben werden kann. Auch auf eine ordentliche Dokumentation bei Fehlern und deren Behebung sowie bei Beschwerden und deren Bearbeitung lege ich großen Wert. Abschließend möchte ich nochmal anmerken, dass wir Gutachter uns als Helfer verstehen, nicht als Richter. Wir wollen dazu beitragen, dass die Qualität in medizinischen Laboratorien, falls möglich, noch besser wird. Herr Dr. Schubert, vielen Dank, dass Sie sich die Zeit für dieses Interview genommen haben. Wir haben das Interview während der diesjährigen Jahrestagung der Arbeitsgemeinschaft Akkreditierter Laboratorien in Mainz geführt. Ilka Richert, Sales Consultant Quality Controls Troponin-T: mehr Sicherheit im Entscheidungsbereich Bei der Bestimmung von Troponin werden im niedrigen Konzentrationsbereich wichtige klinische Entscheidungen getroffen, da sich hier die diagnostischen Cut-Off Werte befinden. Die neue Liquichek Cardiac Troponins Control wurde speziell für Roche-Analysesysteme entwickelt. Sie bietet Ihnen die Sicherheit, Ihre Messungen im Entscheidungsbereich zuverlässig zu überwachen. Zusätzlich erfüllen Sie die Empfehlung der ISO zur Verwendung von unabhängigem Kontrollmaterial. Ihre Vorteile auf einen Blick: drei medizinisch relevante Konzentrationen: Troponin T hs (pg/ml) exzellente Stabilität: - geöffnet 25 Tage bei 2 C bis 8 C haltbar - ungeöffnet 36 Monate bei -20 C bis -70 C haltbar flüssig, dadurch einfach in der Handhabung Haben wir Ihr Interesse geweckt? Fordern Sie noch heute Ihr kostenloses Muster an unter: [email protected] oder Auch für andere Systeme bieten wir Kontrollmaterialien für die Überwachung von Troponin-Bestimmungen im Entscheidungsbereich an. Gerne berät Sie Ihr Bio-Rad Mitarbeiter vor Ort. Stephanie Hahn, Team Leader Value Assignment Quality Controls
5 5 Immunhämatologie: Praktische Tipps aus dem Servicelabor In dieser Ausgabe von getconnected starten wir mit einer Serie von Fallbeispielen. Wir nehmen hier die Themen, die Sie am häufi gsten beschäftigen, genauer unter die Lupe. Fallbeispiel 1: Positive Null-Testzelle in der Serumgegenprobe Folgende Untersuchungen wurden angefordert: Blutgruppenbestimmung mit der ID-AB0/D+DAT Karte Serumeigenschaften (Serumgegenprobe) mit ID-NaCl Karte und ID-DiaCell AB0 Die ID-Karten zeigen folgende Reaktionen: Die Antigen-Eigenschaften der Erythrozyten zeigen positive Reaktionen in der Anti-A Kavität und beiden Anti-DVI-Kavitäten. Interpretation der ID-Karte: Blutgruppe A Rh (D) positiv. Die Serumgegenprobe weist das zu den Antigen- Eigenschaften korrespondierende Ergebnis auf: Positive Reaktion in der B-Testzelle. Zusätzlich zeigt sich eine unerwartete positive Reaktion in der Null-Testzelle. Auszug aus der Hämotherapie-Richtlinie (Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten; Gesamtnovelle 2005, Richtlinienanpassung 2010): Punkt beschreibt: Die AB0-Blutgruppenmerkmale sollten mit monoklonalen Testreagenzien Anti-A und Anti-B bestimmt und durch den Nachweis der Serumeigenschaften mit Testerythrozyten A(1), A(2), B und 0 abgesichert werden. Die Bestimmung ist nur vollständig, wenn sowohl die Erythrozytenmerkmale als auch die Serumeigenschaften untersucht worden sind. Wenn die Serumeigenschaften den Erythrozytenmerkmalen nicht entsprechen, ist die Ursache zu klären. Wo gehen Ihre Überlegungen hin? Handelt es sich um spezifi sche oder unspezifi sche irreguläre Antikörper? Trägt die Null-Testzelle das entsprechende Antigen? Wie gehen Sie weiter vor? Durchgeführt werden ein Antikörpersuchtest bei Raumtemperatur (NaCl) und 37 C LISS/Coombs mit ID-DiaCell I II III und Eigenkontrollen. Die ID-Karten zeigen folgende Reaktionen: Antikörpersuchtest mit ID-DiaCell I II III und Eigenkontrolle: Im indirekten Coombstest sind alle Reaktionen negativ. Antikörpersuchtest mit ID-DiaCell I II III und Eigenkontrolle: Bei Raumtemperatur (NaCl) reagieren die Testzellen II und III positiv.
6 Bio-Rad Laboratories CLINICAL diagnostics 6 Die Auswertung des Antikörpersuchtests erfolgt mit der Antigen-Tabelle: Es kommen mehrere Antikörper in Frage: Anti-E Anti-c Anti-Kp a Anti-Fy a Anti-Le b Anti-P1 Anti-M Anti-S Anti-Lu a Um die Spezifi tät des Antikörpers zu bestimmen, ist eine weiterführende Differenzierung mit dem ID-DiaPanel 1-11 notwendig. Da der Antikörpersuchtest nur eine Reaktion bei Raumtemperatur gezeigt hat, ist die Minimalanforderung der Ansatz im NaCl-Milieu bei Raumtemperatur. Die ID-Karten zeigen folgende Reaktionen: Antikörperdifferenzierung mit ID-DiaPanel 1-11: Bei Raumtemperatur (NaCl) reagieren die Testzellen 1,2,3,4,5,9,11 positiv. Die Auswertung der Antikörperdifferenzierung erfolgt mit der Antigen-Tabelle: Aufgrund der positiven Reaktionen deutet dieses Ergebnis auf einen spezifischen irregulären Antikörper vom Typ Anti-M hin. Begleitend dazu muss die Austestung der Patientenerythrozyten auf das korrespondierende Antigen erfolgen. In unserem Fallbeispiel trägt der Patient das M-Antigen nicht (ohne Abbildung).
7 7 Bitte beachten Sie, dass weitere Antikörper maskiert unter dem Anti-M liegen können, die dann weiter differenziert werden sollten. Hierfür bietet sich das 2. ID-DiaPanel 1-11 oder das ID-DiaPanel Plus 6 an. Die viel diskutierte Frage in diesem Fall: Ist das Anti-M im NaCl-Milieu bei Raumtemperatur relevant? Dieser Antikörper kommt oft als Antikörper der IgM Klasse vor, kleinere Anteile vom IgG Typ können beigemischt sein. Anti-M wie in diesem Fallbeispiel ist selten klinisch relevant. Sollte jedoch das Anti-M bei 37 C und/oder im indirekten Coombstest nachweisbar sein, ist es als potentiell klinisch relevant einzustufen. Weitere Informationen hierzu finden Sie im Technical Manual 15th Edition; AABB Die endgültige Entscheidung zur Verfahrensweise liegt in den Händen der transfusionsverantwortlichen Ärzte. Verwendete Reagenzien im Fallbeispiel: Artikelnr v v v v Beschreibung DiaClon AB0/D+DAT Karte NaCl, Kälte-Antikörper und Enzymtest Karte LISS/Coombs Karte ID-DiaCell AB0 Artikelnr. Beschreibung v ID-DiaCell I II III v ID-Diluent 2 ID-Inkubator 37S I; ID-Zentrifuge 24 S; ID-Pipetor FP-6 Die Ansätze erfolgten nach Packungsbeilage. Wie ist Ihre Meinung zu diesem Artikel? Wir freuen uns auf Ihre Rückmeldungen! Schreiben Sie einfach eine an: [email protected] Stefanie Gembe, Sales Consultant Immunhematology Schnell und sicher: Ausschluss oder Nachweis von MRSA Methicillinresistente Staphylococcus aureus (MRSA) Stämme zählen zu den häufigsten multiresistenten Erregern bei Infektionen in medizinischen und pflegerischen Einrichtungen. Damit Präventionsmaßnahmen gegen nosokomiale Infektionen frühzeitig umgesetzt werden können, hat sich ein Screening mit chromogenen Medien bewährt. Mit dem neuen MRSASelect II Medium können Sie MRSA schnell und zuverlässig identifizieren oder ausschließen. Die Vorteile auf einen Blick: Schnell: Positiver Nachweis bereits nach 18 Stunden, Ausschluss nach 28 Stunden Sicher: Einfache Interpretation durch große, farbintensive Kolonien Haben wir Ihr Interesse geweckt? Weitere Informationen erhalten Sie von Ingrid Hallmen: [email protected] oder Tel.: Ingrid Hallmen, Sales Consultant Microbiology
8 Bio-Rad Laboratories CLINICAL diagnostics Ihre Meinung ist uns wichtig Die vielen positiven Rückmeldungen, die wir zu jeder Ausgabe von getconnected erhalten, spornen uns an, auch zukünftig interessante und aktuelle Themen zu beleuchten. Bitte nehmen Sie sich eine Minute Zeit und beantworten Sie uns die folgenden Fragen, damit getconnected auch in Zukunft wertvoll für Sie bleibt. Einfach ankreuzen bzw. ausfüllen und an die 089 / faxen oder online teilnehmen unter: 1. Über welche Themenbereiche möchten Sie gerne in getconnected informiert werden? Autoimmundiagnostik Bakteriologie / Mykologie Diabetes Diagnostik Drogenanalytik Immunhämatologie Infektionsserologie Klinische HPLC Molekulare Diagnostik Qualitätskontroll- und Softwarelösungen Qualitätssicherung und Qualitätsmanagement im medizinischen Labor (Rili-BÄK, ISO 15189) 2. Wie empfinden Sie den Informationsgehalt von getconnected? Genau richtig Zuviel Zuwenig 3. Ihre Wünsche / Anregungen zu getconnected: 4. Möchten Sie getconnected weiterhin als gedruckte Ausgabe erhalten? Ja Nein 5. Nutzen Sie die angegebenen E-Links und QR-Codes, um weitere Informationen anzufordern? Ja Nein Vielen Dank für die Teilnahme! Wir freuen uns auf Ihr Feedback! getconnected DIAGNOSTIKA NACHRICHTEN Herausgeber Bio-Rad Laboratories GmbH Clinical Diagnostics Group Heidemannstraße München Tel.: 089/ Fax: 089/ Das Redaktionsteam von von getconnected wünscht wünscht allen Lesern allen eine Lesern schöne eine Vorweihnachtszeit, schöne Vorweihnachtszeit, besinnliche besinnliche Feiertage Feiertage und für das und Neue für das Jahr Neue viel Glück, Jahr viel Gesundheit Glück, Gesundheit Erfolg! und Erfolg!
DIAGNOSTIKA NACHRICHTEN. Immunhämatologie: Praktische Tipps aus dem Servicelabor
 Bio-Rad Laboratories CLINICAL DIAGNOSTICS SEPTEMBER 2015 AUSGABE 62 getconnected DIAGNOSTIKA NACHRICHTEN Immunhämatologie: Praktische Tipps aus dem Servicelabor Über die vielen positiven und konstruktiven
Bio-Rad Laboratories CLINICAL DIAGNOSTICS SEPTEMBER 2015 AUSGABE 62 getconnected DIAGNOSTIKA NACHRICHTEN Immunhämatologie: Praktische Tipps aus dem Servicelabor Über die vielen positiven und konstruktiven
Kurzanleitung. Qualitätssicherung in der Blutgruppenserologie Seite 1 von 11. Wöchentliche und tägliche Qualitätssicherung im Überblick 1
 in der Blutgruppenserologie Seite 1 von 11 Wöchentliche und tägliche im Überblick 1 Blutgruppenserologische Untersuchungen unterliegen den Regeln der der Bundesärztekammer (Hämotherapie-Richtlinien, zweite
in der Blutgruppenserologie Seite 1 von 11 Wöchentliche und tägliche im Überblick 1 Blutgruppenserologische Untersuchungen unterliegen den Regeln der der Bundesärztekammer (Hämotherapie-Richtlinien, zweite
Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie. Ilka Richert, Bio-Rad Laboratories GmbH
 Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie Ilka Richert, Bio-Rad Laboratories GmbH Hepatitis B Serokonversion Infektionsserologische Tests Sensitivität Spezifität Richtig pos. Ergebnisse
Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie Ilka Richert, Bio-Rad Laboratories GmbH Hepatitis B Serokonversion Infektionsserologische Tests Sensitivität Spezifität Richtig pos. Ergebnisse
DIAGNOSTIKA NACHRICHTEN. Zwei Geräte - gleiche Patientenwerte?
 Bio-Rad Laboratories CLINICAL DIAGNOSTICS JULI 2015 AUSGABE 61 getconnected DIAGNOSTIKA NACHRICHTEN Zwei Geräte - gleiche Patientenwerte? Bei der Bestimmung von Patientenwerten darf es keine Rolle spielen,
Bio-Rad Laboratories CLINICAL DIAGNOSTICS JULI 2015 AUSGABE 61 getconnected DIAGNOSTIKA NACHRICHTEN Zwei Geräte - gleiche Patientenwerte? Bei der Bestimmung von Patientenwerten darf es keine Rolle spielen,
Rili-BÄK Spezieller Teil B 3. Carmen Hansen, Bio-Rad Laboratories GmbH
 Rili-BÄK Spezieller Teil B 3 Carmen Hansen, Bio-Rad Laboratories GmbH Spezieller Teil B 3 Direkter Nachweis und Charakterisierung von Infektionserregern Deutsches Ärzteblatt, Jahrgang 110, Heft 12, 22.
Rili-BÄK Spezieller Teil B 3 Carmen Hansen, Bio-Rad Laboratories GmbH Spezieller Teil B 3 Direkter Nachweis und Charakterisierung von Infektionserregern Deutsches Ärzteblatt, Jahrgang 110, Heft 12, 22.
Umsetzung der Rili-BÄK 2008 Erfahrungen der Überwachungsbehörde in Sachsen
 Umsetzung der Rili-BÄK 2008 Erfahrungen der Überwachungsbehörde in Sachsen 1 22. November 2011 Gabriele Schmidt Rechtliche Grundlagen In 4a MPBetreibV Verankerung der Richtlinie der Bundesärztekammer zur
Umsetzung der Rili-BÄK 2008 Erfahrungen der Überwachungsbehörde in Sachsen 1 22. November 2011 Gabriele Schmidt Rechtliche Grundlagen In 4a MPBetreibV Verankerung der Richtlinie der Bundesärztekammer zur
Reicht positiv und negativ aus? Qualitätskontrolle bei qualitativen Untersuchungen
 Reicht positiv und negativ aus? Qualitätskontrolle bei qualitativen Untersuchungen 1 Nürnberg, Köln, Hamburg, 2018 Ilka Richert, Bio-Rad Laboratories FAQ s Rili-BÄK Wie sind hinsichtlich der Zuordnung
Reicht positiv und negativ aus? Qualitätskontrolle bei qualitativen Untersuchungen 1 Nürnberg, Köln, Hamburg, 2018 Ilka Richert, Bio-Rad Laboratories FAQ s Rili-BÄK Wie sind hinsichtlich der Zuordnung
Rili-BÄK Spezieller Teil B 2. Carmen Hansen, Bio-Rad Laboratories GmbH
 Rili-BÄK Spezieller Teil B 2 Carmen Hansen, Bio-Rad Laboratories GmbH Rili-BÄK komplett Teil A: Grundlegende Anforderungen seit April 2010 Teil B 1: Quantitativ Teil B 2: Qualitativ Teil B 3: Infektionsserologie
Rili-BÄK Spezieller Teil B 2 Carmen Hansen, Bio-Rad Laboratories GmbH Rili-BÄK komplett Teil A: Grundlegende Anforderungen seit April 2010 Teil B 1: Quantitativ Teil B 2: Qualitativ Teil B 3: Infektionsserologie
Landesamt für f r soziale Dienste - Abt. Gesundheitsschutz - Schleswig-Holstein. Erfahrungsbericht
 RiliBÄK 2008 Erfahrungsbericht 1 Zuständige Behörde in Ministerium für Soziales, Gesundheit, Familie, Jugend und Senioren Landesamt für soziale Dienste Schleswig- Holstein - Abteilung Gesundheitsschutz
RiliBÄK 2008 Erfahrungsbericht 1 Zuständige Behörde in Ministerium für Soziales, Gesundheit, Familie, Jugend und Senioren Landesamt für soziale Dienste Schleswig- Holstein - Abteilung Gesundheitsschutz
Überwachung der Qualitätssicherung laboratoriumsmedizinischer Untersuchungen nach der Richtlinie der Bundesärztekammer vom
 1. Grundsätze der Qualitätssicherung 1 (1) 1 (3) Wird für alle vom medizinischen Laboratorium durchgeführten quantitativen laboratoriumsmedizinischen Untersuchungen eine interne Qualitätssicherung durchgeführt?
1. Grundsätze der Qualitätssicherung 1 (1) 1 (3) Wird für alle vom medizinischen Laboratorium durchgeführten quantitativen laboratoriumsmedizinischen Untersuchungen eine interne Qualitätssicherung durchgeführt?
getconnected DIAGNOSTIKA NACHRICHTEN
 getconnected DIAGNOSTIKA NACHRICHTEN 71 Juni 2018 IHD: Praktische Tipps aus dem Servicelabor Vielen Dank für Ihr Feedback und Ihre Ideen zu den bereits vorgestellten Fallbeispielen! Wir greifen in dieser
getconnected DIAGNOSTIKA NACHRICHTEN 71 Juni 2018 IHD: Praktische Tipps aus dem Servicelabor Vielen Dank für Ihr Feedback und Ihre Ideen zu den bereits vorgestellten Fallbeispielen! Wir greifen in dieser
Neue RiliBÄK Teil B1. W.Vogt Heidelberg 14./15. September 2007
 Neue RiliBÄK Teil B1 W.Vogt Heidelberg 14./15. September 2007 RiliBÄK 2008 Begründung Vorgehen Bewertung (Tab. B1) Problemfelder der RiliBÄK 2001 Vorgehen in der Realität und in der RiliBÄK stimmen nicht
Neue RiliBÄK Teil B1 W.Vogt Heidelberg 14./15. September 2007 RiliBÄK 2008 Begründung Vorgehen Bewertung (Tab. B1) Problemfelder der RiliBÄK 2001 Vorgehen in der Realität und in der RiliBÄK stimmen nicht
INFORMATIONEN FÜR DIE PRAXIS
 INFORMATIONEN FÜR DIE PRAXIS Labor September 2011 Qualitätssicherung laboratoriumsmedizinischer Untersuchungen: Erläuterungen zur Richtlinie der Bundesärztekammer Für Laboruntersuchungen gelten umfangreiche
INFORMATIONEN FÜR DIE PRAXIS Labor September 2011 Qualitätssicherung laboratoriumsmedizinischer Untersuchungen: Erläuterungen zur Richtlinie der Bundesärztekammer Für Laboruntersuchungen gelten umfangreiche
Checkliste Patientennahe Sofortdiagnostik mit Unit-use-Reagenzien. Mess- und Eichwesen Baden-Württemberg. Frage. Teil B1. Nein. n.z.
 2.1.5 Patientennahe Sofortdiagnostik mit Unit-use-Reagenzien 2.1.5 (1) Satz 1 und Satz 2 Satz 3 Werden Unit-use-Reagenzien und die entsprechenden Messsysteme in der patientennahen Sofortdiagnostik nach
2.1.5 Patientennahe Sofortdiagnostik mit Unit-use-Reagenzien 2.1.5 (1) Satz 1 und Satz 2 Satz 3 Werden Unit-use-Reagenzien und die entsprechenden Messsysteme in der patientennahen Sofortdiagnostik nach
Rili-BÄK 2008 Wird es einfacher? Carmen Hansen, Bio-Rad Laboratories GmbH
 Rili-BÄK 2008 Wird es einfacher? Carmen Hansen, Bio-Rad Laboratories GmbH Warum ist der Teil B 1 erforderlich? Herausforderungen Rili-BÄK 2001 Prä-/ Postanalytik nicht erfasst Rili-BÄK pflichtige Analyte
Rili-BÄK 2008 Wird es einfacher? Carmen Hansen, Bio-Rad Laboratories GmbH Warum ist der Teil B 1 erforderlich? Herausforderungen Rili-BÄK 2001 Prä-/ Postanalytik nicht erfasst Rili-BÄK pflichtige Analyte
Rili-BÄK Fortbildungsprogramm: Neue Richtlinienteile und Erfahrungen. Carmen Hansen und Olaf Kirchner, Bio-Rad Laboratories GmbH
 Rili-BÄK Fortbildungsprogramm: Neue Richtlinienteile und Erfahrungen Carmen Hansen und Olaf Kirchner, Bio-Rad Laboratories GmbH Struktur Rili-BÄK: A Grundlegende Anforderungen B Spezielle Teile Teil B
Rili-BÄK Fortbildungsprogramm: Neue Richtlinienteile und Erfahrungen Carmen Hansen und Olaf Kirchner, Bio-Rad Laboratories GmbH Struktur Rili-BÄK: A Grundlegende Anforderungen B Spezielle Teile Teil B
Das Labor in der Arztpraxis
 Landesamt für soziale Dienste Das Labor in der Arztpraxis Allgemeine Anforderungen, Qualitätssicherung, Hygiene Fortbildungsveranstaltung - Fachnachmittag 03. Juni 2015 13.00 Uhr bis 17.00 Uhr Landesamt
Landesamt für soziale Dienste Das Labor in der Arztpraxis Allgemeine Anforderungen, Qualitätssicherung, Hygiene Fortbildungsveranstaltung - Fachnachmittag 03. Juni 2015 13.00 Uhr bis 17.00 Uhr Landesamt
Thema: Labor Oktober Qualitätssicherung laboratoriumsmedizinischer Untersuchungen: Erläuterungen zur Richtlinie der Bundesärztekammer
 Qualitätssicherung laboratoriumsmedizinischer : Erläuterungen zur Richtlinie der Bundesärztekammer Für Laboruntersuchungen gelten umfangreiche Vorgaben zur Qualitätssicherung. Grundlage bildet die Richtlinie
Qualitätssicherung laboratoriumsmedizinischer : Erläuterungen zur Richtlinie der Bundesärztekammer Für Laboruntersuchungen gelten umfangreiche Vorgaben zur Qualitätssicherung. Grundlage bildet die Richtlinie
Qualitätsmanagement im immunhämatologischen Labor
 Qualitätsmanagement im immunhämatologischen Labor WOLF D. KUHLMANN MVZ für Laboratoriumsmedizin Koblenz-Mittelrhein Viktoriastrasse 39, 56068 Koblenz Das Transfusionsgesetz (TFG) regelt seit 1998 sowohl
Qualitätsmanagement im immunhämatologischen Labor WOLF D. KUHLMANN MVZ für Laboratoriumsmedizin Koblenz-Mittelrhein Viktoriastrasse 39, 56068 Koblenz Das Transfusionsgesetz (TFG) regelt seit 1998 sowohl
Landesamt für f r soziale Dienste - Abt. Gesundheitsschutz - Schleswig-Holstein. Erfahrungsbericht
 RiliBÄK 2008 Erfahrungsbericht Zuständige Behörde in Ministerium für Soziales, Gesundheit, Familie, Jugend und Senioren Landesamt für soziale Dienste Schleswig- Holstein - Abteilung Gesundheitsschutz -
RiliBÄK 2008 Erfahrungsbericht Zuständige Behörde in Ministerium für Soziales, Gesundheit, Familie, Jugend und Senioren Landesamt für soziale Dienste Schleswig- Holstein - Abteilung Gesundheitsschutz -
Teil B 1 Rili-BÄK 2008 Vertiefungsmodul. Carmen Hansen und Olaf Kirchner, Bio-Rad Laboratories GmbH
 Teil B 1 Rili-BÄK 2008 Vertiefungsmodul Carmen Hansen und Olaf Kirchner, Bio-Rad Laboratories GmbH Rili-BÄK: Aktueller Stand der Dinge Rili-BÄK 2001: Rili-BÄK 2008: Qualitätskontrolle Qualitätssicherung
Teil B 1 Rili-BÄK 2008 Vertiefungsmodul Carmen Hansen und Olaf Kirchner, Bio-Rad Laboratories GmbH Rili-BÄK: Aktueller Stand der Dinge Rili-BÄK 2001: Rili-BÄK 2008: Qualitätskontrolle Qualitätssicherung
Umsetzung der RiliBäk Teil B
 Umsetzung der RiliBäk Teil B Die Ausgangssituation: Die Übergangsfrist für die neue RiliBäk läuft am 31.03.2010 ab Der Teil A (QMS) wurde schon umgesetzt oder ist in Arbeit Das durchgeführte Update der
Umsetzung der RiliBäk Teil B Die Ausgangssituation: Die Übergangsfrist für die neue RiliBäk läuft am 31.03.2010 ab Der Teil A (QMS) wurde schon umgesetzt oder ist in Arbeit Das durchgeführte Update der
Teil A Rili-BÄK 2008 Vertiefungsmodul. Peter Ackermann, Bio-Rad Laboratories GmbH
 Teil A Rili-BÄK 2008 Vertiefungsmodul Peter Ackermann, Bio-Rad Laboratories GmbH Neue Rili-BÄK Teil A Beschreibt die grundlegenden Anforderungen an die Qualitätssicherung laboratoriumsmedizinischer Untersuchungen
Teil A Rili-BÄK 2008 Vertiefungsmodul Peter Ackermann, Bio-Rad Laboratories GmbH Neue Rili-BÄK Teil A Beschreibt die grundlegenden Anforderungen an die Qualitätssicherung laboratoriumsmedizinischer Untersuchungen
Bio-Rad Fortbildungsprogramm 2015
 Bio-Rad Laboratories FORTBILDUNGSPROGRAMM 2015 Bio-Rad Fortbildungsprogramm 2015 Herausforderungen der Qualitätssicherung in der Mikrobiologie und Infektionsserologie Organisatorisches Beginn der Veranstaltung:
Bio-Rad Laboratories FORTBILDUNGSPROGRAMM 2015 Bio-Rad Fortbildungsprogramm 2015 Herausforderungen der Qualitätssicherung in der Mikrobiologie und Infektionsserologie Organisatorisches Beginn der Veranstaltung:
DIAGNOSTIKA NACHRICHTEN. Viertes internationales QC-Experten Meeting in Köln, Teil 5
 Bio-Rad Laboratories CLINICAL DIAGNOSTICS Dezember 2013 AUSGAbe 55 getconnected DIAGNOSTIKA NACHRICHTEN Viertes internationales QC-Experten Meeting in Köln, Teil 5 Im letzten Teil unserer Reihe informieren
Bio-Rad Laboratories CLINICAL DIAGNOSTICS Dezember 2013 AUSGAbe 55 getconnected DIAGNOSTIKA NACHRICHTEN Viertes internationales QC-Experten Meeting in Köln, Teil 5 Im letzten Teil unserer Reihe informieren
PeliCase 2 Best.-Nr
 PeliCase 2 Best.-Nr. 546009 Charge: 8000243354 Verfallsdatum: 2017-12-11 Name: Krankenhaus: Unterschrift: Station: Fall: Frau Jonkhuis (63 Jahre alt) wurde am Darm operiert und ist erneut für eine Operation
PeliCase 2 Best.-Nr. 546009 Charge: 8000243354 Verfallsdatum: 2017-12-11 Name: Krankenhaus: Unterschrift: Station: Fall: Frau Jonkhuis (63 Jahre alt) wurde am Darm operiert und ist erneut für eine Operation
Qualitätsmanagement = Patientensicherheit?
 Qualitätsmanagement = Patientensicherheit? Was wollen wir nicht?!!! Erwartungen Qualität Auch die Politik hat erkannt, dass Qualität in der Medizin wichtig ist, denn schlechte Qualität kostet Geld und
Qualitätsmanagement = Patientensicherheit? Was wollen wir nicht?!!! Erwartungen Qualität Auch die Politik hat erkannt, dass Qualität in der Medizin wichtig ist, denn schlechte Qualität kostet Geld und
getconnected DIAGNOSTIKA NACHRICHTEN
 getconnected DIAGNOSTIKA NACHRICHTEN 65 JULI 216 Dokumentation nach ISO 15189 - eine Herausforderung? Lesen Sie hier, wie am Institut für Klinische Chemie und Klinische Pharmakologie / Zentrallabor des
getconnected DIAGNOSTIKA NACHRICHTEN 65 JULI 216 Dokumentation nach ISO 15189 - eine Herausforderung? Lesen Sie hier, wie am Institut für Klinische Chemie und Klinische Pharmakologie / Zentrallabor des
DIAGNOSTIKA NACHRICHTEN. Neue FAQ zur Rili-BÄK veröffentlicht
 Bio-Rad Laboratories CLINICAL DIAGNOSTICS DEZEMBEr 2010 AUSGABE 43 getconnected DIAGNOSTIKA NACHRICHTEN Neue FAQ zur Rili-BÄK veröffentlicht Im Oktober hat die Bundesärztekammer ihre Sammlung der Häufig
Bio-Rad Laboratories CLINICAL DIAGNOSTICS DEZEMBEr 2010 AUSGABE 43 getconnected DIAGNOSTIKA NACHRICHTEN Neue FAQ zur Rili-BÄK veröffentlicht Im Oktober hat die Bundesärztekammer ihre Sammlung der Häufig
Das ABO System. Praktikum für Medizinstudenten im IV Jahrgang. Zsuzsa Faust MD, PhD Zita Csernus MD
 Das ABO System Praktikum für Medizinstudenten im IV Jahrgang Zsuzsa Faust MD, PhD Zita Csernus MD Regionale Bluttransfusionszentrale von Pécs Nationaler Bluttransfusionsdienst [email protected] Blutgruppensysteme
Das ABO System Praktikum für Medizinstudenten im IV Jahrgang Zsuzsa Faust MD, PhD Zita Csernus MD Regionale Bluttransfusionszentrale von Pécs Nationaler Bluttransfusionsdienst [email protected] Blutgruppensysteme
Anforderungen an die interne und externe Qualitätskontrolle des POCT
 Anforderungen an die interne und externe Qualitätskontrolle des POCT Dr. rer. nat. Manfred Falck Zentrallabor Zentralinstitut für Klinische Chemie und Laboratoriumsdiagnostik Direktor Univ.-Prof. Dr. F.
Anforderungen an die interne und externe Qualitätskontrolle des POCT Dr. rer. nat. Manfred Falck Zentrallabor Zentralinstitut für Klinische Chemie und Laboratoriumsdiagnostik Direktor Univ.-Prof. Dr. F.
Rili-BÄK- Was gibt es Neues?
 Rili-BÄK- Was gibt es Neues? 11. Dresdner MTA-Tag, 11. März 2015 Geeicht auf Sachsen! Gliederung 1. Einleitung 2. Neuerungen im Eichwesen 3. Neufassung Rili-BÄK 4. Rili-BÄK Teil B 3 5. Fragen 2 11. März
Rili-BÄK- Was gibt es Neues? 11. Dresdner MTA-Tag, 11. März 2015 Geeicht auf Sachsen! Gliederung 1. Einleitung 2. Neuerungen im Eichwesen 3. Neufassung Rili-BÄK 4. Rili-BÄK Teil B 3 5. Fragen 2 11. März
RiliBÄK und Immundiagnostik
 RiliBÄK und Immundiagnostik 6. Immundiagnostisches Meeting Dresden 7.10.008 Dr. Christoph M. Niederau Labor Dr. Niederau und Kollegen GbR Medizinisches Versorgungszentrum für Labormedizin, Mikrobiologie
RiliBÄK und Immundiagnostik 6. Immundiagnostisches Meeting Dresden 7.10.008 Dr. Christoph M. Niederau Labor Dr. Niederau und Kollegen GbR Medizinisches Versorgungszentrum für Labormedizin, Mikrobiologie
RhD-Bestimmung. Bedside-Test Antikörpersuchtest Dr. Vera Pászthy
 RhD-Bestimmung Bedside-Test Antikörpersuchtest 2013. 11. 18. Dr. Vera Pászthy Nationaler Bluttransfusionsdienst Regionale Bluttransfusionszentrale Pécs natürlich vorkommende Antikörper (REGULÄRE) A - anti-b
RhD-Bestimmung Bedside-Test Antikörpersuchtest 2013. 11. 18. Dr. Vera Pászthy Nationaler Bluttransfusionsdienst Regionale Bluttransfusionszentrale Pécs natürlich vorkommende Antikörper (REGULÄRE) A - anti-b
Messunsicherheit, Gerätevergleich & Co - einfach umgesetzt mittels QC-Datenmanagement
 Messunsicherheit, Gerätevergleich & Co - einfach umgesetzt mittels QC-Datenmanagement 1 Nürnberg, Köln, Hamburg, 2018 Wolfgang Riedl, Bio-Rad Laboratories Unity Real Time 2.0 & ISO 15189 Anforderungen
Messunsicherheit, Gerätevergleich & Co - einfach umgesetzt mittels QC-Datenmanagement 1 Nürnberg, Köln, Hamburg, 2018 Wolfgang Riedl, Bio-Rad Laboratories Unity Real Time 2.0 & ISO 15189 Anforderungen
getconnected DIAGNOSTIKA NACHRICHTEN
 getconnected DIAGNOSTIKA NACHRICHTEN 67 März 2017 Carbapenemase-Testung leicht gemacht Die Testung auf multiresistente Erreger stellt das Labor oft vor eine Herausforderung. Konventionelle Methoden sind
getconnected DIAGNOSTIKA NACHRICHTEN 67 März 2017 Carbapenemase-Testung leicht gemacht Die Testung auf multiresistente Erreger stellt das Labor oft vor eine Herausforderung. Konventionelle Methoden sind
Rili-BÄK 2008 Qualitätssicherung in medizinischen Laboratorien
 Rili-BÄK 2008 Qualitätssicherung in medizinischen Laboratorien Ministerium für Arbeit, Gesundheit und Soziales des Landes Medizinproduktegesetz (MPG) 14 Medizinprodukte dürfen nur nach Maßgabe der Rechtsverordnung
Rili-BÄK 2008 Qualitätssicherung in medizinischen Laboratorien Ministerium für Arbeit, Gesundheit und Soziales des Landes Medizinproduktegesetz (MPG) 14 Medizinprodukte dürfen nur nach Maßgabe der Rechtsverordnung
PeliCase 1 Best.-Nr
 PeliCase 1 Best.-Nr. 546009 Charge: 8000239827 Verfallsdatum: 2017-06-27 Name: Krankenhaus: Unterschrift: Station: Fall: Herr Wanderer (63 Jahre alt) wurde beim Überqueren der Strasse von einem Auto angefahren.
PeliCase 1 Best.-Nr. 546009 Charge: 8000239827 Verfallsdatum: 2017-06-27 Name: Krankenhaus: Unterschrift: Station: Fall: Herr Wanderer (63 Jahre alt) wurde beim Überqueren der Strasse von einem Auto angefahren.
Sächsisches Landesamt für Mess- und Eichwesen. Bio-Rad Laboratories Fortbildungsprogramm Rili-BÄK 2008, Vertiefungsmodul.
 Bio-Rad Laboratories Fortbildungsprogramm Rili-BÄK 2008, Vertiefungsmodul Rili-BÄK 2008 aus der Sicht der Überwachungsbehörde in Sachsen Gabriele Schmidt Sächsisches Landesamt für Mess- und Eichwesen 11.11.2009
Bio-Rad Laboratories Fortbildungsprogramm Rili-BÄK 2008, Vertiefungsmodul Rili-BÄK 2008 aus der Sicht der Überwachungsbehörde in Sachsen Gabriele Schmidt Sächsisches Landesamt für Mess- und Eichwesen 11.11.2009
Informationsblatt. 2. Begriffe
 Informationsblatt Patientennahe Sofortdiagnostik (POCT) mit Unit-use-Reagenzien nach der Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen (Rili-BÄK 2014)
Informationsblatt Patientennahe Sofortdiagnostik (POCT) mit Unit-use-Reagenzien nach der Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen (Rili-BÄK 2014)
PeliCase 1 Best.-Nr
 PeliCase 1 Best.-Nr. 546009 Charge: 8000233305 Verfallsdatum: 2016-12-13 Name: Krankenhaus: Unterschrift: Station: Fall: Frau Claasen (63 Jahre alt) wurde in die chirurgische Abteilung Ihres Krankenhauses
PeliCase 1 Best.-Nr. 546009 Charge: 8000233305 Verfallsdatum: 2016-12-13 Name: Krankenhaus: Unterschrift: Station: Fall: Frau Claasen (63 Jahre alt) wurde in die chirurgische Abteilung Ihres Krankenhauses
DIAGNOSTIKA NACHRICHTEN
 Bio-Rad Laboratories CLINICAL DIAGNOSTICS April 2014 AUSGABE 56 getconnected DIAGNOSTIKA NACHRICHTEN Schneller - effizienter - einfacher arbeiten Workflow-Analyse in der Immunhämatologie Jeder kennt das
Bio-Rad Laboratories CLINICAL DIAGNOSTICS April 2014 AUSGABE 56 getconnected DIAGNOSTIKA NACHRICHTEN Schneller - effizienter - einfacher arbeiten Workflow-Analyse in der Immunhämatologie Jeder kennt das
Erfahrungsbericht zur Umsetzung der Teile A und B 1 aus der Sicht der Überwachungsbehörde
 Erfahrungsbericht zur Umsetzung der Teile A und B 1 aus der Sicht der Überwachungsbehörde Fortbildungsveranstaltung der Firma Bio-Rad Laboratories GmbH 17. Oktober 2011 Mainz Was immer wieder gefragt wird!
Erfahrungsbericht zur Umsetzung der Teile A und B 1 aus der Sicht der Überwachungsbehörde Fortbildungsveranstaltung der Firma Bio-Rad Laboratories GmbH 17. Oktober 2011 Mainz Was immer wieder gefragt wird!
Blutgruppenserologische Untersuchungen und. Transfusion
 Teil I Ernst-Moritz-Arndt-Universität, Praktikum Transfusionsmedizin Blutgruppenserologische Untersuchungen und Transfusion Blutgruppenbestimmung, Antikörperscreening serologische Verträglichkeitsprobe
Teil I Ernst-Moritz-Arndt-Universität, Praktikum Transfusionsmedizin Blutgruppenserologische Untersuchungen und Transfusion Blutgruppenbestimmung, Antikörperscreening serologische Verträglichkeitsprobe
Statistik Klausur. 1. a) Wie erfolgt die Erkennung systematische Fehler im Labor? b) Wie erfolgt die Erkennung zufälliger Fehler im Labor?
 Statistik Klausur 1. a) Wie erfolgt die Erkennung systematische Fehler im Labor? b) Wie erfolgt die Erkennung zufälliger Fehler im Labor? a) durch Richtigkeitskontrolle b) durch Präzisionskontrolle 2.
Statistik Klausur 1. a) Wie erfolgt die Erkennung systematische Fehler im Labor? b) Wie erfolgt die Erkennung zufälliger Fehler im Labor? a) durch Richtigkeitskontrolle b) durch Präzisionskontrolle 2.
Referenz- und Kreuzprobenlabor Immunhämatologie
 Referenz- und Kreuzprobenlabor Immunhämatologie Blutgruppe Methode: Material: Indikation: Transport: Hämagglutinationtest (Antigenaustestung, Isoagglutinine und Antikörpersuchtest) 10 ml Nativ-Blut (ohne
Referenz- und Kreuzprobenlabor Immunhämatologie Blutgruppe Methode: Material: Indikation: Transport: Hämagglutinationtest (Antigenaustestung, Isoagglutinine und Antikörpersuchtest) 10 ml Nativ-Blut (ohne
mvzlm RUHR REFERENZWERTTABELLE
 Blutgruppe / AK-Suchtest vor erwarteter bzw. wahrscheinlicher Transfusion; vor Therapie mit monoklonalen Antikörpern Material: EDTA, 7,5 ml Häufigkeit: 24 h täglich Meßverfahren: Agglutinationsverfahren
Blutgruppe / AK-Suchtest vor erwarteter bzw. wahrscheinlicher Transfusion; vor Therapie mit monoklonalen Antikörpern Material: EDTA, 7,5 ml Häufigkeit: 24 h täglich Meßverfahren: Agglutinationsverfahren
DIAGNOSTIKA NACHRICHTEN. Der professionelle Blick von außen: Mit der Workflow-Analyse Arbeitsabläufe verbessern. Rili-BÄK: Neue FAQs veröffentlicht
 CLINICAL DIAGNOSTICS DEZEMBER 2015 AUSGABE 63 getconnected DIAGNOSTIKA NACHRICHTEN Der professionelle Blick von außen: Mit der Workflow-Analyse Arbeitsabläufe verbessern Im Institut für Transfusionsmedizin
CLINICAL DIAGNOSTICS DEZEMBER 2015 AUSGABE 63 getconnected DIAGNOSTIKA NACHRICHTEN Der professionelle Blick von außen: Mit der Workflow-Analyse Arbeitsabläufe verbessern Im Institut für Transfusionsmedizin
Blutgruppenserologie und Immunhämatologie
 Blutgruppenserologie und Immunhämatologie Blutgruppenbestimmung (ABO, RhD, Rh-Untergruppe, Kell, Antikörpersuchtest) Indikation: Serologische Bestimmung der Blutgruppenmerkmale und Durchführung des Antikörpersuchtests,
Blutgruppenserologie und Immunhämatologie Blutgruppenbestimmung (ABO, RhD, Rh-Untergruppe, Kell, Antikörpersuchtest) Indikation: Serologische Bestimmung der Blutgruppenmerkmale und Durchführung des Antikörpersuchtests,
Häufig gestellte Fragen zur Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen
 Allgemeine Fragen 1. Wer muss die Richtlinie anwenden? Rechtsgrundlage für die Anwendung der Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen, kurz Rili-BÄK
Allgemeine Fragen 1. Wer muss die Richtlinie anwenden? Rechtsgrundlage für die Anwendung der Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen, kurz Rili-BÄK
DIAGNOSTIKA NACHRICHTEN. Rili-BÄK jetzt komplett: Teil B 3 Direkter Nachweis und Charakterisierung von Infektionserregern veröffentlicht
 Bio-Rad Laboratories CLINICAL DIAGNOSTICS MAI 2013 AUSGABE 53 getconnected DIAGNOSTIKA NACHRICHTEN Rili-BÄK jetzt komplett: Teil B 3 Direkter Nachweis und Charakterisierung von Infektionserregern veröffentlicht
Bio-Rad Laboratories CLINICAL DIAGNOSTICS MAI 2013 AUSGABE 53 getconnected DIAGNOSTIKA NACHRICHTEN Rili-BÄK jetzt komplett: Teil B 3 Direkter Nachweis und Charakterisierung von Infektionserregern veröffentlicht
Herz-Kreislauf-Erkrankungen
 Herz-Kreislauf-Erkrankungen Diagnose und Beurteilung in der Praxis Roche cobas h 232 Jetzt kostenlos testen Point-of-Care-Analysesysteme im Praxisalltag unerlässlich Bei Verdacht auf Herzinsuffizienz (HI),
Herz-Kreislauf-Erkrankungen Diagnose und Beurteilung in der Praxis Roche cobas h 232 Jetzt kostenlos testen Point-of-Care-Analysesysteme im Praxisalltag unerlässlich Bei Verdacht auf Herzinsuffizienz (HI),
Stand der Umsetzung der neuen RiliBÄK
 Stand der Umsetzung der neuen RiliBÄK Sybille Döring Landesamt für Mess- und Eichwesen Berlin-Brandenburg Berlin 3.12.2009 1 Landesamt für Mess- und Eichwesen Berlin - Brandenburg gemeinsames Landesamt
Stand der Umsetzung der neuen RiliBÄK Sybille Döring Landesamt für Mess- und Eichwesen Berlin-Brandenburg Berlin 3.12.2009 1 Landesamt für Mess- und Eichwesen Berlin - Brandenburg gemeinsames Landesamt
Rili-BÄK Fortbildungsprogramm: Neue Richtlinienteile und Erfahrungen. Peter Ackermann, Bio-Rad Laboratories GmbH
 Rili-BÄK Fortbildungsprogramm: Neue Richtlinienteile und Erfahrungen Peter Ackermann, Bio-Rad Laboratories GmbH Was ist passiert seit April 2010? oder www.bundesaerztekammer.de 11 FAQ Stand Juli 2011 2
Rili-BÄK Fortbildungsprogramm: Neue Richtlinienteile und Erfahrungen Peter Ackermann, Bio-Rad Laboratories GmbH Was ist passiert seit April 2010? oder www.bundesaerztekammer.de 11 FAQ Stand Juli 2011 2
5. ERFAHRUNGSAUSTAUSCH DER QUALITÄTSBEAUFTRAGTEN HÄMOTHERAPIE 11. September Dr. med. Patricia Klein Ärztliche Geschäftsführerin
 5. ERFAHRUNGSAUSTAUSCH DER QUALITÄTSBEAUFTRAGTEN HÄMOTHERAPIE 11. September 2018 Dr. med. Patricia Klein Ärztliche Geschäftsführerin DIE NEUEN FORMULARE Sie finden die neuen Formulare in Ihren Unterlagen.
5. ERFAHRUNGSAUSTAUSCH DER QUALITÄTSBEAUFTRAGTEN HÄMOTHERAPIE 11. September 2018 Dr. med. Patricia Klein Ärztliche Geschäftsführerin DIE NEUEN FORMULARE Sie finden die neuen Formulare in Ihren Unterlagen.
Umsetzung der RiLi-BÄK für die Patientennahe Sofortdiagnostik Ein Erfahrungsbericht -
 Umsetzung der RiLi-BÄK für die Patientennahe Sofortdiagnostik Ein Erfahrungsbericht - Theresa Winter, Matthias Nauck Institut für Klinische Chemie und Laboratoriumsmedizin Universitätsmedizin Greifswald
Umsetzung der RiLi-BÄK für die Patientennahe Sofortdiagnostik Ein Erfahrungsbericht - Theresa Winter, Matthias Nauck Institut für Klinische Chemie und Laboratoriumsmedizin Universitätsmedizin Greifswald
Allgemeine Fragen zur Rili-BÄK
 Allgemeine Fragen zur Rili-BÄK 1. Wer muss die Richtlinie anwenden? Gemäß 9 Absatz (1) Medizinprodukte-Betreiberverordnung (MPBetreibV) müssen alle Personen, die laboratoriumsmedizinische Untersuchungen
Allgemeine Fragen zur Rili-BÄK 1. Wer muss die Richtlinie anwenden? Gemäß 9 Absatz (1) Medizinprodukte-Betreiberverordnung (MPBetreibV) müssen alle Personen, die laboratoriumsmedizinische Untersuchungen
Überwachung nach dem Medizinproduktegesetz in Sachsen
 Sächsisches Landesamt für Mess- und Eichwesen Überwachung nach dem Medizinproduktegesetz in Sachsen - 2007 Es werden die Ergebnisse der Tätigkeit des Sächsischen Landesamtes für Mess- und Eichwesen (SLME)
Sächsisches Landesamt für Mess- und Eichwesen Überwachung nach dem Medizinproduktegesetz in Sachsen - 2007 Es werden die Ergebnisse der Tätigkeit des Sächsischen Landesamtes für Mess- und Eichwesen (SLME)
Neue Richtlinie der Bundesärztekammer zur Qualitätssicherung. ungen in der Heilkunde.
 SONDERAUSGABE Ausgabe 34 Diagnostica Nachrichten März 2008 Neue Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen Jetzt ist sie da! Am 15. Februar 2008 wurde
SONDERAUSGABE Ausgabe 34 Diagnostica Nachrichten März 2008 Neue Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen Jetzt ist sie da! Am 15. Februar 2008 wurde
Rili-BÄK und mehr zukunftsfähiges Qualitätsmanagement rund um POCT Glukose
 Rili-BÄK und mehr zukunftsfähiges Qualitätsmanagement rund um POCT Glukose Qualitätssicherung, Qualitätsmanagement und moderne Prozessdokumentation rund um Patientennahe Sofortdiagnostik. Astrid Petersmann
Rili-BÄK und mehr zukunftsfähiges Qualitätsmanagement rund um POCT Glukose Qualitätssicherung, Qualitätsmanagement und moderne Prozessdokumentation rund um Patientennahe Sofortdiagnostik. Astrid Petersmann
Novellierung des Infektionsschutzgesetzes - Konsequenzen für die Praxis - Christoph Huesmann. Fachkrankenpfleger für Hygiene und Infektionsprävention
 Novellierung des Infektionsschutzgesetzes - Konsequenzen für die Praxis - Christoph Huesmann Fachkrankenpfleger für Hygiene und Infektionsprävention Entwicklung Bundesseuchengesetz Bekämpfung ansteckender
Novellierung des Infektionsschutzgesetzes - Konsequenzen für die Praxis - Christoph Huesmann Fachkrankenpfleger für Hygiene und Infektionsprävention Entwicklung Bundesseuchengesetz Bekämpfung ansteckender
PeliCase 2 Best.-Nr
 PeliCase 2 Best.-Nr. 546009 Charge: 8000231623 Verfallsdatum: 2016-09-20 Name: Krankenhaus: Unterschrift: Station: Fall: Frau G. Lop ist eine passionierte Reiterin. Bei einem Ausritt fällt sie vom Pferd
PeliCase 2 Best.-Nr. 546009 Charge: 8000231623 Verfallsdatum: 2016-09-20 Name: Krankenhaus: Unterschrift: Station: Fall: Frau G. Lop ist eine passionierte Reiterin. Bei einem Ausritt fällt sie vom Pferd
Untersuchungsstellen nach 15 Abs. 4 TrinkwV
 Transfer- und Gründerzentrum AQS Baden-Württemberg Jahrestagung 2011/2012 Untersuchungsstellen nach 15 Abs. 4 TrinkwV Stuttgart-Büsnau 15. März 2012 Jürgen Ammon / Christine Baumgart Untersuchungsstellen
Transfer- und Gründerzentrum AQS Baden-Württemberg Jahrestagung 2011/2012 Untersuchungsstellen nach 15 Abs. 4 TrinkwV Stuttgart-Büsnau 15. März 2012 Jürgen Ammon / Christine Baumgart Untersuchungsstellen
Richtlinie Bundesärztekammer Teil B2 Qualitätssicherung qualitativer labormedizinischer Untersuchungen Stand der Beratungen und Anforderungen
 Richtlinie Bundesärztekammer Teil B2 Qualitätssicherung qualitativer labormedizinischer Untersuchungen Stand der Beratungen und Anforderungen Dr. André Schmitz und Andrea Michelsen Zentralstelle der Länder
Richtlinie Bundesärztekammer Teil B2 Qualitätssicherung qualitativer labormedizinischer Untersuchungen Stand der Beratungen und Anforderungen Dr. André Schmitz und Andrea Michelsen Zentralstelle der Länder
Arzneimitteltherapiesicherheit im Krankenhaus
 HANDLUNGSEMPFEHLUNG Arzneimitteltherapiesicherheit im Krankenhaus Neuauflage der Checkliste zur AMTS im Krankenhaus der AG Arzneimitteltherapiesicherheit des Aktionsbündnis Patientensicherheit Diese Handlungsempfehlung
HANDLUNGSEMPFEHLUNG Arzneimitteltherapiesicherheit im Krankenhaus Neuauflage der Checkliste zur AMTS im Krankenhaus der AG Arzneimitteltherapiesicherheit des Aktionsbündnis Patientensicherheit Diese Handlungsempfehlung
Kapitel 11 B): Spendenanalytik: Blutgruppen-serologische Untersuchungen an Spenderproben
 Vorschriften Blutspendedienst SRK BSD SRK Kapitel 11 B): Spendenanalytik: Blutgruppen-serologische Untersuchungen an REFERENZEN 1 - Heilmittelgesetz (HMG) - Nr. 812.21 - Art. 39 und 40-2000 2 - Verordnung
Vorschriften Blutspendedienst SRK BSD SRK Kapitel 11 B): Spendenanalytik: Blutgruppen-serologische Untersuchungen an REFERENZEN 1 - Heilmittelgesetz (HMG) - Nr. 812.21 - Art. 39 und 40-2000 2 - Verordnung
Kalibrator C Bestellnummern und Chargennummern 19JAN JAN JAN JAN JAN JAN JAN JAN JAN2013
 Healthcare Siemens Healthcare Diagnostics AG, Freilagerstrasse 4, CH-847 Zürich Name Abteilung Robert Schlatter RAQS-EHS Telefon +41( ) 585 581 66 Telefax +41 () 585 581 151 Mobil E-mail [email protected]
Healthcare Siemens Healthcare Diagnostics AG, Freilagerstrasse 4, CH-847 Zürich Name Abteilung Robert Schlatter RAQS-EHS Telefon +41( ) 585 581 66 Telefax +41 () 585 581 151 Mobil E-mail [email protected]
Interne Qualitätskontrollen Im Urinlabor
 Interne Qualitätskontrollen Im Urinlabor Interne Qualitätskontrollen - Auszüge Interne Qualitätskontrollen Auszüge aus Teil B3 2 Interne Qualitätskontrollen - Auszüge 1 (2) Qualitätskontrolle an einzelnen
Interne Qualitätskontrollen Im Urinlabor Interne Qualitätskontrollen - Auszüge Interne Qualitätskontrollen Auszüge aus Teil B3 2 Interne Qualitätskontrollen - Auszüge 1 (2) Qualitätskontrolle an einzelnen
Beschluss des Gemeinsamen Bundesausschusses über Maßnahmen zur Qualitätssicherung bei nichtmedikamentösen
 Beschluss des Gemeinsamen Bundesausschusses über Maßnahmen zur Qualitätssicherung bei nichtmedikamentösen lokalen Verfahren zur Behandlung des benignen Prostatasyndroms Vom 16. Dezember 2010 Der Gemeinsame
Beschluss des Gemeinsamen Bundesausschusses über Maßnahmen zur Qualitätssicherung bei nichtmedikamentösen lokalen Verfahren zur Behandlung des benignen Prostatasyndroms Vom 16. Dezember 2010 Der Gemeinsame
getconnected DIAGNOSTIKA NACHRICHTEN
 getconnected DIAGNOSTIKA NACHRICHTEN 68 Juni 2017 Offener Brief an unsere Kunden zu den aktuellen Umstrukturierungen Von Anita Glombik, Geschäftsführerin der Bio-Rad Laboratories GmbH Sehr geehrte Kundin,
getconnected DIAGNOSTIKA NACHRICHTEN 68 Juni 2017 Offener Brief an unsere Kunden zu den aktuellen Umstrukturierungen Von Anita Glombik, Geschäftsführerin der Bio-Rad Laboratories GmbH Sehr geehrte Kundin,
Wichtiger Produkthinweis
 ADVIA Centaur ADVIA Centaur XP ADVIA Centaur XPT ADVIA Centaur CP Wichtiger Produkthinweis CC 16-02.A.OUS Oktober 2016 CA 19-9 Abweichung zwischen ADVIA Centaur CP und ADVIA Centaur/XP/XPT Laut unseren
ADVIA Centaur ADVIA Centaur XP ADVIA Centaur XPT ADVIA Centaur CP Wichtiger Produkthinweis CC 16-02.A.OUS Oktober 2016 CA 19-9 Abweichung zwischen ADVIA Centaur CP und ADVIA Centaur/XP/XPT Laut unseren
EFQM die Alternative!
 EFQM die Alternative! European Foundation for Quality Management Matthias Nauck Institut für Klinische Chemie und Laboratoriumsmedizin Universitätsmedizin Greifswald 18.06.2016 Matthias Nauck 1 Gemeinsamkeiten?
EFQM die Alternative! European Foundation for Quality Management Matthias Nauck Institut für Klinische Chemie und Laboratoriumsmedizin Universitätsmedizin Greifswald 18.06.2016 Matthias Nauck 1 Gemeinsamkeiten?
Mikrobiologische Untersuchungsmethoden
 Mikrobiologische Untersuchungsmethoden Roesebeckstr. 4-6 30449 Hannover Fon 0511/4505-0 Fax 0511/4505-140 ISO 14189 C. perfringens ISO 9308-1 E. coli/coliforme B. Lüchtenburger Weg 24 26603 Aurich Fon
Mikrobiologische Untersuchungsmethoden Roesebeckstr. 4-6 30449 Hannover Fon 0511/4505-0 Fax 0511/4505-140 ISO 14189 C. perfringens ISO 9308-1 E. coli/coliforme B. Lüchtenburger Weg 24 26603 Aurich Fon
REAGENZIEN UND MATERIALIEN Positivkontrolle (1) Negativkontrolle (1) Verdünnungslösung (1) Packungsbeilage (1)
 Nur zur Verwendung in der In-vitro-Diagnostik VERWENDUNGSZWECK InflammaDry externe Kontrollen sind nur für die Verwendung mit dem InflammaDry Test. Sie dienen der Überprüfung, ob die Testreagenzien funktionieren
Nur zur Verwendung in der In-vitro-Diagnostik VERWENDUNGSZWECK InflammaDry externe Kontrollen sind nur für die Verwendung mit dem InflammaDry Test. Sie dienen der Überprüfung, ob die Testreagenzien funktionieren
Erklärung. Kreuzen Sie bitte Zutreffendes an und ergänzen fehlende Angaben in den markierten Feldern!
 Erklärung zur Sachstandserhebung aufgrund der zum 004.2018 neu in Kraft getretenen Vereinbarung von Qualitätssicherungsmaßnahmen nach 135 SGB V zur Erbringung von speziellen Untersuchungen der Laboratoriumsmedizin
Erklärung zur Sachstandserhebung aufgrund der zum 004.2018 neu in Kraft getretenen Vereinbarung von Qualitätssicherungsmaßnahmen nach 135 SGB V zur Erbringung von speziellen Untersuchungen der Laboratoriumsmedizin
Aktuelles zur neuen Rili-BÄK
 Bio-Rad Laboratories C L I N I C A L D I A G N O S T I C S F E B R U A R 2 0 1 0 A U S G A B E 4 0 getconnected D I A G N O S T I K A N A C H R I C H T E N Aktuelles zur neuen Rili-BÄK Am 07. Januar 2010
Bio-Rad Laboratories C L I N I C A L D I A G N O S T I C S F E B R U A R 2 0 1 0 A U S G A B E 4 0 getconnected D I A G N O S T I K A N A C H R I C H T E N Aktuelles zur neuen Rili-BÄK Am 07. Januar 2010
Neues Protokoll FSSC Version 4 Was Sie unbedingt wissen sollten
 Neues Protokoll FSSC 22000 Version 4 Was Sie unbedingt wissen sollten i Was genau ist das Protokoll Version 4? Welche Änderungen betreffen Ihr Unternehmen? Was ist eine kritische Abweichung? Was ist die
Neues Protokoll FSSC 22000 Version 4 Was Sie unbedingt wissen sollten i Was genau ist das Protokoll Version 4? Welche Änderungen betreffen Ihr Unternehmen? Was ist eine kritische Abweichung? Was ist die
Beschluss. vom 21. Oktober 2010 veröffentlicht im Bundesanzeiger (BAnz. S. 4506) in Kraft getreten am 22. Dezember 2011
 Beschluss über Maßnahmen zur Qualitätssicherung der Positronenemissionstomographie bei Patientinnen und Patienten mit Hodgkin- Lymphomen und aggressiven Non-Hodgkin- Lymphomen zum Interim-Staging nach
Beschluss über Maßnahmen zur Qualitätssicherung der Positronenemissionstomographie bei Patientinnen und Patienten mit Hodgkin- Lymphomen und aggressiven Non-Hodgkin- Lymphomen zum Interim-Staging nach
Sicherheitsdatenblätter für Blutbankprodukte
 Sehr geehrte Kundin, sehr geehrter Kunde, Sicherheitsdatenblätter für Blutbankprodukte Ortho Clinical Diagnostics (OCD) stellt Sicherheitsdatenblätter (SDB) für alle OCD-Produkte zur Verfügung, die gefährdendes
Sehr geehrte Kundin, sehr geehrter Kunde, Sicherheitsdatenblätter für Blutbankprodukte Ortho Clinical Diagnostics (OCD) stellt Sicherheitsdatenblätter (SDB) für alle OCD-Produkte zur Verfügung, die gefährdendes
Information zur Budgetierung von Laboratoriumsuntersuchungen des Abschnitts
 des Abschnitts 32.3 EBM entsprechend dem Honorarverteilungsmaßstab der Kassenärztlichen Vereinigung Bayerns, Abschnitt E, Anlage 7 Stand: April 2018 Budgetierung von speziellen Laboratoriumsuntersuchungen
des Abschnitts 32.3 EBM entsprechend dem Honorarverteilungsmaßstab der Kassenärztlichen Vereinigung Bayerns, Abschnitt E, Anlage 7 Stand: April 2018 Budgetierung von speziellen Laboratoriumsuntersuchungen
Anforderungen an die Kompetenz von Prüflaboratorien
 Anforderungen an die Kompetenz von Prüflaboratorien A. Loock Hygiene-Institut für Hygiene und der Öffentliche Universität Gesundheit Bonn der Universität Bonn Gliederung - Begleit- und Begründungstext
Anforderungen an die Kompetenz von Prüflaboratorien A. Loock Hygiene-Institut für Hygiene und der Öffentliche Universität Gesundheit Bonn der Universität Bonn Gliederung - Begleit- und Begründungstext
Fachgespräch Emissionsüberwachung Merkblatt
 Merkblatt zur Kalibrierung von automatischen Messeinrichtungen für Stickoxide (NO x ) und Kohlenmonoxid (CO) nach EN 14181 Die DIN EN 14181 Qualitätssicherung für automatische Messeinrichtungen fordert
Merkblatt zur Kalibrierung von automatischen Messeinrichtungen für Stickoxide (NO x ) und Kohlenmonoxid (CO) nach EN 14181 Die DIN EN 14181 Qualitätssicherung für automatische Messeinrichtungen fordert
INFORMATIONEN QUALITÄTSMANAGEMENT REGELUNGEN GEMÄẞ RILI-BÄK BEWERTUNG DER ERGEBNISSE LAUT RILI-BÄK... 07
 RILI-BÄK INFOBROSCHÜRE ZUR UMSETZUNG DER QUALITÄTSSICHERUNG IME-DC Blutzuckermessgeräte für den Einsatz in medizinischen Einrichtungen ÜBERSICHT INFORMATIONEN... 04 QUALITÄTSMANAGEMENT... 05 REGELUNGEN
RILI-BÄK INFOBROSCHÜRE ZUR UMSETZUNG DER QUALITÄTSSICHERUNG IME-DC Blutzuckermessgeräte für den Einsatz in medizinischen Einrichtungen ÜBERSICHT INFORMATIONEN... 04 QUALITÄTSMANAGEMENT... 05 REGELUNGEN
Weiterführende Informationen zur Progesteron Restandardisierung
 Siemens Healthcare Diagnostics Inc. Kundeninformation 21-4 Weiterführende Informationen zur Restandardisierung Mit diesem Schreiben möchte Siemens Ihnen weiterführende Informationen zur Restandardisierung
Siemens Healthcare Diagnostics Inc. Kundeninformation 21-4 Weiterführende Informationen zur Restandardisierung Mit diesem Schreiben möchte Siemens Ihnen weiterführende Informationen zur Restandardisierung
Erfahrungsbericht zur Umsetzung der Rili-BÄK aus der Sicht der Überwachungsbehörde. Fortbildungsveranstaltung der Firma Bio-Rad Laboratories GmbH
 Erfahrungsbericht zur Umsetzung der Rili-BÄK aus der Sicht der Überwachungsbehörde Fortbildungsveranstaltung der Firma Bio-Rad Laboratories GmbH 11. September 2013 Mainz Was gibt es neues seit der letzten
Erfahrungsbericht zur Umsetzung der Rili-BÄK aus der Sicht der Überwachungsbehörde Fortbildungsveranstaltung der Firma Bio-Rad Laboratories GmbH 11. September 2013 Mainz Was gibt es neues seit der letzten
POCT Point of care testing
 POCT Point of care testing Anke Urban POCT-Koordinatorin, Qualitätsmanagerin, Gesundheitsbetriebswirtin Institut für Labordiagnostik, Hygiene und Transfusionsmedizin Klinikum der Stadt Ludwigshafen ggmbh
POCT Point of care testing Anke Urban POCT-Koordinatorin, Qualitätsmanagerin, Gesundheitsbetriebswirtin Institut für Labordiagnostik, Hygiene und Transfusionsmedizin Klinikum der Stadt Ludwigshafen ggmbh
Organisation der klinischen und ambulanten Hämotherapie in Deutschland
 Organisation der klinischen und ambulanten Hämotherapie in Deutschland Beate Zimmermann DRK-Blutspendedienst NSTOB Institut Bremen-Oldenburg Gesetz zur Regelung des Transfusionswesens (Transfusionsgesetz
Organisation der klinischen und ambulanten Hämotherapie in Deutschland Beate Zimmermann DRK-Blutspendedienst NSTOB Institut Bremen-Oldenburg Gesetz zur Regelung des Transfusionswesens (Transfusionsgesetz
B E S C H L U S S. des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 316. Sitzung (schriftliche Beschlussfassung)
 B E S C H L U S S des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 316. Sitzung (schriftliche Beschlussfassung) Teil A zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung
B E S C H L U S S des Bewertungsausschusses nach 87 Abs. 1 Satz 1 SGB V in seiner 316. Sitzung (schriftliche Beschlussfassung) Teil A zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung
Interne Qualitätskontrolle
 Interne Qualitätskontrolle In der Qualitätssicherung der Analytik ist die interne Qualitätskontrolle das Hilfsmittel des Labor- Personals für die unmittelbare Entscheidung, ob eine Bestimmung (d.h. auch
Interne Qualitätskontrolle In der Qualitätssicherung der Analytik ist die interne Qualitätskontrolle das Hilfsmittel des Labor- Personals für die unmittelbare Entscheidung, ob eine Bestimmung (d.h. auch
Anleitung für die Managementbewertung
 Anleitung für die Managementbewertung Managementbewertung 1 bedeutet: die Apothekenleitung analysiert jährlich die Unternehmenssituation ( funktioniert unser QM-System? ) und trifft dann auf Basis der
Anleitung für die Managementbewertung Managementbewertung 1 bedeutet: die Apothekenleitung analysiert jährlich die Unternehmenssituation ( funktioniert unser QM-System? ) und trifft dann auf Basis der
SOPS Tranfusionskette SOP-6 Version Nr.: 1 vom Dok. Nr.: 6-SEROLOG DOC Seite 1 von 5
 Version Nr.: 1 vom 07.02.1997 Dok. Nr.: 6-SEROLOG-12.11.2006.DOC Seite 1 von 5 1 Titel Auswahl von Blutprodukten unter Berücksichtigung blutgruppenserologischer Befunde 2 Ziel und Zweck Standardisierung
Version Nr.: 1 vom 07.02.1997 Dok. Nr.: 6-SEROLOG-12.11.2006.DOC Seite 1 von 5 1 Titel Auswahl von Blutprodukten unter Berücksichtigung blutgruppenserologischer Befunde 2 Ziel und Zweck Standardisierung
Richtlinien. des Bundesausschusses der Ärzte und Krankenkassen
 Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Gesundheitsuntersuchung zur Früherkennung von Krankheiten ( Gesundheitsuntersuchungs-Richtlinien ) in der Fassung vom 24. August 1989
Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Gesundheitsuntersuchung zur Früherkennung von Krankheiten ( Gesundheitsuntersuchungs-Richtlinien ) in der Fassung vom 24. August 1989
Qualitätsbericht Hämotherapie
 Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Berichtszeitraum 20 Vorlage für den Qualitätsbericht gemäß Abschnitt 6.4.2.3 der Richtlinien zur Gewinnung von Blut und Blutbestandteilen und
Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Berichtszeitraum 20 Vorlage für den Qualitätsbericht gemäß Abschnitt 6.4.2.3 der Richtlinien zur Gewinnung von Blut und Blutbestandteilen und
Qualitätsbericht Hämotherapie. Dokumentationsbogen (Berichtsjahr 2018)
 Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Dokumentationsbogen (Berichtshr 2018) (einzureichen bis zum 1. März 2019 an die Landesärztekammer und zeitgleich an die Leitung der Einrichtung)
Qualitätssicherung Hämotherapie Qualitätsbericht Hämotherapie Dokumentationsbogen (Berichtshr 2018) (einzureichen bis zum 1. März 2019 an die Landesärztekammer und zeitgleich an die Leitung der Einrichtung)
Frankfurter Fragebogen zum Sicherheitsklima in Hausarztpraxen (Version der Pilotstudie 2008)
 Frankfurter Fragebogen zum Sicherheitsklima in Hausarztpraxen (Version der Pilotstudie 2008) Patientensicherheit bedeutet, dass Patienten sicher in der Praxis versorgt werden und es nicht zu Fehlern in
Frankfurter Fragebogen zum Sicherheitsklima in Hausarztpraxen (Version der Pilotstudie 2008) Patientensicherheit bedeutet, dass Patienten sicher in der Praxis versorgt werden und es nicht zu Fehlern in
Siemens Material Number (SMN)
 , Ludwig-Erhard-Str. 12, 65760 Eschborn Name Abteilung QM Deutschland Telefon +49 800 5 806 910 50 Telefax +49 6196 7713-8899 E-Mail Internet Unser Zeichen Datum 24.11.2016 www.healthcare.siemens.de/ laboratory-diagnostics
, Ludwig-Erhard-Str. 12, 65760 Eschborn Name Abteilung QM Deutschland Telefon +49 800 5 806 910 50 Telefax +49 6196 7713-8899 E-Mail Internet Unser Zeichen Datum 24.11.2016 www.healthcare.siemens.de/ laboratory-diagnostics
