Moleküle. Zweiatomige Moleküle: H 2+
|
|
|
- Clara Koch
- vor 6 Jahren
- Abrufe
Transkript
1 Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet werden können. Es entstehen zwei verschiedenartige Molekülorbitale: Wenn die beiden Atomorbitale mit gleicher Phase kombiniert werden, entsteht ein bindendes Orbital, welches die größte Elektronendichte zwischen den beiden Kernen aufweist (σ-orbital), wenn die Atomorbitale mit entgegengesetzter Phase kombiniert werden, entsteht ein Molekülorbital mit einer Knotenfläche senkrecht zur Molekülachse und das Orbital ist antibindend (σ*-orbital). Beide Orbitale sind rotationssymmetrisch bezüglich der Molekülachse, das bindende Orbital liegt energetisch tiefer als das 1s Atomorbital und das anti-bindende σ* Orbital liegt entsprechend höher. Dabei spielt die gegenseitige Abstoßung der Kerne aufgrund ihrer positiven Ladung und die Anziehung durch das Elektron aufgrund der negativen Ladung eine wichtige Rolle. Der optimale Kern-Kern Abstand (die Bindungslänge) und der Energiegewinn können mit ilfe einer qantenmechanischen Rechnung ermittelt werden und sind durch das Energieminimum des σ-orbitals bestimmt.
2 Bindungsenergie Moleküle Zweiatomige Moleküle: gegenphasige Überlagerung der Atomorbitale σ-bindungen aus Überlagerung von s-atomorbitalen 2+ : => anti-bindendes Orbital + Knotenebene - gleichphasige Überlagerung der Atomorbitale 0 => bindendes Orbital + +
3 Bindungsenergie Moleküle Zweiatomige Moleküle: 2+ : gegenphasige Überlagerung der Atomorbitale anti-bindendes Orbital + Knotenebene - gleichphasige Überlagerung der Atomorbitale kjmol nm Kernabstand r bindendes Orbital + + r
4 Bindungsenergie Moleküle Zweiatomige Moleküle: 2+ : gegenphasige Überlagerung der Atomorbitale + Knotenebene - gleichphasige Überlagerung der Atomorbitale 0 + +
5 Moleküle Zweiatomige Moleküle: 2 : zwei gepaarte Elektronen im 1σ-Orbital (=> Pauli-Prinzip!)
6 Moleküle Zweiatomige Moleküle: e 2 : je zwei Ellektronen im s- und s*- Orbital kein Energiegewinn, keine Bindung!
7 Moleküle Zweiatomige Moleküle: π-molekülorbitale aus Überlagerung von p-atomorbitalen:
8 Bindungsenergie Moleküle Zweiatomige Moleküle: π-molekülorbitale aus Überlagerung von p-atomorbitalen: 0
9 Bindu ngsenergie Moleküle Zweiatomige Moleküle: σ Molekülorbitale aus p- Atomorbitalen Knotenebene anti-bindend 0 bindend
10 Moleküle Zweiatomige Moleküle: Energielagen der σ und π Molekülorbitale
11 Zweiatomige Moleküle: Moleküle
12 Moleküle Zweiatomige Moleküle aus unterschiedlichen Atomen: Bsp. F
13 ybridisierung sp 2 ybridisierung: 1s - Orbital + 2p-Orbitale => 3sp 2 Orbitale + 1p-Orbital sp ybridisierung: 1s - Orbital + 1p-Orbital => 2sp-Orbitale + 2p-Orbitale sp 3 ybridisierung: 1s - Orbital + 3p-Orbitale => 4sp 3 -Orbitale
14 ybridisierung sp 3 - ybridisierung 1s - Orbital + 3p-Orbitale => 4sp 3 Orbitale öchste Symmetrie: => tetraedrisch Tetraeder o
15 ybridisierung sp 3 - ybridisierung 1s - Orbital + 3p-Orbitale => 4sp 3 Orbitale öchste Symmetrie: => tetraedrisch Tetraeder o
16 ybridisierung sp 3 - ybridisierung 1s - Orbital + 3p-Orbitale => 4sp 3 Orbitale öchste Symmetrie: => tetraedrisch Bsp. Methan C o C
17 ybridisierung sp 2 - ybridisiereung 1s - Orbital + 2p-Orbitale => 3sp 2 Orbitale 1p-Orbital übrig öchste Symmetrie => trigonal gleichseitiges Dreieck 120 o
18 ybridisierung sp - ybridisierung 1s - Orbital + 1p-Orbital => 2sp Orbitale 2p-Orbitale übrig öchste Symmetrie = linear Beispiel C 2 2 C C
19 Bindung in Kohlenwasserstoffmolekülen C-C Einfachbindung sp 3 -ybridisierung der C-=> σ-bindung Geringe Rotationsbarriere der C 3 freie Rotation Beispiel: C 2 6 C C
20 Bindung in Kohlenwasserstoffmolekülen C=C Doppelbindung sp 2 -ybridisierung der C-Atome => π-bindung der p-orbitale Planares Molekül, keine Drehung möglich σ-bindung der sp 2 -Orbitale Ethen: C o C C
21 Bindung in Kohlenwasserstoffmolekülen CC Dreifachbindung sp 1 - ybridisierung der C-Atom => 2 π-bindungen der p-orbitale σ-bindung der sp 1 -Orbitale Linear Beispiel: Ethin C 2 2 C C
Valenz-Bindungstheorie H 2 : s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie
 Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Chemische Bindung zweiatomiger Moleküle
 Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Übungen zu Physik 2 für Maschinenwesen
 Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Die chemische Bindung
 Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Übungen zur VL Chemie für Biologen und Humanbiologen Diese Aufgaben werden in der Übung besprochen.
 Übungen zur VL Chemie für Biologen und umanbiologen 03.10.2010 Diese Aufgaben werden in der Übung besprochen. Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben
Übungen zur VL Chemie für Biologen und umanbiologen 03.10.2010 Diese Aufgaben werden in der Übung besprochen. Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
4 Die Atombindung im Wasserstoff-Molekül
 4.1 Übersicht und Lernziele Thema Bis jetzt haben wir nur von Atomen gesprochen. In der Chemie beschäftigen wir uns aber normalerweise mit Molekülen oder Ionen. Wir wollen deshalb in diesem Kapitel auf
4.1 Übersicht und Lernziele Thema Bis jetzt haben wir nur von Atomen gesprochen. In der Chemie beschäftigen wir uns aber normalerweise mit Molekülen oder Ionen. Wir wollen deshalb in diesem Kapitel auf
4.Teil Kovalente Bindung
 4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
2-01. Das Ethen-Molekül. Perspektivische Darstellung des Ethen-Moleküls.
 Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
2 Die Atombindung im Wasserstoff-Molekül
 2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
Übungen zur Vorlesung Physikalische Chemie II Lösungsvorschlag zu Blatt 5
 Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Organische Chemie. Kapitel 1. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Organische Verbindungen enthalten Kohlenstoff
 rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
Grundlagen der Chemie Allgemeine Chemie Teil 2
 Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Orbitalmodell SPF BCH am
 Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
ORGANISCHE CHEMIE 1. Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO...
 Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO... ORGANISCHE CHEMIE 1 16. Vorlesung, Freitag, 14. Juni 2013 I. Hybridorbitale im Kohlenstoff - Regeln für Wechselwirkung von Orbitalen - σ und π MO s
Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO... ORGANISCHE CHEMIE 1 16. Vorlesung, Freitag, 14. Juni 2013 I. Hybridorbitale im Kohlenstoff - Regeln für Wechselwirkung von Orbitalen - σ und π MO s
Atom-, Molekül- und Festkörperphysik
 Atom-, Molekül- und Festkörperphysik für LAK, SS 2014 Peter Puschnig basierend auf Unterlagen von Prof. Ulrich Hohenester 4. Vorlesung, 27. 3. 2014 Molekülbindung, H2+ - Molekülion, Hybridisierung, Kohlenstoffverbindungen
Atom-, Molekül- und Festkörperphysik für LAK, SS 2014 Peter Puschnig basierend auf Unterlagen von Prof. Ulrich Hohenester 4. Vorlesung, 27. 3. 2014 Molekülbindung, H2+ - Molekülion, Hybridisierung, Kohlenstoffverbindungen
CHE 172.1: Organische Chemie für die Life Sciences
 1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
Valence Shell Electron Pair Repulsion
 Das VSEPR-Modell der Molekularen Struktur Valence Shell Electron Pair Repulsion Vorhersage der Molekülstruktur basierend auf der Anordnung von Elektronen-Paaren in der Valenz-Schale R. J. Gillespie, 1963
Das VSEPR-Modell der Molekularen Struktur Valence Shell Electron Pair Repulsion Vorhersage der Molekülstruktur basierend auf der Anordnung von Elektronen-Paaren in der Valenz-Schale R. J. Gillespie, 1963
5 Mehrelektronensysteme
 5.1 Übersicht und Lernziele Thema Im ersten Teil dieses Kapitels behandeln wir Atome, die mehr als ein Elektron besitzen. Anschliessend betrachten wir im zweiten Teil die Bildung von Bindungen zwischen
5.1 Übersicht und Lernziele Thema Im ersten Teil dieses Kapitels behandeln wir Atome, die mehr als ein Elektron besitzen. Anschliessend betrachten wir im zweiten Teil die Bildung von Bindungen zwischen
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Wechselwirkungen zwischen Atomen Was bisher geschah Quantenmechanisches
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Wechselwirkungen zwischen Atomen Was bisher geschah Quantenmechanisches
Das Lewis-Modell zur Erklärung kovalenter Bindungen
 Das Lewis-Modell zur Erklärung kovalenter Bindungen Erarbeiten Sie sich, innerhalb der Expertengruppe, einen Überblick über das Lewis-Modell zur Erklärung kovalenter Bindungen! Gehen Sie zusätzlich auf
Das Lewis-Modell zur Erklärung kovalenter Bindungen Erarbeiten Sie sich, innerhalb der Expertengruppe, einen Überblick über das Lewis-Modell zur Erklärung kovalenter Bindungen! Gehen Sie zusätzlich auf
2. Linear Combination of Atomic Orbitals
 . Linear Combination of Atomi Orbitals Molekülorbitale werden mit ilfe des Variationsansatzes erhalten. Beispiel: -atomiges Molekül Atom, ϕ Atom, ϕ amilton-operator: Orthonormierung: ˆ ϕ El. Atom ϕ = =
. Linear Combination of Atomi Orbitals Molekülorbitale werden mit ilfe des Variationsansatzes erhalten. Beispiel: -atomiges Molekül Atom, ϕ Atom, ϕ amilton-operator: Orthonormierung: ˆ ϕ El. Atom ϕ = =
Bindungskonzepte in der. Organischen Chemie. 1.1 Hybridisierung
 O:/Wiley/Organische_Chemie_Aufl_1/3d/c01.3d from 19.07.2012 09:18:28 1 Bindungskonzepte in der 1 Organischen Chemie In diesem Kapitel Die Organische Chemie wird gemeinhin als die Chemie der Kohlenstoffverbindungen
O:/Wiley/Organische_Chemie_Aufl_1/3d/c01.3d from 19.07.2012 09:18:28 1 Bindungskonzepte in der 1 Organischen Chemie In diesem Kapitel Die Organische Chemie wird gemeinhin als die Chemie der Kohlenstoffverbindungen
Grundlagen der Chemie
 Grundlagen der Chemie Angelika Brückner, Thomas Werner Leibniz-Institut für Katalyse e. V. an der Universität Rostock Bitte! 1 Informationen Vorlesung Dienstag, 11:00-12:30, LHSL Mittwoch, 11:30-13:00,
Grundlagen der Chemie Angelika Brückner, Thomas Werner Leibniz-Institut für Katalyse e. V. an der Universität Rostock Bitte! 1 Informationen Vorlesung Dienstag, 11:00-12:30, LHSL Mittwoch, 11:30-13:00,
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 CHE 102.1: Grundlagen der Chemie - Organische Chemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur: Die Ordnungszahl (oder Atomzahl /Atomnummer
CHE 102.1: Grundlagen der Chemie - Organische Chemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur: Die Ordnungszahl (oder Atomzahl /Atomnummer
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Oktett-Theorie von Lewis
 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006
 Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Ausarbeitung zum Theoretischen Seminar
 Ausarbeitung zum Theoretischen Seminar Kovalente Molekübindungen 28.01.2015 Robin.Stegmueller@googlemail.com Inhaltsverzeichnis 1 Einführung 1 1.1 Molekulare Bindungen......................... 1 1.2 Beispiel:
Ausarbeitung zum Theoretischen Seminar Kovalente Molekübindungen 28.01.2015 Robin.Stegmueller@googlemail.com Inhaltsverzeichnis 1 Einführung 1 1.1 Molekulare Bindungen......................... 1 1.2 Beispiel:
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Grundtypen der Bindung. Grundtypen chemischer Bindung. Oktettregel. A.8.1. Atombindung
 Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
: Quantenmechanische Lösung H + 2. Molekülion und. Aufstellen der Schrödingergleichung für das H + 2
 H + 2 Die molekulare Bindung : Quantenmechanische Lösung Aufstellen der Schrödingergleichung für das H + 2 Molekülion und Lösung Wichtige Einschränkung: Die Kerne sind festgehalten H Ψ(r) = E Ψ(r) (11)
H + 2 Die molekulare Bindung : Quantenmechanische Lösung Aufstellen der Schrödingergleichung für das H + 2 Molekülion und Lösung Wichtige Einschränkung: Die Kerne sind festgehalten H Ψ(r) = E Ψ(r) (11)
1.8. Aufgaben zur Elektronenpaarbindung
 1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung
 1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
ACF-Vorkurs: Symmetrie in der Anorganischen Chemie
 ACF-Vorkurs: Symmetrie in der Anorganischen Chemie Stichworte: - Symmetrielemente - Punktgruppen - Charaktertafeln - Anwendung in der MO-Theorie I.1 Zur qualitativen Beschreibung genügt es oft, die Form
ACF-Vorkurs: Symmetrie in der Anorganischen Chemie Stichworte: - Symmetrielemente - Punktgruppen - Charaktertafeln - Anwendung in der MO-Theorie I.1 Zur qualitativen Beschreibung genügt es oft, die Form
Chemie II. Vorlesung: Mo Uhr, HPT C103 Übungen: Mo Uhr, HCI H2.1, HCI J4
 hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
Schrödinger-Gleichung
 Schrödinger-Gleichung abgeleitet aus Teilchen-Welle-Dualismus (de Broglie) Ψ = Ε Ψ Der amiltonian enthält kinetische und potentielle Energie aller Teilchen wirkt auf die Wellenfunktion Ψ. Ψ 2 beschreibt
Schrödinger-Gleichung abgeleitet aus Teilchen-Welle-Dualismus (de Broglie) Ψ = Ε Ψ Der amiltonian enthält kinetische und potentielle Energie aller Teilchen wirkt auf die Wellenfunktion Ψ. Ψ 2 beschreibt
3 Mehrelektronensysteme
 3.1 Lernziele 1. Sie sind in der Lage, den Aufbau des Periodensystems nachzuvollziehen. 2. Sie können die Elektronenverteilung eines Atoms angeben, wenn Sie seine Elektronenanzahl kennen. 3. Sie können
3.1 Lernziele 1. Sie sind in der Lage, den Aufbau des Periodensystems nachzuvollziehen. 2. Sie können die Elektronenverteilung eines Atoms angeben, wenn Sie seine Elektronenanzahl kennen. 3. Sie können
Symmetrieelemente C 3 C 2 C 3 O H H N H H H
 Symmetrieelemente Ein Symmetrielement liegt vor, wenn ein Objekt (hier: Molekül) durch eine Symmetrieoperation mit sich selbst zur Deckung gebracht werden kann. neue und alter Orientierung nicht unterscheidbar
Symmetrieelemente Ein Symmetrielement liegt vor, wenn ein Objekt (hier: Molekül) durch eine Symmetrieoperation mit sich selbst zur Deckung gebracht werden kann. neue und alter Orientierung nicht unterscheidbar
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
4.2.2.Das Wasserstoff-Molekül H 2 Vergleich der Wellenfunktionen für antiparallele Spinkonfiguration
 g 4.2.2.Das Wasserstoff-Molekül H 2 Vergleich der Wellenfunktionen für antiparallele Spinkonfiguration a () ϕ ( 2) ϕ ( 2) ϕ ( 1) ψ = ϕ + 1 b a b Heitler-London ( ) ϕ ( 2) + ϕ ( 2) ϕ ( 1) + [ ϕ ( 1) ϕ (
g 4.2.2.Das Wasserstoff-Molekül H 2 Vergleich der Wellenfunktionen für antiparallele Spinkonfiguration a () ϕ ( 2) ϕ ( 2) ϕ ( 1) ψ = ϕ + 1 b a b Heitler-London ( ) ϕ ( 2) + ϕ ( 2) ϕ ( 1) + [ ϕ ( 1) ϕ (
Gruppentheorie ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD. Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE
 ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Physikalische Chemie Prof. Dr. Walter Langel Gruppentheorie Molekülschwingungen
ERNST MORITZ ARNDT UNIVERSITÄT GREIFSWALD Mathematisch-Naturwissenschaftliche Fakultät INSTITUT FÜR BIOCHEMIE Arbeitskreis Physikalische Chemie Prof. Dr. Walter Langel Gruppentheorie Molekülschwingungen
CHE 172.1: Organische Chemie für die Life Sciences
 1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson Inhaltsangabe 1. Struktur und Bindung organischer Moleküle 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen.
1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson Inhaltsangabe 1. Struktur und Bindung organischer Moleküle 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen.
Allgemeine Chemie I, Organische Chemie HS 2016
 Allgemeine Chemie I, rganische Chemie S 2016 Prof. elma Wennemers CAB Departement Chemie und Angewandte Biowissenschaften Freitag 7:45 09:30, CI G3 Übungen: Montag, 08.45 09.30 CI J343 Valeria Rondo-Brovetto
Allgemeine Chemie I, rganische Chemie S 2016 Prof. elma Wennemers CAB Departement Chemie und Angewandte Biowissenschaften Freitag 7:45 09:30, CI G3 Übungen: Montag, 08.45 09.30 CI J343 Valeria Rondo-Brovetto
10. Chemische Bindung
 10. Chemische Bindung 10.1 Hybridisierung 10.2 Massenwirkungsgesetz 10.1 van de Waals Bindung van de Waals-Wechselwirkung wirkt zwischen neutralen inerten Atomen/Molekülen (z.b. Edelgas- Atome) ohne permanentes
10. Chemische Bindung 10.1 Hybridisierung 10.2 Massenwirkungsgesetz 10.1 van de Waals Bindung van de Waals-Wechselwirkung wirkt zwischen neutralen inerten Atomen/Molekülen (z.b. Edelgas- Atome) ohne permanentes
Molekülorbitaltheorie
 O:/Wiley/Fleming_Molekuel/3d/c01.3d from 10.11.2011 09:03:23 1 1 Molekülorbitaltheorie 1.1 Die Atomorbitale des Wasserstoffatoms Die räumliche Verteilung des Elektrons in einem Wasserstoffatom wird für
O:/Wiley/Fleming_Molekuel/3d/c01.3d from 10.11.2011 09:03:23 1 1 Molekülorbitaltheorie 1.1 Die Atomorbitale des Wasserstoffatoms Die räumliche Verteilung des Elektrons in einem Wasserstoffatom wird für
Allgemeine Chemie I, Organische Chemie HS 2017
 Allgemeine Chemie I, rganische Chemie S 2017 Prof. elma Wennemers CAB Departement Chemie und Angewandte Biowissenschaften Freitag 7:45 09:30, CI G3 Übungen: Montag, 08.45 09.30 CI J343 annes Ausserwöger
Allgemeine Chemie I, rganische Chemie S 2017 Prof. elma Wennemers CAB Departement Chemie und Angewandte Biowissenschaften Freitag 7:45 09:30, CI G3 Übungen: Montag, 08.45 09.30 CI J343 annes Ausserwöger
Organische Chemie für Technische Biologen Organische Chemie für Lehramtskandidaten Sommersemester 2005 Prof. Dr. Stephen Hashmi.
 Organische Chemie für Technische Biologen Organische Chemie für Lehramtskandidaten Sommersemester 2005 Prof Dr Gliederung des Vorlesungsstoffes I Allgemeines II Chemische Bindung III Einteilung der Organischen
Organische Chemie für Technische Biologen Organische Chemie für Lehramtskandidaten Sommersemester 2005 Prof Dr Gliederung des Vorlesungsstoffes I Allgemeines II Chemische Bindung III Einteilung der Organischen
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3
 Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Nur zur Information: So So würden die f-orbitale räumlich aussehen 1 Lernziele Block 3 Atom-Eigenschaften Eigenschaften Ionisierungsenergie
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Nur zur Information: So So würden die f-orbitale räumlich aussehen 1 Lernziele Block 3 Atom-Eigenschaften Eigenschaften Ionisierungsenergie
Übungsaufgaben Serie 5 Chemie WS09/10
 Übungsaufgaben Serie 5 Chemie WS09/10 Dr. M. Presselt 1) Wie lautet Döbereiners Triadenregel? Welche der folgenden Elemente bilden Triaden: Si, P, S, As, Te, Sb, Na, Li, K, Ca, Sr, Ba? Elemente, die ein
Übungsaufgaben Serie 5 Chemie WS09/10 Dr. M. Presselt 1) Wie lautet Döbereiners Triadenregel? Welche der folgenden Elemente bilden Triaden: Si, P, S, As, Te, Sb, Na, Li, K, Ca, Sr, Ba? Elemente, die ein
5 Elektronenübergänge im Festkörper
 5 Elektronenübergänge im Festkörper 5.1 Übersicht und Lernziele Übersicht Die Bindung in einem Molekül erfolgt durch gemeinsame Elektronenpaare, die jeweils zwei Atomen angehören (Atombindung, Elektronenpaarbindung).
5 Elektronenübergänge im Festkörper 5.1 Übersicht und Lernziele Übersicht Die Bindung in einem Molekül erfolgt durch gemeinsame Elektronenpaare, die jeweils zwei Atomen angehören (Atombindung, Elektronenpaarbindung).
TC1 Grundlagen der Theoretischen Chemie
 TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Sarah Römer (roemer@em.uni-frankfurt.de) Simona Scheit (simona.scheit@googlemail.com) Juanma
TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Sarah Römer (roemer@em.uni-frankfurt.de) Simona Scheit (simona.scheit@googlemail.com) Juanma
(2.65 ev), da sich die beiden Elektronen gegenseitig abstossen.
 phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
Orbital. Atombindung, Bindung. Elektronegativität. Dipol
 GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
Supramolekulare Chemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung. Pflanzenschutz. Organische Synthese.
 OCI_folie1 Proteine DNA, RNA Enzyme polymere Werkstoffe und Materialien Makromoleküle Peptide Nucleotide Supramolekulare Chemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung Synthetische Oligo-
OCI_folie1 Proteine DNA, RNA Enzyme polymere Werkstoffe und Materialien Makromoleküle Peptide Nucleotide Supramolekulare Chemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung Synthetische Oligo-
08.12.2013. Wichtige Stoffgruppen. Stoffgruppe. Atomverband. Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Metall Metall:
 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten oder in Festkörpern vor.
 phys4.025 Page 1 13. Moleküle Nur eine kleine Anzahl von Elementen kommt natürlich in Form von einzelnen Atomen vor. Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten
phys4.025 Page 1 13. Moleküle Nur eine kleine Anzahl von Elementen kommt natürlich in Form von einzelnen Atomen vor. Die meisten Elemente liegen in gebundener Form als einzelne Moleküle, in Flüssigkeiten
mentor Abiturhilfe: Chemie Oberstufe
 mentor Abiturhilfen mentor Abiturhilfe: Chemie Oberstufe Organische Chemie. Aufbauwissen von eribert Rampf, Sandra Schaumann-Eckel 1. Auflage mentor Abiturhilfe: Chemie Oberstufe Rampf / Schaumann-Eckel
mentor Abiturhilfen mentor Abiturhilfe: Chemie Oberstufe Organische Chemie. Aufbauwissen von eribert Rampf, Sandra Schaumann-Eckel 1. Auflage mentor Abiturhilfe: Chemie Oberstufe Rampf / Schaumann-Eckel
(15) Orbitaltheorie.
 (15) Orbitaltheorie. Die ältere Quantentheorie: Wir kennen es schon, das ELEMENTARTEILCHENMODELL: jedes Atom besteht aus (mit p, n 0 ) und Hülle (e ). Durch die Zahl der Elementarteilchen wird die Masse
(15) Orbitaltheorie. Die ältere Quantentheorie: Wir kennen es schon, das ELEMENTARTEILCHENMODELL: jedes Atom besteht aus (mit p, n 0 ) und Hülle (e ). Durch die Zahl der Elementarteilchen wird die Masse
σ-bindung beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
 VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
1 Struktur und Bindung organischer Moleküle
 Struktur und Bindung organischer Moleküle 5. (sowie 6 und 30, siehe unten) (a) d d l F d (b) Br d d Die Dreifachbindung ist notwendig, um am - und am -Atom ein ktett zu erhalten. (c) l S l l S l auptbeitrag
Struktur und Bindung organischer Moleküle 5. (sowie 6 und 30, siehe unten) (a) d d l F d (b) Br d d Die Dreifachbindung ist notwendig, um am - und am -Atom ein ktett zu erhalten. (c) l S l l S l auptbeitrag
1 Struktur und Bindung organischer Moleküle
 1 Struktur und Bindung organischer Moleküle 20. (sowie 21 und 25, s. unten) (a) (b) Die Dreifachbindung ist fur die Ausbildung der Oktette an C und N erforderlich. (c) d + d H:O :Cl: (d) Man beachte, dass
1 Struktur und Bindung organischer Moleküle 20. (sowie 21 und 25, s. unten) (a) (b) Die Dreifachbindung ist fur die Ausbildung der Oktette an C und N erforderlich. (c) d + d H:O :Cl: (d) Man beachte, dass
WAS FEHLT? STATISCHE KORRELATION UND VOLLE KONFIGURATIONSWECHSELWIRKUNG
 31 besetzen als die β Elektronen. Wenn man dies in der Variation der Wellenfunktion zulässt, also den Satz der Orbitale verdoppelt und α und β Orbitale gleichzeitig optimiert, so ist i. A. die Energie
31 besetzen als die β Elektronen. Wenn man dies in der Variation der Wellenfunktion zulässt, also den Satz der Orbitale verdoppelt und α und β Orbitale gleichzeitig optimiert, so ist i. A. die Energie
6. Chemische Bindung 6.1. Was ist Chemische Bindung 6.2. Strukturen und Erscheinungsformen der Elemente 6.3. Kovalente Bindung
 6. Chemische Bindung 6.1. Was ist Chemische Bindung 6.2. Strukturen und Erscheinungsformen der Elemente 6.3. Kovalente Bindung 6. Chemische Bindung 6.1. Was ist Chemische Bindung 6.2. Strukturen und Erscheinungsformen
6. Chemische Bindung 6.1. Was ist Chemische Bindung 6.2. Strukturen und Erscheinungsformen der Elemente 6.3. Kovalente Bindung 6. Chemische Bindung 6.1. Was ist Chemische Bindung 6.2. Strukturen und Erscheinungsformen
π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!)
 . Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
. Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
Was ist Organische Chemie?
 Gene und Gifte Was ist rganische hemie? Industrie und Labor jeder Blick in den Spiegel hemie Vom Großen zum Kleinen....und wieder zurück! Wie bestimmt das Zusammenspiel der Moleküle die Eigenschaften des
Gene und Gifte Was ist rganische hemie? Industrie und Labor jeder Blick in den Spiegel hemie Vom Großen zum Kleinen....und wieder zurück! Wie bestimmt das Zusammenspiel der Moleküle die Eigenschaften des
4.2 Kovalente Bindung. Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916)
 4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
1. Partner und Widersacher - Sterik und Stereoelektronik
 Prof. Dr. liver eiser, Institut für rganische Chemie, Universität egensburg 1 1. Partner und Widersacher - terik und tereoelektronik 1.1. Das Konzept der terischen Effekte ubstituenten in Molekülen stoßen
Prof. Dr. liver eiser, Institut für rganische Chemie, Universität egensburg 1 1. Partner und Widersacher - terik und tereoelektronik 1.1. Das Konzept der terischen Effekte ubstituenten in Molekülen stoßen
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 4 Molekülstruktur Ausnahmen von der Oktettregel Hypervalente Verbindungen VSEPR Hybridisierung Molekülorbitale
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 4 Molekülstruktur Ausnahmen von der Oktettregel Hypervalente Verbindungen VSEPR Hybridisierung Molekülorbitale
2. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
1.1 Darstellung organischer Verbindungen
 1 Lösung 1 AC/OC I, HS 2017 1.1 Darstellung organischer Verbindungen Organische Verbindungen können auf verschiedene Weise dargestellt werden. Ergänzen Sie die untenstehenden Beispiele von Harnstoff, Ethylenglykol
1 Lösung 1 AC/OC I, HS 2017 1.1 Darstellung organischer Verbindungen Organische Verbindungen können auf verschiedene Weise dargestellt werden. Ergänzen Sie die untenstehenden Beispiele von Harnstoff, Ethylenglykol
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil 2: 20.10.2004) MILESS: Chemie für Biologen 24 Aufbau
Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil 2: 20.10.2004) MILESS: Chemie für Biologen 24 Aufbau
Das Tetraeder-Bällchen/Oktaeder-Bällchen
 H-Atome: klein, weiß Edelgas-Atome: He, Ne, Ar, Kr, Xe, Rn: verschiedene Lila-Töne Metalle: Natrium, Calcium: eher Dunkelblau-Töne Nichtmetalle: C N O F P S Cl grau (kopiert) hellblau rot hellgelb orange
H-Atome: klein, weiß Edelgas-Atome: He, Ne, Ar, Kr, Xe, Rn: verschiedene Lila-Töne Metalle: Natrium, Calcium: eher Dunkelblau-Töne Nichtmetalle: C N O F P S Cl grau (kopiert) hellblau rot hellgelb orange
Drill&Practice: Alkene und Alkine
 Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Drill&Practice: Alkene und Alkine 1. Orbitalzeichnungen sind sehr aufwändig. Zeichnen Sie in die folgenden Strukturen mit rot die π -Bindungen und
Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Drill&Practice: Alkene und Alkine 1. Orbitalzeichnungen sind sehr aufwändig. Zeichnen Sie in die folgenden Strukturen mit rot die π -Bindungen und
Hybridorbitale und ihre Bedeutung
 Hybridorbitale und ihre Bedeutung Roland Heynkes 27.4.2005, Aachen Die Chemie wird kaum von den Atomkernen und den inneren Elektronenschalen, sondern hauptsächlich von der jeweils äußersten Elektronenschale
Hybridorbitale und ihre Bedeutung Roland Heynkes 27.4.2005, Aachen Die Chemie wird kaum von den Atomkernen und den inneren Elektronenschalen, sondern hauptsächlich von der jeweils äußersten Elektronenschale
V Chemische Bindung. 15.2 Von welchen Größen hängt die Gitterenergie ab?
 V Chemische Bindung 15. Chemische Bindung Stichwörter: Ionenbindung, Kovalenzbindung, Ionenradius, Atomradius, Kovalenzradius, Ionenverbindung, Metalle und ichtmetalle, Gitterenergie, Born-aber-Zyklus,
V Chemische Bindung 15. Chemische Bindung Stichwörter: Ionenbindung, Kovalenzbindung, Ionenradius, Atomradius, Kovalenzradius, Ionenverbindung, Metalle und ichtmetalle, Gitterenergie, Born-aber-Zyklus,
z n z m e 2 WW-Kern-Kern H = H k + H e + H ek
 2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
KSO ATOMBINDUNG (GF) Skript Atombindung (GF) V1.0 12/12 MMo, edited by Bor
 1 KSO ATOMBINDUNG (GF) Skript Atombindung (GF) V1.0 12/12 MMo, edited by Bor 2 INALTSVERZEICNIS "ATOMBINDUNG" 1. Einleitung... 03 2. Das Kugelwolkenmodell... 03 2.1 Einleitung... 03 2.2 Die Elektronenwolke....
1 KSO ATOMBINDUNG (GF) Skript Atombindung (GF) V1.0 12/12 MMo, edited by Bor 2 INALTSVERZEICNIS "ATOMBINDUNG" 1. Einleitung... 03 2. Das Kugelwolkenmodell... 03 2.1 Einleitung... 03 2.2 Die Elektronenwolke....
Universität Regensburg
 Universität Regensburg Fakultät für Chemie und Pharmazie 93040 Regensburg 14. März 2006 Institut für Anorganische Chemie Prof. Dr. R. Winter 1. Was besagt das Moseleysche Gesetz? Welche Größe kann man
Universität Regensburg Fakultät für Chemie und Pharmazie 93040 Regensburg 14. März 2006 Institut für Anorganische Chemie Prof. Dr. R. Winter 1. Was besagt das Moseleysche Gesetz? Welche Größe kann man
Chemische Bindung. Kovalente Bindung (Atombindung) Ionenbindung Metallischer Zustand. Zwischenmolekulare Kräfte:
 Chemische Bindung Chemische Bindung Kovalente Bindung (Atomindung) Ionenindung Metallischer Zustand Zwischenmolekulare Kräfte: o H-Brücken o Van-der-Waals-Kräfte/Londonkräfte LEWIS-Darstellung Oktettregel
Chemische Bindung Chemische Bindung Kovalente Bindung (Atomindung) Ionenindung Metallischer Zustand Zwischenmolekulare Kräfte: o H-Brücken o Van-der-Waals-Kräfte/Londonkräfte LEWIS-Darstellung Oktettregel
Organische Chemie I. OC I Lehramt F. H. Schacher 1
 Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
9 WOODWARD-HOFFMANN-REGELN 92
 9 WOODWARD-HOFFMANN-REGELN 92 Die SMOs des Reaktanden und der Produkte (die nach Idealisierung nicht mehr unterschieden werden) müssen konstruiert und nach ihrer Knotenstruktur energetisch klassifiziert
9 WOODWARD-HOFFMANN-REGELN 92 Die SMOs des Reaktanden und der Produkte (die nach Idealisierung nicht mehr unterschieden werden) müssen konstruiert und nach ihrer Knotenstruktur energetisch klassifiziert
Das H + 2 -Molekül. Das Wasserstoffmolekülion H + 2 ist das einfachste
 Moleküle Wir haben in den vergangenen Wochen gelernt, wie sich Atome, zusammengesetzt aus elektrisch geladenen Kernen und Elektronen, verhalten. Wie aber verbinden sich elektrisch neutrale Atome zu Molekülen
Moleküle Wir haben in den vergangenen Wochen gelernt, wie sich Atome, zusammengesetzt aus elektrisch geladenen Kernen und Elektronen, verhalten. Wie aber verbinden sich elektrisch neutrale Atome zu Molekülen
5. Elektronen- und Rotations- Spektren von Molekülen
 5. Elektronen- und Rotations- Spektren von Molekülen Absorptionsspektren Optische Dichte Elektronischer Übergang S 0 S von Benzol: In der Gasphase: Rotations-Schwingungsstruktur Im Kristall: Spektrale
5. Elektronen- und Rotations- Spektren von Molekülen Absorptionsspektren Optische Dichte Elektronischer Übergang S 0 S von Benzol: In der Gasphase: Rotations-Schwingungsstruktur Im Kristall: Spektrale
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
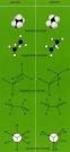 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
VL 22 VL Homonukleare Moleküle VL Heteronukleare Moleküle VL Molekülschwingungen
 VL 22 VL 21 21.1. Homonukleare Moleküle VL 22 22.1. Heteronukleare Moleküle VL 23 23.1. Molekülschwingungen Wim de Boer, Karlsruhe Atome und Moleküle, 04.07.2013 1 Zum Mitnehmen Moleküle: Wellenfunktion
VL 22 VL 21 21.1. Homonukleare Moleküle VL 22 22.1. Heteronukleare Moleküle VL 23 23.1. Molekülschwingungen Wim de Boer, Karlsruhe Atome und Moleküle, 04.07.2013 1 Zum Mitnehmen Moleküle: Wellenfunktion
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
ORGANISCHE CHEMIE 1. Stoff der 15. Vorlesung: Atommodell, Bindungsmodell...
 Stoff der 15. Vorlesung: Atommodell, Bindungsmodell... ORGANISCHE CHEMIE 1 15. Vorlesung, Dienstag, 07. Juni 2013 - Einelektronensysteme: H-Atom s,p,d Orbital - Mehrelektronensysteme: He-Atom Pauli-Prinzip,
Stoff der 15. Vorlesung: Atommodell, Bindungsmodell... ORGANISCHE CHEMIE 1 15. Vorlesung, Dienstag, 07. Juni 2013 - Einelektronensysteme: H-Atom s,p,d Orbital - Mehrelektronensysteme: He-Atom Pauli-Prinzip,
VL 21 VL Periodensystem VL Röntgenstrahlung VL Homonukleare Moleküle VL Heteronukleare Moleküle
 VL 21 VL 19 20.1. Periodensystem VL 20 21.1. Röntgenstrahlung VL 21 22.1. Homonukleare Moleküle VL 22 23.1. Heteronukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 02.07.2013 1 Vorlesung 22:
VL 21 VL 19 20.1. Periodensystem VL 20 21.1. Röntgenstrahlung VL 21 22.1. Homonukleare Moleküle VL 22 23.1. Heteronukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 02.07.2013 1 Vorlesung 22:
Vom Atom zum Molekül
 Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
11. Quantenchemische Methoden
 Computeranwendung in der Chemie Informatik für Chemiker(innen) 11. Quantenchemische Methoden Jens Döbler 2004 "Computer in der Chemie", WS 2003-04, Humboldt-Universität VL11 Folie 1 Grundlagen Moleküle
Computeranwendung in der Chemie Informatik für Chemiker(innen) 11. Quantenchemische Methoden Jens Döbler 2004 "Computer in der Chemie", WS 2003-04, Humboldt-Universität VL11 Folie 1 Grundlagen Moleküle
Günter Baars E-Lern- und Lehrmedium: Quantenchemie und Chemie farbiger Stoffe Modul: Quantenchemie und chemische Bindung Übungen mit Lösungen
 Günter Baars E-Lern- und Lehrmedium: Quantenchemie und Chemie farbiger Stoffe Modul: Quantenchemie und chemische Bindung Übungen mit Lösungen Korrektorat: Dina Baars, Bern Illustrationen: Christoph Frei,
Günter Baars E-Lern- und Lehrmedium: Quantenchemie und Chemie farbiger Stoffe Modul: Quantenchemie und chemische Bindung Übungen mit Lösungen Korrektorat: Dina Baars, Bern Illustrationen: Christoph Frei,
