v = - = - = = k [R] [S]
|
|
|
- Richard Boer
- vor 5 Jahren
- Abrufe
Transkript
1 Vorlesung 7 Die hemische Kinetik (Vollhardt, 3 Aufl, S 70-72, 4 Aufl, S 54-58; art, S ; Buddrus, S 26-29) befasst sich mit Geschwindigkeit, mit der eine Reaktion abläuft R S P Geschwindigkeit einer Reaktion zweiter Ordnung d[r] d[s] d[p] v = - = - = = k [R] [S] dt dt dt Arrhenius-Gleichung Die Reaktionsgeschwindigkeit ist k = Ae a) proportional zur Zahl der Stöße, die die Reaktionspartner untereinander erleiden b) proportional zur Wahrscheinlichkeit, dass bei einem Stoß genügend Energie vorhanden ist, damit die Reaktion erfolgen kann Ein Stoß kann nur zu einer Reaktion führen, wenn die kinetische Energie, mit der sich die Stoßpartner einander nähern, mindestens den Wert E a hat (Aktivierungsenergie) Nach Boltzmann ist bei der Temperatur T der Anteil der Stöße mit der E Mindestenergie E a proportional zu a / RT e (Vollhardt, 3 Aufl, Abb 2-9, S 62, 4 Aufl, Abb 2-2, S 56) Bei vielen Reaktionen verursacht eine Temperaturerhöhung um 10 eine Steigerung der Reaktionsgeschwindigkeit um den Faktor 2-3 Bindungsdissoziationsenergien und Radikalische Substitution (Vollhardt, 3 Aufl, S 95-99, 4 Aufl, S ; art S 71-76; Buddrus, S 77-82) omolytische Spaltung A B A B Δ = Bindungsdissoziationsenergie Radikale l l l l Beispiele Δ = 2424 kj mol -1 E a / RT Δ = 431 kj mol -1 Δ = 440 kj mol -1 Δ = 377 kj mol -1 Experimentalchemie, Prof Mayr 29
2 eterolytische Spaltung A B A B - Ionen Beispiele 3 3 l 3 l Der Energiebedarf hängt stark vom Lösungsmittel ab Die tabellierten Bindungsdissoziationsenergien beziehen sich auf homolytische Spaltungen Dissoziationsenergien einiger A B-Bindungen / kj mol 1 B A F l Br I ( 3 ) ( 3 ) Experimentalchemie, Prof Mayr 30
3 Radikalische hlorierung des Methans (Vollhardt, 3 Aufl, S 95-99, 4 Aufl, S ; art, S 71-76) Versuch: Vorbereitung der Verbrennung eines Methan-hlor-Gemisches Kann Methan mit hlor überhaupt reagieren? Wir betrachten die Thermodynamik: l l l l Brechen von Brechen von Bildung von Bildung von l l l l kj mol -1 Substitutionsreaktion: Ein Wasserstoffatom im Methan wird durch hlor ersetzt Allgemein: Substitution ist der Ersatz eines Atoms oder einer Atomgruppe durch ein anderes Atom oder eine Atomgruppe Versuch: Ein zu 2 / 3 mit hlor aufgefüllter Standzylinder wird mit Methan aufgefüllt Obwohl eine exotherme Reaktion vorausgesagt wurde, passiert nichts Kinetik! Erst beim Entzünden oder Belichten erfolgt eine Reaktion Versuch: Methanflamme in hlor-atmosphäre Um diese Reaktion zu verstehen, müssen wir uns mit ihrem Mechanismus befassen Unter dem Reaktionsmechanismus versteht man eine detaillierte Beschreibung der Vorgänge, die von den Reaktanten zu den Produkten der Reaktion führen, einschließlich der harakterisierung der beteiligten Zwischenstufen und Übergangszustände Experimentalchemie, Prof Mayr 31
4 Am Beispiel der hlorierung des Methans betrachten wir erstmals einen Reaktionsmechanismus Kettenstart: hν oder Δ l l 2 Δ = 242 kj mol -1 hlor-atom = hlor-radikal Durch ein Lichtquant oder durch Erhitzen auf über 300 wird die Energie aufgebracht, um einzelne hlor-moleküle (l 2 ) in hlor-radikale (l ) zu spalten Kettenfortpflanzung: l Δ = 9 kj mol -1 l l Δ = kj mol -1 Methyl-Radikal kj mol -1 Kettenabbruch: l l l Die Gesamtreaktion besteht demnach aus einer Reihe von Einzelschritten, die jeweils für sich betrachtet werden müssen Experimentalchemie, Prof Mayr 32
5 hemiker verwenden zur Beschreibung von Reaktionsabläufen häufig Energieprofile Bei der Besprechung der Rotation um die -Bindung des Ethans haben wir bereits die potentielle Energie als Funktion eines Dihedral-Winkels betrachtet Allgemein tragen wir zur Beschreibung des Reaktionsablaufs die potentielle Energie des Systems (manchmal auch die Enthalpie oder die freie Enthalpie) gegen einen Parameter auf, der den Reaktionsfortschritt beschreibt: Man nennt dies die Reaktionskoordinate Sie wird häufig als qualitativer Parameter verwendet Ein Maximum im Energieprofil nennen wir Übergangszustand Eine Delle im Energieprofil nennen wir Zwischenstufe Diskussion des Energieprofils für die Bildung von hlormethan aus Methan und hlor (Vollhardt, 3 Aufl, Abb 3-8, S 98, 4 Aufl, Abb 3-6, S 115) Reaktionskoordinate Experimentalchemie, Prof Mayr 33
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
II. Halogenalkane, radikalische und nukleophile Substitution
 II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
2. Radikalische Substitution 2.1
 2. Radikalische Substitution 2.1 Die Radikalische Substitution Alkane sind im Vergleich zu den Alkenen sehr reaktionsträge. Alkane zählen zu den gesättigten, Alkene zu den ungesättigten Kohlenwasserstoffen.
2. Radikalische Substitution 2.1 Die Radikalische Substitution Alkane sind im Vergleich zu den Alkenen sehr reaktionsträge. Alkane zählen zu den gesättigten, Alkene zu den ungesättigten Kohlenwasserstoffen.
= Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s]
![= Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s] = Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s]](/thumbs/94/122358469.jpg) Ache2 Kapitel 14: Chemische Kinetik (Geschwindigkeit) Reaktionsgeschwindigkeit Beeinflussung: 1. Aggregatszustände der Reaktanten: Je öfters Moleküle zusammenstossen, desto schneller reagieren sie. (Oberflächenvergrösserung
Ache2 Kapitel 14: Chemische Kinetik (Geschwindigkeit) Reaktionsgeschwindigkeit Beeinflussung: 1. Aggregatszustände der Reaktanten: Je öfters Moleküle zusammenstossen, desto schneller reagieren sie. (Oberflächenvergrösserung
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Zerlegung der Gesamtreaktion in eine Folge von elementaren Einzelreaktionen
 Mikrokinetik egriffe, Definitionen Reaktionsgeschwindigkeit Reaktionskinetik Differentialgleichungen Ordnung Mechanismus Parallele Reaktionen Sequentielle Reaktionen Stationärer Zwischenzustand Geschwindigkeitsbestimmender
Mikrokinetik egriffe, Definitionen Reaktionsgeschwindigkeit Reaktionskinetik Differentialgleichungen Ordnung Mechanismus Parallele Reaktionen Sequentielle Reaktionen Stationärer Zwischenzustand Geschwindigkeitsbestimmender
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie
 Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
EinFaCh 2. Studienvorbereitung Chemie. Einstieg in Freibergs anschauliches Chemiewissen Teil 2: Chemische Reaktionskinetik. tu-freiberg.
 Studienvorbereitung Chemie EinFaCh 2 Einstieg in Freibergs anschauliches Chemiewissen Teil 2: Chemische Reaktionskinetik tu-freiberg.de tu-freiberg.de/fakultaet2/einfach Was bedeutet Chemische Reaktionskinetik?
Studienvorbereitung Chemie EinFaCh 2 Einstieg in Freibergs anschauliches Chemiewissen Teil 2: Chemische Reaktionskinetik tu-freiberg.de tu-freiberg.de/fakultaet2/einfach Was bedeutet Chemische Reaktionskinetik?
Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen. c(a) t. v = -
 REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
Thermodynamik & Kinetik
 Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen.
 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
4.3 Reaktionsgeschwindigkeit und Katalysator
 4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Die Herstellung von Alkenen aus Chloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen.
 Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
Vorlesung "Organische Chemie 1" Übungsblatt 4
 Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.)
 Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.) Gliederung Grundlagen der physikalisch-organischen Chemie Radikalreaktionen Nukleophile und elektrophile Substitution am gesättigten C-Atom
Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.) Gliederung Grundlagen der physikalisch-organischen Chemie Radikalreaktionen Nukleophile und elektrophile Substitution am gesättigten C-Atom
Elektrophile Additionen von HX an die CC-Doppelbindung (Vollhardt, 3. Aufl., S , 4. Aufl., S ; Hart, S ; Buddrus, S.
 Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 5 Verhalten von Lösungen Konzentrationen Solvatation und Solvatationsenthalpie Kolligative Eigenschaften Kryoskopie/Ebullioskopie
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 5 Verhalten von Lösungen Konzentrationen Solvatation und Solvatationsenthalpie Kolligative Eigenschaften Kryoskopie/Ebullioskopie
Thermodynamik. Thermodynamik
 Geschlossenes System: Energieaustausch, aber kein Materieaustausch mit der Umgebung. Innere Energie: Jeder Stoff hat in sich Energie in irgendeiner Form gespeichert: die innere Energie U. U 1 = innere
Geschlossenes System: Energieaustausch, aber kein Materieaustausch mit der Umgebung. Innere Energie: Jeder Stoff hat in sich Energie in irgendeiner Form gespeichert: die innere Energie U. U 1 = innere
5 Teilchen treffen Teilchen: Reaktionskinetik
 5 Teilchen treffen Teilchen: Reaktionskinetik 5.1 Elementarreaktionen und Mehrschritt-Reaktionen Wassergasreaktion: H 2 O + CO CO 2 + H 2 Dies ist lediglich der makroskopisch sichtbare Ablauf der Reaktion.
5 Teilchen treffen Teilchen: Reaktionskinetik 5.1 Elementarreaktionen und Mehrschritt-Reaktionen Wassergasreaktion: H 2 O + CO CO 2 + H 2 Dies ist lediglich der makroskopisch sichtbare Ablauf der Reaktion.
Name, Vorname: Matrikelnummer: Studienrichtung: Fragen auf den folgenden Seiten:
 rganisch-chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 15. September 2010 Musterlösung zur Wiederholungszwischenklausur zur Experimentalvorlesung rganische Chemie
rganisch-chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 15. September 2010 Musterlösung zur Wiederholungszwischenklausur zur Experimentalvorlesung rganische Chemie
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik
 Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik 34 Geben Sie die systematischen Namen jeder der folgenden Verbindungen an: Welche der Verbindungen aus Übung besitzen E- und
Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik 34 Geben Sie die systematischen Namen jeder der folgenden Verbindungen an: Welche der Verbindungen aus Übung besitzen E- und
Organische Chemie 1 Teil 2 1. Vorlesung, Dienstag
 Inhalte der 1. Vorlesung: 1. Die Reaktivität organischer Moleküle 1.1 Warum geschehen Chemische Reaktionen 1.2 Gleichgewichtsreaktionen, Ungleichgewichtsreaktionen 1.2.1 Triebkraft chemischer Reaktionen
Inhalte der 1. Vorlesung: 1. Die Reaktivität organischer Moleküle 1.1 Warum geschehen Chemische Reaktionen 1.2 Gleichgewichtsreaktionen, Ungleichgewichtsreaktionen 1.2.1 Triebkraft chemischer Reaktionen
3. Photochemie und Reaktionskinetik 3.1 Allgemeine Grundlagen
 . Photochemie und Reaktionskinetik.1 Allgemeine Grundlagen In Molekülen sind Atome durch chemische Kräfte gebunden. Manche Moleküle sind reaktiver (z.b. Stickoxide) als andere (z.b. Kohlendioxid). Welche
. Photochemie und Reaktionskinetik.1 Allgemeine Grundlagen In Molekülen sind Atome durch chemische Kräfte gebunden. Manche Moleküle sind reaktiver (z.b. Stickoxide) als andere (z.b. Kohlendioxid). Welche
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Homologe Reihe der unverzweigten Alkane C n H (2n+2)
 Organische hemie I 3.01 Homologe Reihe der unverzweigten Alkane n H (2n+2) (Paraffine) (veraltet: normale Alkane = n-alkane) Name Konstitution Siedepunkt ausführliche Schreibweise Stenographie [ ] Methan
Organische hemie I 3.01 Homologe Reihe der unverzweigten Alkane n H (2n+2) (Paraffine) (veraltet: normale Alkane = n-alkane) Name Konstitution Siedepunkt ausführliche Schreibweise Stenographie [ ] Methan
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Thermo Dynamik. Mechanische Bewegung (= Arbeit) Wärme (aus Reaktion) maximale Umsetzung
 Thermo Dynamik Wärme (aus Reaktion) Mechanische Bewegung (= Arbeit) maximale Umsetzung Aussagen der Thermodynamik: Quantifizieren von: Enthalpie-Änderungen Entropie-Änderungen Arbeit, maximale (Gibbs Energie)
Thermo Dynamik Wärme (aus Reaktion) Mechanische Bewegung (= Arbeit) maximale Umsetzung Aussagen der Thermodynamik: Quantifizieren von: Enthalpie-Änderungen Entropie-Änderungen Arbeit, maximale (Gibbs Energie)
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 CE 102.1: Grundlagen der Chemie - Organische Chemie Prof Dr. E. Landau und Prof. Dr. J.. Robinson 3. Organische Reaktionen - Einordung nach chanismen. lkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1
CE 102.1: Grundlagen der Chemie - Organische Chemie Prof Dr. E. Landau und Prof. Dr. J.. Robinson 3. Organische Reaktionen - Einordung nach chanismen. lkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1
Organische Chemie 2. Skript. zur. Vorlesung. Wintersemester 2010/2011. Prof. H. Mayr
 Skript zur Vorlesung rganische hemie 2 Wintersemester 2010/2011 Prof.. Mayr Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 1 Liebe Studierende, ein Vorlesungsskript kann und soll nicht ein gutes
Skript zur Vorlesung rganische hemie 2 Wintersemester 2010/2011 Prof.. Mayr Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 1 Liebe Studierende, ein Vorlesungsskript kann und soll nicht ein gutes
H = kj/mol. DH = +435 kj/mol
 4. REAKTIONEN DER ALKANE Die in diesem Teil verwendeten Abbildungen stammen aus: K. P. C. Vollhardt, N. E. Schore, Organische Chemie, 4. Auflage, Wiley-VCH. Homolytischer und heterolytischer Bindungsbruch
4. REAKTIONEN DER ALKANE Die in diesem Teil verwendeten Abbildungen stammen aus: K. P. C. Vollhardt, N. E. Schore, Organische Chemie, 4. Auflage, Wiley-VCH. Homolytischer und heterolytischer Bindungsbruch
PC I Thermodynamik und Transportprozesse. Kapitel 7. Kinetik. PC I-Kap :27 1
 20.07.2006 11:27 1 PC I Thermodynamik und Transportprozesse Kapitel 7 Kinetik Reaktionsgeschwindigkeit 20.07.2006 11:27 2 Messung der Reaktionsgeschwindigkeit. Die Konzentration des Edukts A ist als Funktion
20.07.2006 11:27 1 PC I Thermodynamik und Transportprozesse Kapitel 7 Kinetik Reaktionsgeschwindigkeit 20.07.2006 11:27 2 Messung der Reaktionsgeschwindigkeit. Die Konzentration des Edukts A ist als Funktion
Fragen zum Thema chemische Reaktionen Klasse 4 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion
 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
ren. Wie viele hatte Molly richtig beschriftet? Korri- Krebs spielen könnte. b-carotin besitzt die Summen-
 Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik 34 Geben Sie die systematischen Namen jeder der folgenden Verbindungen an: Welche der Verbindungen aus Übung besitzen E- und
Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik 34 Geben Sie die systematischen Namen jeder der folgenden Verbindungen an: Welche der Verbindungen aus Übung besitzen E- und
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
4.3 Reaktionsgeschwindigkeit und Katalysator
 4.3 Reaktionsgeschwindigkeit und Katalysator Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Einstellung des Gleichgewichts,
4.3 Reaktionsgeschwindigkeit und Katalysator Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Einstellung des Gleichgewichts,
Universität Ulm Grundpraktikum Physikalische Chemie Versuch Nr. 24 Temperaturabhängigkeit von Gleichgewichts- und Geschwindigkeitskonstanten
 Universität Ulm Grundpraktikum Physikalische Chemie Versuch Nr. 24 Temperaturabhängigkeit von Gleichgewichts- und Geschwindigkeitskonstanten 1. Grundlagen 1.1. Vorkenntnisse Informieren Sie sich vor Durchführung
Universität Ulm Grundpraktikum Physikalische Chemie Versuch Nr. 24 Temperaturabhängigkeit von Gleichgewichts- und Geschwindigkeitskonstanten 1. Grundlagen 1.1. Vorkenntnisse Informieren Sie sich vor Durchführung
Gruppe 3 Pflichtversuch. Umsetzung von Cyclohexan und Cyclohexen mit Bromwasser. Menge R-Sätze S-Sätze Gefahrensymbole. 300 ml /38
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 3 Pflichtversuch Umsetzung von Cyclohexan
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 3 Pflichtversuch Umsetzung von Cyclohexan
Kohlenwasserstoffe. Benzol Naphthalin usw. Alkane Alkene Alkine Cycloaliphaten. Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w.
 OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
Illustration des Crack-Prozesses am Beispiel der Pentan-Pyrolyse
 Vorlesung 9. Erdölverarbeitung. (Vollhardt, 3. Aufl., S. 92-95, 4. Aufl., S. 108-111; art, S. 127-129; Buddrus, S.87-88) Nach Entfernung von Wasser, Feststoffen und Erdgas (Erhitzen) erfolgt eine fraktionierte
Vorlesung 9. Erdölverarbeitung. (Vollhardt, 3. Aufl., S. 92-95, 4. Aufl., S. 108-111; art, S. 127-129; Buddrus, S.87-88) Nach Entfernung von Wasser, Feststoffen und Erdgas (Erhitzen) erfolgt eine fraktionierte
Bromierung von Hexan G2 Pflichtversuch Bromierung von Cyclohexan und Cyclohexen G3 Pflichtversuch
 Anna-Lena Eicke Philipps-Universität Marburg Organisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 13.11.08 Schulversuche Assistentin: Beate Abé omierung von exan G2 Pflichtversuch omierung von
Anna-Lena Eicke Philipps-Universität Marburg Organisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 13.11.08 Schulversuche Assistentin: Beate Abé omierung von exan G2 Pflichtversuch omierung von
Organische Chemie, Reaktionsmechanismen
 , Reaktionen, Teil 3-1 - hemieskript Dr. R. Steiger rganische hemie, Reaktionsmechanismen Das Lernziel dieser Unterrichtseinheit beinhaltet folgende Punkte: Wie können funktionelle Gruppen ineinander überführt
, Reaktionen, Teil 3-1 - hemieskript Dr. R. Steiger rganische hemie, Reaktionsmechanismen Das Lernziel dieser Unterrichtseinheit beinhaltet folgende Punkte: Wie können funktionelle Gruppen ineinander überführt
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Grundlagen der Kinetik
 Kapitel 1 Grundlagen der Kinetik In diesem Kapitel werden die folgenden Themen kurz wiederholt: Die differenziellen und integralen Geschwindigkeitsgesetze von irreversiblen Reaktionen., 1., und. Ordnung
Kapitel 1 Grundlagen der Kinetik In diesem Kapitel werden die folgenden Themen kurz wiederholt: Die differenziellen und integralen Geschwindigkeitsgesetze von irreversiblen Reaktionen., 1., und. Ordnung
3 Teilchen treffen Teilchen: Reaktionskinetik
 3 Teilchen treffen Teilchen: Reaktionskinetik Die chemische Kinetik oder Reaktionskinetik beschäftigt sich mit der Geschwindigkeit von chemischen Reaktionen. Daneben dient sie zur Aufklärung des Mechanismus
3 Teilchen treffen Teilchen: Reaktionskinetik Die chemische Kinetik oder Reaktionskinetik beschäftigt sich mit der Geschwindigkeit von chemischen Reaktionen. Daneben dient sie zur Aufklärung des Mechanismus
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Hauptsätze der Thermodynamik
 Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Hauptsätze der Thermodynamik Dominik Pfennig, 31.10.2012 Inhalt 0. Hauptsatz Innere Energie 1. Hauptsatz Enthalpie Satz von Hess 2. Hauptsatz
Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Hauptsätze der Thermodynamik Dominik Pfennig, 31.10.2012 Inhalt 0. Hauptsatz Innere Energie 1. Hauptsatz Enthalpie Satz von Hess 2. Hauptsatz
3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen.
 Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene
Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene
2.1 Massenbilanz bei chemischen Stoffumwandlungen. 2.2 Energiebilanz bei chemischen Stoffumwandlungen
 Inhalt von Kapitel 2 2.1-0 2. Chemische Stoffumwandlungen 2.1 Massenbilanz bei chemischen Stoffumwandlungen 2.2 Energiebilanz bei chemischen Stoffumwandlungen 2.2.1 Energiebilanz 2.2.2 Die Bildungsenthalpie
Inhalt von Kapitel 2 2.1-0 2. Chemische Stoffumwandlungen 2.1 Massenbilanz bei chemischen Stoffumwandlungen 2.2 Energiebilanz bei chemischen Stoffumwandlungen 2.2.1 Energiebilanz 2.2.2 Die Bildungsenthalpie
endotherme Reaktionen
 Exotherme/endotherme endotherme Reaktionen Edukte - H Produkte Exotherme Reaktion Edukte Produkte + H Endotherme Reaktion 101 Das Massenwirkungsgesetz Das Massenwirkungsgesetz Gleichgewicht chemischer
Exotherme/endotherme endotherme Reaktionen Edukte - H Produkte Exotherme Reaktion Edukte Produkte + H Endotherme Reaktion 101 Das Massenwirkungsgesetz Das Massenwirkungsgesetz Gleichgewicht chemischer
Reaktionen von Alkanen
 Reaktionen von Alkanen Werden durch chemische Reaktionen aus kovalenten Ausgangsstoffen neue Elementkombinationen gebildet, so müssen zuvor die Bindungen zwischen den Komponenten der Ausgangsverbindungen
Reaktionen von Alkanen Werden durch chemische Reaktionen aus kovalenten Ausgangsstoffen neue Elementkombinationen gebildet, so müssen zuvor die Bindungen zwischen den Komponenten der Ausgangsverbindungen
Thermochemie. Arbeit ist das Produkt aus wirkender Kraft F und Weglänge s. w = F s 1 J = 1 Nm = 1 kgm 2 /s 2
 Thermochemie Energie ist die Fähigkeit, Arbeit zu leisten. E pot = m g h E kin = ½ m v 2 Arbeit ist das Produkt aus wirkender Kraft F und Weglänge s. w = F s 1 J = 1 Nm = 1 kgm 2 /s 2 Eine wirkende Kraft
Thermochemie Energie ist die Fähigkeit, Arbeit zu leisten. E pot = m g h E kin = ½ m v 2 Arbeit ist das Produkt aus wirkender Kraft F und Weglänge s. w = F s 1 J = 1 Nm = 1 kgm 2 /s 2 Eine wirkende Kraft
Brückenkurs Chemie Physikalische Chemie
 Brückenkurs Chemie Physikalische Chemie Inhalte Chemische Thermodynamik Thermodynamische Begriffe Die Hauptsätze Chemische Reaktionen Kalorimetrie Das chemische Gleichgewicht Elektrochemische Gleichgewichte
Brückenkurs Chemie Physikalische Chemie Inhalte Chemische Thermodynamik Thermodynamische Begriffe Die Hauptsätze Chemische Reaktionen Kalorimetrie Das chemische Gleichgewicht Elektrochemische Gleichgewichte
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion:
 Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
Physikalische Chemie II
 Physikalische Chemie II Kinetik und Struktur Kapitel 2 Kinetik Reaktionsordnungen, Elementarreaktionen, Temperaturabhängigkeit Kapitel 3: zusammengesetzte Reaktionen, Quasistationarität, Atmosphärenchemie,
Physikalische Chemie II Kinetik und Struktur Kapitel 2 Kinetik Reaktionsordnungen, Elementarreaktionen, Temperaturabhängigkeit Kapitel 3: zusammengesetzte Reaktionen, Quasistationarität, Atmosphärenchemie,
Physikalische Chemie II
 Physikalische Chemie II Kinetik und Struktur Kapitel 2 Kinetik Reaktionsordnungen, Elementarreaktionen, Temperaturabhängigkeit Kapitel 3: zusammengesetzte Reaktionen, Quasistationarität, Atmosphärenchemie,
Physikalische Chemie II Kinetik und Struktur Kapitel 2 Kinetik Reaktionsordnungen, Elementarreaktionen, Temperaturabhängigkeit Kapitel 3: zusammengesetzte Reaktionen, Quasistationarität, Atmosphärenchemie,
PCG Grundpraktikum Versuch 5 Lösungswärme Multiple Choice Test
 PCG Grundpraktikum Versuch 5 Lösungswärme Multiple Choice Test 1. Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Lösungswärme wird dieses Vorgespräch durch einen Multiple Choice
PCG Grundpraktikum Versuch 5 Lösungswärme Multiple Choice Test 1. Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Lösungswärme wird dieses Vorgespräch durch einen Multiple Choice
Aufstellen von Geschwindigkeitsgesetzen I. Chemische Verfahrenstechnik FH D
 Beispiel: Gasphasenoxidation von Stickstoffmonoxid Messungen ergaben ==> 3. Ordnung NO (g) + O (g) NO (g) v (NO ) = k [NO] [O ] Annahme: Ordnung = Molekularität => wenn Elementarreaktion => Dreierstoß
Beispiel: Gasphasenoxidation von Stickstoffmonoxid Messungen ergaben ==> 3. Ordnung NO (g) + O (g) NO (g) v (NO ) = k [NO] [O ] Annahme: Ordnung = Molekularität => wenn Elementarreaktion => Dreierstoß
2 Nucleophile Substitutionen am gesättigten Kohlenstoff
 2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
Versuch: Bromierung von n-hexan. Chemikalien Menge R-Sätze S-Sätze Gefahrensymbol Bemerkung
 Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 25.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2: Alkane Versuch: omierung von n-hexan Zeitbedarf: Vorbereitung:
Versuch: Reaktivität von primären, sekundären und tertiären Alkylbromiden gegenüber ethanolischer Silbernitratlösung. keine Reaktion.
 Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Hochschule Düsseldorf University of Applied Sciences. 26. April 2017 HSD. Energiespeicher Wärme
 Energiespeicher 02 - Wärme Wiederholung Energiearten Primärenergie Physikalische Energie Kernenergie Chemische Energie Potentielle Energie Kinetische Energie Innere Energie Quelle: Innere Energie Innere
Energiespeicher 02 - Wärme Wiederholung Energiearten Primärenergie Physikalische Energie Kernenergie Chemische Energie Potentielle Energie Kinetische Energie Innere Energie Quelle: Innere Energie Innere
Reaktion und Energie
 Reaktion und Energie Grundsätzliches Bei chemischen Reaktionen werden die Atome der Ausgangsstoffe neu angeordnet, d. h. Bindungen werden gespalten und neu geknüpft. Die Alltasgserfahrung legt nahe, dass
Reaktion und Energie Grundsätzliches Bei chemischen Reaktionen werden die Atome der Ausgangsstoffe neu angeordnet, d. h. Bindungen werden gespalten und neu geknüpft. Die Alltasgserfahrung legt nahe, dass
0.1 Geschwindigkeit bei Reaktionen
 1 0.1 Geschwindigkeit bei Reaktionen Salzsäure reagiert mit Magnesium Erklärung 2HCl + Mg MgCl 2 + H 2 Das M g-pulver reagiert schneller mit der Salzsäure als die Mg-Späne. Definition: Reaktionsgeschwindigkeit
1 0.1 Geschwindigkeit bei Reaktionen Salzsäure reagiert mit Magnesium Erklärung 2HCl + Mg MgCl 2 + H 2 Das M g-pulver reagiert schneller mit der Salzsäure als die Mg-Späne. Definition: Reaktionsgeschwindigkeit
Einführung in die Chemische Kinetik (Formale Reaktionskinetik)
 Einführung in die Chemische Kinetik (Formale Reaktionskinetik) 1 Einführung 2 Formale Reaktionskinetik einfacher Reaktionen 2.1 Reaktionsgeschwindigkeit einfacher Reaktionen 2.2 Bestimmung des Geschwindigkeitsgesetzes
Einführung in die Chemische Kinetik (Formale Reaktionskinetik) 1 Einführung 2 Formale Reaktionskinetik einfacher Reaktionen 2.1 Reaktionsgeschwindigkeit einfacher Reaktionen 2.2 Bestimmung des Geschwindigkeitsgesetzes
ISBN (Buch); (E-Book)
 Bibliografische Information der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; detaillierte bibliografische Daten sind im Internet über
Bibliografische Information der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; detaillierte bibliografische Daten sind im Internet über
Kapitel 4. Die Grundlagen der Kinetik
 Kapitel 4. Die Grundlagen der Kinetik Monomolekulare Reaktion erster rdnung A Produkte; v = k [A] (S N 1) bimolekulare Reaktion zweiter rdnung (S N 2) A + B Produkte; v = k [A] [B] Einfluss der Aktivierungsbarrieren
Kapitel 4. Die Grundlagen der Kinetik Monomolekulare Reaktion erster rdnung A Produkte; v = k [A] (S N 1) bimolekulare Reaktion zweiter rdnung (S N 2) A + B Produkte; v = k [A] [B] Einfluss der Aktivierungsbarrieren
Richtung chemischer Reaktionen, chemisches Gleichgewicht. Massenwirkungsgesetz
 Richtung chemischer Reaktionen, chemisches Gleichgewicht a A + b B K [C] [A] c a [D] [B] c C + d D d b K = Gleichgewichtskonstante Massenwirkungsgesetz [ ] = in Lösung: Konzentration (in mol L -1 ), für
Richtung chemischer Reaktionen, chemisches Gleichgewicht a A + b B K [C] [A] c a [D] [B] c C + d D d b K = Gleichgewichtskonstante Massenwirkungsgesetz [ ] = in Lösung: Konzentration (in mol L -1 ), für
Enzyme: Grundlegende Konzepte und Kinetik
 Enzyme: Grundlegende Konzepte und Kinetik Enzyme sind Katalysatoren biologischer Systeme Wichtigste Eigenschaften: katalytische Stärke und Spezifität Nahezu alle bekannten Enzyme sind Proteine, es gibt
Enzyme: Grundlegende Konzepte und Kinetik Enzyme sind Katalysatoren biologischer Systeme Wichtigste Eigenschaften: katalytische Stärke und Spezifität Nahezu alle bekannten Enzyme sind Proteine, es gibt
Die Freie Aktivierungsenthalpie
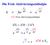 Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
Umwandlung von Alkoholen in Ester (Vollhardt, 3. Aufl. S , 4. Aufl., S )
 Vorlesung 17 Umwandlung von Alkoholen in Ester (Vollhardt, 3. Aufl. S. 343-347, 4. Aufl., S. 392-397) Ester erhält man formal dadurch, dass in organischen oder anorganischen Säuren der saure Wasserstoff
Vorlesung 17 Umwandlung von Alkoholen in Ester (Vollhardt, 3. Aufl. S. 343-347, 4. Aufl., S. 392-397) Ester erhält man formal dadurch, dass in organischen oder anorganischen Säuren der saure Wasserstoff
Vinyl-Polymerisation (Vollhardt, 3. Aufl., S , 4. Aufl. S ; Hart, S , S )
 Vorlesung 23. Polyolefine Vinyl-Polymerisation (Vollhardt, 3. Aufl., S. 532-538, 4. Aufl. S. 599-605; art, S. 116-118, S. 497-507) Thermodynamik: Die π-bindung der Alkene ist um etwa 80 kj mol 1 schwächer
Vorlesung 23. Polyolefine Vinyl-Polymerisation (Vollhardt, 3. Aufl., S. 532-538, 4. Aufl. S. 599-605; art, S. 116-118, S. 497-507) Thermodynamik: Die π-bindung der Alkene ist um etwa 80 kj mol 1 schwächer
Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus)
 Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff
 Vorlesung 16 Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff Bimolekulare nucleophile Substitutionen (S N 2-Reaktionen) In Vorlesung 11 hatten wir bereits die nucleophile Substitution
Vorlesung 16 Mechanismen nucleophiler Substitutionen am aliphatischen Kohlenstoff Bimolekulare nucleophile Substitutionen (S N 2-Reaktionen) In Vorlesung 11 hatten wir bereits die nucleophile Substitution
+ HBr. Gruppe 2 Pflichtversuch. Fotochemische Halogenierung des Toluols. Reaktion: h ν. Zeitbedarf: Versuchsdurchführung: Nachbereitung
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe Pflichtversuch Fotochemische Halogenierung
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe Pflichtversuch Fotochemische Halogenierung
STRUKTUR UND REAKTION INDER CHEMIE
 STRUKTUR UND REAKTION INDER CHEMIE Ein Leitfaden für das Studium der Chemie 2., bearbeitete Auflage Mit 129 Bildern und 32 Tabellen INHALTSVERZEICHNIS Abkürzungen, Größen, Konstanten und Umrechnungsfaktoren
STRUKTUR UND REAKTION INDER CHEMIE Ein Leitfaden für das Studium der Chemie 2., bearbeitete Auflage Mit 129 Bildern und 32 Tabellen INHALTSVERZEICHNIS Abkürzungen, Größen, Konstanten und Umrechnungsfaktoren
4.1. Eigenschaften von Enzymen
 4. Enzyme 106 107 4.1. Eigenschaften von Enzymen Enzyme sind Proteine, die chemische Reaktionen beschleunigen (Biokatalysatoren) Herausragende Merkmale verglichen mit anderen Katalysatoren: drastische
4. Enzyme 106 107 4.1. Eigenschaften von Enzymen Enzyme sind Proteine, die chemische Reaktionen beschleunigen (Biokatalysatoren) Herausragende Merkmale verglichen mit anderen Katalysatoren: drastische
1) Ein offenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus.
 1) Ein offenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus. kann mit der Umgebung Energie austauschen. kann mit der Umgebung Entropie
1) Ein offenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus. kann mit der Umgebung Energie austauschen. kann mit der Umgebung Entropie
RT N j Mit den Potentialen unter Standardbedingungen können wir die Energien der beiden Zustände identifizieren: = e Ei
 im Gleichgewicht wechseln genauso viele Teilchen aus dem einen Zustand in den zweiten wie umgekehrt, die chemischen Potentiale µ i sind also gleich) N i = e µ i µ N Mit den Potentialen unter Standardbedingungen
im Gleichgewicht wechseln genauso viele Teilchen aus dem einen Zustand in den zweiten wie umgekehrt, die chemischen Potentiale µ i sind also gleich) N i = e µ i µ N Mit den Potentialen unter Standardbedingungen
Reaktionstypen der Aromate
 Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Lösungen 10 (Kinetik)
 Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Energetik und Kinetik chemischer Reaktionen
 Energetik und Kinetik chemischer Reaktionen Reaktionsenergetik als Teil der Thermodynamik - wann läuft eine chemische Reaktion freiwillig ab? - in welchem Umfang läuft eine Reaktion ab? - wie viel Energie
Energetik und Kinetik chemischer Reaktionen Reaktionsenergetik als Teil der Thermodynamik - wann läuft eine chemische Reaktion freiwillig ab? - in welchem Umfang läuft eine Reaktion ab? - wie viel Energie
Benutzen Sie, falls erforderlich, die folgenden Werte für die Naturkonstanten. Naturkonstante Zahlenwert Einheit
 Benutzen Sie, falls erforderlich, die folgenden Werte für die Naturkonstanten. Naturkonstante Zahlenwert Einheit Allgemeine Gaskonstante R 8,3145 J mol -1 K -1 Elementarladung e 1,6022 10-19 C Faradaykonstante
Benutzen Sie, falls erforderlich, die folgenden Werte für die Naturkonstanten. Naturkonstante Zahlenwert Einheit Allgemeine Gaskonstante R 8,3145 J mol -1 K -1 Elementarladung e 1,6022 10-19 C Faradaykonstante
Anorganische-Chemie. Dr. Stefan Wuttke Butenandstr. 11, Haus E, E
 Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de norganische-chemie Grundpraktikum für Biologen 2017 Chemische Gleichungen Chemische Reaktionen können
Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de norganische-chemie Grundpraktikum für Biologen 2017 Chemische Gleichungen Chemische Reaktionen können
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene)
 Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Die Substituenten und ihre Positionen werden dem Namen des Alkens als Präfixe vorgestellt:
 23 3. Organische Reaktionen - Einordung nach chanismen. lkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der lkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die für die lkene
23 3. Organische Reaktionen - Einordung nach chanismen. lkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der lkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die für die lkene
Fragen zum Versuch Kinetik:
 Fragen zum Versuch Kinetik: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen von Rohrzucker im Wasser
Fragen zum Versuch Kinetik: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen von Rohrzucker im Wasser
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
M(Mononatriumgluatamt) = 5 x M(C) + 8 x M(H) + 1 x M(N) + 4 x M(O) = 169,13 g/mol
 1. Geben Sie die Verhältnisformel von folgenden Verbindungen an (8P): a) Magnesiumiodid MgI 2 b) Indium(III)chlorid InCl 3 c) Calciumoxid CaO d) Kaliumphosphat K 3 PO 4 2. Bei normaler Mischkost ohne künstliche
1. Geben Sie die Verhältnisformel von folgenden Verbindungen an (8P): a) Magnesiumiodid MgI 2 b) Indium(III)chlorid InCl 3 c) Calciumoxid CaO d) Kaliumphosphat K 3 PO 4 2. Bei normaler Mischkost ohne künstliche
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
3. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 3. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Beschreiben Sie den Reaktionsmechanismus einer S N 1- und einer S N 2- Reaktion. 2.
Allgemeine und Anorganische Chemie 3. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Beschreiben Sie den Reaktionsmechanismus einer S N 1- und einer S N 2- Reaktion. 2.
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Chemische Oszillationen
 Ludwig Pohlmann Thermodynamik offener Systeme und Selbstorganisationsphänomene SS 007 Chemische Oszillationen. Chemische (Formal-)Kinetik Die chemische Kinetik untersucht die Geschwindigkeit und den Mechanismus
Ludwig Pohlmann Thermodynamik offener Systeme und Selbstorganisationsphänomene SS 007 Chemische Oszillationen. Chemische (Formal-)Kinetik Die chemische Kinetik untersucht die Geschwindigkeit und den Mechanismus
