Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
|
|
|
- Helene Krüger
- vor 6 Jahren
- Abrufe
Transkript
1 FACHINFORMATION (ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS) 1 BEZEICHNUNG DES ARZNEIMITTELS Priorix-Tetra Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff 2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (0,5 ml) des gelösten Impfstoffes enthält: Masernviren, Stamm Schwarz 1 (lebend, attenuiert) mindestens 10 3,0 ZKID 3 50 Mumpsviren, Stamm RIT , abgeleitet vom Stamm Jeryl Lynn (lebend, attenuiert) mindestens 10 4,4 ZKID 3 50 Rötelnviren, Stamm Wistar RA 27/3 2 (lebend, attenuiert) mindestens 10 3,0 ZKID 3 50 Varicella-Viren, Stamm OKA 2 (lebend, attenuiert) mindestens 10 3,3 PBE 4 1 hergestellt in embryonalen Hühnerzellen 2 hergestellt in humanen diploiden Zellen (MRC-5) 3 ZKID 50 = Zellkultur-Infektionsdosis 50 % 4 PBE = Plaque-bildende Einheiten Der Impfstoff enthält Spuren von Neomycin. Siehe Abschnitt 4.3 Sonstiger Bestandteil mit bekannter Wirkung: Dieser Impfstoff enthält 14 mg Sorbitol. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt DARREICHUNGSFORM Pulver und Lösungsmittel zur Herstellung einer Injektionslösung. Vor dem Auflösen hat das Pulver ein weißes bis leicht rosafarbenes Aussehen. Das Lösungsmittel ist klar und farblos. 4 KLINISCHE ANGABEN 4.1 Anwendungsgebiete Priorix-Tetra ist indiziert zur aktiven Immunisierung gegen Masern, Mumps, Röteln und Varizellen (Windpocken) bei Kindern ab dem vollendeten 11. Lebensmonat bis zum vollendeten 12. Lebensjahr. Die Anwendung bei Kindern im Alter von 9 bis 10 Monaten kann unter bestimmten Umständen in Betracht gezogen werden. Siehe Abschnitt
2 Hinweis: Die Anwendung von Priorix-Tetra sollte auf Grundlage der offiziellen Impfempfehlungen erfolgen. 4.2 Dosierung und Art der Anwendung Dosierung Kinder vom vollendeten 11. Lebensmonat bis 12 Jahre: Säuglinge und Kinder vom vollendeten 11. Lebensmonat bis zum vollendeten 12. Lebensjahr erhalten zwei Dosen Priorix-Tetra (jeweils 0,5 ml). Die Wahl des Alters, in dem Säuglinge oder Kinder Priorix-Tetra erhalten sollte die jeweiligen offiziellen Impfempfehlungen*, die sich aufgrund der Epidemiologie der Erkrankungen unterscheiden, berücksichtigen. Der Abstand zwischen den beiden Dosen sollte vorzugsweise* zwischen 6 Wochen und 3 Monaten betragen. Wenn die erste Dosis im Alter von 11 Monaten verabreicht wird, sollte die zweite Dosis innerhalb von 3 Monaten verabreicht werden. Auf keinen Fall sollte der Abstand zwischen den Dosen jedoch weniger als 4 Wochen betragen. Siehe Abschnitt 5.1. Alternativ und in Übereinstimmung mit den offiziellen Impfempfehlungen*: - eine Einzeldosis Priorix-Tetra kann Kindern verabreicht werden, die zuvor eine Dosis eines anderen Masern-, Mumps- und Röteln (MMR)-Impfstoffs und/oder eine Dosis eines anderen Varizellen-Impfstoffs erhalten haben - eine Einzeldosis Priorix-Tetra kann verabreicht werden, gefolgt von einer Dosis eines anderen Masern-, Mumps- und Röteln (MMR)-Impfstoffs und/oder einer Dosis eines anderen Varizellen-Impfstoffs. *Die offiziellen Impfempfehlungen können hinsichtlich des zeitlichen Abstands zwischen den Impfdosen und der Zahl der erforderlichen Impfdosen (ein oder zwei Dosen) von Masern-, Mumps- und Röteln- und Varizellen-Impfstoffen in verschiedenen Ländern voneinander abweichen. Kinder zwischen 9 und 10 Monaten: Wenn eine epidemiologische Situation die Impfung vor dem vollendeten 11. Lebensmonat notwendig macht, kann die erste Dosis Priorix-Tetra ab dem vollendeten 9. Lebensmonat verabreicht werden. Eine zweite Dosis Priorix-Tetra sollte drei Monate nach der ersten Dosis verabreicht werden (siehe Abschnitt 5.1). Art der Anwendung Priorix-Tetra ist für die subkutane Injektion im Bereich der Deltoid-Region des Oberarms oder der oberen anterolateralen Region des Oberschenkels vorgesehen. Hinweise zur Rekonstitution des Arzneimittels vor Verabreichung, siehe Abschnitt Gegenanzeigen - Wie bei anderen Impfstoffen sollte auch bei Priorix-Tetra die Impfung im Falle einer akuten, schweren, mit Fieber einhergehenden Erkrankung auf einen späteren Zeitpunkt verschoben werden. Jedoch die Präsenz eines leichten Infektes, wie z.b. eine Verkühlung, sollte nicht zu einer Verschiebung der Impfung führen. 2
3 - Überempfindlichkeit gegen die Wirkstoffe, einen der sonstigen Bestandteile, die im Abschnitt 6.1 angeführt sind, oder Neomycin. Eine Neomycin-Kontaktdermatitis in der Anamnese stellt keine Kontraindikation dar. Zu Hühnereiweißallergie siehe Abschnitt Überempfindlichkeit nach vorausgegangener Impfung mit einem Masern-, Mumps-, Rötelnund/oder Varizellen-Impfstoff. - Schwere humorale oder zelluläre Immundefizienz (angeboren oder erworben), z. B. schwere kombinierte Immundefizienz, Agammaglobulinämie und AIDS oder symptomatische HIV- Infektion oder ein altersspezifischer CD4+-T-Lymphozyten-Anteil von < 25 % (bei Säuglingen im Alter < 12 Monate), < 20 % (bei Kindern im Alter Monate), < 15 % (bei Kindern im Alter Monate) (siehe Abschnitt 4.4). - Schwangerschaft. Darüber hinaus sollte nach der Impfung eine Schwangerschaft über einen Zeitraum von einem Monat verhindert werden (siehe Abschnitt 4.6). 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung - Wie bei allen injizierbaren Impfstoffen sollten für den seltenen Fall einer anaphylaktischen Reaktion nach der Gabe des Impfstoffes stets entsprechende medizinische Behandlungs- und Überwachungsmöglichkeiten sofort verfügbar sein. - Alkohol oder andere Desinfektionsmittel müssen vollständig von der Hautoberfläche verdunstet sein, ehe der Impfstoff injiziert wird, da diese Mittel die attenuierten Viren im Impfstoff inaktivieren können. - Die Masern- und Mumpskomponenten des Impfstoffes werden in Kulturen embryonaler Hühnerzellen gezüchtet und können daher Spuren von Hühnereiweiß enthalten. Bei Personen mit anaphylaktischen, anaphylaktoiden oder anderen Reaktionen vom Soforttyp (z.b. generalisierte Urtikaria, Schwellung des Mundes und Rachens, Atembeschwerden, Hypotonie oder Schock) nach Verzehr von Hühnereiweiß ist das Risiko für eine Überempfindlichkeitsreaktion vom Soforttyp nach der Impfung erhöht, obwohl diese Reaktionen nur sehr selten beobachtet wurden. Personen, die schon einmal eine Überempfindlichkeitsreaktion vom Soforttyp nach dem Verzehr von Hühnereiweiß gezeigt haben, sollten mit äußerster Vorsicht geimpft werden. Für den Fall einer anaphylaktischen Reaktion sollten geeignete Behandlungsmaßnahmen zur Verfügung stehen. - Die Anwendung von Salicylaten während einer natürlichen Windpockenerkrankung wird mit dem Auftreten des Reye-Syndroms in Zusammenhang gebracht. Daher sollte die Verwendung von Salicylaten bis zu 6 Wochen nach Impfung mit Priorix-Tetra unterbleiben. - Durch eine Impfung bis zu 72 Stunden nach natürlicher Masern-Exposition kann eine begrenzte Schutzwirkung gegen Masern erzielt werden. Fieberkrämpfe - Es besteht ein höhere Risiko von Fieber und Fieberkrämpfen 5 bis 12 Tage nach der ersten Dosis von Priorix-Tetra verglichen mit einer gleichzeitigen Masern-Mumps-Röteln- und Varizellen-Impfung mit separaten Impfstoffen (siehe Abschnitt 4.8 und 5.1). - Vorsicht ist bei Personen mit Krampfanfällen oder Krampfanfällen in der Familienanamnese geboten (einschließlich Fieberkrämpfen). Für diese Personen sollte eine alternative 3
4 Immunisierung mit getrennten Masern-Mumps-Röteln- und Varizellen-Impfstoffen für die erste Dosis in Erwägung gezogen werden (siehe Abschnitt 4.2). Auf jeden Fall sollten die geimpften Personen unter Beobachtung hinsichtlich Fieber während der Risikoperiode bleiben. - Die Fieberraten sind meistens höher nach einer Impfung die Masern beinhaltet. Es gibt keinen Hinweis auf ein erhöhtes Risiko nach der zweiten Dosis. Patienten mit eingeschränkter Immunantwort - Eine Impfung kann bei Patienten mit bestimmten Formen der Immundefizienz in Betracht gezogen werden, wenn der Nutzen der Impfung die Risiken überwiegt (z. B. Personen mit asymptomatischer HIV-Infektion, IgG-Subklassendefekten, angeborener Neutropenie, chronischer granulomatöser Erkrankung und Erkrankungen, die mit einem Komplementdefekt einhergehen). - Bei Patienten mit eingeschränkter Immunantwort, für die keine Kontraindikation zur Impfung besteht (siehe Abschnitt 4.3), ist die Immunantwort möglicherweise schwächer als bei immunkompetenten Personen. Daher können einige dieser Patienten bei Kontakt mit Masern, Mumps, Röteln oder Varizellen erkranken, auch wenn sie geimpft sind. Diese Patienten sollten sorgfältig auf Zeichen von Masern, Parotitis, Röteln und Varizellen überwacht werden. Übertragung - Eine Übertragung von Masern-, Mumps- oder Rötelnviren vom Impfling auf empfängliche Kontaktpersonen ist bisher nicht beschrieben worden, obwohl bekannt ist, dass eine Ausscheidung des Rötelnvirus über das Rachensekret etwa 7 bis 28 Tage nach der Impfung auftritt, mit einer maximalen Ausscheidung um den 11. Tag. Eine Übertragung des Oka- Impfvirus wurde sehr selten bei seronegativen Kontaktpersonen von Impflingen mit Ausschlag festgestellt. Eine Übertragungen des Oka-Impfvirus von geimpften Personen, die keine Hautläsionen entwickelt haben, auf seronegative Kontaktpersonen kann nicht ausgeschlossen werden. - Geimpfte Personen, auch diejenigen, bei denen es zu keinem windpockenähnlichen Ausschlag gekommen ist, sollten versuchen, sofern es möglich ist, den Kontakt zu Hochrisikopersonen für eine Windpockenerkrankung 6 Wochen lang nach der Impfung zu vermeiden, Sollte ein Kontakt mit Hochrisikopersonen für eine Windpockenerkrankung unumgänglich sein, muss das Risiko für die Übertragung des Varizella-Impfvirus im Vergleich zum Risiko der Übertragung eines wild-typ Varizella-Virus abgewogen werden. Hochrisikopersonen für eine Windpockenerkrankung sind: - immunsupprimierte Patienten (siehe Absatz 4.3 und 4.4) - schwangere Frauen ohne belegte Nachweise einer Windpockenerkrankung oder evidente Laborwerte einer früheren Infektion - Neugeborene von Müttern ohne belegte Nachweise einer Windpockenerkrankung oder evidente Laborwerte einer früheren Infektion - Priorix-Tetra darf auf keinen Fall intravasal oder intradermal verabreicht werden. Thrombozytopenie - Es wurde über Fälle einer Verschlimmerung und das Wiederauftreten einer Thrombozytopenie nach einer Impfung mit Masern-, Mumps- und Röteln- Lebendimpfstoffen bei Personen berichtet, bei denen bereits nach der ersten Dosis eine 4
5 Thrombozytopenie auftrat. In diesen Fällen ist Nutzen und Risiko einer Impfung mit Priorix- Tetra sorgfältig abzuwägen. - Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmaßen begleitet sein. Es ist wichtig, Maßnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern. - Wie bei jedem Impfstoff kann es sein, dass nicht bei allen Geimpften eine schützende Immunantwort aufgebaut wird. Wie bei anderen Varizella-Impfstoffen sind Fälle einer Varizellenerkrankung bei Personen, die vorher schon Priorix-Tetra erhalten hatten, aufgetreten. Diese Durchbruchsfälle sind üblicherweise mild, mit einer geringeren Anzahl von Läsionen und weniger Fieber im Vergleich zu ungeimpften Personen. - Es gibt nur wenige Berichte, von meist immungeschwächten Personen, über Varizella- Ausbreitung mit Auswirkung auf die inneren Organe nach Impfung mit dem Oka-Impfvirus.. - Interferenzen mit serologischen Tests (siehe Abschnitt 4.5) 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen - Klinische Studien zeigten, dass Priorix-Tetra gleichzeitig mit jedem der folgenden monovalenten oder kombinierten Impfstoffe, einschließlich hexavalenter Impfstoffe (DTPa-HBV-IPV/Hib), verabreicht werden kann: Diphtherie-Tetanus-azelluläre Pertussis (DTPa), Haemophilus influenzae-typ b (Hib), Polio inaktiviert (IPV), Hepatitis B (HBV),, Meningokokken der Serogruppe B (MenB), Meningokokken der Serogruppe C konjugiert (MenC), Meningokokken der Serogruppe A, C, W-135 und Y konjugiert (MenACWY) und 10-valent und Pneumokokken konjugiert. - Aufgrund eines erhöhten Risikos für Fieber, Druckschmerz an der Injektionsstelle, Änderung der Ernährungsgewohnheiten und Reizbarkeit nach Co-Administration von Bexsero mit Priorix-Tetra, können diese Impfungen, sofern dies möglich ist, getrennt voneinander verabreicht werden. - Bisher liegen keine ausreichenden Daten zur Anwendung von Priorix-Tetra mit anderen als den genannten Impfstoffen vor. - Sollte eine gleichzeitige Verabreichung von Priorix Tetra mit anderen Impfstoffen nötig sein, sind getrennte Injektionsstellen zu wählen. Serologische Tests - Ein eventuell erforderlicher Tuberkulintest muss entweder vor oder gleichzeitig mit der Impfung vorgenommen werden, da kombinierte Masern-Mumps-Röteln-Lebendimpfstoffe die Tuberkulinempfindlichkeit der Haut zeitweise herabsetzen können. Da diese verminderte Reaktion bis zu maximal 6 Wochen anhalten kann, sollte zur Vermeidung falsch negativer Ergebnisse ein Tuberkulintest nicht innerhalb dieses Zeitraumes nach der Impfung durchgeführt werden. - Bei Personen, die Human-Gammaimmunglobuline oder eine Bluttransfusion erhalten haben, sollte die Impfung um mindestens 3 Monate verschoben werden, da die Möglichkeit eines Impfversagens durch passiv erworbene Antikörper gegen Masern, Mumps, Röteln 5
6 und/oder Varizellen besteht. - Die Verwendung von Salicylaten sollte bis zu 6 Wochen nach jeder Impfung mit Priorix- Tetra unterbleiben (siehe Abschnitt 4.4). 4.6 Fertilität, Schwangerschaft und Stillzeit Fertilität Priorix-Tetra wurde nicht in Fertilitätsstudien untersucht. Schwangerschaft Schwangere Frauen dürfen nicht mit Priorix-Tetra geimpft werden. Bisher wurden jedoch keine Schädigungen des Fetus nach Verabreichung von Masern-, Mumps-, Röteln- oder Varizellen-Impfstoffen an schwangere Frauen beschrieben. Nach der Impfung sollte eine Schwangerschaft über einen Zeitraum von einem Monat verhindert werden. Frauen, die schwanger werden möchten, sollte empfohlen werden, die Schwangerschaft zu verschieben. Stillzeit Es liegen keine ausreichenden Daten zur Anwendung von Priorix-Tetra während der Stillzeit vor. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Nicht zutreffend 4.8 Nebenwirkungen Zusammenfassung des Sicherheitsprofils: Das folgende Sicherheitsprofil basiert auf Daten aus klinischen Studien, in denen mehr als Dosen Priorix-Tetra an mehr als Kinder im Alter von 9 bis 27 Monaten verabreicht wurden. Die Ereignisse wurden bis zu 42 Tage nach der Impfung im Rahmen klinischer Studien aktiv erfasst. Die häufigsten Nebenwirkungen nach Verabreichung von Priorix- Tetra sind Schmerzen und Rötung an der Injektionsstelle sowie Fieber 38 C (rektal) oder 37,5 C (axiliär/oral). Tabellarische Liste der Nebenwirkungen: Nebenwirkungen werden nach folgenden Häufigkeiten angeführt: Sehr häufig: ( 1/10) Häufig: ( 1/100 bis <1/10) Gelegentlich: ( 1/1.000 bis <1/100) Selten: ( 1/ bis <1/1.000) Sehr selten: (<1/10.000) Klinische Studien 6
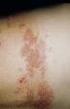
7 Systemorganklasse Häufigkeit Nebenwirkungen Infektionen und parasitäre Erkrankungen Erkrankungen des Blutes und des Lymphsystems Gelegentlich: Selten Gelegentlich: Infektionen der oberen Atemwege Mittelohrentzündung Lymphadenopathie Stoffwechsel- Ernährungsstörungen und Gelegentlich Appetitlosigkeit Psychiatrische Erkrankungen Häufig Reizbarkeit Gelegentlich Schreien, Nervosität, Schlaflosigkeit Erkrankungen des Selten: Fieberkrämpfe* Nervensystems Erkrankungen der Atemwege, des Brustraums und Mediastinums Gelegentlich Selten Schnupfen Husten, Bronchitis Erkrankungen Gastrointestinaltrakts des Gelegentlich Parotisvergrößerung, Durchfall, Erbrechen Erkrankungen der Haut und des Unterhautzellgewebes Häufig Hautausschlag Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: Sehr häufig Schmerzen und Rötung an der Injektionsstelle, Fieber (rektal: 38 C bis 39,5 C; axillar/oral: 37,5 C bis 39 C)** Häufig Schwellung an der Injektionsstelle, Fieber (rektal > 39,5 C; axillar/oral > 39 C)** Gelegentlich Lethargie, Unwohlsein, Mattigkeit * Das Risiko von Fieberkrämpfen nach der ersten Dosis wurde anhand einer retrospektiven Analyse einer Datenbank evaluiert. Kinder zwischen 9 und 30 Monaten, die mit Priorix-Tetra geimpft worden waren, wurden mit einer Kohorte, die Maser-Mumps-Röteln- oder gleichzeitig Masern-Mumps-Röteln und Varizella-Impfungen erhalten hatten, verglichen. In der Studie wurden Kinder mit Masern-Mumps-Röteln-Varizella geimpft, Kinder mit Maser-Mumps-Röteln und Kinder mit Masern-Mumps-Röteln- und Varizella-Impfstoffen getrennt immunisiert. Abhängig von der gewählten diagnostischen Falldefinition hinsichtlich der Identifikation von Fieberkrämpfen betrug das relative Risiko für Fieberkrämpfe in der kritischen Periode (zwischen 5 und 12 Tage nach der ersten Priorix-Tetra Dosis), 2,18 (95% KI: 1,38; 3,45) oder 6,19 (95% KI: 4,71; 8,13) pro Personen für die Priorix-Tetra-Gruppe und 0,49 (95% KI: 0,19; 1,25) oder 2,55 (95% KI: 1,67; 3,89) pro Personen der Kontroll-Kohorte. Diese Daten deuten auf Fieberkrämpfe pro oder Personen mit Priorix-Tetra, 7
8 verglichen mit der Kontroll-Kohorte, die MMR oder gleichzeitig aber an getrennten Injektionstellen MMR und einen Varizella-Impfstoff erhalten hatten, (mit attributablen Risiken von 1,70 (95% KI:-1,86; 3,46) bzw. 3,64/ (95% KI: -6,11; 8,30) pro Personen hin. (siehe Abschnitt 5.1) ** Nach Verabreichung der ersten Dosis des tetravalentes Masern-Mumps-Röteln-Varizellen- Impfstoffs wurde im Vergleich zu einer gleichzeitigen Gabe von 2 Impfstoffen (Masern-, Mumps- und Röteln- bzw. Varizellen-Impfstoff) an verschiedenen Injektionsstellen, eine höhere Inzidenz von Fieber (ca. 1,5-mal) beobachtet. Postmarketing-Überwachung Folgende Nebenwirkungen wurden nach Markteinführung in seltenen Fällen identifiziert. Da diese von einer Population unbekannter Größe spontan berichtet wurden, kann hier keine Einschätzung der Häufigkeit angeführt werden. Systemorganklasse Infektionen und parasitäre Erkrankungen Erkrankungen des Blutes und des Lymphsystems Erkrankungen des Immunsystems Erkrankungen des Nervensystems Gefäßerkrankungen Erkrankungen der Haut und des Unterhautzellgewebes Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Nebenwirkungen Meningitis, Herpes zoster***, Masern-ähnliches Syndrom, Mumps-ähnliches Syndrom (einschließlich Orchitis, Epididymitis und Parotitis) Thrombozytopenie, thrombozytopenische Purpura Allergische Reaktionen (einschließlich anaphylaktische und anaphylaktoide Reaktionen) Enzephalitis, Cerebellitis, Hirndurchblutungsstörung, Guillain-Barré-Syndrom, Transverse Myelitis, periphere Neuritis, Cerebellitis ähnliche Symptome (einschließlich vorübergehende Gangstörung und vorübergehende Ataxie) Vasculitis Erythema multiforme, Varizella-ähnlicher Ausschlag Arthralgie, Arthritis ***Diese Nebenwirkung, die nach der Impfung berichtet wurde, tritt auch nach einer Infektion mit dem Varicella-Wildtyp-Virus auf. Es gibt keine Hinweise, dass das Risiko für das Auftreten dieser Nebenwirkung nach der Impfung höher ist als nach einer Varizellenerkrankung. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem anzuzeigen: Bundesamt für Sicherheit im Gesundheitswesen 8
9 Traisengasse WIEN ÖSTERREICH Fax: + 43 (0) Website: Überdosierung Es wurden keine Fälle von Überdosierung berichtet. 5 PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Viraler Impfstoff, ATC-Code: J07BD54 Wirkung Die Wirksamkeit von GlaxoSmithKlines (GSK) monovalentem Oka Impfstoff (Varilrix) und Priorix-Tetra in der Prävention von Windpocken wurde in einer großen randomisierten klinischen Studie mit dem GSK Masern-Mumps-Röteln Impfstoff (Priorix) als Vergleichssubstanz evaluiert. Die Studie wurde in Europa, wo kein Routineimpfprogramm gegen Varizellen implementiert ist, durchgeführt. Kinder im Alter von 12 bis 22 Monaten erhielten zwei Dosen Priorix-Tetra im Abstand von 6 Wochen oder eine Dosis Varilrix Die Wirksamkeit gegen epidemiologisch bestätigte Varizelleninfektionen oder gegen durch PCR (Polymerase-Ketten-Reaktion) bestätigte Varizelleninfektionen jeglichen Schweregrades (bestimmt anhand einer vordefinierten Skala) und gegen bestätigte moderate oder schwere Varizelleninfektionen, beobachtet nach primärem Follow-up von 2 Jahren (Median Dauer 3,2 Jahren) sowie nach erweitertem Follow-up von 6 Jahren (Median Dauer 6,4 Jahren) wird in folgender Tabelle (Langzeit Follow-up Zeit 10 Jahre) dargestellt: Gruppe Zeit Wirksamkeit gegen bestätigte Varizelleninfektionen jeglichen Schweregrades Priorix-Tetra (2 Dosen) Jahr 2 94,9% (97,5% KI: 92,4; 96,6) N = Jahr 6 (1) 95,0% (95% KI: 93,6;96,2) Varilrix (1 Dosis) Jahr % (97,5% CI: 57.2;72,1) N = Jahr 6 (1) 67,0% (95% KI: 61,8;71,4) N = Anzahl eingeschlossener und geimpfter Personen (1) deskriptive Analyse Wirksamkeit gegen mittelschwere oder schwere bestätigte Varizelleninfektionen 99,5% (97,5% KI: 97,5;99,9) 99,0% (95% KI: 97,7;99,6) 90,7% (97.5% KI: 85,9;93,9) 90,3% (95% KI: 86,9;92,8) In einer finnischen Studie, die speziell auf die Evaluierung von Varilrix zugeschnitten war, wurden 493 Kinder im Alter von 10 bis 30 Monaten über den Zeitraum von ungefähr 2,5 Jahren nach der Impfung mit einer Dosis beobachtet. Die Schutzwirkung gegen gewöhnliche oder 9
10 schwere klinische Fälle von Windpocken ( 30 Bläschen) betrug 100% (95% KI: 80;100) und 88% (95% KI: 72;96) gegen jegliche serologisch bestätigte Fälle von Windpocken (zumindest 1 Bläschen oder Pustel) Wirksamkeit Wirksamkeitsdaten zeigen einen höheren Schutz und eine Reduktion von Durchbruchs- Erkrankungen bei Verabreichung von zwei Impfdosen im Vergleich zur einer einmaligen Dosis. Die Wirksamkeit zweier Dosen Priorix-Tetra während Varizellenausbrüchen in Kindertagesstätten in Deutschland, wo eine Routineimpfung gegen Varizellen für Kinder ab 11 Monaten an empfohlen wird, betrug 91% (95% CI: 65;98) gegen jegliche Varizellen- Erkrankung und 94% (95% CI: 54;99) gegen die moderate Erscheinungsform. Die Wirksamkeit von einer Dosis Varilrix wurde in verschiedene Situationen (Ausbruch, Fall- Kontroll- und Datenbank-Studien) bewertet und reichte von 20%-92% gegen jegliche Verlaufsform und von 86%-100% gegen moderate oder schwere Erkrankungsfälle. Immunantwort: In mehreren klinischen Studien wurde die durch Priorix-Tetra hervorgerufene Immunantwort untersucht. Antikörpertiter gegen Masern, Mumps und Röteln wurden mit kommerziell erhältlichen ELISA-(enzyme-linked immunosorbent assays)-tests bestimmt. Zusätzlich wurden die Mumps-Antikörper mit einem Plaque-Reduktions-Neutralisationstest bestimmt. Diese serologischen Parameter sind als Surrogatmarker für die Schutzwirkung allgemein akzeptiert. Ein modifizierter kommerzieller IFT (indirekter Immunfluoreszenztest) und ein kommerzieller ELISA wurden verwendet, um die durch Priorix-Tetra hervorgerufene Immunantwort gegen Varizellen mit der Immunantwort durch den monovalenten Varizellen-Impfstoff von GSK zu vergleichen. In drei klinischen Studien in Europa (Österreich, Finnland, Deutschland, Griechenland, Polen) wurde ca zuvor ungeimpften Kindern im Alter von 11 bis 23 Monaten zwei Dosen Priorix-Tetra im Abstand von 6 Wochen verabreicht. Die Serokonversionsraten (SC) und Geometrischen Mittelwerte der Antikörperkonzentration/-titer (GMCs/GMTs) sind in der folgenden Tabelle zusammengefasst: 10
11 Antikörper- Test (cut-off) SC (95% KI) Masern ELISA (150 mi.e./ml) 96,4% (KI: 95,5; 97,2) Mumps ELISA (231 E/ml) Neutralisation (1:28) 91,3% (KI: 90,0; 92,5) 95,4% (KI: 94,3; 96,3) Rubella ELISA (4 I.E./ml) 99,7% Varicella IFA (1:4) (KI: 99,4; 99,9) 97,2% (KI: 96,3; 97,9) Nach der 1. Dosis GMC/GMT (95% KI) 3184,5 (KI: 3.046,5; 3.328,7) 976,7 (KI: 934,8; 1020,5) 147,0 (KI: 138,6; 155,8) 62,2 (KI: 60,0; 64,5) 97,5 (KI: 92,2; 103,1) SC (95% KI) 99,1% (KI: 98,6; 99,5) 98,8% (KI: 98,2; 99,2) 99,4% (KI: 98,9; 99,7) 99,9% (KI: 99,6; 100) 99,8% (KI: 99,5; 100) Nach der 2. Dosis GMC/GMT (95% KI) 4.828,6 (KI: 4.644,3; 5020,1) 1.564,4 (KI: 1.514,6; 1.615,8) 478,4 (KI: 455,1; 503,0) 119,7 (KI: 116,4; 123,1) 2.587,8 (KI: 2.454,0; 2.728,9) ELISA (50 mi.e./ml) 89,4% (KI: 87,8;90.8) 112,0% (KI: 93,5;134,0) 99,2% (KI: 98,5; 99,6) 2403,9 (KI: 1962,4;2944,6) Die beobachteten Serokonversionsraten und GMCs/GMTs waren ähnlich wie nach der separater Impfung mit Varilrix und Priorix. Bei im Alter von 11 Monaten geimpften Kindern liegt der Anteil mit schützenden Masern- Antikörpertitern (d.h. 150 mi.e./ml) nach der ersten Dosis bei 91-92%. Dieser Anteil ist niedriger als der, der bei Verabreichung der ersten Dosis ab dem vollendeten 12. Lebensmonat beobachtet wurde. Die zweite Dosis Priorix-Tetra induzierte eine Erhöhung der Serokonversionsraten und/oder der Antikörperspiegel gegen die Masern-, Mumps- und Röteln-Impfstoffkomponenten. Daher sollte die zweite Dosis vorzugsweise innerhalb von drei Monaten nach der ersten Dosis verabreicht werden, um eine Erkrankung im Intervall zwischen den beiden Dosen zu vermeiden. Die vorliegenden Daten deuten darauf hin, dass die Verabreichung von zwei Dosen Priorix- Tetra im Vergleich zu einer Dosis zu einer höheren Wirksamkeit und einer Abnahme der Varizellen-Durchbruchserkrankungen führt. Dies korreliert mit dem Anstieg der Varizellen- Antikörper nach der zweiten Dosis, was auf einen Boostereffekt durch die Gabe der zweiten Varizellenantigenkomponente schließen lässt. Die Immunantwort von Priorix-Tetra, als zweite Dosis einer MMR-Impfung bei Kindern zwischen 24 Monaten und 6 Jahren verabreicht, wurde in zwei klinischen Studien beobachtet. Kinder wurden im Vorfeld mit einer MMR-Impfung oder mit einer MMR- und gemeinsam mit einer lebend-abgeschwächten Varizella-Impfung geimpft. Die Serokonversionsraten für Varizella-Antikörper waren 98,1 % (IFA) bei Kindern die zuvor mit einer MMR-Impfung und 100% bei Kindern die zuvor mit einer MMR- und gemeinsam mit einer lebend-abgeschwächten Varizella-Impfung geimpft wurden. Die Serokonversionsraten waren 100% für Masern-, 11
12 Mumps- und Röteln-Antikörper in beiden Studien. Immunantwort bei Kindern zwischen 9 und 10 Monaten In eine klinische Studie in Asien (Singapur) wurden 300 gesunde Kinder im Alter von 9 bis 10 Monaten zum Zeitpunkt der ersten Impfstoffdosis eingeschlossen. Von diesen erhielten 153 Kinder zwei Dosen Priorix-Tetra im Abstand von drei Monaten und 147 Kinder erhielten Priorix und Varilrix. Die Serokonversionsraten und GMCs/GMTs waren denen nach getrennter Verabreichung von Varilrix und Priorix ähnlich. Die Serokonversionsraten nach der ersten Dosis Priorix-Tetra waren für alle Antigene außer Masern mit denen, die in anderen klinischen Studien bei Kindern im Alter von 12 bis 24 Monaten beobachtet wurden, vergleichbar. Die Serokonversionsrate für Masern bei Kindern im Alter von 9 bis 10 Monaten nach einer Dosis Priorix-Tetra betrug 93,3% (95% KI: 87,6; 96,9). Die Immunantwort von Kindern kann im ersten Lebensjahr wegen einer möglichen Interferenz mit maternalen Antikörpern nicht ausreichend sein. Daher sollte eine zweite Dosis Priorix-Tetra drei Monate nach der ersten Dosis verabreicht werden. Persistenz der Masern-, Mumps- und Röteln-Immunantwort: In einer klinischen Studie, bei der Kinder im Alter von 12 bis 22 Monaten zwei Dosen von Priorix Tetra (N = 2.489), erhielten, wurden die Seropositivitätsraten gegen Masern-, Mumpsund Röteln-Antkörper (definiert als Personen mit einer Antikörperkonzentration, die bei oder über einem zuvor festgelegten Grenzwert lag), nach Follow-up über eine Dauer von 2 und 6 Jahren beobachet und sind in der folgenden Tabelle zusammengefasst: Zeit Antikörper- Test (cut-off) Masern ELISA (150 mi.e./ml Mumps ELISA (231 E/ml) Röteln ELISA (4 I.E/ml) Jahr 2 99,1% 90,5% 100% Jahr 6 99,0% 90,5% 99,8% ELISA: Enzyme Linked Immuno Sorbent Assay Post-Marketing Beobachtungen - Sicherheitsstudie nach Markteinführung: Das Risiko von Fieberkrämpfen nach der ersten Dosis wurde anhand einer retrospektiven Analyse einer Datenbank bei Kindern zwischen 9 und 30 Monate evaluiert. (siehe Abschnitt 4.8) 5.2 Pharmakokinetische Eigenschaften Nicht zutreffend. 5.3 Präklinische Daten zur Sicherheit Eine Toxizitätsstudie bei Tieren nach wiederholter Gabe ergab keinerlei Hinweise auf lokale oder systemische Toxizität des Impfstoffes. 12
13 6 PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Pulver: Aminosäuren, Lactose wasserfrei Mannitol, Sorbitol, Medium 199 Lösungsmittel: Wasser für Injektionszwecke 6.2 Inkompatibilitäten Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden. 6.3 Dauer der Haltbarkeit 18 Monate Nach dem Auflösen sollte der Impfstoff umgehend verabreicht werden oder im Kühlschrank aufbewahrt werden (2 C 8 C). Wenn der Impfstoff nicht innerhalb von 24 Stunden verwendet wird, ist er zu verwerfen. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Kühl lagern und transportieren (2 C - 8 C). Nicht einfrieren. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels, siehe Abschnitt Art und Inhalt der Behältnisse Pulver in einer Durchstechflasche (Glas Typ I) mit Stopfen (Butyl-Gummi). Lösungsmittel in einer Ampulle (Glas Typ I) (0,5 ml). Packungsgrößen zu 1, 10 oder 100. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Der rekonstituierte (gelöste) Impfstoff ist vor der Verabreichung per Augenschein auf etwaige Fremdpartikel und/oder physikalische Veränderungen zu untersuchen. Wenn solche Abweichungen beobachtet werden, ist der Impfstoff zu verwerfen. Der Impfstoff wird gelöst, indem der gesamte Inhalt der beigefügten Durchstechflasche oder Ampulle mit Lösungsmittel in die Durchstechflache mit dem Pulver gegeben wird. Danach 13
14 wird die Mischung gründlich geschüttelt, bis sich das Pulver im Lösungsmittel vollständig gelöst hat. Aufgrund geringfügig abweichender ph-werte kann die Farbe des gelösten Impfstoffes von pfirsichfarben bis fuchsienrosa variieren. Diese Farbschwankungen stellen keine Beeinträchtigung der Wirksamkeit des Impfstoffes dar. Bei Beobachtung anderer Veränderungen ist der Impfstoff zu verwerfen. Eine neue Nadel sollte für die Verabreichung des Impfstoffes verwendet werden. Es ist der gesamte Inhalt der Durchstechflasche zu applizieren. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen. 7 INHABER DER ZULASSUNG GlaxoSmithKline Pharma GmbH, Wien. 8 ZULASSUNGSNUMMER DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG / STAND DER INFORMATION April 2017 VERSCHREIBUNGSPFLICHT/APOTHEKENPFLICHT Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. 14
Mumpsviren, Stamm RIT , abgeleitet vom Stamm Jeryl Lynn (lebend, attenuiert) mindestens 10 3,7 ZKID 50
 1. BEZEICHNUNG DES ARZNEIMITTELS MMR-PRIORIX - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis
1. BEZEICHNUNG DES ARZNEIMITTELS MMR-PRIORIX - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis
Priorix Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
 1 FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Priorix Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff
1 FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Priorix Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Priorix-Tetra Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff Lesen
Gebrauchsinformation: Information für Anwender Priorix-Tetra Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff Lesen
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Priorix-Tetra Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Priorix-Tetra Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff Lesen Sie die gesamte Packungsbeilage
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
1. Was ist Priorix Tetra und wofür wird es angewendet?
 Gebrauchsinformation: Information für Anwender PRIORIX TETRA, Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Impfstoff gegen Masern, Mumps, Röteln und Windpocken (lebend) Lesen Sie die
Gebrauchsinformation: Information für Anwender PRIORIX TETRA, Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Impfstoff gegen Masern, Mumps, Röteln und Windpocken (lebend) Lesen Sie die
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert)
 1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (1,0 ml) enthält: Hepatitis A Virus
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (1,0 ml) enthält: Hepatitis A Virus
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 3. DARREICHUNGSFORM 4. KLINISCHE ANGABEN
 1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 720 Kinder Injektionssuspension Hepatitis-A-Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (0,5ml) enthält: Hepatitis-A-Virus
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 720 Kinder Injektionssuspension Hepatitis-A-Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (0,5ml) enthält: Hepatitis-A-Virus
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Daflon 500 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 500 mg gereinigte, mikronisierte
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Daflon 500 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 500 mg gereinigte, mikronisierte
Twinrix Kinder, Injektionssuspension Hepatitis-A (inaktiviert)- und Hepatitis-B (rdna) (HAB)-Impfstoff (adsorbiert)
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Twinrix Kinder, Injektionssuspension Hepatitis-A (inaktiviert)- und Hepatitis-B (rdna) (HAB)-Impfstoff (adsorbiert) 2. QUALITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Twinrix Kinder, Injektionssuspension Hepatitis-A (inaktiviert)- und Hepatitis-B (rdna) (HAB)-Impfstoff (adsorbiert) 2. QUALITATIVE
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften)
 F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS Influvac - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff aus inaktivierten Oberflächenantigenen)
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS Influvac - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff aus inaktivierten Oberflächenantigenen)
FACHINFORMATION. 1. BEZEICHNUNG DES ARZNEIMITTELS Varilrix Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Varizellen-Lebendimpfstoff
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Varilrix Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Varizellen-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Varilrix Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Varizellen-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine
2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Page 1 of 8 FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung. Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung. 2 QUALITATIVE UND QUANTITATIVE
Page 1 of 8 FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung. Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung. 2 QUALITATIVE UND QUANTITATIVE
Gebrauchsinformation: Information für Patienten und Anwender
 Gebrauchsinformation: Information für Patienten und Anwender Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff
Gebrauchsinformation: Information für Patienten und Anwender Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff
Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
FACHINFORMATION 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix, Injektionssuspension Diphtherie-Tetanus-(azellulärer) Pertussis Adsorbatimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Impfdosis
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix, Injektionssuspension Diphtherie-Tetanus-(azellulärer) Pertussis Adsorbatimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Impfdosis
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Influenzavirus Oberflächenantigene (Hämagglutinin und Neuroaminidase) der folgenden Stämme*:
 1. BEZEICHNUNG DES ARZNEIMITTELS Sandovac Injektionssuspension in einer Fertigspritze Influenzaimpfstoff (Oberflächenantigene, inaktiviert) (2014/2015) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Influenzavirus
1. BEZEICHNUNG DES ARZNEIMITTELS Sandovac Injektionssuspension in einer Fertigspritze Influenzaimpfstoff (Oberflächenantigene, inaktiviert) (2014/2015) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Influenzavirus
Fachinformation. mind. 30 Internationale Einheiten (I.E.) Tetanus-Toxoid 1
 1. BEZEICHNUNG DES ARZNEIMITTELS - Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie-Tetanus- (azellulärer) Pertussis-, Poliomyelitis (inaktiviert)- und Haemophilus-influenzae-Typ
1. BEZEICHNUNG DES ARZNEIMITTELS - Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie-Tetanus- (azellulärer) Pertussis-, Poliomyelitis (inaktiviert)- und Haemophilus-influenzae-Typ
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Mumpsviren, Stamm RIT 4385 1, abgeleitet vom Stamm Jeryl Lynn (lebend, attenuiert) mindestens 10 4,4 ZKID 50
 Priorix-Tetra Pulver in einer Durchstechflasche und Lösungsmittel in einer Fertigspritze zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff 2. Qualitative und quantitative
Priorix-Tetra Pulver in einer Durchstechflasche und Lösungsmittel in einer Fertigspritze zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff 2. Qualitative und quantitative
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS: FLUAD, Injektionssuspension in einer Fertigspritze Influenza-Impfstoff, Oberflächenantigene, inaktiviert, mit MF59C.1 als
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS: FLUAD, Injektionssuspension in einer Fertigspritze Influenza-Impfstoff, Oberflächenantigene, inaktiviert, mit MF59C.1 als
Fachinformation. 8 D-Antigeneinheiten Typ 3 (Saukett) 2. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis (azellulär, aus Komponenten) und Poliomyelitis (inaktivierter)-
Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis (azellulär, aus Komponenten) und Poliomyelitis (inaktivierter)-
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Varilrix Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Varilrix Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Varizellen-Lebendimpfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Varilrix Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Varizellen-Lebendimpfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION. VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen
 GEBRAUCHSINFORMATION VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
GEBRAUCHSINFORMATION VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels)
 FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Condrosulf 800 mg-tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Tablette enthält 800 mg Natriumchondroitinsulfat
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Condrosulf 800 mg-tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Tablette enthält 800 mg Natriumchondroitinsulfat
GEBRAUCHSINFORMATION Purevax RCPCh Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension
 GEBRAUCHSINFORMATION Purevax RCPCh Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
GEBRAUCHSINFORMATION Purevax RCPCh Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
Fachinformation. Internationale Einheiten, untere Vertrauensgrenze (p=0,95) der nach der Methode der Ph.Eur. ermittelten Wirksamkeit
 1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis (inaktiviert)-adsorbat-impfstoff (reduzierter Antigengehalt) 2. Qualitative und quantitative
1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis (inaktiviert)-adsorbat-impfstoff (reduzierter Antigengehalt) 2. Qualitative und quantitative
Mumpsviren, Stamm RIT 4385 1, abgeleitet vom Stamm Jeryl Lynn 3. (lebend, attenuiert) mindestens 10 3,0 ZKID 50. Rötelnviren, Stamm Wistar RA 27/3 2
 Priorix Pulver in einer Durchstechflasche und Lösungsmittel in einer Fertigspritze zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff 2. Qualitative und quantitative Zusammensetzung
Priorix Pulver in einer Durchstechflasche und Lösungsmittel in einer Fertigspritze zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff 2. Qualitative und quantitative Zusammensetzung
FACHINFORMATION. Diphtherie, Tetanus, Pertussis und Poliomyelitis. offiziellen Empfehlungen erfolgen. Kinder und Jugendliche
 1. BEZEICHNUNG DES ARZNEIMITTELS Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, (azellulär, aus Komponenten)- und Poliomyelitis (inaktiviert)-adsorbatimpfstoff (mit reduziertem Antigengehalt)
1. BEZEICHNUNG DES ARZNEIMITTELS Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, (azellulär, aus Komponenten)- und Poliomyelitis (inaktiviert)-adsorbatimpfstoff (mit reduziertem Antigengehalt)
GEBRAUCHSINFORMATION Bovalto Respi 3 Injektionssuspension für Rinder
 GEBRAUCHSINFORMATION Bovalto Respi 3 Injektionssuspension für Rinder 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH
GEBRAUCHSINFORMATION Bovalto Respi 3 Injektionssuspension für Rinder 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH
FACHINFORMATION. 4.3 Gegenanzeigen Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
 1. BEZEICHNUNG DES ARZNEIMITTELS Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-GruppenA,C,W-135und Y-Konjugatimpfstoff 2. QUALITATIVE UND QUANTITATIVE
1. BEZEICHNUNG DES ARZNEIMITTELS Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-GruppenA,C,W-135und Y-Konjugatimpfstoff 2. QUALITATIVE UND QUANTITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Trosyd 1 % Creme 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Creme enthält 10 mg Tioconazol. Sonstiger Bestandteil
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Trosyd 1 % Creme 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Creme enthält 10 mg Tioconazol. Sonstiger Bestandteil
Fachinformation 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Seite 1 von 7 PIERRE FABRE PHARMA Fachinformation RIBOMUNYL uno Tabletten, Granulat 1. BEZEICHNUNG DER ARZNEIMITTEL Ribomunyl uno Tabletten Ribomunyl uno Granulat 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Seite 1 von 7 PIERRE FABRE PHARMA Fachinformation RIBOMUNYL uno Tabletten, Granulat 1. BEZEICHNUNG DER ARZNEIMITTEL Ribomunyl uno Tabletten Ribomunyl uno Granulat 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
20 Mikrogramm. Adsorbiert an hydratisiertes Aluminiumhydroxid Gesamt: 0,50 Milligramm Al 3+ 2
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Engerix -B Erwachsene Injektionssuspension in einer Durchstechflasche oder in einer Fertigspritze Hepatitis-B (rdna)-impfstoff (adsorbiert) (HBV) 2. QUALITATIVE
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Engerix -B Erwachsene Injektionssuspension in einer Durchstechflasche oder in einer Fertigspritze Hepatitis-B (rdna)-impfstoff (adsorbiert) (HBV) 2. QUALITATIVE
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Twinrix Erwachsene, Injektionssuspension Hepatitis-A (inaktiviert)- und Hepatitis-B (rdna) (HAB)-Impfstoff (adsorbiert)
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Twinrix Erwachsene, Injektionssuspension Hepatitis-A (inaktiviert)- und Hepatitis-B (rdna) (HAB)-Impfstoff (adsorbiert)
Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15.
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 AHAG I ZUSAMMEFASSUG DER MERKMALE DES ARZEIMITTELS 1 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
AHAG I ZUSAMMEFASSUG DER MERKMALE DES ARZEIMITTELS 1 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS. Lyophilisat zur Herstellung einer Suspension zur Verabreichung als Sprühnebel für Hühner
 Poulvac IB QX ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. BEZEICHNUNG DES TIERARZNEIMITTELS Poulvac IB QX Lyophilisat zur Herstellung einer Suspension zur Verabreichung als Sprühnebel für Hühner
Poulvac IB QX ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. BEZEICHNUNG DES TIERARZNEIMITTELS Poulvac IB QX Lyophilisat zur Herstellung einer Suspension zur Verabreichung als Sprühnebel für Hühner
Sonstige Bestandteile: Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 1. BEZEICHNUNG DES ARZNEIMITTELS MUTAGRIP 2013/2014 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis (0,5 ml)
1. BEZEICHNUNG DES ARZNEIMITTELS MUTAGRIP 2013/2014 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis (0,5 ml)
1. Was ist TdaP-IMMUN und wofür wird es angewendet?
 Page 1 of 6 Gebrauchsinformation: Information für Anwender TdaP-IMMUN Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis- (azelluläre Komponente) Impfstoff (adsorbiert, reduzierter
Page 1 of 6 Gebrauchsinformation: Information für Anwender TdaP-IMMUN Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis- (azelluläre Komponente) Impfstoff (adsorbiert, reduzierter
nicht weniger als 2 Internationale Einheiten (I.E.) (2,5 Lf) nicht weniger als 20 Internationale Einheiten (I.E.) (5 Lf) 2,5 Mikrogramm
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, und Pertussis (azellulär, Komponente) - Impfstoff
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, und Pertussis (azellulär, Komponente) - Impfstoff
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
Gebrauchsinformation: Information für Patienten. Tabletten gegen Magen-Darm-Beschwerden Similasan
 1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Varilrix Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Varilrix Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Wirkstoff: Varizellen-Lebendvirus-Impfstoff (OKA Stamm) Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Varilrix Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Wirkstoff: Varizellen-Lebendvirus-Impfstoff (OKA Stamm) Lesen Sie die gesamte
Tetravac. 1. Bezeichnung des Arzneimittels. 2. Qualitative und quantitative Zusammensetzung. 3. Darreichungsform
 1. Bezeichnung des Arzneimittels, Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff 2. Qualitative und quantitative Zusammensetzung
1. Bezeichnung des Arzneimittels, Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff 2. Qualitative und quantitative Zusammensetzung
FACHINFORMATION. Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis (azellulär, aus Komponenten)- und Poliomyelitis (inaktiviert)-
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis (azellulär, aus Komponenten)- und Poliomyelitis (inaktiviert)-
Gebrauchsinformation: Information für Anwender. Inaktivierter Poliomyelitis-Impfstoff
 Gebrauchsinformation: Information für Anwender IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
360 ELISA-Einheiten Hepatitis-B-Oberflächenantigen 3,4
 Twinrix Kinder-Injektionssuspension in einer Fertigspritze Hepatitis-A (inaktiviert)- und Hepatitis-B (rdna) (HAB)-Impfstoff (adsorbiert) 2. Qualitative und quantitative Zusammensetzung 1 Dosis (0,5 ml)
Twinrix Kinder-Injektionssuspension in einer Fertigspritze Hepatitis-A (inaktiviert)- und Hepatitis-B (rdna) (HAB)-Impfstoff (adsorbiert) 2. Qualitative und quantitative Zusammensetzung 1 Dosis (0,5 ml)
ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS
 Ingelvac CircoFLEX abcd ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS spcde (Renewal) - FINAL - genehmigt am: 14.01.2013 1 1. BEZEICHNUNG DES TIERARZNEIMITTELS Ingelvac CircoFLEX Injektionssuspension
Ingelvac CircoFLEX abcd ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS spcde (Renewal) - FINAL - genehmigt am: 14.01.2013 1 1. BEZEICHNUNG DES TIERARZNEIMITTELS Ingelvac CircoFLEX Injektionssuspension
GEBRAUCHSINFORMATION Eurican SHPPi2LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde
 GEBRAUCHSINFORMATION Eurican SHPPi2LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
GEBRAUCHSINFORMATION Eurican SHPPi2LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Eine Fertigspritze mit 0,4 ml enthält Hepatitis-B-Immunglobulin vom Menschen 200 I.E..
 1. BEZEICHNUNG DES ARZNEIMITTELS Fovepta 200 I.E. Injektionslösung in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Fertigspritze mit 0,4 ml enthält Hepatitis-B-Immunglobulin
1. BEZEICHNUNG DES ARZNEIMITTELS Fovepta 200 I.E. Injektionslösung in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Fertigspritze mit 0,4 ml enthält Hepatitis-B-Immunglobulin
Gebrauchsinformation: Information für Patienten
 Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 Sinupret Tropfen GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Flüssigextrakt aus Enzianwurzel, Schlüsselblumenblüte mit Kelch, Gartensauerampferkraut, Holunderblüte und Eisenkraut Lesen Sie die gesamte
Sinupret Tropfen GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Flüssigextrakt aus Enzianwurzel, Schlüsselblumenblüte mit Kelch, Gartensauerampferkraut, Holunderblüte und Eisenkraut Lesen Sie die gesamte
5 bis 10 Jahre: 0,5 ml Td-pur
 Td-pur für Erwachsene und Heranwachsende Tetanus-Diphtherie-Impfstoff (inaktiviert, adsorbiert, reduzierter Antigengehalt) Injektionssuspension in Fertigspritze 2. Qualitative und quantitative Zusammensetzung
Td-pur für Erwachsene und Heranwachsende Tetanus-Diphtherie-Impfstoff (inaktiviert, adsorbiert, reduzierter Antigengehalt) Injektionssuspension in Fertigspritze 2. Qualitative und quantitative Zusammensetzung
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS M-M-RVAXPRO Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Masern-Mumps-Röteln-Lebendimpfstoff
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS M-M-RVAXPRO Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Masern-Mumps-Röteln-Lebendimpfstoff
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN chronisch- Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN chronisch- Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
FACHINFORMATION. der Erkrankungen in den verschiedenen Ländern unterscheiden, berücksichtigen.
 1. BEZEICHNUNG DES ARZNEIMITTELS Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1. BEZEICHNUNG DES ARZNEIMITTELS Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
GEBRAUCHSINFORMATION Vacoviron FS Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension
 GEBRAUCHSINFORMATION Vacoviron FS Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
GEBRAUCHSINFORMATION Vacoviron FS Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Infanrix, Injektionssuspension Diphtherie-Tetanus-(azellulärer) Pertussis-Adsorbatimpfstoff für Säuglinge (ab 2 Monaten) und Kinder (bis 6 Jahre) Lesen Sie
Gebrauchsinformation: Information für Anwender Infanrix, Injektionssuspension Diphtherie-Tetanus-(azellulärer) Pertussis-Adsorbatimpfstoff für Säuglinge (ab 2 Monaten) und Kinder (bis 6 Jahre) Lesen Sie
PHV-issue: Anti-Human-Thymozyten-Immunglobulin vom Kaninchen
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.09.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.09.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
Zusammenfassung der Merkmale des Arzneimittels
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio - Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis azellulär- und Poliomyelitis
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio - Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis azellulär- und Poliomyelitis
FACHINFORMATION. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Ciclopirox WinthropNagellack 8 % 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g wirkstoffhaltiger Nagellack enthält 80 mg Ciclopirox. Vollständige
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Ciclopirox WinthropNagellack 8 % 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g wirkstoffhaltiger Nagellack enthält 80 mg Ciclopirox. Vollständige
M-M-RVAXPRO-Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension
 M-M-RVAXPRO-Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension in einer Fertigspritze Masern-Mumps-Röteln-Lebendimpfstoff 2. Qualitative und quantitative Zusammensetzung Eine Dosis (0,5
M-M-RVAXPRO-Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension in einer Fertigspritze Masern-Mumps-Röteln-Lebendimpfstoff 2. Qualitative und quantitative Zusammensetzung Eine Dosis (0,5
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6 Wirkstoff: Drosera D3/D4/D6 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6 Wirkstoff: Drosera D3/D4/D6 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten. Allernon 10 mg-tabletten Wirkstoff: Loratadin
 Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
Neuerungen im Impfplan 2010
 Neuerungen im Impfplan 2010 Wien, 17. Februar 2010 Univ.-Prof.Dr. Ingomar Mutz Der Impfplan 2010 enthält gegenüber den bisherigen Empfehlungen mehrere signifikante Veränderungen. Dabei wurde besonders
Neuerungen im Impfplan 2010 Wien, 17. Februar 2010 Univ.-Prof.Dr. Ingomar Mutz Der Impfplan 2010 enthält gegenüber den bisherigen Empfehlungen mehrere signifikante Veränderungen. Dabei wurde besonders
1. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS
 GEBRAUCHSINFORMATION Eurican SHPL Staupe-Adenovirose-Parvovirose-Lebendimpfstoff und Leptospirose-lmpfstoff, inaktiviert; Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Hunde
GEBRAUCHSINFORMATION Eurican SHPL Staupe-Adenovirose-Parvovirose-Lebendimpfstoff und Leptospirose-lmpfstoff, inaktiviert; Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Hunde
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 Page 1 of 7 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung Tuberkulin PPD RT 23 Lesen
Page 1 of 7 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung Tuberkulin PPD RT 23 Lesen
Emgecard 2,5 mmol-filmtabletten
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Emgecard 2,5 mmol-filmtabletten Magnesium-L-aspartat-hydrochlorid-trihydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Emgecard 2,5 mmol-filmtabletten Magnesium-L-aspartat-hydrochlorid-trihydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Cefavora - Tropfen. Gebrauchsinformation: Information für Anwender
 1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
NeuroBloc. Botulinumtoxin Typ B Injektionslösung 5000 E/ml. Wichtige Informationen zur Sicherheit für Ärzte
 NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Locabiosol 1% - Dosierspray 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 5 ml Lösung (= 100 Sprühstöße) enthalten 50
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Locabiosol 1% - Dosierspray 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 5 ml Lösung (= 100 Sprühstöße) enthalten 50
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER MMR-Priorix Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER MMR-Priorix Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff Lesen Sie die gesamte Packungsbeilage
B/Brisbane/60/2008 ähnlicher Stamm (B/Brisbane/60/2008, Wildtyp) Mikrogramm HA 2
 1. BEZEICHNUNG DES ARZNEIMITTELS VAXIGRIP 2016/2017 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis (0,5 ml)
1. BEZEICHNUNG DES ARZNEIMITTELS VAXIGRIP 2016/2017 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis (0,5 ml)
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12 Wirkstoff: Phosphorus D4/D6/D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12 Wirkstoff: Phosphorus D4/D6/D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
FACHINFORMATION. Wirkstoffe: Haemophilus influenzae Typ b-polysaccharide (Polyribosylribitolphosphat) konjugiert an
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Act-HIB Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension in einer Fertigspritze Haemophilus influenzae Typ b-konjugatimpfstoff 2.
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Act-HIB Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension in einer Fertigspritze Haemophilus influenzae Typ b-konjugatimpfstoff 2.
1. Was ist Apis/Belladonna cum Mercurio und wofür wird es angewendet?
 WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Iberogast Flüssigkeit zum Einnehmen Wirkstoffe: Bittere Schleifenblume, Angelikawurzel, Kamillenblüten, Kümmel, Mariendistelfrüchte, Melissenblätter, Pfefferminzblätter,
Gebrauchsinformation: Information für Anwender Iberogast Flüssigkeit zum Einnehmen Wirkstoffe: Bittere Schleifenblume, Angelikawurzel, Kamillenblüten, Kümmel, Mariendistelfrüchte, Melissenblätter, Pfefferminzblätter,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER PROAGIL Rheuma- und Gicht-Tabletten Wirkstoffe: Causticum Hahnemanni Trit. D6, Ferrum phosphoricum Trit. D6, Ledum Trit. D2, Rhododendron Trit. D2 Lesen Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER PROAGIL Rheuma- und Gicht-Tabletten Wirkstoffe: Causticum Hahnemanni Trit. D6, Ferrum phosphoricum Trit. D6, Ledum Trit. D2, Rhododendron Trit. D2 Lesen Sie
ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1 1. BEZEICHNUNG DES TIERARZNEIMITTELS Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Rinder 2. QUALITATIVE UND
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1 1. BEZEICHNUNG DES TIERARZNEIMITTELS Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Rinder 2. QUALITATIVE UND
Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre
 Gebrauchsinformation: Information für den Anwender Aspecton Eukaps 200 mg Weichkapseln Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre Wirkstoff: Eucalyptusöl Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für den Anwender Aspecton Eukaps 200 mg Weichkapseln Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre Wirkstoff: Eucalyptusöl Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
A/Hong Kong/4801/2014 (H3N2) - ähnlicher Stamm (A/Hong Kong/4801/2014, NYMC X-263B)
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN - Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN - Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält
Der Fachdienst Gesundheitsschutz und Umweltmedizin. informiert. Aufklärung über die Impfung gegen Masern, Mumps und Röteln
 Der Fachdienst Gesundheitsschutz und Umweltmedizin informiert Aufklärung über die Impfung gegen Masern, Mumps und Röteln M den folgenden Informationen möchten wir über die Impfung gegen Masern, Mumps und
Der Fachdienst Gesundheitsschutz und Umweltmedizin informiert Aufklärung über die Impfung gegen Masern, Mumps und Röteln M den folgenden Informationen möchten wir über die Impfung gegen Masern, Mumps und
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Gelsemium-Homaccord -Tropfen
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Gelsemium-Homaccord -Tropfen Wirkstoffe: Gelsemium sempervirens, Toxicodendron quercifolium, Cimicifuga racemosa Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Gelsemium-Homaccord -Tropfen Wirkstoffe: Gelsemium sempervirens, Toxicodendron quercifolium, Cimicifuga racemosa Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender. APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen Wirkstoffe: Plantago major Dil. D4, Belladonna Dil. D6, Causticum Hahnemanni Dil. D30, Ferrum metallicum
Gebrauchsinformation: Information für Anwender APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen Wirkstoffe: Plantago major Dil. D4, Belladonna Dil. D6, Causticum Hahnemanni Dil. D30, Ferrum metallicum
Sonstige Bestandteile: Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 1. BEZEICHNUNG DES ARZNEIMITTELS MUTAGRIP Kinder 2014/2015 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis
1. BEZEICHNUNG DES ARZNEIMITTELS MUTAGRIP Kinder 2014/2015 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis
Gebrauchsinformation: Information für Anwender. APOZEMA Blutarmut China complex Nr.38-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Blutarmut China complex Nr.38-Tropfen Wirkstoffe: China Dil. D5, Arsenicum album Dil. D6, Chininum arsenicosum Dil D6 und Pulsatilla Dil. D4 Lesen
Gebrauchsinformation: Information für Anwender APOZEMA Blutarmut China complex Nr.38-Tropfen Wirkstoffe: China Dil. D5, Arsenicum album Dil. D6, Chininum arsenicosum Dil D6 und Pulsatilla Dil. D4 Lesen
GEBRAUCHSINFORMATION UND FACHINFORMATION
 GEBRAUCHSINFORMATION UND FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Grippe-Impfstoff CSL, Suspension zur Injektion in Fertigspritzen Influenza-Impfstoff (Spaltvirus, inaktiviert) 2. QUALITATIVE UND
GEBRAUCHSINFORMATION UND FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Grippe-Impfstoff CSL, Suspension zur Injektion in Fertigspritzen Influenza-Impfstoff (Spaltvirus, inaktiviert) 2. QUALITATIVE UND
Gebrauchsinformation: Information für Patienten. Osanit Hustenkügelchen Wirkstoff: Drosera D6
 Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION Gallimune 407 ND+IB+EDS+ART, Wasser-in-Öl-Emulsion zur Injektion, für Hühner (Elterntiere und Junghennen)
 GEBRAUCHSINFORMATION Gallimune 407 ND+IB+EDS+ART, Wasser-in-Öl-Emulsion zur Injektion, für Hühner (Elterntiere und Junghennen) 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES
GEBRAUCHSINFORMATION Gallimune 407 ND+IB+EDS+ART, Wasser-in-Öl-Emulsion zur Injektion, für Hühner (Elterntiere und Junghennen) 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Act-HIB Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Haemophilus influenzae Typ b-konjugat-impfstoff Bitte lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Act-HIB Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Haemophilus influenzae Typ b-konjugat-impfstoff Bitte lesen Sie die gesamte
Wortlaut der für die Packungsbeilage vorgesehenen Angaben
 Zulassungsnummer: 6312395.00.00 Seite 1 von 5 Apothekenpflichtig TUSSISANA Mischung 20 und 50 ml Stoff Darreichungsform Menge Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation:
Zulassungsnummer: 6312395.00.00 Seite 1 von 5 Apothekenpflichtig TUSSISANA Mischung 20 und 50 ml Stoff Darreichungsform Menge Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation:
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels)
 FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS PREFLUCEL Injektionssuspension in einer Fertigspritze Influenza-Impfstoff (Spaltimpfstoff, inaktiviert,
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS PREFLUCEL Injektionssuspension in einer Fertigspritze Influenza-Impfstoff (Spaltimpfstoff, inaktiviert,
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels)
 1. BEZEICHNUNG DES ARZNEIMITTELS Lösung zum Einnehmen Rotavirus-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Dosis (2 ml) enthält: Rotaviren*, Typ G1 mind. 2,2 10 6 IE 1,2 Rotaviren*,
1. BEZEICHNUNG DES ARZNEIMITTELS Lösung zum Einnehmen Rotavirus-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Dosis (2 ml) enthält: Rotaviren*, Typ G1 mind. 2,2 10 6 IE 1,2 Rotaviren*,
Gebrauchsinformation: Information für Patienten. Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt
 Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
