Anhang III Änderungen der relevanten Abschnitte der Produktinformation
|
|
|
- Sofie Kappel
- vor 5 Jahren
- Abrufe
Transkript
1 Anhang III Änderungen der relevanten Abschnitte der Produktinformation Hinweis: Diese Änderungen in den relevanten Abschnitten der Produktinformation sind das Ergebnis des Referrals. Die Produktinformation wird anschließend von den zuständigen Behörden der Mitgliedsstaaten, gegebenenfalls in Zusammenarbeit mit dem Referenzmitgliedstaat, gemäß den in Kapitel 4 von Titel III der Richtlinie 2001/83/EG beschriebenen Verfahren aktualisiert. 80
2 Teratogene Effekte Für alle oralen Retinoide, die Acitretin, Alitretinoin und Isotretinoin enthalten, wird die vorhandene Produktinformation geändert (nach Bedarf Einfügen, Ersetzen oder Löschung des Texts), um dem nachstehend aufgeführten vereinbarten Wortlaut zu entsprechen. Zusammenfassung der Merkmale des Arzneimittels Da diese Arzneimittel jetzt einer zusätzlichen Überwachung unterliegen, muss das schwarze Dreieck und ein entsprechender Hinweis vor Abschnitt 1 eingefügt werden. Der Warnhinweis bezüglich teratogener Effekte und die Information zum Schwangerschaftsverhütungsprogramm soll an den folgenden Text angepasst werden; außerdem soll ein umrandeter Warnhinweis wie unten angeführt ergänzt werden: Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen siehe Abschnitt 4.8. [ ] 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Teratogene Effekte [Arzneimittelbezeichnung] ist ein starkes menschliches Teratogen, das schwere und lebensbedrohliche Missbildungen beim ungeborenen Kind verursacht. [Arzneimittelbezeichnung] ist streng kontraindiziert bei: - schwangeren Frauen - Frauen im gebärfähigen Alter, es sei denn, es werden alle Bedingungen des Schwangerschaftsverhütungsprogramms eingehalten Schwangerschaftsverhütungsprogramm Dieses Arzneimittel ist TERATOGEN. [INN] ist bei Frauen im gebärfähigen Alter kontraindiziert, es sei denn, dass alle folgenden Bedingungen des Schwangerschaftsverhütungsprogramms eingehalten werden: [zugelassene Indikationen] (siehe Abschnitt 4.1). Die Gebärfähigkeit muss bei allen weiblichen Patienten individuell beurteilt werden. Die Patientin versteht das teratogene Risiko. Die Patientin versteht die Notwendigkeit einer strengen monatlichen Überwachung. Die Patientin versteht und akzeptiert die Notwendigkeit einer zuverlässigen, kontinuierlichen Empfängnisverhütung einen Monat vor der Behandlung, während der gesamten Behandlung und für einen Monat [3 Jahre bei Acitretin] nach Behandlungsende. Es müssen mindestens eine sehr zuverlässige Methode zur Empfängnisverhütung (d.h. eine nutzerunabhängige Methode) oder zwei sich ergänzende nutzerabhängige Methoden zur Empfängnisverhütung angewendet werden. 81
3 Die individuelle Situation jeder Patientin soll bei der Wahl der Empfängnisverhütungsmethode beurteilt und die Patientin in die Diskussion einbezogen werden, um ihre Mitarbeit und die Einhaltung der gewählten Maßnahmen sicherzustellen. Auch im Falle einer Amenorrhö muss die Patientin alle Anweisungen für eine zuverlässige Empfängnisverhütung befolgen. Die Patientin ist über die möglichen Konsequenzen einer Schwangerschaft informiert und versteht diese. Sie ist sich darüber im Klaren, dass sie sich bei einem möglichen Risiko, dass eine Schwangerschaft eingetreten ist, oder bei einem Schwangerschaftsverdacht unverzüglich an ihren Arzt wenden muss. Die Patientin versteht die Notwendigkeit und akzeptiert, regelmäßige Schwangerschaftstests vor und während der Behandlung, idealerweise monatlich, sowie einen Monat nach Therapieende durchführen zu lassen. o [bei Acitretin soll dieser letzte Aufzählungspunkt lauten] Die Patientin versteht die Notwendigkeit und akzeptiert, regelmäßige Schwangerschaftstests vor und während der Behandlung, idealerweise monatlich, sowie nach Therapieende in regelmäßigen Abständen mit 1-3 monatlichen Intervallen über einen Zeitraum von 3 Jahren durchführen zu lassen. Die Patientin bestätigt, dass sie die Gefahren und die bei der Anwendung von <INN> erforderlichen Vorsichtsmaßnahmen verstanden hat. Diese Voraussetzungen gelten auch für Frauen, die gegenwärtig sexuell nicht aktiv sind, es sei denn, der verschreibende Arzt sieht zwingende Gründe dafür, dass keinerlei Risiko besteht, dass eine Schwangerschaft eintritt. Der verschreibende Arzt muss sicherstellen, dass: die Patientin die Voraussetzungen für das o. g. Schwangerschaftsverhütungsprogramm erfüllt, einschließlich eines Nachweises, dass sie über ein angemessenes Verständnis verfügt. die Patientin bestätigt, dass sie die o. g. Voraussetzungen erfüllt. die Patientin versteht, dass sie mindestens einen Monat vor Beginn der Behandlung durchgängig und korrekt eine sehr zuverlässige Methode zur Empfängnisverhütung (d.h. eine nutzerunabhängige Methode) oder zwei sich ergänzende nutzerabhängige Methoden zur Empfängnisverhütung anwenden muss und dass sie die zuverlässige Empfängnisverhütung während der gesamten Behandlungsdauer und für mindestens einen Monat [3 Jahre bei Acitretin] nach Behandlungsende weiterführen muss. Schwangerschaftstests mit negativem Resultat vor und während der Behandlung sowie einen Monat nach Therapieende vorliegen. Die Daten und Ergebnisse der Schwangerschaftstests müssen dokumentiert werden. o [bei Acitretin soll dieser letzte Aufzählungspunkt lauten] Schwangerschaftstests mit negativem Resultat vor und während der Behandlung sowie nach Therapieende mit 1-3 monatlichen Intervallen über einen Zeitraum von 3 Jahren vorliegen. Die Daten und Ergebnisse der Schwangerschaftstests müssen dokumentiert werden. 82
4 Falls bei einer mit [INN] behandelten Frau eine Schwangerschaft eintritt, muss die Behandlung sofort abgebrochen und die Patientin zur Abklärung und Beratung an einen im Bereich der Teratologie spezialisierten oder erfahrenen Arzt überwiesen werden. Falls eine Schwangerschaft nach Behandlungsende eintritt, bleibt ein Risiko ernsthafter und schwerwiegender Missbildungen des Fötus bestehen. Das Risiko besteht bis das Produkt vollständig ausgeschieden wurde, was bis zu einem Monat [bis zu 3 Jahren bei Acitretin] nach dem Ende der Behandlung dauert. Empfängnisverhütung Patientinnen müssen umfassend zum Thema Schwangerschaftsverhütung informiert sein und über geeignete Methoden beraten werden, falls sie noch keine zuverlässige Empfängnisverhütung durchführen. Sollte der verschreibende Arzt diese Informationen der Patientin nicht zur Verfügung stellen können, muss die Patientin an einen entsprechenden Arzt überwiesen werden. Frauen im gebärfähigen Alter müssen mindestens eine sehr zuverlässige Methode zur Empfängnisverhütung (d.h. eine nutzerunabhängige Maßnahme) oder zwei sich ergänzende nutzerabhängige Maßnahmen zur Empfängnisverhütung anwenden. Die Empfängnisverhütung muss einen Monat vor der Behandlung, während der gesamten Behandlung und einen Monat [3 Jahre bei Acitretin] nach Behandlungsende mit <INN> angewendet werden, auch bei Patientinnen mit Amenorrhö. Die individuelle Situation jeder Patientin soll bei der Wahl der Empfängnisverhütungsmethode beurteilt und die Patientin soll in die Diskussion einbezogen werden, um ihre Mitarbeit und die Einhaltung der gewählten Maßnahmen sicherzustellen. Schwangerschaftstests Ärztlich überwachte Schwangerschaftstests mit einer Mindestsensitivität von 25 miu/ml sind in Übereinstimmung mit der klinischen Praxis wie folgt durchzuführen: Vor Behandlungsbeginn Mindestens einen Monat nach Beginn der Maßnahmen zur Empfängnisverhütung und kurz (vorzugsweise wenige Tage) vor der ersten Verschreibung muss ein Schwangerschaftstest unter ärztlicher Überwachung durchgeführt werden. Dieser Test soll sicherstellen, dass die Patientin nicht schwanger ist, wenn sie mit der <INN>-Behandlung beginnt. Kontrolluntersuchungen In regelmäßigen Intervallen, idealerweise monatlich, müssen Kontrolluntersuchungen durchgeführt werden. Die Notwendigkeit monatlicher, ärztlich überwachter Schwangerschaftstests (entsprechend der üblichen Praxis) sollte unter Berücksichtigung der sexuellen Aktivität der Patientin, ihrer Menstruationsanamnese (Menstruationsanomalien, Ausbleiben von Perioden oder Amenorrhö) und der Methode zur Empfängnisverhütung beurteilt werden. Sofern indiziert, muss der Kontrollschwangerschaftstest am Verschreibungstermin oder innerhalb der letzten 3 Tage vor dem Besuch beim verschreibenden Arzt erfolgen. Am Behandlungsende Einen Monat nach dem Ende der Behandlung müssen sich die Patientinnen einem abschließenden Schwangerschaftstest unterziehen. [bei Acitretin soll dieser letzte Absatz lauten] Patientinnen müssen sich über einen Zeitraum von 3 Jahren nach Therapieende regelmäßig in 1-3 monatlichen Intervallen einem Schwangerschaftstest unterziehen. 83
5 Verschreibungs- und Abgabeeinschränkungen Für Frauen im gebärfähigen Alter müssen Verordnungen von <Arzneimittelbezeichnung> idealerweise auf 30 Tage limitiert sein, um regelmäßige Kontrolluntersuchungen einschließlich Schwangerschaftstests zu unterstützen. Idealerweise sollten der Schwangerschaftstest, die Ausstellung des Rezeptes und die Abgabe von <Arzneimittelbezeichnung> am selben Tag erfolgen. Diese monatlichen Kontrollen sollen sicherstellen, dass regelmäßige Schwangerschaftstests durchgeführt werden und dass die Patientin nicht schwanger ist, bevor sie den nächsten Behandlungszyklus erhält. Männliche Patienten Die verfügbaren Daten deuten darauf hin, dass die Exposition der Mutter durch die Samenflüssigkeit des mit <Arzneimittelbezeichnung> behandelten Partners nicht ausreicht, um mit teratogenen Effekten von <Arzneimittelbezeichnung> einherzugehen. Männliche Patienten müssen daran erinnert werden, dass sie ihr Arzneimittel nicht an andere weitergeben dürfen, insbesondere nicht an Frauen. Zusätzliche Vorsichtsmaßnahmen Die Patienten müssen angewiesen werden, das Arzneimittel niemals an andere Personen weiterzugeben und nicht benötigte Kapseln am Ende der Behandlung an ihre Apotheke zurückzugeben. Patienten dürfen während und einen Monat [3 Jahre bei Acitretin] nach der Behandlung mit <INN> kein Blut spenden, da bei schwangeren Frauen, die eine solche Bluttransfusion erhalten, ein potenzielles Risiko für den Fötus besteht. Schulungsmaterial Um verschreibende Ärzte, Apotheker und Patienten bei der Vermeidung einer fötalen Exposition gegenüber <INN> zu unterstützen, wird der Zulassungsinhaber Schulungsmaterialien zur Verfügung stellen, welche die Warnungen zur Teratogenität von <INN> bekräftigen, Hinweise zur Empfängnisverhütung vor dem Behandlungsbeginn geben und Aufklärung über die Notwendigkeit von Schwangerschaftstests liefern. Alle Patienten, männlich und weiblich, müssen vom Arzt in vollem Umfang über das teratogene Risiko und die im Schwangerschaftsverhütungsprogramm dargelegten strengen Maßnahmen zur Empfängnisverhütung aufgeklärt werden. 84
6 Etikettierung Ein umrandeter Warnhinweis soll auf den Umkarton für die oralen Retinoide Acitretin, Alitretinoin und Isotretinoin wie folgt aufgenommen werden: ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG Umkarton 7. WEITERE WARNHINWEISE, FALLS ERFORDERLICH Warnhinweis KANN SCHWERWIEGENDE SCHÄDIGUNGEN DES UNGEBORENEN KINDES VERURSACHEN Frauen müssen für eine zuverlässige Schwangerschaftsverhütung sorgen. Nicht einnehmen, wenn Sie schwanger sind oder vermuten schwanger zu sein. Packungsbeilage Der Warnhinweis bezüglich teratogener Effekte und die Information zum Schwangerschaftsverhütungsprogramm soll an den folgenden Text angepasst werden; außerdem soll ein umrandeter Warnhinweis wie unten angeführt ergänzt werden: Umrandeter Warnhinweis Der folgende umrandete Warnhinweis soll in der Packungsbeilage für die oralen Retinoide Acitretin, Alitretinoin und Isotretinoin unter der Arzneimittelbezeichnung aufgenommen werden: {Name des Arzneimittels Stärke Darreichungsform} {Wirkstoff(e)} Warnhinweis KANN SCHWERWIEGENDE SCHÄDIGUNGEN DES UNGEBORENEN KINDES VERURSACHEN Frauen müssen für eine zuverlässige Schwangerschaftsverhütung sorgen. Nicht einnehmen, wenn Sie schwanger sind oder vermuten schwanger zu sein. 85
7 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende Nebenwirkung melden. Hinweise zur Meldung von Nebenwirkungen, siehe Ende Abschnitt 4. Abschnitt 2. Was sollten Sie vor der Einnahme von <ARZNEIMITTELBEZEICHNUNG> beachten <ARZNEIMITTELBEZEICHNUNG> darf nicht eingenommen werden, wenn Sie schwanger sind oder stillen. wenn irgendeine Möglichkeit besteht, dass Sie schwanger werden können, müssen Sie die Vorsichtsmaßnahmen unter Schwangerschaftsverhütungsprogramm befolgen, siehe Abschnitt Warnhinweise und Vorsichtsmaßnahmen. Schwangerschaftsverhütungsprogramm Schwangere dürfen <Arzneimittelbezeichnung> nicht einnehmen Dieses Arzneimittel kann ein ungeborenes Kind schwer schädigen (das Arzneimittel wird als tetratogen`bezeichnet) es kann schwere Missbildungen von Gehirn, Gesicht, Ohr, Auge, Herz und verschiedenen Drüsen (Thymusdrüse und Nebenschilddrüse) beim ungeborenen Kind verursachen. Es erhöht auch die Wahrscheinlichkeit einer Fehlgeburt. Dies kann auch der Fall sein, wenn <ARZNEIMITTELBEZEICHNUNG> nur für eine kurze Zeit während einer Schwangerschaft eingenommen wird. Sie dürfen <ARZNEIMITTELBEZEICHNUNG> nicht einnehmen, wenn Sie schwanger sind oder wenn Sie vermuten, schwanger zu sein. Sie dürfen <ARZNEIMITTELBEZEICHNUNG> nicht einnehmen, wenn Sie stillen. Das Arzneimittel geht voraussichtlich in die Muttermilch über und kann Ihrem Baby schaden. Sie dürfen <ARZNEIMITTELBEZEICHNUNG> nicht einnehmen, wenn Sie während der Behandlung schwanger werden könnten. Sie dürfen einen Monat nach Ende der Behandlung nicht schwanger werden, da noch Reste des Arzneimittels in Ihrem Körper vorhanden sein können. bei Acitretin soll dieser letzte Aufzählungspunkt lauten: Sie dürfen 3 Jahre nach Therapieende nicht schwanger werden, da noch Reste des Arzneimittels in Ihrem Körper vorhanden sein können. Frauen im gebährfähigen Alter wird <ARZNEIMITTELBEZEICHNUNG> aufgrund des Risikos für schwere Schädigungen des ungeborenen Kindes unter strengen Regeln verschrieben. Diese Regeln sind: Ihr Arzt muss Ihnen das Risiko für die Schädigung des ungeborenen Kindes erklären Sie müssen verstehen, warum Sie nicht schwanger werden dürfen und was Sie tun müssen, um eine Schwangerschaft zu verhindern. Sie müssen mit Ihrem Arzt über schwangerschaftsverhütende Maßnahmen (Geburtenkontrolle) gesprochen haben. Der Arzt wird Ihnen Informationen zur Schwangerschaftsverhütung geben. Der Arzt kann Sie für die Beratung zur Schwangerschaftsverhütung an einen Spezialisten überweisen. 86
8 Vor Behandlungsbeginn wird Ihr Arzt einen Schwangerschaftstest durchführen. Der Test muss zeigen, dass Sie bei Beginn der Behandlung mit <ARZNEIMITTELBEZEICHNUNG> nicht schwanger sind. Frauen müssen vor, während und nach der Einnahme von <ARZNEIMITTELBEZEICHNUNG> zuverlässige schwangerschaftsverhütende Methoden anwenden. Sie müssen sich bereit erklären, mindestens eine sehr zuverlässige schwangerschaftsverhütende Methode (zum Beispiel eine Spirale (Intrauterinpessar) oder ein schwangerschaftsverhütendes Implantat) oder zwei zuverlässige Methoden, die auf verschiedene Weise wirken (zum Beispiel eine hormonelle Verhütungspille und ein Kondom) anzuwenden. Besprechen Sie mit Ihrem Arzt, welche Methode für Sie geeignet ist. Sie müssen einen Monat vor Einnahme von <ARZNEIMITTELBEZEICHNUNG>, während der Behandlung und einen Monat nach Ende der Behandlung ohne Unterbrechung schwangerschaftsverhütende Methoden anwenden. [bei Acitretin: 3 Jahre] Sie müssen auch dann Schwangerschaftsverhütungsmaßnahmen anwenden, wenn Sie keine Periode haben oder wenn Sie sexuell nicht aktiv sind (es sei denn, Ihr Arzt entscheidet, dass dies nicht notwendig ist). Frauen müssen Schwangerschaftstests vor, während und nach der Einnahme von <ARZNEIMITTELBEZEICHNUNG> zustimmen Sie müssen regelmäßigen, idealerweise monatlichen, Kontrolluntersuchungen zustimmen. Sie müssen regelmäßigen Schwangerschaftstests vor, idealerweise jeden Monat während der Behandlung und einen Monat nach Beendigung der Behandlung mit <ARZNEIMITTELBEZEICHNUNG>, zustimmen, da noch Reste des Arzneimittels in Ihrem Körper vorhanden sein können (es sei denn, Ihr Arzt entscheidet, dass dies in Ihrem Fall nicht notwendig ist). [Bei Acitretin: alle 1 bis 3 Monate über einen Zeitraum von 3 Jahren nach Behandlungsende mit <ARZNEIMITTELBEZEICHNUNG> ] Sie müssen zusätzlichen Schwangerschaftstests zustimmen, wenn es Ihr Arzt verlangt. Sie dürfen während der Behandlung oder einen Monat danach nicht schwanger werden, da noch Reste des Arzneimittels in Ihrem Körper vorhanden sein können. bei Acitretin soll dieser letzte Aufzählungspunkt lauten: Sie dürfen während der Behandlung oder 3 Jahre danach nicht schwanger werden, da noch Reste des Arzneimittels in Ihrem Körper vorhanden sein können. Ihr Arzt wird all diese Punkte mittels einer Checkliste mit Ihnen besprechen und Sie (oder einen Elternteil/einen gesetzlichen Vertreter) bitten, ein Formular zu unterzeichnen. Mit diesem Formular wird bestätigt, dass Sie über die Risiken aufgeklärt wurden und dass Sie die oben genannten Regeln befolgen werden. Wenn Sie während der Einnahme von <ARZNEIMITTELBEZEICHNUNG>schwanger werden, müssen Sie das Arzneimittel sofort absetzen und Ihren Arzt verständigen. Ihr Arzt kann Sie an einen Spezialisten überweisen, der Sie weiter berät. 87
9 Auch wenn Sie innerhalb eines Monats [von 3 Jahren bei Acitretin] nach Beendigung der Behandlung mit <ARZNEIMITTELBEZEICHNUNG> schwanger werden, müssen Sie Ihren Arzt verständigen. Ihr Arzt kann Sie an einen Spezialisten überweisen, der Sie weiter berät. Hinweise für Männer Die Mengen des Wirkstoffs im Sperma von Männern, die <ARZNEIMITTELBEZEICHNUNG> einnehmen, sind zu gering, um dem ungeborenen Kind der Partnerin zu schaden. Bitte denken Sie aber daran, dass Sie Ihr Arzneimittel keinesfalls an Andere weitergeben dürfen. Zusätzliche Warnhinweise Sie dürfen dieses Arzneimittel niemals an andere Personen weitergeben. Bitte geben Sie am Ende der Behandlung nicht benötigte <Kapseln> an ihre Apotheke zurück. Sie dürfen während der Behandlung mit diesem Arzneimittel und einen Monat [3 Jahre bei Acitretin] nach der Behandlung mit <ARZNEIMITTELBEZEICHNUNG> kein Blut spenden, weil ein ungeborenes Kind einer Schwangeren, die Ihr Blut erhält, geschädigt werden kann. Schwangerschaft, Stillzeit und Fortpflanzungsfähigkeit Für weitere Informationen zu Schwangerschaft und Verhütung, siehe Abschnitt 2 Schwangerschaft und Verhütungsprogramm. Der folgende Satz sollte am Ende der Packungsbeilage eingefügt werden (letzter Satz): <Ausführliche und aktualisierte Informationen zu diesem Produkt sind durch Scannen des in der GI enthaltenen QR Codes mit einem Smartphone verfügbar. Dieselben Informationen sind auch unter folgender Webadresse: [Webadresse einsetzen] und <http. verfügbar>. QR Code einfügen + <Webadresse> 88
10 Neuropsychiatrische Störungen Für alle oralen Retinoide, die Acitretin, Tretinoin und Bexaroten enthalten, wird die vorhandene Produktinformation geändert (nach Bedarf Einfügen, Ersetzen oder Löschung des Texts), um dem nachstehend aufgeführten vereinbarten Wortlaut zu entsprechen. Zusammenfassung der Merkmale des Arzneimittels Der Warnhinweis zu psychiatrischen Störungen sollte wie folgt geändert werden: Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Psychiatrische Störungen Bei mit systemischen Retinoiden (einschließlich <INN>) behandelten Patienten wurde über Depressionen, Verstärkung von Depressionen, Angst und Stimmungsschwankungen berichtet. Bei Patienten mit einer Depression in der Anamnese ist besondere Vorsicht geboten. Patienten sind auf Anzeichen einer Depression zu überwachen und, falls notwendig, entsprechend zu behandeln. Eine Aufklärung von Familie oder Freunden könnte helfen, eine Verschlechterung der psychischen Verfassung wahrzunehmen. Packungsbeilage Der Warnhinweis zu psychiatrischen Störungen sollte wie folgt geändert werden: Abschnitt 2 Warnhinweise und Vorsichtsmaßnahmen Bitte sprechen Sie mit Ihrem Arzt, bevor Sie <ARZNEIMITTELBEZEICHNUNG> einnehmen: - wenn Sie schon einmal an psychischen Problemen einschließlich Depressionen, Aggressivität oder Stimmungsschwankungen gelitten haben, da die Einnahme von <ARZNEIMITTELBEZEICHNUNG> Ihre Stimmung beeinflussen kann. Psychische Probleme Es kann sein, dass Sie einige Veränderungen in Ihrer Stimmung und in Ihrem Verhalten nicht wahrnehmen und deshalb ist es sehr wichtig, dass Sie Ihren Freunden und Ihrer Familie erzählen, dass dieses Arzneimittel Ihre Stimmung und Ihr Verhalten beeinflussen kann. Diese könnten solche Veränderungen bemerken und Ihnen helfen, etwaige Probleme, die Sie mit Ihrem Arzt besprechen müssen, zu erkennen. 89
11 Für alle oralen Retinoide, die Alitretinoin und Isotretinoin enthalten, wird die vorhandene Produktinformation geändert (nach Bedarf Einfügen, Ersetzen oder Löschung des Texts), um dem nachstehend aufgeführten vereinbarten Wortlaut zu entsprechen. Zusammenfassung der Merkmale des Arzneimittels Der Warnhinweis zu psychiatrischen Störungen soll wie folgt geändert werden: Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Psychiatrische Störungen Bei mit <INN> behandelten Patienten wurde über Depressionen, Verstärkung von Depressionen, Angst, Aggressivität, Stimmungsschwankungen, psychotische Symptome und in sehr seltenen Fällen über Suizidgedanken, Suizidversuche und Suizide berichtet (siehe Abschnitt 4.8). Bei Patienten mit einer Depression in der Anamnese ist besondere Vorsicht geboten und alle Patienten sind auf Anzeichen einer Depression zu überwachen und, falls notwendig, entsprechend zu behandeln. Da eine Unterbrechung der <INN>-Behandlung möglicherweise zu einer unzureichenden Besserung der Symptome führt, kann eine weitere psychiatrische oder psychologische Abklärung (Beratung) notwendig sein. Eine Aufklärung von Familie oder Freunden könnte helfen, eine Verschlechterung der psychischen Verfassung wahrzunehmen. Abschnitt 4.8 Nebenwirkungen Die folgende(n) Nebenwirkung(en) sollen unter der Systemorganklasse Psychiatrische Erkrankungen aufgenommen werden: Selten (kann 1 von Behandelten betreffen): Depression, Verstärkung von Depressionen, Aggressivität, Angst, Stimmungsschwankungen Sehr selten (kann 1 von Behandelten betreffen): Suizide, Suizidversuche, Suizidgedanken, psychotische Störungen, Verhaltensauffälligkeiten Packungsbeilage Der Warnhinweis zu psychiatrischen Störungen soll wie folgt geändert werden: Abschnitt 2 Warnhinweise und Vorsichtsmaßnahmen Bitte sprechen Sie mit Ihrem Arzt, bevor Sie <ARZNEIMITTELBEZEICHNUNG> einnehmen: - wenn Sie schon einmal an psychischen Problemen einschließlich Depressionen, Aggressivität oder Stimmungsschwankungen gelitten haben. Dies umfasst auch Selbstverletzungs- oder Selbstmordgedanken, da die Einnahme von <ARZNEIMITTELBEZEICHNUNG> Ihre Stimmung beeinflussen kann. Psychische Probleme Es kann sein, dass Sie einige Veränderungen in Ihrer Stimmung und in Ihrem Verhalten nicht wahrnehmen; deshalb ist es sehr wichtig, dass Sie Ihren Freunden und Ihrer Familie erzählen, dass Sie dieses Arzneimittel einnehmen. Diese könnten solche Veränderungen bemerken und Ihnen helfen, etwaige Probleme, die Sie mit Ihrem Arzt besprechen müssen, schnell zu erkennen. Abschnitt 4 Welche Nebenwirkungen sind möglich? 90
12 Die folgende(n) Nebenwirkung(en) sind aufzunehmen: Psychische Probleme Seltene Nebenwirkungen (kann bis zu 1 von Patienten betreffen) Depression oder ähnliche Erkrankungen. Deren Anzeichen umfassen traurige oder veränderte Stimmungen, Angst, seelisches Unbehagen Verschlechterung einer vorhandenen Depression Neigung zu Gewalttätigkeit oder Aggressivität Sehr seltene Nebenwirkungen (kann bis zu 1 von Patienten betreffen) Manche Patienten hatten den Gedanken oder Wunsch sich selbst zu verletzen oder sich das Leben zu nehmen (Selbstmordgedanken), versuchten, sich das Leben zu nehmen (Selbstmordversuch) oder haben ihr Leben beendet (Selbstmord). Solche Patienten müssen nicht depressiv erscheinen. Ungewöhnliches Verhalten Anzeichen einer Psychose: ein Verlust des Bezugs zur Realität, wie zum Beispiel das Hören von Stimmen oder Sehen von Dingen, die nicht da sind. Kontaktieren Sie sofort Ihren Arzt, wenn bei Ihnen Anzeichen eines dieser psychischen Probleme auftreten. Ihr behandelnder Arzt kann das Absetzen von <ARZNEIMITTELBEZEICHNUNG> anordnen. Möglicherweise reicht diese Maßnahme nicht aus, um die Probleme zu beenden: Sie benötigen vielleicht weitere Hilfe und Ihr behandelnder Arzt kann die entsprechenden Maßnahmen einleiten. 91
13 Für alle topischen Retinoide, die Adapalen, Alitretinoin, Isotretinoin, Tretinoin und Tazaroten enthalten, wird die vorhandene Produktinformation geändert (nach Bedarf Einfügen, Ersetzen oder Löschung des Texts), um dem nachstehend aufgeführten vereinbarten Wortlaut zu entsprechen. Zusammenfassung der Merkmale des Arzneimittels Eine Gegenanzeige soll wie folgt eingefügt werden: Abschnitt 4.3 Gegenanzeigen: - Schwangerschaft (siehe Abschnitt 4.6) - Frauen, die eine Schwangerschaft planen Abschnitt 4.6 Fertilität, Schwangerschaft und Stillzeit: Die orale Anwendung von Retinoiden verursacht kongenitale Fehlbildungen. Bei bestimmungsgemäßer Anwendung wird bei topisch verabreichten Retinoiden generell angenommen, dass es aufgrund minimaler dermaler Absorption zu einer niedrigen systemischen Exposition kommt. Es kann jedoch individuelle Faktoren geben (z.b. verletzte Hautbarriere, übermäßiger Gebrauch), die zu einer erhöhten systemischen Exposition beitragen können. Schwangerschaft <ARZNEIMITTELBEZEICHNUNG> ist in der Schwangerschaft und bei Frauen, die eine Schwangerschaft planen, kontraindiziert (siehe Abschnitt 4.3). Wird das Arzneimittel während der Schwangerschaft angewendet oder wird die Patientin während der Anwendung dieses Arzneimittels schwanger, muss die Behandlung abgebrochen werden. Packungsbeilage Eine Gegenanzeige soll wie folgt eingefügt werden: Abschnitt 2 <ARZNEIMITTELBEZEICHNUNG> darf nicht angewendet werden: wenn Sie schwanger sind wenn Sie planen schwanger zu werden [ ] Schwangerschaft, Stillzeit und Fortpflanzungsfähigkeit: VERWENDEN Sie<ARZNEIMITTELBEZEICHNUNG> NICHT, wenn Sie schwanger sind oder planen schwanger zu werden. Ihr Arzt kann Ihnen weitere Informationen geben. 92
PHV-issue: Retinoide (Acitretin, Adapalen, Alitretinoin, Bexaroten, Isotretinoin, Tazaroten, Tretinoin) Sehr geehrte Damen und Herren,
 BASG / AGES MEA Traiseng. 5, 1200 Wien, Österreich Datum: 27.06.2018 Kontakt: Ing. Veronika Heimlich, B.Sc. T: +43 505 55-36247 E-Mail: pv-implementation@basg.gv.at Unser Zeichen: PHV-11118339 -A-180626-EUIM
BASG / AGES MEA Traiseng. 5, 1200 Wien, Österreich Datum: 27.06.2018 Kontakt: Ing. Veronika Heimlich, B.Sc. T: +43 505 55-36247 E-Mail: pv-implementation@basg.gv.at Unser Zeichen: PHV-11118339 -A-180626-EUIM
Hinweise für Apotheker zur Abgabe von Ciscutan (Isotretinoin)
 Hinweise für Apotheker zur Abgabe von Ciscutan (Isotretinoin) Einführung Ciscutan (Isotretinoin) ist stark teratogen. Aufgrund des hohen Risikos für ernsthafte und sehr schwerwiegende Missbildungen beim
Hinweise für Apotheker zur Abgabe von Ciscutan (Isotretinoin) Einführung Ciscutan (Isotretinoin) ist stark teratogen. Aufgrund des hohen Risikos für ernsthafte und sehr schwerwiegende Missbildungen beim
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Informationsbroschüre für Patientinnen und Patienten. Schwangerschaftsverhütungs-Programm
 Cutterguide: NO Printing Process: Offset; GD: SB32430 Size: 210 (W) x 297 (H) mm Pages:8 Colors: C M Y K (4 Colors); Native File: Indesign CC Windows Generated in: Acrobat Distiller 11.0 Informationsbroschüre
Cutterguide: NO Printing Process: Offset; GD: SB32430 Size: 210 (W) x 297 (H) mm Pages:8 Colors: C M Y K (4 Colors); Native File: Indesign CC Windows Generated in: Acrobat Distiller 11.0 Informationsbroschüre
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Erivedge Schwangerschaftsverhütungs-Programm:
 Erivedge Schwangerschaftsverhütungs-Programm: Wichtige Informationen zu Empfängnisverhütung und Verhütungsmethoden für männliche und weibliche Patienten, die Erivedge einnehmen. Erivedge kann schwere Geburtsfehler
Erivedge Schwangerschaftsverhütungs-Programm: Wichtige Informationen zu Empfängnisverhütung und Verhütungsmethoden für männliche und weibliche Patienten, die Erivedge einnehmen. Erivedge kann schwere Geburtsfehler
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN. Information über die Risiken für das ungeborene Baby
 MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
MYCOPHENOLAT-MOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Information über die Risiken für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen
Leitfaden für Ärzte und Apotheker
 SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
Leitfaden für Ärzte und Apotheker
 SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN
 MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR PATIENTEN Informationen über das Risiko für das ungeborene Baby Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln (Mycophenolat Mofetil
Anhang III. Änderungen der relevanten Abschnitte der Produktinformation
 Anhang III Änderungen der relevanten Abschnitte der Produktinformation Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage sind
Anhang III Änderungen der relevanten Abschnitte der Produktinformation Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage sind
Direkte Mitteilung an Angehörige der Heilberufe
 81829 München München, August 2013 Direkte Mitteilung an Angehörige der Heilberufe Wir möchten Sie über wichtige Aspekte der klinischen Anwendung von Imnovid (Pomalidomid) informieren, das nun in Kombination
81829 München München, August 2013 Direkte Mitteilung an Angehörige der Heilberufe Wir möchten Sie über wichtige Aspekte der klinischen Anwendung von Imnovid (Pomalidomid) informieren, das nun in Kombination
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm
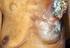 Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Checkliste für den Arzt / Bestätigungsformular zur Verschreibung an Patientinnen
 Checkliste für den Arzt / Bestätigungsformular zur Verschreibung an Patientinnen Für alle Frauen, denen TOCTINO verschrieben wurde, muss das Schwangerschaftsrisiko beurteilt werden. Ist die Patientin gebärfähig?
Checkliste für den Arzt / Bestätigungsformular zur Verschreibung an Patientinnen Für alle Frauen, denen TOCTINO verschrieben wurde, muss das Schwangerschaftsrisiko beurteilt werden. Ist die Patientin gebärfähig?
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen
 Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Wichtige Sicherheitshinweise in Bezug auf Schwangerschaften bei Patientinnen, die Odomzo -Kapseln (Sonidegib) einnehmen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Erivedge Schwangerschaftsverhütungs-Programm
 behördlich genehmigtes Schulungsmaterial Erivedge Schwangerschaftsverhütungs-Programm Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer
behördlich genehmigtes Schulungsmaterial Erivedge Schwangerschaftsverhütungs-Programm Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer
Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern
 Mycophenolat (z.b. CellCept ) Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern Bonn (26. Oktober 2015) - Die Europäische Arzneimittel Agentur (EMA) warnt, dass der in der
Mycophenolat (z.b. CellCept ) Verschärfung der Warnungen um die Anwendung in der Schwangerschaft zu verhindern Bonn (26. Oktober 2015) - Die Europäische Arzneimittel Agentur (EMA) warnt, dass der in der
Isotretinoin-ratiopharm
 Isotretinoin-ratiopharm Dokumentation für Ärzte & Apotheker zur Verordnung und Abgabe VIELMEHRWERT Isotretinoin-ratiopharm 10 mg Weichkapseln Isotretinoin-ratiopharm 20 mg Weichkapseln Dokumentationsbroschüre
Isotretinoin-ratiopharm Dokumentation für Ärzte & Apotheker zur Verordnung und Abgabe VIELMEHRWERT Isotretinoin-ratiopharm 10 mg Weichkapseln Isotretinoin-ratiopharm 20 mg Weichkapseln Dokumentationsbroschüre
Toctino Bestätigungsformular für Patienten
 Cutterguide: N/A Printing Process: Offset GD: SD428639 Size: A5: 148 X 210 mm Pages: 12 Colors: C M Y K (4 Color) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller XI Datum Name des Patienten
Cutterguide: N/A Printing Process: Offset GD: SD428639 Size: A5: 148 X 210 mm Pages: 12 Colors: C M Y K (4 Color) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller XI Datum Name des Patienten
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE
 MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Teratogenes Risiko Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln wurde als Teil der Zulassungsauflagen
MYCOPHENOLAT-HALTIGE ARZNEIMITTEL LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Teratogenes Risiko Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln wurde als Teil der Zulassungsauflagen
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen
 Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Dokumentationsbroschüre mit Checkliste für den Arzt für die Verordnung von
 Dokumentationsbroschüre mit Checkliste für den Arzt für die Verordnung von behördlich genehmigtes Schulungsmaterial ISOTRETINOIN BASICS - Teil des Schwangerschaftsverhütungsprogramms - Diese Dokumentationsbroschüre
Dokumentationsbroschüre mit Checkliste für den Arzt für die Verordnung von behördlich genehmigtes Schulungsmaterial ISOTRETINOIN BASICS - Teil des Schwangerschaftsverhütungsprogramms - Diese Dokumentationsbroschüre
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 74 Wissenschaftliche Schlussfolgerungen Am 7. Juli 2016 veranlasste das Vereinigte Königreich ein Verfahren nach Artikel 31 der Richtlinie 2001/83/EG aufgrund
Anhang II Wissenschaftliche Schlussfolgerungen 74 Wissenschaftliche Schlussfolgerungen Am 7. Juli 2016 veranlasste das Vereinigte Königreich ein Verfahren nach Artikel 31 der Richtlinie 2001/83/EG aufgrund
Patientenbroschüre. Behandlung mit Valproat. Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten
 Patientenbroschüre Behandlung mit Valproat (Depakine, Depakine Chrono, Valproate Chrono Sanofi, Orfiril, Valproat Chrono Desitin, Valproat Sandoz, Convulex ) Empfängnisverhütung und Schwangerschaft: Was
Patientenbroschüre Behandlung mit Valproat (Depakine, Depakine Chrono, Valproate Chrono Sanofi, Orfiril, Valproat Chrono Desitin, Valproat Sandoz, Convulex ) Empfängnisverhütung und Schwangerschaft: Was
Spezielle Informationen bei Kinderwunsch und Schwangerschaft
 Spezielle Informationen bei Kinderwunsch und Schwangerschaft Patientenbroschüre Beauflagtes Schulungsmaterial 2 Diese Informationsbroschüre für Patienten zur Anwendung von Leflunomid medac ist eine Auflage
Spezielle Informationen bei Kinderwunsch und Schwangerschaft Patientenbroschüre Beauflagtes Schulungsmaterial 2 Diese Informationsbroschüre für Patienten zur Anwendung von Leflunomid medac ist eine Auflage
'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine
 'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende
'Y Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende
MEDIKAMENTE, DIE MYCOPHENOLAT ENTHALTEN Informationsbroschüre für Patienten. Informationen über die Risiken für den Fötus
 Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
LEITFADEN FÜR PATIENTINNEN
 LEITFADEN FÜR PATIENTINNEN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
LEITFADEN FÜR PATIENTINNEN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE
 MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln
MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln
Dokumentationsbroschüre mit Checkliste für die Verordnung von Acitretin-haltigen Arzneimitteln
 für den Arzt: Dokumentationsbroschüre mit Checkliste für die Verordnung von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des
für den Arzt: Dokumentationsbroschüre mit Checkliste für die Verordnung von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von. Isoderm. Wirkstoff: Isotretinoin. Teil des Schwangerschaftsverhütungsprogramms
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isoderm Wirkstoff: Isotretinoin Teil des Schwangerschaftsverhütungsprogramms Stand: August 2004 Anweisungen für den Arzt zur Verordnung von
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isoderm Wirkstoff: Isotretinoin Teil des Schwangerschaftsverhütungsprogramms Stand: August 2004 Anweisungen für den Arzt zur Verordnung von
ANHANG III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION
 ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des Schwangerschaftsverhütungsprogramms
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des Schwangerschaftsverhütungsprogramms
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des Schwangerschaftsverhütungsprogramms
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des Schwangerschaftsverhütungsprogramms
MEDIKAMENTE, DIE MYCOPHENOLAT ENTHALTEN Informationsbroschüre für Patienten. Informationen über die Risiken für den Fötus
 Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Mycophenolat SANDOZ. Mycophenolathaltige Arzneimittel. Leitfaden für Angehörige der Gesundheitsberufe
 Mycophenolat SANDOZ Mycophenolathaltige Arzneimittel Leitfaden für Angehörige der Gesundheitsberufe 1 Teratogenes Risiko Dieser Leitfaden zur Anwendung von mycophenolathaltigen Arzneimitteln wurde als
Mycophenolat SANDOZ Mycophenolathaltige Arzneimittel Leitfaden für Angehörige der Gesundheitsberufe 1 Teratogenes Risiko Dieser Leitfaden zur Anwendung von mycophenolathaltigen Arzneimitteln wurde als
ISOTRETINOIN BASICS. Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe. - Teil des Schwangerschaftsverhütungsprogramms -
 ISOTRETINOIN BASICS Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe behördlich genehmigtes Schulungsmaterial - Teil des Schwangerschaftsverhütungsprogramms - Dieser Leitfaden ist verpflichtender
ISOTRETINOIN BASICS Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe behördlich genehmigtes Schulungsmaterial - Teil des Schwangerschaftsverhütungsprogramms - Dieser Leitfaden ist verpflichtender
INFORMATIONSBROSCHÜRE FÜR DEN PATIENTEN
 Damit Valproat enthaltene Arzneimittel ihre volle Wirkung entfalten können und, um deren ordnungsgemäße Anwendung sicherzustellen und deren Nebenwirkungen zu begrenzen, müssen bestimmte Maßnahmen/Vorsichtsmaßnahmen
Damit Valproat enthaltene Arzneimittel ihre volle Wirkung entfalten können und, um deren ordnungsgemäße Anwendung sicherzustellen und deren Nebenwirkungen zu begrenzen, müssen bestimmte Maßnahmen/Vorsichtsmaßnahmen
Dokumentationsbroschüre mit Checkliste für die Verordnung von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms
 für den Arzt: Dokumentationsbroschüre mit Checkliste für die Verordnung von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms Isotretinoin ist sehr teratogen. Selbst während der Einnahme über
für den Arzt: Dokumentationsbroschüre mit Checkliste für die Verordnung von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms Isotretinoin ist sehr teratogen. Selbst während der Einnahme über
Mitteilung des Bundesamts für Sicherheit im Gesundheitswesen über Maßnahmen zur Gewährleistung der Arzneimittelsicherheit:
 Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
MAVENCLAD. Informationsmaterial für Patienten. Version 1.0, [Stand Juli 2017]
![MAVENCLAD. Informationsmaterial für Patienten. Version 1.0, [Stand Juli 2017] MAVENCLAD. Informationsmaterial für Patienten. Version 1.0, [Stand Juli 2017]](/thumbs/78/78512222.jpg) MAVENCLAD Informationsmaterial für Patienten Version 1.0, [Stand Juli 2017] Wichtige Informationen für Patienten, die eine Therapie mit Mavenclad beginnen Inhalt Einführung Wie erfolgt die Behandlung mit
MAVENCLAD Informationsmaterial für Patienten Version 1.0, [Stand Juli 2017] Wichtige Informationen für Patienten, die eine Therapie mit Mavenclad beginnen Inhalt Einführung Wie erfolgt die Behandlung mit
Toctino Bestätigungsformular für Patienten
 * Toctino wird zur Behandlung von Patientinnen/Patienten unter 18 Jahren nicht empfohlen. Datum Unterschrift des Patienten Geburtsdatum Name des Patienten (Druckschrift) Mein behandelnder Dermatologe hat
* Toctino wird zur Behandlung von Patientinnen/Patienten unter 18 Jahren nicht empfohlen. Datum Unterschrift des Patienten Geburtsdatum Name des Patienten (Druckschrift) Mein behandelnder Dermatologe hat
MAVENCLAD. Informationsmaterial für verschreibende Ärzte. Version 1.0, [Stand Juli 2017]
![MAVENCLAD. Informationsmaterial für verschreibende Ärzte. Version 1.0, [Stand Juli 2017] MAVENCLAD. Informationsmaterial für verschreibende Ärzte. Version 1.0, [Stand Juli 2017]](/thumbs/77/74803261.jpg) MAVENCLAD Informationsmaterial für verschreibende Ärzte Version 1.0, [Stand Juli 2017] Inhalt Einführung Behandlungsschemata Überwachung während der Behandlung Lymphozytenzahlen Schwere Infektionen Progressive
MAVENCLAD Informationsmaterial für verschreibende Ärzte Version 1.0, [Stand Juli 2017] Inhalt Einführung Behandlungsschemata Überwachung während der Behandlung Lymphozytenzahlen Schwere Infektionen Progressive
Informationsbroschüre für Patienten Was Sie wissen müssen
 Europa hat Bedingungen für die Markteinführung des Arzneimittels VOLIBRIS gestellt (europaweit eingetragen). Dieser in Belgien und Luxemburg obligatorische Risikomanagementplan, zu dem dieses Informationsschreiben
Europa hat Bedingungen für die Markteinführung des Arzneimittels VOLIBRIS gestellt (europaweit eingetragen). Dieser in Belgien und Luxemburg obligatorische Risikomanagementplan, zu dem dieses Informationsschreiben
Leitfaden für Ärzte und Apotheker. zur Verordnung und Abgabe von Isotretinoin. - Teil des Schwangerschaftsverhütungsprogramms
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms Anweisungen für den Arzt zur Verordnung von Isotretinoin Bitte lesen Sie diesen
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms Anweisungen für den Arzt zur Verordnung von Isotretinoin Bitte lesen Sie diesen
ISOCURAL Weichkapseln, zum Einnehmen (Isotretinoin)
 Die Markteinführung von ISOCURAL wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende Informationsblatt
Die Markteinführung von ISOCURAL wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende Informationsblatt
LEITFADEN FÜR PATIENTINNENN
 LEITFADEN FÜR PATIENTINNENN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
LEITFADEN FÜR PATIENTINNENN Valproathaltige Arzneimittel Empfängnisverhütung und Schwangerschaft: Was Sie unbedingt wissen sollten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies er
Bezeichnung des Arzneimittels: Vom Pharmazeutischen Unternehmer auszufüllen Pharmazeutischen Unternehmer:
 Fragebogen für Angehörige der Gesundheitsberufe zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln (z. B. CellCept, Myfortic und andere Arzneimittelnamen) während einer Schwangerschaft
Fragebogen für Angehörige der Gesundheitsberufe zur Meldung einer Exposition gegenüber Mycophenolat-haltigen Arzneimitteln (z. B. CellCept, Myfortic und andere Arzneimittelnamen) während einer Schwangerschaft
Thalidomid / Lenalidomide
 Thalidomid / Lenalidomide Bedingungen für das Inverkehrbringen aus den zentralen Zulassungsverfahren R Zugelassene Indikationen Lenalidomide (Revlimid ): Revlimid ist in Kombination mit Dexamethason indiziert
Thalidomid / Lenalidomide Bedingungen für das Inverkehrbringen aus den zentralen Zulassungsverfahren R Zugelassene Indikationen Lenalidomide (Revlimid ): Revlimid ist in Kombination mit Dexamethason indiziert
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 12.04.2018 Ing. Veronika Heimlich, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 12.04.2018 Ing. Veronika Heimlich, B.Sc. REGA +43 (0) 505 55 36247 pv-implementation@ages.at
PATIENTEN- INFORMATIONSKARTE
 PATIENTEN- INFORMATIONSKARTE Diese Patienteninformationskarte ist ein verpflichtender Teil der Zulassung, um sicherzustellen, dass Angehörige der Heilberufe, sowie Patienten die besonderen Sicherheitsanforder
PATIENTEN- INFORMATIONSKARTE Diese Patienteninformationskarte ist ein verpflichtender Teil der Zulassung, um sicherzustellen, dass Angehörige der Heilberufe, sowie Patienten die besonderen Sicherheitsanforder
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP)
 INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP) Wichtige Informationen zu Truvada (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko einer Infektion mit dem
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP) Wichtige Informationen zu Truvada (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko einer Infektion mit dem
Wichtige Informationen für Ärzte und Apotheker zur Minimierung des Teratogenitätsrisikos von Odomzo -Kapseln (Sonidegib)
 Wichtige Informationen für Ärzte und Apotheker zur Minimierung des Teratogenitätsrisikos von Odomzo -Kapseln (Sonidegib) Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Wichtige Informationen für Ärzte und Apotheker zur Minimierung des Teratogenitätsrisikos von Odomzo -Kapseln (Sonidegib) Diese Informationsbroschüre ist verpflichtender Teil der Zulassung von Odomzo (Sonidegib)
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von. Acicutan. - Teil des Schwangerschaftsverhütungsprogramms
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acicutan - Teil des Schwangerschaftsverhütungsprogramms - Stand: Mai 2012 Anweisungen für den Arzt zur Verordnung von Acitretin Bitte lesen
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acicutan - Teil des Schwangerschaftsverhütungsprogramms - Stand: Mai 2012 Anweisungen für den Arzt zur Verordnung von Acitretin Bitte lesen
Sehr geehrte Damen und Herren,
 BASG / AGES MEA Traiseng. 5, 1200 Wien, Österreich Datum: Kontakt: T: 08.06.2018 Ing. Veronika Heimlich, B.Sc. +43 505 55-36247 E-Mail: pv-implementation@basg.gv.at Unser Zeichen: PHV-10968363 -A-180605-EUIM
BASG / AGES MEA Traiseng. 5, 1200 Wien, Österreich Datum: Kontakt: T: 08.06.2018 Ing. Veronika Heimlich, B.Sc. +43 505 55-36247 E-Mail: pv-implementation@basg.gv.at Unser Zeichen: PHV-10968363 -A-180605-EUIM
MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko
 MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln
MYCOPHENOLATMOFETIL (MMF)-/ MYCOPHENOLSÄURE (MPA)-HALTIGE ARZNEIMITTEL: Teratogenes Risiko LEITFADEN FÜR ANGEHÖRIGE DER GESUNDHEITSBERUFE Dieser Leitfaden zur Anwendung von Mycophenolat-haltigen Arzneimitteln
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung
 Die Gesundheitsbehörden der Europäischen Union haben für das Medikament Erivedge eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung in Belgien
Die Gesundheitsbehörden der Europäischen Union haben für das Medikament Erivedge eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung in Belgien
Die sichere Anwendung von Retinoiden in der Dermatologie
 Bern, im Januar 2017 Die sichere Anwendung von Retinoiden in der Dermatologie Angesichts des hohen teratogenen Potenzials der Retinoide ist eine strikte Einhaltung der Vorsichtsmassnahmen bei Frauen im
Bern, im Januar 2017 Die sichere Anwendung von Retinoiden in der Dermatologie Angesichts des hohen teratogenen Potenzials der Retinoide ist eine strikte Einhaltung der Vorsichtsmassnahmen bei Frauen im
PHV-issue: Methotrexat. Sehr geehrte Damen und Herren,
 BASG / AGES MEA Traiseng. 5, 1200 Wien, Österreich Datum: 28.05.2018 Kontakt: Ing. Veronika Heimlich, B.Sc. T: +43 505 55-36247 E-Mail: pv-implementation@ages.at Unser Zeichen: PHV-10944483 -A-180525-EUIM
BASG / AGES MEA Traiseng. 5, 1200 Wien, Österreich Datum: 28.05.2018 Kontakt: Ing. Veronika Heimlich, B.Sc. T: +43 505 55-36247 E-Mail: pv-implementation@ages.at Unser Zeichen: PHV-10944483 -A-180525-EUIM
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Gebrauchsinformation: Information für Patienten. Schlaf- und Entspannungstropfen Similasan Avena sativa D1, Passiflora incarnata D1
 1/5 Gebrauchsinformation: Information für Patienten Schlaf- und Entspannungstropfen Similasan Avena sativa D1, Passiflora incarnata D1 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
1/5 Gebrauchsinformation: Information für Patienten Schlaf- und Entspannungstropfen Similasan Avena sativa D1, Passiflora incarnata D1 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CRIMAX Haarvitaltropfen Wirkstoffe: Acidum hydrofluoricum Dil. D12, Graphites Dil. D8, Pel talpae Dil. D8, Selenium amorphum Dil. D12 Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CRIMAX Haarvitaltropfen Wirkstoffe: Acidum hydrofluoricum Dil. D12, Graphites Dil. D8, Pel talpae Dil. D8, Selenium amorphum Dil. D12 Lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender. RheumaCare Tabletten
 Gebrauchsinformation: Information für Anwender RheumaCare Tabletten Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält wichtige
Gebrauchsinformation: Information für Anwender RheumaCare Tabletten Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält wichtige
Behandlung mit. was Sie darüber wissen müssen
 Information für Patienten, denen Volibris verschrieben wurde Behandlung mit was Sie darüber wissen müssen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung um sicherzustellen, dass Angehörige
Information für Patienten, denen Volibris verschrieben wurde Behandlung mit was Sie darüber wissen müssen Diese Informationsbroschüre ist verpflichtender Teil der Zulassung um sicherzustellen, dass Angehörige
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
Gebrauchsinformation: Information für den Anwender. Koreanischer Reiner Roter Ginseng Kapseln
 Gebrauchsinformation: Information für den Anwender Koreanischer Reiner Roter Ginseng Kapseln Wirkstoff: Ginsengwurzel-Pulver 1 Hartkapsel enthält 300 mg rote (wasserdampfbehandelte) Ginsengwurzel, pulverisiert.
Gebrauchsinformation: Information für den Anwender Koreanischer Reiner Roter Ginseng Kapseln Wirkstoff: Ginsengwurzel-Pulver 1 Hartkapsel enthält 300 mg rote (wasserdampfbehandelte) Ginsengwurzel, pulverisiert.
JINARC (Tolvaptan) Broschüre zur Aufklärung von Patienten. rz_jin_patientenbroschuere_a4_2017.indd :58
 JINARC (Tolvaptan) Broschüre zur Aufklärung von Patienten 1 rz_jin_patientenbroschuere_a4_2017.indd 1 01.03.17 11:58 rz_jin_patientenbroschuere_a4_2017.indd 2 01.03.17 11:58 Inhalt 5 Welchen Zweck erfüllt
JINARC (Tolvaptan) Broschüre zur Aufklärung von Patienten 1 rz_jin_patientenbroschuere_a4_2017.indd 1 01.03.17 11:58 rz_jin_patientenbroschuere_a4_2017.indd 2 01.03.17 11:58 Inhalt 5 Welchen Zweck erfüllt
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER VENODRIL Tropfen Wirkstoffe: Aesculus hippocastanum Dil. D6, Hamamelis virginiana Dil. D4, Melilotus officinalis Dil. D6, Silybum marianum Dil. D4 Lesen Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER VENODRIL Tropfen Wirkstoffe: Aesculus hippocastanum Dil. D6, Hamamelis virginiana Dil. D4, Melilotus officinalis Dil. D6, Silybum marianum Dil. D4 Lesen Sie
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Medivitan iv Fertigspritze 5mg, 1mg, 1,05mg Injektionslösung Wirkstoffe: Pyridoxinhydrochlorid / Cyanocobalamin / Folsäure Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Medivitan iv Fertigspritze 5mg, 1mg, 1,05mg Injektionslösung Wirkstoffe: Pyridoxinhydrochlorid / Cyanocobalamin / Folsäure Lesen Sie die gesamte Packungsbeilage
Anwendungsrichtlinien für Ärztinnen und Ärzte
 CURAKNE Isotretinoin Anwendungsrichtlinien für Ärztinnen und Ärzte Dieses Arzneimittel ist teratogen, daher ist während der Behandlung eine zuverlässige Schwangerschaftsverhütung zwingend erforderlich.
CURAKNE Isotretinoin Anwendungsrichtlinien für Ärztinnen und Ärzte Dieses Arzneimittel ist teratogen, daher ist während der Behandlung eine zuverlässige Schwangerschaftsverhütung zwingend erforderlich.
: Schulungsmaterial (Educational Material) für medizinisches Fachpersonal
 Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT EMTRICITABIN/TENOFOR DISOPROXIL ACCORD ZUR PRÄ-EXPOSITIONS-PROPHYLAXE
 INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT EMTRICITABIN/TENOFOR DISOPROXIL ACCORD ZUR Wichtige Informationen zu Emtricitabin/Tenofovir disoproxil Accord (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT EMTRICITABIN/TENOFOR DISOPROXIL ACCORD ZUR Wichtige Informationen zu Emtricitabin/Tenofovir disoproxil Accord (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko
Gebrauchsinformation: Information für Patienten. Essentiale forte-kapseln Wirkstoff: Phospholipide aus Sojabohnen
 Gebrauchsinformation: Information für Patienten Essentiale forte-kapseln Wirkstoff: Phospholipide aus Sojabohnen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten Essentiale forte-kapseln Wirkstoff: Phospholipide aus Sojabohnen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Anhang III. Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Gebrauchsinformation: Information für Patienten. Graphites D 12, Jodum D 15, Petroleum rectificatum D 12, Thallium sulfuricum.
 Tropfen gegen Haarausfall und brüchige Nägel Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Haarausfall und brüchige Nägel Similasan Graphites D 12, Jodum D 15, Petroleum rectificatum
Tropfen gegen Haarausfall und brüchige Nägel Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Haarausfall und brüchige Nägel Similasan Graphites D 12, Jodum D 15, Petroleum rectificatum
Gebrauchsinformation: Information für Patienten
 Tropfen gegen Heuschnupfen Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Heuschnupfen Similasan Cardiospermum halicacabum D 4, Luffa operculata D 6, Thryallis glauca (Galphimia
Tropfen gegen Heuschnupfen Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Heuschnupfen Similasan Cardiospermum halicacabum D 4, Luffa operculata D 6, Thryallis glauca (Galphimia
Gebrauchsinformation: Information für Patienten. Aesculus hippocastanum D 8, Lycopodium clavatum D 12, Graphites D 10, Lachesis D 12
 Tropfen gegen Krampfadern und Hämorrhoiden Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Krampfadern und Hämorrhoiden Similasan Aesculus hippocastanum D 8, Lycopodium clavatum
Tropfen gegen Krampfadern und Hämorrhoiden Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Krampfadern und Hämorrhoiden Similasan Aesculus hippocastanum D 8, Lycopodium clavatum
