Dokumentationsbroschüre mit Checkliste für die Verordnung von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms
|
|
|
- Tomas Dresdner
- vor 6 Jahren
- Abrufe
Transkript
1 für den Arzt: Dokumentationsbroschüre mit Checkliste für die Verordnung von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms
2 Isotretinoin ist sehr teratogen. Selbst während der Einnahme über einen kurzen Zeitraum besteht ein äußerst hohes Risiko für Missbildungen des Fötus, wenn eine Patientin schwanger wird. Isotretinoin ist daher bei Frauen, die schwanger sind oder während der sdauer schwanger werden könnten, kontraindiziert. Bevor Sie als verschreibender Arzt eine Isotretinoin-Therapie beginnen (oder fortsetzen), müssen Sie sich davon überzeugen, dass die folgenden Bedingungen alle erfüllt sind: 2
3 CHECKLISTE ZUR VERORDNUNG VON ISOTRETINOIN (Der Teil, der ausschließlich Patientinnen betrifft, ist kursiv gedruckt) Verordnung von Isotretinoin v Vor der Verordnung Prüfung der Indikation (schwere Akne wie noduläre Akne oder Acne conglobata oder Akne mit der Gefahr einer dauerhaften Narbenbildung, die gegenüber einer angemessenen Standardbehandlung mit systemischen Antibiotika in Kombination mit topischer therapieresistent ist.) Prüfung der Kontraindikationen: Isotretonoin ist kontraindiziert bei schwangeren oder stillenden Frauen gebärfähigen Frauen, sofern nicht alle Bedingungen des Empfängnisverhütungsprogramms erfüllt werden Leberinsuffizienz Stark erhöhten Blutfettwerte Hypervitaminose A Überempfindlichkeit gegenüber Isotretinoin oder einem der Hilfsstoffe gleichzeitiger mit Tetrazyklinen Stellen Sie sicher, dass Ihre Patientin und Ihr Patient über das teratogene Risiko der mit Isotretonoin mündlich und schriftlich informiert ist und es versteht. Weisen Sie darauf hin, dass er/sie wegen des teratogenen Risikos nicht Blut spenden darf (bis einschließlich 1 Monat nach sende), das Arzneimittel mit niemanden teilen darf und unverbrauchte Tabletten an die Apotheke zurückgeben muß. Händigen Sie allen Patienten und Patientinnen die Patienteninformationsbroschüre aus. Händigen Sie allen Patientinnen im gebärfähigen Alter die Informationsbroschüre zur Schwangerschaftsverhütung aus. Stellen Sie sicher, dass Ihre Patientin im gebärfähigen Alter die Notwendigkeit von monatlichen Kontrolluntersuchungen versteht und diese einhält. Vergewissern Sie sich, dass Ihre Patientin die Notwendigkeit einer ununterbrochenen wirksamen Verhütung im Sinne des Schwangerschaftsverhütungsprogramms (siehe Abschnitt Verhütung) mindestens einen Monat vor Beginn der, während der gesamten und mindestens einen Monat nach Ende der versteht und gewillt ist, kontinierlich und gewissenhaft diese wirksame Verhütung zu praktizieren. Ermuntern Sie Ihre Patientin, alle für sie wichtigen Fragen dazu zu stellen. Überweisen Sie Ihre Patientin vor Beginn der Therapie zur Beratung an einen Gynäkologen. Lassen Sie sich die Dokumentation über den Besuch beim Gynäkologen aushändigen. Achten Sie darauf, dass auch Patientinnen mit Amenorrhoe und auch diejenigen, die zur Zeit nicht sexuell aktiv sind, alle Ratschläge zur wirksamen Verhütung befolgen müssen (Ausnahme:gynäkologisch nachgewiesene irreversible Sterilität). 3
4 Erster Schwangerschaftstest: Führen Sie oder der Gynäkologe den ersten Schwangerschaftstest mit einer Mindestempfindlichkeit von 25 miu/ml innerhalb der ersten drei Tagen des Zyklus (oder wenn die Periode unregelmäßig ist ca. drei Wochen nach dem letzten ungeschützten Geschlechtsverkehr) durch. Fällt dieser negativ aus, sollte die Patientin mit den für die unter Isotretinoin gewählten Verhütungsmaßnahmen beginnen. Wegen verbleibender Restrisiken einer Einzelmethode sollten Sie darauf hinwirken, dass die Patientin zwei komplementäre Formen der Verhütung verwendet. Zweiter Schwangerschaftstest: Nach mindestens vier Wochen fortgesetzter Verhütung führen Sie am Tag der Verordnung oder innerhalb von drei Tagen davor einen weiteren Schwangerschaftstest mit einer Mindestempfindlichkeit von 25 miu/ml durch. Stellen Sie sicher, dass die Frau die möglichen Folgen einer Schwangerschaft kennt und versteht und weiß, dass sie die Therapie sofort abbrechen und unbedingt sofort einen Arzt aufsuchen muss, wenn die Möglichkeit besteht, dass eine Schwangerschaft eingetreten ist. Achten Sie darauf, dass die Frau die Notwendigkeit versteht und akzeptiert, weitere Schwangerschaftstests während und fünf Wochen nach Ende der vornehmen zu lassen. Sorgen Sie dafür, dass die Patientin und der Patient von Ihnen alle mündlichen und schriftlichen Informationen erhält und anschließend durch Unterzeichnung des Formulars bestätigt, dass sie/er die Risiken und notwendigen Vorsichtsmaßnahmen im Zusammenhang mit der Verwendung von Isotretinoin verstanden hat. Nehmen Sie es zu ihren Akten. Es dient zu Ihrer Absicherung. Die Therapie mit Isotretinoin darf erst begonnen werden, wenn die Patientin vier Wochen konsequent (mit einer, vorzugsweise zwei sich ergänzenden Methoden) verhütet hat und wenn zwei ärztlich überwachte, im Abstand von vier Wochen durchgeführte Schwangerschaftstests mit einer Mindestempfindlichkeit von 25 miu/ml negativ ausfielen. Während der Wenn alle Voraussetzungen erfüllt sind, können Sie das Arzneimittel nun an Patientinnen und Patienten verordnen. Die Verordnung an Frauen im gebärfähigen Alter muß innerhalb von 3 Tagen nach dem letzten Schwangerschaftstest erfolgen.sie muss auf jeweils 30 Tage beschränkt werden. Im Idealfall sollten Schwangerschaftstest, die Ausstellung des Rezeptes und die Abgabe von Isotretinoin am selben Tag erfolgen. Die Abgabe durch den Apotheker an Frauen im gebärfähigen Alter muss innerhalb von 7 Tagen nach dem Verordnungsdatum erfolgt sein. Weisen Sie die Patientin darauf hin, dass sie das Rezept innerhalb vom 7 Tagen einlösen muß. Weitere Schwangerschaftstests: Führen Sie bei Patientinnen monatlich weitere ärztlich überwachte Schwangerschaftstests mit einer Mindestempfindlichkeit von 25 miu/ml am Tag der Verordnung oder innerhalb von drei Tagen davor durch. Weisen Sie erneut auf das teratogene Risiko des Arzneimittels hin und beantworten Sie weitere Fragen zur Schwangerschaftsverhütung. Stellen Sie bei Vorliegen aller Voraussetzungen ein weiteres Rezept (Abgabebeschränkungen s.o.) aus. 4
5 Hinweis: Tritt trotz aller Vorsichtsmaßnahmen während der oder im darauf folgenden Monat eine Schwangerschaft ein, muss die sofort abgebrochen werden. Die Patientin sollte mit einem Arzt mit Erfahrung in Teratologie besprechen, ob es ratsam ist, die Schwangerschaft fortzusetzen. Melden Sie eingetretene Schwangerschaften unter Isotretinoin bitte sofort sowohl den zuständigen Behörden als auch dem pharmazeutischen Unternehmer. Bei sende Weisen Sie nochmals darauf hin, dass weibliche Patienten ihre wirksame Verhütung noch 1 Monat fortsetzen müssen, dass Patientinnen und Patienten bis 1 Monat nach sende kein Blut spenden dürfen und dass sie unbenutzte Tabletten an keine andere Person weitergeben dürfen, sondern an die Apotheke zurückgeben müssen. Abschließender Schwangerschaftstest: Bestellen Sie ihre Patientin für einen abschließenden Schwangerschaftstest fünf Wochen nach Ende der erneut ein. Weisen Sie die Patientin darauf hin, dass sie mit der Durchführung des abschließenden Schwangerschaftstests ihre Zuverlässigkeit unter Beweis stellt, die für eine möglicherweise notwendige erneute mit Isotretinoin erforderlich ist. Schwangerschaftstests Für alle Schwangerschaftstests ist eine Mindestempfindlichkeit von 25mIU/ml vorgeschrieben. Sie sind unter ärztlicher Überwachung durchzuführen. Das und Ergebnis soll in die nachfolgende Tabelle eingetragen werden. Die ärztlich überwachten Schwangerschaftstests sind mit mit einer Mindestempfindlichkeit von 25 miu/ml durchzuführen. Vor sbeginn: Vor Beginn der Empfängnisverhütung ist ein erster Schwangerschaftstest durchzuführen, um eine bestehende Schwangerschaft auszuschließen. Wenn die Patientin keinen regelmäßigen Zyklus hat, sollte dieser erste Schwangerschaftstest ca. 3 Wochen nach dem letzten ungeschützten Geschlechtsverkehr durchgeführt werden. Der zweite Schwangerschaftstest muss nach mindestens vier Wochen wirksamer Verhütung (mit den sich ergänzenden Methoden) und vor Beginn der und zwar innerhalb von maximal 3 Tagen vor dem Verschreibungstermin durchgeführt werden. Während der : Kontrolluntersuchungen müssen in Intervallen von 1 Monat festgesetzt werden. Bei den Kontrolluntersuchungen muss bei dem Untersuchungstermin zur Verschreibung (oder in den 3 Tagen vor dem Besuch beim verschreibenden Arzt) jedesmal ein Schwangerschaftstest durchgeführt werden. Dies gilt in der Regel auch bei jugendlichen Patientinnen (siehe dazu den Leitfaden für Ärzte und Apotheker ) Nach dem Ende der Die Empfängnisverhütung muss während mindestens 1 Monat nach Beendigung der mit Isotretinoin fortgesetzt werden. Fünf Wochen nach dem Ende der müssen die Frauen einen abschliessenden Schwangerschaftstest durchführen, um eine Schwangerschaft auszuschliessen. 5
6 Dokumentation der Schwangerschaftstests Für alle Schwangerschaftstests ist eine Mindestempfindlichkeit von 25mIU/ml vorgeschrieben. Sie sind unter ärztlicher Überwachung durchzuführen. Das und Ergebnis soll in die nachfolgende Tabelle eingetragen werden. 1.Test vor 2. Test vor Abschlußtest nach Behandsende der letzten Menstruationsperiode des Schwangerschafts tests Ergebnis des Schwangerschafts -tests Handzeichen 6
7 Arzterklärung Die Patientin (Name, Vorname), geb. am, erschien am in meiner Praxis. Die Patientin leidet an der schweren Form der (Diagnose eintragen); diese sprach auf die bisherigen Therapien, namentlich nicht an. Als ultima ratio wurde daher eine Therapie mit Isotretinoin mit der Patientin erörtert; der Patientin waren vor dem hier dokumentierten stermin die nachfolgenden Broschüren durch mich ausgehändigt worden: Isotretinoin-Was Sie wissen müssen Informationsbroschüre für Patientinnen und Patienten Empfängnisverhütung Was Sie wissen müssen Wichtige Informationen für Patientinnen, denen Isotretinoin verschrieben werden soll, und deren Partner Im heutigen Termin wurde die Patientin aufgrund der äußerst fruchtschädigenden Wirkung des Isotretinoin im Nachgang zu den zugrundeliegenden Broschüren von mir über die erforderlichen Maßnahmen bei einer solchen umfassend aufgeklärt. Insbesondere habe ich das Risiko einer mit Isotretinoin vor dem Hintergrund einer Schwangerschaft verständlich dargelegt. Es bestand die Möglichkeit eines offenen Gesprächs mit Fragen seitens der Patientin. Die Patientin hat das Risiko nach meiner Einschätzung vollumfänglich nicht ausreichend verstanden und es konnten (konnten noch nicht) alle offenen Fragen geklärt werden. Ich habe die Patientin auf das Erfordernis einer sorgfältigen Verhütung aufgrund des teratogenen Risikos von Isotretinoin aufmerksam gemacht und sie daher an einen Gynäkologen überwiesen. Dieser wird sie hinsichtlich der Möglichkeiten einer optimalen Empfängnisverhütung aufklären und die für die Patientin bestmögliche Methoden auswählen. Vorbehaltlich dieser fachärztlichen Beratung durch den Gynäkologen beurteile ich das Verantwortungsgefühl und die -bereitschaft der Patientin hinsichtlich der sorgfältigen Einhaltung erforderlicher Verhütungsmaßnahmen, die im Einzelnen mit dem Gynäkologen durchgesprochen werden, als verantwortungsbewusst / nicht hinreichend verantwortungsbewusst Die Patientin hat das Ziel der verstanden, sie ist über die Risiken aufgeklärt und hat auf Befragen ausdrücklich erklärt, die mit Isotretinoin durchführen zu wollen. Im Ergebnis befürworte ich eine entsprechende / lehne sie aus obigen Erwägungen heraus ab. Unterschrift 7
8 Dokumentation über den Besuch beim Gynäkologen (bitte der Patientin mitgeben) Mir sind die teratogen Eigenschaften von Isotretinoin-haltigen Arzneimitteln bekannt und ich kenne die Grundzüge des Schwangerschaftsverhütungsprogramms, das Voraussetzung für die Verordnung von Isotretinoin an weibliche Patienten ist. Die Patientin (Vor- Zuname in Druckbuchstaben, Geburtsdatum) ist am ( des Praxisbesuchs) von mir über für sie in Frage kommende, zwei sich ergänzende, Möglichkeiten zur sicheren Schwangerschaftsverhütung unter Isotretinoin beraten worden. Ich habe den Eindruck, / Ich habe nicht ich den Eindruck*, dass die Patientin die verschiedenen Verhütungsmethoden hinsichtlich der Risiken und Versagungsquoten, verstanden hat und dass alle offenen Fragen geklärt werden konnten. Ich habe folgende Methoden zur Schwangerschaftsverhütung verordnet/ angeraten: Methode der ersten Wahl: Methode der zweiten Wahl: des letzten negativen Schwangerschaftstests: Beginn der Verhütung (): Ich habe den Eindruck, / Ich habe nicht ich den Eindruck*, dass die Patientin diese Verhütungsmethoden vor, während und einschließlich 1 Monat nach der mit Isotretinoin verantwortungsbewußt anwenden wird (Unterschrift der Gynäkologin/ des Gynäkologen) (Ort, ) (Praxisstempel) DIESES FORMULAR AUSGEFÜLLT UND VERSCHLOSSEN BITTE AN DEN VERSCHREIBENDEN ARZT WEITERLEITEN * Weitere Bemerkungen bitte auf der Rückseite des Formulars vornehmen. 8
9 BESTÄTIGUNGSFORMULAR FÜR MÄNNLICHE PATIENTEN Name des Patienten (Blockbuchstaben) Mit Ihrer Unterschrift unter diese Bestätigung erklären Sie, dass Sie die unten aufgelisteten Punkte gelesen und verstanden haben und dass Sie die Risiken und notwendigen Vorsichtsmaßnahmen, die mit der Einnahme von Isotretinoin verbunden sind, akzeptieren. Bitte lesen Sie die Punkte 1 bis 3 sorgfältig durch und unterschreiben Sie diese Bestätigung nur dann, wenn Sie alle verstanden haben. Wenn ein Elternteil oder Vormund diese Bestätigung unterschreiben muss, so muss auch dieser den Text gelesen und verstanden haben, bevor er oder sie eine Unterschrift leistet. Unterschreiben Sie diese Vereinbarung nicht und nehmen Sie kein Isotretinoin ein, wenn Sie eine der Informationen über die mit Isotretinoin nicht verstanden haben. (1) Ich weiß, dass ich während der Einnahme von Isotretinoin und einen Monat danach kein Blut spenden darf, um schwangere Frauen und deren ungeborene Kinder, die dieses Blut erhalten könnten, nicht zu gefährden. Ich weiß dies und werde mich daran halten. Insbesondere ist mir bewußt, dass ich im Falle einer Zuwiderhandlung mit strafrechtlichen Konsequenzen (Körperverletzung; versuchter oder vollendeter Totschlag am Ungeborenen) und einer zivilrechtlichen Haftung zu rechnen habe. (2) Aufgrund des mir bekannten Gefahrenpotentials von Isotretinoin werde ich das mir verschriebene Arzneimittel keiner anderen Person zur Verfügung stellen, unabhängig davon, ob sie das gleiche Krankheitsbild hat wie ich und ob es sich um Familienangehörige handelt. (3) Ich verpflichte mich, nach Therapieende unbenutzte Tabletten umgehend in die Apotheke zur Entsorgung zurückzubringen. Der verschreibende Arzt hat mich umfassend aufgeklärt und alle meine Fragen zu Isotretinoin beantwortet und ich akzeptiere die Risiken und die damit verbundenen Vorsichtsmaßnahmen, die mir eingehend erklärt wurden. Mit meiner Unterschrift erkläre ich, dass ich die in den Punkten 1 bis 3 aufgeführten Hinweise verstanden habe und befolgen werde. Unterschrift Patient Unterschrift Eltern/gesetzlicher Vertreter (wenn erforderlich) 9
10 BESTÄTIGUNGSFORMULAR FÜR WEIBLICHE PATIENTEN Name der Patientin (Blockbuchstaben) Mit Ihrer Unterschrift unter diese Bestätigung erklären Sie, dass Sie die unten aufgelisteten Punkte gelesen und verstanden haben und dass Sie die Risiken und notwendigen Vorsichtsmaßnahmen, die mit der Einnahme von Isotretinoin verbunden sind, akzeptieren. Bitte lesen Sie alle Punkte sorgfältig durch und unterschreiben Sie diese Bestätigung nur dann, wenn Sie alle verstanden haben und damit einverstanden sind, die ärztlichen Anweisungen zu befolgen. Wenn ein Elternteil oder Vormund diese Bestätigung unterschreiben muss, so muss auch dieser jeden Punkt gelesen und verstanden haben, bevor er oder sie eine Unterschrift leistet. Unterschreiben Sie diese Vereinbarung nicht und nehmen Sie kein Isotretinoin ein, wenn Sie eine der Informationen über die mit Isotretinoin nicht verstanden haben. Ich wurde darüber aufgeklärt und informiert, dass während der Einnahme von Isotretinoin ein extrem hohes Risiko für schwere Missbildungen bei meinem ungeborenen Kind besteht, wenn ich schwanger bin oder während der Einnahme schwanger werde. Ich habe dies verstanden und weiß, dass ich deshalb während der mit Isotretinoin auf keinen Fall schwanger werden darf. Aufgrund des extrem hohen Risikos für schwere Mißbildungen bei ungeborenen Kindern ist mir bewußt, dass ich kein Isotretinoin nehmen darf, wenn ich schwanger bin. Ich weiß, dass ich auch im ersten Monat nach Ende der mit Isotretinoin auf keinen Fall schwanger werden darf. Im Rahmen der umfassenden Aufklärung durch meinen Arzt ist mit mir erörtert und dargelegt worden, dass ich mindestens eine, vorzugsweise zwei sichere Verhütungsmethoden einen Monat vor, während und einen Monat nach dem Ende der anwenden muss. Eine der Verhütungsmethoden muss eine Methode der 1. Wahl sein (Einzelheiten zu den unter Isotretinoin geeigneten Empfängnisverhütungsmethoden finden Sie in der Broschüre Empfängnisverhütung Was Sie wissen müssen, die Ihnen Ihr Arzt ebenfalls gibt und die zu dem vorgeschriebenen Empfängnisverhütungsprogramm gehört). Ich habe dies verstanden und bin gewillt, diese Verhütungsmaßnahmen in dem erforderlichen Umfang und für diesen Zeitraum in verantwortungsbewußter Weise durchzuführen. Ich weiß, dass auch die sicherste Verhütungsmethode versagen kann und dass ich das Schwangerschaftsrisiko durch die gleichzeitige Anwendung von zwei Methoden verringern kann. Ich werde meinen Arzt immer und in jedem Fall darüber informieren, welche Medikamente, auch solche pflanzlicher Art, ich während der mit Isotretinoin nehmen möchte, da hormonelle Verhütungsmittel (beispielsweise die Anti-Baby-Pille) möglicherweise nicht wirken, wenn ich bestimmte Medikamente oder pflanzliche Heilmittel einnehme. Mir ist im Rahmen der Aufklärung mitgeteilt worden, dass ich kein Rezept für Isotretinoin erhalte, wenn ich nicht zwei ärztlich überwachte negative Schwangerschaftstests vor Beginn der mit Isotretinoin vorweisen kann. Ich weiß, dass ich während der Einnahme von Isotretinoin und einen Monat danach kein Blut spenden darf, um schwangere Frauen und deren ungeborene Kinder, die dieses Blut erhalten könnten, nicht zu gefährden. Ich weiß dies und werde mich daran halten. Insbesondere ist mir bewußt, dass ich im Falle einer Zuwiderhandlung mit strafrechtlichen Konsequenzen (Körperverletzung; versuchter oder vollendeter Totschlag am Ungeborenen) und einer zivilrechtlichen Haftung zu rechnen habe. Mir ist im Rahmen der Aufklärung mitgeteilt worden, dass ich monatliche Schwangerschaftstests während der Einnahme von Isotretinoin durchführen lassen muss, um die Therapie mit Isotretinoin fortsetzen zu können. Wenn ich diese nicht durchführen lasse, hat das dies zur Folge, dass die Therapie abgebrochen wird. Ich weiß, dass ich einen Monat nach Therapie-Ende oder Therapie-Abbruch auf keinen Fall schwanger werden darf. Ich verpflichte mich, in jedem Fall (auch im Falle eines Therapieabbruchs) 5 Wochen nach Beendigung der Isotretinoin-Einnahme eine Abschlußuntersuchung mit Schwangerschaftstest durchführen zu lassen. Ich bin darüber aufgeklärt worden und mir ist daher bewußt, dass diese Abschlußuntersuchung einschließlich des Schwangerschaftstests Voraussetzung dafür ist, dass ich für eine evt. notwendige Anschlußtherapie in Frage komme. Ich habe die mir vom Arzt übergebenen Unterlagen, namentlich Isotretinoin- Was Sie wissen müssen und Empfängnisverhütung wichtige Informationen für Patientinnen, denen Isotretinoin verschrieben werden soll, und deren Partner durchgelesen und den Inhalt zur Kenntnis genommen. Ich habe die Inhalte verstanden und mir wurde die Möglichkeit gegeben, alle offenen Fragen mit meinem Arzt 10
11 durchzusprechen. Ich bin nun allumfassend über die Möglichkeiten einer sorgfältigen Empfängnisverhütung aufgeklärt. Ich weiß, dass ich die Einnahme von Isotretinoin sofort abbrechen und meinen Arzt informieren muss, wenn die Möglichkeit einer Schwangerschaft mit Sicherheit nicht ausgeschlossen werden kann. Insbesondere, wenn ich ungeschützten Geschlechtsverkehr hatte, entgegen meiner hier erteilten Zusage nicht mehr verhüte, muss ich dies mitteilen. Aber auch im Falle einer sorgfältigen Empfängnisverhütung werde ich bei Anzeichen einer Schwangerschaft, wie beispielsweise dem Ausbleiben meiner Periode, dies mitteilen. Ich weiß, dass mich mein Arzt, wenn ich schwanger werde, zur Bewertung des Falles und zur Beratung an einen Facharzt überweisen kann. Aufgrund des mir bekannten Gefahrenpotentials von Isotretinoin werde ich das mir verschriebene Arzneimittel keiner anderen Person zur Verfügung stellen, unabhängig davon, ob sie das gleiche Krankheitsbild hat wie ich und ob es sich um Familienangehörige handelt. Ich verpflichte mich, unbenutzte Tabletten nach Therapieende unverzüglich in die Apotheke zur Entsorgung zurückzubringen. Ich werde meinen Arzt sofort verständigen, wenn eine der in der Packungsbeilage oder Patienteninformationsbroschüre genannte schwerwiegende Nebenwirkung bei mir auftritt. Mein behandelnder Arzt, hat mich umfassend zu Isotretinoin und dessen Gefahrenpotential, insbesondere zur fruchtschädigenden Wirkung des Isotretionoin auf das ungeborene Kind, aufgeklärt und mit mir die Maßnahmen zur Verhinderung dieser Risiken nach dem Schwangerschaftsverhütungsprogramm erörtert. Dies tat er zunächst durch Zur-Verfügung-Stellen der Broschüren: ( Isotretinoin- Was Sie wissen müssen und Empfängnisverhütung wichtige Informationen für Patientinnen, denen Isotretinoin verschrieben werden soll und deren Partner ). Nachdem ich zu Hause die Möglichkeit hatte, diese Broschüren zur Kenntnis zu nehmen, habe ich in dem anschließendem Aufklärungsgespräch die Möglichkeit gehabt, alle offenen Fragen zu klären. Mir ist nun insbesondere das Risiko, das mit einer Schwangerschaft verbunden wäre, und die Notwendigkeit der Schwangerschaftsverhütung klar, und ich werde alle Maßnahmen, die dazu erforderlich sind, ergreifen. Auch nach Abwägung der gesamten Risiken möchte ich eine Isotretinoin- durchführen. Unterschrift Patientin Unterschrift Eltern/gesetzlicher Vertreter (wenn erforderlich) Unterschrift des Arztes (Arztstempel) 11
Dokumentationsbroschüre mit Checkliste für die Verordnung von Acitretin-haltigen Arzneimitteln
 für den Arzt: Dokumentationsbroschüre mit Checkliste für die Verordnung von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des
für den Arzt: Dokumentationsbroschüre mit Checkliste für die Verordnung von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des
Dokumentation Broschüre mit Checkliste für die Verordnung von Neotigason Patientin/Patient Teil des Schwangerschafts- verhütungsprogramms
 Dokumentation Broschüre mit Checkliste für die Verordnung von Neotigason für den Arzt Patientin/Patient Teil des Schwangerschaftsverhütungsprogramms Acitretin ist sehr teratogen. Selbst während der Einnahme
Dokumentation Broschüre mit Checkliste für die Verordnung von Neotigason für den Arzt Patientin/Patient Teil des Schwangerschaftsverhütungsprogramms Acitretin ist sehr teratogen. Selbst während der Einnahme
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von. Isoderm. Wirkstoff: Isotretinoin. Teil des Schwangerschaftsverhütungsprogramms
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isoderm Wirkstoff: Isotretinoin Teil des Schwangerschaftsverhütungsprogramms Stand: August 2004 Anweisungen für den Arzt zur Verordnung von
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isoderm Wirkstoff: Isotretinoin Teil des Schwangerschaftsverhütungsprogramms Stand: August 2004 Anweisungen für den Arzt zur Verordnung von
Leitfaden für Ärzte und Apotheker. zur Verordnung und Abgabe von Isotretinoin. - Teil des Schwangerschaftsverhütungsprogramms
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms Anweisungen für den Arzt zur Verordnung von Isotretinoin Bitte lesen Sie diesen
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Isotretinoin - Teil des Schwangerschaftsverhütungsprogramms Anweisungen für den Arzt zur Verordnung von Isotretinoin Bitte lesen Sie diesen
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen
 Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Leitfaden für Ärzte und Apotheker
 SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Toctino (Alitretinoin) behördlich genehmigtes Schulungsmaterial 2 3 Dieses Informationsmaterial zur Anwendung
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von. Acicutan. - Teil des Schwangerschaftsverhütungsprogramms
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acicutan - Teil des Schwangerschaftsverhütungsprogramms - Stand: Mai 2012 Anweisungen für den Arzt zur Verordnung von Acitretin Bitte lesen
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acicutan - Teil des Schwangerschaftsverhütungsprogramms - Stand: Mai 2012 Anweisungen für den Arzt zur Verordnung von Acitretin Bitte lesen
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln
 Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des Schwangerschaftsverhütungsprogramms
Leitfaden für Ärzte und Apotheker zur Verordnung und Abgabe von Acitretin-haltigen Arzneimitteln Teil des Schwangerschaftsverhütungsprogramms Diese Informationsbroschüre als Bestandteil des Schwangerschaftsverhütungsprogramms
Toctino Bestätigungsformular für Patienten
 Cutterguide: N/A Printing Process: Offset GD: SD428639 Size: A5: 148 X 210 mm Pages: 12 Colors: C M Y K (4 Color) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller XI Datum Name des Patienten
Cutterguide: N/A Printing Process: Offset GD: SD428639 Size: A5: 148 X 210 mm Pages: 12 Colors: C M Y K (4 Color) Native File: Indesign CS5 Windows Generated in: Acrobat Distiller XI Datum Name des Patienten
Isoderm. Dokumentationsbroschüre für den Arzt. nur für Frauen. Dermapharm Umweltschutz
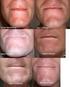 Isoderm Dermapharm Umweltschutz Hauterkrankungen und Umwelt stehen in einem engen Zusammenhang. Gerade in der heutigen Zeit wird dies immer mehr erkennbar. Dermapharm sieht es als ihre Verpflichtung an,
Isoderm Dermapharm Umweltschutz Hauterkrankungen und Umwelt stehen in einem engen Zusammenhang. Gerade in der heutigen Zeit wird dies immer mehr erkennbar. Dermapharm sieht es als ihre Verpflichtung an,
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm
 Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
- Teil des Schwangerschaftsverhütungsprogramms -
 für den Arzt: Acicutan Dokumentationsbroschüre mit Checkliste für die Verordnung von Acicutan - Teil des Schwangerschaftsverhütungsprogramms - Patientin / Patient: Acitretin ist sehr teratogen. Selbst
für den Arzt: Acicutan Dokumentationsbroschüre mit Checkliste für die Verordnung von Acicutan - Teil des Schwangerschaftsverhütungsprogramms - Patientin / Patient: Acitretin ist sehr teratogen. Selbst
Checkliste für die Verordnung von Tocino
 Wirkstoff: Alitretinoin. Indikation: Zur Behandlung von Erwachsenen mit therapierefraktärem, schwerem chronischem Handekzem, die eine ausgebaute lokale Behandlung für mindestens 4 Wochen erhalten und nicht
Wirkstoff: Alitretinoin. Indikation: Zur Behandlung von Erwachsenen mit therapierefraktärem, schwerem chronischem Handekzem, die eine ausgebaute lokale Behandlung für mindestens 4 Wochen erhalten und nicht
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale
MEDIKAMENTE, DIE MYCOPHENOLAT ENTHALTEN Informationsbroschüre für Patienten. Informationen über die Risiken für den Fötus
 Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Toctino Bestätigungsformular für Patienten
 * Toctino wird zur Behandlung von Patientinnen/Patienten unter 18 Jahren nicht empfohlen. Datum Unterschrift des Patienten Geburtsdatum Name des Patienten (Druckschrift) Mein behandelnder Dermatologe hat
* Toctino wird zur Behandlung von Patientinnen/Patienten unter 18 Jahren nicht empfohlen. Datum Unterschrift des Patienten Geburtsdatum Name des Patienten (Druckschrift) Mein behandelnder Dermatologe hat
Checkliste für die Verordnung von Toctino
 SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Checkliste für die Verordnung von Toctino für die ärztliche Dokumentation Name der Patientin Alitretinoin Bestätigungsformular für behandelnde Ärzte Die Patientin kam
SCHWANGERSCHAFTSVERHÜTUNGSPROGRAMM Checkliste für die Verordnung von Toctino für die ärztliche Dokumentation Name der Patientin Alitretinoin Bestätigungsformular für behandelnde Ärzte Die Patientin kam
Informationsbroschüre für Patienten Was Sie wissen müssen
 Europa hat Bedingungen für die Markteinführung des Arzneimittels VOLIBRIS gestellt (europaweit eingetragen). Dieser in Belgien und Luxemburg obligatorische Risikomanagementplan, zu dem dieses Informationsschreiben
Europa hat Bedingungen für die Markteinführung des Arzneimittels VOLIBRIS gestellt (europaweit eingetragen). Dieser in Belgien und Luxemburg obligatorische Risikomanagementplan, zu dem dieses Informationsschreiben
Mitteilung des Bundesamts für Sicherheit im Gesundheitswesen über Maßnahmen zur Gewährleistung der Arzneimittelsicherheit:
 Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP)
 INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP) Wichtige Informationen zu Truvada (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko einer Infektion mit dem
INFORMATIONSBROSCHÜRE FÜR PERSONEN MIT TRUVADA ZUR PRÄ-EXPOSITIONS-PROPHYLAXE (PrEP) Wichtige Informationen zu Truvada (Emtricitabin/ Tenofovirdisoproxilfumarat), um das Risiko einer Infektion mit dem
Die Pille danach. Sandoz Pharmaceuticals AG Hinterbergstrasse Cham 2 Tel Fax a Novartis company
 Sandoz Pharmaceuticals AG Hinterbergstrasse 24 6330 Cham 2 Tel. 041 748 85 85 Fax 041 748 85 86 www.generika.ch Die Pille danach. a Novartis company 90681/November 2007 Was ist eine Notfallverhütung oder
Sandoz Pharmaceuticals AG Hinterbergstrasse 24 6330 Cham 2 Tel. 041 748 85 85 Fax 041 748 85 86 www.generika.ch Die Pille danach. a Novartis company 90681/November 2007 Was ist eine Notfallverhütung oder
Ihre Verantwortung: Verhinderung von Missbildungen Wichtige Informationen für weibliche Patienten und ihre Partner
 Über diese Broschüre Was Sie wissen müssen: Missbildungen Wieso wurde mir Isotretinoin-ratiopharm verschrieben? Über Akne Ihre Verantwortung: Verhinderung von Missbildungen Wichtige Informationen für weibliche
Über diese Broschüre Was Sie wissen müssen: Missbildungen Wieso wurde mir Isotretinoin-ratiopharm verschrieben? Über Akne Ihre Verantwortung: Verhinderung von Missbildungen Wichtige Informationen für weibliche
Anwendungsrichtlinien für Ärztinnen und Ärzte
 CURAKNE Isotretinoin Anwendungsrichtlinien für Ärztinnen und Ärzte Dieses Arzneimittel ist teratogen, daher ist während der Behandlung eine zuverlässige Schwangerschaftsverhütung zwingend erforderlich.
CURAKNE Isotretinoin Anwendungsrichtlinien für Ärztinnen und Ärzte Dieses Arzneimittel ist teratogen, daher ist während der Behandlung eine zuverlässige Schwangerschaftsverhütung zwingend erforderlich.
Broschüre zur Aufklärung von Patienten
 Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
Patienteninformation Lamotrigin Desitin 04/2007
 Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
MUSTERTEXT. empfohlen vom Arbeitskreis Medizinischer Ethik-Kommissionen gemäß Beschluss vom *
 MUSTERTEXT für die Information und Einwilligung von Kindern im Alter von etwa 7-11 Jahren, die an einer klinischen Prüfung eines Arzneimittels teilnehmen empfohlen vom Arbeitskreis Medizinischer Ethik-Kommissionen
MUSTERTEXT für die Information und Einwilligung von Kindern im Alter von etwa 7-11 Jahren, die an einer klinischen Prüfung eines Arzneimittels teilnehmen empfohlen vom Arbeitskreis Medizinischer Ethik-Kommissionen
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Anwendungsrichtlinien und Therapieleitfaden für Ärztinnen/Ärzte und Apothekerinnen/Apotheker
 TOCTINO. W: Alitretinoin. I: Zur Erwachsenen mit therapierefraktärem, schwerem, chronischem Handekzem, die auf eine ausgebaute lokale (einschliesslich Vermeidung Kontakten mit auslösender Noxe, TOCTINO.
TOCTINO. W: Alitretinoin. I: Zur Erwachsenen mit therapierefraktärem, schwerem, chronischem Handekzem, die auf eine ausgebaute lokale (einschliesslich Vermeidung Kontakten mit auslösender Noxe, TOCTINO.
Empfängnisverhütung. Ratgeber für Patientinnen und Patienten. CURAKNE Isotretinoin. Methoden, Sicherheit und Anwendungstipps. Isotretinoin CURAKNE
 Dieses Arzneimittel ist teratogen. Während der Behandlung ist eine wirksame Schwangerschaftsverhütung zwingend. Ratgeber für Patientinnen und Patienten Isotretinoin CURAKNE CURAKNE Isotretinoin Empfängnisverhütung
Dieses Arzneimittel ist teratogen. Während der Behandlung ist eine wirksame Schwangerschaftsverhütung zwingend. Ratgeber für Patientinnen und Patienten Isotretinoin CURAKNE CURAKNE Isotretinoin Empfängnisverhütung
Patienteninformation von DR. MED. PETER BERNHARD DR. MED. BIRGIT KIRSCHEY
 Patienteninformation von DR. MED. PETER BERNHARD DR. MED. BIRGIT KIRSCHEY Fachärzte für Frauenheilkunde und Geburtshilfe Schwerpunkt: Pränatale Diagnostik DEGUM II ERgänzende Informationen zum Ersttrimester-Screening
Patienteninformation von DR. MED. PETER BERNHARD DR. MED. BIRGIT KIRSCHEY Fachärzte für Frauenheilkunde und Geburtshilfe Schwerpunkt: Pränatale Diagnostik DEGUM II ERgänzende Informationen zum Ersttrimester-Screening
Bekanntmachung. zu lenalidomid- und thalidomidhaltigen Arzneimitteln. vom 8. Dezember 2008
 Bekanntmachung zu lenalidomid- und thalidomidhaltigen Arzneimitteln vom 8. Dezember 2008 Die nachfolgenden Anforderungen gelten mit Datum vom 08.02.2009. Thalidomide Pharmion 50 mg Hartkapseln in Kombination
Bekanntmachung zu lenalidomid- und thalidomidhaltigen Arzneimitteln vom 8. Dezember 2008 Die nachfolgenden Anforderungen gelten mit Datum vom 08.02.2009. Thalidomide Pharmion 50 mg Hartkapseln in Kombination
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DOLPRONE 500 MG TABLETTE. Paracetamol
 Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DOLPRONE 500 MG TABLETTE Paracetamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für
Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DOLPRONE 500 MG TABLETTE Paracetamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für
Wortlaut der für die Packungsbeilage vorgesehenen Angaben
 Seite 1 von 5 Wortlaut der Gebrauchsinformation mit Änderungen durch Auflagen des Zulassungsbescheids vom 14.12.2005 Legende zu den Änderungen und Korrekturen Xxxx wörtlicher Auflagentext Xxxx ergänzte
Seite 1 von 5 Wortlaut der Gebrauchsinformation mit Änderungen durch Auflagen des Zulassungsbescheids vom 14.12.2005 Legende zu den Änderungen und Korrekturen Xxxx wörtlicher Auflagentext Xxxx ergänzte
Therapiepass Thalidomide Celgene TM
 Hinweis: Dieser Therapiepass gilt allein für die Verordnung und Anwendung der darin aufgeführten Originalprodukte von Celgene und darf nur dafür verwendet werden. Insbesondere unsere Empfehlungen zu Anwendungsgebieten,
Hinweis: Dieser Therapiepass gilt allein für die Verordnung und Anwendung der darin aufgeführten Originalprodukte von Celgene und darf nur dafür verwendet werden. Insbesondere unsere Empfehlungen zu Anwendungsgebieten,
Freiwilliger Schwangerschaftsabbruch. Informationen und Beratung
 Freiwilliger Schwangerschaftsabbruch Informationen und Beratung Direction de la santé et des affaires sociales DSAS Direktion für Gesundheit und Soziales GSD Wann ist ein Schwangerschaftsabbruch erlaubt?
Freiwilliger Schwangerschaftsabbruch Informationen und Beratung Direction de la santé et des affaires sociales DSAS Direktion für Gesundheit und Soziales GSD Wann ist ein Schwangerschaftsabbruch erlaubt?
Einleitung und Leseanweisung
 VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
FORMULAR FÜR DEN START DER BEHANDLUNG MIT TYSABRI
 Die europäischen Gesundheitsbehörden haben für die Markteinführung von TYSABRI Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information gehört - ist
Die europäischen Gesundheitsbehörden haben für die Markteinführung von TYSABRI Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information gehört - ist
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
ReCap DEINEN ARZTBESUCH AUF EINEN BLICK
 ReCap DEINEN ARZTBESUCH AUF EINEN BLICK ehealth Schweiz [Video] Was haben wir gerade gesehen? Zusammenfassung Fachinfos Rezept Termine Fachinfos Fachinfos Die Pille Durch die Pille wird der Eisprung
ReCap DEINEN ARZTBESUCH AUF EINEN BLICK ehealth Schweiz [Video] Was haben wir gerade gesehen? Zusammenfassung Fachinfos Rezept Termine Fachinfos Fachinfos Die Pille Durch die Pille wird der Eisprung
Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage
 Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage 1 B. Packungsbeilage 1. Was ist und wofür wird es angewendet? [Dieser Abschnitt soll wie folgt gefasst werden:]
Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage 1 B. Packungsbeilage 1. Was ist und wofür wird es angewendet? [Dieser Abschnitt soll wie folgt gefasst werden:]
Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre
 Gebrauchsinformation: Information für den Anwender Aspecton Eukaps 200 mg Weichkapseln Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre Wirkstoff: Eucalyptusöl Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für den Anwender Aspecton Eukaps 200 mg Weichkapseln Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre Wirkstoff: Eucalyptusöl Lesen Sie die gesamte Packungsbeilage
Name: Größe: cm Vorname: Gewicht: kg. Adresse: Letzte Krebsvorsorgeuntersuchung: Letzte Blutung / Periode: Telefonnummer: Handy:
 Anamnesebogen Liebe Patientin, um einen möglichst reibungslosen Behandlungsablauf zu gewährleisten bitten wir Sie, die folgenden Fragen bereits vor dem Gespräch mit Ihrer Ärztin nach bestem Wissen zu beantworten.
Anamnesebogen Liebe Patientin, um einen möglichst reibungslosen Behandlungsablauf zu gewährleisten bitten wir Sie, die folgenden Fragen bereits vor dem Gespräch mit Ihrer Ärztin nach bestem Wissen zu beantworten.
Sanvita Meno Tabletten
 Gebrauchsinformation: Information für Anwender Sanvita Meno Tabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifuga rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Sanvita Meno Tabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifuga rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
So vermeiden Sie Wechselwirkungen. Der Sanitas Medikamentencheck
 So vermeiden Sie Wechselwirkungen Der Sanitas Medikamentencheck Steigende Lebenserwartung, steigende Medikamenteneinnahme Männer leben hierzulande durchschnittlich 80 Jahre, Frauen sogar 85 Jahre. Damit
So vermeiden Sie Wechselwirkungen Der Sanitas Medikamentencheck Steigende Lebenserwartung, steigende Medikamenteneinnahme Männer leben hierzulande durchschnittlich 80 Jahre, Frauen sogar 85 Jahre. Damit
zur Verfügung gestellt von Gebrauchs.info
 Liebe Patientin! Lieber Patient! Bitte lesen Sie die folgende Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Anwendung dieses Arzneimittels beachten sollen.
Liebe Patientin! Lieber Patient! Bitte lesen Sie die folgende Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Anwendung dieses Arzneimittels beachten sollen.
Patienteninformation
 I Patientenaufklärung und Einverständniserklärung Liebe Patientin, lieber Patient! Sie leiden unter einer Erkrankung des rheumatischen Formenkreises. Dazu zählen sowohl entzündliche (Arthritis) als auch
I Patientenaufklärung und Einverständniserklärung Liebe Patientin, lieber Patient! Sie leiden unter einer Erkrankung des rheumatischen Formenkreises. Dazu zählen sowohl entzündliche (Arthritis) als auch
Wortlaut der für die Packungsbeilage vorgesehenen Angaben
 Zulassungsnummer: 6312395.00.00 Seite 1 von 5 Apothekenpflichtig TUSSISANA Mischung 20 und 50 ml Stoff Darreichungsform Menge Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation:
Zulassungsnummer: 6312395.00.00 Seite 1 von 5 Apothekenpflichtig TUSSISANA Mischung 20 und 50 ml Stoff Darreichungsform Menge Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation:
3 Beratung bei der Abgabe von OTC-Arzneimitteln... 40
 Inhaltsverzeichnis Vorwort V Teil A Anatomie und Physiologie der Haut 1 Anatomie und Physiologie der Haut 2 1.1 Aufbau der Haut 2 1.1.1 Die Subkutis (Unterhaut) 4 1.1.2 Die Dermis (Lederhaut) 5 1.1.3 Die
Inhaltsverzeichnis Vorwort V Teil A Anatomie und Physiologie der Haut 1 Anatomie und Physiologie der Haut 2 1.1 Aufbau der Haut 2 1.1.1 Die Subkutis (Unterhaut) 4 1.1.2 Die Dermis (Lederhaut) 5 1.1.3 Die
GEBRAUCHSINFORMATION 1/6. PROGESTOGEL 1%, gel Version Juni 2014 be-pl-de (Implementation PSUR #17445 var IB #180584)
 GEBRAUCHSINFORMATION 1/6 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION 1/6 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Patienten-/Patientinneninformation und Einwilligungserklärung zur Teilnahme an der Beobachtungsstudie
 Patienten-/Patientinneninformation und Einwilligungserklärung zur Teilnahme an der Beobachtungsstudie APRES: Angemessenheit der Antibiotika -Verschreibungen in der hausärztlichen Praxis in Europa im Hinblick
Patienten-/Patientinneninformation und Einwilligungserklärung zur Teilnahme an der Beobachtungsstudie APRES: Angemessenheit der Antibiotika -Verschreibungen in der hausärztlichen Praxis in Europa im Hinblick
Meine persönliche Checkliste
 Meine persönliche Checkliste Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung. Was Sie fragen sollten, was Sie wissen sollten Der Umgang mit
Meine persönliche Checkliste Leitfaden für Ihr Gespräch mit dem Arzt und praktische Informationen rund um die Erkrankung und ihre Behandlung. Was Sie fragen sollten, was Sie wissen sollten Der Umgang mit
Version 1.3, 04/2010 PACKUNGSBEILAGE
 Version 1.3, 04/2010 PACKUNGSBEILAGE GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PYRIDOXINE LABAZ 250 mg Tabletten Pyridoxinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn
Version 1.3, 04/2010 PACKUNGSBEILAGE GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PYRIDOXINE LABAZ 250 mg Tabletten Pyridoxinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Sandoz Pharmaceuticals AG
 Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Die Pille danach. Was ist eine Notfallverhütung oder die sogenannte «Pille danach»? 1 Wann wird NorLevo Uno eingenommen? 2 Bei der «Pille danach» handelt es sich um eine Notfallverhütung, die eine unerwünschte
Gebrauchsinformation: Information für Patienten. Essentiale forte-kapseln Wirkstoff: Phospholipide aus Sojabohnen
 Gebrauchsinformation: Information für Patienten Essentiale forte-kapseln Wirkstoff: Phospholipide aus Sojabohnen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten Essentiale forte-kapseln Wirkstoff: Phospholipide aus Sojabohnen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender ANGOCIN Anti-Infekt N Filmtabletten Wirkstoffe: Kapuzinerkressenkrautpulver und Meerrettichwurzelpulver Bitte lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für den Anwender ANGOCIN Anti-Infekt N Filmtabletten Wirkstoffe: Kapuzinerkressenkrautpulver und Meerrettichwurzelpulver Bitte lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Sidroga Johanniskrauttee Wirkstoff: Johanniskraut (Hypericum folium) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Sidroga Johanniskrauttee Wirkstoff: Johanniskraut (Hypericum folium) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
Gebrauchsinformation: Information für Patienten. Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt
 Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
Aknenormin Therapiebegleitheft. für die Patientin. Name:
 Aknenormin Therapiebegleitheft für die Patientin Name: Bestätigungsformular Name der Patientin: Ausfertigung für den Arzt Mit Ihrer Unterschrift unter diese Bestätigung erklären Sie, dass Sie die unten
Aknenormin Therapiebegleitheft für die Patientin Name: Bestätigungsformular Name der Patientin: Ausfertigung für den Arzt Mit Ihrer Unterschrift unter diese Bestätigung erklären Sie, dass Sie die unten
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Patientenverfügung. Vorsorge: Meine Patientenverfügung
 Patientenverfügung Vorsorge: Meine Patientenverfügung Meine PATIENTENVERFÜGUNG Diese Patientenverfügung wird gemäß Patientenverfügungs-Gesetz (BGBl. Nr. 55/2006) errichtet. Im Vollbesitz meiner geistigen
Patientenverfügung Vorsorge: Meine Patientenverfügung Meine PATIENTENVERFÜGUNG Diese Patientenverfügung wird gemäß Patientenverfügungs-Gesetz (BGBl. Nr. 55/2006) errichtet. Im Vollbesitz meiner geistigen
Wenn Sie sich nach 7 Tagen nicht besser oder gar schlechter fühlen, wenden Sie sich an Ihren
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Bronchoverde Hustenlöser 25 mg Granulat Granulat zur Herstellung einer Lösung zum Einnehmen Wirkstoff: Efeublätter-Trockenextrakt Pflanzliches Arzneimittel
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Bronchoverde Hustenlöser 25 mg Granulat Granulat zur Herstellung einer Lösung zum Einnehmen Wirkstoff: Efeublätter-Trockenextrakt Pflanzliches Arzneimittel
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Postinor 1500 Mikrogramm - Tablette Wirkstoff: Levonorgestrel
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Postinor 1500 Mikrogramm - Tablette Wirkstoff: Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Postinor 1500 Mikrogramm - Tablette Wirkstoff: Levonorgestrel Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
Wortlaut der für die Packungsbeilage vorgesehenen Angaben
 Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender Presselin FE Mischung Homöopathisches Arzneimittel Zur Anwendung bei Kindern über 12 Jahren
Wortlaut der für die Packungsbeilage vorgesehenen Angaben Gebrauchsinformation: Information für den Anwender Presselin FE Mischung Homöopathisches Arzneimittel Zur Anwendung bei Kindern über 12 Jahren
Gebrauchsinformation: Information für Anwender. EVIT 600 I.E. Kapseln. Wirkstoff: RRR-alpha-Tocopherol (Vitamin E)
 Gebrauchsinformation: Information für Anwender EVIT 600 I.E. Kapseln Wirkstoff: RRR-alpha-Tocopherol (Vitamin E) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Gebrauchsinformation: Information für Anwender EVIT 600 I.E. Kapseln Wirkstoff: RRR-alpha-Tocopherol (Vitamin E) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Neurobion 100 mg 100 mg 1 mg / 3 ml Injektionslösung Vitamine B 1 + B 6 + B 12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch bevor Sie mit der Anwendung
WICHTIGE INFORMATIONEN FÜR PATIENTEN. denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde
 WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung des mittelschweren bis schweren aktiven Morbus Crohn verschrieben wurde 2 Version 2 (Stand: Februar 2017) Erstellt in Abstimmung mit dem
Der Leitfaden zur Beratung. Informations- und Beratungshinweise in öffentlichen Apotheken
 Informations- und shinweise in öffentlichen Apotheken Dieser Leitfaden dient zur Eigen- und Fremdbeurteilung der und Information bei der Abgabe von Arzneimitteln auf ärztliche Verordnung sowie im Rahmen
Informations- und shinweise in öffentlichen Apotheken Dieser Leitfaden dient zur Eigen- und Fremdbeurteilung der und Information bei der Abgabe von Arzneimitteln auf ärztliche Verordnung sowie im Rahmen
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
850 mg / Tablette Zur Anwendung bei Heranwachsenden über 12 Jahren und Erwachsenen Wirkstoff: Natriumhydrogencarbonat
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Original Bullrich Salz Magentabletten 850 mg / Tablette Zur Anwendung bei Heranwachsenden über 12 Jahren und Erwachsenen Wirkstoff: Natriumhydrogencarbonat
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Original Bullrich Salz Magentabletten 850 mg / Tablette Zur Anwendung bei Heranwachsenden über 12 Jahren und Erwachsenen Wirkstoff: Natriumhydrogencarbonat
Sangenor Trinkampullen. Wirkstoff: Mono-L-Arginin-L-Aspartat
 43-STA-10/10-GI/1 2010-10-20/VT GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Sangenor Trinkampullen Wirkstoff: Mono-L-Arginin-L-Aspartat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn
43-STA-10/10-GI/1 2010-10-20/VT GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Sangenor Trinkampullen Wirkstoff: Mono-L-Arginin-L-Aspartat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn
Tretinac. Wichtige Informationen für Patientinnen und Patienten
 Tretinac. Wichtige Informationen für Patientinnen und Patienten Diese Broschüre enthält wichtige Informationen über das Aknemedikament Tretinac. Falls Sie zusätzlich etwas wissen möchten, sprechen Sie
Tretinac. Wichtige Informationen für Patientinnen und Patienten Diese Broschüre enthält wichtige Informationen über das Aknemedikament Tretinac. Falls Sie zusätzlich etwas wissen möchten, sprechen Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
1. Was ist Apis/Belladonna cum Mercurio und wofür wird es angewendet?
 WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
Diese Patientenverfügung wird gemäß Patientenverfügungs-Gesetz (BGBl. I Nr. 55/2006) errichtet.
 Pat-Verfuegung_end 10.07.2006 14:01 Uhr Seite 1 Patientenverfügung Diese Patientenverfügung wird gemäß Patientenverfügungs-Gesetz (BGBl. I Nr. 55/2006) errichtet. Meine Patientenverfügung: Im Vollbesitz
Pat-Verfuegung_end 10.07.2006 14:01 Uhr Seite 1 Patientenverfügung Diese Patientenverfügung wird gemäß Patientenverfügungs-Gesetz (BGBl. I Nr. 55/2006) errichtet. Meine Patientenverfügung: Im Vollbesitz
GEHT DA MEHR? Fragen und Antworten zum Thema Erektionsstörung
 GEHT DA MEHR? Fragen und Antworten zum Thema Erektionsstörung EREKTIONSSTÖRUNGEN Gute Nachrichten: Man(n) kann was tun! Wenn die Liebe auf kleiner Flamme brennt, kann dies eine vorübergehende Abkühlung
GEHT DA MEHR? Fragen und Antworten zum Thema Erektionsstörung EREKTIONSSTÖRUNGEN Gute Nachrichten: Man(n) kann was tun! Wenn die Liebe auf kleiner Flamme brennt, kann dies eine vorübergehende Abkühlung
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
 Gebrauchsinformation: Information für den Anwender Gargarisma zum Gurgeln 9,6 g/100 ml Lösung Wirkstoff: Aluminiumchlorid-Hexahydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält
Gebrauchsinformation: Information für den Anwender Gargarisma zum Gurgeln 9,6 g/100 ml Lösung Wirkstoff: Aluminiumchlorid-Hexahydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält
WICHTIGE INFORMATIONEN FÜR PATIENTEN
 WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bzw. aktiven psoriatischen Arthritis verschrieben wurde 2 Version 5 (Stand: Februar 2017)
WICHTIGE INFORMATIONEN FÜR PATIENTEN denen STELARA zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bzw. aktiven psoriatischen Arthritis verschrieben wurde 2 Version 5 (Stand: Februar 2017)
Informationen zum Thema Arzneimitteldokumentation und Arzneimitteltherapiesicherheit
 Gesundheitskarte AKTUELL Informationen zum Thema Arzneimitteldokumentation und Arzneimitteltherapiesicherheit Arzneimittel sind ein elementarer Bestandteil in der modernen medizinischen Behandlung. Bei
Gesundheitskarte AKTUELL Informationen zum Thema Arzneimitteldokumentation und Arzneimitteltherapiesicherheit Arzneimittel sind ein elementarer Bestandteil in der modernen medizinischen Behandlung. Bei
Gebrauchsinformation: Information für Patienten
 Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
De-ursil - De-ursil RR - De-ursil RR mite
 Bern, 23.10.2015 Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben
Bern, 23.10.2015 Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben
Gebrauchsinformation: Information für Patienten. Tabletten gegen Magen-Darm-Beschwerden Similasan
 1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Antrag auf Betreuung in einer Kindertagesstätte der Stadt Lohr a. Main
 Az. 423-02/05 Antrag auf Betreuung in einer Kindertagesstätte der Stadt Lohr a. Main Auf der Grundlage der - Satzung der Stadt Lohr a. Main über die Benutzung und den Betrieb der Kindertagesstätten der
Az. 423-02/05 Antrag auf Betreuung in einer Kindertagesstätte der Stadt Lohr a. Main Auf der Grundlage der - Satzung der Stadt Lohr a. Main über die Benutzung und den Betrieb der Kindertagesstätten der
2. Was müssen Sie vor der Anwendung von Aureocort-Salbe beachten?
 Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Aureocort -Salbe Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Aureocort -Salbe Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Gelsemium-Homaccord -Tropfen
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Gelsemium-Homaccord -Tropfen Wirkstoffe: Gelsemium sempervirens, Toxicodendron quercifolium, Cimicifuga racemosa Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Gelsemium-Homaccord -Tropfen Wirkstoffe: Gelsemium sempervirens, Toxicodendron quercifolium, Cimicifuga racemosa Lesen Sie die gesamte Packungsbeilage sorgfältig
zur Verfügung gestellt von Gebrauchs.info
 Gebrauchsinformation: Information für den Anwender, 1000 µg/ml Injektionslösung Wirkstoff: Hydroxocobalaminacetat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
Gebrauchsinformation: Information für den Anwender, 1000 µg/ml Injektionslösung Wirkstoff: Hydroxocobalaminacetat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen
Entscheidungen vor dem Hintergrund des Patientenrechtegesetzes
 Entscheidungen vor dem Hintergrund des Patientenrechtegesetzes Juristische Aspekte Johannes Schopohl 9. Landespsychotherapeutentag Berlin Berlin, 9. März 2013 Überblick 1. Juristischer Hintergrund von
Entscheidungen vor dem Hintergrund des Patientenrechtegesetzes Juristische Aspekte Johannes Schopohl 9. Landespsychotherapeutentag Berlin Berlin, 9. März 2013 Überblick 1. Juristischer Hintergrund von
ANHANG III ÄNDERUNGEN DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE
 ANHANG III ÄNDERUNGEN DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE 25 KORREKTUREN, DIE IN DIE JEWEILIGEN ABSCHNITTE DER ZUSAMMENFASSUNG DER PRODUKTEIGENSCHAFTEN FÜR BROMOCRIPTIN-HALTIGE
ANHANG III ÄNDERUNGEN DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE 25 KORREKTUREN, DIE IN DIE JEWEILIGEN ABSCHNITTE DER ZUSAMMENFASSUNG DER PRODUKTEIGENSCHAFTEN FÜR BROMOCRIPTIN-HALTIGE
Gebrauchsinformation: Information für Patienten. Osanit Hustenkügelchen Wirkstoff: Drosera D6
 Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Mutterschutz / Schwangerschaft
 Leitfaden zum Thema Mutterschutz / Schwangerschaft der Stiftung Katholische Freie Schule Stand: März 2016 I. Allgemeine Daten: Name der werdenden Mutter: Beschäftigt als : vorauss. Entbindungstermin :
Leitfaden zum Thema Mutterschutz / Schwangerschaft der Stiftung Katholische Freie Schule Stand: März 2016 I. Allgemeine Daten: Name der werdenden Mutter: Beschäftigt als : vorauss. Entbindungstermin :
Cefavora - Tropfen. Gebrauchsinformation: Information für Anwender
 1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
ellaone Die wirksamste Pille für danach Jetzt rezeptfrei (Liste C)
 ellaone Die wirksamste Pille für danach Jetzt rezeptfrei (Liste C) 1 Pannen passieren: ellaone jetzt auf Liste C 2 ellaone jetzt auf Liste C warum ist sie die 1. Wahl? Agenda Notfallverhütung betrifft
ellaone Die wirksamste Pille für danach Jetzt rezeptfrei (Liste C) 1 Pannen passieren: ellaone jetzt auf Liste C 2 ellaone jetzt auf Liste C warum ist sie die 1. Wahl? Agenda Notfallverhütung betrifft
SICHERHEITSHINWEIS. Hypothermiegerät FlexTherm. Identifikation der betroffenen Medizinprodukte: Hypothermiegerät FlexTherm (Bestellnummer: )
 SICHERHEITSHINWEIS Identifikation der betroffenen Medizinprodukte: (Bestellnummer: 16-70-00) Datum: 06. Februar 2017 Referenznummer: 9611109-02/06/17-001-R Adressat: Verantwortliche für Risiko- und Sicherheitsfragen,
SICHERHEITSHINWEIS Identifikation der betroffenen Medizinprodukte: (Bestellnummer: 16-70-00) Datum: 06. Februar 2017 Referenznummer: 9611109-02/06/17-001-R Adressat: Verantwortliche für Risiko- und Sicherheitsfragen,
