file:///i /fernlehre skriptum/studienbrief2/inhalt.htm Atomphysik II Die verschiedenen Arten der Radioaktivität - Zerfallsreihen (Isotope)
|
|
|
- Johann Fiedler
- vor 7 Jahren
- Abrufe
Transkript
1 inhalt file:///i /fernlehre skriptum/studienbrief2/inhalt.htm Atomphysik II Das Periodensystem - Radioaktivität Bis ins 17. Jhdt. versuchte man in der Alchimie die Materie zu "veredeln". Berühmt wurden die Alchimisten durch ihre Bemühungen Gold zu machen. Obwohl ihnen dies nicht gelang, waren es ihre Experimente und in weiterer Folge die empirische Chemie, die zur Systematisierung der Eigenschaften der Elemente führte. Das Periodensystem hat seinen Ursprung in diesen Untersuchungen. Unter Berücksichtigung des Atommodells ist es eine der Elektronenkonfiguration entsprechende Anordnung der Elemente. In gewisser Weise kam der Traum der Alchimisten durch die Entdeckung der Radioaktivität zu einer späten Erfüllung. Beim radioaktiven Zerfall kommt es nämlich zu einer Umwandlung der Elemente. Den durch Neutronenbeschuß gezielt hervorgerufenen Kernzerfall nennt man Kernspaltung. Zusammen mit der Kernfusion (Kernverschmelzung) stellt sie die prinzipielle Möglichkeit einer uneingeschränkten Umformung der Elemente ineinander dar. Während die kontrollierte Kernspaltung bereits in zahlreichen Atomkraftwerken technisch realisiert ist, ist eine kontrollierte Kernfusion noch nicht gelungen. Die Radioaktivität ist ein Phänomen dem gerade in heutiger Zeit große gesellschaftliche Beachtung zukommt, da sie ein beträchtliches Gefahrenpotential in sich birgt. Für eine Urteilsbildung ist jedoch die Kenntnis der grundlegenden physikalischen Zusammenhänge eine Mindestvoraussetzung. Wir werden also im Folgenden die physikalischen Grundlagen zum Phänomen der Radioaktivität behandeln. Das Periodensystem Radioaktivität: Die Entdeckung des Phänomens Die verschiedenen Arten der Radioaktivität - Zerfallsreihen (Isotope) Kernfusion und Kernspaltung - Das Zerfallsgesetz (Halbwertszeit) 1 von :11
2 teil1 file:///i /fernlehre skriptum/studienbrief2/teil1.htm Das Periodensystem Wiederholen wir zunächst kurz, was wir in den vorangehenden Kapiteln besprochen haben. Näherungsweise kann ein isoliert gedachtes Atom als Kugel aufgefaßt werden, deren Radius in der Größenordnung von 100 pm liegt. Es besteht aus Atomkern und Atomhülle. Der Durchmesser des Atomkerns ist im Vergleich zum Durchmesser des Atoms sehr klein; sein Radius liegt in der Größenordnung von 0.01 pm. Stellt man sich ein Atom als eine stark vergrößerte Kugel von einem Radius mit 10 m vor, so hätte darin der Atomkern einen Radius von nur 1 mm. In diesem kleinen Atomkern ist praktisch die gesamte Masse des Atoms konzentriert. Bei einem Element mit einer Dichte von 1000 kg/m3 beträgt die Materialdichte im Kern 10^15 kg/m3 oder 1 Mill t/cm^3. Die Atomhülle ist praktisch materiefrei; sie enthält nur elektrisch negativ geladene Teilchen, die Elektronen. Alle Atome sind aus nur wenigen Bausteinsorten aufgebaut, zum groben Verständnis des Atombaues reicht es aus, sich auf Protonen, Neutronen und Elektronen zu beschränken (nur das Elektron ist ein Elementarteilchen). Bisher haben wir mehr oder weniger immer nur die Atomhülle behandelt. Zur vollständigen Beschreibung des Atoms gehört jedoch wesentlich auch der Atomkern. Im Atomkern sind Protonen und Neutronen enthalten. Sie haben etwa die gleiche Masse. Das Proton besitzt außer seiner Masse eine positive Ladung, und zwar die kleinste bekannte Ladung, das elektrische Elementarquantum [e=1,602 10^-19 C (Coulomb)]. Im elektrisch neutralen Atom sind in seiner Hülle ebensoviele negative Ladungen (Elektronen) vorhanden, wie positive Ladungen (Protonen) im Atomkern enthalten sind. Die Ruhmasse eines Protons beträgt 1,672 10^-24 g. 6, ^23 Protonen haben die Masse von 1,0069 g. Man bezeichnet die Masse von 6, ^23 Teilchen als relative Atommasse und die Zahl der in ihr enthaltenen Teilchen als die Avogadrosche Konstante, früher auch Loschmidtsche Zahl genannt. Sie hat die Einheit mol^-1. Neben den Protonen sind in allen Atomkernen (mit Ausnahme des leichten Wasserstoffkernes) Neutronen vorhanden. Sie unterscheiden sich von den Protonen dadurch, daß sie elektrisch neutral sind, also keine Ladung tragen. Die Ruhmasse des Neutrons beträgt ^-27 kg und die relative Atommasse 1,0081. Die Masse eines Elektrons ist sehr viel kleiner als diejenige eines Protons oder Neutrons, nämlich 1/1836 der Masse eines Protons. Die Massenzahl A eines Atoms ist die Summe der Zahlen seiner Protonen P und Neutronen N (A=P+N). Protonen und Neutronen werden durch die sehr starken Kernkräfte im Atomkern zusammengehalten. Die Zahl der in einem Atomkern enthaltenen Neutronen ist in der Regel mindestens so groß wie die der Protonen. Mit wachsender Atommasse wird die Zahl der Neutronen größer als die Zahl der Protonen: der Urankern mit der Massenzahl 238 enthält 92 Protonen und 146 Neutronen. Die Zahl der Protonen in einem Kern wird Ordnungszahl, Kernladungszahl oder 1 von :13
3 teil1 file:///i /fernlehre skriptum/studienbrief2/teil1.htm Atomnummer genannt. In einem neutralen Atom ist sie gleich der Anzahl der Elektronen in der Atomhülle. Unter einem Element wird ein Stoff verstanden, welcher in Atome gleicher Ordnungszahl (und damit gleicher Elektronenanzahl in der Atomhülle) zerlegt werden kann. Durch die Angabe der Ordnungszahl ist ein Element eindeutig charakterisiert; es wäre daher nicht nötig, es zusätzlich durch Name und Symbol zu kennzeichnen. Beispielsweise ist das Element mit der Ordnungszahl 1 Wasserstoff, das Element mit der Ordnungszahl 6 Kohlenstoff und dasjenige mit der Ordnungszahl 92 Uran. Gegenwärtig sind 107 Elemente bekannt, von denen etwa 90 in der Natur vorkommen. Der gedankliche Aufbau der Elektronenhüllen der einzelnen Atome ist in der Weise möglich, daß, beginnend mit dem leichtesten Atom, dem Wasserstoffatom, Elektronen schrittweise (unter gleichzeitiger Zugabe je eines Protons und der erforderlichen Neutronen in den Atomkern) in den energetisch günstigsten Zustand, d.h. jenen minimaler Energie, eingefügt werden. Dabei muß wie schon oben erwähnt das Pauli-Prinzip berücksichtigt werden. Mit Hilfe des Pauli-Prinzips ist es möglich, die Elektronen in einem Atom und ihre Quantenzustände zu charakterisieren. Innerhalb eines Atoms kann es maximal zwei Elektronen mit der Hauptquantenzahl n 1 geben. Bei n = 1 können nämlich - wie wir schon gezeigt haben - sowohl die Nebenquantenzahl l als auch die magnetische Quantenzahl m nur den Wert null haben. Die beiden Elektronen mit der Hauptquantenzahl n = 1 können nur s-elektronen (l=0) sein (m s = +1/2,-1/2). Mit der Hauptquantenzahl n = 2 sind acht verschiedene Elektronenzustände möglich, da l = 0 oder 1 = 1 sein kann; für l = 0 (s-elektronen) stehen zwei Elektronenzustände zur Verfügung, nämlich m s = + 1/2 und -1/2 und bei l = 1 gibt es 6 p-elektronen-zustände entsprechend der möglichen Werte für m (m=0,+1,-1). Jeder dieser Zustände kann durch zwei Elektronen mit verschiedenen Spinquantenzahlen besetzt werden. Es sind also in einem Atom maximal acht Elektronen mit der Hauptquantenzahl n = 2 möglich: zwei 2s- und sechs 2p-Elektronen. Analog können 18 Elektronen für n = 3 und 32 Elektronen für n = 4 in einem Atom auftreten. Die Anzahl der Elektronen, welche maximal bei gegebener Hauptquantenzahl n möglich ist, ist 2n^2. Im folgenden Periodensystem sind die ersten 36 Elemente dargestellt. Die Zahlen unter den Elementen sind die Massenzahlen. Da die meisten Elemente in der Natur als Isotopengemische (Isotop: Nuklid gleicher Ordnungszahl, aber verschiedener Neutronenzahl) vorkommen, sind die Zahlen nicht ganzzahlig. Durch Klicken auf ein Element wird die Elektronenkonfiguration des betreffenden Elementes angezeigt. Gehen Sie die einzelnen Elemente durch und verfolgen Sie, wie die einzelnen Energieniveaus aufgefüllt werden. 2 von :13
4 teil2 file:///i /fernlehre skriptum/studienbrief2/teil2.htm Die Entdeckung des Phänomens Ursprünglich untersuchte Röntgen 1895 die Kathoden- (Elektronen-) Strahlen. Um das durch die Kathodenstrahlen hervorgerufene schwache Fluoreszenzlicht sehen zu können, hatte Röntgen das sichtbare Licht seines Kathodenstrahlrohres mit undurchsichtigem schwarzem Papier vollkommen abgeschirmt. Dennoch bemerkte er beim Betrieb des Entladungsrohrs ein kräftiges Leuchten an allen in der Nähe befindlichen fluoreszierenden Salzen, obwohl kein sichtbares Licht und erst recht keine Kathodenstrahlen auf die Salze auftreffen konnten. Zunächst glaubte man die Röntgenstrahlen, durch die die Salze zum Fluoreszieren angeregt wurden, seien selbst die Folge eines Fluoreszenzeffektes wenn die Elektronen auf die Wand der Kathodenstrahlröhre treffen. Wilhelm Conrad Röntgen ( ). Um dieser Vermutung nachzugehen hat Becquerel eine sorgfältig in schwarzes Papier eingehüllte Fotoplatte verwendet, auf der keine Spur einer Belichtung zu bemerken war, wenn sie über mehrere Stunden intensiver Sonnenbestrahlung ausgesetzt wurde. Auf die derartig verpackte Platte hat er einen Uransalzkristall gelegt, mit dem er schon früher bei seinen Fluoreszenzuntersuchungen experimentiert hatte. Platte und Kristall hat er dann der Sonnenstrahlung ausgesetzt, um das Uransalz zum Fluoreszieren zu bringen. Nach dem Entwickeln der Fotoplatte stellte Becquerel auf ihr eine Schwärzung in der Form des Uransalzkristalles fest. Er glaubte damit seine Annahme, daß die Fluoreszenz mit einer Emission von Röntgenstrahlen einhergeht, als bewiesen ansehen zu können. Wie wir wissen, existiert der vermutete Zusammenhang zwischen Fluoreszenz und Röntgenstrahlung nicht. Die Röntgenstrahlen gehen von den Elektronen aus, die beim Auftreffen auf die Glaswandung des Entladungsrohres abgebremst werden, wobei die Fluoreszenz lediglich eine Begleiterscheinung ist. Bei den heute verwendeten Röntgenröhren werden die Elektronen nicht an der Glaswand, sondern gewöhnlich beim Auftreffen auf eine Wolfram-Elektrode abgebremst. Die Emission von Röntgenstrahlen ist hier mit keinerlei Fluoreszenzerscheinungen verbunden. 1 von :13
5 teil2 file:///i /fernlehre skriptum/studienbrief2/teil2.htm Ein zufälliges Ereignis hat dann die Physiker zu der Erkenntnis geführt, daß die Schwärzung der Fotoplatte eigentlich gar nichts mit der Fluoreszenz des Uransalzes zu tun hat. Becquerel wollte seine Versuche mit der Fotoplatte und dem Uransalzkristall wiederholen. Da die Sonne jedoch nur zeitweise schien, reichte die Lichtmenge nicht aus um das Uransalz zum Fluoreszieren zu bringen. Erlegte also den Plattenbehälter zurück in eine dunkle Schublade, wobei er das Uransalz auf ihm liegen ließ. Da sich das Wetter aber nicht besserte, entwickelte er schließlich die Photoplatten in der Erwartung, sehr schwache Bilder zu bekommen. Tatsächlich erschienen aber die Silhouetten des Uransalzkristalls in sehr großer Intensität. Bei den weiteren Untersuchungen hat Becquerel festgestellt, daß das beobachtete Phänomen tatsächlich mit der Fluoreszenz nichts zu tun hat und ausschließlich auf die Anwesenheit des Urans zurückzuführen ist. Er hat dann bemerkt, daß die Wirkung des Uransalzes nicht von seinem physikalischen oder chemischen Zustand abhängt und daß die Strahlen, die eine Zeit lang als Becquerel-Strahlen bezeichnet wurden, die Luft genauso zu ionisieren vermögen wie die Röntgenstrahlen hat Rutherford begonnen, die ionisierende Wirkung der Becquerel-Strahlung zu studieren. Dabei hat er festgestellt, daß die Strahlung nicht homogen ist und eine ionisierende Komponente hat, die bereits von einer dünnen Papierschicht absorbiert wird und deren Reichweite auch in der Luft nur einige Zentimeter beträgt. Die andere Komponente hat ein sehr viel kleineres Ionisationsvermögen, aber eine wesentlich größere Reichweite. Rutherford hat diese Strahlen ohne weitere Begründung nach den ersten Buchstaben des griechischen Alphabets als α- und β-strahlen bezeichnet. Es soll an dieser Stelle noch bemerkt werden, daß Villard 1900 eine dritte Form der Strahlen, die γ-strahlen, entdeckt hat, die eine weitaus größere Reichweite (Durchdringungsvermögen) als die β-strahlen haben. Becquerel konnte schließlich nachweisen, daß die β-strahlen von korpuskularer Natur sind und eine negative Ladung tragen. Nachdem der Quotient ihrer Ladung zu ihrer Masse bestimmt worden war, konnte man sie mit den Elektronen identifizieren, die vor nicht allzu langer Zeit entdeckt worden waren. Die Identifizierung der α-strahlen war nicht so einfach ahnte Rutherford bereits, daß die α-strahlen aus zweifach ionisierten Heliumatomen bestehen; den endgültigen Beweis hat er jedoch erst im Jahre 1909 erbracht. 2 von :13
6 teil2 file:///i /fernlehre skriptum/studienbrief2/teil2.htm Ablenkung radioaktiver Strahlung im Magnetfeld In den ersten Jahren des 20. Jahrhunderts hat sich also ein im großen und ganzen richtiges Bild über die Radioaktivität durchgesetzt. Die Natur der Strahlung war bekannt, und man wußte, daß α-strahlen aus Ionen mit einer positiven Ladung bestehen, wobei man sogar vermutete, daß diese Ionen Helium-lonen sind. Die β-strahlen waren als Elektronenstrahlen identifiziert worden, und schließlich hat man geahnt, daß die γ-strahlen den Röntgenstrahlen verwandt sind. Man hat auch gewußt, daß ein Element in einem bestimmten Akt entweder nur α- oder nur ß-Strahlen emittiert und daß sich die Atome bei der Emission dieser Strahlung chemisch umwandeln. Das Zerfallsgesetz war bereits aufgestellt und der Begriff der Halbwertszeit des Zerfalls eingeführt worden. Man darf aber nicht vergessen, daß diese Beobachtungen noch nicht kernphysikalisch gedeutet worden sind, weil vom Atom noch nicht bekannt war, daß es aus einem zentralen Kern und einer Hülle besteht. Zurück 3 von :13
7 teil3 file:///i /fernlehre skriptum/studienbrief2/teil3.htm Die verschiedenen Arten der Radioaktivität Instabile Kerne senden bei ihrer Umwandlung charakteristische Strahlen aus. Bei Elementen mit Ordnungszahlen über 83 sind alle Isotope radioaktiv. Der Zeitpunkt der radioaktiven Umwandlung für ein einzelnes Atom ist völlig unbestimmt, für eine große Menge von Atomen gelten jedoch die statistischen Gesetze der Zerfallsgeschwindigkeit (siehe weiter unten). Die Radioaktivität wird charakterisiert durch die Natur der Strahlung, die Strahlungsenergie, die Zerfallsgeschwindigkeit der Kerne und schließlich die Strahlungsaktivität. α-strahlen sind doppelt positiv geladene Heliumkerne; sie werden mit Geschwindigkeiten bis zu 10% der Lichtgeschwindigkeit aus den radioaktiven Kernen ausgestoßen. Sie üben eine stark ionisierende Wirkung aus. β-strahlen sind schnell bewegte, freie Elektronen. Sie sind etwa 7300 mal leichter als α-teilchen und können beinahe Lichtgeschwindigkeit erreichen. β-strahlen haben meist geringere kinetische Energie sowie ein geringeres Ionisierungsvermögen als α-strahlen, γ-strahlen können als Begleiterscheinung beim α- wie auch beim α-zerfall auftreten. Sie sind hochenergetische elektromagnetische Strahlen. Die drei Arten radioaktiver Strahlung Die Strahlungsenergie wird meist in MeV/Atom angegeben. Ein ev ist jene Energie, die einem Elektron oder Proton beim Durchlaufen der Potentialdifferenz von 1 Volt erteilt wird. 1 ev= 1,6 10^-22 kj und liegt in der Größenordnung des bei chemischen Reaktionen auftretenden Energieumsatzes. Die kinetischen Energien von α-teilchen liegen meist zwischen 4 und 11MeV/Atom, sind also 10^6 bis 10^7 mal so groß wie etwa die typischen Energieänderungen bei chemischen Reaktionen. Unter der Strahlungsaktivität wird der Quotient aus der Anzahl der Zerfallsakte 1 von :14
8 teil3 file:///i /fernlehre skriptum/studienbrief2/teil3.htm und der Zeit verstanden. Die Strahlungsaktivität eines bestimmten radioaktiven Präparates ist seiner Menge proportional. Ein Curie (Ci) entspricht etwa der Aktivität von 4 g Radium bzw. derjenigen Menge eines radioaktiven Stoffes, welche 3.7 1O^10 Zerlallsakte pro Sekunde aufweist. Zerfallsreihen (Isotope) Ein Nuklid ist eine Atomart, die durch ihre Ordnungszahl und ihre Massenzahl definiert ist. Zur Kennzeichnung wird die Massenzahl links oben dem chemischen Symbol vorangestellt. 1 H ist das Nuklid des Wasserstoffes mit der Massenzahl 1, 16 O das Nuklid des Sauerstoffes, mit der Massenzahl 16. Häufig wird außerdem die Ordnungszahl dem Symbol des Elements, und zwar links unten, vorangestellt, also 1 1 H für das Wasserstoffnuklid mit der Massenzahl 1 und 8 16 O für das Sauerstoffnuklid mit der Massenzahl 16. Isotope sind Nuklide gleicher Ordnungszahl, aber verschiedener Neutronenzahl und demnach verschiedener Massenzahl. Sie sind Nuklide ein und desselben Elements. In der Regel sind sie chemisch gleichartig, unterscheiden sich aber in physikalischen Eigenschaften. Nuklide gleicher Massenzahl, aber verschiedener Ordnungszahl und verschiedener Neutronenzahl sind Angehörige verschiedener Elemente und werden Isobare genannt; sie können daher auf chemischem Weg leicht voneinander getrennt werden. Diejenigen Elemente, welche in der Natur in einer einzigen Nuklidgattung vorkommen, nennt man Reinelemente oder mononuklidische Elemente (z.b. Fluor). Die meisten in der Natur vorkommenden Elemente sind jedoch Isotopengemische, polynuklidische oder Mischelemente. Bei Aussendung von α-strahlen (He-Kerne) erfolgt eine Verringerung der Massenzahl um vier Einheiten (ein He-Kern enthält 2 Protonen und 2 Neutronen) und eine Verringerung der Ordnungszahl um zwei Einheiten. Beispiel: Aus Ra entsteht durch Emission von α-strahlen das Edelgas Radon Rn. Die Kernreaktion hat unmittelbar eine Umbildung der Elektronenhülle zur Folge, da das Rn-Atom zwei Elektronen weniger enthält als das Radiumatom. Bei β-strahlung wird ein Elektron aus dem Kern (nicht ein Elektron aus der Atomhülle) ausgestoßen. Man kann sich vorstellen, daß im Kern die Umwandlung eines Neutrons in ein Proton unter Abgabe eines Elektrons erfolgt: n => p + e. Durch Emission des Elektrons aus dem Atomkern bleibt die Massenzahl des Kerns unverändert, aber die Ordnungszahl wird um eine Einheit erhöht. Beispiel: Aus Protactinium-234 (Ordnungszahl 91) entsteht Uran-234 (Ordnungszahl 92). 2 von :14
9 teil3 file:///i /fernlehre skriptum/studienbrief2/teil3.htm Ausschnitt aus der Uran-Radium- Zerfallsreihe Bei einem radioaktiven Umwandlungsprozeß können Nuklide entstehen, welche wieder radioaktiv sind. Da sich die Massenzahl entweder überhaupt nicht oder nur um vier Einheiten ändern kann, sind vier verschiedene Zerfallsreihen möglich. Davon kommen in der Natur nur drei vor: die Thorium-Reihe, die Uran-Reihe und die Actinium-Reihe. Endprodukt einer Zerfallsreihe ist entweder ein Blei- oder ein Wismut-Isotop. Zurück 3 von :14
10 teil4 file:///i /fernlehre skriptum/studienbrief2/teil4.htm Kernfusion und Kernspaltung Die Atommasse eines Atoms ist geringer als die Summe der Massen der in ihm enthaltenen Protonen und Neutronen. Die für Helium (2p, 2n) berechnete Atommasse ist 4,0300, der gefundene Wert 4,0026. Die Differenz zwischen berechnetem und gefundenem Wert wird als Massendefekt bezeichnet. Er beträgt demnach für Helium Masseneinheiten. Der Massendefekt ist ein Maß für die gesamte Bindungsenergie der Nukleonen (Protonen und Neutronen) in einem Atomkern. Er ist das Massenäquivalent der bei der Bildung der Kerne abgegebenen Bindungsenergie. Bei der Bildung des Heliums aus Protonen und Neutronen tritt ein Verlust an Masse (Zuwachs an Bindungsenergie) ein, welcher in Energie umgewandelt wird. Zur Einleitung der Kernfusion sind allerdings Temperaturen von vielen Millionen Grad Celsius erforderlich, wie sie beispielsweise in der Sonne vorherrschen oder auch bei der Explosion einer Atombombe erreicht werden. Daher ist es möglich, mit Hilfe einer Atombombe eine Kernverschmelzung auszulösen, gegenwärtig jedoch nur die unkontrollierte Form (Wasserstoffbombe). Kernbindungsenergie pro Nukleon Die Kernbindungsenergie pro Nukleon steigt bei den sehr leichten Atomen mit zunehmender Massenzahl zunächst steil an und erreicht schon beim Sauerstoff einen Wert um 8 MeV pro Nukleon. Die größte Bindungsenergie pro Nukleon wird bei Kernen mit Massenzahlen um etwa 60 gefunden. Sie nimmt sodann mit steigender Ordnungszahl wieder ab. Durch die Spaltung schwerer Atomkerne (Kernspaltung), z.b. von Uran, in zwei Atomkerne mittlerer Massenzahl wird ebenfalls Masse in Energie umgewandelt. 1 von :14
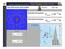
11 teil4 file:///i /fernlehre skriptum/studienbrief2/teil4.htm Das Zerfallsgesetz (Halbwertszeit) Die Geschwindigkeit des radioaktiven Zerfalles ist von äußeren Bedingungen (Druck, Temperatur) unabhängig und für ein radioaktives Nuklid charakteristisch. Die je Zeiteinheit zerfallende Zahl der Atome eines radioaktiven Stoffes ist in jedem Augenblick zu der Anzahl N(t) der noch nicht zerfallenen Atome proportional: Die Zerfallskonstante λ gibt an, welcher Bruchteil der Masse des radioaktiven Stoffes je Sekunde umgewandelt wird. Sie ändert sich im Laufe der Zeit nicht. Für Radium ist λ = 1,36 10^-11 s (je Sekunde zerfallen von l g Ra 1,36 10^-11 g). Trennen wir in obiger Gleichung die Variablen N und t erhalten wir: Durch unbestimmte Integration erhalten wir: Für die Zahl N(t) der zur Zeit t noch nicht zerfallenen Atome ergibt sich also: (Zerfallsgesetz) Dabei ist N 0 die Zahl der Atome zum Zeitpunkt t=0. Als Halbwertszeit wird die Zeit verstanden, innerhalb der sich die Hälfte der ursprünglich vorhandenen Atome umwandelt. Unter Berücksichtigung des Zerfallsgesetzes ist sie durch folgenden Ausdruck gegeben: Im folgenden Programm haben Sie die Möglichkeit den radioaktiven Zerfall dreier Substanzen zu untersuchen. Wählen Sie die Substanzen durch Klicken auf das Feld "Atom" links oben. Zunächst haben Sie 90 aktive Atome dieser Substanz. Geben Sie in der entsprechenden Zeile ein Zeitintervall ein (zwischen 1 und 100, ganzzahlig) und drücken Sie "Enter". Durch Klicken auf das Feld "Nächstes Zeitintervall" können Sie beobachten wieviele der aktiven Atome innerhalb des Zeitintervalls zerfallen. Wiederholtes Klicken auf dieses Feld läßt die Zeit immer um das eingegebene Zeitintervall weiter laufen. In der Grafik rechts wird die Anzahl der noch aktiven Atome angezeigt. Nach 10 Zeitintervallen können Sie durch Klicken auf das Feld "Zurücksetzen" wieder von vorne beginnen und eine andere Atomart wählen. Aufgaben: Versuchen Sie die Halbwertszeit der einzelnen Substanzen zu ermitteln. Bei gegebenem Zeitintervall und gegebener Atomart: Ist die Rate der pro Zeiteinheit zerfallenden Atome im Mittel konstant? Wieso gibt es im Einzelfall Abweichungen? 2 von :14
12 teil4 file:///i /fernlehre skriptum/studienbrief2/teil4.htm Wenn nur mehr ein Atom aktiv ist: Steigt seine Zerfallswahrscheinlichkeit mit fortschreitender Zeit? Zurück 3 von :14
Radioaktivität. den 7 Oktober Dr. Emőke Bódis
 Radioaktivität den 7 Oktober 2016 Dr. Emőke Bódis Prüfungsfrage Die Eigenschaften und Entstehung der radioaktiver Strahlungen: Alpha- Beta- und Gamma- Strahlungen. Aktivität. Zerfallgesetz. Halbwertzeit.
Radioaktivität den 7 Oktober 2016 Dr. Emőke Bódis Prüfungsfrage Die Eigenschaften und Entstehung der radioaktiver Strahlungen: Alpha- Beta- und Gamma- Strahlungen. Aktivität. Zerfallgesetz. Halbwertzeit.
Lernziele zu Radioaktivität 1. Radioaktive Strahlung. Entdeckung der Radioaktivität. Entdeckung der Radioaktivität
 Radioaktive Strahlung Entstehung Nutzen Gefahren du weisst, Lernziele zu Radioaktivität 1 dass Elementarteilchen nur bedingt «elementar» sind. welche unterschiedlichen Arten von radioaktiven Strahlungen
Radioaktive Strahlung Entstehung Nutzen Gefahren du weisst, Lernziele zu Radioaktivität 1 dass Elementarteilchen nur bedingt «elementar» sind. welche unterschiedlichen Arten von radioaktiven Strahlungen
2) Kernstabilität und radioaktive Strahlung (2)
 2) Kernstabilität und radioaktive Strahlung (2) Periodensystem der Elemente vs. Nuklidkarte ca. 115 unterschiedliche chemische Elemente Periodensystem der Elemente 7 2) Kernstabilität und radioaktive Strahlung
2) Kernstabilität und radioaktive Strahlung (2) Periodensystem der Elemente vs. Nuklidkarte ca. 115 unterschiedliche chemische Elemente Periodensystem der Elemente 7 2) Kernstabilität und radioaktive Strahlung
d 10 m Cusanus-Gymnasium Wittlich Das Bohrsche Atomodell Nils Bohr Atomdurchmesser 10 Kerndurchmesser 14 d 10 m Atom
 Das Bohrsche Atomodell Nils Bohr 1885-1962 Atomdurchmesser 10 d 10 m Atom Kerndurchmesser 14 http://www.matrixquantenenergie.de d 10 m Kern 14 dkern 10 m 10 datom 10 m Masse und Ladung der Elementarteilchen
Das Bohrsche Atomodell Nils Bohr 1885-1962 Atomdurchmesser 10 d 10 m Atom Kerndurchmesser 14 http://www.matrixquantenenergie.de d 10 m Kern 14 dkern 10 m 10 datom 10 m Masse und Ladung der Elementarteilchen
Grundbausteine des Mikrokosmos (4) Die Entdeckung des Atomkerns...
 Grundbausteine des Mikrokosmos (4) Die Entdeckung des Atomkerns... Alles begann mit den Röntgenstrahlen... November 1895, Würzburg Wilhelm Conrad Röntgen untersuchte Kathodenstrahlen, wobei er eine Fluoreszenz
Grundbausteine des Mikrokosmos (4) Die Entdeckung des Atomkerns... Alles begann mit den Röntgenstrahlen... November 1895, Würzburg Wilhelm Conrad Röntgen untersuchte Kathodenstrahlen, wobei er eine Fluoreszenz
Thema heute: Aufbau der Materie, Atommodelle Teil 2
 Wiederholung der letzten Vorlesungsstunde: Atomistischer Aufbau der Materie, historische Entwicklung des Atombegriffes Atome Thema heute: Aufbau der Materie, Atommodelle Teil 2 Vorlesung Allgemeine Chemie,
Wiederholung der letzten Vorlesungsstunde: Atomistischer Aufbau der Materie, historische Entwicklung des Atombegriffes Atome Thema heute: Aufbau der Materie, Atommodelle Teil 2 Vorlesung Allgemeine Chemie,
Radioaktiver Zerfall des Atomkernes: α-zerfall
 Radioaktiver Zerfall des Atomkernes: α-zerfall Schwere Atomkerne (hohes Z, hohes N) sind instabil gegen spontanen Zerfall. Die mögliche Emission einzelner Protonen oder einzelner Neutronen ist nicht häufig.
Radioaktiver Zerfall des Atomkernes: α-zerfall Schwere Atomkerne (hohes Z, hohes N) sind instabil gegen spontanen Zerfall. Die mögliche Emission einzelner Protonen oder einzelner Neutronen ist nicht häufig.
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
27. Vorlesung EP V. STRAHLUNG, ATOME, KERNE
 27. Vorlesung EP V. STRAHLUNG, ATOME, KERNE 28. Atomphysik, Röntgenstrahlung (Fortsetzung: Röntgenröhre, Röntgenabsorption) 29. Atomkerne, Radioaktivität (Nuklidkarte, α-, β-, γ-aktivität, Dosimetrie)
27. Vorlesung EP V. STRAHLUNG, ATOME, KERNE 28. Atomphysik, Röntgenstrahlung (Fortsetzung: Röntgenröhre, Röntgenabsorption) 29. Atomkerne, Radioaktivität (Nuklidkarte, α-, β-, γ-aktivität, Dosimetrie)
Radioaktivität Haller/ Hannover-Kolleg 1
 Radioaktivität 17.09.2007 Haller/ Hannover-Kolleg 1 Radioaktivität 17.09.2007 Haller/ Hannover-Kolleg 2 Radioaktivität 1. Was verstehe ich darunter? 2. Welche Wirkungen hat die Radioaktivität? 3. Muss
Radioaktivität 17.09.2007 Haller/ Hannover-Kolleg 1 Radioaktivität 17.09.2007 Haller/ Hannover-Kolleg 2 Radioaktivität 1. Was verstehe ich darunter? 2. Welche Wirkungen hat die Radioaktivität? 3. Muss
11. Kernphysik. [55] Ianus Münze
![11. Kernphysik. [55] Ianus Münze 11. Kernphysik. [55] Ianus Münze](/thumbs/52/29657300.jpg) 11. Kernphysik Der griechische Gott Ianus ist einer der ältesten römischen Gottheiten. Er gehört zur rein römischen Mythologie, das heißt es gibt in der griechischen Götterwelt keine vergleichbare Gestalt.
11. Kernphysik Der griechische Gott Ianus ist einer der ältesten römischen Gottheiten. Er gehört zur rein römischen Mythologie, das heißt es gibt in der griechischen Götterwelt keine vergleichbare Gestalt.
Masse etwa 1 u = e-27 kg = MeV/c^2. Neutron (Entdeckung 1932 James Chadwick)
 Masse etwa 1 u = 1.6605e-27 kg = 931.5 MeV/c^2 Neutron (Entdeckung 1932 James Chadwick) Kraft Reichweite (cm) Stärke bei 10 13 cm im Vergleich zu starker Kraft Gravitation unendlich 10 38 elektrische Kraft
Masse etwa 1 u = 1.6605e-27 kg = 931.5 MeV/c^2 Neutron (Entdeckung 1932 James Chadwick) Kraft Reichweite (cm) Stärke bei 10 13 cm im Vergleich zu starker Kraft Gravitation unendlich 10 38 elektrische Kraft
Thema heute: Aufbau der Materie: Kernumwandlungen, Spaltung von Atomkernen
 Wiederholung der letzten Vorlesungsstunde: Experiment von Rutherford, Atombau, atomare Masseneinheit u, 118 bekannte Elemente, Isotope, Mischisotope, Massenspektroskopie, Massenverlust 4H 4 He, Einstein:
Wiederholung der letzten Vorlesungsstunde: Experiment von Rutherford, Atombau, atomare Masseneinheit u, 118 bekannte Elemente, Isotope, Mischisotope, Massenspektroskopie, Massenverlust 4H 4 He, Einstein:
Atomphysik Klasse 9. Aufgabe: Fülle die freien Felder aus!
 1. Was gibt die Massenzahl A eines Atoms an? Die Zahl der Neutronen im Kern. Die Zahl der Protonen im Kern. Die Summe aus Kernneutronen und Kernprotonen. Die Zahl der Elektronen. Die Summe von Elektronen
1. Was gibt die Massenzahl A eines Atoms an? Die Zahl der Neutronen im Kern. Die Zahl der Protonen im Kern. Die Summe aus Kernneutronen und Kernprotonen. Die Zahl der Elektronen. Die Summe von Elektronen
Arbeitsfragen zur Vorbereitung auf den Quali
 Arbeitsfragen zur Vorbereitung auf den Quali Atombau 1 Was bedeutet das Wort Atom? 2 Welche Aussage mache Dalton über die Atome? 3 Was ist der größte Teil eines Atoms? 4 Was sind Moleküle? 5 Durch welchen
Arbeitsfragen zur Vorbereitung auf den Quali Atombau 1 Was bedeutet das Wort Atom? 2 Welche Aussage mache Dalton über die Atome? 3 Was ist der größte Teil eines Atoms? 4 Was sind Moleküle? 5 Durch welchen
Röntgenstrahlen. Röntgenröhre von Wilhelm Konrad Röntgen. Foto: Deutsches Museum München.
 Röntgenstrahlen 1 Wilhelm Konrad Röntgen Foto: Deutsches Museum München. Röntgenröhre von 1896 2 1 ev = 1 Elektronenvolt = Energie die ein Elektron nach Durchlaufen der Potentialdifferenz 1V hat (1.6 10-19
Röntgenstrahlen 1 Wilhelm Konrad Röntgen Foto: Deutsches Museum München. Röntgenröhre von 1896 2 1 ev = 1 Elektronenvolt = Energie die ein Elektron nach Durchlaufen der Potentialdifferenz 1V hat (1.6 10-19
Radioaktivität. Bildungsstandards Physik - Radioaktivität 1 LEHRPLANZITAT. Das radioaktive Verhalten der Materie:
 Bildungsstandards Physik - Radioaktivität 1 Radioaktivität LEHRPLANZITAT Das radioaktive Verhalten der Materie: Ausgehend von Alltagsvorstellungen der Schülerinnen und Schüler soll ein grundlegendes Verständnis
Bildungsstandards Physik - Radioaktivität 1 Radioaktivität LEHRPLANZITAT Das radioaktive Verhalten der Materie: Ausgehend von Alltagsvorstellungen der Schülerinnen und Schüler soll ein grundlegendes Verständnis
Elektronen, Protonen und Neutronen haben folgende Eigenschaften, die in Tabelle 2.1 wiedergegeben sind:
 Aufbau der Atome.1 Elektronen, Protonen, Neutronen, Isotope Atome bestehen aus Elektronen, die die Atomhülle bilden, sowie den im Kern vereinigten Protonen und Neutronen. Die elektromagnetischen Wechselwirkungen
Aufbau der Atome.1 Elektronen, Protonen, Neutronen, Isotope Atome bestehen aus Elektronen, die die Atomhülle bilden, sowie den im Kern vereinigten Protonen und Neutronen. Die elektromagnetischen Wechselwirkungen
Physik für Mediziner Radioaktivität
 Physik für Mediziner http://www.mh-hannover.de/physik.html Radioaktivität Peter-Alexander Kovermann Institut für Neurophysiologie Kovermann.peter@mh-hannover.de Der Aufbau von Atomen 0-5 - 0-4 m 0-0 -4
Physik für Mediziner http://www.mh-hannover.de/physik.html Radioaktivität Peter-Alexander Kovermann Institut für Neurophysiologie Kovermann.peter@mh-hannover.de Der Aufbau von Atomen 0-5 - 0-4 m 0-0 -4
Das Magnetfeld. Das elektrische Feld
 Seite 1 von 5 Magnetisches und elektrisches Feld Das Magnetfeld beschreibt Eigenschaften der Umgebung eines Magneten. Auch bewegte Ladungen rufen Magnetfelder hervor. Mithilfe von Feldlinienbilder können
Seite 1 von 5 Magnetisches und elektrisches Feld Das Magnetfeld beschreibt Eigenschaften der Umgebung eines Magneten. Auch bewegte Ladungen rufen Magnetfelder hervor. Mithilfe von Feldlinienbilder können
41. Kerne. 34. Lektion. Kernzerfälle
 41. Kerne 34. Lektion Kernzerfälle Lernziel: Stabilität von Kernen ist an das Verhältnis von Protonen zu Neutronen geknüpft. Zu viele oder zu wenige Neutronen führen zum spontanen Zerfall. Begriffe Stabilität
41. Kerne 34. Lektion Kernzerfälle Lernziel: Stabilität von Kernen ist an das Verhältnis von Protonen zu Neutronen geknüpft. Zu viele oder zu wenige Neutronen führen zum spontanen Zerfall. Begriffe Stabilität
Atombau. Chemie. Zusammenfassungen. Prüfung Mittwoch, 14. Dezember Elektrische Ladung. Elementarteilchen. Kern und Hülle
 Chemie Atombau Zusammenfassungen Prüfung Mittwoch, 14. Dezember 2016 Elektrische Ladung Elementarteilchen Kern und Hülle Atomsorten, Nuklide, Isotope Energieniveaus und Schalenmodell Steffi Alle saliorel
Chemie Atombau Zusammenfassungen Prüfung Mittwoch, 14. Dezember 2016 Elektrische Ladung Elementarteilchen Kern und Hülle Atomsorten, Nuklide, Isotope Energieniveaus und Schalenmodell Steffi Alle saliorel
Atomphysik NWA Klasse 9
 Atomphysik NWA Klasse 9 Atome wurden lange Zeit als die kleinsten Teilchen angesehen, aus denen die Körper bestehen. Sie geben den Körpern ihre chemischen und physikalischen Eigenschaften. Heute wissen
Atomphysik NWA Klasse 9 Atome wurden lange Zeit als die kleinsten Teilchen angesehen, aus denen die Körper bestehen. Sie geben den Körpern ihre chemischen und physikalischen Eigenschaften. Heute wissen
Technologie/Informatik Kernaufbau und Kernzerfälle. Dipl.-Phys. Michael Conzelmann, StR Staatliche FOS und BOS Bad Neustadt a. d.
 Technologie/Informatik Kernaufbau und Kernzerfälle Dipl.-Phys. Michael Conzelmann, StR Staatliche FOS und BOS Bad Neustadt a. d. Saale Übersicht Kernaufbau Rutherford-Experiment, Nukleonen Schreibweise,
Technologie/Informatik Kernaufbau und Kernzerfälle Dipl.-Phys. Michael Conzelmann, StR Staatliche FOS und BOS Bad Neustadt a. d. Saale Übersicht Kernaufbau Rutherford-Experiment, Nukleonen Schreibweise,
Aufbau des Atomkerns a) Gib an, aus wie vielen Protonen und Neutronen die
 Aufbau des Atomkerns a) Gib an, aus wie vielen Protonen und Neutronen die Atomkerne von Cl bestehen. b) Erkläre, was man unter Isotopen versteht. Gib ein Beispiel an. 3, Cl c) Im Periodensystem wird die
Aufbau des Atomkerns a) Gib an, aus wie vielen Protonen und Neutronen die Atomkerne von Cl bestehen. b) Erkläre, was man unter Isotopen versteht. Gib ein Beispiel an. 3, Cl c) Im Periodensystem wird die
Dieter Suter Physik B3
 Dieter Suter - 421 - Physik B3 9.2 Radioaktivität 9.2.1 Historisches, Grundlagen Die Radioaktivität wurde im Jahre 1896 entdeckt, als Becquerel feststellte, dass Uransalze Strahlen aussenden, welche den
Dieter Suter - 421 - Physik B3 9.2 Radioaktivität 9.2.1 Historisches, Grundlagen Die Radioaktivität wurde im Jahre 1896 entdeckt, als Becquerel feststellte, dass Uransalze Strahlen aussenden, welche den
Atome. Definition: das kleinste Teilchen eines chemischen Elementes, das mit chemischen Verfahren nicht mehr zerlegbar ist.
 Atome Definition: das kleinste Teilchen eines chemischen Elementes, das mit chemischen Verfahren nicht mehr zerlegbar ist. Das Atom besitzt einen positiv geladene Atomkern und eine negative Elektronenhülle.
Atome Definition: das kleinste Teilchen eines chemischen Elementes, das mit chemischen Verfahren nicht mehr zerlegbar ist. Das Atom besitzt einen positiv geladene Atomkern und eine negative Elektronenhülle.
Radioaktivität und Strahlenschutz. FOS: Kernumwandlungen und Radioaktivität
 R. Brinkmann http://brinkmann-du.de Seite 25..23 -, Beta- und Gammastrahlen Radioaktivität und Strahlenschutz FOS: Kernumwandlungen und Radioaktivität Bestimmte Nuklide haben die Eigenschaft, sich von
R. Brinkmann http://brinkmann-du.de Seite 25..23 -, Beta- und Gammastrahlen Radioaktivität und Strahlenschutz FOS: Kernumwandlungen und Radioaktivität Bestimmte Nuklide haben die Eigenschaft, sich von
15 Kernphysik Der Atomkern 15.2 Kernspin Zerfallsgesetz radioaktiver Kerne
 15 Kernphysik 15.1 Der Atomkern 15.2 Kernspin 15.3 Radioaktivität ität 15.4 Zerfallsgesetz radioaktiver Kerne 15.5 Kernprozesse 15.5.1 Kernfusion 15.5.2 Kernspaltung 1553K 15.5.3 Kettenreaktion 15. Kernphysik
15 Kernphysik 15.1 Der Atomkern 15.2 Kernspin 15.3 Radioaktivität ität 15.4 Zerfallsgesetz radioaktiver Kerne 15.5 Kernprozesse 15.5.1 Kernfusion 15.5.2 Kernspaltung 1553K 15.5.3 Kettenreaktion 15. Kernphysik
FOS: Radioaktivität und Strahlenschutz. Chemische Elemente und ihre kleinsten Teilchen
 R. Brinkmann http://brinkmann-du.de Seite 5..03 Chemische Elemente FOS: Radioaktivität und Strahlenschutz Chemische Elemente und ihre kleinsten Teilchen Der Planet Erde besteht aus 9 natürlich vorkommenden
R. Brinkmann http://brinkmann-du.de Seite 5..03 Chemische Elemente FOS: Radioaktivität und Strahlenschutz Chemische Elemente und ihre kleinsten Teilchen Der Planet Erde besteht aus 9 natürlich vorkommenden
2. Der Aufbau der Atome wird mit dem Rutherford schen und dem Bohr schen Atommodellen beschrieben. Ordne die Aussagen zu und verbinde.
 Atommodelle 1. Vervollständige den Lückentext. Atome bestehen aus einer mit negativ geladenen und einem mit positiv geladenen und elektrisch neutralen. Die Masse des Atoms ist im konzentriert. Die Massenzahl
Atommodelle 1. Vervollständige den Lückentext. Atome bestehen aus einer mit negativ geladenen und einem mit positiv geladenen und elektrisch neutralen. Die Masse des Atoms ist im konzentriert. Die Massenzahl
15 Kernphysik Physik für E-Techniker. 15 Kernphysik
 15 Kernphysik 15.1 Der Atomkern 15.2 Kernspin 15.3 Radioaktivität 15.4 Zerfallsgesetz radioaktiver Kerne 15.5 Kernprozesse 15.5.1 Kernfusion 15.5.2 Kernspaltung 15.5.3 Kettenreaktion 15. Kernphysik 15.
15 Kernphysik 15.1 Der Atomkern 15.2 Kernspin 15.3 Radioaktivität 15.4 Zerfallsgesetz radioaktiver Kerne 15.5 Kernprozesse 15.5.1 Kernfusion 15.5.2 Kernspaltung 15.5.3 Kettenreaktion 15. Kernphysik 15.
9. Kernphysik 9.1. Zusammensetzung der Atomkerne
 Prof. Dieter Suter Physik B2 SS 01 9. Kernphysik 9.1. Zusammensetzung der Atomkerne 9.1.1. Nukelonen Die Atomkerne bestehen aus Protonen und Neutronen. Die Zahl der Nukleonen wird durch die Massenzahl
Prof. Dieter Suter Physik B2 SS 01 9. Kernphysik 9.1. Zusammensetzung der Atomkerne 9.1.1. Nukelonen Die Atomkerne bestehen aus Protonen und Neutronen. Die Zahl der Nukleonen wird durch die Massenzahl
Energie wird normalerweise in Joule gemessen. Ein Joule (J) einspricht einem Newtonmeter
 Maße wie Gammastrahlen abgeschwächt werden. Im Gegensatz zu den Gammastrahlen sind die Neutronenstrahlen auch Teilchenstrahlen wie Alpha- und Betastrahlen. Die Reichweiten von Strahlen mit einer Energie
Maße wie Gammastrahlen abgeschwächt werden. Im Gegensatz zu den Gammastrahlen sind die Neutronenstrahlen auch Teilchenstrahlen wie Alpha- und Betastrahlen. Die Reichweiten von Strahlen mit einer Energie
Klausur -Informationen
 Klausur -Informationen Datum: 4.2.2009 Uhrzeit und Ort : 11 25 im großen Physikhörsaal (Tiermediziner) 12 25 ibidem Empore links (Nachzügler Tiermedizin, bitte bei Aufsichtsperson Ankunft melden) 11 25
Klausur -Informationen Datum: 4.2.2009 Uhrzeit und Ort : 11 25 im großen Physikhörsaal (Tiermediziner) 12 25 ibidem Empore links (Nachzügler Tiermedizin, bitte bei Aufsichtsperson Ankunft melden) 11 25
Theoretische Grundlagen Physikalisches Praktikum. Versuch 8: Radioaktivität
 Theoretische Grundlagen Physikalisches Praktikum Versuch 8: Radioaktivität Radioaktivität spontane Umwandlung instabiler tomkerne natürliche Radioaktivität: langlebige Urnuklide und deren Zerfallsprodukte
Theoretische Grundlagen Physikalisches Praktikum Versuch 8: Radioaktivität Radioaktivität spontane Umwandlung instabiler tomkerne natürliche Radioaktivität: langlebige Urnuklide und deren Zerfallsprodukte
Natürliche Radioaktivität
 Natürliche Radioaktivität Definition Natürliche Radioaktivität Die Eigenschaft von Atomkernen sich spontan in andere umzuwandeln, wobei Energie in Form von Teilchen oder Strahlung frei wird, nennt man
Natürliche Radioaktivität Definition Natürliche Radioaktivität Die Eigenschaft von Atomkernen sich spontan in andere umzuwandeln, wobei Energie in Form von Teilchen oder Strahlung frei wird, nennt man
Der Streuversuch. Klick dich in den Streuversuch ein. Los geht s! Vorüberlegungen. Versuchsaufbau. animierte Versuchsaufbau. Durchführung.
 Der Streuversuch Der Streuversuch wurde in Manchester von den Physikern Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906 mit dem Versuch und benötigten sieben Jahre um das Geheimnis des Aufbaus
Der Streuversuch Der Streuversuch wurde in Manchester von den Physikern Rutherford, Geiger und Marsden durchgeführt. Sie begannen 1906 mit dem Versuch und benötigten sieben Jahre um das Geheimnis des Aufbaus
Radioaktiver Zerfall Strahlung Nukliderzeugung. Nukliderzeugung
 Radioaktiver Zerfall Strahlung Nukliderzeugung Wiederholung: Struktur der Materie Radioaktivität Nuklidkarte, Nuklide Zerfallsarten Strahlung Aktivität Nukliderzeugung Was ist Radioaktivität? Eigenschaft
Radioaktiver Zerfall Strahlung Nukliderzeugung Wiederholung: Struktur der Materie Radioaktivität Nuklidkarte, Nuklide Zerfallsarten Strahlung Aktivität Nukliderzeugung Was ist Radioaktivität? Eigenschaft
Radioaktivität, Kernspaltung. medizinische, friedliche und kriegerische Nutzungen der Radioaktivität
 Radioaktivität, Kernspaltung. medizinische, friedliche und kriegerische Nutzungen der Radioaktivität LaCh Seite 1 von 7 1. Grundlagen der Atomtheorie... 3 Aufbau eines Atoms... 3 2. Eigenschaften der radioaktiven
Radioaktivität, Kernspaltung. medizinische, friedliche und kriegerische Nutzungen der Radioaktivität LaCh Seite 1 von 7 1. Grundlagen der Atomtheorie... 3 Aufbau eines Atoms... 3 2. Eigenschaften der radioaktiven
Ergebnis: Atome haben einen Durchmesser im Bereich von m (Zehnmillionstelmillimeter).
 Atome 1 Größenordnung Ölfleckversuch: Auf die Wasseroberfläche wird eine so kleine Menge an Öl aufgebracht, dass sich eine monomolekulare Schicht (nur ein Molekül dick) bildet. Der Trick besteht darin,
Atome 1 Größenordnung Ölfleckversuch: Auf die Wasseroberfläche wird eine so kleine Menge an Öl aufgebracht, dass sich eine monomolekulare Schicht (nur ein Molekül dick) bildet. Der Trick besteht darin,
Als Radioaktivität bezeichnet den spontanen Zerfall von Radionukliden unter Emission ionisierender Strahlung.
 Als Radioaktivität bezeichnet den spontanen Zerfall von Radionukliden unter Emission ionisierender Strahlung. 1803 John Dalton, Atomtheorie 1869 D.I. Mendelejev, Periodensystem 1888 H. Hertz, experimenteller
Als Radioaktivität bezeichnet den spontanen Zerfall von Radionukliden unter Emission ionisierender Strahlung. 1803 John Dalton, Atomtheorie 1869 D.I. Mendelejev, Periodensystem 1888 H. Hertz, experimenteller
Widerlegung des Modells von Thomson durch Rutherford
 Atomkerne Eine wichtige Frage stellt sich nach dem Aufbau eines Atoms aus diesen subatomaren Bausteinen. Gibt es eine Systematik des Aufbaus der Atome der verschiedenen chemischen Element im Hinblick auf
Atomkerne Eine wichtige Frage stellt sich nach dem Aufbau eines Atoms aus diesen subatomaren Bausteinen. Gibt es eine Systematik des Aufbaus der Atome der verschiedenen chemischen Element im Hinblick auf
Atommodell führte Rutherford den nach ihm benannten Streuversuch durch. Dabei bestrahlte er eine dünne Goldfolie mit α Teilchen.
 Atommodell nach Rutherford 1911 führte Rutherford den nach ihm benannten Streuversuch durch. Dabei bestrahlte er eine dünne Goldfolie mit α Teilchen. Beobachtung: Fast alle Teilchen fliegen ungestört durch.
Atommodell nach Rutherford 1911 führte Rutherford den nach ihm benannten Streuversuch durch. Dabei bestrahlte er eine dünne Goldfolie mit α Teilchen. Beobachtung: Fast alle Teilchen fliegen ungestört durch.
umwandlungen Atommodelle, Rutherford-Experiment, Atomaufbau, Elektronen, Protonen,
 Wiederholung der letzten Vorlesungsstunde: Atommodelle, Rutherford-Experiment, Atomaufbau, Elektronen, Protonen, Neutronen, Element, Ordnungszahl Thema heute: Aufbau von Atomkernen, Kern- umwandlungen
Wiederholung der letzten Vorlesungsstunde: Atommodelle, Rutherford-Experiment, Atomaufbau, Elektronen, Protonen, Neutronen, Element, Ordnungszahl Thema heute: Aufbau von Atomkernen, Kern- umwandlungen
1 Natürliche Radioaktivität
 1 NATÜRLICHE RADIOAKTIVITÄT 1 1 Natürliche Radioaktivität 1.1 Entdeckung 1896: Henri BEQUEREL: Versuch zur Fluoreszenz = Emission einer durchdringenden Stahlung bei fluoreszierenden Uran-Verbindungen Eigenschaften:
1 NATÜRLICHE RADIOAKTIVITÄT 1 1 Natürliche Radioaktivität 1.1 Entdeckung 1896: Henri BEQUEREL: Versuch zur Fluoreszenz = Emission einer durchdringenden Stahlung bei fluoreszierenden Uran-Verbindungen Eigenschaften:
durch Teilungsversuche durch Spektraluntersuchungen Jedes Atom besitzt einen Atomkern, in dem fast die gesamte Masse vereinigt ist.
 1. Kreuze die richtige Aussage über Atome an: Sie sind sehr kleine, unteilbare Körper aus einem einheitlichen (homogenen) Stoff. Sie sind so klein, dass man ihren Aufbau nicht erforschen kann. Sie sind
1. Kreuze die richtige Aussage über Atome an: Sie sind sehr kleine, unteilbare Körper aus einem einheitlichen (homogenen) Stoff. Sie sind so klein, dass man ihren Aufbau nicht erforschen kann. Sie sind
Markus Drapalik. Universität für Bodenkultur Wien Institut für Sicherheits- und Risikowissenschaften
 Praxisseminar Strahlenschutz Teil 2: Ionisierende Strahlung Markus Drapalik 14.03.2013 26.03.2013 Praxisseminar Strahlenschutz Teil 2: Ionisierende Strahlung 1 1 Inhalt Aufbau des Atoms Atomarer Zerfall
Praxisseminar Strahlenschutz Teil 2: Ionisierende Strahlung Markus Drapalik 14.03.2013 26.03.2013 Praxisseminar Strahlenschutz Teil 2: Ionisierende Strahlung 1 1 Inhalt Aufbau des Atoms Atomarer Zerfall
Physikalische. Grundlagen. L. Kölling, Fw Minden
 Physikalische Grundlagen L. Kölling, Fw Minden Radioaktivität kann man weder sehen, hören, fühlen, riechen oder schmecken. Daher muss sie der FA (SB) zumindest verstehen, um im Einsatzfall die erforderlichen
Physikalische Grundlagen L. Kölling, Fw Minden Radioaktivität kann man weder sehen, hören, fühlen, riechen oder schmecken. Daher muss sie der FA (SB) zumindest verstehen, um im Einsatzfall die erforderlichen
VI Kernphysik. A Atomkerne. 1 Wichtigste Eigenschaften der Atomkerne. 1.1 Elektrische Ladung der Atomkerne. 1.2 Masse der Atomkerne. 1.
 -VI.A1- A Atomkerne 1 Wichtigste Eigenschaften der Atomkerne 1.1 Elektrische Ladung der Atomkerne Die Atomkerne besitzen eine positive elektrische Ladung. Diese beträgt stets ein ganzzahliges Vielfaches
-VI.A1- A Atomkerne 1 Wichtigste Eigenschaften der Atomkerne 1.1 Elektrische Ladung der Atomkerne Die Atomkerne besitzen eine positive elektrische Ladung. Diese beträgt stets ein ganzzahliges Vielfaches
Einführungsseminar S2 zum Physikalischen Praktikum
 Einführungsseminar S2 zum Physikalischen Praktikum 1. Organisatorisches 2. Unterweisung 3. Demo-Versuch Radioaktiver Zerfall 4. Am Schluss: Unterschriften! Praktischer Strahlenschutz Wechselwirkung von
Einführungsseminar S2 zum Physikalischen Praktikum 1. Organisatorisches 2. Unterweisung 3. Demo-Versuch Radioaktiver Zerfall 4. Am Schluss: Unterschriften! Praktischer Strahlenschutz Wechselwirkung von
15 Kernphysik Der Atomkern 15.2 Kernspin 15.3 Radioaktivität 15.4 Zerfallsgesetz radioaktiver Kerne
 Inhalt 15 Kernphysik 15.1 Der Atomkern 15.2 Kernspin 15.3 Radioaktivität 15.4 Zerfallsgesetz radioaktiver Kerne 15.5 Kernprozesse 15.5.1 Kernfusion 15.5.2 Kernspaltung 15.5.3 Kettenreaktion Der Atomkern
Inhalt 15 Kernphysik 15.1 Der Atomkern 15.2 Kernspin 15.3 Radioaktivität 15.4 Zerfallsgesetz radioaktiver Kerne 15.5 Kernprozesse 15.5.1 Kernfusion 15.5.2 Kernspaltung 15.5.3 Kettenreaktion Der Atomkern
1 Chemische Elemente und chemische Grundgesetze
 1 Chemische Elemente und chemische Grundgesetze Die Chemie ist eine naturwissenschaftliche Disziplin. Sie befasst sich mit der Zusammensetzung, Charakterisierung und Umwandlung von Materie. Unter Materie
1 Chemische Elemente und chemische Grundgesetze Die Chemie ist eine naturwissenschaftliche Disziplin. Sie befasst sich mit der Zusammensetzung, Charakterisierung und Umwandlung von Materie. Unter Materie
Thema heute: Aufbau der Materie: Das Bohr sche Atommodell
 Wiederholung der letzten Vorlesungsstunde: Erste Atommodelle, Dalton Thomson, Rutherford, Atombau, Coulomb-Gesetz, Proton, Elektron, Neutron, weitere Elementarteilchen, atomare Masseneinheit u, 118 bekannte
Wiederholung der letzten Vorlesungsstunde: Erste Atommodelle, Dalton Thomson, Rutherford, Atombau, Coulomb-Gesetz, Proton, Elektron, Neutron, weitere Elementarteilchen, atomare Masseneinheit u, 118 bekannte
Radioaktivität und seine Strahlung
 Radioaktivität und seine Strahlung Radioaktivität (radioactivité wurde 1898 von Marie Curie eingeführt) ist ein Phänomen der Kerne von tomen. Darum ist die Radioaktivität heute in die Kernphysik eingeordnet.
Radioaktivität und seine Strahlung Radioaktivität (radioactivité wurde 1898 von Marie Curie eingeführt) ist ein Phänomen der Kerne von tomen. Darum ist die Radioaktivität heute in die Kernphysik eingeordnet.
1. Aufbau des Atomkerns
 801-1 1.1 Bausteine des Atomkerns VIII. Der Atomkern und Kernstrahlung 1. Aufbau des Atomkerns 1.1 Bausteine des Atomkerns Der Atomkern ist aus den Nukleonen aufgebaut. Dazu gehören die Protonen (p) und
801-1 1.1 Bausteine des Atomkerns VIII. Der Atomkern und Kernstrahlung 1. Aufbau des Atomkerns 1.1 Bausteine des Atomkerns Der Atomkern ist aus den Nukleonen aufgebaut. Dazu gehören die Protonen (p) und
Aufbau der Atome und Atomkerne
 ufbau der tome und tomkerne tome bestehen aus dem tomkern (d 10-15 m) und der Elektronenhülle (d 10-10 m). Der Raum dazwischen ist leer. (Rutherfordscher Streuversuch (1911): Ernest Rutherford beschoss
ufbau der tome und tomkerne tome bestehen aus dem tomkern (d 10-15 m) und der Elektronenhülle (d 10-10 m). Der Raum dazwischen ist leer. (Rutherfordscher Streuversuch (1911): Ernest Rutherford beschoss
42. Radioaktivität. 35. Lektion Radioaktivität
 42. Radioaktivität 35. Lektion Radioaktivität Lernziel: Unstabile Kerne zerfallen unter Emission von α, β, oder γ Strahlung Begriffe Begriffe Radioaktiver Zerfall ktivität Natürliche Radioaktivität Künstliche
42. Radioaktivität 35. Lektion Radioaktivität Lernziel: Unstabile Kerne zerfallen unter Emission von α, β, oder γ Strahlung Begriffe Begriffe Radioaktiver Zerfall ktivität Natürliche Radioaktivität Künstliche
3. Das Atom 3.1. Geschichte des Atombegriffs 3.2. Elementarteilchen: Proton, Neutron und Elektron 3.3. Atomaufbau 3.4. Nuklide, Isotope und
 3. Das Atom 3.1. Geschichte des Atombegriffs 3.2. Elementarteilchen: Proton, Neutron und Elektron 3.3. Atomaufbau 3.4. Nuklide, Isotope und Reinelemente 3.5. Häufigkeit der Elemente 3.6. Atomare Masseneinheit
3. Das Atom 3.1. Geschichte des Atombegriffs 3.2. Elementarteilchen: Proton, Neutron und Elektron 3.3. Atomaufbau 3.4. Nuklide, Isotope und Reinelemente 3.5. Häufigkeit der Elemente 3.6. Atomare Masseneinheit
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Lagerung des Abfalls. radioaktiver Abfall
 Lagerung des Abfalls radioaktiver Abfall Radioaktivität Was ist Radioaktivität? Welche Eigenschaften besitz sie? Welche Auswirkungen kann sie haben? Warnung vor radioaktiver Strahlung Internationale Strahlenschutzzeichen
Lagerung des Abfalls radioaktiver Abfall Radioaktivität Was ist Radioaktivität? Welche Eigenschaften besitz sie? Welche Auswirkungen kann sie haben? Warnung vor radioaktiver Strahlung Internationale Strahlenschutzzeichen
Natürliche Radioaktivität Lehrerinformation
 Lehrerinformation 1/7 Arbeitsauftrag Ziel Material Sozialform Die SuS lesen den Informationstext. Als Verständnishilfe verwenden sie gleichzeitig das Arbeitsblatt Leitfragen zum Text. In Partnerarbeit
Lehrerinformation 1/7 Arbeitsauftrag Ziel Material Sozialform Die SuS lesen den Informationstext. Als Verständnishilfe verwenden sie gleichzeitig das Arbeitsblatt Leitfragen zum Text. In Partnerarbeit
Allgemeine Chemie. Der Atombau
 Allgemeine Chemie Der Atombau Dirk Broßke Berlin, Dezember 2005 1 1. Atombau 1.1. Der Atomare Aufbau der Materie 1.1.1. Der Elementbegriff Materie besteht aus... # 6.Jh.v.Chr. Empedokles: Erde, Wasser,
Allgemeine Chemie Der Atombau Dirk Broßke Berlin, Dezember 2005 1 1. Atombau 1.1. Der Atomare Aufbau der Materie 1.1.1. Der Elementbegriff Materie besteht aus... # 6.Jh.v.Chr. Empedokles: Erde, Wasser,
Kernphysik. Physik Klasse 9. Quelle: AkadOR W. Wagner, Didaktik der Chemie, Universität Bayreuth (verändert für Kl.9/Sachsen
 Kernphysik Physik Klasse 9 Quelle: AkadOR W. Wagner, Didaktik der Chemie, Universität Bayreuth (verändert für Kl.9/Sachsen Lehrplan Atomodelle Niels Bohr Rutherford Begriff: Modell Ein Modell zeichnet
Kernphysik Physik Klasse 9 Quelle: AkadOR W. Wagner, Didaktik der Chemie, Universität Bayreuth (verändert für Kl.9/Sachsen Lehrplan Atomodelle Niels Bohr Rutherford Begriff: Modell Ein Modell zeichnet
1. Physikalische Grundlagen
 1.2. Kernumwandlung und Radioaktivität - Entdeckung Antoine Henri Becquerel Entdeckte Radioaktivität 1896 Ehepaar Marie und Pierre Curie Nobelpreise 1903 und 1911 Liese Meitner, Otto Hahn 1. Kernspaltung
1.2. Kernumwandlung und Radioaktivität - Entdeckung Antoine Henri Becquerel Entdeckte Radioaktivität 1896 Ehepaar Marie und Pierre Curie Nobelpreise 1903 und 1911 Liese Meitner, Otto Hahn 1. Kernspaltung
1 Einführung in den Strahlenschutz der Feuerwehr
 1 Einführung in den Strahlenschutz der Feuerwehr Als das erste Rote Heft»Strahlenschutz«im Jahr 1960 erschien, war das Thema radioaktive Stoffe Neuland für die Feuerwehren. Heute finden die Feuerwehren
1 Einführung in den Strahlenschutz der Feuerwehr Als das erste Rote Heft»Strahlenschutz«im Jahr 1960 erschien, war das Thema radioaktive Stoffe Neuland für die Feuerwehren. Heute finden die Feuerwehren
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt für die Klassen 7 bis 9: Strahlung
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt für die Klassen 7 bis 9: Strahlung Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt für die Klassen 7 bis 9: Strahlung Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT
R. Brinkmann Seite
 R. Brinkmann http://brinkmann-du.de Seite 25..203 Oberstufe: se und ausführliche Lösungen zur Klassenarbeit zur Elektrik und Kernphysik se: E Eine Glühlampe 4V/3W (4 Volt, 3 Watt) soll an eine Autobatterie
R. Brinkmann http://brinkmann-du.de Seite 25..203 Oberstufe: se und ausführliche Lösungen zur Klassenarbeit zur Elektrik und Kernphysik se: E Eine Glühlampe 4V/3W (4 Volt, 3 Watt) soll an eine Autobatterie
(in)stabile Kerne & Radioaktivität
 Übersicht (in)stabile Kerne & Radioaktivität Zerfallsgesetz Natürliche und künstliche Radioaktivität Einteilung der natürlichen Radionuklide Zerfallsreihen Zerfallsarten Untersuchung der Strahlungsarten
Übersicht (in)stabile Kerne & Radioaktivität Zerfallsgesetz Natürliche und künstliche Radioaktivität Einteilung der natürlichen Radionuklide Zerfallsreihen Zerfallsarten Untersuchung der Strahlungsarten
Die Anzahl der Protonen und Neutronen entspricht der Atommassenzahl.
 Atom Der Begriff Atom leitet sich von atomos her, was unteilbar heisst. Diese Definition ist alt, da man heutzutage fähig ist, Atome zu teilen. Atommassenzahl Die Anzahl der Protonen und Neutronen entspricht
Atom Der Begriff Atom leitet sich von atomos her, was unteilbar heisst. Diese Definition ist alt, da man heutzutage fähig ist, Atome zu teilen. Atommassenzahl Die Anzahl der Protonen und Neutronen entspricht
Physikalisches Praktikum I
 Fachbereich Physik Physikalisches Praktikum I K20 Name: Halbwertszeit von Rn Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Dieser Fragebogen muss
Fachbereich Physik Physikalisches Praktikum I K20 Name: Halbwertszeit von Rn Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Dieser Fragebogen muss
3) Natürliche und künstliche Radioaktivität (1)
 3) Natürliche und künstliche Radioaktivität (1) Kosmische Strahlung - Protonen (93 %) - Alpha-Teilchen (6.3 %) - schwerere Kerne (0. %) - Ohne Zerfallsreihen - 0 radioaktive Nuklide, die primordial auf
3) Natürliche und künstliche Radioaktivität (1) Kosmische Strahlung - Protonen (93 %) - Alpha-Teilchen (6.3 %) - schwerere Kerne (0. %) - Ohne Zerfallsreihen - 0 radioaktive Nuklide, die primordial auf
Das Periodensystem der Elemente
 Q34 LK Physik 17. November 2015 Aufbau Die ermittelten Zusammenhänge der Elektronenzustände in der Atomhülle sollen dazu dienen, den der Elemente zu verstehen. Dem liegen folgende Prinzipien zugrunde:
Q34 LK Physik 17. November 2015 Aufbau Die ermittelten Zusammenhänge der Elektronenzustände in der Atomhülle sollen dazu dienen, den der Elemente zu verstehen. Dem liegen folgende Prinzipien zugrunde:
Dieter Suter Physik B3
 Dieter Suter - 426 - Physik B3 9.3 Kernenergie Kernenergie ist eine interessante Möglichkeit, nutzbare Energie zu gewinnen. Das kann man sehen wenn man vergleicht, wie viel Energie in 1 kg unterschiedlicher
Dieter Suter - 426 - Physik B3 9.3 Kernenergie Kernenergie ist eine interessante Möglichkeit, nutzbare Energie zu gewinnen. Das kann man sehen wenn man vergleicht, wie viel Energie in 1 kg unterschiedlicher
Kernreaktionen chemisch beschrieben
 Physics Meets Chemistry Kernreaktionen chemisch beschrieben 1 Kernreaktionen chemisch beschrieben 1. Ausgangslage 2. Ziele 3. Unterrichtsvorschlag mit Übungen Physics Meets Chemistry Kernreaktionen chemisch
Physics Meets Chemistry Kernreaktionen chemisch beschrieben 1 Kernreaktionen chemisch beschrieben 1. Ausgangslage 2. Ziele 3. Unterrichtsvorschlag mit Übungen Physics Meets Chemistry Kernreaktionen chemisch
Kann-Liste. Jahrgangsstufe 9 Physik. TNW =Tätigkeitsnachweis Tax = x/xx/xxx/xxxx. Name:
 Themenbereich 1: Magnetismus 1 die Stoffe, die ferromagnetisch sind, benennen und ihren Aufbau und Eigenschaften erläutern 2, was man unter einem magnetischen Feld versteht 3 Feldlinienbilder für unterschiedliche
Themenbereich 1: Magnetismus 1 die Stoffe, die ferromagnetisch sind, benennen und ihren Aufbau und Eigenschaften erläutern 2, was man unter einem magnetischen Feld versteht 3 Feldlinienbilder für unterschiedliche
3 SPF Bio/Che Name: r A. ρ g/cm 3
 3 SPF Bio/Che Name: 1. Radioaktivität und Kernreaktionen 1.1 Atomkerne und chemische Reaktionen Atomkerne sind ca. 100'000 mal kleiner als der Atomdurchmesser aber sie enthalten fast die gesamte Masse
3 SPF Bio/Che Name: 1. Radioaktivität und Kernreaktionen 1.1 Atomkerne und chemische Reaktionen Atomkerne sind ca. 100'000 mal kleiner als der Atomdurchmesser aber sie enthalten fast die gesamte Masse
Grundwissen Atome und radioaktiver Zerfall
 Atome, Radioaktivität und radioaktive Abfälle Arbeitsblatt 6 1 Grundwissen Atome und radioaktiver Zerfall Repetition zum Atombau Die Anzahl der... geladenen Protonen bestimmt die chemischen Eigenschaften
Atome, Radioaktivität und radioaktive Abfälle Arbeitsblatt 6 1 Grundwissen Atome und radioaktiver Zerfall Repetition zum Atombau Die Anzahl der... geladenen Protonen bestimmt die chemischen Eigenschaften
Lösungen der Kontrollaufgaben
 Lösungen der Kontrollaufgaben Lösungen zu den Kontrollaufgaben 1.1 1.) 1000 2.) Glas und PVC ziehen einander an. - Begründung: Da offenbar Hartgummi und PVC gleichartig geladen sind (Abstossung), Glas
Lösungen der Kontrollaufgaben Lösungen zu den Kontrollaufgaben 1.1 1.) 1000 2.) Glas und PVC ziehen einander an. - Begründung: Da offenbar Hartgummi und PVC gleichartig geladen sind (Abstossung), Glas
Kapitel 3: Kernstruktur des Atoms. Kathodenstrahlrohr: 3.1 Durchgang von Elektronen durch Materie
 03. Kernstruktur Page 1 Kapitel 3: Kernstruktur des Atoms Kathodenstrahlrohr: 3.1 Durchgang von Elektronen durch Materie Elektronen erzeugt im Kathodenstrahlrohr wechselwirken mit Gasatomen im Rohr. Elektronen
03. Kernstruktur Page 1 Kapitel 3: Kernstruktur des Atoms Kathodenstrahlrohr: 3.1 Durchgang von Elektronen durch Materie Elektronen erzeugt im Kathodenstrahlrohr wechselwirken mit Gasatomen im Rohr. Elektronen
10.6. Röntgenstrahlung
 10.6. Röntgenstrahlung Am 8. November 1895 entdeckte Wilhelm Conrad Röntgen in Würzburg die Röntgenstrahlung. Seine Entdeckung zählt zu den wohl bedeutendsten Entdeckungen in der Menschheitsgeschichte.
10.6. Röntgenstrahlung Am 8. November 1895 entdeckte Wilhelm Conrad Röntgen in Würzburg die Röntgenstrahlung. Seine Entdeckung zählt zu den wohl bedeutendsten Entdeckungen in der Menschheitsgeschichte.
Radioaktivität. Entdeckung:
 Kernstrahlung Entdeckung: 1896 entdeckte der französische Physiker Henri Becquerel eine von Uransalzen ausgehende unbekannte Strahlung, die eine Fotoplatte belichtete. Radioaktivität Die beiden französischen
Kernstrahlung Entdeckung: 1896 entdeckte der französische Physiker Henri Becquerel eine von Uransalzen ausgehende unbekannte Strahlung, die eine Fotoplatte belichtete. Radioaktivität Die beiden französischen
Übungsaufgaben zum Atomaufbau und Periodensystem mit Lösungen
 Allgemeine und Anorganische Chemie Übungsaufgaben zum Atomaufbau und Periodensystem mit Lösungen Aufgabe 1: Welche der folgenden Aussagen trifft für alle Atome, einschließlich des Wasserstoffatoms, zu?
Allgemeine und Anorganische Chemie Übungsaufgaben zum Atomaufbau und Periodensystem mit Lösungen Aufgabe 1: Welche der folgenden Aussagen trifft für alle Atome, einschließlich des Wasserstoffatoms, zu?
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Kernmodell der Quantenphysik
 Kernmodell der Quantenphysik M. Jakob Gymnasium Pegnitz 10. Dezember 2014 Inhaltsverzeichnis 1 Atomkerne 2 Potentialtopfmodell In diesem Abschnitt 1 Atomkerne 1.1 Aufbau 1.2 Starke Wechselwirkungen 2 Potentialtopfmodell
Kernmodell der Quantenphysik M. Jakob Gymnasium Pegnitz 10. Dezember 2014 Inhaltsverzeichnis 1 Atomkerne 2 Potentialtopfmodell In diesem Abschnitt 1 Atomkerne 1.1 Aufbau 1.2 Starke Wechselwirkungen 2 Potentialtopfmodell
Musterlösung Übung 5
 Musterlösung Übung 5 Aufgabe 1: Elektromagnetische Wellen und die Wellengleichung a) Da das Magnetfeld B senkrecht zum elektrischen Feld E und senkrecht zum Wellenvektor k steht ( k E B), zeigt das Magnetfeld
Musterlösung Übung 5 Aufgabe 1: Elektromagnetische Wellen und die Wellengleichung a) Da das Magnetfeld B senkrecht zum elektrischen Feld E und senkrecht zum Wellenvektor k steht ( k E B), zeigt das Magnetfeld
Kernmodell der Quantenphysik
 M. Jakob Gymnasium Pegnitz 10. Dezember 2014 Inhaltsverzeichnis In diesem Abschnitt 1.1 Aufbau 1.2 Starke Wechselwirkungen Aufbau Tröpfchenmodell Atomkerns Wesentliche Eigenschaften von n können im Tröpfchenmodell
M. Jakob Gymnasium Pegnitz 10. Dezember 2014 Inhaltsverzeichnis In diesem Abschnitt 1.1 Aufbau 1.2 Starke Wechselwirkungen Aufbau Tröpfchenmodell Atomkerns Wesentliche Eigenschaften von n können im Tröpfchenmodell
Kernchemie und Kernreaktionen
 Kernchemie und Kernreaktionen Die Kernchemie befaßt sich mit der Herstellung, Analyse und chemische Abtrennung von Radionukliden. Weiterhin werden ihre Methoden in der Umweltanalytik verwendet. Radioaktive
Kernchemie und Kernreaktionen Die Kernchemie befaßt sich mit der Herstellung, Analyse und chemische Abtrennung von Radionukliden. Weiterhin werden ihre Methoden in der Umweltanalytik verwendet. Radioaktive
Physik am Samstagmorgen 19. November Radioaktivität. Ein unbestechlicher Zeitzeuge. Christiane Rhodius
 Physik am Samstagmorgen 19. November 2005 Radioaktivität Ein unbestechlicher Zeitzeuge Christiane Rhodius Archäochronometrie Warum und wie datieren wir? Ereignisse innerhalb der menschlichen Kulturentwicklung
Physik am Samstagmorgen 19. November 2005 Radioaktivität Ein unbestechlicher Zeitzeuge Christiane Rhodius Archäochronometrie Warum und wie datieren wir? Ereignisse innerhalb der menschlichen Kulturentwicklung
Klausurinformation. Sie dürfen nicht verwenden: Handy, Palm, Laptop u.ae. Weisses Papier, Stifte etc. Proviant, aber keine heiße Suppe u.dgl.
 Klausurinformation Zeit: Mittwoch, 3.Februar, 12:00, Dauer :90 Minuten Ort: Veterinärmediziner: Großer Phys. Hörsaal ( = Hörsaal der Vorlesung) Geowissenschaftler u.a.: Raum A140, Hauptgebäude 1. Stock,
Klausurinformation Zeit: Mittwoch, 3.Februar, 12:00, Dauer :90 Minuten Ort: Veterinärmediziner: Großer Phys. Hörsaal ( = Hörsaal der Vorlesung) Geowissenschaftler u.a.: Raum A140, Hauptgebäude 1. Stock,
Physik-Vorlesung. Radioaktivität.
 3 Physik-Vorlesung. Radioaktivität. SS 16 2. Sem. B.Sc. Oec. und B.Sc. CH 5 Themen Aufbau der Atomkerns Isotope Zerfallsarten Messgrößen Strahlenschutz 6 Was ist Radioaktivität? Radioaktivität = Umwandlungsprozesse
3 Physik-Vorlesung. Radioaktivität. SS 16 2. Sem. B.Sc. Oec. und B.Sc. CH 5 Themen Aufbau der Atomkerns Isotope Zerfallsarten Messgrößen Strahlenschutz 6 Was ist Radioaktivität? Radioaktivität = Umwandlungsprozesse
Stoffmenge. Isotope Radioaktivität. Aufgabe 1-1: Welche Aussagen zum Atomaufbau treffen zu bzw. sind falsch?
 Zusammenfassung Atome bestehen aus Protonen (p + ), Elektronen (e - ) und Neutronen (n) Elemente sind durch ihre Ordnungszahl und Massezahl definiert Stoffmenge n ist ein Maß für die Teilchenanzahl (Atome,
Zusammenfassung Atome bestehen aus Protonen (p + ), Elektronen (e - ) und Neutronen (n) Elemente sind durch ihre Ordnungszahl und Massezahl definiert Stoffmenge n ist ein Maß für die Teilchenanzahl (Atome,
Bundesrealgymnasium Imst. Chemie Klasse 4. Aufbauprinzipien der Materie Periodensystem de Elemente
 Bundesrealgymnasium Imst Chemie 2010-11 Periodensystem de Elemente Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff
Bundesrealgymnasium Imst Chemie 2010-11 Periodensystem de Elemente Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff
Basiskenntnistest - Chemie
 Basiskenntnistest - Chemie 1.) Welche Aussage trifft auf Alkohole zu? a. ) Die funktionelle Gruppe der Alkohole ist die Hydroxygruppe. b. ) Alle Alkohole sind ungiftig. c. ) Mehrwertige Alkohole werden
Basiskenntnistest - Chemie 1.) Welche Aussage trifft auf Alkohole zu? a. ) Die funktionelle Gruppe der Alkohole ist die Hydroxygruppe. b. ) Alle Alkohole sind ungiftig. c. ) Mehrwertige Alkohole werden
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde. Sommersemester VL #47 am
 Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 007 VL #47 am 0.07.007 Vladimir Dyakonov Kernphysik 1 Zusammensetzung von Kernen Atomkerne bestehen
Einführung in die Physik II für Studierende der Naturwissenschaften und Zahnheilkunde Sommersemester 007 VL #47 am 0.07.007 Vladimir Dyakonov Kernphysik 1 Zusammensetzung von Kernen Atomkerne bestehen
Feldbegriff und Feldlinienbilder. Elektrisches Feld. Magnetisches Feld. Kraft auf Ladungsträger im elektrischen Feld
 Feldbegriff und Feldlinienbilder Elektrisches Feld Als Feld bezeichnet man den Bereich um einen Körper, in dem ohne Berührung eine Kraft wirkt beim elektrischen Feld wirkt die elektrische Kraft. Ein Feld
Feldbegriff und Feldlinienbilder Elektrisches Feld Als Feld bezeichnet man den Bereich um einen Körper, in dem ohne Berührung eine Kraft wirkt beim elektrischen Feld wirkt die elektrische Kraft. Ein Feld
Klausur 3 Kurs 12Ph1e Physik
 0-03-07 Klausur 3 Kurs Phe Physik Name: Rohpunkte : / Bewertung : Punkte ( ) Erläutern Sie jeweils, woraus α-, β- und γ-strahlen bestehen und geben Sie jeweils mindestens eine Methode an, wie man sie identifizieren
0-03-07 Klausur 3 Kurs Phe Physik Name: Rohpunkte : / Bewertung : Punkte ( ) Erläutern Sie jeweils, woraus α-, β- und γ-strahlen bestehen und geben Sie jeweils mindestens eine Methode an, wie man sie identifizieren
