ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
|
|
|
- Mareke Bach
- vor 6 Jahren
- Abrufe
Transkript
1 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Fortum 1 g Pulver zur Herstellung einer Injektionslösung Fortum 2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Fortum 1g Jede Durchstechflasche enthält 1g Ceftazidim (als Pentahydrat) mit Natriumcarbonat (118 mg pro Gramm Ceftazidim) Sonstiger Bestandteil mit bekannter Wirkung: Jede Durchstechflasche enthält 52 mg (2,3 mmol) Natrium pro Flasche. Fortum 2g Jede Durchstechflasche enthält 2 g Ceftazidim (als Pentahydrat) mit Natriumcarbonat (118 mg pro Gramm Ceftazidim) Sonstiger Bestandteil mit bekannter Wirkung: Jede Durchstechflasche enthält 104 mg (4,6 mmol) Natrium pro Flasche. Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt DARREICHUNGSFORM 1 g Pulver zur Herstellung einer Injektionslösung: Pulver zur Herstellung einer Injektionslösung Durchstechflaschen mit weißem bis cremefarbenem sterilem Pulver 2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung: Pulver zur Herstellung einer Injektions- oder Infusionslösung Durchstechflaschen mit weißem bis cremefarbenem sterilem Pulver 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Fortum wird angewendet bei Erwachsenen und Kindern inklusive Neugeborenen (von Geburt an), bei Infektionen, die untenstehend aufgelistet sind. Nosokomiale Pneumonie Broncho-pulmonale Infektionen bei zystischer Fibrose Bakterielle Meningitis Chronische Otitis media perforata simplex Maligne Otitis externa Komplizierte Harnwegsinfektionen Komplizierte Haut- und Weichteilinfektionen Komplizierte intraabdominale Infektionen Knochen- und Gelenksinfektionen
2 Peritonitis assoziiert mit Dialyse bei CAPD-Patienten Behandlung von Patienten mit Bakteriämie im Zusammenhang oder bei vermutetem Zusammenhang mit einer der oben angeführten Infektionen. Ceftazidim kann zur Behandlung von neutropenischen Patienten mit Fieber, aufgrund einer vermuteten bakteriellen Infektion, eingesetzt werden. Ceftazidim kann als peri-operative Prophylaxe für Harnwegsinfekte bei Patienten, die sich einer transurethralen Resektion der Prostata (TURP) unterziehen, verwendet werden. Bei der Wahl von Ceftazidim sollte sein antibakterielles Spektrum berücksichtigt werden, welches hauptsächlich auf aerobe Gram-negative Bakterien limitiert ist (siehe Abschnitt 4.4 und 5.1). Ceftazidim sollte gemeinsam mit anderen antibakteriellen Substanzen angewendet werden, wenn die mögliche Bandbreite der verursachenden Bakterien nicht vom Wirkspektrum von Ceftazidim abgedeckt wird. Offizielle Richtlinien zum angemessenem Gebrauch von antibakteriellen Arzneimitteln sollten berücksichtigt werden. 4.2 Dosierung, Art und Dauer der Anwendung Dosierung Tabelle 1: Erwachsene und Kinder 40 kg Intermittierende Verabreichung Infektion Broncho-pulmonale Infektionen bei zystischer Fibrose Febrile Neutropenie Nosokomiale Pneumonie Bakterielle Meningitis Bakteriämie * Knochen- und Gelenksinfektionen Komplizierte Haut- und Weichteilinfektionen Komplizierte intraabdominale Infektionen Peritonitits assoziiert mit einer Dialyse bei Patienten mit CAPD Komplizierte Harnwegsinfektionen perioperative Prophylaxe bei transuretheraler Prostata Resektion (TURP) Chronische Otitis media perforata simplex Maligne Otitis externa Kontinuierliche Infusion Infektion Febrile Neutropenie Nosokomiale Pneumonie Broncho-pulmonale Infektionen bei zystischer Fibrose Bakterielle Meningitis Bakteriämie* Knochen- und Gelenksinfektionen Zu verabreichende Dosis mg/kg/tag alle 8h, Maximum 9 g pro Tag 1 2 g alle 8 h 1-2 g alle 8 h 1-2 g alle 8 h oder 12 h 1 g beim Start der Anästhesie und eine zweite Dosis beim Entfernen des Katheters 1 g - 2 g alle 8 h Zu verabreichende Dosis Startdosis von 2 g gefolgt von einer kontinuierlichen Infusion von 4 bis 6 g alle 24 h 1
3 Komplizierte Haut- und Weichteilinfektionen Komplizierte intraabdominale Infektionen Peritonitis assoziiert mit Dialyse bei CAPD- Patienten 1 Erwachsene mit normaler Nierenfunktion haben 9 g/tag ohne Nebenwirkungen vertragen. * Im Zusammenhang mit einer im Abschnitt 4.1 angeführten Infektion oder bei Verdacht auf einen solchen Zusammenhang. Tabelle 2: Kinder < 40 kg Kinder und Kleinkinder > 2 Monate und Kinder < 40 kg Infektion Normale Dosierung Intermittierende Verabreichung Kontinuierliche Infusion Neugeborene und Kinder 2 Monate Intermittierende Verabreichung Komplizierte Harnwegsinfektionen Chronische Otitis media perforata simplex Maligne Otitis externa Neutropenische Kinder Broncho-pulmonale Infektionen bei zystischer Fibrose Bakterielle Meningitis Bakteriämie* Knochen- und Gelenksinfektionen Komplizierte Haut- und Weichteilinfektionen Komplizierte intraabdominale Infektionen Peritonitis assoziiert mit Dialyse bei CAPD-Patienten mg/kg/tag aufgeteilt auf 3 gleiche Dosen, Maximum 6 g/tag 150 mg/kg/tag aufgeteilt auf 3 gleiche Dosen, Maximum 6 g/tag mg/kg/tag aufgeteilt auf 3 gleiche Dosen, Maximum 6 g/tag Febrile Neutropenie Startdosis/Bolus von 60- Nosokomiale Pneumonie 100 mg/kg gefolgt von einer Broncho-pulmonale Infektionen kontinuierlichen Infusion von bei zystischer Fibrose mg/kg/tag, Maximum Bakterielle Meningitis 6 g/tag Bakteriämie * Knochen- und Gelenksinfektionen Komplizierte Haut- und Weichteilinfektionen Komplizierte intraabdominale Infektionen Peritonitis assoziiert mit Dialyse bei CAPD-Patienten Infektion Normale Dosierung Bei den meisten Infektionen mg/kg/tag aufgeteilt auf 2 gleiche Dosen 1 1 Bei Neugeborenen und Kindern 2 Monaten, kann die Serumhalbwertszeit von Ceftazidim drei bis viermal so hoch sein wie bei Erwachsenen.
4 * Im Zusammenhang mit einer im Abschnitt 4.1 angeführten Infektion oder bei Verdacht auf einen solchen Zusammenhang. Kinder Die Sicherheit und Wirksamkeit von Fortum, verabreicht als kontinuierliche Infusion, wurde für Neugeborene und Kinder 2 Monate nicht bewiesen. Ältere Patienten Im Hinblick auf die altersbedingte verringerte Clearance von Ceftazidim bei älteren Patienten sollte die tägliche Dosis bei Patienten über 80 Jahren normalerweise 3 g nicht überschreiten. Patienten mit eingeschränkter Leberfunktion Die vorliegenden Daten weisen nicht auf die Notwendigkeit einer Dosisanpassung bei schwach oder moderat eingeschränkter Leberfunktion hin. Es gibt keine Studiendaten an Patienten mit stark eingeschränkter Leberfunktion (siehe auch Abschnitt 5.2). Eine engmaschige klinische Überwachung zur Sicherheit und Wirksamkeit ist anzuraten. Patienten mit eingeschränkter Nierenfunktion Ceftazidim wird von den Nieren unverändert ausgeschieden. Daher sollte die Dosis bei Patienten mit eingeschränkter Nierenfunktion reduziert werden (siehe auch Abschnitt 4.4). Eine Initialdosis von 1 g sollte verabreicht werden. Die Erhaltungsdosis sollte auf Basis der Kreatinin- Clearance berechnet werden: Tabelle 3: Empfohlene Erhaltungsdosis von Fortum bei Patienten mit eingeschränkter Nierenfunktion intermittierende Infusion Erwachsene und Kinder 40 kg Kreatinin-Clearance (ml/min) < 5 Ungefähres Serum- Kreatinin µmol/l (mg/dl) (1,7-2,3) (2,3-4,0) (4,0-5,6) > 500 (> 5,6) Empfohlene Einzeldosis von Fortum (g) Dosierungsfrequenz (stündlich) ,5 24 0,5 48 Bei Patienten mit schweren Infektionen sollte die Dosis um 50 % erhöht oder die Dosierungsfrequenz erhöht werden. Bei Kindern sollte die Kreatinin-Clearance an die Körperoberfläche oder fettfreie Körpermasse angepasst werden. Kinder < 40 kg Kreatinin-Clearance (ml/min)** Ungefähres Serum- Kreatinin* µmol/l (mg/dl) (1,7-2,3) Empfohlene individuelle Dosis mg/kg Körpergewicht Dosierungsfrequenz (stündlich) 25 12
5 (2,3-4,0) (4,0-5,6) 12,5 24 < 5 > 500 (> 5,6) 12,5 48 * Die Serum-Kreatinin-Werte sind Richtwerte, welche möglicherweise nicht genau das gleiche Ausmaß von Einschränkung für alle Patienten mit eingeschränkter Nierenfunktion anzeigen. ** Geschätzt aufgrund der Körperoberfläche, oder gemessen Eine engmaschige klinische Überwachung zur Sicherheit und Wirksamkeit ist anzuraten. Tabelle 4: Empfohlene Erhaltungsdosis von Fortum bei Patienten mit eingeschränkter Nierenfunktion kontinuierliche Infusion Erwachsene und Kinder 40 kg Kreatinin-Clearance (ml/min) Ungefähres Serum-Kreatinin µmol/l (mg/dl) (1,7-2,3) (2,3-4,0) >350 (>4.0) Dosierungsfrequenz (stündlich) Startdosis von 2 g gefolgt von 1 g bis 3 g / 24 h Startdosis von 2 g gefolgt von 1 g / 24 h Nicht untersucht Bei der Dosiswahl ist Vorsicht angebracht. Eine engmaschige klinische Überwachung zur Sicherheit und Wirksamkeit ist anzuraten. Kinder < 40 kg Die Sicherheit und Effektivität von Fortum, verabreicht als kontinuierliche Infusion, wurde bei Kindern < 40 kg mit eingeschränkter Nierenfunktion nicht bewiesen. Eine engmaschige klinische Überwachung zur Sicherheit und Wirksamkeit ist anzuraten. Bei Anwendung von Dauerinfusionen bei Kindern mit eingeschränkter Nierenfunktion soll die Kreatinin-Clearance der Körperoberfläche oder der Magermasse angepasst werden Hämodialyse Die Serumhalbwertszeit während der Hämodialyse variiert von 3 bis 5 h. Nach jeder Hämodialyse sollte die Erhaltungsdosis von Ceftazidim, wie in Tabellen 5 & 6 empfohlen, erneut gegeben werden. Peritonealdialyse Ceftazidim kann während der Peritonealdialyse und während der kontinuierlichen ambulanten Peritonealdialyse verwendet werden (CAPD). Zusätzlich zur intravenösen Verabreichung kann Ceftazidim auch in die Dialyseflüssigkeit eingebracht werden (üblicherweise 125 bis 250 mg auf 2 Liter Dialyselösung). Bei Patienten mit Nierenversagen mit kontinuierlicher arteriovenöser Hämodialyse oder Hochfluss- Hämofiltration auf Intensivstationen: 1 g täglich entweder als Einzeldosis oder in aufgeteilten Dosen.
6 Bei Niedrigfluss-Hämofiltration folgen Sie der Dosisempfehlung für Patienten mit eingeschränkter Nierenfunktion. Bei Patienten mit venovenöser Hämofiltration and venovenöser Hämodialyse folgen Sie der Dosisempfehlung in der untenstehenden Tabellen 5 & 6. Tabelle 5: Dosierungsrichtlinie für kontinuierliche venovenöse Hämofiltration Verbleibende Nierenfunktion (Kreatinin- Clearance ml/min) Erhaltungsdosis (mg) bei einer Ultrafiltrationsrate (ml/min) von 1 : Erhaltungsdosis ist alle 12 h zu verabreichen. Tabelle 6: Dosierungsrichtlinie für kontinuierliche venovenöse Hämodialyse Verbleibende Erhaltungsdosis (mg) bei einem Dialysat Durchfluss von 1 : Nierenfunktion 1,0 Liter/Stunde 2,0 Liter/Stunde (Kreatinin Clearance Ultrafiltrationsrate (Liter/Stunde) Ultrafiltrationsrate (Liter/Stunde) ml/min) 0,5 1,0 2,0 0,5 1,0 2, Erhaltungsdosis ist alle 12 h zu verabreichen. Art der Anwendung Die Dosis hängt ab von Schwere, Empfindlichkeit, Ort und Typ der Infektion sowie vom Alter und der Nierenfunktion des Patienten. Fortum 1g sollte mittels intravenöser Injektion oder Infusion, oder durch tiefe intramuskuläre Injektion verabreicht werden. Empfohlene intramuskuläre Injektionsstellen sind der obere äußere Quadrant des Gluteus maximus oder der laterale Teil des Oberschenkels. Fortum Lösungen können direkt in die Vene verabreicht werden oder in den Schlauch des Infusionsbestecks eingebracht werden, wenn der Patient parenterale Flüssigkeiten erhält. Üblicherweise wird die intravenöse intermittierende Injektion oder intravenöse kontinuierliche Infusion als Anwendungsart empfohlen. Eine intramuskuläre Verabreichung sollte nur dann in Erwägung gezogen werden, wenn die intravenöse Verabreichung nicht möglich oder für den Patienten weniger geeignet ist. Fortum 2g sollte mittels intravenöser Injektion oder Infusion verabreicht werden. Fortum Lösungen können direkt in die Vene verabreicht oder in den Schlauch des Infusionsbestecks eingebracht werden, wenn der Patient parenterale Flüssigkeiten erhält. Üblicherweise wird die intravenöse Verabreichung, intermittierende Injektion oder kontinuierliche Infusion als Anwendungsart empfohlen.
7 4.3 Gegenanzeigen Überempfindlichkeit gegen Ceftazidim, andere Cephalosporine oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. Schwere Überempfindlichkeit (z. B. anaphylaktische Reaktion) gegen andere Beta-Lactam- Antibiotika (Penicilline, Monobactame und Carbapeneme) in der Anamnese. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Hypersensitivität Wie bei allen Beta-Lactam-Antibiotika wurden schwere und gelegentlich tödliche Überempfindlichkeitsreaktionen berichtet. Im Falle einer schweren Überempfindlichkeitsreaktion muss die Behandlung mit Ceftazidim sofort abgebrochen werden und angemessene Notfallsmaßnahmen müssen eingeleitet werden. Vor Beginn der Behandlung sollte festgestellt werden, ob der Patient in seiner Vorgeschichte bereits schwere Überempfindlichkeitsreaktionen, hervorgerufen durch Ceftazidim, durch andere Cephalosporine oder durch andere Typen von Beta-Lactam-Antibiotika hatte. Vorsicht ist geboten, wenn Ceftazidim Patienten mit leichten Überempfindlichkeitsreaktionen gegen andere Beta-Lactam-Antibiotika in der Vorgeschichte verabreicht wird. Aktivitätsspektrum Ceftazidim hat ein eingeschränktes antibakterielles Spektrum. Es ist zur alleinigen Behandlung mancher Infektionsarten nicht geeignet, außer der Erreger ist bereits dokumentiert und als empfindlich bekannt, oder es besteht ein sehr großer Verdacht, dass die wahrscheinlichsten Erreger für die Behandlung mit Ceftazidim geeignet sind. Dies trifft insbesondere bei Erwägungen zur Behandlung von Patienten mit Bakteriämie und zur Behandlung der bakteriellen Meningitis, Hautund Weichteilinfektionen sowie Knochen- und Gelenksinfektionen zu. Zusätzlich ist Ceftazidim empfindlich auf Hydrolyse durch einige der erweiterten Spektren von Beta-Lactamasen (ESBLs). Deshalb sollte die Information über die Prävalenz von ESBL produzierenden Organismen berücksichtigt werden, wenn Ceftazidim zur Behandlung ausgesucht wird. Pseudomembranöse Colitis Antibiotika-assoziierte Colitis und pseudomembranöse Colitis wurden bei fast allen Antibiotika berichtet, einschließlich Ceftazidim. Diese können in ihrer Ausprägung von mild bis lebensbedrohlich schwanken. Dies ist zu bedenken bei Patienten, die an einer Diarrhö während oder anschließend an die Behandlung mit Ceftazidim leiden (siehe Abschnitt 4.8). Der Abbruch der Behandlung mit Ceftazidim und eine spezifische Behandlung gegen Clostridium difficile sollten erwogen werden. Arzneimittel, die die Peristaltik hemmen, sollten nicht angewendet werden. Nierenfunktion Gleichzeitige Behandlung mit hohen Dosen Cephalosporin und nephrotoxischen Arzneimitteln wie Aminoglykosiden oder wirksamen Diuretika (z. B. Furosemid) kann die Nierenfunktion ungünstig beeinflussen. Ceftazidim wird über die Nieren ausgeschieden, daher sollte die Dosis entsprechend der Einschränkung der Nierenfunktion reduziert werden. Patienten mit eingeschränkter Nierenfunktion sollten zur Sicherheit und Wirksamkeit engmaschiger kontrolliert werden. Neurologische Folgen wurden gelegentlich berichtet, wenn die Dosis bei Patienten mit eingeschränkter Nierenfunktion nicht reduziert wurde (siehe Abschnitte 4.2 und 4.8). Vermehrtes Wachstum von nichtempfindlichen Keimen Längere Anwendung kann zu vermehrtem Wachstum von nichtempfindlichen Keimen (z. B. Enterokokken, Pilze) führen, was eine Unterbrechung der Behandlung oder andere angemessene Maßnahmen erfordern kann. Wiederholte Überprüfung des Zustandes des Patienten ist wichtig.
8 Wechselwirkungen bei Tests und Analysen Ceftazidim beeinflusst Enzym-basierte Tests für Glykosurie nicht, aber eine leichte Beeinflussung (falsch-positiv) der Kupfer-Reduktionsmethode (Benedict, Fehling, Clinitest) kann vorkommen. Ceftazidim beeinflusst den alkalischen Pikrat-Test für Kreatinin nicht. Bei ungefähr 5% der Patienten fällt durch die Behandlung mit Ceftazidim der Coombs-Test positiv aus, was die Blut-Kreuzprobe beeinträchtigen kann. Natriumgehalt Wichtige Information über einen Bestandteil von Fortum: 1 g Pulver zur Herstellung einer Injektionslösung Fortum 1 g enthält 52 mg (2,3 mmol) Natrium pro Durchstechflasche 2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung Fortum 2 g enthält 104 mg (4,6 mmol) Natrium pro Durchstechflasche Dies sollte bei Patienten berücksichtigt werden, die eine natriumarme Diät einhalten. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Wechselwirkungsstudien wurden nur mit Probenecid und Furosemid durchgeführt. Gleichzeitige Anwendung hoher Ceftazidim-Dosen mit nephrotoxischen Arzneimitteln kann die Nierenfunktion ungünstig beeinflussen (siehe Abschnitt 4.4). Chloramphenicol wirkt in vitro als Antagonist von Ceftazidim und anderen Cephalosporinen. Die klinische Bedeutung ist unbekannt, aber bei gleichzeitiger Anwendung von Ceftazidim und Chloramphenicol sollte die Möglichkeit des Antagonismus bedacht werden. 4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft Die Daten zur Anwendung von Ceftazidim bei schwangeren Frauen sind begrenzt. Tierstudien haben keine direkten oder indirekten schädlichen Wirkungen auf Schwangerschaft, embryonale/fötale Entwicklung, Geburtsvorgang oder postnatale Entwicklung gezeigt (siehe Abschnitt 5.3). Fortum sollte schwangeren Frauen nur verschrieben werden, wenn der Nutzen das Risiko überwiegt. Stillzeit Ceftazidim wird in geringen Mengen in die Muttermilch ausgeschieden, jedoch sind bei therapeutischen Ceftazidim-Dosen keine Auswirkungen auf gestillte Kinder zu erwarten. Ceftazidim kann während der Stillzeit angewendet werden. Fertilität Es liegen keine Daten vor. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Es wurden keine Studien durchgeführt, um die Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen zu untersuchen. Allerdings können unerwünschte Effekte (z. B. Schwindelgefühl) auftreten, die die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinflussen (siehe Abschnitt 4.8).
9 4.8 Nebenwirkungen Die häufigsten Nebenwirkungen sind Eosinophilie, Thrombozytose, Phlebitis oder Thrombophlebitis bei intravenöseranwendung, Diarrhö, vorübergehender Anstieg von Leberenzymen, makulopapulöser oder urtikarieller Ausschlag, Schmerz und/oder Entzündung nach intramuskulärer Injektion und positiver Coombs Test. Es wurden Daten von gesponserten und nicht gesponserten klinischen Studien verwendet, um die Häufigkeiten für häufige und gelegentliche Nebenwirkungen zu bestimmen. Die Häufigkeiten aller anderen Nebenwirkungen wurden hauptsächlich mittels post-marketing-daten bestimmt, diese beziehen sich eher auf eine Berichterstattungsrate als auf eine wahre Häufigkeit. Innerhalb jeder Häufigkeitsgruppierung werden Nebenwirkungen in abnehmender Schwere aufgelistet. Die folgende Einteilung wurde zur Klassifizierung der Häufigkeiten verwendet: Sehr häufig (1/10) Häufig (1/100, <1/10) Gelegentlich (1/1.000, <1/100) Selten (1/10.000, <1/1.000) Sehr selten (<1/10.000) Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) Systemorganklasse Häufig Gelegentlich Sehr selten Nicht bekannt Infektionen und parasitäre Erkrankungen Erkrankungen des Blutes und des Lymphsystems Erkrankungen des Immunsystems Erkrankungen des Nervensystems Gefäßerkrankungen Erkrankungen des Gastrointestinaltrakts Leber- und Gallenerkrankungen Eosinophilie Thrombozytose Phlebitis oder Thrombophlebitis bei intravenöser Anwendung Diarrhö Vorübergehender Anstieg eines oder mehrerer Leberenzyme 3 Candidiasis (einschließlich Vaginitis und orale Candidose) Neutropenie Leukopenie Thrombozytopenie Kopfschmerzen Schwindel Antibiotikaassoziierte Diarrhö und Colitis 2 (siehe Abschnitt 4.4) Abdominale Schmerzen Übelkeit Erbrechen Agranulozytose Hämolytische Anämie Lymphozytose Anaphylaxie (einschließlich Bronchospasmus und/oder Hypotonie) (siehe Abschnitt 4.4) Neurologische Folgeerscheinungen 1 Parästhesie Geschmacksstörung Ikterus
10 Erkrankungen der Haut und des Unterhautzellgewebes Erkrankungen der Nieren und Harnwege Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Untersuchungen Makulopapulöser oder urtikarieller Ausschlag Schmerz und/oder Entzündung nach intramuskulärer Injektion Positiver Coombs Test 5 Pruritus Vorübergehende Erhöhung des Blutharnstoffes, des Blut-Harnstoff- Stickstoffes und/oder des Serum Kreatinins Fieber Interstitielle Nephritis Akutes Nierenversagen Toxische epidermale Nekrolyse Stevens-Johnson- Syndrom Erythema Multiforme Angioödem Arzneimittelexanthe m mit Eosinophilie und systemischen Symptomen (DRESS, Drug Reaction with Eosinophilia and Systemic Symptoms) 4 1 Es gab Berichte von neurologischen Folgeerscheinungen einschließlich Zittern, Myoklonie, Krämpfen, Enzephalopathie und Koma bei Patienten mit eingeschränkter Nierenfunktion, bei denen die Dosis von Fortum nicht angemessen reduziert wurde. 2 Diarrhö und Colitis können mit Clostridium difficile und einer pseudomembranösen Colitis in Zusammenhang stehen. 3 ALT (SGPT), AST (SOGT), LDH, GGT, alkalische Phosphatase. 4 Es gab seltene Berichte über einen Zusammenhang von DRESS mit Ceftazidim. 5 Ein positiver Coombs Test entwickelt sich in ca. 5 % der Patienten und kann die Blut-Kreuzprobe beeinflussen. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem anzuzeigen: Bundesamt für Sicherheit im Gesundheitswesen Traisengasse WIEN ÖSTERREICH Fax: + 43 (0) Website: Überdosierung Überdosierung kann zu neurologischen Folgen führen einschließlich Enzephalopathie, Krämpfen und Koma.
11 Überdosierungs-Symptome können auftreten, wenn bei Patienten mit eingeschränkter Nierenfunktion die Dosis nicht angemessen reduziert wird (siehe Abschnitte 4.2 und 4.4). Der Ceftazidim Serum-Spiegel kann mittels Hämodialyse oder Peritonealdialyse reduziert werden. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Antibiotika zur systemischen Anwendung. Cephalosporine der dritten Generation, ATC-Code: J01DD02. Wirkmechanismus Ceftazidim inhibiert die bakterielle Zellwand-Synthese durch Bindung an Penicillin-Bindeproteine (PBPs). Dadurch wird die Biosynthese der Zellwand (Peptidoglycan) unterbrochen, was zur bakteriellen Zelllyse und zum Tod der Bakterien führt. Pharmakokinetische/Pharmakodynamische Beziehung Für Cephalosporine wurde gezeigt, dass der wichtigste pharmakokinetisch-pharmkodynamische Index im Zusammenhang mit der in vivo Wirksamkeit der prozentuale Zeitanteil innerhalb eines Dosierungsintervalls ist, in der die Konzentration an ungebundenem Ceftazidim über der minimalen Hemmkonzentration (MIC) für einzelne Zielarten liegt (z. B. % T > MIC). Resistenzmechanismus Bakterielle Resistenz gegen Ceftazidim kann auf einem oder mehreren der folgenden Mechanismen beruhen: Hydrolyse durch Beta-Lactamasen. Ceftazidim kann wirksam durch ein erweitertes Spektrum an Beta-Lactamasen (ESBLs) hydrolysiert werden, einschließlich der SHV Familie von ESBL und AmpC-Enzymen, die bei einigen aeroben Gram-negativen Bakterienarten konstitutiv vorhanden (dereprimiert) sind oder induziert werden können. reduzierte Affinität von Penicillin-Bindeproteinen zu Ceftazidim Undurchdringlichkeit der äußeren Membran, wodurch in Gram-negativen Organismen die Erreichbarkeit der Penicillin-Bindeproteine für Ceftazidim eingeschränkt wird. bakterielle Efflux-Pumpen. Grenzwerte Folgende Minimale Hemmkonzentrationen (MIC) wurden vom European Committee on Antibicrobial Susceptibility Testing (EUCAST) ermittelt: Organismus Grenzwerte (mg/l) S I R Enterobacteriaceae > 4 Pseudomonas aeruginosa > 8 Nicht Spezies bezogene Grenzwerte > 8 S = sensibel, I = intermediär, R = resistent. 1 Die Grenzwerte beziehen sich auf die Hochdosistherapie (2 g dreimal täglich). 2 Nicht-Spezies bezogene Grenzwerte wurden hauptsächlich auf Basis von PK/PD Daten bestimmt und sind unabhängig von der MIC Verteilung spezieller Spezies. Sie sind nur bei Spezies, die nicht in der Tabelle oder in den Fußnoten angeführt sind, zu verwenden.
12 Mikrobiologische Empfindlichkeiten Die Verbreitung erworbener Resistenzen einzelner Arten kann geografisch und zeitlich variieren. Lokale Information zu Resistenzen ist erwünscht, besonders bei der Behandlung schwerer Infektionen. Bei Bedarf sollte der Rat eines Experten gesucht werden, wenn die lokale Verbreitung von Resistenzen den Nutzen von Ceftazidim bei zumindest einigen Infektionsarten in Frage stellt. Üblicherweise empfindliche Arten Gram-positive Aerobe: Streptococcus pyogenes Streptococcus agalactiae Gram-negative Aerobe: Citrobacter koseri Haemophilus influenzae Moraxella catarrhalis Neisseria meningitidis Pasteurella multocida Proteus mirabilis Proteus spp. (andere) Providencia spp. Arten bei denen erworbene Resistenzen problematisch sein können Gram-negative Aerobe: Acinetobacter baumannii + Burkholderia cepacia Citrobacter freundii Enterobacter aerogenes Enterobacter cloacae Escherichia coli Klebsiella pneumoniae Klebsiella spp. (andere) Pseudomonas aeruginosa Serratia spp. Morganella morganii Gram-positive Aerobe: Staphylococcus aureus Streptococcus pneumoniae Streptococcus viridans-gruppe Gram-positive Anaerobe: Clostridium perfringens Peptostreptococcus spp. Gram-negative Anaerobe: Fusobacterium spp. Von Natur aus resistente Organismen Gram-positive Aerobe: Enterococcus spp. einschließlich Enterococcus faecalis und Enterococcus faecium Listeria spp. Gram-positive Anaerobe: Clostridium difficile Gram-negative Anaerobe: Bacteroides spp. (viele Stämme von Bacteroides fragilis sind resistent). Andere: Chlamydia spp. Mycoplasma spp. Legionella spp. Für Methicillin-empfindliche S. aureus wird eine natürlich vorhandene geringe Empfindlichkeit gegenüber Ceftazidim angenommen. Alle Methicillin-resistenten S. aureus sind resistent gegenüber Ceftazidim.
13 Bei intermediär empfindlichen oder Penicillin-resistenten S. pneumoniae kann erwartet werden, dass zumindest eine reduzierte Empfindlichkeit gegenüber Ceftazidim besteht. + Hohe Resistenzraten wurden in einem oder mehreren Gebieten/Ländern/Regionen innerhalb der EU beobachtet. 5.2 Pharmakokinetische Eigenschaften Resorption Nach intramuskulärer Anwendung von 500 mg und 1 g Ceftazidim werden rasch Spitzen- Plasmaspiegel von 18 bzw. 37 mg/l erreicht. Fünf Minuten nach intravenöser Bolus-Injektion von 500 mg, 1 g oder 2 g sind die Plasmaspiegel bei 46, 87 bzw. 170 mg/l. Die Kinetik von Ceftazidim ist innerhalb des Einzeldosisbereiches von 0,5 bis 2 g nach intravenöser oder intramuskulärer Dosierung linear. Verteilung Die Serumprotein-Bindung von Ceftazidim ist gering und liegt bei etwa 10 %. Höhere Konzentrationen als die MIC für die gängigen Erreger kann in Geweben wie Knochen, Herz, Galle, Sputum, Kammerwasser, Synovia, Rippenfell- und Bauchfell-Flüssigkeit erreicht werden. Ceftazidim passiert schnell die Plazenta und wird in die Muttermilch ausgeschieden. Die Penetration durch die intakte Blut-Hirn-Schranke ist schwach, woraus bei Fehlen einer Entzündung ein niedriger Ceftazidim-Spiegel in der Cerebrospinal-Flüssigkeit resultiert. Wenn die Hirnhäute entzündet sind, werden Konzentrationen von 4 bis 20 mg/l oder mehr in der Cerebrospinal-Flüssigkeit erreicht. Biotransformation Ceftazidim wird nicht metabolisiert. Ausscheidung Nach parenteraler Anwendung sinken die Plasmaspiegel mit einer Halbwertszeit von ungefähr 2 h. Ceftazidim wird durch glomeruläre Filtration unverändert über den Urin ausgeschieden; ungefähr 80 bis 90 % der Dosis werden im Urin innerhalb von 24 h wiedergefunden. Weniger als 1 % wird über die Galle ausgeschieden. Besondere Patientengruppen Eingeschränkte Nierenfunktion Die Ausscheidung von Ceftazidim ist bei Patienten mit eingeschränkter Nierenfunktion verringert und die Dosis sollte reduziert werden (siehe Abschnitt 4.2). Eingeschränkte Leberfunktion Das Vorliegen einer schwachen bis moderaten Leber-Fehlfunktion hatte keinen Effekt auf die Pharmakokinetik von Ceftazidim bei einzelnen Personen, denen 2 g intravenös alle 8 h über 5 Tage verabreicht wurden, vorausgesetzt die Nierenfunktion war nicht beeinträchtigt (siehe Abschnitt 4.2). Ältere Patienten Die verringerte Clearance, die bei älteren Patienten beobachtet wurde, war primär mit einer altersbedingten Abnahme der renalen Clearance von Ceftazidim verbunden. Die mittlere Ausscheidungs-Halbwertszeit schwankte zwischen 3,5 und 4 h nach einer Einzelgabe oder wiederholter BID Dosierung über 7 Tage von 2 g IV Bolus Injektionen bei Patienten von 80 Jahren oder älter. Pädiatrische Patienten Die Halbwertszeit von Ceftazidim ist bei Frühgeburten und Neugeborenen nach Dosen von 25 bis 30 mg/kg auf 4,5 bis 7,5 h verlängert. Bei 2 Monate alten Kindern ist die Halbwertszeit allerdings innerhalb des Bereiches von Erwachsenen.
14 5.3 Präklinische Daten zur Sicherheit Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Reproduktionstoxizität und Genotoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. Studien zum kanzerogenen Potential wurden mit Ceftazidim nicht durchgeführt. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Natriumkarbonat (wasserfrei steril) 6.2 Inkompatibilitäten Fortum ist in einer Natriumbikarbonat-Injektion weniger stabil als in anderen intravenösen Flüssigkeiten. Daher wird es nicht als Lösungsmittel empfohlen. Fortum und Aminoglycoside dürfen nicht mit demselben Verabreichungsset oder derselben Spritze gemischt werden. Bei Hinzufügen von Vancomycin zu Ceftazidimlösungen wurde von Ausfällung berichtet. Deshalb wäre es sinnvoll, die Verabreichungsets und Infusionsschläuche zwischen der Verabreichung dieser beiden Agenzien zu spülen. 6.3 Dauer der Haltbarkeit 1g Pulver zur Herstellung einer Injektionslösung, 2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung: 3 Jahre Nach Rekonstitution: Die chemische und physikalische Stabilität der gebrauchsfertigen rekonstituierten Lösung wurde für 6 Tage bei 4 C und für 9 Stunden bei 25 C nachgewiesen. Aus mikrobiologischer Sicht sollte die rekonstituierte Lösung sofort verwendet werden. Bei nicht sofortiger Verwendung liegen die Aufbewahrungsdauer und bedingungen bis zum Gebrauch in der Verantwortung des Anwenders und sollten normalerweise 24 Stunden bei 2 C bis 8 C nicht überschreiten, außer die Rekonstitution hat unter kontrollierten und validierten aseptischen Bedingungen stattgefunden. Nach Verdünnung: Die chemische und physikalische Stabilität der gebrauchsfertigen verdünnten Lösung wurde für 6 Tage bei 4 C und für 9 Stunden bei 25 C nachgewiesen. Aus mikrobiologischer Sicht sollte die rekonstituierte und verdünnte Lösung sofort verwendet werden. Bei nicht sofortiger Verwendung liegen die Aufbewahrungsdauer und bedingungen bis zum Gebrauch in der Verantwortung des Anwenders und sollten normalerweise 24 Stunden bei 2 C bis 8 C nicht überschreiten, außer die Rekonstitution hat unter kontrollierten und validierten aseptischen Bedingungen stattgefunden. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 25 C lagern. Die Durchstechflasche im Außenkarton aufbewahren, um den Inhalt vor Licht zu schützen. Lagerungsbedingungen nach Rekonstitution siehe Abschnitt 6.3.
15 6.5 Art und Inhalt des Behältnisses 1g Pulver zur Herstellung einer Injektionslösung Fortum 1g Pulver zur Herstellung einer Injektionslösung ist in einer 17ml bzw. 26ml Durchstechflasche aus klarem Ph.Eur. Typ III Glas mit einem Bromobutyl-Gummistopfen und einer Aluminiumkappe mit Abrisseinsatz verpackt. Packungen zu 1, 5, 10, 50 oder 100 Durchstechflaschen. 2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung Fortum 2g Pulver zur Herstellung einer Injektions- oder Infusionslösung ist in einer 60ml bzw. 77 ml Durchstechflasche aus klarem Ph.Eur. Typ III Glas mit einem Bromobutyl-Gummistopfen und einer Aluminiumkappe mit Abrisseinsatz verpackt. Packungen zu 1, 5, 10, 25 oder 50 Durchstechflaschen. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Alle Größen von Fortum-Durchstechflaschen werden mit reduziertem Druck bereitgestellt. Wenn das Produkt aufgelöst wird, wird Kohlendioxid freigesetzt und es kommt zu einem Druckanstieg. Kleine Blasen Kohlendioxid in der rekonstituierten Lösung können ignoriert werden. Anleitung für die Herstellung Siehe Tabelle 7 und 8 über zuzufügende Volumina und entsprechende Konzentrationen der Lösung, was bei Bedarf von Teildosen hilfreich sein kann. Tabelle 7: Pulver zur Herstellung einer Injektionslösung Darreichung 1 g Intramuskulär Intravenöse Bolusgabe Zuzufügende Menge Verdünnungsmittel (ml) 3 ml 10 ml Ungefähre Konzentration (mg/ml) 2 g Intravenöse Bolusgabe 10 ml 170 Vermerk: Das resultierende Volumen der Ceftazidim-Lösung im Rekonstitutionsmedium ist aufgrund des Verdrängungsfaktors des Arzneimittels erhöht und führt zu den in der obigen Tabelle angeführten Konzentrationen in mg/ml. Tabelle 8: Pulver zur Herstellung einer Infusionslösung Darreichung Zuzufügende Menge Verdünnungsmittel (ml) 2 g Intravenöse Infusion 50 ml* 40 * Die Zugabe sollte in 2 Schritten erfolgen Ungefähre Konzentration (mg/ml)
16 Vermerk: Das resultierende Volumen der Ceftazidimlösung im Rekonstitutionsmedium ist aufgrund des Verdrängungsfaktors des Arzneimittels erhöht und resultiert in den in der obigen Tabelle aufgeführten Konzentrationen in mg/ml. Die Lösung variiert in der Farbe von hellgelb bis bernsteinfarben, abhängig von der Konzentration, dem Verdünnungsmittel und den Lagerbedingungen. Bei Beachtung der gegebenen Empfehlungen haben diese Farbunterschiede keinen Einfluss auf die Wirksamkeit. Ceftazidim-Konzentrationen zwischen 1 mg/ml und 40 mg/ml sind kompatibel mit folgenden Injektionslösungen: Natriumchlorid 9 mg/ml (0,9 %) M/6 Natrium-Laktat Natrium-Laktat (Hartmann-Lösung) 5 % Dextrose 0,225 % Natriumchlorid mit 5 % Dextrose 0,45 % Natriumchlorid mit 5 % Dextrose 0,9 % Natriumchlorid mit 5 % Dextrose 0,18 % Natriumchlorid mit 4 % Dextrose 10 % Dextrose Dextran % in 0,9 % Natriumchlorid Dextran % in 5 % Dextrose Dextran 70 6 % in 0,9 % Natriumchlorid Dextran 70 6 % in 5 % Dextrose Ceftazidim-Konzentrationen zwischen 0,05 mg/ml und 0,25 mg/ml sind mit Intra-peritonealen Dialyseflüssigkeiten (Laktate) kompatibel. Ceftazidim in Konzentrationen wie in Tabelle 7 detailliert angeführt kann für die intramuskuläre Anwendung mit 0,5 % oder 1 % Lidocain-Hydrochlorid-Lösung hergestellt werden. Fortum 1 g Pulver zur Herstellung einer Injektionslösung, Fortum 2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung Herstellung einer Lösung für die Bolus-Injektion 1. Stecken Sie die Spritzennadel durch den Ampullenverschluss und spritzen Sie die zur Verdünnung empfohlene Menge an Lösung hinein. Das Vakuum kann den Eintritt der Verdünnungslösung unterstützen. Entfernen Sie die Spritzennadel. 2. Zum Auflösen schütteln: Kohlendioxid wird freigesetzt und man erhält eine klare Lösung in etwa 1 bis 2 Minuten. 3. Drehen Sie die Ampulle um. Stecken Sie die Nadel mit komplett gedrücktem Spritzenstößel durch den Ampullenverschluss und ziehen Sie das komplette Volumen der Lösung in die Spritze auf (der Druck in der Ampulle kann beim Aufziehen helfen). Stellen Sie sicher, dass die Nadel in der Lösung bleibt und nicht in den Kopfraum eintritt. Die entnommene Lösung kann kleine Blasen Kohlendioxid enthalten; diese können vernachlässigt werden. Diese Lösungen können direkt in die Vene gegeben werden, oder in den Schlauch des Infusionsbestecks, wenn der Patient parenterale Flüssigkeiten erhält. Ceftazidim ist mit den oben angeführten intravenösen Flüssigkeiten mischbar. Fortum 2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung Herstellung von Lösungen zur iv Infusion von einer Ceftazidim Injektion in Standard-Ampullen Darreichung (Mini-Taschen oder Büretten-Typ Set):
17 Herstellung unter Verwendung von insgesamt 50 ml (für 1 g und 2 g Ampullen) kompatibler Verdünnungslösung (oben angeführt), hinzugefügt in ZWEI Stufen wie nachstehend. 1. Stecken Sie die Spritzennadel durch den Ampullenverschluss und spritzen Sie 10 ml der Verdünnungslösung für die 1 g und 2 g Ampullen hinein. 2. Entfernen Sie die Nadel und schütteln Sie die Ampulle bis die Lösung klar ist. 3. Geben Sie keine Nadel für den Druckausgleich hinein, bis das Arzneimittel gelöst ist. Stecken Sie eine Nadel für den Druckausgleich durch den Ampullenverschluss, damit der interne Druck entweicht. 4. Übertragen Sie die rekonstituierte Lösung in das endgültige Verabreichungssystem (z. B. Mini-Taschen oder Büretten-Typ Set), was ein Gesamtvolumen von mindestens 50 ml ergeben sollte, und wenden Sie diese mittels intravenöser Infusion über 15 bis 30 Minuten an. Vermerk: Um die Sterilität zu erhalten, ist es wichtig dass die Druckausgleichsnadel nicht durch den Ampullenverschluss gesteckt wird, bevor das Arzneimittel gelöst ist. Jegliche Reste der Antibiotika Lösung sollen verworfen werden. Nur zum einmaligen Gebrauch. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen. 7. INHABER DER ZULASSUNG GlaxoSmithKline Pharma GmbH, Wien 8. ZULASSUNGSNUMMER(N) Fortum 1 g Pulver zur Herstellung einer Injektionslösung Fortum 2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG Fortum 1 g Pulver zur Herstellung einer Injektionslösung Datum der Erteilung der Zulassung:18.August 1986 Datum der letzten Verlängerung der Zulassung: 16. August 2016 Fortum 2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung Datum der Erteilung der Zulassung:18.August 1986 Datum der letzten Verlängerung der Zulassung: 16. August STAND DER INFORMATION August 2016 VERSCHREIBUNGSPFLICHT/APOTHEKENPFLICHT Rezept- und apothekenpflichtig, wiederholte Abgabe verboten
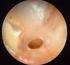
Chronisch eitrige Otitis media Maligne Otitis externa. Komplizierte Harnwegsinfektionen
 Ceftazidim Sandoz 250 mg-pulver zur Herstellung einer Injektionslösung 2. Qualitative und quantitative Zusammensetzung 1 Durchstechflasche mit 0,3203 g Pulver enthält 0,2912 g Ceftazidim-Pentahydrat entsprechend
Ceftazidim Sandoz 250 mg-pulver zur Herstellung einer Injektionslösung 2. Qualitative und quantitative Zusammensetzung 1 Durchstechflasche mit 0,3203 g Pulver enthält 0,2912 g Ceftazidim-Pentahydrat entsprechend
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Daflon 500 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 500 mg gereinigte, mikronisierte
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Daflon 500 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 500 mg gereinigte, mikronisierte
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels)
 FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Condrosulf 800 mg-tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Tablette enthält 800 mg Natriumchondroitinsulfat
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Condrosulf 800 mg-tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Tablette enthält 800 mg Natriumchondroitinsulfat
Maligne Otitis externa Komplizierte Harnwegsinfektionen
 Fortum 1 g Pulver zur Herstellung einer Injektionslösung 2. Qualitative und quantitative Zusammensetzung 1 Fortum 1 g Pulver zur Herstellung einer Injektionslösung enthält: 1,182 g Ceftazidimpentahydrat
Fortum 1 g Pulver zur Herstellung einer Injektionslösung 2. Qualitative und quantitative Zusammensetzung 1 Fortum 1 g Pulver zur Herstellung einer Injektionslösung enthält: 1,182 g Ceftazidimpentahydrat
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Trosyd 1 % Creme 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Creme enthält 10 mg Tioconazol. Sonstiger Bestandteil
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Trosyd 1 % Creme 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Creme enthält 10 mg Tioconazol. Sonstiger Bestandteil
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Komplizierte Harnwegsinfektionen
 Ceftazidim Actavis 1 g Pulver zur Herstellung einer Injektionslösung 2. Qualitative und quantitative Zusammensetzung Eine Durchstechflasche enthält 1,385 g Ceftazidimpentahydrat gepuffert mit Natriumcarbonat
Ceftazidim Actavis 1 g Pulver zur Herstellung einer Injektionslösung 2. Qualitative und quantitative Zusammensetzung Eine Durchstechflasche enthält 1,385 g Ceftazidimpentahydrat gepuffert mit Natriumcarbonat
8 Antibiotika, Antimykotika: Spektrum Dosierung Nebenwirkungen
 8 Antibiotika, Antimykotika: Spektrum Dosierung Nebenwirkungen Amoxicillin Amoxypen j Grampositive (nicht S. aureus) und gramnegative Keime (H. influenzae ca. 10 % Resistenz) * Erwachsene, Kinder 412 Jahre
8 Antibiotika, Antimykotika: Spektrum Dosierung Nebenwirkungen Amoxicillin Amoxypen j Grampositive (nicht S. aureus) und gramnegative Keime (H. influenzae ca. 10 % Resistenz) * Erwachsene, Kinder 412 Jahre
Cefuroxim Sandoz Tabletten
 Stand: März 2013 1. BEZEICHNUNG DER ARZNEIMITTEL Cefuroxim Sandoz überzogene Cefuroxim Sandoz 500 mg überzogene 2. QUALITATIVE UND QUANTITATIVE ZU- SAMMENSETZUNG Wirkstoff: Cefuroxim Cefuroxim Sandoz 1
Stand: März 2013 1. BEZEICHNUNG DER ARZNEIMITTEL Cefuroxim Sandoz überzogene Cefuroxim Sandoz 500 mg überzogene 2. QUALITATIVE UND QUANTITATIVE ZU- SAMMENSETZUNG Wirkstoff: Cefuroxim Cefuroxim Sandoz 1
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Locabiosol 1% - Dosierspray 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 5 ml Lösung (= 100 Sprühstöße) enthalten 50
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Locabiosol 1% - Dosierspray 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 5 ml Lösung (= 100 Sprühstöße) enthalten 50
FACHINFORMATION. 4.2 Dosierung und Art der Anwendung
 1. BEZEICHNUNG DES ARZNEIMITTELS Pulver und Lösungsmittel zur Herstellung einer Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Durchstechflasche mit 0,596 g Pulver enthält 0,596 g Ceftriaxon-Dinatrium
1. BEZEICHNUNG DES ARZNEIMITTELS Pulver und Lösungsmittel zur Herstellung einer Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Durchstechflasche mit 0,596 g Pulver enthält 0,596 g Ceftriaxon-Dinatrium
Gebrauchsinformation: Information für Patienten. Tabletten gegen Magen-Darm-Beschwerden Similasan
 1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. 1 g Salbe enthält 21,5 mg Mupirocin-Calcium entsprechend 20 mg Mupirocin.
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Bactroban - Nasensalbe 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Salbe enthält 21,5 mg Mupirocin-Calcium entsprechend
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Bactroban - Nasensalbe 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Salbe enthält 21,5 mg Mupirocin-Calcium entsprechend
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
9 Antibiotika, Antimykotika: Spektrum Dosierung Nebenwirkungen Kosten
 9 Antibiotika, Antimykotika: Spektrum Dosierung Nebenwirkungen Kosten 9 Amikacin Amikacin j Grampositive (Staphylokokken, nicht: Pneumokokken, Streptokokken, Enterokokken), gramnegative Keime, insbesondere
9 Antibiotika, Antimykotika: Spektrum Dosierung Nebenwirkungen Kosten 9 Amikacin Amikacin j Grampositive (Staphylokokken, nicht: Pneumokokken, Streptokokken, Enterokokken), gramnegative Keime, insbesondere
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN chronisch- Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN chronisch- Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER. NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG
 GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Tracel Injektionslösung in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Fertigspritze zu 10 ml enthält:
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Tracel Injektionslösung in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Fertigspritze zu 10 ml enthält:
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Meropenem Hospira 500 mg Pulver zur Herstellung einer Injektions- oder Infusionslösung Meropenem Hospira 1 g Pulver zur Herstellung einer Injektions-
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Meropenem Hospira 500 mg Pulver zur Herstellung einer Injektions- oder Infusionslösung Meropenem Hospira 1 g Pulver zur Herstellung einer Injektions-
Fachinformation 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Seite 1 von 7 PIERRE FABRE PHARMA Fachinformation RIBOMUNYL uno Tabletten, Granulat 1. BEZEICHNUNG DER ARZNEIMITTEL Ribomunyl uno Tabletten Ribomunyl uno Granulat 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Seite 1 von 7 PIERRE FABRE PHARMA Fachinformation RIBOMUNYL uno Tabletten, Granulat 1. BEZEICHNUNG DER ARZNEIMITTEL Ribomunyl uno Tabletten Ribomunyl uno Granulat 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
NeuroBloc. Botulinumtoxin Typ B Injektionslösung 5000 E/ml. Wichtige Informationen zur Sicherheit für Ärzte
 NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
NeuroBloc Botulinumtoxin Typ B Injektionslösung 5000 E/ml Wichtige Informationen zur Sicherheit für Ärzte Dieses Handbuch dient dazu, Ärzte, die für die Verschreibung und die Verabreichung von NeuroBloc
PARENTERAL VE Infusionslösung
 Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila PARENTERAL VE Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist PARENTERAL VE und wofür wird
Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila PARENTERAL VE Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist PARENTERAL VE und wofür wird
Emgecard 2,5 mmol-filmtabletten
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Emgecard 2,5 mmol-filmtabletten Magnesium-L-aspartat-hydrochlorid-trihydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Emgecard 2,5 mmol-filmtabletten Magnesium-L-aspartat-hydrochlorid-trihydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6 Wirkstoff: Drosera D3/D4/D6 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6 Wirkstoff: Drosera D3/D4/D6 Lesen Sie die gesamte Packungsbeilage sorgfältig
Cefavora - Tropfen. Gebrauchsinformation: Information für Anwender
 1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
Cefotaxim-ratiopharm
 1. BEZEICHNUNG DER ARZNEIMITTEL (Pulver zur Herstellung einer Injektionslösung) (Pulver zur Herstellung einer Injektions- bzw. Infusionslösung) (Pulver zur Herstellung einer Injektions- bzw. Infusionslösung)
1. BEZEICHNUNG DER ARZNEIMITTEL (Pulver zur Herstellung einer Injektionslösung) (Pulver zur Herstellung einer Injektions- bzw. Infusionslösung) (Pulver zur Herstellung einer Injektions- bzw. Infusionslösung)
zur Verfügung gestellt von Gebrauchs.info
 Gebrauchsinformation: Information für Anwender Cefuroxim-ratiopharm 250 mg p.i. Pulver zur Herstellung einer Injektionslösung Wirkstoff: Cefuroxim Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Anwender Cefuroxim-ratiopharm 250 mg p.i. Pulver zur Herstellung einer Injektionslösung Wirkstoff: Cefuroxim Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 Sinupret Tropfen GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Flüssigextrakt aus Enzianwurzel, Schlüsselblumenblüte mit Kelch, Gartensauerampferkraut, Holunderblüte und Eisenkraut Lesen Sie die gesamte
Sinupret Tropfen GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Flüssigextrakt aus Enzianwurzel, Schlüsselblumenblüte mit Kelch, Gartensauerampferkraut, Holunderblüte und Eisenkraut Lesen Sie die gesamte
Gebrauchsinformation: Information für Patienten. Allernon 10 mg-tabletten Wirkstoff: Loratadin
 Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
VANCOMYCIN ENTEROCAPS 250 mg; Hartkapseln Wirkstoff: Vancomycinhydrochlorid
 Gebrauchsinformation: Information für den Anwender VANCOMYCIN ENTEROCAPS 250 mg; Hartkapseln Wirkstoff: Vancomycinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für den Anwender VANCOMYCIN ENTEROCAPS 250 mg; Hartkapseln Wirkstoff: Vancomycinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
FACHINFORMATION. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Ciclopirox WinthropNagellack 8 % 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g wirkstoffhaltiger Nagellack enthält 80 mg Ciclopirox. Vollständige
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Ciclopirox WinthropNagellack 8 % 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g wirkstoffhaltiger Nagellack enthält 80 mg Ciclopirox. Vollständige
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels (Summary of Product Characteristics)
 Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels (Summary of Product Characteristics) 1. BEZEICHNUNG DES TIERARZNEIMITTELS Colivet 2 000 000 IU/ml, Konzentrat für eine orale
Fachinformation in Form der Zusammenfassung der Merkmale des Tierarzneimittels (Summary of Product Characteristics) 1. BEZEICHNUNG DES TIERARZNEIMITTELS Colivet 2 000 000 IU/ml, Konzentrat für eine orale
GEBRAUCHSINFORMATION Information für den Anwender
 GEBRAUCHSINFORMATION Information für den Anwender ViroMed 400 mg - Tabletten Wirkstoff: Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION Information für den Anwender ViroMed 400 mg - Tabletten Wirkstoff: Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Ampho-Moronal Suspension
 Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Ampho-Moronal Suspension Wirkstoff: Amphotericin B Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Ampho-Moronal Suspension Wirkstoff: Amphotericin B Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Page 1 of 8 FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung. Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung. 2 QUALITATIVE UND QUANTITATIVE
Page 1 of 8 FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung. Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung. 2 QUALITATIVE UND QUANTITATIVE
Natriumchlorid 1 molar 5,85% Infusionslösungskonzentrat
 Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Natriumchlorid 1 molar 5,85% Infusionslösungskonzentrat Diese Packungsbeilage beinhaltet: 1. Was ist
Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Natriumchlorid 1 molar 5,85% Infusionslösungskonzentrat Diese Packungsbeilage beinhaltet: 1. Was ist
Ringer-Laktat-Lösung Infusionslösung
 Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Ringer-Laktat-Lösung Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist Ringer-Laktat-Lösung
Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Ringer-Laktat-Lösung Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist Ringer-Laktat-Lösung
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Maxipime 2,0 g, Pulver zur Herstellung einer Injektions- oder Infusionslösung Wirkstoff: Cefepim (als Dihydrochlorid-Monohydrat) Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Maxipime 2,0 g, Pulver zur Herstellung einer Injektions- oder Infusionslösung Wirkstoff: Cefepim (als Dihydrochlorid-Monohydrat) Lesen Sie die gesamte
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften)
 F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS Influvac - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff aus inaktivierten Oberflächenantigenen)
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS Influvac - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff aus inaktivierten Oberflächenantigenen)
Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
Mycostatin - orale Suspension
 Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Mycostatin - orale Suspension Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Mycostatin - orale Suspension Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Patienten
 Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Glazidim 500 mg Pulver zur Herstellung einer Injektionslösung Glazidim 1 g Pulver zur Herstellung einer Injektions-oder Infusionslösung Glazidim 2 g Pulver
Gebrauchsinformation: Information für Anwender Glazidim 500 mg Pulver zur Herstellung einer Injektionslösung Glazidim 1 g Pulver zur Herstellung einer Injektions-oder Infusionslösung Glazidim 2 g Pulver
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12 Wirkstoff: Phosphorus D4/D6/D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12 Wirkstoff: Phosphorus D4/D6/D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN - Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN - Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält
Gebrauchsinformation: Information für Patienten. Vancomycin Pfizer 1000 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
 1 Gebrauchsinformation: Information für Patienten Vancomycin Pfizer 1000 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Wirkstoff: Vancomycin Lesen Sie die gesamte Packungsbeilage sorgfältig
1 Gebrauchsinformation: Information für Patienten Vancomycin Pfizer 1000 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Wirkstoff: Vancomycin Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Claforan 1000 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Claforan 1000 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Cefotaxim Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Claforan 1000 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Cefotaxim Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Gebrauchsinformation: Information für Anwender. APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen Wirkstoffe: Plantago major Dil. D4, Belladonna Dil. D6, Causticum Hahnemanni Dil. D30, Ferrum metallicum
Gebrauchsinformation: Information für Anwender APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen Wirkstoffe: Plantago major Dil. D4, Belladonna Dil. D6, Causticum Hahnemanni Dil. D30, Ferrum metallicum
Anhang III. Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Gelsemium-Homaccord -Tropfen
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Gelsemium-Homaccord -Tropfen Wirkstoffe: Gelsemium sempervirens, Toxicodendron quercifolium, Cimicifuga racemosa Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Gelsemium-Homaccord -Tropfen Wirkstoffe: Gelsemium sempervirens, Toxicodendron quercifolium, Cimicifuga racemosa Lesen Sie die gesamte Packungsbeilage sorgfältig
1. Was ist Apis/Belladonna cum Mercurio und wofür wird es angewendet?
 WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
Fachinformation. aus irgendwelchen Gründen nicht angewendet werden können. Akute Bronchitis Exazerbation einer chronischen Bronchitis
 . Bezeichnung der Arzneimittel Cefpodoxim Sandoz 00 mg Filmtabletten Cefpodoxim Sandoz 200 mg Filmtabletten Cefpodoxim Sandoz 40 mg/5 ml Pulver zur Herstellung einer Suspension zum Einnehmen 2. Qualitative
. Bezeichnung der Arzneimittel Cefpodoxim Sandoz 00 mg Filmtabletten Cefpodoxim Sandoz 200 mg Filmtabletten Cefpodoxim Sandoz 40 mg/5 ml Pulver zur Herstellung einer Suspension zum Einnehmen 2. Qualitative
Gebrauchsinformation: Information für Anwender. APOZEMA Blutarmut China complex Nr.38-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Blutarmut China complex Nr.38-Tropfen Wirkstoffe: China Dil. D5, Arsenicum album Dil. D6, Chininum arsenicosum Dil D6 und Pulsatilla Dil. D4 Lesen
Gebrauchsinformation: Information für Anwender APOZEMA Blutarmut China complex Nr.38-Tropfen Wirkstoffe: China Dil. D5, Arsenicum album Dil. D6, Chininum arsenicosum Dil D6 und Pulsatilla Dil. D4 Lesen
MediPreis Produktsteckbrief
 MediPreis Produktsteckbrief DOCPELIN NACHTSTERNE DOCPELIN Nachtsterne Filmtabletten Pelikan-Apotheke PZN: 04386054 Menge: 20 St Art: Filmtabletten Link: https://www.medipreis.de/04386054 Anwendungsgebiete
MediPreis Produktsteckbrief DOCPELIN NACHTSTERNE DOCPELIN Nachtsterne Filmtabletten Pelikan-Apotheke PZN: 04386054 Menge: 20 St Art: Filmtabletten Link: https://www.medipreis.de/04386054 Anwendungsgebiete
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. EXACYL 500 mg/5 ml Injektionslösung
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN EXACYL 500 mg/5 ml Injektionslösung Tranexamsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN EXACYL 500 mg/5 ml Injektionslösung Tranexamsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Gebrauchsinformation: Information für Patienten. Osanit Hustenkügelchen Wirkstoff: Drosera D6
 Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
1. Was ist Rheumon - Creme und wofür wird sie angewendet?
 Gebrauchsinformation: Information für Anwender Rheumon - Creme Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält
Gebrauchsinformation: Information für Anwender Rheumon - Creme Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält
1.1. Im Abschnitt Warnhinweise (bzw. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung) ist der nachfolgende Text aufzunehmen:
 - 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn MSD Sharp & Dohme GmbH Lindenplatz 1 85540 Haar Nachrichtlich: Stufenplanbeteiligte Postanschrift:
- 2 - Bundesinstitut für Arzneimittel und Medizinprodukte BfArM Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn MSD Sharp & Dohme GmbH Lindenplatz 1 85540 Haar Nachrichtlich: Stufenplanbeteiligte Postanschrift:
PHV-issue: Anti-Human-Thymozyten-Immunglobulin vom Kaninchen
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.09.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.09.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
GEBRAUCHSINFORMATION Information für den Anwender. Sonstiger Bestandteil mit bekannter Wirkung: Lactose-Monohydrat 217,6 mg
 GEBRAUCHSINFORMATION Information für den Anwender ViroMed 200 mg - Tabletten Wirkstoff: Sonstiger Bestandteil mit bekannter Wirkung: Lactose-Monohydrat 217,6 mg Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION Information für den Anwender ViroMed 200 mg - Tabletten Wirkstoff: Sonstiger Bestandteil mit bekannter Wirkung: Lactose-Monohydrat 217,6 mg Lesen Sie die gesamte Packungsbeilage sorgfältig
B. PACKUNGSBEILAGE 1
 B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Metomotyl 2,5 mg/ml Injektionslösung für Katzen und Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Metomotyl 2,5 mg/ml Injektionslösung für Katzen und Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
Piperacillin/Tazobactam Stragen 4 g/0,5 g Pulver zur Herstellung einer Infusionslösung
 1. Bezeichnung des Arzneimittels Piperacillin/Tazobactam Stragen 4 g/0,5 g Pulver 2. Qualitative und quantitative Zusammensetzung 1 Durchstechflasche enthält 4 g Piperacillin (als Natriumsalz) und 0,5
1. Bezeichnung des Arzneimittels Piperacillin/Tazobactam Stragen 4 g/0,5 g Pulver 2. Qualitative und quantitative Zusammensetzung 1 Durchstechflasche enthält 4 g Piperacillin (als Natriumsalz) und 0,5
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Aerocef 400 mg - Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 447,6 mg Cefixim x
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Aerocef 400 mg - Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 447,6 mg Cefixim x
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
Gebrauchsinformation: Information für Anwender. APOZEMA Stuhlregelungs Magnesium chloratum complex Nr.34-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Stuhlregelungs Magnesium chloratum complex Nr.34-Tropfen Wirkstoffe: Magnesium chloratum Dil. D4, Alumina Dil. D12, Bryonia Dil D4, Lycopodium Dil.
Gebrauchsinformation: Information für Anwender APOZEMA Stuhlregelungs Magnesium chloratum complex Nr.34-Tropfen Wirkstoffe: Magnesium chloratum Dil. D4, Alumina Dil. D12, Bryonia Dil D4, Lycopodium Dil.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Magnevist 2 mmol/l Injektionslösung. Gadopentetsäure, Dimeglumin
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
GEBRAUCHSINFORMATION. VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen
 GEBRAUCHSINFORMATION VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
GEBRAUCHSINFORMATION VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
Cefpodoxim-ratiopharm 40 mg/5 ml Pulver zur Herstellung einer Suspension zum Einnehmen
 1. BEZEICHNUNG DES ARZNEIMITTELS Pulver zur Herstellung einer Suspension zum Einnehmen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 5 ml der zubereiteten Suspension enthalten 52,18 mg Cefpodoximproxetil,
1. BEZEICHNUNG DES ARZNEIMITTELS Pulver zur Herstellung einer Suspension zum Einnehmen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 5 ml der zubereiteten Suspension enthalten 52,18 mg Cefpodoximproxetil,
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender Ledermix, Paste zur Anwendung in Zahnkavitäten Wirkstoffe: Demeclocyclin-Calcium (1:1) (30,21 mg/g), Triamcinolonacetonid (10 mg/g) Lesen Sie die gesamte
Gebrauchsinformation: Information für den Anwender Ledermix, Paste zur Anwendung in Zahnkavitäten Wirkstoffe: Demeclocyclin-Calcium (1:1) (30,21 mg/g), Triamcinolonacetonid (10 mg/g) Lesen Sie die gesamte
Betreff: Loperamid - hältige Arzneispezialitäten Änderungen der Fach- und Gebrauchsinformationen aufgrund des HBD PSUR Worksharing Projektes
 Datum: 08.01.2013 Kontakt: Mag. pharm. Dr. Ulrike Rehberger Abteilung: Tel. / Fax: +43 (0) 505 55 36258, DW.Fax-36207 E-Mail: ulrike.rehberger@ages.at Unser Zeichen: 16c-121227-26215-A-PHV Ihr Zeichen:
Datum: 08.01.2013 Kontakt: Mag. pharm. Dr. Ulrike Rehberger Abteilung: Tel. / Fax: +43 (0) 505 55 36258, DW.Fax-36207 E-Mail: ulrike.rehberger@ages.at Unser Zeichen: 16c-121227-26215-A-PHV Ihr Zeichen:
Patienteninformation Lamotrigin Desitin 04/2007
 Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
Dosierung parenteraler ß-Laktame: Welche klinischen Vorteile bieten höhere Dosen und die kontinuierliche Infusion?
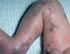 Dosierung parenteraler ß-Laktame: Welche klinischen Vorteile bieten höhere Dosen und die kontinuierliche Infusion? Katja de With Medizinische Universitätsklinik Freiburg Entwicklung antibiotikaresistenter
Dosierung parenteraler ß-Laktame: Welche klinischen Vorteile bieten höhere Dosen und die kontinuierliche Infusion? Katja de With Medizinische Universitätsklinik Freiburg Entwicklung antibiotikaresistenter
Rheumon-Gel Wirkstoff:Etofenamat
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rheumon-Gel Wirkstoff:Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. -
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rheumon-Gel Wirkstoff:Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. -
Gebrauchsinformation: Information für den Anwender. Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium
 Gebrauchsinformation: Information für den Anwender Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Cefuroxim-ratiopharm 250 mg / 500 mg Filmtabletten
 / 500 mg 1. BEZEICHNUNG DER ARZNEIMITTEL 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Filmtablette enthält 300,72 mg Cefuroximaxetil, entsprechend 250 mg Cefuroxim. Jede Filmtablette enthält 601,44
/ 500 mg 1. BEZEICHNUNG DER ARZNEIMITTEL 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Jede Filmtablette enthält 300,72 mg Cefuroximaxetil, entsprechend 250 mg Cefuroxim. Jede Filmtablette enthält 601,44
ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS. Lyophilisat zur Herstellung einer Suspension zur Verabreichung als Sprühnebel für Hühner
 Poulvac IB QX ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. BEZEICHNUNG DES TIERARZNEIMITTELS Poulvac IB QX Lyophilisat zur Herstellung einer Suspension zur Verabreichung als Sprühnebel für Hühner
Poulvac IB QX ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. BEZEICHNUNG DES TIERARZNEIMITTELS Poulvac IB QX Lyophilisat zur Herstellung einer Suspension zur Verabreichung als Sprühnebel für Hühner
Gebrauchsinformation: Information für Anwender. APOZEMA Reizblasen Cantharis complex Nr.26-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Reizblasen Cantharis complex Nr.26-Tropfen Wirkstoffe: Cantharis Dil. D6, Dulcamara Dil. D4, Mandragora ex herba Dil. D4, Mercurius solubilis Hahnemanni
Gebrauchsinformation: Information für Anwender APOZEMA Reizblasen Cantharis complex Nr.26-Tropfen Wirkstoffe: Cantharis Dil. D6, Dulcamara Dil. D4, Mandragora ex herba Dil. D4, Mercurius solubilis Hahnemanni
Gebrauchsinformation: Information für Patienten. Bromhexin Krewel Meuselbach Tropfen 12 mg/ml. Wirkstoff: Bromhexinhydrochlorid
 Gebrauchsinformation: Information für Patienten Bromhexin Krewel Meuselbach Tropfen 12 mg/ml Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Gebrauchsinformation: Information für Patienten Bromhexin Krewel Meuselbach Tropfen 12 mg/ml Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Gebrauchsinformation: Information für Patienten
 Gebrauchsinformation: Information für Patienten Rocephin 500 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Ceftriaxon (als Ceftriaxon-Natrium) Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Patienten Rocephin 500 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Ceftriaxon (als Ceftriaxon-Natrium) Lesen Sie die gesamte Packungsbeilage
octenisept Wund-Desinfektion ist ein Antiseptikum zur wiederholten, zeitlich begrenzten unterstützenden antiseptischen Wundbehandlung.
 Gebrauchsinformation: Information für den Anwender OCTENISEPT WUND-DESINFEKTION Antiseptikum zur unterstützenden Wundbehandlung Lösung zum Aufsprühen auf die Wunde Wirkstoffe: 0.1 g Octenidinhydrochlorid
Gebrauchsinformation: Information für den Anwender OCTENISEPT WUND-DESINFEKTION Antiseptikum zur unterstützenden Wundbehandlung Lösung zum Aufsprühen auf die Wunde Wirkstoffe: 0.1 g Octenidinhydrochlorid
Multiresistente Erreger. Welche sollen es denn diesmal sein? Stäbchen? Kokken? Spiralen?
 Hygiene in der Arztpraxis 3MRGN/4MRGN was ist das nun wieder?? 17.04.2013 Multiresistente Erreger Welche sollen es denn diesmal sein? Stäbchen? Kokken? Spiralen? Multiresistente Erreger Welche sollen
Hygiene in der Arztpraxis 3MRGN/4MRGN was ist das nun wieder?? 17.04.2013 Multiresistente Erreger Welche sollen es denn diesmal sein? Stäbchen? Kokken? Spiralen? Multiresistente Erreger Welche sollen
GEBRAUCHSINFORMATION Mastipent-Euterinjektor 500 mg mg/20 ml Suspension zur intramammären Anwendung für Rinder (laktierende Milchkühe)
 GEBRAUCHSINFORMATION Mastipent-Euterinjektor 500 mg + 500 mg/20 ml Suspension zur intramammären Anwendung für Rinder (laktierende Milchkühe) 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH,
GEBRAUCHSINFORMATION Mastipent-Euterinjektor 500 mg + 500 mg/20 ml Suspension zur intramammären Anwendung für Rinder (laktierende Milchkühe) 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH,
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Ephedrin Carino 30 mg/ml Konzentrat zur Herstellung einer Injektionslösung Ephedrinhydrochlorid (in dieser Gebrauchsinformation als Ephedrin Carino bezeichnet)
Gebrauchsinformation: Information für Anwender Ephedrin Carino 30 mg/ml Konzentrat zur Herstellung einer Injektionslösung Ephedrinhydrochlorid (in dieser Gebrauchsinformation als Ephedrin Carino bezeichnet)
Neue Wege zur Reduktion der Antibiotikaverordnung bei Atemwegsinfektionen.
 Neue Wege zur Reduktion der Antibiotikaverordnung bei Atemwegsinfektionen. Epidemiologie der antimikrobiellen Resistenzen in Deutschland und Europa Miriam Wiese-Posselt Institut für Hygiene und Umweltmedizin
Neue Wege zur Reduktion der Antibiotikaverordnung bei Atemwegsinfektionen. Epidemiologie der antimikrobiellen Resistenzen in Deutschland und Europa Miriam Wiese-Posselt Institut für Hygiene und Umweltmedizin
Avessaron enthält Ondansetron, das zur Stoffgruppe der Antiemetika gehört (Arzneimittel gegen Übelkeit und Erbrechen).
 Gebrauchsinformation: Information für Anwender Avessaron 4 mg Injektionslösung Avessaron 8 mg Injektionslösung Ondansetron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender Avessaron 4 mg Injektionslösung Avessaron 8 mg Injektionslösung Ondansetron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
ANHANG A ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. DOLTHENE 22,65 mg/ml Lösung zur oralen Verabreichung für Hunde.
 ANHANG A ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. NAMEN DES TIERARZNEIMITTELS DOLTHENE 22,65 mg/ml Lösung zur oralen Verabreichung für Hunde. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Pro
ANHANG A ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. NAMEN DES TIERARZNEIMITTELS DOLTHENE 22,65 mg/ml Lösung zur oralen Verabreichung für Hunde. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Pro
Magnesium Verla Filmtabletten
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnesium Verla Filmtabletten Wirkstoff: Magnesiumcitrat 9H 2 O Magnesium-L-Glutamat Tetrahydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnesium Verla Filmtabletten Wirkstoff: Magnesiumcitrat 9H 2 O Magnesium-L-Glutamat Tetrahydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Fasturtec 1,5 mg/ml Pulver und Lösungsmittel zur Herstellung eines Infusionslösungskonzentrats Rasburicase Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Fasturtec 1,5 mg/ml Pulver und Lösungsmittel zur Herstellung eines Infusionslösungskonzentrats Rasburicase Lesen Sie die gesamte Packungsbeilage sorgfältig
Die vollständige Auflistung der sonstigen Bestandteile finden Sie unter Abschnitt 6.1.
 1. BEZEICHNUNG DES TIERARZNEIMITTELS ZACTRAN 150 mg/ml, Injektionslösung für Rinder 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml enthält: Wirkstoff: Gamithromycin Sonstige Bestandteile: 3-Sulfanylpropan-1,2-diol
1. BEZEICHNUNG DES TIERARZNEIMITTELS ZACTRAN 150 mg/ml, Injektionslösung für Rinder 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml enthält: Wirkstoff: Gamithromycin Sonstige Bestandteile: 3-Sulfanylpropan-1,2-diol
Gebrauchsinformation: Information für Anwender. APOZEMA Allergie Acidum formicicum complex Nr. 2-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Allergie Acidum formicicum complex Nr. 2-Tropfen Wirkstoffe: Acidum formicicum Dil. D6, Apis mellifica Dil. D30, Arsenicum album Dil. D12, Calcium
Gebrauchsinformation: Information für Anwender APOZEMA Allergie Acidum formicicum complex Nr. 2-Tropfen Wirkstoffe: Acidum formicicum Dil. D6, Apis mellifica Dil. D30, Arsenicum album Dil. D12, Calcium
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. ESTRADURINE, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionslösung.
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS ESTRADURINE, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionslösung. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS ESTRADURINE, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionslösung. 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Iberogast Flüssigkeit zum Einnehmen Wirkstoffe: Bittere Schleifenblume, Angelikawurzel, Kamillenblüten, Kümmel, Mariendistelfrüchte, Melissenblätter, Pfefferminzblätter,
Gebrauchsinformation: Information für Anwender Iberogast Flüssigkeit zum Einnehmen Wirkstoffe: Bittere Schleifenblume, Angelikawurzel, Kamillenblüten, Kümmel, Mariendistelfrüchte, Melissenblätter, Pfefferminzblätter,
1. BEZEICHNUNG DES ARZNEIMITTELS. Empressin 40 I.E./2 ml Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 1. BEZEICHNUNG DES ARZNEIMITTELS Empressin 40 I.E./2 ml Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Ampulle mit 2 ml Injektionslösung enthält Argipressin, standardisiert auf 40
1. BEZEICHNUNG DES ARZNEIMITTELS Empressin 40 I.E./2 ml Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Ampulle mit 2 ml Injektionslösung enthält Argipressin, standardisiert auf 40
