Informationsbroschüre für ahus-patienten und Eltern oder Betreuungspersonen von ahus-patienten
|
|
|
- Alke Grosse
- vor 6 Jahren
- Abrufe
Transkript
1 BELANGRIJKE VEILIGHEIDSINFORMATIE 1 Ten gevolge van het werkingsmechanisme verhoogt het gebruik van SOLIRIS de vatbaarheid van de patiënt voor meningokokkeninfecties (Neisseria meningitidis). Derhalve dient u: Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels SOLIRIS Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information gehört - ist eine Maßnahme, die ergriffen wurde, um eine sichere Anwendung von SOLIRIS zu gewährleisten (RMA modifizierte Version 10/2017). Uw patiënten ten minste twee weken voor de eerste dosering van SOLIRIS te vaccineren met een vaccin tegen meningokokken; SOLIRIS 300 te mg revaccineren volgens de huidige medische richtlijnen voor vaccins. Konzentrat Tetravalente zur Herstellung vaccins einer tegen Infusionslösung serotypes (Eculizumab) A, C, Y en W135 worden sterk aanbevolen, bij voorkeur geconjugeerde vaccins. Uw patiënten te controleren op vroege tekenen van meningokokkeninfecties, onmiddellijk te beoordelen indien een infectie wordt vermoed, en zo nodig met antibiotica te behandelen. Een educatieve brochure (gids voor de patiënt) te verstrekken en de patiënten te informeren om hen bewuster te maken van mogelijke ernstige infecties en de tekenen en symptomen ervan: hinderlijke hoofdpijn met misselijkheid en/of braken hinderlijke hoofdpijn met een stijve nek of rug koorts koorts en huiduitslag verwardheid hevige spierpijn in combinatie met griepachtige verschijnselen gevoeligheid voor licht. Informationsbroschüre für ahus-patienten und Eltern oder Betreuungspersonen von ahus-patienten Patiënten een veiligheidsinformatiekaart te bezorgen en uit te leggen dat ze deze altijd bij zich moeten hebben. Andere systemische infecties: Ten gevolge van het werkingsmechanisme dient SOLIRIS met voorzichtigheid te worden toegediend aan patiënten met actieve systemische infecties (in het bijzonder ten gevolge van geëncapsuleerde bacteriën). Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie das Arzneimittel SOLIRIS anwenden.
2 Zweck dieser Unterlagen (RMA oder Risikoeinschränkung) Diese Informationen sind Teil des belgischen Plans zur Risikoeinschränkung, der medizinischem Fachpersonal (und Patienten) Informationsmaterial zur Verfügung stellt. Diese zusätzlichen Aktivitäten zur Risikoeinschränkung verfolgen das Ziel, eine sichere und effiziente Anwendung von SOLIRIS zu garantieren und sollen die folgenden Hauptbestandteile umfassen: Eine Behandlung mit Eculizumab erhöht das Risiko auf eine schwere Infektion, insbesondere Neisseria meningitidis. Anzeichen und Symptome einer schweren Infektion und die Notwendigkeit, eine medizinische Notversorgung zu erhalten. Die Patientensicherheitskarte und die Notwendigkeit, diese mit sich zu führen und dem medizinischen Fachpersonal zu sagen, dass sie mit Eculizumab behandelt werden. Die Bedeutung einer Meningokokkenimpfung vor der Behandlung mit Eculizumab und/oder eine Antibiotikaprophylaxe erhalten. Die Notwendigkeit, Kinder gegen Pneumococcus und Haemophilus influenzae zu impfen, bevor sie mit Eculizumab behandelt werden. Das Risiko auf Reaktionen auf die Infusion mit Eculizumab, einschließlich von Anaphylaxie, und die Notwendigkeit der klinischen Kontrolle nach der Infusion. Dass Eculizumab teratogen sein kann und die Notwendigkeit einer wirkungsvollen Empfängnisverhütung während der Behandlung und danach noch fünf Monate lang bei Frauen, die schwanger werden können, und dass während der Behandlung und danach noch fünf Monate lang nicht gestillt werden darf. Risiko auf schwere Komplikationen infolge thrombotischer Mikroangiopathie (bei ahus) nach Ab-/Aussetzen der Verabreichung von Eculizumab, die Anzeichen und Symptome davon und die Empfehlung, einen verschreibenden Arzt zu kontaktieren, bevor die Verabreichung von Eculizumab ab-/ausgesetzt wird. Aufnahme ins ahus-register. Die Sicherheitsmaßnahmen bei Kindern. 2
3 Worterklärungen Atypisches hämolytisch-urämisches Syndrom (ahus) Eine seltene Erkrankung, die durch chronische und übermäßige Aktivierung des Komplementsystems, eines Teils Ihres normalen Immunsystems, verursacht wird. Das überaktive Komplementsystem beschädigt kleine Blutgefäße und führt zur Bildung von Blutgerinnseln im ganzen Körper, ein Prozess, der thrombotische Mikroangiopathie (TMA) genannt wird. TMA kann viele Organe beschädigen, darunter das Gehirn, die Nieren und das Herz. Blutgerinnsel Das Blut kann Gerinnsel bilden, um eine Blutung zu stillen, aber bei ahus können die Blutgerinnsel sehr einfach die Blutgefäße verstopfen und Organe schädigen. Hämolyse Die anormale Zerstörung von roten Blutkörperchen, die bei ahus zu verschiedenen Anzeichen und Symptomen führen kann. Chronische Hämolyse Die Zerstörung roter Blutkörperchen (Hämolyse) über lange Zeit (chronisch). Komplementsystem (auch Komplementkaskade oder einfach Komplement genannt) Der Teil Ihres Immunsystems, der normalerweise Bakterien und andere körperfremde Zellen vernichtet. Bei ahus ist das Komplement chronisch und übermäßig aktiv, was zur Beschädigung Ihrer eigenen Gewebe führt: durch die Zerstörung kleiner Blutgefäße und die Bildung von Blutgerinnseln, die die Organe schädigen, darunter das Gehirn, die Nieren, das Herz und andere Organe. Nierenfunktionsstörung oder Nierenversagen Eine Erkrankung, bei der die Nieren nicht mehr funktionieren und keine Abfallstoffe mehr entfernen können oder nicht mehr in der Lage sind, die Menge an Wasser und essenziellen Stoffen im Körper zu regulieren. Meningokokkeninfektion Eine Infektion, die durch die Bakterie Neisseria meningitidis (auch Meningokokke genannt) verursacht wird. Diese kann zu Hirnhautentzündung oder einer ausgedehnten Blutinfektion (Sepsis) führen. Blutplättchen Blutplättchen sind Blutkörperchen, die sich zusammenballen können und so Blutgerinnsel bilden. Bei ahus können die Blutplättchen sehr einfach Blutgerinnsel bilden und da sie verbraucht werden, um Gerinnsel zu bilden, kann aus einem Bluttest hervorgehen, dass Sie eine geringe Anzahl von Blutplättchen in Ihrem Blut haben. Rote Blutkörperchen (RBK) Blutkörperchen, die Sauerstoff transportieren, indem sie einen Proteinkomplex benutzen, der Hämoglobin genannt wird. Bei ahus werden rote Blutkörperchen vernichtet, wenn sie durch die blockierten und unterbrochenen kleinen Blutgefäße transportiert werden. Thrombose (thrombotische Ereignisse) Die Bildung eines Blutgerinnsels, wodurch die Durchblutung durch ein Blutgefäß blockiert werden kann. Bei ahus können Blutgerinnsel in kleinen Blutgefäßen vorkommen, meist im Gehirn, in den Nieren, im Herzen und in anderen Organen. Thrombotische Mikroangiopathie (TMA) Eine Beschreibung des Prozesses bei ahus, bei dem kleine Blutgefäße vernichtet werden und in diesen beschädigten Blutgefäßen Blutgerinnsel gebildet werden. TMA wird durch eine chronische und übermäßige Aktivierung des Komplementsystems verursacht, was bei Patienten mit ahus zu Schädigung und Erkrankung führt. 3
4 Einleitung Dieser Leitfaden ist für Erwachsene und Jugendliche bestimmt, die am atypischen hämolytischurämischen Syndrom (ahus) leiden, sowie für Eltern von Kindern und Jugendlichen mit ahus. In diesem Leitfaden finden Sie Informationen über SOLIRIS, wie es Ihnen verabreicht wird, und wichtige Sicherheitsinformationen, die Sie kennen müssen. Es gibt noch einen anderen Leitfaden, der sich speziell an Eltern von Kleinkindern richtet und den Ihnen Ihr Arzt geben kann. Was ist SOLIRIS? SOLIRIS enthält den Wirkstoff Eculizumab und gehört zu einer Gruppe von Arzneimitteln, die als monoklonale Antikörper bezeichnet werden. Eculizumab bindet im Körper an ein bestimmtes Protein, das Entzündungen verursacht, und hemmt dieses. Dadurch wird verhindert, dass das Immunsystem des Körpers verletzliche Blutzellen angreift und zerstört. Atypisches hämolytisch-urämisches Syndrom SOLIRIS wird für die Behandlung von Erwachsenen und Kindern mit einer bestimmten Erkrankung des Blutsystems und der Nieren angewendet, die als atypisches hämolytisch-urämisches Syndrom (ahus) bezeichnet wird. Bei ahus-patienten können Nieren und Blutzellen, einschließlich der Blutplättchen durch Entzündungsprozesse beeinträchtigt sein. Dies kann zur Erniedrigung der Zahl der Blutzellen (Thrombozytopenie, Anämie), Einschränkung oder Verlust der Nierenfunktion, Blutgerinnseln, Müdigkeit und Funktionsstörungen führen. Eculizumab kann die Entzündungsreaktion des Körpers blockieren und damit auch seine Fähigkeit, die eigenen verletzlichen Blut- und Nierenzellen anzugreifen und zu zerstören. 4
5 Häufig gestellte Fragen WELCHE SICHERHEITSÜBERLEGUNGEN HÄNGEN MIT SOLIRIS ZUSAMMEN? WICHTIGE SICHERHEITSINFORMATIONEN Da SOLIRIS einen Teil Ihres Immunsystems blockiert, erhöht es das Risiko auf eine schwere Infektion und Sepsis, vor allem durch eine bestimmte Bakterie, Neisseria meningitidis genannt. Das kann Hirnhautentzündung verursachen, eine schwere Entzündung des Gehirns, oder eine schwere Infektion des Blutes. Diese Infektionen müssen dringend adäquat behandelt werden, weil sie schnell letal oder lebensbedrohlich werden können und weil sie zu schwerer Invalidität führen können. Es ist wichtig, dass Sie wissen, welche Vorsorgemaßnahmen getroffen werden müssen, um das Risiko auf diese Infektionen auf ein Minimum zu beschränken, und dass Sie wissen, was Sie tun müssen, wenn Sie vermuten, dass Sie vielleicht eine Infektion haben (siehe unten). Sicherheitsmaßnahme: Müssen Sie / Ihr Kind mindestens 2 Wochen vor der ersten Verabreichung von SOLIRIS gegen eine Meningokokkeninfektion geimpft werden. Wenn die Behandlung mit SOLIRIS früher als 2 Wochen nach einer Meningokokkenimpfung beginnen, müssen Sie / Ihr Kind bis 2 Wochen nach der Impfung mit geeigneten Antibiotika prophylaktisch behandelt werden, um das Risiko auf eine Infektion mit Neisseria meningitidis zu verringern. Ihr Arzt oder das medizinische Fachpersonal werden dafür sorgen, dass Sie diesen Impfstoff mindestens 2 Wochen vor Ihrer ersten Infusion erhalten. Wenn kein Impfstoff für Ihren kleines Kind erhältlich ist oder wenn der Impfstoff kontraindiziert ist, werden Sie bzw. wird Ihr Kind während der gesamten Behandlungsdauer Antibiotika erhalten. Wenn eine Impfung möglich ist, muss die Behandlung mit prophylaktischen Antibiotika bis 2 Wochen nach der Impfung fortgesetzt werden. Kinder und Jugendliche unter 18 Jahren müssen entsprechend den nationalen Impfempfehlungen für die verschiedenen Altersgruppen mindestens 2 Wochen vor Beginn der Behandlung mit SOLIRIS gegen Haemophilus influenzae und Pneumokokkeninfektionen geimpft werden. 5
6 Welche Symptome müssen mich während der Behandlung alarmieren? Eine Impfung senkt das Risiko auf eine Infektion, wird das Risiko aber nicht völlig ausschließen können. Sie müssen auf die Anzeichen und Symptome einer Infektion achten und müssen sich sofort an Ihren Arzt wenden, wenn EINES der folgenden Symptome auftritt: Kopfschmerzen mit Übelkeit oder Erbrechen Kopfschmerzen mit einem steifen Nacken oder Rücken Fieber Hautausschlag Verwirrtheit Starke Muskelschmerzen in Kombination mit grippeähnlichen Symptomen Lichtempfindlichkeit Wenn Sie Ihren Arzt nicht erreichen können, gehen Sie in die Notaufnahme und zeigen Sie dort die Karte mit Sicherheitsinformationen für Patienten. Als Eltern/Vormunde von Neugeborenen und Säuglingen müssen Sie daran denken, dass die typischen Symptome von Kopfschmerzen, Fieber und einem steifen Nacken vermutlich schwer zu erkennen sind. Daher müssen Sie bei Babys auf andere Symptome achten, wie nicht aktiv sein, Reizbarkeit, erbrechen und nicht essen wollen. 6
7 Muss ich bestimmte Schritte unternehmen, bevor ich mit einer Behandlung beginne? Bevor eine Behandlung mit SOLIRIS gestartet wird, wird Ihr Arzt mit Ihnen die Bedeutung folgender Punkte besprechen: Geimpft werden gegen Hirnhautentzündung und in bestimmten Fällen ein bestimmtes Antibiotikum erhalten, um das Risiko auf eine Infektion mit einer bestimmten Bakterie, Neisseria meningitidis genannt, auf ein Minimum zu beschränken. Die Symptome kennen, die mit Infektionen verbunden sind, und was Sie tun müssen, wenn Sie diese Symptome haben. Wenn Ihr Kind behandelt wird, müssen Sie wissen, dass es entsprechend den nationalen Impfempfehlungen mindestens 2 Wochen vor Beginn der Behandlung mit SOLIRIS gegen Haemophilus influenzae und Pneumokokkeninfektionen geimpft werden muss. Die Anwendung von SOLIRIS während der Schwangerschaft wird nicht empfohlen. Informieren Sie Ihren Arzt vor Beginn der Behandlung mit SOLIRIS, wenn Sie schwanger sind oder eine Schwangerschaft planen. Nach dem Aus-/Absetzen der Behandlung mit SOLIRIS müssen Sie durch Ihren Arzt sorgfältig überwacht werden. Ihr Arzt oder das medizinische Fachpersonal werden dafür sorgen, dass Sie / Ihr Kind mindestens 2 Wochen vor der ersten Behandlung mit SOLIRIS eine Impfstoff gegen eine Meningokokkeninfektion erhalten. Wenn die Behandlung mit SOLIRIS früher als 2 Wochen nach Verabreichung eines Meningokokkenimpfung begonnen wird, werden Ihr Arzt oder medizinische Fachpersonal dafür sorgen, dass Sie / Ihr Kind bis 2 Wochen nach der Impfung mit geeigneten Antibiotika prophylaktisch behandelt werden, um das Risiko einer Infektion mit Neisseria meningitidis zu verringern. Darüber hinaus werden Sie im Lauf Ihrer Behandlung genau auf eine Meningokokkeninfektion und andere Infektionen überwacht werden. 7
8 Wie beginne ich mit meiner Behandlung mit SOLIRIS? SOLIRIS muss durch einen Arzt verschrieben werden. Sie erhalten ein Starterpaket mit folgendem Inhalt: Eine Karte mit Sicherheitsinformationen für Patienten. Es ist für Patienten, die mit SOLIRIS behandelt werden, sehr wichtig, bestimmte Infektionen schnell zu erkennen und zu behandeln; daher erhalten Sie ein Sicherheitsinformationspaket, in dem Sie spezifische Symptome finden, auf die Sie immer achten müssen. Sie müssen diese Karte immer mit sich führen und sie medizinischem Fachpersonal zeigen, an das Sie sich wenden. Eine Informationsbroschüre für ahus-patienten und Eltern oder Betreuungspersonen von ahus-patienten Eine Informationsbroschüre für Eltern von kindern mit ahus wird den Eltern/Vormunden von Kleinkindern übergeben. Ihr Arzt wird Ihnen / Ihrem Kind vorschlagen, sich ins ahus-register aufnehmen zu lassen. Ihr Arzt kann das für Sie / Ihr Kind erledigen. Wie wird SOLIRIS verabreicht? SOLIRIS wird über eine intravenöse Infusion verabreicht (dabei läuft eine Flüssigkeit in eine Vene). Die Infusion dauert 25 bis 45 Minuten. Sie muss durch einen Arzt oder anderes ausgebildetes und befugtes medizinisches Fachpersonal zubereitet und verabreicht werden. Wie jedes andere Arzneimittel, das mit einer intravenösen Infusion verabreicht wird, kann SOLIRIS gleich oder später Nebenwirkungen verursachen. Wenden Sie sich an Ihren Arzt, wenn das der Fall ist. Weil das Risiko besteht, dass Sie auf die Infusion reagieren (zum Beispiel eine allergische Reaktion), werden Sie nach jeder Infusion ca. eine Stunde lang überwacht. Die Anweisungen Ihres Arztes müssen genau eingehalten werden. Es ist sehr wichtig, dass dafür gesorgt wird, dass Sie keinen geplanten Termin für die Behandlung auslassen oder aufschieben, sodass thrombotische Mikroangiopathie unter Kontrolle bleibt und Sie optimal von der Behandlung mit SOLIRIS profitieren. Die vollständigen Informationen über die korrekte Anwendung finden Sie in Abschnitt 3. der beiliegenden Packungsbeilage. 8
9 Wie lange werde ich SOLIRIS anwenden müssen? Da ahus eine chronische Erkrankung ist, ist SOLIRIS als bleibende Behandlung konzipiert. Patienten, die mit SOLIRIS begonnen haben, müssen die Behandlung fortsetzen, auch wenn sie sich besser fühlen. Eine Unterbrechung oder Beendigung der Behandlung mit SOLIRIS kann dazu führen, dass die Symptome von ahus erneut auftreten. Manche Patienten, die die Behandlung mit SOLIRIS beenden, stellen erneut die Anzeichen und Symptome von ahus fest. Sie dürfen die Behandlung mit SOLIRIS nicht beenden, ohne das vorab mit Ihrem Arzt zu besprechen, und auch nicht ohne ärztliche Aufsicht. Wenn Sie die Behandlung mit SOLIRIS beenden wollen, besprechen Sie vorab mit Ihrem Arzt die möglichen Nebenwirkungen und Risiken, darunter die erneut auftretende Zerstörung der kleinen Blutgefäße und die Bildung von Blutgerinnseln, die Folgendes verursachen können: - Symptome: weniger Wasser lassen (Nierenprobleme), Verwirrtheit oder Veränderung Ihrer Aufmerksamkeit. - Ergebnisse von Bluttests: eine starke Senkung der Anzahl der Blutplättchen, weil diese durch die Bildung von Blutgerinnseln verbraucht werden, eine verstärkte Zerstörung Ihrer roten Blutkörperchen, ein Anstieg des Kreatiningehalts im Serum (Probleme mit Ihren Nieren). - Schmerzen in der Brust oder Angina pectoris, Kurzatmigkeit. 9
10 Gibt es noch andere Dinge, an die ich während meiner Behandlung mit SOLIRIS denken muss? Infektionsrisiko Aufgrund der Art, auf die SOLIRIS in Ihrem Körper wirkt, muss es besonders vorsichtig verabreicht werden, wenn Sie eine aktive systemische Infektion haben. Allergische Reaktionen SOLIRIS enthält ein Protein, und Proteine können bei einigen Menschen allergische Reaktionen hervorrufen. Wenn Sie Anzeichen oder Symptome haben, nachdem Sie SOLIRIS erhalten haben, müssen Sie sich an Ihren Arzt wenden. Andere Arzneimittel Es ist wichtig zu wissen, dass manche Arzneimittel, die Sie einnehmen, nicht verändert werden dürfen, ohne vorab Ihren Arzt zu fragen. Sorgen Sie dafür, dass Ihr Arzt über alle Arzneimittel Bescheid weiß, die Sie anwenden. Schwangerschaft Die Anwendung von SOLIRIS während der Schwangerschaft wird nicht empfohlen. Informieren Sie Ihren Arzt vor Beginn der Behandlung mit SOLIRIS, wenn Sie schwanger sind oder eine Schwangerschaft planen. Frauen im gebärfähigen Alter müssen während der Behandlung und danach noch fünf Monate lang eine zuverlässige Verhütungsmethode anwenden. Stillzeit SOLIRIS kann über die Muttermilch auf Ihr Baby übergehen. Deshalb sollten Sie während der Behandlung mit SOLIRIS und danach noch fünf Monate lang nicht stillen. Ältere Patienten Es sind keine besonderen Vorsichtsmaßnahmen nötig bei der Behandlung von Patienten, die 65 Jahre und älter sind. Nebenwirkungen SOLIRIS wird im Allgemeinen gut vertragen. Die am häufigsten gemeldete Nebenwirkung war Kopfschmerz und die schwerste Nebenwirkung war Meningokokkensepsis. Die meisten Fälle von Kopfschmerzen waren leicht und gingen nach der ersten Verabreichungsphase von SOLIRIS vorbei. Wenn Sie eine Nebenwirkung bemerken, die nicht in dieser Broschüre angegeben ist, wenden Sie sich an Ihren Arzt oder Apotheker. Die vollständigen Informationen über empfohlene Vorsicht und über mögliche Nebenwirkungen finden Sie respektive in Abschnitt 2. und 4. der beiliegenden Packungsbeilage. 10
11 Sie sollten diese Patientensicherheitskarte immer bei sich tragen.
12 Für nähere Informationen über ahus oder über SOLIRIS schicken Sie eine an oder rufen Sie die Nummer +32 (0) an. Wenn Sie Fragen über die Sicherheit haben, schicken Sie eine an oder rufen Sie die Nummer +32 (0) an. Inhaber der Zulassung Alexion Europe SAS 1-15, avenue Edouard Belin Rueil-Malmaison FRANKREICH SOLIRIS ist eine Handelsmarke von Alexion Pharmaceuticals, Inc. Copyright 2017, Alexion Pharmaceuticals, Inc. Alle Rechte vorbehalten.
Informationsbroschüre für PNH-Patienten und Eltern oder Betreuungspersonen von
 BELANGRIJKE VEILIGHEIDSINFORMATIE 1 Ten gevolge van het werkingsmechanisme verhoogt het gebruik van SOLIRIS de vatbaarheid van de patiënt voor meningokokkeninfecties (Neisseria meningitidis). Derhalve
BELANGRIJKE VEILIGHEIDSINFORMATIE 1 Ten gevolge van het werkingsmechanisme verhoogt het gebruik van SOLIRIS de vatbaarheid van de patiënt voor meningokokkeninfecties (Neisseria meningitidis). Derhalve
Informationsbroschüre für Eltern von Kleinkindern mit ahus
 Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels SOLIRIS Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels SOLIRIS Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
FORMULAR FÜR DEN START DER BEHANDLUNG MIT TYSABRI
 Die europäischen Gesundheitsbehörden haben für die Markteinführung von TYSABRI Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information gehört - ist
Die europäischen Gesundheitsbehörden haben für die Markteinführung von TYSABRI Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information gehört - ist
Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage
 Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage 1 B. Packungsbeilage 1. Was ist und wofür wird es angewendet? [Dieser Abschnitt soll wie folgt gefasst werden:]
Geplante Änderungen an den relevanten Abschnitten der Packungsbeilage 1 B. Packungsbeilage 1. Was ist und wofür wird es angewendet? [Dieser Abschnitt soll wie folgt gefasst werden:]
EINE INFORMATION FÜR PATIENTEN ÜBER DIE BEHANDLUNG MIT OZURDEX
 Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels OZURDEX Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels OZURDEX Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
PATIENTENPASS FÜR PATIËNTEN, DIE MIT TYSABRI (NATALIZUMAB) BEHANDELT WERDEN
 (RMA angepasste Version 10/2016). PATIENTENPASS FÜR PATIËNTEN, DIE MIT TYSABRI (NATALIZUMAB) BEHANDELT WERDEN Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Zeigen Sie diesen Pass jedem
(RMA angepasste Version 10/2016). PATIENTENPASS FÜR PATIËNTEN, DIE MIT TYSABRI (NATALIZUMAB) BEHANDELT WERDEN Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Zeigen Sie diesen Pass jedem
Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
Broschüre zur Aufklärung von Patienten
 Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
Broschüre zur Aufklärung von Patienten Ihnen wurde Jinarc verordnet, weil Sie eine autosomal-dominante polyzystische Nierenerkrankung bzw. ADPKD haben, die ein Wachstum von Zysten in den Nieren verursacht.
Ihr Wegweiser zu. Information für Patienten
 Ihr Wegweiser zu Information für Patienten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können
Ihr Wegweiser zu Information für Patienten Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können
ahus: Entstehung, Symptome und Diagnostik
 ahus: Entstehung, Symptome und Diagnostik Prof. Dr. med. Thorsten Feldkamp 3. ahus-patienten- und Angehörigentag Universitätsklinikum Mainz 20. Juni 2015 Atypisches hämolytisches urämisches Syndrom Einführung
ahus: Entstehung, Symptome und Diagnostik Prof. Dr. med. Thorsten Feldkamp 3. ahus-patienten- und Angehörigentag Universitätsklinikum Mainz 20. Juni 2015 Atypisches hämolytisches urämisches Syndrom Einführung
Gebrauchsinformation: Information für Anwender. EVIT 600 I.E. Kapseln. Wirkstoff: RRR-alpha-Tocopherol (Vitamin E)
 Gebrauchsinformation: Information für Anwender EVIT 600 I.E. Kapseln Wirkstoff: RRR-alpha-Tocopherol (Vitamin E) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Gebrauchsinformation: Information für Anwender EVIT 600 I.E. Kapseln Wirkstoff: RRR-alpha-Tocopherol (Vitamin E) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
MEDIKAMENTE, DIE MYCOPHENOLAT ENTHALTEN Informationsbroschüre für Patienten. Informationen über die Risiken für den Fötus
 Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
Die Gesundheitsbehörden der Europäischen Union haben für Medikamente mit dem Wirkstoff Mycophenolat eine bedingte Zulassung erteilt. Diese Informationsbroschüre ist Teil des verbindlichen Plans zur Risikominimierung
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Broschüre zur Aufklärung von Patienten
 Die belgischen Gesundheitsbehörden haben bestimmte Voraussetzungen für das Inverkehrbringen des Arzneimittels JINARC erlassen. Der in Belgien vorgeschriebene Plan zur Risikominimierung, zu dem diese Information
Die belgischen Gesundheitsbehörden haben bestimmte Voraussetzungen für das Inverkehrbringen des Arzneimittels JINARC erlassen. Der in Belgien vorgeschriebene Plan zur Risikominimierung, zu dem diese Information
Sanvita Meno Tabletten
 Gebrauchsinformation: Information für Anwender Sanvita Meno Tabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifuga rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Sanvita Meno Tabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifuga rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten. Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt
 Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
MEDICA HALSSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, Spray zur Anwendung in der Mundhöhle Chlorhexidingluconat - Lidocain Hydrochlorid
 MEDICA HALSSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, Spray zur Anwendung in der Mundhöhle Chlorhexidingluconat - Lidocain Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
MEDICA HALSSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, Spray zur Anwendung in der Mundhöhle Chlorhexidingluconat - Lidocain Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Cefavora - Tropfen. Gebrauchsinformation: Information für Anwender
 1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
EINVERSTÄNDISERKLÄRUNG ZUR SCHUTZIMPFUNG
 EINVERSTÄNDISERKLÄRUNG ZUR SCHUTZIMPFUNG Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff BITTE
EINVERSTÄNDISERKLÄRUNG ZUR SCHUTZIMPFUNG Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff BITTE
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. EXACYL 500 mg/5 ml Injektionslösung
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN EXACYL 500 mg/5 ml Injektionslösung Tranexamsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN EXACYL 500 mg/5 ml Injektionslösung Tranexamsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Patienten. Tabletten gegen Magen-Darm-Beschwerden Similasan
 1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DOLPRONE 500 MG TABLETTE. Paracetamol
 Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DOLPRONE 500 MG TABLETTE Paracetamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für
Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DOLPRONE 500 MG TABLETTE Paracetamol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15.
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Cefuroxim Hexal 500 mg - Filmtabletten Wirkstoff: Cefuroximaxetil Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Cefuroxim Hexal 500 mg - Filmtabletten Wirkstoff: Cefuroximaxetil Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Visine 0,5 mg/ml Augentropfen, Lösung Tetryzolinhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Visine 0,5 mg/ml Augentropfen, Lösung Tetryzolinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Visine 0,5 mg/ml Augentropfen, Lösung Tetryzolinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER. NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG
 GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten. Allernon 10 mg-tabletten Wirkstoff: Loratadin
 Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten
 Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Aspirine 500 Brause, 500 mg, Brausetabletten Acetylsalicylsäure
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Aspirine 500 Brause, 500 mg, Brausetabletten Acetylsalicylsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Aspirine 500 Brause, 500 mg, Brausetabletten Acetylsalicylsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Orfadin 20 mg Hartkapseln. Orfadin 5 mg Hartkapseln Orfadin 10 mg Hartkapseln.
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Orfadin 2 mg Hartkapseln Orfadin 5 mg Hartkapseln Orfadin 10 mg Hartkapseln Orfadin 20 mg Hartkapseln Nitisinon Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Orfadin 2 mg Hartkapseln Orfadin 5 mg Hartkapseln Orfadin 10 mg Hartkapseln Orfadin 20 mg Hartkapseln Nitisinon Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Patienten. Osanit Hustenkügelchen Wirkstoff: Drosera D6
 Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6 Wirkstoff: Drosera D3/D4/D6 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6 Wirkstoff: Drosera D3/D4/D6 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten. Bromhexin Krewel Meuselbach Tropfen 12 mg/ml. Wirkstoff: Bromhexinhydrochlorid
 Gebrauchsinformation: Information für Patienten Bromhexin Krewel Meuselbach Tropfen 12 mg/ml Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Gebrauchsinformation: Information für Patienten Bromhexin Krewel Meuselbach Tropfen 12 mg/ml Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
ANWEISUNGSKARTE FÜR DEN PATIENTEN
 Der Plan zur Risikobegrenzung in Belgien, zu dem diese Information gehört, ist eine Maßnahme, die ergriffen wurde, um eine sichere und wirksame Anwendung fon ZypAdhera TM zu garantieren. (RMA modifizierte
Der Plan zur Risikobegrenzung in Belgien, zu dem diese Information gehört, ist eine Maßnahme, die ergriffen wurde, um eine sichere und wirksame Anwendung fon ZypAdhera TM zu garantieren. (RMA modifizierte
YERVOY (ipilimumab) Dieses Arzneimittel unterliegt einer zusëtzlichen Überwachung. Patiëntenfolder
 Die De Europese Europäischen gezondheidsautoriteiten Gesundheitsbehörden hebben haben bepaalde an voorwaarden die Zulassung verbonden des Arzneimittels aan het in de handel YERVOY brengen bestimmte van
Die De Europese Europäischen gezondheidsautoriteiten Gesundheitsbehörden hebben haben bepaalde an voorwaarden die Zulassung verbonden des Arzneimittels aan het in de handel YERVOY brengen bestimmte van
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid
 VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. - Heben Sie
VASOCEDINE PSEUDOEPHEDRINE 60 mg, Filmtabletten Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen. - Heben Sie
MenB Information - German
 Meningitis B Auf dieser Seite finden Sie eine kurze Übersicht über die Erkrankung und die Impfung, die Sie davor schützt. Genauere Informationen erhalten Sie über die Links, die unten auf der Seite bereitgestellt
Meningitis B Auf dieser Seite finden Sie eine kurze Übersicht über die Erkrankung und die Impfung, die Sie davor schützt. Genauere Informationen erhalten Sie über die Links, die unten auf der Seite bereitgestellt
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Terbinafin HCL acis 10 mg/g Creme Wirkstoff: Terbinafinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Terbinafin HCL acis 10 mg/g Creme Wirkstoff: Terbinafinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Impfungen für Personen über 60/65 Jahre... Grippe, Pneumokokken, Diphtherie und Tetanus
 Impfungen für Personen über 60/65 Jahre... Grippe, Pneumokokken, Diphtherie und Tetanus Impfungen ermöglichen unserem Körper, seine Abwehrkräfte zu organisieren. Das Immunsystem kann somit später schneller
Impfungen für Personen über 60/65 Jahre... Grippe, Pneumokokken, Diphtherie und Tetanus Impfungen ermöglichen unserem Körper, seine Abwehrkräfte zu organisieren. Das Immunsystem kann somit später schneller
GEBRAUCHSINFORMATION Information für den Anwender
 GEBRAUCHSINFORMATION Information für den Anwender ViroMed 400 mg - Tabletten Wirkstoff: Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION Information für den Anwender ViroMed 400 mg - Tabletten Wirkstoff: Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
1. Was ist Apis/Belladonna cum Mercurio und wofür wird es angewendet?
 WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Aciclovir Genericon 200 mg Tabletten. Wirkstoff: Aciclovir
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Aciclovir Genericon 200 mg Tabletten Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Aciclovir Genericon 200 mg Tabletten Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
1. Was ist TdaP-IMMUN und wofür wird es angewendet?
 Page 1 of 6 Gebrauchsinformation: Information für Anwender TdaP-IMMUN Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis- (azelluläre Komponente) Impfstoff (adsorbiert, reduzierter
Page 1 of 6 Gebrauchsinformation: Information für Anwender TdaP-IMMUN Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis- (azelluläre Komponente) Impfstoff (adsorbiert, reduzierter
PACKUNGSBEILAGE _F_GI_ _Hustentropfen GF 10% 1/6
 PACKUNGSBEILAGE 957562_F_GI_14-05-21_Hustentropfen GF 10% 1/6 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER BRONCHOSTOP Guaifenesin 10% Hustentropfen Wirkstoff: Guaifenesin Lesen Sie die gesamte Packungsbeilage
PACKUNGSBEILAGE 957562_F_GI_14-05-21_Hustentropfen GF 10% 1/6 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER BRONCHOSTOP Guaifenesin 10% Hustentropfen Wirkstoff: Guaifenesin Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDERINNEN. Donnafyta Premens, Filmtabletten. Agni casti extractum siccum
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDERINNEN Donnafyta Premens, Filmtabletten Agni casti extractum siccum Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDERINNEN Donnafyta Premens, Filmtabletten Agni casti extractum siccum Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für den Anwender. Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium
 Gebrauchsinformation: Information für den Anwender Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender Tilavist Augentropfen Wirkstoff: Nedocromil-Natrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Emgecard 2,5 mmol-filmtabletten
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Emgecard 2,5 mmol-filmtabletten Magnesium-L-aspartat-hydrochlorid-trihydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Emgecard 2,5 mmol-filmtabletten Magnesium-L-aspartat-hydrochlorid-trihydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Aciclovir Genericon 400 mg Tabletten. Wirkstoff: Aciclovir
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Aciclovir Genericon 400 mg Tabletten Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Aciclovir Genericon 400 mg Tabletten Wirkstoff: Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Mycostatin - orale Suspension
 Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Mycostatin - orale Suspension Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Mycostatin - orale Suspension Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
IMPLANON NXT Erläuternde Broschüre für Patientinnen
 Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Homviotensin. Mischung zum Einnehmen
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Homviotensin Mischung zum Einnehmen Wirkstoffe: Cactus Dil. D1, Viscum album Urtinktur, Rauwolfia Dil. D3, Crataegus Urtinktur Lesen Sie bitte die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Homviotensin Mischung zum Einnehmen Wirkstoffe: Cactus Dil. D1, Viscum album Urtinktur, Rauwolfia Dil. D3, Crataegus Urtinktur Lesen Sie bitte die gesamte
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12 Wirkstoff: Phosphorus D4/D6/D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12 Wirkstoff: Phosphorus D4/D6/D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Iruxol Mono, Salbe Kollagenase N
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Iruxol Mono, Salbe Kollagenase N Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Iruxol Mono, Salbe Kollagenase N Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender ANGOCIN Anti-Infekt N Filmtabletten Wirkstoffe: Kapuzinerkressenkrautpulver und Meerrettichwurzelpulver Bitte lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für den Anwender ANGOCIN Anti-Infekt N Filmtabletten Wirkstoffe: Kapuzinerkressenkrautpulver und Meerrettichwurzelpulver Bitte lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 ENR: 2602488 Uro-Vaxom GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Uro-Vaxom 6 mg Hartkapseln Wirkstoff: E. coli-fraktionen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
ENR: 2602488 Uro-Vaxom GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Uro-Vaxom 6 mg Hartkapseln Wirkstoff: E. coli-fraktionen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Anwender. LOMUSOL Augentropfen. Wirkstoff: Dinatriumcromoglicat
 Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender. Travogen - Creme. Isoconazolnitrat
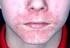 1 Gebrauchsinformation: Information für Anwender Travogen - Creme Isoconazolnitrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
1 Gebrauchsinformation: Information für Anwender Travogen - Creme Isoconazolnitrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
Zur Anwendung bei Erwachsenen und Heranwachsenden ab 12 Jahren
 Gebrauchsinformation: Information für Patienten Aspecton Eukaps 100 mg magensaftresistente Weichkapseln Wirkstoff: Eukalyptusöl Zur Anwendung bei Erwachsenen und Heranwachsenden ab 12 Jahren Lesen Sie
Gebrauchsinformation: Information für Patienten Aspecton Eukaps 100 mg magensaftresistente Weichkapseln Wirkstoff: Eukalyptusöl Zur Anwendung bei Erwachsenen und Heranwachsenden ab 12 Jahren Lesen Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Aciclovir Mylan 800 mg Tabletten Aciclovir
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Aciclovir Mylan 800 mg Tabletten Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Aciclovir Mylan 800 mg Tabletten Aciclovir Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Rheumon-Gel Wirkstoff:Etofenamat
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rheumon-Gel Wirkstoff:Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. -
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rheumon-Gel Wirkstoff:Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. -
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Levocetirizin Genericon 5 mg Filmtabletten. Levocetirizindihydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Levocetirizin Genericon 5 mg Filmtabletten Levocetirizindihydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Levocetirizin Genericon 5 mg Filmtabletten Levocetirizindihydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Gebrauchsinformation. Bitte lesen Sie die gesamte Gebrauchsinformation sorgfältig durch, denn sie enthält wichtige Informationen
 Gebrauchsinformation Bitte lesen Sie die gesamte Gebrauchsinformation sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne ärztliche Verschreibung erhältlich.
Gebrauchsinformation Bitte lesen Sie die gesamte Gebrauchsinformation sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne ärztliche Verschreibung erhältlich.
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN chronisch- Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN chronisch- Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
Gebrauchsinformation: Information für Patienten. Wirkstoffe: Stibium sulfuratum aurantiacum D12, Kalium iodatum D12, Polygala senega D8
 Globuli gegen Husten Nr. 2 Similasan 1 Gebrauchsinformation: Information für Patienten Globuli gegen Husten Nr. 2 Similasan Wirkstoffe: Stibium sulfuratum aurantiacum D12, Kalium iodatum D12, Polygala
Globuli gegen Husten Nr. 2 Similasan 1 Gebrauchsinformation: Information für Patienten Globuli gegen Husten Nr. 2 Similasan Wirkstoffe: Stibium sulfuratum aurantiacum D12, Kalium iodatum D12, Polygala
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Pentasa 1 g Zäpfchen. Mesalazin
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Pentasa 1 g Zäpfchen Mesalazin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Pentasa 1 g Zäpfchen Mesalazin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie
Gebrauchsinformation: Information für Anwender. Tranexamsäure Carino 100 mg/ml Injektionslösung. Tranexamsäure
 Gebrauchsinformation: Information für Anwender Tranexamsäure Carino 100 mg/ml Injektionslösung Tranexamsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender Tranexamsäure Carino 100 mg/ml Injektionslösung Tranexamsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid
 PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
PATIENTENAUFKLÄRUNG UND EINVERSTÄNDNISERKLÄRUNG zur Therapie mit Cyclophosphamid Sehr geehrte Patientin! Sehr geehrter Patient! Sie leiden unter einer schwerwiegenden entzündlichen Erkrankung des rheumatischen
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Furacine Soluble Dressing 2 mg/g Salbe Furacine 2 mg/ml Lösung zur Anwendung auf der Haut Nitrofural
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Furacine Soluble Dressing 2 mg/g Salbe Furacine 2 mg/ml Lösung zur Anwendung auf der Haut Nitrofural Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Furacine Soluble Dressing 2 mg/g Salbe Furacine 2 mg/ml Lösung zur Anwendung auf der Haut Nitrofural Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Iberogast Flüssigkeit zum Einnehmen Wirkstoffe: Bittere Schleifenblume, Angelikawurzel, Kamillenblüten, Kümmel, Mariendistelfrüchte, Melissenblätter, Pfefferminzblätter,
Gebrauchsinformation: Information für Anwender Iberogast Flüssigkeit zum Einnehmen Wirkstoffe: Bittere Schleifenblume, Angelikawurzel, Kamillenblüten, Kümmel, Mariendistelfrüchte, Melissenblätter, Pfefferminzblätter,
GEBRAUCHSINFORMATION Information für den Anwender. Sonstiger Bestandteil mit bekannter Wirkung: Lactose-Monohydrat 217,6 mg
 GEBRAUCHSINFORMATION Information für den Anwender ViroMed 200 mg - Tabletten Wirkstoff: Sonstiger Bestandteil mit bekannter Wirkung: Lactose-Monohydrat 217,6 mg Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION Information für den Anwender ViroMed 200 mg - Tabletten Wirkstoff: Sonstiger Bestandteil mit bekannter Wirkung: Lactose-Monohydrat 217,6 mg Lesen Sie die gesamte Packungsbeilage sorgfältig
Chloropotassuril 1 g/10 ml Lösung zum Einnehmen
 Roundup Var. IB.c.I.z. Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Chloropotassuril 1 g/10 ml Lösung zum Einnehmen Kaliumchlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Roundup Var. IB.c.I.z. Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Chloropotassuril 1 g/10 ml Lösung zum Einnehmen Kaliumchlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Pneumokokkenpolysaccharid-Konjugatimpfstoff (13-valent, adsorbiert)
 EMA/90006/2015 EMEA/H/C/001104 Zusammenfassung des EPAR für die Öffentlichkeit Pneumokokkenpolysaccharid-Konjugatimpfstoff (13-valent, adsorbiert) Dies ist eine Zusammenfassung des Europäischen Öffentlichen
EMA/90006/2015 EMEA/H/C/001104 Zusammenfassung des EPAR für die Öffentlichkeit Pneumokokkenpolysaccharid-Konjugatimpfstoff (13-valent, adsorbiert) Dies ist eine Zusammenfassung des Europäischen Öffentlichen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Kamillosan -Mundspray. Kamillenblütenauszug Pfefferminzöl Anisöl
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Wirkstoff: 1 überzogene Tablette enthält: Arzneilich wirksamer Bestandteil: Knoblauchzwiebel-Pulver 300 mg
 Gebrauchsinformation: Informationen für den Anwender Sapec, Knoblauchzwiebel-Pulver 300 mg, überzogene Tablette Wirkstoff: 1 überzogene Tablette enthält: Arzneilich wirksamer Bestandteil: Knoblauchzwiebel-Pulver
Gebrauchsinformation: Informationen für den Anwender Sapec, Knoblauchzwiebel-Pulver 300 mg, überzogene Tablette Wirkstoff: 1 überzogene Tablette enthält: Arzneilich wirksamer Bestandteil: Knoblauchzwiebel-Pulver
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Gelsemium-Homaccord -Tropfen
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Gelsemium-Homaccord -Tropfen Wirkstoffe: Gelsemium sempervirens, Toxicodendron quercifolium, Cimicifuga racemosa Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Gelsemium-Homaccord -Tropfen Wirkstoffe: Gelsemium sempervirens, Toxicodendron quercifolium, Cimicifuga racemosa Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER PROAGIL Rheuma- und Gicht-Tabletten Wirkstoffe: Causticum Hahnemanni Trit. D6, Ferrum phosphoricum Trit. D6, Ledum Trit. D2, Rhododendron Trit. D2 Lesen Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER PROAGIL Rheuma- und Gicht-Tabletten Wirkstoffe: Causticum Hahnemanni Trit. D6, Ferrum phosphoricum Trit. D6, Ledum Trit. D2, Rhododendron Trit. D2 Lesen Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER SINUTAB 500/30 mg Tabletten SINUTAB FORTE 500/60 mg Tabletten Paracetamol und Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER SINUTAB 500/30 mg Tabletten SINUTAB FORTE 500/60 mg Tabletten Paracetamol und Pseudoephedrinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig
EURE KINDER HABEN WIR AM LIEB- STEN.
 EURE KINDER HABEN WIR AM LIEB- STEN. MASERN SIND KEIN KINDER- SPIEL. Warum Sie sich und Ihre Kinder schützen sollen. MIT DER MMR- GRATIS- IMPFUNG Foto: Corbis MASERN SIND KEIN KINDERSPIEL! Masern sind
EURE KINDER HABEN WIR AM LIEB- STEN. MASERN SIND KEIN KINDER- SPIEL. Warum Sie sich und Ihre Kinder schützen sollen. MIT DER MMR- GRATIS- IMPFUNG Foto: Corbis MASERN SIND KEIN KINDERSPIEL! Masern sind
Gebrauchsinformation: Information für Anwender. Pneumovax 23 Injektionslösung in einer Durchstechflasche. Pneumokokken-Polysaccharid-Impfstoff
 Gebrauchsinformation: Information für Anwender Pneumovax 23 Injektionslösung in einer Durchstechflasche Pneumokokken-Polysaccharid-Impfstoff Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender Pneumovax 23 Injektionslösung in einer Durchstechflasche Pneumokokken-Polysaccharid-Impfstoff Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender. Inaktivierter Poliomyelitis-Impfstoff
 Gebrauchsinformation: Information für Anwender IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender. Euphrasia D3 Augentropfen Weleda
 1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia officinalis D3 Dilution Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia officinalis D3 Dilution Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: Information für den Anwender
 Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben GEBRAUCHSINFORMATION: Information für den Anwender Dexagel 1 g viskosierte Augentropfen enthält 0,985 mg Dexamethasondihydrogenphosphat-Dinatrium
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben GEBRAUCHSINFORMATION: Information für den Anwender Dexagel 1 g viskosierte Augentropfen enthält 0,985 mg Dexamethasondihydrogenphosphat-Dinatrium
Ampho-Moronal Suspension
 Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Ampho-Moronal Suspension Wirkstoff: Amphotericin B Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Ampho-Moronal Suspension Wirkstoff: Amphotericin B Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Sangenor Trinkampullen. Wirkstoff: Mono-L-Arginin-L-Aspartat
 43-STA-10/10-GI/1 2010-10-20/VT GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Sangenor Trinkampullen Wirkstoff: Mono-L-Arginin-L-Aspartat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn
43-STA-10/10-GI/1 2010-10-20/VT GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Sangenor Trinkampullen Wirkstoff: Mono-L-Arginin-L-Aspartat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DUPHALAC DRY 10 g Pulver zum Einnehmen Lactulose
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DUPHALAC DRY 10 g Pulver zum Einnehmen Lactulose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DUPHALAC DRY 10 g Pulver zum Einnehmen Lactulose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen
 Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Therapie mit Acitretin-haltigen Arzneimitteln: Was Sie wissen müssen Informationsbroschüre für männliche Patienten und Patientinnen, die nicht im gebärfähigen Alter sind Diese Informationsbroschüre wurde
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender Microlax Rektallösung Natriumcitrat 450 mg/5 ml Dodecyl(sulfoacetat), Natriumsalz 70 % 64,5 mg/5 ml Sorbitol-Lösung 70 % (kristallisierend) (Ph.Eur.)
Gebrauchsinformation: Information für den Anwender Microlax Rektallösung Natriumcitrat 450 mg/5 ml Dodecyl(sulfoacetat), Natriumsalz 70 % 64,5 mg/5 ml Sorbitol-Lösung 70 % (kristallisierend) (Ph.Eur.)
Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid
 Gebrauchsinformation: Information für den Anwender Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation: Information für den Anwender Mydocalm Filmtablette mit 50 mg Tolperisonhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
Gebrauchsinformation: Information für Anwender. APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen Wirkstoffe: Plantago major Dil. D4, Belladonna Dil. D6, Causticum Hahnemanni Dil. D30, Ferrum metallicum
Gebrauchsinformation: Information für Anwender APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen Wirkstoffe: Plantago major Dil. D4, Belladonna Dil. D6, Causticum Hahnemanni Dil. D30, Ferrum metallicum
Ihr Wegweiser zur. Therapie mit YERVOY (Ipilimumab)
 Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Yervoy unterliegt einer zusätzlichen Überwachung. Dies ermögicht eine schnelle Identifizierung neuer Erkenntnisse
Ihr Wegweiser zur Therapie mit YERVOY (Ipilimumab) Informationsbroschüre für Patienten Yervoy unterliegt einer zusätzlichen Überwachung. Dies ermögicht eine schnelle Identifizierung neuer Erkenntnisse
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Anwender. APOZEMA Blutarmut China complex Nr.38-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Blutarmut China complex Nr.38-Tropfen Wirkstoffe: China Dil. D5, Arsenicum album Dil. D6, Chininum arsenicosum Dil D6 und Pulsatilla Dil. D4 Lesen
Gebrauchsinformation: Information für Anwender APOZEMA Blutarmut China complex Nr.38-Tropfen Wirkstoffe: China Dil. D5, Arsenicum album Dil. D6, Chininum arsenicosum Dil D6 und Pulsatilla Dil. D4 Lesen
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
