zum Beschluss des Gemeinsamen Bundesausschusses
|
|
|
- Mathias Geisler
- vor 6 Jahren
- Abrufe
Transkript
1 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Transzervikale Radiofrequenzablation mit intrauteriner Ultraschallführung bei Uterusmyomen Vom 20. April 2017 Inhalt 1. Rechtsgrundlage Eckpunkte der Entscheidung Gegenstand und Anlass der Beratungsanforderung Beschreibung des theoretisch-wissenschaftlichen Konzepts der gegenständlichen Methode Wirkprinzip Anwendungsgebiet Kriterien der Prüfung der Einschlägigkeit des Bewertungsverfahrens Prüfung der Einschlägigkeit des Bewertungsverfahrens Maßgebliches Medizinprodukt mit hoher Risikoklasse Maßgebliches Medizinprodukt Medizinprodukt mit hoher Risikoklasse Neues theoretisch-wissenschaftliches Konzept Vorgaben in der Verfahrensordnung des G-BA Vorgehen bei der Prüfung auf wesentliche Unterschiede im Wirkprinzip Für die Prüfung herangezogene Herangehensweisen Wesentlichkeit des Unterschieds im Wirkprinzip Leistungsanspruch des gesetzlich Krankenversicherten bei Erfüllung der Voraussetzungen nach 137c SGB V Noch keine Prüfung nach 137h SGB V...10
2 3. Stellungnahmeverfahren Verfahrensablauf Fazit
3 1. Rechtsgrundlage Der Gemeinsame Bundesausschuss (G-BA) berät nach 137h Absatz 6 SGB V Krankenhäuser und Hersteller von Medizinprodukten im Vorfeld des Verfahrens zur Bewertung neuer Untersuchungs- und Behandlungsmethoden mit Medizinprodukten hoher Risikoklasse gemäß 137h SGB V über dessen Voraussetzungen und Anforderungen im Hinblick auf konkrete Methoden. Näheres zum Verfahren der Beratung ist im 2. Kapitel 38 i.v.m. Anlage VI der Verfahrensordnung des G-BA (VerfO) geregelt. Nach 2. Kapitel 38 Absatz 2 Satz 3 VerfO ist die Feststellung, ob eine Methode dem Bewertungsverfahren nach 2. Kapitel 33 Absatz 1 VerfO unterfällt, durch den G-BA einheitlich in Form eines Beschlusses zu treffen. Vor einem solchen Beschluss gibt der G-BA im Wege einer öffentlichen Bekanntmachung im Internet weiteren betroffenen Krankenhäusern sowie den jeweils betroffenen Medizinprodukteherstellern Gelegenheit zur Stellungnahme. 2. Eckpunkte der Entscheidung 2.1 Gegenstand und Anlass der Beratungsanforderung Mit Einreichung Unterlagen nach Anlage VI des 2. Kapitels der VerfO hat ein Medizinproduktehersteller als Beratungsinteressent (BI) eine Beratung gemäß 137h Absatz 6 SGB V angefordert. Gegenstand der Beratungsanforderung ist die Methode der transzervikalen Radiofrequenzablation mit intrauteriner Ultraschallführung bei Uterusmyomen (tzusg-rfa). Ausweislich seiner Anforderung wünscht der BI eine Antwort zu der Frage, ob die gegenständliche Methode dem Bewertungsverfahren nach 137h Absatz 1 Satz 4 SGB V unterfällt (Prüfung der Einschlägigkeit des Bewertungsverfahrens). Außerdem stellt er mehrere weitere Fragen im Rahmen der Beratung in Abschnitt IV des Formulars zur Beratungsanforderung. 2.2 Beschreibung des theoretisch-wissenschaftlichen Konzepts der gegenständlichen Methode Gemäß 2. Kapitel 31 Absatz 3 VerfO ist ein theoretisch-wissenschaftliches Konzept einer Methode die Beschreibung einer systematischen Anwendung bestimmter auf eine Patientin oder einen Patienten einwirkender Prozessschritte (Wirkprinzip), die das Erreichen eines diagnostischen oder therapeutischen Ziels in einer spezifischen Indikation (Anwendungsgebiet) wissenschaftlich nachvollziehbar erklären kann. Nachfolgend werden Wirkprinzip (2.2.1) und Anwendungsgebiet (2.2.2) der Methode beschrieben, auf die sich dieser Beschluss bezieht Wirkprinzip Bei der gegenständlichen Methode soll laut BI unter intrauteriner Ultraschallführung Hochfrequenzenergie über Nadelelektroden in das Innere eines zu behandelnden Uterusmyoms abgegeben (Ablation) und so die thermische Fixierung und Koagulationsnekrose erreicht werden, die eine Verkleinerung des Myoms bewirken sollen. Das Ziel der Behandlung besteht laut BI darin, die von den Uterusmyomen verursachten Beschwerden (starke Regelblutung [Hypermenorrhoe], Schmerzen [Dysmenorrhoe]) dauerhaft zu beseitigen. Das gesamte Ablationsvolumen wird laut BI durch die Strecke, wie weit die Nadeln in das Gewebe eindringen, und die Ablationszeit determiniert. Die Zeit wird nach dem Ausfahren der Nadeln unter Ultraschallkontrolle automatisch errechnet. Das bei der Methode zur Anwendung kommende Medizinprodukt setzt sich aus folgenden Produktkomponenten zusammen: 3
4 a) ein Ultraschallsystem inklusive eines speziell wiederverwendbaren intrauterinen Ultraschallwandlers b) ein einmal verwendbares intrauterines RFA-Ablationsgerät Anwendungsgebiet In den vom BI eingereichten Angaben wurde als Anwendungsgebiet der Methode die Behandlung von Patientinnen mit symptomatischen Leiomyomen des Uterus (synonym verwendet: Gebärmuttermyome, Uterusmyome) angegeben. Eine weitere Eingrenzung hinsichtlich der in Frage kommenden Patientinnen (z.b. Alter, bestehender Kinderwunsch, Myomgröße) wird nicht vorgenommen. Aus dem vom BI angegebenen Behandlungsziel der Linderung der Dysund Hypermenorrhoe kann abgeleitet werden, dass die Methode vornehmlich bei Frauen eingesetzt werden soll, die sich noch vor der Menopause befinden. Für das gegenständliche Verfahren kommen laut BI für eine vollständige Ablation Myome in Frage, die als submukös (1, 2 lt. FIGO 1 -Klassifikation) oder intramural (3,4 lt. FIGO) einzuordnen sind. Transmurale Myome des Typs 5 sowie subseröse Myome des Typs 6 können in dem von der thermischen Sicherheitsgrenze zugelassenen Maße nur teilweise abladiert werden. Ausgeschlossen von der Behandlung mit der hier gegenständlichen Methode sind nach Angaben des BI Patientinnengruppen mit folgenden Merkmalen: a) vorliegende Schwangerschaft, b) akute Beckeninfektion, c) bekanntes oder vermutetes gynäkologisches Malignom oder prämaligne Erkrankungen wie atypische Endometriumhyperplasie, d) mindestens ein intratubares Implantat zur Sterilisation, e) Blutgerinnungsstörungen oder aktuelle Antikoagulanzientherapie f) Myome mit extrauteriner Lage sowie gestielte Formen (intrakavitär [Typ 0] oder subserös [Typ 7]). 2.3 Kriterien der Prüfung der Einschlägigkeit des Bewertungsverfahrens Eine Feststellung dazu, ob eine Methode dem Bewertungsverfahren nach 137h Absatz 1 Satz 4 SGB V unterfällt, trifft der G-BA nach 2. Kapitel 38 Absatz 2 Satz 3 VerfO in Form eines Beschlusses. Hierfür prüft der G-BA, ob für die gegenständliche Methode zutrifft, dass a) ihre technische Anwendung maßgeblich auf einem Medizinprodukt mit hoher Risikoklasse im Sinne von 2. Kapitel 30 VerfO beruht, b) sie ein neues theoretisch-wissenschaftliches Konzept gemäß 2. Kapitel 31 VerfO aufweist, c) sie bei Erfüllung der Voraussetzungen nach 137c SGB V vom Leistungsanspruch des gesetzlich Krankenversicherten umfasst wäre und d) sie noch nicht nach 137h SGB V geprüft wurde oder wird. 2.4 Prüfung der Einschlägigkeit des Bewertungsverfahrens Die Prüfung des G-BA hat ergeben, dass die vier vorgenannten Kriterien für eine Bewertung gemäß 137h Absatz 1 Satz 4 SGB V erfüllt sind. Insofern sind dem G-BA derzeit keine 1 International Federation of Gynecology and Obstetrics 4
5 Sachverhalte bekannt, die bei regelgerechter Informationsübermittlung gemäß 137h Absatz 1 SGB V durch das Krankenhaus, das die erstmalige Anfrage gemäß 6 Absatz 2 Satz 3 des Krankenhausentgeltgesetzes zu der Methode stellt einer Bewertung gemäß 137h Absatz 1 Satz 4 SGB V entgegenstehen würden Maßgebliches Medizinprodukt mit hoher Risikoklasse Maßgebliches Medizinprodukt Die gegenständliche Methode tzusg-rfa beruht maßgeblich auf einem Medizinprodukt, nämlich der Kombination aus einem Ultraschallsystem und einem Radiofrequenzablationsgerät. Gemäß 2. Kapitel 32 Absatz 3 VerfO beruht die technische Anwendung einer Methode maßgeblich auf einem Medizinprodukt, wenn ohne dessen Einbeziehung (technische Anwendung) die Methode bei der jeweiligen Indikation ihr, sie von anderen Vorgehensweisen unterscheidendes, theoretisch-wissenschaftliches Konzept verlieren würde. Dies trifft auf das vorgenannte Medizinprodukt zu. Denn ohne dessen technische Anwendung wäre die ultraschallgeführte Einbringung von Hochfrequenzenergie in die Uterusmyome zum Ziel der Ablation des erkrankten Gewebes nicht möglich und die Methode würde ihr unter 2.2 beschriebenes theoretisch-wissenschaftliches Konzept verlieren. Der Einsatz des o.g. Medizinprodukts stellt offensichtlich ein Kernmerkmal (vgl. 2. Kapitel 22 Absatz 2 Satz 3 VerfO) des dargestellten Verfahrens dar Medizinprodukt mit hoher Risikoklasse Das Medizinprodukt auf dessen Einsatz die technische Anwendung der Methode maßgeblich beruht, ist ausweislich des CE-Zertifikats ein Medizinprodukt der Klasse IIb gemäß Anhang IX der Richtlinie 93/42/EWG. Ein solches Medizinprodukt ist gemäß 2. Kapitel 30 VerfO dann als Medizinprodukt hoher Risikoklasse einzustufen, wenn es mittels Aussendung von Energie oder Abgabe radioaktiver Stoffe gezielt auf wesentliche Funktionen von Organen oder Organsystemen, insbesondere des Herzens, des zentralen Kreislaufsystems oder des zentralen Nervensystems einwirkt und damit einen besonders invasiven Charakter aufweist. Für die Bestimmung der gezielten Einwirkung des Medizinprodukts ist seine der Zweckbestimmung entsprechende Anwendung zugrunde zu legen; dabei sind auch seine beabsichtigten und möglichen Auswirkungen auf die gesundheitliche Situation der Patienten zu betrachten (vgl. 2. Kapitel 30 Absatz 4a i.v.m. Absatz 3a Satz 2 VerfO). Die vorstehend aufgeführten Kriterien sind für die Anwendung der Kombination aus einem Ultraschallsystem und einem Radiofrequenzablationsgerät für das in Kapitel aufgeführte Anwendungsgebiet erfüllt, so dass sie als Medizinprodukt mit hoher Risikoklasse einzustufen ist. Ausweislich der vom BI zur Verfügung gestellten Informationen werden nach der mittels Ultraschall durchgeführten Lokalisation der Myome aus dem RFA-Handstück 7 Nadelelektroden in das Myom hinein ausgefahren. Das System gibt dann für eine bestimmte Zeitspanne eine kontrollierte Dosis von Radiofrequenzenergie ab, wobei die Zeitspanne auf der Größe der durch den Arzt ausgewählten Behandlungszone basiert. Dabei erhöht der Generator die Leistung langsam bis auf ein Maximum von 150 Watt, um die Zieltemperatur von 105 C an der Spitze der Elektroden zu erreichen. Vier der Elektroden verfügen über Thermoelemente, die eine permanente Messung durchführen; so soll sichergestellt werden, dass die maximal zulässige Temperatur der Elektroden (max. 105 C) eingehalten wird. Die Frage, ob die tzusg-rfa gezielt auf wesentliche Funktionen des Uterus einwirkt, wird nachfolgend geprüft. 5
6 Uterusmyome sind gutartige Tumorerkrankungen, die im Verlauf eine fortschreitende Entwicklung nehmen können und symptomatische Beeinträchtigungen bei den betroffenen Patientinnen auslösen können. So können sie u. a. zu starken Regelblutungen, Schmerzen und Fertilitätsstörungen führen. Die Folge dauerhaft zu starker Regelblutungen kann eine behandlungsbedürftige Blutarmut (Anämie) sein. Größere Uterusmyome können verdrängend wirken und auf benachbarte Organe wie die Blase oder den Darm drücken. Mit der gegenständlichen Methode wird Energie auf die Uterusmyome abgegeben, mit dem Ziel, diese teilweise oder auch vollständig zu abladieren. Dadurch sollen die vorgenannten Symptome verringert oder gar Symptomfreiheit erzielt werden. Zum einen kann damit auf die Reproduktionsfunktion des Uterus eingewirkt werden, wenn die Ablation der Myome zu einer Veränderung der Fertilität führt. Zum anderen kann mit der tzusg-rfa aber auch eine Gefährdung weiterer Funktionen des Uterus beeinflusst werden; nämlich die myombedingte maßgebliche Beeinträchtigung der gesundheitlichen Situation der Patientin durch Schmerzen oder übermäßige Blutungen, oder gar die Störung anderer Organe oder Organsysteme (wie z. B. die Blase oder das Blutsystem). Die tzusg-rfa wirkt durch die mit seiner Anwendung intendierte Symptomlinderung auch auf diese Funktion des Uterus ein. Zusammenfassend kann insofern abgeleitet werden, dass mit der tzusg-rfa eine gezielte Einwirkung auf wesentliche Organfunktionen des Uterus erfolgt Neues theoretisch-wissenschaftliches Konzept Vorgaben in der Verfahrensordnung des G-BA Gemäß 2. Kapitel 31 Absatz 1 VerfO weist eine Methode dann ein neues theoretisch-wissenschaftliches Konzept auf, wenn sich ihr Wirkprinzip oder Ihr Anwendungsgebiet von anderen, in der stationären Versorgung bereits eingeführten systematischen Herangehensweisen wesentlich unterscheidet. Gemäß 2. Kapitel 31 Absatz 2 VerfO gilt als eine bereits in die stationäre Versorgung eingeführte systematische Herangehensweise jede Methode, deren Nutzen einschließlich etwaiger Risiken im Wesentlichen bekannt ist. Wird eine Methode in jeweils einschlägigen methodisch hochwertigen Leitlinien oder anderen systematisch recherchierten Evidenzsynthesen als zweckmäßiges Vorgehen empfohlen, kann die Beurteilung insbesondere hierauf gestützt werden. Als eine bereits in der stationären Versorgung eingeführte systematische Herangehensweise gilt gemäß 2. Kapitel 31 Absatz 2 Satz 3 VerfO auch eine Methode, die maßgeblich auf Operationen oder sonstigen Prozeduren beruht, die spezifisch in dem vom Deutschen Institut für Medizinische Dokumentation und Information im Auftrag des Bundesministeriums für Gesundheit gemäß 301 Absatz 2 Satz 2 SGB V herausgegebenen Prozedurenschlüssel (OPS) in der am 23. Juli 2015 geltenden Fassung aufgeführt sind. Gemäß 2. Kapitel 31 Absatz 4 VerfO unterscheidet sich das Wirkprinzip einer Methode wesentlich von einer bereits eingeführten systematischen Herangehensweise, wenn der Unterschied in den beschriebenen Prozessschritten - dazu führt, dass der theoretisch-wissenschaftliche Begründungsansatz der eingeführten systematischen Herangehensweise nicht ausreicht, um den mit dem Einsatz der zu untersuchenden Methode bezweckten diagnostischen oder therapeutischen Effekt zu erklären und ihre systematische Anwendung zu rechtfertigen oder - zu einer derart veränderten Form der Einwirkung auf die Patientin oder den Patienten führt, dass eine Übertragung der vorliegenden Erkenntnisse zum Nutzen einschließlich 6
7 etwaiger Risiken der bereits eingeführten systematischen Herangehensweise auf die zu untersuchende Methode medizinisch wissenschaftlich nicht zu rechtfertigen ist. Gemäß 2. Kapitel 31 Absatz 5 VerfO unterscheidet sich das Anwendungsgebiet einer Methode wesentlich von einer bereits eingeführten systematischen Herangehensweise mit gleichem Wirkprinzip, wenn - der Unterschied in der spezifischen Indikation dazu führt, dass der theoretisch-wissenschaftliche Begründungsansatz der eingeführten systematischen Herangehensweise nicht ausreicht, um den mit dem Einsatz in der zu untersuchenden spezifischen Indikation bezweckten diagnostischen oder therapeutischen Effekt zu erklären und die systematische Anwendung in dieser Indikation zu rechtfertigen oder - bei der zu untersuchenden spezifischen Indikation im Unterschied zu der spezifischen Indikation der bereits eingeführten systematischen Herangehensweise eine derart abweichende Auswirkung zu erwarten ist oder bezweckt wird, dass eine Übertragung der vorliegenden Erkenntnisse zum Nutzen einschließlich etwaiger Risiken der bereits eingeführten systematischen Herangehensweise auf die zu untersuchende spezifische Indikation medizinisch-wissenschaftlich nicht zu rechtfertigen ist. Stellt der G-BA fest, dass sich eine Methode schon in einem der beiden vorgenannten Kriterien (Wirkprinzip oder Anwendungsgebiet) wesentlich von einer bereits eingeführten systematischen Herangehensweise unterscheidet, ist eine Überprüfung des jeweils anderen Kriteriums nicht erforderlich Vorgehen bei der Prüfung auf wesentliche Unterschiede im Wirkprinzip Bei der Prüfung, ob sich das Wirkprinzip der tzusg-rfa bei der Behandlung von Uterusmyomen von den Wirkprinzipien der bereits in die stationäre Versorgung eingeführten systematischen Herangehensweisen derart unterscheidet, dass die veränderte Form der Einwirkung auf die Patientin eine Übertragung der vorliegenden Erkenntnisse zum Nutzen einschließlich etwaiger Risiken der bereits in die stationäre Versorgung eingeführten systematischen Herangehensweisen auf die zu untersuchende Methode medizinisch-wissenschaftlich nicht zu rechtfertigen ist, geht der G-BA hier wie folgt vor: Alle in Frage kommenden Herangehensweisen zur Behandlung von Uterusmyomen werden zunächst in der Weise identifiziert, dass alle diesbezüglich vom BI genannten Herangehensweisen, Erwähnungen in darüber hinaus identifizierten Leitlinien oder in Frage kommende OPS-kodifizierte Herangehensweisen ermittelt werden. Diese werden dann daraufhin geprüft, ob sich die jeweiligen Wirkprinzipien wesentlich von dem der tzusg-rfa unterscheiden. Wird dies bejaht, kann dahingestellt bleiben, ob es sich dabei um eine bereits in die stationäre Versorgung eingeführte systematische Herangehensweisen handelt. Eine solche Prüfung wird erst dann vorgenommen, wenn sich eine Herangehensweise im Wirkprinzip nicht wesentlich von dem der gegenständlichen Methode unterscheidet. Die letztgenannte Prüfung ist hier nicht erforderlich, da sich das Wirkprinzip tzusg-rfa wesentlich von allen nach den vorgenannten Grundsätzen hier zu betrachtenden Herangehensweisen unterscheidet (s. Kapitel 2.4.4). Behandlungen mit Arzneimitteln werden diesbezüglich nicht geprüft. Sie unterscheiden sich in den vorliegenden Anwendungsgebieten stets offensichtlich wesentlich in ihrem Wirkprinzip von der gegenständlichen Methode. Während Arzneimittel pharmakologisch, metabolisch oder immunologisch wirken, handelt es sich bei der tzusg-rfa um eine physikalisch-lokal applizierte Wirkung. 7
8 Für die Prüfung herangezogene Herangehensweisen Für die Prüfung auf wesentliche Unterschiede im Wirkprinzip im Vergleich zur tzusg-rfa zur Behandlung der Uterusmyome werden die nachfolgend aufgeführten Herangehensweisen zur Behandlung der Uterusmyome herangezogen, die vom BI genannt oder in einer Leitlinie der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (Indikation und Methodik der Hysterektomie bei benignen Erkrankungen) 2 adressiert werden oder denen ein OPS-Code (siehe Tabelle) zugeordnet ist. Im Einzelnen handelt es sich um - die Hysterektomie (vaginal, laparoskopisch, abdominal), - die Myomektomie (vaginal/hysteroskopisch, laparoskopisch, abdominal) mit oder ohne ausgedehnte Naht des Endometriums, - die Embolisierung der Uterusarterie (UAE) sowie - den fokussierten Ultraschall (MRgFUS; magnetic resonance imaging-guided focused ultrasound surgery bzw. HiFu: high-intensity focused ultra-sound). Herangehensweisen OPS (Version 2017) Hysterektomie (vaginal, laparoskopisch, abdominal) Myomektomie (vaginal/hysteroskopisch, laparoskopisch, abdominal) mit oder ohne ausgedehnte Naht des Myometriums Uterusexstirpation [Hysterektomie] 0 Offen chirurgisch (abdominal) 1 Vaginal 2 Vaginal, laparoskopisch assistiert 3 Endoskopisch (laparoskopisch) 4 Umsteigen endoskopisch - offen chi rurgisch 5 Umsteigen vaginal - offen chirur gisch Entfernung eines oder mehrerer Myome ohne ausgedehnte Naht des Myometriums 80 Offen chirurgisch (abdominal) 81 Vaginal, laparoskopisch assistiert 82 Endoskopisch (laparoskopisch) 83 Hysteroskopisch 84 Umsteigen endoskopisch - offen chirurgisch 85 Umsteigen vaginal - offen chirurgisch 86 Vaginal Entfernung eines oder mehrerer Myome mit ausgedehnter Naht des Myometriums 90 Offen chirurgisch (abdominal) 91 Vaginal, laparoskopisch assistiert 92 Endoskopisch (laparoskopisch) 93 Hysteroskopisch 94 Umsteigen endoskopisch - offen chi rurgisch 95 Umsteigen vaginal - offen chirurgisch 2 S3-Leitlinie (AWMF-Nr 015/070), Indikation und Methodik der Hysterektomie bei benignen Erkrankungen, gültig bis
9 Embolisierung von Ästen der Uterusarterie (UAE) Fokussierter Ultraschall (MRgFUS) 96 Vaginal Perkutan-transluminale Gefäßinter vention kh Selektive Embolisation mit Partikeln, andere Arterien abdominal und pelvin In Verbindung mit einem Zusatzkode aus 8-83b.1 sowie ggf. Zusatzkode 8-83b.k Exzision und Destruktion von erkranktem Gewebe des Uterus 65 Magnetresonanz-gesteuerte fokussierte Ultraschallkoagulation [MRgFUS] Aus Sicht des G-BA gibt es keinen Anhaltspunkt dafür, dass weitere Herangehensweisen zur Behandlung von Uterusmyomen bestehen, die für einen Vergleich mit der gegenständlichen Methode relevant und hier nicht erfasst sind Wesentlichkeit des Unterschieds im Wirkprinzip Das Wirkprinzip der gegenständlichen Methode unterscheidet sich von den im Anwendungsgebiet bereits eingeführten systematischen Herangehensweisen. Dies wird folgendermaßen begründet: Die in genannten Herangehensweisen zur Behandlung von Uterusmyomen lassen sich im Wesentlichen zwei Gruppen zuordnen: Zum einen gibt es Verfahren, in denen Myome chirurgisch entfernt werden und solche, bei denen das Volumen der Myome reduziert wird. Der theoretisch-wissenschaftliche Begründungsansatz der chirurgischen Vorgehensweise ist die operative Entfernung von Myomgewebe (Myomektomie) oder des gesamten Uterus (Hysterektomie). Das chirurgische Vorgehen unterscheidet sich von der volumenreduzierenden Herangehensweise (medikamenteninduziert, hitzeinduziert) grundsätzlich darin, dass bei Letzterer das volumenreduzierte Myomgewebe nach der Behandlung im Körper verbleibt und erst im Laufe der Zeit resorbiert werden soll. Die tzusg-rfa gehört wie oben beschrieben zu den volumenreduzierenden Verfahren, bei denen das Myomgewebe verkleinert oder komplett sklerosiert und dann vom Körper resorbiert werden soll. Damit erübrigt sich für die Verfahren der Hysterektomie und Myomektomie eine vertiefte Prüfung, da in diesen Fällen der theoretisch-wissenschaftliche Begründungsansatz der chirurgischen Herangehensweise offensichtlich nicht ausreicht, um den mit dem Einsatz der tzusg- RFA bei Uterusmyomen bezweckten therapeutischen Effekt zu erklären und dessen systematische Anwendung zu rechtfertigen. Bei der perkutanen Katheterembolisation der Äste der Uterusarterien (UAE) oder der MRgFUS bzw. HiFu handelt es sich dagegen um zwei volumenreduzierende Vorgehensweisen mit untereinander abweichenden Wirkprinzipien. Diese werden im Folgenden dargestellt und jeweils mit dem Wirkprinzip der hier gegenständlichen Methode verglichen, um die Wesentlichkeit der identifizierten Unterschiede zu ermitteln. a) Das Wirkprinzip der tzusg-rfa unterscheidet sich von dem der UAE, weil hierfür ein perkutaner Zugang zum Gefäßsystem benötigt wird, während bei der gegenständlichen Methode Hochfrequenzenergie transzervikal zugeführt wird. Auch wenn es bei der gegenständlichen Methode zu thermischen Schädigungen benachbarter Organe kommen kann, so liegt doch schon im Ansatz beider Interventionen ein Unterschied 9
10 vor. Darüber hinaus führen beide Verfahren zwar zum Zelltod. Dieses Ziel wird allerdings durch sich unterscheidende Mechanismen erreicht: Bei der UAE durch Unterbrechung der Blutversorgung der Myome, bei der tzusg-rfa durch die in Kapitel beschriebenen. Diese Unterschiede sind insgesamt wesentlich, da der vorgenannte theoretisch-wissenschaftliche Begründungsansatz der UAE, also die Nekrotisierung durch Unterbindung der Gefäßversorgung, offensichtlich nicht ausreicht um den mit Einsatz der gegenständlichen Methode bezweckten Effekt der Nekrotisierung durch Hitzeentwicklung zu erklären. Zudem führen die Prozessschritte, insbesondere die Zugangswege (perkutaner Gefäßzugang und transzervikale Applikation) zu einer derart veränderten Form der Einwirkung auf die Patientinnen, dass eine Übertragung der vorliegenden Erkenntnisse zum Nutzen und Risiko der UAE auf die tzusg-rfa medizinisch-wissenschaftlich nicht zu rechtfertigen ist. b) Der Unterschied im Wirkprinzip der tzusg-rfa und der MRgFUS besteht zum einen darin, dass die Energiezufuhr bei der MRgFUS über die Haut der Bauchdecke erfolgt, während bei der gegenständlichen Methode Hochfrequenzenergie transzervikal zugeführt wird. Zum anderen unterscheiden sich die Energiequellen insofern offensichtlich wesentlich voneinander, dass bei der MRgFUS als Energiequelle hochfokussierter Ultraschall genutzt wird, bei der hier gegenständlichen Methode dagegen hochfrequenter Strom. Dies führt auch für die MRgFUS zu einer derart veränderten Form der Einwirkung auf die Patientinnen, dass eine Übertragung der vorliegenden Erkenntnisse zum Nutzen einschließlich etwaiger Risiken der auf die gegenständliche Methode medizinisch wissenschaftlich nicht zu rechtfertigen ist. Somit unterscheidet sich das Wirkprinzip der gegenständlichen Methode auch wesentlich von dem der MRgFUS-TUF Leistungsanspruch des gesetzlich Krankenversicherten bei Erfüllung der Voraussetzungen nach 137c SGB V Dem G-BA sind keine Informationen bekannt, die bei Erfüllung der Kriterien nach 137c SGB V einer Leistungserbringung der gegenständlichen Methode zu Lasten der gesetzlichen Krankenkassen entgegenstehen würden. Insbesondere erfüllt das Medizinprodukt, auf dessen Einsatz die technische Anwendung der Methode maßgeblich beruht, ausweislich der vorliegenden Produktinformationen die Voraussetzungen für das Inverkehrbringen gemäß 6 des Medizinproduktegesetzes. Der Einsatz des Medizinprodukts im Rahmen der gegenständlichen Methode ist vom medizinprodukterechtlich zulässigen Anwendungsbereich umfasst. Die Feststellung, dass die Methode bei Erfüllung der Voraussetzungen nach 137c SGB V vom Leistungsanspruch des gesetzlich Krankenversicherten umfasst wäre, ist nicht als rechtlich abschließend anzusehen; sollten zu einem späteren Zeitpunkt Rechtshindernisse eintreten oder offenkundig werden, kann der G-BA diese Feststellung revidieren und auch ein bereits begonnenes Bewertungsverfahren gemäß 137h SGB V ohne Beschlussfassung gemäß 2. Kap. 37 Absatz 1 VerfO beenden (vgl. 2. Kap. 33 Absatz 2 S. 2, 2. Halbsatz) Noch keine Prüfung nach 137h SGB V Der G-BA hat bislang keine Bewertung nach 137h Absatz 1 Satz 4 SGB zu der gegenständlichen Methode durchgeführt; es wurde auch noch keine Bewertung nach 137h Absatz 1 Satz 4 SGB V zu der Methode begonnen. 10
11 3. Stellungnahmeverfahren Der G-BA hat das Stellungnahmeverfahren gemäß 137h Absatz 6 Satz 3 SGB V i.v.m. 2. Kapitel 38 Absatz 3 VerfO zum Beschlussentwurf über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 VerfO am 10. Februar 2017 im Wege einer öffentlichen Bekanntmachung im Internet eingeleitet. Innerhalb der gesetzten Frist (4 Wochen) sind fünf schriftliche Stellungnahmen eingegangen (siehe Kapitel B der Zusammenfassenden Dokumentation). Drei Stellungnehmer haben eine mündliche Stellungnahme abgegeben. Aufgrund der schriftlich und mündlich vorgetragenen Argumente zu den zur Stellungnahme gestellten Beschlussinhalten ergaben sich keine neuen Aspekte und somit keine Notwendigkeit für Änderungen des Beschlusses. 4. Verfahrensablauf Datum Gremium Beratungsgegenstand / Verfahrensschritt UA MB Eingang der Beratungsanforderung gemäß 137h Absatz 6 SGB V zur Transzervikalen Radiofrequenzablation mit intrauteriner Ultraschallführung bei Uterusmyomen Einleitung des Stellungnahmeverfahrens gemäß 137h Absatz 6 Satz 3 SGB V (Veröffentlichung im Internet) AG 137e/h Auswertung der Stellungnahmen UA MB Anhörung und orientierende Befassung AG 137e/h Abschließende Befassung UA MB Abschließende Beratung und Beschlussempfehlung für das Plenum Plenum Beschlussfassung 5. Fazit Die Methode der tzusg-rfa unterfällt dem Verfahren nach 2. Kapitel 33 Absatz 1 VerfO, da sie die Voraussetzungen für eine Bewertung gemäß 137h Absatz 1 Satz 4 SGB V erfüllt: - Ihre technische Anwendung beruht maßgeblich auf einem Medizinprodukt mit hoher Risikoklasse im Sinne von 2. Kapitel 30 VerfO, - sie weist ein neues theoretisch-wissenschaftliches Konzept gemäß 2. Kapitel 31 VerfO auf, - bei Erfüllung der Voraussetzungen nach 137c SGB V wäre sie vom Leistungsanspruch des gesetzlich Krankenversicherten umfasst und - sie wurde oder wird noch nicht nach 137h SGB V geprüft. Berlin, den 20. April 2017 Gemeinsamer Bundesausschuss gemäß 91 SGB V Der Vorsitzende Prof. Hecken 11
zum Beschluss des Gemeinsamen Bundesausschusses
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Durchführung einer Bewertung nach 137h Absatz 1 Satz 4 SGB V: Externe Stabilisierung einer arteriovenösen A- nastomose mittels Gerüst
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Durchführung einer Bewertung nach 137h Absatz 1 Satz 4 SGB V: Externe Stabilisierung einer arteriovenösen A- nastomose mittels Gerüst
zum Beschluss des Gemeinsamen Bundesausschusses
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Elektrostimulation des peripheren Nervensystems durch
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Elektrostimulation des peripheren Nervensystems durch
zum Beschluss des Gemeinsamen Bundesausschusses
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Einsatz eines Vena-Cava-Filters gekoppelt mit einem
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Einsatz eines Vena-Cava-Filters gekoppelt mit einem
Abschlussbericht. 23. Januar 2017
 Abschlussbericht zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Elektrostimulation des peripheren Nervensystems
Abschlussbericht zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Elektrostimulation des peripheren Nervensystems
zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung:
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Magnetresonanztomographie-gesteuerte transurethrale
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Magnetresonanztomographie-gesteuerte transurethrale
Tragende Gründe. Vom 19. Oktober 2017
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Endovaskulärer femoro-poplitealer Bypass mittels
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Endovaskulärer femoro-poplitealer Bypass mittels
Tragende Gründe. Vom 4. Oktober 2018
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Fokale vaskuläre photodynamische Therapie mit Padeliporfin
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Fokale vaskuläre photodynamische Therapie mit Padeliporfin
Delegiertenkonferenz der AWMF. Frankfurt/Main,
 Delegiertenkonferenz der AWMF Frankfurt/Main, 05.11.2016 Die Medizinproduktemethoden-Bewertung nach 137h SGB V - Wie kommt das Wissen in den Prozess? RA Andreas Propp Justiziar Gliederung I. Rechtsgrundlage
Delegiertenkonferenz der AWMF Frankfurt/Main, 05.11.2016 Die Medizinproduktemethoden-Bewertung nach 137h SGB V - Wie kommt das Wissen in den Prozess? RA Andreas Propp Justiziar Gliederung I. Rechtsgrundlage
zum Beschluss des Gemeinsamen Bundesausschusses
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Bewertung nach 137h SGB V: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung von Leiomyomen des Uterus
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Bewertung nach 137h SGB V: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung von Leiomyomen des Uterus
zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung:
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Koronare Lithoplastie bei koronarer Herzkrankheit
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Koronare Lithoplastie bei koronarer Herzkrankheit
zum Beschlussentwurf des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung:
 Abschlussbericht zum Beschlussentwurf des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Endoskopische duodenale Thermoablation bei
Abschlussbericht zum Beschlussentwurf des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Endoskopische duodenale Thermoablation bei
zum Beschlussentwurf des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung:
 Abschlussbericht zum Beschlussentwurf des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Koronare Lithoplastie bei koronarer Herzkrankheit
Abschlussbericht zum Beschlussentwurf des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Koronare Lithoplastie bei koronarer Herzkrankheit
Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse. Inhaltliche Voraussetzungen
 Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Informationsveranstaltung am 20. Mai 2016 Inhaltliche Voraussetzungen PD Dr. med. Matthias Perleth
Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Informationsveranstaltung am 20. Mai 2016 Inhaltliche Voraussetzungen PD Dr. med. Matthias Perleth
Auswirkungen europäischer Vorgaben auf die Nutzenbewertung von Methoden mit Medizinprodukten hoher Risikoklassen im G-BA
 Symposium der AWMF Ad-hoc-Kommission Nutzenbewertung Sektion Medizinprodukte MDR - Umsetzung Europäischer Regelungen Herausforderungen und Lösungswege Auswirkungen europäischer Vorgaben auf die Nutzenbewertung
Symposium der AWMF Ad-hoc-Kommission Nutzenbewertung Sektion Medizinprodukte MDR - Umsetzung Europäischer Regelungen Herausforderungen und Lösungswege Auswirkungen europäischer Vorgaben auf die Nutzenbewertung
zum Beschluss des Gemeinsamen Bundesausschusses
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Bewertung nach 137h SGB V: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung der Endometriose des
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Bewertung nach 137h SGB V: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung der Endometriose des
zum Beschluss des Gemeinsamen Bundesausschusses
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Bewertung nach 137h SGB V: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung von nicht chirurgisch
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Bewertung nach 137h SGB V: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung von nicht chirurgisch
Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse
 Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Informationsveranstaltung am 20. Mai 2016 Verfahrensordnung - Vorstellung des Verfahrens nach
Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Informationsveranstaltung am 20. Mai 2016 Verfahrensordnung - Vorstellung des Verfahrens nach
Tragende Gründe. Vom 20. November 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie: Anlage III Nummer 19 traditionell angewendete Vom 20. November 2014 Inhalt 1. Rechtsgrundlage... 2 2.
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie: Anlage III Nummer 19 traditionell angewendete Vom 20. November 2014 Inhalt 1. Rechtsgrundlage... 2 2.
Tragende Gründe. Vom 17. Dezember 2015
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinien über die ärztliche Betreuung während der Schwangerschaft und nach der Entbindung ( Mutterschafts-Richtlinien
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinien über die ärztliche Betreuung während der Schwangerschaft und nach der Entbindung ( Mutterschafts-Richtlinien
Vom 20. Januar Inhaltsverzeichnis. 1 Rechtsgrundlagen
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Beratungsverfahrens: Bewertung der Arthroskopie des Kniegelenks bei Kniegelenksarthrose (Gonarthrose) gemäß 135
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Beratungsverfahrens: Bewertung der Arthroskopie des Kniegelenks bei Kniegelenksarthrose (Gonarthrose) gemäß 135
Tragende Gründe. Vom 21. August 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Clopidogrel, Gruppe 1, in Stufe 1 nach 35 Absatz
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Clopidogrel, Gruppe 1, in Stufe 1 nach 35 Absatz
Tragende Gründe. Vom 18. Februar 2016
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einstellung eines Verfahrens zur Änderung der -Richtlinie (AM-RL): Anlage III Übersicht über Verordnungseinschränkungen und -ausschlüsse
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einstellung eines Verfahrens zur Änderung der -Richtlinie (AM-RL): Anlage III Übersicht über Verordnungseinschränkungen und -ausschlüsse
I. Die Verfahrensordnung wird wie folgt geändert: 1. Im Inhaltsverzeichnis werden nach 28 des zweiten Kapitels die folgenden Angaben ergänzt
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Verfahrensordnung: Verfahren für Bewertung von Methoden mit Medizinprodukten der hohen Risikoklassen aufgrund 137h SGB V Vom 17. März
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Verfahrensordnung: Verfahren für Bewertung von Methoden mit Medizinprodukten der hohen Risikoklassen aufgrund 137h SGB V Vom 17. März
Tragende Gründe. Vom 22. November 2018
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Einsatz von resorbierbaren, durch Ultraschall aktivierbaren
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Einsatz von resorbierbaren, durch Ultraschall aktivierbaren
Tragende Gründe. Vom 21. Januar 2016
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Triazole, Gruppe 1, in Stufe 2 nach 35 Abs. 1
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Triazole, Gruppe 1, in Stufe 2 nach 35 Abs. 1
Tragende Gründe. Vom 19. Juni 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Venlafaxin bei neuropathischen Schmerzen Vom 19. Juni 2014
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Venlafaxin bei neuropathischen Schmerzen Vom 19. Juni 2014
Tragende Gründe. Vom 19. März 2015
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Einstellung der Methodenbewertung gemäß 137c des Fünften Buches Sozialgesetzbuch zu acht Methoden der Stammzelltransplantation
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Einstellung der Methodenbewertung gemäß 137c des Fünften Buches Sozialgesetzbuch zu acht Methoden der Stammzelltransplantation
Tragende Gründe. Vom 18. Dezember 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX - Festbetragsgruppenbildung Anlage X Aktualisierung von Vergleichsgrößen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX - Festbetragsgruppenbildung Anlage X Aktualisierung von Vergleichsgrößen
Tragende Gründe. Vom 12. November Inhaltsverzeichnis. 1. Rechtsgrundlagen. 2. Eckpunkte der Entscheidung. 3. Verfahrensablauf. 4.
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden Krankenhausbehandlung: Autologe Chondrozytenimplantation am Großzehengrundgelenk Vom 12. November
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden Krankenhausbehandlung: Autologe Chondrozytenimplantation am Großzehengrundgelenk Vom 12. November
Tragende Gründe. Vom 18. Oktober 2018
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage VI Off- Label-Use Teil A Ziffer III: Carboplatin bei fortgeschrittenem nicht-kleinzelligem
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage VI Off- Label-Use Teil A Ziffer III: Carboplatin bei fortgeschrittenem nicht-kleinzelligem
Tragende Gründe. Vom 15. August 2013
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Veranlassung einer Nutzenbewertung von Arzneimitteln im Bestandsmarkt nach 35a Abs. 6 SGB V i. V. m. 5. Kapitel 16 VerfO Vom 15.
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Veranlassung einer Nutzenbewertung von Arzneimitteln im Bestandsmarkt nach 35a Abs. 6 SGB V i. V. m. 5. Kapitel 16 VerfO Vom 15.
Tragende Gründe. Vom 15. Februar 2018
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden Krankenhausbehandlung: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden Krankenhausbehandlung: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung
Tragende Gründe. Vom 16. März 2018
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie über Maßnahmen der Qualitätssicherung in Krankenhäusern (QSKH- RL): Änderung 14 Verantwortliches Gremium
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie über Maßnahmen der Qualitätssicherung in Krankenhäusern (QSKH- RL): Änderung 14 Verantwortliches Gremium
Tragende Gründe. Vom 22. Mai 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Pramipexol, Gruppe 1, in Stufe 1 nach 35 Absatz 1 SGB V Vom
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Pramipexol, Gruppe 1, in Stufe 1 nach 35 Absatz 1 SGB V Vom
zum Beschluss des Gemeinsamen Bundesausschusses
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Bewertung nach 137h SGB V: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung von nicht chirurgisch
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Bewertung nach 137h SGB V: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung von nicht chirurgisch
Tragende Gründe. Vom 22. März 2019
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Erteilung des nach 87 Absatz 5b Fünften Buches Sozialgesetzbuch (SGB V) erforderlichen Einvernehmens zu der Verfahrensordnung des
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Erteilung des nach 87 Absatz 5b Fünften Buches Sozialgesetzbuch (SGB V) erforderlichen Einvernehmens zu der Verfahrensordnung des
Vom 15. Dezember Rechtsgrundlagen Eckpunkte der Entscheidung Verfahrensablauf Fazit Anhang...
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einstellung der Beratungen gemäß 137c SGB V zur allogenen Stammzelltransplantation mit nicht verwandtem Spender bei akuter lymphatischer
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einstellung der Beratungen gemäß 137c SGB V zur allogenen Stammzelltransplantation mit nicht verwandtem Spender bei akuter lymphatischer
Tragende Gründe. Vom 21. August 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinien über künstliche Befruchtung: Erforderliche Laboruntersuchungen und Gültigkeit der Testergebnisse Vom 21.
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinien über künstliche Befruchtung: Erforderliche Laboruntersuchungen und Gültigkeit der Testergebnisse Vom 21.
Anlage V zum 2. Kapitel VerfO
 Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse
Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse
Tragende Gründe. Vom 11. August Inhalt 1. Rechtsgrundlage Eckpunkte der Entscheidung Verfahrensablauf Anlage...
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Triazole,
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Triazole,
Tragende Gründe. Vom 21. April 2016
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie zur Empfängnisregelung und zum Schwangerschaftsabbruch: Änderung in Abschnitt B Empfängnisregelung hier:
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie zur Empfängnisregelung und zum Schwangerschaftsabbruch: Änderung in Abschnitt B Empfängnisregelung hier:
Richtlinie. des Gemeinsamen Bundesausschusses zur Erprobung der Magnetresonanztomographiegesteuerten
 Richtlinie des Gemeinsamen Bundesausschusses zur Erprobung der Magnetresonanztomographiegesteuerten hochfokussierten Ultraschalltherapie zur Behandlung des Uterusmyoms (MRgFUS-TUF) (Erprobungs-Richtlinie
Richtlinie des Gemeinsamen Bundesausschusses zur Erprobung der Magnetresonanztomographiegesteuerten hochfokussierten Ultraschalltherapie zur Behandlung des Uterusmyoms (MRgFUS-TUF) (Erprobungs-Richtlinie
Tragende Gründe. Vom 24. Mai 2012
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Doxorubicin bei Gliomrezidiv Vom 24. Mai 2012 Inhalt 1. Rechtsgrundlage...
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Doxorubicin bei Gliomrezidiv Vom 24. Mai 2012 Inhalt 1. Rechtsgrundlage...
zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie (SI-RL): Umsetzung STIKO-Empfehlungen August 2018
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie (SI-RL): Umsetzung STIKO-Empfehlungen August 2018 Vom 22. November 2018 Inhalt 1. Rechtsgrundlage...
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie (SI-RL): Umsetzung STIKO-Empfehlungen August 2018 Vom 22. November 2018 Inhalt 1. Rechtsgrundlage...
Tragende Gründe. Vom 17. Dezember 2015
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Antipsychotika, andere, Gruppe 1, in Stufe 2
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Antipsychotika, andere, Gruppe 1, in Stufe 2
Tragende Gründe. Vom 16. August 2018
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Verfahrensordnung (VerfO) Zusammenarbeit zwischen Bewertungsausschuss und G-BA nach 87 Abs. 5b Satz 6 SGB V: Änderung
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Verfahrensordnung (VerfO) Zusammenarbeit zwischen Bewertungsausschuss und G-BA nach 87 Abs. 5b Satz 6 SGB V: Änderung
Tragende Gründe. Vom 17. September Inhaltsverzeichnis. 1. Rechtsgrundlagen. 2. Eckpunkte der Entscheidung. 3. Verfahrensablauf. 4.
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden Krankenhausbehandlung: Protonentherapie bei altersabhängiger Makuladegeneration Vom 17. September
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden Krankenhausbehandlung: Protonentherapie bei altersabhängiger Makuladegeneration Vom 17. September
Vom 17. Februar Inhaltsverzeichnis. 1 Rechtsgrundlagen. 2 Eckpunkte der Entscheidung. 2.1 Antragsprüfung
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Beratungsverfahrens: Prüfung der EMDR (Eye-Movement-Desensitization and Reprocessing) als Methode der Einzeltherapie
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Beratungsverfahrens: Prüfung der EMDR (Eye-Movement-Desensitization and Reprocessing) als Methode der Einzeltherapie
Tragende Gründe. zum Beschluss des Gemeinsamen Bundesausschusses. über die Änderung des Beschlusses vom 19. Juni 2008 zur Änderung
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung des Beschlusses vom 19. Juni 2008 zur Änderung der Arzneimittel-Richtlinie in Anlage 4: Therapiehinweis zu Exenatide Vom
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung des Beschlusses vom 19. Juni 2008 zur Änderung der Arzneimittel-Richtlinie in Anlage 4: Therapiehinweis zu Exenatide Vom
Tragende Gründe. Vom 7. Januar 2016
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Tragende Gründe. Vom 16. April 2015
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Selektive Serotonin-Wiederaufnahmehemmer, Gruppe
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Selektive Serotonin-Wiederaufnahmehemmer, Gruppe
Bekanntmachung. Vom 22. März 2018
 Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen über eine Richtlinie zur Erprobung des ultraschallgesteuerten hoch-intensiven fokussierten Ultraschalls zur Behandlung
Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen über eine Richtlinie zur Erprobung des ultraschallgesteuerten hoch-intensiven fokussierten Ultraschalls zur Behandlung
Tragende Gründe. Vom 18. April 2013
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Mesalazin, Gruppe 3, in Stufe 1 nach 35 Absatz
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Mesalazin, Gruppe 3, in Stufe 1 nach 35 Absatz
Die neue Arzneimittel-Richtlinie und das Modul Arzneimittel der Verfahrensordnung des G-BA
 Informationsveranstaltung zur neuen Arzneimittel-Richtlinie Die neue Arzneimittel-Richtlinie und das Modul Arzneimittel der Verfahrensordnung des G-BA Vortrag von Dr. Rainer Hess, Vorsitzender des G-BA
Informationsveranstaltung zur neuen Arzneimittel-Richtlinie Die neue Arzneimittel-Richtlinie und das Modul Arzneimittel der Verfahrensordnung des G-BA Vortrag von Dr. Rainer Hess, Vorsitzender des G-BA
Tragende Gründe. Vom 16. März 2017
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Häusliche Krankenpflege-Richtlinie: Medikamentengabe und verrichtungsbezogene krankheitsspezifische Pflegemaßnahmen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Häusliche Krankenpflege-Richtlinie: Medikamentengabe und verrichtungsbezogene krankheitsspezifische Pflegemaßnahmen
Vom 20. Oktober Inhaltsverzeichnis
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden behandlung: Ablation der Prostata mittels Thulium-Laser zur Behandlung des benignen Prostatasyndroms
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden behandlung: Ablation der Prostata mittels Thulium-Laser zur Behandlung des benignen Prostatasyndroms
Tragende Gründe. zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie:
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie: Überarbeitung der Spaltenzuordnung in Anlage 1 Vom 17. Juni 2010 Inhaltsverzeichnis 1 Rechtsgrundlagen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie: Überarbeitung der Spaltenzuordnung in Anlage 1 Vom 17. Juni 2010 Inhaltsverzeichnis 1 Rechtsgrundlagen
Tragende Gründe. Vom 22. November Inhalt 1. Rechtsgrundlage Eckpunkte der Entscheidung Verfahrensablauf... 4
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses zur ambulanten Sanierungsbehandlung von Trägern des Methicillin-resistenten Staphylococcus aureus (MRSA) zu Lasten der gesetzlichen Krankenversicherung
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses zur ambulanten Sanierungsbehandlung von Trägern des Methicillin-resistenten Staphylococcus aureus (MRSA) zu Lasten der gesetzlichen Krankenversicherung
zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Festzuschuss- Richtlinie: Anpassung zahntechnischer Regelversorgungen
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Festzuschuss- Richtlinie: Anpassung zahntechnischer Regelversorgungen Vom 14. November 2013 Inhalt 1. Rechtsgrundlage...
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Festzuschuss- Richtlinie: Anpassung zahntechnischer Regelversorgungen Vom 14. November 2013 Inhalt 1. Rechtsgrundlage...
Tragende Gründe. Vom 9. Juli Inhalt 1. Rechtsgrundlage Eckpunkte der Entscheidung Verfahrensablauf Anlage...
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Serotonin-5HT3-Antagonisten,
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Serotonin-5HT3-Antagonisten,
BAnz AT B3. Bekanntmachung
 Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen über eine Richtlinie zur Erprobung des Einsatzes von aktiven Kniebewegungsschienen zur häuslichen Selbstanwendung
Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen über eine Richtlinie zur Erprobung des Einsatzes von aktiven Kniebewegungsschienen zur häuslichen Selbstanwendung
Die Verfahrensordnung zur Arzneimittelbewertung gemäß AMNOG Informationsveranstaltung des G-BA Berlin, 2. März 2011
 Die Verfahrensordnung zur Arzneimittelbewertung gemäß AMNOG Informationsveranstaltung des G-BA Berlin, 2. März 2011 Referent: Maximilian Grüne, Justiziar, Gemeinsamer Bundesausschuss 1. 35a SGB V. Rechtliche
Die Verfahrensordnung zur Arzneimittelbewertung gemäß AMNOG Informationsveranstaltung des G-BA Berlin, 2. März 2011 Referent: Maximilian Grüne, Justiziar, Gemeinsamer Bundesausschuss 1. 35a SGB V. Rechtliche
1. Rechtsgrundlage. 2. Eckpunkte der Entscheidung
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung -Richtlinie (AM-RL): Anlage VII Hinweise zur Austauschbarkeit von Darreichungsformen (aut idem) gemäß 129 Abs. 1a SGB
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung -Richtlinie (AM-RL): Anlage VII Hinweise zur Austauschbarkeit von Darreichungsformen (aut idem) gemäß 129 Abs. 1a SGB
Die künftige Finanzierung von Medizintechnik und Innovationen im Gesundheitswesen: Was geht?
 Die künftige Finanzierung von Medizintechnik und Innovationen im Gesundheitswesen: Was geht? Isabel Henkel Director Access & Reimbursement Johnson & Johnson Medical GmbH, Germany Marktzugang Erstattung
Die künftige Finanzierung von Medizintechnik und Innovationen im Gesundheitswesen: Was geht? Isabel Henkel Director Access & Reimbursement Johnson & Johnson Medical GmbH, Germany Marktzugang Erstattung
Tragende Gründe zum Beschluss. des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL):
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage 1 (OTC-Übersicht) Nr. 20 Ginkgo-biloba-Blätter-Extrakt Vom 14. April 2011 Inhaltsverzeichnis
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage 1 (OTC-Übersicht) Nr. 20 Ginkgo-biloba-Blätter-Extrakt Vom 14. April 2011 Inhaltsverzeichnis
Tragende Gründe. Vom 19. September 2013
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Benzodiazepin-verwandte Mittel, Gruppe 1, in
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Benzodiazepin-verwandte Mittel, Gruppe 1, in
Myomembolisation Uterusarterien-Embolisation UAE Uterine Fibroid Embolization UFE
 Myomembolisation Synonyme: Uterusarterien-Embolisation UAE Uterine Fibroid Embolization UFE Fast idealer Verlauf Pat., 1999 Reduktion der Myomgröße und des Uterusvolumens innerhalb von 3 Monaten mit spontaner
Myomembolisation Synonyme: Uterusarterien-Embolisation UAE Uterine Fibroid Embolization UFE Fast idealer Verlauf Pat., 1999 Reduktion der Myomgröße und des Uterusvolumens innerhalb von 3 Monaten mit spontaner
Tragende Gründe. Vom 8. Dezember Inhalt 1. Rechtsgrundlage Eckpunkte der Entscheidung Verfahrensablauf Anlage...
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Anlage
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Anlage
Tragende Gründe. zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie:
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie: Umsetzung der STIKO-Empfehlungen / Stand: Juli 2007 vom 18. Oktober 2007 Inhaltsverzeichnis
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Schutzimpfungs-Richtlinie: Umsetzung der STIKO-Empfehlungen / Stand: Juli 2007 vom 18. Oktober 2007 Inhaltsverzeichnis
Teil 1 des OP-Katalogs: alle teilnehmenden Krankenkassen
 Diese Anlage zum Vertrag wird jährlich zum 01.04. angepasst Teil 1 des OP-Katalogs: alle teilnehmenden Krankenkassen Nr 1 95201 95301 845,05 5-704.00 Vaginale Kolporrhaphie und Beckenbodenplasti k: Vorderwandplastik
Diese Anlage zum Vertrag wird jährlich zum 01.04. angepasst Teil 1 des OP-Katalogs: alle teilnehmenden Krankenkassen Nr 1 95201 95301 845,05 5-704.00 Vaginale Kolporrhaphie und Beckenbodenplasti k: Vorderwandplastik
Tragende Gründe. Vom 12. Januar Inhalt 1. Rechtsgrundlage Eckpunkte der Entscheidung Verfahrensablauf Anlage...
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Eplerenon,
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX Festbetragsgruppenbildung Eplerenon,
Tragende Gründe. Vom 21. Juli 2016
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinien zur Jugendgesundheitsuntersuchung: Regelungen über die Ausgestaltung der Empfehlung von Leistungen zur
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinien zur Jugendgesundheitsuntersuchung: Regelungen über die Ausgestaltung der Empfehlung von Leistungen zur
Gebärmuttermyome. Embolisationstheraphie ist eine Behandlungsalternative zur Operation
 Gebärmuttermyome Embolisationstheraphie ist eine Behandlungsalternative zur Operation Für weitere Informationen über die Behandlung von Gebärmuttermyomen sprechen Sie am besten mit Ihrem Gynäkologen oder
Gebärmuttermyome Embolisationstheraphie ist eine Behandlungsalternative zur Operation Für weitere Informationen über die Behandlung von Gebärmuttermyomen sprechen Sie am besten mit Ihrem Gynäkologen oder
BAnz AT B4. Bekanntmachung
 Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen über eine Richtlinie zur Erprobung der transkutanen Vagusnervstimulation bei pharmakoresistenter Epilepsie sowie
Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen über eine Richtlinie zur Erprobung der transkutanen Vagusnervstimulation bei pharmakoresistenter Epilepsie sowie
Tragende Gründe. Vom 20. März 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Die frühe Nutzenbewertung und ihre rechtlichen Herausforderungen
 und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
und ihre rechtlichen Herausforderungen Rechtssymposium Die frühe Nutzenbewertung von Arzneimitteln nach AMNOG G-BA, Berlin Referent: Dr. jur. Rainer Hess, G-BA Seite 1 16. November 2010 Rechtssymposium
Zusammenfassende Dokumentation
 Zusammenfassende Dokumentation über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Fingolimod
Zusammenfassende Dokumentation über die Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Fingolimod
Tragende Gründe. Vom 21. Juli 2016
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Gesundheitsuntersuchungs-Richtlinien: Regelungen über die Ausgestaltung der Empfehlung von Leistungen zur verhaltensbezogenen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Gesundheitsuntersuchungs-Richtlinien: Regelungen über die Ausgestaltung der Empfehlung von Leistungen zur verhaltensbezogenen
Leiden Sie an Myomen?
 Leiden Sie an Myomen? Information für Patientinnen HOLA Minimal-invasive Lasertherapie bei Myomen www.info-myome.de Was sind Myome? Ein Myom (medizinisch Leiomyom des Uterus ) ist eine gutartige Geschwulst
Leiden Sie an Myomen? Information für Patientinnen HOLA Minimal-invasive Lasertherapie bei Myomen www.info-myome.de Was sind Myome? Ein Myom (medizinisch Leiomyom des Uterus ) ist eine gutartige Geschwulst
Tragende Gründe. zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Rehabilitations-Richtlinie:
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Rehabilitations-Richtlinie: Anpassung an Datenschutzvorschriften Vom 22. Januar 2009 1 Rechtsgrundlagen... 2 2 Eckpunkte
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Rehabilitations-Richtlinie: Anpassung an Datenschutzvorschriften Vom 22. Januar 2009 1 Rechtsgrundlagen... 2 2 Eckpunkte
Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse
 Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Informationsveranstaltung am 20. Mai 2016 Formular zur Informationsübermittlung an den G-BA und
Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Informationsveranstaltung am 20. Mai 2016 Formular zur Informationsübermittlung an den G-BA und
Zusammenfassende Dokumentation
 Zusammenfassende Dokumentation zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage II - (Lifestyle Arzneimittel) (SPEDRA ) Vom 16. Oktober 2014
Zusammenfassende Dokumentation zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage II - (Lifestyle Arzneimittel) (SPEDRA ) Vom 16. Oktober 2014
Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen
 Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen über die Einführung neuer Untersuchungs- und Behandlungsmethoden und die Überprüfung erbrachter vertragszahnärztlicher Leistungen (NUB-Richtlinien)
Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen über die Einführung neuer Untersuchungs- und Behandlungsmethoden und die Überprüfung erbrachter vertragszahnärztlicher Leistungen (NUB-Richtlinien)
Tragende Gründe. Vom 18. Januar 2018
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Krebsfrüherkennungs-Richtlinie: Anpassung der Dokumentation der Früherkennungsuntersuchungen auf Hautkrebs Vom 18.
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Krebsfrüherkennungs-Richtlinie: Anpassung der Dokumentation der Früherkennungsuntersuchungen auf Hautkrebs Vom 18.
Tragende Gründe zum Beschluss über eine Änderung der Arzneimittel-Richtlinie
 Tragende Gründe zum Beschluss über eine Änderung der Arzneimittel-Richtlinie Anlage 8 (Lifestyle Arzneimittel) der Arzneimittel-Richtlinie nach 34 Abs. 1 Satz 7 i. V. m. Satz 9 SGB V Vom 18. Januar 2007
Tragende Gründe zum Beschluss über eine Änderung der Arzneimittel-Richtlinie Anlage 8 (Lifestyle Arzneimittel) der Arzneimittel-Richtlinie nach 34 Abs. 1 Satz 7 i. V. m. Satz 9 SGB V Vom 18. Januar 2007
Tragende Gründe. Vom 10. Oktober Inhalt 1. Rechtsgrundlage Eckpunkte der Entscheidung Verfahrensablauf... 3
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage I OTC-Übersicht Vom 10. Oktober
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage I OTC-Übersicht Vom 10. Oktober
Tragende Gründe zum Beschluss. des Gemeinsamen Bundesausschusses. über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Amantadin bei der Multiplen Sklerose zur Behandlung der Fatigue
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage VI Off-Label-Use Amantadin bei der Multiplen Sklerose zur Behandlung der Fatigue
BAnz AT B5. Bekanntmachung
 Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen über eine Richtlinie zur Erprobung der Tumortherapiefelder beim neu diagnostizierten Glioblastom sowie 2. zur
Bekanntmachung des Gemeinsamen Bundesausschusses (G-BA) 1. über die Aufnahme von Beratungen über eine Richtlinie zur Erprobung der Tumortherapiefelder beim neu diagnostizierten Glioblastom sowie 2. zur
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses. über die. Änderung der Richtlinien. Methoden Krankenhausbehandlung und
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Richtlinien Methoden Krankenhausbehandlung und Methoden vertragsärztliche Versorgung sowie der Verfahrensordnung: Berücksichtigung
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über die Änderung der Richtlinien Methoden Krankenhausbehandlung und Methoden vertragsärztliche Versorgung sowie der Verfahrensordnung: Berücksichtigung
Tragende Gründe. Vom 15. Februar 2018
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden Krankenhausbehandlung: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden Krankenhausbehandlung: Ultraschallgesteuerter hoch-intensiver fokussierter Ultraschall zur Behandlung
Tragende Gründe. Vom 21. Juni 2012
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX - Festbetragsgruppenbildung: Redaktionelle Anpassung der Bezeichnungen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX - Festbetragsgruppenbildung: Redaktionelle Anpassung der Bezeichnungen
Rechtsfragen zu dem Bewertungsverfahren nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse
 Rechtsfragen zu dem Bewertungsverfahren nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Rechtssymposium am 26. September 2016 Das Verfahren der Bewertung nach 137h SGB V in den
Rechtsfragen zu dem Bewertungsverfahren nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Rechtssymposium am 26. September 2016 Das Verfahren der Bewertung nach 137h SGB V in den
Endovaskuläre Arterialisierung tiefer Venen bei peripherer arterieller Verschlusskrankheit mit kritischer Extremitätenischämie
 Abschlussbericht zum Beschlussentwurf des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Endovaskuläre Arterialisierung tiefer Venen
Abschlussbericht zum Beschlussentwurf des Gemeinsamen Bundesausschusses über die Einschlägigkeit des Verfahrens gemäß 2. Kapitel 33 Absatz 1 Verfahrensordnung: Endovaskuläre Arterialisierung tiefer Venen
Die Liste verordnungsfähiger Medizinprodukte
 Die Liste verordnungsfähiger Medizinprodukte Informationsveranstaltung zur neuen Arzneimittel-Richtlinie des G-BA 22. September 2009, Berlin Birgit Hein Referentin, Abteilung Arzneimittel des G-BA Die
Die Liste verordnungsfähiger Medizinprodukte Informationsveranstaltung zur neuen Arzneimittel-Richtlinie des G-BA 22. September 2009, Berlin Birgit Hein Referentin, Abteilung Arzneimittel des G-BA Die
Bitte berücksichtigen Sie bei der Erarbeitung eines OPS-Vorschlags die Gesichtspunkte für zukünftige Revisionen des OPS in der aktuellen Fassung:
 Änderungsvorschlag für den OPS 2018 Bearbeitungshinweise 1. Bitte füllen Sie für inhaltlich nicht zusammenhängende Vorschläge jeweils ein eigenes Formular aus. 2. Füllen Sie dieses Formular elektronisch
Änderungsvorschlag für den OPS 2018 Bearbeitungshinweise 1. Bitte füllen Sie für inhaltlich nicht zusammenhängende Vorschläge jeweils ein eigenes Formular aus. 2. Füllen Sie dieses Formular elektronisch
BAnz AT 10.07.2013 B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über Maßnahmen zur Qualitätssicherung bei der Enukleation der Prostata mittels Thulium-Laser (TmLEP) zur Behandlung des benignen Prostatasyndroms (BPS) 21. März
Beschluss des Gemeinsamen Bundesausschusses über Maßnahmen zur Qualitätssicherung bei der Enukleation der Prostata mittels Thulium-Laser (TmLEP) zur Behandlung des benignen Prostatasyndroms (BPS) 21. März
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung des Beschlusses zur Neufassung der Arzneimittel-Richtlinie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung des Beschlusses zur Neufassung der Arzneimittel-Richtlinie / AM-RL vom 18. Dezember 2008: Einfügung des Abschnitts Q zur Verordnung besonderer
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung des Beschlusses zur Neufassung der Arzneimittel-Richtlinie / AM-RL vom 18. Dezember 2008: Einfügung des Abschnitts Q zur Verordnung besonderer
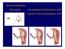
MYOME DER GEBÄRMUTTER
 MYOME DER GEBÄRMUTTER MYOME-BEHANDLUNG MIT DEM SONATA - SYSTEM SO LÄUFT DIE BEHANDLUNG MIT DEM SONATA-SYSTEM AB: 1 Der Arzt schiebt die Sonata-Sonde durch die Vagina in die Gebärmutter. 2 Die Lage des
MYOME DER GEBÄRMUTTER MYOME-BEHANDLUNG MIT DEM SONATA - SYSTEM SO LÄUFT DIE BEHANDLUNG MIT DEM SONATA-SYSTEM AB: 1 Der Arzt schiebt die Sonata-Sonde durch die Vagina in die Gebärmutter. 2 Die Lage des
Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse. Einbettung in die Methodenbewertung
 Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Informationsveranstaltung am 20. Mai 2016 Einbettung in die Methodenbewertung Dr. Dietrich Sonntag
Das Bewertungsverfahren des G-BA nach 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse Informationsveranstaltung am 20. Mai 2016 Einbettung in die Methodenbewertung Dr. Dietrich Sonntag
