ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EMA FÜR DEN WIDERRUF BZW
|
|
|
- Elizabeth Salzmann
- vor 5 Jahren
- Abrufe
Transkript
1 ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EMA FÜR DEN WIDERRUF BZW. DIE ÄNDERUNG DER RELEVANTEN ABSCHNITTE DER ZUSAMMENFASSUNGEN DER ARZNEIMITTEL-EIGENSCHAFTEN, DER ETIKETTIERUNG UND DER PACKUNGSBEILAGE, JE NACH ALTERSANGABE FÜR DIE ZUGELASSENE ZIELPOPULATION 12
2 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Terpenderivate enthaltenden Suppositorien (Zäpfchen) (siehe Anhang I) Terpenderivate enthaltende Zäpfchen wurden in Europa seit den 1950er Jahren über nationale Verfahren zugelassen und sind derzeit in sieben EU-Mitgliedsstaaten zugelassen und auf dem Markt. Diese Arzneimittel sind gewöhnlich indiziert zur unterstützenden Behandlung harmloser (leichter) akuter bronchialer Erkrankungen, insbesondere bei produktivem und trockenem Husten. Nach einer Sicherheitsüberprüfung, die die nationale französische Behörde im Mai 2010 zur Abklärung potenzieller neurologischer Risiken hauptsächlich Krampfanfällen durchführte, wurden Suppositorien, die Terpenderivate (einschließlich Kampfer, Cineol, Niaouli, Wildthymian, Terpineol, Terpin, Citral, Menthol und ätherische Öle aus Kiefernnadel, Eukalyptus und Terpentin) enthalten, in Frankreich für Kinder unter 30 Monaten und Kinder mit anamnestisch bekannten Fieberkrämpfen oder Epilepsien kontraindiziert. Anschließend machten die französischen Behörden am 27. Oktober 2010 eine entsprechende Meldung und leiteten ein Befassungsverfahren gemäß Artikel 31 Absatz 2 der Richtlinie 2001/83/EG ein, um die potenziellen neurologischen Risiken und ihre Auswirkungen auf das Nutzen-Risiko-Verhältnis von Terpenderivate enthaltenden Zäpfchen bei Kindern unter 30 Monaten zu bewerten. Das Verfahren begann im November Der CHMP bewertete die Gesamtheit der von den Inhabern der Genehmigung für das Inverkehrbringen vorgelegten Daten. Insbesondere prüfte der CHMP die Daten zu Suppositorien mit den Inhaltsstoffen Kampfer, Cineol (Eukalyptol) und Menthol, Niaouli, Thymus vulgaris und Cineol, Citral, Cineol (Eukalyptol), ätherisches Kiefernöl und Guaiakol, Terpentin - und Kiefernessenz. Der CHMP berücksichtigte daneben auch die 2010 von der nationalen französischen Behörde durchgeführte Sicherheitsüberprüfung. Nutzen In den Mitgliedsstaaten, in denen sie zugelassen sind, werden Terpenderivate enthaltende Zäpfchen seit Jahrzehnten zur Behandlung von harmlosen akuten bronchialen Erkrankungen und Schleimhautschwellungen im Mund- und Rachenbereich angewendet, insbesondere bei trockenem Husten. Kampfer, Menthol und Eukalyptol sind die aus präklinischer und klinischer Sicht am besten untersuchten Substanzen. Die Wirksamkeit wird hauptsächlich mit der traditionellen Anwendung dieser Arzneimittel begründet und durch Daten zu den pharmakodynamischen Eigenschaften und den Wirkungen als Hustenstiller und Entzündungshemmer in präklinischen Modellen gestützt. Die meisten klinischen Daten stammen aus offenen Studien oder aus der klinischen Praxis und Expertenmeinungen. Es gibt jedoch keine klinischen Daten aus Vergleichsstudien (randomisierten, kontrollierten Doppelblindstudien), gepoolten Analysen oder Metaanalysen zum Vergleich der Wirksamkeit von Terpenderivaten bei rektaler Anwendung, und es sind keine Studien verfügbar, die insbesondere die Anwendung bei Säuglingen und Kindern untersuchen. Risiken Die Daten wurden im Wesentlichen Spontanmeldungen, der wissenschaftlichen Literatur sowie präklinischen Daten entnommen. Der CHMP prüfte eine Reihe von Veröffentlichungen, die bestätigten, dass Terpenderivate beim Menschen Krampfanfälle auslösen können. Bei pädiatrischen Patienten wurden verschiedene unerwünschte Arzneimittelreaktionen (UAR) (einschließlich schwerwiegender Störungen des Nervensystems) beschrieben, so z. B. Krampfanfälle, Agitation, Somnolenz, Hypersomnie, Hypotonie, Desorientiertheit und Halluzinationen. Unter Berücksichtigung aller Systemorganklassen betrafen die beschriebenen unerwünschten Arzneimittelreaktionen hauptsächlich das Nervensystem, aber auch andere Erkrankungen, z. B. der Haut und der Atemwege, wurden festgestellt. Von besonderer Bedeutung sind dabei rektale Läsionen, wie z. B. rektales Brennen, wegen ihres Schweregrades und weil sie einen limitierenden Faktor für die Therapiedauer darstellen. Der CHMP stellte auch fest, dass von einer unvollständigen Erfassung solcher Ereignisse ausgegangen werden kann, da die Arzneimittel rezeptfrei erworben werden können. Darüber hinaus 13
3 wurden auch Abgabe- oder Anwendungsfehler festgestellt, sodass das verabreichte/verordnete Zäpfchen in einigen Fällen für das Alter oder Gewicht des Kindes nicht geeignet war. Der CHMP befasste sich auch mit der im Mai 2010 durchgeführten französischen Sicherheitsüberprüfung zur Anwendung von Terpenderivate enthaltenden Suppositorien bei Kindern. Dabei wurden in der nationalen Pharmakovigilanz-Datenbank und in den regelmäßig aktualisierten Sicherheitsberichten insgesamt 92 Fälle von unerwünschten Arzneimittelreaktionen gefunden; etwa 82 % (76/92) davon waren bei Kindern unter 30 Monaten aufgetreten. 30 Fälle betrafen neurologische Störungen, und es wurden 21 schwerwiegende Fälle mit plausiblem Zusammenhang gemeldet. In den Fällen, in denen ein Zeitintervall angegeben war, waren die neurologischen unerwünschten Arzneimittelreaktionen am Tag des Behandlungsbeginns aufgetreten. Medikationsfehler betrafen 5 neurologische unerwünschte Arzneimittelreaktionen; meistens waren Präparate für Kinder anstelle von Präparaten für Säuglinge verwendet worden. 6 Fälle einer lokalen Reizung und ein Fall einer Rektorrhagie mit unproblematischem Verlauf wurden festgestellt, außerdem 12 Fälle kutaner und 2 Fälle respiratorischer unerwünschter Arzneimittelreaktionen. Der CHMP stellte ferner fest, dass Terpenderivate, die auf anderen Wegen (kutan oder inhalativ) angewendet werden, ebenfalls mit dem Risiko neurologischer, kutaner und lokaler toxischer Reaktionen verbunden sind. Zwar gibt es bezüglich der genannten Aspekte keine direkten Vergleiche der Terpenderivate enthaltenden Suppositorien, und Zäpfchen können für Kinder, die eine Behandlung mit Salben nicht vertragen, eine brauchbare therapeutische Alternative darstellen, dennoch bestätigen die verfügbaren Daten nach Auffassung des CHMP, dass das Sicherheitsprofil der Terpenderivate bei rektaler Anwendung bei Säuglingen und Kindern problematisch ist. Betrachtet man die pharmakologischen Eigenschaften der Terpenderivate aus mechanistischer Sicht, so handelt es sich um unpolare (lipophile) Verbindungen mit einer Affinität zu unpolaren Strukturen im menschlichen Körper. Bei Säuglingen und Kindern, die wenig Fettmasse besitzen, ist dies besonders problematisch, weil die Substanzen stattdessen in das Zentralnervensystem (ZNS) übertreten, das in dieser Altersgruppe praktisch die einzige unpolare Struktur darstellt. Außerdem ist bekannt, dass als Zäpfchen verabreichte Arzneimittel aufgrund der Resorption durch die besonders stark vaskularisierte Rektalschleimhaut systemisch verteilt werden. Der CHMP stellte außerdem fest, dass es aufgrund der begrenzten Datenlage unmöglich ist zu belegen, ob es einen direkten Zusammenhang zwischen der zugeführten Dosis und den beobachteten unerwünschten Arzneimittelreaktionen gibt. Dies erachtete der CHMP als problematisch, insbesondere bei der Betrachtung der Fälle, in denen Kinder eine nicht angemessene Dosierung oder Zäpfchenzubereitung erhielten, beispielsweise weil die Eltern Zäpfchen, die für ältere Kinder verordnet worden waren, bei jüngeren Kindern oder Säuglingen in der Familie anwandten. Maßnahmen zur Risikominimierung Im Rahmen seiner Untersuchung forderte der CHMP die Inhaber der Genehmigungen für das Inverkehrbringen auf, Risikominimierungsmaßnahmen zur Behebung der festgestellten Risiken vorzuschlagen. Nach Prüfung der von den Inhabers der Genehmigungen für das Inverkehrbringen eingereichten Vorschläge (wie Aufnahme spezifischer Warnhinweise oder niedrigerer Gewichtsgrenzen, Begrenzung der Therapiedauer, Kontraindikation bei anamnestisch bekannten Anfällen/Epilepsien und Hervorhebung des Risikos von Wechselwirkungen mit anderen Terpenderivate enthaltenden Arzneimitteln, durch die das Risiko für neurologische Nebenwirkungen zunimmt) gelangte der CHMP zu der Auffassung, dass neben den vorgeschlagenen Maßnahmen eine Kontraindikation für Kinder unter 30 Monaten erforderlich ist, um das Risikoprofil von Terpenderivate enthaltenden Suppositorien adäquat zu gestalten. Der CHMP hielt es außerdem für erforderlich, die Behandlungsdauer in der verbleibenden pädiatrischen Population, in der das Arzneimittel zugelassen ist, aufgrund des Risikos von rektalem Brennen und den mit der Speicherung der Terpenderivate in Geweben und dem Gehirn (aufgrund ihrer lipophilen Eigenschaften sind Metabolisierungs- und Eliminierungsrate unbekannt) verbundenen Risiken, die zu neuropsychologischen Störungen führen können, auf 3 Tage zu befristen. 14
4 Nutzen-Risiko-Verhältnis Nach Durchsicht aller von den Inhabern der Genehmigungen für das Inverkehrbringen zur Anwendung Terpenderivate enthaltender Zäpfchen bei Kindern unter 30 Monaten vorgelegten Daten und unter Berücksichtigung der bei der französischen Sicherheitsüberprüfung 2010 erhobenen Daten gelangte der CHMP zu der Auffassung, dass Terpenderivate enthaltende Suppositorien bei Kindern unter 30 Monaten aufgrund der Unreife ihres Zentralnervensystems mit entsprechend erhöhter Anfälligkeit für neurologische toxische Wirkungen zu neurologischen Störungen, insbesondere Krampfanfällen, führen können. Daneben besteht bei Anwendung der Suppositorien auch das Risiko für rektales Brennen. Die von den Inhabern der Genehmigungen für das Inverkehrbringen vorgeschlagenen Risikominimierungsmaßnahmen wurden als unzureichend beurteilt, um das neurologische Risiko bei Kindern unter 30 Monaten auf ein akzeptables Maß zu reduzieren. In der pädiatrischen Population wurde nur eine begrenzte klinisch relevante Wirksamkeit nachgewiesen, für Kinder unter 30 Monaten liegen keine Daten zur Wirksamkeit vor. Infolgedessen vertrat der CHMP unter Berücksichtigung der neurologischen Toxizität sowie anderer unerwünschter Ereignisse in der pädiatrischen Population die Auffassung, dass das Nutzen-Risiko- Verhältnis von Terpenderivate enthaltenden Suppositorien bei Kindern unter 30 Monaten unter normalen Anwendungsbedingungen nicht positiv ist. Änderung der Produktinformation Der CHMP bewertete die von den Inhabern der Genehmigungen für das Inverkehrbringen vorgelegten Vorschläge für eine Überarbeitung der Produktinformation. Insbesondere schwankten die Mindestaltersempfehlungen bei einigen Arzneimitteln von der Neonatalzeit bis hin zu 1 Monat oder sogar 6 Monaten bei anderen. Um diese Diskrepanzen zu beheben und unter Berücksichtigung des Risikos altersbezogener Medikationsfehler beschloss der CHMP, bestimmte Textabschnitte der Produktinformationen zu harmonisieren. Die wesentliche vom CHMP formulierte Änderung, die je nach Relevanz für den Altersbereich der Zielgruppe in die Produktinformation aller Terpenderivate enthaltenden Suppositorien einzuarbeiten ist, betrifft in Abschnitt 4.3 die Aufnahme von Kontraindikationen bei Kindern unter 30 Monaten aufgrund des Risikos neurologischer Störungen, insbesondere von Krampfanfällen, als auch bei Kindern mit anamnestisch bekannten Fieberkrämpfen oder Epilepsien sowie bei Kindern mit erst kurz zurückliegenden anorektalen Läsionen. Außerdem wurde die Anwendungsdauer aufgrund der Risiken durch die Einlagerung von Terpenderivaten in Geweben und Gehirn sowie dem Risiko für rektales Brennen auf 3 Tage begrenzt. Schlussfolgerungen Zur Erstellung seines Gutachtens berücksichtigte der CHMP die Gesamtheit der verfügbaren Daten zur Sicherheit von Terpenderivate enthaltenden Suppositorien in der pädiatrischen Population und stellte dabei fest, dass die Daten zur Wirksamkeit in der pädiatrischen Population begrenzt sind, für Kinder unter 30 Monaten klinische Studien zum Nachweis eines therapeutischen Nutzens fehlen, Terpenderivate bekanntermaßen neurologische Toxizität aufweisen und das Risiko potenziell schwerwiegender neurologischer und lokaler Schäden sowie das Risiko von Medikationsfehlern durch irrtümliche Anwendung der Kinderpräparate bei Säuglingen besteht. Nach Auffassung des CHMP bestätigen die Daten, dass Terpenderivate enthaltende Suppositorien bei Kindern unter 30 Monaten neurologische Störungen, insbesondere Krampfanfälle, auslösen können. Diese Bedenken werden noch verstärkt durch die Tatsache, dass kein direkter Zusammenhang zwischen der Menge der zugeführten Terpenderivate und dem Auftreten oder dem Schweregrad unerwünschter Ereignisse belegt werden konnte. Die klinischen Daten zeigen, dass neurologische Störungen gehäuft bei Kindern unter 30 Monaten aufgrund der Unreife ihres Zentralnervensystems mit entsprechend erhöhter Anfälligkeit für neurologische toxische Wirkungen auftreten. Außerdem wurde in der pädiatrischen Population nur eine begrenzte klinisch relevante Wirksamkeit nachgewiesen, für Kinder unter 30 Monaten liegen keine Daten zur Wirksamkeit vor. Der CHMP gelangte daher zu dem Schluss, dass Terpenderivate enthaltende Suppositorien bei Kindern unter 30 Monaten sowie bei 15
5 Kindern mit anamnestisch bekannten Epilepsien oder Fieberkrämpfen und bei Kindern mit erst kurz zurückliegenden anorektalen Läsionen kontraindiziert werden sollten. Nach Auffassung des CHMP sollten Genehmigungen für das Inverkehrbringen mit breitem zugelassenem Altersspektrum dahingehend geändert werden, dass die Anwendung bei Kindern unter 30 Monaten kontraindiziert ist, während Genehmigungen für das Inverkehrbringen, die sich ausschließlich auf Kinder unter 30 Monaten beziehen, widerrufen werden sollten. Die Inhaber der Genehmigungen für das Inverkehrbringen und der CHMP einigten sich ferner auf einen Wortlaut für eine Mitteilung an die Fachkreise ( Direct Healthcare Professional Communication, DHPC), die an die relevanten Berufsgruppen im Gesundheitswesen (einschließlich Apotheker) versandt werden sollte, um die Verordnenden über die beschlossenen Kontraindikationen zu informieren. Begründung für den Widerruf der Genehmigung für das Inverkehrbringen bzw. die Änderung relevanter Abschnitte der Zusammenfassungen der Merkmale des Arzneimittels, der Etikettierung und der Packungsbeilage (je nach Altersangabe für die zugelassene Zielpopulation) In Erwägung nachstehender Gründe: Der CHMP prüfte die gesamten verfügbaren Daten einschließlich der französischen Sicherheitsüberprüfung von Insgesamt sind die Daten zur Wirksamkeit für die pädiatrische Population dünn und für Kinder unter 30 Monaten nicht vorhanden, weshalb der therapeutische Nutzen insgesamt als begrenzt angesehen wurde. Schwerwiegende unerwünschte Arzneimittelreaktionen (UAR) einschließlich neurologischer Ereignisse, hauptsächlich Krampfanfälle, wurden im Zusammenhang mit der Anwendung Terpenderivate enthaltender Zäpfchen bei Kindern unter 30 Monaten beobachtet. Eine verstärkte neurologische Toxizität bei Kindern unter 30 Monaten wurde als biologisch plausibel beurteilt, da die Unreife ihres Zentralnervensystems zu einer erhöhten Anfälligkeit führt. Eine Dosis-UAR-Beziehung konnte nicht belegt werden und das festgestellte Risiko unerwünschter neurologischer Ereignisse konnte nicht ausreichend durch andere Maßnahmen als eine Kontraindikation für diese Population behoben werden. Der CHMP gelangte zu der Auffassung, dass das Nutzen-Risiko-Verhältnis von Terpenderivate enthaltenden Suppositorien bei Kindern unter 30 Monaten unter normalen Anwendungsbedingungen nicht positiv ist und die Anwendung daher in dieser Altersgruppe sowie bei Kindern mit anamnestisch bekannten Epilepsien oder Fieberkrämpfen und bei Kindern mit erst kurz zurückliegenden anorektalen Läsionen kontraindiziert werden sollte. empfahl der CHMP den Widerruf bzw. die Änderung (je nach Altersangabe für die zugelassene Zielpopulation) der Genehmigungen für das Inverkehrbringen Terpenderivate enthaltender Suppositorien (siehe Anhang I). Die Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und der Packungsbeilage sind in Anhang III enthalten. 16
ENDGÜLTIGES GUTACHTEN DES AUSSCHUSSES FÜR ARZNEISPEZIALITÄTEN GEMÄSS ARTIKEL 12 DER RICHTLINIE 75/319/EWG DES RATES, EINSCHLIESSLICH ÄNDERUNGEN, FÜR
 The European Agency for the Evaluation of Medicinal Products Human Medicines Evaluation Unit CPMP/375/97-DE ENDGÜLTIGES GUTACHTEN DES AUSSCHUSSES FÜR ARZNEISPEZIALITÄTEN GEMÄSS ARTIKEL 12 DER RICHTLINIE
The European Agency for the Evaluation of Medicinal Products Human Medicines Evaluation Unit CPMP/375/97-DE ENDGÜLTIGES GUTACHTEN DES AUSSCHUSSES FÜR ARZNEISPEZIALITÄTEN GEMÄSS ARTIKEL 12 DER RICHTLINIE
Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für das befürwortende Gutachten für die Genehmigung für das Inverkehrbringen mit einer Auflage und die
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für das befürwortende Gutachten für die Genehmigung für das Inverkehrbringen mit einer Auflage und die
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN UND DER STÄRKEN DES ARZNEIMITTELS UND DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN
 ANHANG I VERZEICHNIS DER BEZEICHNUNGEN UND DER STÄRKEN DES ARZNEIMITTELS UND DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN Anhang A - Chlormezanon Mitgliedstaat Inhaber der
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN UND DER STÄRKEN DES ARZNEIMITTELS UND DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN Anhang A - Chlormezanon Mitgliedstaat Inhaber der
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Phantasiebezeichnung. inn:eucalyptol inn:gaiacol. Kampfer. Pholcodine Child
 ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORMEN, STÄRKEN, ARTEN DER ANWENDUNG, INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSSTAATEN 1 Mitgliedsstaat EU/EWR Inhaber der Zulassung
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORMEN, STÄRKEN, ARTEN DER ANWENDUNG, INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSSTAATEN 1 Mitgliedsstaat EU/EWR Inhaber der Zulassung
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 10 Wissenschaftliche Schlussfolgerungen Solu-Medrol 40 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung (im Folgenden Solu-Medrol genannt)
Anhang II Wissenschaftliche Schlussfolgerungen 10 Wissenschaftliche Schlussfolgerungen Solu-Medrol 40 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung (im Folgenden Solu-Medrol genannt)
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP ist unter Berücksichtigung
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP ist unter Berücksichtigung
Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für den Widerruf oder die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und die detaillierte Erklärung der Abweichungen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für den Widerruf oder die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und die detaillierte Erklärung der Abweichungen
Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Nimesulid enthaltenden Arzneimitteln zur systemischen Anwendung (siehe Anhang I)
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 41 Wissenschaftliche Schlussfolgerungen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 41 Wissenschaftliche Schlussfolgerungen
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 203 Wissenschaftliche Schlussfolgerungen Die Koordinierungsgruppe
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 203 Wissenschaftliche Schlussfolgerungen Die Koordinierungsgruppe
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 74 Wissenschaftliche Schlussfolgerungen Am 7. Juli 2016 veranlasste das Vereinigte Königreich ein Verfahren nach Artikel 31 der Richtlinie 2001/83/EG aufgrund
Anhang II Wissenschaftliche Schlussfolgerungen 74 Wissenschaftliche Schlussfolgerungen Am 7. Juli 2016 veranlasste das Vereinigte Königreich ein Verfahren nach Artikel 31 der Richtlinie 2001/83/EG aufgrund
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION
 ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang IV. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang IV Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP berücksichtigte
Anhang IV Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen Wissenschaftliche Schlussfolgerungen Der CHMP berücksichtigte
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des
Anhang III. Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 13 Wissenschaftliche Schlussfolgerungen Haldol, das den Wirkstoff Haloperidol enthält, ist ein Antipsychotikum aus der Gruppe der Butyrophenone. Es handelt
Anhang II Wissenschaftliche Schlussfolgerungen 13 Wissenschaftliche Schlussfolgerungen Haldol, das den Wirkstoff Haloperidol enthält, ist ein Antipsychotikum aus der Gruppe der Butyrophenone. Es handelt
Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Kytril und zugehörige Bezeichnungen (siehe Anhang I)
 ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS, DER ETIKETTIERUNG UND DER PACKUNGSBEILAGE
ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS, DER ETIKETTIERUNG UND DER PACKUNGSBEILAGE
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Aussetzung des Inverkehrbringens und der Anwendung der Arzneimittel
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Aussetzung des Inverkehrbringens und der Anwendung der Arzneimittel 14 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Aussetzung des Inverkehrbringens und der Anwendung der Arzneimittel 14 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
Anhang IV. Wissenschaftliche Schlussfolgerungen
 Anhang IV Wissenschaftliche Schlussfolgerungen 1 Wissenschaftliche Schlussfolgerungen Vier Fälle von schwerwiegenden Leberschäden, die eine Lebertransplantation erforderlich machten, wurden seit dem Inverkehrbringen
Anhang IV Wissenschaftliche Schlussfolgerungen 1 Wissenschaftliche Schlussfolgerungen Vier Fälle von schwerwiegenden Leberschäden, die eine Lebertransplantation erforderlich machten, wurden seit dem Inverkehrbringen
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 357 Wissenschaftliche Schlussfolgerungen und Begründung für
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 357 Wissenschaftliche Schlussfolgerungen und Begründung für
Sachstand zu den Antihistaminika Dimenhydrinat, Diphenhydramin und Doxylamin
 Sachstand zu den Antihistaminika Dimenhydrinat, Diphenhydramin und Doxylamin Sachverständigen-Ausschuss für Verschreibungspflicht 3. Juli 2018 Sachverständigen-Ausschuss für Verschreibungspflicht 3. Juli
Sachstand zu den Antihistaminika Dimenhydrinat, Diphenhydramin und Doxylamin Sachverständigen-Ausschuss für Verschreibungspflicht 3. Juli 2018 Sachverständigen-Ausschuss für Verschreibungspflicht 3. Juli
Name. Actonel Combi D. Norsedcombi 35 mg mg/880 IU. Norsed plus Calcium D. Optinate Plus Ca &D. Opticalcio D3 35 mg mg/880 IU
 ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORMEN, STÄRKEN DES ARZNEIMITTELS, ART DER ANWENDUNG, ANTRAGSTELLER UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN 1 Mitgliedstaat
ANHANG I VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORMEN, STÄRKEN DES ARZNEIMITTELS, ART DER ANWENDUNG, ANTRAGSTELLER UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN MITGLIEDSTAATEN 1 Mitgliedstaat
Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen
 23 April 2015 EMA/PRAC/273924/2015 Pharmacovigilance Risk Assessment Committee Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen Verabschiedet im Rahmen der PRAC-Sitzung
23 April 2015 EMA/PRAC/273924/2015 Pharmacovigilance Risk Assessment Committee Empfehlungen des PRAC zu Signalen für die Aktualisierung der Produktinformationen Verabschiedet im Rahmen der PRAC-Sitzung
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderungen der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderungen der Bedingungen für die Genehmigungen für das Inverkehrbringen 14 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderungen der Bedingungen für die Genehmigungen für das Inverkehrbringen 14 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung 5 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung 5 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen
Zusammenfassung der wissenschaftlichen Beurteilung der Befassung zu Antifibrinolytika Aprotinin enthaltende Arzneimittel (siehe Anhang I)
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Aufhebung der Aussetzung und die Änderung der Genehmigungen für das Inverkehrbringen für Aprotinin enthaltende Arzneimittel
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Aufhebung der Aussetzung und die Änderung der Genehmigungen für das Inverkehrbringen für Aprotinin enthaltende Arzneimittel
Pressemitteilung der EMEA vom in deutscher Übersetzung:
 Pressemitteilung der EMEA vom 9. 12. 2004 in deutscher Übersetzung: Außerordentliche Sitzung des CHMP zu Paroxetin und anderen selektiven Serotonin-Wiederaufnahmehemmern Der Ausschuss für Humanarzneimittel
Pressemitteilung der EMEA vom 9. 12. 2004 in deutscher Übersetzung: Außerordentliche Sitzung des CHMP zu Paroxetin und anderen selektiven Serotonin-Wiederaufnahmehemmern Der Ausschuss für Humanarzneimittel
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Es kann notwendig sein, dass die Änderungen in der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Es kann notwendig sein, dass die Änderungen in der Zusammenfassung
Anhang III. Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen bzw. die Aussetzung der Genehmigungen für das Inverkehrbringen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen bzw. die Aussetzung der Genehmigungen für das Inverkehrbringen
Methotrexat - Risiko der Überdosierung durch Anwendungsfehler. Verfahren nach Art. 31 der Richtlinie 2001/83/EG
 Methotrexat - Risiko der Überdosierung durch Anwendungsfehler Verfahren nach Art. 31 der Richtlinie 2001/83/EG 82. Routinesitzung, 19. April 2018 82. Routinesitzung 19. April 2018 Seite 1 Einleitung eines
Methotrexat - Risiko der Überdosierung durch Anwendungsfehler Verfahren nach Art. 31 der Richtlinie 2001/83/EG 82. Routinesitzung, 19. April 2018 82. Routinesitzung 19. April 2018 Seite 1 Einleitung eines
Anhang I. Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen
 Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Anhang I Wissenschaftliche Schlussfolgerungen und Gründe für die Änderung der Bedingungen der Genehmigung(en) für das Inverkehrbringen 1 Wissenschaftliche Schlussfolgerungen Unter Berücksichtigung des
Zypern. Zypern. Zypern. Inhaber der Genehmigung für das Inverkehrbringen. Name Stärke Darreichungsfor m. Art der Anwendung. Mitgliedsstaat EU/EEA
 Anhang I Verzeichnis der Bezeichnungen, Darreichungsform, Stärke des Arzneimittels, Art der Anwendung, der Inhaber der Genehmigung für das Inverkehrbringen in den Mitgliedstaaten 1 Mitgliedsstaat EU/EEA
Anhang I Verzeichnis der Bezeichnungen, Darreichungsform, Stärke des Arzneimittels, Art der Anwendung, der Inhaber der Genehmigung für das Inverkehrbringen in den Mitgliedstaaten 1 Mitgliedsstaat EU/EEA
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung 4 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung 4 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen
DELEGIERTER BESCHLUSS (EU) / DER KOMMISSION. vom
 EUROPÄISCHE KOMMISSION Brüssel, den 19.2.2018 C(2018) 884 final DELEGIERTER BESCHLUSS (EU) / DER KOMMISSION vom 19.2.2018 über die anwendbaren Systeme zur Bewertung und Überprüfung der Leistungsbeständigkeit
EUROPÄISCHE KOMMISSION Brüssel, den 19.2.2018 C(2018) 884 final DELEGIERTER BESCHLUSS (EU) / DER KOMMISSION vom 19.2.2018 über die anwendbaren Systeme zur Bewertung und Überprüfung der Leistungsbeständigkeit
ANHANG III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
ANHANG III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Die zuständigen Behörden der Mitgliedstaaten müssen die Zusammenfassung der
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT
 UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
ANHANG I BEZEICHNUNG, DARREICHUNGSFORM, STÄRKE DER ARZNEIMITTEL, TIERARTEN, ARTEN DER ANWENDUNG UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN
 ANHANG I BEZEICHNUNG, DARREICHUNGSFORM, STÄRKE DER ARZNEIMITTEL, TIERARTEN, ARTEN DER ANWENDUNG UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN EMEA/CVMP/166766/2006-DE Mai 2006 1/7 Inhaber der Genehmigung
ANHANG I BEZEICHNUNG, DARREICHUNGSFORM, STÄRKE DER ARZNEIMITTEL, TIERARTEN, ARTEN DER ANWENDUNG UND INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN EMEA/CVMP/166766/2006-DE Mai 2006 1/7 Inhaber der Genehmigung
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR)
 EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
1 - Komplette Zusammenfassung der wissenschaftlichen Beurteilung des PRAC
 Anhang IV Wissenschaftliche Schlussfolgerungen, Begründung der Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und detaillierte Erklärung der wissenschaftlichen Gründe für die Abweichungen
Anhang IV Wissenschaftliche Schlussfolgerungen, Begründung der Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen und detaillierte Erklärung der wissenschaftlichen Gründe für die Abweichungen
Risikobewertungsverfahren zu Codein zur Behandlung von Husten und Erkältungskrankheiten bei Kindern und Jugendlichen
 Risikobewertungsverfahren zu Codein zur Behandlung von Husten und Erkältungskrankheiten bei Kindern und Jugendlichen 76. Routinesitzung, 21.04.2015 Codein-haltige Arzneimittel zur Schmerz-/Hustenlinderung
Risikobewertungsverfahren zu Codein zur Behandlung von Husten und Erkältungskrankheiten bei Kindern und Jugendlichen 76. Routinesitzung, 21.04.2015 Codein-haltige Arzneimittel zur Schmerz-/Hustenlinderung
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
Vorschlag für eine RICHTLINIE DES RATES
 EUROPÄISCHE KOMMISSION Brüssel, den 5.2.2013 COM(2013) 46 final 2013/0026 (NLE) Vorschlag für eine RICHTLINIE DES RATES zur Änderung der Richtlinie 98/8/EG des Europäischen Parlaments und des Rates zwecks
EUROPÄISCHE KOMMISSION Brüssel, den 5.2.2013 COM(2013) 46 final 2013/0026 (NLE) Vorschlag für eine RICHTLINIE DES RATES zur Änderung der Richtlinie 98/8/EG des Europäischen Parlaments und des Rates zwecks
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderungen der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderungen der Bedingungen für die Genehmigungen für das Inverkehrbringen 28 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderungen der Bedingungen für die Genehmigungen für das Inverkehrbringen 28 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung
Was Sie über MabThera wissen sollten
 Die Gesundheitsbehörden der Europäischen Union haben die Markteinführung des Medikaments MabThera an bestimmte Bedingungen gebunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien und im Großherzogtum
Die Gesundheitsbehörden der Europäischen Union haben die Markteinführung des Medikaments MabThera an bestimmte Bedingungen gebunden. Der vorgeschriebene Plan zur Risikominimierung in Belgien und im Großherzogtum
L 59/20 Amtsblatt der Europäischen Union
 L 59/20 Amtsblatt der Europäischen Union 28.2.2014 DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 192/2014 R KOMMISSION vom 27. Februar 2014 zur des Wirkstoffs 1,4-Dimethylnaphthalin gemäß der Verordnung (EG) Nr. 1107/2009
L 59/20 Amtsblatt der Europäischen Union 28.2.2014 DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 192/2014 R KOMMISSION vom 27. Februar 2014 zur des Wirkstoffs 1,4-Dimethylnaphthalin gemäß der Verordnung (EG) Nr. 1107/2009
Gebrauchsinformation: Information für Patienten. Osanit Hustenkügelchen Wirkstoff: Drosera D6
 Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Akute venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie.
 Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
Aktualisierte Indikation Behandlung der schweren Osteoporose: bei postmenopausalen Frauen, bei erwachsenen Männern, mit hohem Frakturrisiko, für die eine Behandlung mit anderen für die Osteoporosetherapie
(Text von Bedeutung für den EWR)
 30.12.2017 L 351/55 DURCHFÜHRUNGSVERORDNUNG (EU) 2017/2468 R KOMMISSION vom 20. Dezember 2017 zur Festlegung administrativer und wissenschaftlicher Anforderungen an traditionelle Lebensmittel aus Drittländern
30.12.2017 L 351/55 DURCHFÜHRUNGSVERORDNUNG (EU) 2017/2468 R KOMMISSION vom 20. Dezember 2017 zur Festlegung administrativer und wissenschaftlicher Anforderungen an traditionelle Lebensmittel aus Drittländern
Amtsblatt der Europäischen Union L 309/17
 19.11.2013 Amtsblatt der Europäischen Union L 309/17 DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 1165/2013 R KOMMISSION vom 18. November 2013 zur des Wirkstoffs Orangenöl gemäß der Verordnung (EG) Nr. 1107/2009 des
19.11.2013 Amtsblatt der Europäischen Union L 309/17 DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 1165/2013 R KOMMISSION vom 18. November 2013 zur des Wirkstoffs Orangenöl gemäß der Verordnung (EG) Nr. 1107/2009 des
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 5 Wissenschaftliche Schlussfolgerungen Beclometasondipropionat (BDP) ist ein Glukokortikoid und ein Prodrug des aktiven Metaboliten, Beclometason-17-monopropionat.
Anhang II Wissenschaftliche Schlussfolgerungen 5 Wissenschaftliche Schlussfolgerungen Beclometasondipropionat (BDP) ist ein Glukokortikoid und ein Prodrug des aktiven Metaboliten, Beclometason-17-monopropionat.
Procain zur Anwendung am äußeren Gehörgang
 Procain zur Anwendung am äußeren Gehörgang Sachverständigen-Ausschuss für Verschreibungspflicht 27. Juni 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Juni 2017 Seite 1 Antrag Antrag auf
Procain zur Anwendung am äußeren Gehörgang Sachverständigen-Ausschuss für Verschreibungspflicht 27. Juni 2017 Sachverständigen-Ausschuss für Verschreibungspflicht 17. Juni 2017 Seite 1 Antrag Antrag auf
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic )
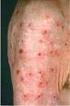 Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung 29 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der Europäischen Arzneimittel-Agentur für die Versagung 29 Wissenschaftliche Schlussfolgerungen Komplette Zusammenfassung der wissenschaftlichen
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Nr. 19 Aknetropfen Mag. Doskar Kalium iodatum D3, Juglans regia D2, Berberis vulgaris D3
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 19 Aknetropfen Mag. Doskar Kalium iodatum D3, Juglans regia D2, Berberis vulgaris D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 19 Aknetropfen Mag. Doskar Kalium iodatum D3, Juglans regia D2, Berberis vulgaris D3 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Neue Einschränkungen zur Minimierung der Risiken für Auswirkungen auf den Herzrhythmus bei Hydroxyzin enthaltenden Arzneimitteln
 Freitag, 27. März 2015 EMA/149624/2015 Neue Einschränkungen zur Minimierung der Risiken für Auswirkungen auf den Herzrhythmus bei Hydroxyzin enthaltenden Arzneimitteln Die Anwendung ist bei Patienten mit
Freitag, 27. März 2015 EMA/149624/2015 Neue Einschränkungen zur Minimierung der Risiken für Auswirkungen auf den Herzrhythmus bei Hydroxyzin enthaltenden Arzneimitteln Die Anwendung ist bei Patienten mit
Thymian / Primel. Sachverständigen-Ausschuss für Apothekenpflicht 13. Juni Sachverständigen-Ausschuss für Apothekenpflicht 13.
 Thymian / Primel Sachverständigen-Ausschuss für Apothekenpflicht 13. Juni 2017 Sachverständigen-Ausschuss für Apothekenpflicht 13. Juni 2017 Seite 1 Antrag Thymiankraut und seine Zubereitungen, auch in
Thymian / Primel Sachverständigen-Ausschuss für Apothekenpflicht 13. Juni 2017 Sachverständigen-Ausschuss für Apothekenpflicht 13. Juni 2017 Seite 1 Antrag Thymiankraut und seine Zubereitungen, auch in
Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten
 Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten (Allergenverordnung, AllergV) vom 11. Dezember 2009 Der Institutsrat des Schweizerischen Heilmittelinstituts
Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten (Allergenverordnung, AllergV) vom 11. Dezember 2009 Der Institutsrat des Schweizerischen Heilmittelinstituts
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 7 Wissenschaftliche Schlussfolgerungen Gesamtzusammenfassung
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen 7 Wissenschaftliche Schlussfolgerungen Gesamtzusammenfassung
KOMPLETTE ZUSAMMENFASSUNG DER WISSENSCHAFTLICHEN BEURTEILUNG VON ARZNEIMITTELN, DIE VALPROINSÄURE/VALPROAT ENTHALTEN (siehe Anhang I)
 ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNGEN DER MERKMALE DER ARZNEIMITTEL UND DER PACKUNGSBEILAGEN 127 WISSENSCHAFTLICHE
ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER EUROPÄISCHEN ARZNEIMITTEL-AGENTUR FÜR DIE ÄNDERUNG DER ZUSAMMENFASSUNGEN DER MERKMALE DER ARZNEIMITTEL UND DER PACKUNGSBEILAGEN 127 WISSENSCHAFTLICHE
VERORDNUNGEN. (Text von Bedeutung für den EWR)
 30.4.2016 DE L 116/3 VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/672 DER KOMMISSION vom 29. April 2016 zur von Peressigsäure als alten Wirkstoff zur Verwendung in Biozidprodukten der en 1, 2, 3, 4,
30.4.2016 DE L 116/3 VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/672 DER KOMMISSION vom 29. April 2016 zur von Peressigsäure als alten Wirkstoff zur Verwendung in Biozidprodukten der en 1, 2, 3, 4,
Dossierbewertung A13-15 Version 1.0 Colestilan Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Colestilan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Colestilan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
Gebrauchsinformation: Information für Patienten. Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12
 Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Blähungskügelchen Wirkstoff: Matricaria recutita (Chamomilla) D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Fachinformation 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Echinacin Salbe Madaus 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: 100 g Salbe enthalten: Presssaft aus frischem blühendem Purpursonnenhutkraut
Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Echinacin Salbe Madaus 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: 100 g Salbe enthalten: Presssaft aus frischem blühendem Purpursonnenhutkraut
Einleitung und Leseanweisung
 VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
VII Einleitung und Leseanweisung Für wen ist dieses Buch? Der Pocket Guide ist für alle klinisch tätigen Psychiater geschrieben, denen das Kompendium der Psychiatrischen Pharmakotherapie für die Kitteltasche
Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie. Sonderfach Grundausbildung (36 Monate)
 Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie Anlage 24 Sonderfach Grundausbildung (36 Monate) 1. Standardisierungsmethoden und biologische Tests 2. Biometrische Methoden 3. Medikamente,
Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie Anlage 24 Sonderfach Grundausbildung (36 Monate) 1. Standardisierungsmethoden und biologische Tests 2. Biometrische Methoden 3. Medikamente,
Anhang II. Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen 7 Wissenschaftliche Schlussfolgerungen Zusammenfassung der wissenschaftlichen Beurteilung methadonhaltiger Arzneimittel zum Einnehmen, in denen Povidon enthalten
Anhang II Wissenschaftliche Schlussfolgerungen 7 Wissenschaftliche Schlussfolgerungen Zusammenfassung der wissenschaftlichen Beurteilung methadonhaltiger Arzneimittel zum Einnehmen, in denen Povidon enthalten
Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie. Sonderfach Grundausbildung (36 Monate)
 Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie Anlage 24 Sonderfach Grundausbildung (36 Monate) A) Kenntnisse absolviert 1. Standardisierungsmethoden und biologische Tests 2. Biometrische
Ausbildungsinhalte zum Sonderfach Pharmakologie und Toxikologie Anlage 24 Sonderfach Grundausbildung (36 Monate) A) Kenntnisse absolviert 1. Standardisierungsmethoden und biologische Tests 2. Biometrische
Gebrauchsinformation: Information für Anwender. RheumaCare Tabletten
 Gebrauchsinformation: Information für Anwender RheumaCare Tabletten Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält wichtige
Gebrauchsinformation: Information für Anwender RheumaCare Tabletten Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält wichtige
Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten
 Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten (Allergenverordnung, AllergV) vom 11. Dezember 2009 (Stand am 1. Januar 2019) Der Institutsrat
Verordnung des Schweizerischen Heilmittelinstituts über die vereinfachte Zulassung von Allergenpräparaten (Allergenverordnung, AllergV) vom 11. Dezember 2009 (Stand am 1. Januar 2019) Der Institutsrat
Anhang II. Wissenschaftliche Schlussfolgerungen und Begründungen für
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründungen für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen der injizierbaren Formulierungen von Calcitonin und die Aussetzung
Anhang II Wissenschaftliche Schlussfolgerungen und Begründungen für die Änderung der Bedingungen für die Genehmigungen für das Inverkehrbringen der injizierbaren Formulierungen von Calcitonin und die Aussetzung
Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen
 Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen Hinweis: Diese Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
Anhang III Änderungen an den Zusammenfassungen der Merkmale des Arzneimittels und den Packungsbeilagen Hinweis: Diese Änderungen der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
(Text von Bedeutung für den EWR)
 L 299/10 DE DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 1090/2014 DER KOMMISSION vom 16. Oktober 2014 zur von Permethrin als alten Wirkstoff zur Verwendung in Biozidprodukten der Produktarten 8 und 18 (Text von Bedeutung
L 299/10 DE DURCHFÜHRUNGSVERORDNUNG (EU) Nr. 1090/2014 DER KOMMISSION vom 16. Oktober 2014 zur von Permethrin als alten Wirkstoff zur Verwendung in Biozidprodukten der Produktarten 8 und 18 (Text von Bedeutung
(Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN
 30.1.2016 DE L 24/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/124 DER KOMMISSION vom 29. Januar 2016 zur von PHMB (1600; 1.8) als alten Wirkstoff zur Verwendung
30.1.2016 DE L 24/1 II (Rechtsakte ohne Gesetzescharakter) VERORDNUNGEN DURCHFÜHRUNGSVERORDNUNG (EU) 2016/124 DER KOMMISSION vom 29. Januar 2016 zur von PHMB (1600; 1.8) als alten Wirkstoff zur Verwendung
Dokumenten-Nr.: Bewertung von Abweichungen, Fehlern und Mängeln 2/5
 Bewertung von Abweichungen, Fehlern und Mängeln 2/5 1 Zweck Ziel der Verfahrensanweisung ist es, bekannt gewordene, vermutete Abweichungen im Zusammenhang mit GMP-Inspektionen zu untersuchen und zu bewerten.
Bewertung von Abweichungen, Fehlern und Mängeln 2/5 1 Zweck Ziel der Verfahrensanweisung ist es, bekannt gewordene, vermutete Abweichungen im Zusammenhang mit GMP-Inspektionen zu untersuchen und zu bewerten.
Wissenschaftliche Schlussfolgerungen
 Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Änderung der Zusammenfassungen der Merkmale des Arzneimittels und der Packungsbeilagen 77 Wissenschaftliche Schlussfolgerungen
Anhang II Wissenschaftliche Schlussfolgerungen und Begründung der EMA für die Änderung der Zusammenfassungen der Merkmale des Arzneimittels und der Packungsbeilagen 77 Wissenschaftliche Schlussfolgerungen
Die Europäische Arzneimittel-Agentur empfiehlt Änderungen für die Anwendung von Metoclopramid
 20. Dezember 2013 EMA/13239/2014 Corr. 1 Die Europäische Arzneimittel-Agentur empfiehlt Änderungen für die Anwendung von Die Änderungen sollen vor allem das Risiko neurologischer Nebenwirkungen senken
20. Dezember 2013 EMA/13239/2014 Corr. 1 Die Europäische Arzneimittel-Agentur empfiehlt Änderungen für die Anwendung von Die Änderungen sollen vor allem das Risiko neurologischer Nebenwirkungen senken
Stelara ist ein Arzneimittel, das zur Behandlung der folgenden Erkrankungen angewendet wird:
 EMA/636854/2016 EMEA/H/C/000958 Zusammenfassung des EPAR für die Öffentlichkeit Ustekinumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/636854/2016 EMEA/H/C/000958 Zusammenfassung des EPAR für die Öffentlichkeit Ustekinumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Hedera Effervescent Tablets MODULE Product Information SPC, Labelling and Package Leaflet 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 50 mg Brausetabletten
1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 50 mg Brausetabletten
Klinische Bewertung für Medizinprodukte inklusive Software
 Klinische Bewertung für Medizinprodukte inklusive Software 13. Linzer Forum Medizintechnik 5.10.2016 Bundesministerium für Gesundheit und Frauen, Wien Klinische Bewertung Aufgaben des Herstellers Teil
Klinische Bewertung für Medizinprodukte inklusive Software 13. Linzer Forum Medizintechnik 5.10.2016 Bundesministerium für Gesundheit und Frauen, Wien Klinische Bewertung Aufgaben des Herstellers Teil
Gebrauchsinformation: Information für Patienten
 1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magenbeschwerden Similasan Wirkstoffe: Calcium carbonicum Hahnemanni D15, Natrium phosphoricum D12, Strychnos nuxvomica D10 Lesen Sie die
1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magenbeschwerden Similasan Wirkstoffe: Calcium carbonicum Hahnemanni D15, Natrium phosphoricum D12, Strychnos nuxvomica D10 Lesen Sie die
Amoxicillin 200 mg Clavulanic acid 50 mg Prednisolone 10 mg. Amoxicillin 200 mg Clavulanic acid 50 mg Prednisolone 10 mg
 Anhang I Verzeichnis der Bezeichnungen, Darreichungsformen, Stärken der Tierarzneimittel, Tierarten, Arten der, Wartezeiten, Antragsteller und Inhaber der Genehmigung für das Inverkehrbringen in den Mitgliedstaaten
Anhang I Verzeichnis der Bezeichnungen, Darreichungsformen, Stärken der Tierarzneimittel, Tierarten, Arten der, Wartezeiten, Antragsteller und Inhaber der Genehmigung für das Inverkehrbringen in den Mitgliedstaaten
DELEGIERTER BESCHLUSS DER KOMMISSION. vom
 EUROPÄISCHE KOMMISSION Brüssel, den 11.9.2017 C(2017) 6054 final DELEGIERTER BESCHLUSS DER KOMMISSION vom 11.9.2017 zur Änderung des Anhangs V der Richtlinie 2005/36/EG des Europäischen Parlaments und
EUROPÄISCHE KOMMISSION Brüssel, den 11.9.2017 C(2017) 6054 final DELEGIERTER BESCHLUSS DER KOMMISSION vom 11.9.2017 zur Änderung des Anhangs V der Richtlinie 2005/36/EG des Europäischen Parlaments und
Gebrauchsinformation: Information für Patienten
 1 Gebrauchsinformation: Information für Patienten Globuli gegen stockenden Schnupfen Similasan Wirkstoffe: Hydrargyrum sulfuratum rubrum D10, Kalium bichromicum D8, Luffa operculata D8 Lesen Sie die gesamte
1 Gebrauchsinformation: Information für Patienten Globuli gegen stockenden Schnupfen Similasan Wirkstoffe: Hydrargyrum sulfuratum rubrum D10, Kalium bichromicum D8, Luffa operculata D8 Lesen Sie die gesamte
Kerato Biciron 5% Augensalbe
 Gebrauchsinformation: Information für den Anwender Kerato Biciron 5% Augensalbe Calciumpantothenat Zur unterstützenden Behandlung der Heilung von Haut- und Schleimhautläsionen am Auge. Lesen Sie die gesamte
Gebrauchsinformation: Information für den Anwender Kerato Biciron 5% Augensalbe Calciumpantothenat Zur unterstützenden Behandlung der Heilung von Haut- und Schleimhautläsionen am Auge. Lesen Sie die gesamte
Stärke Tierart Häufigkeit und Art der Anwendung
 Anhang I Verzeichnis der bezeichnungen, darreichungsformen, stärken des tierarzneimittels, tierarten, arten der anwendung und inhaber der genehmigung für das inverkehrbringen in den mitgliedstaaten 1/8
Anhang I Verzeichnis der bezeichnungen, darreichungsformen, stärken des tierarzneimittels, tierarten, arten der anwendung und inhaber der genehmigung für das inverkehrbringen in den mitgliedstaaten 1/8
Gebrauchsinformation: Information für Patienten Tabletten gegen Lampenfieber Similasan Wirkstoffe: Argentum nitricum D15, Strophanthus gratus D12
 1/5 Gebrauchsinformation: Information für Patienten Tabletten gegen Lampenfieber Similasan Wirkstoffe: Argentum nitricum D15, Strophanthus gratus D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
1/5 Gebrauchsinformation: Information für Patienten Tabletten gegen Lampenfieber Similasan Wirkstoffe: Argentum nitricum D15, Strophanthus gratus D12 Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Wissenschaftliche Schlussfolgerungen und detaillierte Erklärung der wissenschaftlichen Gründe für die Abweichungen von der Empfehlung des PRAC
 Anhang II Wissenschaftliche Schlussfolgerungen und detaillierte Erklärung der wissenschaftlichen Gründe für die Abweichungen von der Empfehlung des PRAC 33 Wissenschaftliche Schlussfolgerungen und detaillierte
Anhang II Wissenschaftliche Schlussfolgerungen und detaillierte Erklärung der wissenschaftlichen Gründe für die Abweichungen von der Empfehlung des PRAC 33 Wissenschaftliche Schlussfolgerungen und detaillierte
Anhang IV. Bedingungen der Genehmigungen für das Inverkehrbringen
 Anhang IV Bedingungen der Genehmigungen für das Inverkehrbringen 66 Bedingungen der Genehmigung(en) für das Inverkehrbringen Die Inhaber der Genehmigungen für das Inverkehrbringen müssen innerhalb der
Anhang IV Bedingungen der Genehmigungen für das Inverkehrbringen 66 Bedingungen der Genehmigung(en) für das Inverkehrbringen Die Inhaber der Genehmigungen für das Inverkehrbringen müssen innerhalb der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 40 Gelenksentzündungstropfen Mag. Doskar Bryonia D4, Colchicum autumnale D4, Rhus toxicodendron (Toxicodendron quercifolium) D4, Echinacea angustifolia
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Nr. 40 Gelenksentzündungstropfen Mag. Doskar Bryonia D4, Colchicum autumnale D4, Rhus toxicodendron (Toxicodendron quercifolium) D4, Echinacea angustifolia
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
