Fachinformation. mind. 30 Internationale Einheiten (I.E.) Tetanus-Toxoid 1
|
|
|
- Anton Brahms
- vor 7 Jahren
- Abrufe
Transkript
1 1. BEZEICHNUNG DES ARZNEIMITTELS - Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie-Tetanus- (azellulärer) Pertussis-, Poliomyelitis (inaktiviert)- und Haemophilus-influenzae-Typ b- Konjugatimpfstoff (adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Dosis (0,5 ml) Impfstoff enthält: Diphtherie-Toxoid 1 mind. 30 Internationale Einheiten (I.E.) Tetanus-Toxoid 1 mind. 40 Internationale Einheiten (I.E.) Bordetella-pertussis-Antigene Pertussis-Toxoid 1 25 µg Filamentöses Hämagglutinin 1 25 µg Pertactin 1 8 µg Poliomyelitisviren (inaktiviert) Typ 1 (Mahoney-Stamm) 2 40 D-Antigeneinheiten Typ 2 (MEF-1-Stamm) 2 8 D-Antigeneinheiten Typ 3 (Saukett-Stamm) 2 32 D-Antigeneinheiten Haemophilus-influenzae-Typ b-polysaccharid (Polyribosylribitolphosphat) 10 μg konjugiert an Tetanustoxoid als Trägerprotein ca. 30 µg 1 adsorbiert an Aluminiumhydroxid 0,5 mg Al 2 vermehrt in VERO-Zellen Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt DARREICHUNGSFORM Pulver und Suspension zur Herstellung einer Injektionssuspension Die Diphtherie-, Tetanus-, azelluläre Pertussis- und inaktivierte Poliomyelitis (DTPa-IPV)-Komponente liegt als trübe, weiße Suspension vor. Die lyophilisierte Haemophilus influenzae Typ b (Hib)-Komponente ist ein weißes Pulver. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete ist zur aktiven Immunisierung gegen Diphtherie, Tetanus, Pertussis, Poliomyelitis und Erkrankungen durch Haemophilus-influenzae-Typ b ab dem vollendeten zweiten Lebensmonat bestimmt. sollte möglichst nicht bei Kindern, die älter als 36 sind, angewendet werden. 4.2 Dosierung, Art und Dauer der Anwendung Dosierung Grundimmunisierung: Die Grundimmunisierung besteht aus zwei oder drei Impfungen (STIKO*), die entsprechend den offiziellen Empfehlungen verabreicht werden. Das Alter bei Verabreichung der ersten Impfdosis sollte mindestens zwei betragen. Zwischen den einzelnen Impfungen der Grundimmunisierung ist ein Mindestabstand von vier Wochen einzuhalten. Auffrischimpfung: Nach einer Grundimmunisierung ist eine Auffrischimpfung mit frühestens sechs nach der letzten Impfung der Grundimmunisierung, vorzugsweise zwischen dem vollendeten 11. und 13. Lebensmonat (STIKO* ), zu verabreichen. Nach einer Grundimmunisierung mit drei Impfdosen sollte die Auffrischimpfung in jedem Falle eine konjugierte Hib-Komponente enthalten. Die Impfung erfolgt gemäß den offiziellen Empfehlungen (STIKO*). Wenn diese die gleichzeitige Verabreichung der in enthaltenen zusätzlichen Antigene vorsehen, kann eingesetzt werden. * STIKO = Ständige Impfkommission am Robert Koch-Institut kann zur Auffrischimpfung bei Kindern verwendet werden, die eine Grundimmunisierung mit anderen DTP-, Polio- und Hib-enthaltenden Impfstoffen erhalten haben. 1
2 Art der Anwendung Der Impfstoff sollte tief intramuskulär in die anterolaterale Oberschenkelmuskulatur appliziert werden. Aufeinander folgende Impfungen sollten vorzugsweise kontralateral appliziert werden. Bei Patienten mit Thrombozytopenie oder hämorrhagischer Diathese ist mit Vorsicht zu verabreichen, da in diesen Fällen eine intramuskuläre Gabe mit Nachblutungen verbunden sein kann. Ohne dabei zu reiben, sollte über mindestens zwei Minuten fester Druck auf die Injektionsstelle ausgeübt werden. darf keinesfalls intravasal injiziert werden! 4.3 Gegenanzeigen Überempfindlichkeit gegen die Wirkstoffe oder einen der sonstigen Bestandteile oder Neomycin, Polymyxin und Polysorbat 80. Überempfindlichkeitsreaktionen nach vorheriger Verabreichung von Diphtherie-, Tetanus-, Pertussis-, Poliooder Hib-Impfstoffen. Eine Impfung mit sollte ebenfalls unterbleiben, wenn in der Impfanamnese eine Enzephalopathie unbekannter Genese innerhalb von sieben Tagen nach Impfung mit einem Impfstoff, der eine Pertussiskomponente enthält, aufgetreten ist. Wie bei anderen Impfstoffen sind Personen mit akuten, schweren, mit Fieber einhergehenden Erkrankungen auch von einer Impfung mit zurückzustellen. Banale Infekte stellen jedoch keine Gegenanzeige für die Impfung dar. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Wie bei allen injizierbaren Impfstoffen sollten für den seltenen Fall einer anaphylaktischen Reaktion nach der Gabe des Impfstoffes entsprechende medizinische Behandlungs- und Überwachungsmöglichkeiten stets sofort verfügbar sein. Trat eines der nachfolgenden Ereignisse im zeitlichen Zusammenhang mit der Gabe eines DTP-haltigen Impfstoffes auf, ist die Entscheidung für die Verabreichung weiterer Dosen eines Impfstoffes mit Pertussiskomponente sorgfältig abzuwägen: - Temperaturerhöhung auf 40,0 C (rektal gemessen) innerhalb von 48 Stunden ohne andere erkennbare Ursachen - Kollaps oder schockähnlicher Zustand (hypotone hyporesponsive Episode) innerhalb von 48 Stunden nach der Impfung - Anhaltendes, nicht zu beruhigendes Schreien über drei Stunden und länger innerhalb von 48 Stunden nach der Impfung - Krampfanfälle mit oder ohne Fieber innerhalb von drei Tagen nach der Impfung. In bestimmten Situationen, wie z. B. bei hoher Pertussisinzidenz, kann der potentielle Nutzen der Impfung gegenüber möglichen Risiken überwiegen, insbesondere da die genannten Ereignisse nicht mit bleibenden Schäden verbunden sind. Die bisher vorliegenden klinischen Daten zeigen, dass das Risiko für das Auftreten solcher Reaktionen bei azellulären Pertussisimpfstoffen geringer als bei Pertussis-Ganzkeimimpfstoffen ist. Wenn bei einem Säugling oder Kind eine ernsthafte neurologische Erkrankung zum ersten Mal auftritt oder eine progrediente schwerwiegende neurologische Erkrankung vorliegt, sollte wie bei jeder Impfung Nutzen und Risiko einer Immunisierung mit gegenüber einem Aufschub dieser Impfung sorgfältig abgewogen werden. Die Hib-Komponente des Impfstoffes schützt nicht vor Erkrankungen, die durch andere Haemophilusinfluenzae-Typen verursacht werden, oder vor einer durch andere Erreger bedingten Meningitis. Fieberkrämpfe in der Anamnese des Impflings sowie Krampfanfälle, plötzlicher Kindstod (SIDS) oder ein unerwünschtes Ereignis nach Impfung mit DTP-, IPV- und/oder Hib-Impfstoffen in der Familienanamnese gelten nicht als Kontraindikationen für eine Impfung mit. Eine HIV-Infektion wird nicht als Kontraindikation für eine Impfung mit betrachtet. Die erwartete Immunreaktion kann bei immunsupprimierten Patienten ausbleiben, z. B. bei Patienten unter immunsuppressiver Therapie. Eine Ausscheidung von Kapselpolysaccharid-Antigen über den Harn ist nach Impfung mit Hib-Impfstoffen beschrieben worden. Ein falsch positives Ergebnis einer Antigenbestimmung ist deshalb innerhalb von ein bis zwei Wochen nach der Impfung möglich. Die Impfung mit soll vom Impfarzt in den Internationalen Impfausweis eingetragen werden. Das potentielle Risiko von Apnoen und die Notwendigkeit einer Überwachung der Atmung über Stunden sollte im Rahmen der Grundimmunisierung von sehr unreifen Frühgeborenen (geboren vor der vollendeten 28. Schwangerschaftswoche) in Betracht gezogen werden. Dies gilt insbesondere für diejenigen, die in der Vorgeschichte Zeichen einer unreifen Atmung gezeigt haben. 2
3 Da der Nutzen der Impfung für diese Kinder hoch ist, sollte sie ihnen weder vorenthalten noch verschoben werden. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Soweit gleichzeitig mit anderen Impfstoffen gegeben wird, sind die Injektionen an verschiedenen (kontralateralen) Körperstellen vorzunehmen. Wie bei anderen Impfstoffen ist zu erwarten, dass bei immungeschwächten Patienten (Patienten unter immunsuppressiver Therapie oder Patienten mit Immundefekten) möglicherweise keine ausreichende Immunantwort erzielt wird. 4.6 Schwangerschaft und Stillzeit Eine Anwendung von im Erwachsenenalter ist nicht vorgesehen. Deshalb liegen auch keine Informationen zur Sicherheit bei der Anwendung in der Schwangerschaft oder Stillzeit vor. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Nicht zutreffend. 4.8 Nebenwirkungen - Klinische Studien Das nachfolgende Nebenwirkungsprofil basiert auf Daten von mehr als Kindern. Wie bereits bei DTPa und DTPa-haltigen Impfstoffkombinationen beobachtet, wurde nach der Auffrischimpfung mit Infanrix-IPV + Hib im Vergleich zur Grundimmunisierung ein vermehrtes Auftreten von Lokalreaktionen und Fieber festgestellt. Häufigkeiten pro verabreichter Dosis werden wie folgt angegeben: Sehr häufig: ( 1/10) Häufig: ( 1/100, < 1/10) Gelegentlich: ( 1/1.000, < 1/100) Selten: ( 1/ , < 1/1.000) Sehr selten: (< 1/10.000) Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben. Erkrankungen des Blutes und des Lymphsystems Gelegentlich: Lymphadenopathie Erkrankungen des Nervensystems Sehr häufig: Somnolenz Erkrankungen der Atemwege, des Brustraums und Mediastinums Gelegentlich: Bronchitis, Husten, Schnupfen Erkrankungen des Gastrointestinaltrakts Häufig: Durchfall, Erbrechen Erkrankungen der Haut und des Unterhautzellgewebes Gelegentlich: Urtikaria, Hautausschlag Selten: Pruritus, Dermatitis Stoffwechsel- und Ernährungsstörungen Sehr häufig: Appetitverlust Infektionen und parasitäre Erkrankungen Gelegentlich: Infektionen der oberen Atemwege Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Sehr häufig: Fieber ( 38 C), Reaktionen, wie Schmerzen und Rötung an der Injektionsstelle, Schwellung an der Injektionsstelle (bis 50 mm) Häufig: Reaktionen an der Injektionsstelle, einschließlich Verhärtung, Schwellung an der Injektionsstelle (über 50 mm) 1 Gelegentlich: diffuse Schwellung der Extremität, an der die Injektion vorgenommen wurde - mitunter unter Einbeziehung des angrenzenden Gelenkes 1, Fieber 2 > 39,5 C, Mattigkeit Psychiatrische Erkrankungen Sehr häufig: Ungewöhnliches Schreien, Reizbarkeit, Unruhe - Post-Marketing-Surveillance Erkrankungen des Nervensystems 3
4 Kollaps oder schockähnlicher Zustand (hypotone-hyporesponsive Episode), Krampfanfälle (mit oder ohne Fieber) Erkrankungen der Atemwege, des Brustraums und Mediastinums Apnoe 3 [siehe Abschnitt 4.4 zu Apnoe bei sehr unreifen Frühgeborenen (geboren vor der vollendeten 28. Schwangerschaftswoche)] Erkrankungen der Haut und des Unterhautzellgewebes Angioneurotisches Ödem 3 Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Schwellung der gesamten Extremität, an der die Injektion vorgenommen wurde 1, Bläschen an der Injektionsstelle 3 Erkrankungen des Immunsystems Allergische Reaktionen (einschließlich anaphylaktische 3 und anaphylaktoide Reaktionen) 1 Kinder, denen zur Grundimmunisierung Impfstoffe mit azellulärer Pertussiskomponente verabreicht worden sind, haben im Vergleich zu Kindern, die mit Ganzkeim-Pertussisimpfstoff grundimmunisiert wurden, eine höhere Wahrscheinlichkeit, nach der Auffrischimpfung eine Schwellung zu entwickeln. Diese Reaktionen klingen im Durchschnitt innerhalb von vier Tagen ab. 2 Häufig nach der Auffrischimpfung 3 Für GSK-Impfstoffe, die DTPa enthalten, berichtet 4.9 Überdosierung Nicht zutreffend. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Kombinierte Bakterien- und Virus-Impfstoffe, ATC-Code: J07CA06 In den folgenden Tabellen sind aus klinischen Studien gewonnene Daten zu den einzelnen Komponenten angegeben: Anteil der Kinder mit Antikörpertitern oberhalb des cut-off-wertes nach der Grundimmunisierung mit : Antikörper (cut-off) Anti-Diphterie Anti-Tetanus Anti-PT Anti-FHA Anti-PRN Anti-Polio-Typ 1 (1/8 Verdünnung)* Anti-Polio-Typ 2 (1/8 Verdünnung)* Anti-Polio-Typ 3 (1/8 Verdünnung)* 3-5 N= 86 1,5-3,5-6 N= N= 337 (3 Studien) N= 624 (6 Studien) N= 127 (2 Studien) 94, ,8 99,3 94,4 99,5 100,0** ,7 99,8 99, ,5** , , ,7** ,0** ,0 Nicht bestimmt 95,3 Nicht bestimmt 98,8 Nicht bestimmt 99,1 99, ,7 99,0 99, ,2 99,4 3-4,5-6 N=198 4
5 Antikörper (cut-off) (0,15 μg/ml)* (1,0 μg/ml) 3-5 N= 86 1,5-3,5-6 N= N= 337 (3 Studien) N= 624 (6 Studien) N= 127 (2 Studien) 83, ,5 98, ,4 51,2 87,1 68,5 76,0 97,6 81,2 3-4,5-6 N=198 *allgemein anerkannter cut-off, der auf eine Schutzwirkung hinweist ** Ergebnisse nach 2 Dosen aus Studien, in denen DTPa-HB-IPV/Hib im Alter von 3, 5 und 11 n verabreicht wurde. Anteil der Kinder mit Antikörpertitern oberhalb des cut-off-wertes nach der Auffrischimpfung mit : Antikörper (cut-off) Anti-Diphterie Anti-Tetanus Anti-PT Anti-FHA Anti-PRN Anti-Polio-Typ 1 (1/8 Verdünnung)* Anti-Polio-Typ 2 (1/8 Verdünnung)* Anti-Polio-Typ 3 (1/8 Verdünnung)* (0,15 μg/ml)* (1,0 μg/ml) Auffrischimpfung im Alter von 11/12 n, wenn die Grundimmunisierung nach einem Impfschema erfolgte N = ,8 99,9** 99,9 99,9** 99,7 99,9** ,5** 99,9 99,4 99, , ,7 99,2 Auffrischimpfung während des 2. Lebensjahres, wenn die Grundimmunisierung nach einem 3-Dosenschema erfolgte N = 1326 (9 Studien) *allgemein anerkannter cut-off, der auf eine Schutzwirkung hinweist ** Ergebnisse nach 3 Dosen aus Studien, in denen DTPa-HB-IPV/Hib im Alter von 3, 5 und 11 n verabreicht wurde. Die Wirksamkeit der Hib-Komponente von GlaxoSmithKline Biologicals (in Kombination mit DTPa, DTPa-IPV oder DTPa-HBV-IPV) wird in einer ausgedehnten Post-Marketing-Surveillance-Studie in Deutschland untersucht. Über einen Zeitraum von 4,5 Jahren betrug die Wirksamkeit der DTPa/Hib- oder DTPa-IPV/Hib- Impfstoffe 96,7 nach vollständiger Grundimmunisierung und 98,5 nach Auffrischimpfung (unabhängig von der Grundimmunisierung). Über einen Zeitraum von 3 Jahren betrug die Wirksamkeit von hexavalenten Impfstoffen 92,8 nach vollständiger Grundimmunisierung und 100 nach Auffrischimpfung. 5.2 Pharmakokinetische Eigenschaften 5
6 Die Evaluierung pharmakokinetischer Eigenschaften ist bei Impfstoffen nicht gefordert. 5.3 Präklinische Daten zur Sicherheit Die Ergebnisse konventioneller präklinischer Studien zur Sicherheit, zur spezifischen Toxizität sowie zur Kompatibilität der Bestandteile deuten nicht auf eine besondere Gefährdung des Menschen hin. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Lyophilisierte Hib-Komponente: Lactose Flüssige DTPa-IPV-Komponente: Natriumchlorid Medium 199 (als Stabilisator, der Aminosäuren, Mineralsalze, Vitamine und andere Substanzen enthält) Wasser für Injektionszwecke. Adjuvans siehe Abschnitt Inkompatibilitäten Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden. 6.3 Dauer der Haltbarkeit Die Haltbarkeit der Impfstoffbestandteile vor der Rekonstitution beträgt 36. Nach Rekonstitution sollte der Impfstoff umgehend verabreicht werden. Wird der Impfstoff nicht sofort verimpft, so liegt es in der Verantwortung des Arztes, die Aufbewahrungszeit und -bedingungen festzulegen. Der gebrauchsfertige Impfstoff sollte nicht länger als 8 Stunden bei 2 C bis 8 C (im Kühlschrank) aufbewahrt werden. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Im Kühlschrank lagern (2 C-8 C). Nicht einfrieren. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. 6.5 Art und Inhalt der Behältnisse Pulver in Glasfläschchen (Glas Typ I) mit Stopfen (aus Chlorbutyl). Suspension (0,5 ml) in einer Fertigspritze (Glas Typ I) mit Kolbendichtungsstopfen (aus Chlorbutyl), mit oder ohne Kanülen. Packungsgrößen zu 1, 10, 20 und 50 Impfdosen. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Bei Lagerung kann sich in der Spritze mit der DTPa-IPV-Suspension eine weiße Ablagerung mit klarem Überstand bilden. Dies ist jedoch kein Anzeichen für eine Qualitätsminderung. Die Fertigspritze ist kräftig zu schütteln, bis eine homogene Suspension entsteht. Die DTPa-IPV-Suspension in der Spritze, das Hib-Pulver im Glasfläschchen sowie auch der rekonstituierte Impfstoff sind per Augenschein auf etwaige Fremdpartikel und/oder physikalische Veränderungen vor Verabreichung zu untersuchen. Wenn solche Abweichungen beobachtet werden, ist der Impfstoff zu verwerfen. Der Impfstoff wird rekonstituiert, indem man dem Fläschchen mit dem darin enthaltenen Hib-Pulver den gesamten Inhalt der Fertigspritze mit der DTPa-IPV-Suspension zusetzt. Der rekonstituierte Impfstoff sollte umgehend verabreicht werden. Hinweise zur Herstellung (Rekonstitution) des Impfstoffes: 1. Fertigspritze mit der DTPa-IPV-Suspension kräftig schütteln. 2. Kanüle auf die Spritze mit der DTPa-IPV-Suspension aufsetzen und anschließend den Inhalt der Spritze in das Glasfläschchen mit dem Hib-Pulver injizieren. 3. Das Fläschchen mit belassener Kanüle kräftig schütteln, bis das gesamte Hib-Pulver gelöst ist. 4. Gelösten Impfstoff vollständig zurück in die Spritze aufziehen. 5. Der Spritze eine neue, zur Injektion geeignete Kanüle aufsetzen und den Impfstoff verabreichen. 6
7 6. Wird der Impfstoff nicht sofort verabreicht, so ist ein erneutes kräftiges Schütteln unmittelbar vor der Injektion notwendig. 7. Nicht verwendeter, bereits rekonstituierter Impfstoff sollte entsprechend den örtlich vorgeschriebenen Bestimmungen entsorgt werden. 7. INHABER DER ZULASSUNG EurimPharm Arzneimittel GmbH Piding 8. ZULASSUNGSNUMMER PEI.H DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG / STAND DER INFORMATION April VERKAUFSABGRENZUNG Verschreibungspflichtig IN DEUTSCHLAND VERFÜGBARE PACKUNGSGRÖßEN Je Impfdosis: Pulver (Hib-Komponente) und 0,5 ml Suspension (DTPa-IPV-Komponente). 1 Impfdosis: 1 Glasfläschchen mit Hib-Pulver und 1 Fertigspritze mit DTPa-IPV-Suspension 10 Impfdosen: 10 Glasfläschchen mit Hib-Pulver und 10 Fertigspritzen mit DTPa-IPV-Suspension 50 Impfdosen: 50 Glasfläschchen mit Hib-Pulver und 50 Fertigspritzen mit DTPa-IPV-Suspension 7
Diphtherie-, Tetanus- (azellulärer) Pertussis-, Poliomyelitis (inaktiviert)- und Haemophilus-influenzae-Typ b-konjugatimpfstoff (adsorbiert)
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS (Fachinformation) 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix -IPV+Hib Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie-, Tetanus-
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS (Fachinformation) 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix -IPV+Hib Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie-, Tetanus-
40 D-Antigeneinheiten Typ 2 (MEF-1-Stamm) 2 8 D-Antigeneinheiten Typ 3 (Saukett-Stamm) 2
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS (Fachinformation) 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix -IPV+Hib Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie (D)-, Tetanus
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS (Fachinformation) 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix -IPV+Hib Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie (D)-, Tetanus
- 1 - FACHINFORMATION
 - 1 - FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix -IPV+Hib Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie (D)-Tetanus (T)- (azellulärer) Pertussis (Pa)-, Poliomyelitis
- 1 - FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix -IPV+Hib Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie (D)-Tetanus (T)- (azellulärer) Pertussis (Pa)-, Poliomyelitis
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Infanrix, Injektionssuspension Diphtherie-Tetanus-(azellulärer) Pertussis-Adsorbatimpfstoff für Säuglinge (ab 2 Monaten) und Kinder (bis 6 Jahre) Lesen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Infanrix, Injektionssuspension Diphtherie-Tetanus-(azellulärer) Pertussis-Adsorbatimpfstoff für Säuglinge (ab 2 Monaten) und Kinder (bis 6 Jahre) Lesen
FACHINFORMATION 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix, Injektionssuspension Diphtherie-Tetanus-(azellulärer) Pertussis Adsorbatimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Impfdosis
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix, Injektionssuspension Diphtherie-Tetanus-(azellulärer) Pertussis Adsorbatimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Impfdosis
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SPC)
 1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär, aus Komponenten)-Adsorbatimpfstoff (mit reduziertem Antigengehalt) ab dem vollendeten
1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär, aus Komponenten)-Adsorbatimpfstoff (mit reduziertem Antigengehalt) ab dem vollendeten
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Infanrix, Injektionssuspension Diphtherie-Tetanus-(azellulärer) Pertussis-Adsorbatimpfstoff für Säuglinge (ab 2 Monaten) und Kinder (bis 6 Jahre) Lesen Sie
Gebrauchsinformation: Information für Anwender Infanrix, Injektionssuspension Diphtherie-Tetanus-(azellulärer) Pertussis-Adsorbatimpfstoff für Säuglinge (ab 2 Monaten) und Kinder (bis 6 Jahre) Lesen Sie
Fachinformation. 8 D-Antigeneinheiten Typ 3 (Saukett) 2. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis (azellulär, aus Komponenten) und Poliomyelitis (inaktivierter)-
Fachinformation 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis (azellulär, aus Komponenten) und Poliomyelitis (inaktivierter)-
Gebrauchsinformation: Information für die Anwenderin/den Anwender
 Gebrauchsinformation: Information für die Anwenderin/den Anwender Infanrix-IPV + Hib Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie-, Tetanus-, (azellulärer) Pertussis-, Poliomyelitis
Gebrauchsinformation: Information für die Anwenderin/den Anwender Infanrix-IPV + Hib Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie-, Tetanus-, (azellulärer) Pertussis-, Poliomyelitis
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Infanrix -IPV+Hib Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie-, Tetanus-, (azellulärer) Pertussis-, Poliomyelitis (inaktiviert)-
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Infanrix -IPV+Hib Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie-, Tetanus-, (azellulärer) Pertussis-, Poliomyelitis (inaktiviert)-
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix hexa, Pulver und Suspension zur Herstellung einer Injektionssuspension in einer Fertigspritze Diphtherie
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix hexa, Pulver und Suspension zur Herstellung einer Injektionssuspension in einer Fertigspritze Diphtherie
Vi-Polysaccharid von Salmonella typhi (Ty2 Stamm)
 Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff 2. Qualitative und quantitative Zusammensetzung
Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff 2. Qualitative und quantitative Zusammensetzung
Td-RIX Injektionssuspension Diphtherie-Tetanus-Kombinationsimpfstoff (adsorbiert) mit reduziertem Antigengehalt
 1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Td-RIX Injektionssuspension Diphtherie-Tetanus-Kombinationsimpfstoff (adsorbiert) mit reduziertem Antigengehalt 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Td-RIX Injektionssuspension Diphtherie-Tetanus-Kombinationsimpfstoff (adsorbiert) mit reduziertem Antigengehalt 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Fachinformation. 32 D-Antigen²-Einheiten³. Antigenmenge im Endprodukt (Final Bulk Product), gemäß WHO (TRS 673, 1982) 3
 1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. Qualitative und quantitative Zusammensetzung 1 Impfdosis (0,5 ml) enthält: Wirkstoffe:
1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. Qualitative und quantitative Zusammensetzung 1 Impfdosis (0,5 ml) enthält: Wirkstoffe:
Fachinformation IPV Mérieux Stand: Juli 2010
 Fachinformation IPV Mérieux Stand: Juli 2010 1. BEZEICHNUNG DES ARZNEIMITTELS IPV Mérieux Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. QUALITATIVE UND QUANTITATIVE
Fachinformation IPV Mérieux Stand: Juli 2010 1. BEZEICHNUNG DES ARZNEIMITTELS IPV Mérieux Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. QUALITATIVE UND QUANTITATIVE
Tetravac. 1. Bezeichnung des Arzneimittels. 2. Qualitative und quantitative Zusammensetzung. 3. Darreichungsform
 1. Bezeichnung des Arzneimittels, Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff 2. Qualitative und quantitative Zusammensetzung
1. Bezeichnung des Arzneimittels, Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff 2. Qualitative und quantitative Zusammensetzung
Hepatyrix, Injektionssuspension Hepatitis-A- (inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert)
 1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Hepatyrix, Injektionssuspension Hepatitis-A- (inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Hepatyrix, Injektionssuspension Hepatitis-A- (inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
FACHINFORMATION IPV Mérieux 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 FACHINFORMATION IPV Mérieux 1. BEZEICHNUNG DES ARZNEIMITTELS IPV Mérieux Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
FACHINFORMATION IPV Mérieux 1. BEZEICHNUNG DES ARZNEIMITTELS IPV Mérieux Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Gebrauchsinformation: Information für Anwender. Inaktivierter Poliomyelitis-Impfstoff
 Gebrauchsinformation: Information für Anwender IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Polysaccharid-Gruppe-A, C, Y und W 135 -Impfstoff 2.
1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Polysaccharid-Gruppe-A, C, Y und W 135 -Impfstoff 2.
Fachinformation 1. Bezeichnung des Arzneimittels
 Anlage zu Zulassungsbescheid Zul.-Nr. PEI.H.04338.01.1 5/16 Fachinformation 1. Bezeichnung des Arzneimittels TETRAVAC Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis
Anlage zu Zulassungsbescheid Zul.-Nr. PEI.H.04338.01.1 5/16 Fachinformation 1. Bezeichnung des Arzneimittels TETRAVAC Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis
Polioviren (inaktiviert)* Typ 1 (Mahoney) 40 D-Antigen-Einheiten Typ 2 (MEF-1) 8 D-Antigen-Einheiten Typ 3 (Saukett) 32 D-Antigen-Einheiten
 1. BEZEICHNUNG DES ARZNEIMITTELS PEDIACEL Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis(azellulär, aus Komponenten)-Poliomyelitis(inaktiviert)- und Haemophilus Typ b Konjugatimpfstoff
1. BEZEICHNUNG DES ARZNEIMITTELS PEDIACEL Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis(azellulär, aus Komponenten)-Poliomyelitis(inaktiviert)- und Haemophilus Typ b Konjugatimpfstoff
Fachinformation. Internationale Einheiten, untere Vertrauensgrenze (p=0,95) der nach der Methode der Ph.Eur. ermittelten Wirksamkeit
 1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis (inaktiviert)-adsorbat-impfstoff (reduzierter Antigengehalt) 2. Qualitative und quantitative
1. Bezeichnung des Arzneimittels Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis (inaktiviert)-adsorbat-impfstoff (reduzierter Antigengehalt) 2. Qualitative und quantitative
FACHINFORMATION. Kinder und Jugendliche
 1. BEZEICHNUNG DES ARZNEIMITTELS Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis (azellulär, aus Komponenten)-Adsorbatimpfstoff (mit reduziertem Antigengehalt) ab dem vollendeten
1. BEZEICHNUNG DES ARZNEIMITTELS Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis (azellulär, aus Komponenten)-Adsorbatimpfstoff (mit reduziertem Antigengehalt) ab dem vollendeten
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert)
 1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (1,0 ml) enthält: Hepatitis A Virus
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (1,0 ml) enthält: Hepatitis A Virus
FACHINFORMATION. Wirkstoffe: Haemophilus influenzae Typ b-polysaccharide (Polyribosylribitolphosphat) konjugiert an
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Act-HIB Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension in einer Fertigspritze Haemophilus influenzae Typ b-konjugatimpfstoff 2.
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Act-HIB Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension in einer Fertigspritze Haemophilus influenzae Typ b-konjugatimpfstoff 2.
FACHINFORMATION. Diphtherie, Tetanus, Pertussis und Poliomyelitis. offiziellen Empfehlungen erfolgen. Kinder und Jugendliche
 Februar 2017 493138PD013N 1. BEZEICHNUNG DES ARZNEIMITTELS Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis (azellulär, aus Komponenten)- und Poliomyelitis (inaktiviert)-adsorbatimpfstoff
Februar 2017 493138PD013N 1. BEZEICHNUNG DES ARZNEIMITTELS Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis (azellulär, aus Komponenten)- und Poliomyelitis (inaktiviert)-adsorbatimpfstoff
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. Arzneimittel nicht länger zugelassen
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Quintanrix, Pulver und Suspension für Injektionssuspension Diphtherie-, Tetanus-, Pertussis (Ganzkeim)-, rekombinanter
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Quintanrix, Pulver und Suspension für Injektionssuspension Diphtherie-, Tetanus-, Pertussis (Ganzkeim)-, rekombinanter
Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff
 Gebrauchsinformation: Information für Patienten und Anwender Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff
Gebrauchsinformation: Information für Patienten und Anwender Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
1. BEZEICHNUNG DES ARZNEIMITTELS
 FACHINFORMATION Pentavac 1. BEZEICHNUNG DES ARZNEIMITTELS Pentavac Lyophilisat und Suspension zur Herstellung einer Injektionssuspension Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff
FACHINFORMATION Pentavac 1. BEZEICHNUNG DES ARZNEIMITTELS Pentavac Lyophilisat und Suspension zur Herstellung einer Injektionssuspension Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff
1. Was ist TdaP-IMMUN und wofür wird es angewendet?
 Page 1 of 6 Gebrauchsinformation: Information für Anwender TdaP-IMMUN Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis- (azelluläre Komponente) Impfstoff (adsorbiert, reduzierter
Page 1 of 6 Gebrauchsinformation: Information für Anwender TdaP-IMMUN Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis- (azelluläre Komponente) Impfstoff (adsorbiert, reduzierter
nicht weniger als 2 Internationale Einheiten (I.E.) (2,5 Lf) nicht weniger als 20 Internationale Einheiten (I.E.) (5 Lf) 2,5 Mikrogramm
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, und Pertussis (azellulär, Komponente) - Impfstoff
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, und Pertussis (azellulär, Komponente) - Impfstoff
FACHINFORMATION. Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis (azellulär, aus Komponenten)- und Poliomyelitis (inaktiviert)-
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis (azellulär, aus Komponenten)- und Poliomyelitis (inaktiviert)-
FACHINFORMATION. Diphtherie, Tetanus, Pertussis und Poliomyelitis. offiziellen Empfehlungen erfolgen. Kinder und Jugendliche
 1. BEZEICHNUNG DES ARZNEIMITTELS Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, (azellulär, aus Komponenten)- und Poliomyelitis (inaktiviert)-adsorbatimpfstoff (mit reduziertem Antigengehalt)
1. BEZEICHNUNG DES ARZNEIMITTELS Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, (azellulär, aus Komponenten)- und Poliomyelitis (inaktiviert)-adsorbatimpfstoff (mit reduziertem Antigengehalt)
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns)
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. Arzneimittel nicht länger zugelassen
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Tritanrix HepB, Suspension zur Injektion Diphtherie (D)-, Tetanus (T)-, Pertussis (Ganzzellen) (Pw)- und Hepatitis-B
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Tritanrix HepB, Suspension zur Injektion Diphtherie (D)-, Tetanus (T)-, Pertussis (Ganzzellen) (Pw)- und Hepatitis-B
Gebrauchsinformation: Information für den Anwender
 Gebrauchsinformation: Information für den Anwender Tetravac Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff Für Säuglinge
Gebrauchsinformation: Information für den Anwender Tetravac Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff Für Säuglinge
Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Mehrdosenbehältnis
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Mehrdosenbehältnis Polysaccharid-Impfstoff
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einem Mehrdosenbehältnis Polysaccharid-Impfstoff
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 3. DARREICHUNGSFORM 4. KLINISCHE ANGABEN
 1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 720 Kinder Injektionssuspension Hepatitis-A-Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (0,5ml) enthält: Hepatitis-A-Virus
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 720 Kinder Injektionssuspension Hepatitis-A-Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (0,5ml) enthält: Hepatitis-A-Virus
2,5 Mikrogramm. Die Verabreichung von Boostrix soll gemäß den jeweiligen offiziellen Empfehlungen erfolgen.
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, und Pertussis (azellulär, Komponente) - Impfstoff
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, und Pertussis (azellulär, Komponente) - Impfstoff
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix hexa, Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie (D)-, Tetanus (T)-,
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix hexa, Pulver und Suspension zur Herstellung einer Injektionssuspension Diphtherie (D)-, Tetanus (T)-,
Sanofi Pasteur MSD GmbH 1. BEZEICHNUNG DES ARZNEIMITTELS
 1. BEZEICHNUNG DES ARZNEIMITTELS REVAXiS Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis(inaktiviert)-Adsorbat-Impfstoff (reduzierter Antigengehalt) 2. QUALITATIVE UND QUANTITATIVE
1. BEZEICHNUNG DES ARZNEIMITTELS REVAXiS Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis(inaktiviert)-Adsorbat-Impfstoff (reduzierter Antigengehalt) 2. QUALITATIVE UND QUANTITATIVE
nicht weniger als 2 Internationale Einheiten (I.E.) (2,5 Lf) Tetanustoxoid 1
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio - Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis azellulär- und Poliomyelitis
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio - Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis azellulär- und Poliomyelitis
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. Arzneimittel nicht länger zugelassen
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix Penta, Injektionssuspension Diphtherie (D)-,Tetanus (T)-, Pertussis (azelluläre Komponenten) (Pa)-, Hepatitis
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Infanrix Penta, Injektionssuspension Diphtherie (D)-,Tetanus (T)-, Pertussis (azelluläre Komponenten) (Pa)-, Hepatitis
Zusammenfassung der Merkmale des Arzneimittels
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio - Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis azellulär- und Poliomyelitis
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio - Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis azellulär- und Poliomyelitis
Gebrauchsinformation: Information für den Anwender. Polio-Salk Mérieux - Fertigspritze Poliomyelitis-Impfstoff (inaktiviert)
 Gebrauchsinformation: Information für den Anwender Polio-Salk Mérieux - Fertigspritze Poliomyelitis-Impfstoff (inaktiviert) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
Gebrauchsinformation: Information für den Anwender Polio-Salk Mérieux - Fertigspritze Poliomyelitis-Impfstoff (inaktiviert) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
Mumpsviren, Stamm RIT , abgeleitet vom Stamm Jeryl Lynn (lebend, attenuiert) mindestens 10 3,7 ZKID 50
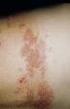 1. BEZEICHNUNG DES ARZNEIMITTELS MMR-PRIORIX - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis
1. BEZEICHNUNG DES ARZNEIMITTELS MMR-PRIORIX - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Masern-Mumps-Röteln-Lebendimpfstoff 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PENTAVAC Lyophylisat und Suspension zur Herstellung einer Injektionssupension Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PENTAVAC Lyophylisat und Suspension zur Herstellung einer Injektionssupension Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff
1 Impfdosis (0,5 ml) enthält: inaktivierte Influenza-Virus Spaltantigene* der folgenden Stämme:
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
Gebrauchsinformation: Information für Patienten und Anwender
 Gebrauchsinformation: Information für Patienten und Anwender Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff
Gebrauchsinformation: Information für Patienten und Anwender Nimenrix - Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff
GEBRAUCHSINFORMATION: INFORMATION FÜR DIE ANWENDERIN/DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DIE ANWENDERIN/DEN ANWENDER Repevax Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär, aus Komponenten)-Poliomyelitis (inaktiviert)-impfstoff
GEBRAUCHSINFORMATION: INFORMATION FÜR DIE ANWENDERIN/DEN ANWENDER Repevax Injektionssuspension in einer Fertigspritze Diphtherie-Tetanus-Pertussis (azellulär, aus Komponenten)-Poliomyelitis (inaktiviert)-impfstoff
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Boostrix Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis (azellulär, Komponente) - Impfstoff (adsorbiert, verminderter
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Boostrix Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis (azellulär, Komponente) - Impfstoff (adsorbiert, verminderter
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Meningokokken-Impfstoff A + C Mérieux
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Meningokokken-Impfstoff A + C Mérieux Lyophilisat (Trockensubstanz) und Lösungsmittel zur Herstellung einer Injektionssuspension Lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Meningokokken-Impfstoff A + C Mérieux Lyophilisat (Trockensubstanz) und Lösungsmittel zur Herstellung einer Injektionssuspension Lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender. IPV Mérieux Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff
 Gebrauchsinformation: Information für Anwender IPV Mérieux Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff Für Säuglinge ab 2 Monaten, Kinder und Erwachsene Lesen Sie
Gebrauchsinformation: Information für Anwender IPV Mérieux Injektionssuspension in einer Fertigspritze Inaktivierter Poliomyelitis-Impfstoff Für Säuglinge ab 2 Monaten, Kinder und Erwachsene Lesen Sie
FACHINFORMATION. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen
 FACHINFORMATION Mencevax ACWY März 2014 493134PD502J 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Polysaccharid-Gruppe-A,
FACHINFORMATION Mencevax ACWY März 2014 493134PD502J 1. BEZEICHNUNG DES ARZNEIMITTELS Mencevax ACWY Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Polysaccharid-Gruppe-A,
Sonstige Bestandteile: Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 1. BEZEICHNUNG DES ARZNEIMITTELS MUTAGRIP 2013/2014 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis (0,5 ml)
1. BEZEICHNUNG DES ARZNEIMITTELS MUTAGRIP 2013/2014 Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Impfdosis (0,5 ml)
Diphtherie-Toxoid mind. 20 I.E. 2 Tetanus-Toxoid mind. 40 I.E. 2 Bordetella-pertussis-Antigene
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Tetanus-Impfstoff Mérieux, mind. 40 I.E. Injektionssuspension in einer Fertigspritze Injektionssuspension Tetanus-Adsorbat-Impfstoff Für Säuglinge, Kinder
Gebrauchsinformation: Information für Anwender Tetanus-Impfstoff Mérieux, mind. 40 I.E. Injektionssuspension in einer Fertigspritze Injektionssuspension Tetanus-Adsorbat-Impfstoff Für Säuglinge, Kinder
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Influenzavirus Oberflächenantigene (Hämagglutinin und Neuroaminidase) der folgenden Stämme*:
 1. BEZEICHNUNG DES ARZNEIMITTELS Sandovac Injektionssuspension in einer Fertigspritze Influenzaimpfstoff (Oberflächenantigene, inaktiviert) (2014/2015) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Influenzavirus
1. BEZEICHNUNG DES ARZNEIMITTELS Sandovac Injektionssuspension in einer Fertigspritze Influenzaimpfstoff (Oberflächenantigene, inaktiviert) (2014/2015) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Influenzavirus
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften)
 F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS Influvac - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff aus inaktivierten Oberflächenantigenen)
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS Influvac - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff aus inaktivierten Oberflächenantigenen)
Gebrauchsinformation: Information für den Anwender. Hepatyrix Injektionssuspension
 Gebrauchsinformation: Information für den Anwender Hepatyrix Injektionssuspension Kombinierter Hepatitis A (inaktiviert) und Typhus-Vi- Polysaccharid Impfstoff (adsorbiert) Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für den Anwender Hepatyrix Injektionssuspension Kombinierter Hepatitis A (inaktiviert) und Typhus-Vi- Polysaccharid Impfstoff (adsorbiert) Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Act-HIB 10 Mikrogramm/0,5 ml, Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Konjugatimpfstoff gegen Haemophilus influenzae Typ b Lesen Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Act-HIB 10 Mikrogramm/0,5 ml, Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Konjugatimpfstoff gegen Haemophilus influenzae Typ b Lesen Sie
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS: FLUAD, Injektionssuspension in einer Fertigspritze Influenza-Impfstoff, Oberflächenantigene, inaktiviert, mit MF59C.1 als
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS: FLUAD, Injektionssuspension in einer Fertigspritze Influenza-Impfstoff, Oberflächenantigene, inaktiviert, mit MF59C.1 als
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels)
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Tetanol pur Injektionssuspension in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Tetanus-Toxoid
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Tetanol pur Injektionssuspension in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Wirkstoff: Tetanus-Toxoid
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Act-HIB Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Haemophilus influenzae Typ b-konjugat-impfstoff Bitte lesen Sie die gesamte
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Act-HIB Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Haemophilus influenzae Typ b-konjugat-impfstoff Bitte lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender. Typhim Vi 25 Mikrogramm Injektionslösung in einer Fertigspritze Typhus-Polysaccharid-Impfstoff
 Gebrauchsinformation: Information für Anwender Typhim Vi 25 Mikrogramm Injektionslösung in einer Fertigspritze Typhus-Polysaccharid-Impfstoff Für Kinder ab 2 Jahren und Erwachsene Lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender Typhim Vi 25 Mikrogramm Injektionslösung in einer Fertigspritze Typhus-Polysaccharid-Impfstoff Für Kinder ab 2 Jahren und Erwachsene Lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Td-Impfstoff Mérieux Injektionssuspension Diphtherie-Tetanus-Adsorbat-Impfstoff (reduzierter Antigengehalt) Für Kinder ab 5 Jahren und Erwachsene Lesen Sie
Gebrauchsinformation: Information für Anwender Td-Impfstoff Mérieux Injektionssuspension Diphtherie-Tetanus-Adsorbat-Impfstoff (reduzierter Antigengehalt) Für Kinder ab 5 Jahren und Erwachsene Lesen Sie
GEBRAUCHSINFORMATION Eurican Lmulti Injektionssuspension
 GEBRAUCHSINFORMATION Eurican Lmulti Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST Zulassungsinhaber:
GEBRAUCHSINFORMATION Eurican Lmulti Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST Zulassungsinhaber:
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns)
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
Gebrauchsinformation. Boostrix Polio
 Gebrauchsinformation Boostrix Polio Lesen Sie diese Packungsbeilage aufmerksam durch, bevor Sie/Ihr Kind diesen Impfstoff erstmals erhalten/erhält. - Heben Sie diese Packungsbeilage auf. Es ist möglich,
Gebrauchsinformation Boostrix Polio Lesen Sie diese Packungsbeilage aufmerksam durch, bevor Sie/Ihr Kind diesen Impfstoff erstmals erhalten/erhält. - Heben Sie diese Packungsbeilage auf. Es ist möglich,
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels) Hexyon
 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels) Hexyon 1. BEZEICHNUNG DES ARZNEIMITTELS Hexyon Injektionssuspension in einer Fertigspritze Hexyon Injektionssuspension Diphtherie-Tetanus-Pertussis(azellulär,
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels) Hexyon 1. BEZEICHNUNG DES ARZNEIMITTELS Hexyon Injektionssuspension in einer Fertigspritze Hexyon Injektionssuspension Diphtherie-Tetanus-Pertussis(azellulär,
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Rotarix Pulver und Lösungsmittel zur Herstellung einer Suspension zum Einnehmen Rotavirus-Lebendimpfstoff 2. QUALITATIVE
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Rotarix Pulver und Lösungsmittel zur Herstellung einer Suspension zum Einnehmen Rotavirus-Lebendimpfstoff 2. QUALITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension in einer Fertigspritze Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels) Hexyon
 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels) Hexyon Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels) Hexyon Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über
Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Priorix-Tetra Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff Lesen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Priorix-Tetra Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff Lesen
Engerix -B Erwachsene Injektionssuspension in einer Durchstechflasche oder in einer Fertigspritze Hepatitis-B (rdna)-impfstoff (adsorbiert) (HBV)
 1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Engerix -B Erwachsene Injektionssuspension in einer Durchstechflasche oder in einer Fertigspritze Hepatitis-B (rdna)-impfstoff (adsorbiert) (HBV) 2. QUALITATIVE
1 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Engerix -B Erwachsene Injektionssuspension in einer Durchstechflasche oder in einer Fertigspritze Hepatitis-B (rdna)-impfstoff (adsorbiert) (HBV) 2. QUALITATIVE
ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. RIKA-VACC Duo Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Kaninchen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS 1. RIKA-VACC Duo Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension, für Kaninchen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels)
 FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Epaxal - Suspension zur Injektion in einer Fertigspritze Hepatitis A-Impfstoff (inaktiviert, virosomal)
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Epaxal - Suspension zur Injektion in einer Fertigspritze Hepatitis A-Impfstoff (inaktiviert, virosomal)
32 D-Antigen Einheiten. Injektionssuspension in einer Fertigspritze. Boostrix Polio ist eine trüb - weiße Suspension.
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio - Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis azellulär- und Poliomyelitis
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Boostrix Polio - Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus-, Pertussis azellulär- und Poliomyelitis
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS HBVAXPRO 5 Mikrogramm, Injektionssuspension Hepatitis B-Impfstoff (rdns) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
GEBRAUCHSINFORMATION: INFORMATION FÜR DIE ANWENDERIN/DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DIE ANWENDERIN/DEN ANWENDER Pentavac Lyophilisat und Suspension zur Herstellung einer Injektionssuspension Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff
GEBRAUCHSINFORMATION: INFORMATION FÜR DIE ANWENDERIN/DEN ANWENDER Pentavac Lyophilisat und Suspension zur Herstellung einer Injektionssuspension Diphtherie-Tetanus-Pertussis (azellulär)-poliomyelitis (inaktiviert)-adsorbat-impfstoff
GEBRAUCHSINFORMATION FÜR. Eurican LR Injektionssuspension
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Eurican LR Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Eurican LR Injektionssuspension 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH
1.3.1 SPC, LABELLING AND PACKAGE LEAFLET
 1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 100 mg Brausetabletten
1.3.1 SPC, LABELLING AND PACKAGE LEAFLET Beschriftungsentwurf der Fachinformation Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Bronchoverde Hustenlöser 100 mg Brausetabletten
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender REVAXiS Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis (inaktiviert)-adsorbat-impfstoff (reduzierter Antigengehalt) Für Kinder
Gebrauchsinformation: Information für Anwender REVAXiS Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis (inaktiviert)-adsorbat-impfstoff (reduzierter Antigengehalt) Für Kinder
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften)
 F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS FluVaccinol Subunit Impfstoff - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS FluVaccinol Subunit Impfstoff - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff
Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15.
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Rotarix Pulver und Lösungsmittel zur Herstellung einer Suspension zum Einnehmen Rotavirus-Lebendimpfstoff 2. QUALITATIVE
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Rotarix Pulver und Lösungsmittel zur Herstellung einer Suspension zum Einnehmen Rotavirus-Lebendimpfstoff 2. QUALITATIVE
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER REVAXiS Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis (inaktiviert)-adsorbat-impfstoff (reduzierter Antigengehalt) Für
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER REVAXiS Injektionssuspension in einer Fertigspritze Tetanus-Diphtherie-Poliomyelitis (inaktiviert)-adsorbat-impfstoff (reduzierter Antigengehalt) Für
Gebrauchsinformation: Information für Patienten. Tetanol pur Injektionssuspension in einer Fertigspritze Tetanus-Toxoid
 Gebrauchsinformation: Information für Patienten Tetanol pur Injektionssuspension in einer Fertigspritze Tetanus-Toxoid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Patienten Tetanol pur Injektionssuspension in einer Fertigspritze Tetanus-Toxoid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
5 bis 10 Jahre: 0,5 ml Td-pur
 Td-pur für Erwachsene und Heranwachsende Tetanus-Diphtherie-Impfstoff (inaktiviert, adsorbiert, reduzierter Antigengehalt) Injektionssuspension in Fertigspritze 2. Qualitative und quantitative Zusammensetzung
Td-pur für Erwachsene und Heranwachsende Tetanus-Diphtherie-Impfstoff (inaktiviert, adsorbiert, reduzierter Antigengehalt) Injektionssuspension in Fertigspritze 2. Qualitative und quantitative Zusammensetzung
