Apremilast. ArzneimittelPROFIL Dermatologie. Psoriasis. Juni 2016
|
|
|
- Calvin Falk
- vor 4 Jahren
- Abrufe
Transkript
1 Psoriasis Juni 2016 ArzneimittelPROFIL Dermatologie
2 , Juni 2016 ArzneimittelPROFIL Dermatologie Editorial Board Univ.-Prof. Dr. Michael Binder, Wien OÄ Priv.-Doz. Dr. Christine Hafner, St. Pölten Univ.-Prof. Dr. Christoph Höller, Wien Assoc.-Prof. Mag. Dr. Roland Lang, Salzburg Univ.-Prof. Dr. Van Anh Nguyen, Innsbruck Prim. Univ.-Prof. Dr. Klemens Rappersberger, Wien Ao. Univ.-Prof. Dr. Gudrun Ratzinger, Innsbruck Priv.-Doz. Dr. Erika Richtig, Graz Prim. Univ.-Prof. Dr. Matthias Schmuth, Innsbruck Prim. Univ.-Prof. Dr. Franz Trautinger, St. Pölten Univ.-Prof. Dr. Iris Zalaudek, Graz Ziel der Publikation Die Reihe ArzneimittelPROFIL fasst die aktuell verfügbare wissenschaftliche Evidenz zu einer Substanz objektiv und komprimiert, aber nicht selektiv, zusammen. Pharmakologische Aspekte, Wirksamkeit und Nebenwirkungsprofil werden übersichtlich und leicht verständlich dargestellt. Grundlage für die Erstellung ist die umfassende Sichtung der wissenschaftlichen Fachliteratur. Hierbei kann auch auf Datenmaterial der Hersteller zurückgegriffen werden. Große kontrollierte Studien werden bevorzugt behandelt, ergänzend ev. Abstracts und Kongressberichte. Die Einhaltung wissenschaftlicher Grundsätze wird durch einen Scientific Editor, einen Managing Scientific Editor sowie ein Editorial Board gewährleistet, das bei der Auswahl von Substanzen, Autoren und Reviewer beratende Funktion hat. Die Beiträge werden von Experten der jeweiligen Fachgebiete verfasst. Objektivität und Korrektheit sind durch zwei unabhängige Reviewer gewährleistet. Die Meinung der Autoren und Reviewer muss nicht immer mit der des Editorial Board und des Verlags übereinstimmen. Die kritische Beurteilung der jeweiligen Substanz und deren klinischer Wertigkeit beruht allein auf der Einschätzung der unabhängigen Experten. Bei Vorliegen neuer Daten wird eine Aktualisierung angestrebt. Autoren dieser Ausgabe Univ.-Prof. Dr. Elisabeth Riedl (Klinik), Universitätsklinik für Dermatologie, Medizinische Universität Wien Univ.-Prof. Dr. Michael Wolzt (Präklinik), Universitätsklinik für Klinische Pharmakologie, AKH Wien und Medizinische Universität Wien Offenlegung von Interessenkonflikten Riedl: Beratungstätigkeit, Teilnahme an Advisory Boards, Referententätigkeit und/ oder Durchführung klinischer Studien für AbbVie, Amgen, Astellas, Celgene, Janssen, Eli-Lilly, Maruho, Merck & Co., Merck Sharp Dohme, Novartis, Pfizer. Wolzt: Vorträge und Beratungstätigkeit für Celgene. Impressum: Verleger, Eigentümer und Herausgeber: Medizin Medien Austria GmbH, DVR-Nr: , Verlagsanschrift: Grünbergstraße 15, 1120 Wien, Tel.: 01/ , Fax-DW: -730, Geschäftsführung: Thomas Zembacher, Prokuristin: Pia Holzer, Chefredaktion: Dr. Susanne Billich, Koordination: Dr. Susanne Billich, Objektleitung: Martina Osterbauer, medizin-medien.at, Art Direction: Karl J. Kuba, Layout und DTP: Sonja Vetters, Lektorat: Heinz Javorsky, Druck: Friedrich Druck & Medien GmbH, A-4020 Linz, Offenlegung gemäß 25 Mediengesetz siehe Auflage: 1500 Exemplare Die Realisierung dieser Ausgabe ermöglichte Celgene: erstellt 6/2016; PK/1482/ Eine inhaltliche Einflussnahme durch die Firma ist abgesehen von Datenkorrekturen gemäß den Studienergebnissen nach Ermessen der Redaktion nicht erfolgt. Copyright: Alle Rechte, insbesondere das Recht der Vervielfältigung und Verbreitung sowie der Übersetzung bleiben der Medizin Medien Austria GmbH vorbehalten. Kein Teil des Werks darf in irgendeiner Form ohne schriftliche Genehmigung des Verlags reproduziert oder unter Verwendung elektronischer Systeme gespeichert, verarbeitet, vervielfältigt, verwertet oder verbreitet werden. ISSN (Print) ISSN X (Online) Hinweise: Autoren, Reviewer und Verlag verwenden höchste Sorgfalt darauf, alle Daten dem Wissensstand bei Fertigstellung entsprechend anzugeben. Der Verlag kann für etwaige Fehler jedoch keine Gewähr übernehmen. Jeder Anwender ist angehalten, die aktuelle Fachinformation zu beachten. Zugunsten der besseren Lesbarkeit wird auf das Verwenden weiblicher Endungen verzichtet. Die Bezeichnung Patient ist geschlechtsneutral zu verstehen.
3 Psoriasis Elisabeth Riedl, Michael Wolzt Abstract Psoriasis ist eine immunpathologische, chronisch entzündliche Erkrankung, die auf eine polygenetische Disposition zurückgeht und durch vielfältige Triggerfaktoren induziert werden kann. In den westlichen Industrienationen sind 2 3% der Bevölkerung von der Erkrankung betroffen. Die häufigste Manifestation ist die chronische Plaque-Psoriasis (Psoriasis vulgaris), die bei 85 90% der erwachsenen Patienten auftritt. ist ein neues Medikament zur Behandlung der mittelschweren und schweren Plaque-Psoriasis, das durch die Hemmung der Phosphodiesterase 4 einen Anstieg von intrazellulärem cyclischem Adenosinmonophosphat (camp) bewirkt und so zu einer Dämpfung der Entzündungsreaktion führt. Die Wirksamkeit von in der Behandlung der Psoriasis wurde in zwei multizentrischen, doppelblinden, placebokontrollierten klinischen Studien untersucht und anhand verschiedener klinischer und psychologischer Scores dokumentiert. Primärer Endpunkt war die 75%-ige (ESTEEM 1) bzw. 50%- ige (ESTEEM 2) Verbesserung des Psoriasis Area and Severity Index (PASI) in Woche 16. In beiden Studien erreichten signifikant mehr Patienten in der -Gruppe den primären Endpunkt (33,1% PASI-75, ESTEEM 1; 35,8% PASI-50, ESTEEM 2) als unter (5,3%; p<0,0001). Unter erzielte auch ein signifikant höherer Anteil der Patienten einen spga (static Physician Global Assessment) von 0 (erscheinungsfrei) oder 1 (nahezu erscheinungsfrei) verglichen mit (ESTEEM 1: 21,7% vs. 17,8%; p<0,0001). führte auch zu einer signifikanten klinischen Verbesserung bei Befall der Kopfhaut und bei Nagelbefall, zur Abnahme von Pruritus und war mit positiven Auswirkungen auf die Lebensqualität verbunden. Die Langzeitwirksamkeit wurde durch anhaltende Effekte bis Woche 52 nachgewiesen. erwies sich in den klinischen Studien als sicher und gut verträglich. Die meisten unerwünschten Wirkungen waren mild und transient. Am häufigsten wurden gastrointestinale Nebenwirkungen beobachtet. Weiters traten Gewichtsabnahmen auf, die meist 5% des Körpergewichts betrugen. Es wurden keine signifikanten Unterschiede im Auftreten psychiatrischer Ereignisse zwischen den Wirkstoff- und den gruppen registriert. Inhalt 1. Einleitung Wirkmechanismus Pathogenetische Grundlagen der Psoriasis Bedeutung der Phosphodiesterase Wirkmechanismus und Effekte Pharmakokinetik Pharmakodynamik Wirksamkeit Phase-II-Studien Phase-III-Studien ESTEEM 1 und Verträglichkeit Dosierung und Verabreichung Zulassungsstatus Bewertung und Aussichten Abkürzungen Literatur Eigenschaften von Dosierung Die empfohlene Dosis beträgt 30mg zweimal täglich, wobei ein initiales Titrationsschema (7. Dosierung) einzuhalten ist. Die Einnahme wird morgens und abends im Abstand von etwa zwölf Stunden empfohlen und ist unabhängig von den Mahlzeiten. Aufnahme und Verteilung Bioverfügbarkeit (absolut)...73% t max...2,5h Verteilungsvolumen...87l Plasmaproteinbindung...68% t ½...9h Metabolisierung und Elimination wird umfassend metabolisiert und zu einer Reihe von Metaboliten abgebaut. Nach der Gabe von radioaktiv markiertem Wirkstoff finden sich etwa 58% der Radioaktivität im Urin und 39% in den Faeces. Unverändert finden sich etwa 3% der Dosis im Urin und 7% in den Faeces. ArzneimittelPROFIL Juni
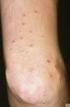
4 1. Einleitung Bei der Psoriasis handelt es sich um eine immunpathologische, chronisch entzündliche Erkrankung, die auf eine polygenetische Disposition zurückgeht und durch vielfältige Triggerfaktoren induziert werden kann. Schätzungen zufolge sind in den westlichen Industrienationen 2 3% der Bevölkerung betroffen (Augustin et al. 2010). Die häufigste Manifestation ist die Plaque-Psoriasis (Psoriasis vulgaris), die bei 85 90% der erwachsenen Patienten auftritt (Griffiths & Barker 2007, Nestle et al. 2009). Sie ist durch erhabene, scharf begrenzte, erythematöse und mit silberweißen Schuppen bedeckte Herde gekennzeichnet, die aus einer Hyperplasie der Epidermis aufgrund einer erhöhten Mitoserate und vorzeitigen Reifung mit unvollständiger Verhornung der basalen Keratinozyten resultiert. His tologische Parameter sind Hyperparakeratose, Akanthose, Papillomatose und intraepidermale Ansammlungen von neutrophilen Granulozyten (Munro-Abszesse). Typische Lokalisationen der Läsionen sind Ellbogen, Knie, Rücken und Sakralregion, sie können aber am gesamten Körper auftreten. Besonders häufig sind auch die behaarte Kopfhaut und die Nägel betroffen. Neben der psychologischen Belastung durch das stigmatisierende Erscheinungsbild der Erkrankung ist ein oft quälender Juckreiz das häufigste Begleitsymptom der Plaque-Psoriasis. Zwei aktuelle Überblicksarbeiten zeigen relativ hohe Therapieabbruchraten bei der Behandlung mit konventionellen systemischen Wirkstoffen und Biologika aufgrund von Aspekten der Verträglichkeit, Sicherheit, Wirksamkeit, Therapieüberwachung oder der Verabreichung durch Injektionen (Armstrong et al. 2013, Lebwohl et al. 2014). In einer US-amerikanischen Erhebung waren 52,3% der Patienten mit der Behandlung nicht zufrieden (Armstrong et al. 2013). Daten aus den USA und Europa haben eine Therapieabbruchrate von 57% ergeben (Lebwohl et al. 2014). 2. Wirkmechanismus 2.1. Pathogenetische Grundlagen der Psoriasis Man geht davon aus, dass es sich bei der Psoriasis um eine Dysregulation des Immunsystems handelt. Als ein entscheidender Schritt in den ersten Phasen der Pathogenese wird die Aktivierung zirkulierender plasmazytoider dendritischer Zellen durch einen Peptid-DNA-Komplex erachtet. In Folge werden weitreichende Entzündungskaskaden in Gang gesetzt (Schafer et al. 2010, Schafer 2012, Nestle et al. 2009). Die entzündlichen Reaktionen werden vor allem durch die Aktivität von dendritschen Zellen und T-Helfer(Th)1- und Th17-Zellen geprägt, wobei wiederum die proinflammatorischen Zytokine Tumornekrosefaktor(TNF)-α, Interleukin(IL)-17 und IL-23 von zentraler Bedeutung sind. Unter Beteiligung weiterer Immun- und Nicht-Immunzellen wie z.b. Keratinozyten sowie Entzündungsmediatoren nimmt der Krankheitsprozess in Feedbackschleifen seinen Fortgang und mündet in den verschiedenen psoriatrischen Manifestationen Bedeutung der Phosphodiesterase 4 Über cyclisches Adenosinmonophosphat (camp) kann die Expression inflammatorischer Mediatoren in Immunzellen reguliert werden, wobei die Entzündungsreaktion durch einen niedrigen camp-spiegel gefördert und durch einen hohen abgeschwächt wird. Der Abbau von camp erfolgt durch Phosphodiesterasen, die gewebsspezifisch exprimiert werden. Die Phosphodiesterase 4 (PDE4) ist das vorherrschende camp-hydrolysierende Enzym in Immunzellen, die in die Pathogenese von Psoriasis und Psoriasis-Arthritis involviert sind wie dendritische Zellen, T-Zellen, Makrophagen und Monozyten sowie Keratinozyten und Synovialzellen (Schett et al. 2010, Schafer 2012). Chemische Struktur von Abb. 1 O NH O O N Quelle: Man et al Wirkmechanismus und Effekte ist ein kleines Molekül mit einer Masse von 460,5g/mol und aus einem Phthalimid- und einem Dialkoxyphenyl-Ring aufgebaut (Abb. 1). Über den Dialkoxyphenyl-Ring bindet kompetitiv an das aktive Zentrum der PDE4 und verhindert damit die Hydrolyse von camp zu AMP (Man et al. 2009). Die IC 50 liegt bei 0,074µM. In einer Konzentration von 10µM werden alle vier PDE4-Subtypen A, B, C und D zu 91 bis 99% gleichermaßen erfasst (Schafer et al 2014). Die Hemmung der PDE4 durch ist selektiv. zeigt keine signifikante inhibitorische Aktivität gegenüber den Phosphodiesterasen der übrigen zehn PDE-Enzymfamilien (Schafer et al. 2014). Bei insgesamt 255 Kinasen und 68 Zellrezeptoren wurde keine signifikante Affinität zu festgestellt (Schafer et al. 2014). entfaltet seine Wirkungen auf Ebene der Genexpression (Abb. 2; Houslay et al. 2005, Schafer et al. 2010, Schafer 2012). Der durch die PDE4-Hemmung vermittelte camp- Anstieg führt zu einer Aktivierung der Proteinkinase A. In der Folge wird die Expression proinflammatorischer Botenstoffe (wie z.b. TNF-α, IL-23, IL-17) gehemmt. Die von camp Response Element-Binding Protein (CREB) und Activating Trans cription Factor-1 (ATF1) abhängige Genexpression und damit die Bildung antiinflammatorischer Botenstoffe wie IL-10 nimmt zu. Obwohl ein breites Spektrum von Immunbotenstoffen moduliert, bleiben seine Effekte auf angeborene Immunmechanismen fokussiert. Der Wirkstoff zeigt keinen Einfluss auf die klonale Expansion von T- oder B-Zellen in vitro oder auf die Antikörperbildung in vivo (Schafer et al. 2014). 3.Pharmakokinetik Die Daten zur Pharmakokinetik wurden der Fachinformation der Europäischen Arzneimittelagentur über entnommen (Fachinformation 2015). Resorption und Verteilung. Mit einer absoluten oralen Bioverfügbarkeit von 73% wird gut resorbiert, wobei die maximalen Plasmakonzentrationen (C max ) im Median nach etwa 2,5h (t max ) erreicht werden. Die Pharmakokinetik ist linear und zeigt einen dosisproportionalen Anstieg der systemischen Exposition im Bereich von 10 bis 100mg täglich. Bei einmal täglicher Gabe ist die Kumulation minimal, bei zweimal täglicher Gabe beträgt sie bei gesunden Probanden etwa 53% und bei Psoriasispatienten 68%. Die Bioverfügbarkeit wird durch eine gleichzeitige Nahrungsaufnahme nicht beeinflusst. Die Plasmaproteinbindung beim Menschen beträgt etwa 68%. Das mitt- O O O O S 4 ArzneimittelPROFIL Juni 2016
5 Wirkmechanismus von Abb. 2 Immunzelle camp NF-κB Proinflammatorische Mediatoren (TNF-α, IL-17, IFN-γ) PDE4 PKA AMP CREB Antiinflammatorische Mediatoren (IL-10) AMP=Adenosinmonophosphat; camp=cyclisches Adenosinmonophosphat; CREB=Response Element-Binding Protein; IFN-γ= Interferon-γ; IL-10=Interleukin-10; IL-17=Interleukin-17; NF-κB=Nuclear Factor Kappa-Light-Chain-Enhancer of Activated B-cells; PDE4=Phosphodiesterase 4; PKA=Proteinkinase A; TNF-α=Tumornekrosefaktor-α Quelle: Schafer et al lere scheinbare Verteilungsvolumen liegt bei 87l, was auf eine extravaskuläre Verteilung hinweist. Metabolismus und Elimination. Die Hauptkomponente im Blutkreislauf nach oraler Gabe ist der unveränderte Wirkstoff. wird sowohl über Cytochrom-P450(CYP)-vermittelte als auch über CYP-unabhängige Stoffwechselwege umfassend metabolisiert. Die terminale Eliminationshalbwertszeit (t ½ ) beträgt ca. neun Stunden. In Urin und Faeces wurden bis zu 23 Metabolite gefunden. Die Abbauwege schließen Oxidations-, Hydrolyse- und Konjugationsreaktionen ein, daher dürfte es bei Hemmung eines einzelnen Abbauwegs zu keinen bedeutsamen Arzneimittelwechselwirkungen kommen. Die oxidative Metabolisierung von wird primär von CYP3A4 getragen, CYP1A2 und CYP2A6 sind in einem geringeren Ausmaß beteiligt. Nach der Gabe von radioaktiv markiertem fanden sich etwa 58% der Radioaktivität im Urin und 39% in den Faeces. Unverändert fanden sich etwa drei Prozent der Dosis im Urin und sieben Prozent in den Faeces. Arzneimittelinteraktionen. Starke CYP3A4-Induktoren vermindern die Exposition von, und es kann zu einem Wirksamkeitsverlust kommen. Die gleichzeitige Anwendung mehrerer Dosen Rifampicin resultierte in einer Abnahme der Area Under the Curve (AUC) und der C max von um 72 bzw. 43%. Daher wird die gleichzeitige Anwendung von Rifampicin und anderen starken CYP3A4-Induktoren wie Carbamazepin, Johanniskraut, Phenobarbital und Phenytoin nicht empfohlen. Spezielle Patientengruppen Alter. Eine Dosisanpassung ist nicht erforderlich. Die Exposition von ist bei älteren Probanden (65 bis 85 Jahre) etwas höher als bei jüngeren (18 bis 55 Jahre). Die AUC ist etwa 13%; die C max etwa 6% höher. Altersbedingte Abnahmen der Clearance weisen keine klinische Signifikanz auf (EPAR-Fachbericht 2015). Es liegen keine Daten zur Sicherheit und Wirksamkeit bei Kindern und Jugendlichen bis 17 Jahren vor. Geschlecht. Da geschlechtsspezifische Unterschiede in der Exposition innerhalb der individuellen Schwankungsbreite lagen ist keine Dosisanpassung erforderlich (EPAR-Fachbericht 2015). Gewicht. Bei zu Beginn der Behandlung untergewichtigen Patienten sollte das Körpergewicht regelmäßig kontrolliert werden. Bei ungeklärtem und klinisch relevantem Gewichtsverlust ist ein Absetzen der Behandlung in Erwägung zu ziehen (6. Verträglichkeit). Patienten mit Leberinsuffizienz. Bei Patienten mit eingeschränkter Leberfunktion ist keine Dosisanpassung erforderlich. Patienten mit Niereninsuffizienz. Bei Patienten mit leicht oder mäßig eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich. Bei stark eingeschränkter Nierenfunktion (estimated glomerular filtration rate, egfr <30ml/min) sollte die Dosis von auf 30mg einmal täglich reduziert werden. Für die initiale Dosistitration bei diesen Patienten wird empfohlen, nur mit den Morgendosen zu titrieren (siehe 7. Dosierung). Schwangerschaft und Stillzeit. ist während der Schwangerschaft kontraindiziert. Zu den Auswirkungen von auf die Trächtigkeit gehörten embryofetale Verluste bei Mäusen und Affen sowie vermindertes fetales Gewicht und verzögerte Ossifikation bei Mäusen in höheren Dosen als der derzeit höchsten beim Menschen empfohlenen Dosis. Bei einer Exposition, die dem 1,3-Fachen der klinischen Exposition entsprach, wurden keine solchen Auswirkungen bei Tieren beobachtet. Während der Stillzeit soll nicht angewendet werden. Der Wirkstoff wurde in der Milch laktierender Mäuse nachgewiesen. Es ist nicht bekannt, ob oder dessen Metabolite in die Muttermilch übergehen. Ein Risiko für das gestillte Kind kann nicht ausgeschlossen werden. 4. Pharmakodynamik führte in vitro bei verschiedenen Zelltypen wie peripheren mononukleären Blutzellen (Peripheral Blood Mononuclear Cells, PBMC), T-Zellen und Keratinozyten zu einer ArzneimittelPROFIL Juni
6 Abnahme proinflammatorischer und einer Zunahme antiinflammatorischer Entzündungsmediatoren (Schafer et al. 2010, 2014). Zellkulturversuche lieferten mehrere Hinweise auf ein antiangiogenetisches Potenzial von (Schafer et al. 2010, EPAR-Fachbericht 2015). In einem SCID-Maus-Modell mit humanen Xenotransplantaten bewirkte eine signifikante Reduktion der Dicke der Läsionen und der Keratinozytenproliferation sowie eine Normalisierung der histologischen Befunde (Schafer et al. 2010). Daten zur klinischen Pharmakodynamik (Gottlieb et al. 2008, 2013) bestätigen die Ergebnisse präklinischer Untersuchungen. Aufgrund der signifikanten Abnahme des Entzündungsinfiltrats und immunphänotypischer Marker wie CD11c (dendritische Zellen), CD3 (T-Zellen) und CD56 (Natürliche Killer-(NK)- und NK-T-Zellen) wurde gefolgert, dass die Infiltration von myeloiden dendritischen Zellen, T-Zellen und NK- sowie NK-T-Zellen in die Dermis und Epidermis partiell inhibiert. Nach zwölf Wochen war TNF-α um 42,7% deutlich, wenn auch statistisch nicht signifikant, reduziert; signifikant war die Reduktion der IL12- und IL23p40-Spiegel unter mit einer Abschwächung der Th1-, Th17- und Th22-T-Zell-Signalkaskade und einer verminderten Produktion von DEFB4 (Defensin Beta 4, antimikrobielles Peptid) und IL-8 durch Keratinozyten. 5. Wirksamkeit Zur Beurteilung der Wirksamkeit von Therapien gegen Psoriasis werden verschiedene Scores und Indices herangezogen (Tab. 1) Phase-II-Studien Wirksamkeitsnachweis. In der Studie von Gottlieb et al. (2013) erhielten 30 erwachsene Patienten ( 18 Jahre) mit zumindest seit sechs Monaten bestehender Plaque-Psoriasis in einer Dosierung von 20mg zweimal täglich (BID). Nach zwölf Wochen erreichten 66,7% eine Verbesserung von 1 Punkt im spga-score, die mittlere Abnahme des PASI betrug 59,0%. Dosisfindung. In einer Phase-IIb-Studie wurden insgesamt 89 Patienten mit mittelschwerer oder schwerer Plaque-Psoriasis 1:1:1:1 randomisiert und erhielten in den Dosierungen 10, 20 oder 30mg BID oder (Papp et al. 2012). Bei einer Dosis von 10mg BID war nach 16 Wochen kein wesentlicher Unterschied zu erkennbar, unter 20mg BID erreichten 28,7% der Patienten zumindest eine PASI-75-Antwort, unter 30mg BID waren es 40,9%. Basierend auf diesen Ergebnissen und den Daten aus präklinischen Untersuchungen (Schafer et al. 2010) wurden die Phase-III-Studien zur Plaque-Psoriasis mit 30mg BID durchgeführt Phase-III-Studien ESTEEM 1 und 2 Es wurden zwei placebokontrollierte, multizentrische, doppelblinde Phase-III-Zulassungsstudien zum Einsatz von bei Plaque-Psoriasis durchgeführt (Efficacy and Safety Trial Evaluating the Effects of in Psoriasis, ESTEEM; Papp et al. 2015a, Paul et al. 2015). Langzeitdaten und gepoolte Analysen wurden im Rahmen von Kongressen präsentiert bzw. sind dem EPAR-Fachbericht (2015) zu entnehmen. Die beiden Studien weisen einen weitgehend identischen dreiphasigen Aufbau auf (Abb. 3; EPAR-Fachbericht). Die Randomisierung zu Studienbeginn erfolgte 2:1 auf 30mg BID bzw. (Abschnitt A). wurde innerhalb einer Woche beginnend mit 10mg einmal täglich bis auf 30mg BID auftitriert (Dosierschema siehe 7. Dosierung). Die Anwendung niederpotenter topischer Kortikosteroide, Kohleteershampoos und salicylsäurehaltiger Präparate für die Kopfhaut war durchgehend erlaubt. Phototherapie war nur in der ursprünglichen gruppe oder bei Non-Respondern gestattet. In beide ESTEEM-Studien waren erwachsene Patienten ( 18 Jahre) mit mittelschwerer oder schwerer Plaque- Psoriasis eingeschlossen. Die Baseline-Charakteristika sind in Tab. 2 für die beiden Wirkstoffgruppen aufgelistet, die Daten der gruppen waren vergleichbar. Primärer Endpunkt war der Prozentsatz von Patienten mit einer mindestens PASI-75- (ESTEEM 1) bzw. PASI-50-Verbesserung (ESTEEM 2) in Woche 16. Patienten, die den Endpunkt erreichten, wurden als Responder bezeichnet. Der wichtigste sekundäre Endpunkt in Woche 16 war der Prozentsatz von Patienten mit einen spga-score von 1 oder 0. Patienten aus der gruppe wurden in Woche 16 auf umgestellt (Switch-Gruppe), wobei analog zur initialen -Kohorte eine Dosistitration von erfolgte (Abschnitt B). In Woche 32 (Abschnitt C) wurden die Responder des ursprünglichen -Arms aus Abschnitt A zwischen und re-randomisiert. Bei Verlust des PASI-75- bzw. PASI-50-Ansprechens wurde zurück auf umgestellt. Die Non-Responder des ursprünglichen -Arms und Patienten der Switch-Gruppe erhielten in Abschnitt C durchgehend. Die Studienteilnehmer aus der gruppe in Abschnitt A, die in Abschnitt B auf Verwendete Bewertungssysteme und Definitionen Tab. 1 Score/Index Body Surface Area bzw. Körperoberfläche: Prozentueller Anteil der betroffenen Körperoberfläche Psoriasis Area and Severity Index (0 72): Ausprägung von Erythem, Infiltration und Schuppung sowie Ausmaß der betroffenen Körperregionen PASI 50, 75 und 90 geben eine mindestens 50-, 75- oder 90-prozentige Reduktion (Verbesserung) des PASI bezogen auf den Ausgangswert an Nail Psoriasis Severity Index (0-8 pro Nagel) beurteilt psoriatische Veränderungen des Nagelbetts und der Nagelmatrix bei Vorliegen einer Nagelpsoriasis Physician s Global Assessment (0-5): standardisierte Beurteilung der Hautläsionen (Erythem, Induration, Schuppung) durch den Arzt staticpga (0-5): PGA zu einem bestimmten Zeitpunkt ScPGA: Variante für den Befall der Kopfhaut (Scalp) Pruritus-VAS-Wert (VAS=Visuelle Analogskala; 0-100): Beurteilung der Stärke des Juckreizes durch den Patienten Dermatology Life Quality Index, dermatologischer Lebensqualitätsfragebogen (0 30): Beurteilung der Beeinträchtigung der Lebensqualität (max. 30) über einen Zeitraum von sieben Tagen durch den Patienten Abkürzung BSA bzw. KOF PASI PASI-50 PASI-75 PASI-90 NAPSI PGA spga ScPGA Pruritus- VAS-Wert DLQI Verwendete Definition von mittelschwerer bis schwerer Plaque- Psoriasis: PASI 12, BSA/KOF 10%, spga 3 6 ArzneimittelPROFIL Juni 2016
7 Design der Phase-III-Studien ESTEEM 1 und 2 Abb. 3 kontrollierte Phase Erhaltungsphase Therapieabsetzphase Screening Randomisierung 1:2 Woche 0 Woche 16 Woche 32 Woche 52 30mg BID 30mg BID 1 PASI-75 bzw. -50 <PASI-75 bzw. -50 PASI-75 bzw mg BID mg BID ± topische Therapie, Phototherapie 30mg BID <PASI-75 bzw mg BID ± topische Therapie, Phototherapie BID=Bis In Die Verlängerung bis zu fünf Jahren 1 Auftitriert 2 Bei Verlust von PASI-75 bzw. 50 zurück zu ohne Auftitrieren, spätestens in Woche 52 Quelle: Rich et al eingestellt worden waren, wurden für den Abschnitt C in Responder und Non-Responder getrennt. Erstere erhielten weiterhin, Letztere zusätzlich topische Behandlungen bzw. UVB-Phototherapie. Beurteilung der Wirksamkeit Resultate zum primären Endpunkt nach 16 Wochen. In ESTEEM 1 waren insgesamt 844 Patienten eingebunden (Papp et al. 2015a). Den primären Endpunkt eine PASI-75-Verbesserung nach 16 Wochen erreichten mit einem Unterschied von 27,8% signifikant mehr Patienten unter (33,1%) als unter (5,3%; 95% CI: 23,1 32,5; p<0,0001; Tab. 3). Den wichtigsten sekundären Endpunkt, einen spga von 0 (befallsfrei) oder 1 (nahezu befallsfrei), erzielten 21,7% der Patienten in der - Gruppe und daher mit 17,8% (95% CI: 13,7 21,9; p<0,0001) ebenfalls deutlich mehr als in der gruppe (3,9%). Signifikante Verbesserungen wurden unter anderem auch bei Nagelbefall, bei Läsionen der Kopfhaut sowie bei Pruritus und Lebensqualität verzeichnet (Tab. 3). Die Ergebnisse von ESTEEM 2 (n=411) bestätigen die Resultate von ESTEEM 1 (Tab. 3; Paul et al. 2015). Generell gilt, dass der Wirkungseintritt von mit einem signifikanten klinischen Benefit bereits nach zwei Wochen rasch erfolgen kann (EPAR-Fachbericht 2015). Der Analyse verschiedener Subgruppen zufolge entfaltet seine Wirksamkeit unabhängig von Erkrankungsdauer, vorangegangenen Therapien und dem Ansprechen auf Vortherapien sowie dem Vorhandensein einer Psoriasis-Arthritis (PsA). PsA in der Vorgeschichte war bei 18% der Teilnehmer von ESTEEM 1 und 2 bekannt (EPAR-Fachbericht 2015). Wiederansprechen. Von den Respondern, die in Woche 32 der ESTEEM-1-Studie auf re-randomisiert worden waren (n=77), verloren 83,1% das PASI-75-Ansprechen, und zwar nach durchschnittlich 5,1 Wochen (CI 95%: 4,1 8,1; Papp et al. 2015a). Nach Wiederaufnahme der Behandlung mit konnten 70,3% dieser Patienten nach 3,4 bis 22,1 Wochen neuerlich eine PASI-75-Verbesserung erreichen. Von den PASI-50-Respondern in der ESTEEM2 Studie, die in Woche 32 auf re-randomisiert worden waren, verloren 52% wieder diese PASI-Verbesserung. Nachdem sie wieder auf eingestellt wurden, erreichten 66% bis Woche 52 neuerlich PASI-50 (Eintritt nach 2,6 bis 18,3 Wochen). Persistenz der Wirkung. Die Auswertung nach 52 Wochen zeigt die Persistenz der Wirkung. Die anhaltende Wirkung von bis Woche 52 wurde in ESTEEM 1 und 2 bei denjenigen Studienteilnehmern gezeigt, die die Substanz durchgehend erhalten hatten und als Responder einzustufen waren (EPAR- Fachbericht 2015, Fachinformation 2015, Papp et al. 2015a, Paul et al. 2015). In ESTEEM 1 waren das jene Studienteilnehmer, die ESTEEM: Baseline-Charakteristika in den Tab. 2 Wirkstoffgruppen ESTEEM-1 n=562 ESTEEM-2 n=274 Alter (Jahre) 45,8±13,1 45,3±13,1 Frauen (%) 32,6 35,8 Body Mass Index (kg/m2) 31,2±6,7 30,9±6,7 Gewicht (kg) 93,2±21,4 91,4±23,0 Krankheitsdauer (Jahre) 19,8±13,0 17,9±11,4 Mittelwert PASI-Score 18,7±7,2 18,9±7,1 PASI-Score >20 (%) 28,1 29,6 Mittelwert KOF (%) 24,4±14,7 25,5±15,4 KOF >20% (%) 47,3 52,2 spga 3 (%) 71,4 spga 4 (%) 28,6 27,4 Mittelwert Pruritus-VAS-Score (mm) 66,2±25,5 67,8±25,2 Mittelwert DLQI-Score 12,7±7,1 Nagelpsoriasis NAPSI 64,6 63,9 ScPGA 3 (%) 66,5 64,2 Vorangegangene systemische Therapie insgesamt (%) 53,6 57,3 Vorangegangene konventionelle systemische Therapie (%) 37,7 38,7 Vorangegangene Therapie mit Biologika (%) 28,8 33,6 Quellen: Papp et al. 2015a, Paul et al ArzneimittelPROFIL Juni
8 Anhaltende Wirkung von (ESTEEM 1) Abb. 4 Mediane Veränderung im PASI-Score im Vergleich zur Baseline (in Prozent) Zeit (in Wochen) kontrollierte Phase Erhaltungsphase Therapieabsetzphase n= n= BID=Bis in Die Quelle: Papp et al. 2015a 30mg BID Responder (PASI-75 in Woche 32), durchgehend unter 30mg Responder (PASI-75 in Woche 32), die bis Woche 16 erhalten hatten ESTEEM 1 und 2: Pruritus nach 16 Wochen Abb. 5 Mediane Veränderung im Pruritus-VAS-Score im Vergleich zur Baseline (in Millimeter) BID=Bis in Die Zeit (in Wochen) ,0-11,4-24,7-25,0 ESTEEM 1 30mg BID ESTEEM 2 30mg BID ESTEEM 1 n= n= ,7-12,9-33,8-36,4 ESTEEM 2 n= n= Quelle: Feldman et al bis Woche 32 ein PASI-75-Ansprechen erreicht hatten und für den Studienabschnitt C auf re-randomisiert worden waren. Von dieser Subgruppe (n=77) erreichten in Woche 52 61,0% ein PASI-75-Ansprechen; 75,3% der Studienteilnehmer erreichten zumindest eine 70-prozentige Abnahme des PASI- Scores. Insgesamt betrug in dieser Subgruppe die durchschnittliche Reduktion des PASI-Scores in Abschnitt C 81 bis 88% im Vergleich zum Ausgangswert (Abb. 4; Papp et al. 2015a). Die Ergebnisse von ESTEEM 2 bestätigen die anhaltende Wirkung von (EPAR-Fachbericht und Fachinformation 2015, Paul et al. 2015). Responder (n=61) hatten im Vergleich zum Ausgangswert eine durchschnittliche Reduktion des PASI- Scores von 77% in Woche 32 und von 74,4% in Woche 52. PASI-50 wurde von den Respondern in Woche 52 zu 80,3% erreicht (Paul et al. 2015). Non-Responder erreichten nach 52 Wochen immerhin zu 45,7% ein PASI-50-Ansprechen (Abb. 4; Paul et al. 2014a). Der in Abschnitt A gezeigte rasche Wirkungseintritt wurde nach der Umstellung von auf in Abschnitt B bestätigt. Patienten, die in Woche 16 von auf umgestellt wurden und in Woche 32 einen PASI-75 (ESTEEM-1) bzw. -50 (ESTEEM-2) erreichten, erzielten nach 52 Wochen eine vergleichbare Reduktion des PASI-Scores wie Patienten, die durchgehend erhalten hatten (Abb. 4). Pruritus. Die signifikante Reduktion des Pruritus-VAS-Score in den beiden ESTEEM- Studien nach 16 Wochen entspricht einer Verringerung der Beschwerden um 50% (Abb. 5, Tab. 3; Papp et al. 2015a, Paul et al. 2015). Eine als klinisch relevante Verbesserung (MCID) bezeichnete 20-prozentige Besserung wird in Woche 16 von 70,6 bzw. 67,5% aller Patienten unter erreicht ( 33,7 bzw. 40,9%; Armstrong et al. 2014, Paul et al. 2015). Der VAS-Score für Hautbeschwerden/Schmerzen von den Werten her mit dem Pruritus-Score vergleichbar wurde in beiden ESTEEM-Studien durch im Vergleich zu signifikant verringert (Yosipovitch et al. 2014). Der Effekt blieb bis zum Messzeitpunkt in Woche 32 erhalten. Kopfhaut. In Woche 16 erreichte in den -Armen der beiden ESTEEM-Studien ein signifikant höherer Prozentsatz der Patienten einen ScPGA 0 1 als unter (Abb. 6, Tab. 3; Papp et al. 2015a, Paul et al. 2015). In einer Analyse der Subgruppe mit Kopfhautbefall aus ESTEEM-1 zeigte sich in Woche 32 bei jenen Patienten, die in Woche 16 von auf randomisiert wurden, ein vergleichbarer Erfolg (Rich et al. 2015). Auch 73% derjenigen Patienten, die in Woche 32 auf und bei Verschlechterung auf re-randomisiert worden waren, erzielten insgesamt eine Reduktion des ScPGA-Scores. Daten aus ESTEEM 2 bestätigen diese Ergebnisse (Tab. 4; Crowley et al. 2015). Alle Studienteilnehmer, die von Anfang an erhalten hatten und in Woche 32 Responder waren, konnten die Verbesserung bis Woche 52 aufrechterhalten. Nagelpsoriasis. Die Wirksamkeit von wurde in ESTEEM 1 und 2 nach 16 Wochen anhand der signifikanten Reduktion des NAPSI-Scores und des deutlichen Überhangs beim Erreichen von NAPSI-50 in der Wirkstoffgruppe im Vergleich zu gezeigt (Abb. 6, Tab. 3; Papp et al. 2015a, Paul et al. 2015). In beiden Studien erfuhren Responder bis Woche 52 eine kontinuierliche Verbesserung (Tab. 4; Crowley et al. 2015, Rich et al. 2015). Dabei war eine klare Korrelation mit der Entwicklung des PASI-Scores gegeben (Rich et al. 2015). Lebensqualität. Nach den Ergebnissen aus dem dermatologischen Lebensqualitätsfragebogen (DLQI) erfahren die Patien- 8 ArzneimittelPROFIL Juni 2016
9 ESTEEM 1 und 2: Kopfhaut und Nägel nach 16 Wochen Abb Kopfhaut 100 Nägel Patienten mit ScPGA-Score 0 1 (in Prozent) ,5 ESTEEM 1 ESTEEM 2 ESTEEM 1 ESTEEM 2 p<0,0001 p<0, ,5 40,9 Patienten mit NAPSI-50 (in Prozent) 80 p<0,0001 p<0, , ,3 17, ,7 14,9 (n=189) 30mg BID (n=374) (n=93) 30mg BID (n=176) (n=195) BID=Bis in Die; ScPGA-Score=Scalp Physician s Global Assessment; NAPSI-50=Nail Psoriasis Severity Index, 50-prozentige Verbesserung 30mg BID (n=363) (n=91) 30mg BID (n=175) Quelle: Crowley et al. 2014; Paul et al. 2014b; Papp et al. 2015a ten unter bereits nach 16 Wochen eine signifikant stärkere Verbesserung ihrer Lebensqualität als unter (Tab. 3; Papp et al. 2015a, Paul et al. 2015). Die Korrelation zwischen PASI-Score und Lebensqualität ist in Abb. 7 für beide ESTEEM-Studien dargestellt (Gooderham et al. 2014). Eine Verbesserung des DLQI-Scores von 5 Punkten und gleichzeitig PASI-50 erreichten unter 49,1% der Patienten, unter waren es 13,4% (p<0,0001). Bei der über 52 Wochen durchgehenden Behandlung mit konnten die Verbesserungen der DLQI-Lebensqualität den ganzen Zeitraum aufrechterhalten werden. Signifikante Verbesserungen bezüglich der Arbeitsfähigkeit, erhoben über den Work Limitations Ergebnisse nach 16 Wochen (primäre Endpunkte fett gedruckt) Tab. 3 ESTEEM 1 (Papp et al. 2015a) (n=282) (n=562) ESTEEM 2 (Paul et al. 2015) (n=137) Questionnaire (WLQ-25), wurden ebenfalls registriert (p<0,05; EPAR-Fachbericht 2015, Papp et al. 2015b). (n=274) PASI-50, % 17,0 58,7* 19,7 55,5* PASI-75, % 5,3 33,1* 5,8 28,8* PASI-90, % 0,4 9,8* 1,5 8,8** Mittelwert Veränderung KOF, % (SD) -6,9 (±38,9) -47,8 (±38,4)* -6,1 (±47,57) -48,4 (±40,78)* spga 0-1, % 3,9 21,7* 4,4 20,4* Mittelwert Veränderung DLQI-Score, % (SD) Mittelwert Veränderung Pruritus-VAS-Score, mm (SD) -2,1 (±5,69) -7,3 (±27,08) -6,6 (±6,66)* -31,5 (±32,43)* -2,8 (±7,22) -12,2 (±30,94) -6,7 (±6,95)* -33,5 (±35,46)* ScPGA 0 1, % 17,5 46,5* 17,2 40,9* Mittelwert Veränderung NAPSI, % (SD) 6,5 (±60,57) -22,5 (±54,86) -7,1 (±46,64) -29,0 (±67,47)*** NAPSI-50, % 14,9 33,3* 18,7 44,6* Full Analysis Set (FAS), fehlende Daten wurden mittels der Last observation carried forward - (LOCF)-Methode berechnet *p<0,0001 vs. ; **p=0,0042, ***p=0,0052 DLQI=Dermatology Life Quality Index; KOF=Betroffene Körperoberfläche; NAPSI=Nail Psoriasis Severity Index; PASI=Psoriasis Area and Severity Index; ScPGA=Physician s Global Assessment Scalp; SD=Standardabweichung; VAS=Visuelle Analogskala von Verträglichkeit Daten zur Verträglichkeit von wurden in allen Phase-II- und Phase-III-Studien des klinischen Entwicklungsprogramms erhoben (EPAR-Fachbericht 2015). Die Angaben in der Fachinformation beruhen auf den gepoolten Daten der -Arme in den Phase-III-Studien zur Indikation Plaque-Psoriasis (ESTEEM 1, 2) und Psoriasis-Arthritis (PA- LACE 1 4). Dabei wurden bzw Patienten erfasst. Die häufigsten Nebenwirkungen betrafen den Gastrointestinaltrakt und waren Diarrhoe (15,7%) und Übelkeit (13,9%), gefolgt von Infektionen der oberen Atemwege (8,4%), Kopfschmerz (7,9%) und Spannungskopfschmerz (7,2%). Insgesamt wurden die meisten Nebenwirkungen als leicht oder mäßig eingestuft. Die Häufigkeit schwerwiegender Nebenwirkungen war gering, gleichmäßig über die Behandlungsgruppen verteilt, nicht auf ein bestimmtes Organsys tem konzentriert und zeigte keine Zunahme mit der Behandlungsdauer. Das Risiko für Vaskulitis, schwerwiegende kardiovaskuläre Ereignisse oder maligne Erkrankungen war in den - und Wirkstoffgruppen vergleichbar. Da sich in den klinischen Studien kein erhöhtes Risiko für Tuberkulose oder andere schwere Infektionskrankheiten gezeigt hat, wurde ein Hinweis darauf in der Fachinformation als nicht erforderlich erachtet (EPAR-Fachbericht 2015). Abweichungen bei Laborparametern ergaben keinen Hinweis auf die Notwendigkeit einer kontinuierlichen Überwachung. Wenn es als notwendig erachtet wird, können im Einzelfall Laborkontrollen in kürzeren Abständen sinnvoll sein. In Dosen von bis zu 50mg BID führt zu keiner Verlängerung des QT-Intervalls. Gastrointestinale Nebenwirkungen. Hinweise aus Tierversuchen mit Mäusen lassen vermuten, dass die Hemmung der Isoform PDE4D mit Emesis zusammenhängt (Robichaud et al. 2002). hemmt die PDE4-Isoformen gleichmäßig, das wird als Erklärung dafür erachtet, dass ArzneimittelPROFIL Juni
10 ESTEEM 1 und 2: Abb. 7 Lebensqualität und PASI-50 nach 16 Wochen Verringerung DLQI 5 Punkte plus PASI-50 (in Prozent) diese NW überwiegend in mildem bis mäßigem Schweregrad ausfallen (Schafer 2012). In klinischen Studien mit einschleichender Dosierung waren gastrointestinale Nebenwirkungen deutlich seltener aufgetreten (Busa & Kavanaugh 2015). Wenn es zu gastrointestinalen Nebenwirkungen kommt, so vor allem in den ersten beiden Wochen der Behandlung. Bei den meisten Betroffenen klingen sie nach etwa vier Wochen wieder ab (Papp et al. 2015a). Schwere Ausprägungen sind nicht häufiger als unter. Gewichtsverlust. Die Neigung zu Gewichtsverlust ist eine bekannte Begleiterscheinung von PDE4-Hemmern (Tashkin 2014). Dies dürfte aber nicht mit gastrointestinalen Nebenwirkungen in Verbindung stehen, sondern mit einer PDE4-Hemmer-assoziierten Abnahme der Körperfettmasse. Ein Zusammenhang zwischen einer PDE4-Hemmung und verringerter Adipositas wurde in vitro und in vivo nachgewiesen, wobei sich im Mausmodell vor allem das weiße Körperfett verringerte (Zhang et al. 2009). Die Hemmung der PDE4 wurde mit einem erhöhten Efflux von Cholesterin aus Zellen aufgrund der Aktivierung des betreffenden Transportproteins in Verbindung gebracht (Lin & Bornfeldt 2002). In Zusammenschau der Ergebnisse aus klinischen Studien betrug der mittlere Gewichtsverlust bei Patienten nach 52 Wochen unter 1,99kg (Fachinformation 2015). Langzeitergebnisse bei Respondern zu Kopfhaut und Nägeln Tab. 4 Endpunkt 13,4 (n=119) Woche p<0,0001 / 30mg BID (n=226) BID=Bis in Die; DLQI=Dermatology Life Quality Index; PASI-50=Psoriasis Area and Severity Index, 50-prozentige Verbesserung Quelle: Gooderham et al ESTEEM 1 ESTEEM 2 / Initiales Titrationsschema für Tab. 5 Tag Morgens (mg) Abends (mg) Bei 14,3% der Patienten wurde eine Gewichtsabnahme von 5 10% und bei 5,7% der Patienten von >10% des Körpergewichts registriert, wobei keine manifesten klinischen Folgen verzeichnet wurden. Gewichtsverlust als Grund für den Therapieabbruch wurde bei insgesamt 0,1% der mit behandelten Patienten angegeben. Psychische/Psychiatrische Aspekte. Während des placebokontrollierten Abschnitts der klinischen Phase-III-Studien zu Psoriasis berichteten 1,2 % (14/1184) der mit behandelten im Vergleich zu 0,5 % (2/418) der mit behandelten Patienten über Depressionen. Keine dieser Depressionen wurde als schwerwiegend eingestuft oder führte zum Ausscheiden aus der Studie. 7. Dosierung und Verabreichung Die empfohlene Dosis von beträgt 30mg BID, morgens und abends im Abstand von etwa zwölf Stunden eingenommen. Die Einnahme kann unabhängig von den Mahlzeiten erfolgen. Zu Beginn der Behandlung ist die Dosis über sechs Tage zu steigern (Titrationsphase; Tab. 5). 8. Zulassungsstatus wurde im Januar 2015 von der Europäischen Arzneimittelagentur (EMA) für die Behandlung der Psoriasis zugelassen. ist indiziert zur Behandlung der mittelschweren bis schweren chronischen Plaque-Psoriasis bei erwachsenen Patienten, die auf eine andere systemische Therapie wie Cyclosporin oder Methotrexat oder Psoralen in Kombination mit UV- Licht nicht angesprochen haben oder bei denen eine solche Therapie kontraindiziert ist oder die diese nicht vertragen haben. Kopfhaut ScPGA 0 1, % (Crowley et al. 2015) 52 53,5 62,5 Nägel Mittelwert Veränderung NAPSI, % (Rich et al. 2015) 52-64,3-60,2-62,0-59,7 NAPSI=Nail Psoriasis Severity Index; ScPGA=Physician s Global Assessment Scalp 49,1 9. Bewertung und Aussichten hat sich in der Indikation Plaque-Psoriasis in klinischen Studien als sicheres und wirksames Systemtherapeutikum erwiesen. Obwohl im Vergleich zu Biologikatherapien eine geringere Wirksamkeit gemessen an der Reduktion des PASI aufweist, sprechen die orale Therapieform, das bisher günstige Nebenwirkungsprofil, der Wegfall regelmäßiger Laborkontrollen und die Möglichkeit des Einsatzes bei Patienten, die bestimmte Kontraindikationen (milde bis mittelschwere Niereninsuffizienz, eingeschränkte Leberfunktion) gegen andere Systemtherapien haben, für den Einsatz von bei mittelschwerer Plaque- Psoriasis. Die Studiendaten zeigen im Behandlungsarm eine geringe Frequenz von Studienabbrüchen wegen mangelnder Wirksamkeit. In diesem Zusammenhang 10 ArzneimittelPROFIL Juni 2016
11 sind auch Patienten-relevante Endpunkte wie die Abnahme des Juckreizes und eine verbesserte Arbeitsfähigkeit zu sehen. Für den klinischen Einsatz von Bedeutung ist die Wirksamkeit von bei psoriatischer Onychopathie, Kopfhaut-Psoriasis und Psoriasis-Arthritis, klinische Manifestationen der Psoriasis, die gemeinsam auftreten können und in dieser Konstellation für Patienten extrem belastend sind. Postmarketing-Erfahrungen und weitere Langzeitsicherheitsdaten sind notwendig, um die bisherigen Erfahrungen aus klinischen Studien zu bestätigen und zu erweitern. Die AutorInnen Univ.-Prof. Dr. Elisabeth Riedl Abteilung für Allgemeine Dermatologie Universitätsklinik für Dermatologie Medizinische Universität Wien Währinger Gürtel 18-20, 1090 Wien Univ.-Prof. Dr. Michael Wolzt Universitätsklinik für Klinische Pharmakologie AKH und Medizinische Universität Wien Währinger Gürtel 18-20; 1090 Wien ArzneimittelPROFIL Juni
12 10. Abkürzungen ATF-1 Activating Transcription Factor-1 AUC Area Under the Curve BID Bis In Die, zweimal täglich BSA Body Surface Area AMP Adenosinmonophosphat camp Cyclisches Adenosinmonophosphat C max Maximale Plasmakonzentration CREB Response Element-Binding Protein CYP Cytochrome P450 DEFB4 Defensin Beta 4 DLQI Dermatology Life Quality Index egfr Estimated Glomerular Filtration Rate IL Interleukin IFN-γ Interferon-γ KOF Körperoberfläche MCID Minimal Clinically Important Difference NAPSI Nail Psoriasis Severity Index NK-Zellen Natürliche Killer-Zellen PASI Psoriasis Area and Severity Index PBMC Periphere mononukleäre Blutzellen (Peripheral Blood Mononuclear Cells) PDE4 Phosphodiesterase 4 PGA Physician s Global Assessment spga Physician s Global Assessment Static ScPGA Physician s Global Assessment Scalp PKA Proteinkinase A PsA Psoriasis-Arthritis t ½ Terminale Halbwertszeit Th T-Helferzellen t max Zeit bis zur Maximalen Plasmakonzentration TNF-α Tumornekrosefaktor α VAS Visuelle Analogskala 11. Literatur Armstrong AW, Robertson AD, Wu J, et al.: Undertreatment, treatment trends, and treatment dissatisfaction among patients with psoriasis and psoriatic arthritis in the United States: findings from the National Psoriasis Foundation surveys, ; JAMA Dermatol 2013; 149: Armstrong AW, Griffiths CE, Tencer T, et al.: Effect of on Patient-Reported Outcomes in Patients with Moderate to Severe Plaque- Psoriasis in the ESTEEM 1 trial. Poster presented at: 23rd Congress of the European Academy of Dermatology and Venerology 2014; October 8 12; Amsterdam, Netherlands Augustin M, Reich K, Glaeske G, et al.: Co-morbidity and age-related prevalence of psoriasis: Analysis of health insurance data in Germany; Acta Derm Venereol 2010; 90: Busa S & Kavanaugh A: Drug safety evaluation of apremilast for treating psoriatic arthritis; Expert Opin Drug Saf 2015; 14: Crowley J, Cather J, Gooderham M, et al.: in moderate to severe plaque psoriasis: 32-Week results in patients with nail, scalp, and palmoplantar involvement (ESTEEM 2) [poster no. P1687]. Presented at: 23rd Congress of the European Academy of Dermatology and Venerology 2014; October 8 12; Amsterdam, Netherlands Crowley J, Gooderham M, Wasel N, et al.:, an Oral Phosphodiesterase 4 Inhibitor, in Nail, Scalp, and Palmoplantar Psoriasis: 52-Week Results from the ESTEEM 2 Study. Poster presented at: 73rd Annual Meeting of the American Academy of Dermatology (AAD) 2015; March 20 24; San Francisco, CA USA EPAR European Public Assessment Report, European Medicines Agency (EMA) Fachinformation Otezla (), Celgene, Stand: Jänner 2015 Feldman SR, Thaci D, Ling M, et al.:, an Oral Phosphodiesterase 4 Inhibitor, in Patients With Moderate to Severe Plaque Psoriasis: Pruritus and DLQI Correlations at Week 16 (ESTEEM 1 and 2). Poster presented at: 73rd Annual Meeting of the American Academy of Dermatology (AAD) 2015; March 20 24; San Francisco, CA USA Gooderham M, Cather J, Crowley J, et al.: Effects of apremilast on health-related quality of life in patients with moderate to severe plaque psoriasis: 16-Week results from the ESTEEM 2 trial. Poster presented at: 23nd Annual Meeting of the European Academy of Dermatology and Venereology (EADV) 2014; October 8 12; Amsterdam, The Netherlands Gottlieb AB, Strober B, Krueger JG, et al.: An open-label, single-arm pilot study in patients with severe plaque-type psoriasis treated with an oral anti-inflammatory agent, ; Curr Med Res Opin 2008; 24: Gottlieb AB, Matheson RT, Menter A, et al.: Efficacy, tolerability, and pharmacodynamics of apremilast in recalcitrant plaque psoriasis: a phase II open-label study; J Drugs Dermatol 2013; 12: Griffiths CE & Barker JN: Pathogenesis and clinical features of psoriasis; Lancet 2007; 370: Houslay MD, Schafer P & Zhang KY: Keynote review: phosphodiesterase-4 as a therapeutic target; Drug Discov Today 2005; 10: Kavanaugh A, Mease PJ, Gomez-Reino JJ, et al.: Longterm (52-week) results of a phase III randomized, controlled trial of apremilast in patients with psoriatic arthritis; J Rheumatol 2015; 42: Lebwohl MG, Bachelez H, Barker J, et al.: Patient perspectives in the management of psoriasis: results from the population-based Multinational Assessment of Psoriasis and Psoriatic Arthritis Survey; J Am Acad Dermatol 2014; 70: e Lin G & Bornfeldt KE: Cyclic AMP-specific phosphodiesterase 4 inhibitors promote ABCA1 expression and cholesterol efflux; Biochem Biophys Res Commun 2002; 290: ArzneimittelPROFIL Juni 2016
13 Man HW, Schafer P, Wong LM, et al.: Discovery of (S)-N-[2-[1-(3-ethoxy- 4-methoxyphenyl)-2-methanesulfonylethyl]-1,3-dioxo-2,3-dihydro-1Hisoindol-4-yl] acetamide (apremilast), a potent and orally active phosphodiesterase 4 and tumor necrosis factor-alpha inhibitor; J Med Chem 2009; 26; 52: Nestle FO, Kaplan DH & Barker J: Psoriasis; N Engl J Med 2009; 361: Papp K, Cather JC, Rosoph L, et al.: Efficacy of apremilast in the treatment of moderate to severe psoriasis: a randomised controlled trial; Lancet 2012; 380: Papp K, Reich K, Leonardi CL, et al.:, an oral phosphodiesterase 4 (PDE4) inhibitor, in patients with moderate to severe plaque psoriasis: Results of a phase III, randomized, controlled trial (Efficacy and Safety Trial Evaluating the Effects of in Psoriasis [ESTEEM] 1); J Am Acad Dermatol 2015a; 73: Papp K, Zhang F, Tencer T, et al.: The impact of apremilast therapy on work productivity among patients with moderate to severe plaque psoriasis: pooled analysis of 2 phase 3 studies [abstract no. 1151]; J Am Acad Dermatol 2015b; 72(Suppl. 1): AB255 Paul C, Cather J, Gooderham M, et al.: Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in patients with moderate to severe plaque psoriasis over 52 weeks: a phase III, randomized, controlled trial (ESTEEM 2); Br J Dermatol 2015, Sep 10. doi: /bjd [Epub ahead of print] Paul C, Gooderham M, Cather J, et al.:, an Oral Phosphodiesterase 4 Inhibitor, in Patients with Moderate to Severe Psoriasis: Results of a Phase 3, Randomized, Controlled Trial (ESTEEM 2). Oral presented at: 23nd Annual Meeting of the European Academy of Dermatology and Venereology (EADV) 2014a; October 8 12; Amsterdam, The Netherlands Paul C, Crowley J, Cather J, et al.:, an oral phosphodiesterase 4 inhibitor, in patients with moderate to severe psoriasis: 16-week results of a phase 3 randomized, controlled trial (ESTEEM 2). Poster presented at: 72nd Annual Meeting of the American Academy of Dermatology 2014b; March 21 25; Denver, CO, USA Rich P, Gooderham M, Bachelez H, et al.:, an oral phosphodiesterase 4 inhibitor, in patients with difficult-to-treat nail and scalp psoriasis: Results of 2 phase III randomized, controlled trials (ESTEEM 1 and ESTEEM 2); J Am Adac Dermatol 2015; pii: S (15) Robichaud A, Stamatiou PB, Jin SL, et al.: Deletion of phosphodiesterase 4D in mice shortens alpha(2)-adrenoceptor-mediated anesthesia, a behavioral correlate of emesis; J Clin Invest 2002; 110: Schafer P: mechanism of action and application to psoriasis and psoriatic arthritis; Biochem Pharmacol 2012; 83: Schafer PH, Parton A, Capone L, et al.: is a selective PDE4 inhibitor with regulatory effects on innate immunity; Cell Signal 2014; 26: Schafer PH, Parton A, Gandhi AK, et al.:, a camp phosphodiesterase-4 inhibitor, demonstrates anti-inflammatory activity in vitro and in a model of psoriasis; Br J Pharmacol 2010; 159: Schett G, Sloan VS, Stevens RM, et al.: : a novel PDE4 inhibitor in the treatment of autoimmune and inflammatory diseases; Ther Adv Musculoskelet Dis 2010; 2: Tashkin DP: Roflumilast : the new orally active, selective phosphodiesterase-4 inhibitor, for the treatment of COPD; Expert Opin Pharmacother 2014; 15: Yosipovitch G, Papp K, Bagel J, et al.: Effects of on Pruritus in Patients with Moderate to Severe Psoriasis: Results from the ESTEEM 1 and 2 Trials. Poster presented at: 23nd Annual Meeting of the European Academy of Dermatology and Venereology (EADV) 2014; October 8 12; Amsterdam, The Netherlands Zhang R, Maratos-Flier E & Flier JS: Reduced adiposity and high-fat diet-induced adipose inflammation in mice deficient for phosphodiesterase 4B; Endocrinology 2009; 150: ArzneimittelPROFIL Juni
Dossierbewertung A15-20 Version 1.0 Secukinumab Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Secukinumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
PRESSEMITTEILUNG. Patientenindividuelle Psoriasis-Therapie mit Apremilast (OTEZLA)
 Celgene GmbH Joseph-Wild-Straße 20 81829 München Telefon: (089) 451519-010 info@celgene.de www.celgene.de PRESSEMITTEILUNG Thema auf der Münchner Fortbildungswoche 2016: 18 Monate Praxiserfahrung mit Apremilast
Celgene GmbH Joseph-Wild-Straße 20 81829 München Telefon: (089) 451519-010 info@celgene.de www.celgene.de PRESSEMITTEILUNG Thema auf der Münchner Fortbildungswoche 2016: 18 Monate Praxiserfahrung mit Apremilast
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union
 Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union Haar (23. Juli 2008) JANUMET (Sitagliptin/Metformin, MSD) hat von der Europäischen Kommission die
Zulassung für JANUMET (Sitagliptin/Metformin) zur Behandlung des Typ-2-Diabetes in der Europäischen Union Haar (23. Juli 2008) JANUMET (Sitagliptin/Metformin, MSD) hat von der Europäischen Kommission die
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen
 Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Humanes-GLP-1 Analogon Liraglutid ist DPP-IV Inhibitor Sitagliptin signifikant überlegen
 Blutzuckerkontrolle Humanes-GLP-1 Analogon Liraglutid ist DPP-IV Inhibitor Sitagliptin signifikant überlegen Mainz (27. April 2010) Die erste direkte Vergleichsstudie eines GLP-1-Analogons mit einem DPP-IV-Inhibitor
Blutzuckerkontrolle Humanes-GLP-1 Analogon Liraglutid ist DPP-IV Inhibitor Sitagliptin signifikant überlegen Mainz (27. April 2010) Die erste direkte Vergleichsstudie eines GLP-1-Analogons mit einem DPP-IV-Inhibitor
Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC
 SATURN-Studie: Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC Grenzach-Wyhlen (13. August 2009) - Aktuelle Daten der SATURN-Studie bestätigen eine signifikante
SATURN-Studie: Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC Grenzach-Wyhlen (13. August 2009) - Aktuelle Daten der SATURN-Studie bestätigen eine signifikante
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Langzeit-Sicherheitsdaten für oral verabreichtes Apremilast bei Plaque- Psoriasis und Psoriasis-Arthritis auf dem EADV-Kongress vorgestellt
 Langzeit-Sicherheitsdaten für oral verabreichtes Apremilast bei Plaque- Psoriasis und Psoriasis-Arthritis auf dem EADV-Kongress vorgestellt Gepoolte 3-Jahres-Daten der Studien ESTEEM-1 und -2 sowie PALACE-1
Langzeit-Sicherheitsdaten für oral verabreichtes Apremilast bei Plaque- Psoriasis und Psoriasis-Arthritis auf dem EADV-Kongress vorgestellt Gepoolte 3-Jahres-Daten der Studien ESTEEM-1 und -2 sowie PALACE-1
Individuelle Bedürfnisse erkennen und behandeln
 Daten aus der Praxis zeigen Vorteile einer Therapie mit Apremilast (OTEZLA ) für Patienten mit chronischer Plaque-Psoriasis, die über Hautverbesserungen hinausgehen Eine Zwischenanalyse von APPRECIATE
Daten aus der Praxis zeigen Vorteile einer Therapie mit Apremilast (OTEZLA ) für Patienten mit chronischer Plaque-Psoriasis, die über Hautverbesserungen hinausgehen Eine Zwischenanalyse von APPRECIATE
Stelara ist ein Arzneimittel, das zur Behandlung der folgenden Erkrankungen angewendet wird:
 EMA/636854/2016 EMEA/H/C/000958 Zusammenfassung des EPAR für die Öffentlichkeit Ustekinumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/636854/2016 EMEA/H/C/000958 Zusammenfassung des EPAR für die Öffentlichkeit Ustekinumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Secukinumab (Plaque-Psoriasis)
 IQWiG-Berichte Nr. 529 Secukinumab (Plaque-Psoriasis) Addendum zum Auftrag A17-08 Addendum Auftrag: A17-31 Version: 1.0 Stand: 28.07.2017 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
IQWiG-Berichte Nr. 529 Secukinumab (Plaque-Psoriasis) Addendum zum Auftrag A17-08 Addendum Auftrag: A17-31 Version: 1.0 Stand: 28.07.2017 Impressum Herausgeber: Institut für Qualität und Wirtschaftlichkeit
DGRh Etanercept bei Ankylosierender Spondylitis: Sicher und wirksam in der klinischen Routineversorgung
 DGRh 2008 - Etanercept bei Ankylosierender Spondylitis: Sicher und wirksam in der klinischen Routineversorgung Berlin (26. September 2008) Patienten mit Ankylosierender Spondylitis (AS) profitieren auch
DGRh 2008 - Etanercept bei Ankylosierender Spondylitis: Sicher und wirksam in der klinischen Routineversorgung Berlin (26. September 2008) Patienten mit Ankylosierender Spondylitis (AS) profitieren auch
ERGEBNISSE Dusch-PUVA vs. Berliner Schema Patientenkollektive
 - 51 Bedingungen (Trennsäule, Zusammensetzung und Fließgeschwindigkeit der mobilen Phase, Probengröße, Temperatur) gleich groß. Zur qualitativen Identifizierung eines Peaks wurden die Reinsubstanzen injiziert
- 51 Bedingungen (Trennsäule, Zusammensetzung und Fließgeschwindigkeit der mobilen Phase, Probengröße, Temperatur) gleich groß. Zur qualitativen Identifizierung eines Peaks wurden die Reinsubstanzen injiziert
Methotrexat in der Therapie des Morbus Crohn wirksam, sicher, günstig
 Medac-Symposium auf dem DGVS-Kongress 2015 in Leipzig zur MTX-Therapie bei Morbus Crohn(1) Methotrexat in der Therapie des Morbus Crohn wirksam, sicher, günstig Leipzig / Wedel (17. September 2015) - Die
Medac-Symposium auf dem DGVS-Kongress 2015 in Leipzig zur MTX-Therapie bei Morbus Crohn(1) Methotrexat in der Therapie des Morbus Crohn wirksam, sicher, günstig Leipzig / Wedel (17. September 2015) - Die
Befristete Aufnahme in die Spezialitätenliste (SL) per 1. August 2018
 Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Kranken- und Unfallversicherung (20752) TREMFYA, Janssen-Cilag AG Befristete Aufnahme in die Spezialitätenliste
Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Kranken- und Unfallversicherung (20752) TREMFYA, Janssen-Cilag AG Befristete Aufnahme in die Spezialitätenliste
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneitel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Ixekizumab
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneitel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Ixekizumab
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneitel-Richtlinie (AM- RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Brodalumab
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneitel-Richtlinie (AM- RL): Anlage XII Beschlüsse über die utzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Brodalumab
Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome
 Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome Basisinformation FACHINFORMATION Lang wirksame Beta-Mimetika - Long Acting Beta Agonists
Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome Basisinformation FACHINFORMATION Lang wirksame Beta-Mimetika - Long Acting Beta Agonists
Psoriasis vulgaris Dermatologische Sicht
 Psoriasis vulgaris Dermatologische Sicht Dr. med. Marguerite Krasovec A. Rahmann FMH Dermatologie und Venerologie Schlieren Zurich Derma Limmattal (Swiss) AG. DD Psoriasis Chronisch-entzündliche systemische
Psoriasis vulgaris Dermatologische Sicht Dr. med. Marguerite Krasovec A. Rahmann FMH Dermatologie und Venerologie Schlieren Zurich Derma Limmattal (Swiss) AG. DD Psoriasis Chronisch-entzündliche systemische
Pasireotid Beschluss vom: 6. Dezember 2012 gültig bis: unbefristet In Kraft getreten am: 6. Dezember 2012 BAnz AT B3
 Beschluss vom: 6. Dezember 01 gültig bis: unbefristet In Kraft getreten am: 6. Dezember 01 BAnz AT 1.01.013 B3 Zugelassenenes Anwendungsgebiet Signifor ist indiziert für die Behandlung von erwachsenen
Beschluss vom: 6. Dezember 01 gültig bis: unbefristet In Kraft getreten am: 6. Dezember 01 BAnz AT 1.01.013 B3 Zugelassenenes Anwendungsgebiet Signifor ist indiziert für die Behandlung von erwachsenen
Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie
 Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose
 Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose Darmstadt (30. September 2009) - Die Merck KGaA hat heute bekannt gegeben, dass
Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose Darmstadt (30. September 2009) - Die Merck KGaA hat heute bekannt gegeben, dass
Bedeutung von Roflumilast (Daxas ) bei Patienten mit fortgeschrittener COPD (Schweregrad III/IV) bestätigt
 Bedeutung von Roflumilast (Daxas ) bei Patienten mit fortgeschrittener COPD (Schweregrad III/IV) bestät Kongress der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin Bedeutung von Roflumilast
Bedeutung von Roflumilast (Daxas ) bei Patienten mit fortgeschrittener COPD (Schweregrad III/IV) bestät Kongress der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin Bedeutung von Roflumilast
Haut und Rheuma. Nikhil Yawalkar. Universitätsklinik für Dermatologie, Inselspital, Bern
 Haut und Rheuma Nikhil Yawalkar Universitätsklinik für Dermatologie, Inselspital, Bern Breites Spektrum verschiedener Erscheinungsbilder Einteilung der Hautmanifestationen beim LE - Akuter kutaner LE (ACLE
Haut und Rheuma Nikhil Yawalkar Universitätsklinik für Dermatologie, Inselspital, Bern Breites Spektrum verschiedener Erscheinungsbilder Einteilung der Hautmanifestationen beim LE - Akuter kutaner LE (ACLE
fortgeschrittenem Lungenemphysem
 PneumRx Coils: Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Pa PneumRx Coils Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Patienten
PneumRx Coils: Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Pa PneumRx Coils Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Patienten
Beschluss vom: 19. Februar 2015 gültig bis: unbefristet In Kraft getreten am: 19. Februar 2015 BAnz AT B3
 Teduglutid Beschluss vom: 19. Februar 215 gültig bis: unbefristet In Kraft getreten am: 19. Februar 215 BAnz AT 16.3.215 B3 Zugelassenes Anwendungsgebiet: Teduglutid (Revestive ) ist angezeigt zur Behandlung
Teduglutid Beschluss vom: 19. Februar 215 gültig bis: unbefristet In Kraft getreten am: 19. Februar 215 BAnz AT 16.3.215 B3 Zugelassenes Anwendungsgebiet: Teduglutid (Revestive ) ist angezeigt zur Behandlung
EINLADUNG zur Fortbildung Stelara bei Morbus Crohn
 EINLADUNG zur Fortbildung Stelara bei Morbus Crohn Dienstag, 3. Oktober 2017 Datum: Dienstag, 03.10.2017 Ort: Cityhotel Design & Classic Völklplatz 1 3100 St. Pölten www.cityhotel-dc.at Wir freuen uns
EINLADUNG zur Fortbildung Stelara bei Morbus Crohn Dienstag, 3. Oktober 2017 Datum: Dienstag, 03.10.2017 Ort: Cityhotel Design & Classic Völklplatz 1 3100 St. Pölten www.cityhotel-dc.at Wir freuen uns
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 Celgene ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS! Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
Celgene ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS! Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
Chicago News: Aktuelles vom ACR 2011: B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß
 Chicago News: Aktuelles vom ACR 2011 B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß Frankfurt am Main (22. November 2011) - Auf dem diesjährigen ACR-Kongress untermauerten gleich drei Studien
Chicago News: Aktuelles vom ACR 2011 B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß Frankfurt am Main (22. November 2011) - Auf dem diesjährigen ACR-Kongress untermauerten gleich drei Studien
Dossierbewertung A16-24 Version 1.0 Nivolumab (Nierenzellkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis eines
Beschluss vom: 6. August 2015 gültig bis: unbefristet In Kraft getreten am: 6. August 2015 BAnz AT B2
 Apremilast Beschluss vom: 6. August 2015 gültig bis: unbefristet In Kraft getreten am: 6. August 2015 BAnz AT 12.10.2015 B2 Zugelassenes Anwendungsgebiet: Psoriasis-Arthritis Otezla allein oder in Kombination
Apremilast Beschluss vom: 6. August 2015 gültig bis: unbefristet In Kraft getreten am: 6. August 2015 BAnz AT 12.10.2015 B2 Zugelassenes Anwendungsgebiet: Psoriasis-Arthritis Otezla allein oder in Kombination
Otezla Filmtabletten Stand:
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
PHYTO-EXTRAKT. Aktuelles für Sie und Ihre Patienten
 Liebe Leserin, lieber Leser, PHYTO-EXTRAKT Aktuelles für Sie und Ihre Patienten Sie besuchen gerne Museen und freuen sich über humorvolle, neue Aspekte? Dann empfehle ich Ihnen eine ganz besondere Ausstellung:
Liebe Leserin, lieber Leser, PHYTO-EXTRAKT Aktuelles für Sie und Ihre Patienten Sie besuchen gerne Museen und freuen sich über humorvolle, neue Aspekte? Dann empfehle ich Ihnen eine ganz besondere Ausstellung:
Dossierbewertung A14-23 Nutzenbewertung gemäß 35a SGB V Version 1.0 Vedolizumab Colitis ulcerosa
 I 2 Nutzenbewertung I 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Vedolizumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
I 2 Nutzenbewertung I 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Vedolizumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
Statistische Auswertung einer Anwendungsbeobachtung mit der Präparateserie ALBICANSAN
 Statistische Auswertung einer Anwendungsbeobachtung mit der Präparateserie ALBICANSAN in den Darreichungsformen Kapseln, Tropfen, Zäpfchen und Injektionslösung von Dr. Reiner Heidl 1. Einleitung In einer
Statistische Auswertung einer Anwendungsbeobachtung mit der Präparateserie ALBICANSAN in den Darreichungsformen Kapseln, Tropfen, Zäpfchen und Injektionslösung von Dr. Reiner Heidl 1. Einleitung In einer
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
Dacogen zur Therapie der Akuten Myeloischen Leukämie
 Epigenetische Behandlungsoption Dacogen zur Therapie der Akuten Myeloischen Leukämie München (20. Februar 2017) - Der epigenetisch wirkende DNA-Methyltransferase-Inhibitor Decitabin (Dacogen ) stellt seit
Epigenetische Behandlungsoption Dacogen zur Therapie der Akuten Myeloischen Leukämie München (20. Februar 2017) - Der epigenetisch wirkende DNA-Methyltransferase-Inhibitor Decitabin (Dacogen ) stellt seit
Projekte: Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
 Statistische Re-Auswertungen für eine Publikation zu einem Diagnosescreeningfragebogen bei axialen Spondylarthritiden und Fallzahlschätzung für eine Validierung selektierter Fragen des Screeningfragebogens
Statistische Re-Auswertungen für eine Publikation zu einem Diagnosescreeningfragebogen bei axialen Spondylarthritiden und Fallzahlschätzung für eine Validierung selektierter Fragen des Screeningfragebogens
kolorektalen Karzinoms
 Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
Integrase-Hemmung mit ISENTRESS : Eine neue Klasse antiretroviraler Wirkstoffe zur Behandlung von HIV
 Integrase-Hemmung mit ISENTRESS : Eine neue Klasse antiretroviraler Wirkstoffe zur Behandlung von HIV Von Dr. med. Markus Rupp, MSD SHARP & DOHME GMBH, Haar München (20. September 2008) Der World-Aids-Report
Integrase-Hemmung mit ISENTRESS : Eine neue Klasse antiretroviraler Wirkstoffe zur Behandlung von HIV Von Dr. med. Markus Rupp, MSD SHARP & DOHME GMBH, Haar München (20. September 2008) Der World-Aids-Report
Beschluss vom: 1. Dezember 2016 gültig bis: unbefristet In Kraft getreten am: 1. Dezember 2016 BAnz AT B2
 Eribulin (neues Anwendungsgebiet: Liposarkom) Beschluss vom:. Dezember 206 gültig bis: unbefristet In Kraft getreten am:. Dezember 206 BAnz AT 27.2.206 B2 Zugelassenes Anwendungsgebiet (laut Zulassung
Eribulin (neues Anwendungsgebiet: Liposarkom) Beschluss vom:. Dezember 206 gültig bis: unbefristet In Kraft getreten am:. Dezember 206 BAnz AT 27.2.206 B2 Zugelassenes Anwendungsgebiet (laut Zulassung
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Pitolisant wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von n mit neuen Wirkstoffen nach 35a SGB V Vom 19. Januar 2017 Der
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der -Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von n mit neuen Wirkstoffen nach 35a SGB V Vom 19. Januar 2017 Der
Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen
 EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
EU-Zulassungserweiterung für Adalimumab (Humira ) Humira jetzt bei polyartikulärer juveniler idiopathischer Arthritis für Kinder ab vier Jahren zugelassen Wiesbaden/Ludwigshafen (1. Juli 2011) Die Europäische
KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM
 KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM 11.11.02 RANDOMISIERTE, OFFENE, NICHT-KOMPARATIVE PHASE II STUDIE ZUR BEURTEILUNG DER WIRKSAMKEIT UND VERTRÄGLICHKEIT VON ZWEI DOSIERUNGEN ZD1839 BEI PATIENTEN
KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM 11.11.02 RANDOMISIERTE, OFFENE, NICHT-KOMPARATIVE PHASE II STUDIE ZUR BEURTEILUNG DER WIRKSAMKEIT UND VERTRÄGLICHKEIT VON ZWEI DOSIERUNGEN ZD1839 BEI PATIENTEN
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom
 Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Gute Überlebensqualität Trastuzumab beim metastasierten Magenkarzinom München (24. April 2012) - Mit dem monoklonalen Antikörper Trastuzumab (Herceptin ) steht bislang die einzige zielgerichtete Substanz
Schlaganfall: im Zweifelsfall für die Lyse-Therapie entscheiden
 Deutsche Schlaganfall-Gesellschaft (DSG) und Deutsche Gesellschaft für Neurologie (DGN) Schlaganfall: im Zweifelsfall für die Lyse-Therapie entscheiden Berlin (17. Juli 2012) Deutlich mehr Schlaganfall-Patienten
Deutsche Schlaganfall-Gesellschaft (DSG) und Deutsche Gesellschaft für Neurologie (DGN) Schlaganfall: im Zweifelsfall für die Lyse-Therapie entscheiden Berlin (17. Juli 2012) Deutlich mehr Schlaganfall-Patienten
Dossierbewertung A15-31 Version 1.0 Tiotropium/Olodaterol Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Tiotropium/ Olodaterol gemäß 35a SGB V beauftragt. Die Bewertung
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der Wirkstoffkombination Tiotropium/ Olodaterol gemäß 35a SGB V beauftragt. Die Bewertung
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Fidaxomicin Beschluss vom: 4. Juli 2013 gültig bis: unbefristet In Kraft getreten am: 4. Juli 2013 BAnz AT 02.08.2013 B7 Zugelassenes Anwendungsgebiet1 (Stand Januar 2013): DIFICLIR ist indiziert bei Erwachsenen
Fidaxomicin Beschluss vom: 4. Juli 2013 gültig bis: unbefristet In Kraft getreten am: 4. Juli 2013 BAnz AT 02.08.2013 B7 Zugelassenes Anwendungsgebiet1 (Stand Januar 2013): DIFICLIR ist indiziert bei Erwachsenen
Dossierbewertung A18-16 Version 1.0 Insulin glargin/lixisenatid (Diabetes mellitus Typ 2)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der fixen Kombination aus Insulin glargin und Lixisenatid (Insulin glargin/lixisenatid)
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung der fixen Kombination aus Insulin glargin und Lixisenatid (Insulin glargin/lixisenatid)
Salicylsäure überlegen
 Keratolyse bei Psoriasis und anderen schuppigen Hauterkrankungen Neue Studie: Physikalisches Wirkprinzip ist Salicylsäure überlegen Berlin (17. März 2015) - Es wirkt genauso effektiv, aber schneller. Es
Keratolyse bei Psoriasis und anderen schuppigen Hauterkrankungen Neue Studie: Physikalisches Wirkprinzip ist Salicylsäure überlegen Berlin (17. März 2015) - Es wirkt genauso effektiv, aber schneller. Es
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom
 Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Warum ist der Einsatz von Ixekizumab sinnvoll in der Behandlung der Psoriasis-Arthritis?
 Mannheim, 20.09.2018 PP-IX-DE-0706 46. Kongress der DGRh Warum ist der Einsatz von Ixekizumab sinnvoll in der Behandlung der Psoriasis-Arthritis? Prof. Dr. Andreas Krause Immanuel Krankenhaus Berlin Klinik
Mannheim, 20.09.2018 PP-IX-DE-0706 46. Kongress der DGRh Warum ist der Einsatz von Ixekizumab sinnvoll in der Behandlung der Psoriasis-Arthritis? Prof. Dr. Andreas Krause Immanuel Krankenhaus Berlin Klinik
Krankenpflege-Journal.com. Schmerzlinderung mit Instanyl nach nur fünf Minuten
 Fentanyl-Nasenspray gegen Durchbruchschmerz ab sofort verfügbar: Schmerzlinderung mit Instanyl nach nur fünf Minuten Frankfurt am Main (9. September 2009) Bis zu 80 Prozent aller Tumorpatienten leiden
Fentanyl-Nasenspray gegen Durchbruchschmerz ab sofort verfügbar: Schmerzlinderung mit Instanyl nach nur fünf Minuten Frankfurt am Main (9. September 2009) Bis zu 80 Prozent aller Tumorpatienten leiden
Versorgung der Psoriasis in Deutschland Neue Daten und Erkenntnisse
 Versorgung der Psoriasis in Deutschland Neue Daten und Erkenntnisse Prof. Dr. med. Ulrich Mrowietz Psoriasis-Zentrum Abt. Dermatologie Universitätsklinikum Schleswig-Holstein Campus Kiel Versorgung der
Versorgung der Psoriasis in Deutschland Neue Daten und Erkenntnisse Prof. Dr. med. Ulrich Mrowietz Psoriasis-Zentrum Abt. Dermatologie Universitätsklinikum Schleswig-Holstein Campus Kiel Versorgung der
Valdoxan (Agomelatin)
 Valdoxan (Agomelatin) Zur Behandlung von Episoden einer Major Depression bei Erwachsenen Informationen für Ärzte Empfehlungen zu: Überprüfung der Leberfunktion (Transaminasenkontrollen) Interaktion mit
Valdoxan (Agomelatin) Zur Behandlung von Episoden einer Major Depression bei Erwachsenen Informationen für Ärzte Empfehlungen zu: Überprüfung der Leberfunktion (Transaminasenkontrollen) Interaktion mit
des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL) Anlage IV: Therapiehinweis Omalizumab
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL) Anlage IV: Therapiehinweis Omalizumab Vom 17. Dezember 2015 Der Gemeinsame Bundesausschuss (G-BA) hat
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL) Anlage IV: Therapiehinweis Omalizumab Vom 17. Dezember 2015 Der Gemeinsame Bundesausschuss (G-BA) hat
Chronisch entzündliche Darmerkrankungen
 Innere Medizin I - Gastroenterologie, Hepatologie, Infektionskrankheiten Chronisch entzündliche Darmerkrankungen Dr. med. Thomas Klag Arbeitsgruppe Univ. Prof. Dr. med. Jan Wehkamp Universitätsklinikum
Innere Medizin I - Gastroenterologie, Hepatologie, Infektionskrankheiten Chronisch entzündliche Darmerkrankungen Dr. med. Thomas Klag Arbeitsgruppe Univ. Prof. Dr. med. Jan Wehkamp Universitätsklinikum
Dossierbewertung A17-18 Version 1.0 Tofacitinib (Rheumatoide Arthritis)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Tofacitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Tofacitinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
Dossierbewertung A15-60 Version 1.0 Sacubitril/Valsartan Nutzenbewertung gemäß 35a SGB V
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Sacubitril/Valsartan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Sacubitril/Valsartan gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die utzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
 Refraktäres indolentes Non-Hodgkin-Lymphom: Gazyvaro erzielt deutlich längeres progressionsfreies Üb Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
Refraktäres indolentes Non-Hodgkin-Lymphom: Gazyvaro erzielt deutlich längeres progressionsfreies Üb Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
Funktion: Name: Datum: Unterschrift: D. Bornand
 Spital-Pharmazie Seite: 1 von 5 : 18.09.2014 Autorisierte Kopie Nr.: 03 Bo 18.09.2014 Dokumentennummer: Vergleichstabelle: Prüfung und Genehmigung Funktion: Name: Datum: Unterschrift: Autor Leiter Klinikbetreuung
Spital-Pharmazie Seite: 1 von 5 : 18.09.2014 Autorisierte Kopie Nr.: 03 Bo 18.09.2014 Dokumentennummer: Vergleichstabelle: Prüfung und Genehmigung Funktion: Name: Datum: Unterschrift: Autor Leiter Klinikbetreuung
Valdoxan (Agomelatin)
 Valdoxan (Agomelatin) Zur Behandlung von Episoden einer Major Depression bei Erwachsenen Informationen für Ärzte Empfehlungen zu: berprüfung der Leberfunktion Ü (Transaminasenkontrollen) Interaktion mit
Valdoxan (Agomelatin) Zur Behandlung von Episoden einer Major Depression bei Erwachsenen Informationen für Ärzte Empfehlungen zu: berprüfung der Leberfunktion Ü (Transaminasenkontrollen) Interaktion mit
Patienteninformation zur Behandlung der Psoriasis mit Fumarsäureester
 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Fumarsäureester Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Fumarsäureester Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit
Warum war die Studie notwendig?
 Eine Studie, in der untersucht wurde, ob BI 409306 die geistigen Fähigkeiten von Menschen mit milder Alzheimer-Krankheit und Problemen bei der geistigen Funktionsfähigkeit verbessert Nachfolgender Text
Eine Studie, in der untersucht wurde, ob BI 409306 die geistigen Fähigkeiten von Menschen mit milder Alzheimer-Krankheit und Problemen bei der geistigen Funktionsfähigkeit verbessert Nachfolgender Text
PsoriaSol 247 Badezusatz dient der pflegenden Unterstützung von Hautarzt-Therapien und hat keine heilende Wirkung. Zur Regeneration der Haut
 PsoriaSol 247 Badezusatz dient der pflegenden Unterstützung von Hautarzt-Therapien und hat keine heilende Wirkung. Zur Regeneration der Haut z. Das Krankheitsbild der Psoriasis Die Psoriasis ist eine systemische
PsoriaSol 247 Badezusatz dient der pflegenden Unterstützung von Hautarzt-Therapien und hat keine heilende Wirkung. Zur Regeneration der Haut z. Das Krankheitsbild der Psoriasis Die Psoriasis ist eine systemische
Chronisch myeloische Leukämie Erstlinentherapien (TKI+ PegIFN) Neuer Wirkmechanismus Update TKI-STOP
 Höhepunkte des Amerikanischen Hämatologie-Kongresses Orlando, 2015 Dr. Sebastian Saur, Med. Klinik II, Universitätsklinik Tübingen Chronisch myeloische Leukämie Erstlinentherapien (TKI+ PegIFN) Neuer Wirkmechanismus
Höhepunkte des Amerikanischen Hämatologie-Kongresses Orlando, 2015 Dr. Sebastian Saur, Med. Klinik II, Universitätsklinik Tübingen Chronisch myeloische Leukämie Erstlinentherapien (TKI+ PegIFN) Neuer Wirkmechanismus
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration
 Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine der Arzneitel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Ixekizumab (neues
Beschluss des Gemeinsamen Bundesausschusses über eine der Arzneitel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneiteln neuen Wirkstoffen nach 35a SGB V Ixekizumab (neues
Warum war die Studie notwendig?
 Eine Studie, in der untersucht wurde, ob BI 409306 die geistigen Fähigkeiten von Menschen mit Alzheimer-Krankheit im Frühstadium verbessert Nachfolgender Text ist die Zusammenfassung einer klinischen Studie
Eine Studie, in der untersucht wurde, ob BI 409306 die geistigen Fähigkeiten von Menschen mit Alzheimer-Krankheit im Frühstadium verbessert Nachfolgender Text ist die Zusammenfassung einer klinischen Studie
PHYTO-EXTRAKT. Aktuelles für Sie und Ihre Patienten
 Ausgabe 13 20.05.2014 Liebe Leserin, lieber Leser, PHYTO-EXTRAKT Aktuelles für Sie und Ihre Patienten mögen Sie auch die Klänge des Rock- und Blues-Altmeisters Joe Cocker? Dieser wird heute 70 Jahre alt.
Ausgabe 13 20.05.2014 Liebe Leserin, lieber Leser, PHYTO-EXTRAKT Aktuelles für Sie und Ihre Patienten mögen Sie auch die Klänge des Rock- und Blues-Altmeisters Joe Cocker? Dieser wird heute 70 Jahre alt.
Europäische Kommission erteilt Zulassung für neue intravenöse Formulierung von Revatio (Sildenafil) d
 Europäische Kommission erteilt Zulassung für neue intravenöse Formulierung von Revatio (Sildenafil) der Firma Pfizer zur Behandlung der pulmonal-arteriellen Hypertonie (PAH) - Revatio ist die einzige PAH-Behandlung
Europäische Kommission erteilt Zulassung für neue intravenöse Formulierung von Revatio (Sildenafil) der Firma Pfizer zur Behandlung der pulmonal-arteriellen Hypertonie (PAH) - Revatio ist die einzige PAH-Behandlung
Die erste und einzige zugelassene orale Therapie gegen Ejaculatio praecox.
 Die erste und einzige zugelassene orale Therapie gegen Ejaculatio praecox. Priligy auf einen Blick: als einzige orale Therapie zur Behandlung von Ejaculatio praecox zugelassen verlängert die Zeit bis zum
Die erste und einzige zugelassene orale Therapie gegen Ejaculatio praecox. Priligy auf einen Blick: als einzige orale Therapie zur Behandlung von Ejaculatio praecox zugelassen verlängert die Zeit bis zum
Bluthochdruck stark und verträglich senken
 Azilsartan bei essenzieller Hypertonie Bluthochdruck stark und verträglich senken München (16. Mai 2012) Die Behandlung der Hypertonie, des weltweit stärksten Risikofaktors für Mortalität, hat mit dem
Azilsartan bei essenzieller Hypertonie Bluthochdruck stark und verträglich senken München (16. Mai 2012) Die Behandlung der Hypertonie, des weltweit stärksten Risikofaktors für Mortalität, hat mit dem
Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab
 Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Ustekinumab
Praxis Dr. Ralph von Kiedrowski Patienteninformation zur Behandlung der Psoriasis mit Ustekinumab Liebe Patientin, lieber Patient, dieses Informationsblatt soll Ihnen die vorgesehene Behandlung mit Ustekinumab
KHK mit Angina pectoris: Ivabradin reduziert kardiale Ereignisse
 Neue Ergebnisse aus der BEAUTIfUL-Studie KHK mit Angina pectoris: Ivabradin reduziert kardiale Ereignisse Barcelona, Spanien, 31. August 2009 Aktuelle Daten einer auf dem Kongress der European Society
Neue Ergebnisse aus der BEAUTIfUL-Studie KHK mit Angina pectoris: Ivabradin reduziert kardiale Ereignisse Barcelona, Spanien, 31. August 2009 Aktuelle Daten einer auf dem Kongress der European Society
Projekte: Erkrankungen der Haut und des Unterhautzellgewebes
 Monitoring services for one country for a multi-country registry in chronic urticaria Preparation of a CRF for a registry in chronic urticaria Development of a Clinical Study Protocol, Master PIC and CRF
Monitoring services for one country for a multi-country registry in chronic urticaria Preparation of a CRF for a registry in chronic urticaria Development of a Clinical Study Protocol, Master PIC and CRF
Plantabetics Eine ergänzende bilanzierte Diät für Diabetiker als Begleittherapie zur Diabetesbehandlung bei Diabetes Typ 2
 Das diesem Bericht zugrunde liegende Vorhaben wurde mit Mitteln des Ministeriums für Wirtschaft und Europaangelegenheiten des Landes Brandenburg und der EU gefördert. Die Verantwortung für den Inhalt der
Das diesem Bericht zugrunde liegende Vorhaben wurde mit Mitteln des Ministeriums für Wirtschaft und Europaangelegenheiten des Landes Brandenburg und der EU gefördert. Die Verantwortung für den Inhalt der
PHYTO-EXTRAKT. Aktuelles für Sie und Ihre Patienten
 Liebe Leserin, lieber Leser, PHYTO-EXTRAKT Aktuelles für Sie und Ihre Patienten heute stellen wir Ihnen Studiendaten vor, die anlässlich des DGPPN*- Kongresses der Fachöffentlichkeit Ende November in Berlin
Liebe Leserin, lieber Leser, PHYTO-EXTRAKT Aktuelles für Sie und Ihre Patienten heute stellen wir Ihnen Studiendaten vor, die anlässlich des DGPPN*- Kongresses der Fachöffentlichkeit Ende November in Berlin
Asenapin: unabhängig von der Depressionsschwere bei mixed specifier wirksam?
 Neue Daten vom APA 2013 Asenapin: unabhängig von der Depressionsschwere bei mixed specifier wirksam? San Francisco, Cal., USA (27. Juni 2013) - Die Vorstellung der fünften Ausgabe des Diagnostic and Statistical
Neue Daten vom APA 2013 Asenapin: unabhängig von der Depressionsschwere bei mixed specifier wirksam? San Francisco, Cal., USA (27. Juni 2013) - Die Vorstellung der fünften Ausgabe des Diagnostic and Statistical
TNF-α-Inhibitoren zeigen Unterschiede in der Immunogenität
 Eine Klasse für sich TNF-α-Inhibitoren zeigen Unterschiede in der Immunogenität Berlin (26. April 2012) - Die Wirksamkeit und Sicherheit der TNF-α-Inhibitoren in der Behandlung der Rheumatoiden Arthritis
Eine Klasse für sich TNF-α-Inhibitoren zeigen Unterschiede in der Immunogenität Berlin (26. April 2012) - Die Wirksamkeit und Sicherheit der TNF-α-Inhibitoren in der Behandlung der Rheumatoiden Arthritis
JC, 14. Mai 2018 Marcel Stöckle. Katherine Plewes et al. Clinical Infectious Diseases Published: 12 March 2018 https://doi.org/10.
 Acetaminophen as a renoprotective adjunctive treatment in patients with severe and moderately severe falciparum malaria: a randomized, controlled, open-label trial Katherine Plewes et al. Clinical Infectious
Acetaminophen as a renoprotective adjunctive treatment in patients with severe and moderately severe falciparum malaria: a randomized, controlled, open-label trial Katherine Plewes et al. Clinical Infectious
Gastrohighlights 2016: Chronisch entzündliche Darmerkrankungen
 29. Oktober 2016, Wien Gastrohighlights 2016: Chronisch entzündliche Darmerkrankungen Gerhard Rogler, Klinik für Gastroenterologie und Hepatologie, UniversitätsSpital Zürich Neues zur Therapie Morbus Crohn
29. Oktober 2016, Wien Gastrohighlights 2016: Chronisch entzündliche Darmerkrankungen Gerhard Rogler, Klinik für Gastroenterologie und Hepatologie, UniversitätsSpital Zürich Neues zur Therapie Morbus Crohn
Neues zur Methotrexat-Intoleranz
 Neues zur Methotrexat-Intoleranz Andrea Scheuern 17.01.2015 40. Garmisch-Partenkirchner Symposium für Kinder- und Jugendrheumatologie Hintergrund Methotrexat-Intoleranz MTX-Intoleranz: - ausgeprägtes Ekelgefühl
Neues zur Methotrexat-Intoleranz Andrea Scheuern 17.01.2015 40. Garmisch-Partenkirchner Symposium für Kinder- und Jugendrheumatologie Hintergrund Methotrexat-Intoleranz MTX-Intoleranz: - ausgeprägtes Ekelgefühl
Johanniskraut Metaanalyse 2005
 Johanniskraut Metaanalyse 2005 Seit 1983 wurden 37 randomisierte klinische Studien mit Johanniskraut-Präparaten publiziert Davon: 26 Placebo-kontrolliert, 14 Verum-kontrolliert Studiendauer: 4 Wochen (10
Johanniskraut Metaanalyse 2005 Seit 1983 wurden 37 randomisierte klinische Studien mit Johanniskraut-Präparaten publiziert Davon: 26 Placebo-kontrolliert, 14 Verum-kontrolliert Studiendauer: 4 Wochen (10
Wirksamkeit und Sicherheit von generischen und originalen wöchentlichen Bisphosphonaten
 Wirksamkeit und Sicherheit von generischen und originalen wöchentlichen Bisphosphonaten Von Prof. Dr. med. Johann D. Ringe, Leverkusen Falkenstein (23. Januar 2009) - Die Osteoporose gehört nach Angaben
Wirksamkeit und Sicherheit von generischen und originalen wöchentlichen Bisphosphonaten Von Prof. Dr. med. Johann D. Ringe, Leverkusen Falkenstein (23. Januar 2009) - Die Osteoporose gehört nach Angaben
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Teduglutid wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
BAnz AT B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Neue Medikamentengruppen bei kardiovaskulärem Syndrom SGLT2-Inhibitoren
 Neue Medikamentengruppen bei kardiovaskulärem Syndrom SGLT2-Inhibitoren Univ. Prof. Dr. med. Jochen Seufert, FRCPE Innere Medizin II Abteilung Endokrinologie und Diabetologie Klinische Effekte von SGLT2
Neue Medikamentengruppen bei kardiovaskulärem Syndrom SGLT2-Inhibitoren Univ. Prof. Dr. med. Jochen Seufert, FRCPE Innere Medizin II Abteilung Endokrinologie und Diabetologie Klinische Effekte von SGLT2
PHYTO-EXTRAKT. Aktuelles für Sie und Ihre Patienten
 Ausgabe 6 11.02.2014 Liebe Leserin, lieber Leser, PHYTO-EXTRAKT Aktuelles für Sie und Ihre Patienten heute vor 167 Jahren wurde Thomas Alva Edison geboren. Er meldete zahlreiche Patente bis ins Alter,
Ausgabe 6 11.02.2014 Liebe Leserin, lieber Leser, PHYTO-EXTRAKT Aktuelles für Sie und Ihre Patienten heute vor 167 Jahren wurde Thomas Alva Edison geboren. Er meldete zahlreiche Patente bis ins Alter,
Wechselwirkungen zwischen Arzneimitteln DR. KATALIN MÜLLNER
 Wechselwirkungen zwischen Arzneimitteln DR. KATALIN MÜLLNER Wechselwirkungen zwischen Arzneimitteln - Definition Auch als Arzneimittelinteraktionen Viele Patienten erhalten gleichzeitig mehrere Medikamente
Wechselwirkungen zwischen Arzneimitteln DR. KATALIN MÜLLNER Wechselwirkungen zwischen Arzneimitteln - Definition Auch als Arzneimittelinteraktionen Viele Patienten erhalten gleichzeitig mehrere Medikamente
Nach der Nahrungsaufnahme werden so genannte Inkretinhormone im Darm freigesetzt, dazu gehören Glucagon-Like Peptide-1 (GLP-1) und
 Sitagliptin bietet in der Klasse der DPP-4-Hemmer das breiteste Zulassungsspektrum (1) Dr. med. Ralph Bierwirth Köln (8. September 2010) - Inkretin-basierte Therapeutika und die dazugehörigen Wirkstoffe
Sitagliptin bietet in der Klasse der DPP-4-Hemmer das breiteste Zulassungsspektrum (1) Dr. med. Ralph Bierwirth Köln (8. September 2010) - Inkretin-basierte Therapeutika und die dazugehörigen Wirkstoffe
Beschluss vom: 18. Juni 2015 gültig bis: unbefristet In Kraft getreten am: 18. Juni 2015 BAnz AT B1
 Pasireotid (neues Anwendungsgebiet: Akromegalie) Beschluss vom: 18. Juni 2015 gültig bis: unbefristet In Kraft getreten am: 18. Juni 2015 BAnz AT 16.07.2015 B1 Neu zugelassenes Anwendungsgebiet vom 19.
Pasireotid (neues Anwendungsgebiet: Akromegalie) Beschluss vom: 18. Juni 2015 gültig bis: unbefristet In Kraft getreten am: 18. Juni 2015 BAnz AT 16.07.2015 B1 Neu zugelassenes Anwendungsgebiet vom 19.
Fortschritt in der Schizophrenietherapie INVEGA stark wirksam gegen die Symptome der Schizophrenie
 Fortschritt in der Schizophrenietherapie INVEGA stark wirksam gegen die Symptome der Schizophren Fortschritt in der Schizophrenietherapie INVEGA stark wirksam gegen die Symptome der Schizophrenie Köln
Fortschritt in der Schizophrenietherapie INVEGA stark wirksam gegen die Symptome der Schizophren Fortschritt in der Schizophrenietherapie INVEGA stark wirksam gegen die Symptome der Schizophrenie Köln
Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis
 Alfried Krupp von Bohlen und Halbach-Stiftungslehrstuhl für Medizinmanagement Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis Survey A: Ärzte 27. August 2010 Finale Version Prof. Dr.
Alfried Krupp von Bohlen und Halbach-Stiftungslehrstuhl für Medizinmanagement Fragebogen zur Versorgung von Kindern und Jugendlichen mit Psoriasis Survey A: Ärzte 27. August 2010 Finale Version Prof. Dr.
Dossier zur Nutzenbewertung gemäß 35a SGB V
 Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Guselkumab (Tremfya ) Janssen-Cilag GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 21.11.2017 Inhaltsverzeichnis
Dokumentvorlage, Version vom 18.04.2013 Dossier zur Nutzenbewertung gemäß 35a SGB V Guselkumab (Tremfya ) Janssen-Cilag GmbH Modul 1 Zusammenfassung der Aussagen im Dossier Stand: 21.11.2017 Inhaltsverzeichnis
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION
 ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
ANHANG III ERGÄNZUNGEN ZUR ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND DER GEBRAUCHSINFORMATION Diese Änderungen von SPC und Packungsbeilage treten zum Zeitpunkt der Kommissionsentscheidung in Kraft.
