AK Chemie Baukasten Der Schüler als Molekülbaumeister Info X303
|
|
|
- Gerburg Bader
- vor 7 Jahren
- Abrufe
Transkript
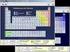
1 Kategorie Übungen und Tests Übungsmodus ja Testmodus - Schwierigkeitsgrade 2/2 vorwählbare Aufgabenzahl 35 Aktueller Notenstand - Highscore ja Musik zur Belobigung wählbar Spezielle Hilfen: Dr. Atom Steuerung durch Master: ja; auch: Schwierigkeitsgrad Auswertung im Master ja Eignung für Whiteboard: ja, in besonderem Maße AK Minilabor nein Besonderheit: Programmbeschreibung: Mit dem Chemie-Baukasten kann der Schüler sich an das komplexe Thema der chemischen Bindungen herantasten. Dieses Programm kombiniert den Sinn der "alten Stabilbaukästen" mit Molekülmodellkästen. Dabei gibt es zum einen den "Baumeister"-Modus und zum anderen den "Chemiker"-Modus. Der "Baumeister" ist zum Experimentieren mit den Bausteinen zu unbekannten Verbindungen gedacht, so dass man schnell erste Erfolge feiern kann. Im "Chemiker"-Modus wird da schon etwas mehr verlangt - beispielsweise das Erahnen der Eigenschaften der Verbindung. Ebenso gibt es zwei "Elektronen-Modi": Entweder man platziert die Atome im Arbeitsbereich und verbindet sie manuell oder man bringt die Atome nur in die Nähe zueinander und autoconnect besorgt den Rest. Insgesamt stehen 35 zu bauende "Verbindungen" als Aufgaben zur Verfügung. Es können auch Strukturisomere zu den Summenformeln C 4 H 10, C 5 H 12, C 6 H 14 und C 2 H 6 O gebaut werden. Materialien AK Labor Programminformationen 10/2012 1
2 Nachdem eine Aufgabe ausgewählt wurde, zieht der Schüler die benötigten Elemente aus dem Periodensystem in die Materialliste. Bevor es ans "Bauen" geht, muss nachgedacht werden: Welcher Typ von Bindung entsteht zwischen den Elementen? Dr. Atom erklärt die "Goldenen Bau-Regeln". Der Schüler zieht die Elemente aus der Materialliste auf die Arbeitsfläche und stellt mit der Maus die Bindungen her. Dr. Atom - penibel wie immer zählt mit der Lupe nach, ob auch bei jedem Atom die Oktett-Regel erfüllt ist. Im Chemiker Modus geht es darum, Eigenschaften der Verbindung abzuschätzen. Wie hoch ist z.b. die Dipolkraft oder der Siedepunkt? Dr. Atom hilft natürlich bei Bedarf weiter. Gibt es mehrere Isomere, so können bereits gebaute Strukturen mit ihren Eigenschaften zum Vergleich aufgerufen werden. Um die Vorstellung vom echten räumlichen Aufbau der Schüler zu schärfen, lässt sich das Molekül mit dem Programm Rasmol in 3D darstellen, meist sogar mit den freien Elektronenpaaren. Materialien AK Labor Programminformationen 10/2012 2
3 Zieht man mehr Atome als unbedingt notwendig in den Arbeitsbereich, so wird den Schülern sogar eine Vorstellung vom Aufbau von Ionenverbindungen vermittelt. Auch der Aufbau von Metallen wird deutlicher, wenn man mehrere Atome in den Arbeitsbereich zieht. Die Bedeutung des Elektronengases wird klar. Tipp beim Bau von Metallgittern: Will man Elektronen vom Atom in den Raum des Metallgitters ziehen, muss der entstehende Pfeil rot sein. Natürlich gibt es zum Abschluss einen Meister Brief - Entschuldigung: Baumeister-Brief Materialien AK Labor Programminformationen 10/2012 3
4 Die Aufgaben im Chemiebaukasten 1 NH 3 Stickstoff und Wasserstoff Welche Eigenschaften hat die einfachste Verbindung aus Stickstoff und Wasserstoff und wie lautet deren 2 H 2 Wasserstoff Er kommt fast nie atomar vor. Welche Eigenschaften hat er und wie lautet die 3 Ne Neon Wie kommt es in der Natur vor? 4 Ar Argon Wie kommt es in der Natur vor? 5 NaCl Natrium und Chlor Welche Eigenschaften hat die einfachste Verbindung aus den Elementen? 6 Al Aluminium Welche Eigenschaften hat das Element? 7 H 2 O Wasserstoff und Sauerstoff Welche Eigenschaften hat die einfachste Verbindung aus 8 O 2 Sauerstoff kommt nicht atomar vor. Welche Eigenschaften hat er und wie lautet die 9 N 2 Stickstoff kommt nicht atomar vor. Welche Eigenschaften hat er und wie lautet die 10 F 2 Fluor kommt nicht atomar vor. Welche Eigenschaften hat es und wie lautet die 11 Cl 2 Chlor kommt nicht atomar vor. Welche Eigenschaften hat es und wie lautet die 12 Br 2 Brom kommt nicht atomar vor. Welche Eigenschaften hat es und wie lautet die 13 I 2 Iod kommt nicht atomar vor. Welche Eigenschaften hat es und wie lautet die 14 Na Natrium Wie ist es aufgebaut und welche Eigenschaften hat es? 15 Mg Magnesium Wie ist es aufgebaut und welche Eigenschaften hat es? 16 MgAl Magnesium und Aluminium Welche Eigenschaften hat die Legierung aus den Elementen? 17 CH 4 Kohlenstoff und Wasserstoff Welche Eigenschaften hat die einfachste Verbindung aus 18 K 2 S Kalium und Schwefel Welche Eigenschaften hat die einfachste Verbindung aus 19 HCl Wasserstoff und Chlor Welche Eigenschaften hat die einfachste Verbindung aus 20 HF Wasserstoff und Fluor Welche Eigenschaften hat die einfachste Verbindung aus 21 CO 2 Kohlenstoffdioxid Wie heißt die Formel und welche Eigenschaften hat die Verbindung? 22 Al 2 O 3 Aluminium und Sauerstoff Welche Eigenschaften hat die einfachste Verbindung aus 23 LiH Lithium und Wasserstoff Welche Eigenschaften hat die einfachste Verbindung aus 24 C 2 H 6 Kohlenstoff und Wasserstoff Baue die einfachste Verbindung mit 2 C-Atomen ohne Mehrfachbindung! 25 C 2 H 4 Kohlenstoff und Wasserstoff Baue die einfachste Verbindung mit 2 C-Atomen und 4 H-Atomen auf! 26 C 2 H 2 Kohlenstoff und Wasserstoff Baue die einfachste Verbindung mit 2 C-Atomen und 2 H-Atomen auf! 27 C 3 H 8 Kohlenstoff und Wasserstoff Baue die einfachste Verbindung mit 3 C-Atomen - ohne Mehrfachbindung und ohne Ring auf! Materialien AK Labor Programminformationen 10/2012 4
5 Aufgaben (Forts.) 28 a) n-butan b) Methylpropan Kohlenstoff und Wasserstoff Baue eine Verbindung mit 4 C's ohne Mehrfachbindung! Kein Ring! 29 a) n-pentan b) Methylbutan Kohlenstoff und Wasserstoff Eigenschaften einer Verbindung mit 5 C's und? H's ohne Mehrfachbindung! Kein Ring! c) Dimethylpropan 30 a) n-hexan b) 2-Methylpentan Kohlenstoff und Wasserstoff Eigenschaften einer Verbindung mit 6 C's und? H's ohne Mehrfachbindung! Kein Ring! c) 3-Methylpentan d) 2,2- Dimethylbutan e)2,3-dimethylbutan 31 Methanol Kohlenstoff, Sauerstoff und Wasserstoff Welche Eigenschaften hat die einfachste Verbindung ohne Doppelbindung? 32 Methanal Kohlenstoff, Sauerstoff und Wasserstoff Welche Eigenschaften hat die einfachste Verbindung mit Doppelbindung? 33 a) Dimethylether b) Ethanol Kohlenstoff, Sauerstoff und Wasserstoff Welche Eigenschaften hat C 2 H 6 O ohne Mehrfachbindung! Kein Ring! 34 Kohlensäure Zwei H-, ein C- und 3 O-Atome Baue die Formel der Substanz ohne O-O- Bindungen und Ringe 35 Natriumhydroxid Wasserstoff, Sauerstoff und Natrium Welche Eigenschaften hat die einfachste Verbindung aus Materialien AK Labor Programminformationen 10/2012 5
Wasserstoff. Helium. Bor. Kohlenstoff. Standort: Name: Ordnungszahl: Standort: Name: Ordnungszahl: 18. Gruppe. Standort: Ordnungszahl: Name:
 H Wasserstoff 1 1. Gruppe 1. Periode He Helium 2 18. Gruppe 1. Periode B Bor 5 13. Gruppe C Kohlenstoff 6 14. Gruppe N Stickstoff 7 15. Gruppe O Sauerstoff 8 16. Gruppe Ne Neon 10 18. Gruppe Na Natrium
H Wasserstoff 1 1. Gruppe 1. Periode He Helium 2 18. Gruppe 1. Periode B Bor 5 13. Gruppe C Kohlenstoff 6 14. Gruppe N Stickstoff 7 15. Gruppe O Sauerstoff 8 16. Gruppe Ne Neon 10 18. Gruppe Na Natrium
Formeln & Namen. Will man ein Kapitel nicht bearbeiten, kann man dessen Aufgabenzahl auf '0' setzen.
 Kategorie Übungen und Tests Kategorien 4 Übungsmodus ja Testmodus ja Schwierigkeitsgrade 2/2 vorwählbare Aufgabenzahl 0-20 Aktueller Notenstand ja Highscore ja Musik zur Belobigung wählbar Spezielle Hilfen:
Kategorie Übungen und Tests Kategorien 4 Übungsmodus ja Testmodus ja Schwierigkeitsgrade 2/2 vorwählbare Aufgabenzahl 0-20 Aktueller Notenstand ja Highscore ja Musik zur Belobigung wählbar Spezielle Hilfen:
Elektronenpaarbindung (oder Atombindung) Nichtmetallatom + Nichtmetallatom Metallatom + Nichtmetallatom 7. Welche Bindungsart besteht jeweils?
 LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
LÖSUNGEN Probetest 1 Kap. 03 Theorie Name: 1. C = Kohlenstoff Ag = Silber Br = Brom Schwefel = S Lithium = Li Uran = U 2. Aluminium - Finde die richtigen Zahlen mit Hilfe deines PSE: Massenzahl: 27 Ordnungszahl:
Kappenberg. AK Master Das Steuerprogramm für die "Rechnerklasse" Info X501
 Kategorie - Kategorien - Übungsmodus - Testmodus - Schwierigkeitsgrade - vorwählbare Aufgabenzahl - Aktueller Notenstand - Highscore - Musik zur Belobigung - Spezielle Hilfen: - Steuerung durch Master:
Kategorie - Kategorien - Übungsmodus - Testmodus - Schwierigkeitsgrade - vorwählbare Aufgabenzahl - Aktueller Notenstand - Highscore - Musik zur Belobigung - Spezielle Hilfen: - Steuerung durch Master:
Posten 1a. Wie sieht das Kugelwolkenmodell aus von einem Sauerstoffatom? Antworten: a) (=> Posten 9o) b) (=> Posten 16l) c) (=> Posten 8k)
 Posten 1a Wie sieht das Kugelwolkenmodell aus von einem Sauerstoffatom? a) (=> Posten 9o) b) (=> Posten 16l) c) (=> Posten 8k) d) (=> Posten 13f) Posten 1d Welcher der beiden Stoffe hat den tieferen Siedepunkt?
Posten 1a Wie sieht das Kugelwolkenmodell aus von einem Sauerstoffatom? a) (=> Posten 9o) b) (=> Posten 16l) c) (=> Posten 8k) d) (=> Posten 13f) Posten 1d Welcher der beiden Stoffe hat den tieferen Siedepunkt?
[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen
![[ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen [ ] 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe + - Moleküle aus gleichen Atomen. Ionen. Moleküle aus verschiedenen Atomen](/thumbs/68/58264490.jpg) 1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
1. Stoffe und Reaktionen (Kartei 8.8, 8.10 und 8.13) Stoffe Gemische Reinstoffe Elemente Verbindungen gleiche Atome Moleküle aus gleichen Atomen Moleküle aus verschiedenen Atomen Ionen + Kation Anion z.b.
Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen. Didaktikpool
 Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen Didaktikpool Periodensystem der Elemente für blinde und hochgradig sehgeschädigte Laptop-Benutzer Reinhard Apelt 2008 Technische
Integration von Schülerinnen und Schülern mit einer Sehschädigung an Regelschulen Didaktikpool Periodensystem der Elemente für blinde und hochgradig sehgeschädigte Laptop-Benutzer Reinhard Apelt 2008 Technische
0.6 Einfache Modelle der chemischen Bindung
 0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
AK SACK Simulation und Analyse Chemischer Kinetik' Info X160
 Kategorie Animation&Simulation Übungsmodus - Testmodus - Schwierigkeitsgrade - vorwählbare Aufgabenzahl - Aktueller Notenstand - Highscore - Musik zur Belobigung - Spezielle Hilfen: - Steuerung durch Master:
Kategorie Animation&Simulation Übungsmodus - Testmodus - Schwierigkeitsgrade - vorwählbare Aufgabenzahl - Aktueller Notenstand - Highscore - Musik zur Belobigung - Spezielle Hilfen: - Steuerung durch Master:
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Atombau und PSE. Das komplette Material finden Sie hier: School-Scout.
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Atombau und PSE Das komplette Material finden Sie hier: School-Scout.de Chemiekonzept Pro Unterrichtsreihen Sekundarstufe I Band 11
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Atombau und PSE Das komplette Material finden Sie hier: School-Scout.de Chemiekonzept Pro Unterrichtsreihen Sekundarstufe I Band 11
Vom Atom zum Molekül
 Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Vom Atom zum Molekül Ionenverbindungen Na + Cl NaCl lebensgefährlich giftig lebensgefährlich giftig lebensessentiell Metall + Nichtmetall Salz Beispiel Natriumchlorid Elektronenkonfiguration: 11Na: 1s(2)
Wasser à. Nachweis: Wasser ist
 Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Repetitionen Chemie und Werkstoffkunde
 BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
BEARBEITUNGSTECHNIK REPETITONEN Kapitel 2 Repetitionen Chemie und Werkstoffkunde Thema 2 Begriffe der Chemie und Werkstoffkunde Verfasser: Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1,
Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem?
 2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
2. DIE KLEINSTEN TEILCHEN ARBEITSBLATT 2.1 DER ATOMAUFBAU FRAGE Wie sind Atome aufgebaut Welche Informationen enthält das Periodensystem? Bausteine der Atome Ladung (+, -, 0) Masse (hoch, sehr gering)
Quintessenz: Elektronen steht der ganze Raum einer Schale als Bewegungsraum zur Verfügung. 2. Gedankenexperiment: treffen sich zwei H-Atome.
 Lehrer-Info 1 Elektronenpaarbindung Impuls: Abbildung vom PSE mit grau markierten Salzen und rot markierten Molekülverbindungen Mögliche Unterrichtsstruktur H Das Periodensystem der Element (unvollständig)
Lehrer-Info 1 Elektronenpaarbindung Impuls: Abbildung vom PSE mit grau markierten Salzen und rot markierten Molekülverbindungen Mögliche Unterrichtsstruktur H Das Periodensystem der Element (unvollständig)
Grundwissenkarten Hans-Carossa-Gymnasium. 9. Klasse. Chemie SG
 Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa-Gymnasium 9. Klasse Chemie SG Es sind insgesamt 18 Karten für die 9. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1. Grundwissen 8. Klasse 2 Grundwissen 8. Klasse 2. Stoffebene
 Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
Grundwissen 8. Klasse 1 Grundwissen 8. Klasse 1 Stoff Einteilung der Stoffe Reinstoff mischen Gemisch Stelle in einem Fließdiagramm folgende Begriffe zueinander in Beziehung: Stoff, Reinstoff, Gemisch,
GEOMIX-Chem Molekülbaukasten Schüler- MINOR Best.- Nr. CL32301
 GEOMIX-Chem Molekülbaukasten Schüler- MINOR Best.- Nr. CL32301 Inhalt 50 Atommodelle 54 Verbindungselemente, Einfach-, Mehrfachbindungen und Kalottenverbindungen 1 Kalottenlöser im GEOMIX-Kunststoffkasten
GEOMIX-Chem Molekülbaukasten Schüler- MINOR Best.- Nr. CL32301 Inhalt 50 Atommodelle 54 Verbindungselemente, Einfach-, Mehrfachbindungen und Kalottenverbindungen 1 Kalottenlöser im GEOMIX-Kunststoffkasten
4.2 Kovalente Bindung. Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916)
 4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
Einheiten und Einheitenrechnungen
 Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 1: allgemeine Chemie, einfache Berechnungen, Periodensystem, Orbitalbesetzung, Metalle und Salze Einheiten und Einheitenrechnungen
Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 1: allgemeine Chemie, einfache Berechnungen, Periodensystem, Orbitalbesetzung, Metalle und Salze Einheiten und Einheitenrechnungen
Grundpraktikum für Biologen 2016
 Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
CHEMIE KAPITEL 1 AUFBAU DER MATERIE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2014 / 2015
 CHEMIE KAPITEL 1 AUFBAU DER MATERIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2014 / 2015 Folie 2 Valenzelektronen und Atomeigenschaften Valenzelektronen (Außenelektronen) bestimmen
CHEMIE KAPITEL 1 AUFBAU DER MATERIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2014 / 2015 Folie 2 Valenzelektronen und Atomeigenschaften Valenzelektronen (Außenelektronen) bestimmen
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE
 SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
SÄUREN, BASE, SALZE GRUNDLAGEN CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE ORGANISCHE UND ANORGANISCHE CHEMIE Wikipedia: Die organische Chemie (kurz: OC), häufig auch kurz Organik, ist ein Teilgebiet der
2. Verhalten der Elemente bei einer Reaktion: Warum funkt s bei unterschiedlichen
 1. Atombau und Periodensystem 1a) Nach welchem Gesichtspunkt sind die Elemente im Periodensystem von 1- ca. 103 angeordnet? 1b) Nach welchem Gesichtspunkt ist ein Element einer PERIODE zugeordnet? 1c)
1. Atombau und Periodensystem 1a) Nach welchem Gesichtspunkt sind die Elemente im Periodensystem von 1- ca. 103 angeordnet? 1b) Nach welchem Gesichtspunkt ist ein Element einer PERIODE zugeordnet? 1c)
N & T 5 Periodensystem der Elemente 01 Name: Vorname: Datum:
 N & T 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
N & T 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
Atomaufbau. Elektronen e (-) Atomhülle
 Atomaufbau Institut für Elementarteilchen Nukleonen Protonen p (+) Neutronen n (o) Elektronen e (-) Atomkern Atomhülle Atom WIBA-NET 2005 Prof. Setzer 1 Elementarteilchen Institut für Name Symbol Masse
Atomaufbau Institut für Elementarteilchen Nukleonen Protonen p (+) Neutronen n (o) Elektronen e (-) Atomkern Atomhülle Atom WIBA-NET 2005 Prof. Setzer 1 Elementarteilchen Institut für Name Symbol Masse
NH 3. CCl 4 CO 2. Lösungen zur Lernzielkontrolle Sekunda. Hilfsmittel: PSE, Taschenrechner
 Lösungen zur Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (1) 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) leitfähig,
Lösungen zur Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (1) 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) leitfähig,
N & T (R) 5 Periodensystem der Elemente 01 Name: Vorname: Datum:
 N & T (R) 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
N & T (R) 5 Periodensystem der Elemente 01 Name: Vorname: Datum: Dalton definierte sein Atommodell um 1803. Schon bald stellten die Chemiker fest, dass das Modell zwar gut war, doch nicht alle Fragen klären
Auf der rechten Seite sind Beispiele für kovalente Bindungen.
 Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Bei einem Gemisch aus Natrium und Chlorid wird einen Ionenverbindung entstehen und sich ein Ionengitter ausbilden. Wenn Natrium nicht vorhanden ist, hat Chlorid aber natürlich noch immer das Bedürfnis,
Kappenberg. Datenbank Schulchemikalien Info X208
 Kategorie Rechnen und Nachschlagen Übungsmodus - Testmodus - Schwierigkeitsgrade - wählbare Aufgabenzahl - Aktueller Notenstand - Highscore - Musik zur Belobigung - spezielle Hilfen - Steuerung durch Master:
Kategorie Rechnen und Nachschlagen Übungsmodus - Testmodus - Schwierigkeitsgrade - wählbare Aufgabenzahl - Aktueller Notenstand - Highscore - Musik zur Belobigung - spezielle Hilfen - Steuerung durch Master:
Orientierungstest für angehende Industriemeister. Vorbereitungskurs Chemie
 Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Weiterbildung Technologie Erlaubte Hilfsmittel: Periodensystem der Elemente Taschenrechner Maximale Bearbeitungszeit: 60 Minuten
Orientierungstest für angehende Industriemeister Vorbereitungskurs Chemie Weiterbildung Technologie Erlaubte Hilfsmittel: Periodensystem der Elemente Taschenrechner Maximale Bearbeitungszeit: 60 Minuten
Werkstoffkunde Chemische Bindungsarten
 Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
Aufgabenblatt 10 Übungsblatt Stöchiometrie
 Name: Datum: Aufgabenblatt 10 Übungsblatt Stöchiometrie Berechnung von Stoffmengen bei chemischen Reaktionen II _ 20091005 Dr. Hagen Grossholz A1 Zusammenhang zwischen den verschiedenen Größen. Masse m
Name: Datum: Aufgabenblatt 10 Übungsblatt Stöchiometrie Berechnung von Stoffmengen bei chemischen Reaktionen II _ 20091005 Dr. Hagen Grossholz A1 Zusammenhang zwischen den verschiedenen Größen. Masse m
Integration von Schülerinnen und Schülern mit einer Sehbeeinträchtigung an Regelschulen
 Integration von Schülerinnen und Schülern mit einer Sehbeeinträchtigung an Regelschulen Didaktikpool Lernmaterial Atomol Material für den Chemieunterricht Panni Szombati, 2015 Technische Universität Dortmund
Integration von Schülerinnen und Schülern mit einer Sehbeeinträchtigung an Regelschulen Didaktikpool Lernmaterial Atomol Material für den Chemieunterricht Panni Szombati, 2015 Technische Universität Dortmund
H Wasserstoff. O Sauerstoff
 He Helium Ordnungszahl 2 Atommasse 31,8 268,9 269,7 0,126 1,25 H Wasserstoff Ordnungszahl 1 Atommasse 14,1 252,7 259,2 2,1 7,14 1 3,45 1,38 Li Lithium Ordnungszahl 3 Atommasse 13,1 1330 180,5 1,0 0,53
He Helium Ordnungszahl 2 Atommasse 31,8 268,9 269,7 0,126 1,25 H Wasserstoff Ordnungszahl 1 Atommasse 14,1 252,7 259,2 2,1 7,14 1 3,45 1,38 Li Lithium Ordnungszahl 3 Atommasse 13,1 1330 180,5 1,0 0,53
Die Stoffteilchen (II): Ionengruppen und ihre Ionen
 Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
10. Klasse / Infoblatt 1. Grundwissen: Periodensystem
 Grundwissen: Periodensystem Metalle / Metallcharakter Nichtmetalle / Nichtmetallcharakter Elektronenaffinität Reaktivität der Halogene Reaktivität der Alkalimetalle 10. Klasse / Infoblatt 1 Eigenschaft
Grundwissen: Periodensystem Metalle / Metallcharakter Nichtmetalle / Nichtmetallcharakter Elektronenaffinität Reaktivität der Halogene Reaktivität der Alkalimetalle 10. Klasse / Infoblatt 1 Eigenschaft
Welche beiden Metalle prägten eine Epoche?
 Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Posten 1a Welche beiden Metalle prägten eine Epoche? a) Silber / Gold (=> Posten 2a) b) Bronze / Eisen (=> Posten 3d) c) Eisen / Gold (=> Posten 4j) d) Silber / Bronze (=> Posten 5s) Posten 2d Welcher
Das Formelpuzzle Kopiervorlage
 Das Formelpuzzle Kopiervorlage Die Vorlage wird foliert, die einzelnen Bausteine werden ausgeschnitten. Durch einfaches Aneinanderlegen von Kationen und Anionen können die Formeln von Säuren, Basen und
Das Formelpuzzle Kopiervorlage Die Vorlage wird foliert, die einzelnen Bausteine werden ausgeschnitten. Durch einfaches Aneinanderlegen von Kationen und Anionen können die Formeln von Säuren, Basen und
Grundtypen der Bindung. Grundtypen chemischer Bindung. Oktettregel. A.8.1. Atombindung
 Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
Grundtypen der Bindung Grundtypen chemischer Bindung Oktettregel A.8.1. Atombindung 1 A.8.1 Atombindung Valenz (Zahl der Bindungen) Atombindung auch: kovalente Bindung, ElektronenpaarBindung Zwei Atome
CHEMIE KAPITEL 1 AUFBAU DER MATERIE. Timm Wilke. Georg-August-Universität Göttingen. Wintersemester 2014 / 2015
 CHEMIE KAPITEL 1 AUFBAU DER MATERIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2014 / 2015 Folie 2 Atombau und Elementarteilchen Folie 3 Atommasse und Stoffmenge Stoffmenge [mol]: 12,000
CHEMIE KAPITEL 1 AUFBAU DER MATERIE Timm Wilke Georg-August-Universität Göttingen Wintersemester 2014 / 2015 Folie 2 Atombau und Elementarteilchen Folie 3 Atommasse und Stoffmenge Stoffmenge [mol]: 12,000
Chemie für Bauingenieure Uebung 2
 Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
Chemie für Bauingenieure Uebung 2 Aufgabe 1 i. Bestimmen Sie mithilfe des Periodensystems für folgende Elemente die Anzahl Elektronen, Protonen und Neutronen. ii. Bestimmen Sie dann für die jeweiligen
Wie gross ist die Stoffmenge von 344g Aluminiumhydrogencarbonat (Al(HCO 3 ) 3 )?
 Posten 1a Wie gross ist die Stoffmenge von 344g Aluminiumhydrogencarbonat (Al(HCO 3 ) 3 )? a) 0.35 mol (=> Posten 9m) b) 1.64 mol (=> Posten 12d) c) 1.33 mol (=> Posten 5n) d) 1.21 mol (=> Posten 13g)
Posten 1a Wie gross ist die Stoffmenge von 344g Aluminiumhydrogencarbonat (Al(HCO 3 ) 3 )? a) 0.35 mol (=> Posten 9m) b) 1.64 mol (=> Posten 12d) c) 1.33 mol (=> Posten 5n) d) 1.21 mol (=> Posten 13g)
Welche Arten von Formeln stehen dem Chemiker zur Verfügung?
 Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
Welche Arten von Formeln stehen dem Chemiker zur Verfügung? 1. Summenformeln 2. Valenzstrichformeln (Lewis-Strichformeln) 3. Strukturformeln Summenformel: Die Summenformel dient dazu Art und Anzahl der
1.8. Aufgaben zur Elektronenpaarbindung
 1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung
 1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
1.8. Aufgaben zur Elektronenpaarbindung Aufgabe 1: Elektronenpaarbindung a) Welche anderen Bezeichnungen gibt es für die Elektronenpaarbindung? b) Wie erreichen Nichtmetallatome die Edelgaskonfiguration,
Periodensystem der Elemente - PSE
 Periodensystem der Elemente - PSE Historische Entwicklung Möglichkeiten der Reindarstellung seit 18. Jhdt. wissenschaftliche Beschreibung der Elemente 1817 Johann Wolfgang Döbereiner: ähnliche Elemente
Periodensystem der Elemente - PSE Historische Entwicklung Möglichkeiten der Reindarstellung seit 18. Jhdt. wissenschaftliche Beschreibung der Elemente 1817 Johann Wolfgang Döbereiner: ähnliche Elemente
Übung zu den Vorlesungen Organische und Anorganische Chemie
 Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 07.11.08 - Lösungen - 1. Vervollständigen Sie die Reaktionsgleichungen und benennen Sie alle Verbindungen und
Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 07.11.08 - Lösungen - 1. Vervollständigen Sie die Reaktionsgleichungen und benennen Sie alle Verbindungen und
Lösung Sauerstoff: 1s 2 2s 2 2p 4, Bor: 1s 2 2s 2 2p 1, Chlor: 1s 2 2s 2 2p 6 3s 2 3p 5 Neon: 1s 2 2s 2 2p 6
 1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
1 of 6 10.05.2005 10:56 Lösung 1 1.1 1 mol Natrium wiegt 23 g => 3 mol Natrium wiegen 69 g. 1 mol Na enthält N A = 6.02 x 10 23 Teilchen => 3 mol enthalten 1.806 x 10 24 Teilchen. 1.2 Ein halbes mol Wasser
Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch. Reinstoff, Element, Verbindung. Zweiatomige Elemente.
 1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
Hewlett-Packard Company. [Dokumenttitel] [Untertitel des Dokuments] Walter Whites explosives Chemie Quiz Fragen & Antworten.
![Hewlett-Packard Company. [Dokumenttitel] [Untertitel des Dokuments] Walter Whites explosives Chemie Quiz Fragen & Antworten. Hewlett-Packard Company. [Dokumenttitel] [Untertitel des Dokuments] Walter Whites explosives Chemie Quiz Fragen & Antworten.](/thumbs/95/126174167.jpg) Hewlett-Packard Company [Dokumenttitel] [Untertitel des Dokuments] Walter Whites explosives Chemie Quiz Fragen & Antworten Johanika [Datum] Walter Whites Chemie Quiz Fragen 1. Aus wie vielen Atomen besteht
Hewlett-Packard Company [Dokumenttitel] [Untertitel des Dokuments] Walter Whites explosives Chemie Quiz Fragen & Antworten Johanika [Datum] Walter Whites Chemie Quiz Fragen 1. Aus wie vielen Atomen besteht
Oktett-Theorie von Lewis
 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Elektronenkonfiguration
 Um die chemischen Eigenschaften von Elementen zu verstehen, muss man deren Elektronenkonfiguration kennen. Als Elektronenkonfiguration bezeichnet man die Verteilung der Elektronen auf Schalen um den Kern
Um die chemischen Eigenschaften von Elementen zu verstehen, muss man deren Elektronenkonfiguration kennen. Als Elektronenkonfiguration bezeichnet man die Verteilung der Elektronen auf Schalen um den Kern
Die Stoffteilchen (II): Ionengruppen und ihre Ionen
 Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Die Stoffteilchen (II): Ionengruppen und ihre Ionen Ionen sind die Bausteine der Ionengruppen, den gedachten Stoffteilchen der Salze. Was haben Ionengruppen mit der Formel von Salzen zu tun? DARUM GEHT
Chemie Grundwissen der achten Jahrgangsstufe (NTG)
 hemie Grundwissen der achten Jahrgangsstufe (NTG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
hemie Grundwissen der achten Jahrgangsstufe (NTG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Eigenschaften Reinstoffe Elemente Kugelteilchen Elementes Atom
 Einstieg: Atom Der Chemiker will alles genau untersuchen, um die Eigenschaften von Stoffen heraus zu finden. Er trennt Gemische in Reinstoffe. Er analysiert Reinstoffe, so dass sie in ihre Elemente zerfallen.
Einstieg: Atom Der Chemiker will alles genau untersuchen, um die Eigenschaften von Stoffen heraus zu finden. Er trennt Gemische in Reinstoffe. Er analysiert Reinstoffe, so dass sie in ihre Elemente zerfallen.
Chemische Bindung. Ue Mol 1. fh-pw
 Ue Mol 1 Chemische Bindung Periodensystem - Atome - Moleküle Periodensystem(e) 3 Nichtmetalle - Metalloide 5 Eigenschaften der Elemente 6 Bindungstypen 7 Ionenbindung 8 Kovalente, homöopolare Bindung 10
Ue Mol 1 Chemische Bindung Periodensystem - Atome - Moleküle Periodensystem(e) 3 Nichtmetalle - Metalloide 5 Eigenschaften der Elemente 6 Bindungstypen 7 Ionenbindung 8 Kovalente, homöopolare Bindung 10
GEOMIX-Chem Molekülbaukasten KASTA Best. - Nr. CL32501
 GEOMIX-Chem Molekülbaukasten KASTA Best. - Nr. CL32501 Der Molekülbaukasten KASTA ermöglicht die Darstellung räumlicher Strukturen von organischen und anorganischen Molekülen sowohl im Kalotten-Modell,
GEOMIX-Chem Molekülbaukasten KASTA Best. - Nr. CL32501 Der Molekülbaukasten KASTA ermöglicht die Darstellung räumlicher Strukturen von organischen und anorganischen Molekülen sowohl im Kalotten-Modell,
EDUKTE PRODUKTE. Bei einer chemischen Reaktion wandeln sich Stoffe in neue Stoffe mit anderen Eigenschaften um. Symbolische Schreibweise: Reagiert zu
 L2 1 Chemische Reaktion, Energetik Bei einer chemischen Reaktion wandeln sich Stoffe in neue Stoffe mit anderen Eigenschaften um. Symbolische Schreibweise: Ausgangsstoff e EDUKTE Reagiert zu Endstoffe
L2 1 Chemische Reaktion, Energetik Bei einer chemischen Reaktion wandeln sich Stoffe in neue Stoffe mit anderen Eigenschaften um. Symbolische Schreibweise: Ausgangsstoff e EDUKTE Reagiert zu Endstoffe
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1. Grundwissen 9.Klasse SG 2 Grundwissen 9.Klasse SG 2. Stoffebene.
 Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
Grundwissen 9.Klasse SG 1 Grundwissen 9.Klasse SG 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp.,
Chemie wässriger Lösungen
 Probenaufbereitung Aufschlusstechniken Beispiel: Nasse Veraschung mit Königswasser KönigswasserAufschluss HNO 3 + 3 HCl NOCl + 2Cl + 2 H 2 O Au + 3 Cl + Cl [AuCl 4 ] Tetrachloroaurat(III) Pt + 4 Cl + 2Cl
Probenaufbereitung Aufschlusstechniken Beispiel: Nasse Veraschung mit Königswasser KönigswasserAufschluss HNO 3 + 3 HCl NOCl + 2Cl + 2 H 2 O Au + 3 Cl + Cl [AuCl 4 ] Tetrachloroaurat(III) Pt + 4 Cl + 2Cl
Periodensystem der Elemente (PSE)
 Periodensystem der Elemente (PSE) 1 2 H 1.0079 4.0026 3 4 5 6 7 8 9 10 Li 6.941 Be 9.0122 B 10.811 C 12.011 N 14.007 O 15.999 F 18.998 Ne 20.180 11 12 13 14 15 16 17 18 Na Mg Al Si P S Cl Ar 22.990 24.305
Periodensystem der Elemente (PSE) 1 2 H 1.0079 4.0026 3 4 5 6 7 8 9 10 Li 6.941 Be 9.0122 B 10.811 C 12.011 N 14.007 O 15.999 F 18.998 Ne 20.180 11 12 13 14 15 16 17 18 Na Mg Al Si P S Cl Ar 22.990 24.305
Übung zu den Vorlesungen Organische und Anorganische Chemie
 Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 12.11.08 1. Stellen sie die Reaktionsgleichung für die Herstellung von Natriumsulfid aus den Elementen auf. Wieviel
Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 12.11.08 1. Stellen sie die Reaktionsgleichung für die Herstellung von Natriumsulfid aus den Elementen auf. Wieviel
Chemie Grundwissen der neunten Jahrgangsstufe (SG)
 hemie Grundwissen der neunten Jahrgangsstufe (SG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
hemie Grundwissen der neunten Jahrgangsstufe (SG) hemie ist die Lehre von den Stoffen und den Stoffänderungen Alle Materie besteht aus kleinsten Teilchen. Sie können sich in ihrer Masse bzw. Größe unterscheiden
8.1. Wie werden naturwissenschaftliche Erkenntnisse gewonnen? 8.2. Wie erstellt man ein Versuchsprotokoll? 8.3
 1) Beobachtung von Umwelterscheinungen Problem Vermutung: Hypothese zur Lösung des Problems 8.1 Wie werden naturwissenschaftliche Erkenntnisse gewonnen? 2) Die Hypothese wird durch ein ausgewähltes Experiment
1) Beobachtung von Umwelterscheinungen Problem Vermutung: Hypothese zur Lösung des Problems 8.1 Wie werden naturwissenschaftliche Erkenntnisse gewonnen? 2) Die Hypothese wird durch ein ausgewähltes Experiment
Name: Punktzahl: von 57 Note:
 Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen
 Wiederholung der letzten Vorlesungsstunde: Thema: Das wellenmechanische h Atommodell (Orbitalmodell) ll) Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen beschrieben werden, Hauptquantenzahl
Wiederholung der letzten Vorlesungsstunde: Thema: Das wellenmechanische h Atommodell (Orbitalmodell) ll) Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen beschrieben werden, Hauptquantenzahl
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006
 Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Anorganische Chemie I
 Anorganische Chemie I PRÜFUNG B. Sc. Chemieingenieurwesen 14. September 2016 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse.
Anorganische Chemie I PRÜFUNG B. Sc. Chemieingenieurwesen 14. September 2016 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse.
Die zu dieser Zeit bekannten 63 Elemente konnten trotzdem nach ihren chemischen Eigenschaften in einem periodischen System angeordnet werden.
 phys4.022 Page 1 12.4 Das Periodensystem der Elemente Dimitri Mendeleev (1869): Ordnet man die chemischen Elemente nach ihrer Ladungszahl Z, so tauchen Elemente mit ähnlichen chemischen und physikalischen
phys4.022 Page 1 12.4 Das Periodensystem der Elemente Dimitri Mendeleev (1869): Ordnet man die chemischen Elemente nach ihrer Ladungszahl Z, so tauchen Elemente mit ähnlichen chemischen und physikalischen
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Unterschied zwischen Physik und Chemie:
 Unterschied zwischen Physik und Chemie: Der Begriff Physik bezeichnet die Lehre über Zustände und Zustandsänderungen die Chemie hingegen beschäftigt sich mit Stoffen und stofflichen Veränderungen. Unterteilung
Unterschied zwischen Physik und Chemie: Der Begriff Physik bezeichnet die Lehre über Zustände und Zustandsänderungen die Chemie hingegen beschäftigt sich mit Stoffen und stofflichen Veränderungen. Unterteilung
Grundlagen Chemie. Dipl.-Lab. Chem. Stephan Klotz. Freiwill ige Feuerwehr Rosenheim
 Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
Grundlagen Dipl.-Lab. Chem. Stephan Klotz Freiwill ige Feuerwehr Rosenheim Einführung Lernziele Einfache chemische Vorgänge, die Bedeutung für die Feuerwehrpraxis haben, erklären. Chemische Grundlagen
Lösungen III Silizium; von innen nach außen: 2 bzw. 8 bzw. 4 Elektronen auf den Schalen
 Lösungen III.1 1. wenn man für die Atomgröße 10-10 m und für die Kerngröße 10-15 m annimmt, ergibt sich: a) 16 000 km (also größer als die Erde!) bzw. 0,4 m, also ist der Kern nicht sichtbar b) der gezeigte
Lösungen III.1 1. wenn man für die Atomgröße 10-10 m und für die Kerngröße 10-15 m annimmt, ergibt sich: a) 16 000 km (also größer als die Erde!) bzw. 0,4 m, also ist der Kern nicht sichtbar b) der gezeigte
41. Welches der folgenden Elemente zeigt die geringste Tendenz, Ionen zu bilden?
 41. Welches der folgenden Elemente zeigt die geringste Tendenz, Ionen zu bilden? A) Ca B) C C) F D) Na 42. Steinsalz löst sich in Wasser, A) weil beide Ionen Hydrathüllen bilden können B) es eine Säure
41. Welches der folgenden Elemente zeigt die geringste Tendenz, Ionen zu bilden? A) Ca B) C C) F D) Na 42. Steinsalz löst sich in Wasser, A) weil beide Ionen Hydrathüllen bilden können B) es eine Säure
Chemie-Tutorien zur Vorbereitung auf das Praktikum
 Seite 1 von 7 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie-Tutorien zur Vorbereitung auf das Praktikum 07.03.-18.03.2017 Dienstag, 07.03.2017 18.00-20.00 Uhr Grundlagen der Chemie I Donnerstag, 09.03.2017
Seite 1 von 7 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie-Tutorien zur Vorbereitung auf das Praktikum 07.03.-18.03.2017 Dienstag, 07.03.2017 18.00-20.00 Uhr Grundlagen der Chemie I Donnerstag, 09.03.2017
Chemisches Rechnen für Bauingenieure
 Chemisches Rechnen für Bauingenieure PD Dr. Martin Denecke Sprechstunde: Freitag, 13.30 14.30 martin.denecke@uni-due.de ++49 201 183 2742 Raum: V15 R05 H18 Periodensystem der Elemente Chemie im Netz http://www.arnold-chemie.de/downloads/molrechnen.pdf
Chemisches Rechnen für Bauingenieure PD Dr. Martin Denecke Sprechstunde: Freitag, 13.30 14.30 martin.denecke@uni-due.de ++49 201 183 2742 Raum: V15 R05 H18 Periodensystem der Elemente Chemie im Netz http://www.arnold-chemie.de/downloads/molrechnen.pdf
1 Das Periodensystem der Elemente (PSE)
 1 DAS PERIODENSYSTEM DER ELEMENTE (PSE) 1 G P E R I U P P E O D E Abbildung 1: Perioden und Gruppen 1 Das Periodensystem der Elemente (PSE) Man unterscheidet Perioden von Gruppen (siehe Abbildung auf dieser
1 DAS PERIODENSYSTEM DER ELEMENTE (PSE) 1 G P E R I U P P E O D E Abbildung 1: Perioden und Gruppen 1 Das Periodensystem der Elemente (PSE) Man unterscheidet Perioden von Gruppen (siehe Abbildung auf dieser
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT Elementfamilien
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Die wichtigsten Elementfamilien Das komplette Material finden Sie hier: Download bei School-Scout.de SCHOOL-SCOUT Elementfamilien
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1. Grundwissen 8.Klasse 2 Grundwissen 8.Klasse 2. Stoffebene. Teilchen -ebene
 Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Grundwissen 8.Klasse 1 Grundwissen 8.Klasse 1 Stoff Reinstoff mischen Gemisch Einteilung der Stoffe Bei gleichen Bedingungen (Temp., Druck) immer gleiche Eigenschaften (z.b. Schmelz- /Siedetemp., Löslichkeit,
Atomverbände. In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die Elektronenkonfiguration
 Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die
Atomverbände Möglichkeit 1: Abgabe von Elektronen bei gleichzeitiger Aufnahme durch einen Reaktionspartner --> SALZE In stabilen Verbindungen, die auf der Erde existieren besitzen die Elemente meist die
1 Chemische Elemente und chemische Grundgesetze
 1 Chemische Elemente und chemische Grundgesetze Die Chemie ist eine naturwissenschaftliche Disziplin. Sie befasst sich mit der Zusammensetzung, Charakterisierung und Umwandlung von Materie. Unter Materie
1 Chemische Elemente und chemische Grundgesetze Die Chemie ist eine naturwissenschaftliche Disziplin. Sie befasst sich mit der Zusammensetzung, Charakterisierung und Umwandlung von Materie. Unter Materie
Selbsteinschätzungstest zum Vorkurs Anorganische Chemie
 WS 15/16 1/7 Selbsteinschätzungstest zum Vorkurs Anorganische Chemie Liebe Studierende! Der Vorkurs frischt Ihr Schulwissen auf, vermittelt aber NICHT die späteren Studieninhalte. Die Inhalte des Vorkurses
WS 15/16 1/7 Selbsteinschätzungstest zum Vorkurs Anorganische Chemie Liebe Studierende! Der Vorkurs frischt Ihr Schulwissen auf, vermittelt aber NICHT die späteren Studieninhalte. Die Inhalte des Vorkurses
Lernzielkontrolle Sekunda
 Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (15) Richtzeit: 25 Minuten 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) Manche
Lernzielkontrolle Sekunda Hilfsmittel: PSE, Taschenrechner 1 Stoffklassen / Bindungslehre / Zwischenmolekulare Kräfte (15) Richtzeit: 25 Minuten 1.1 Elektrische Leitfähigkeit verschiedener Stoffe (3) Manche
2. Schreiben Sie für folgende Atome das Bohrsche Atommodell auf. a) Aluminium
 Übungsaufgaben 1.Seminar Atome 1. Ergänzen Sie die nachfolgende Tabelle Elementsymbol Elementname Ordnungszahl Massenzahl Bsp. H Wasserstoff 1 1 He Au 7 56 2. Schreiben Sie für folgende Atome das Bohrsche
Übungsaufgaben 1.Seminar Atome 1. Ergänzen Sie die nachfolgende Tabelle Elementsymbol Elementname Ordnungszahl Massenzahl Bsp. H Wasserstoff 1 1 He Au 7 56 2. Schreiben Sie für folgende Atome das Bohrsche
Versuchen Sie, die folgende Aufgabe nur mithilfe des Periodensystems zu lösen.
 hemie Vorkurs öhere achschulen für Gesundheitsberufe 1 Der Aufbau der Atome Aufgabe 10 Versuchen Sie, die folgende Aufgabe nur mithilfe des Periodensystems zu lösen. Zeichnen Sie mit dem Bohrmodell und
hemie Vorkurs öhere achschulen für Gesundheitsberufe 1 Der Aufbau der Atome Aufgabe 10 Versuchen Sie, die folgende Aufgabe nur mithilfe des Periodensystems zu lösen. Zeichnen Sie mit dem Bohrmodell und
A. Allgemeine Chemie. 1 Aufbau der Materie 2 Trennverfahren für Stoffgemenge 3 Grundgesetze der Chemie 4 Atomaufbau 5 Periodensystem
 A. Allgemeine Chemie 1 Aufbau der Materie 2 Trennverfahren für Stoffgemenge 3 Grundgesetze der Chemie 4 Atomaufbau 5 Periodensystem Periodensystem der Elemente - PSE Historische Entwicklung Möglichkeiten
A. Allgemeine Chemie 1 Aufbau der Materie 2 Trennverfahren für Stoffgemenge 3 Grundgesetze der Chemie 4 Atomaufbau 5 Periodensystem Periodensystem der Elemente - PSE Historische Entwicklung Möglichkeiten
Atomverband mit festem Atomzahlverhältnis. Anzahl der Atome veränderlich? (bei festem Atomzahlverhältnis) Elektrisch Leitend?
 L3 1 Atomverband mit festem Atomzahlverhältnis. Ja Anzahl der Atome veränderlich? (bei festem Atomzahlverhältnis) Nein Ja Elektrisch Leitend? Nur in der Schmelze? Nein Ionenkristall Beliebig erweiterbar
L3 1 Atomverband mit festem Atomzahlverhältnis. Ja Anzahl der Atome veränderlich? (bei festem Atomzahlverhältnis) Nein Ja Elektrisch Leitend? Nur in der Schmelze? Nein Ionenkristall Beliebig erweiterbar
AK Labor. Ein kostenloses Computerprogramm macht Freude Info X000. Das Computerprogrammpaket. AK Labor
 Labor Das Computerprogrammpaket Labor Mehr Spaß an Chemie mit -Labor Ein kostenfreies Computerprogrammpaket für den Chemieunterricht eine Möglichkeit zum binnendifferenzierten Unterrichten, zur individuellen
Labor Das Computerprogrammpaket Labor Mehr Spaß an Chemie mit -Labor Ein kostenfreies Computerprogrammpaket für den Chemieunterricht eine Möglichkeit zum binnendifferenzierten Unterrichten, zur individuellen
1. Bedeutung der Oxidationszahlen
 1. Bedeutung der Oxidationszahlen Unterschiedliche Atome geben eine unterschiedliche Zahl an Elektronen ab: Dann hat das Atom eine positive Oxidationsstufe; das Atom ist mit weniger Elektronen als Protonen
1. Bedeutung der Oxidationszahlen Unterschiedliche Atome geben eine unterschiedliche Zahl an Elektronen ab: Dann hat das Atom eine positive Oxidationsstufe; das Atom ist mit weniger Elektronen als Protonen
Stereoisomerie. C 2 H 4 O 2 Schmelzpunkt 17 Grad Celcius
 3. Stereochemie Stereoisomerie Definition Isomerie: Als Isomere bezeichnet man Moleküle mit gleicher Summenformel, die sich jedoch in der Sequenz der Atome (Konstitutionsisomere) oder deren räumlichen
3. Stereochemie Stereoisomerie Definition Isomerie: Als Isomere bezeichnet man Moleküle mit gleicher Summenformel, die sich jedoch in der Sequenz der Atome (Konstitutionsisomere) oder deren räumlichen
Grundlagen der Allgemeinen und Anorganischen Chemie. Atome. Chemische Reaktionen. Verbindungen
 Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 92 Grundlagen der Allgemeinen und Anorganischen Chemie 3. Das Periodensystem der Elemente 93
Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 92 Grundlagen der Allgemeinen und Anorganischen Chemie 3. Das Periodensystem der Elemente 93
Eine Einführung in die Organische Chemie
 Kapitel 10 Eine Einführung in die Organische Chemie Abb. 10.1: Das erste e Molekül. Seit der Begründung der Naturwissenschaft Chemie haben die Stoffe der belebten Natur, von Organismen, einen besonderen
Kapitel 10 Eine Einführung in die Organische Chemie Abb. 10.1: Das erste e Molekül. Seit der Begründung der Naturwissenschaft Chemie haben die Stoffe der belebten Natur, von Organismen, einen besonderen
