Klassische Kraftstoffe
|
|
|
- Stephan Bayer
- vor 9 Jahren
- Abrufe
Transkript
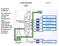
1 Klassische Kraftstoffe Folie 7: Benzin und Diesel die klassischen Kraftstoffe Die klassischen Kraftstoffe werden aus Erdöl gewonnen. Bedingt durch seine Entstehung aus organischem Material unter Luftabschluss besteht Erdöl aus Kohlenwasserstoffverbindungen. Dieses Wissen und Grundkenntnisse über Alkane, Isomerie, Mehrfachbindungen und ringförmige Strukturen werden hier vorausgesetzt. Die Abbildung oben gibt einen kurzen Überblick über die einzelnen Fraktionen. Benzin und Diesel sind hervorgehoben. Da Siedebereiche angegeben sind, können die Schüler schließen, dass es sich bei den Fraktionen um Gemenge handelt. Die Siedetemperaturunterschiede zwischen Benzin und Diesel zeigen, dass Diesel aus größeren, wahrscheinlich längerkettigen Kohlenwasserstoffen besteht. Vergleicht man die Viskosität von Benzin und Diesel, erhärtet sich die Vermutung. Diesel hat eine zehnmal höhere Viskosität als Benzin. Das bedeutet, dass die zwischenmolekularen Anziehungskräfte zwischen den größeren Dieselmolekülen höher sind, als die zwischen den kleineren Benzinmolekülen. Verfahren der Benzinherstellung Die Abbildungen in der Mitte zeigen die chemischen Umwandlungen zur Anpassung des Rohbenzins an die Erfordernisse im Motor. Abbildung Mitte links: Cracken: Der Anteil an Benzin, der durch Destillation aus dem Erdöl gewonnen wird, deckt in keiner Weise den weltweiten Bedarf. Deshalb gewinnt man auf chemischem Wege, durch Cracken, aus den zähflüssigen, hoch siedenden Rückständen weiteres Benzin. Thermisches Cracken: Heizöl S und Bitumen werden unter auf 600 C erhitzt; dabei entstehen niedrig siedende Benzinfraktionen und Gase. Dieses Verfahren wird zur Benzingewinnung nicht mehr angewandt, weil die Crackprodukte zu kurzkettig, unverzweigt und häufig ungesättigt (Olefine) sind. Zur Herstellung von Olefinen als Ausgangsprodukte für die Kunststoffindustrie wird es jedoch weiterhin durchgeführt. Bei den Verfahren des katalytischen Crackens handelt es sich v. a. um das Fluid Catalytic Cracking (FCC), das überwiegend zur Gewinnung von Benzin eingesetzt wird und das Hydrocracken, bei dem hochwertiges Gasöl und Kerosin entstehen. Fluid Catalytic Cracking (FCC): Bei Temperaturen bis 500 C werden unter Normaldruck die hoch siedenden Rückstände am Katalysator in benzintaugliche Verbindungen zerlegt. Eine ständige Regenerierung des Katalysators ist nötig, da dieser sich mit Kohlenstoff belädt. Die Verbrennung dieses Kohlenstoffs liefert aber wieder die Energie für die Erhitzung des Schweröls. Dieses Verfahren wird überwiegend zur Benzingewinnung angewandt (Festbett-Technologie). Bei Temperaturen bis 400 C werden unter Hochdruck ( bar) und Wasserstoffzufuhr am Katalysator die Rückstände in Cycloalkane zerlegt. Das Hydrocracken ist gut geeignet zur Gewinnung von hochwertigem Gasöl und Kerosin, nicht aber von Benzin, da die hoch klopffesten Aromaten durch Wasserstoffanlagerung in weniger klopffeste Cycloalkane umgewandelt werden. Was passiert nun eigentlich beim Cracken? Beim Cracken (to crack, engl. zerbrechen, aufspalten) werden langkettige Kohlenwasserstoffmoleküle in kürzere umgewandelt. Aus hoch siedenden Fraktionen entstehen niedrig siedende. Hierbei fallen größere Mengen kurzkettige, gasige und ungesättigte Kohlenwasserstoffe an, die durch Polymerisieren in einem Reaktor zu überwiegend verzweigten Iso-Alkanen verbunden werden. Es entsteht so genanntes Polymer-Benzin oder Polymerisat. Abbildung Mitte rechts: Reformieren: Beim Reformieren entsprechen die Ausgangsverbindungen aus dem Schwerbenzin zwar im Molekulargewicht denen, die man für Otto-Kraftstoffe braucht, sie haben aber zu niedrige Octanzahlen und müssen deshalb in Kohlenwasserstoffe mit hohen Octanzahlen, also in verzweigte und ringförmige Verbindungen, umgewandelt werden. Dazu wird das Schwerbenzin unter erhöhtem (15 50 bar) und erhöhter Temperatur (~500 C) in Gegenwart des Katalysators Platin zur Reaktion gebracht. Neben den klopffesteren Benzinbestandteilen fällt dabei auch Wasserstoff an. Kraftstoffe: Klassische Kraftstoffe 21
2 Zusammensetzung der Kraftstoffe: 1. Otto-Kraftstoff = Benzin oder Superbenzin Gemenge aus geraden, verzweigten und ringförmigen Kohlenwasserstoffen mit 5 9 C-Atomen. 2. Diesel-Kraftstoff Gemenge aus geraden, verzweigten und ringförmigen Kohlenwasserstoffen mit C-Atomen. Temperatur-Kenndaten in C Flammpunkt Ottokraftstoff 30 C bis 40 C Flammpunkt Dieselkraftstoff 58 C bis 65 C Zündtemperatur Ottokraftstoff 220 C bis 450 C Zündtemperatur Dieselkraftstoff 220 C bis 300 C Verbrennungstemperatur Gemisch Kraftstoff/Luft 2000 C bis 2500 C Iso-Alkane Iso-Paraffine n-alkane ROZ 0 CZ 56 n-paraffine Cyclo-Alkane Cycloparaffine Alkene Olefine Aromaten ROZ 126 CZ 0 Die Zündtemperatur der Kohlenwasserstoffe sinkt im Gegensatz zum Flammpunkt mit steigender Molekülmasse, weil bei den längeren Molekülketten durch die Bewegung bei der Erwärmung die Elektronenpaarbindungen leichter aufbrechen. Hierbei entstehen Kohlenwasserstoff- und Wasserstoffradikale, die leicht mit Sauerstoff reagieren. Die Zündtemperatur von Benzin liegt zwischen 220 und 460 C, die von Diesel zwischen 200 und 350 C. Die verschiedenen Kohlenwasserstoffverbindungen in Kraftstoffen Flammpunkt Die in der unteren Abbildung gezeigte Einstufung brennbarer Stoffe in Gefahrklassen ist zwar rechtlich durch die neue Betriebssicherheitsverordnung außer Kraft gesetzt. Da der Gesetzgeber aber für ihre Regelungsinhalte noch keinen Ersatz geschaffen hat, gelten die bisherigen Vorschriften nach wie vor als Stand der Sicherheitstechnik. Die Fachwelt ist sich darin einig, dass sie deshalb bis zum Erlass neuer Richtlinien/ Regeln weiterhin anzuwenden sind. Definition: Der Flammpunkt ist die Temperatur, bei der ein brennbarer Stoff gerade so viel Dämpfe entwikkelt, dass das Dampf-Luft-Gemisch durch eine 5 mm lange Zündflamme zum Aufflammen gebracht wird. Da die Flammtemperatur von Ottokraftstoff deutlich unter 21 C (von 45 C bis +10 C) liegt, besteht an Tankstellen die Gefahr der Entzündung (höchste Gefahrklasse, Warnhinweise). Hier kann man wieder den Zusammenhang zwischen Molekülgröße und Siedetemperatur herstellen. Benzin besteht aus kleineren Molekülen und hat eine niedrigere Siedetemperatur, wie schon aus der Erdölfraktion ersichtlich. Deshalb verdunstet Benzin bei niedrigen Temperaturen, d. h. bei üblichen Außentemperaturen ist ein Luft-Benzindampf-Verhältnis erreicht, das sich leicht entzündet. Diesel dagegen verdampft erst bei sehr viel höheren Temperaturen aufgrund seiner größeren Moleküle. Deswegen ist er erst bei höheren Temperaturen entflammbar (siehe Kopiervorlage 14: Siedetemperaturen und Flammpunkte von Kraftstoffen). Definition: Die Zündtemperatur ist die Temperatur, bei der sich ein entflammbares Gemisch ohne äußeren Zündfunken selbst entzündet. Eine weitere Kenngröße ist der Brennpunkt. Darunter versteht man die Temperatur, bei der eine Flüssigkeit so viele Dämpfe gebildet hat, dass sie bei Zündung nicht nur aufflammt (Flammpunkt) sondern weiter brennt. Diese Temperatur liegt nur ungefähr C über dem Flammpunkt. Folie 8: Zündung, Verbrennung und Klopfen Die Abbildungen links und rechts oben stellen die unterschiedlichen Zündvorgänge beim Ottomotor und beim Dieselmotor dar. Beim Ottomotor wird das Kraftstoff-Luftgemisch durch die Zündkerze gezündet. Beim Dieselmotor wird die Ansaugluft im Brennraum stark verdichtet. Dadurch erhitzt sie sich, so dass sich der eingespritzte Diesel-Kraftstoff darin nach möglichst kurzer Zeit (Zündverzug ~0,001 s) von selbst entzündet. Langkettige Moleküle im Diesel zerfallen unter dem und der Hitze im Brennraum in kleinere Molekülbruchstücke, die sich mit Sauerstoff verbinden. Bei ausreichender Sauerstoffzufuhr entstehen schließlich Kohlenstoffdioxid und Wasserdampf (siehe auch Zündtemperatur). 22 Kraftstoffe: Klassische Kraftstoffe
3 Abbildungen Mitte links und rechts: Sowohl beim Otto- als auch beim Diesel-Kraftstoff spielt das Zündverhalten im Motor eine wichtige Rolle. Angegeben wird dies jeweils durch einen Kennwert. Beim Benzin ist das die ROZ (Research Octanzahl, meist einfach Octanzahl), beim Diesel die CZ (Cetanzahl). Die Abbildungen zeigen die Referenzverbindungen. Klopffestigkeit von Otto- Kraftstoff (ROZ: Research Octanzahl) Referenzverbindungen: n-heptan: ROZ 0 V keine Klopffestigkeit Iso-Octan (2,2,4 Trimethylpentan): ROZ 100 V hohe Klopffestigkeit Ist an der Tanksäule eine Octanzahl von 95 angegeben bedeutet das, dass sich das Gemisch wie ein Gemenge aus 95 % Iso- Octan und 5 % Heptan verhält. Es sagt nichts über die tatsächliche Zusammensetzung des Kraftstoffes aus. Stoffe, die die Klopffestigkeit verbessern: Aromaten = ringförmige ungesättigte Kohlenwasserstoffe (Beispiel Benzol) haben eine hohe Klopffestigkeit. Seit 1998 darf wegen der krebserzeugenden Wirkung nur noch max. 1 % Benzol im Kraftstoff enthalten sein. früher Bleialkyle: Bleitetraethyl TEL (C 2 H 5 ) 4 Pb und Bleitetramethyl V heute verboten (unverbleites Benzin darf jedoch noch max. 0,013 g/l Blei enthalten). Bei zu hohem Bleigehalt im Benzin entsteht Bleistaub im Abgas, der sich an der Lambdasonde und an den aktiven Zentren des Katalysators absetzt und diese Komponenten unbrauchbar macht. Alkohole haben ebenfalls eine hohe Klopffestigkeit V in heutigen Otto-Kraftstoffen enthalten. Etha-Zusätze: MTBE (Methyl-Tertiär-Butylether) Zündwilligkeit von Diesel- Kraftstoff (CZ: Cetanzahl) Referenzverbindungen: Cetan = n-hexadecan CZ 100 V hohe Zündwilligkeit Methylnaphthalin CZ 0 V niedrige Zündwilligkeit Dieselkraftstoff mit der Cetanzahl 51 verhält sich wie ein Gemisch aus 51 % Cetan und 49 % Methylnaphthalin. Es sagt nichts über die tatsächliche Zusammensetzung des Kraftstoffes aus. CZ heutiger Diesel-Kraftstoffe: (Super Diesel) ( Shell V- Power und Aral Ultimate haben fast CZ 60) Zündbeschleuniger erhöhen die Zündwilligkeit (0,1 1 Vol.%) Bei Diesel-Kraftstoff ist die Zündunwilligkeit der ringförmigen Verbindungen ein Nachteil, bei Otto-Kraftstoff ein Vorteil (Klopffestigkeit). Die Qualität des Diesel-Kraftstoffes steigt also mit dem Anteil der geradkettigen Kohlenwasserstoffe, die des Otto-Kraftstoffes mit dem Anteil der verzweigten und ringförmigen Anteile. Beim Ottomotor muss sichergestellt sein, dass der Kraftstoff ausschließlich durch die Zündkerze gezündet wird. Jede andere Zündung verschlechtert die Leistung des Motors erheblich und führt zu rascherem Verschleiß. Beim Dieselmotor soll der Kraftstoff selbst zünden, d. h. er muss in einem weiten Außentemperaturspektrum besonders zündwillig sein. Abbildung links unten: Das Klopfen im Ottomotor entsteht (sehr vereinfacht, die komplizierten Vorgänge sind noch nicht in allen Einzelschritten geklärt), wenn während der gleichmäßigen Verbrennung an der Flammenfront das noch unverbrannte Gemisch unkontrolliert zu zünden beginnt. Die höhere Ausbreitungsgeschwindigkeit der Flamme, die mit diesem Vorgang einhergeht, führt zu einem schnelleren und stärkeren anstieg im Zylinder und damit zu einem stärkeren Verschleiß bei verminderter Leistung. Der Begriff Klopfen ist auf das im Fahrzeuginnenraum wahrnehmbare unruhige Motorlaufgeräusch zurückzuführen, das durch die nicht vollständig kontrollierte und ungleichmäßige Verbrennung entsteht. Kraftstoff-Luft-Gemenge Berechnung des theoretischen Luftbedarfs am Beispiel der Verbrennung von Iso-Octan (siehe Kopiervorlage 15: Zündung und Verbrennung von Kraftstoffen): Iso-Octan + Sauerstoff V Kohlenstoffdioxid + Wasser C 8 H ½ O 2 V 8 CO H 2 O M: 114 g/mol 32 g/mol 44 g/mol 18 g/mol m = 114 g 400 g 352 g 162 g 1 kg Iso-Octan = 8,77 Mol benötigen also (8,77 x 400 g =) 3,5 kg Sauerstoff. Luft enthält etwa 21 Vol.% Sauerstoff und 78 Vol.% Stickstoff. Multipliziert man diese Volumenverhältniszahlen jeweils mit der Molmasse von O 2 (32 g/mol) und N 2 (28 g/mol), so erhält man ein Gewichtsverhältnis von Sauerstoff zu Stickstoff in der Luft von 1 : 3,25. Die Luftmenge, die 3,5 kg Sauerstoff enthält, enthält also (3,25 x 3,5 =) 11,38 kg Stickstoff. Der theoretische Luftbedarf für die Verbrennung von 1 kg Iso-Octan beträgt also (3,5 kg + 11,38 kg =) 14,88 kg. Bei einer Dichte der Luft von 1,2 kg/m 3 entspricht das (14,88 : 1,2 =) 12,4 m 3 Luft. Da man Benzin in Volumeneinheiten misst, ist es wesentlich anschaulicher den Luftbedarf von 1 Liter Iso-Octan zu berechnen. Iso-Octan hat die Dichte 0,69 g/cm 3. 1 l Iso-Ooctan wiegt also 0,69 kg und benötigt damit (0,69 x 12,4 m 3 =) 8,6 m 3 Luft. Bei der Verbrennung im Motor herrschen keine idealen Bedingungen, außerdem ist die Luftdichte abhängig von der Höhe und der Temperatur. Darüber hinaus haben wir hier reines Iso-Octan als Rechenbeispiel genommen. Der tatsächliche Luftbedarf übersteigt also den hier berechneten theoretischen, so dass man gerundet sagen kann: Kraftstoffe: Klassische Kraftstoffe 23
4 1 l Ottokraftstoff braucht bei der Verbrennung ungefähr den Sauerstoff von 10 m 3 Luft. Abbildung rechts unten: Der tatsächliche Luftbedarf für die Verbrennung des Kraftstoffes im Motor unter den jeweiligen Bedingungen wird durch die so genannte Lambdasonde ermittelt, die den Sauerstoffgehalt der Abgase vor dem Eintritt in den Katalysator misst. Über ein Steuergerät regelt diese Messung die Zusammensetzung des Kraftstoff-Luft-Gemenges, das in den Brennraum geführt wird. Der Luftbedarf im Motor errechnet sich aus dem theoretischen Luftbedarf multipliziert mit der ermittelten Luftzahl λ. L (tatsächlicher Luftbedarf) = λ (Luftzahl) * L 0 (theoretischer Luftbedarf) Ist der Lambdawert klein, spricht man von einem fetten Gemisch (viel Kraftstoff im Verhältnis zur Luft), ist der Lambdawert groß, spricht man von einem mageren Gemisch (wenig Kraftstoff im Verhältnis zur Luft). λ = 1 entspricht dem theoretischen Luftbedarf bei der Verbrennung. Bei Verwendung magerer Kraftstoffgemische ist eine Kraftstoffeinsparung von bis zu 15 % möglich. Der λ-wert für Ottomotoren liegt zwischen 0,85 und 1,25, der für Dieselmotoren zwischen 1,2 und 2. Welche Wirkung sich durch die Veränderung der Luftzufuhr zu einem brennbaren Stoff erzielen lässt, kann man in der Schule am leichtesten am Gasbrenner demonstrieren. Bei nicht geöffneter Luftzufuhr wird der Brennstoff unvollständig verbrannt, was man an der Entwicklung unverbrannten Kohlenstoffs leicht erkennt (Abscheidung an Magnesiarinne), die Temperatur ist deutlich niedriger als bei geöffneter Luftzufuhr. Die nicht leuchtende Flamme ist erheblich heißer und brennt rußfrei. Lösungen zu den Kopiervorlagen Kopiervorlage 14: Siedetemperaturen und Flammpunkte von Kraftstoffen 1 a) Die Anziehungskraft der Moleküle untereinander steigt, d. h. ihre Kettenlänge (Oberfläche) und ihre Molekülmasse steigen. b) Die Fraktionen sind immer noch Gemenge von Kohlenwasserstoffen. 2. Auch die Viskosität hängt mit der Molekülgröße zusammen. Wie die Siedepunkte steigt auch der Zähigkeitsgrad mit wachsender Molekülgröße wegen der steigenden zwischenmolekularen Anziehungskraft. 3. Beim Cracken werden langkettige Moleküle aus dem schweren Heizöl in kürzerkettige Verbindungen gespalten, wie sie für das Benzin benötigt werden. Beim Reformieren werden geradkettige Moleküle in verzweigte oder ringförmige Moleküle umgewandelt, weil diese die Benzinqualität erhöhen. Beide Prozesse finden unter bei etwa 500 C an einem Katalysator statt. 4. Benzin hat einen Flammpunkt von <21 C, damit gehört es in die Gefahrklasse A I der nicht mit Wasser mischbaren brennbaren Flüssigkeiten. Solche Flüssigkeiten können bei den bei uns üblichen Temperaturen ohne weiteres durch einen kleinen Funken gezündet werden. Als Flammpunkt bezeichnet man die Temperatur, bei der ein brennbarer Stoff gerade so viel Dämpfe entwickelt hat, dass diese entzündet werden können. 5. Diesel bildet, aufgrund seiner höheren Siedetemperatur, erst bei höheren Temperaturen als Benzin Dampf-Luft-Gemische, die durch Funken entzündbar sind. Die Zündtemperatur ist die Temperatur, bei der ein entflammbares Gemisch von selbst zündet, ohne dass Funken von außen nötig sind. Die Zündtemperaturen beider Kraftstoffarten liegen über 200 C, bei dieser Temperatur zerbrechen die langkettigen Dieselmoleküle leichter als die kürzeren Benzinmoleküle. Die entstehenden Bruchstücke reagieren leichter spontan mit Sauerstoff als die Benzinbestandteile. Kopiervorlage 15: Zündung und Verbrennung von Kraftstoffen 1. Dieselmotoren haben keine Zündkerzen. Sie sind Selbstzünder. 2. Beim Dieselmotor wird die angesaugte Luft im Brennraum stark verdichtet. Sie erhitzt sich so stark, dass die Zündtemperatur des eingespritzten Diesel- Kraftstoffs überschritten wird und er sich von selbst entzündet. Beim Ottomotor wird das Benzin-Luft- Gemisch durch den Funken der Zündkerze entflammt. 3. a) n-heptan Iso-Octan oder 2,2,4 Trimethylpentan b) Vom Iso-Octan leitet sich die Octanzahl ab, die auf jeder Benzintanksäule angegeben ist, (z. B. ROZ 98 für Superbenzin). Je höher die Octanzahl ist, desto größer ist die Klopffestigkeit des Benzins. 4. Unter Klopfen versteht man eine Selbstzündung im Brennraum des Zylinders eines Ottomotors neben der Zündung durch die Zündkerze. Es kommt dadurch zu einer unregelmäßigen Verbrennung unter erhöhtem, die hörbare Geräusche verursacht (daher der Begriff Klopfen ), die Motorleistung mindert und den Verschleiß erhöht. 5. Ottokraftstoffe enthalten viele verzweigte und ringförmige Verbindungen, da diese zündunwillig sind, also die Klopffestigkeit erhöhen. Dieselkraftstoffe enthalten viele länger- und geradkettige Verbindungen, die wegen ihrer Zündwilligkeit die Selbstzündung ermöglichen. 6. a) Iso-Octan + Sauerstoff V Kohlenstoffdioxid + Wasser C 8 H ½ O 2 V 8 CO H 2 O M: 114 g/mol 32 g/mol 44 g/mol 18 g/mol m =114 g 400 g 352 g 162 g V 1 kg Iso-Octan = 8,77 Mol benötigen also (8,77 x 400 g =) 3,5 kg Sauerstoff. b) Die Luftmenge, die 3,5 kg Sauerstoff enthält, enthält 3,25 x 3,5 = 11,38 kg Stickstoff. 3,5 kg + 11,38 kg = 14,88 kg 14,88 x 1,2 = 17,856 m 3 Luft c) zur Verbrennung von 1 l Iso-Octan sind V (0,69 x 12,4 m 3 =) 8,6 m 3 Luft nötig. 24 Kraftstoffe: Klassische Kraftstoffe
5 Kopiervorlage 16: Versuche zu Verbrennung und Flammpunkt Versuch 1: Verbrennung von verschiedenen Kohlenwasserstoffen Beobachtungen: Man beobachtet eine zunehmende Rußentwicklung. Das Mengenverhältnis C : H verschiebt sich zugunsten des Kohlenstoffs: C H Pentan 1 2,4 Paraffinöl 1 2,11 Naphthalin 1 0,8 Ergebnisse: Die Kohlenwasserstoffe aus dem Erdöl unterscheiden sich stark in ihrem Kohlenstoffanteil im Verhältnis zum Wasserstoff. Je höher der Kohlenstoffanteil im Molekül, desto stärker ist die Rußentwicklung. Langkettige und besonders ringförmige Kohlenwasserstoffe haben einen hohen Kohlenstoffanteil. Versuch 2: Flammpunkt von Benzin und Diesel Beobachtungen: Benzin entzündet sich bei Zimmertemperatur, Dieselöl muss erwärmt werden, um die Flammtemperatur zu erreichen. Bei Zimmertemperatur kann man den brennenden Holzspan sogar im Diesel löschen. Ergebnisse: Die Flammtemperatur von Benzin ist niedriger, weil es aus Kohlenwasserstoffen mit geringerer Siedetemperatur besteht, die schneller verdampfen als die längerkettigen Moleküle des Diesels und daher bei geringerer Erwärmung zündfähige Gemische bilden. Kopiervorlage 17: Versuche zur Zündung von Kraftstoffen Versuch 3: Zündung durch adiabatische Kompression Beobachtungen: Das Benzin zündet mit einem heftigen Knall. Ergebnisse: Das Gemisch entzündet sich durch den ohne Funken, wie der Kraftstoff im Dieselmotor. Adiabatische Kompression = Kompression durch mechanische Arbeit, wobei die Energie im System in umgewandelt wird. Versuch 4: Zündung eines Benzin-Luft-Gemisches Beobachtungen: Bei zu geringer Benzinmenge kommt es nicht zur Zündung. Bei einem bestimmten Mischungsverhältnis gibt es eine heftige Explosion. Bei höherer Benzindampfkonzentration beobachtet man eine langsame Verbrennung. Ergebnisse: Die Reaktion ist am heftigsten, wenn Luft und Benzinmenge genau aufeinander abgestimmt sind (stöchiometrisches Verhältnis), wie bei Wasserstoffknallgas. Kraftstoffe: Klassische Kraftstoffe 25
CHemie am Auto. Klassische Kraftstoffe
 Klassische Kraftstoffe CHemie am Auto Folie 7: benzin und diesel die KlAssischEn KrAFtstoFFE fraktionierte destillation von erdöl Erdöl vakuumdestillation druck 600 c cracken Aus der chemikalienverordnung*
Klassische Kraftstoffe CHemie am Auto Folie 7: benzin und diesel die KlAssischEn KrAFtstoFFE fraktionierte destillation von erdöl Erdöl vakuumdestillation druck 600 c cracken Aus der chemikalienverordnung*
Fossile Rohstoffe. Erdöl
 Fraktionierte Destillation Die stufenweise Abtrennung einzelner Komponenten eines Stoffgemisches aufgrund der unterschiedlichen Siedepunkte wird als fraktionierte Destillation bezeichnet. 1 Fraktionierte
Fraktionierte Destillation Die stufenweise Abtrennung einzelner Komponenten eines Stoffgemisches aufgrund der unterschiedlichen Siedepunkte wird als fraktionierte Destillation bezeichnet. 1 Fraktionierte
Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung. Dr.-Ing. Klaus Herzog
 Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung Dr.-Ing. Klaus erzog Inhalt der Vorlesungsreihe Kraftfahrzeugantriebe Weltenergieressourcen und Energieträger Energiewandlung
Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung Dr.-Ing. Klaus erzog Inhalt der Vorlesungsreihe Kraftfahrzeugantriebe Weltenergieressourcen und Energieträger Energiewandlung
Verbrennungsrechnung als kinetischer Simulationsansatz
 Verbrennungsrechnung als kinetischer Simulationsansatz Simulationsansatz mit CHEMCAD Die Daten für Flammpunkt, Zündtemperatur, Explosionsgrenzen diverser Stoffe sind weitestgehend bekannt. Methoden zur
Verbrennungsrechnung als kinetischer Simulationsansatz Simulationsansatz mit CHEMCAD Die Daten für Flammpunkt, Zündtemperatur, Explosionsgrenzen diverser Stoffe sind weitestgehend bekannt. Methoden zur
Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung. Dr.-Ing. Klaus Herzog
 Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung Dr.-Ing. Klaus erzog Inhalt der Vorlesungsreihe Kraftfahrzeugantriebe Weltenergieressourcen und Energieträger Energiewandlung
Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung Dr.-Ing. Klaus erzog Inhalt der Vorlesungsreihe Kraftfahrzeugantriebe Weltenergieressourcen und Energieträger Energiewandlung
Eigenschaften, Vorkommen und Anwendungen einiger C 5 -C 10 -Alkane
 Eigenschaften, Vorkommen und Anwendungen einiger C 5 -C 10 -Alkane C 5 H 12 : Pentane (3 Konstitutions-Isomere) n-pentan: SdT 36 C SmT - 130 C Dichte 0,63g/cm 3 (20 C) F +, X n, N R 12-65-66-51/53 S (2)-9-16-29-33-61-62
Eigenschaften, Vorkommen und Anwendungen einiger C 5 -C 10 -Alkane C 5 H 12 : Pentane (3 Konstitutions-Isomere) n-pentan: SdT 36 C SmT - 130 C Dichte 0,63g/cm 3 (20 C) F +, X n, N R 12-65-66-51/53 S (2)-9-16-29-33-61-62
Fossile Rohstoffe. Kohlenwasserstoffe als Energieträger
 Kohlenwasserstoffe als Energieträger, Kohle, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da
Kohlenwasserstoffe als Energieträger, Kohle, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da
Kfz Katalysatoren / Lambdasonde. Von Kordula Hurka & Boris Fritz
 Kfz Katalysatoren / Lambdasonde Von Kordula Hurka & Boris Fritz Gliederung Historisches Abgase - Zusammensetzung Benzin - Verbrennungsprodukte - Schadstoffe Katalyse - Aufbau - Reaktion im KAT - Arten
Kfz Katalysatoren / Lambdasonde Von Kordula Hurka & Boris Fritz Gliederung Historisches Abgase - Zusammensetzung Benzin - Verbrennungsprodukte - Schadstoffe Katalyse - Aufbau - Reaktion im KAT - Arten
Alkane als Kraftstoffe
 Alkane als Kraftstoffe Du hast bereits gelernt, dass bei der fraktionierten Destillation Alkane erhalten werden können, die geeignet sind als Kraftstoffe eingesetzt zu werden. Unterschiedliche Motoren
Alkane als Kraftstoffe Du hast bereits gelernt, dass bei der fraktionierten Destillation Alkane erhalten werden können, die geeignet sind als Kraftstoffe eingesetzt zu werden. Unterschiedliche Motoren
Lernzirkel Erdöl. Name:
 Lernzirkel Erdöl Name: Namen der weiteren Gruppenmitglieder: 1 2 3 Inhalt des Lernzirkels: Station Name Inhalt 1 Cracken Experimental Durchführung des Crackens 2 Oktanzahl Internet Recherche Definition
Lernzirkel Erdöl Name: Namen der weiteren Gruppenmitglieder: 1 2 3 Inhalt des Lernzirkels: Station Name Inhalt 1 Cracken Experimental Durchführung des Crackens 2 Oktanzahl Internet Recherche Definition
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
Erdöl Anwendungen und Produkte. Erdöl-Vereinigung
 Erdöl Anwendungen und Produkte Erdöl-Vereinigung Ein vielseitiger Rohstoff Aus dem Rohstoff Erdöl entsteht nicht nur Benzin. In unserem Alltag benutzen wir, mehr oder weniger selbstverständlich, die verschiedensten
Erdöl Anwendungen und Produkte Erdöl-Vereinigung Ein vielseitiger Rohstoff Aus dem Rohstoff Erdöl entsteht nicht nur Benzin. In unserem Alltag benutzen wir, mehr oder weniger selbstverständlich, die verschiedensten
ENGLER-BUNTE-INSTITUT Bereich I: Chemische Energieträger - Brennstofftechnologie. Verfahrenstechnisches Praktikum (22999) am Engler-Bunte-Institut
 ENGLER-BUNTE-INSTITUT Bereich I: Chemische Energieträger - Brennstofftechnologie INHALT Verfahrenstechnisches Praktikum (22999) am Engler-Bunte-Institut - Versuch C3-1 STOFFDATEN VON BENZIN UND DIESEL
ENGLER-BUNTE-INSTITUT Bereich I: Chemische Energieträger - Brennstofftechnologie INHALT Verfahrenstechnisches Praktikum (22999) am Engler-Bunte-Institut - Versuch C3-1 STOFFDATEN VON BENZIN UND DIESEL
Verbrennungskraftmaschine
 Wirtz Luc 10TG2 Verbrennungskraftmaschine Eine Verbrennungskraftmaschine ist im Prinzip jede Art von Maschine, die mechanische Energie in einer Verbrennungskammer gewinnt. Die Kammer ist ein fester Bestandteil
Wirtz Luc 10TG2 Verbrennungskraftmaschine Eine Verbrennungskraftmaschine ist im Prinzip jede Art von Maschine, die mechanische Energie in einer Verbrennungskammer gewinnt. Die Kammer ist ein fester Bestandteil
man sagt : Phosphor + Sauerstoff reagieren Tetraphosphorzu dekaoxid
 Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Struktur-Eigenschafts-Beziehungen von unverzweigten Alkanen
 Struktur-Eigenschafts-Beziehungen von unverzweigten Alkanen Martin Trockel, Dorsten; Petra Wlotzka, Dortmund Niveau: Dauer: Sek. I/II 3 Unterrichtsstunden Kompetenzen: Die Schülerinnen und Schüler 1 können
Struktur-Eigenschafts-Beziehungen von unverzweigten Alkanen Martin Trockel, Dorsten; Petra Wlotzka, Dortmund Niveau: Dauer: Sek. I/II 3 Unterrichtsstunden Kompetenzen: Die Schülerinnen und Schüler 1 können
GEFAHRGUT 2011 Messe Essen
 GEFAHRGUT 2011 Messe Essen 02.02.2011 Experimental Vortrag Brände und Explosionen im Industrie- Werkstatt- und Laborbereich So schützen Sie sich richtig im Umgang mit Gefahrstoffen. Wer bestimmt unser
GEFAHRGUT 2011 Messe Essen 02.02.2011 Experimental Vortrag Brände und Explosionen im Industrie- Werkstatt- und Laborbereich So schützen Sie sich richtig im Umgang mit Gefahrstoffen. Wer bestimmt unser
Gruppe 02: Chemischer Flammenwerfer
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 02: Chemischer Flammenwerfer Reaktion: Chemikalien: Eingesetzte Stoffe
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 02: Chemischer Flammenwerfer Reaktion: Chemikalien: Eingesetzte Stoffe
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09. Name: Sarah Henkel Datum:
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 25.11.2008 Zeitbedarf Vorbereitung: 5 Minuten Durchführung:
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 25.11.2008 Zeitbedarf Vorbereitung: 5 Minuten Durchführung:
Fossile Rohstoffe. Kohlenwasserstoffe als Energieträger
 nwasserstoffe als Energieträger Erdöl,, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da sie
nwasserstoffe als Energieträger Erdöl,, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da sie
Der Dieselmotor wurde 1892 von Rudolf Diesel erfunden. Es gibt zwei und 4 Takt- Motoren. In der Zeichnung sieht man einen 4-Taktmotor.
 Der Dieselmotor 22.Mai 2004 Referat von Jasmin Koch Der Dieselmotor wurde 1892 von Rudolf Diesel erfunden. Es gibt zwei und 4 Takt- Motoren. In der Zeichnung sieht man einen 4-Taktmotor. 1. Takt - Luft
Der Dieselmotor 22.Mai 2004 Referat von Jasmin Koch Der Dieselmotor wurde 1892 von Rudolf Diesel erfunden. Es gibt zwei und 4 Takt- Motoren. In der Zeichnung sieht man einen 4-Taktmotor. 1. Takt - Luft
Struktur-Eigenschafts-Beziehungen von unverzweigten Alkanen
 1 von 16 Struktur-Eigenschafts-Beziehungen von unverzweigten Alkanen Martin Trockel, Dorsten; Petra Wlotzka, Dortmund Niveau: Dauer: Sek. I/II 3 Unterrichtsstunden Kompetenzen: Die Schülerinnen und Schüler*
1 von 16 Struktur-Eigenschafts-Beziehungen von unverzweigten Alkanen Martin Trockel, Dorsten; Petra Wlotzka, Dortmund Niveau: Dauer: Sek. I/II 3 Unterrichtsstunden Kompetenzen: Die Schülerinnen und Schüler*
2. Reinigung von Begleitstoffen (Sand, Wasser [u.a. auch Salzwasser (Korrosionsfaktor, Transportkosten (hohes Gewicht)])
![2. Reinigung von Begleitstoffen (Sand, Wasser [u.a. auch Salzwasser (Korrosionsfaktor, Transportkosten (hohes Gewicht)]) 2. Reinigung von Begleitstoffen (Sand, Wasser [u.a. auch Salzwasser (Korrosionsfaktor, Transportkosten (hohes Gewicht)])](/thumbs/79/79686479.jpg) 1 15.12.2005 0.1 Erdöl 0.1.1 Erdöl-Transport und Aufbereitung 1. Fundstelle 2. Reinigung von Begleitstoffen (Sand, Wasser [u.a. auch Salzwasser (Korrosionsfaktor, Transportkosten (hohes Gewicht)]) 3. Transport
1 15.12.2005 0.1 Erdöl 0.1.1 Erdöl-Transport und Aufbereitung 1. Fundstelle 2. Reinigung von Begleitstoffen (Sand, Wasser [u.a. auch Salzwasser (Korrosionsfaktor, Transportkosten (hohes Gewicht)]) 3. Transport
Übung 1. Göksel Özuylasi Tel.: Torsten Methling Tel.
 Göksel Özuylasi Email: [email protected] Tel.: 0711 6862 8098 Torsten Methling Email: [email protected] Tel.: 0711 6862 277 WS 2013/14 Übung - Einführung in die Verbrennung - Özuylasi, Methling
Göksel Özuylasi Email: [email protected] Tel.: 0711 6862 8098 Torsten Methling Email: [email protected] Tel.: 0711 6862 277 WS 2013/14 Übung - Einführung in die Verbrennung - Özuylasi, Methling
Verbrennungen und ihre Folgen. Unterrichtsreihe CHiK Dirk Dillschneider, RL
 Verbrennungen und ihre Folgen Arbeitsaufträge: (auf den Block) Was fällt Euch ganz spontan beim Anblick dieser Bilder ein? Macht Euch kurze Notizen! weitere Arbeitsaufträge (Gruppenarbeit) Könnt ihr
Verbrennungen und ihre Folgen Arbeitsaufträge: (auf den Block) Was fällt Euch ganz spontan beim Anblick dieser Bilder ein? Macht Euch kurze Notizen! weitere Arbeitsaufträge (Gruppenarbeit) Könnt ihr
Wissenschaftliche Dienste. Sachstand. Benzolgehalt von Kraftstoffen Deutscher Bundestag WD /18
 Benzolgehalt von Kraftstoffen 2018 Deutscher Bundestag Seite 2 Benzolgehalt von Kraftstoffen Aktenzeichen: Abschluss der Arbeit: 26.6.2018 Fachbereich: WD 8: Umwelt, Naturschutz, Reaktorsicherheit, Bildung
Benzolgehalt von Kraftstoffen 2018 Deutscher Bundestag Seite 2 Benzolgehalt von Kraftstoffen Aktenzeichen: Abschluss der Arbeit: 26.6.2018 Fachbereich: WD 8: Umwelt, Naturschutz, Reaktorsicherheit, Bildung
Destillation von Rohöl. + Rohbenzine + Petroleum
 Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 28.09.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Destillation von Rohöl Gruppe
Anna-Lena Eicke Philipps-Universität Marburg Organisch-Chemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 28.09.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Destillation von Rohöl Gruppe
Versuch V1 - Viskosität, Flammpunkt, Dichte
 Versuch V1 - Viskosität, Flammpunkt, Dichte 1.1 Bestimmung der Viskosität Grundlagen Die Viskosität eines Fluids ist eine Stoffeigenschaft, die durch den molekularen Impulsaustausch der einzelnen Fluidpartikel
Versuch V1 - Viskosität, Flammpunkt, Dichte 1.1 Bestimmung der Viskosität Grundlagen Die Viskosität eines Fluids ist eine Stoffeigenschaft, die durch den molekularen Impulsaustausch der einzelnen Fluidpartikel
Themen des Experimentalvortrages
 adfsdfsdfsfsfsdfsdff Handout zum Experimentalvortrag Gefahrstoffe live Referent: Pascal Heger Themen des Experimentalvortrages Schadensereignisse und ihre direkten Folgen Indirekte Folgeschäden Das Gefahrendreieck
adfsdfsdfsfsfsdfsdff Handout zum Experimentalvortrag Gefahrstoffe live Referent: Pascal Heger Themen des Experimentalvortrages Schadensereignisse und ihre direkten Folgen Indirekte Folgeschäden Das Gefahrendreieck
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Organische Chemie II. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
MINERALÖL-ANWENDUNGSTECHNIK
 AVIA Heizöl EL schwefelarm Blatt 31.3-12.11 - Heizöl DIN 51 603-1 EL schwefelarm Dichte bei 15 C kg/m³ - 860 DIN EN ISO 12185 Brennwert MJ/kg 45,4 - DIN 51900-1 und DIN 51900-2 Flammpunkt (PM) C über 55
AVIA Heizöl EL schwefelarm Blatt 31.3-12.11 - Heizöl DIN 51 603-1 EL schwefelarm Dichte bei 15 C kg/m³ - 860 DIN EN ISO 12185 Brennwert MJ/kg 45,4 - DIN 51900-1 und DIN 51900-2 Flammpunkt (PM) C über 55
Struktur-Eigenschafts-Beziehungen von unverzweigten Alkanen
 Struktur-Eigenschafts-Beziehungen von unverzweigten Alkanen Martin Trockel, Dorsten; Petra Wlotzka, Dortmund Niveau: Dauer: Sek. I/II 3 Unterrichtsstunden Kompetenzen: Die Schülerinnen und Schüler 1 können
Struktur-Eigenschafts-Beziehungen von unverzweigten Alkanen Martin Trockel, Dorsten; Petra Wlotzka, Dortmund Niveau: Dauer: Sek. I/II 3 Unterrichtsstunden Kompetenzen: Die Schülerinnen und Schüler 1 können
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden?
 Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Vom Heizöl zum Superbenzin Reinigen und Umwandeln durch Cracken und Veredeln
 Unterrichtsblatt zu dem didaktischen Film Vom Heizöl zum Superbenzin Reinigen und Umwandeln durch Cracken und Veredeln WBF-Unterrichtsfilm, ca. 16 Minuten, Farbe 16mm (Lichtton) oder Video (VHS) Adressatengruppen
Unterrichtsblatt zu dem didaktischen Film Vom Heizöl zum Superbenzin Reinigen und Umwandeln durch Cracken und Veredeln WBF-Unterrichtsfilm, ca. 16 Minuten, Farbe 16mm (Lichtton) oder Video (VHS) Adressatengruppen
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Versuch: Thermisches Cracken von Paraffinöl
 Philipps-Universität Marburg 21.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2, Alkane Versuch: Thermisches Cracken von Paraffinöl
Philipps-Universität Marburg 21.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2, Alkane Versuch: Thermisches Cracken von Paraffinöl
Stellen Sie für die folgenden Reaktionen die Gleichgewichtskonstante K p auf: 1/2O 2 + 1/2H 2 OH H 2 + 1/2O 2 H 2 O
 Klausur H2004 (Grundlagen der motorischen Verbrennung) 2 Aufgabe 1.) Stellen Sie für die folgenden Reaktionen die Gleichgewichtskonstante K p auf: 1/2O 2 + 1/2H 2 OH H 2 + 1/2O 2 H 2 O Wie wirkt sich eine
Klausur H2004 (Grundlagen der motorischen Verbrennung) 2 Aufgabe 1.) Stellen Sie für die folgenden Reaktionen die Gleichgewichtskonstante K p auf: 1/2O 2 + 1/2H 2 OH H 2 + 1/2O 2 H 2 O Wie wirkt sich eine
Arbeitnehmerschutz und EX-Zonen eine Herausforderung für den Instandhalter Ing. Johann Kreimer
 Explosionsfähige Atmosphäre (exat) Gemisch aus brennbaren Gasen, Dämpfen, Nebeln oder Stäuben innerhalb der Explosionsgrenzen und oxidativer Atmosphäre, z.b. Luft Arbeitnehmerschutz und EX-Zonen eine Herausforderung
Explosionsfähige Atmosphäre (exat) Gemisch aus brennbaren Gasen, Dämpfen, Nebeln oder Stäuben innerhalb der Explosionsgrenzen und oxidativer Atmosphäre, z.b. Luft Arbeitnehmerschutz und EX-Zonen eine Herausforderung
Dieselmotor Eigenschaften
 Motoren in der Feuerwehr Benzinmotor Feuerlöschboote Kettensägen Trennschleifer Lüfter Feuerwehrfahr- zeuge Leicht Mittel Super Feuerwehrfahr- zeuge Leicht Tragkraftspritzen Stromerzeuger Hydraulik- aggregate
Motoren in der Feuerwehr Benzinmotor Feuerlöschboote Kettensägen Trennschleifer Lüfter Feuerwehrfahr- zeuge Leicht Mittel Super Feuerwehrfahr- zeuge Leicht Tragkraftspritzen Stromerzeuger Hydraulik- aggregate
Thermodynamik Thermodynamische Systeme
 Thermodynamik Thermodynamische Systeme p... Druck V... Volumen T... Temperatur (in Kelvin) U... innere Energie Q... Wärme W... Arbeit Idealisierung; für die Betrachtung spielt die Temperatur eine entscheidende
Thermodynamik Thermodynamische Systeme p... Druck V... Volumen T... Temperatur (in Kelvin) U... innere Energie Q... Wärme W... Arbeit Idealisierung; für die Betrachtung spielt die Temperatur eine entscheidende
Kerzen - Lichter der Gemütlichkeit oder offene Zündquelle
 Brennende Kerzen dienen in der heutigen Zeit kaum noch als eigentliche Lichtquelle, sondern sind ein Symbol von Gemütlich- oder Feierlichkeit. Wenn wir eine Kerze anzünden, geschieht das frei von Furcht
Brennende Kerzen dienen in der heutigen Zeit kaum noch als eigentliche Lichtquelle, sondern sind ein Symbol von Gemütlich- oder Feierlichkeit. Wenn wir eine Kerze anzünden, geschieht das frei von Furcht
Verbrennung einer Kerze
 Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Kapitel 02: Erdgas und Erdöl
 Kapitel 02: Erdgas und Erdöl 1 Kapitel 02: Erdgas und Erdöl Kapitel 02: Erdgas und Erdöl 2 Inhalt Kapitel 02: Erdgas und Erdöl...1 Inhalt... 2 Einige Produkte aus Erdöl...3 Erdöl ist nicht gleich Erdöl...3
Kapitel 02: Erdgas und Erdöl 1 Kapitel 02: Erdgas und Erdöl Kapitel 02: Erdgas und Erdöl 2 Inhalt Kapitel 02: Erdgas und Erdöl...1 Inhalt... 2 Einige Produkte aus Erdöl...3 Erdöl ist nicht gleich Erdöl...3
 Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Untersuche die Kerzenflamme sowie die Vorgänge, die beim Verbrennen des Kerzenwachses ablaufen.
 Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P7154200) 2.10 Die Kerzenflamme Experiment von: Seb Gedruckt: 24.03.2014 11:14:37 intertess (Version 13.12 B214, Export 2000)
Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P7154200) 2.10 Die Kerzenflamme Experiment von: Seb Gedruckt: 24.03.2014 11:14:37 intertess (Version 13.12 B214, Export 2000)
Erdöl. "... ist eine nutzlose Absonderung der Erde eine klebrige Flüssigkeit, die stinkt und in. keiner Weise verwendet werden kann.
 Erdöl "... ist eine nutzlose Absonderung der Erde eine klebrige Flüssigkeit, die stinkt und in keiner Weise verwendet werden kann." ('Akademie der Wissenschaften' in St. Petersburg 1806) Erdöl, schwarzes
Erdöl "... ist eine nutzlose Absonderung der Erde eine klebrige Flüssigkeit, die stinkt und in keiner Weise verwendet werden kann." ('Akademie der Wissenschaften' in St. Petersburg 1806) Erdöl, schwarzes
Illustration des Crack-Prozesses am Beispiel der Pentan-Pyrolyse
 Vorlesung 9. Erdölverarbeitung. (Vollhardt, 3. Aufl., S. 92-95, 4. Aufl., S. 108-111; art, S. 127-129; Buddrus, S.87-88) Nach Entfernung von Wasser, Feststoffen und Erdgas (Erhitzen) erfolgt eine fraktionierte
Vorlesung 9. Erdölverarbeitung. (Vollhardt, 3. Aufl., S. 92-95, 4. Aufl., S. 108-111; art, S. 127-129; Buddrus, S.87-88) Nach Entfernung von Wasser, Feststoffen und Erdgas (Erhitzen) erfolgt eine fraktionierte
FWU Schule und Unterricht. FWU-Klassiker Erdöl Ein Rohstoff wird veredelt. FWU das Medieninstitut der Länder
 FWU Schule und Unterricht DVD 46 02480 14 min, Farbe FWU-Klassiker Erdöl Ein Rohstoff wird veredelt FWU das Medieninstitut der Länder 00 Lernziele nach Lehrplänen und Schulbüchern Erkenntnis, dass Erdöl
FWU Schule und Unterricht DVD 46 02480 14 min, Farbe FWU-Klassiker Erdöl Ein Rohstoff wird veredelt FWU das Medieninstitut der Länder 00 Lernziele nach Lehrplänen und Schulbüchern Erkenntnis, dass Erdöl
Verbrennung einer Kerze
 Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
(ohne Übergang der Wärme)
 Adiabatische Zustandsänderungen Adiabatische Zustandsänderungen δq= 0 (ohne Übergang der Wärme) Adiabatischer Prozess (Q = const) Adiabatisch = ohne Wärmeaustausch, Temperatur ändert sich bei Expansion/Kompression
Adiabatische Zustandsänderungen Adiabatische Zustandsänderungen δq= 0 (ohne Übergang der Wärme) Adiabatischer Prozess (Q = const) Adiabatisch = ohne Wärmeaustausch, Temperatur ändert sich bei Expansion/Kompression
Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen. Es ist nur eine Antwortmöglichkeit richtig!
 Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen Es ist nur eine Antwortmöglichkeit richtig! 1. Welche Stoffe dehnen sich bei der Erwärmung aus? Nur flüssige
Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen Es ist nur eine Antwortmöglichkeit richtig! 1. Welche Stoffe dehnen sich bei der Erwärmung aus? Nur flüssige
FwDV 2 Truppmannausbildung Teil 1 Brennen und Löschen. LM Steffen Kaspar LB 2
 FwDV 2 Truppmannausbildung Teil 1 Brennen und Löschen Themen des Unterrichts Verbrennungsvoraussetzungen Verbrennungsvorgang (Oxidation) Brandklassen Verbrennungsprodukte (Atemgifte) Hauptlöschwirkungen
FwDV 2 Truppmannausbildung Teil 1 Brennen und Löschen Themen des Unterrichts Verbrennungsvoraussetzungen Verbrennungsvorgang (Oxidation) Brandklassen Verbrennungsprodukte (Atemgifte) Hauptlöschwirkungen
Eigenschaften der brennbaren Stoffe
 Eigenschaften der brennbaren Stoffe TT.MM.JJJJ Referentenunterlage Eigenschaften der brennbaren Stoffe Inhalt: 1. Begrüßung 2. Kapitelpräsentation 3. Sicherheitstechnische Kennzahlen von entzündbaren Flüssigkeiten
Eigenschaften der brennbaren Stoffe TT.MM.JJJJ Referentenunterlage Eigenschaften der brennbaren Stoffe Inhalt: 1. Begrüßung 2. Kapitelpräsentation 3. Sicherheitstechnische Kennzahlen von entzündbaren Flüssigkeiten
Verbrennungstechnik. 1. Brennstoffe. 1.Brennstoffe. 2.Heizwert. 2.1 Oberer Heizwert 2.2 Unterer Heizwert. 3.Verbrennungsvorgang
 Verbrennungstechnik 1.Brennstoffe.Heizwert.1 Oberer Heizwert. Unterer Heizwert.Verbrennungsvorgang.1 Verbrennungsgleichungen 4.Ermittlung von Sauerstoff-, Luftbedarf u. Rauchgasmenge 5.Verbrennungskontrolle
Verbrennungstechnik 1.Brennstoffe.Heizwert.1 Oberer Heizwert. Unterer Heizwert.Verbrennungsvorgang.1 Verbrennungsgleichungen 4.Ermittlung von Sauerstoff-, Luftbedarf u. Rauchgasmenge 5.Verbrennungskontrolle
Rund um den Motor V 1.0
 B C D Gruppe 1 Rund um den Motor V 1.0 rbeitsauftrag für die Stammgruppe Ihr solltet euch innerhalb von 10 Minuten einen kurzen Überblick über das Thema machen und euch entscheiden wer Experte für welches
B C D Gruppe 1 Rund um den Motor V 1.0 rbeitsauftrag für die Stammgruppe Ihr solltet euch innerhalb von 10 Minuten einen kurzen Überblick über das Thema machen und euch entscheiden wer Experte für welches
Thema: Alternative Antriebsformen für Kraftfahrzeuge
 Thema: Alternative Antriebsformen für Kraftfahrzeuge vorgelegt von Name: Cem Koc Inhaltsverzeichnis 1. Einleitung 3 1. Begründung des Themas 3 2. Hauptteil 3 1. Benzin, bald Vergangenheit? 3 2. Neue Energieformen
Thema: Alternative Antriebsformen für Kraftfahrzeuge vorgelegt von Name: Cem Koc Inhaltsverzeichnis 1. Einleitung 3 1. Begründung des Themas 3 2. Hauptteil 3 1. Benzin, bald Vergangenheit? 3 2. Neue Energieformen
Warum ist Feuer nützlich und warum sind Flammen heiß?
 Warum ist Feuer nützlich und warum sind Flammen heiß? Professor Dr.-Ing. Dieter Brüggemann KinderUniversität Bayreuth 1. Juli 2009 Wozu nutzen wir Feuer? Wir nutzen Feuer, um zu beleuchten Quelle: Wikipedia
Warum ist Feuer nützlich und warum sind Flammen heiß? Professor Dr.-Ing. Dieter Brüggemann KinderUniversität Bayreuth 1. Juli 2009 Wozu nutzen wir Feuer? Wir nutzen Feuer, um zu beleuchten Quelle: Wikipedia
Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen. Es ist nur eine Antwortmöglichkeit richtig!
 Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen Es ist nur eine Antwortmöglichkeit richtig! 1. Welche Stoffe dehnen sich bei Erwärmung aus? Nur flüssige Stoffe
Hessische Landesfeuerwehrschule Fragenkatalog zur Hessischen Feuerwehrleistungsübung Brennen Es ist nur eine Antwortmöglichkeit richtig! 1. Welche Stoffe dehnen sich bei Erwärmung aus? Nur flüssige Stoffe
Versuch 6 Bestimmung des Flammpunktes und des Brennpunktes im offenen Tiegel nach Cleveland, ISO Für Flammpunkte über 79 C
 Versuch 6 Bestimmung des Flammpunktes und des Brennpunktes im offenen Tiegel nach Cleveland, ISO 2592. Für Flammpunkte über 79 C Versuch 6 Bestimmung des Flammpunktes und des Brennpunktes im offenen Tiegel
Versuch 6 Bestimmung des Flammpunktes und des Brennpunktes im offenen Tiegel nach Cleveland, ISO 2592. Für Flammpunkte über 79 C Versuch 6 Bestimmung des Flammpunktes und des Brennpunktes im offenen Tiegel
Die Kerzenflamme (Artikelnr.: P )
 Lehrer-/Dozentenblatt Die Kerzenflamme (Artikelnr.: P7154200) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema: Luft und Verbrennungen
Lehrer-/Dozentenblatt Die Kerzenflamme (Artikelnr.: P7154200) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema: Luft und Verbrennungen
2.1 Massenbilanz bei chemischen Stoffumwandlungen. 2.2 Energiebilanz bei chemischen Stoffumwandlungen
 Inhalt von Kapitel 2 2.1-0 2. Chemische Stoffumwandlungen 2.1 Massenbilanz bei chemischen Stoffumwandlungen 2.2 Energiebilanz bei chemischen Stoffumwandlungen 2.2.1 Energiebilanz 2.2.2 Die Bildungsenthalpie
Inhalt von Kapitel 2 2.1-0 2. Chemische Stoffumwandlungen 2.1 Massenbilanz bei chemischen Stoffumwandlungen 2.2 Energiebilanz bei chemischen Stoffumwandlungen 2.2.1 Energiebilanz 2.2.2 Die Bildungsenthalpie
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
Übung 3. Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen (Teil 2) Verständnis des thermodynamischen Gleichgewichts
 Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen (Teil 2) adiabatische Flammentemperatur Verständnis des thermodynamischen Gleichgewichts Definition von K X, K c, K p Berechnung von K
Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen (Teil 2) adiabatische Flammentemperatur Verständnis des thermodynamischen Gleichgewichts Definition von K X, K c, K p Berechnung von K
Je nach Prozessführung unterscheidet man zwischen Verbrennungsmotoren mit äußerer und mit innerer Gemischbildung.
 1.3 Einteilung nach Art der Gemischbildung Je nach Prozessführung unterscheidet man zwischen Verbrennungsmotoren mit äußerer und mit innerer Gemischbildung. Arbeitsweise des Hubkolbenmotors mit äußerer
1.3 Einteilung nach Art der Gemischbildung Je nach Prozessführung unterscheidet man zwischen Verbrennungsmotoren mit äußerer und mit innerer Gemischbildung. Arbeitsweise des Hubkolbenmotors mit äußerer
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
HEGERs. HEGERs Haus der Technik, Gefahrstoffe live erleben! Experimentalvortrag. HEGER Schulungen
 HEGERs - Gefahrstoffe live erleben! HEGER Schulungen Tel.: 0571 / 75 649 Mobil: 0177 25 98 947 [email protected] Hebünte 12 32457 Porta Westfalica Experimentalvortag: Was erwartet Sie? Erleben,
HEGERs - Gefahrstoffe live erleben! HEGER Schulungen Tel.: 0571 / 75 649 Mobil: 0177 25 98 947 [email protected] Hebünte 12 32457 Porta Westfalica Experimentalvortag: Was erwartet Sie? Erleben,
Grundlagen der Wärmelehre
 Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Übungsaufgaben zur Vorlesung Kraft- und Arbeitsmaschinen
 Übungsaufgaben zur Vorlesung Kraft- und Arbeitsmaschinen Aufgabe 1.3-1 Ein Heizgerät verbraucht 5 m³/h Leuchtgas (H u = 21018 kj/m³) und erwärmt 850 dm³/h Wasser um 30 C. Die Wärmekapazitä t des Wassers
Übungsaufgaben zur Vorlesung Kraft- und Arbeitsmaschinen Aufgabe 1.3-1 Ein Heizgerät verbraucht 5 m³/h Leuchtgas (H u = 21018 kj/m³) und erwärmt 850 dm³/h Wasser um 30 C. Die Wärmekapazitä t des Wassers
EINSATZ UND POTENTIAL EINER EXTREM ABGEMAGERTEN, HOMOGENEN VERBRENNUNG
 EINSATZ UND POTENTIAL EINER EXTREM ABGEMAGERTEN, HOMOGENEN VERBRENNUNG REDUZIERUNG DER NO X - EMISSION UND DES KRAFTSTOFFVERBRAUCHES 08.11.2012 von Norman Kamran und Torben Carstensen Gliederung 2 1. Einleitung
EINSATZ UND POTENTIAL EINER EXTREM ABGEMAGERTEN, HOMOGENEN VERBRENNUNG REDUZIERUNG DER NO X - EMISSION UND DES KRAFTSTOFFVERBRAUCHES 08.11.2012 von Norman Kamran und Torben Carstensen Gliederung 2 1. Einleitung
Summenformel Elektronenstrichformel Name Siedepunkt
 Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Glossar. Elektronegativität Wasserstoff 2,2 Kohlenstoff 2,5 Stickstoff 3,1 Sauerstoff 3,5 Fluor 4,1
 Glossar Brennbarkeit: Die Brennbarkeit gibt das Brandverhalten eines Stoffes nach der Zündung, gemessen an der Brenngeschwindigkeit und der Wärmeentwicklungsrate, an. Stoffe werden nach ihrer Brennbarkeit
Glossar Brennbarkeit: Die Brennbarkeit gibt das Brandverhalten eines Stoffes nach der Zündung, gemessen an der Brenngeschwindigkeit und der Wärmeentwicklungsrate, an. Stoffe werden nach ihrer Brennbarkeit
Abituraufgaben Alkane 1980/II/3 1981/II/1
 Abituraufgaben Alkane 1980/II/3 3 Skizzieren Sie das Energiediagramm für die Konformationen des n-butans bei der Rotation (Rotationswinkel 0 bis 180 ) um die Bindung zwischen dem zweiten und dritten Kohlenstoffatom.
Abituraufgaben Alkane 1980/II/3 3 Skizzieren Sie das Energiediagramm für die Konformationen des n-butans bei der Rotation (Rotationswinkel 0 bis 180 ) um die Bindung zwischen dem zweiten und dritten Kohlenstoffatom.
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 2.
 Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
BRANDSCHUTZ. Landesverband Bayern und Sachsen der gewerblichen LVBGBerufsgenossenschaften. Brandschutz
 Brandschutz WAS IST VERBRENNUNG? Verbrennung ist die Reaktion eines brennbaren Stoffes mit Sauerstoff. Damit eine Verbrennung möglich ist, müssen drei Vorraussetzungen gegeben sein: Zündquelle Brennbarer
Brandschutz WAS IST VERBRENNUNG? Verbrennung ist die Reaktion eines brennbaren Stoffes mit Sauerstoff. Damit eine Verbrennung möglich ist, müssen drei Vorraussetzungen gegeben sein: Zündquelle Brennbarer
Antriebsarten Lehrerinformation
 Lehrerinformation 1/10 Arbeitsauftrag Wie funktioniert ein Auto eigentlich? Die SuS lernen den Antrieb (Motor) kennen. Sie lernen, was der Unterschied zwischen einem Diesel- und einem Benzinmotor ist.
Lehrerinformation 1/10 Arbeitsauftrag Wie funktioniert ein Auto eigentlich? Die SuS lernen den Antrieb (Motor) kennen. Sie lernen, was der Unterschied zwischen einem Diesel- und einem Benzinmotor ist.
Chemische Verbrennung
 Christopher Rank Sommerakademie Salem 2008 Gliederung Die chemische Definition Voraussetzungen sgeschwindigkeit Exotherme Reaktion Reaktionsenthalpie Heizwert Redoxreaktionen Bohrsches Atommodell s Elektrochemie:
Christopher Rank Sommerakademie Salem 2008 Gliederung Die chemische Definition Voraussetzungen sgeschwindigkeit Exotherme Reaktion Reaktionsenthalpie Heizwert Redoxreaktionen Bohrsches Atommodell s Elektrochemie:
Heizöl ist ein flüssiger Brennstoff und wird nach Ausgangsprodukt in. - Teeröle
 Zusammenfassung zur Vorlesung Optimierte Gebäudetechnik / Teil Wärmeversorgungssysteme ab 3.KW/00 Heizöl ist ein flüssiger Brennstoff und wird nach Ausgangsprodukt in zwei Hauptgruppen eingeteilt: - Mineralische
Zusammenfassung zur Vorlesung Optimierte Gebäudetechnik / Teil Wärmeversorgungssysteme ab 3.KW/00 Heizöl ist ein flüssiger Brennstoff und wird nach Ausgangsprodukt in zwei Hauptgruppen eingeteilt: - Mineralische
Fragen Leistungsnachweis 2009 Brand- und Löschlehre
 ARBEITSGEMEINSCHAFT DER LEITER DER BERUFSFEUERWEHREN IN NORDRHEIN-WESTFALEN Fachausschuss Schulung und Einsatz Vorsitzender Stv. BBM Friedrich-Ernst Martin Buchenstraße 17, 42579 Heiligenhaus Tel. 02051-317-281
ARBEITSGEMEINSCHAFT DER LEITER DER BERUFSFEUERWEHREN IN NORDRHEIN-WESTFALEN Fachausschuss Schulung und Einsatz Vorsitzender Stv. BBM Friedrich-Ernst Martin Buchenstraße 17, 42579 Heiligenhaus Tel. 02051-317-281
Kettenreaktionen. Kapitel 2. In diesem Kapitel sollen die folgenden Fragen beantwortet werden:
 Kapitel 2 Kettenreaktionen In diesem Kapitel sollen die folgenden Fragen beantwortet werden: Was versteht man unter einer Kettenreaktion? Welches sind die verschiedenen Typen von Reaktionsschritten, die
Kapitel 2 Kettenreaktionen In diesem Kapitel sollen die folgenden Fragen beantwortet werden: Was versteht man unter einer Kettenreaktion? Welches sind die verschiedenen Typen von Reaktionsschritten, die
Shell. Risella X. hochwertige technische weißöle auf der Basis der Technologie der Fischer-Tropsch-Synthese NEXT GENERATION PROCESS OILS
 Shell Risella X hochwertige technische weißöle auf der Basis der Technologie der Fischer-Tropsch-Synthese NEXT GENERATION PROCESS OILS SHELL RISELLA X IST EIN SORTIMENT hochwertiger PROZESSÖLE AUF Basis
Shell Risella X hochwertige technische weißöle auf der Basis der Technologie der Fischer-Tropsch-Synthese NEXT GENERATION PROCESS OILS SHELL RISELLA X IST EIN SORTIMENT hochwertiger PROZESSÖLE AUF Basis
Verbrennung und Dampferzeugung
 Institut für Energietechnik, Verbrennung und Dampferzeugung - universitäres Fernstudium Verbrennung, Vergasung, Pyrolyse Folie 2 von 63 Eine Verbrennung ist eine schnelle Redoxreaktion eines Brennstoffes
Institut für Energietechnik, Verbrennung und Dampferzeugung - universitäres Fernstudium Verbrennung, Vergasung, Pyrolyse Folie 2 von 63 Eine Verbrennung ist eine schnelle Redoxreaktion eines Brennstoffes
Einige Überlegungen zu E10
 Käferteam Nürnberg 212 Klaus Falkenberg inige Überlegungen zu 1 s fällt auf den ersten Blick schwer, die Auswirkungen eines vergrößerten thanolanteils im Kraftstoff einzuschätzen. Hier sollen einige Überschlagsrechnungen
Käferteam Nürnberg 212 Klaus Falkenberg inige Überlegungen zu 1 s fällt auf den ersten Blick schwer, die Auswirkungen eines vergrößerten thanolanteils im Kraftstoff einzuschätzen. Hier sollen einige Überschlagsrechnungen
Vergleich der Kreisprozesse eines Ottomotors in Anwesenheit und Abwesenheit von N 2 O
 Vergleich der Kreisprozesse eines Ottomotors in Anwesenheit und Abwesenheit von N 2 O Wie stark sich das Distickstoffmonooxid auf die Leistung eines Motors auswirkt sieht man sehr gut anhand einer exemplarischen
Vergleich der Kreisprozesse eines Ottomotors in Anwesenheit und Abwesenheit von N 2 O Wie stark sich das Distickstoffmonooxid auf die Leistung eines Motors auswirkt sieht man sehr gut anhand einer exemplarischen
1. Wer sich über Erdgas informieren will, findet im Internet viele Informationen dazu, zum Beispiel diese:
 Autos, die mit Erdgas fahren Seit mehr als 15 Jahren werden Erdgasautos in Serie gefertigt. Das Erdgas wird in Tanks mitgeführt und steht unter einem Druck von 200 bar. Mittlerweile gibt es in Österreich
Autos, die mit Erdgas fahren Seit mehr als 15 Jahren werden Erdgasautos in Serie gefertigt. Das Erdgas wird in Tanks mitgeführt und steht unter einem Druck von 200 bar. Mittlerweile gibt es in Österreich
HEGERs. HEGERs Fachvereinigung Arbeitssicherheit e.v., Gefahrstoffe live erleben! Experimentalvortrag.
 HEGERs - Gefahrstoffe live erleben! HEGER Schulungen Tel.: 0571 / 75 649 Mobil: 0177 25 98 947 [email protected] Hebünte 12 32457 Porta Westfalica Experimentalvortag: Was erwartet Sie? Erleben,
HEGERs - Gefahrstoffe live erleben! HEGER Schulungen Tel.: 0571 / 75 649 Mobil: 0177 25 98 947 [email protected] Hebünte 12 32457 Porta Westfalica Experimentalvortag: Was erwartet Sie? Erleben,
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
HCCI-Motor der MTU Baureihe 1600 mit extrem niedrigen Abgasemissionen im gesamten Motorkennfeld
 HCCI-Motor der MTU Baureihe 1600 mit extrem niedrigen Abgasemissionen im gesamten Motorkennfeld Folie 1 Inhalt 1. Einleitung & Randbedingungen 1. Anwendungsgebiete 2. Abgasgesetzgebung 3. Kraftstoffszenario
HCCI-Motor der MTU Baureihe 1600 mit extrem niedrigen Abgasemissionen im gesamten Motorkennfeld Folie 1 Inhalt 1. Einleitung & Randbedingungen 1. Anwendungsgebiete 2. Abgasgesetzgebung 3. Kraftstoffszenario
Überlege dir welche drei Voraussetzungen gegeben sein müssen, damit Verbrennung stattfinden kann.
 Verbrennungsvorgang Überlege dir welche drei Voraussetzungen gegeben sein müssen, damit Verbrennung stattfinden kann. Trage die Begriffe in die leeren Felder des Verbrennungsdreiecks ein. Die drei Voraussetzungen
Verbrennungsvorgang Überlege dir welche drei Voraussetzungen gegeben sein müssen, damit Verbrennung stattfinden kann. Trage die Begriffe in die leeren Felder des Verbrennungsdreiecks ein. Die drei Voraussetzungen
5 Internetrecherche LI
 Hinweise Die Internetrecherche lässt sich nur knapp in einer Stunde durchführen. Die Schüler müssen daher oft noch einiges zuhause recherchieren und die Aufgaben bearbeiten. Ein Hinweis vor der Durchführung
Hinweise Die Internetrecherche lässt sich nur knapp in einer Stunde durchführen. Die Schüler müssen daher oft noch einiges zuhause recherchieren und die Aufgaben bearbeiten. Ein Hinweis vor der Durchführung
Was haben wir gelernt?
 Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
OTTOKRAFTSTOFF GEFAHR
 Kennzeichnung Zapfsäule für Ottokraftstoff (Mischung) OTTOKRAFTSTOFF Flüssigkeit und Dampf extrem entzündbar. Kann bei Verschlucken und Eindringen in die Atemwege tödlich sein. Verursacht Hautreizungen.
Kennzeichnung Zapfsäule für Ottokraftstoff (Mischung) OTTOKRAFTSTOFF Flüssigkeit und Dampf extrem entzündbar. Kann bei Verschlucken und Eindringen in die Atemwege tödlich sein. Verursacht Hautreizungen.
Propan-Butan. Eigenschaften und Anwendungsgehiete der Flüssiggase. Von. Dr.-Ing. Geert Oldenburg Hamburg. Mit 37 Abbildungen. Springer.
 Propan-Butan Eigenschaften und Anwendungsgehiete der Flüssiggase Von Dr.-Ing. Geert Oldenburg Hamburg Mit 37 Abbildungen Springer. V er lag Berlin / Göttingen / Heidelberg 1955 ISBN 978-3-642-53112-5 ISBN
Propan-Butan Eigenschaften und Anwendungsgehiete der Flüssiggase Von Dr.-Ing. Geert Oldenburg Hamburg Mit 37 Abbildungen Springer. V er lag Berlin / Göttingen / Heidelberg 1955 ISBN 978-3-642-53112-5 ISBN
Brandlehre. Grundbegriffe. Feuer. Brennen. Temperatur, Energie, Wärme. Vorbedingungen für die Verbrennung
 randlehre Grundbegriffe Aufgaben der randlehre ist die eschreibung der stofflichen Umwandlungen, die sich bei der Verbrennung vollziehen. Zur näheren eschreibung der ablaufenden Reaktionen greift man auf
randlehre Grundbegriffe Aufgaben der randlehre ist die eschreibung der stofflichen Umwandlungen, die sich bei der Verbrennung vollziehen. Zur näheren eschreibung der ablaufenden Reaktionen greift man auf
