Illustration des Crack-Prozesses am Beispiel der Pentan-Pyrolyse
|
|
|
- Florian Gerber
- vor 7 Jahren
- Abrufe
Transkript
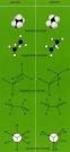
1 Vorlesung 9. Erdölverarbeitung. (Vollhardt, 3. Aufl., S , 4. Aufl., S ; art, S ; Buddrus, S.87-88) Nach Entfernung von Wasser, Feststoffen und Erdgas (Erhitzen) erfolgt eine fraktionierte Destillation zuerst bei Normaldruck, später im Vakuum (50 mbar) Fraktionen und ihre Verwendung (Vollhardt, 3. Aufl., S. 94, Tab. 3-3, 4. Aufl., S. 110, Tab. 3-3; art, S. 127, Tab. 3.3) Aus den angegebenen Tabellen in den Lehrbüchern entnehmen Sie, dass nur ca. 25% des Rohöls bei der Destillation Benzin ergibt. Da dies die am meisten benötigte Fraktion ist, werden höhersiedende Fraktion gecrackt, d. h. langkettige Alkane werden zu einem Gemisch von kurzkettigen Alkanen und Alkenen gespalten. Versuch: racken von Paraffinöl am Aktivkohlekontakt a) Nachweis der Alken-Bildung durch Entfärbung von Bromwasser b) Im Gegensatz zum schwer entflammbaren Paraffinöl lässt sich das rack- Benzin leicht entzünden. Früher: Thermisches racken bei eute: Katalytisches racken bei 500 ydrocrack-prozess in Gegenwart von Wasserstoff, Reforming (Neubildung) Um die Vorgänge beim racken zu verstehen, müssen Bindungsdissoziationsenergien von und -Bindungen verglichen werden (vgl. Vollhardt, 3. Aufl., S. 89, 4. Aufl., S. 105). Bindungsdissoziationsenergien in kj mol -1 (nach Vollhardt) ( 3 ) ( 3 ) Illustration des rack-prozesses am Beispiel der Pentan-Pyrolyse Experimentalchemie, Prof.. Mayr 40
2 Die Spaltung der 2-3-Bindung ist bevorzugt, da dort nur primäre Radikale und nicht das hochenergetische 3 -Radikal entsteht. Der Bruch einer starken -- Bindung wäre noch ungünstiger. Radikale können aus gesättigten Kohlenwasserstoffen Wasserstoffatome abstrahieren oder miteinander unter Kombination oder Wasserstoffübertragung reagieren. Beispiele: Disproportionierung Radikal-Kombination Aus den radikalischen Primärprodukten der Pentan-Pyrolyse können in einem weiteren Schritt Methan, Ethan, Propan, Butan, Ethen, Propen, Buten und durch Alkylradikal-Rekombination längerkettige Alkane entstehen. Verbrennung und ktanzahl (Vollhardt, 3. Aufl., S. 117, 4. Aufl., S. 136; art, S. 128; Buddrus, S. 85/86). Die Verbrennung von Kohlenwasserstoffen ist eine komplizierte über Radikale verlaufende Reaktion, bei der 2 und 2 entstehen. Diese Reaktion dient u. A. zum Antrieb von Kraftfahrzeugen. ohe Verdichtung von Kohlenwasserstoff/Luft-Gemischen kann zum Klopfen des Motors führen. Darunter versteht man Geräusche, die durch spontane, nicht durch den Zündfunken herbeigeführte Entzündungen der Benzin/Luft-Gemische verursacht werden. Generell gilt, dass unverzweigte Alkane stärker zum Klopfen neigen als verzweigte. Zur Kalibrierung hat man die ktan-skala eingeführt, wobei Isooktan (2,2,4- Trimethylpentan), einem sehr guten Treibstoff, der ktanwert 100, n-eptan, einem sehr schlechten Treibstoff, die ktanzahl 0 zugewiesen wird. Normalbenzin mit der ktanzahl 91 hat dieselbe Klopffestigkeit wie eine Mischung aus 91% Isooktan und 9% eptan. Mit ilfe von Katalysatoren werden unverzweigte in verzweigte Alkane isomerisiert (ΔG Δ ist negativ!) Zur Erhöhung der Klopffestigkeit werden dem Benzin tert.-butylmethylether oder 2-3% Benzol zugesetzt (Erhöhung der ktanzahl) vgl. Vollhardt, 3. Aufl., Seite 117, 4. Aufl., S Experimentalchemie, Prof.. Mayr 41
3 Weitere Beispiele für das Vorkommen der Alkane in der Natur Methangehalt der Atmosphäre 1.7 ppm. Nimmt jährlich um 1-2% zu. Treibhauseffekt! Methanhydrate in Permafrostgebieten und in der Tiefsee. Methan im Pansen von Wiederkäuern: Ein Rind produziert täglich bis zu 900 l Gas, das 27% Methan enthält. Methan wird auch durch Termiten produziert. 2-Methylheptadecan: Sexuallockstoff der weiblichen Tigermotte. Undecan: Aggregationspheromon der Küchenschabe. eptacosan und Nonacosan in Blattwachsen. Schutzmittel gegen Regen, Insekten und Mikrobenbefall auf Kohlblättern, Broccoli und Äpfeln. Relative Stabilitäten der Alkane (Vollhardt, 3. Aufl., S , 4. Aufl., S ) Durch kalorimetrische Messungen kann man die Wärmemenge bestimmen, die beim Verbrennen eines mols Alkan zu 2 und 2 frei werden. ( ( Δ /kj mol ( ( ( Die absoluten Zahlen geben keine Information über die relative Stabilität der Alkane, da die Menge an 2 und 2 verschieden ist, die beim Verbrennen eines mols Alkan freigesetzt wird. Lediglich aus dem Vergleich der Verbrennungsenthapie von n- Butan und Isobutan lässt sich entnehmen, dass Isobutan stabiler als n-butan ist. Zum Vergleich des Energieinhalts chemischer Verbindungen verwendet man häufig die molaren Standardbildungsenthalpien (heat of formation) Δ f (früher: Δ f ). Sie ist definiert als der Enthalpiebetrag, der bei der erstellung von 1 mol dieser Verbindung aus den Elementen im Standardzustand freigesetzt (Δ f negativ) oder verbraucht (Δ f positiv) wird. Elemente im Standardzustand (d. h. Kohlenstoff als Graphit, Wasserstoff als 2 ) werden somit gleich 0 gesetzt. Zur Ermittlung der molaren Standardbildungsenthalpien geht man i. Allg. indirekt vor, wie im folgenden Beispiel illustriert. Die molaren Verbrennungsenthalpien von n- Experimentalchemie, Prof.. Mayr 42
4 Butan und Isobutan lassen sich direkt messen (s. oben). Auch die Verbrennungsenthalpie von 4 mol (Graphit) und 5 mol 2 lässt sich direkt messen ( 2 Δ r = 4 x (-394) = ( 2 ) fl = 5 x (-286) = Δ r Summe mit Rundungsfehler ( 2 ) fl. Die molare Reaktionsenthalpie Δ r der Bildung von n-butan aus Graphit und Wasserstoff, definitionsgemäß die molare Standardbildungsenthalpie, lässt sich nicht direkt messen sondern gemäß obigem Schema berechnen zu Δ f (n-butan) = (-2878) = -127 kj mol -1 Standardbildungsenthalpien (kj mol -1 ) einiger Elemente und Verbindungen (Graphit) 0 4 (Gas) (Diamant) (Gas) (Gas) (Gas) (Gas) ( 2 ) 2 3 (Gas) (Gas) ( 3 ) 3 (Gas) (Flüss.) ( 2 ) 3 3 (Gas) , 2, N 2 (Gase) 0 3 ( 2 ) 4 3 (Gas) (atomar) ( 2 ) 5 3 (Gas) (atomar) Experimentalchemie, Prof.. Mayr 43
5 Eine Sammlung von Standardbildungsenthalpien finden Sie im Internet unter webbook.nist.gov/chemistry/ Damit können Sie die Reaktionsenthalpien aller Reaktionen berechnen, die sich auf Verbindungen mit bekannten Standardbildungsenthalpien beziehen. Beispiel: Was ist die molare Verbrennungsenthalpie von Propan? ( ( 2 ) fl Unter Verwendung der Daten aus obiger Tabelle errechnen Sie Δ r = Δ f (Produkte) - Δ f (Reaktanten) = 3 x (-394) 4 x (-286) - (-104) - 0 = = kj mol -1 Übung A9-1. Nach dem Fischer-Tropsch-Verfahren können flüssige Kraftstoffe aus Synthesegas hergestellt werden. Dieses Verfahren wurde im 2. Weltkrieg in Deutschland eingesetzt, da Synthesegas aus heimischer Kohle zugänglich war. Kohle 2 Luft Δ o oder Fe Druck, Berechnen Sie die Reaktionsenthalpie für die Bildung von exan (Δ f = -167 kj mol -1 ) aus Kohlenmonoxid und Wasserstoff. Δ f ( = kj mol -1 ; Δ f ( 2 ) fl = kj mol -1 Übung B9-1. Die molare Verbrennungsenthalpie von gasförmigem n-pentan beträgt Δ r = , die von 2-Methylbutan Δ r = und die von 2,2-Dimethylpropan Δ r = kj mol -1. Berechnen Sie daraus die Standardbildungsenthalpien dieser isomeren Pentane und tragen Sie sie in ein Energieschema ein. Δ f ( 2 ) = -394 kj mol -1 ; Δ f ( 2 ) fl = kj mol -1 Lösung zu Übung B9-1 Δ f (n-pentan) = kj mol -1 Δ f (2-Methylbutan) = kj mol -1 Δ f (2,2-Dimethylpropan) = kj mol -1 Schlussfolgerung: Verzweigte Alkane sind im allgemeinen stabiler als ihre nichtverzweigten Isomeren (Unterschiede der Entropie sind hier vernachlässigt). Experimentalchemie, Prof.. Mayr 44
6 ycloalkane. Summenformel ( 2 ) n entspricht n 2n Nomenklatur: Dem Namen des offenkettigen Alkans mit derselben Zahl von Kohlenstoffatomen wird die Vorsilbe yclo vorangesetzt Bei substituierten ycloalkanen müssen Nummern angegeben werden, wenn mehr als ein Substituent vorhanden ist...cyclohexan...cyclohexan...cyclohexan Aus dem Vergleich der molaren Standardbildungsenthalpien der n-alkane (vgl. Tabelle oben) entnimmt man, dass pro 2 -Gruppe ein Inkrement von 20.6 kj mol -1 addiert wird. Vergleicht man nun die beobachteten Standardbildungsenthalpien von ycloalkanen mit dem aus dem 2 -Vielfachen errechneten Wert, beobachtet man nur beim yclohexan Übereinstimmung. In allen anderen Fällen ist die beobachtete Standardbildungsenthalpie der ycloalkane n 2n größer als der durch n x (-20.6) errechnete Wert. Die Differenz wird als Spannungsenthalpie bezeichnet. [kj mol -1 ] Δ f (Gas) n x (-20.6) Spannungsenthalpie Experimentalchemie, Prof.. Mayr 45
7 Übung A9-2. Bei n-alkanen sinkt die Standardbildungsenthalpie von Glied zu Glied der homologen Reihe um ΔΔ f = kj mol -1 (vgl. Vollhardt, 3. Aufl., Tab. 3-7, 4. Aufl., Tab. 3-8) Verwenden Sie dieses Inkrement, um den Wert der spannungsfreien Bildungsenthalpie von yclononan ( 2 ) 9, yclododecan ( 2 ) 12 und yclohexadecan ( 2 ) 16 zu berechnen, und vergleichen Sie mit den experimentell gefundenen Werten. Δ f (yclononan = kj mol -1 Δ f (yclododecan = kj mol -1 Δ f (yclohexadecan = kj mol -1 Experimentalchemie, Prof.. Mayr 46
Homologe Reihe der unverzweigten Alkane C n H (2n+2)
 Organische hemie I 3.01 Homologe Reihe der unverzweigten Alkane n H (2n+2) (Paraffine) (veraltet: normale Alkane = n-alkane) Name Konstitution Siedepunkt ausführliche Schreibweise Stenographie [ ] Methan
Organische hemie I 3.01 Homologe Reihe der unverzweigten Alkane n H (2n+2) (Paraffine) (veraltet: normale Alkane = n-alkane) Name Konstitution Siedepunkt ausführliche Schreibweise Stenographie [ ] Methan
Vorlesung 5. Alkane. Experimentalchemie, Prof. H. Mayr 20 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. Anzahl C-Atome im n-alkan
 Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Die Herstellung von Alkenen aus Chloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen.
 Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
v = - = - = = k [R] [S]
![v = - = - = = k [R] [S] v = - = - = = k [R] [S]](/thumbs/81/82977406.jpg) Vorlesung 7 Die hemische Kinetik (Vollhardt, 3 Aufl, S 70-72, 4 Aufl, S 54-58; art, S 107-110; Buddrus, S 26-29) befasst sich mit Geschwindigkeit, mit der eine Reaktion abläuft R S P Geschwindigkeit einer
Vorlesung 7 Die hemische Kinetik (Vollhardt, 3 Aufl, S 70-72, 4 Aufl, S 54-58; art, S 107-110; Buddrus, S 26-29) befasst sich mit Geschwindigkeit, mit der eine Reaktion abläuft R S P Geschwindigkeit einer
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
Vorlesung 20/21. Alkine sind Kohlenwasserstoffe mit einer CC-Dreifachbindung
 Vorlesung 0/1. Alkine sind Kohlenwasserstoffe mit einer -Dreifachbindung Nomenklatur (Vollhardt, 3. Aufl., S. 563-564, 4. Aufl. S. 631-63; art, S. 85-89; Buddrus, S. 87-88) Die längste Kette mit möglichst
Vorlesung 0/1. Alkine sind Kohlenwasserstoffe mit einer -Dreifachbindung Nomenklatur (Vollhardt, 3. Aufl., S. 563-564, 4. Aufl. S. 631-63; art, S. 85-89; Buddrus, S. 87-88) Die längste Kette mit möglichst
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Alkane - eine vielseitige Stoffgruppe. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Alkane - eine vielseitige Stoffgruppe Das komplette Material finden Sie hier: School-Scout.de RAAbits Hauptschule 7 9 Naturwissenschaften
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Alkane - eine vielseitige Stoffgruppe Das komplette Material finden Sie hier: School-Scout.de RAAbits Hauptschule 7 9 Naturwissenschaften
Fossile Rohstoffe. Erdöl
 Fraktionierte Destillation Die stufenweise Abtrennung einzelner Komponenten eines Stoffgemisches aufgrund der unterschiedlichen Siedepunkte wird als fraktionierte Destillation bezeichnet. 1 Fraktionierte
Fraktionierte Destillation Die stufenweise Abtrennung einzelner Komponenten eines Stoffgemisches aufgrund der unterschiedlichen Siedepunkte wird als fraktionierte Destillation bezeichnet. 1 Fraktionierte
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 2.
 Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Versuch: Thermisches Cracken von Paraffinöl
 Philipps-Universität Marburg 21.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2, Alkane Versuch: Thermisches Cracken von Paraffinöl
Philipps-Universität Marburg 21.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 2, Alkane Versuch: Thermisches Cracken von Paraffinöl
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
Organische Stofflehre
 Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Einführung in die Nomenklatur der organischen Chemie. Einteilung der Kohlenwasserstoffe
 organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
I. Alkane Homologe Reihe, Nomenklatur
 Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Kohlenwasserstoffe. sp 3 -Orbitale. Alkane. Alkene. sp 2 - Orbitale p z - Orbital. sp -Orbitale p y, p z - Orbitale. Alkine
 Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Kohlenwasserstoffe. Benzol Naphthalin usw. Alkane Alkene Alkine Cycloaliphaten. Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w.
 OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Inhaltsverzeichnis zu Kapitel 2. Alkane
 Inhaltsverzeichnis zu Kapitel 2. Alkane 2. Alkane 2.1. Valenzstrichformel, omologe Reihe, Nomenklatur, Konstitution, 22 Konformation 2.1.1. Valenzstrichformel 22 2.1.2. omologe Reihe 23 2.1.3. Konstitutionsisomere
Inhaltsverzeichnis zu Kapitel 2. Alkane 2. Alkane 2.1. Valenzstrichformel, omologe Reihe, Nomenklatur, Konstitution, 22 Konformation 2.1.1. Valenzstrichformel 22 2.1.2. omologe Reihe 23 2.1.3. Konstitutionsisomere
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Summenformel Elektronenstrichformel Name Siedepunkt
 Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Abituraufgaben Alkane 1980/II/3 1981/II/1
 Abituraufgaben Alkane 1980/II/3 3 Skizzieren Sie das Energiediagramm für die Konformationen des n-butans bei der Rotation (Rotationswinkel 0 bis 180 ) um die Bindung zwischen dem zweiten und dritten Kohlenstoffatom.
Abituraufgaben Alkane 1980/II/3 3 Skizzieren Sie das Energiediagramm für die Konformationen des n-butans bei der Rotation (Rotationswinkel 0 bis 180 ) um die Bindung zwischen dem zweiten und dritten Kohlenstoffatom.
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden?
 Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Station 1: Nomenklatur von Alkanen
 Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Elektrophile Additionen von HX an die CC-Doppelbindung (Vollhardt, 3. Aufl., S , 4. Aufl., S ; Hart, S ; Buddrus, S.
 Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten Eine Gruppe mischt Spiritus mit Wasser. Füllt dazu zunächst zwei Messzylinder mit je exakt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten Eine Gruppe mischt Spiritus mit Wasser. Füllt dazu zunächst zwei Messzylinder mit je exakt
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
Alkane als Kraftstoffe
 Alkane als Kraftstoffe Du hast bereits gelernt, dass bei der fraktionierten Destillation Alkane erhalten werden können, die geeignet sind als Kraftstoffe eingesetzt zu werden. Unterschiedliche Motoren
Alkane als Kraftstoffe Du hast bereits gelernt, dass bei der fraktionierten Destillation Alkane erhalten werden können, die geeignet sind als Kraftstoffe eingesetzt zu werden. Unterschiedliche Motoren
Kapitel 02: Erdgas und Erdöl
 Kapitel 02: Erdgas und Erdöl 1 Kapitel 02: Erdgas und Erdöl Kapitel 02: Erdgas und Erdöl 2 Inhalt Kapitel 02: Erdgas und Erdöl...1 Inhalt... 2 Einige Produkte aus Erdöl...3 Erdöl ist nicht gleich Erdöl...3
Kapitel 02: Erdgas und Erdöl 1 Kapitel 02: Erdgas und Erdöl Kapitel 02: Erdgas und Erdöl 2 Inhalt Kapitel 02: Erdgas und Erdöl...1 Inhalt... 2 Einige Produkte aus Erdöl...3 Erdöl ist nicht gleich Erdöl...3
1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2
 A l k a n e 1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2 2. Die homologe Reihe der Alkane 2 2.1. Beispiele: Butan, exan und Eicosan (Paraffin)
A l k a n e 1. Methan 2 1.1. Eigenschaften und Zusammensetzung 2 1.2. Molekülstruktur 2 1.3. Vorkommen und Bedeutung 2 2. Die homologe Reihe der Alkane 2 2.1. Beispiele: Butan, exan und Eicosan (Paraffin)
Thermodynamik & Kinetik
 Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig
 26 sisomerie (Stereoisomerie I) Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig Isomerie II: sisomere: sisomere (bzw. Konformere) sind Isomere, die sich durch
26 sisomerie (Stereoisomerie I) Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig Isomerie II: sisomere: sisomere (bzw. Konformere) sind Isomere, die sich durch
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Chemie. Elektrochemie, Alkane und Alkene
 Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
Fossile Rohstoffe. Kohlenwasserstoffe als Energieträger
 Kohlenwasserstoffe als Energieträger, Kohle, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da
Kohlenwasserstoffe als Energieträger, Kohle, Erdgas und Torf sind im Laufe von Millionen von Jahren aus Kleinlebwesen und Pflanzen entstanden und werden deswegen als fossile Energieträger bezeichnet. Da
2. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
1. Wer sich über Erdgas informieren will, findet im Internet viele Informationen dazu, zum Beispiel diese:
 Autos, die mit Erdgas fahren Seit mehr als 15 Jahren werden Erdgasautos in Serie gefertigt. Das Erdgas wird in Tanks mitgeführt und steht unter einem Druck von 200 bar. Mittlerweile gibt es in Österreich
Autos, die mit Erdgas fahren Seit mehr als 15 Jahren werden Erdgasautos in Serie gefertigt. Das Erdgas wird in Tanks mitgeführt und steht unter einem Druck von 200 bar. Mittlerweile gibt es in Österreich
Übung 2. Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen
 Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen Wärmekapazitäten isochore/isobare Zustandsänderungen Standardbildungsenthalpien Heizwert/Brennwert adiabatische Flammentemperatur WS 2013/14
Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen Wärmekapazitäten isochore/isobare Zustandsänderungen Standardbildungsenthalpien Heizwert/Brennwert adiabatische Flammentemperatur WS 2013/14
Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen.
 1) DEFINITIONEN DIE CHEMISCHE REAKTION Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen. Der Massenerhalt: Die Masse ändert sich im Laufe einer Reaktion
1) DEFINITIONEN DIE CHEMISCHE REAKTION Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen. Der Massenerhalt: Die Masse ändert sich im Laufe einer Reaktion
Organische Chemie - 4 - Kohlenstoff als Bindungspartner. Kapitel 4: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen
 Organische hemie - 4 - Kohlenstoff als Bindungspartner 1 Kapitel 4: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 4 - Kohlenstoff als Bindungspartner 2 nhalt Kapitel
Organische hemie - 4 - Kohlenstoff als Bindungspartner 1 Kapitel 4: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 4 - Kohlenstoff als Bindungspartner 2 nhalt Kapitel
2.1 Homologe Reihe, Nomenklatur, Konstitution, Konformation CH 2
 Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09. Name: Sarah Henkel Datum:
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 25.11.2008 Zeitbedarf Vorbereitung: 5 Minuten Durchführung:
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 25.11.2008 Zeitbedarf Vorbereitung: 5 Minuten Durchführung:
Eigenschaften, Vorkommen und Anwendungen einiger C 5 -C 10 -Alkane
 Eigenschaften, Vorkommen und Anwendungen einiger C 5 -C 10 -Alkane C 5 H 12 : Pentane (3 Konstitutions-Isomere) n-pentan: SdT 36 C SmT - 130 C Dichte 0,63g/cm 3 (20 C) F +, X n, N R 12-65-66-51/53 S (2)-9-16-29-33-61-62
Eigenschaften, Vorkommen und Anwendungen einiger C 5 -C 10 -Alkane C 5 H 12 : Pentane (3 Konstitutions-Isomere) n-pentan: SdT 36 C SmT - 130 C Dichte 0,63g/cm 3 (20 C) F +, X n, N R 12-65-66-51/53 S (2)-9-16-29-33-61-62
Thermochemie. Arbeit ist das Produkt aus wirkender Kraft F und Weglänge s. w = F s 1 J = 1 Nm = 1 kgm 2 /s 2
 Thermochemie Energie ist die Fähigkeit, Arbeit zu leisten. E pot = m g h E kin = ½ m v 2 Arbeit ist das Produkt aus wirkender Kraft F und Weglänge s. w = F s 1 J = 1 Nm = 1 kgm 2 /s 2 Eine wirkende Kraft
Thermochemie Energie ist die Fähigkeit, Arbeit zu leisten. E pot = m g h E kin = ½ m v 2 Arbeit ist das Produkt aus wirkender Kraft F und Weglänge s. w = F s 1 J = 1 Nm = 1 kgm 2 /s 2 Eine wirkende Kraft
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Organische Chemie II. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
Chemische Thermodynamik ENTROPIE LÖSUNGEN
 L-Üb29: Die Standardentropie der Edelgase steigt in regelmässiger Weise mit der molaren Masse. Diese schöne Regelmässigkeit kommt daher, dass die Edelgase nur Translationsenergie besitzen und keine Schwingungsenergie
L-Üb29: Die Standardentropie der Edelgase steigt in regelmässiger Weise mit der molaren Masse. Diese schöne Regelmässigkeit kommt daher, dass die Edelgase nur Translationsenergie besitzen und keine Schwingungsenergie
Energie und Reaktion Arbeitsblatt SF C. 0. Einführungsversuche: Skizzieren Sie die folgenden Versuchsaufbauten und die Beobachtungen:
 Energie und Reaktion Arbeitsblatt SF Seiten 52/53 0. Einführungsversuche: Skizzieren Sie die folgenden Versuchsaufbauten und die Beobachtungen: Lösen des Salzes Na Lösen des Salzes al2 Lösen des Salzes
Energie und Reaktion Arbeitsblatt SF Seiten 52/53 0. Einführungsversuche: Skizzieren Sie die folgenden Versuchsaufbauten und die Beobachtungen: Lösen des Salzes Na Lösen des Salzes al2 Lösen des Salzes
Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung. Dr.-Ing. Klaus Herzog
 Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung Dr.-Ing. Klaus erzog Inhalt der Vorlesungsreihe Kraftfahrzeugantriebe Weltenergieressourcen und Energieträger Energiewandlung
Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung Dr.-Ing. Klaus erzog Inhalt der Vorlesungsreihe Kraftfahrzeugantriebe Weltenergieressourcen und Energieträger Energiewandlung
Organische Chemie. Kohlenstoff. Kohlenstoffkreislauf. Erdölverarbeitung. Kohlenwasserstoffe
 rganische hemie Teilgebiet der hemie, welches sich mit Aufbau, erstellung und Eigenschaften der Verbindungen des Kohlenstoffs beschäftigt. NTG 10.1 Kohlenstoff - 4. auptgruppe 4 Valenzelektronen 4 Bindungen
rganische hemie Teilgebiet der hemie, welches sich mit Aufbau, erstellung und Eigenschaften der Verbindungen des Kohlenstoffs beschäftigt. NTG 10.1 Kohlenstoff - 4. auptgruppe 4 Valenzelektronen 4 Bindungen
Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen
 2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
Reaktion und Energie
 Reaktion und Energie Grundsätzliches Bei chemischen Reaktionen werden die Atome der Ausgangsstoffe neu angeordnet, d. h. Bindungen werden gespalten und neu geknüpft. Die Alltasgserfahrung legt nahe, dass
Reaktion und Energie Grundsätzliches Bei chemischen Reaktionen werden die Atome der Ausgangsstoffe neu angeordnet, d. h. Bindungen werden gespalten und neu geknüpft. Die Alltasgserfahrung legt nahe, dass
Grundkurs Chemie Alkane
 Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Die Welt der Gifte. Bearbeitet von Karsten Strey
 Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
Die Alkane. Anna Heynkes. 22.6.2005, Aachen. 1 Was sind Alkane 1. 2 Verwendung der Alkane 1. 3 Einige Eigenschaften der Alkane 2
 Die Alkane Anna Heynkes 22.6.2005, Aachen Dieser Text soll so knapp und verständlich wie möglich zusammenfassen, was das Chemieschulbuch des Klett-Verlages über die Alkane berichtet. Zusätzlich enthält
Die Alkane Anna Heynkes 22.6.2005, Aachen Dieser Text soll so knapp und verständlich wie möglich zusammenfassen, was das Chemieschulbuch des Klett-Verlages über die Alkane berichtet. Zusätzlich enthält
2.1 Massenbilanz bei chemischen Stoffumwandlungen. 2.2 Energiebilanz bei chemischen Stoffumwandlungen
 Inhalt von Kapitel 2 2.1-0 2. Chemische Stoffumwandlungen 2.1 Massenbilanz bei chemischen Stoffumwandlungen 2.2 Energiebilanz bei chemischen Stoffumwandlungen 2.2.1 Energiebilanz 2.2.2 Die Bildungsenthalpie
Inhalt von Kapitel 2 2.1-0 2. Chemische Stoffumwandlungen 2.1 Massenbilanz bei chemischen Stoffumwandlungen 2.2 Energiebilanz bei chemischen Stoffumwandlungen 2.2.1 Energiebilanz 2.2.2 Die Bildungsenthalpie
Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung. Dr.-Ing. Klaus Herzog
 Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung Dr.-Ing. Klaus erzog Inhalt der Vorlesungsreihe Kraftfahrzeugantriebe Weltenergieressourcen und Energieträger Energiewandlung
Kraftfahrzeugantriebe 1 Weltenergieressourcen, Energieträger und Energiewandlung Dr.-Ing. Klaus erzog Inhalt der Vorlesungsreihe Kraftfahrzeugantriebe Weltenergieressourcen und Energieträger Energiewandlung
Grundwissen Chemie 10. Klasse NTG
 Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
OSZ Körperpflege Chemie Fachhochschulreife FOS 2009/10
 Name: Klasse: GASCHROMATOGRAFIE Experiment 08 1. Aufgabe: a) Nehmen Sie ein Gaschromatogramm ihres Feuerzeuggases auf. (Füllen Sie dazu 2 ml des Feuerzeuggases in die Spritze!) Siehe Anlage Durchführung!!!
Name: Klasse: GASCHROMATOGRAFIE Experiment 08 1. Aufgabe: a) Nehmen Sie ein Gaschromatogramm ihres Feuerzeuggases auf. (Füllen Sie dazu 2 ml des Feuerzeuggases in die Spritze!) Siehe Anlage Durchführung!!!
6 Stationskarten mit Arbeitsaufträgen Lösungen
 Lernzirkel Vom Rohstoff zum Treibstoff Die Schüler erarbeiten in ca. 8 Stunden die Themenfelder Station 1: Die Entstehung von Erdöl und Kohle Station 2: Fraktionierte Destillation von Erdöl Station 3:
Lernzirkel Vom Rohstoff zum Treibstoff Die Schüler erarbeiten in ca. 8 Stunden die Themenfelder Station 1: Die Entstehung von Erdöl und Kohle Station 2: Fraktionierte Destillation von Erdöl Station 3:
Modul BCh 1.2 Praktikum Anorganische und Analytische Chemie I
 Institut für Anorganische Chemie Prof. Dr. R. Streubel Modul BCh 1.2 Praktikum Anorganische und Analytische Chemie I Vorlesung für die Studiengänge Bachelor Chemie und Lebensmittelchemie Im WS 08/09 Die
Institut für Anorganische Chemie Prof. Dr. R. Streubel Modul BCh 1.2 Praktikum Anorganische und Analytische Chemie I Vorlesung für die Studiengänge Bachelor Chemie und Lebensmittelchemie Im WS 08/09 Die
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14,
 ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen
 Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 04 - Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen 2 nhalt Kapitel 04: Kohlenstoff als Bindungspartner
Kapitel 04: Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen Organische hemie - 04 - Kohlenstoff als Bindungspartner in Alkanen, Alkenen und Alkinen 2 nhalt Kapitel 04: Kohlenstoff als Bindungspartner
Homologe Reihe der Alkane. Benennung der Alkane. Konstitutionsisomerie. Isomerie. Was versteht man unter der Homologen Reihe der Alkane?
 Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C?
 A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
Alkene 1975/III Äthan und Athen reagieren mit Brom! a) Unter welchen Versuchsbedingungen laufen diese Reaktionen ab? b) Formulieren Sie die
 Alkene 1975/III Äthan und Athen reagieren mit Brom! a) Unter welchen Versuchsbedingungen laufen diese Reaktionen ab? b) Formulieren Sie die Reaktionsgleichungen und benennen Sie die Reaktionsprodukte!
Alkene 1975/III Äthan und Athen reagieren mit Brom! a) Unter welchen Versuchsbedingungen laufen diese Reaktionen ab? b) Formulieren Sie die Reaktionsgleichungen und benennen Sie die Reaktionsprodukte!
Butanol Butanal Butansäure
 Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Thermo Dynamik. Mechanische Bewegung (= Arbeit) Wärme (aus Reaktion) maximale Umsetzung
 Thermo Dynamik Wärme (aus Reaktion) Mechanische Bewegung (= Arbeit) maximale Umsetzung Aussagen der Thermodynamik: Quantifizieren von: Enthalpie-Änderungen Entropie-Änderungen Arbeit, maximale (Gibbs Energie)
Thermo Dynamik Wärme (aus Reaktion) Mechanische Bewegung (= Arbeit) maximale Umsetzung Aussagen der Thermodynamik: Quantifizieren von: Enthalpie-Änderungen Entropie-Änderungen Arbeit, maximale (Gibbs Energie)
Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus BITTE AUSFÜLLEN BITTE HALTEN SIE IHREN STUDENTAUSWEIS BEREIT
 1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
Vorlesung "Organische Chemie 1" Übungsblatt 4
 Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Energie und chemische Reaktion. Was ist Energie? Welche Einheit hat Energie?
 Was ist Energie? Welche Einheit hat Energie? Was ist Energie? Es gibt verschiedene Formen von Energie, die ineinander überführt werden können. Energie kann jedoch nicht vernichtet oder erzeugt. Es gibt
Was ist Energie? Welche Einheit hat Energie? Was ist Energie? Es gibt verschiedene Formen von Energie, die ineinander überführt werden können. Energie kann jedoch nicht vernichtet oder erzeugt. Es gibt
Thermodynamik. Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen.
 Thermodynamik Was ist das? Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen. Gesetze der Thermodynamik Erlauben die Voraussage, ob eine bestimmte
Thermodynamik Was ist das? Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen. Gesetze der Thermodynamik Erlauben die Voraussage, ob eine bestimmte
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Landeshauptstadt Hannover
 Landeshauptstadt Hannover Schulbiologiezentrum 19.81 Stöchiometrie zum Anfassen Reaktionsgleichungen und Energiebilanzen mit Molekülmodellen begreifbar machen November 2015 Herausgeber: Landeshauptstadt
Landeshauptstadt Hannover Schulbiologiezentrum 19.81 Stöchiometrie zum Anfassen Reaktionsgleichungen und Energiebilanzen mit Molekülmodellen begreifbar machen November 2015 Herausgeber: Landeshauptstadt
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
Übungsaufgaben: elektrophile Addition und radikalische Substitution. + Cl2
 Lösungsvorschlag mit Erläuterungen Übungsaufgaben: elektrophile Addition und radikalische Substitution In der folgenden Tabelle ist links ein Produkt benannt, das bei einer chemischen Reaktion entstehen
Lösungsvorschlag mit Erläuterungen Übungsaufgaben: elektrophile Addition und radikalische Substitution In der folgenden Tabelle ist links ein Produkt benannt, das bei einer chemischen Reaktion entstehen
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015
 Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
7.2 Energiebilanz bei chemischen Stoffumwandlungen
 7.2 Energiebilanz bei chemischen Stoffumwandlungen Betrachtung eines Reaktionsgefäßes mit eintretenden Edukten und austretenden Produkten am Beispiel der Verbrennung eines Brennstoffes mit Luft (kinetische
7.2 Energiebilanz bei chemischen Stoffumwandlungen Betrachtung eines Reaktionsgefäßes mit eintretenden Edukten und austretenden Produkten am Beispiel der Verbrennung eines Brennstoffes mit Luft (kinetische
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Prüfung in Chemie für Studierende anderer Studiengänge Dienstag, 11. September 2018, 8:00-11:00
 Prüfung in Chemie für Studierende anderer Studiengänge Dienstag, 11. September 2018, 8:00-11:00 Für die Bearbeitung der Aufgaben sind keine Hilfsmittel zugelassen. Ausländische Studenten dürfen ein Wörterbuch
Prüfung in Chemie für Studierende anderer Studiengänge Dienstag, 11. September 2018, 8:00-11:00 Für die Bearbeitung der Aufgaben sind keine Hilfsmittel zugelassen. Ausländische Studenten dürfen ein Wörterbuch
Isomere. 3. Bsp. C5H12
 Fachdidaktik Chemie ET Grundlagenfach: Moleküle S. 7 Isomere Input: 1. Bsp C26 Inszenierung: Schülerinnen zeichnen in einer Aufgabe verschiedene Lewisformeln von C26. Sie gehen durch die Klasse, schauen
Fachdidaktik Chemie ET Grundlagenfach: Moleküle S. 7 Isomere Input: 1. Bsp C26 Inszenierung: Schülerinnen zeichnen in einer Aufgabe verschiedene Lewisformeln von C26. Sie gehen durch die Klasse, schauen
Alkane und Cycloalkane
 Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
2. Radikalische Substitution 2.1
 2. Radikalische Substitution 2.1 Die Radikalische Substitution Alkane sind im Vergleich zu den Alkenen sehr reaktionsträge. Alkane zählen zu den gesättigten, Alkene zu den ungesättigten Kohlenwasserstoffen.
2. Radikalische Substitution 2.1 Die Radikalische Substitution Alkane sind im Vergleich zu den Alkenen sehr reaktionsträge. Alkane zählen zu den gesättigten, Alkene zu den ungesättigten Kohlenwasserstoffen.
5 Internetrecherche LI
 Hinweise Die Internetrecherche lässt sich nur knapp in einer Stunde durchführen. Die Schüler müssen daher oft noch einiges zuhause recherchieren und die Aufgaben bearbeiten. Ein Hinweis vor der Durchführung
Hinweise Die Internetrecherche lässt sich nur knapp in einer Stunde durchführen. Die Schüler müssen daher oft noch einiges zuhause recherchieren und die Aufgaben bearbeiten. Ein Hinweis vor der Durchführung
Chemie Klausur
 Chemie Klausur 12.1 1 21. Oktober 2002 Aufgaben Aufgabe 1 1.1. Definiere: Innere Energie, Enthalpieänderung, Volumenarbeit, Standard-Bildungsenthalpie, molare Standard- Bildungsenthalpie. 4 VP 1.2. Stelle
Chemie Klausur 12.1 1 21. Oktober 2002 Aufgaben Aufgabe 1 1.1. Definiere: Innere Energie, Enthalpieänderung, Volumenarbeit, Standard-Bildungsenthalpie, molare Standard- Bildungsenthalpie. 4 VP 1.2. Stelle
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Alkane einfache Kohlenwasserstoffe
 Dr. Anja Dombrowski andlungsorientierter hemieunterricht an Stationen Sekundarstufe uf I Anja Dombrowski Downloadauszug aus dem Originaltitel: andlungsorientierter hemieunterricht an Stationen Dieser Download
Dr. Anja Dombrowski andlungsorientierter hemieunterricht an Stationen Sekundarstufe uf I Anja Dombrowski Downloadauszug aus dem Originaltitel: andlungsorientierter hemieunterricht an Stationen Dieser Download
Herstellung des Benzoldiazoniumchlorids aus Anilin, Natriumnitrit und Salzsäure. Benzoldiazonium-Ion
 Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne
 1 Lösung 6 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne 6.1 Konformationsanalyse a) Zeichnen Sie für 2-Methylbutan die Konformationen als Newman-Projektionen
1 Lösung 6 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne 6.1 Konformationsanalyse a) Zeichnen Sie für 2-Methylbutan die Konformationen als Newman-Projektionen
