Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
|
|
|
- Gitta Messner
- vor 8 Jahren
- Abrufe
Transkript
1 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum:
2 Nomenklatur und Isomerie organischer Verbindungen Seite 2 von 18 2
3 Nomenklatur und Isomerie organischer Verbindungen Seite 3 von 18 Nomenklatur und Isomerie In der folgenden Abbildung ist eine Übersicht über die verschiedenen Formen der Isomerie gegeben: Isomere gleiches Bindungsmuster Stereoisomere unterschiedliches Bindungsmuster Strukturisomerie (Konstitutionsisomerie) Stereoisomere nicht durch Bindungsrotation ineinander überführbar durch Bindungsrotation überführbar Enatiomere Konfigurationsisomere Diastereomere otamere Konformationsisomere Isomere sind Verbindungen gleicher Summenformel aber mit unterschiedlicher Gestalt. Man unterscheidet zwischen Konstitutionsisomeren (Isomere mit unterschiedlicher Konnenktivität, welche nur durch Bindungsbruch ineinander überführbar sind) und Stereoisomeren (Isomere mit gleichem Bindungsmuster aber unterschiedlicher räumlicher Anordnung). Bei den Stereoismoeren unterscheidet man des weiteren zwischen Konfigurationsisomeren, zu denen die Enatiomere (verhalten sich wie Bild und Spiegelbild und sind nicht durch Drehung ineinander überführbar) und den Diastereomeren (verhalten sich nicht wie Bild und Spiegelbild, besitzen jedoch ein hiralitätszentrum) gehören und den Konformationsisomeren, welche durch Bindungsrotation ineinander überführt werden können. Im Folgenden soll die systematische Benennung von organischen Verbindungen nach IUPA erläutert werden. In diesem Zusammenhang werden verschiedenste Beispiele zu den oben genannten Isomerieformen gegeben. 3
4 Nomenklatur und Isomerie organischer Verbindungen Seite 4 von Nomenklatur der Alkane Die systematische Nomenklatur aller organischen Verbindung basiert auf der Benennung der Alkane. Alkane sind gradkettige, gesättigte Kohlenwasserstoffe, welche keine funktionelle Gruppe aufweisen. Die Summenformel der Alkane folgt der allgemeinen Gleichung: n 2n+2. In der folgenden Tabelle wird eine Übersicht über die homologe eihe der Alkane und ihre systematischen Namen gegeben. n Name Formel Sdp. [ ] Smp. [ ] 1 Methan 4-161,7-182,5 bei aum- 2 Ethan ,6-183,3 temperatur 3 Propan ,1-187,7 ein Gas 4 Butan ,5-138,3 5 Pentan ,1-129,8 bei T 6 exan ,7-95,3 flüssig 7 eptan ctan ctadecan 3 ( 2 ) ,1 28,2 bei T fest 19 Nonadecan ,7 32,1 Bei den Alkanen tritt ab dem Butan eine Form der Isomerie auf. Diese wird als Konstitutionsisomerie bezeichnet. Die Folge dieser Isomerieform sind verzweigte Alkane. Konstitutionsisomere: Isomere welche eine unterschiedliche Konnektivität aufweisen und nur durch Bindungsbruch ineinander überführbar sind. Beispiele für diese Form der Isomerie sind das n-exan, iso-exan und das Neohexan sowie das 2,3-Dimethylbutan. Sie alle folgen der Summenformel Somit sind sie alle Isomere des exans n-exan iso-exan Neohexan 3 3 2,3-Dimethylbutan 4
5 Nomenklatur und Isomerie organischer Verbindungen Seite 5 von 18 Wenn man sich die verschiedenen Isomere näher betrachtet stellt man fest, dass die Kohlenstoffatome unterschiedlich gebunden sind. Es gibt Kohlenstoffatome die an ein weiteres Kohlenstoffatom gebunden sind und welche die an zwei oder drei Kohlenstoffatome gebunden sind. Diese Kohlenstoffatome werden als primäre, sekundäre und tertiäre Kohlenstoffatome bezeichnet und es gibt sogar Verbindungen in denen sich quartäre Kohlenstoffatome finden lassen. primär sekundär 2 3 tertiär quartär IUPA: 2,2,3-Trimethylpentan Es stellt sich nun die Frage wie derartige Verbindung systematisch zu benennen sind. Dazu wurden laut IUPA die folgenden egeln zur Benennung von verzweigten Alkanen aufgestellt. Nomenklatur verzweigter Alkane egel 1: egel 2: egel 3: egel 4: Benennen Sie die längste Kette von Kohlenstoffatomen im Molekül. Benennen Sie die Substituenten an dieser Kette. Nummerieren Sie die Kette von dem Ende, das einem Susbtituenten am nächsten ist. Schreiben Sie den Namen des Alkans, indem Sie zunächst die Substituenten mit Anknüpfungspunkt in alphabetischer eihenfolge angeben und dann den Namen des Stammalkans anhängen. Beispiele: Ethyl-2-methylpentan 1-Ethylpropyl (1-Ethylpropyl)-2,3,5-trimethylnonan Sieht man sich nun die Alkane genauer an, so stellt man eine weitere Form der Isomerie fest - die Konformationsisomerie. 5
6 Nomenklatur und Isomerie organischer Verbindungen Seite 6 von 18 Konformationsisomere: Isomere welche die gleiche Konnektivität aufweisen, aber eine unterschiedliche räumliche Position besitzen. Sie lasssen sich durch otation um Bindungsachsen ineinander überführen. Diese soll im Folgenden anhand des Ethans erläutert werden. Beim Ethan ist eine freie Drehung um die Kohlenstoff-Kohlenstoff-Bindung möglich, so dass sich für die 2mal drei Wasserstoffatome verschiedene Positionen zueinander ergeben. Sieht man sich das Energie-Diagramm der otation um die Bindungsachse an, so stellt man fest, dass die gestaffelte Form des Ethans energetisch geringfügig günstiger ist, da dabei der Wasserstoff-Wasserstoffatom-Abstand am größten ist. Sieht man sich die otation um die zentrale Bindung des n-butans an, so stellt man ähnliches fest, wobei man hierbei zwischen weiteren energetisch unterschiedlichen Stellungen der Methylgruppen zueinander unterscheiden kann. 6
7 Nomenklatur und Isomerie organischer Verbindungen Seite 7 von ycloalkane Neben den kettenartigen und verzweigten Alkanen können Alkane jedoch noch inge bilden. Man spricht bei ringförmigen Alkanen von ycloalkanen. Die unterschiedlichen denkbaren ycloalkane besitzen aufgrund ihrer verschiedenen ingspannungen unterschiedliche Stabilität. Dabei stellt das yclopropan aufgrund seiner hohen Winkelspannung das instabilste ycloaklkan dar. Das yclohexan sowie das yclopentan besitzen geringe ingspannungen und sind somit ziemlich stabil. Bei den ycloalkanen gibt es eine weitere Form der Isomerie. Man bezeichnet sie als cis-trans-isomerie oder (E)-(Z)-Isomerie. Diese Form der Isomerie soll im Folgenden anhand des yclopropans erläutert werden. Die drei Kohlenstoffatome des yclopropans spannen eine Ebene auf. Betrachtet man das Molekül nun von dieser Ebene aus, so stellt man fest, das sich drei Wasserstoffatome über dieser Ebene und drei weitere unter der Ebene befindet. Ersetzt man nun zwei der Wasserstoffatome gegen zwei hloratome, so können diese beide auf einer Seite der Ebene liegen (cis- oder (Z)-Isomer) oder auf entgegengesetzten Seiten (transoder (E)-Isomer). Beispiele: Br l Br Br l cis: Substituenten auf gleicher Seite Br l l trans: unterschiedliche Seiten cis trans Br l Br l l l Br Br Diese Form der Isomerie gehört zur Konfigurationsisomerie. Konfigurationsisomere: Gleiche Atomverknüpfung, aber unterschiedlicher räumlicher Aufbau. 7
8 Nomenklatur und Isomerie organischer Verbindungen Seite 8 von 18 Die Benennung der ycloalkane erfolgt durch voranstellen der Bezeichnung yclovor den Stammnamen des betreffenden Alkans. 1.2 hiralität Eine weitere Form der Konfigurationsisomerie tritt bei den Enatiomeren auf. Enatiomere besitzen chirale Kohlenstoffatome, das heißt diese Kohlenstoffatome besitzen vier unterschiedliche Bindungspartner. hirale Moleküle sind optisch aktiv und besitzen keine Symmetrieachse. hiralität: Verbindungen, die ein -Atom mit 4 verschiedenen Substituenten besitzen, sind chiral. Sie können als 2 spiegelbildliche Isomere (Enantiomere) vorliegen. Ein 1:1-Gemisch der beiden Enatiomere wird acemat beziehungsweise racemisches Gemisch genannt. Bei dem asymmetrischen -Atom handelt es sich um ein hiralitäts- bzw. Stereozentrum. A D * B B A * D Spiegel Verbindungen die sich wie Bild und Spiegelbild verhalten bezeichnet man dabei als Enantiomere. Moleküle mit einem asymmetrischen Kohlenstoffatom die sich nicht wie Bild und Spiegelbild zueinander verhalten werden als Diastereomere bezeichnet. Im Folgenden werden einige Beispiele zu chiralen und achiralen Moleküle gegeben. F 3 I l l Br 3 3 Me achiral chiral achiral chiral 2 Ein Beispiel für eine bedeutende organische Verbindung mit einem asymmetrischen Kohlenstoffatom ist die Asparaginsäure. 8
9 Nomenklatur und Isomerie organischer Verbindungen Seite 9 von 18 Asparaginsäure 2 N N 2 N 2 N 2 In diesem Zusammenhang sei auch das zur traurigen Berümtheit gekommene ontagan oder Thalidomid genannt. Thalidomid (ontergan) teratogen N beruhigend N Bei chiralen Molekülen ist die räumliche Anordnung der Substituenten am asymmetrischen Kohlenstoff von Bedeutung und es stellt sich somit die Frage wie ein chirales Molekül eindeutig zu benennen ist. Um chirale Moleküle eindeutig benennen zu können verwendet man die IP- Nomenklatur, welche auch als ahn-ingold-prelog-egel bekannt ist. IP-Nomenklatur ahn-ingold-prelog-egel Benennung der absoluten Konfiguration - Die Substituenten an einem asymmetrischen -Atom wurden nach ihrer Priorität geordnet A 1 Priorität: B 2 3 D a > b > c > d 4 - Der Substituent mit der niedrigsten Priorität wird nach hinten gezeichnet S A A D B D B - Die Substituenten mit höchster Priorität geben eine Drehrichtung vor, die mit oder S bezeichnet wird. 9
10 Nomenklatur und Isomerie organischer Verbindungen Seite 10 von 18 Um die Priorität der verschiedenen Substituenten festzulegen benötigt man die Sequenzenregel. Die Priorität von Substituenten Die Sequenzregel egel 1: Die Atome an dem asymmetrischen -Atom werden nach Prioritäten (rdnungszahl) geordnet. egel 2: Bei Atomen mit gleicher rdnungszahl wird die weitere Kette betrachtet, bis es einen Unterschied in der Priorität gibt. egel 3: Mehrfachbindungen werden wie mehrere gesättigte Verbindungen betrachtet. Beispiele für die korrekte Nomenklatur von hitralen Molekülen: (S)-3-Ethyl-2,2,4-trimethylpentan I ()-2-Iodbutan Um chirale Moleküle einfach zeichnen zu können wendet man häufig eine von der obenstehenden Darstellung abweichende Form die Fischer Projektion. 1.3 Fischerprojektion Bei der Fischerprojektion betrachtet man das asymmetrische Kohlenstoffatom aus einem anderen Blickwinkel und zeichnet das Molekül nun so, dass das Kohlenstoffatom in der Papierebene liegt und die Bindungen nach oben und nach unten hinter die Papierebene zeigen. Die Bindungen nach links und rechts treten vor die Papierebene. ()-Milchsäure
11 Nomenklatur und Isomerie organischer Verbindungen Seite 11 von Benennung von Alkanen mit Substituenten In den letzten Kapiteln wurden schon mehrfach Verbindungen als Beispiele angeführt, bei denen ein Wasserstoffatom gegen ein anderes Atom oder eine andere Atomgruppierung ausgetauscht wurde. In diesem Kapitel soll nun die systematische Benennung von substituierten Alkanen erläutert werden. Zu besseren Übersichtlichkeit soll zunächst eine Tabelle der funktionellen Gruppen gezeigt werden. Verbidungsklasse allgemeine Struktur funktionelle Gruppe Alkane keine alogenalkane X X Alkohol (steht ein Sc hwefelatom an der stelle des Sauerstoffs, so spricht man von Thiolen) Ether ' Alkene Alkine aromatische Verbindungen Aldehyde Ketone arbonsäure Anhydride Ester Amide ' ' N Nitrile N N Amine N N N 11
12 Nomenklatur und Isomerie organischer Verbindungen Seite 12 von alogenalkanen Bei den alogenalkanen ist ein oder mehrere Wasserstoffatome gegen ein alogenatom ausgetauscht. Derartige Verbindungen werden durch das voranstellen des betreffenden alogennamens vor den Stammnamen des Alkans benannt. 3 3 I 2 l 2 3 Br Iodmethan Dichlormethan Alkohole und Thiole 2-Brom-2-methylpropan (+-Butylbromid) Alkohole sind Alkane bei denen ein oder mehrere Wasserstoffatome durch eine - Gruppierung ersetzt (bei Thiolen entsprechen durch eine S-Gruppe). Die Nomenklatur erfolgt analog zu den Alkanen durch anhängen der Endung ol. Beispiele (der systematische Name nach IUPA ist fett gedruckt): 3 3 Isopropanol oder 2-Propanol tertiär-butanol oder 2-Methyl-2-propanol Bei den Alkoholen ist es üblich anzugeben ob es sich um primäre, sekundäre tertiäre Alkohole handelt primärer Alkohol sekundärer Alkohol tertiärer Alkohol Neben den systematischen Benennung gibt es bei den Alkoholen einige Verbindungen, welche besser unter einem Trivialnamen bekannt sind. Beispiele hierfür sind: Trivialnamen ,2,3-Trihydroxypropan (Glycerin) Phenol Ethanol (Alkohol) 12
13 Nomenklatur und Isomerie organischer Verbindungen Seite 13 von Ether Ether sind Kohlenwasserstoffverbindungen bei denen sich innerhalb der Kohlenstoffkette ein Sauerstoffatom befindet. Ihre Benennung erfolgt durch das alphabetische Voranstellen der Alkylgruppen vor die Endung ether. Beispiel: Diethylether 2.4 Aldehyde Aldehyde sind Verbindungen bei denen ein endständiges Kohlenstoffatome eine Doppelbindung zu einem Sauerstoffatom aufweist. Ihre Benennung erfolgt durch das Anhängen der Endung -al an den Stammnamen des betreffenden Kohlenwasserstoffs. Beispiele: 3 Methanal (Formaldehyd) Ethanal (Acetaldehyd) Benzaldehyd yclopentylcarbaldehyd 2.5 Ketone Der Name eines Ketons ergibt sich durch Anhängen der Endung on an den Stammnamen des betreffenden Alkans. Beispiele: Propanon 2-Butanon Methylphenylketon yclohexanon 13
14 Nomenklatur und Isomerie organischer Verbindungen Seite 14 von arbonsäuren Die Benennung der arbonsäure erfolgt durch Anhängen der Endung säure an den Stammnamen des Alkans. Beispiel: 3 Ethansäure (Essigsäure) 2.7 Ester Ester sind Verbindungen die aus der eaktion von arbonsäuren mit Alkoholen entstehen. Ihr Name leitet sich von den entsprechenden Namen der arbonsäuren und des Alkohols und Anhängen der Endung ester ab. 3 3 Ethansäuremethylester (Methylacetat) yclische Ester werden als Lactone bezeichnet. Wird bei einer arbonsäure die - Gruppierung durch hlorid ersetzt spricht man von einem arbonsäurechlorid. Beim Ersetzen der -Gruppe durch eine Amidgruppierung spricht man entsprechend von arbonsäureamiden. Verbindungen in denen die -Gruppe durch eine Amingruppe ausgetauscht ist und die cyclisch sind werden als Lactame bezeichnet. 3 l Ethansäurechlorid 3 N ' ' Ethansäureamid (Essigsäureamid) Lacton N Lactam 14
15 Nomenklatur und Isomerie organischer Verbindungen Seite 15 von Amine Amine sind Verbindungen, welche Stickstoff enthalten. Ihre Benennung erfolgt durch das Anhängen der Endung -amin an den entsprechenden Alkylrest. 3 2 N 2 ( 3 2 )N ( 3 2 ) 3 N Ethylamin Diethylamin Triethylamin 3 2 N 3 2 N N Ethylmethylamin Ethyl(propyl)amin Ethylpropylamin Eine Aminverbindung von großer technischer Bedeutung ist das Benzolderivat Anilin. N 2 Anilin 15
16 Nomenklatur und Isomerie organischer Verbindungen Seite 16 von Alkene oder lefine Alkene sind ungesättigte Kohlenwasserstoffe, dass heißt sie besitzen Kohlenstoff- Kohlenstoff-Doppelbindungen. Nomenklatur der Alkene - Endung en (-dien, -trien ) - --Dreifachbindung? Alkine? Endung in - beides: -enin - Wählen Sie die längste Kette, die die Doppelbindung (=) enthält Buten nicht Penten - Nummerieren Sie von dem Ende, das der Doppelbindung am nächsten ist nicht nicht Geben Sie nur das niedrigste -Atom der Doppelbindung an Propen nicht 2-Propen - Mehrere Doppelbindungen nicht 1 1,3-Pentadien Neben diesen regeln zur Benennung von Alkenen ist noch die cis-trans-isomerie der Alkene zu beachten. trans-yclodecen: cis-yclodecen cis oder Z-2-Buten Z = zusammen 3 trans oder E-2-Buten E = entgegen 16
17 Nomenklatur und Isomerie organischer Verbindungen Seite 17 von Aromatische Verbindungen Aromatische Verbindungen sind planere, cyclische Kohlenwasserstoffverbindungen, welche konjugierte Kohlenstoff-Kohlenstoffdoppelbindungen aufweisen. Ihr bekanntester Vertreter ist das Benzol. Vom Benzol leiten sich nahezu alle bedeutenden Aromaten ab. Daher wird hier auch nur die Benennung von Benzolderivaten erläutert. Die Benennung von Aromaten erfolgt durch das Benennen des Substituenten und anschließendes anhängen der Endung benzol. Da Benzolderivat meist von großer technischer Bedeutung sind, haben viele vom Benzol abgeleitete Verbindungen Trivialnamen Toluol (Methylbenzol) Styrol Phenol umol Benzaldehyd N 2 Br N 2 l l Benzoesäure Anilin Brombenzol Nitrobenzol ortho-dichlorbenzol Bei zweifach substituierten Benzolverbindungen gibt es verschiedene Möglichkeiten die Substituenten zu positionieren. Aus diesem Grunde wurden verschiedene Bezeichnungen für die Positionen eingeführt ortho-stellung 2 meta-stellung 2 para-stellung 17
18 Nomenklatur und Isomerie organischer Verbindungen Seite 18 von Alkine Die Benennung der Alkine erfolgt analog zur Benennung der Alkene, wobei statt der Endung en in eingesetzt wird. Beispiele: Ethin (Acetylen) 2-Butin (Dimethylacetylen) 2-Propin-1-ol (Propargylalkohol) 18
4-Butyl-2,5-dimethylheptan 5-Ethyl-4,8-dimethylundecan
 Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
IUPAC-Nomenklaturregeln als Grundlage für Q11 Chemie
 Nomenklatur 1 IUPA-Nomenklaturregeln als Grundlage für Q11 hemie 1 Kohlenwasserstoffe und Derivate 1.1 Regeln zur Benennung von unverzweigten Alkanen (n-alkane) Der Name der n-alkane enthält die folgenden
Nomenklatur 1 IUPA-Nomenklaturregeln als Grundlage für Q11 hemie 1 Kohlenwasserstoffe und Derivate 1.1 Regeln zur Benennung von unverzweigten Alkanen (n-alkane) Der Name der n-alkane enthält die folgenden
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 10 Stereochemie (Thema 11.1 11.4) Aufgabe 1: a) Zeichnen Sie den Isomeren-Stammbaum auf. b) Erklären Sie folgende Isomerie-Arten: i) Konstitutionsisomere Konstitutionsisomere
Chemie für Biologen, 2017 Übung 10 Stereochemie (Thema 11.1 11.4) Aufgabe 1: a) Zeichnen Sie den Isomeren-Stammbaum auf. b) Erklären Sie folgende Isomerie-Arten: i) Konstitutionsisomere Konstitutionsisomere
Beispielklausur Allgemeine Chemie II (Organische Chemie)
 Beispielklausur Allgemeine hemie II (rganische hemie) für Studierende mit hemie als Nebenfach zum Üben LÖSUNGEN (Teilweise gibt es viele mögliche richtige Antworten, dann sind lediglich Beispiele angegeben.)
Beispielklausur Allgemeine hemie II (rganische hemie) für Studierende mit hemie als Nebenfach zum Üben LÖSUNGEN (Teilweise gibt es viele mögliche richtige Antworten, dann sind lediglich Beispiele angegeben.)
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Übung 9: Aufbau und Struktur organischer Verbindungen Übung für Medizinische Biologen - Jun.-Prof. Dr. Michael Giese.
 Zusammenfassung Aufbau und Struktur organischer Verbindungen Kohlenstoff besitzt eine Sonderstellung unter den Elementen ybridisierungsmodell beschreibt die Bindungsverhältnisse in Kohlenstoffverbindungen
Zusammenfassung Aufbau und Struktur organischer Verbindungen Kohlenstoff besitzt eine Sonderstellung unter den Elementen ybridisierungsmodell beschreibt die Bindungsverhältnisse in Kohlenstoffverbindungen
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Organische Chemie. 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8. Lehrstuhl für Organische Chemie
 Organische Chemie 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8 Lehrstuhl für Organische Chemie (ivanov43@gmail.com) Prof. Dr. Ivo C. Ivanov 1 1. Gegenstand der Organischen Chemie,
Organische Chemie 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8 Lehrstuhl für Organische Chemie (ivanov43@gmail.com) Prof. Dr. Ivo C. Ivanov 1 1. Gegenstand der Organischen Chemie,
2. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
Einführung in die Nomenklatur der organischen Chemie. Einteilung der Kohlenwasserstoffe
 organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
EINFÜHRUNG IN DIE ORGANISCHE CHEMIE
 rganische Chemie Lehrgang CEMIE FÜR BILGIELERKRÄFTE EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs
rganische Chemie Lehrgang CEMIE FÜR BILGIELERKRÄFTE EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
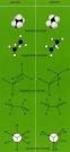 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
Alkane und Cycloalkane
 Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Wiederholung Grundlagen OC
 Wiederholung Grundlagen C 28.04.2017 Auswertung Stichprobe Frage 1: Die oben abgebildete Strukturformel zeigt 25 20 15 10 5 0 Ether Ester Acetal Keton Ester+Weiteres Frage 2: Die absolute Konfiguration
Wiederholung Grundlagen C 28.04.2017 Auswertung Stichprobe Frage 1: Die oben abgebildete Strukturformel zeigt 25 20 15 10 5 0 Ether Ester Acetal Keton Ester+Weiteres Frage 2: Die absolute Konfiguration
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Z 8 EINFÜHRUNG IN DIE ORGANISCHE CHEMIE 1) DEFINITIONEN 2) ELEMENTE UND BINDUNGEN. Organische Chemie. Kunstoffe. Farbstoffe
 EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
Konfigurationsisomerie
 Konfigurationsisomerie Enatiomerie, Diastereomerie (σ undπ). Prof.Dr. Ivo C. Ivanov 1 Optische Aktivität Zur Bestimmung des Drehwertes bedient man sich eines Polarimeters, dessen Aufbau nachfolgend schematisch
Konfigurationsisomerie Enatiomerie, Diastereomerie (σ undπ). Prof.Dr. Ivo C. Ivanov 1 Optische Aktivität Zur Bestimmung des Drehwertes bedient man sich eines Polarimeters, dessen Aufbau nachfolgend schematisch
L.9 Organische Chemie I
 L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Ein Alkan, dem ein H-Atom fehlt, wird Alkyl-Rest genannt. Der Name ergibt sich aus dem Alkan, jedoch mit der Endung yl:
 Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Kohlenwasserstoffe. sp 3 -Orbitale. Alkane. Alkene. sp 2 - Orbitale p z - Orbital. sp -Orbitale p y, p z - Orbitale. Alkine
 Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Grundwissen 10. Klasse NTG 1
 Grundwissen 10. Klasse NTG 1 1. rganische hemie = Kohlenstoffchemie rganische Verbindungen sind Kohlenstoffverbindungen. Ausnahmen:, 2, Kohlensäure, arbonate; 2. Eigenschaften organischer Verbindungen
Grundwissen 10. Klasse NTG 1 1. rganische hemie = Kohlenstoffchemie rganische Verbindungen sind Kohlenstoffverbindungen. Ausnahmen:, 2, Kohlensäure, arbonate; 2. Eigenschaften organischer Verbindungen
Isomerie organischer Verbindungen
 15 Isomerie organischer Verbindungen Organische Verbindungen können, bei gleicher Summenformel, sehr unterschiedliche Strukturen besitzen. Moleküle mit gleicher Summenformel aber unterschiedlicher Struktur
15 Isomerie organischer Verbindungen Organische Verbindungen können, bei gleicher Summenformel, sehr unterschiedliche Strukturen besitzen. Moleküle mit gleicher Summenformel aber unterschiedlicher Struktur
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
Homologe Reihe der Alkane. Benennung der Alkane. Konstitutionsisomerie. Isomerie. Was versteht man unter der Homologen Reihe der Alkane?
 Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
1 Stoffklasse Alkane : C n H 2n+2 Namensendung an
 rganische hemie LÖSUNGEN Seite 1 von 11 1 Stoffklasse Alkane : n 2n+2 Namensendung an Zahl der -Atome Name Molekülformel Lewisformel Keilstrichformel Skelettformel 1 Methan 4 Sinnlos 2 Ethan 2 6 3 Propan
rganische hemie LÖSUNGEN Seite 1 von 11 1 Stoffklasse Alkane : n 2n+2 Namensendung an Zahl der -Atome Name Molekülformel Lewisformel Keilstrichformel Skelettformel 1 Methan 4 Sinnlos 2 Ethan 2 6 3 Propan
Beispielklausur Allgemeine Chemie II (Organische Chemie)
 Beispielklausur Allgemeine Chemie II (rganische Chemie) für Studierende mit Chemie als Nebenfach zum Üben 1. Zeichnen Sie für die folgenden Stoffklassen jeweils die Strukturformel einer dazu passenden
Beispielklausur Allgemeine Chemie II (rganische Chemie) für Studierende mit Chemie als Nebenfach zum Üben 1. Zeichnen Sie für die folgenden Stoffklassen jeweils die Strukturformel einer dazu passenden
Kohlenstoffverbindungen
 Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Vokabular zur Stereochemie
 Vokabular zur tereochemie Zwei Moleküle mit gleicher ummenformel sind: deckungsgleich = identisch Isomere Konstitutionsisomere tereoisomere Enantiomere Diastereomere Konstitutionsisomere: Moleküle mit
Vokabular zur tereochemie Zwei Moleküle mit gleicher ummenformel sind: deckungsgleich = identisch Isomere Konstitutionsisomere tereoisomere Enantiomere Diastereomere Konstitutionsisomere: Moleküle mit
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
Prof. Dr. Thomas Heinze Institut für Organische Chemie und Makromolekulare Chemie Humboldtstraße Jena
 Vorlesung/Seminare Organische Chemie für Materialwissenschaften Prof. Dr. Thomas Heinze Institut für Organische Chemie und Makromolekulare Chemie Humboldtstraße 10 07743 Jena 03641/9 48270 03641/9 48271
Vorlesung/Seminare Organische Chemie für Materialwissenschaften Prof. Dr. Thomas Heinze Institut für Organische Chemie und Makromolekulare Chemie Humboldtstraße 10 07743 Jena 03641/9 48270 03641/9 48271
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen Chemie Jahrgangsstufe 10 (NTG)
 Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
Grundwissen Chemie Jahrgangsstufe 10 (NTG) Die organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen. Kohlenstoffkreislauf ATMSPHÄE (C 2 ) BISPHÄE (Lebewesen) LITHSPHÄE HYDSPHÄE (Gesteine)
I. Alkane Homologe Reihe, Nomenklatur
 Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Clara Schumann -Gymnasium Grundlagen der organischen Chemie
 1 lara Schumann -Gymnasium Grundlagen der organischen hemie Ein Leitprogramm für den Grundlagen-hemieunterricht der Sekundarstufe II Dr. Daniel Bürgisser Neue Kantonsschule Aarau Revision 2003 Modifiziert:
1 lara Schumann -Gymnasium Grundlagen der organischen hemie Ein Leitprogramm für den Grundlagen-hemieunterricht der Sekundarstufe II Dr. Daniel Bürgisser Neue Kantonsschule Aarau Revision 2003 Modifiziert:
Energie. 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital
 sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
Organische Chemie. Kohlenstoff. Kohlenstoffkreislauf. Erdölverarbeitung. Kohlenwasserstoffe
 rganische hemie Teilgebiet der hemie, welches sich mit Aufbau, erstellung und Eigenschaften der Verbindungen des Kohlenstoffs beschäftigt. NTG 10.1 Kohlenstoff - 4. auptgruppe 4 Valenzelektronen 4 Bindungen
rganische hemie Teilgebiet der hemie, welches sich mit Aufbau, erstellung und Eigenschaften der Verbindungen des Kohlenstoffs beschäftigt. NTG 10.1 Kohlenstoff - 4. auptgruppe 4 Valenzelektronen 4 Bindungen
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Chemie. Elektrochemie, Alkane und Alkene
 Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 E 102.1: Grundlagen der hemie - Organische hemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane: Moleküle ohne funktionelle Gruppen
E 102.1: Grundlagen der hemie - Organische hemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane: Moleküle ohne funktionelle Gruppen
Summenformel. Strukturformel. Halbstrukturformel. Fossile Energieträger. ( 10. Klasse NTG 1 / 47 ) ( 10. Klasse NTG 2 / 47 ) ( 10. Klasse NTG 3 / 47 )
 Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
Stereoisomerie. C 2 H 4 O 2 Schmelzpunkt 17 Grad Celcius
 3. Stereochemie Stereoisomerie Definition Isomerie: Als Isomere bezeichnet man Moleküle mit gleicher Summenformel, die sich jedoch in der Sequenz der Atome (Konstitutionsisomere) oder deren räumlichen
3. Stereochemie Stereoisomerie Definition Isomerie: Als Isomere bezeichnet man Moleküle mit gleicher Summenformel, die sich jedoch in der Sequenz der Atome (Konstitutionsisomere) oder deren räumlichen
Chemie. für die Berufsmaturität. Günter Baars. Chemie. Baars. Unter Mitarbeit von Franz Heini, Markus Isenschmid und Doris Kohler
 www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
Klausur zur Vorlesung Allgemeine Chemie II (Organische Chemie) für Studierende der Agrarwissenschaften und der Ökotrophologie. Wintersemester 2002/03
 Klausur zur Vorlesung Allgemeine hemie II (rganische hemie) für Studierende der Agrarwissenschaften und der Ökotrophologie Wintersemester 2002/03 Name: Studienfach: Korrekturbogen Matrikelnummer: Ich versichere,
Klausur zur Vorlesung Allgemeine hemie II (rganische hemie) für Studierende der Agrarwissenschaften und der Ökotrophologie Wintersemester 2002/03 Name: Studienfach: Korrekturbogen Matrikelnummer: Ich versichere,
ORGANISCHE CHEMIE. Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen
 ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Verzeichnis der Wortabkürzungen... Verzeichnis der Zeichen und Symbole...XVII
 VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
IUPAC Nomenklatur. Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten. Feld 2: Stammname der Verbindung
 Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten Feld 2: Stammname der Verbindung Feld 3: Grad der Ungesättigtheit Feld 4: funktionelle Gruppe mit höchster
Der Name eines Moleküls wird in 4 Felder aufgeteilt: Feld 1: Name und Position von Substituenten Feld 2: Stammname der Verbindung Feld 3: Grad der Ungesättigtheit Feld 4: funktionelle Gruppe mit höchster
Vorlesung 5. Alkane. Experimentalchemie, Prof. H. Mayr 20 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. Anzahl C-Atome im n-alkan
 Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
IUPAC Nomenklatur. Der Name eines Moleküls wird in 3 Felder aufgeteilt: Feld 1: Name und Position von Substituenten (Präfixe)
 Der Name eines Moleküls wird in 3 Felder aufgeteilt: Feld 1: Name und Position von Substituenten (Präfixe) Feld 2: Stammkern der Verbindung Feld 3: funktionelle Gruppe mit höchster Priorität (Suffix) Substituenten/
Der Name eines Moleküls wird in 3 Felder aufgeteilt: Feld 1: Name und Position von Substituenten (Präfixe) Feld 2: Stammkern der Verbindung Feld 3: funktionelle Gruppe mit höchster Priorität (Suffix) Substituenten/
Inhaltsverzeichnis. 3 Organische Chemie. Vorwort Chemische Bindung Chemische Reaktionstypen Bindungen...
 VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
4. Stereoisomerie! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind!
 4. Stereoisomerie! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind! http://de.wikipedia.org/wiki/datei:isomerism ball de.svg OC I Lehramt F. H. Schacher 1 Stereoisomerie andere
4. Stereoisomerie! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind! http://de.wikipedia.org/wiki/datei:isomerism ball de.svg OC I Lehramt F. H. Schacher 1 Stereoisomerie andere
4. Stereoisomerie. ! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind! Organische Chemie I LA / J. C.
 4. Stereoisomerie! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind! http://de.wikipedia.org/wiki/datei:isomerism-ball-de.svg Organische Chemie I LA / J. C. Brendel 1 Stereoisomerie
4. Stereoisomerie! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind! http://de.wikipedia.org/wiki/datei:isomerism-ball-de.svg Organische Chemie I LA / J. C. Brendel 1 Stereoisomerie
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
LÖSUNGSBOGEN... Name Vorname Matr.-Nr.
 Christian-Albrechts-Universität zu Kiel Kiel, 16. 07. 2004 Institut für rganische Chemie Klausur zur Vorlesung Allgemeine Chemie II (rg.chem.) Sommersemester 2004 FÜR STUDIENFAC (Zutreffendes bitte ankreuzen)
Christian-Albrechts-Universität zu Kiel Kiel, 16. 07. 2004 Institut für rganische Chemie Klausur zur Vorlesung Allgemeine Chemie II (rg.chem.) Sommersemester 2004 FÜR STUDIENFAC (Zutreffendes bitte ankreuzen)
1. Nomenklatur (Fettgedruckt...IUPAC Namen) 1.1. Alkane
 rganisch-chemisches Proseminar für Molekulargenetiker und Mikrobiologen AAG. omenklatur (Fettgedruckt...IUPA amen).. Alkane Die längste Kohlenstoffkette wird bestimmt und daraus ergibt sich der ame Alkan:
rganisch-chemisches Proseminar für Molekulargenetiker und Mikrobiologen AAG. omenklatur (Fettgedruckt...IUPA amen).. Alkane Die längste Kohlenstoffkette wird bestimmt und daraus ergibt sich der ame Alkan:
Inhaltsverzeichnis VII. Vorwort... V
 VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
Zur Benennung organischer Moleküle
 Zur Benennung organischer Moleküle Beispiele und Übungen Funktionelle Gruppen Es sind Atomgruppen in organischen Verbindungen. Sie verändern die Stoffeigenschaften und das Reaktionsverhalten des Ausgangskohlenwasserstoffs.
Zur Benennung organischer Moleküle Beispiele und Übungen Funktionelle Gruppen Es sind Atomgruppen in organischen Verbindungen. Sie verändern die Stoffeigenschaften und das Reaktionsverhalten des Ausgangskohlenwasserstoffs.
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
c) Gleichzeitiger Bruch der C-X-Bindung und der C-H-Bindung
 Eliminierungen Das Nucleophil mit seinem freien Elektronenpaar muß nicht am Kohlenstoffatom der C-- Bindung angreifen, es kann auch am nächsten Kohlenstoffatom ein Proton abstrahieren und somit als Base
Eliminierungen Das Nucleophil mit seinem freien Elektronenpaar muß nicht am Kohlenstoffatom der C-- Bindung angreifen, es kann auch am nächsten Kohlenstoffatom ein Proton abstrahieren und somit als Base
Kennsilbe. -an. -en -in. -yl. -ol. -al (VI) -on. (VII) -säure (VIII)
 Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Chemie Alkohole, Aldehyde & Ketone, Carbonsäuren
 Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Zahl der C-Atome Allgemeine Summenformel C n H 2n+ ₂
 1 Kohlenwasserstoffe Übungsaufgaben zum Kapitel sauerstoffhaltige organische Verbindungen mit Hilfe des Lernprogramms Isomerer 1.1 Ergänze mit Hilfe des Programms "Isomerer" die folgende Tabelle für nur
1 Kohlenwasserstoffe Übungsaufgaben zum Kapitel sauerstoffhaltige organische Verbindungen mit Hilfe des Lernprogramms Isomerer 1.1 Ergänze mit Hilfe des Programms "Isomerer" die folgende Tabelle für nur
Organische Chemie für MST 6. Lienkamp/ Prucker/ Rühe
 Organische Chemie für MST 6 Lienkamp/ Prucker/ Rühe Valenzisomere Inhalt 6 Isomerie Konstitutionsisomere Tautomere/ Protonenisomere (= Strukturisomere) Skelett-Isomere Isomerie Isomere = Substanzen mit
Organische Chemie für MST 6 Lienkamp/ Prucker/ Rühe Valenzisomere Inhalt 6 Isomerie Konstitutionsisomere Tautomere/ Protonenisomere (= Strukturisomere) Skelett-Isomere Isomerie Isomere = Substanzen mit
Homologe Reihe. Alkane. Alkene. Alkine
 GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Organische Chemie II. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
Organische Chemie. Einstieg. Chemie-Formeldarstellungen. Formeldarstellungen der Chemie: Bei Ionenverbindungen: Verhältnisformeln. , AlF 3. etc.
 Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Nomenklatur organischer Verbindungen nach den IUPAC-Regeln Hier findest Du die Zauberformel!
 Nomenklatur organischer Verbindungen nach den IUPAC-Regeln Hier findest Du die Zauberformel! Prof. Dr. Ivo C. Ivanov Einführung (interaktive Vorlesung) Die genaue Benennung organischer Verbindungen nach
Nomenklatur organischer Verbindungen nach den IUPAC-Regeln Hier findest Du die Zauberformel! Prof. Dr. Ivo C. Ivanov Einführung (interaktive Vorlesung) Die genaue Benennung organischer Verbindungen nach
ORGANISCHE CHEMIE. Katherina Standhartinger. für Ahnungslose Eine Einstiegshilfe für Studierende. von Katherina Standhartinger, Memmingen
 Katherina Standhartinger ORGANISCHE CHEMIE für Ahnungslose Eine Einstiegshilfe für Studierende von Katherina Standhartinger, Memmingen Mit 150 Abbildungen und 35 Tabellen S. Hirzel Verlag Stuttgart r VII
Katherina Standhartinger ORGANISCHE CHEMIE für Ahnungslose Eine Einstiegshilfe für Studierende von Katherina Standhartinger, Memmingen Mit 150 Abbildungen und 35 Tabellen S. Hirzel Verlag Stuttgart r VII
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Aldehyde, Ketone und Kohlenhydrate
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Aldehyde, Ketone und Kohlenhydrate Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Aldehyde,
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Aldehyde, Ketone und Kohlenhydrate Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Aldehyde,
Lösungen zu Übung 22
 rganische hemie I Lösungen zu Übung 22 1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan
rganische hemie I Lösungen zu Übung 22 1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan
Übungsbeispiele Kapitel Organische Verbindungen
 Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! 3-Ethylheptan-2-on
 15-3 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Anilin Propionsäure Phenol 3-Ethylheptan-2-on Glycerin Formaldehyd Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
15-3 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Anilin Propionsäure Phenol 3-Ethylheptan-2-on Glycerin Formaldehyd Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
Grundwissen der 10.Klasse NTG
 Grundwissen der 10.Klasse NTG 1. Kohlenwasserstoffe 1.1 Alkane 1.1.1 Organische Stoffe = Verbindungen, die Kohlenstoffatome enthalten Ausnahme: Kohlenstoffoxide, Kohlensäure, Carbonate 1.1.2 Kohlenwasserstoffe
Grundwissen der 10.Klasse NTG 1. Kohlenwasserstoffe 1.1 Alkane 1.1.1 Organische Stoffe = Verbindungen, die Kohlenstoffatome enthalten Ausnahme: Kohlenstoffoxide, Kohlensäure, Carbonate 1.1.2 Kohlenwasserstoffe
Die Welt der Gifte. Bearbeitet von Karsten Strey
 Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
4.1. Gesättigte Kohlenwasserstoffe (Alkane)
 4. Stoffgruppen 4.1. Gesättigte Kohlenwasserstoffe (Alkane) ffenkettige Alkane à für n C-Atome ergibt sich: C n 2n+2 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 3 C C 3 3 C C 3 C 4 10 3 C C 3 à Es gibt
4. Stoffgruppen 4.1. Gesättigte Kohlenwasserstoffe (Alkane) ffenkettige Alkane à für n C-Atome ergibt sich: C n 2n+2 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 3 C C 3 3 C C 3 C 4 10 3 C C 3 à Es gibt
Lernkontrollen Medizinerpraktikum LK 3. - eine kleine Sammlung verschiedener, alter Lernkontrollen mit Lösungen -
 Lernkontrollen Medizinerpraktikum LK 3 - eine kleine Sammlung verschiedener, alter Lernkontrollen mit Lösungen - Lernkontrollen zur Übung - LK 3a SS 1996 1.) (2.5) Welche absolute Konfiguration (R oder
Lernkontrollen Medizinerpraktikum LK 3 - eine kleine Sammlung verschiedener, alter Lernkontrollen mit Lösungen - Lernkontrollen zur Übung - LK 3a SS 1996 1.) (2.5) Welche absolute Konfiguration (R oder
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
CH CH 2 H 2 C H 2 C CH 2 CH CH CH 2 CH 2 C H H 2 C CH 2 C 2 CH 2 H CH 2 CH 2
 Eine spezielle Form von Kohlenwasserstoffen, die ebenfalls nur Einfachbindungen besitzt, genügt nicht der allgemeinen Summenformel n n+ sondern besitzt die allgemeine Summenformel n n. Diese Alkane sind
Eine spezielle Form von Kohlenwasserstoffen, die ebenfalls nur Einfachbindungen besitzt, genügt nicht der allgemeinen Summenformel n n+ sondern besitzt die allgemeine Summenformel n n. Diese Alkane sind
Grundwissen Chemie Mittelstufe (10 MNG)
 Grundwissen hemie Mittelstufe (10 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Grundwissen hemie Mittelstufe (10 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt
 Chemisches Praktikum für Studierende der umanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 2. Klausur zum 2. Praktikumsteil (C) vom 25.07.17 NAME;
Chemisches Praktikum für Studierende der umanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 2. Klausur zum 2. Praktikumsteil (C) vom 25.07.17 NAME;
