CHE 102.1: Grundlagen der Chemie - Organische Chemie
|
|
|
- Frida Frank
- vor 6 Jahren
- Abrufe
Transkript
1 E 102.1: Grundlagen der hemie - Organische hemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane: Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannte organische Substanzen. Glücklicherweise können diese Verbindungen auf Grund ihrer funktionellen Gruppen in Substanz-Klassen eingeordent werden. Die funktionellen Gruppen bestimmen die Eigenschaften und die Reaktivität des gesamten Moleküls, und chemische Reaktionen laufen fast ausschliesslich an ihnen ab. Z.B. Die = Doppelbindungen in Ethylen und a-pinen reagieren mit Brom in ähnlicher Weise: Eine Liste der am häufigsten vorkommenden funktionellen Gruppen ist separat beigelegt. Sie können, zum Beispiel, in folgende Kategorien klassifiziert werden: Funktionelle Gruppen mit - hrfachbindungen
2 Eine Einfachbindung zwischen und einem elektronegativen Atom X O O N 2 S X = F, l, Br, I alogenalkan Alkohol Ether Amin Thiol Funktionelle Gruppen mit einer =O Doppelbindung (arbonyl Gruppe) O O O O O O OR N Aldehyd Keton arbonsäure Ester Amid 2.2 Alkane (Moleküle ohne funktionelle Gruppen): Nomenklatur, Isomerie, Konformation. Moleküle, deren empirische Formel der allgemeinen Form x y entspricht, bezeichnet man als Kohlenwasserstoffe. Kohlenwasserstoffe, die nur Einfachbindungen enthalten, tragen die Bezeichnung Alkane oder gesättigte Kohlenwasserstoffe (saturated hydrocarbon). Alkane lassen sich aufgrund ihrer Struktur in verschiedene Typen unterteilen: die geradkettigen Alkane, die verzweigten Alkane, in denen sich in der Kohlenstoffkette ein oder mehrere Verzweigungspunkte befinden, und die cyclischen Alkane oder ycloalkane sowie die komplizierteren bicyclischen, tricyclischen und polycyclischen Alkane.
3 Moleküle, welche dieselbe Molekularformel (Summenformel) haben, aber unterschiedliche chemische oder physikalische Eigenschaften besitzen, nennt man Isomere. Z.B. existieren zwei 4 10 Moleküle und drei mögliche 5 12 Moleküle. Mit der Summenformel findet man 4,111,846,763 mögliche Isomere. Man unterscheidet zwischen zwei Arten von Isomerie : Konstitutionsisomerie und Stereoisomerie. Beide kann man in allen organischen Stoffklassen antreffen (Stereoisomerie wird später behandelt). Konstitutionsisomere besitzen die gleiche Summenformel, aber sie unterscheiden sich durch die Verknüpfungsweise ihrer Atome und Gruppen. Sie unterscheiden sich also in ihren Konstitutionen (Atomverknüpfungen, Konnektivitäten) : z.b.
4 Die ersten vier Alkane haben eigene Namen, die in das IUPA-System mit aufgenommen wurden (International Union of Pure and Applied hemistry), aber alle enden auf -an : Namen der geradkettigen Alkane n 2n+2 ; Mit Ausname der vier ersten setzen sich die Namen der Alkane aus dem griechischen Zahlwort für die Anzahl der -Atome und der Endung -an zusammen. n Name FORMEL 1 than 4 2 Ethan Propan Butan Pentan 3 ( 2 ) exan 3 ( 2 ) eptan 3 ( 2 ) Octan 3 ( 2 ) Nonan 3 ( 2 ) Decan 3 ( 2 ) Undecan 3 ( 2 ) Dodecan 3 ( 2 ) Tridecan 3 ( 2 ) Tetradecan 3 ( 2 ) Pentadecan 3 ( 2 ) exadecan 3 ( 2 ) eptadecan 3 ( 2 ) Octadecan 3 ( 2 ) Nonadecan 3 ( 2 ) Eicosan 3 ( 2 ) 18 3
5 Die formal durch Abspaltung eines -Atoms gebildete Gruppe ( 3, 2 5, ) erhält die Endung -yl ( thyl, Ethyl,...) Wenn man verzweigte Alkane benennen möchte, muss man den IUPA-Nomenklatur-Regeln folgen ;oder i) Suchen Sie die längste Kette von Kohlenstoffatomen im Molekül und benennen Sie diese Bei zwei Ketten mit der gleichen länge, hat die mit mehr Substituenten Vorrang ii) Bestimmen Sie die Namen der an die längste Kette gebundenen Alkylgruppen iii) Numerieren Sie die Kohlenstoffatome der längsten Kette von dem Ende her, das einer Substitution am nächsten ist.
6 und bei 2 Substituenten mit dem gleichen Abstand vom Kettenende dann alphabetisch iv) Schreiben Sie den Namen des Alkans, indem Sie zunächst die Namen der Seitenketten in alphabetischer Reihenfolge ordnen (jedem geht die Nummer des Kohlenstoffatoms, an das es gebunden ist und ein Bindestrich voraus), und fügen sie dann den Namen des Stammalkans, wie am Rand gezeigt, hinzu. 2.3 Physikalische Eigenschaften der Alkane Wie sehen nun die dreidimensionalen Strukturen der Alkane aus, und welche physikalische Eigenschaften haben sie? Bei Raumtemperatur sind die homologen Alkane mit kleinerer molarer Masse Gase oder farblose Flüssigkeiten und mit grösserer molarer Masse Feststoffe:
7 2.4 hemische Eigenschaften Bei Raumtemperatur sind die Alkane gegenüber den meisten Reagenzien praktisch völlig inert. Wird ein Gemisch eines Alkans mit hlor oder mit Brom kräftig belichtet, findet eine alogenierung statt. Die Verbrennung der Alkane zu O 2 und 2 O verläuft stark exotherm : O 2 O O Kcal/mol Die grössten natürlichen Quellen von Alkanen sind im Erdöl. In den USA stammen um 99% aller organischen Rohstoffe aus Erdöl : Schmieröl Paraffinwachse Asphalt Erdöl Gasöl, Dieselöl ( ) Kerosin, eizöl ( ) Erdgas ( 1-4 ) Erdgasbenzin Petrolether ( 5-11 ) 2.5 Konformation Strukturen, die durch Drehung um Einfachbindungen ineinander übergeführt werden können, bezeichnet man als Konformationen. Für das Molekül des Ethans, dessen --Bindung eine rotationssymmetrische s-bindung ist, würde man erwarten, dass um die --Bindung freie Rotation möglich ist. Aber experimentelle Untersuchungen und berechnete thermodynamische Daten stimmen nur dann überein, wenn man für
8 die Rotation eine Energiebarriere von etwa 12.6 KJ/mol (3.0 Kcal/mol) annimmt, die dem Energieunterschied zwischen gestaffelter und ekliptischer Konformation entsprechen muss : Sägeblock-Projektion (Sawhorse projection) : Rotation 60 o Newman-Projection : Potentielle Energie der Konformationen des Ethans als Funktion des Torsionswinkels. Die Torsionsspannung (oder Pitzer-Spannung) führt dazu, das die gestaffelte Konformation am stabilsten ist: Moleküle, die in Konformationen vorliegen, welche den Energieminima entsprechen, nennt man Konformere (oder Konformationsisomere).
9 Während beim Propan die Energiedifferenz zwischen gestaffelter und ekliptischer Konformation trotz des Vorhandenseins einer weiteren thylgruppe an Stelle eines Wasserstoffatoms nur geringfügig erhöht ist gegenüber dem Ethan (14.6 KJ/mol), unterscheiden sich beim n-butan wegen der grösseren Wechselwirkungen zwischen zwei thylgruppen die verschiedenen Konformationen energetisch stärker von einander : 3.8 kj/mol Bei höheren Alkanen sind natürlich noch viel mehr verschiedene ausgezeichnete Konformationen möglich als beim Ethan oder n-butan. Die Energieunterschiede zwischen ihnen sind jedoch ebenfa lls nur gering, so dass die Konformere nicht als Substanzen fassbar sind. Im festen Zustand treten am häufigsten nur zickzackförmige Ketten auf, wobei die Wasserstoffatome durchweg in antiperiplanarer Stellung zueinander stehen :
10 2.6 yclische Alkane Die Nomenklatur dieser Verbindungsklasse ist ganz einfach : Dem Namen des offenkettigen Alkans mit derselben Zahl von Kohlenstoffatomen wird einfach die Vorsilbe cyclo vorangesetzt :. yclopropan yclobutan yclopentan yclohexan ycloheptan Untersucht man Molekülmodelle disubstituierter ycloalkane, bei denen sich beide Substituenten an unterschiedlichen Kohlenstoffatomen befinden, so sieht man, dass es in jedem Fall zwei mögliche Isomere gibt. Z.B. ier handelt es sich nicht um Konstitutionsisomere, sondern um Stereoisomere. Stereoisomere haben dieselbe Konstitution aber unterschiedliche Geometrien und Topographien (d.h. sie unterscheiden sich in der räumlichen Anordnung der gebundenen Atome oder Gruppen). 2.7 Die Struktur der ycloalkane yclopropan besitzt die Gestalt eines ebenen gleichseitigen Dreiecks, die ---Winkel betragen daher 60 o, was eine beträchtliche Abweichung von o bedeutet. Ausserdem stehen alle Wasserstoffatome ekliptisch zueinander. yclopropan ist weitaus instabiler, als man es für ein Molekül mit drei thylengruppen erwarten sollte:
11 Alle drei - Bindungen sind gebogen (Orbitalwinkel 104 o ), obwohl die Überlappung genügend gross ist um zu einer Bindung zu führen. Die Bindungsdissoziationsenergien (-) = 272 KJ/mol (65 Kcal/mol) sind relativ schwach (reaktiver!). ier liegt eine beträchtliche Ringspannung (oder Baeyer- Spannung) vor. Die Struktur von yclobutan zeigt, dass das Molekül nicht eben, sondern gefaltet ist. Die Spannung, die durch die acht ekliptisch stehenden Wasserstoffatome entsteht, wird hierdurch teilweise verringert Das Molekül klappt sehr schnell von einer gefalteten Konformation in die andere um. Man könnte erwarten, dass yclopentan eben gebaut ist, da die Winkel in einem regelmässigen Fünfeck 108 o betragen. Eine solche planare Anordnung wäre jedoch mit zehn ungünstigen ekliptischen - Wechselwirkungen verbunden. Dies wird durch Falten des Ringes umgangen :
12 ier ist dier Ringspannung klein. Das Molekül klappt wieder sehr schnell von einer gefalteten Konformation in die andere um. Der yclohexanring ist eine der am häufigsten vorkommenden und wichtigsten Struktureinheiten in der Organischen hemie. Ein hypothetisches ebenes yclohexan enthielte zwölf ekliptische - Wechselwirkungen und eine sechsfache Winkelspannung. Es gibt jedoch eine nahezu spannungsfreie Konformation des yclohexan : eine Sesselkonformation thylengruppen sind als gauche-substituenten der benachbarten --Bindung anzusehen. Ein anti- Konfomer ist in einem Sechsring nicht möglich : Sechs - Bindungen stehen parallel zu der Drehachse des Moleküls, und werden als axial bezeichnet. Die anderen sechs stehen senkrecht zu dieser Achse - sie werden äquatorial genannt :
13 Es gibt noch weitere (weniger stabile) Konformationen des yclohexans. Eine von ihnen ist die Wannen- (Boot-)Form. Sie ist 29.3 kj/mol energiereicher als die Sesselform. ier kommt ein transannulare Spannung vor. Die Wannenform ist recht beweglich (liegt auf einem Energiemaximum im potentiellen Energiediagramm). Eine leichte Drehung um eine --Bindung ergibt die Twist- Konformation. Sie ist 23 KJ/mol energiereicher als die Sesselform, weil die Wechselwirkungen zwischen den inneren Wasserstoffatomen aufgehoben werden. albsessel E Wanne 6.3 kj/mol Twist Twist 45.2 kj/mol 23.0 kj/mol Sessel Sessel Vgl:
14 yclohexan ist kein starres Gebilde! Es gibt nur ein Isomer von thyl- oder Brom-cyclohexan (nicht zwei : axial vs. äquatorial). Eine Sesselkonformation klappt in die andere um, wodurch axiale und äquatoriale Wasserstoffatome ihre Positionen tauschen, d.h. dass beim Umklappen des Ringes alle axialen Wasserstoffatome zu äquatorialen werden und umgekehrt : Ring-flip Die Aktivierungsenergie für diesen Prozess beträgt 45.2 KJ/mol (klein genug, dass sich die beiden Sesselformen bei Raumtemperatur (RT) ausserordentlich schnell ineinander umlagern). Im thylcyclohexan kann die thylgruppe entweder eine äquatoriale oder eine axiale Position einnehmen : Beim äquatorialen Konformer ragt die thylgruppe in den Raumbereich, in dem sich keine anderen Teile des Moleküls befinden, während im axialen Konformer der thylsubstituent gauche zu zwei - Bindungen und sehr nahe bei zwei axialen Wasserstoffatomen auf derselben Seite des Ringes steht ; bezeichnet als 1,3-diaxiale Wechselwirkungen.
15 Beide Sesselformen von thylcyclohexan stehen miteinander im Gleichgewicht, wobei der äquatoriale Konformer im Verhältnis 95:5 begünstigt ist. Die freie Enthalpiedifferenz, DG o, zwischen dem axialen und dem äquatorialen Isomer ist bei vielen monosubstituierten yclohexanen gemessen worden (Vgl. Tabelle unten). In vielen Fällen (aber nicht in allen) nimmt der Energieunterschied zwischen beiden Formen mit der Grösse des Substituenten zu. Mit tbu-yclohexan ist der Energieunterschied so gross (DG o = -RT.lnK), dass nur ein geringer Anteil (0.01%) des axialen Isomers in Lösung vorliegt (Der tert-bu Substituent fixiert die Konformation). Tabelle: Unterschiede in der freien Enthalpie zwischen axialen und äquatorialen Konformeren des yclohexans (bei allen Beispiele ist die äquatoriale Form stabiler) Substituent ΔG o (rel.) kj/mol Substituent ΔG o (rel.) kj/mol 0 F ( 3 ) 2 ( 3 ) 3 O O O O l Br I O O N K eq = [Prod.] ΔG o = -RTln(K eq ) = RTlog 10 (K eq ) [Eddukt] ΔG o -6 log 10 (K eq ) kj mol -1 Diese Gleichung sagt uns, dass ein Unterschied von 6 kj mol -1 in ΔG o eine Änderung der Gleichgewichtskonstanten K eq um den Faktor 10 bewirkt. Wenn sich ΔG o um n x 6 kj mol -1 ändert, ändert sich K eq um den Faktor 10 n. 2.8 hrfach-substituierte yclohexane Bei disubstituierten yclohexanen ist allgemein die Konformation mit der grössten Zahl von äquatorialen Substituenten die bevorzugte. Z.B.: 1,2-Dimethylcyclohexan
16 1,3-Dimethylcyclohexan und 1,4-Dimethylcyclohexan? Betrachten wir nun ein yclohexan mit zwei unterschiedliche Substitueten - cis- und trans-1-brom-3- thylcyclohexan : die stabilsten Konformationen?
17 Br Br 2.9 Polycyclische Alkane Im Decalin-Molekül teilen zwei yclohexanringe zwei Kohlenstoffatome miteinander, beide Ringe sind kondensiert oder anneliert ; cis-decalin trans-decalin Steroide kommen häufig in der Natur vor, und eine Reihe von Steroiden wirken als ormone. Z.B.:
18 . O O O O Androsteron
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 Inhalt Index 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer
Inhalt Index 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer
Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Cycloalkane
 3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Cycloalkane
 3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
Kohlenwasserstoffe. sp 3 -Orbitale. Alkane. Alkene. sp 2 - Orbitale p z - Orbital. sp -Orbitale p y, p z - Orbitale. Alkine
 Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 2.
 Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
Einführung in die Nomenklatur der organischen Chemie. Einteilung der Kohlenwasserstoffe
 organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
CH CH 2 H 2 C H 2 C CH 2 CH CH CH 2 CH 2 C H H 2 C CH 2 C 2 CH 2 H CH 2 CH 2
 Eine spezielle Form von Kohlenwasserstoffen, die ebenfalls nur Einfachbindungen besitzt, genügt nicht der allgemeinen Summenformel n n+ sondern besitzt die allgemeine Summenformel n n. Diese Alkane sind
Eine spezielle Form von Kohlenwasserstoffen, die ebenfalls nur Einfachbindungen besitzt, genügt nicht der allgemeinen Summenformel n n+ sondern besitzt die allgemeine Summenformel n n. Diese Alkane sind
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 10 Stereochemie (Thema 11.1 11.4) Aufgabe 1: a) Zeichnen Sie den Isomeren-Stammbaum auf. b) Erklären Sie folgende Isomerie-Arten: i) Konstitutionsisomere Konstitutionsisomere
Chemie für Biologen, 2017 Übung 10 Stereochemie (Thema 11.1 11.4) Aufgabe 1: a) Zeichnen Sie den Isomeren-Stammbaum auf. b) Erklären Sie folgende Isomerie-Arten: i) Konstitutionsisomere Konstitutionsisomere
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne
 1 Lösung 6 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne 6.1 Konformationsanalyse a) Zeichnen Sie für 2-Methylbutan die Konformationen als Newman-Projektionen
1 Lösung 6 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne 6.1 Konformationsanalyse a) Zeichnen Sie für 2-Methylbutan die Konformationen als Newman-Projektionen
I. Alkane Homologe Reihe, Nomenklatur
 Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Übungen zur VL Chemie für Biologen und Humanbiologen Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur:
 Übungen zur VL Chemie für Biologen und Humanbiologen 21.01.2011 1. Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur: a) 3-Methyl-4-propylhexan Erklärung: Es liegt keine funktionelle Gruppe
Übungen zur VL Chemie für Biologen und Humanbiologen 21.01.2011 1. Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur: a) 3-Methyl-4-propylhexan Erklärung: Es liegt keine funktionelle Gruppe
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
III. Cycloalkane (Stereochemie II)
 49 III. Cycloalkane (Stereochemie II) (C 2 ) n-2 2 C C 2 (C 2 ) n-2 2 C C 2 C n 2n+2 Cn 2n Nomenklatur: Alkan Cycloalkan für n = 5 n-pentan Cyclopentan Bruttoformel allgemein C n 2n oder (C 2 ) n Cycloalkane
49 III. Cycloalkane (Stereochemie II) (C 2 ) n-2 2 C C 2 (C 2 ) n-2 2 C C 2 C n 2n+2 Cn 2n Nomenklatur: Alkan Cycloalkan für n = 5 n-pentan Cyclopentan Bruttoformel allgemein C n 2n oder (C 2 ) n Cycloalkane
Cyclohexan und Dekalin
 Cyclohexan und Dekalin Die wohl wichtigste ringförmige Struktur in der organischen Chemie ist der Sechsring, im gesättigten Fall Cyclohexan. Dies gilt schon deshalb, weil dieser Ring zentraler Bestandteil
Cyclohexan und Dekalin Die wohl wichtigste ringförmige Struktur in der organischen Chemie ist der Sechsring, im gesättigten Fall Cyclohexan. Dies gilt schon deshalb, weil dieser Ring zentraler Bestandteil
2. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen
 2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
Offenkettige Verbindungen
 Offenkettige Verbindungen Das Konformationsverhalten von n-butan ist im Skriptum 13 beschrieben worden: 3 3 3 3 3 3 gauche(+) anti gauche(-) ϕ Dies kann durch ein Energieprofil dargestellt werden, bei
Offenkettige Verbindungen Das Konformationsverhalten von n-butan ist im Skriptum 13 beschrieben worden: 3 3 3 3 3 3 gauche(+) anti gauche(-) ϕ Dies kann durch ein Energieprofil dargestellt werden, bei
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
Kohlenwasserstoffe. Alkane Alkene Alkine Cycloaliphaten. Ethin (Acetylen) Propin u.s.w. Cycloalkane Cycloalkene Cycloalkine
 Kohlenwasserstoffe Folie184 Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
Kohlenwasserstoffe Folie184 Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
Organische Chemie. Einstieg. Chemie-Formeldarstellungen. Formeldarstellungen der Chemie: Bei Ionenverbindungen: Verhältnisformeln. , AlF 3. etc.
 Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Alkane und Cycloalkane
 Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Chemie. Elektrochemie, Alkane und Alkene
 Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
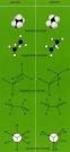 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Kohlenwasserstoffe. Benzol Naphthalin usw. Alkane Alkene Alkine Cycloaliphaten. Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w.
 OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
4.1. Gesättigte Kohlenwasserstoffe (Alkane)
 4. Stoffgruppen 4.1. Gesättigte Kohlenwasserstoffe (Alkane) ffenkettige Alkane à für n C-Atome ergibt sich: C n 2n+2 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 3 C C 3 3 C C 3 C 4 10 3 C C 3 à Es gibt
4. Stoffgruppen 4.1. Gesättigte Kohlenwasserstoffe (Alkane) ffenkettige Alkane à für n C-Atome ergibt sich: C n 2n+2 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 3 C C 3 3 C C 3 C 4 10 3 C C 3 à Es gibt
Energie. 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital
 sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Molekülsymmetrie und Kristallographie
 Substituierte Cyclohexane Der wichtigste Fall ist in diesem Zusammenhang das monosubstituierte Cyclohexan, weil man an ihm die relativen Stabilitäten von Substituenten abschätzen kann. Die dabei gewonnenen
Substituierte Cyclohexane Der wichtigste Fall ist in diesem Zusammenhang das monosubstituierte Cyclohexan, weil man an ihm die relativen Stabilitäten von Substituenten abschätzen kann. Die dabei gewonnenen
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Basisprüfung Allgemeine Chemie (Teil OC) Montag, 3. September 2007
 Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. omenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B (2E,5E)4-Prop-1-inylhepta-2,5-dien
Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. omenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B (2E,5E)4-Prop-1-inylhepta-2,5-dien
Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig
 26 sisomerie (Stereoisomerie I) Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig Isomerie II: sisomere: sisomere (bzw. Konformere) sind Isomere, die sich durch
26 sisomerie (Stereoisomerie I) Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig Isomerie II: sisomere: sisomere (bzw. Konformere) sind Isomere, die sich durch
IUPAC-Nomenklaturregeln als Grundlage für Q11 Chemie
 Nomenklatur 1 IUPA-Nomenklaturregeln als Grundlage für Q11 hemie 1 Kohlenwasserstoffe und Derivate 1.1 Regeln zur Benennung von unverzweigten Alkanen (n-alkane) Der Name der n-alkane enthält die folgenden
Nomenklatur 1 IUPA-Nomenklaturregeln als Grundlage für Q11 hemie 1 Kohlenwasserstoffe und Derivate 1.1 Regeln zur Benennung von unverzweigten Alkanen (n-alkane) Der Name der n-alkane enthält die folgenden
Organische Stofflehre
 Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Organische Experimentalchemie
 PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und
PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und
2. Alkane. Allgemeines. Nomenklatur + Konstitutionsisomerie. Konformationsisomerie. Industrielle Bedeutung. Synthetische Darstellung
 2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane Organische Chemie I LA / J. C. Brendel 1 Allgemeines
2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane Organische Chemie I LA / J. C. Brendel 1 Allgemeines
Bundesrealgymnasium Imst. Chemie Klasse 8. Aliphate
 Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Basisprüfung Allgemeine Chemie (Teil OC) Montag, 3. September 2007
 Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. Nomenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B C D N 1.2 (10
Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. Nomenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B C D N 1.2 (10
Organische Chemie. Kohlenstoff. Kohlenstoffkreislauf. Erdölverarbeitung. Kohlenwasserstoffe
 rganische hemie Teilgebiet der hemie, welches sich mit Aufbau, erstellung und Eigenschaften der Verbindungen des Kohlenstoffs beschäftigt. NTG 10.1 Kohlenstoff - 4. auptgruppe 4 Valenzelektronen 4 Bindungen
rganische hemie Teilgebiet der hemie, welches sich mit Aufbau, erstellung und Eigenschaften der Verbindungen des Kohlenstoffs beschäftigt. NTG 10.1 Kohlenstoff - 4. auptgruppe 4 Valenzelektronen 4 Bindungen
Systematische Nomenklatur
 Systematische Nomenklatur Je größer eine chemische Verbindung wird, desto komplizierter wird in der Regel deren Struktur, und desto schwieriger wird es, diese Verbindung eindeutig zu benennen. Dieses Problem
Systematische Nomenklatur Je größer eine chemische Verbindung wird, desto komplizierter wird in der Regel deren Struktur, und desto schwieriger wird es, diese Verbindung eindeutig zu benennen. Dieses Problem
Übung 9: Aufbau und Struktur organischer Verbindungen Übung für Medizinische Biologen - Jun.-Prof. Dr. Michael Giese.
 Zusammenfassung Aufbau und Struktur organischer Verbindungen Kohlenstoff besitzt eine Sonderstellung unter den Elementen ybridisierungsmodell beschreibt die Bindungsverhältnisse in Kohlenstoffverbindungen
Zusammenfassung Aufbau und Struktur organischer Verbindungen Kohlenstoff besitzt eine Sonderstellung unter den Elementen ybridisierungsmodell beschreibt die Bindungsverhältnisse in Kohlenstoffverbindungen
Was ist ein Kaleidozyklus?
 Polyeder und ihre Euler-Charakteristik Unter einem Polyeder verstehen wir einen zusammenhängenden Teil des dreidimensionalen Raumes der durch Polygone begrenzt wird. Seine Oberfläche besteht also aus Punkten
Polyeder und ihre Euler-Charakteristik Unter einem Polyeder verstehen wir einen zusammenhängenden Teil des dreidimensionalen Raumes der durch Polygone begrenzt wird. Seine Oberfläche besteht also aus Punkten
2.1 Homologe Reihe, Nomenklatur, Konstitution, Konformation CH 2
 Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
ORGANISCHE CHEMIE. Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen
 ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
Vorlesung 5. Alkane. Experimentalchemie, Prof. H. Mayr 20 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. Anzahl C-Atome im n-alkan
 Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
2. Alkane. Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane
 2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane OC I Lehramt F. H. Schacher 1 Allgemeines Kohlenwasserstoffe
2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane OC I Lehramt F. H. Schacher 1 Allgemeines Kohlenwasserstoffe
Kohlenstoffverbindungen
 Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kapitel 4. Cyclische Verbindungen
 Kapitel 4 Cyclische Verbindungen 1 Ringförmige Verbindungen Cholesterol: (von gr. chole: Galle und stereos: fest) O * C 3 * * 8 Stereozentren (256 mögliche Isomere!) Nur ein Isomer kommt in der Natur vor.
Kapitel 4 Cyclische Verbindungen 1 Ringförmige Verbindungen Cholesterol: (von gr. chole: Galle und stereos: fest) O * C 3 * * 8 Stereozentren (256 mögliche Isomere!) Nur ein Isomer kommt in der Natur vor.
Zahl der C-Atome Allgemeine Summenformel C n H 2n+ ₂
 1 Kohlenwasserstoffe Übungsaufgaben zum Kapitel sauerstoffhaltige organische Verbindungen mit Hilfe des Lernprogramms Isomerer 1.1 Ergänze mit Hilfe des Programms "Isomerer" die folgende Tabelle für nur
1 Kohlenwasserstoffe Übungsaufgaben zum Kapitel sauerstoffhaltige organische Verbindungen mit Hilfe des Lernprogramms Isomerer 1.1 Ergänze mit Hilfe des Programms "Isomerer" die folgende Tabelle für nur
Symmetrieelemente C 3 C 2 C 3 O H H N H H H
 Symmetrieelemente Ein Symmetrielement liegt vor, wenn ein Objekt (hier: Molekül) durch eine Symmetrieoperation mit sich selbst zur Deckung gebracht werden kann. neue und alter Orientierung nicht unterscheidbar
Symmetrieelemente Ein Symmetrielement liegt vor, wenn ein Objekt (hier: Molekül) durch eine Symmetrieoperation mit sich selbst zur Deckung gebracht werden kann. neue und alter Orientierung nicht unterscheidbar
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Summenformel. Strukturformel. Halbstrukturformel. Fossile Energieträger. ( 10. Klasse NTG 1 / 47 ) ( 10. Klasse NTG 2 / 47 ) ( 10. Klasse NTG 3 / 47 )
 Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
Organische Chemie im Überblick
 Evelyne Chelain Nadeqe Lubin-Germain Jacques Uziel Organische Chemie im Überblick Grundwissen in Lerneinheiten Aus dem Französischen übersetzt von Karin Beifuss ~ Springer Spektrum Inhaltsverzeichnis 1
Evelyne Chelain Nadeqe Lubin-Germain Jacques Uziel Organische Chemie im Überblick Grundwissen in Lerneinheiten Aus dem Französischen übersetzt von Karin Beifuss ~ Springer Spektrum Inhaltsverzeichnis 1
ORGANISCHE CHEMIE. Prof. Dipl.-Ing. Manfred SUSSITZ. Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt
 ORGANISCHE CHEMIE Prof. Dipl.-Ing. Manfred SUSSITZ Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt 1. Kohlenwasserstoffe KW Kohlenstoff "Kohlenstoff ist in organischen Verbindungen
ORGANISCHE CHEMIE Prof. Dipl.-Ing. Manfred SUSSITZ Kernfragen: Mündliche Reifeprüfung: Alpen-Adria-Gymnasium Völkermarkt 1. Kohlenwasserstoffe KW Kohlenstoff "Kohlenstoff ist in organischen Verbindungen
L.9 Organische Chemie I
 L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 CE 102.1: Grundlagen der Chemie - Organische Chemie Prof Dr. E. Landau und Prof. Dr. J.. Robinson 3. Organische Reaktionen - Einordung nach chanismen. lkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1
CE 102.1: Grundlagen der Chemie - Organische Chemie Prof Dr. E. Landau und Prof. Dr. J.. Robinson 3. Organische Reaktionen - Einordung nach chanismen. lkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Homologe Reihe der Alkane. Benennung der Alkane. Konstitutionsisomerie. Isomerie. Was versteht man unter der Homologen Reihe der Alkane?
 Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Chemie. für die Berufsmaturität. Günter Baars. Chemie. Baars. Unter Mitarbeit von Franz Heini, Markus Isenschmid und Doris Kohler
 www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
www.hep-verlag.ch/chemie-bm-ergaenzungen Franz eini Studium der Biologie mit ebenfach Biochemie. öheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe
 1 Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe Warm Up 1) Erweitern Sie die Ihnen bekannten Regeln der Nomenklatur für Alkene und benennen danach folgende Verbindungen. Die Regel zur
1 Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe Warm Up 1) Erweitern Sie die Ihnen bekannten Regeln der Nomenklatur für Alkene und benennen danach folgende Verbindungen. Die Regel zur
Die Herstellung von Alkenen aus Chloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen.
 Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden?
 Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Wie ist der räumliche Bau von Methan? Wie kann dies als zweidimensionale Formel dargestellte werden? Formeln von Methan Methan hat die ermittelte Summenformel CH 4. Dies ist eine Molekülformel. Die vier
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Chemie Alkohole, Aldehyde & Ketone, Carbonsäuren
 Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Vorlesung Chemie für Biologen: Klausur 1 WS Sa
 1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
4-Butyl-2,5-dimethylheptan 5-Ethyl-4,8-dimethylundecan
 Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Berufliche Oberschule Fürstenfeldbruck
 Berufliche Oberschule Fürstenfeldbruck Staatliche Fachoberschule und Berufsoberschule Fach: hemie Aufstellen von Summenformeln und Reaktionsgleichungen, Ausarbeitung: S. Räthel, S. eilmann,. Preller 10,
Berufliche Oberschule Fürstenfeldbruck Staatliche Fachoberschule und Berufsoberschule Fach: hemie Aufstellen von Summenformeln und Reaktionsgleichungen, Ausarbeitung: S. Räthel, S. eilmann,. Preller 10,
3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen.
 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Organische Experimentalchemie
 PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und
PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Intramolekulare Spannung - Konformationsenergie
 Intramolekulare Spannung - Konformationsenergie Ein gravierendes Problem bei der Bestimmung intramolekularer Spannung von Molekülen ist das der Referenz. Man benötigt einen Standard, von dem man sagen
Intramolekulare Spannung - Konformationsenergie Ein gravierendes Problem bei der Bestimmung intramolekularer Spannung von Molekülen ist das der Referenz. Man benötigt einen Standard, von dem man sagen
Butanol Butanal Butansäure
 Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
Inhaltsverzeichnis zu Kapitel 2. Alkane
 Inhaltsverzeichnis zu Kapitel 2. Alkane 2. Alkane 2.1. Valenzstrichformel, omologe Reihe, Nomenklatur, Konstitution, 22 Konformation 2.1.1. Valenzstrichformel 22 2.1.2. omologe Reihe 23 2.1.3. Konstitutionsisomere
Inhaltsverzeichnis zu Kapitel 2. Alkane 2. Alkane 2.1. Valenzstrichformel, omologe Reihe, Nomenklatur, Konstitution, 22 Konformation 2.1.1. Valenzstrichformel 22 2.1.2. omologe Reihe 23 2.1.3. Konstitutionsisomere
Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik
 Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik 34 Geben Sie die systematischen Namen jeder der folgenden Verbindungen an: Welche der Verbindungen aus Übung besitzen E- und
Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik 34 Geben Sie die systematischen Namen jeder der folgenden Verbindungen an: Welche der Verbindungen aus Übung besitzen E- und
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
