Ermittlung der Struktur organischer Stoffe
|
|
|
- Felix Heidrich
- vor 7 Jahren
- Abrufe
Transkript
1 Ermittlung der Struktur organischer Stoffe 1. Reindarstellung z.b. durch Destillation u.a. 2. Qualitative Analyse Verbrennung mit Analyse der Verbrennungsprodukte z.b. CO 2, 2 O, Beilsteinprobe, Flammenfarbe etc. 3. Quantitative Analyse (Elementaranalyse nach Liebig ) Bestimmung von C,, O Ergebnis: Verhältnisformel z.b. (C) z, (C 2 6 O) y 4. Molmassenbestimmung Ergebnis aus 3. und 4.: Summenformel z.b. C 2 2, C 2 6 O 5. Strukturformel mögliche Strukturisomere 6. funktionelle Gruppen experimentelle Nachweise erstellung von Alkohol durch alkoholische Gärung Zuckerlösung und efe werden in einem Erlenmeyerkolben gemischt. Zum Luftabschluss dient ein U-förmig gebogenes Glasrohr, das in Kalkwasser taucht.
2 1. Reindarstellung z.b. Destillation und andere Verfahren Beispiel: Gewinnung von Alkohol (Ethanol) aus Wein Durch eine einfache Destillation kann aus Wein kein reiner Alkohol gewonnen werden. Es gelingt nur eine Anreicherung. Bei der Brennprobe mit dem Destillat bleibt eine nicht brennbare Flüssigkeit zurück. Diese kann mit Wassernachweispapier als Wasser identifiziert werden. Die Behandlung des Destillats mit wasserentziehenden Mitteln kann reinen (absoluten) Alkohol liefern, der dann durch Filtration abgetrennt werden kann. Destillation Brennproben
3 2. Qualitative Analyse Verbrennung mit Analyse der Verbrennungsprodukte (CO 2, 2 O) Sauerstoffnachweis, Beilsteinprobe, Flammenfarbe etc. Beispiel: Alkohol (Ethanol) 2.1. Kohlenstoff und Wasserstoff- Nachweis in Alkohol Verbrennen einer Probe (aufgearbeitetes Destillat aus 1) auf der Tüpfelplatte. Die Probe brennt mit bläulicher Flamme mit gelbem Saum. Nach Entzünden der Probe wird ein Becherglas darüber gehalten (vgl. Skizze). Die Verbrennungsprodukte sind heiß, haben daher eine geringe Dichte als die umgebende Luft und steigen nach oben. Das Becherglas beschlägt mit einer farblosen Flüssigkeit. gasförmige Reaktionsprodukte abziehen; dann langsam durch Kalkwasser leiten Kalkwasser Flüssigkeit im Becherglas mit Wassernachweis- Papier untersuchen Silikonschlauch Die Nachweise auf Wasser (mit Wassernachweispapier oder weißem Kupfersulfat) und Kohlenstoffdioxid (mit Kalkwasser) verlaufen positiv. Damit ist bewiesen Alkohol enthält Kohlenstoff und Wasserstoff. brennendes Destillat getrübtes Kalkwasser
4 2.2. Nachweis von Sauerstoff in Ethanol Alkoholdämpfe werden in einem schwer schmelzbaren Reagenzglas mit dem Element Magnesium umgesetzt. Die zunächst noch enthaltene Luft in der Apparatur wird durch Verdampfen des Alkohols verdrängt. Erst dann erhitzt man das Magnesiumband. Anders als an Luft verläuft die Reaktion von Alkoholdampf mit Magnesium nur unter schwacher Rotglut. Wendel aus geschmirgeltem Magnesiumband Reaktionsprodukte im Reagenzglas Sand getränkt mit Alkohol Es entstehen: Ein schwarzes Reaktionsprodukt: Kohlenstoff (Ruß) und ein weißes Reaktionsprodukt. Dieses lässt sich als Magnesiumoxid identifizieren. Wenn die Apparatur nur Alkoholdämpfe und Magnesium enthielt (frei von Luft war), muss der Sauerstoff mit dem sich das Magnesium umgesetzt hat aus dem Alkohol stammen. Anmerkung Geübtere Experimentatoren können mit diesem Experiment zwar alle qualitativen Nachweise (Kohlenstoff, Wasserstoff, Sauerstoff) schaffen, es wird aber empfohlen arbeitsteilig vorzugehen. Im Demonstrationsunterricht können Schüler assistieren.
5 3. Quantitative Analyse (Elementaranalyse nach Liebig ) Versuchsaufbau Verbrennungsrohr genau abgewogene Probe der organischen Substanz, vermischt mit Kupferoxid, plus weiteres Kupferoxid (oxidierter Kupferdraht). Trockenrohr wasserfreies Calciumchlorid ist stark wasseranziehend und absorbiert den bei der Verbrennung entstehenden Wasserdampf Kaliapparat Die konzentrierte Kalilauge bindet das bei der Verbrennung entstehende Kohlenstoffdioxid organische Substanz & schwarzes Kupferoxid Calciumchlorid Kalilauge Das Kupferoxid liefert den zur Verbrennung des organischen Stoffs notwendigen Sauerstoff. Dabei wird das schwarze Kupferoxid zu elementarem Kupfer (bzw. rotem Kupferoxid) reduziert. Um die notwendige Temperatur beim Experiment selbst zu erreichen, umgab Liebig das Verbrennungsrohr mit glühender olzkohle. Massenbestimmungen von Trockenrohr und Kaliapparat mit der Balkenwaage
6 3. Quantitative Analyse Auswertungsbeispiel Ergebnisse einer Elementaranalyse nach Liebig Einwaage organische Substanz: 0,391g Massenzunahme Trockenrohr: 0,469g ( 2 O) Massenzunahme Kaliapparat: 0,742g (CO 2 ) Berechnung Masse von C und in der org Sub. CO 2 C 2 O 2 44g g (siehe PSE) 18g --- 2g (siehe PSE) 0,742g --- X 0,469g --- X X / 0,742g = 12g / 44g X / 0,469g = 2g / 18g X = 0,202g X = 0,052g (Masse C in org. Sub.) (Masse in org. Sub.) Aus der Differenz zur Masse der Einwaage organischer Substanz (0,391g) ergibt sich: Massenanteil für Sauerstoff : 0,137g (Masse O in org. Sub.) Massenverhältnis: C : : O = 0,202 : 0,052 : 0,137
7 Vom Massenverhältnis zum Stoffmengenverhältnis Massenverhältnis: C : : O = 0,202 : 0,052 : 0,137 Masse dividieren durch die Molmasse ergibt das Stoffmengenverhältnis: C : : O = 0,202g / 12g/mol : 0,052g / 1g/mol : 0,137g / 16g/mol C : : O = 0,017 mol : 0,052 mol : 0,009 mol Dividieren der Werte durch die kleinste Zahl (hier 0,009) ergibt: C : : O = 1,9 mol : 5,8 mol : 1 mol Diese experimentell ermittelten Werte (Messfehler!) rundet man nun auf die nächste ganze Zahl und hat dann das Atomzahlenverhältnis. Atomzahlenverhältnis: C : : O = 2 : 6 : 1 In dem untersuchten Stoff kommen demnach auf zwei Kohlenstoffatome, sechs Wasserstoffatome und ein Sauerstoffatom. Verhältnisformel: (C 2 6 O) n n: ganze natürliche Zahl zur Verhältnisformel: (C 2 6 O) n gibt es folgende möglichen Summenformeln mögliche Summenformeln zugehörige Molmassen (g/mol) C 2 6 O C 4 12 O 2 C 6 18 O 3... (C 2 6 O) * n * n Eine Molmassenbestimmung legt die Summenformel fest (Art und Anzahl der Elemente in einer Verbindung).
8 4. Molmassenbestimmung Versuchsaufbau Molmassenbestimmung einer leicht verdampfbaren Flüssigkeit Mikroliter-Spritze mit dem flüssigen Stoff Ölbad Kolbenprober Gummi elektrische eizung Zur Bestimmung der Molmasse wird eine genau abgemessene Menge des Stoffes verdampft und das zugehörige Gasvolumen bestimmt. Da nach Avogardo ein Mol jeden Gases ein Volumen von 22,4 L bei Normalbedingungen (273 K, 1013 hpa) einnimmt, kann über einen Dreisatz die Molmasse bestimmt werden, wenn man zuvor das Gasvolumen auf Normalbedingungen umgerechnet hat. zu erhebende Messwerte: Masse der Flüssigkeit, die verdampft wird. m: g Die Masse bestimmt man am einfachsten durch Rückwiegen der vollen und leeren Spritze (Waage: Messbereich auf ein Milligramm genau). Nach dem Einspritzen der flüssigen Probe lässt man die Spritze bis nach dem Ablesen der Temperatur und des Volumens in der Apparatur. Dann wiegt man die leere Spritze zurück Volumen der verdampften Flüssigkeit V 1 : ml Temperatur des Dampfs (= Temperatur Ölbad) T 1 : C Luftdruck im Raum p 1 : hpa
9 4. Molmassenbestimmung Auswertungsbeispiel: Stoff Ethanol (99,8%) Mikroliter- Spritze mit dem flüssigen Stoff m: 0,049 g T 1 : 127 C Ölbad Kolbenprober Barometer: p 1 : 1022 hpa Gummi V 1 : 31 ml elektrische eizung Umrechnung des Volumens auf Normalbedingungen: Für eine Gasportion gilt: p o; V o; T o : Normalbedingungen p 1; V 1; T 1 : Raumbedingungen p V T V o = = konstant p o V o T o = 1022 hpa 31 ml 273 K 400 K 1013 hpa p 1 V 1 T 1 V o = p V T 1 1 o T 1 p o V o = 21,35 ml Gasvolumen bei Normalbedingungen Berechnung der Molmasse Masse Gasvolumen (Normalbedingungen) 0,049 g ,35 ml x ml (Molvolumen bei Normalbedingungen x 0,049 g = ml 21,35 ml x = 51,4 g Masse für ein Mol des Stoffs (experimentell bestimmt) Da nach obigen Überlegungen die Molmasse nur 46g/mol oder ein ganzzahliges Vielfaches davon sein kann, kann man von der Molmasse 46 g/mol ausgehen. Summenformel: C 2 6 O
10 5. Mögliche Strukturformeln Eine Verbindung, die aus zwei Kohlenstoffatomen, sechs Wasserstoffatomen und einem Sauerstoff besteht, kann unterschiedlichen Aufbau haben. Es gibt zur Summenformel C 2 6 O verschiedene mögliche Strukturformeln (Isomere). Atome in Lewis-Schreibweise mögliche Strukturformeln C O C (1) (2) C C O C O C Ethanol Dimethylether (CAS-Nummer: ) (CAS-Nummer: ) eute kann man via Internet und CAS-Nummern sehr leicht Stoffeigenschaften recherchieren. Es zeigt sich, dass Stoff (1) der gesuchte Stoff ist. Aus den Formeln selbst ergeben sich aber auch schon inweise. Bei Stoff (2) sind alle Wasserstoffatome an Kohlenstoff gebunden. Zwei Methyl-Gruppen hängen an einem Sauerstoff-Atom. Das entspricht den Bindungsverhältnissen wie sie bei den Alkanen vorliegen. Durch den räumlichen Bau sind die Methyl-Gruppen selbst unpolar. Das Molekül insgesamt muss allerdings ein Dipolmoment zeigen, da das Sauerstoff-Atom freie Elektronenpaare hat und sein Bau gewinkelt ist. Bei Stoff (1) handelt es sich formal um eine Ethyl-Gruppe an der eine O - Gruppe hängt. Diese O Gruppe zeigt große Ähnlichkeit mit Wasser, wenn man mit der Lewis-Formel vergleicht. Von der Struktur her muss dieser Stoff Wasserstoffbrücken ausbilden können, da der Wasserstoff in der O Gruppe positiv polarisiert sein muss und am Sauerstoff- Atom freie Elektronenpaare vorliegen.
11 6. funktionelle Gruppen Die Gewinnung von Alkohol durch Gärung zeigt, dass Alkohol in Wasser löslich sein muss. Bei allen alkoholischen Getränken (Wein, Whiskey, Wodka) handelt es sich um Lösungen. Falls Alkohol nicht mit Wasser mischbar wäre, müssten sich zwei flüssige Phasen zeigen, wie sie beim Zusammengeben von Benzin und Wasser zu beobachten sind. Die folgenden Experimente zeigen qualitativ Eigenschaften von Alkohol. Leitfähigkeitsprüfung beim Lösen von Ethanol in Wasser Es ist keine Erhöhung der Leitfähigkeit feststellbar, daraus folgt: Ethanol ist eine Molekülverbindung und - beim Lösen in Wasser entstehen keine Ionen. Reaktion von Ethanol mit elementarem Natrium Ein linsengroßes, blankes Stück elementares Natrium wird in einem großen Reagenzglas zu Ethanol gegeben. Das entstehende Gas wird pneumatisch über Wasser aufgefangen und damit die Knallgasprobe durchgeführt. Beobachtungen: Das Natrium sinkt zunächst unter, dann Bildung von Gasblasen am Natrium; es steigt an die Oberfläche der Flüssigkeit, weitere Gasentwicklung am Natrium, die Lösung erwärmt sich, das Natrium löst sich in Ethanol auf. Die Reaktion verläuft analog zur Umsetzung von Wasser mit Natrium Wasser reagiert mit Natrium zu Wasserstoff und Natriumhydroxid Alkohol reagiert mit Natruim zu Wasserstoff und Natriumalkoholat (R: Alkylrest)
Alkohole Brüder des Wassers
 6. Alkohole Brüder des Wassers 6.1 Alkohole Brüder des Wassers entsteht aus Zucker durch die alkoholische Gärung. Dabei werden Glucosemoleküle mit ilfe von efezellen in und Kohlendioxid umgewandelt. NS29
6. Alkohole Brüder des Wassers 6.1 Alkohole Brüder des Wassers entsteht aus Zucker durch die alkoholische Gärung. Dabei werden Glucosemoleküle mit ilfe von efezellen in und Kohlendioxid umgewandelt. NS29
Schulversuchspraktikum. Isabelle Faltiska. Sommersemester Klassenstufen 11 & 12. Quantitative Analyse von. Kohlenwasserstoffen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Im Folgenden
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Im Folgenden
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Organische Chemie II. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Was haben wir gelernt?
 Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
Was haben wir gelernt? - Gesetze chemischer Reaktionen - Atommodell von Dalton - Elementsymbole - Die atomare Masseneinheit u - Die Avogadro-Zahl und deren Umkehrung - Von Massenverhältnissen zu Teilchenverhältnissen
Was passiert denn genau?
 Was passiert denn genau? - Bei chemischen Reaktionen entstehen neue Stoffe, mit neuen Eigenschaften. - Im Teilchenmodell stellen wir uns vor, dass Kugelteilchen (Edukte) neu kombiniert werden. - Wenn wir
Was passiert denn genau? - Bei chemischen Reaktionen entstehen neue Stoffe, mit neuen Eigenschaften. - Im Teilchenmodell stellen wir uns vor, dass Kugelteilchen (Edukte) neu kombiniert werden. - Wenn wir
Empirische Formel - Molekülmassenbestimmung 1979/I 3. Eine organische Verbindung enthält die Elemente Kohlenstoff, Wasserstoff, Sauerstoff und
 Empirische Formel - Molekülmassenbestimmung 1979/I 3. Eine organische Verbindung enthält die Elemente Kohlenstoff, Wasserstoff, Sauerstoff und Stickstoff. Bei der Analyse von 0,377 g der Substanz entstehen
Empirische Formel - Molekülmassenbestimmung 1979/I 3. Eine organische Verbindung enthält die Elemente Kohlenstoff, Wasserstoff, Sauerstoff und Stickstoff. Bei der Analyse von 0,377 g der Substanz entstehen
4. Methoden zur Reinigung der organischen Verbindungen Elementaranalyse. Empirische und Summenformel.
 4. Methoden zur Reinigung der organischen Verbindungen Elementaranalyse. Empirische und Summenformel. Prof. Ivo C. Ivanov 1 Allgemeines Ablauf eines Experiments in der Organischen Chemie: Literaturrecherche
4. Methoden zur Reinigung der organischen Verbindungen Elementaranalyse. Empirische und Summenformel. Prof. Ivo C. Ivanov 1 Allgemeines Ablauf eines Experiments in der Organischen Chemie: Literaturrecherche
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemische Reaktionen. Wir erzeugen Wasser
 hemische Reaktionen + Natrium + -> hlor -> Natriumchlorid = Kochsalz Wir erzeugen Wasser Die kleinsten Teilchen des Sauerstoffes und des Wasserstoffes waren im roten Ballon bereits gut durchmischt. Daher
hemische Reaktionen + Natrium + -> hlor -> Natriumchlorid = Kochsalz Wir erzeugen Wasser Die kleinsten Teilchen des Sauerstoffes und des Wasserstoffes waren im roten Ballon bereits gut durchmischt. Daher
V. Vom Experiment zur Reaktionsgleichung. Themen dieses Kapitels:
 Hinweise zum Kapitel V. Vom Experiment zur Reaktionsgleichung Themen dieses Kapitels: - Stoffmengen (Mole), molare Massen und Massen von Stoffportionen und ihre mathematische Bestimmung - Stoffnamen und
Hinweise zum Kapitel V. Vom Experiment zur Reaktionsgleichung Themen dieses Kapitels: - Stoffmengen (Mole), molare Massen und Massen von Stoffportionen und ihre mathematische Bestimmung - Stoffnamen und
Was passiert denn genau?
 Was passiert denn genau? - Bei chemischen Reaktionen entstehen neue Stoffe, mit neuen Eigenschaften. - Im Teilchenmodell stellen wir uns vor, dass Kugelteilchen (Edukte) neu kombiniert werden. - Wenn wir
Was passiert denn genau? - Bei chemischen Reaktionen entstehen neue Stoffe, mit neuen Eigenschaften. - Im Teilchenmodell stellen wir uns vor, dass Kugelteilchen (Edukte) neu kombiniert werden. - Wenn wir
Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 01: Elementarnachweis: Kohlenstoff- und Wasserstoffnachweis Reaktion:
 Michael Woock Universität Duisburg Fakultät 4 / Didaktik der Chemie Lotharstr. 1 47057 Duisburg e-mail: woock@uni-duisburg.de ----------------------------------------------------------------------------------------------------------
Michael Woock Universität Duisburg Fakultät 4 / Didaktik der Chemie Lotharstr. 1 47057 Duisburg e-mail: woock@uni-duisburg.de ----------------------------------------------------------------------------------------------------------
Echt ätzend! - Was ist und wie wirkt Abflussreiniger?
 Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Echt ätzend! - Was ist und wie wirkt Abflussreiniger? Versuch 1: Zusammensetzung von festem Abflussreiniger (Analyse nach Prof. Pick ): fester Abflussreiniger (z.b. Drano Rohrfrei) Petrischale, Holzstab
Stöchiometrie. (Chemisches Rechnen)
 Ausgabe 2007-10 Stöchiometrie (Chemisches Rechnen) ist die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen sowie der Mengenverhältnisse der beteiligten Stoffe bei chemischen Reaktionen
Ausgabe 2007-10 Stöchiometrie (Chemisches Rechnen) ist die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen sowie der Mengenverhältnisse der beteiligten Stoffe bei chemischen Reaktionen
Ergänzende Hinweise Feste Reaktionsprodukte nicht in den Ausguß schütten! Vorsicht; es entsteht Knallgas!
 Dehydrierung von ** Wassergefährdend! Kupferoxid R-Sätze: 22-50/53 S-Sätze: 22-61 Wasserstoff R-Sätze: 12 S-Sätze: 9-16-33 wird in einem Rundkolben erhitzt. Die Dämpfe werden über erhitzte Kupferspäne
Dehydrierung von ** Wassergefährdend! Kupferoxid R-Sätze: 22-50/53 S-Sätze: 22-61 Wasserstoff R-Sätze: 12 S-Sätze: 9-16-33 wird in einem Rundkolben erhitzt. Die Dämpfe werden über erhitzte Kupferspäne
Unterrichtsvorhaben II Vom Alkohol zum Aromastoff
 Unterrichtsvorhaben II Vom Alkohol zum Aromastoff Umfang: Jgst.: 38 EF Schwerpunkte / Inhalt Konkrete Kompetenzerwartungen Vgl. Kapitel im Schulbuch Anmerkungen Rund um das Parfum: Aromastoffe (Vorkommen,
Unterrichtsvorhaben II Vom Alkohol zum Aromastoff Umfang: Jgst.: 38 EF Schwerpunkte / Inhalt Konkrete Kompetenzerwartungen Vgl. Kapitel im Schulbuch Anmerkungen Rund um das Parfum: Aromastoffe (Vorkommen,
Bist Du nicht "FIT", dann musst Du nacharbeiten.
 Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
 Michael Woock Universität Duisburg Fakultät 4 / Didaktik der Chemie Lotharstr. 1 47057 Duisburg e-mail: woock@uni-duisburg.de ----------------------------------------------------------------------------------------------------------
Michael Woock Universität Duisburg Fakultät 4 / Didaktik der Chemie Lotharstr. 1 47057 Duisburg e-mail: woock@uni-duisburg.de ----------------------------------------------------------------------------------------------------------
Destillation und Alkohol
 Destillation und Alkohol Destillation Veronikas Vater hat die Genehmigung Schnaps zu brennen. Dazu braucht er eine Destillationsanlage: Abb. 1: Destillationsanlage Bei der Destillation wird eine Flüssigkeit
Destillation und Alkohol Destillation Veronikas Vater hat die Genehmigung Schnaps zu brennen. Dazu braucht er eine Destillationsanlage: Abb. 1: Destillationsanlage Bei der Destillation wird eine Flüssigkeit
Bestimmung des Massenverhältnisses bei der Reaktion von Magnesium mit Sauerstoff
 8 0 6 0 4 0 2 0 0 0 0 1 0 8 0 6 0 4 0 2 0 L m 1.1 Konstante Massenproportionen Untersuche, welches Volumen Sauerstoff für die Reaktion mit verschiedenen Massen Magnesium jeweils benötigt wird. Geräte 2
8 0 6 0 4 0 2 0 0 0 0 1 0 8 0 6 0 4 0 2 0 L m 1.1 Konstante Massenproportionen Untersuche, welches Volumen Sauerstoff für die Reaktion mit verschiedenen Massen Magnesium jeweils benötigt wird. Geräte 2
Destillation und Alkohol
 Destillation und Alkohol Destillation Veronikas Vater hat die Genehmigung Schnaps zu brennen. Dazu braucht er eine Destillationsanlage: Abb. 1: Destillationsanlage Bei der Destillation wird eine Flüssigkeit
Destillation und Alkohol Destillation Veronikas Vater hat die Genehmigung Schnaps zu brennen. Dazu braucht er eine Destillationsanlage: Abb. 1: Destillationsanlage Bei der Destillation wird eine Flüssigkeit
Verbrennung einer Kerze
 Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Verbrennung einer Kerze Schauen wir uns zunächst die Kerze genauer an. Aus welchen Bestandteilen besteht sie? Und wozu dienen diese? Bestandteil Stoff Funktion Der Stoff ist das Material, woraus ein Körper
Eigenschaften von Alkanolen (Alkohole) und deren Erklärung aus der Struktur
 Versuchsanweisung: Eigenschaften von Alkoholen, die ydroxylgruppe als funktionelle Gruppe Eigenschaften von Alkanolen (Alkohole) und deren Erklärung aus der Struktur Organische Substanzen bestehen zum
Versuchsanweisung: Eigenschaften von Alkoholen, die ydroxylgruppe als funktionelle Gruppe Eigenschaften von Alkanolen (Alkohole) und deren Erklärung aus der Struktur Organische Substanzen bestehen zum
Station 1: Nomenklatur von Alkanen
 Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Alkane - eine vielseitige Stoffgruppe. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Alkane - eine vielseitige Stoffgruppe Das komplette Material finden Sie hier: School-Scout.de RAAbits Hauptschule 7 9 Naturwissenschaften
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Alkane - eine vielseitige Stoffgruppe Das komplette Material finden Sie hier: School-Scout.de RAAbits Hauptschule 7 9 Naturwissenschaften
1. Klausur Allgemeine und Anorganische Chemie B.Sc. Chemie
 1. Klausur Allgemeine und Anorganische Chemie B.Sc. Chemie Name: Vorname: Matrikel Nr.: 15.12.2010 Die Durchführung und Auswertung der 12 Aufgaben im zweiten Teil dieser Klausur mit je vier Aussagen (a-d)
1. Klausur Allgemeine und Anorganische Chemie B.Sc. Chemie Name: Vorname: Matrikel Nr.: 15.12.2010 Die Durchführung und Auswertung der 12 Aufgaben im zweiten Teil dieser Klausur mit je vier Aussagen (a-d)
Rein oder nicht rein?
 Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
Station 1: Rein oder nicht rein? Versuche: 1 Bestimmen Sie experimentell die Löslichkeit von Kochsalz. [Hinweis: Unter der Löslichkeit versteht man die Masse eines Stoffes in Gramm, die sich gerade noch
8. Löslichkeit verschiedener Salze bestimmen
 Praktikum Chemie N 8 Classe : Date de la remise : Note sur 10 : Nom(s) : 8. Löslichkeit verschiedener Salze bestimmen Video Löslichkeit Die Löslichkeit eines Stoffes gibt an, in welchem Umfang ein Reinstoff
Praktikum Chemie N 8 Classe : Date de la remise : Note sur 10 : Nom(s) : 8. Löslichkeit verschiedener Salze bestimmen Video Löslichkeit Die Löslichkeit eines Stoffes gibt an, in welchem Umfang ein Reinstoff
Verbrennung einer Kerze
 Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Verbrennung einer Kerze Zünde eine Kerze an und notiere deine Beobachtungen: Was passiert eigentlich genau bei der Verbrennung einer Kerze? Diese Frage versuchen wir in diesem Kapitel zu beantworten. Schauen
Was kannst Du (schon)? Stoffe und Eigenschaften D
 Falte zunächst das Blatt entlang des Pfeils nach hinten. Mache Dir zunächst alleine Gedanken über Deine Fähigkeiten und kreuze an. Tausche Dich im Folgenden mit Deinem Nachbar aus bzw. falte das Blatt
Falte zunächst das Blatt entlang des Pfeils nach hinten. Mache Dir zunächst alleine Gedanken über Deine Fähigkeiten und kreuze an. Tausche Dich im Folgenden mit Deinem Nachbar aus bzw. falte das Blatt
1. Wer sich über Erdgas informieren will, findet im Internet viele Informationen dazu, zum Beispiel diese:
 Autos, die mit Erdgas fahren Seit mehr als 15 Jahren werden Erdgasautos in Serie gefertigt. Das Erdgas wird in Tanks mitgeführt und steht unter einem Druck von 200 bar. Mittlerweile gibt es in Österreich
Autos, die mit Erdgas fahren Seit mehr als 15 Jahren werden Erdgasautos in Serie gefertigt. Das Erdgas wird in Tanks mitgeführt und steht unter einem Druck von 200 bar. Mittlerweile gibt es in Österreich
Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser"
 Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser" a) Identifizierung des entstehenden Gases: Chemikalien: Geräte: Lithium [C] [F], Natrium [C] [F] (jeweils in Benzin mit Siedebereich 90-110
Identifizierung der Produkte der Reaktion "Alkalimetalle + Wasser" a) Identifizierung des entstehenden Gases: Chemikalien: Geräte: Lithium [C] [F], Natrium [C] [F] (jeweils in Benzin mit Siedebereich 90-110
Schulcurriculum für die Einführungsphase Chemie Jahrgang 11
 Helene-Lange-Schule Hannover Schulcurriculum für die Einführungsphase Chemie Jahrgang 11 ganzjähriger Unterricht: ca. 64 Unterrichtsstd. Hinweis: Folgende grundlegende Kompetenzen aus dem Bereich Kommunikation
Helene-Lange-Schule Hannover Schulcurriculum für die Einführungsphase Chemie Jahrgang 11 ganzjähriger Unterricht: ca. 64 Unterrichtsstd. Hinweis: Folgende grundlegende Kompetenzen aus dem Bereich Kommunikation
Jetzt wird s undurchsichtig: Der "Louche"-Effekt
 age fotostock / LOOK-foto Jetzt wird s undurchsichtig: Der "Louche"-Effekt Bild 1: Urlaub auf den Kykladen in Griechenland Bild 2: Ouzo (frz.: louche undurchsichtig, verdächtig, anrüchig) Bild 3: Ouzo
age fotostock / LOOK-foto Jetzt wird s undurchsichtig: Der "Louche"-Effekt Bild 1: Urlaub auf den Kykladen in Griechenland Bild 2: Ouzo (frz.: louche undurchsichtig, verdächtig, anrüchig) Bild 3: Ouzo
Kerze, einfach faszinierend
 Der berühmte, englische Forscher Michael Faraday (1791-1867) widmete im Jahre 1860 eine Reihe naturwissenschaftlicher Vorlesungen vor Jungen und Mädchen der Kerze. Er sagte: "Alle im Weltall wirkenden
Der berühmte, englische Forscher Michael Faraday (1791-1867) widmete im Jahre 1860 eine Reihe naturwissenschaftlicher Vorlesungen vor Jungen und Mädchen der Kerze. Er sagte: "Alle im Weltall wirkenden
Organisch-chemisches Praktikum für Studierende des Lehramts WS 2010/11
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in):Beate Abé Name: Johannes Hergt Datum: 16.11.2010 Gruppe 1: Einführung in die organische
Organisch-chemisches Praktikum für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in):Beate Abé Name: Johannes Hergt Datum: 16.11.2010 Gruppe 1: Einführung in die organische
Wie bringt man eine Kerze zum Fliegen?
 Wie bringt man eine Kerze zum Fliegen? Experimentalvortrag im Rahmen der Kinderuniversität am 19. Dezember 2007 Bevor wir diese Frage beantworten können, müssen wir zunächst einmal etwas über Kerzen an
Wie bringt man eine Kerze zum Fliegen? Experimentalvortrag im Rahmen der Kinderuniversität am 19. Dezember 2007 Bevor wir diese Frage beantworten können, müssen wir zunächst einmal etwas über Kerzen an
Europäischer Chemielehrerkongress Leoben Österreich im April 2007
 Einfache und erprobte Experimente für den Anfangsunterricht im Fach Chemie 1. Stoffumwandlung Stoffe reagieren Aggregatzustandsänderung Zusammensetzung der Luft Gesetz von der Erhaltung der Masse Reaktion
Einfache und erprobte Experimente für den Anfangsunterricht im Fach Chemie 1. Stoffumwandlung Stoffe reagieren Aggregatzustandsänderung Zusammensetzung der Luft Gesetz von der Erhaltung der Masse Reaktion
4.4 Borax-Probe. Aufgabe. Wie lässt sich Methanol von Ethanol unterscheiden? (1) Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole
 Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77900) 4.4 Borax-Probe Experiment von: Anouch Gedruckt: 25.02.204 3:45:2 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe Wie lässt
Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77900) 4.4 Borax-Probe Experiment von: Anouch Gedruckt: 25.02.204 3:45:2 intertess (Version 3.2 B24, Export 2000) Aufgabe Aufgabe Wie lässt
1 Lehrerversuch Alkalimetalle in Wasser
 1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen.
 1) DEFINITIONEN DIE CHEMISCHE REAKTION Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen. Der Massenerhalt: Die Masse ändert sich im Laufe einer Reaktion
1) DEFINITIONEN DIE CHEMISCHE REAKTION Eine chemische Reaktion läuft ab, wenn reaktionsfähige Teilchen mit genügend Energie zusammenstoßen. Der Massenerhalt: Die Masse ändert sich im Laufe einer Reaktion
Welche Eigenschaften besitzen Calcium- und Magnesiumlaugen?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P758900) 2.5 Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) Experiment von: Phywe Gedruckt: 5.0.203 2:3:05 intertess
Arbeitsheft Organische Redoxreaktionen Inhalt Jakob 1 Inhaltsverzeichnis: Seite: Vorkenntnisse:
 Arbeitsheft Organishe Reoxreaktionen Inhalt Jakob Inhaltsverzeihnis: Seite: Vorkenntnisse: Bestimmung er OZ bei organishen Molekülen Arbeitsheft Reoxreaktionen Verbrennung von Kohlenwasserstoffen. Oxiation
Arbeitsheft Organishe Reoxreaktionen Inhalt Jakob Inhaltsverzeihnis: Seite: Vorkenntnisse: Bestimmung er OZ bei organishen Molekülen Arbeitsheft Reoxreaktionen Verbrennung von Kohlenwasserstoffen. Oxiation
Verbrennung liefert Energie. Lagerfeuer von Lukas Riebling (eigenes Werk) [CC BY-SA3.0] via Wikimedia commons. Darum geht s bei diesem LernJob:
![Verbrennung liefert Energie. Lagerfeuer von Lukas Riebling (eigenes Werk) [CC BY-SA3.0] via Wikimedia commons. Darum geht s bei diesem LernJob: Verbrennung liefert Energie. Lagerfeuer von Lukas Riebling (eigenes Werk) [CC BY-SA3.0] via Wikimedia commons. Darum geht s bei diesem LernJob:](/thumbs/75/71984198.jpg) LernJob BNT, Klasse 5/6 Verbrennung liefert Hast du schon mal erlebt, wie heiß und hell es um ein Lagerfeuer herum ist? Da steckt ganz schön viel drin! Aber wo steckt die eigentlich genau und wo geht sie
LernJob BNT, Klasse 5/6 Verbrennung liefert Hast du schon mal erlebt, wie heiß und hell es um ein Lagerfeuer herum ist? Da steckt ganz schön viel drin! Aber wo steckt die eigentlich genau und wo geht sie
Standortbestimmung / Äquivalenzprüfung. Chemie. Mittwoch, 13. April 2016, Uhr
 Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
man sagt : Phosphor + Sauerstoff reagieren Tetraphosphorzu dekaoxid
 Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
Die Luft 1.Versuch Wir entzünden eine Kerze und stülpen ein Becherglas darüber. Beobachtung : Nach kurzer Zeit erlischt die Flamme. Feststellung : Für die Verbrennung in unserer Umwelt ist Luft notwendig.
UNTERSUCHUNG VON KNALLERBSEN
 VERSUCHSANLEITUNGEN UNTERSUCHUNG VON KNALLERBSEN Knallerbsen 1 Reagenzglas 10/80 mm 1 Wäscheklammer 600 ml Der Inhalt einer noch nicht zur Reaktion gebrachten Knallerbse wird vorsichtig vom umhüllenden
VERSUCHSANLEITUNGEN UNTERSUCHUNG VON KNALLERBSEN Knallerbsen 1 Reagenzglas 10/80 mm 1 Wäscheklammer 600 ml Der Inhalt einer noch nicht zur Reaktion gebrachten Knallerbse wird vorsichtig vom umhüllenden
Proteinbestimmung in biogenem Material durch Elementaranalyse von Stickstoff. Elementaranalyse Info 1
 Proteinbestimmung in biogenem Material durch Elementaranalyse von Stickstoff Elementaranalyse Info 1 Einleitung 1 qualitative und quantitative Analyse organischer Verbindungen. Es wird nach der Menge jener
Proteinbestimmung in biogenem Material durch Elementaranalyse von Stickstoff Elementaranalyse Info 1 Einleitung 1 qualitative und quantitative Analyse organischer Verbindungen. Es wird nach der Menge jener
Grundwissen Chemie 9. Jahrgangsstufe G8
 Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
Atome. Chemie. Zusammenfassungen. Prüfung Mittwoch, 14. Dezember Dalton-Modell. Reaktionsgrundgesetze. Chemische Formeln.
 Chemie Atome Zusammenfassungen Prüfung Mittwoch, 14. Dezember 2016 Dalton-Modell Reaktionsgrundgesetze Chemische Formeln Avogadro Relative Massen Quantitative Beziehungen Stöchiometrie Steffi, Tom, Marvin
Chemie Atome Zusammenfassungen Prüfung Mittwoch, 14. Dezember 2016 Dalton-Modell Reaktionsgrundgesetze Chemische Formeln Avogadro Relative Massen Quantitative Beziehungen Stöchiometrie Steffi, Tom, Marvin
Curriculum Fach: Chemie Klasse: 8 Hölderlin-Gymnasium Nürtingen. Chemie
 Klassenstufe 8 BS (nach S. 196/197) Curriculum Fach: Chemie Klasse: 8 Chemie Kerncurriculum Inhalte Zeit Kompetenzen: die Schülerinnen und Schüler können Stoffe und ihre Eigenschaften Bemerkungen Wichtige
Klassenstufe 8 BS (nach S. 196/197) Curriculum Fach: Chemie Klasse: 8 Chemie Kerncurriculum Inhalte Zeit Kompetenzen: die Schülerinnen und Schüler können Stoffe und ihre Eigenschaften Bemerkungen Wichtige
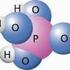
Wasser à. Nachweis: Wasser ist
 Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
Arbeitsblatt zu Kap. 5. Atome Bausteine der Stoffe 5.1 Elemente und Verbindungen Elektrolyse des Reinstoffes Wasser Wasser à Nachweis: Wasser ist Stoffeinteilung 5.2 Von den Elementen zu den Atomen Synthese
Vom Alkohol zum Aromastoff
 Vom Alkohol zum Aromastoff Herstellung Versuchsaufbau und -ablauf: Bottich, Reagenzglas 2-Brom-2-methylpropan, heißes Wasser, Natronlauge Phenolphthalein (PPT), Silbernitratlösung In das Reagenzglas wird
Vom Alkohol zum Aromastoff Herstellung Versuchsaufbau und -ablauf: Bottich, Reagenzglas 2-Brom-2-methylpropan, heißes Wasser, Natronlauge Phenolphthalein (PPT), Silbernitratlösung In das Reagenzglas wird
Fachcurriculum Chemie Jahrgang 11 / Einführungsphase ab 2018/19
 Fachcurriculum Chemie Jahrgang 11 / Einführungsphase ab 2018/19 Ganzjähriger Unterricht 2-stündig Unterthemen Kohlenwasserstoffe Kraftstoffe und mehr Organische Chemie organische Verbindungen Definition
Fachcurriculum Chemie Jahrgang 11 / Einführungsphase ab 2018/19 Ganzjähriger Unterricht 2-stündig Unterthemen Kohlenwasserstoffe Kraftstoffe und mehr Organische Chemie organische Verbindungen Definition
Quantitative Analyse von Kohlenwasserstoffen
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden Versuche
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden Versuche
Versuch: Qualitativer Nachweis von Kohlenstoff und Wasserstoff
 Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Philipps-Universität Marburg 20.11.2007 Organisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 1, Einführung in die OC Versuch: Qualitativer Nachweis
Schuleigener Lehrplan Chemie (Grundlage: KLP 2008) Klasse 9. Schuleigener Lehrplan. Chemie - Klasse 9 -
 Schuleigener Lehrplan Chemie - Klasse 9 - 9 Saure und alkalische Lösungen Ionen in sauren und alkalischen Lösungen Neutralisation Protonenaufnahme und Abgabe an einfachen Beispielen Stöchiometrische Berechnungen
Schuleigener Lehrplan Chemie - Klasse 9 - 9 Saure und alkalische Lösungen Ionen in sauren und alkalischen Lösungen Neutralisation Protonenaufnahme und Abgabe an einfachen Beispielen Stöchiometrische Berechnungen
+ 30,5 O 2 (g) 20 CO 2 (g) + 21 H 2 O
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 11.11.2008 Gruppe 1: Einführung der OC Versuch: Nachweis
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah Henkel Datum: 11.11.2008 Gruppe 1: Einführung der OC Versuch: Nachweis
1. STOFFE UND STOFFEIGENSCHAFTEN ARBEITSBLATT 1.1 MATERIE UND IHRE KLEINSTEN BAUSTEINE VORÜBERLEGUNGEN
 1. STOFFE UND STOFFEIGENSCHAFTEN ARBEITSBLATT 1.1 MATERIE UND IHRE KLEINSTEN BAUSTEINE Chemie beschäftigt sich mit Materie. Die Aggregatzustände (s, l und g) sind Formen der Materie. Materie besteht aus
1. STOFFE UND STOFFEIGENSCHAFTEN ARBEITSBLATT 1.1 MATERIE UND IHRE KLEINSTEN BAUSTEINE Chemie beschäftigt sich mit Materie. Die Aggregatzustände (s, l und g) sind Formen der Materie. Materie besteht aus
Schematische Apparatur zur Bestimmung des Wasserstoff- und Kohlenstoff-Gehalts von Organischen Verbindungen
 Vorlesung 2 rganische Elementaranalyse nach Liebig (1831) Eine genau abgewogene ubstanz C n H m y wird im auerstoffstrom an einer glühenden Cu- chicht verbrannt, wobei der Kohlenstoff in C 2 und der Wasserstoff
Vorlesung 2 rganische Elementaranalyse nach Liebig (1831) Eine genau abgewogene ubstanz C n H m y wird im auerstoffstrom an einer glühenden Cu- chicht verbrannt, wobei der Kohlenstoff in C 2 und der Wasserstoff
Destillation und Alkohol
 Destillation und Alkohol Zuordnung zum Kompetenzmodell (KM) Aufgabe(n) KM Beschreibung C2.3 Physikalische Trennverfahren und deren Anwendung W1 Ich kann Vorgänge und Phänomene in Natur, Umwelt und Technik
Destillation und Alkohol Zuordnung zum Kompetenzmodell (KM) Aufgabe(n) KM Beschreibung C2.3 Physikalische Trennverfahren und deren Anwendung W1 Ich kann Vorgänge und Phänomene in Natur, Umwelt und Technik
Untersuche die Kerzenflamme sowie die Vorgänge, die beim Verbrennen des Kerzenwachses ablaufen.
 Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P7154200) 2.10 Die Kerzenflamme Experiment von: Seb Gedruckt: 24.03.2014 11:14:37 intertess (Version 13.12 B214, Export 2000)
Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P7154200) 2.10 Die Kerzenflamme Experiment von: Seb Gedruckt: 24.03.2014 11:14:37 intertess (Version 13.12 B214, Export 2000)
Untersuche das Verhalten von Zitronensäure gegenüber verschiedene Stoffen in Wasser und in Aceton.
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P758500).6 Brönstedt Säuren - Aciditätvergleich einer wässrigen und einer acetonischen Citronensäurel Experiment von: Phywe Gedruckt: 5.0.203
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P758500).6 Brönstedt Säuren - Aciditätvergleich einer wässrigen und einer acetonischen Citronensäurel Experiment von: Phywe Gedruckt: 5.0.203
Schulversuchspraktikum. Marc Ehlers. Sommersemester Klassenstufen 7 & 8. Sauerstoff. Kurzprotokoll
 Schulversuchspraktikum Marc Ehlers Sommersemester 2016 Klassenstufen 7 & 8 Sauerstoff Kurzprotokoll Auf einen Blick: In diesem Protokoll werden weitere Versuche zum Thema Sauerstoff als Bestandteil der
Schulversuchspraktikum Marc Ehlers Sommersemester 2016 Klassenstufen 7 & 8 Sauerstoff Kurzprotokoll Auf einen Blick: In diesem Protokoll werden weitere Versuche zum Thema Sauerstoff als Bestandteil der
Wer spannt wem den Sauerstoff aus? Metalloxide
 1 von 24 Wer spannt wem den Sauerstoff aus? Metalloxide Ein Beitrag von Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff, Esslingen Mit Illustrationen von Julia Lenzmann, Stuttgart Foto: Colourbox
1 von 24 Wer spannt wem den Sauerstoff aus? Metalloxide Ein Beitrag von Petra Frank, Tobias Frank und Dr. Hans-Peter Haseloff, Esslingen Mit Illustrationen von Julia Lenzmann, Stuttgart Foto: Colourbox
Gas X KK8.1. Reaktionen saurer Lösungen Salzsäure reagiert mit... b)... Magnesium unter Wasserstoffentwicklung
 Salzsäure Salzsäure lässt sich herstellen, indem man ein Gas X in einen Kolben füllt und einströmen lässt. a) Gib den Namen und die Summenformel von Gas X an. b) Gas X kann aus den Elementen hergestellt
Salzsäure Salzsäure lässt sich herstellen, indem man ein Gas X in einen Kolben füllt und einströmen lässt. a) Gib den Namen und die Summenformel von Gas X an. b) Gas X kann aus den Elementen hergestellt
Z 12 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN
 ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
Stöchiometrie. Unterrichtsideen für ein trockenes Thema. Schweizerische Chemische Gesellschaft, 22. Aug Workshop C2
 Schweizerische Chemische Gesellschaft, 22. Aug. 2017 Workshop C2 Stöchiometrie Unterrichtsideen für ein trockenes Thema an Amadeus Bärtsch, Fachdidaktik ETH Zürich www.fdchemie.pbworks.com Vorwort Ideen
Schweizerische Chemische Gesellschaft, 22. Aug. 2017 Workshop C2 Stöchiometrie Unterrichtsideen für ein trockenes Thema an Amadeus Bärtsch, Fachdidaktik ETH Zürich www.fdchemie.pbworks.com Vorwort Ideen
Die chemische Reaktion
 Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Aus den beiden Ausgangsstoffen (Edukten) entsteht ein neuer Stoff (Produkt) mit eigenen,
Die chemische Reaktion 1. Versuch In eine mit Sauerstoff gefüllte Flasche halten wir ein Stück brennenden Schwefel. Aus den beiden Ausgangsstoffen (Edukten) entsteht ein neuer Stoff (Produkt) mit eigenen,
Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen. Kurzprotokoll. Schulversuchspraktikum.
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Aufgabe: Erkläre folgende Tatsache mit Hilfe des Teilchenmodells! An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen.
 An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen. Bei einem Flüssigkeitsthermometer kann die Temperatur an der Höhe des Flüssigkeitsstandes im Röhrchen abgelesen werden. 1827
An heißen Tagen bilden sich auf einer gekühlten Getränkeflasche Wassertropfen. Bei einem Flüssigkeitsthermometer kann die Temperatur an der Höhe des Flüssigkeitsstandes im Röhrchen abgelesen werden. 1827
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Meine eigene Physik-Fibel - Grundbegriffe der Physik
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Meine eigene Physik-Fibel - Grundbegriffe der Physik Das komplette Material finden Sie hier: School-Scout.de SCHOOL-SCOUT Meine eigene
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Meine eigene Physik-Fibel - Grundbegriffe der Physik Das komplette Material finden Sie hier: School-Scout.de SCHOOL-SCOUT Meine eigene
Chemie Alkohole, Aldehyde & Ketone, Carbonsäuren
 Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
1. Standortbestimmung, Januar Chemie. Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung,
 1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
STOFFE U N D STOFFTRENNUNG
 Inhalt WAS IST CHEMIE? 10 STOFFE U N D STOFFTRENNUNG 22 Chemie erlebt Chem ie-chancen und Gefahren...12 Umgang mit Chemikalien... 14 Chemie erlebt Chemie is t... 16 Methode Regeln beim Experimentieren...17
Inhalt WAS IST CHEMIE? 10 STOFFE U N D STOFFTRENNUNG 22 Chemie erlebt Chem ie-chancen und Gefahren...12 Umgang mit Chemikalien... 14 Chemie erlebt Chemie is t... 16 Methode Regeln beim Experimentieren...17
Summenformel Elektronenstrichformel Name Siedepunkt
 Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Übungsaufgaben zur Atombindung, EPA-Modell und zur Polarität
 Übungsaufgaben zur Atombindung, EPA-Modell und zur Polarität TGE Zulässige ilfsmittel: Periodensystem der Elemente mit Angaben zu den Elektronegativitäten. Taschenrechner. 1. Zeichnen Sie zuerst die Strukturformel
Übungsaufgaben zur Atombindung, EPA-Modell und zur Polarität TGE Zulässige ilfsmittel: Periodensystem der Elemente mit Angaben zu den Elektronegativitäten. Taschenrechner. 1. Zeichnen Sie zuerst die Strukturformel
1. Homologe Reihe der Alkansäuren
 1. omologe Reihe der Alkansäuren 2 Mit Zunahme der Kettenlänge verlängern sich die unpolaren Teile (Alkylgruppen) der Alkansäuremoleküle, dadurch steigen die van-der-waals-kräfte zwischen den Molekülen
1. omologe Reihe der Alkansäuren 2 Mit Zunahme der Kettenlänge verlängern sich die unpolaren Teile (Alkylgruppen) der Alkansäuremoleküle, dadurch steigen die van-der-waals-kräfte zwischen den Molekülen
Fortbildung am Schülerlabor in Rechtenthal für die Grundschule. Ideen zu weiterführenden Versuchen in der Klasse:
 Fortbildung am 16.11.2012 Schülerlabor in Rechtenthal für die Grundschule Ideen zu weiterführenden Versuchen in der Klasse: Lernziele: -Die Kinder erkennen chemische, physikalische Veränderungen (auch
Fortbildung am 16.11.2012 Schülerlabor in Rechtenthal für die Grundschule Ideen zu weiterführenden Versuchen in der Klasse: Lernziele: -Die Kinder erkennen chemische, physikalische Veränderungen (auch
Analyse von "Feuerzeuggas"
 5. Ermittlung der Formel von Feuerzeuggas 5.1 Analyse von "Feuerzeuggas" 1. Physikalische Eigenschaften Betrachtet man ein durchsichtiges Einwegfeuerzeug, so erkennt man leicht eine flüssige und eine gasförmige
5. Ermittlung der Formel von Feuerzeuggas 5.1 Analyse von "Feuerzeuggas" 1. Physikalische Eigenschaften Betrachtet man ein durchsichtiges Einwegfeuerzeug, so erkennt man leicht eine flüssige und eine gasförmige
Die Kerzenflamme (Artikelnr.: P )
 Lehrer-/Dozentenblatt Die Kerzenflamme (Artikelnr.: P7154200) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema: Luft und Verbrennungen
Lehrer-/Dozentenblatt Die Kerzenflamme (Artikelnr.: P7154200) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema: Anorganische Chemie Unterthema: Luft und Verbrennungen
4. Chemische Reaktion
 Chemie GU 9 4. Chemische Reaktion 4.1 Stoffe wandeln sich um Aus Kupfer und Schwefel entsteht ein neuer Stoff Metalle reagieren mit Schwefel zu Metallsulfiden o Edukte und Produkte Das Reaktionsschema
Chemie GU 9 4. Chemische Reaktion 4.1 Stoffe wandeln sich um Aus Kupfer und Schwefel entsteht ein neuer Stoff Metalle reagieren mit Schwefel zu Metallsulfiden o Edukte und Produkte Das Reaktionsschema
Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )
![Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 ) Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )](/thumbs/74/69784240.jpg) 1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus BITTE AUSFÜLLEN BITTE HALTEN SIE IHREN STUDENTAUSWEIS BEREIT
 1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt VORANSICHT
 V Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) 1 von 30 Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt Tobias Dunst, Kißlegg Welche Verbindung besteht zwischen dem mysteriösen
V Chemische Reaktionen 4. Redoxreaktionen Schritt für Schritt (Kl. 8/9) 1 von 30 Ein Geben und Nehmen Redoxreaktionen Schritt für Schritt Tobias Dunst, Kißlegg Welche Verbindung besteht zwischen dem mysteriösen
Verbrennung einiger Stoffe
 Verbrennung einiger Stoffe beobachte wie ein Stoff verbrennt! beschreibe den Rückstand der Verbrennung Verbrennung von Flüssigkeiten: 3 Abdampfschalen, 3 Flüssigkeiten (je 10 Tropfen) Flüssigkeit 1 Flüssigkeit
Verbrennung einiger Stoffe beobachte wie ein Stoff verbrennt! beschreibe den Rückstand der Verbrennung Verbrennung von Flüssigkeiten: 3 Abdampfschalen, 3 Flüssigkeiten (je 10 Tropfen) Flüssigkeit 1 Flüssigkeit
Lernmaterial Lernfeld 1 Grundlagen Physik und Chemie. Chemische Grundlagen, Bindungsarten. Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms
 Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Klausur : Allgemeine und Anorganische Chemie. Name...Fachrichtung... Matr.-Nr...
 Klausur : Allgemeine und Anorganische Chemie Mo. 1.03.11 : 13.30 16.30 Uhr 1 Beantworten Sie maximal zehn Fragen. Für jede Frage gibt es maximal 10 Punkte; die Klausur gilt als bestanden, wenn 50 Punkte
Klausur : Allgemeine und Anorganische Chemie Mo. 1.03.11 : 13.30 16.30 Uhr 1 Beantworten Sie maximal zehn Fragen. Für jede Frage gibt es maximal 10 Punkte; die Klausur gilt als bestanden, wenn 50 Punkte
Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) (Artikelnr.: P )
 Lehrer-/Dozentenblatt Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) (Artikelnr.: P7158900) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
Lehrer-/Dozentenblatt Herstellung und Eigenschaften von Kalkwasser (Magnesiumhydroxidlösung) (Artikelnr.: P7158900) Curriculare Themenzuordnung Fachgebiet: Chemie Bildungsstufe: Klasse 7-10 Lehrplanthema:
Alles was uns umgibt!
 Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Thematische Aufgliederung der Prüfungsfragen
 Seite 1 Thematische Aufgliederung der Prüfungsfragen (gemäss Abschlussprüfungen im Fach Chemie der Eidgenössischen Berufsmaturitätsprüfung Technischer Richtung) 1. Heterogene Mischungen; Trennmethoden
Seite 1 Thematische Aufgliederung der Prüfungsfragen (gemäss Abschlussprüfungen im Fach Chemie der Eidgenössischen Berufsmaturitätsprüfung Technischer Richtung) 1. Heterogene Mischungen; Trennmethoden
Quantitative Analyse von Kohlenwasserstoffen
 Schulversuchspraktikum SoSe 2013 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 2 Auf einen Blick: Im Folgenden werden zunächst drei Versuche vorgestellt, welche die benötigten Teilschritte
Schulversuchspraktikum SoSe 2013 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 2 Auf einen Blick: Im Folgenden werden zunächst drei Versuche vorgestellt, welche die benötigten Teilschritte
Chemie Chemie - Klasse 8 - Version 1 (Juli 2004)
 Fehler! Kein Text mit angegebener Formatvorlage im Dokument. - Chemie Chemie Chemie - Klasse 8 - Version 1 (Juli 2004) Themenfeld Kerncurriculum
Fehler! Kein Text mit angegebener Formatvorlage im Dokument. - Chemie Chemie Chemie - Klasse 8 - Version 1 (Juli 2004) Themenfeld Kerncurriculum
Übungsaufgaben - Analytik
 Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
+ MnO MnO 3. Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole. Chemikalien. Materialien
 DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
