FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels)
|
|
|
- Kasimir Weiner
- vor 6 Jahren
- Abrufe
Transkript
1 FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt BEZEICHNUNG DES ARZNEIMITTELS Cuvitru 200 mg/ml Injektionslösung zur subkutanen Anwendung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin vom Menschen (SCIg) 1 ml enthält: Normales Immunglobulin vom Menschen 200 mg (Reinheit von mindestens 98 % IgG) Jede 5 ml-durchstechflasche enthält: 1 g normales Immunglobulin vom Menschen Jede 10 ml-durchstechflasche enthält: 2 g normales Immunglobulin vom Menschen Jede 20 ml-durchstechflasche enthält: 4 g normales Immunglobulin vom Menschen Jede 40 ml-durchstechflasche enthält: 8 g normales Immunglobulin vom Menschen Verteilung der IgG-Subklassen (ungefähre Werte): IgG1 56,9 % IgG2 26,6 % IgG3 3,4 % IgG4 1,7 % Der maximale IgA-Gehalt beträgt 280 Mikrogramm/ml. Aus dem Plasma menschlicher Spender hergestellt. Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt DARREICHUNGSFORM Injektionslösung Die Lösung ist klar und farblos oder schwach gelb oder hellbraun. ph von 4,6 bis 5,1 (gemessen nach Verdünnung in Kochsalzlösung auf eine 1% Proteinlösung) 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Indikationen zur subkutanen Anwendung (SCIg) 1
2 Substitutionstherapie bei Erwachsenen, Kindern und Jugendlichen (0-18 Jahre) mit: Primären Immundefektsyndromen mit verminderter Antikörperbildung (siehe Abschnitt 4.4); Hypogammaglobulinämie und rezidivierenden bakteriellen Infekten bei Patienten mit chronischer lymphatischer Leukämie (CLL), bei denen eine prophylaktische Antibiotikagabe unwirksam war oder kontraindiziert ist; Hypogammaglobulinämie und rezidivierenden bakteriellen Infekten bei Patienten mit multiplem Myelom (MM); Hypogammaglobulinämie bei Patienten vor und nach einer allogenen hämatopoetischen Stammzelltransplantation (HSCT). 4.2 Dosierung und Art der Anwendung Die Substitutionstherapie muss durch einen in der Behandlung von Immundefekten erfahrenen Arzt begonnen und überwacht werden. Dosierung Dosis und Dosisregime hängen von der Indikation ab. Substitutionstherapie Das Arzneimittel muss subkutan verabreicht werden. Bei der Substitutionstherapie muss die Dosis entsprechend dem pharmakokinetischen und klinischen Ansprechen des Patienten individuell angepasst werden. Die nachstehenden Dosierungsangaben können als Richtlinie gelten. Die Dosierung soll ein IgG-Talspiegel (gemessen vor der nächsten Infusion) von mindestens 5 bis 6 g/l erreichen und innerhalb des altersabhängigen Referenzbereichs für IgG im Serum liegen. Eine Initialdosis von mindestens 0,2-0,5 g/kg (1-2,5 ml/kg) Körpergewicht kann erforderlich sein. Diese kann, mit einer maximalen Tagesdosis von 0,1 0,15 g/kg Körpergewicht, über mehrere Tage verteilt verabreicht werden. Nachdem ein Gleichgewicht beim IgG-Spiegel erreicht ist, werden wiederholte Erhaltungsdosen verabreicht, um eine Gesamtmonatsdosis von 0,3-1,0 g/kg zu erreichen (weitere Details siehe Abschnitt 5.2). Es kann erforderlich sein, jede Einzeldosis an einer anderen Stelle des Körpers zu injizieren. Der Talspiegel muss in Hinblick auf die Infektionshäufigkeit gemessen und beurteilt werden. Um die Infektionsrate zu senken, kann ggf. eine Dosiserhöhung zur Anhebung des Talspiegels erforderlich sein. Die Dosierung bei Kindern und Jugendlichen (0-18 Jahre) unterscheidet sich nicht von der für Erwachsene, da die Dosierung für jede Indikation abhängig vom Körpergewicht angegeben und an die klinischen Ergebnisse der oben erwähnten Indikationen angepasst wird. Mit Cuvitru wurden keine klinischen Studien bei Kindern von 0 - <2 Jahren durchgeführt, aber die Erfahrung mit Immunglobulinen deutet darauf hin, dass durch Cuvitru keine schädlichen Wirkungen bei Kindern von 0 - <2 Jahren zu erwarten sind. Art der Anwendung Nur zur subkutanen Anwendung. Cuvitru muss vor der Anwendung visuell auf Partikel und Verfärbungen überprüft werden. Verwenden Sie das Produkt nicht, wenn Partikel und/oder Verfärbungen beobachtet werden. Die Infusion muss unmittelbar nach dem Aufziehen von Cuvitru in die Spritze begonnen werden. Die Verabreichung darf nicht länger als 2 Stunden dauern. Sollte, aufgrund der erforderlichen Dosis oder Verabreichungsgeschwindigkeit von Cuvitru, eine Verabreichung innerhalb von zwei Stunden nicht 2
3 möglich sein, ist die Dosis zu teilen und an verschiedenen Infusionsstellen zu verabreichen. Wenn Cuvitru länger als zwei Stunden in silikonisierten Spritzen verbleibt, können sich sichtbare Partikel bilden. Weitere Hinweise siehe Abschnitt 4.4. Cuvitru darf nicht verdünnt werden. Die subkutane Infusion muss von einer in der Anleitung von Patienten in häuslicher Behandlung erfahrenen medizinischen Fachkraft eingeleitet und anfangs überwacht werden, gefolgt von regelmäßigen Nachkontrollen. Infusionspumpen, die für die subkutane Verabreichung von Immunglobulinen geeignet sind, können verwendet werden. Der Patient oder sein Betreuer muss in der Anwendung einer Infusionspumpe, in Infusionstechniken, in dem Führen des Behandlungstagebuchs sowie in der Erkennung von schweren Nebenwirkungen und den in diesem Fall zu ergreifenden Maßnahmen geschult sein. Cuvitru kann in den Bauch, Oberschenkel, Oberarm und seitlich in die Hüfte injiziert werden. Die Anpassung der Infusionsrate und des Infusionsvolumens pro Infusionsstelle erfolgt nach Verträglichkeit des Patienten. Eine Anfangsgeschwindigkeit von 10 ml/std./infusionsstelle wird empfohlen. Bei guter Verträglichkeit (s. Abschnitt 4.4) kann bei den ersten zwei Infusionen die Infusionsrate in Abständen von mindestens 10 Minuten auf maximal 20 ml/std./infusionsstelle gesteigert werden. Es können mehrere Pumpen gleichzeitig verwendet werden. Die Produktmenge, die an einer bestimmten Stelle infundiert wird, variiert. Bei Kleinkindern und Kindern kann die Infusionsstelle alle 5-15 ml gewechselt werden. Bei Erwachsenen können Dosen über 30 ml je nach Vorliebe des Patienten aufgeteilt werden. Für die Zahl der Infusionsstellen gibt es keine Beschränkung. 4.3 Gegenanzeigen Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile (siehe Abschnitt 4.4). Schwerer IgA-Mangel und anamnestisch bekannte Überempfindlichkeit bei der Behandlung mit Immunglobulinen vom Menschen. Cuvitru darf nicht intravaskulär oder intramuskulär verabreicht werden. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Bei versehentlicher intravaskulärer Verabreichung von Cuvitru können Patienten einen Schock erleiden. Die in Abschnitt 4.2 empfohlene Infusionsgeschwindigkeit und die Hinweise zur Anwendung müssen genau eingehalten werden. Patienten müssen während der gesamten Infusionsdauer engmaschig beobachtet und sorgfältig auf Symptome hin überwacht werden.wenn das Arzneimittel länger als 2 Stunden in einer silikonisierten Spritze verbleibt, können sich sichtbare Partikel bilden. Bestimmte Nebenwirkungen können bei Patienten, die erstmals mit normalem Immunglobulin vom Menschen behandelt werden, bzw. in seltenen Fällen auch bei Umstellung zwischen normalen Immunglobulinpräparaten vom Menschen oder nach einem längeren Abstand seit der vorherigen Infusion häufiger auftreten. Mögliche Komplikationen können oft vermieden werden, wenn: das Produkt bei der ersten Injektion langsam verabreicht wird (siehe Abschnitt 4.2) sichergestellt ist, dass die Patienten während der gesamten Infusionsdauer sorgfältig auf eventuell auftretende Symptome überwacht werden. Insbesondere müssen Patienten, die normales Immunglobulin vom Menschen zum ersten Mal erhalten, bei Präparatewechsel oder nach einer längeren Therapieunterbrechung, während der ersten Infusion sowie eine Stunde danach überwacht werden, um mögliche Anzeichen von Nebenwirkungen erkennen zu können. 3
4 Alle anderen Patienten sind nach der Verabreichung mindestens 20 Minuten lang zu überwachen. Im Fall einer Nebenwirkung muss entweder die Infusionsgeschwindigkeit reduziert oder die Infusion abgebrochen werden. Bei Verdacht auf eine schwere Überempfindlichkeitsreaktion oder auf anaphylaktoide Reaktionen muss die Injektion sofort abgebrochen werden. Die erforderliche Behandlung hängt von der Art und Schwere der Nebenwirkung ab. Bei Schock ist eine Schocktherapie nach aktuellem medizinischem Standard durchzuführen. Überempfindlichkeit Echte allergische Reaktionen sind selten. Sie können insbesondere bei Patienten mit Anti-IgA- Antikörpern auftreten, die mit besonderer Vorsicht behandelt werden müssen. Patienten mit Anti-IgA- Antikörpern, bei denen die Behandlung mit subkutanen IgG-Produkten die einzige Wahl ist, müssen bei der Behandlung mit Cuvitru engmaschig ärztlich überwacht werden. Cuvitru enthält Spuren von IgA (maximal 280 Mikrogramm/ml). In seltenen Fällen kann die Gabe von normalem Immunglobulin vom Menschen einen Blutdruckabfall mit anaphylaktischer Reaktion hervorrufen. Dies kann auch bei Patienten auftreten, die die Behandlung mit normalem Immunglobulin vom Menschen bisher gut vertragen haben. Thromboembolie Arterielle und venöse thromboembolische Ereignisse, einschließlich Herzinfarkt, Schlaganfall, tiefe Venenthrombosen und Lungenembolie, können im Zusammenhang mit der Verwendung von Immunglobulinen auftreten. Besondere Vorsicht gilt bei Patienten mit bestehenden Risikofaktoren für thromboembolische Ereignisse (z. B. fortgeschrittenes Alter, Hypertonie, Diabetes mellitus und Gefäßerkrankungen oder thrombotischen Episoden in der Anamnese, bei Patienten mit erworbener oder angeborener Thrombophilie, Patienten mit längeren Phasen einer Immobilität, Patienten mit schwerer Hypovolämie und Patienten mit Erkrankungen, die die Blutviskosität erhöhen). Die Patienten müssen über die ersten Symptome von thromboembolischen Ereignissen, einschließlich Kurzatmigkeit, Schmerzen und Schwellung einer Gliedmaße, fokale neurologische Störungen und Schmerzen in der Brust, informiert sein und angewiesen werden, bei Auftreten dieser Symptome unverzüglich ihren Arzt zu kontaktieren. Stellen Sie sicher, dass die Patienten vor der Anwendung ausreichend hydriert sind. Patienten mit einem Risiko für Hyperviskosität müssen auf Anzeichen und Symptome einer Thrombose hin überwacht und die Blutviskosität muss bestimmt werden. Renale Komplikationen Bei Patienten unter Immunglobulinbehandlung wurde über schwere renale Nebenwirkungen berichtet, insbesondere bei Produkten, die Saccharose enthalten (Cuvitru enthält keine Saccharose). Dazu gehören akutes Nierenversagen, akute Tubulusnekrose, proximale tubuläre Nephropathie und osmotische Nephrose. Zu den Faktoren, die das Risiko von renalen Komplikationen erhöhen, gehören insbesondere, aber nicht ausschließlich, vorbestehende Niereninsuffizienz, Diabetes mellitus, Hypovolämie, gleichzeitige Verabreichung nephrotoxischer Arzneimittel, ein Alter über 65 Jahre, Sepsis, Hyperviskosität und Paraproteinämie. Aseptisches Meningitisches Syndrom (AMS) Es liegen Berichte über das Auftreten eines Aseptischen Meningitischen Syndroms (AMS) bei der Immunglobulinbehandlung vor. AMS kann bei weiblichen Patienten häufiger auftreten. Nach Absetzen der Ig-Behandlung kann das AMS innerhalb einiger Tage ohne Folgewirkungen abklingen. Das Syndrom beginnt normalerweise innerhalb von einigen Stunden bis zu 2 Tagen nach der Immunglobulinbehandlung. Liquoruntersuchungen sind vielfach positiv mit Pleozytose von bis zu 4
5 mehreren tausend Zellen pro mm 3, vorwiegend aus der Granulozytenreihe, und zeigen erhöhte Proteinspiegel von bis zu mehreren hundert mg/dl. Die Patienten müssen über die anfänglichen Symptome, beispielsweise schwere Kopfschmerzen, Nackensteifigkeit, Benommenheit, Fieber, Photophobie, Übelkeit und Erbrechen, informiert sein. Hämolyse Cuvitru enthält Blutgruppen-Antikörper, die als Hämolysine wirken können und in vivo eine Beladung der Erythrozyten mit Immunglobulinen bewirken. Dies kann zu einer positiven direkten Antiglobulin- Reaktion (DAT, Direkter Coombs-Test) und in seltenen Fällen zu einer Hämolyse führen. Im Anschluss an eine Immunglobulinbehandlung kann es aufgrund einer erhöhten Sequestration der Erythrozyten zu einer verzögerten hämolytischen Anämie kommen. Gleichzeitig mit einer intravaskulären Hämolyse wurde über eine akute hämolytische Anämie berichtet. Interferenzen mit serologischen Untersuchungen Nach Injektion von Immunglobulinen kann der vorübergehende Anstieg der verschiedenen passiv übertragenen Antikörper im Blut des Patienten zu irreführenden positiven Testergebnissen bei serologischen Untersuchungen führen, z.b. auf Hepatitis A, Hepatitis B, Masern und Feuchtblattern (Windpocken). Die passive Übertragung von Antikörpern gegen Erythrozytenantigene, z.b. A, B, D kann bei einigen serologischen Tests auf Erythrozyten-Antikörper, z. B. beim direkten Antiglobulintest (DAT, direkter Coombs-Test), zu Interferenzen führen. Die Verabreichung von Cuvitru kann bei Tests zur Bestimmung von Beta-D-Glykan zum Nachweis von Pilzinfektionen zu falsch positiven Testergebnissen führen. Dies kann noch Wochen nach der Infusion des Arzneimittels andauern. Übertragbare Erreger Standardmaßnahmen zur Vorbeugung von Infektionen, die durch aus menschlichem Blut oder Plasma hergestellten Arzneimitteln übertragen werden können, schließen die Auswahl der Spender, die Testung der Einzelspenden und der Plasmapools auf spezifische Infektionsmarker und die Durchführung effektiver Herstellungsschritte zur Inaktivierung/Abtrennung von Viren mit ein. Trotzdem ist bei der Verabreichung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln die Übertragung von infektiösen Erregern - auch bislang unbekannter Natur - nicht völlig auszuschließen. Die oben beschriebenen Maßnahmen werden für umhüllte Viren wie das humane Immundefizienz- Virus (HIV), das Hepatitis B-Virus (HBV) und das Hepatitis C-Virus (HCV) sowie für nicht-umhüllte Viren wie das Hepatitis A-Virus (HAV) und das Parvovirus B19 für wirksam erachtet. Ausreichende klinische Erfahrungen weisen auf eine Hepatitis A-Virus- oder Parvovirus B19- übertragungsfreie Anwendung von Immunglobulinen hin. Auch wird angenommen, dass der Antikörpergehalt einen wichtigen Beitrag zur Virussicherheit leistet. Es wird dringend empfohlen, jede Verabreichung von Cuvitru mit Produktnamen und Chargennummer zu dokumentieren, um die Verbindung zwischen Patient und Produktcharge herstellen zu können. Natriumgehalt Cuvitru ist praktisch natriumfrei. Obenstehende Warnhinweise und Vorsichtsmaßnahmen gelten sowohl für Erwachsene als auch für Kinder. 5
6 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Virus-Lebendimpfstoffe Die Verabreichung von Immunglobulinen kann die Wirksamkeit von Virus-Lebendimpfstoffen, wie Impfstoffe gegen Masern, Röteln, Mumps und Windpocken, für einen Zeitraum von mindestens 6 Wochen bis zu 3 Monaten beeinträchtigen. Nach der Verabreichung von Cuvitru muss daher ein Zeitraum von 3 Monaten verstreichen bevor eine Impfung mit einem Virus-Lebendimpfstoff erfolgt. Im Fall der Masernimpfung kann die Beeinträchtigung bis zu 1 Jahr lang anhalten. Deshalb muss bei Patienten, die eine Masernimpfung erhalten, der Antikörperspiegel überprüft werden. Die angeführten Wechselwirkungen gelten sowohl für Erwachsene als auch für Kinder. 4.6 Fertilität, Schwangerschaft und Stillzeit Ärzte müssen das mögliche Risiko sorgfältig abwägen und Cuvitru nur verschreiben, wenn es unbedingt erforderlich ist. Schwangerschaft Die Sicherheit dieses Arzneimittels während der Schwangerschaft des Menschen wurde nicht in kontrollierten klinischen Studien untersucht; deshalb darf es Schwangeren und stillenden Müttern nur mit Vorsicht verabreicht werden. Es wurde gezeigt, dass Ig-Produkte die Plazenta passieren, in zunehmendem Maß während des dritten Trimenons. Klinische Erfahrungen mit Immunglobulinen deuten darauf hin, dass keine schädlichen Wirkungen auf den Verlauf der Schwangerschaft, den Foetus und das Neugeborene zu erwarten sind. Stillzeit Immunglobuline gehen in die Muttermilch über und können dazu beitragen, das Neugeborene gegen Pathogene zu schützen, die über die Schleimhaut eindringen. Fertilität Klinische Erfahrungen mit Immunglobulinen deuten darauf hin, dass keine schädlichen Wirkungen auf die Fertilität zu erwarten sind. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen kann durch manche Nebenwirkungen von Cuvitru beeinträchtigt werden. Patienten, bei denen es während der Behandlung zu Nebenwirkungen kommt, müssen warten bis diese wieder abgeklungen sind, bevor sie ein Fahrzeug lenken oder Maschinen bedienen. 4.8 Nebenwirkungen Zusammenfassung des Sicherheitsprofils Gelegentlich können Nebenwirkungen, wie etwa Schüttelfrost, Kopfschmerzen, Schwindelgefühl, Fieber, Erbrechen, allergische Reaktionen, Übelkeit, Arthralgie, niedriger Blutdruck sowie leichte starke Schmerzen im unteren Rücken auftreten. 6
7 In seltenen Fällen können normale Immunglobuline vom Menschen einen plötzlichen Blutdruckabfall und in Einzelfällen einen anaphylaktischem Schock auslösen, auch wenn der Patient bei früherer Verabreichung keine Überempfindlichkeit gezeigt hat. Lokalreaktionen an der Infusionsstelle: Schwellung, Empfindlichkeit, Rötung, Verhärtung, lokale Erwärmung, lokaler Schmerz, Juckreiz, blaue Flecken und Hautausschlag können häufig auftreten. Zur Sicherheit in Hinblick auf übertragbare Erreger siehe Abschnitt 4.4. Tabellarische Auflistung der Nebenwirkungen Die Sicherheit von subkutan verabreichtem Cuvitru wurde in zwei prospektiven, offenen, unkontrollierten, multizentrischen Studien an 122 Personen mit primärem Immundefektsyndrom (PID) überprüft. Die meisten lokalen Nebenwirkungen (98,8 %) waren von leichter Intensität. Ein Studienteilnehmer brach die Behandlung wegen einer lokalen Nebenwirkung (Schmerz) ab. 112 der 122 Studienteilnehmer, die mit Cuvitru behandelt wurden, beendeten die Studie. In untenstehender Tabelle sind die Nebenwirkungen gemäß den MedDRA-Systemorganklasse (SOC und bevorzugter Begriff) gereiht. Die Häufigkeiten wird nach den folgenden Kriterien angegeben: sehr häufig ( 1/10); häufig ( 1/100 bis <1/10); gelegentlich ( 1/1.000 bis <1/100); selten ( 1/ bis <1/1.000); sehr selten (<1/10.000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Häufigkeit von Nebenwirkungen in klinischen Studien mit Cuvitru MedDRA Systemorganklasse ERKRANKUNGEN DES NERVENSYSTEMS Nebenwirkung Häufigkeit pro Häufigkeit Studienteilnehmer a pro Infusion b Kopfschmerzen Sehr häufig Häufig Schwindelgefühl Häufig Gelegentlich Brennen Gelegentlich Selten Migräne Häufig Selten Somnolenz Häufig Selten GEFÄSSERKRANKUNGEN Hypotonie Häufig Selten ERKRANKUNGEN DES GASTROINTESTINALTRAKTS Diarrhoe Sehr häufig Häufig Übelkeit Sehr häufig Gelegentlich Unterbauchschmerzen Gelegentlich Selten Bauchschmerzen Häufig Gelegentlich ERKRANKUNGEN DER HAUT Pruritus Häufig Selten UND DES UNTERHAUTZELLGEWEBES Urtikaria Häufig Selten SKELETTMUSKULATUR-, BINDEGEWEBS- UND KNOCHENERKRANKUNGEN Myalgie Häufig Gelegentlich 7
8 MedDRA Systemorganklasse ALLGEMEINE ERKRANKUNGEN UND BESCHWERDEN AM VERABREICHUNGSORT UNTERSUCHUNGEN Nebenwirkung Häufigkeit pro Häufigkeit Studienteilnehmer a pro Infusion b Lokale Reaktion Sehr häufig Häufig Erythem an der Sehr häufig Häufig Infusionsstelle (einschließlich Erythem an der Injektionsstelle) Schmerzen an der Sehr häufig Häufig Injektionsstelle (einschließlich Beschwerden und Schmerzen an der Infusionsstelle) Schwellungen an Häufig Gelegentlich der Infusionsstelle Juckreiz an der Häufig Gelegentlich Injektionsstelle (einschließlich Juckreiz an der Infusionsstelle) Urtikaria an der Häufig Gelegentlich Infusionsstelle Blauer Fleck an der Häufig Selten Infusionsstelle Ödeme an der Infusionsstelle Gelegentlich Selten Müdigkeit Sehr häufig Gelegentlich Schmerzen Häufig Selten Positiv auf GAD- Gelegentlich Selten Antikörper positiver direkter Gelegentlich Selten Coombs-Test a Die Häufigkeit je Studienteilnehmer wird anhand der Anzahl der Personen in Bezug auf alle Nebenwirkungen, unabhängig davon, ob sie mit Cuvitru in Zusammenhang stehen, berechnet. b Die Häufigkeit je Infusion wird anhand der Anzahl der Infusionen in Bezug auf alle Nebenwirkungen, unabhängig davon, ob sie mit Cuvitru in Zusammenhang stehen, berechnet. Die folgenden zusätzlichen Nebenwirkungen wurden bei der Verwendung eines anderen subkutanen Immunglobulins nach der Marktzulassung beobachtet und berichtet: Parästhesie, Tremor, Tachykardie, Dyspnoe, Laryngospasmus und Beschwerden in der Brust. Das Sicherheitsprofil für entspricht demjenigen von erwachsenen Patienten. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem anzuzeigen: Österreich Bundesamt für Sicherheit im Gesundheitswesen Traisengasse 5 8
9 A-1200Wien Fax: + 43 (0) Website: Überdosierung Folgen einer Überdosierung sind nicht bekannt. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Immunsera und Immunglobuline: Immunglobuline, normal human, zur extravasalen Anwendung, ATC-Code: J06BA01 Wirkmechanismus Normales Immunglobulin vom Menschen enthält hauptsächlich Immunglobulin G (IgG) mit einem breiten Spektrum an Antikörpern gegen infektiöse Erreger. Normales Immunglobulin vom Menschen enthält IgG-Antikörper, die auch in der Normalbevölkerung vorhanden sind. Normalerweise wird es aus gepooltem Plasma von mindestens 1000 Spenden hergestellt. Die Verteilung der Immunglobulin G-Subklassen entspricht in etwa der von nativem humanem Plasma. Mit der Verabreichung ausreichender Dosen dieses Arzneimittels kann die Normalisierung pathologisch verminderter Immunglobulin G-Spiegel erreicht werden. Es gibt keine theoretischen oder tatsächlichen Unterschiede bei der Wirkung von Immunglobulinen auf im Vergleich zu Erwachsenen. 5.2 Pharmakokinetische Eigenschaften Nach der subkutanen Gabe von Cuvitru werden die maximalen Serumspiegel nach etwa 3 Tagen erreicht. In einer klinischen Studie mit Cuvitru (n=48) erreichten die Studienteilnehmer über einen Zeitraum von 52 Wochen dauerhafte IgG-Talspiegel (Median 8,26 g/l), wenn Sie eine wöchentliche Durchschnittsdosis von 0,125 g/kg erhielten. Die Ergebnisse der klinischen Studie mit Cuvitru zeigen, dass IgG-Talspiegel durch Dosen von 0,3 bis 1,0 g/kg Körpergewicht alle 4 Wochen aufrechterhalten werden können. Die Pharmakokinetik von Cuvitru wurde in der Phase 3-Studie zur Wirksamkeit und Sicherheit an 31 Patienten mit primären Immundefekten im Alter von 12 Jahren und älter untersucht. Die Ergebnisse zur Pharmakokinetik sind in nachstehender Tabelle zusammengefasst. Pharmakokinetische Parameter von Cuvitru Parameter Cuvitru Median (95 %-Konfidenzintervall), N=31 AUC [g*tage/l] 62,52 (57,16 bis 68,86) AUC / (Dosis/Gewicht) [(g*tage/l)/(g/kg)] 589,49 (448,40 bis 638,81) Scheinbare Clearance [ml/kg/tag] 1,70 (1,57 bis 2,23) C max [g/l] 9,80 (9,31 bis 10,62) C min [g/l] 8,04 (7,30 bis 8,99) T max [Stunden] 73,92 (69,82 bis 120,08) IgG und IgG-Komplexe werden in den Zellen des retikuloendothelialen Systems abgebaut. 9
10 Einmal wöchentlich, einmal alle zwei Wochen oder häufiger (2-7 Mal pro Woche) Die pharmakokinetische (PK) Charakterisierung der Dosierung von Cuvitru für einmal alle zwei Wochen oder häufiger wurde anhand einer populationsbezogenen PK-Modellierung und -Simulation durchgeführt. Die Daten zur IgG-Konzentration im Serum bestanden aus 724 Proben von 32 verschiedenen Kindern, Jugendlichen und Erwachsenen mit PID. Durch die PK-Modellierung und -Simulation wurde prognostiziert, dass die Gabe von Cuvitru alle zwei Wochen mit der doppelten Wochendosis in einem 2-Wochen-Intervall zu einer sich überschneidenden IgG-Exposition führt. Außerdem wurde durch die PK-Modellierung und -Simulation prognostiziert, dass für die identische Gesamtwochendosis an Cuvitru, die 2-7 Mal pro Woche (häufige Dosierung) verabreicht wurde, ebenfalls in einem 2-Wochen-Intervall zu einer sich überschneidenden IgG-Exposition führt. Es gibt keine theoretischen oder tatsächlichen Unterschiede bei der Pharmakokinetik von Immunglobulinen bei Kindern und Jugendlichen im Vergleich zu Erwachsenen. 5.3 Präklinische Daten zur Sicherheit Immunglobuline sind normale Bestandteile des menschlichen Körpers. Basierend auf den konventionellen Studien zur Sicherheitspharmakologie und Toxizität lassen die präklinischen Daten für Immunglobuline keine besonderen Gefahren für den Menschen erkennen. Cuvitru wurde lokal gut vertragen, wenn es Tieren subkutan verabreicht wurde. Tierexperimentelle Studien zur Toxizität bei wiederholter Gabe und Reproduktionstoxizität sind aufgrund der Bildung von Antikörpern gegen heterologe Proteine und den daraus entstehenden Interferenzen nicht durchführbar. Tierexperimentelle Langzeitstudien zur Einschätzung des kanzerogenen Potentials von Cuvitru oder seinen Auswirkungen auf die Fertilität wurden nicht durchgeführt. Für IGI 10 % wurde ein in-vitro- Mutagenitätstest durchgeführt, in dem keine Mutagenität nachgewiesen wurde. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Glycin Wasser für Injektionszwecke 6.2 Inkompatibilitäten Die Verabreichung von Cuvitru zusammen mit anderen Arzneimitteln wird nicht empfohlen. Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden. Cuvitru darf nicht verdünnt werden. 6.3 Dauer der Haltbarkeit 2 Jahre Nach dem Öffnen sofort verwenden. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 25 C lagern. 10
11 Nicht einfrieren. Die Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. 6.5 Art und Inhalt des Behältnisses 5, 10, 20 oder 40 ml Lösung in einer Durchstechflasche (Typ I-Glas) mit Gummistopfen (Bromobutyl). Packungsgröße: 1 Durchstechflasche Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Falls das Produkt im Kühlschrank aufbewahrt wird, müssen die ungeöffneten Durchstechflaschen vor der Verwendung mindestens für 90 Minuten bei Raumtemperatur gelagert und während der Verabreichung auf Raumtemperatur gehalten werden. Keine Heizgeräte wie z. B. eine Mikrowelle verwenden. Lösungen, die trüb sind oder Ablagerungen aufweisen, dürfen nicht verwendet werden. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen. 7. INHABER DER ZULASSUNG Baxalta Innovations GmbH Industriestraße 67 A-1221 Wien 8. ZULASSUNGSNUMMER Z.Nr DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG Datum der Erteilung der Zulassung: 7. Juli STAND DER INFORMATION Juli 2017 REZEPTPFLICHT/APOTHEKENPFLICHT Rezept- und apothekenpflichtig, wiederholte Abgabe verboten 11
Neues subkutanes Immunglobulin. Hochkonzentriert. High-Speed. Hizentra. Immune Globulin Subcutaneous (Human) 20%Liquid
 Neues subkutanes Immunglobulin Hochkonzentriert. High-Speed. Hizentra. Hizentra bietet Hohe Konzentration und geringes Infusionsvolumen Kurze Infusionsdauer Exzellenten Infektionsschutz Sehr gute Verträglichkeit
Neues subkutanes Immunglobulin Hochkonzentriert. High-Speed. Hizentra. Hizentra bietet Hohe Konzentration und geringes Infusionsvolumen Kurze Infusionsdauer Exzellenten Infektionsschutz Sehr gute Verträglichkeit
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Eine Fertigspritze mit 0,4 ml enthält Hepatitis-B-Immunglobulin vom Menschen 200 I.E..
 1. BEZEICHNUNG DES ARZNEIMITTELS Fovepta 200 I.E. Injektionslösung in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Fertigspritze mit 0,4 ml enthält Hepatitis-B-Immunglobulin
1. BEZEICHNUNG DES ARZNEIMITTELS Fovepta 200 I.E. Injektionslösung in einer Fertigspritze 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Eine Fertigspritze mit 0,4 ml enthält Hepatitis-B-Immunglobulin
Anhang III. Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage
 Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
Anhang III Änderungen der Entsprechenden Abschnitte der Zusammenfassung der Merkmale des arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale, Etikettierung und Packungsbeilage
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Daflon 500 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 500 mg gereinigte, mikronisierte
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Daflon 500 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Filmtablette enthält 500 mg gereinigte, mikronisierte
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels)
 FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Condrosulf 800 mg-tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Tablette enthält 800 mg Natriumchondroitinsulfat
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Condrosulf 800 mg-tabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Tablette enthält 800 mg Natriumchondroitinsulfat
Fachinformation Beriglobin P
 Fachinformation Beriglobin P (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Beriglobin P * Fertigspritze Injektionslösung zur subkutanen oder intramuskulären Anwendung
Fachinformation Beriglobin P (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Beriglobin P * Fertigspritze Injektionslösung zur subkutanen oder intramuskulären Anwendung
HyQvia 100 mg/ml Infusionslösung zur subkutanen Anwendung
 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert,
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
Zusammenfassung der Merkmale des Arzneimittels 1. BEZEICHNUNG DES ARZNEIMITTELS Fluarix Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert) 2. QUALITATIVE UND QUANTITATIVE
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften)
 F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS Influvac - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff aus inaktivierten Oberflächenantigenen)
F A C H I N F O R M A T I O N (Zusammenfassung der Produkteigenschaften) 1. BEZEICHNUNG DES ARZNEIMITTELS Influvac - Injektionssuspension in einer Fertigspritze (Influenza-Impfstoff aus inaktivierten Oberflächenantigenen)
Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Typherix 25 Mikrogramm/0,5 ml Injektionslösung Typhus-Polysaccharid-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Trosyd 1 % Creme 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Creme enthält 10 mg Tioconazol. Sonstiger Bestandteil
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Trosyd 1 % Creme 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g Creme enthält 10 mg Tioconazol. Sonstiger Bestandteil
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. Dosierung. Erwachsene und Kinder (0 18 Jahre)
 1. BEZEICHNUNG DES ARZNEIMITTELS, 200 mg/ml Lösung zur subkutanen Injektion 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (SCIg) Ein ml enthält: Plasmaprotein vom Menschen 200 mg (Reinheit von mindestens
1. BEZEICHNUNG DES ARZNEIMITTELS, 200 mg/ml Lösung zur subkutanen Injektion 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (SCIg) Ein ml enthält: Plasmaprotein vom Menschen 200 mg (Reinheit von mindestens
Cefavora - Tropfen. Gebrauchsinformation: Information für Anwender
 1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
1 von 5 Cefavora - Tropfen Gebrauchsinformation: Information für Anwender Wirkstoffe: Ginkgo biloba Ø / Viscum album Ø / Crataegus Ø Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor sie mit
SUBCUVIA Packungsbeilage 1/11 PACKUNGSBEILAGE: INFORMATION FÜR DEN ANWENDER
 Packungsbeilage 1/11 PACKUNGSBEILAGE: INFORMATION FÜR DEN ANWENDER SUBCUVIA 160 mg/ml, Injektionslösung (intramuskuläre Anwendung) oder Infusionslösung (subkutane Anwendung) Wirkstoff: humanes normales
Packungsbeilage 1/11 PACKUNGSBEILAGE: INFORMATION FÜR DEN ANWENDER SUBCUVIA 160 mg/ml, Injektionslösung (intramuskuläre Anwendung) oder Infusionslösung (subkutane Anwendung) Wirkstoff: humanes normales
2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Page 1 of 8 FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung. Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung. 2 QUALITATIVE UND QUANTITATIVE
Page 1 of 8 FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung. Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung. 2 QUALITATIVE UND QUANTITATIVE
Gebrauchsinformation: Information für Patienten
 Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Tropfen gegen Akne Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Akne Similasan Acidum arsenicosum D 12, Clematis recta D 8, Graphites D 12 Lesen Sie die gesamte Packungsbeilage
Hypogammaglobulinämie und rezidivierende bakterielle Infektionen bei Patienten mit chronischlymphatischer
 Intratect 50 g/l-infusionslösung 2. Qualitative und quantitative Zusammensetzung Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen 50 mg (Reinheit mindestens
Intratect 50 g/l-infusionslösung 2. Qualitative und quantitative Zusammensetzung Normales Immunglobulin vom Menschen (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen 50 mg (Reinheit mindestens
Gebrauchsinformation: Information für Patienten. Tabletten gegen Magen-Darm-Beschwerden Similasan
 1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
1 Gebrauchsinformation: Information für Patienten Tabletten gegen Magen-Darm-Beschwerden Similasan Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels
Gebrauchsinformation: Information für Patienten. Allernon 10 mg-tabletten Wirkstoff: Loratadin
 Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Patienten Allernon 10 mg-tabletten Wirkstoff: Loratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
Seite 1 von 5 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER CORASAN Tropfen Wirkstoffe: Crataegus D1, Selenicereus grandiflorus (Cactus) D2, Digitalis purpurea D6, Strophanthus gratus D6. Lesen Sie die
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN chronisch- Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN chronisch- Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie
Gebrauchsinformation: Information für den Anwender. Varizella-Zoster-Immunglobulin vom Menschen
 Gebrauchsinformation: Information für den Anwender Varitect CP 25 I.E./ml Infusionslösung Varizella-Zoster-Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Gebrauchsinformation: Information für den Anwender Varitect CP 25 I.E./ml Infusionslösung Varizella-Zoster-Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Influenzavirus Oberflächenantigene (Hämagglutinin und Neuroaminidase) der folgenden Stämme*:
 1. BEZEICHNUNG DES ARZNEIMITTELS Sandovac Injektionssuspension in einer Fertigspritze Influenzaimpfstoff (Oberflächenantigene, inaktiviert) (2014/2015) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Influenzavirus
1. BEZEICHNUNG DES ARZNEIMITTELS Sandovac Injektionssuspension in einer Fertigspritze Influenzaimpfstoff (Oberflächenantigene, inaktiviert) (2014/2015) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Influenzavirus
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei akuten Hals- und Rachenschmerzen Belladonna D4/D6/D12 Wirkstoff: Atropa bella-donna D4/D6/D12 Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Patienten. Osanit Hustenkügelchen Wirkstoff: Drosera D6
 Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Osanit Hustenkügelchen Seite 1 von 5 Gebrauchsinformation: Information für Patienten Osanit Hustenkügelchen Wirkstoff: Drosera D6 Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION. VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen
 GEBRAUCHSINFORMATION VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
GEBRAUCHSINFORMATION VERSIFEL CVR, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Katzen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre
 Gebrauchsinformation: Information für den Anwender Aspecton Eukaps 200 mg Weichkapseln Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre Wirkstoff: Eucalyptusöl Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für den Anwender Aspecton Eukaps 200 mg Weichkapseln Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahre Wirkstoff: Eucalyptusöl Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 Sinupret Tropfen GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Flüssigextrakt aus Enzianwurzel, Schlüsselblumenblüte mit Kelch, Gartensauerampferkraut, Holunderblüte und Eisenkraut Lesen Sie die gesamte
Sinupret Tropfen GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Flüssigextrakt aus Enzianwurzel, Schlüsselblumenblüte mit Kelch, Gartensauerampferkraut, Holunderblüte und Eisenkraut Lesen Sie die gesamte
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 1. BEZEICHNUNG DES ARZNEIMITTELS Biseko 50 g/l Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1000 ml Infusionslösung enthalten 50 g Plasmaproteine vom Menschen, davon Albumin ca. 31 g
1. BEZEICHNUNG DES ARZNEIMITTELS Biseko 50 g/l Infusionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1000 ml Infusionslösung enthalten 50 g Plasmaproteine vom Menschen, davon Albumin ca. 31 g
Gebrauchsinformation: Information für Anwender. APOZEMA Blutarmut China complex Nr.38-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Blutarmut China complex Nr.38-Tropfen Wirkstoffe: China Dil. D5, Arsenicum album Dil. D6, Chininum arsenicosum Dil D6 und Pulsatilla Dil. D4 Lesen
Gebrauchsinformation: Information für Anwender APOZEMA Blutarmut China complex Nr.38-Tropfen Wirkstoffe: China Dil. D5, Arsenicum album Dil. D6, Chininum arsenicosum Dil D6 und Pulsatilla Dil. D4 Lesen
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6 Wirkstoff: Drosera D3/D4/D6 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei trockenem Krampf- und Reizhusten Drosera D3/D4/D6 Wirkstoff: Drosera D3/D4/D6 Lesen Sie die gesamte Packungsbeilage sorgfältig
Fachinformation. (Zusammenfassung der Merkmale des Arzneimittels)
 Fachinformation (Zusammenfassung der Merkmale des Arzneimittels) 1. Bezeichnung des Arzneimittels Rhophylac 300 Mikrogramm / 2 ml Injektionslösung in einer Fertigspritze 2. Qualitative und quantitative
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels) 1. Bezeichnung des Arzneimittels Rhophylac 300 Mikrogramm / 2 ml Injektionslösung in einer Fertigspritze 2. Qualitative und quantitative
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12
 Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12 Wirkstoff: Phosphorus D4/D6/D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Apozema Dreiklang Globuli bei Heiserkeit und Reizhusten Phosphorus D4/D6/D12 Wirkstoff: Phosphorus D4/D6/D12 Lesen Sie die gesamte Packungsbeilage sorgfältig
1. Was ist Apis/Belladonna cum Mercurio und wofür wird es angewendet?
 WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
WALA Gebrauchsinformation: Information für Anwender Apis/Bella-donna cum Mercurio Wirkstoffe: Apis mellifica ex animale toto Gl Dil. D4, Atropa bella-donna e fructibus maturis ferm 33a Dil. D3, Mercurius
2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Anti-D-Immunglobulin vom Menschen
 FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Rhesonativ 300 Mikrogramm in 2 ml i.m. Injektionslösung 2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Anti-D-Immunglobulin vom Menschen 1 ml Lösung enthält:
FACHINFORMATION 1 BEZEICHNUNG DES ARZNEIMITTELS Rhesonativ 300 Mikrogramm in 2 ml i.m. Injektionslösung 2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Anti-D-Immunglobulin vom Menschen 1 ml Lösung enthält:
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Iberogast Flüssigkeit zum Einnehmen Wirkstoffe: Bittere Schleifenblume, Angelikawurzel, Kamillenblüten, Kümmel, Mariendistelfrüchte, Melissenblätter, Pfefferminzblätter,
Gebrauchsinformation: Information für Anwender Iberogast Flüssigkeit zum Einnehmen Wirkstoffe: Bittere Schleifenblume, Angelikawurzel, Kamillenblüten, Kümmel, Mariendistelfrüchte, Melissenblätter, Pfefferminzblätter,
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert)
 1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (1,0 ml) enthält: Hepatitis A Virus
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 1440 Injektionssuspension Hepatitis A Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (1,0 ml) enthält: Hepatitis A Virus
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 Page 1 of 7 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung Tuberkulin PPD RT 23 Lesen
Page 1 of 7 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung Tuberkulin PPD RT 23 Lesen
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Gelsemium-Homaccord -Tropfen
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Gelsemium-Homaccord -Tropfen Wirkstoffe: Gelsemium sempervirens, Toxicodendron quercifolium, Cimicifuga racemosa Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Gelsemium-Homaccord -Tropfen Wirkstoffe: Gelsemium sempervirens, Toxicodendron quercifolium, Cimicifuga racemosa Lesen Sie die gesamte Packungsbeilage sorgfältig
Emgecard 2,5 mmol-filmtabletten
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Emgecard 2,5 mmol-filmtabletten Magnesium-L-aspartat-hydrochlorid-trihydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Emgecard 2,5 mmol-filmtabletten Magnesium-L-aspartat-hydrochlorid-trihydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender. APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen Wirkstoffe: Plantago major Dil. D4, Belladonna Dil. D6, Causticum Hahnemanni Dil. D30, Ferrum metallicum
Gebrauchsinformation: Information für Anwender APOZEMA Bettnässer Plantago major complex Nr.8-Tropfen Wirkstoffe: Plantago major Dil. D4, Belladonna Dil. D6, Causticum Hahnemanni Dil. D30, Ferrum metallicum
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Hizentra, 200 mg/ml Lösung zur subkutanen Injektion 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin
ANHANG I ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Hizentra, 200 mg/ml Lösung zur subkutanen Injektion 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Normales Immunglobulin
Gebrauchsinformation: Information für Anwender. APOZEMA Reizblasen Cantharis complex Nr.26-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Reizblasen Cantharis complex Nr.26-Tropfen Wirkstoffe: Cantharis Dil. D6, Dulcamara Dil. D4, Mandragora ex herba Dil. D4, Mercurius solubilis Hahnemanni
Gebrauchsinformation: Information für Anwender APOZEMA Reizblasen Cantharis complex Nr.26-Tropfen Wirkstoffe: Cantharis Dil. D6, Dulcamara Dil. D4, Mandragora ex herba Dil. D4, Mercurius solubilis Hahnemanni
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Rhesonativ, Injektionslösung zur intramuskulären Anwendung
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rhesonativ, Injektionslösung zur intramuskulären Anwendung Anti-D-Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rhesonativ, Injektionslösung zur intramuskulären Anwendung Anti-D-Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor
Anhang III. Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen
 Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Anhang III Änderungen der entsprechenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilagen Anmerkung: Diese Änderungen der entsprechenden Abschnitte der Zusammenfassung
Sanvita Meno Tabletten
 Gebrauchsinformation: Information für Anwender Sanvita Meno Tabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifuga rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Sanvita Meno Tabletten Wirkstoff: Trockenextrakt aus Traubensilberkerzenwurzelstock (Cimicifuga rhizoma) Lesen Sie die gesamte Packungsbeilage sorgfältig
1. Was ist Rheumon - Creme und wofür wird sie angewendet?
 Gebrauchsinformation: Information für Anwender Rheumon - Creme Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält
Gebrauchsinformation: Information für Anwender Rheumon - Creme Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält
Gebrauchsinformation: Information für Anwender. Euphrasia D3 Augentropfen Weleda
 1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia officinalis D3 Dilution Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
1/5 Gebrauchsinformation: Information für Anwender Euphrasia D3 Augentropfen Weleda Wirkstoff: Euphrasia officinalis D3 Dilution Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN - Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AFLUBIN - Hustentropfen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN FLUORESCEINE 10 % Faure Injektionslösung Fluoresceinnatrium Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Hepatect CP 50 I.E./ml Infusionslösung Hepatitis-B-Immunglobulin vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender Hepatect CP 50 I.E./ml Infusionslösung Hepatitis-B-Immunglobulin vom Menschen zur intravenösen Anwendung Lesen Sie die gesamte Packungsbeilage sorgfältig
Flebogamma DIF 100 mg/ml Infusionslösung
 1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen... 100 mg (Reinheit von mindestens 97 % IgG) Jede Flasche mit
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG (IVIg) Ein ml enthält: Normales Immunglobulin vom Menschen... 100 mg (Reinheit von mindestens 97 % IgG) Jede Flasche mit
PHV-issue: Anti-Human-Thymozyten-Immunglobulin vom Kaninchen
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.09.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 28.09.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
Gebrauchsinformation: Information für Anwender. APOZEMA Stuhlregelungs Magnesium chloratum complex Nr.34-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Stuhlregelungs Magnesium chloratum complex Nr.34-Tropfen Wirkstoffe: Magnesium chloratum Dil. D4, Alumina Dil. D12, Bryonia Dil D4, Lycopodium Dil.
Gebrauchsinformation: Information für Anwender APOZEMA Stuhlregelungs Magnesium chloratum complex Nr.34-Tropfen Wirkstoffe: Magnesium chloratum Dil. D4, Alumina Dil. D12, Bryonia Dil D4, Lycopodium Dil.
1. BEZEICHNUNG DES ARZNEIMITTELS 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 3. DARREICHUNGSFORM 4. KLINISCHE ANGABEN
 1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 720 Kinder Injektionssuspension Hepatitis-A-Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (0,5ml) enthält: Hepatitis-A-Virus
1. BEZEICHNUNG DES ARZNEIMITTELS Havrix 720 Kinder Injektionssuspension Hepatitis-A-Impfstoff (inaktiviert, adsorbiert) 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 Dosis (0,5ml) enthält: Hepatitis-A-Virus
Mycostatin - orale Suspension
 Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Mycostatin - orale Suspension Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Dermapharm GmbH Gebrauchsinformation: Information für den Anwender Mycostatin - orale Suspension Wirkstoff: Nystatin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS: FLUAD, Injektionssuspension in einer Fertigspritze Influenza-Impfstoff, Oberflächenantigene, inaktiviert, mit MF59C.1 als
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS: FLUAD, Injektionssuspension in einer Fertigspritze Influenza-Impfstoff, Oberflächenantigene, inaktiviert, mit MF59C.1 als
Gebrauchsinformation: Information für Anwender. EVIT 600 I.E. Kapseln. Wirkstoff: RRR-alpha-Tocopherol (Vitamin E)
 Gebrauchsinformation: Information für Anwender EVIT 600 I.E. Kapseln Wirkstoff: RRR-alpha-Tocopherol (Vitamin E) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Gebrauchsinformation: Information für Anwender EVIT 600 I.E. Kapseln Wirkstoff: RRR-alpha-Tocopherol (Vitamin E) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Rhophylac 300 Mikrogramm / 2 ml Injektionslösung in einer Fertigspritze Anti-D Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Rhophylac 300 Mikrogramm / 2 ml Injektionslösung in einer Fertigspritze Anti-D Immunglobulin vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender. APOZEMA Allergie Acidum formicicum complex Nr. 2-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Allergie Acidum formicicum complex Nr. 2-Tropfen Wirkstoffe: Acidum formicicum Dil. D6, Apis mellifica Dil. D30, Arsenicum album Dil. D12, Calcium
Gebrauchsinformation: Information für Anwender APOZEMA Allergie Acidum formicicum complex Nr. 2-Tropfen Wirkstoffe: Acidum formicicum Dil. D6, Apis mellifica Dil. D30, Arsenicum album Dil. D12, Calcium
Gamunex 10% mg/ml Infusionslösung Wirkstoff: Normales Immunglobulin vom Menschen (IVIg)
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Gamunex 10% - 100 mg/ml Infusionslösung Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Gamunex 10% - 100 mg/ml Infusionslösung Wirkstoff: Normales Immunglobulin vom Menschen (IVIg) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Patienteninformation Lamotrigin Desitin 04/2007
 Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
Information für Patientinnen und Patienten Lesen Sie diese Packungsbeilage sorgfältig, bevor Sie das Arzneimittel einnehmen bzw. anwenden. Dieses Arzneimittel ist Ihnen persönlich verschrieben worden und
B. PACKUNGSBEILAGE 1
 B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Metomotyl 2,5 mg/ml Injektionslösung für Katzen und Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Metomotyl 2,5 mg/ml Injektionslösung für Katzen und Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
1. Was ist TdaP-IMMUN und wofür wird es angewendet?
 Page 1 of 6 Gebrauchsinformation: Information für Anwender TdaP-IMMUN Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis- (azelluläre Komponente) Impfstoff (adsorbiert, reduzierter
Page 1 of 6 Gebrauchsinformation: Information für Anwender TdaP-IMMUN Injektionssuspension in einer Fertigspritze Diphtherie-, Tetanus- und Pertussis- (azelluläre Komponente) Impfstoff (adsorbiert, reduzierter
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER PROAGIL Rheuma- und Gicht-Tabletten Wirkstoffe: Causticum Hahnemanni Trit. D6, Ferrum phosphoricum Trit. D6, Ledum Trit. D2, Rhododendron Trit. D2 Lesen Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER PROAGIL Rheuma- und Gicht-Tabletten Wirkstoffe: Causticum Hahnemanni Trit. D6, Ferrum phosphoricum Trit. D6, Ledum Trit. D2, Rhododendron Trit. D2 Lesen Sie
PARENTERAL VE Infusionslösung
 Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila PARENTERAL VE Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist PARENTERAL VE und wofür wird
Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila PARENTERAL VE Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist PARENTERAL VE und wofür wird
Gebrauchsinformation: Information für Anwender. Travogen - Creme. Isoconazolnitrat
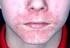 1 Gebrauchsinformation: Information für Anwender Travogen - Creme Isoconazolnitrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
1 Gebrauchsinformation: Information für Anwender Travogen - Creme Isoconazolnitrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
Rheumon-Gel Wirkstoff:Etofenamat
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rheumon-Gel Wirkstoff:Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. -
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Rheumon-Gel Wirkstoff:Etofenamat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. -
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Locabiosol 1% - Dosierspray 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 5 ml Lösung (= 100 Sprühstöße) enthalten 50
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1 1. BEZEICHNUNG DES ARZNEIMITTELS Locabiosol 1% - Dosierspray 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 5 ml Lösung (= 100 Sprühstöße) enthalten 50
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Levocetirizin Genericon 5 mg Filmtabletten. Levocetirizindihydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Levocetirizin Genericon 5 mg Filmtabletten Levocetirizindihydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Levocetirizin Genericon 5 mg Filmtabletten Levocetirizindihydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
GEBRAUCHSINFORMATION. HUMAN ALBUMIN 200 g/l IMMUNO, Infusionslösung. Infusionslösung. Wirkstoff: Albuminlösung vom Menschen
 GEBRAUCHSINFORMATION HUMAN ALBUMIN 200 g/l IMMUNO, Infusionslösung Infusionslösung Wirkstoff: Albuminlösung vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
GEBRAUCHSINFORMATION HUMAN ALBUMIN 200 g/l IMMUNO, Infusionslösung Infusionslösung Wirkstoff: Albuminlösung vom Menschen Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
FACHINFORMATION. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Ciclopirox WinthropNagellack 8 % 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g wirkstoffhaltiger Nagellack enthält 80 mg Ciclopirox. Vollständige
FACHINFORMATION 1. BEZEICHNUNG DES ARZNEIMITTELS Ciclopirox WinthropNagellack 8 % 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 g wirkstoffhaltiger Nagellack enthält 80 mg Ciclopirox. Vollständige
Gebrauchsinformation: Information für Patienten. Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt
 Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Patienten Aspecton Hustentropfen Flüssigkeit zum Einnehmen Thymiankraut-Dickextrakt Für Erwachsene und Kinder ab 2 Jahren Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für Anwender. APOZEMA Gastritis Argentum nitricum complex Nr. 16-Tropfen
 Gebrauchsinformation: Information für Anwender APOZEMA Gastritis Argentum nitricum complex Nr. 16-Tropfen Wirkstoffe: Argentum nitricum Dil. D6, Antimonium crudum Dil. D8, Belladonna Dil. D4, Bryonia Dil.
Gebrauchsinformation: Information für Anwender APOZEMA Gastritis Argentum nitricum complex Nr. 16-Tropfen Wirkstoffe: Argentum nitricum Dil. D6, Antimonium crudum Dil. D8, Belladonna Dil. D4, Bryonia Dil.
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Scheriproct Suppositorien. Wirkstoffe: Prednisoloncaproat, Cinchocainhydrochlorid
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Scheriproct Suppositorien Wirkstoffe: Prednisoloncaproat, Cinchocainhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
1 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Scheriproct Suppositorien Wirkstoffe: Prednisoloncaproat, Cinchocainhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Patienten. trianal vitis caps Hartkapseln Zur Anwendung bei Erwachsenen. Weinblätter, in Pulverform
 PACKUNGSBEILAGE Gebrauchsinformation: Information für Patienten trianal vitis caps Hartkapseln Zur Anwendung bei Erwachsenen Weinblätter, in Pulverform Lesen Sie die gesamte Packungsbeilage sorgfältig
PACKUNGSBEILAGE Gebrauchsinformation: Information für Patienten trianal vitis caps Hartkapseln Zur Anwendung bei Erwachsenen Weinblätter, in Pulverform Lesen Sie die gesamte Packungsbeilage sorgfältig
Gebrauchsinformation: Information für den Anwender. APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen
 Gebrauchsinformation: Information für den Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum
Gebrauchsinformation: Information für den Anwender APOZEMA Bluthochdruck Crataegus complex Nr.10-Tropfen Wirkstoffe: Crataegus Dil. D4, Arnica Dil. D4, Aurum chloratum natronatum Dil. D5, Barium jodatum
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN ECHINACIN MADAUS -TROPFEN. Wirkstoff: Presssaft aus Purpursonnenhutkraut
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN ECHINACIN MADAUS -TROPFEN Wirkstoff: Presssaft aus Purpursonnenhutkraut Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN ECHINACIN MADAUS -TROPFEN Wirkstoff: Presssaft aus Purpursonnenhutkraut Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
Fachinformation 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
 Seite 1 von 7 PIERRE FABRE PHARMA Fachinformation RIBOMUNYL uno Tabletten, Granulat 1. BEZEICHNUNG DER ARZNEIMITTEL Ribomunyl uno Tabletten Ribomunyl uno Granulat 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Seite 1 von 7 PIERRE FABRE PHARMA Fachinformation RIBOMUNYL uno Tabletten, Granulat 1. BEZEICHNUNG DER ARZNEIMITTEL Ribomunyl uno Tabletten Ribomunyl uno Granulat 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. EXACYL 500 mg/5 ml Injektionslösung
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN EXACYL 500 mg/5 ml Injektionslösung Tranexamsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN EXACYL 500 mg/5 ml Injektionslösung Tranexamsäure Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Anhang III. Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage
 Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Anhang III Änderungen an relevanten Abschnitten der Fachinformation und der Packungsbeilage Hinweis: Änderungen an der Fachinformation und der Packungsbeilage müssen unter Umständen im Anschluss durch
Ringer-Laktat-Lösung Infusionslösung
 Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Ringer-Laktat-Lösung Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist Ringer-Laktat-Lösung
Gebrauchsinformation und Fachinformation SERAG-WIESSNER GmbH & Co. KG Zum Kugelfang 8-12 95119 Naila Ringer-Laktat-Lösung Infusionslösung Diese Packungsbeilage beinhaltet: 1. Was ist Ringer-Laktat-Lösung
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. VITAMINE B12 STEROP 1mg/1ml Injektionslösung Lösung zum Einnehmen. Cyanocobalamin
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER VITAMINE B12 STEROP 1mg/1ml Injektionslösung Lösung zum Einnehmen Cyanocobalamin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER VITAMINE B12 STEROP 1mg/1ml Injektionslösung Lösung zum Einnehmen Cyanocobalamin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Gebrauchsinformation: Information für Anwender. AFLUBIN - Nasenspray
 1/5 Gebrauchsinformation: Information für Anwender AFLUBIN - Nasenspray Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält
1/5 Gebrauchsinformation: Information für Anwender AFLUBIN - Nasenspray Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
Gebrauchsinformation: Information für Anwender. Inaktivierter Poliomyelitis-Impfstoff
 Gebrauchsinformation: Information für Anwender IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Gebrauchsinformation: Information für Anwender IMOVAX POLIO Injektionssuspension Inaktivierter Poliomyelitis-Impfstoff Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
Anhang III. Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
Anhang III Änderungen relevanter Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, der Etikettierung und
ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS
 Ingelvac CircoFLEX abcd ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS spcde (Renewal) - FINAL - genehmigt am: 14.01.2013 1 1. BEZEICHNUNG DES TIERARZNEIMITTELS Ingelvac CircoFLEX Injektionssuspension
Ingelvac CircoFLEX abcd ZUSAMMENFASSUNG DER MERKMALE DES TIERARZNEIMITTELS spcde (Renewal) - FINAL - genehmigt am: 14.01.2013 1 1. BEZEICHNUNG DES TIERARZNEIMITTELS Ingelvac CircoFLEX Injektionssuspension
GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER. NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG
 GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION : INFORMATION FÜR DEN ANWENDER NORADRENALINE (norepinephrine) AGUETTANT 1 MG/ML KONZENTRAT ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Anwender
 1/5 Gebrauchsinformation: Information für Anwender Nasenöl Weleda Wirkstoffe: Calendula officinalis, flores cum calycibus H 10 %, Hydrargyrum sulfuratum rubrum D5, Matricariae flos H 10 % Lesen Sie die
1/5 Gebrauchsinformation: Information für Anwender Nasenöl Weleda Wirkstoffe: Calendula officinalis, flores cum calycibus H 10 %, Hydrargyrum sulfuratum rubrum D5, Matricariae flos H 10 % Lesen Sie die
GEBRAUCHSINFORMATION Eurican SHPPi2LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde
 GEBRAUCHSINFORMATION Eurican SHPPi2LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
GEBRAUCHSINFORMATION Eurican SHPPi2LT Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS,
GEBRAUCHSINFORMATION FÜR. Miloxan - Injektionssuspension für Rinder, Schafe und Ziegen
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Miloxan - Injektionssuspension für Rinder, Schafe und Ziegen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS Zulassungsinhaber:
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION FÜR Miloxan - Injektionssuspension für Rinder, Schafe und Ziegen 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS Zulassungsinhaber:
octenisept Wund-Desinfektion ist ein Antiseptikum zur wiederholten, zeitlich begrenzten unterstützenden antiseptischen Wundbehandlung.
 Gebrauchsinformation: Information für den Anwender OCTENISEPT WUND-DESINFEKTION Antiseptikum zur unterstützenden Wundbehandlung Lösung zum Aufsprühen auf die Wunde Wirkstoffe: 0.1 g Octenidinhydrochlorid
Gebrauchsinformation: Information für den Anwender OCTENISEPT WUND-DESINFEKTION Antiseptikum zur unterstützenden Wundbehandlung Lösung zum Aufsprühen auf die Wunde Wirkstoffe: 0.1 g Octenidinhydrochlorid
Gebrauchsinformation: Information für den Anwender. Curatoderm 4 Mikrogramm/g Salbe Tacalcitol
 Gebrauchsinformation: Information für den Anwender 4 Mikrogramm/g Salbe Tacalcitol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
Gebrauchsinformation: Information für den Anwender 4 Mikrogramm/g Salbe Tacalcitol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn
