ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. ERWINASE I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung
|
|
|
- Britta Friedrich
- vor 8 Jahren
- Abrufe
Transkript
1 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS ERWINASE I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Crisantaspase (Asparaginase aus Erwinia chrysanthemi), I.E./Durchstechflasche. Eine Durchstechflasche enthält 167 µkat ( I.E. * ) L-Asparaginase (L-Asparaginamido-hydrolase) aus Erwinia chrysanthemi. * 1 I.E. L-Asparaginase ist die Enzymmenge, welche 1 µmol L-Asparagin pro Minute bei 37 C und ph 8,5 umsetzt. 1 I.E. = 16,6 nkat. Nach Rekonstitution mit 2 ml 0,9%iger Natriumchloridlösung zur Injektion enthält 1 ml der verdünnten Lösung I.E. Crisantaspase. Nach Rekonstitution mit 1 ml 0,9%iger Natriumchloridlösung zur Injektion enthält 1 ml der verdünnten Lösung I.E. Crisantaspase. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt DARREICHUNGSFORM Pulver zur Herstellung einer Injektionslösung. Weißes lyophilisiertes Pulver in einer Durchstechflasche. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Erwinase wird als Bestandteil einer krebshemmenden Kombinationstherapie bei akuter lymphatischer Leukämie (ALL) im Kindes- und Erwachsenenalter angewendet, hauptsächlich bei Patienten, die überempfindlich auf L-Asparaginase aus Escherichia coli, entweder nativ oder pegyliert (Pegaspargase), reagieren. 4.2 Dosierung und Art der Anwendung Erwinase sollte unter Aufsicht eines in der Behandlung der ALL erfahrenen Arztes verabreicht werden. Eine angemessene Durchführung der Behandlung erfordert dafür geeignete Voraussetzungen wie z. B. die Beherrschung von anaphylaktoiden Reaktionen sowie die regelmäßige Durchführung von laborchemischen Kontrolluntersuchungen. June 2014 RCP/ERW/DE/082/03/01 1
2 Dosierung Substitution von Pegaspargase (pegylierte E. coli Asparaginase) Die empfohlene Dosierung beträgt I.E./m 2 drei Mal pro Woche (z. B. montags/mittwochs/freitags) über zwei Wochen, im Austausch für jede vorgesehene Dosis Pegaspargase (d. h. innerhalb von 2 Wochen wird eine vorgesehene Dosis Pegaspargase durch 6 Dosen Erwinase ersetzt). Substitution von nativer E. coli Asparaginase Die empfohlene Dosierung beträgt I.E./m 2, im Austausch für jede vorgesehene Dosis E. coli Asparaginase innerhalb eines Therapiekurses. Substitutionsempfehlungen lokaler Behandlungsprotokolle, die sich in der Therapie der ALL im Rahmen einer krebshemmenden Kombinationstherapie bewährt haben, sollten berücksichtigt werden. Die Dosierung kann entsprechend den lokalen Behandlungsprotokollen angepasst werden. Kinder und Jugendliche Die Dosierung ist für Kinder und Erwachsene gleich. Angesichts der großen Spannbreite der mittleren Asparaginase-Aktivität, die zwischen Patienten beobachtet wurde, kann die optimale Erwinase-Dosis zwischen den Patienten variieren. Daher wird empfohlen, den Asparaginase-Spiegel zwecks Individualisierung der Dosierung zu überwachen. Art der Anwendung Erwinase wird intramuskulär injiziert. Hinweise zur Rekonstitution des Arzneimittels vor der Anwendung siehe Abschnitt 6.6. Erwinase darf vor der Applikation nicht mit anderen Arzneimitteln gemischt werden. 4.3 Gegenanzeigen Überempfindlichkeit gegen Crisantaspase oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. Entzündung der Bauchspeicheldrüse (Pankreatitis), auch in der Vorgeschichte. Schwangerschaft und Stillzeit (siehe Abschnitt 4.6 Fertilität, Schwangerschaft und Stillzeit). 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Erwinase sollte nur von Ärzten, die in dieser Art von Behandlung spezialisiert sind, verwendet werden. Als bakterielles Protein besitzt Erwinase das Potential, allergische Reaktionen auszulösen, welches sich bei wiederholter Behandlung erhöht. Zur Behandlung einer möglichen anaphylaktoiden Reaktion während der Verabreichung sollte eine entsprechende Ausrüstung bereitstehen. Asparaginase aus Erwinia chrysanthemi (Crisantaspase) hat eine andere antigene Struktur als Asparaginase aus Escherichia coli. Daher kann Erwinase auch bei Überempfindlichkeit auf native oder pegylierte Asparaginase aus Escherichia coli angewendet werden. Bei gleicher Dosierung ist die Immunogenität von Erwinase geringer als die von Asparaginase aus Escherichia coli. Bei Auftreten von Überempfindlichkeit muss Erwinase abgesetzt und eine angemessene Therapie begonnen werden. Bei einigen Patienten können neutralisierende Antikörper gegen Asparaginase auftreten, ohne dass eine klinische Hypersensitivitätssymptomatik beobachtet wird. Diese Antikörper können jedoch zu einer mehr June 2014 RCP/ERW/DE/082/03/01 2
3 oder weniger schnellen Inaktivierung ( silent inactivation ) führen. Deshalb erscheint eine Messung der Asparaginase-Aktivität im Serum empfehlenswert. Die nachfolgend aufgeführten Warnhinweise und Vorsichtsmaßnahmen sind nicht spezifisch für Erwinase, sie gelten auch für andere Arzneimittel, die L-Asparaginase enthalten. Bei Auftreten einer Pankreatitis muss die Behandlung mit Erwinase beendet werden. Erwinase kann immunsuppressive Aktivität entwickeln. Daher besteht die Möglichkeit, dass der Einsatz des Arzneimittels bei Patienten Infektionen begünstigen kann. Verminderte Zahl der Blutplättchen (Thrombozytopenie) oder Blutvergiftung (Sepsis) erhöhen das Risiko von Blutungen (insbesondere intrakraniell mit Schlaganfall und Koma). Patienten mit erhöhter Infektionsanfälligkeit, bereits bestehenden Gerinnungsstörungen oder Kleinkinder sind besonders gefährdet. Kombinationstherapien mit Erwinase können zu einer schweren hepatischen Toxizität und Toxizität am zentralen Nervensystem führen. Vorsicht ist geboten, wenn Erwinase in Kombination mit anderen hepatotoxischen Wirkstoffen gegeben wird, insbesondere bei vorliegender eingeschränkter Leberfunktion. Vor und während der Behandlung ist eine sorgfältige Überwachung erforderlich: Zuckerwerte im Urin sollten vor jeder Applikation ermittelt werden. Serum-Amylase, Lipase und Insulin-Spiegel sollten ermittelt werden, um Hyperglykämien und schwere Pankreatitis auszuschließen. Hyperglykämie kann bei Bedarf mit Insulin behandelt werden. Vor Behandlungsbeginn muss das Blutgerinnungsprofil kontrolliert und während der Behandlung regelmäßig überwacht werden. Sollte eine signifikante symptomatische Koagulopathie eintreten, sollte die Behandlung mit Erwinase unterbrochen werden, bis die Koagulopathie beseitigt ist. Anschließend die Behandlung gemäß Behandlungsprotokoll fortsetzen. Während der Behandlung Leberwerte regelmäßig überwachen. Die Nierenfunktionstests und Serum-Harnsäure-Spiegel sollten überwacht werden. Erwinase enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Durchstechflasche. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt. Erwinase darf, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden. Die nachfolgend aufgeführten Wechselwirkungen sind nicht spezifisch für Erwinase, sie können auch bei anderen Arzneimitteln, die L-Asparaginase erhalten, auftreten. Erwinase kann die Toxizität von anderen Medikamenten durch die Beeinflussung der Leberfunktion erhöhen. Bei gleichzeitiger Behandlung mit Arzneimitteln, die die Leberfunktion beeinträchtigen, kann das Risiko veränderter Leberwerte erhöht werden (z. B. erhöhte ASAT-, ALAT-, Bilirubin-Werte). June 2014 RCP/ERW/DE/082/03/01 3
4 Die Verminderung von Serumprotein durch Erwinase kann die Toxizität anderer an Protein gebundener Arzneimittel erhöhen. Zusätzlich kann L-Asparaginase durch die Hemmung der Proteinsynthese und Zellteilung den Wirkungsmechanismus anderer Substanzen, wie z. B. Methotrexat, Cytarabin, die die Zellteilung zur Entfaltung ihrer Wirkung benötigen, stören. Erwinase kann die Wirkung von Methotrexat auf maligne Zellen vermindern oder aufheben. Diese Wirkung hält so lange an, wie die Asparagin-Spiegel im Plasma supprimiert sind. Methotrexat darf nicht zusammen mit oder nach Erwinase angewendet werden, solange die Asparagin-Spiegel unter dem Normalwert liegen. Prednison: Bei gleichzeitiger Behandlung mit Prednison kann das Risiko veränderter Blutgerinnungsfaktoren (z. B. Rückgang der Fibrinogen- und ATIII-Spiegel) und allergischer Reaktionen erhöht werden. Vorsicht ist geboten bei gleichzeitiger Gabe von Antikoagulantien wie Cumarin, Heparin, Dipyridamol, Acetylsalicylsäure oder nichtsteroidalen Antirheumatika. Vincristin: Unmittelbar vorausgehende oder gleichzeitige Behandlung mit Vincristin kann mit einer erhöhten Toxizität und einem erhöhten Anaphylaxie-Risiko einhergehen. Es wurde berichtet, dass die gleichzeitige Anwendung von Imatinib mit L-Asparaginase mit einer erhöhten Lebertoxizität einhergehen könnte. Daher ist bei der Anwendung von Imatinib zusammen mit Erwinase besondere Vorsicht geboten. Eine Vakzinierung mit Lebendimpfstoffen sollte frühestens 3 Monate nach Abschluss der gesamten antileukämischen Behandlung durchgeführt werden. 4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft Es liegen keine ausreichenden Daten zur Anwendung von Erwinase bei schwangeren Frauen vor. Es gibt jedoch eine begrenzte Anzahl von Daten über die Anwendung von E. coli Asparaginase in Kombination mit anderen Antineoplastika während der Schwangerschaft. Diese Daten sind allerdings nicht ausreichend für eine abschließende Beurteilung. Basierend auf den beobachteten Effekten auf die embryonale/fetale Entwicklung während tierexperimenteller Studien (siehe Abschnitt 5.3 präklinische Daten zur Sicherheit), sollte Erwinase während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist absolut erforderlich. Stillzeit Es ist nicht bekannt, ob Erwinase in die Muttermilch übergeht. Die Ausscheidung von Erwinase in die Muttermilch wurde nicht an Tieren untersucht. Da potenzielle schwerwiegende Nebenwirkungen bei gestillten Kindern auftreten können, ist das Stillen kontraindiziert. Fertilität Es liegen keine Daten zur Fertilität vor. June 2014 RCP/ERW/DE/082/03/01 4
5 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Die Auswirkungen von Erwinase auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen wurden nicht untersucht. Aufgrund des bekannten Nebenwirkungsprofils, wie z. B. häufig auftretende Somnolenz, Verwirrungszustände, Benommenheit, Übelkeit oder Erbrechen, sollte der Patient bis zum Abklingen der Symptome keine Fahrzeuge oder Maschinen bedienen. 4.8 Nebenwirkungen a) Zusammenfassung des Sicherheitsprofils Die zwei häufigsten Nebenwirkungen sind: Überempfindlichkeit, einschließlich Nesselsucht, Fieber, Schüttelfrost, Hautausschlag, Kehlkopfödem, Bronchospasmen, Blutdruckabfall oder gar anaphylaktischer Schock. Bei anaphylaktischen Reaktionen müssen (gegebenenfalls unter intensivmedizinischen Bedingungen) die vitalen Parameter überwacht und/oder korrigiert werden. (Als therapeutische Maßnahmen kommen in Frage: Gabe von Sauerstoff, Katecholaminen, Glucocorticoiden, Volumensubstitution usw.). Die Erwinase-Behandlung muss sofort unterbrochen und abgesetzt werden. Blutgerinnungsstörungen (z. B. Thrombosen) aufgrund der gestörten Proteinsynthese sind die zweithäufigsten Nebenwirkungen. Die Störung der Blutgerinnung und Fibrinolyse (Verlängerung der Prothrombinzeit, partiellen Thromboplastinzeit und Thrombinzeit, Hypofibrinogenämie und Verringerung anderer Gerinnungsfaktoren) kann zu Thromboembolien oder Hämorrhagien führen. Es wurden Thrombosen in peripheren Blutgefäßen, in Blutgefäßen der Lunge oder des zentralen Nervensystems beobachtet, die, je nach Lage des Gefäßverschlusses, potenziell tödlich oder mit bleibenden Spätschäden verbunden sind. Zu sonstigen Risikofaktoren, die an Gerinnungsanomalien beteiligt sind, gehören die Erkrankung selbst, gleichzeitige Steroidbehandlung und zentrale Venenkatheter. Bei rasch einsetzendem Fibrinogenabfall und über 30 % erniedrigtem Quick-Wert sollte Fibrinogen substituiert werden. Bei signifikanten Gerinnungsstörungen muss Erwinase abgesetzt werden. In der Regel sind alle Nebenwirkungen reversibel. b) Tabellarische Auflistung der Nebenwirkungen In nachstehender Tabelle sind Nebenwirkungen aufgelistet, die entweder bei der Behandlung mit Erwinase (Crisantaspase) oder E. coli Asparaginase als Teil einer Chemotherapie spontan beobachtet wurden bzw. von denen in der Fachliteratur berichtet wurde. Das Nebenwirkungsspektrum von Erwinase stimmt weitgehend mit dem von E. coli Asparaginase überein. Aus Sicherheitsgründen sind daher auch Nebenwirkungen aufgeführt, die im Zusammenhang mit E. coli Asparaginase aufgetreten sind, aber unter Erwinase bisher nicht beobachtet wurden. Die Nebenwirkungen sind nach Systemorganklassen und Häufigkeit geordnet. Häufigkeit gemäß MedDRA-Konvention: sehr häufig ( 1/10), häufig ( 1/100 bis <1/10), gelegentlich ( 1/1.000 bis <1/100), selten ( 1/ bis <1/1.000) und sehr selten (<1/10.000). Lässt sich die Häufigkeitsrate einer Nebenwirkung auf Grundlage der verfügbaren Daten nicht verlässlich berechnen, wird die Häufigkeit dieser Nebenwirkung als nicht bekannt bezeichnet. June 2014 RCP/ERW/DE/082/03/01 5
6 Infektionen und parasitäre Erkrankungen: Sehr selten: Infektionen, lebensbedrohende Sepsis. Erkrankungen des Blutes und des Lymphsystems: Sehr häufig: Koagulopathien Anomalien der Blutgerinnungsfaktoren, Abfall von Antithrombin III, Protein C, Protein S oder Blutfibrinogen (1). Koagulopathien in Verbindung mit Blutung oder Thrombose, hypokoagulierbarer Zustand, asymptomatische Koagulopathie. Sehr selten: Neutropenie, febrile Neutropenie, Thrombozytopenie. Leukopenie, Anämie, hämolytische Anämie, Knochenmarkdepression. Erkrankungen des Immunsystems: Überempfindlichkeit. Gelegentlich: Anaphylaktische Reaktion. Stoffwechsel- und Ernährungsstörungen: Erhöhte Serumamylase oder -lipase. Gelegentlich: Hyperlipidämie (1), Hyperglykämie. Selten: Diabetische Ketoazidose. Hyperammonämie (3), Hyperurikämie*, Hypoinsulinämie, gestörte Glukosetoleranz, sekundäre Hypothyreose, Abfall des TBG-Spiegels (thyroxinbindendes Globulin), Appetitverlust, Gewichtsverlust. Psychiatrische Erkrankungen: Agitiertheit, Halluzinationen. Erkrankungen des Nervensystems: Lethargie, Somnolenz, Verwirrungszustand, Benommenheit, Neurotoxizität*, Grand-Mal-Konvulsion (2), partielle Anfälle (2), Kopfschmerzen. Selten: Aphasie, Parese, Enzephalopathie (3), Bewusstseinseinschränkung, Koma. Herzerkrankungen: Selten: Herzinfarkt als Folge anderer Nebenwirkungen (z. B. Thrombose, Pankreatitis). Gefäßerkrankungen: Lungen-, Venen- oder Gehirnthrombosen, Blässe. Hämorrhagie, Bluthochdruck, Hitzewallungen (4), Blutdruckabfall (4). Erkrankungen der Atemwege, des Brustraums und Mediastinums: Atembeschwerden (4) Gelegentlich: Kehlkopfödem (4), Atemstillstand, Hypoxie, Rhinitis, Bronchospasmen (4). Erkrankungen des Gastrointestinaltrakts: Durchfall, akute Pankreatitis, Brechreiz, Erbrechen, Bauchschmerzen. Sehr selten: Hämorrhagische oder nekrotisierende Pankreatitis*, Dysphagie. Leber- und Gallenerkrankungen: Erhöhte Bilirubin-, Transaminase-, Alkali-Phosphatase- oder Cholesterinwerte im Serumspiegel, Hepatotoxizität. Selten: Leberfunktionsstörungen, Leberversagen. Hepatomegalie, cholestatischer Ikterus, Hypoalbuminämie, Lebersteatose. Erkankungen der Haut und des Unterhautzellgewebes: Hautausschlag, Nesselsucht, Juckreiz, Erytheme, Gesichtsödem, geschwollene Lippen (4). Toxische epidermale Nekrolyse. June 2014 RCP/ERW/DE/082/03/01 6
7 Sklelettmuskulatur-, Bindegewebs- und Knochenerkrankungen: Sehr selten: Myalgie, reaktive Arthritis. Schmerzen in den Gliedmaßen. Erkrankungen der Nieren- und Harnwege: Nierenfunktionsstörung. Allgemeine Erkrankungen: Pyrexie, Schüttelfrost, peripheres Ödem, Reaktionen am Verabreichungsort (inkl. Schmerzen an der Injektionsstelle, Erythem, Hämatom oder Ödem), Schmerzen. Müdigkeit, Unwohlsein. * Siehe Abschnitt c). 1 Als Folge der gehemmten Proteinsynthese. 2 Konvulsionen können einhergehen mit Thrombose oder metabolischer Enzephalopathie. 3 Als Folge der Ammoniaküberproduktion, bedingt durch die Wirkung von L-Asparaginase auf endogenes Asparagin und Glutamin. 4 Diese Symptome stehen häufig im Zusammenhang mit Überempfindlichkeitsreaktionen. c) Beschreibung ausgewählter Nebenwirkungen Erkrankungen der Bauchspeicheldrüse (siehe Abschnitt 4.4) akute Pankreatitis tritt in <10 % der Fälle auf. Es wurde vereinzelt, und bis zu vier Monate nach der letzten Applikation, von Pseudozystenbildung berichtet. Deshalb sind geeignete Untersuchungen (z. B. Ultraschall) nach Behandlungsende zu erwägen. In sehr seltenen Fällen kommt es zu hämorrhagischer oder nekrotisierender Pankreatitis mit tödlichem Ausgang. L-Asparaginase kann sich auf die endokrine Funktion der Bauchspeicheldrüse auswirken. Hyperglykämie (die am häufigsten beobachtete Nebenwirkung) und Hypoinsulinämie können ohne Weiteres durch die Verabreichung von exogenem Insulin behandelt werden. Es wurde vereinzelt von diabetischer Ketoazidose berichtet. Erkrankungen des Nervensystems und Herzerkrankungen treten häufig als Folge von anderen Nebenwirkungen auf (z. B. Thromboembolie) bzw. synergistisch mit den Wirkungen anderer chemotherapeutischer Arzneimittel (z. B. verzögerte Methotrexat-Clearance). Bei Hyperurikämie ist die Verabreichung von Allopurinol indiziert, einhergehend mit der Gabe von großen Flüssigkeitsmengen und Alkalisierung des Harns. d) Kinder und Jugendliche Es wird davon ausgegangen, dass Häufigkeit, Art und Schweregrad der Nebenwirkungen für Kinder und Erwachsene gleich sind. e) Sonstige spezielle Populationen Es sind keine speziellen Einzelpopulationen bekannt, bei denen das Sicherheitsprofil von dem oben genannten Profil abweicht. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D Bonn, Website: anzuzeigen. June 2014 RCP/ERW/DE/082/03/01 7
8 4.9 Überdosierung Neben akuten allergischen Reaktionen oder anaphylaktischem Schock kann L-Asparaginase zu einer chronischen Vergiftung, gekennzeichnet durch eingeschränkte Leber- oder Nierenfunktion, führen. Die Gabe von L-Asparaginase sollte sofort gestoppt und eine symptomatische Behandlung eingeleitet werden. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: andere antineoplastische Mittel ATC-Code: L01XX02 Wirkmechanismus L-Asparaginase katalysiert die Deaminierung von exogenem Asparagin zu Asparaginsäure und Ammoniak. Die biochemische Reaktion kann schematisch wie folgt dargestellt werden: L-Asparaginase Asparagin Aspartat + NH 3 Asparagin ist Bestandteil der meisten Proteine. Es ist eine normalerweise nicht essentielle Aminosäure, die für manche leukämische Zellen essentiell ist. Fehlt Asparagin, ist die Proteinsynthese unterbrochen. Dadurch wird die RNA- und DNA-Synthese gehemmt, und es kommt zu einem Stillstand der Zellproliferation. Die Anti-Tumor-Aktivität von L-Asparaginase ist ein Ergebnis der anhaltenden Depletion des exogenen Asparagins. 5.2 Pharmakokinetische Eigenschaften Die Halbwertszeit von Erwinase nach i.v. Infusion beträgt 6,4 ± 0,5 Stunden. Die Halbwertszeit von Erwinase nach i.m. Injektion beträgt ungefähr 16 Stunden. L-Asparaginase penetriert geringfügig in die Cerebrospinalflüssigkeit und findet sich auch in der Lymphe. Asparaginase-Aktivitäts-Serum-Talspiegel nach Anwendung von Crisantaspase wurden bei 48 Patienten mit ALL im Alter zwischen 2 und 18 Jahren bestimmt, die an einer einarmigen, multizentrischen, offenen Sicherheits- und klinischen Pharmakologiestudie AALL07P2 teilnahmen. Die Patienten erhielten Erwinase intramusklär I.E./m 2 dreimal pro Woche über 2 Wochen, im Austausch für jede verbleibende Dosis Pegasparagase des vorgesehenen Therapieprotokolls. Das Hauptziel war die Bestimmung, ob die Asparaginase-Aktivitäts-Serum-Talspiegel 48 Stunden nach Dosierungen bei 0,1 I.E./ml lagen. Im ersten Therapiezyklus wurde 48 Stunden nach Dosierung bei 92,5 % der Patienten eine Serum- Asparaginase-Aktivität von über 0,1 I.E./ml und 72 Stunden nach Dosierung bei 88,5 % der Patienten eine Serum-Asparaginase-Aktivität von mindestens 0,1 I.E./ml aufrechterhalten. June 2014 RCP/ERW/DE/082/03/01 8
9 Nach wiederholter Anwendung, kann das Arzneimittel durch spezifische Antikörper gebunden und eliminiert werden. 5.3 Präklinische Daten zur Sicherheit Akute Toxizität: LD 50 i.p. bei Mäusen: 5 x 10 5 I.E./kg; LD 50 i.v. bei Kaninchen: I.E./kg; LD 50 i.p. bei Ratten: I.E./kg. Toxizität bei wiederholter Gabe (subakut und chronisch): Keine pathologischen Effekte wurden beobachtet bei Dosierungen bis zu I.E./kg bei Kaninchen, bis zu I.E./kg bei Hunden und bis zu I.E./kg bei Rhesusaffen. Bei Ratten und Mäusen ist es bei sehr hohen Dosierungen zu subduralen Blutungen und Schädigung der Nierentubuli gekommen. Kanzerogenität und Mutagenität: Tierexperimentelle Untersuchungen wurden nicht durchgeführt. Crisantaspase ist ein Enzym, dessen Struktur und gut beschriebene Aktivität kein kanzerogenes oder mutagenes Potential vermuten lassen. In vitro fanden sich keine Karyotypänderungen, nur Verlangsamung bzw. Stillstand der Mitoserate (= zytostatische Wirkung). Reproduktionstoxizität: Eine Plazentagängigkeit wurde bei Kaninchen gezeigt. Bei einer Dosierung von 100 I.E./kg fanden sich im Dottersack 0,25 I.E./ml nach 2 Stunden und 0,33 I.E./ml nach 4 Stunden. Aus einem Tierversuch liegen Hinweise auf Fruchtschädigungen vor (Missbildungen, Absterben des Embryos). Aufgrund der Asparaginverarmung werden teratogene Effekte vermutet. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Natriumchlorid Glucose-Monohydrat 6.2 Inkompatibilitäten Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden. Siehe Abschnitt 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen. 6.3 Dauer der Haltbarkeit Ungeöffnete Durchstechflasche: 3 Jahre Stabilität des rekonstituierten Arzneimittels in der Durchstechflasche: 15 Minuten Die chemische und physikalische Stabilität der rekonstituierten Lösung, bei Aufbewahrung in einer Glasoder transparenten Polypropylenspritze und einer Temperatur unter 25 C, wurde für bis zu 4 Stunden nachgewiesen. Aus mikrobiologischer Sicht sollte die gebrauchsfertige Injektionslösung sofort verwendet werden, es sei denn, die Methode des Verdünnens schließt das Risiko einer mikrobiellen Kontamination aus. June 2014 RCP/ERW/DE/082/03/01 9
10 Wenn die gebrauchsfertige Injektionslösung nicht sofort verwendet wird, liegen Dauer und Bedingungen der Aufbewahrung in der Verantwortung des Anwenders. Hinweise zur Rekonstitution des Arzneimittels siehe Abschnitt Besondere Vorsichtsmaßnahmen für die Aufbewahrung Im Kühlschrank bei + 2 C bis + 8 C lagern. Lagerungsbedingungen für die rekonstituierte Lösung siehe Abschnitt Art und Inhalt des Behältnisses Durchstechflaschen aus farblosem Glas vom Glastyp 1 mit einem Nennvolumen von 3 ml, verschlossen mit 13-mm-Halobutyl-Stopfen und Aluminium-Bördelkappen. Der Inhalt ist ein weißer lyophilisierter Feststoff. Packungsgröße: 5 Durchstechflaschen. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung, Hinweise zur Anwendung und Handhabung Nachdem Erwinase Raumtemperatur angenommen hat, wird der Inhalt jeder Durchstechflasche mit 1 oder 2 ml Natriumchloridlösung (0,9 %) zur Injektion rekonstituiert. Die 0,9%ige Natriumchloridlösung langsam gegen die Innenwand der Durchstechflasche spritzen, jedoch nicht direkt auf oder in das Pulver! Den Inhalt durch langsames Mischen oder Drehen auflösen. Die Durchstechflasche hierbei aufrecht halten. Schaumbildung durch langes oder starkes Schütteln vermeiden. Die Lösung sollte klar und frei von sichtbaren Partikeln sein. Wenn die Lösung zu stark geschüttelt wird, können sich feine kristalline oder fadenartige Proteinaggregate bilden. Beim Auftreten von sichtbaren Partikeln oder Proteinaggregaten muss die rekonstituierte Lösung verworfen werden. Die Lösung sollte innerhalb von 15 Minuten nach Rekonstitution angewendet werden. Wenn es sich nicht vermeiden lässt, dass zwischen Rekonstitution und Anwendung mehr als 15 Minuten liegen, sollte die Lösung unter sterilen Bedingungen in eine sterile Glas- oder transparente Polypropylenspritze aufgezogen werden. Die Lösung in der Injektionsspritze sollte unter 25 C aufbewahrt und innerhalb von 4 Stunden angewendet werden. Vor der Anwendung ist die rekonstituierte Lösung erneut auf sichtbare Partikeln oder Proteinaggregate zu überprüfen. Erwinase ist keine zytotoxische Substanz, sodass die Vorsichtsmaßnahmen, die bei der Handhabung entsprechender Substanzen notwendig sind, hier entfallen. Trotzdem sollte bei der Herstellung und Anwendung berücksichtigt werden, dass Erwinase Reizungen hervorrufen kann. Die Inhalation des Pulvers oder der Lösung sollte vermieden werden. Im Falle eines Kontakts mit Haut oder Schleimhäuten, insbesondere den Augen, sollten diese mindestens 15 Minuten mit reichlich Wasser gespült werden. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen. June 2014 RCP/ERW/DE/082/03/01 10
11 7. INHABER DER ZULASSUNG EUSA Pharma SAS 3 allée des Séquoias Limonest FRANKREICH Tel.: +33 (0) Fax: +33 (0) Inhaber der registrierten Handelsmarke: Public Health England, Vereinigtes Königreich 8. ZULASSUNGSNUMMER DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG 12. Oktober 1990 / 01. Juli STAND DER INFORMATION VERKAUFSABGRENZUNG Verschreibungspflichtig June 2014 RCP/ERW/DE/082/03/01 11
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. Legalon SIL - Trockensubstanz zur Infusionsbereitung
 PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN Legalon SIL - Trockensubstanz zur Infusionsbereitung Wirkstoff: Silibinin-C-2,3-bis(hydrogensuccinat), Dinatriumsalz Lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender. LOMUSOL Augentropfen. Wirkstoff: Dinatriumcromoglicat
 Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LOMUSOL Augentropfen Wirkstoff: Dinatriumcromoglicat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS Protagent-Einmalaugentropfen 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG 1 ml Lösung (= ca. 30 Tropfen) enthält 20 mg
1. WAS IST DAFALGAN Zäpfchen UND WOFÜR WIRD ES ANGEWENDET?
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DAFALGAN Säuglinge 80 mg Zäpfchen DAFALGAN Kleinkinder 150 mg Zäpfchen DAFALGAN große Kinder 300 mg Zäpfchen Paracetamol Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Viscosan - Augentropfen Wirkstoff: Hypromellose
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Viscosan - Augentropfen Wirkstoff: Hypromellose Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Nasa Rhinathiol 0,1 %ige Nasenspray, Lösung Xylometazolinhydrochlorid
 Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
Seite 1/5 Packungsbeilage Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mir der Anwendung dieses Arzneimittels beginnen. Sie enthält wichtige Informationen für Ihre Behandlung. Wenn
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Heumann s Blasen- und Nierentee Solubitrat Wirkstoffe: Dickextrakt aus Birkenblättern, Dickextrakt aus Riesengoldrutenkraut Lesen Sie die gesamte Packungsbeilage
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tantum Verde 3 mg Pastillen mit Minzgeschmack Wirkstoff: Benzydaminhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Kamillosan -Mundspray. Kamillenblütenauszug Pfefferminzöl Anisöl
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Kamillosan -Mundspray Kamillenblütenauszug Pfefferminzöl Anisöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen
 Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Packungsbeilage CORSODYL Mundspüllösung / Spray 03-2012 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER
 Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
Seite 1/5 BE106802 / BE191764 Belgien GEBRAUCHINFORMATION: INFORMATION FÜR DEN ANWENDER CORSODYL 200mg/100ml mundwasser CORSODYL 200mg/100ml spray zur Anwendung in der Mundhöhle Chlorhexidindigluconat
WAS finde ich WO im Beipackzettel
 WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
Gebrauchsinformation: Information für Anwender Vitagutt Vitamin E 670 mg, Weichkapsel Zur Anwendung bei Erwachsenen Wirkstoff: 1000 mg all-rac-alpha-tocopherolacetat (entsprechend 670 mg RRR-alpha- Tocopherol-Äquivalente).
Zusammenfassung der Merkmale des Arzneimittels. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
 Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Virupos 30 mg/g Augensalbe 2. Qualitative und quantitative Zusammensetzung Wirkstoff: 1 g Salbe enthält Aciclovir 30 mg Die
Zusammenfassung der Merkmale des Arzneimittels 1. Bezeichnung des Arzneimittels Virupos 30 mg/g Augensalbe 2. Qualitative und quantitative Zusammensetzung Wirkstoff: 1 g Salbe enthält Aciclovir 30 mg Die
Bijsluiter DE versie Imaverol 100 mg (glas) B. PACKUNGSBEILAGE 1
 B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
B. PACKUNGSBEILAGE 1 GEBRAUCHSINFORMATION Imaverol 100 mg, Konzentrat zur örtlichen Anwendung 1.NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE
1. Was sind Dorithricin Halstabletten und wofür werden sie angewendet?
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Dorithricin - Halstabletten Wirkstoffe: Tyrothricin, Benzalkoniumchlorid, Benzocain Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen.
 Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Wie unsere Augen Erfahren Sie, wie wir sehen, und wie Sie Ihre Vision zu schützen. Levobunolol ist ein Beta-Blocker, der den Druck im Inneren des Auges reduziert. Levobunolol Augen (Auge) ist für die Behandlung
Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Sidroga Blasentee akut Wirkstoffe: Bärentraubenblätter, Birkenblätter, Goldrutenkraut, Orthosiphonblätter Lesen Sie die gesamte Packungsbeilage sorgfältig
Atronase 0,3 mg/ml Nasenspray, Lösung (Ipratropiumbromid)
 GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
GEBRAUCHSINFORMATION ATRONASE 0,3 MG/ML NASENSPRAY, LÖSUNG Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Dieses Arzneimittel ist auch ohne Verschreibung
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6
 Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Erratum Benkert, Pocket Guide, Psychopharmaka von A bis Z. 3.Aufl. ISBN (print): 978-3-642-54766-9/ DOI 10.1007/978-3-642-54767-6 Trotz sorgfältiger Erstellung des Buchs Benkert, Pocket Guide, Psychopharmaka
Diabetes mellitus : Folgeschäden
 Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
Diabetes mellitus : Folgeschäden Warum ist der Diabetes mellitus eine wichtige Erkrankung? a. Akute Probleme: Hypoglykämie Hyperglykämie Ketoazidose b. Chronische Probleme: Folgeschäden: Typische Schäden:
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. DOLCIDIUM GE 50 mg Zäpfchen DOLCIDIUM 100 mg Zäpfchen. Indometacin
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DOLCIDIUM GE 50 mg Zäpfchen DOLCIDIUM 100 mg Zäpfchen Indometacin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER DOLCIDIUM GE 50 mg Zäpfchen DOLCIDIUM 100 mg Zäpfchen Indometacin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
PACKUNGSBEILAGE. Bisolvon Hustenlöser - Saft Version 4.1 1
 PACKUNGSBEILAGE Bisolvon Hustenlöser - Saft Version 4.1 1 Gebrauchsinformation: Information für Patienten Bisolvon Hustenlöser - Saft Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage
PACKUNGSBEILAGE Bisolvon Hustenlöser - Saft Version 4.1 1 Gebrauchsinformation: Information für Patienten Bisolvon Hustenlöser - Saft Wirkstoff: Bromhexinhydrochlorid Lesen Sie die gesamte Packungsbeilage
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva
 Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Europäische Arzneimittelbehörde empfiehlt Aussetzung der Marktzulassung für Raptiva Darmstadt (19. Februar 2009) Die Merck KGaA hat heute bekannt gegeben, dass die europäische Arzneimittelbehörde EMEA
Labortests für Ihre Gesundheit. Therapie nach Maß 26
 Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
Labortests für Ihre Gesundheit Therapie nach Maß 26 01IPF Labortests für Ihre Gesundheit Therapie nach Maß Die individuelle Dosis finden Jeder Mensch ist einzigartig. Keiner gleicht dem anderen nicht nur
AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen)
 AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen) Lesen Sie die gesamte Information sorgfältig durch, bevor Sie sich bzw.
AUFKLÄRUNGSBLATT* ZUR IMPFUNG GEGEN DIE FSME (Frühsommer-Meningoenzephalitis) *(Auszug aus den jeweiligen Packungsinformationen) Lesen Sie die gesamte Information sorgfältig durch, bevor Sie sich bzw.
LANSOYL Paraffine Gel zum Einnehmenv3.0_B2.0 1/5
 PIL September 2015 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER LANSOYL PARAFFINE 78,230 g/100 g Gel zum Einnehmen Paraffinöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
PIL September 2015 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER LANSOYL PARAFFINE 78,230 g/100 g Gel zum Einnehmen Paraffinöl Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. PROGESTOGEL 1 % Gel. Progesteron
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER PROGESTOGEL 1 % Gel Progesteron Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
InVo. Information zu Verordnungen in der GKV. Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen. Stand: Februar 2010
 Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE
 HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE ERWINASE 10.000 I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung BEI DER ANWENDUNG DER CHARGEN 174aG116 UND 177aG116 IST
HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE ERWINASE 10.000 I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung BEI DER ANWENDUNG DER CHARGEN 174aG116 UND 177aG116 IST
Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut
 Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
Gebrauchsinformation: Information für Anwender HEUMANN Blasen- und Nierentee SOLUBITRAT uro Teeaufgusspulver Wirkstoffe: Trockenextrakt aus Birkenblättern, Trockenextrakt aus Goldrutenkraut Lesen Sie die
Pflichttexte zur Verwendung in der Werbung für Arzneimittel in Deutschland gemäß Heilmittelwerbegesetz (HWG) Endverbraucher
 Cutasept F Pflichttexte Cutasept F: Wirkstoff: Propan-2-ol. Zusammensetzung: 100 g Lösung enthalten: Wirkstoff: Propan-2-ol 63,0 g, entspricht 72 Vol.%. Sonstige Bestandteile: Benzalkoniumchlorid, Gereinigtes
Cutasept F Pflichttexte Cutasept F: Wirkstoff: Propan-2-ol. Zusammensetzung: 100 g Lösung enthalten: Wirkstoff: Propan-2-ol 63,0 g, entspricht 72 Vol.%. Sonstige Bestandteile: Benzalkoniumchlorid, Gereinigtes
GEBRAUCHSINFORMATION. Wirkstoff: Acetylsalicylsäure. Z.Nr.: 3155
 Liebe Patientin, lieber Patient! Bitte lesen Sie diese Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Einnahme dieses Arzneimittels beachten sollen. Wenden
Liebe Patientin, lieber Patient! Bitte lesen Sie diese Gebrauchsinformation aufmerksam, weil sie wichtige Informationen darüber enthält, was Sie bei der Einnahme dieses Arzneimittels beachten sollen. Wenden
Anhang III. Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage
 Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
Anhang III Ergänzungen der relevanten Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage 20 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS [Der unten genannte Wortlaut
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Magnevist 2 mmol/l Injektionslösung. Gadopentetsäure, Dimeglumin
 1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
1 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Magnevist 2 mmol/l Injektionslösung Gadopentetsäure, Dimeglumin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor dieses Arzneimittel bei
Gebrauchsinformation: Information für Patienten. Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench)
 Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Gebrauchsinformation: Information für Patienten Urgenin Tropfen Tinktur aus Serenoa repens (Bartram Small) ; Saft aus Echinacea purpurea (Moench) Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. Tebofortan 40 mg - Filmtabletten. Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tebofortan 40 mg - Filmtabletten Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Tebofortan 40 mg - Filmtabletten Wirkstoff: Trockenextrakt aus Ginkgo-biloba-Blättern Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit
Packungsbeilage GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung. Xylometazolinhydrochlorid
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung Xylometazolinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER NUSO-SAN Menthol 1mg/ml Nasenspray, Lösung Xylometazolinhydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige
IMPLANON NXT Erläuternde Broschüre für Patientinnen
 Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Die Markteinführung von IMPLANON NXT wurde von den belgischen Gesundheitsbehörden an bestimmte Bedingungen geknüpft. Der vorgeschriebene Plan zur Risikominimierung in Belgien, der auch das vorliegende
Gebrauchsinformation: Information für Anwender
 Gebrauchsinformation: Information für Anwender Tilidin N Lichtenstein Wirkstoffe: Tilidinhydrochlorid 50 mg in 20 Tropfen Naloxonhydrochlorid 4 mg in 20 Tropfen Für Erwachsene, Kinder ab 2 Jahre Lösung
Gebrauchsinformation: Information für Anwender Tilidin N Lichtenstein Wirkstoffe: Tilidinhydrochlorid 50 mg in 20 Tropfen Naloxonhydrochlorid 4 mg in 20 Tropfen Für Erwachsene, Kinder ab 2 Jahre Lösung
Diese Broschüre fasst die wichtigsten Informationen zusammen, damit Sie einen Entscheid treffen können.
 Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. Substitutionsempfehlungen lokaler Behandlungsprotokolle,
 1. BEZEICHNUNG DES ARZNEIMITTELS ERWINASE 10.000 I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Crisantaspase (Asparaginase aus Erwinia
1. BEZEICHNUNG DES ARZNEIMITTELS ERWINASE 10.000 I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Crisantaspase (Asparaginase aus Erwinia
Gebrauchsinformation: Information für Anwender. Delphi 0,1 % Creme Triamcinolonacetonid
 Gebrauchsinformation: Information für Anwender Delphi 0,1 % Creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Gebrauchsinformation: Information für Anwender Delphi 0,1 % Creme Triamcinolonacetonid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen,
Klassische Basistherapeutika 1
 Klassische Basistherapeutika 1 Auranofin Ridaura 3-9 mg pro Tag; bei Magenbeschwerden Übelkeit, Bauchschmerzen, Goldallergie, Knochenmark- (1 Filmtablette = 3 mg) Tabletten auf den Tag Darmentzündung,
Klassische Basistherapeutika 1 Auranofin Ridaura 3-9 mg pro Tag; bei Magenbeschwerden Übelkeit, Bauchschmerzen, Goldallergie, Knochenmark- (1 Filmtablette = 3 mg) Tabletten auf den Tag Darmentzündung,
RSV. RSV kennen. Das Virus, das Eltern kennen sollten. Informationen. Kinder schützen
 RSV kennen Kinder schützen RSV Das Virus, das Eltern kennen sollten. Informationen zu einem wenig bekannten Virus sowie praktische Ratschläge, wie Sie das Risiko einer RSV-Infektion verringern können.
RSV kennen Kinder schützen RSV Das Virus, das Eltern kennen sollten. Informationen zu einem wenig bekannten Virus sowie praktische Ratschläge, wie Sie das Risiko einer RSV-Infektion verringern können.
Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15.
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER 22.07.2009 Hepatyrix Injektionssuspension Hepatitis-A-(inaktiviert) und Typhus-Polysaccharid-Impfstoff (adsorbiert) ab dem vollendeten 15. Lebensjahr
Durchfall in der Pflege. Der kleine Ratgeber von Aplona
 Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
Durchfallerkrankungen Durchfall in der Pflege Der kleine von Aplona Der kleine von Aplona 3 Fotos: Titel, Seite 2, 3 und 4: Fotolia.com Durchfall in der Pflege Akute Durchfallerkrankungen stellen eine
zur Verfügung gestellt von Gebrauchs.info GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER
 2,5 mg/g Wirkstoff: Prednicarbat GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
2,5 mg/g Wirkstoff: Prednicarbat GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Heben
10 Antworten zum Thema Generika
 10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
10 Antworten zum Thema Generika Die mit dem Regenbogen Liebe Leserin, Lieber Leser Immer mehr Schweizerinnen und Schweizer leiden unter den jährlich steigenden Gesundheitskosten und Krankenkassenprämien.
Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON
 1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
Gebrauchsinformation: Information für den Anwender
 Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
Wortlaut der für die Gebrauchsinformation vorgesehenen Angaben Stand: Mai 2008 1 Gebrauchsinformation: Information für den Anwender Harntee-Steiner, Teeaufgusspulver Zur Anwendung bei Heranwachsenden ab
Dontisolon D Mundheilpaste
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER 5 mg/g Paste Wirkstoff: Prednisolonacetat (Ph.Eur.) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER 5 mg/g Paste Wirkstoff: Prednisolonacetat (Ph.Eur.) Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
ANWEISUNGSKARTE FÜR DEN PATIENTEN
 Der Plan zur Risikobegrenzung in Belgien, zu dem diese Information gehört, ist eine Maßnahme, die ergriffen wurde, um eine sichere und wirksame Anwendung fon ZypAdhera TM zu garantieren. (RMA modifizierte
Der Plan zur Risikobegrenzung in Belgien, zu dem diese Information gehört, ist eine Maßnahme, die ergriffen wurde, um eine sichere und wirksame Anwendung fon ZypAdhera TM zu garantieren. (RMA modifizierte
Ein neues System für die Allokation von Spenderlungen. LAS Information für Patienten in Deutschland
 Ein neues System für die Allokation von Spenderlungen LAS Information für Patienten in Deutschland Ein neues System für die Allokation von Spenderlungen Aufgrund des immensen Mangels an Spenderorganen
Ein neues System für die Allokation von Spenderlungen LAS Information für Patienten in Deutschland Ein neues System für die Allokation von Spenderlungen Aufgrund des immensen Mangels an Spenderorganen
Verschreibungsfreie Arzneimittel wieder in der Erstattung
 Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Gefährlich hohe Blutzuckerwerte
 Gefährlich hohe Blutzuckerwerte In besonderen Situationen kann der Blutzuckerspiegel gefährlich ansteigen Wenn in Ausnahmefällen der Blutzuckerspiegel sehr hoch ansteigt, dann kann das für Sie gefährlich
Gefährlich hohe Blutzuckerwerte In besonderen Situationen kann der Blutzuckerspiegel gefährlich ansteigen Wenn in Ausnahmefällen der Blutzuckerspiegel sehr hoch ansteigt, dann kann das für Sie gefährlich
Das NEUE Leistungspaket der Sozialversicherung. Mehr Zahngesundheit für Kinder und Jugendliche bis zum 18. Lebensjahr. Fragen und Antworten
 Das NEUE Leistungspaket der Sozialversicherung Mehr Zahngesundheit für Kinder und Jugendliche bis zum 18. Lebensjahr Fragen und Antworten Stand: Juni 2015 1 Grundsatzfragen zum neuen Leistungspaket 1.1
Das NEUE Leistungspaket der Sozialversicherung Mehr Zahngesundheit für Kinder und Jugendliche bis zum 18. Lebensjahr Fragen und Antworten Stand: Juni 2015 1 Grundsatzfragen zum neuen Leistungspaket 1.1
PACKUNGSBEILAGE. CORSODYL Zahngel, 10 mg Chlorhexidin digluconat pro g Zahngel
 Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
Seite 1/5 981 IS 153 F7 Belgien PACKUNGSBEILAGE Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie. Wenn Sie weitere Fragen haben, wenden Sie sich an
Informationsbroschüre für Eltern von Kleinkindern mit ahus
 Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels SOLIRIS Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
Die europäischen Gesundheitsbehörden haben für die Markteinführung des Arzneimittels SOLIRIS Bedingungen auferlegt. Dieser verpflichtende Plan zur Risikoeinschränkung in Belgien - zu dem diese Information
Faltschachtel. Unverkäufliches Muster (Eindruck auf Linie) Teil einer Klinikpackung, Einzelverkauf unzulässig (Eindruck auf Linie)
 Packmittelmanuskript Nr. 64000/009/94/6 Seite 2 Faltschachtel HEUMANN PHARMA GmbH & Co. Generica KG Südwestpark 50 90449 Nürnberg Urso 400 Heumann Filmtabletten mit 400 mg Ursodeoxycholsäure Zur Auflösung
Packmittelmanuskript Nr. 64000/009/94/6 Seite 2 Faltschachtel HEUMANN PHARMA GmbH & Co. Generica KG Südwestpark 50 90449 Nürnberg Urso 400 Heumann Filmtabletten mit 400 mg Ursodeoxycholsäure Zur Auflösung
Gebrauchsinformation: Information für Anwender. LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid
 Gebrauchsinformation: Information für Anwender LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
Gebrauchsinformation: Information für Anwender LIVOSTIN - Augentropfen Wirkstoff: Levocabastin-Hydrochlorid Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels
1.1. Aufschriften auf der Außenseite von ME-Geräten oder ME-Geräte-Teilen
 1. Bezeichnung, Aufschriften und Begleitpapiere 1.1. Aufschriften auf der Außenseite von ME-Geräten oder ME-Geräte-Teilen 1.1.1. Aufschriften auf der Außenseite von ME-Geräten oder ME-Geräte-Teilen, die
1. Bezeichnung, Aufschriften und Begleitpapiere 1.1. Aufschriften auf der Außenseite von ME-Geräten oder ME-Geräte-Teilen 1.1.1. Aufschriften auf der Außenseite von ME-Geräten oder ME-Geräte-Teilen, die
Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker)
 Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker) EIN LEITFADEN ZUR ERSTEN VERWENDUNG VON APIDRA in 10ml- DURCHSTECHFLASCHEN Apidra
Anleitung zur Handhabung von Durchstechflasche und Einmalspritze (für Patienten, Ärzte, Diabetesberater und Apotheker) EIN LEITFADEN ZUR ERSTEN VERWENDUNG VON APIDRA in 10ml- DURCHSTECHFLASCHEN Apidra
Gebrauchsinformation: Information für Patienten. Desloratadin Genericon 5 mg Filmtabletten. Wirkstoff: Desloratadin
 Gebrauchsinformation: Information für Patienten Desloratadin Genericon 5 mg Filmtabletten Wirkstoff: Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
Gebrauchsinformation: Information für Patienten Desloratadin Genericon 5 mg Filmtabletten Wirkstoff: Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses
APOTHEKIA SPECIAL DIE PILLE DANACH
 APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
APOTHEKIA SPECIAL DIE PILLE DANACH Die zwei Pillen danach In Deutschland sind aktuell zwei Wirkstoffe für die Pille danach zugelassen, Ulipristalacetat (Handelsname ellaone) und Levonorgestrel (Handelsname
Subkutane spezifische Immuntherapie. Eine Information für Patienten
 Subkutane spezifische Immuntherapie Eine Information für Patienten Spezifische Immuntherapie Die Allergietestung durch Ihren Arzt hat ergeben, dass Sie (oder Ihr Kind) an einer Allergie leiden. Allergische
Subkutane spezifische Immuntherapie Eine Information für Patienten Spezifische Immuntherapie Die Allergietestung durch Ihren Arzt hat ergeben, dass Sie (oder Ihr Kind) an einer Allergie leiden. Allergische
FACHINFORMATION ELUDRIL N
 FACHINFORMATION ELUDRIL N ZUSAMMENSETZUNG Wirkstoffe: Chlorhexidini Digluconas. Hilfsstoffe: Propylenglycolum, Aromatica Vanillinum et alia, Color: E 124, Conserv.: Alcohol benzylicus, Excipiens ad solutionem
FACHINFORMATION ELUDRIL N ZUSAMMENSETZUNG Wirkstoffe: Chlorhexidini Digluconas. Hilfsstoffe: Propylenglycolum, Aromatica Vanillinum et alia, Color: E 124, Conserv.: Alcohol benzylicus, Excipiens ad solutionem
aktive / passive Immunisierung
 FS 2010 aktive / passive Immunisierung DTP-Impfstoff Michelle, Andrea 3Ma Überblick Wo befinden wir uns eigentlich? 10 000 Mia. Zellen Nerven-, Muskel-, Bindegewebsoder Blutzellen weißes BK (Leukozyt)
FS 2010 aktive / passive Immunisierung DTP-Impfstoff Michelle, Andrea 3Ma Überblick Wo befinden wir uns eigentlich? 10 000 Mia. Zellen Nerven-, Muskel-, Bindegewebsoder Blutzellen weißes BK (Leukozyt)
Cytomegalie & Co. Häufige Virusinfektionen in der Schwangerschaft. Deutsches Grünes Kreuz e.v.
 Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
Cytomegalie & Co Häufige Virusinfektionen in der Schwangerschaft Schwangerschaft Eine ganz besondere Zeit der Vorfreude Verantwortung Sorge Die werdenden Eltern möchten alles richtig machen für das Wohl
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Gebrauchsinformation: Information für Anwender. Cyprostol - Tabletten Wirkstoff: Misoprostol
 1 Gebrauchsinformation: Information für Anwender Cyprostol - Tabletten Wirkstoff: Misoprostol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
1 Gebrauchsinformation: Information für Anwender Cyprostol - Tabletten Wirkstoff: Misoprostol Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. AERIUS 5 mg Filmtabletten Desloratadin
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Filmtabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Die östrogenfreie Pille
 Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
Alle wichtigen Infos über Sexualität und Verhütung unter: www.frau-und-pille.de Mit bester Empfehlung Die östrogenfreie Pille Verhütung für Frauen mit besonderem Anspruch. Einscannen und mehr erfahren...
SUBSTANZABHÄNGIGKEIT - PROBLEMSTELLUNG IN DER BEURTEILUNG DER FAHRTAUGLICHKEIT
 SUBSTANZABHÄNGIGKEIT - PROBLEMSTELLUNG IN DER BEURTEILUNG DER FAHRTAUGLICHKEIT HR Dr. Wilhelm SAURMA LandespolizeidirekHon Wien Ref. A 1.3 Polizeiärztlicher Dienst Verordnung des Bundesministers für WissenschaT
SUBSTANZABHÄNGIGKEIT - PROBLEMSTELLUNG IN DER BEURTEILUNG DER FAHRTAUGLICHKEIT HR Dr. Wilhelm SAURMA LandespolizeidirekHon Wien Ref. A 1.3 Polizeiärztlicher Dienst Verordnung des Bundesministers für WissenschaT
Trockenes Auge. Haben Sie Trockene Augen?
 Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Screening Das Programm. zur Früherkennung von Brustkrebs
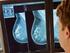 Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU - Kombination mit Sulfonylharnstoff n
 Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER ISOPTO CARPINE 1% Augentropfen ISOPTO CARPINE 2% Augentropfen ISOPTO CARPINE 3% Augentropfen ISOPTO CARPINE 4% Augentropfen Pilocarpinhydrochlorid Lesen
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER ISOPTO CARPINE 1% Augentropfen ISOPTO CARPINE 2% Augentropfen ISOPTO CARPINE 3% Augentropfen ISOPTO CARPINE 4% Augentropfen Pilocarpinhydrochlorid Lesen
Gebrauchsinformation: Information für Patienten
 Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
Gebrauchsinformation: Information für Patienten Esberitox -Tabletten Trockenextrakt aus einer Mischung von Lebensbaumspitzen und -blättern, Purpursonnenhutwurzel, Blassfarbener Sonnenhutwurzel und Färberhülsenwurzel
DRINGEND Medizingeräte-Korrektur Philips HeartStart MRx Monitor/Defibrillator
 Philips Healthcare - 1/5 - FSN86100123A Sehr geehrte Kundin, Sehr geehrter Kunde, wir möchten Ihnen mitteilen, dass Philips Healthcare aufgrund eines Problems, das bei Verwendung des s zur synchronisierten
Philips Healthcare - 1/5 - FSN86100123A Sehr geehrte Kundin, Sehr geehrter Kunde, wir möchten Ihnen mitteilen, dass Philips Healthcare aufgrund eines Problems, das bei Verwendung des s zur synchronisierten
Gebrauchsinformation: Information für Anwender. DAFALGAN CODEINE 500mg/30mg, Brausetabletten DAFALGAN CODEINE 500mg/30mg Filmtabletten
 Gebrauchsinformation: Information für Anwender DAFALGAN CODEINE 500mg/30mg, Brausetabletten DAFALGAN CODEINE 500mg/30mg Filmtabletten Paracetamol, halb entwässertes Codeinphosphat Lesen Sie die gesamte
Gebrauchsinformation: Information für Anwender DAFALGAN CODEINE 500mg/30mg, Brausetabletten DAFALGAN CODEINE 500mg/30mg Filmtabletten Paracetamol, halb entwässertes Codeinphosphat Lesen Sie die gesamte
1 Belastung. 1.1 Standortbestimmung 1.2 Belastungsvorhersage 1.3 Favoriten
 Inhalt 1 Belastung 1.1 Standortbestimmung 1.2 Belastungsvorhersage 1.3 Favoriten 2 Beschwerden 2.1 Registrierung / Einloggen 2.2 Symptome 2.3 Diagramme 3 Info 3.1 Lexikon 3.2 Tutorial 3.3 Impressum 4 Einstellungen
Inhalt 1 Belastung 1.1 Standortbestimmung 1.2 Belastungsvorhersage 1.3 Favoriten 2 Beschwerden 2.1 Registrierung / Einloggen 2.2 Symptome 2.3 Diagramme 3 Info 3.1 Lexikon 3.2 Tutorial 3.3 Impressum 4 Einstellungen
Ihre Protein Analyse
 Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
Meinungen der Bürgerinnen und Bürger in Hamburg und Berlin zu einer Bewerbung um die Austragung der Olympischen Spiele
 Meinungen der Bürgerinnen und Bürger in Hamburg und Berlin zu einer Bewerbung um die Austragung der Olympischen Spiele 4. März 2015 q5337/31319 Le forsa Politik- und Sozialforschung GmbH Büro Berlin Schreiberhauer
Meinungen der Bürgerinnen und Bürger in Hamburg und Berlin zu einer Bewerbung um die Austragung der Olympischen Spiele 4. März 2015 q5337/31319 Le forsa Politik- und Sozialforschung GmbH Büro Berlin Schreiberhauer
Der Gesundheitskompass für die junge Frau
 Haarausfall? Blutentnahme zu Hormonlabor, Eisenwerte, Schilddrüsenwerte, Biotin und Zink 86,87 EURO Wiederholte Scheideninfektionen? Mit dem Vaginalstatus können Infektionen durch spezielle Kulturen auf
Haarausfall? Blutentnahme zu Hormonlabor, Eisenwerte, Schilddrüsenwerte, Biotin und Zink 86,87 EURO Wiederholte Scheideninfektionen? Mit dem Vaginalstatus können Infektionen durch spezielle Kulturen auf
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN. AERIUS 5 mg Schmelztabletten Desloratadin
 GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Schmelztabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN AERIUS 5 mg Schmelztabletten Desloratadin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen,
Fragebogen Kopfschmerzen
 Fragebogen Kopfschmerzen Fragen an Dich Fragen an Dich Fragen an die Eltern Bei diesen Fragen geht es um Deine Kopfschmerzen. Es wäre schön, wenn Du darüber etwas sagst. Deine Antworten helfen, für Deine
Fragebogen Kopfschmerzen Fragen an Dich Fragen an Dich Fragen an die Eltern Bei diesen Fragen geht es um Deine Kopfschmerzen. Es wäre schön, wenn Du darüber etwas sagst. Deine Antworten helfen, für Deine
Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn
 Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn Ein Wort zuvor: Etwas Haarverlust ist ganz natürlich Das große Problem: Erblich bedingter Haarausfall as Leben eines Haares dauert
Der Medizinkamm fürs Haar Ein Ratgeber bei Haarausfall für Sie und Ihn Ein Wort zuvor: Etwas Haarverlust ist ganz natürlich Das große Problem: Erblich bedingter Haarausfall as Leben eines Haares dauert
Karies-Schutz für Kinder
 Karies-Schutz für Kinder F I S S U R E N V E R S I E G E L U N G Fissuren Was sind Fissuren? Fissuren sind Rillen und Furchen in den Kauflächen der Backenzähne. Sie sind so klein, dass sie von der Zahnbürste
Karies-Schutz für Kinder F I S S U R E N V E R S I E G E L U N G Fissuren Was sind Fissuren? Fissuren sind Rillen und Furchen in den Kauflächen der Backenzähne. Sie sind so klein, dass sie von der Zahnbürste
Die spezifische Vitaminkombination in nur einer Tablette.
 Die spezifische Vitaminkombination in nur einer Tablette. Die gezielte Vitaminergänzung bei medikamentös behandelter Epilepsie. Schließen Sie Ihre Vitaminlücken ganz gezielt. Hinweis EPIVIT ist ein ernährungsmedizinisch
Die spezifische Vitaminkombination in nur einer Tablette. Die gezielte Vitaminergänzung bei medikamentös behandelter Epilepsie. Schließen Sie Ihre Vitaminlücken ganz gezielt. Hinweis EPIVIT ist ein ernährungsmedizinisch
Diabetische Retinopathie
 Netzhautkomplikationen Diabetische Netzhautkomplikationen sind krankhafte Veränderungen in den Augen, die durch einen Diabetes mellitus verursacht werden können. Es handelt sich um die diabetische Retinopathie
Netzhautkomplikationen Diabetische Netzhautkomplikationen sind krankhafte Veränderungen in den Augen, die durch einen Diabetes mellitus verursacht werden können. Es handelt sich um die diabetische Retinopathie
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. ERWINASE I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung
 ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS ERWINASE 10.000 I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS 1. BEZEICHNUNG DES ARZNEIMITTELS ERWINASE 10.000 I.E./Durchstechflasche Pulver zur Herstellung einer Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Patientenaufklärung. Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:...
 Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Chemotherapie und Zweck der Studie Sehr geehrte
Patientenaufklärung Patientenname:... Vorname:... Geburtsdatum:... Diagnose:... Das Aufklärungsgespräch erfolgte am:... durch:... Art der Erkrankung, Ziel der Chemotherapie und Zweck der Studie Sehr geehrte
Hilfedatei der Oden$-Börse Stand Juni 2014
 Hilfedatei der Oden$-Börse Stand Juni 2014 Inhalt 1. Einleitung... 2 2. Die Anmeldung... 2 2.1 Die Erstregistrierung... 3 2.2 Die Mitgliedsnummer anfordern... 4 3. Die Funktionen für Nutzer... 5 3.1 Arbeiten
Hilfedatei der Oden$-Börse Stand Juni 2014 Inhalt 1. Einleitung... 2 2. Die Anmeldung... 2 2.1 Die Erstregistrierung... 3 2.2 Die Mitgliedsnummer anfordern... 4 3. Die Funktionen für Nutzer... 5 3.1 Arbeiten
