Siede- und Schmelztemperatur
|
|
|
- Arnim Kolbe
- vor 9 Jahren
- Abrufe
Transkript
1 Schulversuchspraktikum Name: Anna Elisabeth Gulyas Semester: Sommersemester 2013 Klassenstufen 5 & 6 Siede- und Schmelztemperatur
2 Auf einen Blick: In dieser Unterrichtseinheit lernen die SuS Siede- und Schmelztemperatur als charakteristische Eigenschaft von Stoffen kennen. In dem folgenden Protokoll werden fünf Experimente zum Thema Siede- und Schmelztemperatur vorgestellt: zwei Lehrerdemonstrationsexperimente und drei Schülerexperimente. In den Lehrerdemonstrationsversuchen werden Blei und Woodsches Metall vorgestellt - zwei Stoffe, deren Schmelzpunkte weit auseinanderliegen. Die SuS führen qualitative und quantitative Versuche durch, um die Siede- und Schmelztemperaturen unterschiedlicher Stoffe miteinander zu vergleichen. Inhalt 1 Beschreibung des Themas und zugehörige Lernziele Relevanz des Themas für SuS Lehrerversuche V 1 Bleigießen V 2 Der Zauberlöffel Schülerversuche V 3 Schmelzen von Haushaltsartikeln V 4 Schmelzpunktbestimmung von Glycerin V 5 Siedetemperaturen von Wasser und Ethanol Reflexion des Arbeitsblattes Erwartungshorizont (Kerncurriculum) Erwartungshorizont (Inhaltlich)... 16
3 1 Beschreibung des Themas und zugehörige Lernziele Das Thema Siede- und Schmelztemperatur baut auf dem Thema Aggregatzustände auf. Dieser Themenkomplex bildet für Klasse 5&6 einen Schwerpunkt im Kerncurriculum, da ein einfaches Teilchenmodell zum grundlegenden Verständnis ausreicht und das Thema daher für die SuS gut verständlich ist. Außerdem beschäftigen sich die SuS in diesen Klassenstufen verstärkt damit, wie sich Stoffe anhand ihrer Stoffeigenschaften unterscheiden lassen. Siede- und Schmelztemperatur wichtige Stoffeigenschaften, anhand derer Stoffe analysiert und identifiziert werden können. Konkret werden in der Unterrichtseinheit Siede- und Schmelztemperaturen folgende im Kerncurriculum geforderten Kompetenzen erworben: Basiskonzept Stoff-Teilchen Fachwissen Stoffe besitzen typische Eigenschaften Die Schülerinnen und Schüler... unterscheiden Stoffe und Körper. unterscheiden Stoffe anhand ihrer mit den Sinnen erfahrbaren Eigenschaften. unterscheiden Stoffe anhand ausgewählter messbarer Eigenschaften. Stoffeigenschaften bestimmen ihre Verwendung Die Schülerinnen und Schüler... schließen aus den Eigenschaften ausgewählter Stoffe auf ihre Verwendungsmöglichkeiten. Inhalte und Begriffe: Stoffeigenschaften: Aggregatzustände, Siedetemperatur, Schmelztemperatur; Umgang mit dem Gasbrenner; Basiskonzept Energie Fachwissen Stoffe kommen in verschiedenen Aggregatzuständen vor Die Schülerinnen und Schüler... beschreiben, dass der Aggregatzustand eines Stoffes von der Temperatur abhängt. Auch die anderen im Kerncurriculum aufgeführten Kompetenzen werden in dieser Einheit gefördert, insbesondere durch das Durchführen und Auswerten der Experimente in verschiedenen Sozialformen. 2 Relevanz des Themas für SuS Alle Stoffe, welche die SuS in ihrer Lebenswelt umgeben, liegen in einem bestimmten Aggregatzustand vor. Oft finden im Alltag Zustandsänderungen statt; darunter viele, die für die Schüler relevant sind und sie interessieren. Beispielsweise könnten sie sich folgende Fragen stellen: - Wann schneit es endlich?
4 - Warum schmelzen meine drei Kugeln Eis eigentlich immer schneller, als ich sie aufessen kann? - Wann dürfen wir endlich Schlittschuh laufen? - Warum ist die Schokolade in meiner Hosentasche geschmolzen? - Das Thema Siede- und Schmelzpunkte hat demnach einen starken Alltagsbezug, daher wird es bei den SuS vermutlich auf Interesse stoßen. Die in diesem Protokoll beschriebenen Versuche zielen darauf ab, die Motivation der SuS, sich mit diesen und ähnlichen Fragestellungen zu beschäftigen, zu erhalten oder sogar zu erhöhen. 3 Lehrerversuche 3.1 V 1 Bleigießen Beim Bleigießen wird Blei über der Brennerflamme erhitzt und anschließend in kaltes Wasser gegossen, wo es zu beeindruckenden Strukturen erstarrt. Um den Versuch deuten zu können, sollten die SuS über Vorwissen zu Aggregatzuständen verfügen. Gefahrenstoffe Blei H: 360D-360F P: Wasser H: - P: - Sicherheitshinweise: Blei nur mit Handschuhen anfassen. Materialien: Chemikalien: Durchführung: Beobachtung: Löffel, Gasbrenner, Wanne Blei (als Blech), Wasser Ein kleines Stück Blei wird auf den Löffel gegeben. Dieser wird anschließend über die rauschende Brennerflamme gehalten. Sobald das Blei geschmolzen ist, wird es in die mit Wasser gefüllte Wanne gegossen. Das Blei schmilzt nach kurzer Zeit über der Brennerflamme. Beim Abgießen ins Wasser erstarrt das Metall sofort und sinkt zu Boden. Es entstehen filigrane Strukturen.
5 Abb. 1 Versuchsdurchführung V1: Flüssiges Blei wird in das Wasser gegossen. Abb. 2 - Beobachtung V1: Bleistrukturen Deutung: Beim Erhitzen über der Brennerflamme schmilzt das Metall, weil die Temperatur höher ist als die Schmelztemperatur des Metalls. Das Wasser hat eine Temperatur, die weit unter der Schmelztemperatur des Metalls liegt. Daher erstarrt das Blei sofort. Entsorgung: Blei: Schwermetallabfall (oder Wiederverwendung), Wasser: Ausguss Literatur: - Unterrichtsanschlüsse: Versuch 1 eignet sich gut als Einstieg in die Unterrichtseinheit, weil wenig Vorwissen vorausgesetzt wird. Anhand des Versuches kann wiederholt werden, was die SuS bereits über Aggregatzustände gelernt haben. Durch diesen Versuch lernen die SuS, dass Blei durch die Brennerflamme über seine Schmelztemperatur hinaus erhitzt wird und dass die Raumtemperatur weit unter der Schmelztemperatur liegen muss, da das Blei sofort erstarrt, sobald es in das Wasser gegossen wird. (Um die SuS zu diesem Schluss zu führen, können Vergleiche mit dem Herstellen von Eiswürfeln gezogen werden.) Dies macht neugierig: Wo genau liegen denn diese Schmelztemperaturen? Und wie kann man sie messen? Diese Fragen können im Verlauf der Einheit weiter verfolgt werden.
6 Alternativversuch: Statt Blei kann auch Kerzenwachs verwendet werden. Hierzu wird ein Teelicht entzündet und nach einer Weile das flüssige Wachs ins Wasser gegossen. Das Wachs ist im Gegensatz zu Blei ungiftig; das modifizierte Experiment kann daher als Schülerversuch durchgeführt werden. Die entstehenden Strukturen sind allerdings bei weitem nicht so filigran und eindrucksvoll. 3.2 V 2 Der Zauberlöffel In diesem Versuch wird ein Stück Woodsches Metall, eine Legierung mit einem Schmelzpunkt von 60 C, eingeschmolzen, indem sie in siedendes Wasser eingetaucht wird. Die Zusammensetzung der Legierung ist wie folgt: 50 Gew.-% Bismut, 25 Gew.-% Blei, 12,5 Gew.-% Cadmium und 12,5 Gew.-% Zinn. Der niedrige Schmelzpunkt ist überraschend, denn die uns aus dem Alltag bekannten Metalle und Legierungen haben alle eine hohe Schmelztemperatur. Der Versuch lebt vom Überraschungseffekt. Es ist jedoch kein Wunderexperiment, denn die SuS können sich die Beobachtungen mit ihrem Vorwissen über Aggregatzustände und Schmelztemperaturen erklären. Gefahrenstoffe Woodsches Metall H: f- 361d P: Wasser H: - P: - Sicherheitshinweise: Woodsches Metall nur mit Handschuhen anfassen. Materialien: Chemikalien: Durchführung: Gießform, großes Becherglas, Gasbrenner, Dreifuß, Spatel Woodsches Metall (Granulat), Wasser Das Woodsche Metall wird im Becherglas über dem Gasbrenner erhitzt, bis es flüssig wird. Anschließend wird das flüssige Metall in die Gießform gegossen. Nach dem Erkalten wird es aus der Form entnommen. In einem großen Becherglas wird Wasser über dem Gasbrenner erhitzt. Sobald es siedet, wird es aus der Flamme genommen. Nun wird das Wood-
7 sche Metall ins heiße Wasser gehalten (Achtung: Handschuhe tragen, denn die Legierung ist toxisch). Nach dem Versuch wird das Wasser dekantiert und das Woodsche Metall wieder in die Gießform geschüttet. Gegebenenfalls muss es vorher noch einmal erwärmt werden. Anmerkung: Als Gießform eignet sich z.b. eine Form aus Holz. An der Gussstelle kann Knete ausgelegt werden. Aus dieser lässt sich das erkaltete Metall mithilfe eines Spatels leicht herauslösen. Beobachtung: Über dem Gasbrenner schmilzt das silbrige Granulat und wird zu einer silberfarbenen Flüssigkeit. Diese erstarrt innerhalb von wenigen Minuten nachdem sie in die Form gegossen wurde. Das Woodsche Metall schmilzt beim Eintauchen in das heiße Wasser. Silbrige Metalltropfen sinken herab. Auf dem Boden setzt sich eine silberfarbene Flüssigkeit ab. Nach kurzer Zeit ist der ganze Feststoff geschmolzen. Abb. 3 - Beobachtung V2: Woodsches Metall schmilzt in heißem Wasser. Abb. 4 - Beobachtung V2: Geschmolzenes Woodsches Metall am Boden des Becherglases.
8 Deutung: Entsorgung: Die Schmelztemperatur der Legierung liegt unter der Temperatur des Wassers. Daher schmilzt das Woodsche Metall, sobald es in das Wasser eingetaucht wird. Woodsches Metall: Schwermetallabfall, Wasser: Abfluss Literatur: Tausch, Michael, et al., Stoff Formel Umwelt, Chemie 1, C.C. Buchner, 2. Auflage, 2009, S. 62. Unterrichtsanschlüsse: Dieser Versuch eignet sich als Parallel- bzw. Gegenversuch zu Versuch 1. In V1 erstarrt eine Flüssigkeit im Wasser, in V2 passiert das Gegenteil: ein Feststoff wird flüssig. Hier können Vergleiche angestellt und Rückschlüsse bezüglich der Schmelzpunkte der beiden Stoffe gezogen werden. Als Ergänzung zu V1 könnten die beim Versuch entstandenen Bleistrukturen in kochendes Wasser gegeben werden, damit ein direkter Vergleich zwischen den Stoffen stattfinden kann. Weiterhin eignet sich der Versuch als Anlass, um zu thematisieren, warum das Ergebnis so unerwartet ist, das heißt, es kann über die Stoffklasse der Metalle gesprochen werden und darüber, wie sich durch Vermischen der Metalle Legierungen mit neuen Stoffeigenschaften bilden. 4 Schülerversuche 4.1 V 3 Schmelzen von Haushaltsartikeln In diesem Versuch erhitzen die SuS verschiedene Haushaltsartikel über Kerzenflammen: Wachs, Schokolade, Käse, Butter, Maoam u.ä. Da die verschiedenen Proben gleichzeitig erhitzt werden, können die SuS Vergleiche anstellen. Gefahrenstoffe Zartbitterschokolade H: - P: - Kinderriegel H: - P: - Gouda H: - P: - Kerzenwachs H: - P: - Maoam H: - P: - Butter H: - P: -
9 Margarine H: - P: - Salz H: - P: - Sicherheitshinweise: Das Drahtnetz sowie die pneumatische Wanne und die Proben werden sehr heiß. Materialien: Chemikalien: Durchführung: Wanne, Teelichte, Teelichtschalen, unbelegtes Drahtnetz, Feuerzeug, Mörser mit Pistill Zartbitterschokolade, Salz, Butter, Margarine, Maoam, Kinderschokolade, Gouda, Wachs Die Wanne wird mit Kerzen bestückt. Dabei werden so viele Schichten Kerzen gelegt, dass die oberste bis knapp unter den Rand der Wanne reicht (Siehe Abb. 5). 5 g jeder Stoffprobe werden in je eine Teelichtschale gegeben. Die Zartbitterschokolade und das Wachs werden in grobe Stücke zerkleinert, der Gouda und die Kinderschokolade werden platt gedrückt, und die Butter und die Margarine so verteilt, dass der ganze Boden der Teelichtschale bedeckt ist. Anschließend werden die Proben auf das Drahtnetz gestellt. Die oberste Reihe der Kerzen wird entzündet und das Drahtnetz auf die Wanne gestellt. Hierbei ist zu beachten, dass die Teelichtschalen mit den Proben direkt über je einer Kerze stehen müssen. Nun wird etwa 10 Minuten beobachtet, was passiert. Anmerkungen: Ein herkömmliches Drahtnetz, wie es beim Erhitzen mit dem Gasbrenner verwendet wird, ist nicht für diesen Versuch geeignet. Die Mittelverstärkung blockiert die Sauerstoffzufuhr und die Kerzen erlöschen. Beobachtung: Schon nach kurzer Zeit auf den Flammen ist bei Butter und Margarine eine gelbliche, trübe Flüssigkeit zu sehen. In dieser Flüssigkeit steigen Gasblasen auf. Nach dreieinhalb Minuten ist nur noch Flüssigkeit in den beiden Proben. Auf der Butterprobe entsteht Schaum. Auch beim Wachs entsteht eine Flüssigkeit. Diese ist farblos und klar. Nach etwa 6 Minuten ist ausschließlich Flüssigkeit in der Probe.
10 Nach ca. einer halben Minute fängt der Käse an, Blasen zu bilden. Er zerfließt im Laufe des Versuchs. Gleiches gilt für den Maoam. Er zerfließt jedoch langsamer und die Blasen, die sich bilden, sind braun. Zartbitterschokolade und Vollmilchschokolade bilden ebenfalls Blasen. Sie verändern sich rein äußerlich kaum, doch am Ende des Versuchs sind sie ganz weich und von unten etwas verbrannt. Beim Salz ist keine Veränderung zu beobachten. Abb. 5 Versuchsaufbau V3: Aufbau zum Erhitzen der Proben Abb. 6 Beobachtung V3: Proben zu Beginn des Versuchs Abb. 7 Beobachtung V3: Ergebnis nach 7 Minuten über den Flammen Deutung: Alle Stoffe bis auf Salz schmelzen über der Kerzenflamme. Demnach haben alle Stoffe außer Salz eine niedrigere Schmelztemperatur als die Temperatur der Flamme. Die Stoffe, die zuerst schmelzen, haben die niedrigste Schmelztemperatur. Die Stoffe, die als letztes schmelzen, haben die höchste
11 Schmelztemperatur von den Stoffen. Die ungefähre Reihenfolge der Schmelztemperaturen ist also Butter, Margarine < Käse < Wachs. Zartbitter- und Kinderschokolade sind schwierig einzuordnen, weil sie ihre Form kaum verändern. Die Kinderschokolade hat jedoch eine niedrigere Schmelztemperatur, denn hier bilden sich früher und mehr Gasblasen. Entsorgung: Hausmüll Literatur: - Unterrichtsanschlüsse: Bei diesem Versuch beobachten die SuS, dass unterschiedliche Stoffe bei gleichen Erhitzungsbedingungen verschieden schnell schmelzen. Daraus können sie lernen, dass jeder Stoff eine bestimmte, charakteristische Schmelztemperatur hat, bzw. im Fall von Stoffgemischen wie Schokolade und Butter einen charakteristischen Schmelzbereich. An diesen qualitativen Versuch können gut die beiden folgenden quantitativen Schülerexperimente angeschlossen werden, bei denen die Schmelz- und Siedetemperaturen einiger Stoffe gemessen werden. 4.2 V 4 Schmelzpunktbestimmung von Glycerin Bei diesem Versuch wird die Schmelztemperatur von Glycerin ermittelt. Dazu wird in regelmäßigen Abständen die Temperatur notiert, während das zuvor im Eisschrank abgekühlte Glycerin sich durch die Raumtemperatur erwärmt. Bei diesem Versuch kann auch das Erstellen und Interpretieren von Temperatur-Zeit- Diagrammen eingeübt werden. Gefahrenstoffe Glycerin H: - P: - Materialien: Chemikalien: Duranglas, Thermometer, Stoppuhr Glycerin
12 Durchführung: Beobachtung: Das Glycerin wird in ein Duranglas gegossen, sodass dieses zu ca. 10 cm mit der Flüssigkeit gefüllt ist. Das Duranglas wird mit einem Stopfen verschlossen und in eine Gefriertruhe gestellt, bis es erstarrt ist. Nun wird der Stopfen abgenommen und mit einem Thermometer alle 60 Sekunden die Temperatur des Glycerins gemessen, bis eine Temperatur von ca. 25 C erreicht ist. Glycerin ist bei Raumtemperatur eine leicht gelbliche, transparente, dickflüssige Flüssigkeit. Nach dem Abkühlen ist das Glycerin zähflüssig und trüb. Temperatur [ C] Schmelztemperatur von Glycerin Zeit [min] Abb. 8 - Temperatur-Zeit-Diagamm für den Schmelzvorgang von Glycerin Abb. 9 Versuchsaufbau V 4 Deutung: Das Glycerin wird wärmer, weil die Raumtemperatur es erhitzt. Bei 18 C bleibt die Temperatur für 2 Minuten stabil, weil hier der Aggregatzustand von Glycerin von fest nach flüssig wechselt. Die Teilchen rücken auseinan-
13 der. Die Schmelztemperatur von Glycerin ist 18 C. Ab einer Temperatur von 18 C lässt sich das Thermometer leichter bewegen. Literatur: - Entsorgung: Glycerin: Abwasser, mit viel Wasser nachspülen. Unterrichtsanschlüsse: Dieser Versuch ist experimentell nicht schwierig, doch er ist fachlich anspruchsvoll. Bei der Deutung muss auf das bei den Aggregatzuständen eingeführte Teilchenmodell verwiesen werden, um zu erklären, warum die Temperatur beim Schmelzpunkt eine Weile stabil bleibt. Falls das Teilchenmodell noch nicht eingeführt wurde, muss als Erklärung genügen, dass der Wechsel zwischen Aggregatzuständen Energie erfordert. Auch das Zeichnen des Graphens ist für eine sechste Klasse noch keine Routine. Dieser Versuch eignet sich gut dazu, diese Technik einzuführen bzw. zu wiederholen. 4.3 V 5 Siedetemperaturen von Wasser und Ethanol In diesem Versuch werden Wasser und Ethanol im Ölbad bis zum Sieden erhitzt. Am Siedepunkt werden die Temperaturen der Stoffe gemessen. Vorwissen über die Aggregatzustände und das Teilchenmodell zu ihrer Erklärung müssen vorhanden sein. Gefahrenstoffe Ethanol H: 225 P: 210 Wasser - - Sicherheitshinweis: Der Umgang mit dem Ölbad muss eingeübt sein. Es darf kein Wasser in das Ölbad gelangen, sonst gibt es Fettspritzer. Das Öl darf nicht zu stark erhitzt werden. Materialien: Chemikalien: Ölbad, 2 Reagenzgläser, Heizplatte, 2 Thermometer, Stativ, 2 Stativklemmen, Rührfisch, Siedesteinchen. Ethanol, Wasser.
14 Durchführung: Beobachtung: Ein Reagenzglas wird 3 cm hoch mit Wasser, das andere 3 cm hoch mit Ethanol befüllt. Zusätzlich werden in beide Reagenzgläser 1-2 Siedesteinchen gegeben, um eventuellen Siedeverzug zu vermeiden. Die Reagenzgläser werden in das Ölbad getaucht und in jedes ein Thermometer gestellt. Nun wird das Ölbad angestellt (250 C). Am Siedepunkt werden die Temperaturen der Flüssigkeiten abgelesen. Anmerkung: Da besonders das Wasser lange braucht, um zu sieden, sollten die Flüssigkeiten auf ca. 60 (Ethanol) und 80 C (Wasser) vorgewärmt werden. Beim Ethanol steigen bei 78 C Gasblasen auf, bei Wasser erst bei 100 C. Die Temperatur steigt nicht weiter, obwohl weiter erhitzt wird. Abb Versuchsaufbau V 5 Deutung: Ethanol und Wasser haben unterschiedliche Siedetemperaturen. Die Siedetemperatur von Ethanol liegt bei 78 C, die von Wasser bei 100 C. Die Temperatur steigt trotz weiterer Wärmezufuhr nicht an, da die Flüssigkeit nicht heißer werden kann als ihre Siedetemperatur. Nur als Gas kann die Substanz noch heißer werden.
15 Literatur: Wiechoczek, Dagmar, (Zuletzt abgerufen am , 22:40Uhr). Die Versuchsanleitung wurde jedoch modifiziert. Unterrichtsanschlüsse Anhand dieses Versuches kann gezeigt werden, dass Stoffe nicht nur unterschiedliche Schmelztemperaturen, sondern auch unterschiedliche Siedetemperaturen besitzen. Dies ist in diesem Fall besonders erstaunlich, weil beide Proben farblose, klare Flüssigkeiten sind. Eine Fragestellung, die an den Anfang der Stunde gestellt werden könnte, lautet: Wie kann ich diese beiden Flüssigkeiten unterscheiden, ohne daran zu riechen? (Die Geschmacksprobe ist im Labor ja von vorneherein ausgeschlossen.) Wenn die Heizplatten zu schwach sind oder kein Ölbad vorhanden ist, kann das Wasser stattdessen über dem Gasbrenner und das Ethanol in einem Wasserbad erhitzt werden. Ethanol sollte aber in keinem Fall direkt über dem Gasbrenner erhitzt werden (Brandgefahr!).
16 Siede- und Schmelztemperaturen 1. Erkläre noch einmal in eigenen Worten, warum flüssiges Ethanol nicht heißer als 78 C und Wasser nicht heißer als 100 C wird. Du kannst auch eine passende Zeichnung anfertigen, wenn sie dir beim Erklären hilft. Wenn du nicht weiter weißt, kannst du auf S.74 im Buch nachlesen. 2. Warum haben wir das Ethanol und das Wasser in einem Ölbad und nicht in einem Wasserbad erhitzt? Erkläre! Hinweis: Das Öl hat einen Siedepunkt von über 300 C. 3. a) Woodsches Metall hat einen Schmelzpunkt von 60 C, der von Stahl liegt bei 1500 C. Nenne mindestens 5 Dinge, für die man Stahl verwenden kann, Woodsches Metall aber nicht. Begründe deine Auswahl. b) Fällt dir etwas ein, wofür man Woodsches Metall verwenden kann, Stahl aber nicht? Begründe deine Antwort(en). Nimm an, Woodsches Metall sei nicht giftig.
17 16 5 Reflexion des Arbeitsblattes Das Arbeitsblatt kann als Ergänzung zu Versuch 5 eingesetzt werden, am besten, wenn Versuch 2 bereits durchgeführt wurde. Aufgabe 1 und 2 greifen wichtige Aspekte aus dem Versuch auf. Aufgabe 3 soll die Kinder dazu anregen, über Anwendungsgebiete zweier Legierungen nachzudenken, die sich in ihrer Schmelztemperatur unterscheiden. 5.1 Erwartungshorizont (Kerncurriculum) Basiskonzept Stoff-Teilchen Fachwissen Stoffeigenschaften bestimmen ihre Verwendung Die Schülerinnen und Schüler... schließen aus den Eigenschaften ausgewählter Stoffe auf ihre Verwendungsmöglichkeiten. (Aufgabe 2 und 3) Bewertung Stoffeigenschaften bewerten Die Schülerinnen und Schüler... unterscheiden förderliche von hinderlichen Eigenschaften für die bestimmte Verwendung eines Stoffes. (Aufgabe 3) Basiskonzept Energie Fachwissen Stoffe kommen in verschiedenen Aggregatzuständen vor Die Schülerinnen und Schüler... beschreiben, dass der Aggregatzustand eines Stoffes von der Temperatur abhängt. (Anders herum in Aufgabe 1) Bewertung Chemische Sachverhalte in der Lebenswelt erkennen Die Schülerinnen und Schüler... erkennen Aggregatzustandsänderungen in ihrer Umgebung. (Aufgabe 3) 5.2 Erwartungshorizont (Inhaltlich) 1. Flüssiges Ethanol siedet bei 78 C, Wasser siedet bei 100 C. Wenn die Stoffe heißer werden, treten sie in den gasförmigen Zustand über. Die Flüssigkeiten können also nicht heißer werden als 78 C bzw. 100 C, denn das noch heißere Gas, das entsteht, steigt nach oben. (Möglich: Zeichnung der Aggregatzustände im Teilchenmodell mit Temperaturangaben) 2. Wasser hat einen Siedepunkt von 100 C, das Öl hat einen Siedepunkt von über 300 C. Wenn die Reagenzgläser im Wasserbad erhitzt werden würden, würde bei einer Temperatur von maximal 100 C erhitzt. (sh. Aufgabe 1). Dies dauert viel länger, als die Proben in einem Ölbad zu erhitzen, was sehr viel heißer ist. Außerdem würde das Wasserbad bei 100 C sieden, es würden sich also Gasblasen bilden. So könnten die Flüssigkeiten in den Reagenzgläsern nicht so gut beobachtet werden. 3. a) Anwendungsmöglichkeiten von Stahl:
18 17 o Man kann ihn als Räder für Züge verwenden, Woodsches Metall aber nicht, denn: wenn der Zug schnell fährt, werden die Räder heiß und Woodsches Metall würde schmelzen. o Topf Woodsches Metall würde auf dem Herd schmelzen o Hausbau Man kann Stahl in Hauswänden benutzen, um sie zu stabilisieren. Wenn es brennt, bleibt das Haus mit Stahl stehen. Würde Woodsches Metall verwendet, würde das Haus in sich zusammen brechen. o Ofen in der Sauna Ein Ofen aus Woodschem Metall würde schmelzen. o Grill Ein Stahlgrill grillt wunderbar; ein Grill aus Woodschem Metall wäre nur nützlich, wenn man eine Diät macht. b) Anwendungsmöglichkeiten für Woodsches Metall o Als Scherzartikel, z.b. ein falscher Löffel Bei dieser Aufgabe wird erwartet, dass die SuS sinnvolle Anwendungen für die Legierungen finden und schlüssig begründen können, warum die eine Legierung sich eignet, die andere hingegen nicht.
Temperaturabhängigkeit, Schmelzund Siedetemperatur
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit, Schmelzund Siedetemperatur Kurzprotokoll Auf einen Blick: Im Folgenden
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit, Schmelzund Siedetemperatur Kurzprotokoll Auf einen Blick: Im Folgenden
Temperaturabhängigkeit, Schmelz- und Siedetemperatur
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit, Schmelz- und Siedetemperatur Auf einen 1 Beschreibung Blick: des Themas
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit, Schmelz- und Siedetemperatur Auf einen 1 Beschreibung Blick: des Themas
Aggregatzustände und deren Temperaturabhängigkeit
 Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Name: Sissy Freund Semester: Sommersemester 2013 Klassenstufen: 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit Beschreibung des Themas und zugehörige Lernziele 2 Auf einen Blick: Dieses Protokoll
Schulversuchspraktikum. Isabel Böselt. Sommersemester Klassenstufen 5 & 6. Aggregatzustände. und deren Temperaturabhängigkeit
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 5 & 6 Aggregatzustände und deren Temperaturabhängigkeit 1 Konzept und Lernziele 1 Auf einen Blick: In diesem Protokoll werden einfache
Umweltschutz und Recycling
 Schulversuchspraktikum Hendrik Schöneich Sommersemester 2017 Klassenstufen 5/6 Umweltschutz und Recycling Kurzprotokoll Auf einen Blick: In diesem Protokoll werden drei Versuche zum Thema Recycling vorgestellt.
Schulversuchspraktikum Hendrik Schöneich Sommersemester 2017 Klassenstufen 5/6 Umweltschutz und Recycling Kurzprotokoll Auf einen Blick: In diesem Protokoll werden drei Versuche zum Thema Recycling vorgestellt.
Schulversuchspraktikum. Name Thomas Polle. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum Name Thomas Polle Sommersemester 2015 Klassenstufen 5 & 6 Feuer und Kerzen 2 Auf einen Blick: Es werden je ein Schüler- und Lehrerversuch zum Thema Kerzen und Feuer für den 5. und
Schulversuchspraktikum. Sommersemester Klassenstufen 5 & 6. Feuer und Kerzen
 Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Schulversuchspraktikum Sommersemester 2013 Klassenstufen 5 & 6 Feuer und Kerzen Text zuzuweisen, der hier Fehler! Verwenden Sie 2 Auf einen Blick: In diesem Protokoll werden sechs Versuche dargestellt,
Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser?
 http://www.kostenloseausmalbilder.de/media/.gallery/main606.jpg (02.08.2015) Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser? Pip, die kleine Maus, benötigt zum Atmen Luft, vor allem den Sauerstoff,
http://www.kostenloseausmalbilder.de/media/.gallery/main606.jpg (02.08.2015) Arbeitsblatt Pip und Lucky: Was atmen Tiere im Wasser? Pip, die kleine Maus, benötigt zum Atmen Luft, vor allem den Sauerstoff,
Umwelt und Recycling
 Schulversuchspraktikum Anonym_16 Sommersemester 2016 Klassenstufen 5 & 6 Umwelt und Recycling Kurzprotokoll Auf einen Blick: Versuch 1 und 2 behandeln die Problematik der Meeresverschmutzung mit Ölen.
Schulversuchspraktikum Anonym_16 Sommersemester 2016 Klassenstufen 5 & 6 Umwelt und Recycling Kurzprotokoll Auf einen Blick: Versuch 1 und 2 behandeln die Problematik der Meeresverschmutzung mit Ölen.
Schulversuchspraktikum. Constanze Koch. Sommersemester Klassenstufen 5 & 6. Wasser als Lösungsmittel. Kurzprotokoll
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel Kurzprotokoll Auf einen Blick: In diesem Protokoll werden ein Lehrerversuch und vier Schülerversuche
Aggregatszustände und deren Temperaturabhängigkeit
 Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 5/6 Aggregatszustände und deren Temperaturabhängigkeit 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf
Schulversuchspraktikum Name: Christoph Biesemann Semester: Sommersemester 2012 Klassenstufe 5/6 Aggregatszustände und deren Temperaturabhängigkeit 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf
prozessbezogene Kompetenzen E = Erkenntnisgewinnung K = Kommunikation B = Bewertung beachten Sicherheitsaspekte (E)
 Helene-Lange-Schule Hannover Fachcurriculum Chemie Jahrgang 5+6 Unterrichtsinhalte und inhaltsbezogene Kompetenzen (Die Schülerinnen und Schüler...) Klasse 5 prozessbezogene Kompetenzen E = Erkenntnisgewinnung
Helene-Lange-Schule Hannover Fachcurriculum Chemie Jahrgang 5+6 Unterrichtsinhalte und inhaltsbezogene Kompetenzen (Die Schülerinnen und Schüler...) Klasse 5 prozessbezogene Kompetenzen E = Erkenntnisgewinnung
Merkmale einer chemischen Reaktion
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale einer chemischen Reaktion 1 Auf Beschreibung einen Blick: des Themas und zugehörige Lernziele Im Folgenden werden
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale einer chemischen Reaktion 1 Auf Beschreibung einen Blick: des Themas und zugehörige Lernziele Im Folgenden werden
Saure, neutrale und alkalische Lösungen
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 5 & 6 Saure, neutrale und alkalische Lösungen Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 5 und 6 einen Lehrerversuch
Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden?
 Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden? Beschrifte die Kästchen mit je einem Aggregatzustand. Benenne die Nummern, es handelt sich dabei um Fachbegriffe für die Übergänge
Arbeitsblatt Sollte eine Wasserflasche aus Glas im Gefrierfach gekühlt werden? Beschrifte die Kästchen mit je einem Aggregatzustand. Benenne die Nummern, es handelt sich dabei um Fachbegriffe für die Übergänge
Arbeitsblatt zum Thema Einfache Messinstrumente
 Arbeitsblatt zum Thema Einfache Messinstrumente Das Flüssigkeitsthermometer dient zur Messung der Temperatur, welche in der Einheit Grad Celsius gemessen wird. Materialien: Chemikalien: Heizplatte, Stativ,
Arbeitsblatt zum Thema Einfache Messinstrumente Das Flüssigkeitsthermometer dient zur Messung der Temperatur, welche in der Einheit Grad Celsius gemessen wird. Materialien: Chemikalien: Heizplatte, Stativ,
Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften
 Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften Vorbereitungen: Benötigte Materialien sind entsprechend der Anzahl an Gruppen für die Teams bereitzustellen. -Aufgabenstellung und Hinweise
Aufgabe: Unterscheidung von Stoffen anhand von Eigenschaften Vorbereitungen: Benötigte Materialien sind entsprechend der Anzahl an Gruppen für die Teams bereitzustellen. -Aufgabenstellung und Hinweise
Endotherm und Exotherm
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 7 & 8 Endotherm und Exotherm Kurzprotokoll Auf einen Blick: Das Protokoll enthält für die Klassen 7 und 8 einen Lehrerversuch und einen
Wasser als Lösungsmittel
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Versuche zum Thema Wasser
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 5 & 6 Wasser als Lösungsmittel 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die Versuche zum Thema Wasser
Untersuche die ausgegebenen Stoffe auf Brennbarkeit und Schmelztemperatur.
 Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt: 07.2.205 :7:33 intertess (Version
Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt: 07.2.205 :7:33 intertess (Version
Energie und Energieumwandlung
 Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Schulversuchspraktikum Maximilian Wolf Sommersemester Klassenstufen 7 & 8 Energie und Energieumwandlung Kurzprotokoll Auf einen Blick: In Versuch 1 werden Lycopodium-Sporen (Bärlapp) in der Gasbrennerflamme
Untersuche die ausgegebenen Stoffe auf Brennbarkeit und Schmelztemperatur.
 Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt:.0.203 2:44:57 intertess (Version 3.06
Naturwissenschaften - Chemie - Allgemeine Chemie - Stoffeigenschaften (P750200).2 Stoffeigenschaften - Brennbarkeit, Schmelztemperatur Experiment von: Phywe Gedruckt:.0.203 2:44:57 intertess (Version 3.06
Unterrichtskonzept zum Themenbereich Wasser (NT 5.1.2)
 Staatsinstitut für Schulqualität und Bildungsforschung Unterrichtskonzept zum Themenbereich Wasser (NT 5.1.2) Lehrplanbezug Beim Themenbereich Wasser sollen die Schülerinnen und Schüler die drei Aggregatzustände
Staatsinstitut für Schulqualität und Bildungsforschung Unterrichtskonzept zum Themenbereich Wasser (NT 5.1.2) Lehrplanbezug Beim Themenbereich Wasser sollen die Schülerinnen und Schüler die drei Aggregatzustände
Merkmale chemischer Reaktionen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 7 & 8 Merkmale chemischer Reaktionen Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Merkmale einer
Nährstoffe und Nahrungsmittel
 1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
1 Weitere Lehrerversuche Schulversuchspraktikum Annika Nüsse Sommersemester 2016 Klassenstufen 5 & 6 Nährstoffe und Nahrungsmittel Kurzprotokoll 1 Weitere Lehrerversuche Auf einen Blick: Der Lehrerversuch
Schmelz- und Siedetemperatur
 Schulversuchspraktikum Name: Bastian Engelke Semester: Sommersemester 2012 Klassenstufen 5 & 6 Schmelz- und Siedetemperatur 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Das vorgestellte
Schulversuchspraktikum Name: Bastian Engelke Semester: Sommersemester 2012 Klassenstufen 5 & 6 Schmelz- und Siedetemperatur 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Das vorgestellte
Schulversuchspraktikum. Ansgar Misch. Sommersemester Klassenstufen 7 & 8. Stickstoff. Kurzprotokoll
 Schulversuchspraktikum Ansgar Misch Sommersemester 2016 Klassenstufen 7 & 8 Stickstoff Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll zum Thema Stickstoff enthält weitere Versuche, die die Eigenschaften
Schulversuchspraktikum Ansgar Misch Sommersemester 2016 Klassenstufen 7 & 8 Stickstoff Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll zum Thema Stickstoff enthält weitere Versuche, die die Eigenschaften
Versuch 1. Baue ein Thermometer. Nun erwärme das Wasser im Erlenmeyerkolben auf einem Stövchen. Was geschieht?
 Versuch 1 Nun erwärme das Wasser im Erlenmeyerkolben auf einem Stövchen. Was geschieht? Baue ein Thermometer Fülle den Erlenmeyerkolben mit Wasser und verschließe ihn mit dem Stopfen. Im Stopfen befindet
Versuch 1 Nun erwärme das Wasser im Erlenmeyerkolben auf einem Stövchen. Was geschieht? Baue ein Thermometer Fülle den Erlenmeyerkolben mit Wasser und verschließe ihn mit dem Stopfen. Im Stopfen befindet
Brennbarkeit und Löslichkeit
 Schulversuchspraktikum Theresa Beck Sommersemester 2017 Klassenstufen 5 & 6 Brennbarkeit und Löslichkeit Kurzprotokoll Auf einen Blick: Dieses Protokoll beschäftigt sich mit den Eigenschaften Brennbarkeit
Schulversuchspraktikum Theresa Beck Sommersemester 2017 Klassenstufen 5 & 6 Brennbarkeit und Löslichkeit Kurzprotokoll Auf einen Blick: Dieses Protokoll beschäftigt sich mit den Eigenschaften Brennbarkeit
Alles was uns umgibt!
 Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Was ist Chemie? Womit befasst sich die Chemie? Die Chemie ist eine Naturwissenschaft, die sich mit der Materie (den Stoffen), ihren Eigenschaften und deren Umwandlung befasst Was ist Chemie? Was ist Materie?
Wir untersuchen Mineralwasser
 Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Wir untersuchen Mineralwasser Jeder von uns kennt es: Mineralwasser. Im Geschäft wird es mit viel, wenig oder gar keiner Kohlensäure angeboten. Kohlensäure beschreibt die Form, in der das Gas Kohlenstoffdioxid
Schmelz- und Erstarrungskurve von watriumthiosulfat
 Lehrer-/Dozentenblatt Schmelz- und Erstarrungskurve von watriumthiosulfat (Artikelnr.: P044600) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-0 Lehrplanthema: Wärmelehre Unterthema:
Lehrer-/Dozentenblatt Schmelz- und Erstarrungskurve von watriumthiosulfat (Artikelnr.: P044600) Curriculare Themenzuordnung Fachgebiet: Physik Bildungsstufe: Klasse 7-0 Lehrplanthema: Wärmelehre Unterthema:
Schulversuchspraktikum. Isabelle Faltiska. Sommersemester Klassenstufen 11 & 12. Quantitative Analyse von. Kohlenwasserstoffen
 Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Im Folgenden
Schulversuchspraktikum Isabelle Faltiska Sommersemester 2015 Klassenstufen 11 & 12 Quantitative Analyse von Kohlenwasserstoffen 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Im Folgenden
Schmelz- und Siedetemperaturen
 Schmelz- und Siedetemperaturen 1) Schmelztemperatur einiger fester Stoffe und Siedetemperatur von Wasser: Chemikalien: Geräte: Stearinsäure (=Octadecansäure), Fixiersalz (=Natriumthiosulfat-pentahydrat),
Schmelz- und Siedetemperaturen 1) Schmelztemperatur einiger fester Stoffe und Siedetemperatur von Wasser: Chemikalien: Geräte: Stearinsäure (=Octadecansäure), Fixiersalz (=Natriumthiosulfat-pentahydrat),
Reinstoffe und Stoffgemische, Verfahren zur Stofftrennung
 Schulversuchspraktikum Name: Jana Pfefferle Semester: SoSe 2014 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische, Verfahren zur Stofftrennung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen
Schulversuchspraktikum Name: Jana Pfefferle Semester: SoSe 2014 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische, Verfahren zur Stofftrennung 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen
Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen. Kurzprotokoll. Schulversuchspraktikum.
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 7 & 8 Chemische Gesetzmäßigkeiten I Erhaltung der Masse und konstante Proportionen Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll
Die hier im pdf-format dargestellten Musterblätter sind geschützt und können weder bearbeitet noch kopiert werden.
 Die hier im pdf-format dargestellten Musterblätter sind geschützt und können weder bearbeitet noch kopiert werden. Inhalt Themengebiet Beschreibung Millimeterpapier-Vorlage Versuch zum Temperaturverlauf
Die hier im pdf-format dargestellten Musterblätter sind geschützt und können weder bearbeitet noch kopiert werden. Inhalt Themengebiet Beschreibung Millimeterpapier-Vorlage Versuch zum Temperaturverlauf
Warum korrodiert Eisen?
 Warum korrodiert Eisen? Korrodiertes Eisen bzw. Rost findet sich überall. An Brücken, Autos, an unseren Fahrrädern und an altem Werkzeug. Es richtet in Deutschland jährlich Schäden im Wert von 100 Millionen
Warum korrodiert Eisen? Korrodiertes Eisen bzw. Rost findet sich überall. An Brücken, Autos, an unseren Fahrrädern und an altem Werkzeug. Es richtet in Deutschland jährlich Schäden im Wert von 100 Millionen
Schulversuchspraktikum. Jans Manjali. Sommersemester Klassenstufen 7 & 8. Kohlenstoffdioxid. Kurzprotokoll
 Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 7 & 8 Kohlenstoffdioxid Kurzprotokoll Auf einen Blick: In diesem Protokoll werden bestimmte Eigenschaften des Kohlenstoffdioxids näher
Schulversuchspraktikum Jans Manjali Sommersemester 2015 Klassenstufen 7 & 8 Kohlenstoffdioxid Kurzprotokoll Auf einen Blick: In diesem Protokoll werden bestimmte Eigenschaften des Kohlenstoffdioxids näher
Eine Reaktion mit Kupfer und Schwefel
 Eine Reaktion mit Kupfer und Schwefel Materialien: Chemikalien: Duranglas, Stativstange mit Stativklemme, Gasbrenner Schwefelpulver, Kupferblech Durchführung: Fülle vorsichtig ca. 1cm breit Schwefelpulver
Eine Reaktion mit Kupfer und Schwefel Materialien: Chemikalien: Duranglas, Stativstange mit Stativklemme, Gasbrenner Schwefelpulver, Kupferblech Durchführung: Fülle vorsichtig ca. 1cm breit Schwefelpulver
Erscheinungsformen und Eigenschaften des Wassers
 Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 5 & 6 Erscheinungsformen und Eigenschaften des Wassers 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In
Schulversuchspraktikum Isabel Großhennig Sommersemester 2015 Klassenstufen 5 & 6 Erscheinungsformen und Eigenschaften des Wassers 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In
Reinstoffe und Stoffgemische
 Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Auf einen Blick: Dieses Versuchsprotokoll enthält zwei Lehrer- und vier SchülerInnenexperimente
Schulversuchspraktikum Dörte Hartje Sommersemester 2013 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Auf einen Blick: Dieses Versuchsprotokoll enthält zwei Lehrer- und vier SchülerInnenexperimente
Verfahren zur Stofftrennung
 Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Verfahren zur Stofftrennung Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll enthält
Schulversuchspraktikum Marie-Lena Gallikowski Sommersemester 2015 Klassenstufen 5 & 6 Reinstoffe und Stoffgemische Verfahren zur Stofftrennung Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll enthält
Illustrierende Aufgaben zum LehrplanPLUS
 Was passiert, wenn s heiß wird? - Wir untersuchen Stoffe Jahrgangsstufen 1/2 Stand: 13.12.2015 Fach Zeitrahmen Benötigtes Material Heimat- und Sachunterricht 4 Unterrichtseinheiten Papier für Zeichnungen
Was passiert, wenn s heiß wird? - Wir untersuchen Stoffe Jahrgangsstufen 1/2 Stand: 13.12.2015 Fach Zeitrahmen Benötigtes Material Heimat- und Sachunterricht 4 Unterrichtseinheiten Papier für Zeichnungen
1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat
 1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat Geräte/Chemikalien: Mörser mit Pistill, feuerfeste Unterlage, Zucker, Kaliumnitrat, Zünder: Kaliumpermanganat
1. Chemie ist da wo es stinkt und kracht Die chemische Reaktion zwischen Zucker und Kaliumnitrat Geräte/Chemikalien: Mörser mit Pistill, feuerfeste Unterlage, Zucker, Kaliumnitrat, Zünder: Kaliumpermanganat
Fluoreszierende Verbindungen
 Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
Thema: Fluoreszierende Verbindungen Klasse 11 / 12 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 11 & 12 Fluoreszierende Verbindungen Thema: Fluoreszierende Verbindungen Klasse
Schulversuchspraktikum. Marc Ehlers. Sommersemester Klassenstufen 7 & 8. Sauerstoff. Kurzprotokoll
 Schulversuchspraktikum Marc Ehlers Sommersemester 2016 Klassenstufen 7 & 8 Sauerstoff Kurzprotokoll Auf einen Blick: In diesem Protokoll werden weitere Versuche zum Thema Sauerstoff als Bestandteil der
Schulversuchspraktikum Marc Ehlers Sommersemester 2016 Klassenstufen 7 & 8 Sauerstoff Kurzprotokoll Auf einen Blick: In diesem Protokoll werden weitere Versuche zum Thema Sauerstoff als Bestandteil der
Jeder Gegenstand Stoff Jeder Stoff Eigenschaften
 Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Stoffe Jeder Gegenstand der Welt, die euch umgibt, besteht aus einem chemischen Stoff. Jeder Stoff hat ganz spezielle Eigenschaften, die bestimmen, wie er verwendet wird. Die Chemie hat die Aufgabe die
Teilchenmodell, Brown sche Molekularbewegung
 Schulversuchspraktikum Stefan Krüger SoSe 2014 Klassenstufen 7/8 Teilchenmodell, Brown sche Molekularbewegung und Diffusion 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses
Schulversuchspraktikum Stefan Krüger SoSe 2014 Klassenstufen 7/8 Teilchenmodell, Brown sche Molekularbewegung und Diffusion 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses
Schulversuchspraktikum. Olga Streck. Sommersemester Klassenstufen 5 & 6. Papier
 Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 5 & 6 Papier 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Lehrerversuche und 2 Schülerversuche zum Thema
Schulversuchspraktikum Olga Streck Sommersemester 2012 Klassenstufen 5 & 6 Papier 2 Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 enthält 2 Lehrerversuche und 2 Schülerversuche zum Thema
Merkmale Chemischer Reaktionen (qualitativ)
 Schulversuchspraktikum Carolin Schilling Sommersemester 2016 Klassenstufen 7&8 Merkmale Chemischer Reaktionen (qualitativ) Kurzprotokoll Auf einen Blick: Die beiden Schülerexperimente dieses Kurzprotokolls
Schulversuchspraktikum Carolin Schilling Sommersemester 2016 Klassenstufen 7&8 Merkmale Chemischer Reaktionen (qualitativ) Kurzprotokoll Auf einen Blick: Die beiden Schülerexperimente dieses Kurzprotokolls
Untersuche die Kerzenflamme sowie die Vorgänge, die beim Verbrennen des Kerzenwachses ablaufen.
 Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P7154200) 2.10 Die Kerzenflamme Experiment von: Seb Gedruckt: 24.03.2014 11:14:37 intertess (Version 13.12 B214, Export 2000)
Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P7154200) 2.10 Die Kerzenflamme Experiment von: Seb Gedruckt: 24.03.2014 11:14:37 intertess (Version 13.12 B214, Export 2000)
Sonne wärmt A Papier. 1 Metall. 4 Holz
 Sonne wärmt A 20 An einem schönen sonnigen Tag treffen die Strahlen der Sonne auf Platten aus unterschiedlichen Materialien, die im Hof gelagert sind. 1 Metall 2 Papier 3 Mamor 4 Holz a) Ordne die Platten
Sonne wärmt A 20 An einem schönen sonnigen Tag treffen die Strahlen der Sonne auf Platten aus unterschiedlichen Materialien, die im Hof gelagert sind. 1 Metall 2 Papier 3 Mamor 4 Holz a) Ordne die Platten
1 Weitere Schülerversuche. Schulversuchspraktikum. Moritz Pemberneck. Sommersemester Klassenstufen 5 & 6. Thema.
 Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 5 & 6 Thema Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Licht und Farben vorgestellt. Aufgrund
Schulversuchspraktikum Moritz Pemberneck Sommersemester 2016 Klassenstufen 5 & 6 Thema Kurzprotokoll Auf einen Blick: Im Folgenden werden weitere Versuche zum Thema Licht und Farben vorgestellt. Aufgrund
Von Arrhenius zu Brönsted
 Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Schulversuchspraktikum Name Annika Münch Sommersemester 2015 Klassenstufen 9/10 Von Arrhenius zu Brönsted Kurzprotokoll Auf einen Blick: Für die Unterrichtseinheit zum Themas Säure-Base-Konzepte und im
Reaktionen von Metallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: Die
V 1 Herstellung von Natriumchlorid
 1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
Säuren und Basen im Haushalt
 Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 9 & 10 Säuren und Basen im Haushalt Kurzprotokoll Auf einen Blick: Die Unterrichtseinheit,,Säuren und Basen im Haushalt für die
Schulversuchspraktikum Lars Lichtenberg Sommersemester 2015 Klassenstufen 9 & 10 Säuren und Basen im Haushalt Kurzprotokoll Auf einen Blick: Die Unterrichtseinheit,,Säuren und Basen im Haushalt für die
Unterrichtsentwurf. Thema: Lösungsvorgänge. Titel der Unterrichtssequenz: "Salz trifft Eis"
 Unterrichtsentwurf Thema: Lösungsvorgänge Titel der Unterrichtssequenz: "Salz trifft Eis" Lerngruppe: Schülerinnen und Schüler der 5./6. Jahrgangsstufe (Sekundarstufe I) Zeitrahmen: 90 Inhalt: Aggregatzustände
Unterrichtsentwurf Thema: Lösungsvorgänge Titel der Unterrichtssequenz: "Salz trifft Eis" Lerngruppe: Schülerinnen und Schüler der 5./6. Jahrgangsstufe (Sekundarstufe I) Zeitrahmen: 90 Inhalt: Aggregatzustände
erweiterter Redoxbegriff
 Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 7 & 8 erweiterter Redoxbegriff 2 Auf einen Blick: Der erweiterte Redoxbegriff beschreibt die Redoxreaktion als Elektronenübertragungsreaktion,
Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 7 & 8 erweiterter Redoxbegriff 2 Auf einen Blick: Der erweiterte Redoxbegriff beschreibt die Redoxreaktion als Elektronenübertragungsreaktion,
Brennbarkeit und Löslichkeit
 Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 5 & 6 Brennbarkeit und Löslichkeit 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beschäftigt
Schulversuchspraktikum Till Beuermann Sommersemester 2013 Klassenstufen 5 & 6 Brennbarkeit und Löslichkeit 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beschäftigt
Arbeitsblatt Bestimmung der Reaktionsgeschwindigkeit
 Arbeitsblatt Bestimmung der Reaktionsgeschwindigkeit Aufgabe 1: Definieren Sie die folgenden Begriffe: a)reaktionsgeschwindigkeit:. b) Reaktionsordnung: :. Aufgabe 2: Nennen Sie mindestens zwei Beispiele
Arbeitsblatt Bestimmung der Reaktionsgeschwindigkeit Aufgabe 1: Definieren Sie die folgenden Begriffe: a)reaktionsgeschwindigkeit:. b) Reaktionsordnung: :. Aufgabe 2: Nennen Sie mindestens zwei Beispiele
Dichte und Nachweis von Kohlenstoffdioxid
 Schulversuchspraktikum Name: Lydia Reinhardt Semester: Sommersemester 2014 Klassenstufen 7 & 8 Dichte und Nachweis von Kohlenstoffdioxid 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Name: Lydia Reinhardt Semester: Sommersemester 2014 Klassenstufen 7 & 8 Dichte und Nachweis von Kohlenstoffdioxid 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schwierigkeitsgrad Vorbereitungszeit Durchführungszeit Empfohlene Gruppengröße. {time:2} 20 Minuten. Versuchsvarianten:
 Lehrer-/Dozentenblatt Gedruckt: 2.8.27 6::24 P753 Siedetemperatur Lehrerinformationen Einführung Schwierigkeitsgrad Vorbereitungszeit Durchführungszeit Empfohlene Gruppengröße {complexity:3} mittel {time:}
Lehrer-/Dozentenblatt Gedruckt: 2.8.27 6::24 P753 Siedetemperatur Lehrerinformationen Einführung Schwierigkeitsgrad Vorbereitungszeit Durchführungszeit Empfohlene Gruppengröße {complexity:3} mittel {time:}
Schwimmen, Schweben, Sinken
 Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Kurzprotokoll Auf einen Blick: In diesem Kurzprotokoll werden weitere Versuche rund um das Thema
Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Kurzprotokoll Auf einen Blick: In diesem Kurzprotokoll werden weitere Versuche rund um das Thema
Schulversuchspraktikum. Julia Müller. Klassenstufen 5/6. Feuer und Kerzen
 Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Schulversuchspraktikum Name Julia Müller Semester SoSe 2012 Klassenstufen 5/6 Feuer und Kerzen 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Diese Unterrichtseinheit für die Klassenstufen
Thema: Sauerstoff Klasse 7 / 8. Schulversuchspraktikum. Bastian Hollemann. Sommersemester Klassenstufen 7 & 8. Sauerstoff
 Thema: Sauerstoff Klasse 7 / 8 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 7 & 8 Sauerstoff Thema: Sauerstoff Klasse 7 / 8 Auf einen Blick: Diese Unterrichtseinheit für die
Thema: Sauerstoff Klasse 7 / 8 Schulversuchspraktikum Bastian Hollemann Sommersemester 2015 Klassenstufen 7 & 8 Sauerstoff Thema: Sauerstoff Klasse 7 / 8 Auf einen Blick: Diese Unterrichtseinheit für die
Untersuche, ob Wasser gelöste Gase enthält und wovon die Löslichkeit der Gase abhängt.
 Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P754700) 3.3 Löslichkeit von Gasen in Wasser Experiment von: Seb Gedruckt: 24.03.204 :24:34 intertess
Naturwissenschaften - Chemie - Anorganische Chemie - 3 Wasser, Wasserbestandteile und Wasserreinigung (P754700) 3.3 Löslichkeit von Gasen in Wasser Experiment von: Seb Gedruckt: 24.03.204 :24:34 intertess
Qualitativer Nachweis von Säuren und Basen
 Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Schulversuchspraktikum Constanze Koch Sommersemester 2015 Klassenstufen 9 & 10 Qualitativer Nachweis von Säuren und Basen Kurzprotokoll Auf einen Blick: In diesem Protokoll wird ein Lehrerversuch, der
Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer
 Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer chemischen Reaktion? In der letzten Chemiestunde hast du eine Hypothese zu der Frage formuliert: Verändert sich die Masse von
Arbeitsblatt Verändert sich die Masse von Edukten und Produkten während einer chemischen Reaktion? In der letzten Chemiestunde hast du eine Hypothese zu der Frage formuliert: Verändert sich die Masse von
Wie verändern sich die Eigenschaften der Alkohole bei Zunahme der Kohlenstoffzahl?
 Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77200) 4.6 Eigenschaften der homologen Reihe Experiment von: Phywe Gedruckt: 20.07.206 3:58:38 intertess (Version 3.2 B24, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Organische Chemie - 4 Alkohole (P77200) 4.6 Eigenschaften der homologen Reihe Experiment von: Phywe Gedruckt: 20.07.206 3:58:38 intertess (Version 3.2 B24, Export 2000) Aufgabe
Arbeitsblatt Wasserkreislauf der Erde
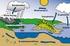 Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
Arbeitsblatt Wasserkreislauf der Erde Aufgabe 1) Du hast im Unterricht bereits den Begriff des Aggregatzustands kennengelernt. Benenne die Übergänge zwischen den Aggregatzuständen, indem du die Pfeile
1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure
 1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure In diesem Versuch soll der Satz von Hess (die umgesetzte Wärmemenge ist bei einer chemischen Reaktion unabhängig vom Weg)
1.1 V 1 Überprüfung des Satzes von Hess mit der Reaktion von Calcium und Salzsäure In diesem Versuch soll der Satz von Hess (die umgesetzte Wärmemenge ist bei einer chemischen Reaktion unabhängig vom Weg)
Wir untersuchen einige Flammen auf ihre Temperatur
 Station 1 Wir untersuchen einige Flammen auf ihre Temperatur Du benötigst den Graphikrechner, das CBL2 und das Thermoelement. Verbinde das Thermoelement mit dem CBL2. Verbinde das CBL2 mit dem Rechner.
Station 1 Wir untersuchen einige Flammen auf ihre Temperatur Du benötigst den Graphikrechner, das CBL2 und das Thermoelement. Verbinde das Thermoelement mit dem CBL2. Verbinde das CBL2 mit dem Rechner.
4.1 Vergleich von physikalischem Vorgang und chemischer Reaktion. Aufgabe. Woran lassen sich chemische Reaktionen erkennen? (1)
 Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
Naturwissenschaften - Chemie - Allgemeine Chemie - 4 Chemische Reaktionen (P75200) 4. Vergleich von physikalischem Vorgang und chemischer Reaktion Experiment von: Phywe Gedruckt:.0.203 2:58:37 intertess
Chemie Fragenkatalog Jahrgang 8
 Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
Chemie Fragenkatalog Jahrgang 8 - Stoffe und ihre Eigenschaften - Stoffgemische und Trennverfahren - Vom Aufbau der Stoffe - Die chemische Reaktion - Luft und Verbrennung - Gewinnung von Metallen Redoxreaktionen
1 Lehrerversuch Alkalimetalle in Wasser
 1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
1 Lehrerversuch Alkalimetalle in Wasser Diese Versuchsreihe kann zum Einstieg in das Thema Alkalimetalle verwendet werden, da kein Vorwissen benötigt wird. Die Versuche sind nur gering aufwändig und können
Schule: Lehrer: Kapitel Titel der Lerneinheit Fachwissen Erkenntnisgewinnung Kommunikation Bewertung im Buch
 Stoffverteilungsplan mit Kompetenzuordnung ISBN: 978-3-12-756331-3 Vorlage für die Erstellung eines Schulcurriculums für die Klassen 5/6 Version: 01.02.2016 Elemente Chemie 5/6 Niedersachsen G9 Schule:
Stoffverteilungsplan mit Kompetenzuordnung ISBN: 978-3-12-756331-3 Vorlage für die Erstellung eines Schulcurriculums für die Klassen 5/6 Version: 01.02.2016 Elemente Chemie 5/6 Niedersachsen G9 Schule:
Anhand welcher Eigenschaften lässt sich Sauerstoff identifizieren?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75400) 5. Nachweis von Sauerstoff Experiment von: Phywe Gedruckt:.0.203 3:00:4 intertess (Version 3.06 B200, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Allgemeine Chemie - 5 Nachweisreaktionen (P75400) 5. Nachweis von Sauerstoff Experiment von: Phywe Gedruckt:.0.203 3:00:4 intertess (Version 3.06 B200, Export 2000) Aufgabe
Wovon hängt das Reaktionsverhalten der Metalle beim Erhitzen an Luft ab?
 Naturwissenschaften - Chemie - Anorganische Chemie - Metalle (P75300).2 Abhängigkeit des Reaktionsverhaltens von Metallen Experiment von: Phywe Gedruckt:.0.203 5:7:52 intertess (Version 3.06 B200, Export
Naturwissenschaften - Chemie - Anorganische Chemie - Metalle (P75300).2 Abhängigkeit des Reaktionsverhaltens von Metallen Experiment von: Phywe Gedruckt:.0.203 5:7:52 intertess (Version 3.06 B200, Export
Schwimmen, Schweben, Sinken
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 beinhaltet einen Lehrer- und vier Schülerversuche.
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken Auf einen Blick: Diese Unterrichtseinheit für die Klassen 5 & 6 beinhaltet einen Lehrer- und vier Schülerversuche.
Fette, Öle und Tenside
 Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Schulversuchspraktikum Thomas Polle Sommersemester 2015 Klassenstufen 11 & 12 Fette, Öle und Tenside Kurzprotokoll Inhalt Inhaltsverzeichnis 1Weitere Lehrerversuche... 3 V1 Verseifungszahl... 3 2Weitere
Die SuS erklären die Entstehung saurer Lösungen mit dem Konzept von Arrhenius als Dissoziation von Chlorwasserstoff zu Hydoniumionen und
 1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert sind, da die SuS über diese
1 Arbeitsblatt Das Arbeitsblatt dient der Protokollierung und der Auswertung des Lehrerversuches V1. Während die Versuchsdurchführung und Versuchbeobachtung wenig strukturiert sind, da die SuS über diese
Schulversuchspraktikum. Friederike Kellner. Sommersemester Klassenstufen 11 & 12. Alkanone
 Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 11 & 12 Alkanone 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte Unterrichtseinheit
Schulversuchspraktikum Friederike Kellner Sommersemester 2014 Klassenstufen 11 & 12 Alkanone 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Die im Folgenden vorgestellte Unterrichtseinheit
Wie wirkt sich die Zugabe von Salz auf den Schmelz- und Siedepunkt von Wasser aus?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
Naturwissenschaften - Chemie - Allgemeine Chemie - 7 Chemische Bindung (P752400) 7.4 Schmelzpunktserniedrigung und Siedepunktserhöhung Experiment von: Phywe Gedruckt:.0.203 3:5:43 intertess (Version 3.06
02. Was kann man über die Teilchen eines schmelzenden Stoffes aussagen?
 01. Nenne je beide Übergänge zwischen a) dem festen und dem flüssigen b) dem flüssigen und dem gasförmigen c) dem festen und dem gasförmigen Aggregatzustand. 02. Was kann man über die Teilchen eines schmelzenden
01. Nenne je beide Übergänge zwischen a) dem festen und dem flüssigen b) dem flüssigen und dem gasförmigen c) dem festen und dem gasförmigen Aggregatzustand. 02. Was kann man über die Teilchen eines schmelzenden
Schulversuchspraktikum. Carl Föst. Sommersemester Klassenstufen 5 & 6. Einfache Messgeräte
 Schulversuchspraktikum Carl Föst Sommersemester 2015 Klassenstufen 5 & 6 Einfache Messgeräte 1 1 Auf einen Blick: In dieser Versuchsreihe geht es um den Bau von Messinstrumenten für Temperatur, Luftfeuchtigkeit
Schulversuchspraktikum Carl Föst Sommersemester 2015 Klassenstufen 5 & 6 Einfache Messgeräte 1 1 Auf einen Blick: In dieser Versuchsreihe geht es um den Bau von Messinstrumenten für Temperatur, Luftfeuchtigkeit
V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung
 V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung Bei diesem Versuch geht es darum, die Geschwindigkeit
V 2 Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration und der Temperatur bei der Reaktion von Kaliumpermanganat mit Oxalsäure in Lösung Bei diesem Versuch geht es darum, die Geschwindigkeit
Forschertagebuch WÄRME eine heiße Sache
 Forschertagebuch WÄRME eine heiße Sache Von Forscherauftrag Nr. 1 Schmelzen Löffel Aluminiumfolie Tee-Kerze Zündhölzer Schokolade Käse Zucker Papier Kreide Bildquelle: cc_stampfer Marina 1. Umwickle den
Forschertagebuch WÄRME eine heiße Sache Von Forscherauftrag Nr. 1 Schmelzen Löffel Aluminiumfolie Tee-Kerze Zündhölzer Schokolade Käse Zucker Papier Kreide Bildquelle: cc_stampfer Marina 1. Umwickle den
Korrosion und Korrosionsschutz
 Schulversuchspraktikum Christian Köhler Sommersemester 2016 Klassenstufen 7&8 Korrosion und Korrosionsschutz Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll beinhaltet drei weitere Schülerversuche
Schulversuchspraktikum Christian Köhler Sommersemester 2016 Klassenstufen 7&8 Korrosion und Korrosionsschutz Kurzprotokoll Auf einen Blick: Dieses Kurzprotokoll beinhaltet drei weitere Schülerversuche
Arbeitsblatt Ist groß besser als klein?
 Arbeitsblatt Ist groß besser als klein? Aufgabe 1: Führe folgendes Experiment durch und notiere deine Beobachtungen. Materialien: 4 Reagenzgläser, Reagenzglasständer, Spatel Chemikalien: Gefahrenstoffe
Arbeitsblatt Ist groß besser als klein? Aufgabe 1: Führe folgendes Experiment durch und notiere deine Beobachtungen. Materialien: 4 Reagenzgläser, Reagenzglasständer, Spatel Chemikalien: Gefahrenstoffe
Schulversuchspraktikum. Tatjana Müller Sommersemester 2017 Klassenstufen 5 & 6. Schwimmen Schweben Sinken
 Schulversuchspraktikum Tatjana Müller Sommersemester 2017 Klassenstufen 5 & 6 Schwimmen Schweben Sinken 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beinhaltet
Schulversuchspraktikum Tatjana Müller Sommersemester 2017 Klassenstufen 5 & 6 Schwimmen Schweben Sinken 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: Dieses Protokoll beinhaltet
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10. Die Brennstoffzelle
 Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10 Die Brennstoffzelle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll sind drei Lehrerversuche
Schulversuchspraktikum Sebastian Gerke Sommersemester 2012 Klassenstufen 9 & 10 Die Brennstoffzelle 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll sind drei Lehrerversuche
Schwimmen, Schweben, Sinken
 Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll werden
Schulversuchspraktikum Patricia Hiller Sommersemester 2015 Klassenstufen 5 & 6 Schwimmen, Schweben, Sinken 1 Beschreibung des Themas und zugehörige Lernziele Auf einen Blick: In diesem Protokoll werden
Reaktion von Nichtmetallen mit Sauerstoff und mit Luft
 Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 7 & 8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Isabel Böselt Sommersemester 2014 Klassenstufen 7 & 8 Reaktion von Nichtmetallen mit Sauerstoff und mit Luft 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Werkstoff Glas wir stellen Glasprodukte her
 II Stoffe und ihre Eigenschaften 10. Werkstoff Glas (Kl. 7 10) 1 von 20 Werkstoff Glas wir stellen Glasprodukte her Ein Beitrag von Dr. Meike Reinhold, Duisburg Mit Illustrationen von Wolfgang Zettlmeier,
II Stoffe und ihre Eigenschaften 10. Werkstoff Glas (Kl. 7 10) 1 von 20 Werkstoff Glas wir stellen Glasprodukte her Ein Beitrag von Dr. Meike Reinhold, Duisburg Mit Illustrationen von Wolfgang Zettlmeier,
1 Stoffe in Alltag und Technik
 Schülerband Blickpunkt Chemie 1 Niedersachsen (978-3-507-77292-2) Basiskonzept inhaltsbezogene Kompetenzen: Fachwissen prozessbezogene Kompetenzen: Erkenntnisgewinnung, Kommunikation, Bewertung Die Schülerinnen
Schülerband Blickpunkt Chemie 1 Niedersachsen (978-3-507-77292-2) Basiskonzept inhaltsbezogene Kompetenzen: Fachwissen prozessbezogene Kompetenzen: Erkenntnisgewinnung, Kommunikation, Bewertung Die Schülerinnen
Schulversuchspraktikum. Sommersemester 2014 Klassenstufen 7 & 8. Reaktionen von Metallen mit Sauerstoff und mit Luft.
 Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 7 & 8 Reaktionen von Metallen mit Sauerstoff und mit Luft Zerteilungsgrad 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick:
Marco Kröpfl, Doris Wagner 1
 Marco Kröpfl, Doris Wagner 1 ZIELE Die Phasenübergänge anhand des Teilchenmodells beschreiben können Unter welchen Bedingungen ein Phasenübergang stattfindet & welche Größen dabei eine Rolle spielen THEMA
Marco Kröpfl, Doris Wagner 1 ZIELE Die Phasenübergänge anhand des Teilchenmodells beschreiben können Unter welchen Bedingungen ein Phasenübergang stattfindet & welche Größen dabei eine Rolle spielen THEMA
Physik 7 Lernbuffet Teilchenmodell und thermisches Verhalten von Körpern Damköhler
 Physik 7 Lernbuffet Teilchenmodell und thermisches Verhalten von Körpern Damköhler Aufgabe 1 (Aggregatzustände nennen und Aufbau und Bewegung beschreiben) N1: Betrachte aufmerksam die Bilder und benenne
Physik 7 Lernbuffet Teilchenmodell und thermisches Verhalten von Körpern Damköhler Aufgabe 1 (Aggregatzustände nennen und Aufbau und Bewegung beschreiben) N1: Betrachte aufmerksam die Bilder und benenne
