Aptima Mycoplasma genitalium Assay
|
|
|
- Hannelore Bruhn
- vor 6 Jahren
- Abrufe
Transkript
1 Aptima Mycoplasma genitalium Assay In-vitro-Diagnostikum. Allgemeine Informationen Verwendungszweck Zusammenfassung und Testerklärung Testprinzip Warnhinweise und Vorsichtsmaßnahmen Laborbezogen Probenbezogen Testbezogen Lagerungs- und Handhabungsbedingungen für Reagenzien Probenentnahme und -lagerung Transport von Patientenproben Panther System Reagenzien und Materialien Erforderliche, jedoch nicht im Lieferumfang enthaltene Materialien Optionale Materialien Testverfahren mit dem Panther System Verfahrenshinweise Qualitätskontrolle Assay-Kalibrierung Interne Kontrolle Interpretation der Ergebnisse Ergebnisse und Akzeptanz von Qualitätskontrollen Einschränkungen Testleistung auf dem Panther System Testleistung klinischer und künstlich positiver Proben Reproduzierbarkeit des Assays Analytische Sensitivität Kreuzreaktivität bei Vorliegen von Mikroorganismen Interferenz Literatur Aptima Mycoplasma genitalium Assay 1 AW Rev. 005
2 Allgemeine Informationen Verwendungszweck Der Aptima Mycoplasma genitalium Assay ist ein In-vitro-Nukleinsäure-Amplifikationstestest (NAAT) zum qualitativen Nachweis der ribosomalen RNA (rrna) von Mycoplasma genitalium auf dem vollautomatisierten Panther System. Er ist bei Männern und Frauen zur Verwendung als Hilfsmittel bei der Diagnose einer Infektion mit M. genitalium im Urogenitaltrakt bestimmt. Der Assay kann zur Untersuchung folgender Proben verwendet werden: Vom Arzt bzw. selbst abgenommene Vaginalabstriche, vom Arzt abgenommene Endozervikalabstriche, vom Arzt abgenommene Zervixabstriche in PreservCyt -Lösung, selbst abgenommene Erststrahlurin-Proben von Männern und Frauen, vom Arzt abgenommene Urethralabstriche bei Männern und selbst abgenommene penile Harnröhrenabstriche (Meatus). Zusammenfassung und Testerklärung M. genitalium ist ein durch Geschlechtsverkehr übertragenes gramnegatives Bakterium, das zur Klasse der Mollicutes zählt. M. genitalium besitzt eine Zellmembran, jedoch keine Zellwand und findet sich bei Männern und Frauen auf sowie in den Epithelzellen des Urogenitaltraktes. Die Prävalenz einer Infektion mit M. genitalium bei Männern und Frauen mit geringerem Erkrankungsrisiko wird in der Literatur mit etwa 1 3 % angegeben (1, 2, 3, 4). In Patientenkollektiven mit höherem Erkrankungsrisiko liegt die Prävalenz unter Männern bei % bzw. unter Frauen bei 7,3 14 % (3, 5, 6, 7). In den Gruppen mit erhöhtem Risiko übersteigt die Prävalenz von M. genitalium häufig den Wert für Neisseria gonorrhoeae und liegt etwa auf demselben Niveau wie bei Chlamydia trachomatis (8, 9, 10, 11, 12). In einem Übersichtsartikel zu den hierzu veröffentlichten Studien zeigte sich ein deutlicher Zusammenhang zwischen einer Infektion mit M. genitalium und der Nicht-Gonokokken- Urethritis (NGU) bei Männern (13). Unter den untersuchten Patienten fand sich M. genitalium bei % der Männer mit symptomatischer NGU und bei > 30 % der Männer mit nicht durch Chlamydien bedingter NGU. Mehrere Studien an Patientinnen konnten nachweisen, dass M. genitalium mit Zervizitis einhergeht (P 0,03; 8, 12, 14). Laut einer neueren Metaanalyse steigt bei einer Infektion mit M. genitalium das Risiko einer Zervizitis, entzündlichen Beckenerkrankung, vorzeitigen Geburt, eines Spontanaborts und der Unfruchtbarkeit etwa um das Doppelte an (15). Infektionen mit M. genitalium werden meist nicht erkannt, da die infizierten Betroffenen entweder asymptomatisch sind oder Symptome aufweisen, die denen anderer bakterieller Infektionen des Urogenitaltraktes ähneln. Bei der Auswertung männlicher Patienten einer schwedischen Klinik für sexuell übertragbare Infektionen (STI) waren 61 % (17/28) der mit M. genitalium infizierten Männer symptomatisch, während 93 % (26/28) die Anzeichen einer Urethritis aufwiesen (14). Bei Frauen verläuft die Infektion mit M. genitalium häufig asymptomatisch. Bei der Auswertung von Patientinnen einer schwedischen Klinik für sexuell übertragbare Infektionen (STI) waren 77 % (17/22) der mit M. genitalium infizierten Frauen asymptomatisch, obwohl viele von ihnen die klinischen Anzeichen einer Infektion aufwiesen; 50 % (11/22) hatten Anzeichen einer Urethritis und/oder Zervizitis: 2 Frauen zeigten nur Anzeichen einer Urethritis, 6 nur die Anzeichen einer Zervizitis und 3 Patientinnen wiesen Anzeichen sowohl einer Urethritis als auch Zervizitis auf (16). Aptima Mycoplasma genitalium Assay 2 AW Rev. 005
3 Die derzeitigen Therapieempfehlungen für Patienten mit signifikanten Anzeichen oder Symptomen betreffen primär Infektionen mit Chlamydien, Gonokokken und Trichomonaden. Allerdings ist die optimale Antibiose einer bakteriellen Urethritis und Zervizitis erregerspezifisch, so dass die therapeutische Gabe von Antibiotika gegen diese Keime für die Heilung einer Infektion mit M. genitalium nicht wirkungsvoll ist. Da die Anzüchtung von M. genitalium ausgesprochen anspruchsvoll und schwierig ist, empfehlen die US Zentren für Gesundheitskontrolle und Prävention (United States Centers for Disease Control and Prevention CDC) zum Nachweis von M. genitalium den Einsatz von Nukleinsäure-Amplifikationstests (NAAT) (17). Der Aptima Mycoplasma genitalium Assay ist ein NAAT, der zum Nachweis von 16s rrna des M. genitalium drei Technologien nutzt: Target Capture, transkriptionsvermittelte Amplifikation (TMA) und Hybridisierungsschutz- Assay (HPA). Testprinzip Der Aptima Mycoplasma genitalium Assay umfasst drei Hauptschritte, die alle in einem einzigen Röhrchen auf dem Panther System stattfinden: Target Capture, transkriptionsvermittelte Amplifikation (TMA) und Hybridisierungsschutz-Assay (HPA). Der Assay verfügt über eine interne Kontrolle (IC) zur Überwachung von Capture, Amplifikation und Detektion der Nukleinsäuren sowie von Anwender- und Gerätefehlern. Die gewonnenen Proben werden in entsprechenden Probentransportröhrchen überführt. Die Transportlösung in diesen Gefäßen setzt das rrna-target frei und schützt es vor Abbau während der Lagerung. Bei Durchführung des Aptima Mycoplasma genitalium Assays im Labor wird die Ziel-rRNA, sofern vorhanden, durch Einsatz magnetischer Mikropartikel und eines spezifischen Fänger-Oligomers im so genannten Target Capture-Verfahren isoliert. Das Fänger-Oligomer enthält eine Sequenz, die zu einem spezifischen Bereich des Targetmoleküls komplementär ist, sowie eine Kette von Desoxyadenosinresten. Während des Hybridisierungsschritts bindet sich die sequenzspezifische Region des Fänger-Oligomers an eine spezifische Region des Targetmoleküls. Die Isolierung des Fänger-Oligomer/Target-Komplexes aus der Lösung erfolgt dann durch Absenkung der Reaktionstemperatur auf Raumtemperatur. Diese Temperatursenkung ermöglicht die Hybridisierung der Desoxyadenosinregion auf dem Fänger-Oligomer mit den Polydesoxythymidin-Molekülen, die kovalent an die Magnetpartikel gebunden sind. Die Mikropartikel, einschließlich der an sie gebundenen Targetmoleküle, werden mit Hilfe von Magneten an die Seite des Reaktionsgefäßes gezogen und der Überstand wird aspiriert. Die Partikel werden gewaschen, um Reste der Probenmatrix, die Amplifikationshemmer enthalten kann, zu entfernen. Nach Abschluss der Target-Capture-Schritte ist die rrna zur Amplifikation bereit. Target-Amplifikationstests basieren auf der Fähigkeit, komplementäre Oligonukleotid-Primer spezifisch reassoziieren zu lassen (Annealing) und eine enzymatische Amplifikation der Target-Nukleinsäurestränge zu ermöglichen. Die TMA-Reaktion von Hologic amplifiziert einen spezifischen Abschnitt der kleinen ribosomalen Untereinheit von M. genitalium über DNAund RNA-Zwischenprodukte und erzeugt RNA-Amplikonmoleküle. Die Detektion der rrna- Amplifikationsproduktsequenzen wird durch Nukleinsäurehybridisierung erreicht. Eine einsträngige chemilumineszierende DNA-Sonde, die komplementär zu einer Region des Target-Amplikons ist, wird mit einem Acridiniumestermolekül markiert. Die markierte DNA- Sonde bindet an das Amplikon und bildet stabile RNA:DNA-Hybride. Das Selektionsreagenz unterscheidet hybridisierte von ungebundener Sonde und unterbindet somit die Erzeugung eines Messssignal von einer nicht hybridisierten Sonde. Während des Detektionsschritts wird Licht, das von den markierten RNA-DNA-Hybriden emittiert wird, als Photonensignale in einem Luminometer gemessen und als relative Lichteinheiten (Relative Light Units, RLU) angegeben. Aptima Mycoplasma genitalium Assay 3 AW Rev. 005
4 Warnhinweise und Vorsichtsmaßnahmen A. In-vitro-Diagnostikum. B. Zur Verringerung des Risikos ungültiger Ergebnisse müssen die Packungsbeilage und das Panther System Operator s Manual (Bedienungsanleitung für das Panther System) vollständig durchgelesen werden, bevor dieser Assay durchgeführt wird. C. Dieses Verfahren sollte nur von Personen durchgeführt werden, die in der Anwendung des Aptima Mycoplasma genitalium Assays und in der Handhabung potenziell infektiösen Materials entsprechend geschult sind. Bei Materialverschüttung sind die betroffenen Flächen unter Einhaltung entsprechender vor Ort gültiger Verfahren sofort zu desinfizieren. D. Warnung: Reiz- und Ätzstoffe: Kontakt von Auto Detect 1 und Auto Detect 2 mit der Haut, den Augen und Schleimhäuten vermeiden. Bei Kontakt dieser Flüssigkeiten mit der Haut oder den Augen den betroffenen Bereich mit Wasser spülen. Bei Verschütten dieser Flüssigkeiten die Verschüttung mit Wasser verdünnen und dann aufwischen. Weitere Einzelheiten hierzu siehe das entsprechende Sicherheitsdatenblatt. E. Weitere spezielle Warnungen und Vorsichtsmaßnahmen siehe das Panther System Operator s Manual (Bedienungsanleitung für das Panther System). Laborbezogen F. Nur die im Lieferumfang enthaltenen oder angegebenen Einweg-Laborprodukte verwenden. G. Die normalen Vorsichtsmaßnahmen im Labor ergreifen. Nicht mit dem Mund pipettieren. In den ausgewiesenen Arbeitsbereichen nicht essen, trinken oder rauchen. Beim Umgang mit Proben und Kitreagenzien ungepuderte Einweghandschuhe, Augenschutz und Laborkittel tragen. Nach der Handhabung von Proben und Kitreagenzien die Hände gründlich waschen. Hinweis: Wie bei jedem Reagenzsystem kann übermäßiger Puder auf manchen Handschuhen eine Kontamination geöffneter Röhrchen verursachen. Es werden ungepuderte Handschuhe benötigt. H. Arbeitsflächen, Pipetten und andere Geräte müssen regelmäßig mit einer 2,5 3,5 %igen (0,35 M bis 0,5 M) Natriumhypochloritlösung dekontaminiert werden. Alle Arbeitsflächen gründlich reinigen und desinfizieren. I. Sämtliche Materialien, die mit den Proben und Reagenzien in Kontakt gekommen sind, sind gemäß den geltenden regionalen, nationalen und internationalen Vorschriften zu entsorgen. J. Zu der guten Standardpraxis für Molekularbiologie-Laboratorien gehört auch die Überwachung der Laborumgebung. Zur Überwachung der Laborumgebung wird folgende Vorgehensweise empfohlen: a. Für jede zu untersuchende Fläche wird ein Aptima Unisex Abstrichkit für endozervikale Abstriche und Abstriche der männlichen Urethra benötigt. b. Jedes Röhrchen entsprechend beschriften. c. Die Probenentnahmetupfer (blauer Abstrichschaft mit grüner Beschriftung) aus der Verpackung nehmen. Aptima Mycoplasma genitalium Assay 4 AW Rev. 005
5 Probenbezogen d. Zur Erfassung der Oberflächenproben die Probenentnahmetupfer leicht mit nukleasefreiem Wasser befeuchten. e. Die Abstrichbürste auf der betreffenden Oberfläche in einer vertikalen Bewegung von oben nach unten führen. Während der Probengewinnung die Abstrichbürste etwa eine halbe Drehung drehen. f. Die Abstrichprobe sofort in das Transportröhrchen einbringen. g. Den Schaft der Abstrichbürste an der Einkerbung vorsichtig abbrechen. Dabei darauf achten, dass der Inhalt nicht verspritzt wird. h. Das Transportgefäß für die Abstrichbürste wieder fest verschließen. i. Die Schritte mit den verbleibenden Abstrichbürsten-Proben wiederholen. j. Die Abstrichtupfer mit dem molekularen Assay testen. K. Das Verfallsdatum der Kits für den Probentransport bezieht sich auf die Gewinnung/den Transfer der Proben und nicht auf die Probentestung. Die zu irgendeinem Zeitpunkt vor diesen Verfallsdaten gesammelten/transferierten Proben sind selbst nach dem Verfallsdatum auf dem Transferröhrchen gültig für Tests, vorausgesetzt sie wurden gemäß der entsprechenden Packungsbeilage transportiert oder gelagert. L. Proben können infektiös sein. Bei der Durchführung dieses Assays sind die allgemein gültigen Vorsichtsmaßnahmen zu befolgen. Die Vorgehensweise zur korrekten Handhabung und Entsorgung muss gemäß den geltenden regionalen, nationalen und internationalen Vorschriften festgelegt werden. M. Um die Probenintegrität zu wahren, müssen während des Probenversands die ordnungsgemäßen Lagerbedingungen aufrechterhalten werden. Die Probenstabilität unter anderen Versandbedingungen als den hier empfohlenen wurde nicht untersucht. N. Kreuzkontamination während der Probenhandhabungsschritte vermeiden. Die Proben können sehr hohe Konzentrationen von Organismen aufweisen. Es ist sicherzustellen, dass die Probenbehälter nicht miteinander in Berührung kommen. Benutzte Materialien dürfen nicht über offene Behälter hinweg entsorgt werden. Wechseln Sie die Handschuhe, wenn diese mit Proben in Kontakt kommen. O. Nach der Punktion kann unter bestimmten Bedingungen aus den Verschlüssen der Aptima-Transportgefäße Flüssigkeit auslaufen. Nähere Informationen finden Sie unter Testverfahren mit dem Panther System. P. Nach der Zugabe von Urin muss der Füllstand im Urintransportröhrchen zwischen den beiden schwarzen Markierungslinien auf dem Reaktionsgefäßetikett liegen. Ansonsten muss die Probe verworfen werden. Q. Wenn das Labor ein Abstrichproben-Transportgefäß ohne Abstrichbürste, mit zwei Abstrichbürsten, mit einem Reinigungstupfer oder mit einem nicht von Hologic gelieferten Entnahmeinstrument erhält, muss die Probe verworfen werden. Aptima Mycoplasma genitalium Assay 5 AW Rev. 005
6 Testbezogen R. Nach Ablauf des Verfallsdatums die Reagenzien- und Kalibrator-Kits nicht mehr verwenden. S. Verschließen und lagern Sie Reagenzien bei den angegebenen Temperaturen. Die Testleistung kann durch Verwendung von falsch gelagerten Assay-Reagenzien beeinträchtigt sein. Siehe Lagerungs- und Handhabungsbedingungen für Reagenzien und Testverfahren mit dem Panther System für weitere Informationen. T. Assay-Reagenzien oder Flüssigkeiten nicht ohne ausdrückliche Anweisung miteinander kombinieren. Reagenzien und Flüssigkeiten nicht nachfüllen. Das Panther System überprüft die Reagenzien-Füllstände. U. Eine Kontamination der Reagenzien mit Mikroben und Ribonuklease vermeiden. V. Reagenzien aus Kits mit verschiedenen Chargennummern nicht untereinander austauschen, vermischen oder kombinieren. Da Kalibratoren nicht chargenspezifisch sind, können Assay-Flüssigkeiten aus unterschiedlichen Chargen stammen. Aptima Mycoplasma genitalium Assay 6 AW Rev. 005
7 Lagerungs- und Handhabungsbedingungen für Reagenzien Hinweis: Informationen zu eventuell mit den Reagenzien verbundenen Gefahren- und Vorsichtshinweisen finden sich in der Sicherheitsdatenblatt-Sammlung (Safety Data Sheet Library) unter A. Die folgende Tabelle zeigt die Lagerungsbedingungen und die Stabilität der Reagenzien und Kalibratoren. Reagenz Lagerung im ungeöffneten Zustand Offenes Kit (rekonstituiert) Lagerung Stabilität Amplifikationsreagenz 2 ºC bis 8 ºC Enzymreagenz 2 ºC bis 8 ºC Sondenreagenz 2 ºC bis 8 ºC Internes Kontrollreagenz 2 ºC bis 8 ºC Amplifikationsrekonstitutionslösung 15 ºC bis 30 ºC 2 ºC bis 8 ºC 30 Tage Enzymrekonstitutionslösung 15 ºC bis 30 ºC 2 ºC bis 8 ºC 30 Tage Sondenrekonstitutionslösung 15 ºC bis 30 ºC 2 ºC bis 8 ºC 30 Tage Target-Capture-Reagenz 15 ºC bis 30 ºC 15 ºC bis 30 ºC 30 Tage Selektionsreagenz 2 ºC bis 30 ºC 2 ºC bis 30 ºC 30 Tage Negativkalibrator 2 ºC bis 8 ºC Fläschchen für den Einmalgebrauch Positivkalibrator 2 ºC bis 8 ºC Fläschchen für den Einmalgebrauch B. Bei gekühlter Lagerung des Selektionsreagenz sollte dieses sich erst auf Raumtemperatur erwärmen, bevor es in das Panther System eingebracht wird. C. Alle unbenutzten rekonstituierten Reagenzien und das Target Capture-Arbeitsreagenz (working Target Capture Reagent, wtcr) nach 30 Tagen oder nach Ablauf des Verfallsdatums der Hauptcharge (das frühere Datum ist ausschlaggebend) entsorgen. D. Ungeöffnete Kontrollen sind bis zu dem Datum stabil, das auf dem jeweiligen Fläschchen angegeben ist. E. Im Panther System gelagerte rekonstituierte Reagenzien sind im Gerät 156 Stunden stabil. Das Laden von Reagenzien wird jedes Mal im Panther System-Protokoll vermerkt. F. Bei Handhabung und Lagerung der Reagenzien Kreuzkontamination vermeiden. Sämtliche rekonstituierten Reagenzien jedes Mal vor Lagerung mit neuen Reagenzienverschlüssen verschließen. G. Das Sondenreagenz und das rekonstituierte Sondenreagenz sind lichtempfindlich. Während der Lagerung diese Reagenzien vor Licht schützen. H. Reagenzien nicht einfrieren. Aptima Mycoplasma genitalium Assay 7 AW Rev. 005
8 Probenentnahme und -lagerung Hinweis: Alle Patientenproben sind als potenziell infektiös zu handhaben. Es sind allgemeine Vorsichtsmaßnahmen zu treffen. Hinweis: Bei den Schritten, die eine Handhabung von Proben erfordern, darauf achten, dass es zu keiner Kreuzkontamination kommt. Benutztes Material ist beispielsweise so zu entsorgen, dass es nicht über geöffnete Röhrchen geführt wird. Der Aptima Mycoplasma genitalium Assay kann zur Untersuchung folgender Proben verwendet werden: Vom Arzt bzw. selbst abgenommene Vaginalabstriche, vom Arzt abgenommene Endozervikalabstriche, vom Arzt abgenommene Zervixabstriche in PreservCyt -Lösung, selbst abgenommene Erststrahlurin-Proben von Männern und Frauen, vom Arzt abgenommene Urethralabstriche bei Männern und selbst abgenommene penile Harnröhrenabstriche. Die Assay-Leistung wurde ausschließlich mit Proben ermittelt, die mit folgenden Kits gewonnen wurden: Aptima Unisex Abstrichkit für Endozervikalabstriche und Abstriche der männlichen Urethra Aptima Urinprobenkit für Männer und Frauen Aptima Entnahmekit für Vaginalabstriche Aptima Multitest-Kit für Vaginalabstriche und Abstriche des männlichen Meatus Aptima Probentransport-Kit (zur Verwendung bei gynäkologischen Proben, die in PreservCyt-Lösung abgenommen wurde) A. Probenentnahme Die Anleitung zur Probengewinnung ist in der Packungsbeilage des entsprechenden Probenentnahmekits enthalten. B. Probentransport und -lagerung vor dem Test: 1. Abstrichproben a. Nach ihrer Abnahme können Abstrichproben in Transportröhrchen bei 2 ºC bis 30 ºC für einen Zeitraum von maximal 60 Tagen gelagert werden. b. Sollte eine längere Lagerung erforderlich sein, können Abstriche in Transportröhrchen bei -20 ºC oder -70 ºC für weitere 90 Tage gelagert werden. 2. Urinproben: a. Vor Untersuchung der Urinproben muss der Urin gemäß den Anweisungen in der Packungsbeilage des Urinprobenkits in ein Aptima Urintransportröhrchen transferiert werden. b. Nach Probengewinnung können Urinproben im Primärentnahmebehälter bei 2 ºC bis 30 ºC für einen Zeitraum von maximal 24 Stunden gelagert werden, bevor der Urin in das Transportröhrchen transferiert wird. c. Nach ihrer Abnahme können aufbereitete Urinproben in Transportröhrchen bei 2 ºC bis 30 ºC für einen Zeitraum von maximal 30 Tagen (ab Transfer) gelagert werden. d. Sollte eine längere Lagerung erforderlich sein, kann die aufbereitete Urinprobe im Transportröhrchen bei -20 ºC oder -70 ºC für weitere 90 Tage gelagert werden (ab Transfer). Aptima Mycoplasma genitalium Assay 8 AW Rev. 005
9 3. In PreservCyt-Lösung gewonnene Proben a. Vor der Untersuchung gynäkologischer Proben in PreservCyt-Lösung muss ein Flüssigkeitsvolumen gemäß den Anweisungen in der Packungsbeilage des Aptima Probentransferkits in ein Aptima Probentransportröhrchen transferiert werden. b. Nach ihrer Gewinnung können gynäkologische Proben im Fläschchen mit PreservCyt- Lösung bei 2 ºC bis 30 ºC für einen Zeitraum von maximal 30 Tagen gelagert werden, bevor der Inhalt in das Aptima Probentransportröhrchen transferiert wird. c. Aufbereitete gynäkologische Proben in den Transportröhrchen können bei 2 ºC bis 30 ºC für einen Zeitraum von maximal 60 Tagen (ab Transfer) gelagert werden. d. Sollte eine längere Lagerung erforderlich sein, können aufbereitete gynäkologische Proben im Transferröhrchen bei -20 ºC oder -70 ºC für weitere 90 Tage gelagert werden (ab Transfer). C. Probenlagerung nach dem Test: 1. Die bereits getesteten Proben müssen aufrecht stehend in einem Ständer gelagert werden. 2. Die Probentransportgefäße sind mit einem neuen Barriereschutz aus sauberer Kunststofffolieolie zu umschließen. 3. Wenn getestete Proben versendet werden müssen, sind die durchstechbaren Verschluss auf den Probentransportröhrchen zu entfernen und durch neue durchstechfeste Verschluss zu ersetzen. Wenn Proben zum Test an eine andere Einrichtung versendet werden müssen, müssen die empfohlenen Temperaturen eingehalten werden. Vor der Entfernung des Verschlusses müssen die Probentransportgefäße 5 Minuten bei 420 RCF (Relative Zentrifugalkraft) zentrifugiert werden, damit sich die gesamte Flüssigkeit am Boden des Gefäßes sammelt. Spritzer und Kreuzkontamination vermeiden. Transport von Patientenproben Die unter Probenentnahme und -lagerung beschriebenen Lagerbedingungen für Proben einhalten. Hinweis: Ein Versand der Patientenproben muss in Übereinstimmung mit geltenden nationalen, internationalen und regionalen Frachtbestimmungen erfolgen. Aptima Mycoplasma genitalium Assay 9 AW Rev. 005
10 Panther System Nachstehend sind die Reagenzien für den Aptima Mycoplasma genitalium Assay für das Panther System gelistet. Die Symbole zur Identifikation der Reagenzien sind neben dem Reagenznamen angegeben. Reagenzien und Materialien Hinweis: Informationen zu eventuell mit den Reagenzien verbundenen Gefahren- und Vorsichtshinweisen finden sich in der Sicherheitsdatenblatt-Sammlung (Safety Data Sheet Library) unter Aptima Mycoplasma genitalium Assay Kit 100 Tests (2 Kartons) (Kat.- Nr. PRD-03374) * 100 Tests (2 Kartons und 1 Kalibratoren-Kit) (Kat.- Nr. PRD-03919) Aptima Mycoplasma genitalium Kühlkarton (nach Wareneingang bei 2 ºC bis 8 ºC lagern) Symbol Komponente Menge A E P IC Aptima Mycoplasma genitalium Amplifikationsreagenz Nicht infektiöse Nukleinsäuren, getrocknet in gepufferter Lösung mit < 5 % Füllstoff. Aptima Mycoplasma genitalium Enzymreagenz Reverse Transkriptase und RNA-Polymerase, getrocknet in HEPES-gepufferter Lösung mit < 10 % Füllreagenz. Aptima Mycoplasma genitalium Sondenreagenz Chemilumineszierende DNA-Sonden, getrocknet in succinatgepufferter Lösung mit < 5 % Detergens. Aptima Mycoplasma genitalium Interne Kontrolle Nichtinfektiöses RNA-Transkript in gepufferter Lösung mit <5% Detergens. 1 Fläschchen 1 Fläschchen 1 Fläschchen 1 Fläschchen Aptima Mycoplasma genitalium Raumtemperatur-Karton (nach Wareneingang bei 15 ºC bis 30 ºC lagern) Symbol Komponente Menge AR ER PR Aptima Mycoplasma genitalium Amplifikationsrekonstitutionslösung Wässrige Lösung mit Konservierungsmitteln. Aptima Mycoplasma genitaliumenzymrekonstitutionslösung HEPES-Pufferlösung mit einem Surfactant und Glycerol. Aptima Mycoplasma genitalium Sondenrekonstitutionslösung Succinatpufferlösung mit < 5 % Detergens. 1 Flasche 1 Flasche 1 Flasche * Kalibrator-Kits sind separat erhältlich. Siehe nachfolgend die jeweilige Karton-Katalognummer. Aptima Mycoplasma genitalium Assay 10 AW Rev. 005
11 Aptima Mycoplasma genitalium Raumtemperatur-Karton (nach Wareneingang bei 15 ºC bis 30 ºC lagern) (Fortsetzung) Symbol Komponente Menge S TCR Aptima Mycoplasma genitalium Selektionsreagenz 600 mm Boratpufferlösung mit Surfactant. Aptima Mycoplasma genitalium Target Capture- Reagenz Pufferlösung mit Fänger-Oligomeren und Magnetpartikeln. 1 Flasche 1 Flasche Rekonstitutionsverbindungsstücke 3 Barcode-Blatt für Hauptcharge 1 Blatt Aptima Mycoplasma genitalium Kalibratoren-Kit (PRD-03393) (nach Wareneingang bei 2 ºC bis 8 ºC lagern) Symbol Komponente Menge NCAL PCAL Aptima Mycoplasma genitalium Negativ-Kalibrator Pufferlösung mit < 5 % Detergens. Aptima Mycoplasma genitalium Positiv-Kalibrator Nichtinfektiöses In-vitro-RNA-Transkript von Mycoplasma genitalium in gepufferter Lösung mit < 5 % Detergens. 5 Fläschchen 5 Fläschchen Erforderliche, jedoch nicht im Lieferumfang enthaltene Materialien Hinweis: Materialien, die von Hologic erhältlich sind, sind mit der Katalognummer aufgeführt, sofern nicht anders angegeben. Kat.- Nr. Panther System Aptima Assayflüssigkeitskit enthält Aptima Waschlösung, Aptima Puffer für Deaktivierungsflüssigkeit und Aptima Ölreagenz Aptima Auto Detect Kit (1000 Tests) (1000 Tests) Multi-Röhrchen-Einheiten (MTUs) Panther Entsorgungsbeutel-Kit Panther Abfallabdeckung Oder Panther System-Durchlaufkit enthält MTUs, Entsorgungsbeutel, Abdeckungen für Abfallbehälter, Assayflüssigkeiten und Auto Detects Spitzen, 1000 µl, leitfähig, zur Flüssigkeitsstandmessung Aptima Mycoplasma genitalium Kalibratoren-Kit Aptima Probentransferkit Zur Verwendung mit Proben in PreservCyt -Lösung (5000 Tests) (Tecan) PRD C Aptima Entnahmekit für Vaginalabstriche Aptima Mycoplasma genitalium Assay 11 AW Rev. 005
12 Aptima Multitest-Entnahmekit für Vaginalabstriche Aptima Unisex Abstrichkit für Endozervikalabstriche und Abstriche der männlichen Urethra PRD Aptima Entnahmekit für Urinproben Oder Aptima Transportröhrchen für Urinproben Chlorbleiche, 5 % bis 7 % (0,7 M bis 1,0 M) Natriumhypochloritlösung Ungepuderte Einweghandschuhe Aptima Durchstechverschlüsse Reagenzien-Ersatzverschlüsse für 100 Testkits Rekonstitutionslösungen für Amplifikations-, Enzym- und Sondenreagenz TCR und Selektionsreagenz Labortischunterlagen mit Kunststoffrückseite Zentrifuge CL0041 (100 Verschlüsse) (100 Verschlüsse) Optionale Materialien Kat.- Nr. Hologic Chlorbleiche-Verstärker für die Reinigung für die routinemäßige Reinigung von Oberflächen und Geräten Ersatz Verschluss, durchstechfest A Aptima Mycoplasma genitalium Assay 12 AW Rev. 005
13 Testverfahren mit dem Panther System Hinweis: Nähere Verfahrensinformationen zum Panther System finden sich im Panther System Operator's Manual (Bedienungsanleitung für das Panther System). A. Vorbereitung des Arbeitsbereichs 1. Die Arbeitsflächen, auf der die Reagenzien vorbereitet werden, reinigen. Die Arbeitsflächen mit einer 2,5 %igen bis 3,5 %igen (0,35 M bis 0,5 M) Natriumhypochloritlösung abwischen. Die Natriumhypochloritlösung mindestens 1 Minute auf den Flächen einwirken lassen und die Flächen anschließend mit entionisiertem Wasser abspülen. Die Natriumhypochloritlösung darf nicht antrocknen. Die Labortischoberflächen mit sauberen, saugfähigen Labortischunterlagen mit Kunststoffrückseite abdecken. 2. Eine separate Arbeitsfläche, auf der die Proben vorbereitet werden, reinigen. Wie vorstehend (Schritt A.1) beschrieben vorgehen. B. Reagenzrekonstitution/Vorbereitung eines neuen Kits Hinweis: Die Reagenzrekonstitution sollte vor Beginn von Arbeiten mit dem Panther System durchgeführt werden. 1. Zur Rekonstitution von Amplifikations-, Enzym- und Sondenreagenz jeweils die Flasche mit gefriergetrocknetem Reagenz mit der entsprechenden Rekonstitutionslösung kombinieren. Rekonstitutionslösungen, die möglicherweise gekühlt sind, vor Gebrauch auf Raumtemperatur erwärmen lassen. a. Die gefriergetrockneten Reagenzien (2 ºC bis 8 ºC) und die entsprechenden Rekonstitutionslösungen (15 ºC bis 30 ºC) aus der Lagerung entnehmen. b. Vor Anschluss des Rekonstitutionsverbindungsstücks kontrollieren, dass Rekonstitutionslösung und gefriergetrocknetes Reagenz farblich übereinstimmende Etiketten aufweisen. c. Die Chargennummern auf dem Hauptchargen-Barcodeblatt kontrollieren, um sicherzustellen, dass die richtigen Reagenzien miteinander gepaart wurden. d. Zum Öffnen des Fläschchens mit dem gefriergetrockneten Reagenz die Metallversiegelung und den Gummistopfen entfernen. Das gekerbte Ende des Rekonstitutionsverbindungsstücks (schwarz) fest in das Fläschchen einführen (Abbildung 1, Schritt 1). e. Die Flasche mit der entsprechenden Rekonstitutionslösung öffnen und den Deckel auf eine saubere, abgedeckte Arbeitsfläche legen. f. Die Flasche mit der Rekonstitutionslösung auf eine stabile Fläche stellen (z. B. den Labortisch). Dann das Fläschchen mit dem gefriergetrockneten Reagenz über der Flasche mit der Rekonstitutionslösung umdrehen und das Verbindungsstück an der Flasche mit der Rekonstitutionslösung befestigen (Abbildung 1, Schritt 2). g. Die zusammengefügten Flaschen (an Flasche mit Lösung aufgesetztes Fläschchen) langsam umdrehen, damit die Lösung in das Glasfläschchen laufen kann (Abbildung 1, Schritt 3). h. Die beiden miteinander verbundenen Fläschchen hochnehmen und behutsam schwenken. Beim Schwenken der Flasche Schaumbildung vermeiden (Abbildung 1, Schritt 4). Aptima Mycoplasma genitalium Assay 13 AW Rev. 005
14 i. Warten, bis das gefriergetrocknete Reagenz in Lösung geht. Nachdem das gefriergetrocknete Reagenz sich aufgelöst hat, den Inhalt durch behutsames Schwenken durchmischen und dann die beiden miteinander verbundenen Fläschchen invertieren, wobei der Winkel 45º nicht überschreiten sollte, um die Schaumbildung so gering wie möglich zu halten (Abbildung 1, Schritt 5). Die zusammengefügten Flaschen dann wieder langsam umdrehen, damit die Lösung komplett in die Flasche mit der Rekonstitutionslösung zurückfließen kann. j. Rekonstitutionsverbindungsstück und Glasfläschchen vorsichtig entfernen (Abbildung 1, Schritt 6). k. Die Flasche wieder verschließen. Die Initialen des Anwenders und das Rekonstitutionsdatum auf dem Etikett eintragen (Abbildung 1, Schritt 7). l. Rekonstitutionsverbindungsstück und Fläschchen entsorgen (Abbildung 1, Schritt 8). Warnung: Bei der Rekonstitution von Reagenzien Schaumbildung vermeiden. Schaum beeinträchtigt die Füllstandsmessung im Panther System. Abbildung 1. Rekonstitution von Reagenzien 2. Zur wtcr-vorbereitung wie folgt vorgehen: a. Die entsprechenden Flaschen mit TCR- (15 ºC bis 30 ºC) und IC-Reagenz (2 ºC bis 8 ºC) aus dem Lager holen. b. Die Chargennummer auf der TCR-Flasche und der Flasche mit dem internen Kontrollreagenz überprüfen, um sicherzustellen, dass sie mit der Chargennummer auf dem Hauptchargen-Barcodeblatt übereinstimmen. c. Die TCR-Flasche öffnen und den Deckel auf eine saubere, abgedeckte Arbeitsfläche legen. d. Die IC-Flasche öffnen und den gesamten Inhalt in die TCR-Flasche gießen. Es ist davon auszugehen, dass eine geringe Menge Flüssigkeit in der IC-Flasche verbleibt. e. Die TCR-Flasche verschließen und die Lösung behutsam schwenken, um den Inhalt zu durchmischen. Während dieses Schritts Schaumbildung vermeiden. f. Die Initialen des Anwenders und das aktuelle Datum auf dem Etikett eintragen. g. Die Flasche mit dem internen Kontrollreagenz wieder verschließen und entsorgen. Aptima Mycoplasma genitalium Assay 14 AW Rev. 005
15 3. Vorbereitung des Selektionsreagenz a. Das Selektionsreagenz aus der Lagerung entnehmen (2 ºC bis 30 ºC). Die Chargennummer auf der Flasche mit dem Selektionsreagenz kontrollieren, um sicherzustellen, dass sie mit der Chargennummer auf dem Hauptchargen- Barcodeblatt übereinstimmt. b. Bei gekühlter Lagerung des Selektionsreagenz sollte dieses sich erst auf Raumtemperatur erwärmen, bevor es in das Panther System eingebracht wird. c. Die Initialen des Anwenders und das aktuelle Datum auf dem Etikett eintragen. Hinweis: Alle Reagenzien vor dem Laden in das System durch vorsichtiges Umdrehen gründlich durchmischen. Beim Umdrehen der Reagenzien Schaumbildung vermeiden. C. Reagenzienvorbereitung für bereits angesetzte Reagenzien 1. Die bereits angesetzten Reagenzien aus der Lagerung (2 ºC bis 8 ºC) entnehmen. Bereits rekonstituierte Amplifikations-, Enzym- und Sondenreagenzien müssen vor Testbeginn auf Raumtemperatur (15 ºC bis 30 ºC) gebracht werden. 2. Wenn das rekonstituierte Sondenreagenz einen Niederschlag enthält, der bei Raumtemperatur (15 ºC bis 30 ºC) nicht wieder in Lösung geht, die mit Deckel verschlossene Flasche 1 bis 2 Minuten auf eine Temperatur nicht über 62 ºC erwärmen. Nach diesem Erwärmungsschritt kann das Sondenreagenz verwendet werden, selbst wenn noch ein Restpräzipitat vorhanden ist. Zum Mischen das Sondenreagenz umdrehen. Beim Umdrehen der Reagenzien Schaumbildung vermeiden. 3. Vor dem Laden auf das System müssen Amplifikations-, Enzym- und Sondenreagenzien zum gründlichen Mischen umgedreht werden. Beim Umdrehen der Reagenzien Schaumbildung vermeiden. 4. Die Reagenzflaschen nicht nachfüllen. Das Panther System erkennt Flaschen, die nachgefüllt wurden, und nimmt sie nicht an. D. Vorbereitung des Kalibrators Die Kalibratoren aus dem Lagerkühlschrank (2 ºC bis 8 ºC) nehmen und darauf achten, dass sie sich vor der Verarbeitung auf Raumtemperatur (15 ºC bis 30 ºC) erwärmt haben. E. Probenhandhabung 1. Die Patientenproben vor der Verarbeitung auf eine Temperatur von 15 ºC bis 30 ºC bringen. 2. Proben nicht mit dem Vortex mischen. 3. Optisch kontrollieren, dass jedes Probenröhrchen eines der folgenden Kriterien erfüllt: a. In Unisex-Probentransportröhrchen befindet sich jeweils nur eine einzelne blaue Aptima Entnahmebürste. b. In Multitest- und Vaginalabstrich-Probentransportröhrchen befindet sich jeweils nur ein einzelnes rosafarbenes Aptima Abstrichinstrument. c. In Urin-Probentransportröhrchen liegt das Urinendvolumen zwischen den schwarzen Füllstandsmarkierungen. d. Aptima Probentransportröhrchen für Proben in PreservCyt -Lösung enthalten keine Abnahmebürste oder ein Probenentnahmeinstrument. e. Falls die Probe die Kriterien nicht erfüllt, muss sie verworfen werden. Aptima Mycoplasma genitalium Assay 15 AW Rev. 005
16 4. Vor dem Laden in den Ständer die Probengefäße kontrollieren: a. Wenn sich im Probenröhrchen zwischen der Flüssigkeit und dem Verschluss Luftblasen befinden, das Reaktionsgefäß 5 Minuten bei 420 RCF zentrifugieren, um die Luftblasen zu entfernen. b. Weist ein Probenröhrchen ein geringeres Volumen auf als bei korrekt nach Anleitung gewonnener Proben üblich, das Reaktionsgefäß 5 Minuten bei 420 RCF zentrifugieren, um sicherzustellen, dass sich keine Flüssigkeit im Deckel befindet. c. Wenn ein Urinprobenröhrchen Präzipitat enthält, die Probe bis zu 5 Minuten auf 37 ºC erwärmen. Hinweis: Bei Nichtbefolgen der Schritte 4a-4c kann aus dem Verschluss des Probenröhrchens Flüssigkeit auslaufen. Hinweis: Je Probenröhrchen können bis zu 3 getrennte Aliquote getestet werden. Wenn versucht wird, mehr als 3 Aliquote aus einem Probenröhrchen zu pipettieren, kann dies zu Verarbeitungsfehlern führen. F. Vorbereitung des Systems 1. Das System entsprechend den Anweisungen im Panther System Operator s Manual (Bedienungsanleitung für das Panther System) und den Verfahrenshinweise einrichten. 2. Die Proben in den Probenständer laden. 3. Sobald alle Proben geladen sind, die Probensicherung am Probenständer befestigen und die Proben in das Probenfach laden. 4. Schritte 2 und 3 für den nächsten Probenständer wiederholen. Verfahrenshinweise A. Kalibratoren 1. Auf dem Panther System können die Röhrchen des Aptima Positivkalibrators für Mycoplasma genitalium und des Aptima Negativkalibrators für Mycoplasma genitalium an jede Position des Probenständers und in jede Spur des Probenfaches geladen werden. Die Pipettierung der Proben beginnt, wenn eine der beiden folgenden Bedingungen erfüllt ist: a. Das System bearbeitet derzeit ein Kalibratorenpaar. b. Gültige Ergebnisse für die Kalibratoren werden auf dem System registriert. 2. Sobald die Kalibratorröhrchen pipettiert worden sind und mit dem Reagenzien-Kit für den Aptima Mycoplasma genitalium Assay verarbeitet werden, können bis zu 48 Stunden lang Patientenproben mit dem zugehörigen rekonstituierten Kit getestet werden, es sei denn: a. Die Kalibratorgebnisse sind ungültig. b. Das zugehörige Assayreagenzien-Kit wird aus dem System genommen. c. Das zugehörige Assayreagenzien-Kit hat die Stabilitätsgrenze überschritten. 3. Jedes Kalibratorröhrchen kann nur einmal verwendet werden. Wenn versucht wird, mehr als einmal aus dem Röhrchen zu pipettieren, kann es zu Verarbeitungsfehlern kommen. Aptima Mycoplasma genitalium Assay 16 AW Rev. 005
17 Qualitätskontrolle Ein Lauf- oder Patientenprobenergebnis kann von einem Anwender für ungültig erklärt werden, wenn während der Durchführung des Assays technische, anwender- oder gerätebezogene Probleme auftreten und dokumentiert werden. Alle vom Gerät oder Anwender invalidierten Ergebnisse müssen erneut getestet werden. Assay-Kalibrierung Zur Erzeugung gültiger Ergebnisse muss eine Assay-Kalibrierung durchgeführt worden sein. Wann immer ein Reagenzien-Kit auf das Panther System geladen wird, erfolgt jeweils eine Duplikattestung mit Positiv- und Negativkalibrator. Das Handbuch für das Panther System gibt eine Stabilitätsdauer von 24 Stunden für den Kalibrator an, die Kalibrierung des Aptima Mycoplasma genitalium Assays ist jedoch bis zu 48 Stunden gültig. Der Anwender wird von der Software auf dem Panther System darauf aufmerksam gemacht, wenn ein neuer Kalibratorsatz erforderlich ist. Während der Verarbeitung werden die Annahmekriterien für den Kalibrator von der Software auf dem Panther System automatisch verifiziert. Wenn entweder für den Positiv- oder den Negativkalibrator zwei Replikate ungültig sind, invalidiert die Software den Lauf automatisch. Proben eines für ungültig erklärten Laufs sind mit einem frisch angesetztem Satz Kalibratoren erneut zu testen. Hinweis: Bei Kalibratoren, die aufgrund von Messbereichsfehlern markiert wurden (out-ofrange error flags), kontaktieren Sie den Technischen Kundendienst von Hologic. Interne Kontrolle Jede Probe enthält eine interne Kontrolle (IC). Während der Verarbeitung werden IC- Annahmekriterien von der Software auf dem Panther System automatisch verifiziert. Wenn ein IC-Ergebnis ungültig ist, wird das Probenergebnis für ungültig erklärt. Jede Probe mit ungültigem IC-Ergebnis muss erneut getestet werden. Die Software für das Panther System dient zur genauen Verifizierung der Prozesse, wenn Verfahren gemäß den Anweisungen in der Packungsbeilage und im Panther System Operator s Manual (Bedienungsanleitung für das Panther System) durchgeführt werden. Aptima Mycoplasma genitalium Assay 17 AW Rev. 005
18 Interpretation der Ergebnisse Die Software des Panther Systems wertet die Testergebnisse des Aptima Mycoplasma genitalium Assays automatisch aus. Je nach der relativen Lichteinheit (RLU) der internen Kontrolle (IC) und dem Signal/Cut-off-Quotienten (S/CO) für den Analyten im Detektionsschritt kann ein Testergebnis negativ, positiv oder ungültig sein (siehe unten). Ein Testergebnis kann aufgrund von RLU-Werten, die außerhalb der normal erwarteten Bereiche liegen, ungültig sein. Initial ungültige Testergebnisse sollten erneut getestet werden. Es ist das erste gültige Ergebnis anzugeben. Tabelle 1: Ergebnisinterpretation Testergebnis Kriterien Negativ Positiv Ungültig Analyt S/CO < 1,0 IC IC Cut-off IC RLU Analyt S/CO 1,0 IC RLU Analyt RLU Analyt S/CO < 1,0 und IC < IC Cut-off oder IC > RLU oder Analyt > RLU Ergebnisse und Akzeptanz von Qualitätskontrollen Validitätskriterien eines Testlaufs Die Software stellt automatisch die Gültigkeit des Testlaufs fest. Die Software erklärt einen Testlauf für ungültig, wenn einer der folgenden Zustände eintritt: Beide Negativkalibrator-Replikate sind ungültig. Beide Positivkalibrator-Replikate sind ungültig. Der Anwender kann einen Testlauf für ungültig erklären, wenn während der Durchführung des Assays technische, anwender- oder gerätebezogene Probleme auftreten und dokumentiert werden. Ein ungültiger Testlauf muss wiederholt werden. Abgebrochene Testläufe müssen wiederholt werden. Annahmekriterien für Kalibratoren Die Kalibratoren für den Aptima Mycoplasma genitalium Assay müssen folgende Testresultate liefern: Aptima Mycoplasma genitalium Assay 18 AW Rev. 005
19 Tabelle 2: Annahmekriterien Kalibrator RLU Ergebnis M. genitalium Negativkalibrator Analyt 0 und Gültig Negativkalibrator IC und Gültig Positivkalibrator Analyt und Gültig Positivkalibrator IC 0 und Gültig Berechnung des IC Cut-offs Der IC Cut-off wird aus dem IC-Signal gültiger Negativkalibrator-Replikate ermittelt. IC Cut-off = 0,5 x [IC-RLU-Mittelwert der gültigen Negativkalibrator-Replikate] Berechnung des Analyt Cut-offs Der Analyt Cut-off wird aus dem RLU-Signal gültiger Negativ- und Positivkalibrator-Replikate ermittelt. Analyt Cut-off = [1 * Analyt-RLU-Mittelwert der gültigen Negativkalibrator-Replikate] + [0,035 x Analyt-RLU-Mittelwert der gültigen Positivkalibrator-Replikate] Berechnung des Signal/Cut-off (S/CO)-Wertes für Analyte Der S/CO-Quotient für den Analyten wird aus dem Analyt-RLU-Wert der Testprobe und dem Analyt Cut-off für den Testlauf ermittelt. Analyt-S/CO = Analyt-RLU der Testprobe Analyt Cut-off Aptima Mycoplasma genitalium Assay 19 AW Rev. 005
20 Einschränkungen A. Dieser Test darf nur von Mitarbeitern durchgeführt werden, die im Verfahren unterwiesen wurden. Eine Nichtbefolgung der Anweisungen in dieser Beilage kann fehlerhafte Ergebnisse zur Folge haben. B. Die Auswirkungen von Tamponverwendung, Intimduschen und variablen Faktoren bei der Probenentnahme auf den Nachweis von M. genitalium wurden nicht untersucht. C. Die Entnahme von Urinproben, Vaginalabstrichen und Abstrichen in PreservCyt -Lösung soll keinesfalls Zervixuntersuchungen und endozervikale Proben zur Diagnostik urogenitaler Infektionen bei Frauen ersetzen. Die Patientinnen können Zervizitis, Urethritis, Harnwegsinfektionen oder Vaginalinfektionen anderer Ursache oder als Begleitinfektion durch andere Erreger aufweisen. D. Dieser Assay wurde nur mit den angegebenen Probenarten getestet. Die Leistung mit anderen Probenarten wurde nicht beurteilt. E. Zuverlässige Ergebnisse hängen davon ab, dass die Patientenproben entsprechend gewonnen, transportiert, gelagert und verarbeitet wurden. Weil das für diesen Test verwendete Transportsystem keine mikroskopische Beurteilung der Probeneignung zulässt, muss das klinischen Personal in den ordnungsgemäßen Probenentnahmetechniken geschult werden. Zur Vorgehensweise siehe Probenentnahme und -lagerung. Nähere Informationen siehe die entsprechende Gebrauchsanweisung. F. Ein therapeutischer Misserfolg oder Erfolg kann nicht mit dem Aptima Mycoplasma genitalium Assay bestimmt werden, da Nukleinsäure auch nach entsprechender antimikrobieller Therapie fortbestehen kann. G. Die Ergebnisse des Aptima Mycoplasma genitalium Assays sollten in Verbindung mit anderen dem Arzt verfügbaren klinischen Daten gewertet werden. H. Ein negatives Ergebnis schließt eine mögliche Infektion nicht aus, weil die Ergebnisse von der angemessenen Probenentnahme abhängen. Die Testergebnisse können durch eine unsachgemäße Probenentnahme, technische Fehler, Probenverwechslung oder Target- Konzentrationen unter der Detektionsgrenze des Tests beeinträchtigt sein. I. Der Aptima Mycoplasma genitalium Assay liefert qualitative Ergebnisse. Daher kann keine Korrelation zwischen der Größe eines positiven Testmesssignals und der Anzahl der Organismen in einer Probe aufgestellt werden. J. Die Assayleistung mit Probenarten von Schwangeren wurde nicht bestimmt. K. Die Assayleistung mit Proben von Frauen unter 19 Jahren wurde nicht bestimmt. L. Weist eine Probe eine geringe Anzahl von M. genitalium -Erreger auf, können diese Erreger ungleich verteilt sein, was die Nachweisfähigkeit für M. genitalium rrna im entnommenen Material beeinträchtigen kann. Wenn negative Ergebnisse aus der Probe nicht dem klinischen Eindruck entsprechen, kann eine neue Probenentnahme notwendig sein. Aptima Mycoplasma genitalium Assay 20 AW Rev. 005
21 M. Kunden müssen einen LIS-Transfer unabhängig validieren. N. Für den Aptima Mycoplasma genitalium Assay wurde die Messleistung für gynäkologische Proben, die im PreservCyt-Lösungsfläschchen gewonnen und mit den ThinPrep Systemen verarbeitet wurden, nicht bestimmt. Aptima Mycoplasma genitalium Assay 21 AW Rev. 005
22 Testleistung auf dem Panther System Testleistung klinischer und künstlich positiver Proben Die Leistung des Aptima Mycoplasma genitalium Assay wurde mit einem M. genitalium TMA- Assay verglichen, der an einem anderen Target ansetzt. In Europa, Kanada und den USA wurden insgesamt Patientenproben mit dem Aptima Probenentnahmekits gewonnen. Die von Ärzten und Patienten selbst gewonnenen Vaginalabstriche (n=173), Endozervikalabstriche (n=177), zytologische Abstriche in PreservCyt -Lösung (n=352), Urinabstriche der Frau (n=302) und des Mannes (n=133), Urethraabstriche des Mannes (n=136) sowie die selbst abgenommenen Abstriche des Penismeatus (n=149) wurden mit beiden Assays firmenintern getestet. Die Studie umfasste auch künstliche klinische Proben jeder Probenart außer männlichem Urin, die mit M. genitalium Ganzzelllysat versetzt worden waren. Die Konzentration an M. genitalium in den versetzten Proben betrug 0,1 KBE/ml (0,025 KBE/Reaktion), was einen halben Log-Wert kleiner als die kleinstmögliche Konzentration von M. genitalium in einer klinischen Probe ist. Für jede Probenart, in der sich klinische und künstliche Proben wiederfanden, wurden die positiven und negativen Übereinstimmungen berechnet; die Ergebnisse sind in Tabelle 3 aufgeführt. Tabelle 3: Positive und negative Übereinstimmung des Aptima Mycoplasma genitalium Assay (AMG) versus einem M. genitalium TMA-Assay mit Alternativziel (ALT TMA) Probenart N AMG + AMG + AMG - AMG - Positive Übereinstimmung Negative Übereinstimmung Gesamtübereinstimmung ALT TMA + ALT TMA - ALT TMA + ALT TMA - (95 % VI) (95 % VI) (95 % VI) Peniler Meatusabstrich 149* Urinprobe Mann Urethraabstrich Mann 136* Urinprobe Frau 302* Zytologieprobe in PreservCyt-Lösung 352* Vaginalabstrich 173* ,0 % 97,6 % 98,7 % (94,3-100 %) (91,4-99,4 %) (95,2-99,6%) 100,0 % 98,9 % 99,2 % (92,1-100 %) (93,8-99,8 %) (95,9-99,9 %) 100,0 % 100 % 100 % (91,0-100 %) (96,2-100 %) (97,3-100 %) 100,0 % 100,0 % 100 % (93,9-100 %) (98,4-100 %) (98,7-100 %) 100,0 % 99,7 % 99,7 % (93,9-100 %) (98,1-99,9 %) (98,4-100 %) 100,0 % 98,1 % 98,8 % (94,7-100 %) (93,3-99,5 %) (95,9-99,7 %) 100 % 100 % 100 % Endozervikalabstrich 177* (94,3-100 %) (96,7-100 %) (97,9-100 %) * Anzahl der versetzten Proben: Penile Meatusabstriche = 49; Urethraabstriche = 25; Urinproben Frauen = 49; PreservCyt Proben = 52; Vaginalabstriche = 46; Endozervikalabstriche = 50. Reproduzierbarkeit des Assays Die Reproduzierbarkeit des Aptima Mycoplasma genitalium Assays wurde auf dem Panther System evaluiert. Die Messungen erfolgten an drei Tagen mit zwei Chargen Assayreagenzien und wurden von drei Anwendern auf drei Panther Systemen durchgeführt. Die Panels für die Reproduzierbarkeit wurden erstellt, indem Probentransportmedium (Specimen Transport Medium, STM) mit der entsprechenden Menge an M. genitalium RNA-Transkript versetzt wurde. Die Endkonzentrationen der M. genitalium RNA lagen bei 0 bzw. 100 Kopien/ml. Die S/CO-Daten jeder einzelnen Panelprobe sind in Tabelle 4 als Mittelwert, Standardabweichung (SD) und Variationskoeffizient (CV) zwischen Anwendern, Geräten, Tagen, Chargen und Läufen sowie innerhalb eines Laufes und schließlich insgesamt (Gesamt) dargestellt. Tabelle 5 Aptima Mycoplasma genitalium Assay 22 AW Rev. 005
23 gibt die Positivität und die prozentuale Übereinstimmung der Panels wieder. In der Studie zeigten sich keine falscch-negativen Ergebnisse und nur ein falsch-positives Ergebnis. Proben mit gültigen Ergebnissen flossen in die Auswertungen ein. Tabelle 4: Reproduzierbarkeitsstudie: Reproduzierbarkeit des Aptima Mycoplasma genitalium Assays nach Panel Zwischen Zwischen Zwischen Zwischen Zwischen Innerhalb Total Mittl. Anwendern Geräten Tagen Chargen Läufen eines Laufes Panel N S/CO CV CV CV CV CV CV CV SD (%) SD (%) SD (%) SD (%) SD (%) SD (%) SD (%) Negativpanel , ,00 31, , , Positivpanel ,73 0,22 0,85 0,30 1, ,12 0,45 0,80 3,11 1,23 4,79 1,52 5,90 N = Anzahl; SD = Standardabweichung; CV = Variationskoeffizient; S/CO = Signal/Cut-Off-Quotient. Hinweis: Die Variabilität aufgrund mancher Faktoren kann numerisch negativ sein, und zwar dann, wenn die durch diese Faktoren bedingte Variabilität sehr klein ist. In diesem Fall gilt SD = 0 und CV = 0 %. Tabelle 5: Prozentuale Übereinstimmung des Aptima Mycoplasma genitalium Assays nach Panelbeschreibung Beschreibung Gültige N % Positiv % Übereinstimmung Negativpanel ,07 % (0,01-0,39) 99,93 % (99,61-99,99) Positivpanel % (99,73-100) 100 % (99,73-100) Analytische Sensitivität Sensitivitätspanels mit 0,01 KBE/ml in Probentransportmedium wurden mit M. genitalium Lysat angesetzt. Der Test war für 0,01 KBE/ml zu 100 % positiv. Kreuzreaktivität bei Vorliegen von Mikroorganismen Spezifität Die Spezifität des Aptima Mycoplasma genitalium Assays wurde anhand verschiedener Mikroorganismen bestimmt, u. a. anhand der normalen Flora des Urogenitaltraktes, opportunistischer sowie eng verwandter Organismen. Die Testung erfolgte in Probentransportmedium mit jeweils 20 Replikaten für jedes Isolat. Tabelle 6 enthält die Aufstellung der Organismen und ihrer Testkonzentrationen. Bei keinem der getesteten Organismen fand sich im Aptima Mycoplasma genitalium Assay eine Kreuzreaktivität. Sensitivität Die Ermittlung der Sensitivität des Aptima Mycoplasma genitalium Assays erfolgte anhand derselben Organismen (Tabelle 6) in Probentransportlösung, die mit M. genitalium Lysat zu einer Endkonzentration von 0,25 KBE/ml versetzt wurden (20 Replikate für jedes Isolat). Bei Vorliegen der untersuchten Erreger wurde keine Interferenz festgestellt. Aptima Mycoplasma genitalium Assay 23 AW Rev. 005
24 Tabelle 6: Mit dem Aptima Mycoplasma genitalium Assay auf dem Panther System getesteten Mikroorganismen Mikroorganismus Konzentration Mikroorganismus Konzentration Acinetobacter lwoffii 1x10 6 KBE/ml Humanes Papillomvirus Typ 16 (SiHa-Zellen) 1x10 4 Zelln/ml Actinomyces israelii 1x10 6 KBE/ml Klebsiella pneumoniae 1x10 6 KBE/ml Alcaligenes faecalis 1x10 6 KBE/ml Lactobacillus acidophilus 1x10 6 KBE/ml Atopobium vaginae 1x10 6 KBE/ml Lactobacillus crispatus 1x10 6 KBE/ml Bacteriodes fragilis 1x10 6 KBE/ml Leptotrichia buccalis 1x10 6 KBE/ml Bifidobacterium adolescentis 1x10 6 KBE/ml Listeria monocytogenes 1x10 6 KBE/ml Campylobacter jejuni 1x10 6 KBE/ml Mobiluncus curtisii 1x10 6 KBE/ml Candida albicans 1x10 6 KBE/ml Mycoplasma hominis 1x10 6 KBE/ml Chlamydia trachomatis 1x10 6 KBE/ml Mycoplasma pneumoniae 250 KBE/ml Clostridium difficile 1x10 6 KBE/ml Neisseria gonorrhoeae 1x10 6 KBE/ml Corynebacterium genitalium 1x10 6 KBE/ml Peptostreptococcus magnus 1x10 6 KBE/ml Cryptococcus neoformans 1x10 6 KBE/ml Prevotella bivia 1x10 6 KBE/ml Cytomegalievirus 1x10 5 TCID 50/ml Propionibacterium acnes 1x10 6 Zellen/ml Enterobacter cloacae 1x10 6 KBE/ml Proteus vulgaris 1x10 6 KBE/ml Enterococcus faecalis 1x10 6 KBE/ml Pseudomonas aeruginosa 1x10 6 KBE/ml Escherichia coli 1x10 6 KBE/ml Staphylococcus aureus 1x10 6 KBE/ml Fusobacterium nucleatum 1x10 6 KBE/ml Staphylococcus epidermidis 1x10 6 KBE/ml Gardnerella vaginalis 1x10 6 KBE/ml Streptococcus agalactiae 1x10 6 KBE/ml Haemophilus ducreyi 1x10 6 KBE/ml Streptococcus pyogenes 1x10 6 KBE/ml Herpes-Simplex-Virus Typ 1 2,5x10 6 TCID 50/ml Trichomonas vaginalis 1x10 6 KBE/ml Herpes-Simplex-Virus Typ 2 2,5x10 6 TCID 50/ml Ureaplasma parvum 1x10 6 KBE/ml HIV-1 1x10 6 Kopien/ml Ureaplasma urealyticum 1x10 6 Zellen/ml Interferenz STM-Lösung wurden einzelne endogene und exogene Stoffe wie Gleitmittel, Körperdeos, Spermizide und Antimykotika auf eine Endkonzentration von 1 % (Vol/Vol bzw. Gewicht/Vol) sowie Magenschleim des Schweins auf 0,3 % und Vollblut auf 5 % zugesetzt. Zur Überprüfung der Auswirkungen von Harnmetaboliten wurde anstelle von Urin die Urinanalysekontrolle KOVA-Trol I Hochabnorm mit Urobilinogen in das Urintransportmedium (UTM) verdünnt. Dieses humane Urinanalyse-Kontrollmaterial auf Harnbasis enthält potenzielle Störgrößen wie Protein (Albumin), Bilirubin, Glukose, Ketone, Erythrozyten, Nitrit, Urobilinogen und Leukozyten. Die Testung mit geeister Essigsäure erfolgte durch Zusetzen in PreservCyt - STM (Endkonzentration 1 %). Nachdem M. genitalium Ganzzelllysat bis zu einer Endkonzentration von 0,25 KBE/ml mit den genannten Stoffen versetzt und dann mit dem Aptima Mycoplasma genitalium Assay getestet wurde, zeigte sich keinerlei Interferenz. Aptima Mycoplasma genitalium Assay 24 AW Rev. 005
25 Literatur 1. Andersen, B., I. Sokolowski, L. Østergaard, J. K., Møller, F. Olesen und J. S. Jensen Mycoplasma genitalium: prevalence and behavioural risk factors in the general population. Sex. Transm. Infect. 83: doi: /sti: Manhart, L. E., K. K. Holmes, J. P. Hughes, L. S. Houston und P. A. Totten Mycoplasma genitalium among young adults in the United States: an emerging sexually transmitted infection. Am. J. Public Health. 97: McGowin, C. L. und C. Anderson-Smits Mycoplasma genitalium: an emerging cause of sexually transmitted disease in women. PLoS Pathogens. 7:e doi: /journal.ppat Oakeshott, P., A. Aghaizu, P. Hay, F. Reid, S. Kerry, H. Atherton, I. Simms, D. Taylor-Robinson, B. Dohn und J. S. Jensen Is Mycoplasma genitalium in women the new chlamydia? A community-based prospective cohort study. Clin. Infect. Dis. 51: doi: / Hilton, J., S. Azariah und M. Reid A case-control study of men with non-gonococcal urethritis at Aukland Sexual Health Service: rates of detection of Mycoplasma genitalium. Sex Health. 7: doi: /sh Wikstrøm, A. und J. S. Jensen Mycoplasma genitalium: a common cause of persistent urethritis among men treated with doxycycline. Sex. Transm. Infect. 82: doi: /sti Wroblewski, J. K. H., L. E. Manhart, K. A. Dickey, M. K. Hudspeth und P. A. Totten Comparison of transcription-mediated amplification and PCR assay results for various genital specimen types for detection of Mycoplasma genitalium. J. Clin. Microbiol. 44: doi: /jcm Gaydos, C., N. E. Maldeis, A. Hardick, J. Hardick und T. C. Quinn. 2009a. Mycoplasma genitalium as a contributor to the multiple etiologies of cervicitis in women attending sexually transmitted disease clinics. Sex. Transm. Dis. 36: doi: / OLQ.0b013e3181b Gaydos, C., N. E. Maldeis, A. Hardick, J. Hardick und T. C. Quinn. 2009b. Mycoplasma genitalium compared to chlamydia, gonorrhoea and trichomonas as an aetiological agent of urethritis in men attending STD clinics. Sex. Transm. Infect. 85: doi: /sti: Hancock, E. B., L. E. Manhart, S. J. Nelson, R. Kerani, J. K. H. Wrobleski und P. A. Totten Comprehensive assessment of sociodemographic and behavioral risk factors for Mycoplasma genitalium infection in women. Sex. Transm. Dis. 37: doi: /olq.0b013e3181e8087e. 11. Huppert, J. S., J. E. Mortensen, J. L. Reed, J. A. Kahn, K. D. Rich und M. M. Hobbs Mycoplasma genitalium detected by transcription-mediated amplification is associated with Chlamydia trachomatis in adolescent women. Sex Transm Dis. 35: doi: /olq.0b013e31815abac Mobley, V. L., M. M. Hobbs, K. Lau, B. S. Weinbaum, D. K. Getman und A. C. Seña Mycoplasma genitalium infection in women attending a sexually transmitted infection clinic: diagnostic specimen type, coinfections, and predictors. Sex. Transm. Dis. 39: doi: /olq.0b013e318255de Taylor-Robinson, D. und J. S. Jensen Mycoplasma genitalium: from chrysalis to multicolored butterfly. Clin. Microbiol. Rev. 24: Anagrius, C., B. Loré und J. S. Jensen Mycoplasma genitalium: prevalence, clinical significance, and transmission. Sex. Transm. Infect. 81: doi: /sti: Lis, R., A. Rowhani-Rahbar und L. E. Manhart Mycoplasma genitalium infection and female reproductive tract disease: a meta-analysis. Clin. Infect. Dis. 61: doi: /cid/civ Falk, L., H. Fredlund und J. S. Jensen Signs and symptoms of urethritis and cervicitis among women with or without Mycoplasma genitalium or Chlamydia trachomatis infection. Sex. Transm. Infect. 81: doi: /sti: CDC Leitlinien zur Behandlung sexuell übertragbarer Krankheiten, Herausgegeben 20. August Aptima Mycoplasma genitalium Assay 25 AW Rev. 005
26 Hologic, Inc Genetic Center Drive San Diego, CA 92121, USA Kundendienst: Hologic ( ) Technischer Kundendienst: Weitere Kontaktinformationen unter Hologic, Aptima, Panther, PreservCyt, ThinPrep und assoziierte Logos sind Marken oder eingetragene Marken von Hologic, Inc. und/oder seinen Tochterunternehmen in den Vereinigten Staaten und/oder anderen Ländern. Alle anderen Marken, eingetragenen Marken und Produktnamen, die möglicherweise in dieser Packungsbeilage erscheinen, sind Eigentum des jeweiligen Eigentümers. KOVA-TROL ist eine Marke von Hycor Biomedical, Inc Hologic, Inc. Alle Rechte vorbehalten. AW Rev Aptima Mycoplasma genitalium Assay 26 AW Rev. 005
Aptima HPV 16 18/45 Genotype Assay
 Aptima Aptima HPV 16 18/45 Genotype Assay In-vitro-Diagnostikum. Nur für den US-Export. Allgemeine Informationen....................................................2 Verwendungszweck........................................................2
Aptima Aptima HPV 16 18/45 Genotype Assay In-vitro-Diagnostikum. Nur für den US-Export. Allgemeine Informationen....................................................2 Verwendungszweck........................................................2
Aptima Trichomonas vaginalis Assay
 Aptima Trichomonas vaginalis Assay In-vitro-Diagnostikum. Nur zum US-Export. Allgemeine Informationen........................................... 2 Verwendungszweck................................................
Aptima Trichomonas vaginalis Assay In-vitro-Diagnostikum. Nur zum US-Export. Allgemeine Informationen........................................... 2 Verwendungszweck................................................
Progensa PCA3 Urine Specimen Transport Kit
 Anleitung für Ärzte Progensa PCA3 Urine Specimen Transport Kit Zur in vitro diagnostischen Anwendung. Nur zum US-Export. Anleitung 1. Es kann sich als nützlich erweisen, wenn der Patient eine große Menge
Anleitung für Ärzte Progensa PCA3 Urine Specimen Transport Kit Zur in vitro diagnostischen Anwendung. Nur zum US-Export. Anleitung 1. Es kann sich als nützlich erweisen, wenn der Patient eine große Menge
Aptima Zika Virus Assay
 Aptima Zika Virus Assay In-vitro-Diagnostikum. Nur zum US-Export. Allgemeine Informationen............................................ 2 Verwendungszweck.............................................................
Aptima Zika Virus Assay In-vitro-Diagnostikum. Nur zum US-Export. Allgemeine Informationen............................................ 2 Verwendungszweck.............................................................
Aptima HBV Quant Assay
 Aptima Aptima HBV Quant Assay In-vitro-Diagnostikum Nur zum US-Export Allgemeine Informationen............................................ 2 Bestimmungsgemäßer Gebrauch..................................................
Aptima Aptima HBV Quant Assay In-vitro-Diagnostikum Nur zum US-Export Allgemeine Informationen............................................ 2 Bestimmungsgemäßer Gebrauch..................................................
Aptima HPV Assay. In-vitro-Diagnostikum. Nur für den US-Export.
 Aptima HPV Assay In-vitro-Diagnostikum. Nur für den US-Export. Allgemeine Informationen....................................................2 Verwendungszweck........................................................2
Aptima HPV Assay In-vitro-Diagnostikum. Nur für den US-Export. Allgemeine Informationen....................................................2 Verwendungszweck........................................................2
Aptima Herpes Simplex Viruses 1 & 2 Assay
 Aptima Aptima Herpes Simplex Viruses 1 & 2 Assay In-vitro-Diagnostikum. Nur zum US-Export. Allgemeine Informationen... 2 Verwendungszweck... 2 Zusammenfassung und Testerklärung... 2 Testprinzip... 3 Warnhinweise
Aptima Aptima Herpes Simplex Viruses 1 & 2 Assay In-vitro-Diagnostikum. Nur zum US-Export. Allgemeine Informationen... 2 Verwendungszweck... 2 Zusammenfassung und Testerklärung... 2 Testprinzip... 3 Warnhinweise
cobas T PCR Sample Kits Der erste Schritt zu verlässlichen CT/NG-Ergebnissen
 Der erste Schritt zu verlässlichen CT/NG-Ergebnissen cobast PCR Sample Kits sind Transportsysteme für Abstrich- und Urinproben, aus denen ein Chlamydia trachomatis und/oder Neisseria gonorrhoeae Nachweis
Der erste Schritt zu verlässlichen CT/NG-Ergebnissen cobast PCR Sample Kits sind Transportsysteme für Abstrich- und Urinproben, aus denen ein Chlamydia trachomatis und/oder Neisseria gonorrhoeae Nachweis
APTIMA Chlamydia trachomatis Assay
 APTIMA Chlamydia trachomatis Assay Zur Verwendung in der In-vitro-Diagnostik. Nur zum US-Export. Allgemeine Informationen...................... 2 Verwendungszweck........................................
APTIMA Chlamydia trachomatis Assay Zur Verwendung in der In-vitro-Diagnostik. Nur zum US-Export. Allgemeine Informationen...................... 2 Verwendungszweck........................................
PROGENSA PCA3 Assay. In-vitro-Diagnostikum. Nur für den US-Export. Allgemeine Informationen... 2
 PROGENSA PCA3 Assay In-vitro-Diagnostikum. Nur für den US-Export. Allgemeine Informationen............................... 2 Verwendungszweck........................................ 2 Zusammenfassung und
PROGENSA PCA3 Assay In-vitro-Diagnostikum. Nur für den US-Export. Allgemeine Informationen............................... 2 Verwendungszweck........................................ 2 Zusammenfassung und
Aptima Specimen Transfer Kit
 Aptima Aptima Specimen Transfer Kit Verwendungszweck In-vitro-Diagnostikum. Nur zum US-Export. Das Aptima Specimen Transfer Kit (Aptima Probentransferkit) ist ausschließlich für Aptima Assays vorgesehen.
Aptima Aptima Specimen Transfer Kit Verwendungszweck In-vitro-Diagnostikum. Nur zum US-Export. Das Aptima Specimen Transfer Kit (Aptima Probentransferkit) ist ausschließlich für Aptima Assays vorgesehen.
HybriScan D Abwasser Gesamtkeimzahlbestimmung
 HybriScan D Abwasser Gesamtkeimzahlbestimmung Modul I Molekularbiologisches Schnelltestsystem zum Nachweis von Bakterien im Abwasser Produkt-Nr.: 78436 Kontaktinformationen: HybriScan - Schnelltestsystem
HybriScan D Abwasser Gesamtkeimzahlbestimmung Modul I Molekularbiologisches Schnelltestsystem zum Nachweis von Bakterien im Abwasser Produkt-Nr.: 78436 Kontaktinformationen: HybriScan - Schnelltestsystem
Aptima HIV-1 Quant Dx Assay
 Aptima HIV-1 Quant Dx Assay In-vitro-Diagnostikum. Nur zum US-Export. Allgemeine Informationen............................................ 2 Verwendungszweck.............................................................
Aptima HIV-1 Quant Dx Assay In-vitro-Diagnostikum. Nur zum US-Export. Allgemeine Informationen............................................ 2 Verwendungszweck.............................................................
RealLine DNA Extraction 2
 RealLine Pathogen Diagnostic Kits Gebrauchsinformation RealLine DNA Extraction 2 KIT FÜR DIE EXTRAKTION VON DNA AUS KLINISCHEN PROBEN In-vitro Diagnostikum RealLine DNA-Extraction 2 VBC8897 96 Tests gültig
RealLine Pathogen Diagnostic Kits Gebrauchsinformation RealLine DNA Extraction 2 KIT FÜR DIE EXTRAKTION VON DNA AUS KLINISCHEN PROBEN In-vitro Diagnostikum RealLine DNA-Extraction 2 VBC8897 96 Tests gültig
SCRIPTUM HIGH PRECISE
 Nur für Forschungszwecke Datenblatt Artikel BS.50.020 = 20 Reaktionen x 50 µl Artikel BS.50.100 = 100 Reaktionen x 50 µl Artikel BS.50. 500 = 500 Reaktionen x 50 µl Haltbarkeit: 12 Monate Lagerung bei
Nur für Forschungszwecke Datenblatt Artikel BS.50.020 = 20 Reaktionen x 50 µl Artikel BS.50.100 = 100 Reaktionen x 50 µl Artikel BS.50. 500 = 500 Reaktionen x 50 µl Haltbarkeit: 12 Monate Lagerung bei
KURZANLEITUNG Nur zum Gebrauch mit dem Sofia Analyzer.
 Analyzer und FIA KURZANLEITUNG Nur zum Gebrauch mit dem Sofia Analyzer. Durchführung des Tests Der Benutzer sollte sich vor Verwendung der Kurzanleitung gründlich mit der Packungsbeilage und dem Benutzerhandbuch
Analyzer und FIA KURZANLEITUNG Nur zum Gebrauch mit dem Sofia Analyzer. Durchführung des Tests Der Benutzer sollte sich vor Verwendung der Kurzanleitung gründlich mit der Packungsbeilage und dem Benutzerhandbuch
QIAsymphony DSP Virus/Pathogen Kit
 QIAsymphony DSP Virus/Pathogen Kit Die QIAsymphony DSP Virus/Pathogen Kits sind nur für den Gebrauch mit dem QIAsymphony SP vorgesehen. Die QIAsymphony DSP Virus/Pathogen Kits enthalten die Reagenzien
QIAsymphony DSP Virus/Pathogen Kit Die QIAsymphony DSP Virus/Pathogen Kits sind nur für den Gebrauch mit dem QIAsymphony SP vorgesehen. Die QIAsymphony DSP Virus/Pathogen Kits enthalten die Reagenzien
Prävalenz bei ambulanten Patienten mit ambulant erworbener Pneumonie nach Erreger
 Produktnummer: IF1250M Rev. I Leistungsmerkmale Nicht für den Vertrieb in den USA ERWARTETE WERTE Patienten mit ambulant erworbener Pneumonie Zwei externe Prüfer untersuchten den Focus Chlamydia MIF IgM
Produktnummer: IF1250M Rev. I Leistungsmerkmale Nicht für den Vertrieb in den USA ERWARTETE WERTE Patienten mit ambulant erworbener Pneumonie Zwei externe Prüfer untersuchten den Focus Chlamydia MIF IgM
Vorstellung der GeneXpert Kartusche und Technologie Präanalytik der Xpert Tests Matthias Schelberger , Rev. 1
 Vorstellung der GeneXpert Kartusche und Technologie Präanalytik der Xpert Tests Matthias Schelberger 301-1031, Rev. 1 Schulungsprogramm Übersicht der GeneXpert Technologie Darstellung der Funktionsweise
Vorstellung der GeneXpert Kartusche und Technologie Präanalytik der Xpert Tests Matthias Schelberger 301-1031, Rev. 1 Schulungsprogramm Übersicht der GeneXpert Technologie Darstellung der Funktionsweise
Gebrauchsanweisung MBT Galaxy HCCA Matrix GPR
 Gebrauchsanweisung MBT Galaxy HCCA Matrix GPR Aufgereinigte Matrixsubstanz für die Matrix-unterstützte Laser-Desorption/Ionisation Flugzeit Massenspektrometrie (MALDI-TOF-MS) Erzeugnis für den allgemeinen
Gebrauchsanweisung MBT Galaxy HCCA Matrix GPR Aufgereinigte Matrixsubstanz für die Matrix-unterstützte Laser-Desorption/Ionisation Flugzeit Massenspektrometrie (MALDI-TOF-MS) Erzeugnis für den allgemeinen
Urogenitale Infektionserreger mittels PCR
 Urogenitale Infektionserreger mittels PCR Dr. Monika Börner Planegg 09. September 2009 Urogenitale Infektionserreger mittels PCR Grundlagen / Allgemeines Chlamydia trachomatis Neisseria gonorrhoeae Mykoplasmen
Urogenitale Infektionserreger mittels PCR Dr. Monika Börner Planegg 09. September 2009 Urogenitale Infektionserreger mittels PCR Grundlagen / Allgemeines Chlamydia trachomatis Neisseria gonorrhoeae Mykoplasmen
Sexuell übertragbare Infektionen MUSTER. Sexuell übertragbare. Was muss ich wissen?
 Sexuell übertragbare Infektionen Sexuell übertragbare Infektionen Was muss ich wissen? Was sind STDs? Sexuell übertragbare Infektionen (STD sexually transmitted diseases) werden durch verschiedene Erreger
Sexuell übertragbare Infektionen Sexuell übertragbare Infektionen Was muss ich wissen? Was sind STDs? Sexuell übertragbare Infektionen (STD sexually transmitted diseases) werden durch verschiedene Erreger
AdnaTest ER/PR-Detect
 PCR-Expressionsanalyse der Östrogen- und Progesteron- Hormonrezeptoren in angereicherten Tumorzellen Zur In-vitro-Diagnostik Gebrauchsanweisung T-1-532 Inhaltsverzeichnis Bestellinformation... 3 Anwendungszweck...
PCR-Expressionsanalyse der Östrogen- und Progesteron- Hormonrezeptoren in angereicherten Tumorzellen Zur In-vitro-Diagnostik Gebrauchsanweisung T-1-532 Inhaltsverzeichnis Bestellinformation... 3 Anwendungszweck...
Rekonstitution und Verabreichung von Cinryze (C1-Inhibitor [vom Menschen]) Hinweise für Ärzte und medizinisches Fachpersonal
![Rekonstitution und Verabreichung von Cinryze (C1-Inhibitor [vom Menschen]) Hinweise für Ärzte und medizinisches Fachpersonal Rekonstitution und Verabreichung von Cinryze (C1-Inhibitor [vom Menschen]) Hinweise für Ärzte und medizinisches Fachpersonal](/thumbs/67/57052806.jpg) Rekonstitution und Verabreichung von Cinryze (C1-Inhibitor [vom Menschen]) Hinweise für Ärzte und medizinisches Fachpersonal Diese Informationen werden Ihnen von der Shire Deutschland GmbH zur Verfügung
Rekonstitution und Verabreichung von Cinryze (C1-Inhibitor [vom Menschen]) Hinweise für Ärzte und medizinisches Fachpersonal Diese Informationen werden Ihnen von der Shire Deutschland GmbH zur Verfügung
Blut DNA Midi Kit. Datenblatt. (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen: Farbe: Bio&SELL
 Datenblatt Artikel-Nr. BS44.721.0010 Artikel-Nr. BS44.721.0050 Artikel-Nr. BS44.721.0250 10 Präparationen 50 Präparationen 250 Präparationen (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens
Datenblatt Artikel-Nr. BS44.721.0010 Artikel-Nr. BS44.721.0050 Artikel-Nr. BS44.721.0250 10 Präparationen 50 Präparationen 250 Präparationen (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens
Wichtiger Produkthinweis
 ADVIA Centaur ADVIA Centaur XP ADVIA Centaur XPT ADVIA Centaur CP Wichtiger Produkthinweis CC 16-02.A.OUS Oktober 2016 CA 19-9 Abweichung zwischen ADVIA Centaur CP und ADVIA Centaur/XP/XPT Laut unseren
ADVIA Centaur ADVIA Centaur XP ADVIA Centaur XPT ADVIA Centaur CP Wichtiger Produkthinweis CC 16-02.A.OUS Oktober 2016 CA 19-9 Abweichung zwischen ADVIA Centaur CP und ADVIA Centaur/XP/XPT Laut unseren
Benutzerhandbuch Version PathoTrack EDIM ELISA. Testkit zum Nachweis von Anti körpern gegen das murine Rotavirus (EDIM)
 Benutzerhandbuch Version 2016-05 PathoTrack EDIM ELISA Testkit zum Nachweis von Anti körpern gegen das murine Rotavirus (EDIM) 2 Inhaltsverzeichnis Auf einen Blick Produktbeschreibung Inhalt des Kits Versand
Benutzerhandbuch Version 2016-05 PathoTrack EDIM ELISA Testkit zum Nachweis von Anti körpern gegen das murine Rotavirus (EDIM) 2 Inhaltsverzeichnis Auf einen Blick Produktbeschreibung Inhalt des Kits Versand
MPP Multiplex 2x PCR-Mastermix
 Datenblatt Artikel-Nr. BS91.522.0250 250 Reaktionen in 20µl Artikel-Nr. BS91.522.1250 1250 Reaktionen a 20µl (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen:
Datenblatt Artikel-Nr. BS91.522.0250 250 Reaktionen in 20µl Artikel-Nr. BS91.522.1250 1250 Reaktionen a 20µl (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen:
Weiterführende Informationen zur Progesteron Restandardisierung
 Siemens Healthcare Diagnostics Inc. Kundeninformation 21-4 Weiterführende Informationen zur Restandardisierung Mit diesem Schreiben möchte Siemens Ihnen weiterführende Informationen zur Restandardisierung
Siemens Healthcare Diagnostics Inc. Kundeninformation 21-4 Weiterführende Informationen zur Restandardisierung Mit diesem Schreiben möchte Siemens Ihnen weiterführende Informationen zur Restandardisierung
S-Dis Hotstart Polymerase
 Datenblatt Artikel-Nr. BS91.219.0200 Artikel-Nr. BS91.219.1000 200 Units 1000 Units (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen: Farbe: 1 Beschreibung Die
Datenblatt Artikel-Nr. BS91.219.0200 Artikel-Nr. BS91.219.1000 200 Units 1000 Units (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen: Farbe: 1 Beschreibung Die
PyroMark Q24 Cartridge
 PyroMark Q24 Cartridge Version 2 Für das Dispensieren von Nukleotiden und Reagenzien im PyroMark Q24 MDx Für in-vitro-diagnostische Anwendungen 979302 1062816DE QIAGEN GmbH, QIAGEN-Straße 1, D-40724 Hilden
PyroMark Q24 Cartridge Version 2 Für das Dispensieren von Nukleotiden und Reagenzien im PyroMark Q24 MDx Für in-vitro-diagnostische Anwendungen 979302 1062816DE QIAGEN GmbH, QIAGEN-Straße 1, D-40724 Hilden
APTIMA COMBO 2 Assay
 APTIMA COMBO 2 Assay Zur Verwendung in der In-vitro-Diagnostik. Nur zum US-Export. Allgemeine Informationen...................... 2 Verwendungszweck........................................ 2 Zusammenfassung
APTIMA COMBO 2 Assay Zur Verwendung in der In-vitro-Diagnostik. Nur zum US-Export. Allgemeine Informationen...................... 2 Verwendungszweck........................................ 2 Zusammenfassung
ZytoFast DNA (-) Control Probe
 ZytoFast DNA (-) Control Probe (Digoxigenin-markiert) T-1054-400 40 (0,4 ml) Zur Abschätzung der unspezifischen Hintergrundfärbung durch chromogene in situ Hybridisierung (CISH).... In-Vitro-Diagnostikum
ZytoFast DNA (-) Control Probe (Digoxigenin-markiert) T-1054-400 40 (0,4 ml) Zur Abschätzung der unspezifischen Hintergrundfärbung durch chromogene in situ Hybridisierung (CISH).... In-Vitro-Diagnostikum
3M Food Safety Das 3M Molekulare Detektionssystem. Testen auf Krankheitserreger: schnell und einfach
 3M Food Safety Das 3M Molekulare Detektionssystem Testen auf Krankheitserreger: schnell und einfach Die Verarbeitung von Lebensmitteln ist Ihr Geschäft. Lebensmittelsicherheit ist unseres. Verbraucher
3M Food Safety Das 3M Molekulare Detektionssystem Testen auf Krankheitserreger: schnell und einfach Die Verarbeitung von Lebensmitteln ist Ihr Geschäft. Lebensmittelsicherheit ist unseres. Verbraucher
Technik der subkutanen Injektion
 Technik der subkutanen Injektion Die folgende Anleitung wurde unter Verwendung einer Patienteninformation des Arzneimittelherstellers AMGEN Roche, der das Medikament Neupogen vertreibt, erstellt. Dieselbe
Technik der subkutanen Injektion Die folgende Anleitung wurde unter Verwendung einer Patienteninformation des Arzneimittelherstellers AMGEN Roche, der das Medikament Neupogen vertreibt, erstellt. Dieselbe
Anleitung KONDENSAT TEST KIT 10/13. In der Druckluftindustrie werden verschiedene Kompressor öle, so wie Synthetik- und Mineralöle, verwendet.
 Anleitung KONDENSAT TEST KIT ALLGEMEINE INFORMATIONEN 10/13 In der Druckluftindustrie werden verschiedene Kompressor öle, so wie Synthetik- und Mineralöle, verwendet. Es gibt verschiedene Kompressor Schmierstoffen
Anleitung KONDENSAT TEST KIT ALLGEMEINE INFORMATIONEN 10/13 In der Druckluftindustrie werden verschiedene Kompressor öle, so wie Synthetik- und Mineralöle, verwendet. Es gibt verschiedene Kompressor Schmierstoffen
DIV/ERW/CH/682/01 Page 1 of 5 HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE
 DIV/ERW/CH/682/01 Page 1 of 5 HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE VERWENDEN SIE EINE 5-MIKRON-FILTERKANÜLE MIT DURCHSTECHFLASCHEN VON ERWINASE DER CHARGEN 174* UND 177* Sehr geehrter
DIV/ERW/CH/682/01 Page 1 of 5 HINWEIS ZUM LIEFERENGPASS UND BESONDERE HANDHABUNGSHINWEISE VERWENDEN SIE EINE 5-MIKRON-FILTERKANÜLE MIT DURCHSTECHFLASCHEN VON ERWINASE DER CHARGEN 174* UND 177* Sehr geehrter
Antikörper-Index-Kontrolle Kontrolle zur Bestimmung des Antikörperindex in der Liquordiagnostik
 Antikörper-Index-Kontrolle Kontrolle zur Bestimmung des Antikörperindex in der Liquordiagnostik Bestell-Nr.: Borrelia afzelii+vlse IgG EBV HSV Screen Masern Rubella Virus VZV FSME/TBE IgG EN022L65 IgG
Antikörper-Index-Kontrolle Kontrolle zur Bestimmung des Antikörperindex in der Liquordiagnostik Bestell-Nr.: Borrelia afzelii+vlse IgG EBV HSV Screen Masern Rubella Virus VZV FSME/TBE IgG EN022L65 IgG
Zur Registrierung der Proben sind folgende Angaben auf dem Auftragsschein wichtig:
 Probentransport Zur Registrierung der Proben sind folgende Angaben auf dem Auftragsschein wichtig: Datum der Probenentnahme Uhrzeit der Probenentnahme Vollständige Patientendaten (Name, Vorname, Geburtsdatum
Probentransport Zur Registrierung der Proben sind folgende Angaben auf dem Auftragsschein wichtig: Datum der Probenentnahme Uhrzeit der Probenentnahme Vollständige Patientendaten (Name, Vorname, Geburtsdatum
Empfehlungen für die Aufbereitung und Verabreichung
 Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Öffentliche Gesundheit Stand: 29-10-2009 Der Impfstoff Pandemrix gegen die pandemische Grippe (H1N1) 2009 Empfehlungen
Eidgenössisches Departement des Innern EDI Bundesamt für Gesundheit BAG Direktionsbereich Öffentliche Gesundheit Stand: 29-10-2009 Der Impfstoff Pandemrix gegen die pandemische Grippe (H1N1) 2009 Empfehlungen
ATP Hygiene Monitoring
 3M Food Safety Deutschland ATP Hygiene Monitoring Mathias Boldt, Scientific Marketing & Tech. Service 3M 2009. All Rights Reserved. gemäß DIN 10124:2009 ATP-Messung Grundlagen zur Erfassung des Hygienestatus
3M Food Safety Deutschland ATP Hygiene Monitoring Mathias Boldt, Scientific Marketing & Tech. Service 3M 2009. All Rights Reserved. gemäß DIN 10124:2009 ATP-Messung Grundlagen zur Erfassung des Hygienestatus
AdnaTest EMT-2/StemCell Add-on ProstateDetect
 AdnaTest EMT-2/StemCell Add-on ProstateDetect RT-PCR-Nachweis von Prostatakrebs-assoziierter Genexpression in angereicherten Tumorzellen Nur für Forschungszwecke Gebrauchsanweisung T-1-537-PP Inhaltsverzeichnis
AdnaTest EMT-2/StemCell Add-on ProstateDetect RT-PCR-Nachweis von Prostatakrebs-assoziierter Genexpression in angereicherten Tumorzellen Nur für Forschungszwecke Gebrauchsanweisung T-1-537-PP Inhaltsverzeichnis
SERVA Streptavidin Agarose Resin Agarosematrix zur Affinitätsreinigung von biotinylierten Biomolekülen
 GEBRAUCHSANLEITUNG SERVA Streptavidin Agarose Resin Agarosematrix zur Affinitätsreinigung von biotinylierten Biomolekülen (Kat.-Nr. 42177) SERVA Electrophoresis GmbH - Carl-Benz-Str. 7-69115 Heidelberg
GEBRAUCHSANLEITUNG SERVA Streptavidin Agarose Resin Agarosematrix zur Affinitätsreinigung von biotinylierten Biomolekülen (Kat.-Nr. 42177) SERVA Electrophoresis GmbH - Carl-Benz-Str. 7-69115 Heidelberg
Phosphin Resistenz Test Kit. Gebrauchsanleitung
 Phosphin Resistenz Test Kit Gebrauchsanleitung 1 INHALT 1 Wichtige Hinweise 3 1.1 Adresse 3 1.2 Allgemeine Hinweise 3 1.3 Haftungshinweise 3 2 Bezeichnung 3 3 Anwendungsgebiet 4 4 Zubehör 4 5 Befüllen
Phosphin Resistenz Test Kit Gebrauchsanleitung 1 INHALT 1 Wichtige Hinweise 3 1.1 Adresse 3 1.2 Allgemeine Hinweise 3 1.3 Haftungshinweise 3 2 Bezeichnung 3 3 Anwendungsgebiet 4 4 Zubehör 4 5 Befüllen
ZytoFast DNA (+) Control Probe
 ZytoFast DNA (+) Control Probe (Digoxigenin-markiert) T-1053-400 40 (0,4 ml) Zum Nachweis humaner repetitiver Alu-Sequenzen durch chromogene in situ Hybridisierung (CISH).... In-Vitro-Diagnostikum gemäß
ZytoFast DNA (+) Control Probe (Digoxigenin-markiert) T-1053-400 40 (0,4 ml) Zum Nachweis humaner repetitiver Alu-Sequenzen durch chromogene in situ Hybridisierung (CISH).... In-Vitro-Diagnostikum gemäß
SCQM BIOBANK. Prozessbeschreibung für Spitäler und Praxen. März
 März 16 SCQM BIOBANK Prozessbeschreibung für Spitäler und Praxen SCQM Foundation, Aargauerstrasse 250, 8048 Zuerich, Tel.: +41 (0)43 268 55 77, Fax:+41 (0)43 268 55 79, Email: info@scqm.ch Inhaltsverzeichnis
März 16 SCQM BIOBANK Prozessbeschreibung für Spitäler und Praxen SCQM Foundation, Aargauerstrasse 250, 8048 Zuerich, Tel.: +41 (0)43 268 55 77, Fax:+41 (0)43 268 55 79, Email: info@scqm.ch Inhaltsverzeichnis
Gonokokken. Klinik, Diagnostik, Resistenzlage, Therapie Dr. Peter Kleemann 1
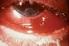 Gonokokken Klinik, Diagnostik, Resistenzlage, Therapie 24.05.2013 Dr. Peter Kleemann 1 Gonokokken Gonokokken sind gramnegative, unbewegliche, nierenförmige, meist paarweise gelagerte Kokken (Diplokokken)
Gonokokken Klinik, Diagnostik, Resistenzlage, Therapie 24.05.2013 Dr. Peter Kleemann 1 Gonokokken Gonokokken sind gramnegative, unbewegliche, nierenförmige, meist paarweise gelagerte Kokken (Diplokokken)
AdnaTest OvarianCancerSelect
 AdnaTest OvarianCancerSelect Anreicherung von Tumorzellen aus dem Blut von Ovarialkrebspatientinnen zur Genexpressionsanalyse Zur In-vitro-Diagnostik Gebrauchsanweisung T-1-526 Inhaltsverzeichnis Bestellinformation...
AdnaTest OvarianCancerSelect Anreicherung von Tumorzellen aus dem Blut von Ovarialkrebspatientinnen zur Genexpressionsanalyse Zur In-vitro-Diagnostik Gebrauchsanweisung T-1-526 Inhaltsverzeichnis Bestellinformation...
cobas T HSV 1/2 Test Erweiterung Ihres STI Menüs mit Dual-Target Detektion für zuverlässige Befunde
 cobas T HSV 1/2 Test Erweiterung Ihres STI Menüs mit Dual-Target Detektion für zuverlässige Befunde Zuverlässige HSV 1/2 Ergebnisse, zukunftssicher Herpes simplex Viren zählen zu den am häufigsten sexuell
cobas T HSV 1/2 Test Erweiterung Ihres STI Menüs mit Dual-Target Detektion für zuverlässige Befunde Zuverlässige HSV 1/2 Ergebnisse, zukunftssicher Herpes simplex Viren zählen zu den am häufigsten sexuell
Mycoplasma gallisepticum
 BACTOTYPE PCR Amplification Kit Mycoplasma gallisepticum Labor Diagnostik Leipzig Gebrauchsanweisung Technologie Die Produktgruppe BACTOTYPE PCR Amplification Kit umfasst optimierte Systeme zum Nachweis
BACTOTYPE PCR Amplification Kit Mycoplasma gallisepticum Labor Diagnostik Leipzig Gebrauchsanweisung Technologie Die Produktgruppe BACTOTYPE PCR Amplification Kit umfasst optimierte Systeme zum Nachweis
Pflanze direkt 2x PCR-Mastermix
 Datenblatt Artikel-Nr. BS91.322.0250 Artikel-Nr. BS91.322.1250 250 Reaktionen in 20 μl 1250 Reaktionen in 20 μl (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen:
Datenblatt Artikel-Nr. BS91.322.0250 Artikel-Nr. BS91.322.1250 250 Reaktionen in 20 μl 1250 Reaktionen in 20 μl (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen:
Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie. Ilka Richert, Bio-Rad Laboratories GmbH
 Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie Ilka Richert, Bio-Rad Laboratories GmbH Hepatitis B Serokonversion Infektionsserologische Tests Sensitivität Spezifität Richtig pos. Ergebnisse
Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie Ilka Richert, Bio-Rad Laboratories GmbH Hepatitis B Serokonversion Infektionsserologische Tests Sensitivität Spezifität Richtig pos. Ergebnisse
HIV1 /HIV2 Schnelltest In nur 60 Sekunden
 HIV1 /HIV2 Schnelltest In nur 60 Sekunden INSTI TM HIV Antikörper Test Features HIV 1 and HIV 2 Antikörpertest Human IgG Kontrolle Findet alle bekannten HIV 1 und HIV 2 Antikörpersubtypen, einschließlich
HIV1 /HIV2 Schnelltest In nur 60 Sekunden INSTI TM HIV Antikörper Test Features HIV 1 and HIV 2 Antikörpertest Human IgG Kontrolle Findet alle bekannten HIV 1 und HIV 2 Antikörpersubtypen, einschließlich
DRINGENDER SICHERHEITSHINWEIS
 DRINGENDER SICHERHEITSHINWEIS Fehlaktivierung der Sicherung des internen Akkus der Astral kann zu einem Stromausfall führen BRIEF FÜR PATIENTEN/PFLEGEPERSONEN Referenz: FSN1706001 Datum: 27. Juni 2017
DRINGENDER SICHERHEITSHINWEIS Fehlaktivierung der Sicherung des internen Akkus der Astral kann zu einem Stromausfall führen BRIEF FÜR PATIENTEN/PFLEGEPERSONEN Referenz: FSN1706001 Datum: 27. Juni 2017
Tests Circulating Tumor Cell Control Kit
 7900003 24 Tests Circulating Tumor Cell Control Kit 1 ZWECKBESTIMMUNG In-vitro-Diagnostikum Das CELLSEARCH Circulating Tumor Cell Control Kit ist als Testkontrolle zur Gewährleistung der korrekten Funktion
7900003 24 Tests Circulating Tumor Cell Control Kit 1 ZWECKBESTIMMUNG In-vitro-Diagnostikum Das CELLSEARCH Circulating Tumor Cell Control Kit ist als Testkontrolle zur Gewährleistung der korrekten Funktion
Zusammenfassender Bericht der Feldstudie ulti med Schweiß-/ Oberflächen-Drogenscreening-System
 Zusammenfassender Bericht der Feldstudie ulti med Schweiß-/ Oberflächen-Drogenscreening-System Parameter (AMP/OPI/THC) (MTD/MET/COC) (AMP/OPI/THC) (PCP/ MET/COC) Produktnummer: 008S804 Produktnummer: 008S805
Zusammenfassender Bericht der Feldstudie ulti med Schweiß-/ Oberflächen-Drogenscreening-System Parameter (AMP/OPI/THC) (MTD/MET/COC) (AMP/OPI/THC) (PCP/ MET/COC) Produktnummer: 008S804 Produktnummer: 008S805
PFBV - ELISA. Enzyme Linked Immuno Sorbent Assay. zum Nachweis des. Pelargonium flower break virus (PFBV)
 Baumgartenstr. 5 D-79285 Ebringen (FRG) Tel.: +49 7664 600254 Fax: +49 7664 600255 Email: info@steffens-biotec.com PFBV - ELISA Enzyme Linked Immuno Sorbent Assay zum Nachweis des Pelargonium flower break
Baumgartenstr. 5 D-79285 Ebringen (FRG) Tel.: +49 7664 600254 Fax: +49 7664 600255 Email: info@steffens-biotec.com PFBV - ELISA Enzyme Linked Immuno Sorbent Assay zum Nachweis des Pelargonium flower break
Kalibrator C Bestellnummern und Chargennummern 19JAN JAN JAN JAN JAN JAN JAN JAN JAN2013
 Healthcare Siemens Healthcare Diagnostics AG, Freilagerstrasse 4, CH-847 Zürich Name Abteilung Robert Schlatter RAQS-EHS Telefon +41( ) 585 581 66 Telefax +41 () 585 581 151 Mobil E-mail robert.schlatter@siemens.com
Healthcare Siemens Healthcare Diagnostics AG, Freilagerstrasse 4, CH-847 Zürich Name Abteilung Robert Schlatter RAQS-EHS Telefon +41( ) 585 581 66 Telefax +41 () 585 581 151 Mobil E-mail robert.schlatter@siemens.com
Auf der Suche nach der Wundermedizin
 Auf der Suche nach der Wundermedizin Experimente im Schullabor 1 Herausgeber Novartis Pharma AG, CH-4002 Basel Autoren: Dr. Gesche Standke und Dr. Christiane Röckl Michel Zeichnungen: Fonds der Chemischen
Auf der Suche nach der Wundermedizin Experimente im Schullabor 1 Herausgeber Novartis Pharma AG, CH-4002 Basel Autoren: Dr. Gesche Standke und Dr. Christiane Röckl Michel Zeichnungen: Fonds der Chemischen
QUANTA Chek ANA Panel
 QUANTA Chek ANA Panel 708111 Verwendungszweck Die QUANTA Chek TM ANA Probereihe wird für die Qualitätskontrolle bei IFA und ELISA antinukleären Antikörperverfahren verwendet. Jedes Serum dient sowohl als
QUANTA Chek ANA Panel 708111 Verwendungszweck Die QUANTA Chek TM ANA Probereihe wird für die Qualitätskontrolle bei IFA und ELISA antinukleären Antikörperverfahren verwendet. Jedes Serum dient sowohl als
GEBRAUCHSANLEITUNG PARASITE SUSPENSIONS. n Parasite Suspensions in Formalin ANWENDUNGSGEBIET INHALT & ERLÄUTERUNG GRUNDLAGEN ZUSAMMENSETZUNG
 GEBRAUCHSANLEITUNG n Parasite Suspensions in Formalin ANWENDUNGSGEBIET Parasite Suspensions von Microbiologics sind zur Unterstützung von Qualitätssicherungsprogrammen bestimmt, indem sie als Vergleichsmaterial
GEBRAUCHSANLEITUNG n Parasite Suspensions in Formalin ANWENDUNGSGEBIET Parasite Suspensions von Microbiologics sind zur Unterstützung von Qualitätssicherungsprogrammen bestimmt, indem sie als Vergleichsmaterial
PROTOKOLLE FÜR DIE VORDESINFEKTION, REINIGUNG UND STERILISATION ALLER ADAPTER VON PIERRE ROLLAND
 PROTOKOLLE FÜR DIE VORDESINFEKTION, REINIGUNG UND STERILISATION ALLER ADAPTER VON PIERRE ROLLAND E-Mail: satelec@acteongroup.com www.acteongroup.com Seite 1 von 8 Anweisungen für die Vordesinfektion, manuelle
PROTOKOLLE FÜR DIE VORDESINFEKTION, REINIGUNG UND STERILISATION ALLER ADAPTER VON PIERRE ROLLAND E-Mail: satelec@acteongroup.com www.acteongroup.com Seite 1 von 8 Anweisungen für die Vordesinfektion, manuelle
Zur Verwendung bei der Isolation von gereinigten Lymphozyten direkt aus Vollblut PACKUNGSBEILAGE. In-vitro-Diagnostikum PI-TT.
 Zur Verwendung bei der Isolation von gereinigten Lymphozyten direkt aus Vollblut PACKUNGSBEILAGE In-vitro-Diagnostikum PI-TT.610-DE-V5 Anwendungsinformationen Verwendungszweck Das T-Cell Xtend Reagenz
Zur Verwendung bei der Isolation von gereinigten Lymphozyten direkt aus Vollblut PACKUNGSBEILAGE In-vitro-Diagnostikum PI-TT.610-DE-V5 Anwendungsinformationen Verwendungszweck Das T-Cell Xtend Reagenz
digene HPV Genotyping RH Test, Amplification Kit Handbuch 20
 April 2010 digene HPV Genotyping RH Test, Amplification Kit Handbuch 20 Version 1 Zur Amplifikation von Hochrisiko-HPV-Genotypen (humanes Papillomvirus) 613413 1057454DE QIAGEN GmbH, QIAGEN Straße 1 D-40724
April 2010 digene HPV Genotyping RH Test, Amplification Kit Handbuch 20 Version 1 Zur Amplifikation von Hochrisiko-HPV-Genotypen (humanes Papillomvirus) 613413 1057454DE QIAGEN GmbH, QIAGEN Straße 1 D-40724
58. Jahrestagung der deutschen STD-Gesellschaft
 58. Jahrestagung der deutschen STD-Gesellschaft 17.-19. September 2009 Bochum Neues zur Chlamydien Diagnostik T. Meyer Institut für Medizinische Mikrobiologie, Virologie und Hygiene Universitätsklinikum
58. Jahrestagung der deutschen STD-Gesellschaft 17.-19. September 2009 Bochum Neues zur Chlamydien Diagnostik T. Meyer Institut für Medizinische Mikrobiologie, Virologie und Hygiene Universitätsklinikum
SERVA Lightning Sci2. SERVA Lightning Sci3. SERVA Lightning Sci5. SERVA Lightning SciDye Set
 GEBRAUCHSANLEITUNG SERVA Lightning Sci2 (Kat.-Nr. 43404) SERVA Lightning Sci3 (Kat.-Nr. 43405) SERVA Lightning Sci5 (Kat.-Nr. 43406) SERVA Lightning SciDye Set (Kat.-Nr. 43407) Fluoreszenzfarbstoffe für
GEBRAUCHSANLEITUNG SERVA Lightning Sci2 (Kat.-Nr. 43404) SERVA Lightning Sci3 (Kat.-Nr. 43405) SERVA Lightning Sci5 (Kat.-Nr. 43406) SERVA Lightning SciDye Set (Kat.-Nr. 43407) Fluoreszenzfarbstoffe für
Sicherheitsdatenblatt
 Sicherheitsdatenblatt Puffer ph 1.679 NIST (9801) 1. Stoff- / Zubereitungs- und Firmenbezeichnung Verwendung des Stoffes/ der Zubereitung Chemische Charakterisierung Lösung zur ph-kalibrierung. Wässrige
Sicherheitsdatenblatt Puffer ph 1.679 NIST (9801) 1. Stoff- / Zubereitungs- und Firmenbezeichnung Verwendung des Stoffes/ der Zubereitung Chemische Charakterisierung Lösung zur ph-kalibrierung. Wässrige
QUANTA Chek Celiac Panel
 QUANTA Chek Celiac Panel 708113 Verwendungszweck Die QUANTA Chek TM Celiac Probereihe wird für die Qualitätskontrolle bei IFA und ELISA Autoantikörper verfahren verwendet. Jedes Serum dient sowohl als
QUANTA Chek Celiac Panel 708113 Verwendungszweck Die QUANTA Chek TM Celiac Probereihe wird für die Qualitätskontrolle bei IFA und ELISA Autoantikörper verfahren verwendet. Jedes Serum dient sowohl als
Säuren und Basen. Biology with Vernier Versuch Nr. 3 Schülerversion LERNZIELE
 Biology with Vernier Versuch Nr. 3 Schülerversion n und n Organismen reagieren oft sehr empfindlich auf die Auswirkungen von n und n in ihrer Umgebung. Sie müssen zum Überleben einen stabilen inneren ph-wert
Biology with Vernier Versuch Nr. 3 Schülerversion n und n Organismen reagieren oft sehr empfindlich auf die Auswirkungen von n und n in ihrer Umgebung. Sie müssen zum Überleben einen stabilen inneren ph-wert
QIAsymphony SP Protokollblatt
 QIAsymphony SP Protokollblatt Protokoll: DNA_Buffy_Coat_400_V6_DSP Allgemeine Informationen Für in-vitro-diagnostische Anwendungen. Dieses Protokoll ist für die Reinigung von genomischer Gesamt-DNA und
QIAsymphony SP Protokollblatt Protokoll: DNA_Buffy_Coat_400_V6_DSP Allgemeine Informationen Für in-vitro-diagnostische Anwendungen. Dieses Protokoll ist für die Reinigung von genomischer Gesamt-DNA und
Screening auf CPE Informationen für Patienten
 Screening auf CPE Informationen für Patienten Bei Fragen zu den folgenden Informationen wenden Sie sich bitte an ein Mitglied Ihres Pflege- oder Ärzteteams. Es ist sehr wichtig, sämtliche Fragen zu klären.
Screening auf CPE Informationen für Patienten Bei Fragen zu den folgenden Informationen wenden Sie sich bitte an ein Mitglied Ihres Pflege- oder Ärzteteams. Es ist sehr wichtig, sämtliche Fragen zu klären.
Pasteurella multocida
 BACTOTYPE PCR Amplification Kit Pasteurella multocida Labor Diagnostik Leipzig Gebrauchsanweisung Technologie Die Produktgruppe BACTOTYPE PCR Amplification Kit umfasst optimierte Systeme zum Nachweis von
BACTOTYPE PCR Amplification Kit Pasteurella multocida Labor Diagnostik Leipzig Gebrauchsanweisung Technologie Die Produktgruppe BACTOTYPE PCR Amplification Kit umfasst optimierte Systeme zum Nachweis von
Informationen zur Sicherheit
 Schreiben für den Anwender Berlin, den 16.11.2015 Unser Zeichen: FSN 2015-01 Informationen zur Sicherheit Wichtige Informationen bezüglich der Bedingungen für die Handhabung und Lagerung des Produkts GlucoMen
Schreiben für den Anwender Berlin, den 16.11.2015 Unser Zeichen: FSN 2015-01 Informationen zur Sicherheit Wichtige Informationen bezüglich der Bedingungen für die Handhabung und Lagerung des Produkts GlucoMen
GEBRAUCHSANWEISUNG. EZ-CFU One Step Mikroorganismen VERWENDUNGSZWECK
 GEBRAUCHSANWEISUNG EZ-CFU One Step Mikroorganismen VERWENDUNGSZWECK Die EZ-CFU One Step Mikroorganismen sind lyophilisierte, ausgezählte Mikroorganismenpräparate zur Verwendung in Industrielabors für die
GEBRAUCHSANWEISUNG EZ-CFU One Step Mikroorganismen VERWENDUNGSZWECK Die EZ-CFU One Step Mikroorganismen sind lyophilisierte, ausgezählte Mikroorganismenpräparate zur Verwendung in Industrielabors für die
BD ProbeTec ET Anleitung für Peripheriegeräte für Mykobakterien-Assays
 BD ProbeTec ET Anleitung für Peripheriegeräte für Mykobakterien-Assays 2003/07 Becton, Dickinson and Company Dokument-Nr.: L 006357(B) 7 Loveton Circle Sparks, Maryland 21152 USA Tel: 800.638.8663 BENEX
BD ProbeTec ET Anleitung für Peripheriegeräte für Mykobakterien-Assays 2003/07 Becton, Dickinson and Company Dokument-Nr.: L 006357(B) 7 Loveton Circle Sparks, Maryland 21152 USA Tel: 800.638.8663 BENEX
siehe auch Leistungsverzeichnis bitte Entnahmestelle angeben z.b. Haut, Mund, Rachen ect.
 Mikrobiologische Entnahmesysteme für Allgemeinmediziner und Kinderärzte z.b. Haut, Mund, Rachen ect. flexibler Abstrichstäbchen z.b. Haut, Mund, Rachen ect. (Kohlepartikel) einschließlich Anaerobier z.b.
Mikrobiologische Entnahmesysteme für Allgemeinmediziner und Kinderärzte z.b. Haut, Mund, Rachen ect. flexibler Abstrichstäbchen z.b. Haut, Mund, Rachen ect. (Kohlepartikel) einschließlich Anaerobier z.b.
Wichtige sicherheitsrelevante Produktinformation (Field Safety Notice, FSN) Fluorocell PLT
 Wichtige sicherheitsrelevante Produktinformation (Field Safety Notice, FSN) Fluorocell PLT Sehr geehrte Anwender der Sysmex XN-Serie Sysmex möchte Sie darüber informieren, dass für den diagnostischen Parameter
Wichtige sicherheitsrelevante Produktinformation (Field Safety Notice, FSN) Fluorocell PLT Sehr geehrte Anwender der Sysmex XN-Serie Sysmex möchte Sie darüber informieren, dass für den diagnostischen Parameter
digene HPV Genotyping LQ Test, Amplification Kit Handbuch 96
 April 2010 digene HPV Genotyping LQ Test, Amplification Kit Handbuch 96 Version 1 Zur Amplifikation von Hochrisiko-Genotypen des humanen Papillomvirus (HPV) 613215 1057457DE QIAGEN GmbH, QIAGEN Straße
April 2010 digene HPV Genotyping LQ Test, Amplification Kit Handbuch 96 Version 1 Zur Amplifikation von Hochrisiko-Genotypen des humanen Papillomvirus (HPV) 613215 1057457DE QIAGEN GmbH, QIAGEN Straße
ZytoFast EBV Probe (Biotin-markiert)
 ZytoFast EBV Probe (Biotin-markiert) T-1014-400 40 (0,4 ml) Zum Nachweis von Epstein-Barr-Virus (EBV) EBER RNA durch chromogene in situ Hybridisierung (CISH) Nur für Forschungszwecke bestimmt Biotin-markierte
ZytoFast EBV Probe (Biotin-markiert) T-1014-400 40 (0,4 ml) Zum Nachweis von Epstein-Barr-Virus (EBV) EBER RNA durch chromogene in situ Hybridisierung (CISH) Nur für Forschungszwecke bestimmt Biotin-markierte
Erfahrungsbericht zur C. trachomatis Diagnostik mit Fallbeispielen
 Erfahrungsbericht zur C. trachomatis Diagnostik mit Fallbeispielen Michaela TRATTNIG, Biomedizinische Analytikerin Dermatologie KA Rudolfstiftung, Wien Chlamydia trachomatis Gram negatives, kokkoides Bakterium
Erfahrungsbericht zur C. trachomatis Diagnostik mit Fallbeispielen Michaela TRATTNIG, Biomedizinische Analytikerin Dermatologie KA Rudolfstiftung, Wien Chlamydia trachomatis Gram negatives, kokkoides Bakterium
Das Reagenz speziell für die Transfektion von Säugerzellen mit sirna und mirna
 METAFECTENE SI + Das Reagenz speziell für die Transfektion von Säugerzellen mit sirna und mirna Bestellinformationen, MSDS, Publikationen und Anwendungsbeispiele unter www.biontex.com Produkt Katalognummer
METAFECTENE SI + Das Reagenz speziell für die Transfektion von Säugerzellen mit sirna und mirna Bestellinformationen, MSDS, Publikationen und Anwendungsbeispiele unter www.biontex.com Produkt Katalognummer
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER. AQUA STEROP AQUA STEROP FLEXO Lösungsmittel zur Herstellung von Parenteralia. Wasser zur Injektion
 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AQUA STEROP AQUA STEROP FLEXO Lösungsmittel zur Herstellung von Parenteralia Wasser zur Injektion Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER AQUA STEROP AQUA STEROP FLEXO Lösungsmittel zur Herstellung von Parenteralia Wasser zur Injektion Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
Serologisches Untersuchungsspektrum. Allgemeine Hinweise:
 Serologisches Untersuchungsspektrum Anaplasma phagocytophilum Bartonella henselae Brucella spp. Chlamydia trachomatis Mycobacterium tuberculosis Salmonella spp. Yersinia enterocolitica Allgemeine Hinweise:
Serologisches Untersuchungsspektrum Anaplasma phagocytophilum Bartonella henselae Brucella spp. Chlamydia trachomatis Mycobacterium tuberculosis Salmonella spp. Yersinia enterocolitica Allgemeine Hinweise:
Bradford Reagent, 5x
 GEBRAUCHSANLEITUNG Bradford Reagent, 5x Reagenz für die Proteinkonzentrationsbestimmung (Kat.-Nr. 39222) SERVA Electrophoresis GmbH Carl-Benz-Str. 7 D-69115 HeidelbergPhone +49-6221-138400, Fax +49-6221-1384010
GEBRAUCHSANLEITUNG Bradford Reagent, 5x Reagenz für die Proteinkonzentrationsbestimmung (Kat.-Nr. 39222) SERVA Electrophoresis GmbH Carl-Benz-Str. 7 D-69115 HeidelbergPhone +49-6221-138400, Fax +49-6221-1384010
Tests Circulating Tumor Cell Control Kit
 7900003 24 Tests Circulating Tumor Cell Control Kit 1 ZWECKBESTIMMUNG In-vitro-Diagnostikum Das CELLSEARCH Circulating Tumor Cell Control Kit ist als Testkontrolle zur Gewährleistung der korrekten Funktion
7900003 24 Tests Circulating Tumor Cell Control Kit 1 ZWECKBESTIMMUNG In-vitro-Diagnostikum Das CELLSEARCH Circulating Tumor Cell Control Kit ist als Testkontrolle zur Gewährleistung der korrekten Funktion
ZytoFast DNA (+) Control Probe
 ZytoFast DNA (+) Control Probe (Biotin-markiert) T-1022-100 10 (0,1 ml) Zum Nachweis humaner repetitiver Alu-Sequenzen durch chromogene in situ Hybridisierung (CISH) Nur für Forschungszwecke bestimmt Biotin-markierte
ZytoFast DNA (+) Control Probe (Biotin-markiert) T-1022-100 10 (0,1 ml) Zum Nachweis humaner repetitiver Alu-Sequenzen durch chromogene in situ Hybridisierung (CISH) Nur für Forschungszwecke bestimmt Biotin-markierte
: SSG 4000 E. Version 1. Druckdatum Überarbeitet am
 1. STOFF-/ZUBEREITUNGS- UND FIRMENBEZEICHNUNG Handelsname Verwendung : : Silicon Elastomer Firma : Momentive Performance Materials GmbH Chempark Leverkusen Gebaeude V7 DE - 51368 Leverkusen Telefon : +49
1. STOFF-/ZUBEREITUNGS- UND FIRMENBEZEICHNUNG Handelsname Verwendung : : Silicon Elastomer Firma : Momentive Performance Materials GmbH Chempark Leverkusen Gebaeude V7 DE - 51368 Leverkusen Telefon : +49
Mycobacterium paratuberculosis
 BACTOTYPE PCR Amplification Kit Mycobacterium paratuberculosis Labor Diagnostik Leipzig Gebrauchsanweisung Technologie Die Produktgruppe BACTOTYPE PCR Amplification Kit umfasst optimierte Systeme zum Nachweis
BACTOTYPE PCR Amplification Kit Mycobacterium paratuberculosis Labor Diagnostik Leipzig Gebrauchsanweisung Technologie Die Produktgruppe BACTOTYPE PCR Amplification Kit umfasst optimierte Systeme zum Nachweis
Protokoll Praktikum für Humanbiologie Studenten
 Protokoll Praktikum für Humanbiologie Studenten Teil A: Charakterisierung der Auswirkungen von γ Interferon auf die Protein und mrna Mengen in humanen A549 Lungenepithelzellen. Studentenaufgaben Tag 1
Protokoll Praktikum für Humanbiologie Studenten Teil A: Charakterisierung der Auswirkungen von γ Interferon auf die Protein und mrna Mengen in humanen A549 Lungenepithelzellen. Studentenaufgaben Tag 1
GEBRAUCHSANLEITUNG. Lowry Assay Kit. Kit für die Proteinkonzentrationsbestimmung. (Kat.-Nr )
 GEBRAUCHSANLEITUNG Lowry Assay Kit Kit für die Proteinkonzentrationsbestimmung (Kat.-Nr. 39236) SERVA Electrophoresis GmbH Carl-Benz-Str. 7 D-69115 Heidelberg Phone +49-6221-138400, Fax +49-6221-1384010
GEBRAUCHSANLEITUNG Lowry Assay Kit Kit für die Proteinkonzentrationsbestimmung (Kat.-Nr. 39236) SERVA Electrophoresis GmbH Carl-Benz-Str. 7 D-69115 Heidelberg Phone +49-6221-138400, Fax +49-6221-1384010
FRUKTOSEMALABSORPTION
 - FRUKTOSEMALABSORPTION DURCHFÜHRUNG ZUM NACHWEIS EINER FRUKTOSEMALABSORPTION DAS PRINZP Bei einer Fruktosemalabsorption ist die Aufnahme (Resorption) von Fruchtzucker aus dem Dünndarm gestört. Nach Zufuhr
- FRUKTOSEMALABSORPTION DURCHFÜHRUNG ZUM NACHWEIS EINER FRUKTOSEMALABSORPTION DAS PRINZP Bei einer Fruktosemalabsorption ist die Aufnahme (Resorption) von Fruchtzucker aus dem Dünndarm gestört. Nach Zufuhr
Von Microgenics lieferbare Materialien:
 Microgenics Corporation Part of Thermo Fisher Scientific CEDIA Cyclosporine PLUS High Range Anwendung Ortho Clinical Diagnostics VITROS 5600 Integrated System und VITROS 5,1 FS und 4600 Chemistry Systeme
Microgenics Corporation Part of Thermo Fisher Scientific CEDIA Cyclosporine PLUS High Range Anwendung Ortho Clinical Diagnostics VITROS 5600 Integrated System und VITROS 5,1 FS und 4600 Chemistry Systeme
Gefahren für Mensch und Umwelt
 Betriebsanweisung nach 14 GefStoff (Sammelanweisung) Version 02-11/09 Umgang mit Methanol Datum: Unterschrift: Gefahren für Mensch und Umwelt Zukünftig Gefahr Giftig beim Einatmen, Hautkontakt, Verschlucken
Betriebsanweisung nach 14 GefStoff (Sammelanweisung) Version 02-11/09 Umgang mit Methanol Datum: Unterschrift: Gefahren für Mensch und Umwelt Zukünftig Gefahr Giftig beim Einatmen, Hautkontakt, Verschlucken
PreventID Ovulation. Weiterführende Informationen Testanleitung (Teststreifen) Testanleitung (Testkassette)
 Weiterführende Informationen estanleitung (eststreifen) estanleitung (estkassette) KS12110 (eststreifen) Der (Art.-Nr. KS 12110 als Streifenversion) ist ein Schnelltest zum Nachweis des luteinisierenden
Weiterführende Informationen estanleitung (eststreifen) estanleitung (estkassette) KS12110 (eststreifen) Der (Art.-Nr. KS 12110 als Streifenversion) ist ein Schnelltest zum Nachweis des luteinisierenden
