INSTITUT FÜR MOLEKULARE UND ZELLULÄRE ANATOMIE MIKROSKOPISCHE ANATOMIE ARBEITSBUCH zum Kurs für Studierende der Human- und Zahnmedizin
|
|
|
- Elly Böhme
- vor 6 Jahren
- Abrufe
Transkript
1 INSTITUT FÜR MOLEKULARE UND ZELLULÄRE ANATOMIE MIKROSKOPISCHE ANATOMIE 2017 ARBEITSBUCH zum Kurs für Studierende der Human- und Zahnmedizin
2 1. Allgemeine Hinweise Kursstruktur und Termine Ziele und Verhaltensregeln Scheinkriterien Hinweise für Wiederholer Besondere Regelungen für den Studiengang Molekulare Medizin Literaturempfehlungen Verzeichnis der Kurspräparate und -abbildungen Kursprogramm Kurstag 1 Werkzeuge und histologische Techniken Kurstag 2 Epithelgewebe I Kurstag 3 Epithelgewebe II Kurstag 4 Binde- und Fettgewebe Kurstag 5 Knorpel- und Knochengewebe Kurstag 6 Muskelgewebe Kurstag 7 Nerven- und Gliagewebe, Rückenmark Kurstag 8 Zentrales Nervensystem (ZNS) Kurstag 9 Sinnesorgane Kurstag 10 Haut, Hautanhangsgebilde Kurstag 11 Kreislauforgane und Blut Kurstag 12 Lymphatische Organe Kurstag 13 Respirationstrakt Kurstag 14 Verdauungstrakt I Kurstag 15 Verdauungstrakt II Kurstag 16 Verdauungstrakt III Kurstag 17 Endokrine Organe Kurstag 18 Niere und ableitende Harnwege Kurstag 19 Männliche Geschlechtsorgane Kurstag 20 Weibliche Geschlechtsorgane Glossar Aktuelle Informationen zu dieser anatomischen Lehrveranstaltung finden Sie unter:
3 1
4 INSTITUT FÜR MOLEKULARE UND ZELLULÄRE ANATOMIE KURSUS DER MIKROSKOPISCHEN ANATOMIE Sommersemester 2017 für Studierende der Human-, Zahn- und Molekularen Medizin 1. Allgemeine Hinweise 1.1. Kursstruktur und Termine Kursleitung: Prof. Dr. Stefan Britsch Der Kursus der Mikroskopischen Anatomie wird jeweils im Sommersemester für Studierende der Human- (HM), Zahn- (ZM), und Molekularen Medizin (Wiederholer nach Prüfungsordnung 2011, MM) angeboten. Er wird in 3 inhaltlich identischen Parallelkursen durchgeführt und umfasst jeweils 20 Kurstage, wobei die Kurstage 19 und 20 (Kursthemen: männliche und weibliche Geschlechtsorgane) für Studierende der ZM entfallen. Inhaltlich gliedert sich der Kursus der Mikroskopischen Anatomie in einen allgemeinen (Werkzeuge und Techniken, Zytologie, allgemeine mikroskopische Anatomie und Gewebelehre) und einen speziellen Teil (spezielle mikroskopische Anatomie). Jeweils am Ende beider Kursteile finden Leistungskontrollen statt. Kursbegleitend werden außerdem die 4-stündige Vorlesung Mikroskopische Anatomie (= Vorlesung Anatomie B ), sowie die vertiefende Veranstaltung HistoScout angeboten. Unseren Studierenden steht außerdem die virtuelle Unterrichtsplattform MyMiCROscope ( sowie die neu entwickelte App MyMi.mobile ( zur Vor- und Nachbereitung der Kursinhalte zur Verfügung. Dieses Angebot ist passwortgeschützt. Sie erhalten den Zugangscode im Rahmen der Hauptvorlesung bzw. über die jeweiligen Fachschaftsvertretungen. Darüber hinaus finden Sie im Übersichtsplan am Ende des Kursskripts Informationen zum Integrierten Seminar DeepInCyte Molekulare Histologie (nur HM). KURSANMELDUNG: Für Studierende der Human- und Zahnmedizin sowie für Kurswiederholer (MM nach Prüfungsordnung 2011, HM, ZM) erfolgt die verbindliche Kursanmeldung online beim Studiendekanat ( Kurs- und Platzzuteilung erfolgen im Rahmen der Online-Anmeldung. Kurs- und Platznummer werden zu Semesterbeginn per Aushang im Kurssaal (N26, Raum 218) nochmals bestätigt. In Ausnahmefällen kann es aus organisatorischen Gründen zu einer kurzfristigen Änderung Ihrer Platznummer kommen. Der zugeteilte Platz ist unbedingt einzuhalten. Nachrücker werden gebeten, sich bei Kursbeginn zunächst mit Frau Hartwig in Verbindung zu setzen, bevor sie einen Kursplatz einnehmen. Zahnmediziner, Molekulare Mediziner oder nachgerückte Humanmediziner sind grundsätzlich dem Kurs III zugeordnet. KURSORT: N26, Raum 218 2
5 KURSZEITEN: Kurs I (HM): Mo 09:15-11:00 Uhr und Mi 09:15-11:00 Uhr Kurs II (HM): Di 08:15-10:00 Uhr und Do 08:15-10:00 Uhr Kurs III (HM, ZM, MM): Mi 11:15-13:00 Uhr und Fr 10:15-12:00 Uhr KURSEINFÜHRUNG: Kurse I, II, III: Di , 08:15 09:00 Uhr, Hörsaal H4/5 KURSBEGINN: Kurs I: Mi , 09:15-11:00 Uhr Kurs II: Do , 08:15-10:00 Uhr Kurs III: Mi , 11:15-13:00 Uhr KURSENDE: Kurs I: Mo , 09:15-11:00 Uhr Kurs II: Mo , 08:15-10:00 Uhr Kurs III: Fr , 10:15-12:00 Uhr KURS-/VORLESUNGSFREIE TAGE: Maifeiertag: Mo Christi Himmelfahrt: Do Pfingstmontag: Mo Fronleichnam: Do Brückentag: Fr PRÜFUNGEN: Zwischenprüfung: Do (allgemeiner theoretischer Teil) Abschlussprüfung: Mi (praktischer Teil) Mo (spezieller theoretischer Teil) KURSBEGLEITENDE VERANSTALTUNGEN: Begleitvorlesung: Mo 08:15-09:00 Uhr (= Vorlesung Anatomie B ) Mo 13:15-14:00 Uhr Mi 08:15-09:00 Uhr Fr 08:15-09:00 Uhr Di 08:15-09:00 Uhr Do 13:15-14:00 Uhr Fr 09:15-10:00 Uhr HistoScout: Mo 18:00-19:00 Uhr Kurs III (Beginn: ) Mo 19:00-20:00 Uhr Kurs I Fr 09:00-10:00 Uhr Kurs II KURSORGANISATION: Siglinde Hartwig KURSLEITUNG: Prof. Dr. Stefan Britsch Tel , siglinde.hartwig@uni-ulm.de Tel ; stefan.britsch@uni-ulm.de AKTUELLE KURSINFORMATIONEN: oder 3
6 1.2. Ziele und Verhaltensregeln Ziel des Kurses ist es, durch die lichtmikroskopische Untersuchung von Schnittpräparaten den dreidimensionalen Aufbau sowie Struktur-Funktionsbeziehungen der Gewebe und Organe des menschlichen Körpers zu verstehen. Das mikroskopische Studium setzt sehr gute Kenntnisse über den Aufbau und die Funktion von Zellen (Zytologie) voraus. Es ist darüber hinaus unverzichtbar, dass sich jeder Kursteilnehmer vor Beginn der einzelnen Kursabschnitte anhand der empfohlenen Lehrbücher und Atlanten, sowie der Inhalte der Begleitvorlesung grundlegendes histologisches Vorwissen aneignet. Für die gezielte Vor- und Nachbereitung der Kursinhalte stehen außerdem der Kurssaal im Rahmen der Veranstaltung HistoScout sowie MyMiCROscope und die mobile App MyMi.mobile ( zur Verfügung. LERNZIELKATALOG: Der den einzelnen Kurstagen vorangestellte Lernzielkatalog orientiert sich an dem vom IMPP veröffentlichten Gegenstandskatalog für die 1. ärztliche Prüfung (M1) und soll Sie bei der Erarbeitung der prüfungsrelevanten Lerninhalte des Kursus der Mikroskopischen Anatomie unterstützen. PRAKTISCHE LERNZIELE: Im Rahmen des Kursus der Mikroskopischen Anatomie sollen neben theoretischen Kenntnissen folgende praktische Fähigkeiten erworben werden: Korrekte Handhabung und Justierung des Mikroskops Erkennen typischer histologischer Färbungen und Techniken am Präparat Systematische Analyse von mikroskopischen Präparaten mit gezieltem Aufsuchen charakteristischer Strukturen und ihrer zeichnerischen Dokumentation Selbständiges Erstellen von Gewebe-/Organdiagnosen anhand eines Präparats einschließlich differentialdiagnostischer Erörterung und Abgrenzung ZEICHNUNGEN: Während des Kurses sollen von mikroskopierten Präparaten Zeichnungen angefertigt werden. Das kontinuierliche Zeichnen soll die Beobachtung, das erinnernde Sehen und das strukturierte Herangehen an ein mikroskopisches Präparat schulen. Es setzt keinerlei künstlerische Begabung voraus und kann von jedem Studierenden erlernt werden. Die Zeichnungen sollen allerdings Größenverhältnisse und Lagebeziehungen einzelner mikroskopischer Strukturen korrekt wiedergeben. Das Anfertigen und präzise Beschriften von Zeichnungen erleichtert außerdem die Kommunikation mit den Dozenten und hilft, Missverständnisse auszuräumen. Benutzen Sie beim Zeichnen bitte keinen Kugelschreiber, sondern Blei- oder Buntstifte. MIKROSKOPE UND PRÄPARATE: Mikroskope, Präparatekästen und Bildmappen sind jeweils bestimmten Platznummern zugeteilt. Die mit Nummern gekennzeichneten Mikroskope müssen unbedingt an den entsprechenden Plätzen verbleiben. Für deren intakten Zustand haften alle Studierenden gemeinsam, die auf diesem Platz eingewiesen sind. Defekte an den Mikroskopen sind sofort mitzuteilen. Insbesondere ist auf die pflegliche Behandlung der mikroskopischen Präparate zu achten, da deren Anfertigung zeitraubend und teuer ist. Zum Teil ist das Material unersetzlich. Die Scheinvergabe kann daher nur erfolgen, nachdem Präparatekästen und Bildmappen am Ende des Kurses vollständig zurückgegeben und vorsätzliche Beschädigungen oder Manipulationen an den zugewiesenen Mikroskopen ausgeschlossen wurden. Die Präparatekästen werden zu Beginn jedes Kurstages von den Tutoren gegen Vorlage des Studenten-/Kursausweises ausgegeben. Für beschädigte oder verlorene Präparate bzw. Bildmappen berechnen wir eine Gebühr von 30,-/Präparat bzw. 100,-/Mappe. Kann der Verursacher nicht festgestellt werden, verteilt sich der Betrag auf alle Inhaber des jeweiligen Kursplatzes. Präparatekästen oder einzelne Präparate dürfen unter keinen Umständen aus dem Kurssaal entfernt werden! Im Kursraum sind außerdem Rauchen, Essen und Trinken, sowie die private Benutzung von Handys oder ähnlicher elektronischer Geräte mit Ausnahme für die Nutzung von MyMiCROscope und MyMi.mobile nicht gestattet. 4
7 1.3. Scheinkriterien VORAUSSETZUNGEN FÜR DIE SCHEINVERGABE: 1. Regelmäßige Kursteilnahme (nicht mehr als 3 Fehltage) 2. Bestandene Leistungskontrolle (mindestens 60% der erreichbaren Punkte) 3. Vollständige Rückgabe von Kurspräparaten und Bildmappe, bzw. Ersatz beschädigter oder verlorener Präparate. ANWESENHEIT: Die regelmäßige Teilnahme an 20 Kurstagen kann nicht mehr angenommen werden, wenn der Studierende egal aus welchen Gründen mehr als 3 Kurstage (mehr als 15% der Gesamtkurszeit) gefehlt hat. LEISTUNGSKONTROLLEN: Mit der Kursanmeldung ist die verbindliche Anmeldung zu den kursinternen Leistungskontrollen 1-3 verbunden. Bitte beachten Sie die besonderen Regelungen für den Studiengang Molekulare Medizin in Abschnitt 1.5. Die Leistungskontrollen im Rahmen des Kursus der Mikroskopischen Anatomie setzen sich aus insgesamt 3 Einzelprüfungen zusammen: 1. Zwischenprüfung: Klausur über insgesamt 20 MC-Fragen (Einfachauswahlfragen, teilweise mit Abbildungen) nach dem 7. Kurstag. Diese Prüfung umfasst den Unterrichtsstoff der Allgemeinen Mikroskopischen Anatomie, also der Kurstage 1-7, Kenntnisse der Zytologie, der korrespondierenden Inhalte der Begleitvorlesung Anatomie B, sowie die im Rahmen der Vorlesung Anatomie A erworbenen Grundkenntnisse der allgemeinen mikroskopischen Anatomie. 2. Theoretische Abschlussprüfung: Klausur über insgesamt 30 MC-Fragen (Einfachauswahlfragen, teilweise mit Abbildungen) nach Kursende. Diese Prüfung umfasst den gesamten Unterrichtsstoff der Speziellen Mikroskopischen Anatomie, also der Kurstage 8-20 sowie der korrespondierenden Inhalte der Begleitvorlesung Anatomie B. 3. Praktische Abschlussprüfung: 2 lichtmikroskopische Präparate sollen mikroskopiert werden. Zu einem Präparat soll die korrekte Diagnose gestellt und differentialdiagnostisch begründet werden. Im zweiten Fall soll das Präparat diagnostiziert werden und charakteristische, Diagnosebegründende Baumerkmale in zeichnerischer Form kurz dargestellt werden, wie es während des Kurses mit den Teilnehmern eingeübt wurde. In diesem Prüfungsteil können insgesamt 20 Punkte erreicht werden. Insgesamt können in den 3 Prüfungsabschnitten also 70 Punkte erreicht werden. Für das Bestehen der Leistungskontrolle und damit für den Scheinerwerb müssen aus allen 3 Prüfungen kumulativ mindestens 60%, d.h. 42 Punkte erzielt werden. Es ist nicht erforderlich, dass in jedem einzelnen Prüfungsteil mindestens 60% der erreichbaren Punkte erzielt werden, entscheidend ist die Gesamtzahl von mindestens 42 Punkten aus allen 3 Prüfungen. Diese Kriterien zum Scheinerwerb gelten nur, soweit keine Änderungen der Studienordnung für den Studiengang Humanmedizin vom erfolgt sind. Bei Nicht-Bestehen der Leistungskontrollen (insgesamt weniger als 42 Punkte, bzw. 60% der erreichbaren Punktezahl) und regelmäßiger Teilnahme am Kurs besteht die Möglichkeit, zu Beginn des Wintersemesters, Anfang Oktober 2017, an einer Wiederholungsklausur (40 MC-Fragen) über das gesamte Stoffgebiet der Mikroskopischen Anatomie und der Zytologie teilzunehmen. Für die Durchführung der schriftlichen MC-Prüfungen gelten die offiziellen Hinweise des IMPP, insbesondere folgender Absatz: Der in einer Prüfungsfrage angesprochene Sachverhalt bezieht sich, soweit im Aufgabentext nicht ausdrücklich besondere Bedingungen angesprochen werden, grundsätzlich auf den medizinischen oder wissenschaftlichen Regelfall sowie auf die Gegebenheiten in der Bundesrepublik Deutschland. 5
8 KRANKHEITSBEDINGTES VERSÄUMEN VON LEISTUNGSKONTROLLEN: Mit der Kursanmeldung erfolgt die verbindliche Anmeldung zu den Prüfungen des Kurses. Bei krankheitsbedingtem Fehlen an Prüfungsterminen muss ein ärztliches Attest innerhalb von drei Werktagen direkt beim Kursleiter bzw. bei Frau Hartwig im Lehrsekretariat vorliegen. 3 Absatz (6-8) der Studienordnung der Universität Ulm sieht darüber hinaus vor, dass das unentschuldigte Fehlen bei einer Prüfung oder jeder Betrugsversuch zu einer Annullierung der jeweiligen Prüfung (Wertung: 0 Punkte) führen. SCHEINAUSGABE: Scheine für Zahnmediziner können persönlich zu Beginn des Wintersemesters im Lehrsekretariat des Instituts für Molekulare und Zelluläre Anatomie abgeholt werden. Sprechzeiten und aktuelle Informationen finden Sie auf unserer Homepage. Die Ergebnismitteilungen für die Studiengänge Humanmedizin und Molekulare Medizin erfolgen elektronisch an die zuständigen Studiendekanate Hinweise für Wiederholer Für die Teilnahme an der Wiederholungsklausur ist die vorherige Anmeldung über die Corona (Studiengänge Human- und Zahnmedizin) bzw. das Hochschulportal (Studiengang Molekulare Medizin) und eine schriftliche Anmeldung im Lehrsekretariat des Instituts für Molekulare und Zelluläre Anatomie zwingend erforderlich (Ausschlussfrist: 4-7 Werktage, je nach Studiengang, vor dem Klausurtermin). Das Anmeldeformular/Kursverzichtsformular finden Sie auf unserer Institutshomepage unter der Rubrik Aktuelles. Die Anmeldung zur Wiederholungsklausur muss fristgerecht vor dem Klausurtermin entweder per E- Mail an Frau Hartwig (siglinde.hartwig@uni-ulm.de) eingegangen oder persönlich im Lehrsekretariat abgegeben worden sein. Anmeldeschluss: siehe Homepage des Instituts für Molekulare und Zelluläre Anatomie, Lehre, Aktuelles sowie MOODLE. Kurswiederholer Kategorie I: Sie haben nicht regelmäßig am Kurs teilgenommen unabhängig davon, ob Sie die Leistungskontrolle bestanden haben oder nicht. Demnach nehmen Sie am kompletten Kurs unter den herkömmlichen Teilnahmebedingungen wie Kursteilnehmer im 1. Versuch teil (maximal 3 Kurstage Fehlzeit; mindestens 60% in den drei Prüfungsteilen). Kurswiederholer Kategorie II: Sie haben bereits regelmäßig in einem vorangegangenen Kurs an den praktischen Übungen teilgenommen, aber die Leistungskontrollen nicht bestanden. Demnach können Sie ein zweites Mal mit nicht mehr als 3 Fehlterminen am Kurs teilnehmen. Sie haben aber auch die Möglichkeit, schriftlich auf die Kursteilnahme zu verzichten und nur die Leistungskontrollen zu absolvieren. Die Teilnahme an den Leistungskontrollen kann an den regulären Prüfungen im Kursverlauf erfolgen (siehe 2.3) oder an einer der Wiederholungsklausuren. Kurswiederholer Kategorie III: Sie haben bereits zweimal an den praktischen Übungen teilgenommen, aber die Leistungskontrollen nicht bestanden. Demnach können Sie kein weiteres Mal am praktischen Kurs jedoch weiterhin an den Wiederholungsklausuren teilnehmen (schriftliche Anmeldung erforderlich). Bitte beachten Sie: 3 Absatz (2, 3) der Studienordnung der Universität Ulm sieht vor, dass nur innerhalb von 24 Monaten nach Beginn der Lehrveranstaltung Prüfungen, die für die erfolgreiche Teilnahme erforderlich sind, höchstens dreimal abgelegt werden können. 6
9 1.5. Regelungen für den Bachelor-Studiengang Molekulare Medizin Die 1. Wiederholungsprüfung für Studierende des Studiengangs Molekulare Medizin (nach Prüfungsordnung 2011) findet jeweils Anfang Oktober statt. Zugelassen werden ausschließlich Studierende, die für die kursinternen Leistungskontrollen 1-3 angemeldet waren bzw. diese nicht bestanden haben. Die 2. Wiederholungsprüfung für Studierende des Studiengangs Molekulare Medizin (nach Prüfungsordnung 2011) findet jeweils im darauffolgenden Sommersemester statt. Eine informelle Anmeldung per an Lehrsekretariat Institut für Molekulare und Zelluläre Anatomie, ist aus organisatorischen Gründen erforderlich. Falls ein Kursteilnehmer mit Attest wegen Prüfungsunfähigkeit von der Erstprüfung zurückgetreten ist, muss sich dieser direkt bei Herrn Mangold zur Wiederholungsprüfung im Studiensekretariat anmelden (eine Online-Anmeldung ist in diesem Fall nicht möglich). Im Namen aller Dozent*innen und Mitarbeiter*innen wünsche ich allen Kursteilnehmer*innen einen erfolgreichen Kursus der Mikroskopischen Anatomie! Prof. Dr. med. Stefan Britsch Institut für Molekulare und Zelluläre Anatomie 2. Literaturempfehlungen Lehrbücher Lüllmann-Rauch, R: Taschenlehrbuch Histologie. Thieme Verlag, Stuttgart, 5. Auflage 2015 Kerr, J.B.: Functional Histology. Elsevier, 2nd edition, 2009 Ross, MH, Pawlina, W: Histology A Text and Atlas with correlated cell and molecular biology. Lippincott Williams & Wilkins, 7th edition, 2015 Welsch, U: Sobotta Lehrbuch Histologie. Zytologie, Histologie, Mikroskopische Anatomie. Urban und Fischer, 4. Auflage 2014 Nachschlagewerke Alberts, B et al.: Molecular Biology of the cell. Garland Science, 6 th edition, 2014 Benninghoff, A, Drenckhahn, D: Anatomie. Urban und Fischer, 17. Auflage, 2008 Standring, S. et al.: Gray s Anatomy. The anatomical basis of clinical practice. 40 th edition, 2008 Atlanten Kühnel, W.: Taschenatlas Histologie Thieme, Stuttgart, 13. Auflage, 2014 Sobotta/Hammersen: Histologie: Farbatlas der Mikroskopischen Anatomie. Urban und Fischer, 7. Auflage, 2005 Ross, MH, Pawlina, W, Barnash, TA: Atlas of Descriptive Histology. Sinauer Associates, 2009 Internet Resourcen MyMiCROscope: ( MyMi.mobile ( 7
10 3. Verzeichnis der Kurspräparate und -abbildungen (BM = Bildmappe) Kurstag 1 Werkzeuge 34. Blutausstrich (Leukozytenkonzentrat), Mensch, Pappenheim 73. Niere, Schwein, H.E. 11. Unterhaut, Ratte, Semidünnschnitt, Richardson Kurstag 2 Epithelgewebe I 73. Niere, Schwein, H.E. (einschichtiges Plattenepithel) 15. Auge, Schwein, H.E. [Übungspräparat] 73. Niere, Schwein, H.E. (einschichtiges, isoprismatisches Epithel) BM 11 Tubulus contortus, Maus 1. Schilddrüse, Schwein, H.E. [Übungspräparat] 71. Gallenblase, Mensch, H.E. (einschichtiges, hochprismatisches Epithel) 2. Dünndarm, menschl. Foetus, Azan [Übungspräparat] 12. Trachea, Mensch, H.E. (mehrreihiges, hochprismatisches Epithel mit Kinozilien) 3. Nebenhodengang, Schaf, HOPA [Übungspräparat] 4. Oesophagus, Mensch, H.E. (mehrschichtiges, unverhorntes Plattenepithel) 86. Vagina, Mensch, H.E. [Übungspräparat] 5. Fingerbeere, Mensch, H.E. (mehrschichtiges, verhorntes Plattenepithel) Kurstag 3 Epithelgewebe II 75. Ureter, Mensch, H.E. (Übergangsepithel) 65. Colon, Mensch, H.E. (einzellige Drüsen) 40. Kopfhaut, Mensch, H.E. (alveoläre Talgdrüsen) 40. Kopfhaut, Mensch, H.E. (tubulöse Drüsen) 41. Achselhaut, Mensch, van Gieson (tubuloalveoläre Drüsen) 43. Glandula submandibularis, Mensch, Azan (tubuloazinöse Drüsen) 8
11 Kurstag 4 Binde- und Fettgewebe 6. Rattenfetus, HOPA (mesenchymales, embryonales Bindegewebe) 2. Dünndarm, Mensch, Azan (lockeres, faseriges Bindegewebe) BM 2 Kollagenfasern der Epineuralscheide, Ratte 41. Achselhaut, Mensch, van Gieson [Übungspräparat] 8. Pankreas Mensch, Versilberung (retikulärfaseriges Bindegewebe) 56. Lunge, Mensch, Elastika-/Resorcinfuchsin (Bindegewebe mit elastischen Fasern) BM 20 Kollagenfibrillen und elastische Fasern, Ratte 7. Mesenterium, Häutchenpräparat, Hämalaun-Thiazinrot [Demo-/Übungspräparat] 9. Skrotalhaut, Mensch, Orcein [Übungspräparat] 10. Makrophagen (Milz), Ratte, Tusche (in vivo), H.E. (ortsfremde, mobile Bindegewebszellen) 11. Mastzellen, Ratte, Semidünnschnitt, Richardson 72. Niere, Ratte, HOPA (Fettgewebe) BM 3 Fettzellen und kollagene Fasern 41. Achselhaut, Mensch, van Gieson [Übungspräparat] 44. Glandula parotidea, Mensch, Azan [Übungspräparat] Kurstag 5 Knorpel- und Knochengewebe 12. Trachea, Mensch, H.E. (hyaliner Knorpel) 13. Epiglottis, Affe, Orcein-Hämalaun (elastischer Knorpel) 14. Discus intervertebralis, Mensch, H.E. (Faserknorpel) 6. Rattenfetus, HOPA (desmale Osteogenese) 16. Knie, menschl. Fetus ( Woche), H.E. (chondrale Osteogenese) 17. Tibia (quer, Knochenschliff), Schaf, Fuchsin (Lamellenknochen) Kurstag 6 Muskelgewebe 18. Darm, Axolotl, Hopa (glatte Muskulatur) 76. Harnblase, Hund, H.E. 19. Quergestreifte Muskulatur, Hund, Eisenhämatoxylin (quergestreifte Muskulatur) BM 4 Skelettmuskel, Amphibienlarve 20. Zunge, Katze, HOPA oder van Gieson 21. Herzmuskel, Mensch, H.E. (Herzmuskulatur) 22. Herzmuskel, Kalb, van Gieson (Erregungsleitungssystem) 9
12 Kurstag 7 Nerven- und Gliagewebe, Peripheres Nervensystem (PNS), Rückenmark 27. Rückenmark, Mensch, van Gieson (motorische Vorderhornzellen) 85. Rückenmark, Katze, Vergoldung [Übungspräparat] BM 14 Rückenmark (Neuropil, Vorderhorn), Ratte BM 16 Nucleus nervi hypoglossi, Ratte, Richardson [Übungspräparat] 25. Spinalganglion, Kaninchen, Azan (sensible Ganglienzellen) BM 17 Ganglion trigeminale, Ratte, Richardson [Übungspräparat] 26. Jejunum, Mensch, HOPA (autonome Ganglienzellen) 23. Nervus ischiadicus (quer), Schwein, Azan 24. Peripherer Nerv (längs), Ratte, Semidünnschnitt, Richardson BM 2 Perineuralscheide (N. ischiadicus), Ratte BM 5 Marklose Nervenfasern, Ratte [Übungspräparat] BM 6 Ranvierscher Schnürring, Maus [Übungspräparat] Kurstag 8 Zentrales Nervensystem (ZNS) 29. Großhirn, Mensch, Nisslfärbung 30. Großhirn, Mensch, Markscheidenfärbung n. Weigert 32. Gehirn (Frontalschnitt), Ratte, Anti-GFAP, Hämalaun 33. Mittelhirn, Maus, anti-tyrosinhydroxylase 31. Kleinhirn, Mensch, Luxolechtblau-PAS-Hämalaun Kurstag 9 Sinnesorgane 15. Auge, Schwein, H.E. 28. Retina, Kalb, Hopa 5. Fingerbeere, Mensch, H.E (Hautsinnesorgane) Kurstag 10 Haut, Hautanhangsgebilde 5. Fingerbeere, Mensch, H.E BM 22 Epidermis, Mensch (Langerhans-Zellen) 40. Kopfhaut, Mensch, H.E. 41. Achselhaut, Mensch, van Gieson [Übungspräparat] 88. Augenlid, Mensch, Goldner 46. Brustdrüse, Mensch, HOPA, (laktierend) 60. Brustdrüse, Mensch, H.E., (ruhend) 10
13 Kurstag 11 Kreislauforgane und Blut 35. Arteria und Vena femoralis, Katze, Azan 36. Arteria und Vena femoralis, Kaninchen, Aldehydfuchsin 38. Aorta, Schwein, H.E. 37. Aorta, Mensch, Orcein 11. Kapillaren (Unterhaut), Ratte, SD, Richardson [Demo-/Übungsspräparat] BM 7 Corpusculum renale, Maus [Übungspräparat] BM 8 Interalveolarseptum, Maus [Übungspräparat] 39. fetale Lunge, Mensch, HOPA (Lymphgefäße) [Demo-/Übungspräparat] 101. Peripherer Blutausstrich, Mensch, Pappenheim 34. Blutausstrich (Leukozytenkonzentrat), Mensch, Pappenheim Kurstag 12 Lymphatische Organe 49. Thymus, menschl. Fetus, H.E. 50. Lymphknoten, Hund, H.E. 51. Lymphknoten, Mensch, anti-b-lymphozyten, Hämalaun [Übungspräparat] 52. Milz, Mensch, H.E. 10. Milz, Ratte, Tusche (in vivo), H.E. [Übungspräparat] 47. Tonsilla palatina, Mensch, H.E. 48. Tonsilla pharyngea, Mensch, H.E. 64. Ileum, Mensch, H.E. (MALT) 12. Trachea, Mensch, H.E. [Übungspräparat] Kurstag 13 Respirationstrakt 53. Stimmlippe, Mensch, van Gieson 12. Trachea, Mensch, H.E. 54. Lunge, Schwein, H.E. 55. Lunge, Mensch, H.E. BM 8 Alveolarseptum, Maus 56. Lunge, Mensch, Resorcinfuchsin 39. Lunge, menschlicher Fetus, HOPA 11
14 Kurstag 14 Verdauungstrakt I 42. Oberlippe, Mensch, H.E. 20. Zunge, Katze, HOPA oder van Gieson 57. Zunge, Kaninchen, HOPA 6. Zahnanlage, Rattenfetus, HOPA 98. Zahnanlage, Mensch, (22. Woche), H.E. 99. Zahnwurzel, Schaf, Schliff, Fuchsin [Demo-/Übungspräparat] 100. Zahn (längs), Schwein, HOPA 4. Oesophagus, Mensch, H.E. Kurstag 15 Verdauungstrakt II 58. Magen, Fundus, Mensch, PAS-Toluidinblau-Aurantia 59. Magen, pars pylorica, Mensch, Azan oder Hopa 61. Magen, pars pylorica, Hund, Anti-Gastrin, Hämalaun [Demo-/Übungspräparat] 62. Duodenum, Mensch, H.E. 63. Duodenum, Mensch, PAS [Übungspräparat] 64. Ileum, Mensch, van Gieson 26. Jejunum, Mensch, HOPA [Übungspräparat] BM 21 Darmschleimhaut, Mensch, Proliferation und Zelltod [Übungspräparat] 65. Colon, Mensch, H.E. BM 23 Enteroendokrine Zellen, Colon, Mensch [Übungspräparat] 66. Processus vermiformis, Mensch, H.E. oder HOPA Kurstag 16 Verdauungstrakt III 67. Leber, Schwein, HOPA 68. Leber, Mensch H.E. BM 9 Leberzelle, Maus [Übungspräparat] 89. Leber, Mensch, Semidünnschnitt (Toluidinblau) 69. Leber, Sinusoide, Ratte, Minuten nach Tuscheinjektion [Übungspräparat] 70. Leber, Makrophagen, Ratte, 1 Std. nach Injektion, H.E. [Übungspräparat] 71. Gallenblase, Mensch, H.E. 87. Glandula sublingualis, Mensch, HOPA 44. Glandula parotidea, Mensch, Azan 43. Glandula submandibularis, Mensch, Azan [Übungspräparat] 45. Pankreas, Mensch, H.E. BM 1 Exokrine Pankreaszelle, Fledermaus [Übungspräparat] 12
15 Kurstag 17 Endokrine Organe 97. Pankreas, Hund, Anti-Glucagon, Hämalaun 45. Pankreas, Mensch, H.E. [Übungspräparat] 92. Schilddrüse, Hund, HOPA 1. Schilddrüse, Schwein, H.E. [Übungspräparat] 93. Nebenniere, Mensch, HOPA 94. Hypophyse, Mensch, Azan 95. Adenohypophyse, corticotrope Zellen, Ratte, Anti-ACTH, Hämalaun [Übungspräparat] 96. Adenohypophyse, mammotrope Zellen, Ratte, Anti-Prolaktin, Hämalaun [Übungspräparat] Kurstag 18 Niere und ableitende Harnwege 72. Niere, Ratte, HOPA 73. Niere, Schwein, H.E. BM 7 Corpusculum renale, Maus BM 10 Glomerulum, Ratte BM 11 proximaler Tubulus contortus, Maus 74. Niere, Ratte, Trypanblau (in vivo), Kernechtrot [Übungspräparat] 75. Ureter, Mensch, H.E. 76. Harnblase, Hund, H.E. Kurstag 19 Männliche Geschlechtsorgane 77. Testis, Schwein, HOPA 78. Testis, Mensch, HOPA 3. Corpus und Cauda epididymidis, Schaf, HOPA 79. Ductus deferens, Mensch, H.E. 80. Prostata, Mensch, H.E. Kurstag 20 Weibliche Geschlechtsorgane 81. Ovar, Katze, Azan 82. Corpus luteum graviditatis, Mensch, Azan [Übungspräparat] 82. Corpus luteum menstruationis, Mensch, H.E. [Übungspräparat] 83. Ampulla tubae uterinae, Mensch, H.E. 84. Uterus (Proliferationsphase), Mensch, H.E. 86. Vagina, Mensch, H.E. 90. Plazenta (1. Schwangerschaftshälfte), Mensch, HOPA 91. Plazenta (2. Schwangerschaftshälfte), Mensch, HOPA [Demo-/Übungspräparat] 13
16 4. Kursprogramm Kurstag 1 Werkzeuge und histologische Techniken Lernziele Prüfungsrelevante Lehrinhalte Mikroskopaufbau- und Funktionsweise. Optische Systeme. Artefakte im Präparat erkennen und deuten. Histologische Präparierschritte. Gängige Färbetechniken: H.E.-Färbung, Azan-Färbung, HOPA, van Gieson, Elastikafärbung, Eisenhämatoxylinfärbung, PAS-Reaktion. Immunhistologie, Enzymhistochemie, In-situ-Hybridisierung, in vivo Tracing, genetische Marker. Lernziele der Vorlesung Histologie Die Studierenden sollen die Grundlagen der Mikroskopie verstehen und erläutern können. die Herstellung eines histologischen Präparates und die wichtigsten Färbemethoden erklären können. den Begriff der Metachromasie anhand eines Beispieles erläutern können. Verschiedene Zell- und Molekularbiologische Techniken kennen und erklären können. die Eigenschaften embryonaler Stammzellen kennen und deren Einsatz bei der Herstellung von Knock-out Mäusen erklären können. Lernziele des Kurses Histologie Die Studierenden sollen Komponenten des Mikroskops benennen und zeigen können. die allgemeine Funktionsweise eines Mikroskops erklären und anwenden können. das Mikroskop köhlern können. Größendimensionen wichtiger Zelltypen und subzellulärer Strukturen kennen. die Herstellung eines Paraffinpräparats erläutern können. typische Artefakte im Präparat kennen und identifizieren können. die Dreidimensionalität der Gewebe im Präparat rekonstruieren können. wichtige histologische Färbungen erkennen und erklären können: H.E.-Färbung, Azan-Färbung, HOPA, van Gieson, Elastikafärbung, Eisenhämatoxylinfärbung, PAS-Reaktion den Begriff der Metachromasie erläutern können. Immunhistologie, Enzymhistochemie, In-situ- Hybridisierung, genetische Markierungen als histologische Verfahren erläutern können. 14
17 Beispielpräparate Kurstag Blutausstrich (Leukozytenkonzentrat), Mensch, Pappenheim 73. Niere, Schwein, H.E. 11. Unterhaut-Bindegewebe, Ratte, Semidünnschnitt, Richardson Herstellung histologischer Präparate 1. Fixierung: Das Gewebe wird chemisch durch Eiweißfällungsmittel konserviert und gehärtet. Häufig verwendete Fixierungsmittel sind z. B. Formalin (wässrige Lösung von Formaldehyd) oder Mischungen von Formalin, Pikrinsäure, Essigsäure (Bouinsche Lösung). 2. Entwässern und Einbetten: Nach der Fixierung Auswaschen des Fixierungsmittels, Entwässern durch aufsteigende Konzentrationen von Alkohol, Einbringen über Xylol oder Toluol in flüssiges Paraffin bei ca. 60 C. 3. Schneiden: Nach dem Aushärten werden die Gewebsstückchen im Paraffinblock auf einem Mikrotom geschnitten (Schnittdicke ca µm) und auf Glasobjektträger aufgezogen. 4. Entparaffinieren: Die Schnitte werden durch Einstellen in Xylol entparaffiniert und über absteigende Alkoholkonzentrationen in destilliertes Wasser überführt. 5. Färben, Eindecken: Die Schnitte werden meist mit wässrigen Färbelösungen gefärbt. Nach der Färbung, die oft aus zahlreichen Schritten besteht (beizen, oxydieren u. a. Vorbehandlungen; verschiedene Farbstoffe simultan oder nacheinander), erneute Entwässerung und Eindecken in Kunstharz unter einem Deckglas. Um dünnere Schnitte anfertigen zu können (Semidünnschnitte zur lichtmikroskopischen Beobachtung ca. 1 µm, Ultradünnschnitte zur elektronenmikroskopischen Beobachtung ca. 0,01 µm), müssen die Gewebsstücke in Kunststoffpolymere (wesentlich härter als Paraffin) eingebettet und mit Glas- oder Diamantmessern auf einem Ultramikrotom geschnitten werden. Zahlreiche Modifikationen bestehen für Spezialzwecke: z. B. kommt für den Nachweis von Fetten eine Paraffineinbettung wegen der dabei verwendeten Lösungsmittel nicht in Frage. Für viele histochemische Reaktionen muss sogar unfixiertes Gewebe verarbeitet werden. Nichtein-gebettetes Gewebe (fixiert oder unfixiert) kann nach Einfrieren mit dem Gefriermikrotom oder im Kryostaten geschnitten werden. 15
18 Häufig verwendete Färbungen Färbung Farbstoffe Kerne Zytoplasma Kollagenfasern Elastische Fasern H.E. Azan van Gieson HOPA Elastika Hämatoxylin Eosin Azokarmin Anilinblau/Orange G Eisenhämatoxylin Pikrinsäure Säurefuchsin Hämatoxylin Orange G Phosphomolybdänsäure Anilinblau Orcein oder Resorcin-Fuchsin blauviolett rosa bis rot rot ungefärbt bis blass-rosa leuchtend rot rötlich bis bläulich Hämatoxylin - Eosin = H.E.: Hämatoxylin (Hämalaun) ist ein (bei niedrigem ph) positiv geladener Farbstoff, färbt daher negativ geladene ("basophile") Gewebsbestandteile blau, vor allem Nukleinsäuren, aber auch saure Proteoglykane. Eosin: negativ geladener Farbstoff, färbt Proteine des Zytoplasmas hellrot ("Acidophilie"). Ähnlich wie Eosin verhält sich Thiazinrot oder Orange G. In die Gruppe der positiv geladenen Farbstoffe gehört auch das zur Nissl-Färbung verwendete Kresylviolett oder Toluidinblau. Trichromfärbungen dienen zur Differenzierung von extrazellulären Bindegewebsfasern und Zellbestandteilen. Azan (Azan = Azokarmin Anilinblau - Orange G) färbt kollagene Fasern leuchtend blau, Zellkerne und Zytoplasma (u.a. auch Muskelfasern) in verschiedenen Rottönen. blau ungefärbt bis zartblau blauschwarz gelb rot ungefärbt bis blass-gelb braun bis violett grau-blau (Erys: gelb) blau ungefärbt bis blau braun bis rot (Orcein) violett (Resorcin-F.) HOPA (HOPA = Hämatoxylin Orange G Phosphomolybdänsäure - Anilinblau) färbt Bindegewebsfasern blau, Zytoplasma grau-blau, Zellkerne braun bis violett, Erythrozyten gelb. (Weigert) van Gieson färbt kollagene Fasern rot, Zytoplasma gelb, Zellkerne blauschwarz. Silberimprägnation Darstellung von retikulären Fasern. Aldehyd- oder Resorcin-Fuchsin, Orcein Darstellung von elastischen Fasern. PAS-Reaktion (Periodic acid Schiff - Reaktion) - Darstellung von histochemischen Bestandteilen des Gewebes, z.b. von kohlenhydrathaltigen Molekülen (beispielsweise Muzine). Semidünnschnitte werden häufig nach Richardson mit einem blauen Farbstoffgemisch (Azur II - Methylenblau) gefärbt, der bevorzugt basophile Strukturen darstellt. Ultradünnschnitte für die Elektronenmikroskopie werden nicht mit Farblösungen, sondern mit Schwermetallsalzen (Osmium-, Uranyl- oder Wolframsalze), die eine unterschiedliche Elektronenstreuung (und damit unterschiedliche Schwärzung des photographischen Negativs) erzeugen, "kontrastiert". Immunhistologie selektiver Nachweis von Proteinen im Gewebe mit Hilfe spezifischer Antikörper. In-situ-Hybridisierung selektiver Nachweis von spezifischer mrna im Gewebe und damit Nachweis der Expression einzelner Gene. 16
19 Beispiele wichtiger Größenordnungen von Zellen- und Organbestandteilen Leberläppchen 1mm Schilddrüse-Follikel 0,05-0,5 mm Oocyte µm Perikaryon eines Neurons bis zu 150 µm Zellen des weißen Fettgewebes 100 µm Betz-Zellen bis zu 100 µm Zellen des braunen Fettgewebes 30 µm Hepatozyten µm Darmepithelzelle (Höhe) µm Venulen µm (Länge bis zu 500 µm) Blutkapillaren 3-20 µm Neuriten Dicke: 0,5-20 µm; Länge: bis zu 1 m Lymphozyten 8 µm Erythrozyten 7-8 µm Thrombozyten 1-4 µm Mitochondrien 0,5-1 µm (Länge: 2-5 µm) Mikrovilli (Dünndarm) Länge: 1-1,5 µm Bakterien 1-2 µm Viren nm Glykogenpartikel 20 nm cm = 0,01 m Keratinfilamente 10 nm mm = 0,001 m Bündel kollagener Fibrillen nm µm = 10-6 m Myosinfilamente 16 nm (Länge: 8 µm) nm = 10-9 m Quellen: Welsch, Lehrbuch der Histologie, Elsevier, 2. Auflage, 2006; Bucher, Cytologie, Histologie und Mikroskopische Anatomie, Huber, 11. Auflage 1989; Geyer, Histologie, Thieme, 1980; Lüllmann-Rauch, Histologie, Thieme, 2. Auflage, 2006 Das Lichtmikroskop Was heißt Köhlern August Köhler ( ) war ein früher Mitarbeiter von Carl Zeiss in Jena und veröffentlichte 1893 Regeln für die richtige Beleuchtung mikroskopischer Präparate. Die von Köhler eingeführte Beleuchtung führt zu homogen ausgeleuchteten Bildern und ermöglicht gleichzeitig eine Steigerung des Auflösungsvermögens durch die Verwendung eines Kondensors. Besonders vorteilhaft ist dabei, dass durch die Aperturblende im Kondensor Bildkontrast und Auflösungsvermögen gegeneinander abgewogen werden können, ohne dass sich an der Homogenität der Bildhelligkeit etwas ändert. 17
20 So köhlern Sie Ihr Mikroskop Kondensor durch den Kondensortrieb in eine Position direkt unter dem Objekttisch bringen - Beleuchtung einschalten und das mit dem Deckglas nach oben aufgelegte Präparat mit dem 10x Objektiv fokussieren. Aperturblende am Kondensor vollständig öffnen und Leuchtfeldblende im Stativfuß vollständig schließen - beim Blick durch das Mikroskop erscheint ein unscharf konturiertes Bild der Blende. Wenn das mikroskopische Bild völlig dunkel wird, so befindet sich das Bild der Leuchtfeldblende außerhalb des Gesichtsfeldes und muss durch die Zentrierschrauben des Kondensors in das Gesichtsfeld gebracht werden. Kondensor so lange in der Höhe verstellen, bis das Bild der Leuchtfeldblende scharf im Gesichtsfeld erscheint. Bei manchen Mikroskopen besteht die Gefahr, dass man den Kondensor zu weit anhebt und es zu einer Kollision mit dem Objektträger kommt. Hier ist also etwas Vorsicht geboten. Mit den Zentrierschrauben des Kondensorträgers das Bild der Leuchtfeldblende in die Mitte des Gesichtsfeldes bringen. Leuchtfeldblende wieder öffnen, vollständig geöffnete Aperturblende während der Betrachtung durch das Mikroskop soweit schließen, bis kontrastreiches Bild entsteht. Nun ist ihr Mikroskop richtig geköhlert. 18
21 Kurstag 2 Epithelgewebe I Lernziele Prüfungsrelevante Lerninhalte Aufbau, Klassifikation, Vorkommen und Funktion von Epithelien, Polarer Aufbau von Epithelzellen, Oberflächendifferenzierung (z. B. Mikrovilli, Kinozilien, Stereozilien), Reihigkeit, Schichtigkeit, Verhornungsprozess. Zytoskelett: Mikrotubuli (Aufbau, Polarität, assoziierte Proteine, Motorproteine, Zentrosom, Zentriol, Kinozilie, Kinetosom), Aktin (Aufbau, Polarität, assoziierte Proteine, Organisationsformen), Intermediärfilamente (Aufbau, Heterogenität, Lokalisation, als Beispiele: Vimentin, Desmin, Zytokeratin, GFAP). Interzellularkontakte: Molekularer Aufbau und Funktion von Adhäsions- (Desmosom, Hemidesmosom, Zonula adhaerens), Verschluss- (Tight junction bzw. Zonula occludens) und Kommunikationskontakten (Nexus bzw. Gap junction), Schlussleistenkomplex, Epithel-Bindegewebsübergang, Integrine, Ankerfilamente und -fibrillen und deren Funktion, Basalmembran, Basallamina und deren Bestandteile. Kommunikation: Zell/Substrat-Kontakte, Zell/Zell-Kommunikation, Möglichkeiten der Kommunikation (kontaktabhängig, parakrin, endokrin, synaptisch), Membranständige Enzymsysteme (G-Protein-gekoppelte Rezeptoren), Ionenkanäle, Veränderung der Ca 2+ Konzentration, NO-Freisetzung, Wachstumsfaktoren, Zytokine, Hormone, Signalwege, Zelldifferenzierung, Kompetenzfaktoren, Determination, Induktion der Differenzierung, Signalübermittlung durch Proteolyse (Notch, Hedgehog). Lernziele der Vorlesung Histologie Die Studierenden sollen die Begriffe Zelle, Gewebe, Organ definieren können. Größendimensionen abschätzen können. die Klassifikation der Epithelien wiedergeben können. unterschiedliche Oberflächendifferenzierungen sowie deren Vorkommen, Aufbau und Funktionen benennen können. den morphologischen Aufbau von Epithelzellen mit deren Funktion in Zusammenhang bringen können. Bestandteile des Stütz- und Bewegungsapparats der Zelle aufzählen und Struktur-/Funktions- Beziehungen erläutern können. beschreiben können, wie Epithelzellen einen Zellverband bilden und wie sie sich an dem darunterliegenden Gewebe befestigen. Lernziele des Kurses Histologie Die Studierenden sollen die gezeigten Epithelien anhand der zelltypischen Charakteristika erkennen, entsprechend der Klassifikation einordnen (Schichtig-/Reihigkeit, Zellform) und skizzieren können. die Begriffe Schichtigkeit und Reihigkeit korrekt benutzen können. den gezeigten Präparateausschnitt in ein dreidimensionales Gewebebild transferieren können. Oberflächendifferenzierungen der apikalen Zellmembran unterscheiden, sowie strukturelle und funktionelle Unterschiede erläutern können. angeben können, wo welche Epitheltypen vorkommen. die Epidermisschichten im Präparat identifizieren können. die Kurspräparate mit ihren Besonderheiten erkennen, erläutern und voneinander unterschieden können. Klinische Aspekte (fakultativ) Karzinome, Hyperplasie, Metaplasie 19
22 Einschichtiges Plattenepithel Präparat 73: Präparat 15: Niere, Schwein, H.E. (Capsula glomeruli / Bowmansche Kapsel) Auge, Schwein, H.E.. [Übungspräparat] Aufsuchen von Nierenkörperchen und parietalem Blatt der Bowmanschen Kapsel. Kernmorphologie, Kern-Zytoplasma-Relation beachten. Zum Vergleich Endothelzellen von renalen Blutgefäßen im gleichen Präparat mikroskopieren. Präparatübersicht, Detailausschnitt markieren. Nierenkörperchen und Anteile des parietalen Blatts der Bowmanschen Kapsel zeichnen.! Weitere Beispiele für einschichtiges Plattenepithel: Gefäßendothel, Mesothel, häutiges Labyrinth des Innenohrs. Studieren Sie das Präparat 15, findet sich in diesem Präparat ein einschichtiges Plattenepithel 20
23 Einschichtiges, isoprismatisches Epithel Präparat 73: Niere, Schwein, H.E. (Sammelrohrepithel) BM 11: Tubulus contortus, Maus, TEM x Präparat 1: Schilddrüse, Schwein, H.E. [Übungspräparat] Quer-, Längsschnitte von Sammelrohren in Nierenmark oder Markstrahlen aufsuchen. Präparatübersicht Niere, Detailausschnitte markieren. Sammelrohrquerschnitt zeichnen, dabei beachten: Kern-Zytoplasma-Relation, Zellgrenzen, Basalmembran. Nach weiteren Beispielen für einschichtiges, isoprismatisches Epithel im Präparat suchen. Gibt es Unterschiede zwischen den einzelnen Tubulusabschnitten Wodurch kommt die luminal unscharfe Begrenzung bei manchen Tubulusepithelien zustande (vgl. BM 11) Besteht ein Unterschied zwischen kubischem und isoprismatischem Epithel! Weitere Beispiele für einschichtiges isoprismatisches Epithel: Follikelepithel der Schilddrüse, Plexus choroideus, Pigmentepithel des Auges, vorderes Linsenepithel, Keimepithel des Ovars. Studieren Sie das Präparat 1, welche Epithelformen finden Sie in diesem Präparat 21
24 Einschichtiges, hochprismatisches Epithel Präparat 71: Präparat 2: Gallenblase, Mensch, H.E. Dünndarm, menschl. Foetus, Azan [Übungspräparat] Studium des Präparats: Färbung beachten. Lumenseite mit Schleimhautrelief und typischen Schleimhautbrücken (Rokitansky-Aschoff-Sinus) des Gallenblasenepithels und äußere muskuläre Wand identifizieren. Detailstudium des Oberflächenepithels: Hauptzellen des Gallenblasenepithels identifizieren, Lage und Form der Zellkerne, Schlussleistenkomplex. Präparatübersicht, Detailausschnitt markieren. Gallenblasenepithel bei höherer Vergrößerung exemplarisch zeichnen. Hauptzellen, Schlussleistenkomplex markieren.! Was ist das ultrastrukturelle Korrelat des Bürstensaums Aus welchen Komponenten besteht der Schlußleistenkomplex und wo an der Zelle findet man ihn Weitere Beispiele für einschichtiges, hochprismatisches Epithel: periphere Abschnitte des Bronchialepithels, Darmepithel, Uterus-, Eileiterepithel. Studieren Sie zum Vergleich Präparat 2. Welcher Epitheltyp findet sich dort Rekapitulieren Sie die Charakteristika der Azanfärbung anhand dieses Päparates. 22
25 Mehrreihiges, hochprismatisches Epithel Präparat 12: Präparat 3: Trachea, Mensch, H.E. ( Respiratorisches Epithel mit Kinozilien) Nebenhodengang, Schaf, HOPA [Übungspräparat] Studium des Präparats in der Übersicht: Wandaufbau mit Knorpelgewebe ( Kurstag 5) beachten, Lumen mit respiratorischem Epithel aufsuchen, bei höherer Vergrößerung mikroskopieren. Basal-, Intermediärzellen, Kinozilien, Basalkörperchen (Kinetosomen), Becherzellen aufsuchen. Präparatübersicht, Detailausschnitt der Schleimhaut markieren. Basal-, Intermediärzellen, mit spezifischer Kernmorphologie und -lage, Kinozilien, Basalkörperchen, Becherzellen, intraepitheliale Lymphozyten erkennen und markieren.! Welche Funktion haben die Basalzellen Welche klinischen Folgen könnte eine Störung der Kinozilienfunktion haben An manchen Stellen ist der Schleimhaut zellreiches Material aufgelagert. Was könnte das sein Weitere Beispiele für zwei-/mehrreihiges Epithel: Ductus epididymidis, Ductus deferens, Ductus parotideus. Studieren Sie zum Vergleich Präparat 3: Welcher Epitheltyp, welche Oberflächendifferenzierung liegen vor 23
26 Mehrschichtiges, unverhorntes Plattenepithel Präparat 4: Präparat 86: Oesophagus, Mensch,H.E. Vagina, Mensch, H.E. [Übungspräparat] Studium des Präparats in der Übersicht: Oberflächenepithel aufsuchen und Schichtung studieren. Wie verändern sich Kernmorphologie, Kern-Zytoplasma-Relation, Orientierung und Form der Zellen in den einzelnen Schichten Präparatübersicht, Detailausschnitt der Schleimhaut markieren. Ausschnitt des Oberflächenepithels im Detail zeichnen.! Wo findet Proliferation in diesem Epitheltyp statt Gibt es auch mehrschichtiges hochprismatisches Epithel Wenn ja, wo Weitere Beispiele für mehrschichtiges unverhorntes Plattenepithel: Schleimhaut der Mundhöhle (überall) und des Analkanals, vorderes Hornhautepithel. Mikroskopieren Sie zum Vergleich das Präparat 86, Vagina (Mensch): Wie ist das Zytoplasma in den obersten Zellschichten gefärbt, warum 24
27 Mehrschichtiges, verhorntes Plattenepithel Präparat 5: Fingerbeere, Mensch, H.E. (Epidermis) Studium des Präparats in der Übersicht: Oberflächenepithel aufsuchen und Schichtung studieren. Detailausschnitt der Epidermis mit typischer Schichtung zeichnen. Dabei besonders Kern-, Zellmorphologie beachten. Stratum basale, spinosum, granulosum, (lucidum), corneum, Reteleisten und Bindegewebspapillen markieren. Worauf beruht das körnige Aussehen des Stratum granulosum Was ist das biochemische Korrelat von Keratohyalingranula Worauf beruht die Bezeichnung Stachelzellschicht Was passiert mit den Kernen in den oberflächlichen Zellschichten Welche Funktionen hat das verhornte Epithel Gibt es weitere physiologische Beispiele für diesen Epitheltyp, gibt es pathologische Beispiele 25
28 Kurstag 3 Epithelgewebe II Lernziele Prüfungsrelevante Lerninhalte Exokrine Drüsen: Synthese, Speicherung und Extrusionsmechanismen von Sekreten, Sekrettypen, Sekretionmodus (ekkrin, apokrin, holokrin), Drüsenbau, Klassifikation. Lernziele der Vorlesung Histologie Die Studierenden sollen die Entwicklung von Drüsen erläutern können. die Klassifikation, Form und Aufbau exokriner Drüsenendstücke (seröse, muköse, gemischte Endstücke) kennen. das Drüsenparenchym, das Ausführungsgangssystem in seinen einzelnen Abschnitten, das Drüsenstroma und die Myoepithelzellen beschreiben können. Lernziele des Kurses Histologie Die Studierenden sollen den Aufbau, die Lokalisation, Sekretionsmodus und Funktion exokriner Drüsen erläutern können. Struktur-Funktions-Beziehungen exokriner Drüsen darstellen können. die Präparate mit ihren Besonderheiten erkennen und erläutern können. 26
29 Übergangsepithel (Urothel) Präparat 75: Ureter, Mensch, H.E. Studium des Präparats in der Übersicht: Oberflächenepithel aufsuchen und studieren. Epithelzellmorphologie in Abhängigkeit des Dehnungszustandes untersuchen. Spezifische Merkmale von Deckzellen beachten. Übergangsepithel in unterschiedlichem Dehnungszustand zeichnen. Deckzellen, Crusta, Mehrkernigkeit, basale Zellen markieren. Welche Rolle spielen die Deckzellen Was ist das ultrastrukturelle, was das molekulare Korrelat der Crusta Was sind Uroplakine Welchen Hinweis könnte Mehrkernigkeit auf den Funktionszustand der Zelle liefern Sternförmiges Lumen beachten. Wo ist Ihnen dieses Merkmal schon einmal begegnet! Woran erkennen Sie den Unterschied zwischen mehrschichtig und mehrreihig Übergangsepithel (Urothel) kommt ausschließlich in den Harnwegen vor, es ist damit für die Organdiagnose beweisend! 27
30 Endoepitheliale, einzellige Drüsen Präparat 65: Colon, Mensch, H.E. (Becherzellen) Aufsuchen von Colonkrypten in unterschiedlichen Schnittebenen (quer, längs). Aufsuchen von einzelnen Becherzellen, Lage des Zellkerns, unterschiedlichen Sekretionszustand beachten. Exemplarische Zeichnung von Becherzellen im Epithelverband in verschiedenen Sekretionsphasen. In welchen Geweben haben sie bereits Becherzellen kennengelernt Welche Funktion haben Becherzellen Wie stellen sich Becherzellen in einer PAS Färbung dar! Gibt es endoepitheliale mehrzellige Drüsen Wenn ja, wo Einzelne Colonkrypten können auch als exoepitheliale, tubulöse Drüsen aufgefasst werden. 28
31 Alveoläre Talgdrüsen Präparat 40: Kopfhaut, Mensch, H.E. (holokrine Talgdrüsen) Präparat in der Übersicht studieren. Einzelne Talgdrüsen aufsuchen, Nachbarschaftsbeziehungen beachten. Talgdrüsen zeichnen und Morphologie der Drüsenzellen beachten. Welchen Sekretionsmechanismus besitzen Talgdrüsen Was geschieht dabei mit dem Drüsenepithel Wie verändert sich die Kernmorphologie des Talgdrüsenepithels von der Drüsenbasis hin zum -zentrum Wo findet Proliferation in den Drüsenendstücken statt Wohin mündet der Ausführungsgang von Talgdrüsen in diesem Präparat Was sind freie Talgdrüsen Wo kommen sie vor 29
32 Tubulöse Drüsen Präparat 40: Kopfhaut, Mensch, H.E. (ekkrine Schweißdrüsen) Aufsuchen einzelner ekkriner Schweißdrüsen im Präparat. Ausführungsgänge und Endstücke unterscheiden. Drüsenendstücke und Ausführungsgänge exemplarisch zeichnen. Verändert sich der Epitheltyp entlang der Ausführungsgänge Dreidimensionalen Aufbau ekkriner Schweißdrüsen der Haut überlegen. 30
33 Tubuloalveoläre Drüsen Präparat 41: Achselhaut, Mensch, van Gieson (apokrine Duftdrüsen) Aufsuchen von Duftdrüsen im Präparat. Weite Endstücklumina, korbartige Anordnung von Myoepithelzellen beachten. Morphologische Kennzeichen des apokrinen Sekretionsmechanismus studieren. Endstücke, Ausführungsgänge, Myoepithelzellen exemplarisch zeichnen. Wie könnte man Myoepithelzellen selektiv sichtbar machen Von welchem Anteil des Peripheren Nervensystems werden Myoepithelzellen innerviert Merkmale der van Gieson Färbung anhand des Präparats rekapitulieren. 31
34 Tubuloazinöse Drüsen Präparat 43: Glandula submandibularis, Mensch, Azan Studium des Präparats in der Übersicht: Läppchenförmige Gliederung, intra-, interlobuläre Ausführungsgänge, unterschiedliche Endstücke aufsuchen. Seröse und muköse Drüsenendstücke, seröse Kappen, Schaltstücke, Streifenstücke (Sekretrohre), interlobuläre Ausführungsgänge exemplarisch zeichnen.! Woher stammt der Begriff Streifenstück, was ist das morphologische, ultrastrukturelle und funktionelle Korrelat Kennen Sie andere Beispiele mit ähnlichen Eigenschaften Welcher Begriff könnte in Präparat 43 statt tubuloazinös verwendet werden Überlegen Sie, worin sich die Begriffe zusammengesetzte und gemischte Drüsen unterscheiden Weitere Beispiele tubuloazinöser Drüsen: Glandula sublingualis, Glandulae labiales. Rekapitulieren sie zum Abschluss des Kurstages Systematik und Einteilungskriterien exokriner Drüsen und überlegen sie sich Beispiele. 32
35 Kurstag 4 Binde- und Fettgewebe Lernziele Prüfungsrelevante Lerninhalte Prinzipieller Aufbau, Klassifikation (Mesenchym, lockeres, retikuläres, retikulärfaseriges, straffes geflechtartiges, straffes parallelfaseriges Bindegewebe), Funktion, Regeneration von Bindegewebe. Zelltypen: Fixe (Fibroblasten,- zyten), freie Zellen (z.b. Makrophagen). Extrazellulärmatrix (EZM): Aufbau, Vorkommen und Synthese von Kollagenfasern und elastischen Fasern, Kollagenfasersubtypen, mechanische Fasereigenschaften, Glykosaminoglykane, Proteoglykane, Adhäsionsproteine, Basalmembran (s. Kurstag 2). Makrophagenfunktion. Funktion der Mastzellen, Inhalt der Granula. Weißes und braunes Fettgewebe: Aufbau, Vorkommen, Funktion, Unterschiede, Cytochrome, Lipogenese, Lipolyse. Klinische Aspekte (fakultativ) Skorbut, Ehlers-Danlos-Syndrom, Marfan- Syndrom. Lernziele der Vorlesung Histologie Die Studierenden sollen die Klassifikation des Bindegewebes wiedergeben können. Struktur-Funktionsbeziehungen kennen und erläutern können. Unterschiede im molekularen Aufbau der Extrazellulärmatrix, sowie deren Produktion und Freisetzung erläutern können. den Unterschied zwischen fixen und freien Zellen und deren Funktion erläutern können. Fettgewebstypen unterscheiden, sowie Funktion und Besonderheiten von Fettgewebe erklären können. Lernziele des Kurses Histologie Die Studierenden sollen in den Präparaten die gezeigten Fasertypen benennen und identifizieren können. die gezeigten Bestandteile des Bindegewebes (freie/fixe Zellen und Fasern) zu einem Gesamtbild von Bindegewebe bzw. Organ zusammenfügen können. Färbemethoden zur Darstellung elastischer Fasern nennen und erkennen können. bereits gelernte Inhalte an den gezeigten Präparaten wiedererkennen und wiederholen können. weißes und braunes Fettgewebe identifizieren können. 33
36 Mesenchymales embryonales Bindegewebe Präparat 6: Rattenfetus, HOPA Studium des Präparats in der Übersicht: Frontalschnitt durch den Kopf eines Rattenfetus. Aufsuchen von Augenanlagen, Oberkiefer-, Unterkiefer-, Mundhöhlen- und Zahnanlage. Zeichnen Sie exemplarisch zwischen Organanlagen gelegenes mesenchymales Bindegewebe. Woraus besteht die extrazelluläre Matrix des Mesenchyms Wie sind die Mesenchymzellen miteinander verbunden Aus welchem Keimblatt entsteht mesenchymales Bindegewebe des fetalen Kopfes Welche weiteren embryonalen Bindegewebsformen gibt es 34
37 Lockeres faseriges Bindegewebe Präparat 2: Dünndarm, Mensch, Azan BM 2: Kollagenfasern Epineuralscheide, Ratte, TEM x Präparat 41: Achselhaut, Mensch, van Gieson [Übungspräparat] Aufsuchen von Bereichen mit lockerem Bindegewebe in der Tela submucosa. Zelluläre, faserige Bestandteile und Färbbarkeit beachten. Exemplarische Zeichnung mit Markierung von Fasern und Fibrozyten.! Welche Zellen bilden kollagene und elastische Fasern Vergleichen Sie straffes Bindegewebe im Bereich der Epineuralscheide (BM 2). Wo kommt straffes, parallelfaseriges Bindegewebe noch vor Weiteres Vorkommen: Bestandteil der Subserosa, von Faszien und der weichen Hirnhäute, Organstroma, interstitielles Bindegewebe. Studieren Sie Präparat 41: Welcher Bindegewebstyp kommt im Bereich des Coriums vor 35
38 Retikulärfaseriges Bindegewebe Präparat 8: Pankreas, Mensch, Versilberung Studium des Präparats in der Übersicht: Läppchenförmige Gliederung, keine Anfärbung von zellulären Strukturen. Bei hoher Vergrößerung unter beständigem Durchfokussieren des Präparats, retikuläre Fasern (schwarze, scharf-begrenzte Linien) in ihrer 3-dimensionalen Anordnung und räumlichen Beziehung zum Parenchym studieren. Zeichnen Sie einen Ausschnitt aus diesem Präparat mit den retikulären Fasernetzen (quer und längs verlaufend).! Woraus bestehen retikuläre Fasern Lassen sich in diesem Präparat Langerhanssche Inseln abgrenzen Unterscheiden Sie retikuläres Bindegewebe und retikulärfaseriges Bindegewebe! Weiteres Vorkommen von retikulären Fasern: Lamina propria des Darms, Organgerüste (Milz, Leber, Lymphknoten, Niere, Fettgewebe). 36
39 Bindegewebe mit elastischen Fasern Präparat 56: BM 20: Präparat 7: Präparat 9: Lunge, Mensch, Elastika-/Resorcinfuchsin Kollagenfibrillen und elastische Fasern Mesenterium, Häutchenpräparat, Hämalaun-Thiazinrot [Demo-/Übungspräparat] Skrotalhaut, Mensch, Orcein [Übungspräparat] Aufsuchen von Alveolarsepten im Lungenpräparat bei höherer Vergrößerung. Ausschnittszeichnung bei höherer Vergrößerung: schwarz-violett gefärbte elastische Fasernetze im Bereich der Alveolarsepten. Was sind charakteristische histologische Merkmale elastischer Fasern Wo kommen diese Fasern vor Vergleichen Sie das elektronenmikroskopische Bild von kollagenen und elastischen Fasern miteinander (BM 20). Was ist das ultrastrukturelle Korrelat einer Faser Wie können Sie in Präparat 7 kollagene von elastischen Fasern lichtmikroskopisch unterscheiden Studieren Sie zum Vergleich Präparat 9, Skrotalhaut, Mensch, Orcein. Wie erscheinen elastische Fasern in dieser Färbung 37
40 Ortsfremde, mobile Bindegewebszellen Präparat 10: Präparat 11: Milz-Makrophagen, Ratte, Tuscheinjektion, H.E. Mastzellen, Ratte, Semidünnschnitt, Richardson Schwarz gefärbte Makrophagen bei höherer Vergrößerung aufsuchen (Präparat 10). Mastzellen im lockeren Bindegewebe aufsuchen, zytoplasmatische Sekretgranula beachten (Präparat 11). Ausschnitte aus den Präparaten mit den beiden Zelltypen zeichnen. Worauf beruht die schwarze Färbung der Makrophagen Was enthalten die Mastzellgranula Lassen sich im Präparat 11 typische Nachbarschaftsbeziehungen zu den Mastzellen beobachten Was bedeutet Metachromasie Kommt sie in diesem Präparat vor 38
41 Uni- und plurivakuoläres Fettgewebe Präparat 72: Niere, Ratte, HOPA BM 3: Fettzellen und lockeres Bindegewebe, TEM 4.000x Präparat 41: Achselhaut, Mensch, van Gieson [Übungspräparat] Präparat 44: Glandula parotidea, Mensch, Azan [Übungspräparat] Suchen Sie Bereiche uni- und plurivakuolären Fettgewebes im Präparat auf. Zeichnen Sie Ausschnitte beider Gewebetypen bei hoher Vergrößerung. Welche Funktionen haben weißes und braunes Fettgewebe Warum erscheinen univakuoläre Adipozyten histologisch leer Wie könnte dies verhindert werden Worauf beruht die braune Farbe des plurivakuolären Fettgewebes Suchen Sie univakuoläres Fettgewebe in BM 3. Studieren Sie die Präparate 41 und 44. Wiederholen Sie anhand dieser Präparate die verschiedenen Formen der Epithelien, der Drüsen und des Binde- und Fettgewebes. 39
42 Kurstag 5 Knorpel- und Knochengewebe Lernziele Prüfungsrelevante Lerninhalte Knorpelgewebe: Entstehung, Wachstum, Ernährung, Degeneration, Regeneration. Chondrozyten, - blasten, Chondron, Zusammensetzung der EZM, funktionelle Eigenschaften von Knorpelgewebe, Schichten des Perichondriums, Aufbau und Vorkommen des hyalinen Knorpels, ( maskierte Kollagenfasern), elastischen Knorpels und Faserknorpels. Knochengewebe: Endost, Periost, Gefäßversorgung, Knochenmark (rot/gelb). Herkunft und Entstehung (desmal, enchondral, Osteogenese und Ossifikation), Zusammensetzung der EZM, funktionelle Eigenschaften von Knochengewebe, Entstehung, Wachstum, Ernährung, Degeneration, Regeneration, Osteozyten, - blasten; -klasten, Osteoid, Mineralisation, Dickenwachstum, Längenwachstum, Epiphysenfuge, Knochenumbau, Knochenaufbau, Osteon, Geflechtknochen, Lamellenknochen Wirkung von Parathormon und Calcitonin, Calcitriol. Lernziele der Vorlesung Histologie Die Studierenden sollen die Einteilungskriterien des Knorpelgewebes und die Charakteristika der Subtypen wiedergeben können. den molekularen Aufbau des Knorpels erläutern können. die Entstehung und den stetigen Umbau von Knochengewebe erklären können. die Begriffe desmale und chondrale Osteogenese sowie desmale und (en)chondrale Ossifikation voneinander abgrenzen können. die Funktion der unterschiedlichen Knochenzelltypen erläutern können. die endokrine Regulation des Knochenstoffwechsels erklären können. Lernziele des Kurses Histologie Die Studierenden sollen die Präparate zeichnen und ihre Besonderheiten, insbesondere ihre Strukturunterschiede, aufzeigen können. verschiedene Knorpelarten im mikroskopischen Bild voneinander unterscheiden können. Osteoblasten,- zyten und -klasten voneinander unterscheiden können. die Zonen in der Epiphysenfuge abgrenzen und die dort stattfindenden Vorgänge erklären können. die histologische Architektur des Lamellenknochens beschreiben können. Haverssche und Volkmannsche Kanälchen, Spezial-, Schalt- und Generallamellen identifizieren können. Klinische Aspekte (fakultativ) Arthrose, Arthritis; primäre und sekundäre Knochenbruchheilung, Kallusbildung, Osteogenesis imperfecta, Rachitis, Osteoporose, primärer und sekundärer Hyperparathyreoidismus. 40
43 Hyaliner Knorpel Präparat 12: Trachea, Mensch, H.E. Studium des Präparats zunächst in der Übersicht: Intensiv blau-violett gefärbte Knorpelspangen in der Trachealwand identifizieren. Aufsuchen von Perichondrium mit Übergangszone zum Knorpel, Chondrozyten, Knorpelhöhle, Knorpelkapsel, Knorpelhof, Chondronen (=Territorien), Interterritorien. Schrumpfungsartefakte beachten. Gruppen von Chondronen mit angrenzendem Perichondrium zeichnen, o.g. Strukturen markieren. Klären Sie die Begriffe Chondroblasten, Chondrozyten und Chondroklasten. Woraus besteht das Perichondrium Welche Funktion hat diese Struktur Welches sind die Komponenten der Knorpelgrundsubstanz Was sind Hyaluronan und Aggrecan Enthält hyaliner Knorpel Kollagenfasern Wenn ja, warum sind sie lichtmikroskopisch nicht sichtbar! Was sind Asbestfasern Vorkommen von hyalinem Knorpel: embryonales Skelett, Gelenkknorpel, Rippenknorpel, Epiphysenfugen, Nasenknorpel, Bronchien. Welche Bestandteile des Kehlkopfes bestehen aus hyalinem Knorpel 41
44 Elastischer Knorpel Präparat 13: Epiglottis, Affe, Orcein-Hämalaun Studium des Präparats zunächst in der Übersicht. Aufsuchen von Knorpelarealen mit rot-braun gefärbten elastischen Fasern und von Chondronen. Gruppe von Chondronen mit angrenzendem Perichondrium zeichnen.! Wie unterscheiden sich die Chondrone im elastischen und hyalinen Knorpel Welche Epithelien kommen in diesem Präparat vor Wo findet man noch elastischen Knorpel Überlegen Sie: Könnte man, und wenn ja wie, ohne Elastika-Färbung elastischen und hyalinen Knorpel voneinander unterscheiden 42
45 Faserknorpel (Bindegewebsknorpel) Präparat 14: Discus intervertebralis, Mensch, H.E. Aufsuchen des Anulus fibrosus. Äußeres straffes Bindegewebe vom intensiver gefärbten inneren Knorpel mit vereinzelten Chondronen unterscheiden. Charakteristika des Faserknorpels zeichnerisch festhalten: Chondrozyten, fischgrätenartig angeordnete Kollagenfasern.! Wie können Sie Faserknorpel von straffem Bindegewebe unterscheiden Vorkommen von Faserknorpel: Kiefergelenk, Schlüsselbeingelenke, (Symphysen). 43
46 Desmale Osteogenese Präparat 6: Rattenfetus, HOPA Aufsuchen von blau gefärbten Knochenbälkchen im Bereich der Schädelkalotte und Gesichtsknochen, Osteoblasten, Osteozyten, mehrkernige Osteoklasten, Howshipsche Lakunen, Osteoid. Detailzeichnung mit Markierung o. g. Strukturen. Wie arbeiten Osteoklasten Welches Gewebe befindet sich in der Nähe der Knochenbälkchen Aus welchen Vorläuferzellen differenzieren sich Osteoblasten 44
47 Chondrale Osteogenese Präparat 16: Knie, menschlicher Fetus ( Woche), H.E. Studium des Präparats in der Übersicht: Identifizieren Sie Femur, Tibia, Patella, Kniegelenk, Epiphyse, Diaphyse, Epiphysenfuge, Bereiche der perichondralen und enchondralen Ossifikation. Aufsuchen folgender Strukturen: Perichondrale Knochenmanschette, Periost (Stratum osteogenicum, - fibrosum), primäre Markhöhle, Osteoidbälkchen, Reserve-, Proliferations- (Säulenknorpel), Hypertrophie- (Blasenknorpel) und Eröffnungszone, Zone der enchondralen Knochenbildung. Zeichnen Sie die Entwicklungsstadien der enchondralen Ossifikation anhand des vorliegenden Präparats. Suchen Sie neugebildete Knochenbälkchen im Bereich der Diaphyse auf und lokalisieren Sie Osteoblasten, Osteozyten, Osteoid und Osteoklasten. Halten Sie diese Strukturen zeichnerisch fest. Wo findet enchondrale bzw. perichondrale Ossifikation statt Wodurch kommen Längen- und Dickenwachstum der Röhrenknochen zustande Wodurch unterscheiden sich perichondral und enchondral entstandene Knochenbälkchen Wo befinden sich primäre Markhöhle und primäres Knochenmark Welche Erkrankung führt zu einer verfrühten Verknöcherung der Epiphysenfuge und damit verbundener Einschränkung des Längenwachstums der Röhrenknochen Welche Ursachen für diese Erkrankung sind bekannt 45
48 Lamellenknochen Präparat 17: Tibia (quer), Schaf, Knochenschliff, Fuchsin Querschnitt durch einen Röhrenknochen: Aufsuchen der Kompakta mit einzelnen Osteonen (Haverssche Systeme), von äußeren und inneren Generallamellen, Schalt-, Speziallamellen, Volkmann Kanälen (evtl.), Osteozyten. Ausschnitt mit inneren / äußeren Generallamellen, Spezial- und Schaltlamellen, Osteozyten, Haversund Volkmann Kanälen zeichnen. Wie entstehen Schaltlamellen Was stellen die radiären Streifen in den Osteonen dar und wodurch sind diese Strukturen miteinander verbunden Wie unterscheiden sich Lamellen- und Geflechtknochen voneinander Was versteht man unter Kallus und Kallusbildung Worauf beruht das Krankheitsbild der Osteogenesis imperfecta 46
49 Kurstag 6 Muskelgewebe Lernziele Prüfungsrelevante Lerninhalte Muskelgewebe: Quergestreifte Skelettmuskulatur: Entstehung, Aufbau und Funktion, morphologische Grundlagen der Kontraktilität (Querstreifung, Sarkomeraufbau, Aktin, Myosin, Titin, Nebulin, Desmin, Dystrophin, Kontraktionszyklus, elektromechanische Kopplung). Bindegewebshüllen des Muskels, Muskelfaser, Myofibrille,-filament, funktionelle Anpassung, Satellitenzellen, Regeneration, motorische Endplatte, Muskelspindeln. Herzmuskulatur: Bau des Endokards und der Klappen, Bau der Arbeitsmuskulatur, Kardiomyozyten, elektrische und mechanische Kopplung, Disci intercalares, endokrin aktive Myozyten (ANP), Unterschiede der Zellen des Reizleitungssystems zur Arbeitsmuskulatur. Glatte Muskulatur Bau und Vorkommen, Anordnung des Filamentsystems, Caveolae, Verdichtungszonen, Anheftungsplaques, Sekretion von Tropoelastin, Fibrillin und Kollagen. Lernziele der Vorlesung Histologie Die Studierenden sollen Muskelgewebe und Muskelzelltypen korrekt klassifizieren können. den Feinbau eines Muskels (Gliederung in Muskelfaserbündel, Muskelfasern/Myofibrillen und dazwischen liegende Bindegewebssepten) erläutern können. die molekularen Mechanismen der Muskelkontraktion erläutern können. Lernziele des Kurses Histologie Die Studierenden sollen die Präparate identifizieren und ihre Charakteristika skizzieren können. Größenverhältnisse zwischen den 3 Muskelzelltypen einschätzen können. das Bandenmuster eines Sarkomers anhand einer EM-Aufnahme erklären können. den ultrastrukturellen Aufbau des Sarkomers mit der Funktion in Verbindung bringen können. Epi-, Peri- und Endomysium identifizieren können. die morphologischen und funktionellen Unterschiede zwischen Arbeitsmyokard und Reizleitungssystem kennen. Eigenstudium unterschiedliche Fasertypen Myofibroblasten. Klinische Aspekte (fakultativ) Muskeldystrophien, kongenitale Myopathien. 47
50 Glatte Muskulatur Präparat 18: Präparat 76: Darm, Axolotl, HOPA Harnblase, Hund, H.E. Vergleichendes Studium beider Präparate zunächst in der Übersicht: Aufsuchen der Tunica muscularis mit zwei- (Darm), bzw. dreischichtigem (Harnblase) Aufbau. Bei höherer Vergrößerung Zellform, -grenzen, Kernform, -lage, Kern-Zytoplasma-Relation, Sarkoplasma von glatten Muskelzellen unterscheiden. Zeichnen Sie glattes Muskelgewebe in Längs- und Querschnitten, o. g. Merkmale beachten und markieren. Warum ist der Zellkern in quer angeschnittenen glatten Muskelzellen nicht immer sichtbar Was sind Myofibroblasten 48
51 Skelettmuskulatur (quergestreifte Muskulatur) Präparat 19: Quergestreifte Muskulatur, Hund, Eisenhämatoxylin BM 4: Skelettmuskel, Amphibienlarve, TEM x Überwiegend längs verlaufende Muskelfasern identifizieren. Region mittlerer Färbungsintensität mit gut sichtbarer Querstreifung auswählen. Sarkoplasma mit Myofibrillen, Sarkolemm, Myozytenkerne aufsuchen, Lage und Verteilung bestimmen. Detailzeichnung von Muskelfasern und umgebendem Bindegewebe, Markierung der o. g. Strukturen.! Worauf beruht die Querstreifung in diesem Präparat Aufbau von Sarkomeren in BM 4 studieren. Welchen elektronenmikroskopisch sichtbaren Abschnitten des Sarkomers entsprechen die hellen und dunklen Streifen in Präparat 19 Was versteht man beim elektronenmikroskopischen Bild quergestreifter Muskelfasern unter einer Triade Was sind Diaden Sind Skelettmuskelzellen in jeder Phase ihrer Entwicklung mehrkernig Wann und wodurch entsteht Mehrkernigkeit Welche Funktionen besitzen Satellitenzellen Welche Lagebeziehung haben sie zur Basalmembran der Skelettmuskelzelle 49
52 Präparat 20: Zunge, Katze, HOPA oder van Gieson Studium des Präparats in der Übersicht: Region mit exakt quer geschnittenen Muskelfasern aufsuchen, dort Myofibrillenfelderung, Lage und Anzahl von Myozytenkernen, Satellitenzellen beachten. Von der Muskeloberfläche ausgehend Organisation der Bindegewebshüllen untersuchen: Epimysium, Perimysium externum, Perimysium internum, Endomysium mit begleitenden Blutgefäßen aufsuchen. Übersichts- und Detailzeichnungen von quergestreifter Muskulatur in unterschiedlichen Schnittebenen, o. g. Strukturen markieren. Kann man in den Skelettmuskelfasern Mitosen finden Was versteht man unter Cohnheimscher Felderung Wie kommt sie zustande Ändert sich das Querstreifenmuster während der Kontraktion Wenn ja, wie 50
53 Herzmuskulatur Präparat 21: Herzmuskel, Mensch, H.E. Aufsuchen von quergestreiften Herzmuskelzellen mit Verzweigungen, Myozytenkernen, myofibrillenfreien Sarkoplasmabereichen an den Kernpolen, Lipofuszin, Glanzstreifen, interstitiellem, vaskularisiertem Bindegewebe. Zeichnen Sie mehrere Herzmuskelzellen mit Verzweigungen, markieren Sie die o.g. Strukturen. Was sind Lipofuszingranula, wo liegen sie typischerweise Was stellen die Glanzstreifen (Disci intercalares) dar Bilden Herzmuskelzellen ein Synzytium Wie kommunizieren Herzmuskelzellen untereinander Könnte man einen akuten Herzinfarkt histopathologisch erkennen 51
54 Erregungsleitungssystem Präparat 22: Herzmuskel, Kalb, van Gieson Aufsuchen von Anschnitten des Erregungsleitungssystems subendokardial und am Rand des Präparats. Arbeitsmuskulatur und Zellen des Reizleitungssystems (umgeben von lockerem, kollagenem Bindegewebe) nebeneinander zeichnen. Vergleichen Sie die Zellen des Arbeitsmyokards und des Erregungsleitungssystems hinsichtlich: Zellgröße, Lage der Zellkerne, Fibrillengehalt, und -verteilung, Färbung des Zytoplasmas, Vorkommen von Glanzstreifen. Wodurch sind die Zellen des Reizleitungssystems miteinander verbunden Warum sind diese Zellen besonders reich an Glykogen 52
55 Kurstag 7 Nerven- und Gliagewebe Peripheres Nervensystem (PNS) Rückenmark Lernziele Prüfungsrelevante Lerninhalte Nervengewebe/PNS: Gliederung des Nervensystems und Neurons, Entwicklung des Nervensystems, des Neuralrohrs und der Neuralleiste werden vorausgesetzt. Zelluläre Bestandteile des Nerven- und Gliagewebes, Nervenzelltypen und deren Vorkommen, axonaler Transport, chemische Synapse (Typen und Aufbau) und Neurotransmitter, Neurosekretion. Rückenmark (Aufbau und Funktion). Periphere Nervenfaser, Markhaltige/marklose Nervenfaser, Klassifizierung nach Durchmesser u. Myelinisierung, Myelin, Erregungsleitung, Struktur und Funktion peripherer Gliazellen: myelinisierende/ nichtmyelinisierende Schwann-Zellen, Mantelzellen, Beteiligung an De- und Regeneration. Hüllen und Bindegewebsräume des PNS, Blut-Nerven-Schranke, Gestalt der Neurone in sympathischen, parasympathischen, enteralen und sensiblen Ganglien. Morphologie und Funktion sensorischer/vegetativer Ganglien. Klinische Aspekte (fakultativ) Lernziele der Vorlesung Histologie Die Studierenden sollen die strukturelle Gliederung des Neurons benennen können und unterschiedliche Neuronentypen (pseudounipolar, bipolar, multipolar etc.) nach ihrem Aufbau, ihrem Vorkommen und ihrer Funktion einordnen können. die Unterschiede von markhaltigen/marklosen Nervenfasern erläutern können und in diesem Zusammenhang den Aufbau und die Funktion der Schwannzelle als Gliazelle des PNS definieren können. den grundlegenden Aufbau eines peripheren Nerven beschreiben können und die allgemeingeltenden strukturgebenden Hüllen und Bindegewebsräume benennen können. Lernziele des Kurses Histologie Die Studierenden sollen die Präparate identifizieren und mit ihren Charakteristika skizzieren. wichtige Färbetechniken der Neurohistologie kennen und ihre Bedeutung erläutern können (z.b. Nissl-Färbung, Markscheidenfärbung nach Weigert, Golgi-Färbung). den charakteristischen Aufbau des Lumbalmarks erklären können. die Neurone im Rückenmark entsprechend ihrer histologischen Charakteristika unterscheiden und in verschiedene Typen einordnen können. die Architektur der Rückenmarkshäute erklären können. die Bindegewebshüllen und versorgenden Strukturen des Nerven differenzieren und im Präparat auffinden können. den Aufbau der Myelinscheide mit Struktur- Funktionsbeziehungen erläutern können. die Ultrastruktur von markhaltigen/marklosen Nervenfasern im EM-Bild erklären können. Neuropathien, Charcot-Marie-Tooth- Syndrom, Neuritiden, Multiple Sklerose, Morbus Hirschsprung, Polio, spinale Muskelatrophie, Amyotrophe Lateralsklerose. 53
56 Rückenmark Präparat 27: Präparat 85: Rückenmark (lumbal), Mensch, van Gieson Rückenmark, Katze, Vergoldung [Übungspräparat] Präparat mit bloßem Auge betrachten: Identifizieren von schmetterlingsförmiger, zentral gelegener grauer Substanz und äußerer, mantelförmiger weißer Substanz, Vorder-, Seiten-, Hinterhörner. Aufsuchen von Fissura mediana anterior, Sulcus medianus posterior, Canalis centralis mit Ependym, Substantia grisea mit Vorder-, Seiten-, Hinterhorn, Substantia alba mit Vorder-, Seiten-, Hintersträngen, Vorderwurzel, Hinterwurzel. Aufsuchen von Hirn- (Rückenmarkshäuten): Dura mater, Arachnoidea, Pia mater. Rückenmarksquerschnitt in der Übersicht, prinzipielle Gliederung markieren. Detailzeichnungen von Rückenmark und Hirnhäuten mit Markierung der o. g. Strukturen. Wie kann man Vorder- und Hinterhorn, bzw. ventrale und dorsale Hälfte in einem Rückenmarksquerschnitt unterscheiden In welchen Höhenabschnitten des Rückenmarks findet sich ein ausgeprägtes Seitenhorn Welche Funktionen sind dort angesiedelt Was versteht man unter der Substantia gelatinosa Welche Verschaltungen finden dort statt Welcher Bindegewebstyp findet sich in der Dura mater spinalis In welchen Raum dringt die Punktionsnadel bei einer Liquorpunktion vor, von welchen Anteilen der Hirnhäute wird er begrenzt Studieren Sie das Präparat 85, Rückenmark, Katze, Vergoldung. Welche Strukturen sind bei dieser Färbung selektiv dargestellt und warum 54
57 Motorische (multipolare) Vorderhornzellen Präparat 27: Rückenmark, Mensch, van Gieson BM 14: Rückenmark (Neuropil, Vorderhorn), TEM x BM 16: Nucleus nervi hypoglossi, Ratte, Semidünnschnitt, Richardson, 500x [Übungspräparat] Aufsuchen von multipolaren Vorderhornzellen, Aufbau mit typischer Kernmorphologie, Nissl Schollen, Axonkegel, Dendriten untersuchen. Aufsuchen von Zellen mit kleinem, dunklerem Kern (Glia- oder Nervenzellen) im Vorderhorn. Aufbau des Neuropils anhand BM 14 studieren. Detailzeichnungen aus Vorderhorn mit multipolaren Nervenzellen, Neuropil, o. g. Strukturen markieren.! Was sind Nissl-Schollen und was ist ihr ultrastrukturelles, was ihr funktionelles Korrelat Womit ist das Auftreten von Nissl-Schollen zytomorphologisch typischerweise vergesellschaftet Wie können lichtmikroskopisch in Vorderhornzellen Axone und Dendriten unterschieden werden Welche weiteren Unterscheidungsmerkmale gibt es zwischen Axonen und Dendriten Rekapitulieren Sie Ultrastruktur und Funktionen des Nukleolus. Welche Zellen haben typischerweise in welchen Lebenssituationen einen ausgeprägten Nukleolus Studieren Sie das Präparat BM16. Rekapitulieren Sie die typischen Merkmale von Motoneuronen. 55
58 Sensible (pseudounipolare) Ganglienzellen Präparat 25: BM 17: Spinalganglion, Kaninchen, Azan Ganglion trigeminale, Ratte, Semidünnschnitt, Richardson, 600x [Übungspräparat] Studium des Präparats in der Übersicht: Identifizieren von Bindegewebskapsel und septen, von Bereichen mit großen Ganglienzellen und mit Anschnitten von Axonbündeln. Aufsuchen von großen Ganglienzellperikarya, Mantel- (Satelliten-) zellen, Axonquerschnitten, Blutgefäßkapillaren. Übersichts- Detailzeichnungen mit Markierung der o. g. Strukturen. Größenverhältnisse von Ganglien-, und Gliazellen beachten und zeichnerisch korrekt wiedergeben! Wie könnte man im histologischen Schnitt ungefähr die Größe einzelner Strukturen abschätzen Woher stammen entwicklungsgeschichtlich Satellitenzellen, welche Funktionen haben sie während der Embryonalentwicklung Spinale Ganglienzellen lassen sich anhand ihrer Größe und Morphologie klassifizieren. Kann man das im lichtmikroskopischen Präparat nachvollziehen und was ist das funktionelle Korrelat dieser unterschiedlichen Ganglienzelltypen Woher stammt die Bezeichnung pseudounipolar! Wo kommen bipolare Nervenzellen zeitlebens vor Wo endet das zentrale Axon pseudounipolarer, spinaler Ganglienzellen Studieren Sie BM 17. Identifizieren Sie die verschiedenen Strukturen innerhalb des Ganglions. Welche baulichen Übereinstimmungen bestehen zu Präparat 25 56
59 Autonome Ganglienzellen Präparat 26: Jejunum (Plexus myentericus, -submucosus), Mensch, HOPA Aufsuchen von Tunica muscularis mit Stratum circulare und longitudinale. Zwischen beiden Schichten autonome Ganglien mit Ganglienzellen, Mantelzellen, Bindegewebskapsel untersuchen. Detailzeichnung eines myenterischen Ganglions. Woher stammen entwicklungsgeschichtlich die autonomen Ganglienzellen des Darms Wie groß ist ungefähr die Zahl enterischer Nervenzellen im Vergleich zum ZNS Welche angeborene Krankheit ist durch das teilweise Fehlen enterischer Nervenzellen, typischerweise im distalsten Darmabschnitt charakterisiert 57
60 Peripherer Nerv Präparat 23: N. ischiadicus (quer), Schwein, Azan Präparat 24: Peripherer Nerv (längs), Ratte, Semidünnschnitt, Richardson BM 2: Perineuralscheide (N. ischiadicus), Ratte, TEM x BM 5: Marklose Nervenfasern, Ratte, TEM x [Übungspräparat] BM 6: Ranvierscher Schnürring, Maus, TEM x [Übungspräparat] Präparat 23 zunächst in der Übersicht studieren: Organisation des Nerven durch Epi-, Peri-, Endoneuralscheiden in Nervenfaserbündel und einzelne Nervenfasern untersuchen. Aufbau der einzelnen Neuralscheiden anhand BM 2 untersuchen. Einzelne markhaltige Nervenfasern mit umgebender Myelinscheide in Längs- (Präparat 24) und Querschnitten (Präparat 23) untersuchen, lichtmikroskopisches Erscheinungsbild verstehen. Übersichten und Detailzeichnungen aus den einzelnen Präparaten. Wie viele Axone werden von einer Schwann Zelle umgeben Was ist ein Internodium Vergleichen Sie den elektronenmikroskopischen und den molekularen Aufbau der Myelinscheide. Wo findet sich kompaktiertes, wo nicht kompaktiertes Myelin Was sind Schmidt-Lantermann-Inzisuren Wie sind sie aufgebaut Was passiert, wenn sie fehlen! Was versteht man unter einem Remak-Bündel Wodurch wird die Dicke der Myelinscheide bestimmt Anhand welcher Bau- und Funktionsmerkmale werden periphere Nervenfasern klassifiziert Studieren Sie die Präparate BM5 und BM6. Wiederholen Sie die Unterschiede zwischen marklosen und markhaltigen Nervenfasern. 58
61 Kurstag 8 Zentrales Nervensystem (ZNS) Themen Großhirn Mittelhirn Dopaminerge Nervenzellen Kleinhirn Lernziele Prüfungsrelevante Lerninhalte ZNS: (Übergeordnete Gliederung und allgemeine Begriffe: ZNS/PNS, afferente/efferente Neurone, somatisches/viscerales Nervensystem, Hirnnerv/Spinalnerv, graue/weiße Substanz, Cortex, Medulla, Nucleus, Tractus, Fasciculus werden vorausgesetzt.) Struktur und Funktion zentraler Glia, Makroglia: Astrozyt, Oligodendrozyt, Ependymzelle, Mikroglia, Blut-Hirn-Schranke, Hirnhäute und Liquorräume, Plexus choroideus. Isocortex: Zytoarchitektur des Isokortex Cerebellum: Kleinhirnrinde, -mark, Zytoarchitektur u. Verschaltung im Kleinhirn, Mesencephalon: Substantia nigra, Klinische Aspekte (fakultativ) Lernziele der Vorlesung Histologie Die Studierenden sollen Isokortex und Allokortex unterscheiden und die Unterschiede erläutern können. Struktur von Mark und Rinde des Groß- und Kleinhirns einschließlich deren Schichtenaufbau, Zelltypen mit ihren Charakteristika, Funktionen, Transmittern und Verschaltungsprinzipien erläutern und wiedergeben können. Lernziele des Kurses Histologie Die Studierenden sollen die kursrelevanten Präparate identifizieren und mit ihren Charakteristika beschreiben bzw. skizzieren. die Verteilung von grauer und weißer Substanz (Cortex, Medulla, Nucleus) in den Präparaten, sowie die Verteilung von Gliazellen zuordnen können. den Aufbau von Neuronen und Synapsen (s. auch Kurstag 7) erläutern können. die zentrale Glia klassifizieren können und die besonderen Eigenschaften und Funktionen von Astrozyten, Oligodendrozyten, Mikroglia und Ependymzellen erläutern können. die Bildung von Grenzmembranen und der Blut- Hirn-Schranke erläutern und deren Funktionen erklären können. die Architektur der Hirnhäute und deren Unterschiede zwischen Rückenmark und Telencephalon erklären können. Amyotrophe Lateralsklerose (progressive Bulbärparalyse), Morbus Parkinson, Multiple Sklerose. Lage, Funktion und Aufbau der Substantia nigra im Mesencephalon mitsamt ihren Zelltypen und die aus deren Fehlfunktion resultierenden Pathologien (wie z.b. der Morbus Parkinson) erklären können. 59
62 Präparat 29: Großhirn, Mensch, Nissl Färbung Aufsuchen der äußeren Oberfläche des Gehirns mit Anteilen der weichen Hirnhäute, Identifizieren von Gyri/Sulci der Großhirnrinde. Von der äußeren Gehirnoberfläche in die Tiefe mikroskopieren, graue (Rinde) und weiße (Mark) Substanz unterscheiden. Innerhalb der Rinde Schichtengliederung untersuchen wie viele Schichten lassen sich im vorliegenden Präparat klar unterscheiden Betzsche Riesenzellen aufsuchen. Zeichnen Sie eine Übersicht von der Großhirnrinde sowie eine Detailansicht vom Kortex mit Schichtengliederung (soweit erkennbar). Wie unterscheiden sich Iso- und Allokortex voneinander Wo kommen diese Formen im Gehirn vor Kann Allokortex weiter untergliedert werden Wie unterscheiden sich granulärer und agranulärer Kortex voneinander Wo kommen diese Formen typischerweise vor Kommen Betzsche Riesenzellen in allen Bereichen des Isokortex vor Welche Bauelemente der Großhirnrinde können mit der Nissl Färbung nicht analysiert werden Kann man in diesem Präparat Gliazellen sicher identifizieren, gibt es indirekte histologische Merkmale 60
63 Präparat 30: Großhirn, Mensch, Markscheidenfärbung nach Weigert Vergleichen Sie dieses Präparat mit dem vorherigen Präparat 29. Aufsuchen der Rinden-Markgrenze, davon ausgehend Untersuchung der Faserarchitektur der Großhirnrinde. Zeichnen Sie einen Ausschnitt aus der Rinde, sowie aus dem Mark-/Rindengrenzbereich mit radiär ausgerichteten myelinisierten Axonen. Welche Bauelemente von Nervenzellen werden in der vorliegenden Färbung nicht oder nur sehr schwach dargestellt Auf welche Schichten des Isokortex projizieren sich äußerer und innerer Baillarger Streifen Wie würde sich der Gennari-Streifen in der Markscheidenfärbung darstellen 61
64 Präparat 32: Gehirn, Ratte, anti-gfap Immunhistologie, Hämalaun Identifizierung wichtiger Areale in der Übersicht: Cortex, Corpus callosum (Balken), Seitenventrikel und III. Ventrikel, Hippocampus, Hypothalamus. Aufsuchen von dunkelbraun gefärbten Astrozyten und Studium ihrer Morphologie. Ausschnitt aus dem Präparat zeichnen. Andere, blaugefärbte Zellkerne von Neuronen oder Oligodendrozyten beachten. Was sind Astrozyten und welche Funktionen besitzen diese Zellen Lokalisieren Sie die Gliagrenzmembran (Membrana limitans gliae superficialis und perivascularis). Vergleichen Sie Gemeinsamkeiten/Unterschiede von zentraler und peripherer Glia. Wiederholen Sie das Prinzip einer immunhistologischen Färbung.! In welchen Zellkompartimenten der Astrozyten ist GFAP lokalisiert Ist der Nachweis von GFAP-Expression in allen Entwicklungsphasen des ZNS spezifisch für Astrozyten Wie könnte man selektiv andere Gliazelltypen im ZNS nachweisen 62
65 Präparat 33: Mittelhirn, Maus, anti-tyrosinhydroxylase, Immunhistologie Orientierung im Präparat: Großhirnhemisphären und Mittelhirn. Das Mittelhirn wird gegliedert in: Tectum (dorsal), Tegmentum und Crura cerebri (basal). Aufsuchen der braun gefärbten Substantia nigra des Mittelhirns. Zeichnen Sie einen Ausschnitt mit braun gefärbten Perikarya (Zytoplasma) und Dendriten der Substantia nigra. Welche Neurone werden über den immunhistologischen Nachweis des Enzyms Tyrosinhydroxylase dargestellt Warum sind die Kerne typischerweise nicht gefärbt Wie spezifisch ist dieses Verfahren Könnten auch andere Neurone angefärbt werden Welche physiologische Funktion besitzt Tyrosinhydroxylase in Nervenzellen Welche Erkrankung geht mit einer Degeneration der dopaminergen Neurone der Substantia nigra einher Welche Symptomatik tritt bei diesen Patienten auf und warum 63
66 Präparat 31: Kleinhirn, Mensch, Luxolechtblau-PAS-Hämalaun (Klüver-Barrera) Studium des Präparats zunächst in der Übersicht: Baumartige Struktur ( Thuja occidentalis, Arbor vitae ) mit Folia, Rinde und Markzone identifizieren. Aufsuchen von Stratum moleculare mit Korb- und Sternzellen, Stratum purkinjense (ganglionare) mit Purkinje Zellen, Stratum granulosum mit Körnerzellen, Golgi Zellen und Glomeruli cerebellares. Übersichtszeichnung mit typischer baumartiger Architektur. Zeichnen Sie einen Ausschnitt aus dreischichtiger Rinde und Markbereich, o. g. Strukturen markieren. Welches sind die einzigen efferenten Neurone der Kleinhirnrinde Was geschieht in den Glomeruli cerebellares Was ist ihr typisches lichtmikroskopisches Merkmal Wo enden Moos- und Kletterfasern im Kleinhirn Wer liegt in den Körben von Korbzellen 64
67 Kurstag 9 Sinnesorgane Themen Auge Hautsinnesorgane Lernziele Prüfungsrelevante Lerninhalte Sinnesorgane: Aufbau des Auges, Schichtungen des Bulbus: äußere, mittlere, innere Augenhaut, vorderer, mittlerer, hinterer Augenabschnitt, Choroidea, Iris, Ciliarkörper, Kammerwasser, Glaskörper, Linse, Sklera, Cornea mit Schichtung, Retina: Schichtung, Pars caeca, Pars optica, Macula lutea, Discus n. optici, Zelltypen der Retina, Funktion und Verschaltung. Hautsinnesorgane: fein-, grobdifferenzierende, schnell-, langsamadaptierende Rezeptoren, sog. Oberflächen-, Tiefensensibilität. Geschmackssinnesorgane: Lokalisation, Aufbau, Formen, Zelltypen, Funktion, assoziierte Drüsen incl. deren Lage und Funktion; s. Kurstag 14. Eigenstudium Entwicklung des Auges und des Mittel- und Innenohrs. Innenohr: Labyrinth, Peri- und Endolymphe, Corti-Organ: Bau, Zelltypen, Gleichgewichtsorgan: Rezeptoren mit Bau, Lage, Zelltypen. Klinische Aspekte (fakultativ) Lernziele der Vorlesung Histologie Die Studierenden sollen beim Auge Aufbau und Funktion von Cornea, Sklera, Konjunktiva, Linse, Glaskörper, Choroidea, Corpus ciliare und Iris erläutern können. die Zelltypen der Retina wiedergeben können sowie deren Schichtung und Verschaltung skizzieren können. beim Innenohr die Begriffe häutiges und knöchernes Labyrinth, Endound Perilymphe differenzieren können. den Aufbau und die Funktion der Cochlea mit Scala vestibuli, Scala tympani, Ductus cochlearis, Corti- Organ, samt Zelltypen und Räumen erläutern können. den Aufbau und die Funktion der Sinnesorgane des Vestibularapparates erklären können. Lernziele des Kurses Histologie Die Studierenden sollen die gezeigten Strukturen skizzieren und charakterisieren können. beim Auge Aufbau und Funktion von Cornea, Sklera, Konjunktiva, Linse, Glaskörper, Choroidea, Corpus ciliare und Iris erläutern können. die Zelltypen der Retina wiedergeben können sowie deren Schichtung und Verschaltung skizzieren können. den Aufbau und die Funktion des Innenohrs kennen und erläutern können. (s. Vorlesung ) den Aufbau und die Funktion der Geschmackssinnesorgane, deren Lokalisation, Formen, Zelltypen, assoziierte Drüsen kennen und erklären können; s. Kurstag 14. den Aufbau und die Funktion von Merkel-Zellen, Ruffini-Körperchen, Meissner-Körperchen, Vater-Pacini-Körperchen, freien Nervenendigungen, Muskelspindeln sowie von Golgi- Sehnenorganen erklären und skizzieren können. Katarakt, Retinaablösung, Glaukom, Stauungspapille, Neuritis nervi optici, Hörsturz, CIPA Syndrom. 65
68 Auge Präparat 15: Auge, Schwein, H.E. (! Bitte beachten: nur jeder 2. Kasten enthält dieses Präparat) Studium des Präparats mit bloßem Auge und in der Übersicht: Identifizieren der prinzipiellen Architektur und Gliederung des Augapfels: Vorderer, mittlerer, hinterer Augenabschnitt, äußere, mittlere, innere Augenhaut. Aufsuchen von Cornea mit vorderem, hinterem Hornhautepithel, Hornhautstroma, Membrana limitans posterior (= Descemet Membran = Basalmembran des Hornhautendothels). Membrana limitans anterior (=Bowmansche Membran). Aufsuchen von vorderer und hinterer Augenkammer, Corpus ciliare, Processus ciliaris, Musculus ciliaris, Iris, Linse mit Linsenkapsel, -epithel, -fasern, Kammerwinkel mit Schlemm Kanal, Retina mit Pars optica, Pars caeca, Ora serrata, Choroidea, Sklera. Übersicht anfertigen. Skizzieren Sie die verschiedenen Anteile des vorderen Augenabschnitts: Cornea, Iris, Corpus ciliare, Linse. Wie wird die Cornea ernährt Wie ist sie innerviert Kommt im Präparat Muskulatur vor (glatt oder quergestreift) Um welche Muskeln handelt es sich Was wird vom Epithel des Ciliarkörpers produziert Welche Funktionen besitzen Linsen- und Zonulafasern Was könnten die Folgen eines zu engen Kammerwinkels sein 66
69 Präparat 28: Retina, Kalb, HOPA Mikroskopieren Sie die verschiedenen Schichten der Retina. Aufsuchen von Stratum segmentorum externum und internum, Stratum limitans externum, Str. nucleare externum, Str. plexiforme externum, Str. nucleare internum, Str. plexiforme internum, Str. ganglionare, Str. neurofibrarum, Str. limitans internum. Zeichnen Sie einen Ausschnitt mit allen Schichten der Retina. Ordnen Sie den lichtmikroskopischen Schichten der Retina ihre funktionell-anatomischen Korrelate zu. Was enthalten die plexiformen Schichten Finden sich in der Retina myelinisierte Axone Wie sehen Außensegmente im elektronenmikroskopischen Bild aus und welche Funktion besitzen sie 67
70 Hautsinnesorgane Präparat 5: Fingerbeere, Mensch, H.E. Relevante Inhalte/Vorkenntnisse aus Kurstag 2 Oberflächenepithelien rekapitulieren! Studium des Präparats in der Übersicht: Epidermis, Dermis und Subcutis identifizieren. Aufsuchen von Meissner-Tastkörperchen im Corium (Stratum papillare), Vater-Pacini-Lamellenkörperchen in den tiefen Dermisschichten bzw. an der Grenze von Dermis zu Subkutis. Übersichtszeichnung durch die Schichten der Haut. Zeichnen Sie Ausschnitte mit den verschiedenen Rezeptortypen. Über welche Rezeptoren werden Schmerz und Temperatur wahrgenommen Wo liegen diese Rezeptoren Sind sie lichtmikroskopisch sichtbar Über welche Nervenfasertypen werden Schmerzreize zum Rückenmark geleitet Wieso wird in einem entzündeten Hautbezirk ein Berührungsreiz u. U. als schmerzhaft wahrgenommen 68
71 Kurstag 10 Haut und Hautanhangsgebilde Themen Leistenhaut Haare Hautdrüsen Brustdrüse Lernziele Prüfungsrelevante Lerninhalte Haut: Bauprinzip und funktionelle Bedeutung, Turgor, Pigmentierung, Leisten- und Felderhaut, Spaltlinien, Verschieblichkeit, Hautanhangsgebilde. Behaarung: Lanugo-, Terminalbehaarung, Haarzyklus, M. arrector pili, Talgdrüsen. Aufbau der Brustdrüse, Laktation und Milchejektion. Eigenstudium Nägel: Matrix, Hyponychium, Eponychium, Lunula, Einbau des Nagels Tunica dartos (Kurstag 4) Entwicklung der Brustdrüse. Klinische Aspekte (fakultativ) Altersveränderungen, Naevus, gut- und bösartige Hauttumoren, Hyperkeratosen, Melanom, Keloidbildung, Acne vulgaris, Furunkel, Karbunkel. Lernziele der Vorlesung Histologie Die Studierenden sollen die Schichten, die morphologischen Unterschiede und die verschiedenen Funktionen der Haut kennen. die Drüsen der Haut im Aufbau und mit Ausführungsgangsystem beschreiben können. die unterschiedlichen Sinnesfunktionen der Haut und dort den einzelnen Rezeptorgebilden zuordnen können (siehe Kurstag 9). den Aufbau und die Funktionsweise der weiblichen Brustdrüse erläutern können. Lernziele des Kurses Histologie Die Studierenden sollen Präparate mit ihren Besonderheiten beschreiben und erkennen können. die Schichtung der Haut kennen und den Schichten wesentliche Funktionen zuordnen können. die Lage von Hautorganen, -zelltypen und -anhangsgebilden angeben können. bei der Epidermis Schichtenbau, Pigmentierung, Keratinozyten, Langerhans- Zellen, Merkel-Zellen, Melanozyten erkennen können. bei der Dermis Fasertextur und Unterschiede sowie den Schichtenbau benennen können. in der Subcutis regionale Unterschiede, die Funktion als Speicherorgan und die Gliederung erklären können. die Sinnesfunktion der Haut beschreiben und dabei freie Nervenendigungen und Rezeptoren für Oberflächensensibilität (siehe Kurstag 9) erklären können. Längs- und Querschnitte des Haares und die Bauelemente erkennen können. den Aufbau, die Lokalisation, Sekretionsmodus und Funktion verschiedener Hautdrüsen erläutern können. 69
72 Leistenhaut Präparat 5: BM 22 : Fingerbeere, Mensch, H.E. Menschliche Epidermis, Hämalaun, 700x Wiederholen Sie Aufbau und Funktion des verhornten Plattenepithels (Kurstag 2). Aufsuchen der einzelnen Schichten und Bauelemente der Haut: Epidermis, Dermis mit Stratum papillare, -reticulare, Tela subcutanea, ekkrine Schweißdrüsen mit intraepithelialen Ausführungsgängen, Meissner und Vater-Pacini Körperchen. Querschnitt durch alle Schichten des Integumentum commune. Welche nichtepithelialen Zellen kommen in der Epidermis noch vor und welche Funktion haben diese Zellen (vgl. auch BM 22) Woraus wird Melanin synthetisiert Wie ist die dermo-epidermale Verbindungszone aufgebaut Wie entstehen die Hautleisten Welche Bedeutung kommt dem Leistenmuster zu 70
73 Haare Hautdrüsen Präparat 40: Präparat 41: Kopfhaut, Mensch, H.E. Achselhaut, Mensch, van Gieson [Übungspräparat] Schichtung der Haut mit vorherigem Präparat vergleichen Gemeinsamkeiten, Unterschiede Aufsuchen von Haarfollikeln, Haarschaft, Talgdrüsen, Schweißdrüsen, Musculus arrector pili. Übersicht mit den oben erwähnten Strukturen zeichnen. Haarfollikel im Detail darstellen. Welche Anteile des Haares sind verhornt Welche Bedeutung haben die Matrixzellen Was ist der Wulst Welche Zellen mit welcher Funktion kommen in dieser Struktur vor Wie ist die epitheliale Wurzelscheide aufgebaut Wie kommt es zur Entstehung von Acne vulgaris Welche Drüsen sind beim Schweißdrüsenabszess der Achselhöhle betroffen Die Verdachtsdiagnose Zystische Fibrose (Mukoviszidose) kann mit Hilfe eines Schnelltestes gestellt werden. Dabei wird der Chlorid-Gehalt des Endschweißes gemessen. Überlegen Sie den pathophysiologischen Zusammenhang. Studieren Sie Präparat 41. Lokalisieren Sie die apokrinen (Duftdrüsen) und ekkrinen Schweißdrüsen in der Dermis. Beachten Sie die quer angeschnittenen Haarfollikel. Wo findet man noch apokrine Duftdrüsen Welche Art des Sekrets bilden sie Wozu dienen ekkrine Schweißdrüsen 71
74 Hautdrüsen Präparat 88: Augenlid, Mensch, Goldner Studium des Präparats zunächst in der Übersicht: Unterscheidung zwischen Innen- und Außenfläche des Augenlids. Aufsuchen von Epidermis, Haaren, Wimpern, M. orbicularis oculi, Tarsus, Glandulae tarsales, (Meibomsche Drüsen = Talgdrüsen), Glandulae ciliares (Mollsche Drüsen = apokrine Schweißdrüsen), Haarbalg-assoziierte Talgdrüsen (Zeissche Drüsen), M. tarsalis superior, Tunica conjunctiva palpebrae. Zeichnen Sie Ausschnitte des Augenlids mit den o.g. Strukturen. Welches ist die Funktion der Meibom- und Moll-Drüsen, wo münden sie Gibt es quergestreifte und/oder glatte Muskulatur im Präparat Um welche Muskeln handelt es sich Welche Rolle spielt der M. tarsalis Klären Sie die Begriffe Gerstenkorn (Hordeolum externum) und Hagelkorn (Chalazion) Welche Beziehung haben sie zu den Drüsen des Augenlids 72
75 Brustdrüse Präparat 46: Präparat 60: Brustdrüse (laktierend), Mensch, HOPA Brustdrüse (ruhend), Mensch, H.E. Orientierung im Präparat: Gliederung in Lappen und Läppchen über Bindegewebssepten. Aufsuchen der tubulo-alveolären Drüsenendstücke und der Drüsenausführungsgänge im intra- und extralobulären Bindegewebe. Mikroskopieren Sie zum Vergleich Präparat 60: Identifizieren Sie die histologischen Unterschiede zwischen der ruhenden und der laktierenden Brustdrüse. Brustdrüsenläppchen mit Bindegewebe und Gangsystem zeichnen. Wie ist das Sekret zusammengesetzt Wie erfolgt die Sekretion Welche Hormone beeinflussen die Brustdrüse Mammakarzinome entstehen meist aus dem Gangepithel, sogenannte duktale Karzinome (selten aus dem Epithel der Drüsenendstücke). Überlegen Sie, womit das zusammenhängen könnte 73
76 Kurstag 11 Kreislauforgane und Blut Themen Blutgefäße Lymphgefäße Peripheres Blut Lernziele Prüfungsrelevante Lerninhalte Blut und Gefäße: Arterien, Wandaufbau: elastischer und muskulärer Typ und deren Vorkommen, Arteriolen, Kapillaren: Bau, Typen (geschlossen, fenestriert, mit und ohne Diaphragma), Barriereeigenschaften, Durchtrittsmechanismen, Sinusoide, Venolen, Venen, Wandaufbau, Venenklappen, arteriovenöse Anastomosen, Sperrarterien, Drosselvenen, Vasa lymphatica et Trunci lymphatici. Arten von Blutzellen, deren Aufbau, Erscheinungsbild, Größe, Zahl, Lebensdauer, Bildungsort, Funktionen. Rotes Knochenmark: Aufbau, Grundzüge der Blutzellbildung. Klinische Aspekte (fakultativ) Arteriosklerose, Bluthochdruck, venöser Rückfluß, Thrombose, Varizen, Lymphabfluß, - ödeme, Anämien. Lernziele der Vorlesung Histologie Die Studierenden sollen zwischen Aorta, Arterien, Arteriolen, Kapillaren, Venolen, Venen differenzieren, die Funktionen der Blutgefäße aufzählen und den Wandbau der Gefäße mit Besonderheiten in den Gefäßabschnitten beschreiben können. die Bedeutung des Endothels für die Regulation der Gefäßpermeabilität, Gefäßweite, Blutgerinnung und Leukozytenmigration erläutern können. die Zusammensetzung des Blutes darstellen, die Funktionen seiner Bestandteile und alle Blutzellen mit ihren morphologischen Eigenschaften und Funktionen benennen können. den Aufbau des Knochenmarks, die Blutzellbildung mit allen Vorstufen der Erythropoese, Thrombozytopoese, Granulozytopoese und Monozytopoese in ihren Grundzügen beschreiben können. die Bedeutung des Knochenmarkausstrichs für die Diagnose von Erkrankungen erkennen. Lernziele des Kurses Histologie Die Studierenden sollen die Kurspräparate identifizieren und ihre Besonderheiten beschreiben können. Struktur-Funktionsbeziehungen kennen und erläutern können. Blutgefäße erkennen und deren Aufbau darstellen können. Abschnitte des Gefäßsystems und Blutzellen mikroskopisch unterscheiden können. 74
77 Blutgefäße Präparat 35: Präparat 36: Arteria und Vena femoralis, Katze, Azan Arteria und Vena femoralis, Kaninchen, Aldehydfuchsin Studium des Präparats in der Übersicht: Aufsuchen von Arteria und Vena femoralis. Beachten Sie die Form des jeweiligen Gefäßlumens und die Relation von Lumenweite zu Wandstärke. Arterie: Aufsuchen von Tunica intima mit Endothel und Stratum subendotheliale, Membrana elastica interna, Tunica media, Membrana elastica externa, Tunica externa bzw. Adventitia. Vene: Aufsuchen von Tunica intima, -media, -externa. Vergleichen Sie den Wandaufbau beider Gefäße, das färberische Verhalten, und die relative Dicke einzelner Schichten der Gefäßwand. Übersichtszeichnung. Detailskizzen zur Arterien- und Venenwand mit Markierung der o. g. Strukturen. Welche dritte morphologische Struktur findet sich neben A. und V. femoralis in dem Präparat Vergleichen Sie die Präparate 35 und 36 miteinander. Welche Bauelemente werden in Präparat 36 selektiv dargestellt Überlegen Sie welche Struktur-Funktionsbeziehungen sich aus dem Wandaufbau beider großer Gefäße ableiten lassen. Zu welchem Arterientyp gehört die Arteria femoralis! In der Arterienwand finden sich Anschnitte kleiner Blutgefäße. Wie nennt man diese und welche Funktionen besitzen sie Was versteht man unter den Begriffen Vaskulogenese und Angiogenese 75
78 Präparat 38: Präparat 37: Präparat 11: BM 7: BM 8: Aorta, Schwein, H.E. Aorta, Mensch, Orcein Kapillaren, Ratte, Richardson (Unterhaut, Semidünnschnitt) [Demo-/Übungspräparat] Corpusculum renale, Maus, TEM x [Übungspräparat] Interalveolarseptum, Maus, TEM x [Übungspräparat] Mikroskopieren Sie die Präparate 38 und 37 im Vergleich. Beachten Sie, dass in beiden Fällen Tunica intima und -externa meist nicht im Präparat erhalten sind. Zeichnen Sie einen Ausschnitt aus den Präparaten 37 und 38 mit glatten Muskelzellen und elastischen Fasern. Welche Funktionen besitzen glatte Muskelzellen in Arterien vom elastischen Typ Was versteht man unter Windkesselfunktion Was ist das morphologische Korrelat dieser funktionellen Eigenschaft Studieren sie das Präparat 11. Unterscheiden Sie zwischen Arteriolen, Venolen und Kapillaren. Achten Sie dabei auf die Charakteristika von Kapillaren: dünnes Endothel mit flachen Zellkernen, Basalmembran und Perizyten. Welche Typen von Kapillarendothelien gibt es Wo kommen sie vor Was sind Sinusoide Vergleichen Sie BM 7 (Glomerulumkapillaren) und BM 8 (Interalveolarkapillaren). 76
79 Lymphgefäße Präparat 39: Fetale Lunge, Mensch, HOPA [Demo-/Übungspräparat] Demonstration des Präparats zunächst in der Übersicht: Blutgefäße (teilweise mit Erythrozyten), Lymphgefäße, fetales Bronchialsystem und Lungenparenchym. Wie unterscheidet sich der Wandaufbau von Lymphkapillaren und großen Lymphgefäßen Wie wird die Lymphe gebildet und woraus besteht sie Welche Funktion hat das Lymphgefäßsystem! Welche Rolle spielen Lymphgefäße bei der Ödembildung In den Lymphgefäßen des Präparats kann amorphes Material beobachtet werden. Was könnte dies sein Studieren Sie das Präparat 39. Identifizieren Sie Blut- und Lymphgefäße. 77
80 Peripheres Blut Präparat 101: Präparat 34: Peripherer Blutausstrich, Mensch, Pappenheim Blutausstrich (Leukozytenkonzentrat), Mensch, Pappenheim Wählen Sie einen Bereich im Präparat aus, wo die Blutzellen dicht aber vereinzelt liegen. Bei hoher Vergrößerung Aufsuchen von Erythrozyten, Thrombozyten und Leukozyten. Verdeutlichen Sie sich die absoluten und relativen Größenverhältnisse der einzelnen Blutzelltypen. Versuchen Sie unterschiedliche Leukozytenformen zu unterscheiden. Übersichtszeichnung eines typischen peripheren Blutbildes. Detailzeichnung zu den einzelnen Blutzelltypen. Beachten Sie dabei die lichtmikroskopischen Merkmale der unterschiedlichen Leukozytentypen. Nehmen Sie dabei das Leukozyten-angereicherte Präparat 34 zu Hilfe. Welche Proteine sind für die Gestalt der Erythrozyten verantwortlich Was versteht man unter Substantia reticulofilamentosa Wie lässt sie sich darstellen Was wissen Sie über den Abbau der Erythrozyten Was versteht man unter Links- bzw. Rechtsverschiebung im Blutbild Was sind stabkernige Granulozyten Unter welchen physiologischen oder pathologischen Bedingungen können kernhaltige Erythrozyten im peripheren Blutbild auftreten 78
81 Kurstag 12 Themen Lymphatische Organe Thymus Lymphknoten Milz MALT Lernziele Prüfungsrelevante Lerninhalte Immunsystem: Unspezifische/spezifische Abwehr, humoral/zellvermittelt, primäre und sekundäre lymphatische Organe, Rekombination, Selektion, Aktivierung, klonale Vermehrung, Memory cells, Lymphozytenzirkulation, Hochendothelvenolen, Selektine, Ablauf der Immunantwort. B-Lymphozyten, B-Zellrezeptoren, Plasmazellen (EM), Antikörperaufbau, -bildung und klassen, T-Lymphozyten, zytotoxische T-Zellen (CD8- Zellen), T-Zellrezeptoren, Antigenpräsentation mittels MHC I und II, Perforine, zelluläre Immunität, T-Helferzellen (CD4-Zellen), TH1/TH2-Zellen, Cytokine, Makrophagen, Phagozytose, antigenpräsentierende Zellen, Mastzellen. Thymus: Aufbau, Charakteristika, T-Lymphozytenreifung und Selektion, Subklassenprägung, Blut-Thymus-Schranke, Altersveränderungen. Lymphknoten: Aufbau: Kortex, Parakortex, (Markstränge), B- und T-Zell-Regionen, Vasa afferentia, Vasa efferentia, Mikrozirkulation des Blutes, Filter- und Immunfunktion. Tonsillen: Tonsilla palatina, pharyngea, lingualis; Aufbau, Epithelschichten, FAE, Krypten, retikuläres Gewebe, Follikel, Interfollikularregion, Immunfunktion. Klinische Aspekte (fakultativ) Infektionskrankheiten, Überempfindlichkeitsreaktionen Typ I (Atopie), II, III, IV, Thymus-Hyperplasie, Myasthenia gravis, Tonsillitis. Lernziele der Vorlesung Histologie Die Studierenden sollen strukturelle Voraussetzungen von Pathogenen kennen und deren Wirkung auf das Immunsystem zuordnen können. unspezifische (angeborene) und spezifische (erworbene) Bestandteile der Immunabwehr nennen können. die Entwicklung und Zelldifferenzierung der für die Immunabwehr relevanten Zelltypen darstellen und die Funktion dieser Zellen einordnen können. den grundsätzlichen Aufbau lymphatischer Organe beschreiben und deren Charakteristika zur Differentialdiagnose heranziehen können. Lernziele des Kurses Histologie Die Studierenden sollen die Kurspräparate identifizieren und ihre Besonderheiten beschreiben können. in den Präparaten bereits erlernte Strukturen, wie Gefäße, Nerven, Epithelien identifizieren können. die Organdiagnose anhand des Gewebeaufbaus und des Oberflächenepithels stellen können. Unterschiede zwischen primär oder sekundär lymphatischen Organen erkennen und erläutern können. das lymphatische Organ in Stützgerüst und lymphatische Zellen gliedern können. T- und B- Zellregionen zuordnen können. den Lymphfluß durch den Lymphknoten erklären können. 79
82 Thymus Präparat 49: Thymus, menschl. Foetus, H.E. Mikroskopieren Sie von der Oberfläche entlang der Bindegewebssepten. Aufsuchen von interlobulärem Bindegewebe mit Gefäßen, Gliederung in Pseudoläppchen mit Rinde und Mark, (T-) Lymphozyten, Hassallsche Körperchen, Retikulumzellen. Übersichtszeichnung. Detailskizzen aus Rinden- und Markbereich, o. g. Strukturen markieren. Können Sie Thymusepithelzellen von T-Lymphozyten unterscheiden Was enthält das Mark Was versteht man unter Blut-Thymus Schranke Was sind Hassall-Körperchen Was findet man häufig in ihrem Zentrum! Welche Unterschiede gibt es zwischen dem Thymus eines Kindes und dem eines Erwachsenen Woher stammt entwicklungsgeschichtlich der Thymus 80
83 Lymphknoten Präparat 50: Präparat 51: Lymphknoten, Hund, H.E. Lymphknoten, Mensch, Antiserum gegen B-Lymphozyten [Übungspräparat] Mikroskopieren Sie von der Kapsel ausgehend die Rindenregion (außen), die Parakortikalzone und das Mark mit Marksträngen und Marksinus (innen). Aufsuchen von Randsinus und Radiärsinus, Vasa afferentia und Vas efferens. Suchen Sie einen Bereich, in dem die verschiedenen Zellarten, Blutgefäße, Primärfollikel, Sekundärfollikel und Keimzentren vertreten sind und zeichnen Sie diese. Wem entspricht die parafollikuläre/parakortikale Zone Was sind hochendotheliale Venolen Was sind Uferzellen Zu welchem übergeordneten System gehören sie Welche Unterschiede gibt es zwischen Primärfollikel und Sekundärfollikel Studieren Sie Präparat 51. Welche Zellen sind für die B-Lymphozyten-Differenzierung notwendig 81
84 Milz Präparat 52: Präparat 10: Milz, Mensch, H.E. Milz, Ratte, Tusche in vivo, H.E. [Übungspräparat] Präparat 52: Bindegewebskapsel mit Trabekeln in das Organinnere betrachten, rote und weisse Pulpa mikroskopieren. Verästelung der Milzarterien bis zu den Pinselarteriolen (Penicilli) verfolgen, Venen studieren. Achten Sie auf die Malpighi Knötchen (Milzknötchen). Von der Kapsel ausgehend die verschiedenen Bereiche der Milz zeichnen und beschriften. Versuchen Sie die Gliederung der Malpighi Knötchen wiederzugeben. Welches sind die Anteile der weißen Milzpulpa Woraus besteht die rote Milzpulpa / woraus bestehen die roten Pulpastränge Was sind Malpighi Knötchen Erarbeiten Sie den Blutfluss in der Milz. Wohin gelangt das Blut aus der Milzvene Was könnten klinische Implikationen sein Studieren Sie im Präparat 10 die Bereiche der roten Pulpa mit den Makrophagen. Warum wird die Tusche beseitigt Welche anderen Zellen erfüllen eine ähnliche Aufgabe 82
85 Tonsillen Präparat 47: Präparat 48: Tonsilla palatina, Mensch, H.E. Tonsilla pharyngea, Mensch, H.E. Mikroskopieren Sie beide Präparate ausgehend von der Schleimhaut in die Einsenkungen (Fossulae tonsillares und Krypten). Aufsuchen von mehrschichtigem unverhorntem Plattenepithel (Präparat 47), lymphoretikulärem Gewebe, durchwandernden Lymphozyten, Sekundärfollikel. Zeichnen Sie einen Ausschnitt mit den charakteristischen Merkmalen dieser Organe. Was wird als Follikel-assoziiertes Epithel (FAE) bezeichnet Welches sind die Unterscheidungskriterien zwischen den beiden Tonsillen In welchen anderen Organen findet man die hier vorkommenden Epitheltypen Was wird als Detritus bezeichnet Wo sitzen im Präparat 47 B-Lymphozyten Wo befindet sich die T-Zellregion Was versteht man unter dem Waldeyer Ring (Lymphatischer Rachenring) 83
86 MALT Mukosa assoziiertes lymphatisches Gewebe Präparat 64: Präparat 12: Ileum, Mensch, van Gieson Trachea, Mensch, H.E. [Übungspräparat] Mikroskopieren Sie vom Lumen ausgehend und achten Sie auf die Noduli lymphatici aggregati (Peyer Plaques oder Peyer Platten). Zeichnen Sie einen Ausschnitt der Darmmucosa mit Peyer Plaques. Woraus bestehen die Peyer Plaques Was wird als Domepithel bezeichnet Was sind M-Zellen und welche Funktion haben diese Zellen Studieren Sie das Präparat 12. Wo finden sich hier Lymphozyten Was bedeutet BALT Charakterisieren Sie das Epithel, welche Oberflächendifferenzierung finden Sie hier 84
87 Kurstag 13 Respirationstrakt Themen Stimmlippe Trachea Lunge Lernziele Prüfungsrelevante Lerninhalte Respirationstrakt: Wandbau, Schleimhaut von Trachea, Bronchien, Bronchiolen, Bronchialepithel, Bau und Zelltypen der Alveolarregion, Surfactant, neuroendokrine Zellen, Blut-Luft-Barriere, mukoziliäre Clearance. Eigenstudium Extrapulmonale Atemwege (Nasenhöhle, Rachen), Pleura. Klinische Aspekte (fakultativ) Glottisödem, Asthma bronchiale, Lungenfibrose, Lungenödem, Lungenemphysem, Pneumonie. Lernziele der Vorlesung Histologie Die Studierenden sollen die Anteile des Atemtraktes kennen und konduktiven und respiratorischen Funktionen zuordnen können. den allgemeinen Wandaufbau des Atemtraktes beschreiben und die spezifischen Merkmale der einzelnen Anteile als differentialdiagnostische Kriterien anwenden können. den zellulären und ultrastrukturellen Aufbau der Alveolen darstellen können. Lernziele des Kurses Histologie Die Studierenden sollen die verschiedenen Abschnitte der Atemwege anhand des Oberflächenepithels, der Drüsen und des Wandaufbaus beschreiben können. Struktur-Funktions-Beziehungen kennen und erläutern können. den ultrastrukturellen Aufbau der Blut-Luft- Schranke kennen. eine in vivo Färbetechnik beschreiben können. 85
88 Stimmlippe Präparat 53: Stimmlippe, Mensch, van Gieson Studium des Präparats in der Übersicht: Supraglottis (Epiglottis, Plica vestibularis et Ventriculus laryngis), Glottis (Plica vocalis), Subglottis (Anteil unter der Plica vocalis bis zum Unterrand des Ringknorpels). Aufsuchen von Stimmband mit Ligamentum vocale, M. vocalis. Übersichtszeichnung, o. g. Strukturen beschriften. Welche unterschiedlichen Oberflächenepithelien lassen sich in diesem Präparat finden Was versteht man unter dem Reinkeschen Raum, was unter der Morgagnischen Tasche Welcher Teil des Kehlkopfes ist frei von Drüsen Welche histologischen Besonderheiten des Kehlkopfes begünstigen die Entstehung eines Glottisödems Wo entsteht ein Reinke-Ödem Welche Symptomatik weist der betreffende Patient auf 86
89 Präparat 12: Trachea, Mensch, H.E. Studium des Präparats in der Übersicht: Hufeisenförmige Begrenzung des Lumens im Querschnitt. Aufsuchen von Tunica mucosa mit respiratorischem Epithel (rekapitulieren Sie Kurstag 2), Lamina propria, Tela submucosa, Tunica fibromusculocartilaginea, Paries membranaceus, M. trachealis, Gll. tracheales, Tunica adventitia, Trachealknorpel. Beachten Sie das Vorkommen von lymphatischen Zellen und das lichtmikroskopische Bild der Basalmembran. Übersichtszeichnung mit Markierung der o. g. Strukturen. Welcher Sekretionstyp liegt bei den Glandulae tracheales vor Gibt es Sinneszellen im Bereich der Trachea 87
90 Präparat 54: Lunge, Schwein, H.E. Präparat 55: Lunge, Mensch, H.E. BM 8: Alveolarseptum, Maus, TEM x Studium der Präparate 54 und 55 zunächst in der Übersicht im Vergleich: Anteile des Lungenparenchyms und von Anschnitten des Luftleitungssystems (Bronchialbaums) identifizieren. Aufsuchen von Bronchusanschnitten mit Knorpel, eventuell Glandulae bronchiales, Bronchioli terminales, - respiratorii, Ductus alveolares et Sacculi alveolares mit Alveolen, Pneumozyten Typ I, II, Alveolarmakrophagen, Anthracos. Ultrastruktur des Alveolarseptums studieren (BM 8). Übersichtszeichnung, Detailzeichnungen einzelner Bronchustypen und des Übergangs zum Lungenparenchym. In welchen Abschnitten des Bronchialbaums sind Flimmerepithelzellen vorhanden Anhand welcher Baumerkmale lassen sich Bronchien von Bronchiolen unterscheiden In welchen Abschnitten des Bronchialbaums findet man vor allem Clara-Zellen Welche Funktionen haben sog. small granule cells im respiratorischen Epithel Bei Verdacht auf akute Schädigung der Lunge (z.b. nach Inhalation toxischer Substanzen) wird in der bronchoalveolären Lavage und im Blut der Gehalt an Clara-Zell-Proteinen untersucht überlegen Sie warum und wie diese verändert sein könnten! 88
91 Präparat 56: Lunge, Mensch, Resorcinfuchsin Bei höherer Vergrößerung elastische Fasern mikroskopieren. Lage und Verteilungsmuster auf die Präparate 54 und 55 beziehen. Fakultativ. Welche Funktion besitzen elastische Fasern in der gesunden Lunge Welche funktionellen Konsequenzen könnte der Verlust an elastischen Fasern in der Lunge haben 89
92 Präparat 39: Lunge, menschlicher Fetus, HOPA Studium des Präparats in der Übersicht: typisches lichtmikroskopisches Erscheinungsbild einprägen. Aufsuchen von drüsenartigen Bronchien mit aufgefaltetem Lumen, lichtmikroskopisch unreifer Knorpel, nicht-entfaltete Alveolarräume mit z.t. isoprismatischem Epithel und ins Lumen abgestoßenen Zellen. Übersichts-, Detailzeichnungen von fetalem Lungenparenchym und Bronchien anfertigen.! Welche Voraussetzung muss erfüllt sein, damit sich die Lunge eines Frühgeborenen entfalten kann Mit welchen Organen oder Geweben könnte die fetale Lunge differentialdiagnostisch verwechselt werden 90
93 Kurstag 14 Verdauungstrakt I Themen Lippe Zunge Zahn/Zahnentwicklung Ösophagus Lernziele Prüfungsrelevante Lerninhalte Zahn: Zahnaufbau, -abschnitte, -formel, Milchgebiß und Dauergebiß, Okklusion, Kauakt, Artikulation, Zahnentwicklung, Grundkenntnisse des Zahndurchbruchs und des Zahnwechsels, Hartsubstanzen, Parodontium, Gingiva. Mundhöhle: Zungenaufbau, Schleimhaut mit Zungenpapillen, Geschmacksknospen, Zungentonsillen, -drüsen. Verdauungstrakt: Für alle Abschnitte des Verdauungstraktes: Schichtenbau der Wand, Zellen und Aufbau der Schleimhaut, Anordnung der Muskulatur, lymphatische Anteile, enterisches Nervensystem, diffuses neuroendokrines System. Lernziele der Vorlesung Histologie Die Studierenden sollen den Aufbau der Zähne darstellen können. spezifische Anpassungen der Zähne in Abhängigkeit von der Lage innerhalb des Gebisses ableiten können. sowohl pränatale aus auch postnatale Phasen der Zahnentwicklung aufzeigen können. Lernziele des Kurses Histologie Die Studierenden sollen die Präparate identifizieren und ihre Besonderheiten beschreiben können. anhand der gezeigten Präparate die Entwicklung des Zahns bzw. der einzelnen Zahnanteile erklären können. den typischen Wandaufbau und die einzelnen Schichten des Darmrohres anhand des Ösophagus erklären können. Klinische Aspekte (fakultativ) Gingivitis, Karies. 91
94 Präparat 42: Oberlippe, Mensch, H.E. Unterscheiden Sie Hautseite und Schleimhautseite mit ihren spezifischen Baumerkmalen. Übersichtszeichnung. Zeichnen und beschriften Sie repräsentative Ausschnitte des Präparats. Beachten Sie folgende Strukturen: Haut, -anhangsgebilde, Schleimhaut, Gll. labiales, Bindegewebssockel, Muskulatur. Wo liegt das Lippenrot Was sind die korrespondierenden Baumerkmale Würde die Schleimhaut im Bereich der Gingiva gleich aussehen Zu welchem Muskel gehört die quergestreifte Muskulatur im Präparat Wie würde sich ein Präparat aus der Wangenregion unterscheiden 92
95 Präparat 20: Präparat 57: Zunge, Katze, HOPA oder van Gieson Zunge, Kaninchen, HOPA Identifizieren Sie die Zungenober- und -unterseite, Binnenmuskulatur (3D-Anordnung beachten), Gefäße, Nerven, Drüsengewebe. Zeichnen Sie einen Ausschnitt der Zungenoberseite mit Papillae filiformes und fungiformes. Aufsuchen und Zeichnen von Papillae foliatae mit Geschmacksknospen und serösen Spüldrüsen in Präparat 57.! Gibt es weitere Arten von Papillen Wo liegen diese Welche Geschmacksqualitäten empfindet man wo auf der Zunge Wo findet man lymphatisches Gewebe Was versteht man unter Umami 93
96 Präparat 6: Zahnanlage, Rattenfetus, HOPA Präparat in der Übersicht studieren: Frontalschnitt durch Kopfanlage. Aufsuchen von Zahnanlagen in Ober-, Unterkiefer: äußeres, inneres Schmelzepithel, Schmelzpulpa, Zahnpapille. Zahnanlage, falls vorhanden in unterschiedlichen Stadien zeichnen, o.g. Strukturen markieren. Wo findet bei der frühen Zahnentwicklung eine epithelio-mesenchymale Transformation statt Welche Epitheltypen liegen beim äußeren und inneren Schmelzepithel vor Findet man eine Ersatzzahnleiste Weshalb entstehen nur an bestimmten Stellen aus Ektoderm Schmelzknospen 94
97 Präparat 98: Zahnanlage, Mensch (22. Woche), H.E. Zahnanlage mit äußerem Schmelzepithel, Schmelzpulpa, innerem Schmelzepithel, Adamantoblasten, Schmelz, Dentin/Prädentin, Odontoblasten, Zahnpulpa mit einsprossenden Gefäßen aufsuchen. Zahnanlage exemplarisch zeichnen und o.g. Strukturen beschriften. In welchem Stadium befindet sich die Zahnanlage in diesem Präparat Welcher Zelltyp produziert welche Hartsubstanz Welche Zellen bilden wo Zahnzement Woher stammen diese Zellen Welche Bedeutung hat der Schmelzknoten während der Zahnentwicklung Was passiert mit der Schmelzpulpa 95
98 Präparat 99: Zahnwurzel, Schaf (Schliff), Fuchsin [Demo-/Übungspräparat] Demonstration (von der Pulpahöhle aus nach außen): Dentin, Dentinkanälchen, Tomessche Körnerschicht, Schmelz, Zahnzement, Zementozyten, Periodontium, Sharpey-Fasern, Knochen der Alveolenwand. Beim Schaf gibt es eine Überlappung von Schmelz und Zement; wie verhalten sich Schmelz und Zement beim menschlichen Zahn Durch den Zahnhalteapparat wird der Kaudruck in Zug umgewandelt wie und warum Studieren Sie das Präparat. Fertigen Sie eine Zeichnung an, welche die oben genannten Strukturen zeigt. 96
99 Präparat 100: Zahn (längs), Schwein, HOPA Präparat zunächst in der Übersicht studieren: Zahnkrone, -hals, -wurzel. Aufsuchen von Wurzelkanal, Pulpahöhle, Schmelz(), Dentin, Dentinkanälchen, Zement, Wurzelhaut (=Desmodont, Periodontium), Alveolarknochen, Gingiva. Übersichtszeichnung und Markierung der o. g. Strukturen. Was ist der grundsätzliche Unterschied zu Präparat 99 Was versteht man unter dem Zahnhalteapparat (Parodontium) Welche Strukturen verlaufen in den Dentinkanälchen Welche Oberflächendifferenzierung besitzt die Mundschleimhaut im Bereich der Gingiva 97
100 Präparat 4: Ösophagus, Mensch, H.E. Studium des Präparats in der Übersicht: Hohlorgan mit sternförmigem Lumen. Aufsuchen von Tunica mucosa mit Lamina epithelialis, Lamina propria, Lamina muscularis mucosae, Tela submucosa, Gll. oesophageae, Tunica muscularis mit Ring-, Längsmuskulatur, Tunica adventitia/serosa, Anteile des enterischen Nervensystems. Präparat in der Übersicht und Schnitt durch alle Wandanteile zeichnen, o. g. Strukturen markieren.! Welche Art(en) von Muskulatur kann man im Ösophagus finden Finden sich lymphatische Zellen, ist das typisch Was sind die charakteristischen Baumerkmale des Rumpfdarms Welche Organe müssen bei einem Hohlorgan mit sternförmigem Lumen differentialdiagnostisch in Betracht gezogen werden 98
101 Kurstag 15 Verdauungstrakt II Themen Magen Dünndarm Dickdarm Lernziele Prüfungsrelevante Lerninhalte Verdauungstrakt: Für alle Abschnitte des Verdauungstraktes: Schichtenbau der Wand, Zellen und Aufbau der Schleimhaut, Anordnung der Muskulatur, lymphatische Anteile, enterisches Nervensystem, diffuses neuroendokrines System. Magen: Schleimhaut des Corpus und Pars pylorica, Foveolae gastricae, Oberflächenepithelzellen, Korpusdrüsen, Haupt-, Beleg- und Nebenzellen, Funktion und Regulation, Pylorusdrüsen. Duodenum: Wandbau, Schleimhaut, Falten, Zotten, Krypten, Enterozyten, Becherzellen, sekretorische Zellen, Duodenaldrüsen, enteroendokrine Zellen, Resorptionsmechanismen für Kohlenhydrate, Proteine, Lipide, Elektrolyte und Wasser, enterisches Nervensystem, Regeneration des Schleimhautepithels. Jejunum/Ileum/Colon s.o. Darmtonsille : Peyersche Plaques, Solitärfollikel der Darmwand, Appendix vermiformis, MALT, M-Zellen. Eigenstudium die allgemeine Makroskopische Anatomie zu den Verdauungsorganen wird vorausgesetzt. Lernziele der Vorlesung Histologie Die Studierenden sollen die Zellen und den Aufbau der Schleimhaut des Verdauungstraktes wiedergeben, die Anordnung der Muskulatur beschreiben, lymphatische Anteile, enterisches Nervensystem, diffuses neuroendokrines System erkennen und deren Funktion benennen können. die Schleimhaut des Corpus und der Pars pylorica gliedern, die Foveolae gastricae erkennen und die Zelltypen charakterisieren können, die Funktionsweise der Belegzellen erläutern können. Schleimhautschutzmechanismen benennen können. Resorptionsmechanismen für Kohlenhydrate, Proteine, Lipide, Elektrolyte und Wasser erläutern können. die Begriffe MALTund M-Zellen erklären können. Lernziele des Kurses Histologie Die Studierenden sollen die Präparate identifizieren und ihre Besonderheiten beschreiben können. in den Präparaten bereits erlernte Strukturen, wie Gefäße, Nerven, Epithelien identifizieren können. anhand des Oberflächenepithels und der Wandschichtung die Darmabschnitte voneinander und von anderen Hohlorganen unterscheiden können. Epithelzellen, Nebenzellen, Beleg- und Hauptzellen erkennen können. eine PAS-Färbung erkennen und das Prinzip dieser Färbung erklären können. im histologischen Präparat zwischen Krypten und Zotten differenzieren können. vegetative Ganglien in der Darmwand aufsuchen und deren Funktion erklären können. Klinische Aspekte (fakultativ) Gastritis, Ulcus ventriculi, Karzinom. 99
102 Präparat 58: Magen (Fundus), Mensch, PAS-Toluidin-Aurantia Orientieren Sie sich über den Wandaufbau: Identifizieren der im vorherigen Präparat erarbeiteten prinzipiellen Wandschichtung. Finden Sie einen Präparatebereich, in welchem die Glandulae gastricae im Längsschnitt zu sehen sind. Aufsuchen von Haupt-, Beleg-, und Nebenzellen. Zeichnen und beschriften Sie eine/mehrere Magendrüsen und die in der Lamina epithelialis vorkommenden Zelltypen. Welche Funktionen besitzen die einzelnen Zelltypen, was produzieren sie Wie verändert sich die Ultrastruktur von Belegzellen beim Übergang von ruhender zu aktiver HCl- Sekretion Wie wird die Schleimhaut vor Selbstverdauung geschützt Das Bakterium Helicobacter pylori profitiert von diesem Schutzmechanismus. Wissen Sie wie 100
103 Präparat 59: Präparat 61: Magen (Pars pylorica), Mensch, Azan oder HOPA Magen (Pars pylorica), Hund, anti-gastrin, Hämalaun [Demo-/Übungspräparat] Vergleichen Sie Präparat 58 und 59. Erarbeiten Sie Unterschiede im Aufbau der Schleimhaut, in der Anordnung der Drüsen und der relativen Häufigkeit einzelner Epithelzelltypen. Übersichtszeichnungen des Schleimhautreliefs der Präparate 58 und 59 gegenüberstellen. Welche Schleimhautverhältnisse würden Sie im Vergleich dazu in einem Präparat der Cardiaregion erwarten Was fällt in der Lamina propria auf Studieren Sie die Tunica muscularis in Präparat 59, wodurch könnte die große Muskelmasse zustande kommen Kann man in diesem Präparat eine Lamina muscularis mucosae erkennen Wo liegen die im Präparat 61 markierten Zellen Was synthetisieren diese Zellen, welche Funktionen hat diese Substanz Rekapitulieren Sie für sich die in Präparat 61 angewandte histologische Technik. 101
104 Präparat 62: Präparat 63: Duodenum, Mensch, H.E. Duodenum, Mensch, PAS-Hämalaun [Übungspräparat] Studium des Präparats 62 in der Übersicht: Orientieren Sie sich über die Schnittebene, Lumen-, Außenseite identifizieren. Schleimhautrelief untersuchen: Plicae circulares (Kerckring-Falten), Villi intestinales (Zotten), Krypten. Aufsuchen von Enterozyten, Bürstensaum, Becherzellen, Paneth-Zellen, entero-endokrinen Zellen, intraepithelialen Lymphozyten, Brunnerschen Drüsen, Plexus myentericus, - submucosus. Zeichnen Sie den Bau der Duodenalwand mit besonderer Berücksichtigung der Tunica mucosa. Zeichnen Sie Querschnitte von Krypten und Zotten. Wodurch unterscheiden sich Zotten und Krypten im Querschnitt Wodurch lassen sich Plicae und Villi intestinales eindeutig unterscheiden Was ist das morphologische Korrelat der sog. Zottenpumpe Durch welche Baumerkmale erfolgt im Dünndarm die Vergrößerung der resorbierenden Oberfläche Um welchen Faktor erfolgt jeweils die Oberflächenvergrößerung Was versteht man unter Gruenhagenschen (Spalt-)Räumen Wie kommen diese zustande Studieren Sie das Präparat 63. Welche Zellen sind hier besonders stark angefärbt und warum 102
105 Präparat 64: Präparat 26: BM 21: Ileum, Mensch, van Gieson Jejunum, Mensch, HOPA [Übungspräparat] Darmschleimhaut, Mensch, versch. Antikörper, Hämalaun, 600x [Übungspräparat] Studium des Präparates 64 in der Übersicht: Vergleich des Schleimhautreliefs mit vorherigem Präparat. Rekapitulieren Sie den Wandaufbau und unterschiedliche Zelltypen der Lamina epithelialis. Aufsuchen von proliferierenden, apoptotischen Epithelzellen, Paneth-Zellen, Peyerschen Plaques, Anteilen des enterischen Nervensystems. Exemplarische Zeichnung. Was produzieren Paneth-Zellen Was passiert, wenn sie fehlen Vergleichen Sie das Präparat 26 mit den Präparaten 62 und 64. Welche Unterschiede gibt es Studieren Sie das Präparat BM 21. Wie rasch und von wo aus regenerieren die Enterozyten 103
106 Präparat 65: BM 23: Colon, Mensch, H.E. Enteroendokrine Zellen, Mensch, Antikörper gegen Chromogranin, Hämalaun, 800x [Übungspräparat] Studium des Präparats in der Übersicht: Schleimhautrelief und Wandschichtung untersuchen. Aufsuchen von längs und quer geschnittenen Krypten, Enterozyten, Becherzellen. Übersichtszeichnung, Ausschnittszeichnung aus Schleimhautbereich, Kryptenmorphologie in unterschiedlichen Schnittebenen zeichnen.! Welche Besonderheiten gibt es im Aufbau der Tunica muscularis des Colons Welche Funktion hat der Schleim im Dickdarm Fassen Sie abschließend die differentialdiagnostischen Merkmale der einzelnen Darmabschnitte nochmals zusammen. Studieren Sie das Präparat BM 23. Findet man im Colon enteroendokrine Zellen Was produzieren diese 104
107 Präparat 66: Processus (Appendix) vermiformis, Mensch, H.E. oder HOPA Orientieren Sie sich über den Wandaufbau. Aufsuchen von Lymphfollikeln in der Lamina propria und Submucosa. Übersichts-, Detailzeichnung. Welcher Typ von Lymphfollikeln findet sich in der Appendix vermiformis Zu welchem Colonabschnitt gehört die Appendix vermiformis Welchen Zelltyp findet man gehäuft in der Tunica mucosa, warum 105
108 Kurstag 16 Verdauungstrakt III Themen Leber Gallenblase Große Mundspeicheldrüsen Pankreas Lernziele Prüfungsrelevante Lerninhalte Leber Leberzirkulation, Leberläppchen, Portalläppchen, Leberazinus, Glissonsche Trias, Mikrozirkulation, Lebersinusoide, Lebervenen, Dissescher Raum, Hepatozyten, Kupfferzellen, Fettspeicherzellen (Itozellen), Gallenkapillaren, Hering-Kanälchen, Feinbau und Funktion der Hepatozyten. Gallenwege und Gallenblase Organisation, histologischer Aufbau. Speicheldrüsen: Bau, Klassifikation, Form und Aufbau der unterschiedlichen Drüsenendstücke und der Ausführungsgänge, Drüsenparenchym, Stroma, Myoepithelzellen. Exokrines Pankreas: Azinuszellen, zentroazinäre Zellen, Sekretbildung, Sekretzusammensetzung, Sekretionsregulation, Ausführungsgangsystem. Klinische Aspekte (fakultativ) Fettleber, Zirrhose, Ikterus, Hepatitis. Lernziele der Vorlesung Histologie Die Studierenden sollen den Feinbau der Leber (Leberläppchen, Portalläppchen, Leberazinus, Glissonsche Trias, Lebersinusoide, Lebervenen, Dissescher Raum) beschreiben können, die Begriffe Leberzirkulation, Mikrozirkulation erläutern können, die Zelltypen der Leber (Hepatozyten, Kupfferzellen, Fettspeicherzellen (Itozellen)) unterscheiden können, den Feinbau und die Funktion der Hepatozyten erklären können. Gallenkapillaren und Hering-Kanälchen identifizieren können. Systematik, Baumerkmale und Differentialdiagnose der großen Speicheldrüsen erläutern können. den histologischen Aufbau der Pankreaszellen und der Ausführungsgänge beschreiben können. die Funktion des exokrinen Pankreas bei der Verdauung erläutern können. Lernziele des Kurses Histologie Die Studierenden sollen die Präparate identifizieren und ihre Besonderheiten beschreiben können. im EM-Bild die Ultrastruktur des Lebergewebes erklären können. Struktur- Funktionsbeziehungen herstellen und erläutern können. die Abschnitte des Ausführungsgangsystems der Speicheldrüsen gliedern, identifizieren und benennen können. die Funktion der Streifenstücke erklären können. in der Glandula parotidea Nerven- und Gefäßanschnitte erkennen können. die großen Speicheldrüsen mikroskopisch erkennen und differentialdiagnostisch abgrenzen können. das Ausführungsgangsystem des Pankreas in Abschnitte gliedern, diese identifizieren und benennen können. 106
109 Leber Präparat 67: Präparat 68: BM 9: Leber, Schwein, HOPA Leber, Mensch H.E. Leberzelle, Maus, TEM x [Übungspräparat] Vergleich beider Präparate (67, 68) in der Übersicht: Läppchengliederung, Portalfelder, Zentralvenen identifizieren. Welche prinzipiellen Unterschiede bestehen zwischen beiden Präparaten Aufsuchen von Glisson Trias, intrahepatischen Gallenwegen, Blutgefäßen des hepatischen und portalen Kreislaufs, Leberzellbälkchen, Sinusoiden, Endothelzellen, Kupffer-Zellen. Zeichnen Sie eine Struktur-/Funktionseinheit und markieren Sie die o. g. Strukturen. Zu welchem Endothelzelltyp gehören Sinusendothelzellen Wo befindet sich der Disse-Raum, wie wird er begrenzt Wo beginnen die Gallenwege Gibt es noch eine 4. Struktur in der Glissonschen Trias Besitzen Hepatozyten eine Basalmembran Wo findet man Retikulinfasern in der Leber Welche biologischen Funktionen von oval cells werden diskutiert und wo findet man oval cells Wie ist das Zytoskelett in der Umgebung von Gallekapillaren aufgebaut Könnte das perikapilläre Zytoskelett eine Rolle bei krankhaften Prozessen spielen Studieren Sie das Präparat BM 9: Welche Ultrastruktur-Funktionsbeziehungen lassen sich erkennen 107
110 Leber Präparat 89: Präparat 69: Präparat 70: Leber, Mensch, Semidünnschnitt (Toluidinblau) Leber (Sinusoide), Ratte, Tuscheinjektion [Übungspräparat] Leber (Makrophagen), Ratte, Tuscheinjektion, H.E. [Übungspräparat] Aufsuchen von: Portalfeldern, Glisson Trias, Canaliculi und Ductuli biliferi, Leberzellbälkchen, Disse- Raum, Sinusoiden, Endothelzellen, Ito-Zellen, Kupffer-Zellen, Grenzlamelle fakultativ Welches ist die genaue Lage und die Funktion der Kupffer-Zellen Woher stammen Kupffer Zellen Was sind Ito-Zellen und wo liegen sie Wer bildet die Galleflüssigkeit Wie erscheint in diesem Präparat der initiale Abschnitt der intrahepatischen Gallenwege Welche Bedeutung hat die Galle für die Verdauung Welcher Zusammenhang besteht zwischen Ito-Zellen und Leberfibrose Suchen Sie im Präparat 69 einen Läppchenquerschnitt mit versorgenden Portalvenenästen, Sinusoiden und drainierender Zentralvene. Finden Sie im Präparat 70 die mit Tusche markierten Kupffer-Zellen. Bei beiden Präparaten wurde intravital Tusche injiziert. Wodurch kommt die unterschiedliche Darstellung in der Leber zustande 108
111 Gallenblase Präparat 71: Gallenblase, Mensch, H.E. Aufsuchen der verschiedenen Wandschichten, der typischen Schleimhautbrücken (Rokitansky-Aschoff- Sinus) des Gallenblasenepithels. Zeichnen Sie den Wandaufbau und Oberflächenepithel der Gallenblase. Welche für den Verdauungstrakt (Rumpfdarm) charakteristische Schicht der Tunica mucosa fehlt Um welchen Typ von Epithel handelt es sich Oberflächendifferenzierung Welches Hormon steuert die Entleerung der Gallenblase! Funktion(en) der Gallenblase Mit welchen Präparaten könnte die Gallenblase histologisch verwechselt werden Informieren Sie sich auch über die Gliederung der extrahepatischen Gallengänge. 109
112 Große Mundspeicheldrüsen Präparat 87: Präparat 44: Präparat 43: Glandula sublingualis, Mensch, HOPA Glandula parotidea, Mensch, Azan Glandula submandibularis, Mensch, Azan [Übungspräparat] Vergleichendes Studium der Präparate 87 und 44: Färbung, Textur, Gliederung, natürliche/künstliche Gewebegrenzen, typische Baumerkmale, relativer Anteil einzelner Baumerkmale. Organspezifische, differentialdiagnostisch wichtige Baumerkmale bestimmen und exemplarisch zeichnen.! Gegen welche anderen Organe/Gewebe müssen die großen Speicheldrüsen abgegrenzt werden und anhand welcher DD-Kriterien erfolgt dies In welcher Drüse findet man typischerweise gehäuft Anschnitte peripherer Nerven Um Anschnitte welches Nerven handelt es sich dabei Unter welchen Fixierungsbedingungen lassen sich gewöhnlich keine von Ebner Halbmonde beobachten Warum Studieren Sie das Präparat 43. Welche Baumerkmale weist diese Drüse auf und wie würden Sie diese Drüse bezogen auf die Beschaffenheit des Sekrets klassifizieren 110
113 Pankreas Präparat 45: BM 1: Pankreas, Mensch, H.E. Exokrine Pankreaszelle, Fledermaus, TEM x [Übungspräparat] Studium des Präparats 45 in der Übersicht: Läppchenförmige Gliederung, homogene Färbung beachten. Unterscheiden zwischen exokrinem und endokrinem Anteil. Aufsuchen von Organkapsel, Bindegewebssepten, inter-, intralobulären Ausführungsgängen, Gangdrüsen, Schaltstücken, Azini, zentroazinären Zellen, Langerhansschen Inseln. Übersichtszeichnung. Detailzeichnungen aus exokrinem Organanteil. Welche Epitheltypen kommen in den Azini und im Gangsystem vor Azinuszellen zeigen typischerweise eine inhomogene Anfärbung des Zytoplasmas. Worauf beruht diese Gegen welche Präparate muss das Pankreas differenzialdiagnostisch abgegrenzt werden; anhand welcher Kriterien Was ist der embryonale Ursprung von Zellen des exokrinen Pankreas Merke: 90% aller Pankreaskarzinome gehen vom Gangepithel aus. Welche Symptomatik ist typisch für eine Pankreatitis Ursachen für diese Erkrankung Studieren Sie das Präparat BM 1. Welche Strukturen finden sich im Zytoplasma der Zellen 111
114 Kurstag 17 Themen Endokrine Organe Pankreas Schilddrüse Nebenniere Hypophyse Lernziele Prüfungsrelevante Lerninhalte Allgemeine Prinzipien: Struktur- Funktionsbeziehungen, Hormone: Regulation der Hormonsynthese und Ausschüttung, Aufgaben und Wirkmechanismen. Hypophyse: Entwicklung, Gliederung, Zuordnung der Zelltypen zu den Hormonen. Glandula thyroidea: Entwicklung, Follikel, Regulation der Schilddrüsenfunktion, Wirkung der Hormone, C-Zellen. Glandula parathyroidea: Entwicklung, Zelltypen, Wirkung der Hormone. Nebenniere: Entwicklung, Aufbau, Zelltypen, Funktion, Steroidhormon-Synthese. Pankreas: Aufbau, Langerhans-Inseln, Zellen der Inseln, Funktion, Wirkung. Disseminierte endokrine Zellen: Lage, Produktion und Sekretion dieser Zellen. Klinische Aspekte (fakultativ) Hypophysenadenome, Hyper/Hypothyreose, Morbus Basedow, Iodmangelstruma, Cushing- Syndrom, Diabetes mellitus. Lernziele der Vorlesung Histologie Die Studierenden sollen die Steuerung des endokrinen Systems erläutern können. Hormone nach Produktion- Sekretionsform, Zusammensetzung und Wirkmechanismus klassifizieren können. alle Hormone der Hypophyse samt ihres Produktionsortes benennen können. Entwicklung, Organeinteilung, Hormonregulation und -bildung der Hypophyse beschreiben können. den Aufbau der Schilddrüsenfollikel und die Hormonsynthese, - speicherung und -freisetzung beschreiben können. die Gliederung der Nebenniere mit den zugehörigen Hormonen und die Besonderheiten der Gefäßversorgung erläutern können. den verschiedenen Zelltypen des Inselorgans die entsprechenden Hormone zuordnen können. Lernziele des Kurses Histologie Die Studierenden sollen die Präparate identifizieren und ihre Gewebe und Besonderheiten beschreiben können. Struktur-Funktions-Beziehungen endokriner Organe kennen und erläutern können. die Gliederung der Hypophyse beschreiben und am Mikroskop einstellen können. den Aufbau der Schilddrüsenfollikel beschreiben und erkennen können. C-Zellen identifizieren können. die Nebenniere in Nebennierenmark und - rinde differenzieren können. die verschiedenen Zelltypen der Nebenniere zeigen und ihre Funktion beschreiben können. im Pankreas Inselorgane einstellen können. Den zellulären Aufbau Langerhansscher Inseln kennen und erläutern können. 112
115 Pankreas Präparat 97: Präparat 45: Pankreas, Hund, anti-glukagon, Hämalaun Pankreas, Mensch, H.E. [Übungspräparat] Mikroskopieren Sie das Präparat 97. Beachten Sie: Lage der Inselorgane, prozentuale Verteilung der gefärbten Zellen im Inselorgan, Morphologie der Langerhans schen Inseln im Vergleich zum exokrinen Pankreasparenchym. Vervollständigen Sie die Zeichnung zum Teil Pankreas des vorherigen Kurstages mit dem aktuell Gesehenen.! Lage und Funktion der Inselzellen (vergleichen Sie Präparat 97) Rekapitulieren Sie den relativen Anteil einzelner Zelltypen in den Langerhans Inseln. Wie wurden die sichtbar gemachten Zellen gefärbt Was ist der embryonale Ursprung von Zellen des endokrinen Pankreas Studieren Sie das Präparat 45. Welche Unterschiede weist dieses im Vergleich zum Präparat 97 auf 113
116 Schilddrüse Präparat 92: Präparat 1: Schilddrüse, Hund, HOPA Schilddrüse, Schwein, H.E. [Übungspräparat] Studium des Präparates 92 in der Übersicht: Organkapsel, Bindegewebssepten, läppchenförmige Gliederung des Parenchyms. Aufsuchen von Follikeln, Follikelepithel, Kolloid, interstitielles BG, parafollikuläre C-Zellen. Übersichtszeichnung anfertigen. Im Detail Follikel mit Inhalt und umgebendem Bindegewebe, Epithelzellen und C-Zellen zeichnen. Beachten Sie die unterschiedliche Höhe des Follikelepithels. Was ist das funktionelle Korrelat Was produzieren bzw. sezernieren Schilddrüsenepithelzellen Was enthält das Schilddrüsenkolloid Was enthalten parafollikuläre C-Zellen Mit welchem Gewebe bringen Sie diese Substanz in Verbindung Wie könnte man C-Zellen selektiv nachweisen! Mit welchen anderen Organen könnte die Schilddrüse verwechselt werden Was versteht man unter einer Hypo-/Hyperthyreose Ursachen Welche Symptomatik weisen die Patienten beim jeweiligen Krankheitsbild auf Rekapitulieren Sie bitte den Aufbau der Schilddrüse anhand des Präparates 1. Können Sie hier auch die C-Zellen erkennen 114
117 Nebenniere Präparat 93: Nebenniere, Mensch, HOPA Mikroskopieren Sie von der Bindegewebskapsel nach innen. Achten Sie in der Rinde auf die drei Schichtenzonen: Zona glomerulosa, fasciculata, reticularis und auf die unterschiedliche Färbbarkeit der Zellen. Das Mark (Medulla) besteht aus großen epithelartigen Zellen. Zeichnen Sie die unterschiedlichen Zellarten und berücksichtigen Sie das Bindegewebe und die Gefäße.! Welche Besonderheiten zeigen die Blutgefäße im Mark Was bilden Zona glomerulosa, Zona fasciculata und Zona reticularis Woher stammen die chromaffinen Zellen des Nebennierenmarks Wie könnte man das Mark funktionell charakterisieren Was versteht man unter dem Morbus Cushing Welche Symptomatik weisen die Patienten auf 115
118 Hypophyse Präparat 94: Präparat 95: Präparat 96: Hypophyse, Mensch, Azan Hypophyse anti-acth, Ratte, Hämalaun (corticotrope Zellen) [Übungspräparat] Hypophyse, anti-prolactin, Ratte, Hämalaun (mammotrope Zellen) [Übungspräparat] Präparat 94 in der Übersicht studieren: Gliederung in Adenohypophyse (mit Pars distalis bzw. Vorderlappen, Pars intermedia mit Kolloidzysten und Pars tuberalis) und Neurohypophyse (mit Pars nervosa und gegebenenfalls mit Pars infundibularis) beachten. Aufsuchen von chromophoben, azidophilen (eosinophilen) und basophilen Zellen im Vorderlappen; von Pituizyten, Herring Körpern im Hinterlappen. Zeichnen Sie Ausschnitte aus verschiedenen Anteilen der Drüse und achten Sie auf die unterschiedliche Anfärbbarkeit der Zellen. Ordnen Sie den unterschiedlich angefärbten Zellpopulationen der Adenohypophyse ihre spezifischen Hormonsyntheseprodukte zu. Was versteht man unter dem Pfortadersystem der Hypophyse Was versteht man unter Herring-Körpern und Pituizyten der Neurohypophyse! Wenn man in der Neurohypophyse Zellkerne findet, zu welchem Zelltyp können sie nicht gehören Woher stammen entwicklungsgeschichtlich die unterschiedlichen Anteile der Hypophyse Fassen Sie Bildungsort, Funktion und Regulation von Prolaktin zusammen. Kommt Prolaktin bei Frauen und Männern vor Gibt es tagesabhängige Unterschiede der Plasmakonzentration Wie wird die ACTH-Sekretion reguliert Wie entsteht ACTH und welches sind die Zielorgane Studieren Sie zum Vergleich die Präparate 95 und 96. Wie wurden diese Zellen angefärbt 116
119 Kurstag 18 Niere und ableitende Harnwege Themen Niere Ureter Harnblase Lernziele Prüfungsrelevante Lerninhalte Niere/ableitende Harnwege Rinde, Mark, Zonengliederung, Nephron, Glomerulum, Zelltypen, Filtrationsbarrieren bzw. Blut-Harn-Schranke, Tubulus- und Sammelrohrsystem, Abschnitte, zelluläre Zusammensetzung und abschnittstypische Transportmechanismen, juxtaglomerulärer Apparat und seine Funktion, Interstitium, endokrine Nierenfunktion (Renin, Erythropoetin, Calcitriol), intrarenale Gefäßarchitektur, Harnbildung und - konzentrierung, Feinbau der Glomeruli und Kanälchen. Ureter/Harnblase: Schichtenbau der Wand, Urothel. Urethra: Abschnitte, Verlauf bei Mann und Frau, Epithelien. Eigenstudium Makroskopische Gliederung der Niere wird vorausgesetzt. Entwicklung der Harnorgane. Klinische Aspekte (fakultativ) Lernziele der Vorlesung Histologie Die Studierenden sollen die Niere in Mark und Rinde sowie in funktionelle Zonen gliedern können. den Bau des Nephrons und seiner Bestandteile (Corpusculum renale mit Glomerulus und Capsula glomerularis, Tubulus renalis mit proximalem, intermediärem und distalem Tubulus) beschreiben können. die Filtrationsbarrieren bzw. die Anteile der Blut-Harn-Schranke benennen können. den Begriff des juxtaglomerulären Apparates erklären können. das Prinzip der Harnbildung beschreiben können. den Wandbau von Ureter und Harnblase erläutern können. die Abschnitte der Urethra, die Epithelien und den Verlauf bei Mann und Frau erklären können. Lernziele des Kurses Histologie Die Studierenden sollen die Präparate identifizieren und ihre Charakteristika beschreiben können. die Bestandteile des Nephrons topographisch den Nierenregionen zuordnen können. den Feinbau der Niere anhand von EM- Aufnahmen erläutern können. anhand von EM-Aufnahmen die Anteile der Blut-Harn-Schranke aufzeigen und erklären können. Proteinurie, Hämaturie, renale Anämie, Glomerulonephritis, renale Glukosurie, Diuretikawirkung. 117
120 Niere Präparat 72: Niere, Ratte, HOPA Präparat 73: Niere, Schwein, H.E. BM 7: Corpusculum renale, Maus, TEM x BM 10: Glomerulum, Ratte, REM 5.000x BM11: Proximaler Tubulus contortus, Maus, TEM x Präparate 72 und 73 zunächst in der Übersicht studieren: Beachten Sie: Nieren von Nagern (Ratte und Maus) sind unipapillär, d.h. man findet je nach Schnittführung nur eine Markpyramide, von einer Rindenzone umgeben! Aufsuchen und prinzipielle Organarchitektur studieren: Capsula fibrosa, Nierenrinde, -mark mit unterschiedl. Markzonen, Rindenlabyrinth, Markstrahlen, Columnae renales (Bertinische Säulen), Markpyramiden, Markpapillen, Sinus renalis, Nierenbecken (-anteile), Vasa renalia. Corpuscula renalia in unterschiedlichen Anschnitten aufsuchen: Gefäß-, Harnpol, Bowmansche Kapsel, Vas afferens, - efferens, Glomerulus, Glomeruluskapillaren, Podozyten, Endothelzellen, glomeruläres, extraglomeruläres Mesangium, Macula densa, Juxtaglomerulärer Apparat (JGA). BM 7 und 10 zum Vergleich studieren. Systematisch einzelne Abschnitte des Tubulusapparats aufsuchen: Proximaler, distaler, intermediärer Tubulus, Verbindungstubulus, Sammelrohre, Ductus papillares. Einzelne Tubulusabschnitte auf korrespondierende Organzonen beziehen. BM 11 zum Vergleich studieren. Nephron-Architektur auf Gefäßarchitektur beziehen. Von den großen zu den kleinen Strukturen! Übersichten anfertigen, wichtige Baumerkmale zeichnen. Auch TEM zeichnerisch festhalten. Wodurch kommt die basale Streifung einzelner Tubulusabschnitte zustande! Was ist das ultrastrukturelle, was das funktionelle Korrelat Wie kann man Anschnitte der Henleschen Schleife von Markkapillaren morphologisch unterscheiden Warum sind manche Tubulusepithelien luminal (d.h. apikal) unscharf begrenzt Zwischen welchen Blättern bzw. Anteilen der Capsula glomeruli wird der Primärharn aufgefangen Was ist das ultrastrukturelle, was das biophysikalische Korrelat des glomerulären Ultrafilters Was könnten die pathophysiologischen Konsequenzen aktivierter Mesangiumzellen sein Erinnern Sie sich an ein ähnliches Phänomen, das Ihnen im Kurs bereits begegnet ist Wo wird Renin gebildet Gibt es Beziehungen zwischen Nierenfunktion und Knochenstoffwechsel 118
121 Präparat 74: Niere, Ratte, Trypanblauinjektion/Kernechtrot [Übungspräparat] Trypanblau wurde intravital in die Blutbahn injiziert. Wodurch kommt die Blaufärbung in diesem Nierenpräparat zustande Welche Eigenschaften muss dann dieser Farbstoff besitzen, welche darf er nicht besitzen Welche aktiven Transportprozesse im Nierentubulussystem kennen Sie Was kann passieren, wenn die Kapazität von renalen Transportern überschritten wird Worin könnte die Ursache begründet sein, wenn Patienten mit Diabetes mellitus viel Urin ausscheiden Präparat 74 in der Übersicht studieren: In welchen Organzonen und in welchen Abschnitten des Nephrons ist der blaue Farbstoff nachweisbar, in welchen nicht 119
122 Ureter Präparat 75: Ureter, Mensch, H.E. Präparat zunächst in der Übersicht studieren, die verschiedenen Wandschichten erkennen: Sternförmiges Lumen, Tunica mucosa, Tunica muscularis, Tunica adventitia beachten. Baumerkmale des Übergangsepithels (Kurstag 2) rekapitulieren. Übersicht mit typischem Wandaufbau und Anordnung der Muskelschichten zeichnen und beschriften. Wo kommt Übergangsepithel vor Welche anderen Organe mit sternförmigem Lumen müssen differentialdiagnostisch gegen den Ureter abgegrenzt werden und anhand welcher Kriterien 120
123 Harnblase Präparat 76: Harnblase, Hund, H.E. Präparat in der Übersicht studieren. Äußere Organoberfläche beachten, gibt es regionale Unterschiede Tunica epithelialis, Lamina propria, Tunica muscularis, -adventitia und Anteile des autonomen Nervensystems aufsuchen. Schnitt durch alle Wandanteile zeichnen, beschriften. Wie ist die Tunica muscularis aufgebaut Gibt es regionale Unterschiede 121
124 Kurstag 19 Männliche Geschlechtsorgane Themen Testis Nebenhoden Ductus deferens Prostata Lernziele Prüfungsrelevante Lerninhalte Männliche Geschlechtsorgane Hoden: Tubuli seminiferi, Keimepithel: Sertolizellen, Blut-Hoden-Schranke, Spermatogenese, Spermatogonien, Spermatozyten I und II, Spermatiden, Spermiohistogenese, Spermien, Spermatozoen: Kopf, Akrosom, Geißel. Kinetik des Keimepithels, Regulation der Spermatogenese, Interstitium, Leydig-Zellen, Testosteronsynthese. Nebenhoden: Ductuli efferentes, Ductus epididymidis, Ausreifung und Speicherung der Spermatozoen. Ductus deferens: Wandbau, Epithel, Transportfunktion. Prostata: Aufbau und Funktion: Zonengliederung, Drüsen, Stroma, Sekretbildung, PSA. Eigenstudium Makroskopische Anatomie und Entwicklung der Gonaden/Samenwege sowie Mitose/Meiose. Mikroskopische Anatomie von Vesicula seminalis und Penis. Klinische Aspekte (fakultativ) Lernziele der Vorlesung Histologie Die Studierenden sollen Grundzüge der Entwicklung des männlichen Genitale kennen und erläutern können. den allgemeinen Aufbau des Hodens und dessen hormonelle Steuerung verstehen und erklären können. die Spermatogenese untergliedern und diese histologisch zuordnen können. die Samenwege mit den Organen (z.b. Nebenhoden, Samenleiter) und Geschlechtsdrüsen (z.b. Prostata, Samenblase) beschreiben und histologisch funktionell erläutern können. Gemeinsamkeiten und spezifische Unterschiede in der Entwicklung männlicher und weiblicher Geschlechtsorgane kennen und erläutern können. Lernziele des Kurses Histologie Die Studierenden sollen die Präparate identifizieren und ihre Besonderheiten erläutern können. die Zelltypen im Keimepithel bzw. Leydig- Zellen einstellen und erläutern können. anhand des Aufbaus und Oberflächenepithels die Abschnitte der Samenwege identifizieren und benennen können. Fertilität, Infertilität, Sterilisation, Prostatahyperplasie, - karzinom. 122
125 Testis Präparat 77: Präparat 78: Testis, Schwein, HOPA Testis, Mensch, HOPA Mikroskopieren Sie beide Präparate zunächst in der Übersicht: Identifizieren Sie die Tunica albuginea und das Hodenparenchym. Aufsuchen von Septula testis, interstitiellem Bindegewebe, Tubuli seminiferi contorti et recti mit Tunica propria, spermatopoetischem Epithel mit Spermatogonien, Spermatozyten I/II, Spermatiden, Spermien, Sertoli-Zellen, Mikroskopieren Sie zum Vergleich das Präparat 78. Aufsuchen von Leydig-Zellen. Übersichtszeichnung. Detailzeichnungen verschiedener Tubuli mit unterschiedlichen Stadien der Spermatogenese, Markieren der o.g. Strukturen.! Wo liegen die Spermatogonien Wo befinden sich die Leydig-Zellen Was produzieren sie Was versteht man unter Reinke-Kristallen Welche zytologischen Merkmale erwarten Sie bei Leydig-Zellen Was sind Sertoli-Zellen Welche Funktionen besitzen sie Wie sind Sertoli-Zellen untereinander verbunden Was versteht man unter der Blut-Testis-Schranke 123
126 Nebenhoden Präparat 3: Corpus und Cauda epididymidis, Schaf, HOPA Studium des Präparats zunächst in der Übersicht. Fahnden Sie nach unterschiedlichen Anteilen des Nebenhodengangsystems: Ductuli efferentes, Ductus epididymidis, Lamina propria, glatte Muskelzellen, Myofibroblasten, Epithel mit Haupt- und Basalzellen. Beachten Sie: die meisten Kurspräparate enthalten kein Caput epididymidis. Anschnitte von Ductuli efferentes sind daher sehr selten oder können im Präparat fehlen. Übersichts- und Detailzeichnungen mit Wiedergabe typischer Epithelformen und Oberflächendifferenzierungen. Wie unterscheidet sich das Epithel von Ductuli efferentes und Ductus epididymidis Was versteht man unter Säurestarre Mit welchen anderen Organen könnte der Nebenhoden differentialdiagnostisch verwechselt werden 124
127 Ductus deferens Präparat 79: Ductus deferens, Mensch, H.E. Studium des Präparats zunächst in der Übersicht: Quergeschnittenes Hohlorgan mit sternförmigem Lumen. Vom Lumen nach außen mikroskopieren: Aufsuchen des Oberflächenepithels, Lamina propria, dreischichtige Tunica muscularis, Tunica adventitia mit Gefäß- und Nervenanschnitten. Übersichtszeichnung mit Markierung der einzelnen Wandschichten. Detaildarstellung des Oberflächenepithels.! Der Ductus deferens ist die unmittelbare Fortsetzung des Ductus epididymidis. Wie unterscheiden sich beide Strukturen im Wandaufbau und Oberflächenepithel Überlegen Sie die differentialdiagnostische Abgrenzung gegenüber Tuba uterina, Ureter und Ductus choledochus. Was ist das Korrelat der stark ausgebildeten Tunica muscularis des Ductus deferens bei der Untersuchung am Lebenden Wenn sich in der Umgebung des Ductus deferens quergestreifte Muskulatur findet, zu welchem Muskel könnte diese gehören 125
128 Prostata Präparat 80: Prostata, Mensch, H.E. Studium des Präparats in der Übersicht: Aufsuchen von tubuloalveolären Drüsenschläuchen mit ausgeprägter Faltenbildung, Prostata-Steine, interstitielles Gewebe mit reichlich glatter Muskulatur (= Stroma myoelasticum). Bei höherer Vergrößerung Oberflächenepithel untersuchen. Übersichts-, Detailzeichnungen mit Markierung der o.g. Strukturen.! Ist das Prostataepithel einheitlich gebaut Verändert sich das Epithel funktionsabhängig Welche Funktionen besitzen Stromazellen Mit welchem anderen Organ könnte die Prostata mikroskopisch verwechselt werden 126
129 Kurstag 20 Weibliche Geschlechtsorgane Themen Ovar Tuba uterina Uterus Vagina Plazenta Lernziele Prüfungsrelevante Lerninhalte Weibliche Geschlechtsorgane Ovar: Mark und Rinde, Follikel und Follikulogenese, Granulosazellschicht, Theca folliculi, Follikelatresie, Thekaorgan, Ovulation, Corpus luteum graviditatis et menstruationis, Corpus albicans, Hormonbildung, neuroendokrine Regulation. Tuba uterina: Wandbau, Schleimhaut, zyklische Veränderungen, Flimmerzellen, Drüsenzellen. Vagina: Wandbau, zyklische und altersbedingte Veränderungen. Uterus: Wandbau (Endo-, Myo- Perimetrium); Schleimhaut von Fundus-, Corpus- und Cervixbereich, Stratum functionale, basale, Spiralarterien, Schleimhautzyklus (Menstruationszyklus), hormonelle Regulation, Zervix-Portio-Übergang, zyklische und altersbedingte Veränderungen. Plazenta: Entwicklung und Funktion, plazentare Hormone Aufteilung in fetale und maternale Seite: Chorionplatte mit Amnion-, Chorionepithel, Plazentarzotten mit Synzytiotrophoblast und Zytotrophoblast, Haftzotten, Intervillöser Raum, Deziduazellen, Basalplatte, Plazentarsepten Plazentaschranke. Eigenstudium Makroskopie und Entwicklung des Uterus werden vorausgesetzt, Konzeption, Nidation, Implantation, Nabelschnur. Klinische Aspekte (fakultativ) Lernziele der Vorlesung Histologie Die Studierenden sollen Aufbau und Funktion des Ovars, der Tuba uterina, des Uterus, der Vagina und der Plazenta beschreiben und erläutern können. die Entwicklungsphasen der Organe wiedergeben können. Funktion, Synthese und Regulation ovarialer Hormone erläutern können. zyklusabhängige morphologische Veränderungen des weiblichen Genitale beschreiben können. den Menstruationszyklus in drei Phasen einteilen und die histologischen Unterschiede erkennen können. morphologische und funktionelle Unterschiede zwischen maternaler und fetaler Seite der Plazenta benennen können.. Lernziele des Kurses Histologie Die Studierenden sollen die Präparate identifizieren und ihre Besonderheiten beschreiben können. das Ovar (in Mark und Rinde) gliedern können. die Stadien der Follikulogenese identifizieren können. die Bestandteile eines Follikels identifizieren und benennen können. die Morphologie der Follikel den Meiosestadien zuordnen können. die Morphologie des weiblichen Genitale den jeweiligen Zyklusabschnitten und ihrer hormonellen Regulation zuordnen können. die Differentialdiagnose der Tuba uterina stellen und begründen können. die zyklusabhängigen und morphologischen Veränderungen von Endometrium und Uterus kennen und erläutern können. zwischen fetalen und maternalen Anteilen der Plazenta unterscheiden können. zwischen Plazenta der 1. und 2. Schwangerschaftshälfte morphologisch unterscheiden können. den plazentaren Blutkreislauf erläutern können. den Aufbau der Plazentaschranke beschreiben können. Ovulation, Ovarialtumoren Tubargravidität, Sterilisation, Karthagener-Syndrom Vaginalabstrich, Zervixkarzinom, Rhesusinkompatibilität. 127
130 Ovar Präparat 81: Präparat 82: Ovar, Katze, Azan Corpus luteum graviditatis, Mensch, Azan [Übungspräparat] Corpus luteum menstruationis, Mensch, H.E. [Übungspräparat] Studium des Präparats zunächst in der Übersicht: Oberflächenepithel, Rinde mit Oberflächenepithel, Tunica albuginea, Stroma ovarii, Follikel unterschiedlicher Entwicklungsstadien, Mark mit lockerem Bindegewebe und Blutgefäßen. Aufsuchen von Primordialfollikeln, Primärfollikeln, Sekundärfollikeln, Tertiärfollikeln, Corpus luteum, atretischen Follikeln, interfollikulären Thekazellarealen (= interstitielle Drüse ). Bei höherer Vergrößerung: Aufsuchen von Oozyten, Follikelepithel, Zona pellucida, Corona radiata, Glashaut, Theka folliculi. Übersichts-, Detailzeichnungen mit Darstellung einzelner Follikelstadien und Markierung der genannten Strukturen. Welche Hormone sind bei der Follikelreifung beteiligt Was versteht man unter spinozellulärem Bindegewebe In welchen Entwicklungsstadien kann ein Follikel atretisch werden Gibt es im Ovar Zellen, die Ähnlichkeiten mit Leydig-Zellen aufweisen Wo liegen sie Auf welchem Funktionsprinzip basiert die Wirkung eines Kontrazeptivums, welches Östrogene in gleichbleibender Dosierung enthält Studieren Sie beide Präparatevarianten. Aufsuchen von Corpora lutea, Stroma ovarii, Theca-, Granulosaluteinzellen. Woran lassen sich Granulosaluteinzellen morphologisch erkennen Was produzieren sie Welche Hormonrezeptoren exprimieren sie Wie lange persistiert das Corpus luteum menstruationis Warum bildet es sich zurück 128
Werkzeuge und histologische Techniken
 4. Kursprogramm Kurstag 1 Werkzeuge und histologische Techniken Lernziele Prüfungsrelevante Lehrinhalte Mikroskopaufbau- und Funktionsweise. Optische Systeme. Artefakte im Präparat erkennen und deuten.
4. Kursprogramm Kurstag 1 Werkzeuge und histologische Techniken Lernziele Prüfungsrelevante Lehrinhalte Mikroskopaufbau- und Funktionsweise. Optische Systeme. Artefakte im Präparat erkennen und deuten.
Binde- und Fettgewebe
 Kurstag 4 Binde- und Fettgewebe Lernziele Prüfungsrelevante Lerninhalte Prinzipieller Aufbau, Klassifikation (Mesenchym, lockeres, retikuläres, retikulärfaseriges, straffes geflechtartiges, straffes parallelfaseriges
Kurstag 4 Binde- und Fettgewebe Lernziele Prüfungsrelevante Lerninhalte Prinzipieller Aufbau, Klassifikation (Mesenchym, lockeres, retikuläres, retikulärfaseriges, straffes geflechtartiges, straffes parallelfaseriges
Anatomisches Institut der Rheinischen Friedrich-Wilhelms- Universität Bonn
 1 Anatomisches Institut der Rheinischen Friedrich-Wilhelms- Universität Bonn Mikroskopisch-Anatomische Kurse Verzeichnis der Präparate und EM-Bilder Sommersemester 2017 Oberflächenepithelien 1 Prismatisches
1 Anatomisches Institut der Rheinischen Friedrich-Wilhelms- Universität Bonn Mikroskopisch-Anatomische Kurse Verzeichnis der Präparate und EM-Bilder Sommersemester 2017 Oberflächenepithelien 1 Prismatisches
Einfaches Plattenepithel 1. Peritoneum Versilberung Häutchenpräparat Mehrschichtiges Plattenepithel ohne 98. Cornea HE
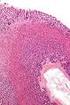 1 Präparate Histologie, Färbungen Routine AZAN Bindegewebesfärbung allgemein Zellgrenzen Versilberung retikuläre Fasern (Typ III-Kollagen) Neurofibrillen in Nervengewebe RF elastische Fasern EH (nur im
1 Präparate Histologie, Färbungen Routine AZAN Bindegewebesfärbung allgemein Zellgrenzen Versilberung retikuläre Fasern (Typ III-Kollagen) Neurofibrillen in Nervengewebe RF elastische Fasern EH (nur im
Kreislauforgane und Blut
 Kurstag 11 Kreislauforgane und Blut Themen Blutgefäße Lymphgefäße Peripheres Blut Lernziele Prüfungsrelevante Lerninhalte Blut und Gefäße: Arterien, Wandaufbau: elastischer und muskulärer Typ und deren
Kurstag 11 Kreislauforgane und Blut Themen Blutgefäße Lymphgefäße Peripheres Blut Lernziele Prüfungsrelevante Lerninhalte Blut und Gefäße: Arterien, Wandaufbau: elastischer und muskulärer Typ und deren
Leber Gallenblase Große Mundspeicheldrüsen Pankreas. Vorlesung Histologie. Die Studierenden sollen
 Kurstag 16 Verdauungstrakt III Themen Leber Gallenblase Große Mundspeicheldrüsen Pankreas Lernziele Prüfungsrelevante Lerninhalte Leber Leberzirkulation, Leberläppchen, Portalläppchen, Leberazinus, Glissonsche
Kurstag 16 Verdauungstrakt III Themen Leber Gallenblase Große Mundspeicheldrüsen Pankreas Lernziele Prüfungsrelevante Lerninhalte Leber Leberzirkulation, Leberläppchen, Portalläppchen, Leberazinus, Glissonsche
Kurs der Zytologie und allgemeinen Histologie WS 2016/2017. Institut für Anatomie und Zellbiologie
 Kurs der Zytologie und allgemeinen Histologie WS 2016/2017 Institut für Anatomie und Zellbiologie 1. Semester Humanmedizin und 1. Semester Zahnmedizin Leiterin: OÄ Dr. med. B. Miehe Ansprechpartner in
Kurs der Zytologie und allgemeinen Histologie WS 2016/2017 Institut für Anatomie und Zellbiologie 1. Semester Humanmedizin und 1. Semester Zahnmedizin Leiterin: OÄ Dr. med. B. Miehe Ansprechpartner in
Testis Nebenhoden Ductus deferens Prostata. Vorlesung Histologie. Die Studierenden sollen
 Kurstag 19 Männliche Geschlechtsorgane Themen Testis Nebenhoden Ductus deferens Prostata Lernziele Prüfungsrelevante Lerninhalte Männliche Geschlechtsorgane Hoden: Tubuli seminiferi, Keimepithel: Sertolizellen,
Kurstag 19 Männliche Geschlechtsorgane Themen Testis Nebenhoden Ductus deferens Prostata Lernziele Prüfungsrelevante Lerninhalte Männliche Geschlechtsorgane Hoden: Tubuli seminiferi, Keimepithel: Sertolizellen,
Welche Form der Knochenverbindungen sehen wir bei diesem Knochen?
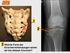 1 2 3 Welche Form der Knochenverbindungen sehen wir bei diesem Knochen? Name der 5 Gelenkfläche: 4 6 7 Welcher Pfeil zeigt die Articulatio carpometacarpea pollicis? A B 8 Wie heißt das Gelenk A? 9 Welche
1 2 3 Welche Form der Knochenverbindungen sehen wir bei diesem Knochen? Name der 5 Gelenkfläche: 4 6 7 Welcher Pfeil zeigt die Articulatio carpometacarpea pollicis? A B 8 Wie heißt das Gelenk A? 9 Welche
Gewebelehre Epithelgewebe, Muskelgewebe
 Gewebelehre Epithelgewebe, Muskelgewebe David P. Wolfer Institut für Bewegungswissenschaften und Sport, D-HEST, ETH Zürich Anatomisches Institut, Medizinische Fakultät, Universität Zürich 76-0-00/0 Anatomie
Gewebelehre Epithelgewebe, Muskelgewebe David P. Wolfer Institut für Bewegungswissenschaften und Sport, D-HEST, ETH Zürich Anatomisches Institut, Medizinische Fakultät, Universität Zürich 76-0-00/0 Anatomie
Einteilung der Histokurse
 Einteilung der Histokurse A B C D E Mo 9:30-11:00 Di 14:15-15:45 Di 7:30-9:00 Mi 9:30-11:0 Di 9:30-11:00 Do 14:15-15:45 Di 16:30-18:00 Do 16:30-18:00 Mo 7:30-9:00 Mi 7:30-9:00 Gruppen 7-12 Gruppen 19-22
Einteilung der Histokurse A B C D E Mo 9:30-11:00 Di 14:15-15:45 Di 7:30-9:00 Mi 9:30-11:0 Di 9:30-11:00 Do 14:15-15:45 Di 16:30-18:00 Do 16:30-18:00 Mo 7:30-9:00 Mi 7:30-9:00 Gruppen 7-12 Gruppen 19-22
Gewebelehre Epithelgewebe, Muskelgewebe
 Gewebelehre Epithelgewebe, Muskelgewebe David P. Wolfer Institut für Bewegungswissenschaften und Sport, D-HEST, ETH Zürich Anatomisches Institut, Medizinische Fakultät, Universität Zürich 76-0-00/0 Anatomie
Gewebelehre Epithelgewebe, Muskelgewebe David P. Wolfer Institut für Bewegungswissenschaften und Sport, D-HEST, ETH Zürich Anatomisches Institut, Medizinische Fakultät, Universität Zürich 76-0-00/0 Anatomie
Themenkomplex 1: Grundlagen der Anatomie von Herz und Kreislauf. Einstiegsfragen:
 Themenkomplex 1: Grundlagen der von Herz und Kreislauf 1. Beschreiben Sie den Weg des Blutes durch den Körper. 2. Erklären Sie den Unterschied von Arterien und Venen. Themenkomplex 2: Orientierung am Körper
Themenkomplex 1: Grundlagen der von Herz und Kreislauf 1. Beschreiben Sie den Weg des Blutes durch den Körper. 2. Erklären Sie den Unterschied von Arterien und Venen. Themenkomplex 2: Orientierung am Körper
Gewebelehre Epithelgewebe, Muskelgewebe
 Gewebelehre Epithelgewebe, Muskelgewebe David P. Wolfer Institut für Bewegungswissenschaften und Sport, D-HEST, ETH Zürich Anatomisches Institut, Medizinische Fakultät, Universität Zürich 76-0-00 Anatomie
Gewebelehre Epithelgewebe, Muskelgewebe David P. Wolfer Institut für Bewegungswissenschaften und Sport, D-HEST, ETH Zürich Anatomisches Institut, Medizinische Fakultät, Universität Zürich 76-0-00 Anatomie
Haut und Hautanhangsgebilde
 Kurstag 10 Haut und Hautanhangsgebilde Themen Leistenhaut Haare Hautdrüsen Brustdrüse Lernziele Prüfungsrelevante Lerninhalte Haut: Bauprinzip und funktionelle Bedeutung, Turgor, Pigmentierung, Leisten-
Kurstag 10 Haut und Hautanhangsgebilde Themen Leistenhaut Haare Hautdrüsen Brustdrüse Lernziele Prüfungsrelevante Lerninhalte Haut: Bauprinzip und funktionelle Bedeutung, Turgor, Pigmentierung, Leisten-
B. Epithelgewebe : E. Niere (Mensch), Goldner : - Darstellung der Grenze zwischen Rinde (Cortex) und Mark (Medulla) : 1.
 B. Epithelgewebe : E. Niere (Mensch), Goldner : - Darstellung der Grenze zwischen Rinde (Cortex) und Mark (Medulla) : 1. Nierenkörperchen sind nur im Cortex vorhanden 2. Aa. et Vv. Arcuata verlaufen auf
B. Epithelgewebe : E. Niere (Mensch), Goldner : - Darstellung der Grenze zwischen Rinde (Cortex) und Mark (Medulla) : 1. Nierenkörperchen sind nur im Cortex vorhanden 2. Aa. et Vv. Arcuata verlaufen auf
Schattauer Schattauer Schattauer. Schattauer. Schattauer. 2 Epithelgewebe.
 2 Epithelgewebe 2010 GmbH, Stuttgart Exokrine Drüsen exokrine Sekretgranula Lumen einer Schlauchdrüse (Querschnitt) mit Sekret exokrine Sekretgranula Exokrine Drüsen, Magen, Hund. Vergr. 5 500fach. ekkrine,
2 Epithelgewebe 2010 GmbH, Stuttgart Exokrine Drüsen exokrine Sekretgranula Lumen einer Schlauchdrüse (Querschnitt) mit Sekret exokrine Sekretgranula Exokrine Drüsen, Magen, Hund. Vergr. 5 500fach. ekkrine,
Prüfungen zum Histologiekurs im SS 2003
 Prüfungen zum Histologiekurs im SS 2003 1. Teilprüfung: - Klausur - Thema: allgemeine Zell und Gewebelehre - Termin: Mo 26.05. um 19:00 - Ort: Audimax und HS 5 des zentralen HSG 2. Teilprüfung: - mündliches
Prüfungen zum Histologiekurs im SS 2003 1. Teilprüfung: - Klausur - Thema: allgemeine Zell und Gewebelehre - Termin: Mo 26.05. um 19:00 - Ort: Audimax und HS 5 des zentralen HSG 2. Teilprüfung: - mündliches
Schattauer Schattauer Schattauer. Schattauer. Schattauer. 15 Allgemeine Körperdecke.
 15 Allgemeine Körperdecke 2010 GmbH, Stuttgart Haut Haare mit anliegenden Talgdrüsen Talgdrüsen Epidermis, mit abschilferndem Stratum corneum Stratum papillare exoepitheliale, exokrine, tubuläre, apokrine
15 Allgemeine Körperdecke 2010 GmbH, Stuttgart Haut Haare mit anliegenden Talgdrüsen Talgdrüsen Epidermis, mit abschilferndem Stratum corneum Stratum papillare exoepitheliale, exokrine, tubuläre, apokrine
Nerven- und Gliagewebe Peripheres Nervensystem (PNS) Rückenmark
 Kurstag 7 Nerven- und Gliagewebe Peripheres Nervensystem (PNS) Rückenmark Lernziele Prüfungsrelevante Lerninhalte Nervengewebe/PNS: Gliederung des Nervensystems und Neurons, Entwicklung des Nervensystems,
Kurstag 7 Nerven- und Gliagewebe Peripheres Nervensystem (PNS) Rückenmark Lernziele Prüfungsrelevante Lerninhalte Nervengewebe/PNS: Gliederung des Nervensystems und Neurons, Entwicklung des Nervensystems,
Knorpel- und Knochengewebe
 Kurstag 5 Knorpel- und Knochengewebe Lernziele Prüfungsrelevante Lerninhalte Knorpelgewebe: Entstehung, Wachstum, Ernährung, Degeneration, Regeneration. Chondrozyten, - blasten, Chondron, Zusammensetzung
Kurstag 5 Knorpel- und Knochengewebe Lernziele Prüfungsrelevante Lerninhalte Knorpelgewebe: Entstehung, Wachstum, Ernährung, Degeneration, Regeneration. Chondrozyten, - blasten, Chondron, Zusammensetzung
Einführung in die LV des SoSe und des Kurses Mikroskopische Anatomie
 Einführung in die LV des SoSe und des Kurses Mikroskopische Anatomie - Willkommen - Vorklinisches Curriculum in Halle: bewährt und gemessen an den Ergebnissen in Klausuren, Testaten und im Physikum erfolgreich
Einführung in die LV des SoSe und des Kurses Mikroskopische Anatomie - Willkommen - Vorklinisches Curriculum in Halle: bewährt und gemessen an den Ergebnissen in Klausuren, Testaten und im Physikum erfolgreich
Arbeitsheft Histologie & mikroskopische Anatomie Einleitung
 Arbeitsheft Histologie & mikroskopische Anatomie 11 1. Einleitung 1.1. Hierarchisches Bauprinzip des menschlichen Organismus als Voraussetzung für das Verständnis der mikroskopischen und makroskopischen
Arbeitsheft Histologie & mikroskopische Anatomie 11 1. Einleitung 1.1. Hierarchisches Bauprinzip des menschlichen Organismus als Voraussetzung für das Verständnis der mikroskopischen und makroskopischen
18 Weibliche Geschlechtsorgane
 8 Weibliche Geschlechtsorgane Ovar, Katze, HE... -0 Corpus luteum menstruationis, HE... - Corpus luteum graviditatis, HE...,4,5 Tuba uterina, Pars ampullaris, HE... 6-8 Uterus, Proliferationsphase, HE...
8 Weibliche Geschlechtsorgane Ovar, Katze, HE... -0 Corpus luteum menstruationis, HE... - Corpus luteum graviditatis, HE...,4,5 Tuba uterina, Pars ampullaris, HE... 6-8 Uterus, Proliferationsphase, HE...
Vorlesung Histologie. Die Studierenden sollen
 Kurstag 20 Weibliche Geschlechtsorgane Themen Ovar Tuba uterina Uterus Vagina Plazenta Lernziele Prüfungsrelevante Lerninhalte Weibliche Geschlechtsorgane Ovar: Mark und Rinde, Follikel und Follikulogenese,
Kurstag 20 Weibliche Geschlechtsorgane Themen Ovar Tuba uterina Uterus Vagina Plazenta Lernziele Prüfungsrelevante Lerninhalte Weibliche Geschlechtsorgane Ovar: Mark und Rinde, Follikel und Follikulogenese,
Mikroskopische Anatomie
 Mikroskopische Anatomie Haut und Anhangsorgane Herz und Blutgefäße Atmungstrakt Blut und Blutbildung Lymphatische Organe Endokrine Organe Auge Verdauungstrakt Harntrakt Genitalorgane Allgemeines: Gesamtfläche:
Mikroskopische Anatomie Haut und Anhangsorgane Herz und Blutgefäße Atmungstrakt Blut und Blutbildung Lymphatische Organe Endokrine Organe Auge Verdauungstrakt Harntrakt Genitalorgane Allgemeines: Gesamtfläche:
ANATOMIE KOLLOQUIUMSFRAGEN Jahrgang /2011, 2. Semester
 Universität Szeged, Medizinische Fakultät Institut für Anatomie, Histologie und Embryologie Institutsleiter: Prof. András Mihály M.D., Ph.D., D.Sc. Kossuth L. sgt. 40, H-6724 Szeged, Ungarn Tel.: +36-(62)-545-665
Universität Szeged, Medizinische Fakultät Institut für Anatomie, Histologie und Embryologie Institutsleiter: Prof. András Mihály M.D., Ph.D., D.Sc. Kossuth L. sgt. 40, H-6724 Szeged, Ungarn Tel.: +36-(62)-545-665
INSTITUT FÜR ANATOMIE, HISTOLOGIE UND EMBRYOLOGIE UNIVERSITÄT SZEGED Institutsleiter: Prof. András Mihály MD, DSc
 INSTITUT FÜR ANATOMIE, HISTOLOGIE UND EMBRYOLOGIE UNIVERSITÄT SZEGED Institutsleiter: Prof. András Mihály MD, DSc Kossuth L. sgt. 40. Email: titk@anat-fm.szote.u-szeged.hu H-6724 Szeged, Hungary http://www.szote.u-szeged.hu//anatomy
INSTITUT FÜR ANATOMIE, HISTOLOGIE UND EMBRYOLOGIE UNIVERSITÄT SZEGED Institutsleiter: Prof. András Mihály MD, DSc Kossuth L. sgt. 40. Email: titk@anat-fm.szote.u-szeged.hu H-6724 Szeged, Hungary http://www.szote.u-szeged.hu//anatomy
Zentrales Nervensystem (ZNS)
 Kurstag 8 Zentrales Nervensystem (ZNS) Themen Großhirn Mittelhirn Dopaminerge Nervenzellen Kleinhirn Lernziele Prüfungsrelevante Lerninhalte ZNS: (Übergeordnete Gliederung und allgemeine Begriffe: ZNS/PNS,
Kurstag 8 Zentrales Nervensystem (ZNS) Themen Großhirn Mittelhirn Dopaminerge Nervenzellen Kleinhirn Lernziele Prüfungsrelevante Lerninhalte ZNS: (Übergeordnete Gliederung und allgemeine Begriffe: ZNS/PNS,
Skelettmuskulatur (M.uvulae) quer/längs geschnitten
 Mundhöhle, Zunge Kurspräparate: Nr.50 Uvula Nr.39 Zunge, Papillae fungiformes Nr.40 Zungenmitte Nr.42 Zunge, Papillae foliatae Nr.44 Zunge, Papillae vallatae Nr.86 Harter Gaumen Uvula- weicher Gaumen Präparat
Mundhöhle, Zunge Kurspräparate: Nr.50 Uvula Nr.39 Zunge, Papillae fungiformes Nr.40 Zungenmitte Nr.42 Zunge, Papillae foliatae Nr.44 Zunge, Papillae vallatae Nr.86 Harter Gaumen Uvula- weicher Gaumen Präparat
Herz Herz, HE... 2,3 Herz, Schwein, HE, Purkinjefasern Aorta Aorta, Masson-Trichrom Aorta, Resorcin-Fuchsin... 8,9
 9 Kreislauforgane Herz Herz, HE..., Herz, Schwein, HE, Purkinjefasern... 4 Aorta Aorta, Masson-Trichrom... 5-7 Aorta, Resorcin-Fuchsin... 8,9 Arterie und Vene Arterie und Vene, HE... 0 Arterie und Vene,
9 Kreislauforgane Herz Herz, HE..., Herz, Schwein, HE, Purkinjefasern... 4 Aorta Aorta, Masson-Trichrom... 5-7 Aorta, Resorcin-Fuchsin... 8,9 Arterie und Vene Arterie und Vene, HE... 0 Arterie und Vene,
Anleitung zum histologischen Kurs für Studierende der Veterinärmedizin
 Anleitung zum histologischen Kurs für Studierende der Veterinärmedizin Johannes Seeger Günther Michel Gerda Gutte Thomas Ludewig Martina Menzel Veterinär - Anatomisches Institut, Veterinärmedizinische
Anleitung zum histologischen Kurs für Studierende der Veterinärmedizin Johannes Seeger Günther Michel Gerda Gutte Thomas Ludewig Martina Menzel Veterinär - Anatomisches Institut, Veterinärmedizinische
Anatomie und Physiologie I Vorlesung , HS 2012
 Anatomie und Physiologie I Vorlesung 376-0151-00, HS 2012 Teil Anatomie: Gewebelehre D.P. Wolfer, A. Rhyner, M. Sebele, M. Müntener Bei den Zeichenvorlagen handelt es sich zum Teil um modifizierte Abbildungen
Anatomie und Physiologie I Vorlesung 376-0151-00, HS 2012 Teil Anatomie: Gewebelehre D.P. Wolfer, A. Rhyner, M. Sebele, M. Müntener Bei den Zeichenvorlagen handelt es sich zum Teil um modifizierte Abbildungen
Fixation. Einbettung. Schneiden. Färbung. Eindecken
 Fixation Einbettung Schneiden Färbung Eindecken Beurteilung / Klassifikation von Epithelien: 1. Schichtung einschichtig (einschichtig einfach) mehrreihig (einschichtig mehrreihig) mehrschichtig 2. Zellform
Fixation Einbettung Schneiden Färbung Eindecken Beurteilung / Klassifikation von Epithelien: 1. Schichtung einschichtig (einschichtig einfach) mehrreihig (einschichtig mehrreihig) mehrschichtig 2. Zellform
Studienbrief Heilpraktiker
 Studienbrief Heilpraktiker Einführung in die allgemeine Anatomie und Physiologie 3 Histologie 3. HISTOLOGIE IHRE LERNZIELE In diesem Kapitel vermitteln wir Ihnen Kenntnisse über die unterschiedlichen Formen
Studienbrief Heilpraktiker Einführung in die allgemeine Anatomie und Physiologie 3 Histologie 3. HISTOLOGIE IHRE LERNZIELE In diesem Kapitel vermitteln wir Ihnen Kenntnisse über die unterschiedlichen Formen
6. Tutorium AMB/OBOE
 6. Tutorium AMB/OBOE 01.12.05 1. Teil Zoologie 1) Larve - Selbstständige, aber noch nicht geschlechtsreife Entwicklungsstadien mit eigenen charakteristischen Merkmalen, die beim adulten Tier fehlen 2)
6. Tutorium AMB/OBOE 01.12.05 1. Teil Zoologie 1) Larve - Selbstständige, aber noch nicht geschlechtsreife Entwicklungsstadien mit eigenen charakteristischen Merkmalen, die beim adulten Tier fehlen 2)
Bindegewebe Zellen und Extrazellulärmatrix (EZM)
 Bindegewebe Zellen und Extrazellulärmatrix (EZM) Ortsständige Zellen: Fibroblast ist für Stoffwechsel der Extrazellulärmatrix-Bestandteile zuständig (Kollagenfibrillen, elastische Fasern, retikuläre Fasern,
Bindegewebe Zellen und Extrazellulärmatrix (EZM) Ortsständige Zellen: Fibroblast ist für Stoffwechsel der Extrazellulärmatrix-Bestandteile zuständig (Kollagenfibrillen, elastische Fasern, retikuläre Fasern,
1. Klausur in Histologie SS 2010
 1. Klausur in Histologie SS 2010 1. Beim gezeigten Gewebe handelt es sich A) straffes Bindegewebe B) Skelettmuskulatur C) kollagene Fasern D) glatte Muskulatur E) Geflechtknochen F) Sehne G) Nerv H) Herzmuskulatur
1. Klausur in Histologie SS 2010 1. Beim gezeigten Gewebe handelt es sich A) straffes Bindegewebe B) Skelettmuskulatur C) kollagene Fasern D) glatte Muskulatur E) Geflechtknochen F) Sehne G) Nerv H) Herzmuskulatur
Zellkern Blutausstrich, nach Pappenheim... 2 Eizelle, Ovar, HE... 3 Leber, HE... 4 Zellkern, EM... 5 Nucleolus, EM... 6 Kernhülle, EM...
 Zelle Zellkern Blutausstrich, nach Pappenheim... Eizelle, Ovar, HE... 3 Leber, HE... 4 Zellkern, EM... 5 Nucleolus, EM... 6 Kernhülle, EM... 7,8 Mitose Zwiebelwurzel...9,0 Endoplasmatisches Retikulum Pankreas,
Zelle Zellkern Blutausstrich, nach Pappenheim... Eizelle, Ovar, HE... 3 Leber, HE... 4 Zellkern, EM... 5 Nucleolus, EM... 6 Kernhülle, EM... 7,8 Mitose Zwiebelwurzel...9,0 Endoplasmatisches Retikulum Pankreas,
Basiswissen Histologie und Zytologie
 Basiswissen Histologie und Zytologie Lehr- und Arbeitsbuch 3., aktualisierte und erweiterte Auflage (Hrsg.) Christof Henne Heike Storjohann Mit 12 Tabellen und 69 Abbildungen dvta Vorwort zur 3. Auflage
Basiswissen Histologie und Zytologie Lehr- und Arbeitsbuch 3., aktualisierte und erweiterte Auflage (Hrsg.) Christof Henne Heike Storjohann Mit 12 Tabellen und 69 Abbildungen dvta Vorwort zur 3. Auflage
Kursus der mikroskopischen Anatomie Teil I: Gewebelehre
 Stand: 25. 04. 2016 Kursus der mikroskopischen Anatomie Teil I: Gewebelehre für die Studiengänge Humanmedizin, Zahnmedizin und Molekulare Medizin an der Universität Göttingen Göttinger Zentrum Anatomie
Stand: 25. 04. 2016 Kursus der mikroskopischen Anatomie Teil I: Gewebelehre für die Studiengänge Humanmedizin, Zahnmedizin und Molekulare Medizin an der Universität Göttingen Göttinger Zentrum Anatomie
20 Männliche Geschlechtsorgane
 0 Männliche Geschlechtsorgane Hoden, Mensch, HE... -8 Hoden, Ratte, Semidünnschnitt, Toluidinblau,... 9 Nebenhoden, HE... 0- Funiculus spermaticus, HE...,5 Glandula vesiculosa, HE... 6-8 Prostata, HE...
0 Männliche Geschlechtsorgane Hoden, Mensch, HE... -8 Hoden, Ratte, Semidünnschnitt, Toluidinblau,... 9 Nebenhoden, HE... 0- Funiculus spermaticus, HE...,5 Glandula vesiculosa, HE... 6-8 Prostata, HE...
Harnkanälchen. Proximaler Tubulus
 Harnkanälchen Der Harnkanälchenapparat des Nephrons ist etwa 3-4 cm lang und gliedert sich in den proximalen, intermediäre und distalen Tubulus. Alle Tubuli bestehen aus einem einschichtigen Epithel, das
Harnkanälchen Der Harnkanälchenapparat des Nephrons ist etwa 3-4 cm lang und gliedert sich in den proximalen, intermediäre und distalen Tubulus. Alle Tubuli bestehen aus einem einschichtigen Epithel, das
Gewebelehre Zellfortsätze, Binde- und Stützgewebe
 Gewebelehre Zellfortsätze, Binde- und Stützgewebe David P. Wolfer Institut für Bewegungswissenschaften und Sport, D-HEST, ETH Zürich Anatomisches Institut, Medizinische Fakultät, Universität Zürich 76-0-00
Gewebelehre Zellfortsätze, Binde- und Stützgewebe David P. Wolfer Institut für Bewegungswissenschaften und Sport, D-HEST, ETH Zürich Anatomisches Institut, Medizinische Fakultät, Universität Zürich 76-0-00
Allgemeines Grundsätzlicher Aufbau einer Epithelzelle Es gibt einige grundsätzliche Strukturelemente, die allen Epithelverbänden gemein sind.
 Allgemeines Grundsätzlicher Aufbau einer Epithelzelle Es gibt einige grundsätzliche Strukturelemente, die allen Epithelverbänden gemein sind. Diese sollen hier kurz vorgestellt werden. So ist bei allen
Allgemeines Grundsätzlicher Aufbau einer Epithelzelle Es gibt einige grundsätzliche Strukturelemente, die allen Epithelverbänden gemein sind. Diese sollen hier kurz vorgestellt werden. So ist bei allen
Bau des Nervengewebes
 Bau des Nervengewebes Das Nervengewebe hat eine zelluläre Gliederung und wird prinzipiell in die erregbaren Neuronen und die nicht erregbaren Zellen der Neuroglia unterteilt. Das Nervengewebe organisiert
Bau des Nervengewebes Das Nervengewebe hat eine zelluläre Gliederung und wird prinzipiell in die erregbaren Neuronen und die nicht erregbaren Zellen der Neuroglia unterteilt. Das Nervengewebe organisiert
Kursus in Histopathologie. Allgemeines
 Kursus in Histopathologie I. Bestandteile des Kursus: Präparate zur - Allgemeinen Pathologie (n = 31) - Speziellen (Organ)Pathologie (n = 23) II. Ziel des Kursus: Wiederholung von: - Allgemeiner Pathologie
Kursus in Histopathologie I. Bestandteile des Kursus: Präparate zur - Allgemeinen Pathologie (n = 31) - Speziellen (Organ)Pathologie (n = 23) II. Ziel des Kursus: Wiederholung von: - Allgemeiner Pathologie
Histologie. K. Spanel-Borowski. H. Hilbig F. Keller K. Punkt W. Schmidt. K. Welt
 Histologie K. Spanel-Borowski H. Hilbig F. Keller K. Punkt W. Schmidt K. Welt 10 1 EINLEITUNG 1 EINLEITUNG Zytologie ist die Lehre von der Zelle, deren Strukturen im Fach Biologie / Zellbiologie besprochen
Histologie K. Spanel-Borowski H. Hilbig F. Keller K. Punkt W. Schmidt K. Welt 10 1 EINLEITUNG 1 EINLEITUNG Zytologie ist die Lehre von der Zelle, deren Strukturen im Fach Biologie / Zellbiologie besprochen
13 Verdauungstrakt - Mundhöhle, Zahn, Zahnentwicklung
 Verdauungstrakt - Mundhöhle, Zahn, Zahnentwicklung Zunge Papillae filiformes, HE..., Papilla circumvallata, Kalb, HE...,5 Speicheldrüsen Glandula submandibularis HE... 6-0 Glandula sublingualis, HE...
Verdauungstrakt - Mundhöhle, Zahn, Zahnentwicklung Zunge Papillae filiformes, HE..., Papilla circumvallata, Kalb, HE...,5 Speicheldrüsen Glandula submandibularis HE... 6-0 Glandula sublingualis, HE...
Kurzlehrbuch Anatomie
 Hellmuth Michels, Claas Lennart Neumann Kurzlehrbuch Anatomie 1. Auflage Mit 183 Abbildungen und 80 Tabellen URBAN& FISCHER URBAN& FISCHER München Jena Inhaltsverzeichnis 1 Allgemeine Embryologie 1 1.1
Hellmuth Michels, Claas Lennart Neumann Kurzlehrbuch Anatomie 1. Auflage Mit 183 Abbildungen und 80 Tabellen URBAN& FISCHER URBAN& FISCHER München Jena Inhaltsverzeichnis 1 Allgemeine Embryologie 1 1.1
Fixation. Einbettung. Schneiden. Färbung. Eindecken
 Fixation Einbettung Schneiden Färbung Eindecken Beurteilung / Klassifikation von Epithelien: 1. Schichtung einschichtig (einschichtig einfach) mehrreihig (einschichtig mehrreihig) mehrschichtig 2. Zellform
Fixation Einbettung Schneiden Färbung Eindecken Beurteilung / Klassifikation von Epithelien: 1. Schichtung einschichtig (einschichtig einfach) mehrreihig (einschichtig mehrreihig) mehrschichtig 2. Zellform
Hoden, Ovar. Kurspräparate: Nr. 66 Hoden Nr. 67 Hoden Nr. 68 Ovar Nr. 69 Ovar
 Hoden, Ovar Kurspräparate: Nr. 66 Hoden Nr. 67 Hoden Nr. 68 Ovar Nr. 69 Ovar Hoden Präparat 66 Färbung HE dichte kollagenfaserige Tunica albuginea Anschnitte des Tubulussystems Gefäß Hodenparenchym Rest
Hoden, Ovar Kurspräparate: Nr. 66 Hoden Nr. 67 Hoden Nr. 68 Ovar Nr. 69 Ovar Hoden Präparat 66 Färbung HE dichte kollagenfaserige Tunica albuginea Anschnitte des Tubulussystems Gefäß Hodenparenchym Rest
Charakteristisch für die Lymphfollikel der Milz sind die darin enthaltenen Arteriolen. Abb. 4 Pinselarteriolen Mensch, HE-Färbung
 Die ist das größte lymphatische Organ und in besonderer Weise in den Blutstrom integriert. Sie ist nicht in den Lymphstrom eingeschaltet und hat folgende Aufgaben: Reinigung des Blutes von körperfremden
Die ist das größte lymphatische Organ und in besonderer Weise in den Blutstrom integriert. Sie ist nicht in den Lymphstrom eingeschaltet und hat folgende Aufgaben: Reinigung des Blutes von körperfremden
Anhangsdrüsen 53. An der Parotis kann gut der allgemeine Aufbau einer Speicheldrüse veranschaulicht werden.
 Anhangsdrüsen 53 139: Parotis (Ohrspeicheldrüse) Mensch Ladewig Die Parotis wird von der derben Fascia parotidea umhüllt und ist eine rein seröse Drüse mit azinösen Endstücken. Alle Abschnitte des Ausführungsgangssystems
Anhangsdrüsen 53 139: Parotis (Ohrspeicheldrüse) Mensch Ladewig Die Parotis wird von der derben Fascia parotidea umhüllt und ist eine rein seröse Drüse mit azinösen Endstücken. Alle Abschnitte des Ausführungsgangssystems
Wintersemester 2010/2011
 Wintersemester 2010/2011 Name: Matr. Nr.: Histologie Niere, Harnwege, Geschlechtsorgane Seite 1 von 10 Herzlich willkommen zum Histologiekurs des Systemblocks Harn und Geschlechtsorgane. In diesem Kurs
Wintersemester 2010/2011 Name: Matr. Nr.: Histologie Niere, Harnwege, Geschlechtsorgane Seite 1 von 10 Herzlich willkommen zum Histologiekurs des Systemblocks Harn und Geschlechtsorgane. In diesem Kurs
Histologie des Epithelgewebes. Äußere und innere Oberflächen des Körpers
 Histologie des Epithelgewebes Das Epithel ist Grenzflächengewebe der inneren und äußeren Körperoberfläche, einschließlich der Auskleidung in den Gefäßen (Blut- und Lymphgefäße). Epi, lat. oben auf, steht
Histologie des Epithelgewebes Das Epithel ist Grenzflächengewebe der inneren und äußeren Körperoberfläche, einschließlich der Auskleidung in den Gefäßen (Blut- und Lymphgefäße). Epi, lat. oben auf, steht
Kursus der mikroskopischen Anatomie Teil I: Gewebelehre
 Stand: 21. 11. 2014 Kursus der mikroskopischen Anatomie Teil I: Gewebelehre für die Studiengänge Humanmedizin, Zahnmedizin und Molekulare Medizin an der Universität Göttingen Zentrum Anatomie Universitätsmedizin
Stand: 21. 11. 2014 Kursus der mikroskopischen Anatomie Teil I: Gewebelehre für die Studiengänge Humanmedizin, Zahnmedizin und Molekulare Medizin an der Universität Göttingen Zentrum Anatomie Universitätsmedizin
Funktion des Bindegewebes. Bestandteile des Bindegewebes. 1. Zelluläre Bestandteile
 Funktion des Bindegewebes Entsprechend der Namensgebung stellt das Bindegewebe die Verbindung zwischen den verschiedenen Geweben des Organismus her. Es stützt, füllt Räume, dient der Übertagung von Informationen,
Funktion des Bindegewebes Entsprechend der Namensgebung stellt das Bindegewebe die Verbindung zwischen den verschiedenen Geweben des Organismus her. Es stützt, füllt Räume, dient der Übertagung von Informationen,
Normales histologisches Präparat mit Azan gefärbt, wodurch eine Differenzierung der azidophilen, basophilen und chromophoben Zellen möglich wird.
 Präparatedetails Organ Herkunft Färbung HYPOPHYSE MENSCH AZAN Methode Normales histologisches Präparat mit Azan gefärbt, wodurch eine Differenzierung der azidophilen, basophilen und chromophoben Zellen
Präparatedetails Organ Herkunft Färbung HYPOPHYSE MENSCH AZAN Methode Normales histologisches Präparat mit Azan gefärbt, wodurch eine Differenzierung der azidophilen, basophilen und chromophoben Zellen
Binde- und Stützgewebe
 Bindegewebe Fettgewebe Knorpelgewebe Knochengewebe Kapsel Stroma Parenchym Embryonale Abstammung: Mesenchym Ortsfeste Zellen Freie Zellen Bindegewebsfasern Grundsubstanz Bindegewebe Ortsfeste Zellen Fibrozyten
Bindegewebe Fettgewebe Knorpelgewebe Knochengewebe Kapsel Stroma Parenchym Embryonale Abstammung: Mesenchym Ortsfeste Zellen Freie Zellen Bindegewebsfasern Grundsubstanz Bindegewebe Ortsfeste Zellen Fibrozyten
C. MUSKELGEWEBE : 4. Glattes Muskelgewebe (Harnblase, Ratte), Semi-Feinschnitt, Toluidinblau : 16. Glattes Muskelgewebe (Harnblase, Mensch), HE :
 C. MUSKELGEWEBE : 4. Glattes Muskelgewebe (Harnblase, Ratte), Semi-Feinschnitt, Toluidinblau : - Der zigarrförmige Kern liegt zentral und scheint im Querschnitt rund. - Kleine längliche, spindelförmige
C. MUSKELGEWEBE : 4. Glattes Muskelgewebe (Harnblase, Ratte), Semi-Feinschnitt, Toluidinblau : - Der zigarrförmige Kern liegt zentral und scheint im Querschnitt rund. - Kleine längliche, spindelförmige
1 Organisation der Zelle 5 2 Plasmamembran und Oberflächendifferenzierungen 8. 3 Zytoskelett Zellkontakte Zellorganellen und Zytosol 44
 IX Zellenlehre 1 Organisation der Zelle 5 2 Plasmamembran und Oberflächendifferenzierungen 8 2.1 Aufbau der Plasmamembran 8 2.2 Kanäle, Transporter, Pumpen, Rezeptoren 11 2.3 Differenzierungen der Zelloberfläche
IX Zellenlehre 1 Organisation der Zelle 5 2 Plasmamembran und Oberflächendifferenzierungen 8 2.1 Aufbau der Plasmamembran 8 2.2 Kanäle, Transporter, Pumpen, Rezeptoren 11 2.3 Differenzierungen der Zelloberfläche
WS 2008/2009. Klausur für Studierende der Ernährungswissenschaften am 24. Februar 2009
 WS 2008/2009 Klausur für Studierende der Ernährungswissenschaften am 24. Februar 2009 (1) Die Arteria cerebri media versorgt das Mesencephalon den Hinterhauptslappen den Temporallappen und angrenzende
WS 2008/2009 Klausur für Studierende der Ernährungswissenschaften am 24. Februar 2009 (1) Die Arteria cerebri media versorgt das Mesencephalon den Hinterhauptslappen den Temporallappen und angrenzende
Gewebelehre Zellfortsätze, Binde- und Stützgewebe
 Gewebelehre Zellfortsätze, Binde- und Stützgewebe David P. Wolfer Institut für Bewegungswissenschaften und Sport, D-HEST, ETH Zürich Anatomisches Institut, Medizinische Fakultät, Universität Zürich 376-0-00/0
Gewebelehre Zellfortsätze, Binde- und Stützgewebe David P. Wolfer Institut für Bewegungswissenschaften und Sport, D-HEST, ETH Zürich Anatomisches Institut, Medizinische Fakultät, Universität Zürich 376-0-00/0
Inhaltsverzeichnis. 1 Zellaufbau... 1 Manfred Gratzl
 Inhaltsverzeichnis 1 Zellaufbau................................... 1 1.1 Plasmamembran......................... 3 1.1.1 Transportvorgänge.................... 3 1.1.2 Rezeptoren und Signalverarbeitung..........
Inhaltsverzeichnis 1 Zellaufbau................................... 1 1.1 Plasmamembran......................... 3 1.1.1 Transportvorgänge.................... 3 1.1.2 Rezeptoren und Signalverarbeitung..........
Herzlich Willkommen! Marylin Gossett Telefon Mobil Mail: um Uhr geht s los :-)
 Herzlich Willkommen! Heilpraktiker Kurs: Gewebe Epithelgewebe Binde- und Stützgewebe Muskelgewebe Nervengewebe um 20.00 Uhr geht s los :-) Marylin Gossett Telefon 06857 2994022 Mobil 0157 84015935 Mail:
Herzlich Willkommen! Heilpraktiker Kurs: Gewebe Epithelgewebe Binde- und Stützgewebe Muskelgewebe Nervengewebe um 20.00 Uhr geht s los :-) Marylin Gossett Telefon 06857 2994022 Mobil 0157 84015935 Mail:
Niere, Affe, HE , 9-13 Niere, Glomerulus, EM... 7,8 Niere, Mark, quer, HE Ureter, HE Harnblase, HE... 18,19
 7 Niere, Harnwege Niere, Affe, HE... -6, 9- Niere, Glomerulus, EM... 7,8 Niere, Mark, quer, HE... 4 Ureter, HE... 5-7 Harnblase, HE... 8,9 Urethra, männlich, HE... 0- Niere - Übersicht (HE) 4 5 6 5 Rinde
7 Niere, Harnwege Niere, Affe, HE... -6, 9- Niere, Glomerulus, EM... 7,8 Niere, Mark, quer, HE... 4 Ureter, HE... 5-7 Harnblase, HE... 8,9 Urethra, männlich, HE... 0- Niere - Übersicht (HE) 4 5 6 5 Rinde
MEDIZINISCHE FAKULTÄT DER UNIVERSITÄT ROSTOCK INSTITUT FÜR ANATOMIE KURSUS DER HISTOLOGIE UND DER MIKROSKOPISCHEN ANATOMIE
 MEDIZINISCHE FAKULTÄT DER UNIVERSITÄT ROSTOCK INSTITUT FÜR ANATOMIE KURSUS DER HISTOLOGIE UND DER MIKROSKOPISCHEN ANATOMIE Rostock 2 Medizinische Fakultät Institut für Anatomie Gertrudenstr. 9 18057 Rostock
MEDIZINISCHE FAKULTÄT DER UNIVERSITÄT ROSTOCK INSTITUT FÜR ANATOMIE KURSUS DER HISTOLOGIE UND DER MIKROSKOPISCHEN ANATOMIE Rostock 2 Medizinische Fakultät Institut für Anatomie Gertrudenstr. 9 18057 Rostock
SS 2015. 040177 - Kursus der Histologie und mikroskopischen Anatomie für Mediziner und Zahnmediziner, Teil 2
 SS 2015 040177 - Kursus der Histologie und mikroskopischen Anatomie für Mediziner und Zahnmediziner, Teil 2 (1) Verdauungstrakt I (Oesophagus, Magen, Jejunum) (3 Std.) Mittwoch, 08.04.2015 (Kurs A: 13.00-15.15
SS 2015 040177 - Kursus der Histologie und mikroskopischen Anatomie für Mediziner und Zahnmediziner, Teil 2 (1) Verdauungstrakt I (Oesophagus, Magen, Jejunum) (3 Std.) Mittwoch, 08.04.2015 (Kurs A: 13.00-15.15
INSTITUT FÜR ANATOMIE UND ZELLBIOLOGIE
 MARTIN - LUTHER - UNIVERSITÄT HALLE - WITTENBERG MEDIZINISCHE FAKULTÄT INSTITUT FÜR ANATOMIE UND ZELLBIOLOGIE DIREKTOR: UNIVERSITÄTSPROFESSOR DR. MED. DR. AGR. BERND FISCHER Testatrelevanter Stoff für
MARTIN - LUTHER - UNIVERSITÄT HALLE - WITTENBERG MEDIZINISCHE FAKULTÄT INSTITUT FÜR ANATOMIE UND ZELLBIOLOGIE DIREKTOR: UNIVERSITÄTSPROFESSOR DR. MED. DR. AGR. BERND FISCHER Testatrelevanter Stoff für
Schattauer Schattauer Schattauer. Schattauer. Schattauer. 6 Kreislaufsystem.
 6 Kreislaufsystem 2010 GmbH, Stuttgart Arterie univakuoläres Fettgewebe Adventitia (Tunica externa) Media (Tunica media) Lumen der Arterie mit Blut Intima (Tunica interna) Arterie, Gekröse, Pferd. Färbung
6 Kreislaufsystem 2010 GmbH, Stuttgart Arterie univakuoläres Fettgewebe Adventitia (Tunica externa) Media (Tunica media) Lumen der Arterie mit Blut Intima (Tunica interna) Arterie, Gekröse, Pferd. Färbung
Immunbiologie. Teil 6
 Teil 6 Lymphatische Organe - Übersicht (1) - zusätzlich zu der Einteilung primäre, sekundäre und tertiäre lymphatische Organe - kann man zwei Gruppen unterscheiden: 1. Strukturen, die embryonal angelegt
Teil 6 Lymphatische Organe - Übersicht (1) - zusätzlich zu der Einteilung primäre, sekundäre und tertiäre lymphatische Organe - kann man zwei Gruppen unterscheiden: 1. Strukturen, die embryonal angelegt
einschichtiges, hochprismatisches Epithel des Epithelium mucosae Tunica mucosa Lamina propria mucosae mit tubulären Eigendrüsen
 einschichtiges, hochprismatisches Epithel des Epithelium mucosae mit tubulären Eigendrüsen Tunica mucosa Blutgefäße mit Blut angefüllt Lamina muscularis mucosae Verdauungsapparat Drüsenmagen, Eigendrüsen,
einschichtiges, hochprismatisches Epithel des Epithelium mucosae mit tubulären Eigendrüsen Tunica mucosa Blutgefäße mit Blut angefüllt Lamina muscularis mucosae Verdauungsapparat Drüsenmagen, Eigendrüsen,
Die Leber Entstehung der Leber. Histologie der Leber
 Die Leber Entstehung der Leber Die Hepatozyten sind endodermaler Herkunft und entwickeln sich aus den selben Vorläuferzellen, die auch den Darm bilden. Bindegewebe und Gefäße der Leber entstehen aus mesenchymalen
Die Leber Entstehung der Leber Die Hepatozyten sind endodermaler Herkunft und entwickeln sich aus den selben Vorläuferzellen, die auch den Darm bilden. Bindegewebe und Gefäße der Leber entstehen aus mesenchymalen
11 Organe des Immunsystems
 Organe des Immunsystems Mucosa-assoziiertes lymphatisches Gewebe (MALG) Tonsilla palatina, HE... -7 Peyer sche Plaques... 8-0 Appendix... - Lymphknoten, HE und Silberimprägnierung nach Bielschowsky...
Organe des Immunsystems Mucosa-assoziiertes lymphatisches Gewebe (MALG) Tonsilla palatina, HE... -7 Peyer sche Plaques... 8-0 Appendix... - Lymphknoten, HE und Silberimprägnierung nach Bielschowsky...
Schattauer Schattauer Schattauer. Schattauer. Schattauer. 13 Männliche Geschlechtsorgane.
 13 Männliche Geschlechtsorgane 2010 GmbH, Stuttgart Nebenhoden Flachschnitte durch die Wand des Nebenhodenganges Samenflüssigkeit Nebenhodengang, im Bereich des Nebenhodenschwanzes, Katze. Färbung H.E.,
13 Männliche Geschlechtsorgane 2010 GmbH, Stuttgart Nebenhoden Flachschnitte durch die Wand des Nebenhodenganges Samenflüssigkeit Nebenhodengang, im Bereich des Nebenhodenschwanzes, Katze. Färbung H.E.,
Herausgegeben von MANFRED GRATZL. Technische Universität Darmstadt FACHBEREICH 10 BIOLOGIE. Bibliothek Schnittspahnstraße 10 D Darmstadt
 L. C. JUNQUEIRA J. CARNEIRO R. O. KELLEY Histologie Herausgegeben von Fünfte, neu übersetzte, überarbeitete und aktualisierte Auflage Mit 500 überwiegend farbigen Abbildungen in 71 Einzeldarstellungen
L. C. JUNQUEIRA J. CARNEIRO R. O. KELLEY Histologie Herausgegeben von Fünfte, neu übersetzte, überarbeitete und aktualisierte Auflage Mit 500 überwiegend farbigen Abbildungen in 71 Einzeldarstellungen
Bündel glatter Muskelzellen
 Lumen der Harnblase Universität Leipzig, erstellt von J. Kacza Schleimhautfalten mit Urothel Blutgefäß äße lockeres Bindegewebe Bündel glatter Muskelzellen Muskelgewebe: Glatte Muskulatur Harnblase - Hund:
Lumen der Harnblase Universität Leipzig, erstellt von J. Kacza Schleimhautfalten mit Urothel Blutgefäß äße lockeres Bindegewebe Bündel glatter Muskelzellen Muskelgewebe: Glatte Muskulatur Harnblase - Hund:
Stoffumfangsplan für das Testat Allgemeine Histologie (Histologiekurs I) und Embryologie
 Institut für Anatomie und Zellbiologie EMAU Greifswald 27.01.2015 Stoffumfangsplan für das Testat Allgemeine Histologie (Histologiekurs I) und Embryologie Stoffumfang Histologie Die mündliche Prüfung umfasst
Institut für Anatomie und Zellbiologie EMAU Greifswald 27.01.2015 Stoffumfangsplan für das Testat Allgemeine Histologie (Histologiekurs I) und Embryologie Stoffumfang Histologie Die mündliche Prüfung umfasst
Praktikums- und Seminarordnung des Institutes für Anatomie für Studierende der Medizin und Zahnmedizin (Stand November 2010)
 Praktikums- und Seminarordnung des Institutes für Anatomie für Studierende der Medizin und Zahnmedizin (Stand November 2010) Auf der Grundlage der Anlage 1 zur Studienordnung für den Studiengang Medizin
Praktikums- und Seminarordnung des Institutes für Anatomie für Studierende der Medizin und Zahnmedizin (Stand November 2010) Auf der Grundlage der Anlage 1 zur Studienordnung für den Studiengang Medizin
Microscopy. Light microscope (LM) TEM
 Microscopy Light microscope (LM) TEM Microscopes Light microscope (LM) Transmission electron microscope (TEM) Scanning electron microscope (SEM) Transmission electron microscope (TEM) Die tierische Zelle
Microscopy Light microscope (LM) TEM Microscopes Light microscope (LM) Transmission electron microscope (TEM) Scanning electron microscope (SEM) Transmission electron microscope (TEM) Die tierische Zelle
Referat zum Chat vom mit Alexandra. Thema: Binde- und Stützgewebe
 Referat zum Chat vom 26.05.2010 mit Alexandra Thema: Binde- und Stützgewebe Welche Gewebearten gibt es? - Epithel- bzw. Deckgewebe - Binde- und Stützgewebe - Nervengewebe - Muskelgewebe Welche Funktion
Referat zum Chat vom 26.05.2010 mit Alexandra Thema: Binde- und Stützgewebe Welche Gewebearten gibt es? - Epithel- bzw. Deckgewebe - Binde- und Stützgewebe - Nervengewebe - Muskelgewebe Welche Funktion
14 11 lle Ze a b c d e f g h 15
 14 11 a b c d 15 e f g h 12 16 Mitose Bei der Kernteilung der Euzyten, dermitose, werden die Chromosomen für die späteren Tochterkerne aufgeteilt ( 14). Unsere Abbildung zeigt einen sich teilenden Fibroblasten
14 11 a b c d 15 e f g h 12 16 Mitose Bei der Kernteilung der Euzyten, dermitose, werden die Chromosomen für die späteren Tochterkerne aufgeteilt ( 14). Unsere Abbildung zeigt einen sich teilenden Fibroblasten
Histologie. Bearbeitet von Renate Lüllmann-Rauch. überarbeitet Taschenbuch. 648 S. Paperback ISBN Format (B x L): 12,5 x 19 cm
 Histologie Bearbeitet von Renate Lüllmann-Rauch überarbeitet 2006. Taschenbuch. 648 S. Paperback ISBN 978 3 13 129242 1 Format (B x L): 12,5 x 19 cm Zu Leseprobe schnell und portofrei erhältlich bei Die
Histologie Bearbeitet von Renate Lüllmann-Rauch überarbeitet 2006. Taschenbuch. 648 S. Paperback ISBN 978 3 13 129242 1 Format (B x L): 12,5 x 19 cm Zu Leseprobe schnell und portofrei erhältlich bei Die
Blut und Blutkreislauf
 Blut und Blutkreislauf (Copyright: Teleskop und Mikroskop Zentrum, Lacerta GmbH, 1050 WIEN, Schönbrunnerstr. 96) www.teleskop-austria.at 1. Blut Mensch Die folgende Abbildung zeigt die roten Blutkörperchen
Blut und Blutkreislauf (Copyright: Teleskop und Mikroskop Zentrum, Lacerta GmbH, 1050 WIEN, Schönbrunnerstr. 96) www.teleskop-austria.at 1. Blut Mensch Die folgende Abbildung zeigt die roten Blutkörperchen
Einleitung zu Pathologie des Atmungstraktes. Teil 2
 Einleitung zu Pathologie des Atmungstraktes Teil 2 Pathologische Grundmechanismen am Atmungstrakt d.h. Veränderungen, die bei zahlreichen unterschiedlichen Ursachen in gleicher Form auftreten, die aber
Einleitung zu Pathologie des Atmungstraktes Teil 2 Pathologische Grundmechanismen am Atmungstrakt d.h. Veränderungen, die bei zahlreichen unterschiedlichen Ursachen in gleicher Form auftreten, die aber
PRÄPARATION EINER MAUS
 PRÄPARATION EINER MAUS Anna Typplt Hewlett-Packard 22.11.2013 Präparation einer Maus In diesem Portfolio möchte ich das Sezieren einer Maus und die jeweiligen Schritte wiedergeben. Dieses Projekt fand
PRÄPARATION EINER MAUS Anna Typplt Hewlett-Packard 22.11.2013 Präparation einer Maus In diesem Portfolio möchte ich das Sezieren einer Maus und die jeweiligen Schritte wiedergeben. Dieses Projekt fand
7 Epithelgewebe Epithelgewebe
 96 Epithelgewebe Epithelgewebe Epithelien sind Verbände aus polar gebauten Zellen, die dicht an dicht sitzen, mit einem Minimum an Extrazellulärraum dazwischen. Die Zellen sind durch Zellkontakte untereinander
96 Epithelgewebe Epithelgewebe Epithelien sind Verbände aus polar gebauten Zellen, die dicht an dicht sitzen, mit einem Minimum an Extrazellulärraum dazwischen. Die Zellen sind durch Zellkontakte untereinander
Einleitung zu Pathologie der Niere
 Einleitung zu Pathologie der Niere Anteile der Niere: Pathologie Harntrakt Histologische Elemente der Niere: - Glomerulum (- a) Nephron (* - Tubulusapparat inkl. Sammelrohre - Gefäßsystem - Interstitium
Einleitung zu Pathologie der Niere Anteile der Niere: Pathologie Harntrakt Histologische Elemente der Niere: - Glomerulum (- a) Nephron (* - Tubulusapparat inkl. Sammelrohre - Gefäßsystem - Interstitium
2012/ Zweites Semester Thematik
 Pharmaziestudium Anatomisches Praktikum 2012/2013 - Zweites Semester Thematik Institut für Humanmorphologie und Entwicklungsbiologie Semmelweis Universität Lehrstoff: Grundlagen der menschlichen Anatomie,
Pharmaziestudium Anatomisches Praktikum 2012/2013 - Zweites Semester Thematik Institut für Humanmorphologie und Entwicklungsbiologie Semmelweis Universität Lehrstoff: Grundlagen der menschlichen Anatomie,
Diabetes & Dialyse. Ein Praxiskompendium. von Werner Kleophas. 1. Auflage. Thieme 2000
 Diabetes & Dialyse Ein Praxiskompendium von Werner Kleophas. Auflage Thieme 000 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 0558 Zu Inhaltsverzeichnis schnell und portofrei erhältlich bei beck-shop.de
Diabetes & Dialyse Ein Praxiskompendium von Werner Kleophas. Auflage Thieme 000 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 0558 Zu Inhaltsverzeichnis schnell und portofrei erhältlich bei beck-shop.de
Beispielheft Praktikum Histologie
 Unterschrift. Beispielheft 6-7 Modulprüfung BME7 van Leeuwenhoek Praktikum Histologie Antonie Art der Prüfung Multiple Choice Prüfung mit Fragen vom Typ Kprim (siehe Seite ) Dauer der Prüfung Ausweis Hilfsmittel
Unterschrift. Beispielheft 6-7 Modulprüfung BME7 van Leeuwenhoek Praktikum Histologie Antonie Art der Prüfung Multiple Choice Prüfung mit Fragen vom Typ Kprim (siehe Seite ) Dauer der Prüfung Ausweis Hilfsmittel
Inhalt. Einleitung. 1 Anatomie und chemische Grundlagen. 2 Die Zelle. 3 Gewebe. 4 Haut und Hautanhangsorgane. 5 Knochen und Skelettgewebe
 Inhalt Einleitung 1 Anatomie und chemische Grundlagen Was ist Anatomie, was ist Physiologie? 17 Atome, Moleküle, Ionen und Bindungen 22 Anorganische Verbindungen 25 Organische Moleküle 26 Chemische Reaktionen
Inhalt Einleitung 1 Anatomie und chemische Grundlagen Was ist Anatomie, was ist Physiologie? 17 Atome, Moleküle, Ionen und Bindungen 22 Anorganische Verbindungen 25 Organische Moleküle 26 Chemische Reaktionen
Kursus der Mikroskopischen Anatomie Wintersemester 2016/17
 Kursus der Mikroskopischen Anatomie Wintersemester 2016/17 Der Kursus der Mikroskopischen Anatomie soll Kenntnisse in Zytologie (Zelllehre), allgemeiner Histologie (Gewebelehre) und mikroskopischer Anatomie
Kursus der Mikroskopischen Anatomie Wintersemester 2016/17 Der Kursus der Mikroskopischen Anatomie soll Kenntnisse in Zytologie (Zelllehre), allgemeiner Histologie (Gewebelehre) und mikroskopischer Anatomie
Abb. 27: Durasinus mit Erythrozyten (TEM). kf kollagene Fibrillen, BM Basalmembran, En Endothel mit Vesikeln, E Erythrozyten, F Fibrozyt, v Mikrovilli
 66 Die Dura mater wird von Gefäßen durchzogen, wobei Venen häufiger als Arterien anzutreffen sind. Die Gefäße sind mit einem flachen, kontinuierlichen Endothel ausgekleidet, das einer kontinuierlichen
66 Die Dura mater wird von Gefäßen durchzogen, wobei Venen häufiger als Arterien anzutreffen sind. Die Gefäße sind mit einem flachen, kontinuierlichen Endothel ausgekleidet, das einer kontinuierlichen
Anatomie - Histologie. Bindegewebe
 Bindegewebe 1 Binde- und Stützgewebe Lockeres Bindegew., Fettgewebe, Knorpel, Knochen 2 Binde- und Stützgewebe Zusammengesetzt aus Bindegewebszellen und größerer Mengen geformter, bzw. ungeformter Interzellularsubstanzen
Bindegewebe 1 Binde- und Stützgewebe Lockeres Bindegew., Fettgewebe, Knorpel, Knochen 2 Binde- und Stützgewebe Zusammengesetzt aus Bindegewebszellen und größerer Mengen geformter, bzw. ungeformter Interzellularsubstanzen
Epithelgewebe und Drüsengewebe
 University of Fribourg - Department of Medicine D i v i s i o n o f H i s t o l o g y Epithelgewebe und Drüsengewebe Skript mit Zeichnungen zur Erleichterung des Verständnis der Vorlesung über Oberflächenepithelien
University of Fribourg - Department of Medicine D i v i s i o n o f H i s t o l o g y Epithelgewebe und Drüsengewebe Skript mit Zeichnungen zur Erleichterung des Verständnis der Vorlesung über Oberflächenepithelien
Kursus der Mikroskopischen Anatomie Wintersemester 2017/18
 Kursus der Mikroskopischen Anatomie Wintersemester 2017/18 Der Kursus der Mikroskopischen Anatomie soll Kenntnisse in Zytologie (Zellenlehre), allgemeiner Histologie (Gewebelehre) und mikroskopischer Anatomie
Kursus der Mikroskopischen Anatomie Wintersemester 2017/18 Der Kursus der Mikroskopischen Anatomie soll Kenntnisse in Zytologie (Zellenlehre), allgemeiner Histologie (Gewebelehre) und mikroskopischer Anatomie
1 Einführung 13. 3 Gewebe 37. 2 Zytologie 17. Inhaltsverzeichnis. Inhaltsverzeichnis. 2.8.2 Die Form, Lage und Größe des Zellkerns
 7 1 Einführung 13 1.1 Was bedeutet Histologie? 15 1.2 Wozu Histologie? 15 2 Zytologie 17 2.1 Einleitung 19 2.1.1 Die Zelle 19 2.2 Die Zellmembran 19 2.2.1 Der Überblick 19 2.2.2 Die Lipid-Doppelschicht
7 1 Einführung 13 1.1 Was bedeutet Histologie? 15 1.2 Wozu Histologie? 15 2 Zytologie 17 2.1 Einleitung 19 2.1.1 Die Zelle 19 2.2 Die Zellmembran 19 2.2.1 Der Überblick 19 2.2.2 Die Lipid-Doppelschicht
6 Knorpel, Knochen, Knochenbildung, Gelenk
 6 Knorpel, Knochen, Knochenbildung, Gelenk Knorpel Hyalin: Trachea, HE..., Elastisch: Ohrmuschel, Elastika..., Faserknorpel: Zwischenwirbelscheibe, HE....6,7 Knochen Lamellenknochen, Diaphyse quer, Schnitt,
6 Knorpel, Knochen, Knochenbildung, Gelenk Knorpel Hyalin: Trachea, HE..., Elastisch: Ohrmuschel, Elastika..., Faserknorpel: Zwischenwirbelscheibe, HE....6,7 Knochen Lamellenknochen, Diaphyse quer, Schnitt,
